一种无机离子介导的有机化合物纳米酶及制备方法和应用
1.本发明属于材料领域,具体涉及一种无机离子介导的有机化合物纳米酶及制备方法和应用。
背景技术:
2.在过去的几十年里,由细菌引起的疾病不断增加,已成为持续威胁全球人类健康的最大问题之一。由于耐抗生素菌株的出现,许多依靠抗生素的传统抗感染治疗逐渐失去效力。目前,基于纳米材料的新型抗菌方法的出现,如光热疗法(ptt)、光动力疗法(pdt)和超声疗法。其中光热疗法(ptt)具有创伤小、组织穿透性高、可远程操作、无耐药性能优点,具有光热性质的纳米材料能够将光能转化为热能,热能通过破坏细胞膜、蛋白质变性来杀死细胞,从而导致细菌死亡。与传统的抗生素疗法相比,化学动力疗法(cdt)是一种新兴的治疗方法,它是基于芬顿或类芬顿反应催化过氧化氢(h2o2)产生羟基自由基(
·
oh),从而破坏细菌的正常生理功能,诱导细菌死亡。将h2o2转化为
·
oh的这一类材料被定义为纳米酶。与h2o2相比,
·
oh是最强的氧化剂之一,具有更有效的抗菌性能。并且具有光热性质的材料在光照条件下可以促进
·
oh的产生。目前,将协同治疗模式代替单一治疗模式,可以高效激活化学动力学疗法,促进其由细菌引起的伤口感染的治疗效果。本发明旨在将光热疗法和化学动力学疗法结合,达到协同高效治疗细菌感染的目的。
技术实现要素:
3.本发明的目的是提供具有无机离子介导的有机化合物纳米酶,利用无机离子与有机化合物的配位,增强其化合物的光热性质,且形成的纳米酶在加入h2o2后会产生
·
oh,同时热能促进
·
oh的产生,通过光热与化学动力学联合疗法实现对细菌感染的治疗。
4.为了达到上述目的,本发明采取下列技术方案:
5.一种无机离子介导的有机化合物纳米酶,所述纳米酶通过以下步骤制得:
6.步骤1,化合物m1与无机离子溶解在四氢呋喃中,室温搅拌,混合均匀得到化合物m1
‑
fe;
7.步骤2,将化合物m1
‑
fe和聚乳酸
‑
羟基乙酸共聚物
‑
聚乙二醇(plga
‑
peg)溶解在四氢呋喃中,在超声条件下加入过滤膜的超纯水中,超声5~8min,得到该纳米酶。
8.所述无机离子为fe
2+
,所述化合物m1为:
[0009][0010]
进一步,所述步骤1中化合物m1与无机离子摩尔比为1:1~3,所述室温搅拌的时间为2~4h。
[0011]
进一步,所述步骤2中m1
‑
fe与聚乳酸
‑
羟基乙酸共聚物
‑
聚乙二醇的质量比为1:4~8。
[0012]
一种无机离子介导的有机化合物纳米酶的制备方法,包括以下步骤:
[0013]
步骤1,化合物m1与无机离子溶解在四氢呋喃中,室温搅拌,混合均匀得到化合物m1
‑
fe;
[0014]
步骤2,将化合物m1
‑
fe和聚乳酸
‑
羟基乙酸共聚物
‑
聚乙二醇(plga
‑
peg)溶解在四氢呋喃中,在超声条件下加入过滤膜的超纯水中,超声5~8min,得到该纳米酶;
[0015]
所述无机离子为fe
2+
,所述化合物m1为:
[0016][0017]
进一步,所述述步骤1中化合物m1与无机离子摩尔比为1:1~3,所述室温搅拌的时间为2~4h。
[0018]
进一步,所述步骤2中m1
‑
fe与聚乳酸
‑
羟基乙酸共聚物
‑
聚乙二醇的质量比为1:4~8。
[0019]
一种无机离子介导的有机化合物纳米酶的应用,所述纳米酶外加过氧化氢产生羟基自由基的应用,所述纳米酶通过fe
2+
介导增加了m1的光热性质。
[0020]
与现有技术相比本发明具有以下优点:
[0021]
本发明得到的无机离子介导的有机化合物纳米酶,该纳米酶不仅具有比原来的化合物m1更强的光热性质,而且加入h2o2可以产生
·
oh,在光照条件下,该纳米酶产生局部热既可以对细菌造成损伤还可以加速
·
oh的产生,
·
oh的氧化能力非常强,也能够杀伤细菌或者癌细胞,实现光热与化学动力学联合高效治疗。该纳米酶可以应用在生物医药领域。
附图说明
[0022]
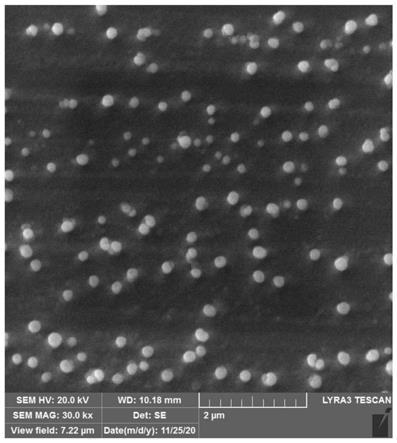
图1为本发明纳米酶的扫描电镜(sem)图;
[0023]
图2本发明纳米酶(m1
‑
fenps)与m1nps的紫外吸收归一化光谱图;
[0024]
图3为本发明纳米酶产生羟基自由基(
·
oh)的能力测试;
[0025]
图4为本发明纳米酶(m1
‑
fenps)在660nm激光照射下不同浓度的升温曲线;
[0026]
图5为本发明纳米酶(m1
‑
fenps)和m1nps在波长为660nm激光照射下的的光热升降曲线;
[0027]
图6为本发明纳米酶(m1
‑
fenps)在波长为660nm激光照射下的光稳定性曲线;
[0028]
图7为本发明含有不同浓度纳米酶(m1
‑
fenps)在ph=6.5、ph=7.4对金黄色葡萄球菌的杀菌性能研究图(光照条件为激光660nm,1w/cm2)。
具体实施方式
[0029]
实施例1
[0030]
一种无机离子介导的有机化合物纳米酶的制备方法,包括以下步骤:
[0031]
步骤1,取0.25mg/ml的化合物m1四氢呋喃溶液500μl与1mg/ml的fecl2·
4h2o四氢呋喃溶液22μl,室温搅拌2h,得到化合物m1
‑
fe;
[0032]
步骤2,将混合均匀的化合物m1
‑
fe和8mg/ml的plga
‑
pegthf溶液62.5μl加入thf中,最终体积是4ml,在超声条件下加入过滤膜的10ml超纯水中,超声5min,得到该纳米酶。
[0033]
实施例2
[0034]
一种无机离子介导的有机化合物纳米酶的制备方法,包括以下步骤:
[0035]
步骤1,取0.25mg/ml的化合物m1四氢呋喃溶液500μl与1mg/ml的fecl2·
4h2o四氢呋喃溶液44μl,室温搅拌4h,得到化合物m1
‑
fe;
[0036]
步骤2,将混合均匀的化合物m1
‑
fe和8mg/ml的plga
‑
pegthf溶液125μl加入thf中,最终体积是4ml,在超声条件下加入过滤膜的10ml超纯水中,超声8min,得到该纳米酶。
[0037]
实施例3
[0038]
步骤1,取0.25mg/ml的化合物m1四氢呋喃溶液500μl与1mg/ml的fecl2·
4h2o四氢呋喃溶液22μl,室温搅拌3h,得到化合物m1
‑
fe;
[0039]
步骤2,将混合均匀的化合物m1
‑
fe和8mg/ml的plga
‑
pegthf溶液125μl加入thf中,最终体积是4ml,在超声条件下加入过滤膜的10ml超纯水中,超声6min,得到该纳米酶。
[0040]
实施例4
[0041]
步骤1,取0.25mg/ml的化合物m1四氢呋喃溶液500μl与1mg/ml的fecl2·
4h2o四氢呋喃溶液66μl,室温搅拌3h,得到化合物m1
‑
fe;
[0042]
步骤2,将混合均匀的化合物m1
‑
fe和8mg/ml的plga
‑
pegthf溶液93.75μl加入thf中,最终体积是4ml,在超声条件下加入过滤膜的10ml超纯水中,超声7min,得到该纳米酶。
[0043]
实施例5
[0044]
m1
‑
fenps测量时采取的浓度为10
‑1μg/ml,将4μl的溶液滴加在硅片上,
‑
20℃放置1h,之后冷冻干燥2h,将干燥的样品用于测量sem。测量结果见图1,测量得粒径约为90nm。
[0045]
实施例6
[0046]
m1
‑
fenps稀释为30μg/ml的水溶液,测量紫外,得到最大吸收为655nm,测量结果见
图2,与m1nps相比蓝移了15nm。
[0047]
实施例7
[0048]
无机离子介导的有机化合物纳米酶的产生
·
oh的性能测试:
[0049]
用ph=6.5的缓冲溶液稀释,将氨基苯基荧光素溶液与各组分混合(h2o2、m1nps+h2o2、m1
‑
fenps、m1
‑
fenps+h2o2)放在37℃的恒温培养箱中,最终氨基苯基荧光素浓度为1mm,m1nps/m1
‑
fenps浓度为50μg/ml,h2o2浓度为10mm,其中m1
‑
fenps+h2o2光照组是在激光660nm1w/cm2的条件下照射,每隔1min检测荧光强度。测量结果见图3,m1
‑
fenps+h2o2可以产生大量的
·
oh,光照可以促进
·
oh的产生。
[0050]
实施例8
[0051]
无机离子介导的有机化合物纳米酶的光热性能测试:
[0052]
配制不同浓度纳米酶(0
‑
10μg/ml)。取200μl于0.5ml的离心管中,用激光强度为1w/cm2的660nm激光照射8min,得到不同浓度纳米酶的光热曲线。测量结果见图4。
[0053]
配制纳米酶(m1
‑
fenps)和没有无机离子参与的有机化合物m1nps浓度10μg/ml,取200μl于0.5ml的离心管中,各用激光强度为1w/cm2的660nm激光照射8min,监测并记录温度。然后关闭激光器,监测溶液的温度,直到恢复到原始值。测量结果见图5,m1
‑
fenps可以升高到55.2℃,m1nps升高到52.2℃。
[0054]
配制纳米酶的浓度10μg/ml,取200μl于0.5ml的离心管中,用激光强度为1w/cm2的660nm激光照射8min,监测并记录温度。然后关闭激光器,监测溶液的温度,直到恢复到原始值。重复5次。测量结果见图6。
[0055]
实施例9
[0056]
无机离子介导的有机化合纳米酶对金黄色葡萄球菌的杀菌效果测试(所用的缓冲溶液为ph=6.5):
[0057]
在超净台中,将在nb液体培养基中培养10小时左右的金黄色葡萄球菌吸取2ml菌液进行离心(7100rpm,2min)沉淀,将沉淀的金黄色葡萄球菌用1хpbs洗涤后离心沉淀,弃去上清液,重复两次后,弃去上清液,将菌液重新悬浮于pbs中,调od
600
为1.0。在1.5ml的离心管中,加入100μl(od
600
=1)的菌液和一定量的m1
‑
fenps(最终浓度分别为2.5μg/ml、5μg/ml、7.5μg/ml,10μg/ml),用无菌1
×
pbs将体积补充到500μl,并在暗处37℃下孵育20min,每个浓度各两组,分别为非光照组和光照组,空白组不加药。孵育结束后,光照组在660nm(1w/cm2)的激光下,照射8min。每组稀释1
×
104倍后吸取100μl菌液均匀涂布于90mmnb固体培养基上,37℃培养12h,计数菌落形成单位。(测试结果见图7,在ph=6.5的条件下,10μg/ml的m1
‑
fenps光照细菌存活率为7.1%,杀菌效果最好)
[0058]
实施例10
[0059]
无机离子介导的纳米酶对金黄色葡萄球菌的杀菌效果测试(所用的缓冲溶液为ph=7.4):
[0060]
在超净台中,将在nb液体培养基中培养10小时左右的金黄色葡萄球菌吸取2ml菌液进行离心(7100rpm,2min)沉淀,将沉淀的金黄色葡萄球菌用1хpbs洗涤后离心沉淀,弃去上清液,重复两次后,弃去上清液,将菌液重新悬浮于pbs中,调od
600
为1.0。在1.5ml的离心管中,加入100μl(od
600
=1)的菌液和一定量的m1
‑
fenps(最终浓度分别为2.5μg/ml、5μg/ml、7.5μg/ml,10μg/ml),用无菌1
×
pbs将体积补充到500μl,并在暗处37℃下孵育20min,每
个浓度各两组,分别为非光照组和光照组,空白组不加药。孵育结束后,非光照组稀释1
×
104倍后吸取100μl菌液均匀涂布于90mmnb固体培养基上,37℃培养12h,计数菌落形成单位。光照组在660nm(1w/cm2)的激光下,照射8min。(测试结果见图7,10μg/ml的m1
‑
fenps光照细菌存活率为30.8%)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1