一种可降解药物支架输送系统的制作方法
1.本实用新型属于三类植入性医疗器械技术领域,特别涉及一种可降解药物支架输送系统。
背景技术:
2.人类对于冠心病的斗争已经持续多年,在经过了球囊时代、金属裸支架时代、药物金属支架阶段,冠心病已经得到了很好的治疗和控制。但是,在时下流行的药物金属支架阶段,依然不能减少由于手术过程中血管短暂缺血带来的病人的胸痛,以及由于永久植入非可降解材料所产生的血管刺激而永久服用抗血小板的药物。
3.可降解支架也叫做生物可吸收支架,被称为经皮冠状动脉介入治疗领域的最新革命。与永久性植入和存在的药物金属不可降解支架不同,可降解支架在被植入人体后,经过1至3年的时间可以完全降解,最后没有任何物质留在病变的位置。这样的治疗效果极大的降低了金属支架带来的晚期支架内不良事件有关的血栓形成,而且由于支架材料可降解,病人的服药周期也可以被降低,而不是终身服用。
4.随着对可降解支架的深入研究,人们逐渐发现,许多医用高分子聚合物可以用于制备可降解支架,并且已经有许多医用高分子聚合物成功应用于骨科或齿科。这些用于制备可降解支架医用高分子聚合物被制成不同的支架形态,包括开环结构和闭环结构,并对这些支架形态进行各种力学分析。但是无论将可降解材料制成何种形态,由于其材料自身的性能,可降解支架的力学性能不如金属支架,其弹性模量和屈服强度均低于金属支架,这样必然会导致可降解支架在血管内部会大面积回弹。但是,可降解支架的完全降解性能所带来的远期血管无异物的性能确实优异。所以在不久的将来,只要降低扩张后的回缩率问题,可降解支架有极大可能全面代替金属支架,成为治疗冠心病的首选方法。
5.与传统的金属支架一致,可降解支架也是要经过动脉穿刺的方式被植入于人体血管内,具体方法为将可降解支架首先经过刷涂、浸涂或喷涂的方式赋予表面一层药物涂层,然后压握于球囊输送系统之上,使用时,将带有可降解支架的球囊输送系统经特定的管路进入到病变部位,球囊输送系统连有充压装置,当可降解支架进入到病变部位后,充压装置将球囊充起,随之压握在球囊上的可降解支架一并被充起。此时,由于材料较低的弹性模量,可降解支架被充起的状态一定要保持一段时间,利用球囊撑起时的稳定压力,可使可降解支架获得足够的时间进行定型于血管内部,然后球囊逐渐卸压并抽出体外,完成可降解支架的安装全过程。
6.在安装的全过程中,使可降解支架有足够的时间定型于血管内部尤为重要,如果定型时间短,血管势必会给可降解支架周向的压紧力,从而给可降解支架带来较大的回缩率。另外,病变部位由于有血栓的存在,血管是无规则的,使在支架未完全打开前就有可能已经完全阻断血流,从而导致血管远端缺血,造成病人术中胸痛。
7.所以,在可降解支架安装的过程中,保持足够的时间来扩张支架是非常重要的,目前,并没有很好的方式来提高可降解支架的扩张时间。
技术实现要素:
8.本实用新型的目的在于,针对现有技术的不足,提供一种可降解药物支架输送系统,具体包括可降解支架1、药物涂层2和球囊输送系统3;所述药物涂层2附在可降解支架1表面,附有药物涂层2的可降解支架1压握于球囊输送系统3的球囊7上;
9.所述可降解支架1为镂空结构。所述可降解支架1壁厚为0.05mm~0.2mm,材料为可降解材料,如非金属可降解材料,优选为左旋聚乳酸(plla)、右旋聚乳酸(pdla)、消旋聚乳酸(pdlla)、聚乙交酯(pga)、聚乙二醇 (peg)、聚谷氨酸(plg)中的一种以上或多种相应单体的嵌段共聚物,分子量为30万~100万。
10.本实用新型可降解支架1由可降解粒料经过挤出工艺成管材,可降解管材经过激光雕刻和(或)腐蚀剂腐蚀和(或)3d打印的方式得到。
11.所述药物涂层2为治疗血管内壁增生或血栓的药物涂层。药物涂层2能控制药物释放,包括聚合物与有效药物;其中聚合物与有效药物的配比为 1:0.05~1:10。所述药物涂层2中有效药物包括紫杉醇、紫杉醇衍生物、雷帕霉素、雷帕霉素衍生物中的一种或多种;利用左旋聚乳酸、右旋聚乳酸、消旋聚乳酸、聚乙交酯、聚乙二醇、聚谷氨酸中的一种以上或多种相应单体的嵌段共聚物控制有效药物的释放,聚合物的分子量为3万~15万。
12.本实用新型药物涂层2中聚合物分子量以及聚合物与药物的配比可以控制有效药物的释放时间,使得所述药物涂层2的药物释放时间为14~45天。具体通过将有效药物和控制药物释放的聚合物采用溶剂溶解的方式混合,溶剂包括四氢呋喃、氯苯、二甲苯、甲苯、乙腈、甲醇、乙醇、氯仿、乙酸乙酯、环己烷、丁酮、丙酮、石油醚等。混合完成后通过喷涂、浸涂或刷涂的方式赋予在可降解支架的表面,即得到带有药物涂层2的可降解支架1。
13.所述球囊输送系统3包括手柄4、支撑杆5、近端管6、球囊7和尖端8,近端管6为环状导管;所述近端管6设有1个以上孔径0.005mm~1mm的自灌注孔9,自灌注孔9设置在近端管6上近端内管和近端外管的焊接处。自灌注孔9的周围或球囊7上设置1个以上的能够在x光下显影的显影环10;其中自灌注孔9周围的显影环10设置在近端管6的近端内管上。其中显影环10为在 x光下显影的金属和/或非金属环。
14.更进一步地,所述自灌注孔9周围的显影环10距离自灌注孔9不超过5cm。
15.本实用新型带有药物涂层2的可降解支架1通过自动压握或手动压握的方式被赋予在球囊输送系统3的球囊7覆盖区域,压握的时间为1min~30min。
16.本实用新型中球囊输送系统3为可降解支架1的载体,自灌注孔9可以使得在可降解支架扩张过程中,血液从血管的近端流向远端,保证在可降解支架缓慢扩张和在病变部位保持压力的同时,血管内有持续的血流存在。显影环10 不仅能够标注球囊7的位置,还能够标注自灌注孔9的位置。
17.本实用新型提供的可降解药物支架输送系统将可降解支架1植入人体后,通常经过降解的方式从高分子聚合物变成中小分子,再进过人体代谢排出体外,降解周期一般为1年至3年。
18.本实用新型提供的可降解药物支架输送系统的可降解支架扩张时间提高了1倍以上。
19.本实用新型的有益效果为:
20.(1)本实用新型提供的可降解药物支架输送系统,当可降解支架在病人靶病变血
管内扩张时,医生可以根据标定自灌注孔的显影环回撤手术配件——导丝,血液可以从自灌注孔进入并从远端流出,从而使得远端血管有血流的存在,能够保证在可降解支架缓慢扩张和在病变部位保持压力的同时,血管内有持续的血流存在,进而提高可降解支架扩张时间,增加可降解支架在病人靶病变部位的保压时间,给予可降解支架的充分打开和变形以及在血管内的固定,从而减少患者在术中因远端缺血产生的胸痛,使病人能够支撑更长的可降解支架扩张时间,增加可降解支架的塑型时间,提高手术安全性,增加手术成功率。
21.(2)本实用新型提供的可降解药物支架输送系统,不仅提供了能够完全降解的非金属可降解支架,以及能够通过精准的药物释放来对靶病变血管的血栓进行治疗,还解决了由于与金属支架相比下的支撑力不足的问题,可降解支架扩张时间更长,远期血管收缩更小,血管晚期管腔丢失率更低。
附图说明
22.附图1为本实用新型提供的可降解药物支架输送系统;
23.附图2为本实用新型提供的可降解药物支架输送系统的局部放大图;
24.标号说明:1
‑
可降解支架;2
‑
药物涂层;3
‑
球囊输送系统;4
‑
手柄;5
‑
支撑杆、6
‑
近端管、7
‑
球囊;8
‑
尖端;9
‑
自灌注孔;10
‑
显影环。
具体实施方式
25.本实用新型提供了一种可降解药物支架输送系统,下面结合实施例和附图对本实用新型做进一步的说明。
26.如图1所示的可降解药物支架输送系统,由可降解支架1、药物涂层2和球囊输送系统3组成。球囊输送系统3包括手柄4、支撑杆5、近端管6、球囊7和尖端8。
27.如图2所示,所述药物涂层2附在可降解支架1表面,附有药物涂层2的可降解支架1压握于球囊输送系统3的球囊7上。球囊输送系统3中近端管6 上设有1个以上孔径0.005mm~1mm的自灌注孔9,自灌注孔9的周围或球囊7 上设置1个以上的能够在x光下显影的显影环10。
28.可降解药物支架输送系统通过常规经皮冠状动脉腔内血管成形术植入动物心脏内,球囊7在靶病变部位扩张,可降解支架1撑起后,撤回导丝,血液通过自灌注孔9从血管的近端流向远端,在可降解支架缓慢扩张和在病变部位保持压力的同时,保证靶病变部位血管内有持续的血流存在。
29.实施例1
30.(1)将分子量为60万的左旋聚乳酸(plla)粒料通过熔融挤出的方式制成壁厚为0.15mm的管材;
31.(2)将管材通过激光雕刻的方式制成镂空状支架形态。
32.(3)将制作成镂空形态的可降解支架1用离子风机吹除表面杂质,并消除可降解支架表面的静电。
33.(4)采用分子量为15万的消旋聚乳酸(pdlla)与紫杉醇以2:1的比例溶解于丙酮中,取可降解支架1,以喷涂的方式将紫杉醇与消旋聚乳酸的混合物喷涂在可降解支架1表面,待氯仿挥发干净后,在可降解支架1表面获得一层致密的药物涂层2。
34.(5)将球囊输送系统3的近端内管和近端外管上通过热焊接在一起,然后通过钻孔的方式在近端管6打上4个孔径为0.05mm的灌注孔9,并在灌注孔9靠近手柄侧的近端内管上装配有能在x光下显影的显影环10。
35.(6)将载有药物涂层2的可降解支架1通过自动压握机压握在球囊输送系统3的球囊7上。
36.实施例2
37.(1)将分子量为60万的左旋聚乳酸(plla)粒料通过熔融挤出的方式制成壁厚为0.18mm的管材。
38.(2)将管材通过激光雕刻的方式制成镂空状支架形态。
39.(3)将制作成镂空形态的可降解支架1用离子风机吹除表面杂质,并消除可降解支架表面的静电。
40.(4)采用分子量为15万的消旋聚乳酸(pdlla)与紫杉醇以2:1的比例溶解于丙酮中,取可降解支架1,以喷涂的方式将紫杉醇与消旋聚乳酸的混合物喷涂在可降解支架1表面,待氯仿挥发干净后,在可降解支架1表面获得一层致密的药物涂层2。
41.(5)将球囊输送系统3的近端内管和近端外管上通过热焊接在一起,然后通过钻孔的方式在近端管6打上4个孔径为0.05mm的灌注孔9,并在灌注孔9靠近手柄侧的近端内管上装配有能在x光下显影的显影环10。
42.(6)将载有药物涂层2的可降解支架1通过自动压握机压握在球囊输送系统3的球囊7上。
43.实施例3
44.(1)将分子量为60万的左旋聚乳酸(plla)粒料通过熔融挤出的方式制成壁厚为0.2mm的管材。
45.(2)将管材通过激光雕刻的方式制成镂空状支架形态。
46.(3)将制作成镂空形态的可降解支架1用离子风机吹除表面杂质,并消除可降解支架表面的静电。
47.(4)采用分子量为15万的消旋聚乳酸(pdlla)与紫杉醇以2:1的比例溶解于丙酮中,取可降解支架1,以喷涂的方式将紫杉醇与消旋聚乳酸的混合物喷涂在可降解支架1表面,待氯仿挥发干净后,在可降解支架1表面获得一层致密的药物涂层2。
48.(5)将球囊输送系统3的近端内管和近端外管上通过热焊接在一起,然后通过钻孔的方式在近端管6打上4个孔径为0.05mm的灌注孔9,并在灌注孔9靠近手柄侧的近端内管上装配有能在x光下显影的显影环10。
49.(6)将载有药物涂层2的可降解支架1通过自动压握机压握在球囊输送系统3的球囊7上。
50.实施例4
51.将实施例1
‑
3所制成的带有可降解支架输送系统与普通的、未设置自灌注孔的可降解支架输送系统进行体内的动物实验。
52.动物实验分别将两种支架输送系统通过常规经皮冠状动脉腔内血管成形术植入动物心脏内,植入前用冠脉造影的方式测量血管直径的初始值。植入过程分别记录两种可降解支架输送系统的扩张时间,并观测心电图,当心电图出现不良变化时,结束扩张并记录
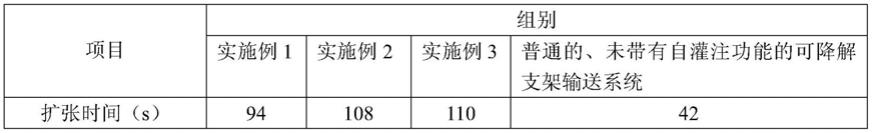
扩张时间。可降解支架植入后,分别在10分钟、30分钟、1小时通过冠脉造影的方式测量血管直径,并通过对比血管直径的初始值,计算和记录回缩量;得到如表1所示数据:
53.表1
[0054][0055][0056]
从表1可以看出,相比于普通的、未带有自灌注功能的可降解支架输送系统,本实用新型提供的可降解支架输送系统相同时间内血管回缩量小,可降解支架扩张时间提高了1倍以上。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1