一种肝脏原位移植干细胞来源的外泌体装置的制作方法
本实用新型涉及干细胞及其衍生物治疗设备技术领域,具体涉及一种肝脏原位移植干细胞来源的外泌体装置。
背景技术:
间充质干细胞(mesenchymalstemcells,mscs),自我更新能力高且易于扩增,被广泛应用于各种临床试验。然而随着再生医学的发展,细胞治疗遇到许多现实的问题,如免疫排斥、伦理问题以及暴露于受损部位的炎症微环境时干细胞呈现低存活率限制其持续修复能力等。因此避免直接使用活的干细胞,采用干细胞衍生物比如外泌体等提供更安全的方式干预疾病进展至关重要。
随着干细胞作用机制的深入研究,发现mscs可通过分泌多种生物活性细胞因子和各种形式的转录物,发挥旁分泌效应,介导细胞与细胞之间的相互作用。而外泌体正是这类物质的重要转运载体,可以靶向和激活特定细胞,通过治疗伤口炎症而达到修复受伤组织的作用,被视为诱导免疫耐受和调节免疫应答的介体,可广泛应用于临床治疗。
肝纤维化是由慢性肝损伤引起的,最终会导致门静脉高压、肝硬化和肝癌,是全世界发病和死亡的主要原因。在临床实践中,肝纤维化依旧没有有效的治疗方法,目前最佳方法是肝移植,但是存在诸多限制,例如手术复杂、器官供体严重缺乏和移植后易引起并发症。因此,ofm定向移植装置,在肝纤维化治疗中,不仅可以提高局部外泌体有效浓度并且能动态监测治疗效果。
外泌体的特点是:细胞主动分泌的、大小均一、直径30~150nm、密度1.10~1.19g/ml的囊泡样小体,保持着与亲代细胞相似的生物学活性。外泌体的应用主要集中在临床诊断及抗肿瘤方面,正逐渐开发成为一种替代细胞疗法的新方法。外泌体移植目前常规多数采用静脉输注方式,需要提取大量的外泌体,成本高昂,而且会很快在体内被代谢掉,不能定向富集到特定损伤部位,导致需要修复的局部浓度很低,严重影响修复效果。因此,急需发展一种专门的外泌体原位定向移植装置来解决上面的难题。
开放式微灌注(openflowmicroperfusion,ofm),是通过应用肉眼可见的开口钢丝网替代透析膜,依据对流的原理进行活体取样,结合蠕动式ofm泵在推挽模式下获得稳定的样品回收率。ofm具有定量、定速及微创的特点,对于原位定向移植外泌体治疗疾病具有非常显著的优势。
技术实现要素:
本实用新型的目在于针对现有技术的不足,提供一种肝脏原位移植干细胞来源的外泌体装置。
为实现上述目的,本实用新型提供的技术方案是:
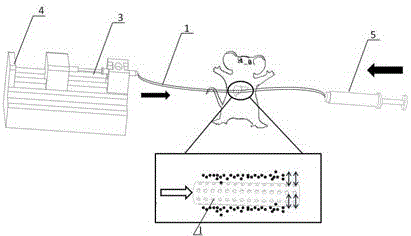
一种肝脏原位移植干细胞来源的外泌体装置,其特征在于:包括微灌注毛细管,所述微灌注毛细管上设置有若干个微孔,形成开放式微灌注探针;所述灌注毛细管的一端与微量注射泵内的第一微量注射器连接,另一端与空置的第二微量注射器连接,干细胞来源的外泌体通过微量注射泵被匀速推入微灌注毛细管内,通过微孔扩散进入肝脏。
为优化上述技术方案,采取的具体措施还包括:
上述的微灌注毛细管为聚酰亚胺毛细管。
上述的微灌注毛细管的长度为15~20cm。
上述的微灌注毛细管内径为0.15~0.25mm;外径为0.25~0.35mm。
上述的微灌注毛细管的内径为0.25mm;外径为0.35mm。
上述的微孔直径为30μm。
上述的微孔均匀分布在微灌注毛细管中段6~10mm范围内,沿微灌注毛细管周向均匀排布。
上述的微孔的设计数量为40个。
上述的微孔采用激光打孔的方式形成。
本实用新型与现有技术相比的优点在于:
本实用新型设计一种肝脏原位移植干细胞来源的外泌体装置,可将干细胞来源的外泌体通过微灌注的方式输入至肝脏,通过本装置治疗肝纤维化,组织创伤小,实现靶器官组织原位外泌体移植,确保外泌体在靶器官内富集浓度,减少因传统输注方式引起的个体差异性,治疗效果显著、稳定。
附图说明
图1为本实用新型实施例微灌注毛细管结构示意图。
图2为本实用新型实施例微灌注注射模式图。
附图中的标号为:1、微灌注毛细管;2、微孔;3、第一微量注射器;4、微量注射泵;5、第二微量注射器。
具体实施方式
下面结合附图和实施例对本实用新型作进一步说明。为使本实用新型实施例的目的、技术方案和优点更加清楚,下面将结合本实用新型实施例中的附图,对本实用新型实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本实用新型的一部分实施例,而不是全部的实施例。基于本实用新型中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本实用新型保护的范围。
参照图1-2,本实用新型提供一种肝脏原位移植干细胞来源的外泌体装置,包括微灌注毛细管1,所述微灌注毛细管1上设置有若干个微孔2,形成开放式微灌注探针;所述灌注毛细管1的一端与微量注射泵4内的第一微量注射器3连接,另一端与空置的第二微量注射器5连接,干细胞来源的外泌体通过微量注射泵4被匀速推入微灌注毛细管1内,通过微孔2扩散进入肝脏;所述微灌注毛细管1的长度为15~20cm。
本实用新型实施例中,所述微灌注毛细管1为聚酰亚胺毛细管;所述微灌注毛细管1内径为0.15~0.25mm;外径为0.25~0.35mm,优选内径为0.25mm;外径为0.35mm。
本实用新型实施例中,所述微孔2的直径为30μm;所述微孔2均匀分布在微灌注毛细管1中段6~10mm范围内,优选为8mm,沿微灌注毛细管周向均匀排布;微孔2的设计数量为40个;微孔2采用激光打孔的方式形成。
本实用新型实施例中,微灌注毛细管1的两端通过cma公司的tubingconnector进行连接。
本装置在使用时,先通过空心引导针将微灌注毛细管1引入靶器官组织内,使微灌注毛细管1的中部带有微孔2的部分留置于器官组织内,收回空心引导针;将微灌注毛细管1的两端(在体外)分别连接微量注射泵和空置的微量注射器,通过微量注射泵将外泌体悬液匀速推入微灌注毛细管1内,并通过微孔2扩散进入肝脏。
下面以实施例1为例,具体阐述本实用新型的制备及应用方法。
实施例1
(1)微灌注探针的制备:取一根长度约16cm、内径为0.25mm、外径为0.35mm的聚酰亚胺毛细管,采用激光打孔的方式在聚酰亚胺毛细管的中间位置8mm范围内周向均匀的打40个微孔,微孔直径为30μm;
(2)小鼠肝纤维化模型造模:将ccl4溶解在玉米油中,配制成浓度25%的ccl4肝纤维化诱导剂;在7周龄的雌性c57bl/6小鼠腹膜内注射1.6g/kgccl4溶液,对照的模型组注射同样体积的玉米油,每周注射两次,持续7周;
(3)制备外泌体悬液:制备、分离和扩增临床级人脐带间充质干细胞(huc-mscs),培养到第五代(p5)时进行饥饿收集细胞培养上清;排阻超滤法提取huc-mscs的外泌体。包括:细胞上清100kd超滤管浓缩,排阻柱超滤,外泌体馏分收集,测定收集产物的粒子浓度和蛋白浓度,对收集到的外泌体产物进行浓缩富集;
(4)肝脏原位ofm注射干细胞来源的外泌体:小鼠麻醉后仰卧固定,剃毛,上腹部消毒,从正中切口进入腹腔,暴露出肝脏;将微灌注探针由空心引导针穿入小鼠肝左中叶,微灌注探针留微孔的中段置于肝脏内,收回空心引导针;将微灌注探针的两端分别连接微量注射泵和空置的微量注射器;6×1010的外泌体重悬于200μl无菌pbs中,通过微量注射泵连接微灌注探针,以10μl/min注射进入肝脏;注射完成后,将小鼠腹腔肌肉层和皮肤层分别缝合。
治疗组相比模型组具有明显的治疗效果,纤维化结节显著减少。
本实用新型可将干细胞来源的外泌体通过微灌注的方式输入至肝脏,通过本装置治疗肝纤维化,组织创伤小,可以实现靶器官组织原位外泌体移植,减少外泌体损失,确保外泌体在靶器官内富集浓度,减少因传统输注方式引起的个体差异性,治疗效果显著、稳定。
以上仅是本实用新型的优选实施方式,本实用新型的保护范围并不仅局限于上述实施例,凡属于本实用新型思路下的技术方案均属于本实用新型的保护范围,应当指出,对于本技术领域的普通技术人员来说,在不脱离本实用新型原理前提下的若干改进和润饰,应视为本实用新型的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!