对对象固有的血管的血流模拟方法及装置与流程
本发明涉及一种对对象固有的血管的血流模拟方法及装置。更详细而言,涉及一种将cfd模型与lpm模型联系起来对对象固有的三维血管模型执行血流模拟的新的方法及装置。
背景技术:
为了获得有关在血管内流动的血流的信息,利用一种叫作计算流体力学(computationalfluiddynamics,cfd)的技术。cfd技术是一种在三维形状血管模型的边界设定边界条件,并应用有关流体力学的物理定律模拟对三维形状血管模型的血液的流动的技术。对三维血管模型执行血流模拟,可以求对在三维血管模型的内部流动的血流的信息,例如,压力、速度、流量等。此外,对三维血管模型执行血流模拟,不仅可以求血流的信息外,还可以求产生在血管壁的壁面剪切应力(wallshearstress,wss)。
当通过血流模拟求血流的信息时,可以评估诸如血管的狭窄(stenosis)或动脉瘤(aneurysm)等的血管的病理变化(pathologicalchange)的临床重要性。例如,可以利用于预测冠状动脉狭窄部位的冠状动脉血流储备分数(fractionalflowreserve,ffr),或预测形成于血管的动脉瘤的破裂(rupture)的风险。
为了执行对对象固有的血管的血流模拟,需要对对象固有的血管的三维血管模型。对对象固有的血管的三维血管模型可以通过处理对象的三维医疗影像数据(3dmedicalimagedata)来求。对象可以是疑似患有血管疾病的患者或欲确认健康状态的非患者的一般人士。三维医疗影像数据可以利用ct(computedtomography)图像体积或mri(magneticresonanceimaging),但不限于此,可以利用超声影像等任意的三维医疗影像数据。将从三维医疗影像数据求三维血管模型的技术称为分割(segmentation)。通过处理三维医疗影像数据来自动或半自动地分割血管的多种技术已为人所知。近来,人们正在开发利用机器学习(machinelearning),尤其深度学习(deeplearning)的技术。尤其,[专利文献1]中公开了一种结合深度学习技术和数值计算算法以从三维医疗影像数据自动分割血管的方法。
此外,为了执行对对象固有的血管的血流模拟,除了对象固有的三维血管模型外,还需要诸如血压、心率数、心输出量的对象固有的生理数据。此外,需要用于应用于对象固有的三维血管模型的入口、出口及血管壁的对象固有的边界条件。为了求对三维血管模型的入口和出口的对象固有的边界条件,可以测量入口和出口处的血流压力或血流速度(或血流量),并执行对对象固有的三维血管模型的血流模拟。代替测量血流压力或血流速度(或血流量)地,与集中参数模型(lumpedparametermodel,lpm模型)联系起来求边界条件的方法已为人所知。集中参数模型是一种利用电路对血流的特性进行建模和分析的方法,该方法利用阻力r(resistance)和顺应性c(compliance)等要素来对血流的流动进行建模。
在对血管系统的血流力学系统分析中,将cfd模型与lpm模型联系起来执行对三维血管模型的血流模拟的方法已广为人知。尤其,对连接于三维血管模型的出口的微血管床,将lpm模型联系起来求三维血管模型的出口的边界条件的方法已为人所知。微血管床的lpm模型是通过阻力r与顺应性c的结合对微血管床的血流学特征进行建模而得的。
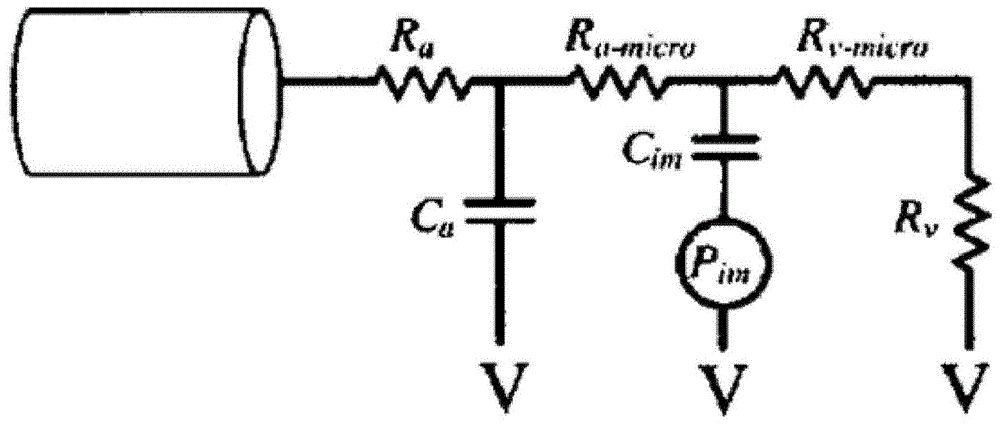
[非专利文献1]中公开了一种对冠状动脉中的血流和血压的患者固有的建模方法。尤其,[非专利文献1]中公开了一种将集中参数冠状动脉微血管床模型与患者固有的三维冠状动脉模型的出口联系起来求边界条件的方法。图1示出与[非专利文献1]中公开的冠状动脉的出口联系起来的集中参数冠状动脉微血管床模型。如图1所示,冠状动脉微血管床模型包括冠状动脉阻力ra、冠状动脉顺应性ca、冠状动脉毛细血管阻力ra-micro,心肌顺应性cim、冠状静脉毛细血管阻力rv-micro、冠状静脉阻力rv、以及内心肌压力pim(t)。上述[非专利文献1]中记载了诸如集中参数模型的阻力和顺应性的患者固有的参数的值通过基于血流量和血压并参考文献数据求出。然而,[非专利文献1]未对具体求患者固有的参数值的方法进行详细说明。
[专利文献2]中公开了一种对患者固有的脑血管模型的血流模拟方法。[专利文献2]中公开的方法是一种利用患者的mri影像数据求患者固有的脑血管模型,并将连接于脑血管模型的出口的微血管床替代为集中参数阻力-顺应性-阻力rcr模型并进行联系来模拟的方法。使用通过利用pcmra(phasecontrastmagneticresonanceangiographic)图像所测量的血流量来求模拟中使用的患者固有的参数值(阻力和顺应性)。
[专利文献3]中公开了一种对患者固有的冠状动脉的血流建模方法。尤其,[专利文献3]中公开了一种基于心肌质量求冠状动脉的微血管床的血流力学特征的方法。图2是示出上述[专利文献3]中揭示的将cfd模型与lpm模型联系起来进行冠状动脉的血流力学模拟的方法的示意图。参照图2,在冠状动脉的出口a-m中应用集中参数冠状动脉模型(lumped-parametercoronarymodel)作为边界条件。为了将边界条件应用于冠状动脉的出口,需要决定集中参数模型的参数ra、ca、ra-micro、lvp、cim、rv的值。为了求患者固有的lpm模型的参数值,由基于从心肌质量m通过实验导出的生理规律的公式q∝qomα(qo为已设定的常数,α为已设定的缩放指数)求患者的冠状动脉血流量q。基于每个出口的截面积求冠状动脉的总阻力r,并且由基于通过实验导出的生理规律的公式ri∝ri,odiβ(其中,ri,o为已设定的常数,di为出口的直径,β为已设定的乘方指数,取值介于-3与-2之间)求连接于每个出口的阻力。此外,虽然记载了其余参数值通过实验求出,但未明示性地记载通过何种实验求出。此外,为了应用[专利文献3]中公开的方法,需要求患者固有的心肌质量。就患者固有的心肌质量而言,通过分割心脏ct图像数据以求心脏的三维形状模型,并由心脏的三维形状模型求心肌的体积,并对心肌体积乘以心肌密度来求心肌质量。
此外,[专利文献4]中公开了一种基于冠状动脉血管的长度求连接于三维血管模型的出口的微血管床的血流力学特征的方法。图3是示出上述[专利文献4]中揭示的将cfd模型与lpm模型联系起来执行冠状动脉的血流力学模拟的方法的示意图。上述专利文献中公开的实施例的三维血管模型是从ct图像数据仅分割冠状动脉而得的三维冠状动脉模型。作为三维冠状动脉模型的入口边界条件,使用通过测量患者的血压求出的压力模式。三维冠状动脉模型的出口边界条件通过与lpm模型联系起来而定。如图3所示,通过对cfd模型的血流力学模拟,将向cfd模型的出口流出的计算流量提供至集中式参数模型(lpm模型)。在lpm模型中,计算对应于接收到的计算流量的冠状动脉的出口的压力,并重洗提供至cfd模型。提供至cfd模型的压力被用作用于cfd模型的下一步计算的cfd模型的出口边界条件。
尤其,在上述[专利文献4]的方法中,为了求lpm模型的患者固有的参数值,利用冠状动脉分支的长度。每个冠状动脉分支(rca、lad、lcx)的长度在冠状动脉的三维形状模型求出。凭借冠状动脉分支的长度之比,可以利用下式求流经每个冠状动脉分支的血流量的比率。
在上式中,α为右心室血液供应血管校正系数,qla为左前降支冠状动脉lad的血流量,llad为左前降支冠状动脉的长度,qlcx为左旋支冠状动脉lcx的血流量,llcx为左旋支冠状动脉的长度,qrca为右冠状动脉rca的血流量,lrca为右冠状动脉的长度,(lrca)rv为右冠状动脉中的右心室血液供应部分的长度,(lrca)lv为右冠状动脉中的左心室血液供应部分的长度。求出流经每个冠状动脉分支的血流量的比率后,可以求对每个冠状动脉分支的阻力(lpm模型的阻力值)。
<现有技术文献>
<专利文献>
(专利文献1)1.韩国专利申请号第10-2018-0105726号,一种利用机器学习和影像处理算法自动地对医疗影像的血管进行区域化的方法及系统;
(专利文献2)2.us7,191,110b1,患者特异性循环模型(patientspecificcirculationmodel);
(专利文献3)3.wo2012/021307a2,一种用于血流的患者特异性建模的方法及系统(methodandsystemforpatient-specificmodelingofbloodflow);
(专利文献4)4.韩国专利第10-1986424号,一种决定不同患者的血管信息的方法,
<非专利文献>
(非专利文献1)1.vignon-clementel等,“三维出流边界条件(outflowboundaryconditionsforthree)”;
(非专利文献2)“可变形动脉中的非周期性血流和压力场的维模拟(dimensionalsimulationsofnon-periodicbloodflowandpressurefieldsindeformablearteries)”,13(5),第625至640页(2010);
(非专利文献3)2.spaan,j.a.e.等,临床应用的冠状动脉血流动力学指数的生理基础,《循环》(physiologicalbasisofclinicallyusedcoronaryhemodynamicindices.circulation),2006;113:446-455。
(非专利文献4)3.毛细血管转运时间异质性在心肌氧合及局部缺血性心脏病中的作用,《心脏病学基础研究》(ostergaardl、kristiansensb、angleysh、
(非专利文献5)4.从对比超声心动图和心脏磁共振成像的肺通过时间:样式与感兴趣区域特征的影响的比较,《超声心动图》(monahank、coffins、lawsonm、salibal、rutherfordr、brittaine,pulmonarytransittimefromcontrastechocardiographyandcardiacmagneticresonanceimaging:comparisonbetweenmodalitiesandtheimpactofregionofinterestcharacteristics.echocardiography),2019年1月;36(1):119-124;
(非专利文献6)5.taylorca、fonteta、minjk,应用于血流储备分数的无创量化的心脏断层扫瞄的计算流体力学:科学基础(computationalfluiddynamicsappliedtocardiaccomputedtomographyfornoninvasivequantificationoffractionalflowreserve:scientificbasis),jamcollcardiol.2013年6月4日;61(22):2233-41;
(非专利文献7)6.kwonss、chungec、parkjs、kimgt、kimjw、kimkh、shines、shimeb,一种计算冠状血流储备分数的新型患者特异性模型,《生物物理学与分子生物学研究进展》(anovelpatient-specificmodeltocomputecoronaryfractionalflowreserve.progbiophysmolbiol),2014年9月,116(1):48-55;
(非专利文献8)7.liuj、yanz、puy、shiuws、wuj、chenr、lengx、qinh、liux、jiab、songl、wangy、miaoz、wangy、liul、caixc,脑动脉狭窄的功能评估:基于计算流体力学的探索性研究,《脑血流与代谢》(functionalassessmentofcerebralarterystenosis:apilotstudybasedoncomputationalfluiddynamics.jcerebbloodflowmetab),2017年7月,37(7):2567-2576;
(非专利文献9)8.shimeb、kammrd、heldtt、markrg,利用耦合的多尺度模拟方法的通过狭窄动脉的血流的数值分析,《心脏病学中的计算》(numericalanalysisofbloodflowthroughastenosedarteryusingacoupled,multiscalesimulationmethod,computcardiol),2000;27:219-22;
(非专利文献10)9.shimeb、changks.主动脉中三维bjrk-shiley瓣流动的数值分析,《生物医学工程杂志》(numericalanalysisofthree-dimensionalbjrk-shileyvalvularflowinanaorta.jbiomecheng),1997年2月,119(1):45-51;
(非专利文献11)10.leeke、ryuaj、shines、shimeb,用于心脏和大脑中血管血流储备的分析的生理组学方法,《弗鲁格档案-欧洲生理学杂志》(physiomeapproachfortheanalysisofvascularflowreserveintheheartandbrain.pflugersarch),2017年6月,469(5-6):613-628。
技术实现要素:
技术问题
为了提高对对象固有的三维血管模型的血流力学模拟的准确度,应使用被精密地分割的三维血管模型。即,应使用尺寸和形状与对象的实际血管尺寸和形状相同的三维血管模型来进行血流力学模拟。此外,三维血管模型的入口与出口之间的边界条件应准确。即,应提供与对象的实际血管的入口和出口的压力或血流速度(或流量)相同的压力和血流速度(或流量)作为三维血管模型的边界条件。如上述[专利文献4]所公开,当使用从对象测量的血压作为三维血管模型的入口边界条件,并与lpm模型联系起来定出口边界条件时,血压测量值应准确,并且,lpm模型的参数值应使用与对象的毛细血管床的血流力学特征一致的参数值。
对象的三维血管模型的准确度依赖于分割技术。当利用[专利文献1]中公开的方法来分割对象固有的血管时,可以获得提供能够应用于临床的程度的准确度的对象固有的三维血管模型。此外,可以将从对象测量的血压用作对象固有的三维血管模型的入口边界条件,以在模拟中进行使用。但是,当将对象固有的三维血管模型的出口的边界条件与lpm模型联系起来进行血流力学模拟时,在lpm模型中,应求出并使用准确的对象固有的参数,才可以确保血流模拟的准确性。
作为以无创地求lpm模型的对象固有的参数的方法,利用[专利文献3]中公开的心肌质量来求对象固有的参数的方法和利用[专利文献4]中公开的血管的长度来求对象固有的参数的方法已为人所知。然而,通过上述两种方法求出的lpm模型的对象固有的参数值存在无法反映因血管的形状变化(尤其,生成狭窄)而致使微血管床的血流力学特征发生变化的生理学现象的问题。
作为提供对如上所述的主张的根据的文献,有[非专利文献2]。[非专利文献2]中公开了形成于冠状动脉的狭窄(stenosis)会在充血状态下影响微血管床的阻力的实验结果。考虑上述文献的实验结果,可以认为对象固有的微血管床阻力应反映受形成于对象固有的血管的狭窄病变的影响的血流状态而定。因此,若要执行更符合人体的生理学现象的的cfd-lpm联系血流力学模拟,则应求考虑对象固有的血管形状的lpm模型的参数,并将其使用于血流力学模拟。
图4中示出微血管床的示意图和对此的建模。如图4所示,微血管床由小动脉、毛细血管和小静脉构成。微血管床因血管的直径非常小而难以进行分割。因此,为了分析通过微血管床而流动的血流,将微血管床的血流力学特性建模为电路并对其进行分析的方法被广为使用。将这样的分析方法称为集中参数模型(lumpedparametermodel,lpm)方法。如图4所示,微血管床可以被建模为阻力r(resistance)和顺应性c(compliance)。微血管床的特征在于,根据血管内部压力、代谢产物(二氧化碳等)及自主神经系统的状态,容易收缩/膨胀。当微血管床中的血管的收缩/膨胀时,血管的直径发生变化,随着血管直径发生,阻力会发生变化,随着血流阻力发生变化,血流量会发生变化。
例如,假定图4所示微血管床连接在形成有冠状动脉的狭窄的分支。当在充血状态下冠状动脉中存在诸如狭窄的病变时,病变下游侧(distal)冠状动脉内的压力pd(distalpressure)变得低于病变上游侧(proximal)冠状动脉内的压力pa(aorticpressure)。当施加于微血管床的压力pd变低时,微血管床血管的直径减小,当微血管床血管的直径减小时,微血管床的血流阻力rm增大。因此,通过微血管床的血流量qd也会减少。相反,在冠状动脉中没有诸如狭窄的病变,因而施加于微血管床的压力pd不变低的情况下,由于微血管床的直径不减小,因而血流量qd不会减少。最终,认为微血管床的血流力学特征由流经微血管床的血流量q0和施加于微血管床的压力p0而定从从生理学上而言是合理的。从结论而言,表示微血管床的血流力学特征的lpm模型的参数应由与微血管床联系的血管形状通过反映施加于微血管床的压力pd和供应至微血管床的血流量qd来决定。此外,这样的结论不仅局限于心脏的冠状动脉,而是对连接于包括脑血管的人体的所有血管的微血管床也是合理的。
本发明的第一个目的在于,提供一种新的对对象固有的三维血管模型的cfd-lpm联系血流模拟方法及装置。新的血流模拟方法及装置是一种求反映三维血管模型的形状的lpm模型的参数,并应用其来执行cfd-lpm联系血流模拟的方法及装置。
本发明的第二个目的在于,提供一种利用新的cfd-lpm联系血流模拟方法来推定与对象固有的血管连接的微血管床的血流力学特征,即阻力和顺应性的方法及装置。
技术方案
根据本发明的一方面,提供一种利用计算机系统对对象固有的三维血管模型进行血流模拟的方法。本发明的模拟方法包括:(a)接收所述对象固有的三维血管模型的步骤;(b)将血流方程应用于接收到的所述对象固有的三维血管模型以生成用于血流分析的cfd模型(分析模型)的步骤;(c)在所述cfd模型中设定初始条件和边界条件的步骤;(d)生成用于提供所述cfd模型的出口边界条件的、包括动脉参数和微血管床参数的lpm模型(集中参数模型)的步骤;以及(e)将所述cfd模型与所述lpm模型联系起来执行对所述cfd模型的血流模拟的步骤。此外,将所述cfd模型与lpm模型联系起来执行血流模拟的步骤(e)包括:(f)以所设定的所述初始条件和边界条件执行对cfd模型的血流模拟的步骤;(g)通过所述血流模拟计算cfd模型的每个出口的血流量qi和总流出血流量qtot_cfd的步骤;(h)利用所述cfd模型的每个出口的血流量和总流出血流量更新所述lpm模型的微血管床参数的步骤;(i)利用更新后的所述lpm模型更新所述cfd模型的出口边界条件的步骤;以及(j)反复执行上述步骤(f)至(i),直至满足对所述cfd模型的血流模拟的收敛条件的步骤。
在一些实施例中,可以配置为,在所述lpm模型中,动脉参数和微血管床参数串联连接,所述动脉参数包括并联连接的动脉阻力ra和动脉顺应性ca,所述微血管床参数包括并联连接的微血管床阻力rm和微血管床顺应性cm。
在一些实施例中,所述lpm模型的动脉参数可以使用利用对象固有的三维血管模型的分支的长度决定的参数值。
在一些实施例中,所述lpm模型的动脉参数可以使用利用对象固有的三维血管模型的分支末端的直径决定的参数值。
在一些实施例中,所述lpm模型的动脉参数可以使用提供对对象固有的三维血管模型的cfd-lpm联系模拟决定的参数值。在这种情况下,在用于决定所述动脉参数的cfd–lpm联系模拟中使用的lpm模型是仅包括动脉参数的lpm模型,在所述cfd-lpm联系模拟中,lpm模型的动脉参数下游的压力条件是使用对象的休息状态的压力条件求出的动脉参数值。
在一些实施例中,在利用所述cfd模型的每个出口的血流量和总血流量来更新所述lpm模型的微血管床参数的步骤(h)中,每个lpm模型的微血管床顺应性参数cm,i可以通过利用说明书的详细说明的[数学式12]求出的值来更新,每个分支的微血管床阻力参数rm,i可以通过利用说明书的详细说明的[数学式10]和[数学式7]求出的值来更新。[数学式12]是以通过cfd模型模拟求出的每个分支的出口流出血流量qi除以从对象测量的收缩期血压和舒张期血压之差,并乘以心率周期求出的值近似血管床顺应性参数cm,i的公式。[数学式10]是求所选择的基准分支的阻力rm,ref的公式,[数学式7]是给予表示微血管床阻力rm,i和微血管床顺应性cm,i的乘积作为时间常数相同的约束条件的数学式。
在一些实施例中,在利用更新后的所述lpm模型更新所述cfd模型的每个分支的出口的边界条件的步骤(i)中,作为被设定为所述cfd模型的每个分支的出口边界条件的血压,可以使用通过利用说明书的详细说明的[数学式15]而得的血压。
根据本发明的另一方面,提供一种用于执行对对象固有的三维血管模型的血流模拟的装置。本发明的装置包括:处理器;以及存储器,其存储有用于在所述处理器中执行的计算机程序。此外,所述计算机程序被配置为执行:(a)接收所述对象固有的三维血管模型的步骤;(b)将血流方程应用于接收到的所述对象固有的三维血管模型以生成用于血流分析的cfd模型(分析模型)的步骤;(c)在所述cfd模型中设定初始条件和边界条件的步骤;(d)生成用于提供所述cfd模型的出口边界条件的、包括动脉参数和微血管床参数的lpm模型(集中参数模型)的步骤;以及(e)将所述cfd模型与所述lpm模型联系起来执行对所述cfd模型的血流模拟的步骤。此外,将所述cfd模型与lpm模型联系起来执行血流模拟的步骤(e)包括:(f)以所设定的所述初始条件和边界条件执行对cfd模型的血流模拟的步骤;(g)通过所述血流模拟来计算cfd模型的每个出口的血流量和总血流量的步骤;(h)利用所述cfd模型的每个出口的血流量和总血流量来更新所述lpm模型的微血管床参数的步骤;(i)利用更新后的所述lpm模型更新所述cfd模型的出口边界条件的步骤;以及(j)反复执行上述步骤(f)至(i),直至满足对所述cfd模型的血流模拟的收敛条件的步骤。
发明的效果
通过以往的方法求出的lpm模型的参数存在当血管中存在诸如狭窄的病变时无法反映对应于血管的形状变化的参数值的影响的问题。此外,根据以往的方法,存在为了求lpm参数而需要进行复杂的计算或有创测量的困难。此外,存在凭借不准确的lpm参数执行的血流模拟的准确度下降的问题。
根据本发明的对对象固有的三维血管模型的cfd-lpm联系模拟方法,可以容易地求反映血管的形状的lpm模型的微血管床参数。此外,可以使用反映血管的形状变化的lpm模型的微血管床参数来准确地执行对对象固有的血管的血流模拟。
可以对对象固有的血管的三维血管模型执行血流模拟,以计算对对象固有的血管的血流力学感兴趣数量(hemodynamicquantitiesofinterest)。作为血流力学感兴趣数量,例如有冠状动脉血流储备分数(ffr)、冠状动脉血流储备(cfr),微血管床阻力指数(imr),瞬时无波形比率(ifr),基底狭窄阻力(basalstenosisresistance)、充血狭窄阻力(hyperemicstenosisresistance)等。
附图说明
图1是示出[非专利文献1]中公开的与冠状动脉的出口联系起来的集中参数冠状动脉微血管床模型的示意图。
图2是[专利文献3]所揭示的冠状动脉的血流模拟模型(cfd-lpm联系模拟模型)的概念图。
图3是示出[专利文献4]所揭示的将cfd模型与lpm模型联系起来执行冠状动脉的血流模拟的方法的示意图。
图4是微血管床(microvascularbed)的示意图。
图5是本发明的装置的示意图。
图6是用于应用本发明的方法的三维冠状动脉模型。
图7是用于说明以往的cfd-lpm联系模拟方法的顺序图。
图8是三维冠状动脉的网格模型的示意图。
图9是用于说明本发明的新的cfd-lpm联系血流模拟方法的顺序图。
图10是应用于本发明的新的cfd-lpm联系模拟方法的lpm模型的一实施例的示意图。
图11是基于血管长度求动脉血管的血流力学特征的方法的示意图。
图12是基于对血管分支的默里定律的理论流量分配说明图。
图13是利用本发明的新的cfd-lpm联系血流模拟方法求动脉参数的方法的顺序图。
图14是用于应用图13的方法来求动脉参数的lpm模型的一实施例的示意图。
图15是示出每个血液循环血管的血压的变化的图表。
图16是示出每个血液循环血管的血流速度及血管截面积的图表。
具体实施方式
下面参照附图对本发明的优选实施例进行说明。本说明书中描述的实施例针是针对对象固有的三维冠状动脉模型的。以下描述的cfd-lpm联系血流模拟方法及装置是示例性的,并不限于三维冠状动脉模型。本发明的cfd-lpm联系血流模拟方法及装置可以应用于三维脑血管模型等人体器官的任意三维血管模型。
此外,本说明书中描述的实施例本发明的方法旨在为了描述根据本发明的方法而促进视觉理解。数字图像是对诸如血管的对象的数字表达,对数字图像的处理被描述为识别和操作对象物。这样的数字数据的处理是一种存储于计算机系统的存储器并在处理器中执行的虚拟处理。即,本发明的方法应被理解为存储于计算机系统的存储器并由计算机系统的处理器执行。
本发明的cfd-lpm联系血流模拟装置
图5是本发明的对对象固有的三维血管模型的血流模拟装置的示意图。本发明的装置700可以由通常的计算机系统构成。计算机系统包括处理器720和存储器730。处理器720执行存储于存储器730的计算机程序指令,以执行对本发明的对象固有的三维血管模型的血流模拟。此外,装置700可以包括用于存储数据的储存器750,用于显示模拟结果的显示器740、用于输入或输出数据的输入/输出单元760、以及网络接口710。医疗影像获取装置500提供用于生成对象固有的三维血管模型的医疗影像图像数据。医疗影像获取装置500是如同ct(ccta)、mri(mra)、超声影像摄影装置用于拍摄人体的三维图像数据的装置。医疗影像处理装置600是对从医疗影像获取装置500接收的医疗影像图像数据进行处理,以对位于(分割)感兴趣对象区域的三维形状进行建模的装置。医疗影像处理装置600可以是单独的计算机系统或用于在装置700中执行的计算机程序。
在本发明的cfd-lpm血流模拟装置的存储器730中存储有以程序语言编写本发明的权利要求1中记载的方法的计算机程序。在本发明的装置700中,由处理器720执行所述计算机程序,以执行基于权利要求中记载的方法的血流模拟。
对象固有的三维血管模型的生成
在人体的主要器官,例如心脏或大脑等主要器官中,血管分布于器官整体,以向构成器官的细胞供应血液。由心脏供应的血液通过动脉(artery)、小动脉(arteriole)、毛细血管(capillary)、小静脉(venule)、静脉(vein)而重新循环至心脏。微血管床由小动脉、毛细血管、小静脉构成。图4中示出微血管床(microvascularbed)和微血管床的lpm模型。小动脉的平均血管直径约为30μm,小静脉的平均血管直径约为20μm左右,毛细血管的平均直径约为8μm左右。
图6中示出心脏的冠状动脉的三维血管模型的一实施例。图6所示的三维冠状动脉模型100是通过对从医疗影像获取装置500提供的心脏ct图像数据(ccta图像数据)应用[专利文献1]中公开的算法来自动地分割对象固有的冠状动脉的结果。
三维冠状动脉模型100被区分为右冠状动脉102(rca)和左冠状动脉(104)。此外,左冠状动脉104被区分为左旋支动脉105(lcx)和左前降支动脉106(lad)。三维冠状动脉模型100由连接于主动脉的两个入口a1、a2、多个出口b1至b14、以及连接入口和出口的树状血管(bloodvessletree)构成。冠状动脉100的每个出口b1至b14的下游部虽然因技术上的难度未能从ct图像数据中分割下来,但通过连接于每个出口的直径较小的血管连接于微血管床(microvescularbed)。迄今为止为人所知的用于由三维医疗影像数据求三维血管模型的分割技术难以精确地分割血管的直径为1mm以下的血管。本实施例的三维冠状动脉模型100是血管的直径约为1mm以上的三维血管模型。
以往的对三维血管模型的cfd-lpm联系模拟方法
对于如图6所示的三维冠状动脉模型100,[专利文献4]中公开了以往的执行血流模拟的方法之一。图3示意性地示出[专利文献4]中公开的方法。参照图3,与lpm模型联系起来提供对三维血管模型100的每个出口的边界条件,以执行对三维cfd模型的血流模拟。
图7是对以往的三维冠状动脉模型100的cfd-lpm联系血流模拟方法的顺序图。首先,利用计算机系统接收患者的医疗影像图像数据,以生成三维冠状动脉模型100(s10)。作为医疗影像图像数据,当要进行对心脏的冠状动脉的分析时,使用ccta数据。当要进行对脑血管的分析时,可以使用mri数据。
接下来,生成用于分析所生成的三维冠状动脉模型100的有限元模型(三维mesh模型)(网格模型)(s20)。图8中间示出通过处理三维冠状动脉模型100来生成的三维冠状动脉网格模型150的一部分。由于对三维形状模型的有限元网格模型的生成方法是在cfd模拟技术领域中公知的方法,因而其具体说明从略。
接下来,将对血流的支配方程结合于冠状动脉网格模型150来生成用于对三维血管模型的血流分析的分析模型(cfd模型)(s30)。作为对血管的血流的支配方程,应用纳维-斯托克斯方程(navier-stokesequations)和对血流的连续性方程(continuityequations)。cfd模型被构成为将支配方程应用于构成三维网格模型的每个网格来表示有限元网格之间的物理关系的大型矩阵方程的形式。为了分析分析模型,应决定分析模型的入口及出口的边界条件。
接下来,生成用于与cfd模型联系起来决定cfd模型的出口的边界条件的lpm模型(s40)。lpm模型是用于决定模型的入口和出口的压力或向入口流入或向出口流出的流量(或血流的速度)的模型,将微血管床的血流特性以电阻和电容简化来表示。lpm模型的流特性根据构成lpm模型的电阻和电容值(电阻和电容参数值)来决定。
在[专利文献4]中公开的模拟方法中,通过无创地测量诸如血压、心输出量、血管长度等患者的生理特性功能值来设定lpm模型的参数值(s50)。在[专利文献3]中公开的模拟方法中,通过无创地测量诸如血压、心输出量、心肌质量等患者的生理特性值来设定lpm模型的参数值。设定作为cfd模型的入口的边界条件测量的血压pao。作为以往的模拟方法中使用的lpm模型,使用如图3所公开的lpm模型。
设定图3所示lpm模型的参数值后,如图3所示,将cfd模型与lpm模型联系起来执行模拟(s60)。输出对cfd模型的血流流动模拟结果,例如在正常状态下在三维血管模型内部流动的血液的压力、速度、流量(s70)。
在如上所述的以往的对三维血管模型的cfd-lpm联系血流模拟方法中,由于在未考虑三维血管模型的形状的lpm模型的参数来决定cfd模型的边界条件,因而存在无法准确地反映血流的生理学现象的问题。
本发明的新的对三维血管模型的cfd-lpm联系模拟方法
微血管床的血流力学特征,即阻力和顺应性由通过微血管床的血流的压力和流量而定,并且,通过微血管床的血流量受形成在血管的内部的狭窄病变的影响。本发明的新的cfd-lpm联系模拟方法是反映这样的生理学现象的模拟方法。本发明的cfd-lpm联系模拟方法是求与适合于执行血流力学模拟时通过微血管床的血流状态的微血管床相对应的lpm模型的参数并将其应用于模拟的方法。
图9是用于说明本发明的新的cfd-lpm联系模拟方法的顺序图。为了应用本发明的cfd-lpm联系血流模拟方法,假定作为模拟对象的特定器官的血管系统(bloodvesselsystem)满足以下四种生理学原理。
(假定1)
特定器官的血管系统的总阻力为构成血管系统的分支血管的阻力的并行分配的和。此外,血管系统的总阻力基于被推定为在血管系统中流动的血流量与血压的关系而定。
(假定2)
在用于与血管系统的每个分支联系起来的lpm模型中,动脉参数和微血管床参数串联连接。动脉参数包括动脉阻力ra和动脉顺应性ca,微血管床参数包括微血管床阻力rm和微血管床顺应性cm。在每个参数后面附以数字,以表示用于与参数联系起来的分支的编号。
(假定3)
连接于血管系统的每个分支的lpm模型的微血管床的阻力rm与微血管床的顺应性cm的乘积具有恒定的值作为时间常数(timeconstant)。
在血管系统的每个血管分支流动的血流利用通过心跳施加于从左心室喷出的血液的喷出压力来流动。因此,即使流经血管系统的每个分支的血流量存在差异,通过每个分支并被供应至微血管床的血流与通过微血管床并排向静脉的血流的周期应与心跳的周期(或施加于血液的喷出压力的周期)几乎等同。即,作为在每个微血管床流动的血流的特征之一的时间常数应几乎等同才可能满足对流向血管系统的分支-微血管床-静脉的血流的连续性方程。
另一方面,特定器官的氧需求量(demand)与血管的氧供应量(supply)应达到均衡。因此,从主动脉供应至特定器官的动脉血管系统的血液在每个分支同时到达末端组织,并进行氧交换后同时回收至静脉系统。实际上,据报道,进入心脏血管系统的氧饱和血液到达组织的时间几乎相似[非专利文献3],在没有极其严重的动脉的病变的情况下,该假定在生理学角度而言是合理的。这样的现象在肺中也曾被类似地观察到[非专利文献4]。此外,lpm模型的动脉阻力ra和动脉顺应性ca的乘积也将具有几乎恒定的值作为时间常数。
(假定4)
在图10所示的lpm模型中,与在每个分支流动的血流量无关地,与每个分支联系起来的动脉参数与微血管床参数之间的血压p0相同。即,假定连接于血管系统的每个分支的微血管床的上游的血压相同。这样的假定可以从图16所示的每个血液循环血管的血流速度和血管截面积图表中类推。如图16所示,通过毛细血管的血流的速度恒定。此外,毛细血管的平均直径恒定,约为8μm左右。因此,在毛细血管中,上游与下游之间的血压差将维持恒定。毛细血管的下游连接于静脉,静脉的血压具有几乎恒定的值,因而可以认为毛细血管上游的血压也恒定。此外,微血管床的阻力的大部分由毛细血管引起,因而可以假定相同的血压p0作用于血管系统的分支的微血管床邻近的上游。
满足上述假定的lpm模型的微血管床参数的计算方法
若对构成特定器官的血管系统的每个分支的动脉血管和其下游的微血管床做如上所述的四种假定,则可以推导出约束用于与每个分支联系起来的lpm模型的参数的关系式。
在推导关系式之前,假定根据对象的状态预先决定进入特定器官的动脉的理论血流量。例如,当对处于休息状态的对象进行血流模拟时,可以假定心脏的冠状动脉的心输出量co(cardiacoutput)的约4%左右的血液流入冠状动脉系统。此外,当模拟作为冠状动脉患者的临床中重要的指标的冠状动脉血流储备ffr(fractionalflowreserve)时,由于是对为患者施用腺苷以使微血管床膨胀的状态的血流模拟,因而可以假定休息状态下的冠状动脉血流量的约4.5倍的血流流入冠状动脉系统[非专利文献5]。此外,当进行对脑血流的血流模拟时,可以假定休息状态下的心输出量co的约15%流入脑血管系统。
这样的假定对象的特定状态的血流量的流入条件在现有的ffr模拟和脑血流分析相关技术中被广泛使用。在本发明中,假定对象的特定状态的推定血流量用于推定与cfd模型的出口边界条件联系起来的lpm模型的参数,以执行对三维血管模型的模拟。在本说明书中,将这样的推定血流量称为“理论血流量”。倘若三维血管模型的实际流动阻力几乎收敛于0时,理论血流量将接近实际的血流量。此外,三维血管模型的入口处的边界条件采用从对象直接测量的血压数据[非专利文献6]。此外,在本实施例中,假定cfd模型和lpm模型的血流的流动处于正常状态。
图10是用于当应用本发明的新的cfd-lpm联系血流模拟方法时与图6所示三维冠状动脉模型的每个出口联系起来的lpm模型200的一实施例。本实施例的lpm模型200虚拟地连接于图6所示三维冠状动脉模型100的每个分支(b1、b2、...、b13、b14)。在用于与三维冠状动脉模型100的每个分支联系起来的lpm模型中,分别串联连接有动脉参数210和微血管床参数210。动脉参数210包括并联连接的动脉阻力ra和动脉顺应性ca,微血管床参数210包括并联连接的微血管床阻力rm和微血管床顺应性cm(假定2)。在图9中,显示于lpm模型200的每个参数ra、ca、rm、cm之后的数字表示所联系起来的三维冠状动脉模型100的分支编号。例如,连接于分支1的lpm模型的动脉阻力为(ra,1),动脉顺应性为ca,1,微血管床阻力为rm,1,微血管床顺应性为cm,1。此外,当将cfd模型lpm模型联起来执行模拟时,q1是cfd模型中向分支1的出口流出的血流量,p1是用于为cfd模型的分支1的出口设定的边界条件。血流量qi通过对cfd模型的模拟求出,pi通过对lpm模型的计算求出。此外,pv是微血管床的小静脉之后的压力。
参照图10,用于与图6所示三维冠状动脉模型的每个分支联系起来的lpm模型的参数包括ra,i、ca,i、rm,i、cm,i。其中,i为分支的索引。此外,假定流入图6所示三维冠状动脉模型的理论血流量为qtot。理论血流量指在假定没有三维冠状动脉模型100的阻力的情况下可以流动的最大血流量。如所周知,当一般健康的正常人士处于休息状态时,心输出量co的约4%左右被供应至冠状动脉,并且,当通过腺苷诱导充血(hyperemia)时,为正常状态下的血流量的约4.5倍。就脑动脉而言,如所周知,在正常状态的情况下co的约15%被供应至脑动脉,并且,当通过二氧化碳或乙酰唑胺等药物使微血管床膨胀时,正常状态的约2倍左右的血流被供应至脑动脉[非专利文献7]。
当对图10所示lpm模型假定理论血流量qtot时,总阻力rtot可以通过下面的[数学式1]求出。在图10中,为方便起见,假定lpm模型的末端的静脉的压力pv为0。
[数学式1]
总阻力rtot被并行地分配至冠状动脉血管系统的每个分支的阻力。因此,总阻力rtot和每个分支的阻力满足如下面的[数学式2]和[数学式3]所示的关系(假定1)。其中,下标i表示分支的编号。
[数学式2]
ri=ra,i+rm,i
[数学式3]
其中,下标i为分支的编号,n为分支的总数。此外,ri为第i个分支的总阻力,ra,i为第i个分支的动脉阻力,rm,i为第i个分支的微血管床阻力。
此外,基于(假定4),图10所示lpm模型的每个分支的动脉阻力ra,i的下游压力等于p0。因此,如下面的[数学式4]和[数学式5]所示的关系成立。即,可以将血管系统的总阻力表示为总动脉阻力和总微血管床阻力的和。
[数学式4]
rtot=ra,tot+rm,tot
[数学式5]
其中,ra,tot为每个动脉阻力的和,rm,tot为微血管床阻力的和。
对[数学式3]、[数学式4]、[数学式5]重新进行整理,可以求如下[数学式6]。
[数学式6]
此外,基于(假定3),在微血管床阻力rm与微血管床顺应性c之间成立[数学式7]的关系。
[数学式7]
rm,1cm,1=rm,2cm,2=……=rm,ncm,n若通过选择对cfd模型执行模拟时给定的边界条件中预期为血流流量最多的分支选择作为基准分支(referencebranch)来重新整理上述[数学式7],则可以如[数学式8]表示。
[数学式8]
在上式中,下标“ref”指被预计为血流流动最多的分支的微血管床阻力和顺应性。基准分支用于便于说明,在实际计算中,被定位基准的分支并非必须有最多的血流流动。若将[数学式8]代入[数学式6],并对成为基准的分支进行整理,则获得下面的[数学式9]。
[数学式9]
若将上述[数学式9]对rm,ref重新进行整理,则如下面的[数学式10]所示。
[数学式10]
若从[数学式10]针对(rtot-ra,tot)值和每个分支求相对于基准分支的微血管床顺应性cm,ref的别的分支的微血管床顺应性cm,i的比率,则可以求基准分支的微血管床阻力rm,ref。
下面对当执行cfd-lpm联系血流模拟时求相对于基准分支的微血管床顺应性的别的分支的微血管床顺应性比率cm,i/cm,ref的方法进行说明。
微血管床顺应性cm,i指血液能够被储存于微血管床的程度。此外,微血管床顺应性cm,i被定义为相对于施加于微血管床的压力的变化的微血管床的体积的变化,可以如下面的[数学式11]表示。
[数学式11]
在[数学式11]中,为了引入流量的概念,以相对于时间的变化的压力和体积的变化表示。在本发明中,为了求对特定血管的分支的微血管床的顺应性cm,i,如下面的[数学式12]近似[数学式11]。
[数学式12]
在[数学式12]中,qi是第i个分支的血流量。此外,δpi/δτ表示相对于第i个分支中的时间的压力变化。
在本发明中,若以每个分支末端中的一个心搏周期期间的压力变化近似δpi,则δτ成为心搏周期。若利用[数学式12]在给定的边界条件下执行对cfd模型的血流模拟以求向每个分支流出的血流量qi,则可以求lpm模型的每个分支的微血管床的顺应性cm,i。求出lpm模型的每个分支的微血管床的顺应性cm,i后,可以利用[数学式10]求基准分支的微血管床阻力rm,ref。此外,求出基准分支的微血管床阻力rm,ref后,可以利用[数学式8]求其余分支的微血管床阻力rm,i和微血管床顺应性cm,i。
下文中,参照图9,利用如上所述的对lpm模型的参数的关系对本发明的cfd-lpm联系血流模拟方法进行详细说明。本发明的模拟的特征在于,与cfd模型的每个分支联系起来的图9所示lpm模型的微血管床参数并非预先设定,而是由cfd-lpm联系模拟而定,以符合cfd模型的形状。虽然本实施例是针对对象固有的冠状动脉的血流模拟的说明,但不限于此,凡是诸如脑血管的对象固有的器官的血管系统,则均可以应用。
首先,利用计算机系统接收患者的医疗影像图像数据,并生成三维冠状动脉模型100(s110)。就医疗影像图像数据而言,当要对心脏的冠状动脉进行分析时,使用ccta数据。当对脑血管进行分析时,可以使用mri数据。
接下来,生成用于分析所生成的三维冠状动脉模型100的有限元模型(三维mesh模型)(s120)。图8示出通过处理三维冠状动脉模型100而生成的三维冠状动脉网格模型150的一部分。由于对三维形状模型的有限元网格模型的生成方法是在cfd模拟技术;领域中公知的方法,因而其具体说明从略。
接下来,在三维冠状动脉网格模型150中结合关于血流流动的支配方程,以生成迪用于对三维血管模型进行血流分析的分析模型(cfd模型)(s130)。作为对cfd模型的分析方法,可以使用在[非专利文献8]或[非专利文献9]中使用的piso方式的fem(finiteelementmethod)。作为对血管的血流流动的支配方程,应用纳维-斯托克斯方程(navier-stokesequations)和对血流的连续性方程(continuityequations)。当假定非压缩性粘性流体时,对血流的支配方程用纳维-斯托克斯方程表示为如下面的[数学式13]和[数学式14]所示。
[数学式13]
[数学式14]
[数学式13]是流体的连续性方程,[数学式14]是动量守恒方程。上式中,ρ为流体的密度,u为速度矢量,t为时间,p为压力,μ粘性系数。
为了在三维冠状动脉网格模型150中结合对血流流动的支配方程,并离散化为用于血流分析方分析模型(cfd模型),应用fem的galerkin方法,最终,化为网格点处的代数方程。代数方程构成为表示有限元网格的网格点处的物理关系的大型矩阵方程的形式。利用计算机解网格点处的代数方程,可以求网格点处的血流速度和压力。对cfd模型的分析的最终结果被表示为三维网格模型的网格点处的速度和压力。为了对进行分析模型进行分析,决定分析模型的网格点处的初始条件和入口及出口的边界条件(s150)。
接下来,与cfd模型联系起来生成用于决定cfd模型的出口的边界条件的lpm模型(s160)。lpm模型是用于决定cfd模型的入口和出口的压力或向入口流入或向出口流出的流量(或血流的速度)的模型。在lpm模型中,阻力和顺应性简化表示微血管床的血流特性。此外,lpm模型的血流特性根据构成lpm模型的阻力和顺应性值(阻力和顺应性参数值)来决定。在lpm模型的参数中,先设定动脉参数ra,i、ca,i的值。动脉参数ra,i、ca,i的值是通过单独的方法预先求出的值。关于求lpm模型的动脉参数ra、ca的方法,将在后面进行描述。
接下来,设定在对象的特定状态下流入冠状动脉血管系统的理论血流量qtot。就理论血流量而言,可以使用从对象测量到的心率、搏出量(strokevolume,以下简称为sv)计算心输出量(cardiacoutput,简称为co)。此外,可以利用现有文献中已知的对流入特定器官的co的血流比率来推定流入对象的特定器官的血流量并用作理论血流量qtot。如所周知,在休息状态下,在心脏的情况下,血流流入比率为co的4%左右,在脑血管的情况下,血流流入比率为15%左右[非专利文献10]。此外,当要进行对作为向对象施用血管扩张剂的情况的充血状态(hyperemicstate)的血流模拟时,可以使用文献中已知的充血状态下的血流比率。如所周知,当对象处于充血状态下时,在冠状动脉的情况下,流入休息期的约4.5倍,在脑血管的情况下,流入2-3倍左右[非专利文献10]。求出对象的理论流量qtot后,利用从对象测量到的动脉血压pao,根据[数学式1]求冠状动脉血管系统的总阻力rtot。
接下来,对在执cfd-lpm联系模拟时求lpm模型的微细血管参数rm,i、cm,i的方法进行说明。在执行cfd-lpm联系模拟之前,在三维冠状动脉模型中选择基准分支(reference分支)。选择基准分支时,了方便起见,可以选择截面积最大且长度最长的分支。这是因为,推定为大量的流量会流向截面积大且长度长的分支的较合理。
设定除微细血管参数外的lpm模型的参数值,并设定cfd模型的边界条件后,首先在给定的边界条件下执行对cfd模型的模拟(s170)。在最初的对cfd模型的模拟中,可以设定从对象测量的血压pao作为cfd模型的入口边界条件,并且模型的每个分支的出口边界条件可以任意地设定。为方便起见,可以将所测量的血压的50%以上的血压设定为每个出口的压力边界条件。
接下来,由在既定的初始条件和边界条件下执行的对cfd模型的模拟结果求向每个分支的出口流出的流出血流量qi,并求向每个分支流出的流量的和,即总流出血流量qtot_cfd(s190)。其中,i为分支的索引。
接下来,利用cfd模型的每个出口的流出流量qi计算每个分支的微血管床参数rm,i、cm,i(s200)。计算微血管床参数rm,i、cm,i的顺序如下。首先,计算向cfd模型的每个出口流出的血流量qi,并通过将计算出的结果应用于[数学式12]来求每个分支的微血管床顺应性cm,i。接下来,利用求出的每个分支的微血管床顺应性cm,i和[数学式10]来求基准分支的阻力rm,ref,并利用[数学式8]求其余微血管床阻力rm,i。
接下来,为了向cfd模型的每个分支提供更新后的边界条件,使用先前求出的微血管床参数rm,i、cm,i来更新lpm模型的微血管床参数(s210)。
接下来,利用更新后的lpm模型重新设定cfd模型的每个出口的边界条件(s220)。为了重新设定cfd模型的每个出口的边界条件,首先,计算推定为流向更新后的lpm模型的每个分支的虚拟lpm血流量qlpm,i。流向每个分支的虚拟lpm血流量qlpm,i利用在步骤s190中求出的cfd模型的总流出流量qtot_cfd来计算。每个分支的虚拟lpm血流量qlpm,i通过将总流出血流量qtot-cfd以与在步骤s200求出的每个分支的微血管床阻力rm,i成反比的比率分配至每个分支来求。将总流出血流量qtot_cfd以与更新后的微血管床阻力rm,i成反比的比率分配由假定4支持。这是因为,当假定相同的压力p0作用于连接到每个分支的微血管床的上游,且相同的pv的压力作用于微血管床下游时,通过每个微血管床的血流量会与微血管床的阻力成反比。即,由qi=(p0-pv)/rm,i的关系可知,通过每个微血管床的血流与阻力成反比。
求出对更新后的lpm模型的每个分支的虚拟lpm血流量qlpm,i后,使用下面的[数学式15]重新设定对应于每个虚拟lpm血流量qlpm,i的cfd模型的分支的出口边界条件。
[数学式15]
pi=(ra,i+rm,i)×qlpm,i
其中,pi是为cfd模型的每个分支的出口更新设定的边界条件血压;ra,i是预先设定的lpm模型的动脉阻力;rm,i是通过cfd模拟更新后的lpm模型的微血管床阻力;并且qlpm,i为将总流出血流量qtot_cfd以与更新后的每个lpm微血管床阻力rm,i成反比的方式分配的虚拟lpm血流量。
接下来,增加迭代执行索引(iter)(s230),并重新对具有更新后的边界条件的cfd模型的血流模拟(s170),并反复执行上述步骤s170至步骤s220,直至满足对cfd模型的模拟的收敛条件(s180)。就迭代执行索引而言,也可以以反复预定的反复次数的方式设定界限。此外,作为迭代执行索引,也可以使用规定的时间间隔的增量δt的时间推进算法(timemarchingalgorithm)。
判断如上所述的反复性的cfd-lpm联系血流模拟结果是否收敛的收敛条件可以有多种。例如,当计算出的cfd模型区域的各网格点处的rms(rootmeansquare)误差为预定的规定的值以下时,可以判断为满足收敛条件,并输出对三维血管模型的血流信息(s240)。所输出的对三维血管模型的血流信息是压力和血流的速度。
此外,经将通过cfd-lpm联系模拟更新的lpm模型的微血管床参数rm,i、cm,i以及向每个分支输出的血流量qi的值与先前步骤的值进行比较,当其差为预定的值以下时,可以判断为满足收敛条件,并输出对三维血管模型的血流信息(s240)。此外,也可以通过分别应用或以从重复的方式应用前述收敛条件来修改收敛条件。
本发明的cfd-lpm联系血流模拟方法区别于以往的方法的最大的特征在于,lpm模型的微血管床参数通过cfd模拟来决定。若再次说明,根据形成于三维血管模型的狭窄或血管的大小及形状以适合向分支流出的血流量的方式更新微血管床参数,并在由更新后的微血管床参数决定的边界条件下反复地执行对cfd模型的血流模拟来决定微血管床参数。这样的血流力学模拟方法是符合微血管床的血流力学特征根据连接于微血管床的动脉的血流力学状态(动脉末端的血压及向动脉末端流出的血流量)适当地变化的生理学现象的方法。
求lpm模型的动脉参数的方法
下面对求lpm模型的动脉参数的方法进行说明。lpm模型的动脉参数是对象的固有血管系统的每个血管分支的血流力学特征,即动脉分支的阻力和顺应性。
这样的求动脉分支的血流力学特征的方法之一是测量流经每个分支的血流量的方法。流经分支的血流量可以有创地或无创地测量。例如,可以将导丝有创地插入于血管来直接测量血压或血流速度。或者,也可以利用四维医疗影像摄影装置测量血流速度。
作为无创地求动脉分支的血流力学特征的方法,有利用三维血管模型的形状的方法。例如,是通过测量三维血管模型的每个分支的长度来推定流向每个分支的血流量的方法。关于基于血管的长度来求动脉血管的血流力学特征的方法,可以利用[专利文献4]中公开的方法。
图11是基于血管长度来求动脉血管的血流力学特征的方法的示意图。参照图11,通过如图示测量利用心脏ct图像数据来生成的对象的三维冠状动脉模型的每个分支来求总血管长度lsum。当求三维冠状动脉模型时,优选使所有分支的末端直径为既定的值以上。例如,优选使分支末端的直径为1mm以上。接下来,如图11所示,从如图示通过实验获得的图表求对应于总血管长度lsum的理论血流量ql。决定理论血流量ql后,从如图11所示通过实验获得的图表求对应于理论血流量的对冠状动脉血管系统的动脉的总阻力rl。求出对冠状动脉血管系统动脉的总阻力后,将总阻力以与每个分支的长度成反比的比率分配来求每个分支的阻力。
作为无创地求动脉分支的血流力学特征的方法,有利用三维血管模型的形状的另一种方法。例如,是通过测量三维血管模型的每个分支的截面积来推定流向每个分支的血流量的方法。该方法基于根据murray'srule(默里定律)的理论流量分配,在现有研究中被广为使用[非专利文献5]。该方法根据murray'srule来为每个分支分配理论流量,并基于所分配的理论流量来决定每个分支的阻力和顺应性。例如,如图12所示,当一个大的分支分为2个小的分支时,对每个分支的理论流量的分配可以利用下面的[数学式16]求出。
[数学式16]
通过cfd-lpm联系模拟来求lpm模型的动脉参数的方法
作为无创地求动脉分支的血流力学特征的方法,有利用三维血管模型的形状的又一种方法。例如,如图13所示利用cfd-lpm联系血流模拟方法来求动脉分支的血流力学特征的方法。
可以认为对象固有的血管的血流力学特征是由血管的形状和材质而定的性质。即,可以认为流经血管的血流的阻力是由血管的几何学形状和尺寸决定的血管的特征。此外,可以认为血管的顺应性是主要由血管的弹性决定的血管的特征。此外,知道对象的特定的状态下的cfd模型的边界条件,便可通过对cfd模型的血流模拟来求cfd模型的血管分支的血流力学特征,即血管分支的阻力和顺应性。因此,设定对象的特定状态下的cfd模型的边界条件,并执行对对象固有的cfd模型的模拟,便可求由对象固有的cfd模型的形状决定的对血管的血流力学特征。此外,即使对象的状态由休息状态变更为运动状态,若血管的形状和物性没有大的变化,则对血管的血流的阻力和顺应性将不会有大的变化。即使随着对象的运动状态的变化,血管的物性值发生变化,根据本发明的方法,将对象的状态变化引起的特性变化容纳为lpm模型的微血管床参数变化。因此,根据本发明的方法,可以求对对象的休息状态的血管的动脉参数,并用作lpm模型的动脉参数。
图13所示的求动脉分支的血流力学特征的方法与图9所示的cfd-lpm联系血流模拟方法在两个方面存在差异。
第一、如图14所示,使用仅由动脉参数构成的lpm模型300。第二、在cfd-lpm联系模拟中,在将lpm模型的每个分支的动脉参数下游的血压均固定为相同的血压p0的状态下执行cfd-lpm联系血流模拟。
优选所述p0血压被设定为对象处于休息状态时的血压。对象处于休息状态时的血压p0可以被设定为从对象测量的血压的80%~95%的范围的血压。图15是血液循环引起的每个血管的血压的变化图表。参照图15,可以看出,在血流循环系统中,血流的平均血压的值在动脉中几乎恒定,而在血流通过小动脉和毛细血管时急剧下降。即,在动脉中,由于平均血压几乎维持不变,因而血流阻力非常小,而在毛细血管床中,由于平均压力迅速下降,因而阻力非常大。因此,当对象处于休息状态时,可以认为即使将动脉参数下游的血压p0设定为测量血压的80%~95%也符合生理现象。
下面参照图14对图13所示的方法进行详细说明。在用于求动脉参数的模拟中,同样地,与cfd模型的每个分支联系起来的图14所示的lpm模型的动脉参数并非预先设定,而是与cfd模型的形状相符地通过cfd-lpm联系模拟来求。
在图13所示的实施例中,通过接收对象的心脏医疗影像图像来生成三维血管模型、三维网格模型、以及cfd模型的过程s310至s330与在图9中描述的过程相同。
生成对象固有的cfd模型后,设定对象处于特定状态时的总血流量和总阻力(s340)。当将特定状态设为休息状态时,在如本实施例的心脏的情况下,总血流量qtot(理论血流量)可以被设定为对象的co的4%。在脑血管的情况下,血流比率被设定为15%左右。总阻力可以通过rtot=(pao-p0)/qtot求出。
接下来,为了对分析模型进行分析,决定分析模型的网格点处的初始条件和入口及出口的边界条件(s350)。
接下来,生成用于决定cfd模型的出口的边界条件的lpm模型(s360)。作为lpm模型,如图14所示,使用仅由没有微血管床参数的动脉参数构成的模型。
接下来,执行用于求lpm模型的动脉参数ra、ca的cfd–lpm联系模拟。在执行cfd-lpm联系模拟之前,从三维冠状动脉模型选择基准分支(reference分支)。
接下来,在给定的边界条件下执行对cfd模型的模拟(s370)。可以设定从对象测量到的血压pao作为cfd模型的入口边界条件,并任意地设定模型的每个分支的出口的边界条件。为方便起见,优选将测量出的血压的50%以上的相同的血压设定为出口的压力边界条件。
接下来,在既定的初始条件和边界条件下从对cfd模型的模拟结果求流向每个分支的出口的流出血流量qi,并求向每个分支流出的流量的和,即总流出血流量qtot_cfd(s390)。其中,i为分支的索引。
接下来,利用cfd模型的每个出口的流出流量qi计算每个分支的动脉参数ra,i、ca,i(s400)。首先,将向cfd模型的每个出口流出的血流量应用于[数学式12]来求每个分支的动脉顺应性ca,i。此外,利用每个分支的动脉顺应性ca,i和先前所选择的基准分支的动脉顺应性ca,ref求每个分支的动脉阻力ra,i。首先,利用[数学式10]求基准分支的阻力ra,ref,并利用[数学式8]求其余微血管床阻力ra,i。
接下来,利用先前求出的动脉参数ra,i、ca,i更新lpm模型的动脉参数(s410)。
接下来,利用更新后的lpm模型重新设定cfd模型的每个出口的边界条件(s420)。为了重新设定cfd模型的每个出口的边界条件,首先推定预计流经更新后的lpm模型的每个分支的虚拟lpm血流量qlpm,i。流经每个分支的虚拟lpm血流量qlpm,i利用在步骤s390中求出的cfd模型的总流出流量qtot_cfd来计算。每个分支的虚拟lpm血流量qlpm,i通过将总流出血流量(qtot-cfd)以与在步骤s400中求出的每个分支的动脉阻力ra,i成反比的比率分配至每个分支来求。
求出对更新后的lpm模型的每个分支的虚拟lpm血流量qlpm,i后,利用下面的[数学式15]重新设定对应于每个虚拟lpm血流量qlpm,i的cfd模型的分支的出口边界条件。此时,将[数学式15]中的微血管床阻力rm,i设为0。
接下来,增加迭代执行索引iter(s430),并利用更新后的边界条件执行对cfd模型的血流模拟(s370),并反复执行上述步骤s370至s420,直至满足对cfd模型的模拟的收敛条件(s380)。判断如上所述的反复性的cfd-lpm联系血流模拟结果是否收敛的收敛条件可以有多种。例如,当计算出的cfd模型区域的各网格点处的rms(rootmeansquare,均方根)误差为预定的值以下时,判断为满足收敛条件,并输出对每个动脉分支的ra,i、ca,i值(s440).
此外,将通过cfd-lpm联系模拟更新的lpm模型的微血管床参数ra,i,ca,i及向每个分支输出的血流量qi的值与之前步骤的值进行比较,当其差为预定的值以下时,可以判断为满足收敛条件,并输出对每个动脉分支的ra,i、ca,i值(s440)。此外,也可以通过分别应用或以重叠的方式应用前述收敛条件来修改收敛条件。
通过前述方法对针对对象固有的血管的三维血管模型执行血流模拟,可以首次获得对三维血管模型的血压和血流速度。此外,可以利用通过模拟计算出的血压和血流速度求流经每个分支的血流量、壁面剪切应力(wss)、每个血管的分支的阻力和顺应性、以及微血管床的阻力和顺应性。此外,也可以利用模拟结果计算针对多种对象固有的冠状动脉的血流力学兴趣量(hemodynamicquantitiesofinterest)。作为血流力学兴趣量,例如有冠状动脉血流储备分数ffr(fractionalflowreserve)、冠状动脉血流储备cfr(coronaryflowreserve)、微血管床阻力指数imr(indexofmicrovascularresistance)、瞬时无波形比率ifr(instantaneouswave-freeratio)、基础pd/pa(basalpd/pa)、基础狭窄阻力(basalstenosisresistance)、充血狭窄阻力(hyperemicstenosisresistance)等。
- 还没有人留言评论。精彩留言会获得点赞!