组蛋白乙酰基转移酶调节剂及其组合物和用途的制作方法
组蛋白乙酰基转移酶调节剂及其组合物和用途
1.相关申请的交叉引用
2.本技术要求2019年2月8日提交的标题为“组蛋白乙酰基转移酶(hat)调节剂及其用途(histone acetyltransferase(hat)regulators and uses thereof)”的美国临时专利申请号62/803,195的权益,其通过引用并入本文。
3.背景
4.已知组蛋白、转录因子和其它调节蛋白的乙酰化状态的调节影响它们在神经元细胞、癌症细胞和炎症细胞内的活性。蛋白的乙酰化状态由两个主要组的酶(组蛋白脱乙酰基酶(hdac)和组蛋白乙酰基转移酶(hat))的活性控制。hdac除去乙酰基基团,而hat将乙酰基基团转移至目标蛋白。
5.认知性神经变性障碍的特征在于突触功能障碍、认知异常和/或遍布于cns的包涵体的存在,所述包涵体含有例如、但不限于以不同百分比存在和与特定疾病相关的天然β
‑
淀粉样蛋白片段、天然和磷酸化的tau、天然和磷酸化的α
‑
突触核蛋白、脂褐素、切割的tardbp(tdb
‑
43)、淀粉样蛋白
‑
β(aβ)的寡聚体、tau和α
‑
突触核蛋白。
6.阿尔茨海默氏病(ad)是不可逆的神经变性疾病,其特征在于记忆丧失、突触功能障碍和淀粉样蛋白β
‑
肽(aβ)的积累。ad的发病机制被认为是由脑中淀粉样蛋白
‑
β(aβ)的高水平及其聚集造成。已经发现aβ通过减少对记忆形成重要的特定组蛋白赖氨酸的乙酰化来损害记忆。组蛋白是与dna分子紧密缔合并在基因转录中起重要作用的蛋白。
7.目前可得到的ad疗法是姑息性的并且不治愈疾病。胆碱酯酶抑制剂诸如(加兰他敏)、(利凡斯的明)、(多奈哌齐)和(他克林)已开处方用于阿尔茨海默氏病的早期阶段,并且可以暂时延缓或防止与ad有关的症状的进展。然而,随着ad进展,脑失去较少的乙酰胆碱,从而使胆碱酯酶抑制剂作为ad的治疗无效。(美金刚)即一种n
‑
甲基d
‑
天冬氨酸(nmda)拮抗剂也被开处方用于治疗中度至重度阿尔茨海默氏病;但仅实现临时益处。
8.经典地,已知乙酰化状态的调节影响染色质的凝缩。在癌症中,组蛋白被脱乙酰化,从而保持凝缩的染色质结构和转录沉默状态。该转录失活由hdac介导,所述hdac从组蛋白尾部除去乙酰基基团,保持凝缩的染色质的结构。hdac的抑制剂有助于保持具有转录活性的染色质,在理论上允许肿瘤抑制基因的表达。已经逐步形成的一个观察是,组蛋白不是乙酰化的唯一靶标。现在接受的是,细胞内蛋白诸如肿瘤抑制基因(p53)和癌基因(bcl6)的翻译后乙酰化在影响它们的活性中起关键作用。已经确定的是,存在可通过乙酰化而修饰的蛋白和酶的网络,现在被统称为乙酰化组(acetylome)。
9.组蛋白乙酰基转移酶(hat)参与组蛋白乙酰化(导致基因活化)、染色体去凝缩、dna修复和非组蛋白底物修饰。染色质的翻译后乙酰化状态由两类酶hat和hdac的竞争活性控制。已经广泛研究了抑制hdac以抵抗神经变性障碍的潜力(curr drug targets cns neurol disord,2005.4(1):第41
‑
50页;特此通过引用整体并入)。然而,已经在较低程度上研究hat。已报道了hat活化剂,但是许多既不是可溶性的也不是膜透性的,这使得它们成为
治疗剂的差候选物。ctpb和ctb是不溶性且膜不可渗透的hat活化剂(j phys chem b,2007.111(17):第4527
‑
34页;j biol chem,2003.278(21):第19134
‑
40页;每篇特此通过引用整体并入)。nemorosone是另一种hat活化剂(chembiochem.11(6):第818
‑
27页;特此通过引用整体并入)。然而,这些化合物具有用于cns疾病的不利的物理化学特性。
10.需要新型的hat活化剂。还需要对涉及hat活性的多种疾病状态的新型治疗。进一步需要针对神经变性疾病、神经障碍和癌症的新型且有效的治疗。具体地,持续需要与阿尔茨海默氏病相关的痴呆和记忆丧失的治疗。还存在对治疗癌症的持续需要。
技术实现要素:
11.本公开内容涉及调节hat活性的化合物和组合物以及它们用于治疗神经变性疾病或癌症的方法。在不同的实施方案中,调节hat活性的化合物可以是hat活化剂或hat抑制剂。因而,药物组合物可以包含hat调节性化合物,且所述方法可以包括给受试者施用调节hat活性的化合物或组合物。
12.在某些实施方案中,本公开内容提供了式(i)的化合物,
[0013][0014]
其中,
[0015]
x是
‑
c(o)n(r
a1
)
‑
或
‑
n(r
a2
)c(o)
‑
;
[0016]
y是
‑
c1‑6‑
烷基、烷基、
[0017]
z
a
和z
b
各自独立地是ch或n;
[0018]
r
a1
和r
a2
各自独立地是h、
‑
c1‑3烷基、
‑
(ch2)
m
‑
r
c
;
[0019]
r
b
是h、卤素、
‑
oh、
‑
o
‑
c1‑6‑
烷基;
[0020]
r
c
是
‑
oh、
‑
o
‑
烷基、
‑
nh(c1‑3‑
烷基)或
‑
n(c1‑3‑
烷基)2;
[0021]
r
d
是
‑
oh、
‑
ome、
‑
oet、
‑
o
‑
(ch2)
n
‑
r
e1
、
‑
n(h)
‑
(ch2)
n
‑
r
e2
;或
‑
n(me)
‑
(ch2)
n
‑
r
e2
;
[0022]
r
e1
和r
e2
各自独立地是
‑
oh、
‑
ome、
‑
nh2、
‑
nhme、
‑
nme2、
‑
nhet或
‑
net2;
[0023]
m是1、2或3;且
[0024]
n是2或3,
[0025]
前提条件是,
[0026]
当x是
‑
c(o)n(h)
‑
、y是z
a
是
‑
ch和r
b
是
‑
ome或
‑
oet时,r
d
不是
‑
oh、
‑
o
‑
(ch2)2‑
nme2、
‑
o
‑
(ch2)2‑
net2、
‑
o
‑
(ch2)3‑
nme2、
‑
o
‑
(ch2)3‑
net2或
‑
n(h)
‑
(ch2)2‑
nme2;
[0027]
当x是
‑
c(o)n(h)
‑
、y是z
a
是
‑
ch和r
b
是h时,r
d
不是
‑
oh、
‑
ome、
‑
oet、
‑
o
‑
(ch2)2‑
nme2或
‑
n(h)
‑
(ch2)2‑
nme2;
[0028]
当x是
‑
c(o)n(me)
‑
、y是z
a
是
‑
ch和r
b
是
‑
oet时,r
d
不是
‑
o
‑
(ch2)2‑
nme2;和
[0029]
当x是
‑
c(o)n(me)
‑
、y是z
a
是
‑
ch和r
b
是
‑
oh时,r
d
不是
‑
oh。
[0030]
在某些实施方案中,本文中公开的药物组合物包含式(i)的化合物和药学上可接受的赋形剂。在某些实施方案中,式(i)的化合物是hat活化剂。在其它实施方案中,式(i)的化合物是hat抑制剂。
[0031]
在某些实施方案中,本公开内容提供了增加受试者中的组蛋白乙酰化的方法,所述方法包括给所述受试者施用治疗有效量的式(i)的化合物或包含式(i)的化合物的组合物。
[0032]
在某些实施方案中,本公开内容提供了在有此需要的受试者中治疗神经变性疾病或病症的方法,所述方法包括给所述受试者施用治疗有效量的式(i)的化合物或包含式(i)的化合物的组合物。
[0033]
在某些实施方案中,本公开内容提供了在有此需要的受试者中治疗癌症的方法,所述方法包括给所述受试者施用治疗有效量的式(i)的化合物或包含式(i)的化合物的组合物。
附图说明
[0034]
图1a和图1b提供了对于ra010115的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0035]
图2提供了对于ra010143的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0036]
图3a和图3b提供了对于ra010146的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0037]
图4a和图4b提供了对于ra010155的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0038]
图5a和图5b提供了对于ra010159的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0039]
图6a和图6b提供了对于ra010160的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0040]
图7a和图7b提供了对于ra010162的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0041]
图8a和图8b提供了对于ra010163的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0042]
图9a和图9b提供了对于ra010165的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0043]
图10a和图10b提供了对于ra010168的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0044]
图11a和图11b提供了对于ra010171的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0045]
图12a和图12b提供了对于在dmso中的ra010900的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0046]
图13a和图13b提供了对于在水中的ra010900的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0047]
图14a和图14b提供了对于ra013005的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0048]
图15提供了对于ra013011的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0049]
图16a和图16b提供了对于ra013012的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0050]
图17a和图17b提供了对于ra013886的赖氨酸残基乙酰化的平均值和标准误差范围的图。
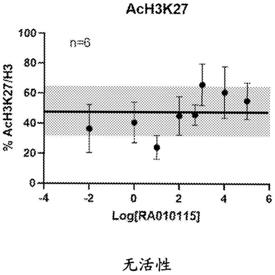
[0051]
图18a和图18b提供了对于ra013894的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0052]
图19a和图19b提供了对于ra013905的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0053]
图20a和图20b提供了对于ra013915的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0054]
图21a和图21b提供了对于ra013917的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0055]
图22a和图22b提供了对于ra013919的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0056]
图23a和图23b提供了对于ra013928的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0057]
图24a和图24b提供了对于ra013931的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0058]
图25a和图25b提供了对于ra013938的赖氨酸残基乙酰化的平均值和标准误差范围的图。
[0059]
图26的图表明,ra010115挽救(rescue)寡聚体tau(otau)
‑
和aβ(oaβ)诱导的ltp缺乏。
[0060]
图27的图表明,ra010115在空间短期记忆的2天放射臂水迷宫试验中挽救otau
‑
和oaβ诱导的缺陷(defect)。
[0061]
图28的图表明,ra010115在情境恐惧记忆中挽救otau
‑
和oaβ诱导的缺陷。
[0062]
图29显示了在有和没有ra010115的情况下,在存在otau和oaβ的情况下,在提示性恐惧联想记忆试验(cued fear associative memory test)中的平均僵硬(freezing)的图。
[0063]
图30a和图30b显示了在有和没有ra010115的情况下,在存在otau和oaβ的情况下,到达位于水面上方的平台的平均时间和速度的图。
[0064]
图31a和图31b显示了在有和没有ra010115的情况下,在存在otau和oaβ的情况下,小鼠在开放场试验中的表现。绘制了在场地中央花费的时间(a)和进入中央的次数(b)。
[0065]
图32表明,感觉阈不受otau和oaβ的存在以及有和没有ra010115影响。
[0066]
图33的图表明,ra013915挽救寡聚体tau(otau)
‑
和aβ(oaβ)诱导的ltp缺乏。
具体实施方式
[0067]
在以下描述中,阐述了某些特定细节以便提供对各种实施方案的透彻理解。但是,本领域技术人员会理解,可以在没有这些细节的情况下实践本发明。在其它情况下,没有详细示出或描述众所周知的结构以避免不必要地模糊实施方案的描述。
[0068]
如本文所定义和使用的所有定义应理解为优先于字典定义、通过引用并入的文件中的定义和/或所定义术语的普通含义。流程图的使用并不意味着关于所有实施方案执行的操作顺序的限制。除非明确地相反指出,否则本文在说明书中和在权利要求中使用的不定冠词“一个/种(a)”和“一种/个(an)”应当被理解为是指“至少一个/种”。
[0069]
贯穿本说明书对“一个实施方案”或“实施方案”等的提及意指,与所述实施方案关联描述的特定特征、结构或特性被包括在至少一个实施方案中。因而,在贯穿本说明书的不同地方出现的短语“在一个实施方案中”或“在实施方案中”不一定都指同一个实施方案。此外,特定特征、结构或特性可以以任何适合方式组合在一个或多个实施方案中。并且,如在本说明书和所附权利要求中使用的,单数形式“一种”、“一个”和“所述”包括复数指示物,除非上下文另外清楚地指示。还应当指出,术语“或”通常以它的包括“和/或”的含义使用,除非上下文另外清楚地指示。
[0070]
如本文在说明书中和在权利要求中使用的,关于一个或多个要素的列表的短语“至少一个”应当被理解为是指至少一个选自要素列表中的任意一个或多个要素的要素,但不一定包括在所述要素列表内明确地列出的每个和每一个要素中的至少一个,且不排除所述要素列表中的要素的任意组合。该定义还允许除了在短语“至少一个”所指的要素列表中明确地指出的要素之外的要素可以任选地存在,无论与明确地指出的那些要素有关还是无关。因而,作为非限制性例子,“a和b中的至少一个”(或等效地“a或b中的至少一个”,或等效地“a和/或b中的至少一个”)可以在一个实施方案中表示至少一个(任选地包括超过一个)a、且不存在b(且任选地包括除了b以外的要素);在另一个实施方案中,表示至少一个(任选地包括超过一个)b、且不存在a(且任选地包括除了a以外的要素);在另一个实施方案中,表示至少一个(任选地包括超过一个)a和至少一个(任选地包括超过一个)b(且任选地包括其它要素);等。
[0071]
在权利要求中以及在上述说明书中,所有过渡短语诸如“包含”、“包括”、“携带”、“具有”、“含有”、“涉及”、“持有”、“组成(composed of)”等应当理解为开放式的,即,意在包
括、但不限于。仅过渡短语“由
……
组成(consisting of)”和“基本上由
……
组成”应当分别是封闭式或半封闭式过渡短语,如在美国专利局专利审查程序手册(united states patent office manual of patent examining procedures)第2111.03部分中所述。
[0072]“烷基”或“烷基基团”表示完全饱和的、直链或支链烃链残基,并且其通过单键连接至分子的其余部分。包括含有从1个至12个的任何数目的碳原子的烷基。包含至多12个碳原子的烷基是c1‑
c
12
烷基,包含至多10个碳原子的烷基是c1‑
c
10
烷基,包含至多6个碳原子的烷基是c1‑
c6烷基,并且包含至多5个碳原子的烷基是c1‑
c5烷基。c1‑
c5烷基包括c5烷基、c4烷基、c3烷基、c2烷基和c1烷基(即,甲基)。c1‑
c6烷基包括上文关于c1‑
c5烷基描述的所有部分,但还包括c6烷基。c1‑
c
10
烷基包括上文关于c1‑
c5烷基和c1‑
c6烷基描述的所有部分,但还包括c7烷基、c8烷基、c9烷基和c
10
烷基。类似地,c1‑
c
12
烷基包括所有前述部分,但还包括c
11
烷基和c
12
烷基。c1‑
c
12
烷基的非限制性例子包括甲基、乙基、正丙基、异丙基、仲丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、叔戊基、正己基、正庚基、正辛基、正壬基、正癸基、正十一烷基和正十二烷基。除非在说明书中另外具体地说明,否则烷基基团可以任选地被取代。
[0073]“亚烷基”或“亚烷基链”表示完全饱和的、直链或支链二价烃链残基。包括含有从1个至12个的任何数目的碳原子的亚烷基。c1‑
c
12
亚烷基的非限制性例子包括亚甲基、亚乙基、亚丙基、亚正丁基、亚乙烯基、亚丙烯基、亚正丁烯基、亚丙炔基、亚正丁炔基等。亚烷基链通过单键连接至分子的其余部分并且通过单键连接至残基基团。亚烷基链与分子的其余部分的连接点以及与残基基团的连接点可以是通过该链内的一个碳或任何两个碳。除非在说明书中另外具体地说明,否则亚烷基链可以任选地被取代。
[0074]“烯基”或“烯基基团”表示具有从2个至12个碳原子并且具有一个或多个碳
‑
碳双键的直链或支链烃链残基。每个烯基基团通过单键连接至分子的其余部分。包括含有从2个至12个的任何数目的碳原子的烯基基团。包含至多12个碳原子的烯基基团是c2‑
c
12
烯基,包含至多10个碳原子的烯基是c2‑
c
10
烯基,包含至多6个碳原子的烯基基团是c2‑
c6烯基,并且包含至多5个碳原子的烯基是c2‑
c5烯基。c2‑
c5烯基包括c5烯基、c4烯基、c3烯基和c2烯基。c2‑
c6烯基包括上文关于c2‑
c5烯基描述的所有部分,但还包括c6烯基。c2‑
c
10
烯基包括上文关于c2‑
c5烯基和c2‑
c6烯基描述的所有部分,但还包括c7烯基、c8烯基、c9烯基和c
10
烯基。类似地,c2‑
c
12
烯基包括所有前述部分,但还包括c
11
烯基和c
12
烯基。c2‑
c
12
烯基的非限制性例子包括乙烯基(ethenyl)(乙烯基(vinyl))、1
‑
丙烯基、2
‑
丙烯基(烯丙基)、异丙烯基、2
‑
甲基
‑1‑
丙烯基、1
‑
丁烯基、2
‑
丁烯基、3
‑
丁烯基、1
‑
戊烯基、2
‑
戊烯基、3
‑
戊烯基、4
‑
戊烯基、1
‑
己烯基、2
‑
己烯基、3
‑
己烯基、4
‑
己烯基、5
‑
己烯基、1
‑
庚烯基、2
‑
庚烯基、3
‑
庚烯基、4
‑
庚烯基、5
‑
庚烯基、6
‑
庚烯基、1
‑
辛烯基、2
‑
辛烯基、3
‑
辛烯基、4
‑
辛烯基、5
‑
辛烯基、6
‑
辛烯基、7
‑
辛烯基、1
‑
壬烯基、2
‑
壬烯基、3
‑
壬烯基、4
‑
壬烯基、5
‑
壬烯基、6
‑
壬烯基、7
‑
壬烯基、8
‑
壬烯基、1
‑
癸烯基、2
‑
癸烯基、3
‑
癸烯基、4
‑
癸烯基、5
‑
癸烯基、6
‑
癸烯基、7
‑
癸烯基、8
‑
癸烯基、9
‑
癸烯基、1
‑
十一碳烯基、2
‑
十一碳烯基、3
‑
十一碳烯基、4
‑
十一碳烯基、5
‑
十一碳烯基、6
‑
十一碳烯基、7
‑
十一碳烯基、8
‑
十一碳烯基、9
‑
十一碳烯基、10
‑
十一碳烯基、1
‑
十二碳烯基、2
‑
十二碳烯基、3
‑
十二碳烯基、4
‑
十二碳烯基、5
‑
十二碳烯基、6
‑
十二碳烯基、7
‑
十二碳烯基、8
‑
十二碳烯基、9
‑
十二碳烯基、10
‑
十二碳烯基和11
‑
十二碳烯基。c1‑
c3烷基的例子包括甲基、乙基、正丙基和异丙基。c1‑
c4烷基的例子包括甲基、乙基、正丙基、异丙基、正丁基、异丁基和仲丁基。除非在说明书中另外具体地说明,否则烷基基团可以任选地被取代。
[0075]“亚烯基”或“亚烯基链”表示具有从2个至12个碳原子并且具有一个或多个碳
‑
碳双键的直链或支链二价烃链残基。c2‑
c
12
亚烯基的非限制性例子包括乙烯、丙烯、丁烯等。亚烯基链通过单键连接至分子的其余部分并且通过单键连接至残基基团。亚烯基链与分子的其余部分的连接点以及与残基基团的连接点可以是通过该链内的一个碳或任何两个碳。除非在说明书中另外具体地说明,否则亚烯基链可以任选地被取代。
[0076]“炔基”或“炔基基团”表示具有从2个至12个碳原子并且具有一个或多个碳
‑
碳三键的直链或支链烃链残基。每个炔基基团通过单键连接至分子的其余部分。包括含有从2个至12个的任何数目的碳原子的炔基基团。包含至多12个碳原子的炔基基团是c2‑
c
12
炔基,包含至多10个碳原子的炔基是c2‑
c
10
炔基,包含至多6个碳原子的炔基基团是c2‑
c6炔基,并且包含至多5个碳原子的炔基是c2‑
c5炔基。c2‑
c5炔基包括c5炔基、c4炔基、c3炔基和c2炔基。c2‑
c6炔基包括上文关于c2‑
c5炔基描述的所有部分,但还包括c6炔基。c2‑
c
10
炔基包括上文关于c2‑
c5炔基和c2‑
c6炔基描述的所有部分,但还包括c7炔基、c8炔基、c9炔基和c
10
炔基。类似地,c2‑
c
12
炔基包括所有前述部分,但还包括c
11
炔基和c
12
炔基。c2‑
c
12
烯基的非限制性例子包括乙炔基、丙炔基、丁炔基、戊炔基等。除非在说明书中另外具体地说明,否则烷基基团可以任选地被取代。
[0077]“亚炔基”或“亚炔基链”表示具有从2个至12个碳原子并且具有一个或多个碳
‑
碳三键的直链或支链二价烃链残基。c2‑
c
12
亚炔基的非限制性例子包括亚乙炔基、亚丙炔基(propargylene)等。亚炔基链通过单键连接至分子的其余部分并且通过单键连接至残基基团。亚炔基链与分子的其余部分的连接点以及与残基基团的连接点可以是通过该链内的一个碳或任何两个碳。除非在说明书中另外具体地说明,否则亚炔基链可以任选地被取代。
[0078]“烷氧基”表示式
‑
or
a
的残基,其中r
a
是如上定义的含有1
‑
12个碳原子的烷基、烯基或炔基残基。除非在说明书中另外具体地说明,否则烷氧基基团可以任选地被取代。
[0079]“烷基氨基”表示式
‑
nhr
a
或
‑
nr
a
r
a
的残基,其中每个r
a
独立地是如上定义的含有1
‑
12个碳原子的烷基、烯基或炔基残基。除非在说明书中另外具体地说明,否则烷基氨基基团可以任选地被取代。
[0080]“烷基羰基”表示
‑
c(=o)r
a
部分,其中r
a
是如上定义的烷基、烯基或炔基残基。烷基羰基的一个非限制性例子是甲基羰基(“缩醛”)部分。烷基羰基基团还可以被称作“cw
‑
cz酰基”,其中w和z描绘了如上定义的r
a
中的碳的数目的范围。例如,“c1
‑
c
10
酰基”表示如上定义的烷基羰基基团,其中r
a
是如上定义的c1‑
c
10
烷基、c1‑
c
10
烯基或c1‑
c
10
炔基残基。除非在说明书中另外具体地说明,否则烷基羰基基团可以任选地被取代。
[0081]“芳基”表示包含氢、5
‑
18个碳原子和至少一个芳族环的烃环系残基。为了本发明的目的,芳基残基可以是单环、二环、三环或四环环系,其可以包括稠合的或桥接的环系。芳基残基包括、但不限于从醋蒽烯、苊烯、醋菲烯(acephenanthrylene)、蒽、薁、苯、荧蒽、芴、不对称引达省(as
‑
indacene)、对称引达省、茚满、茚、萘、非那烯、菲、七曜烯(pleiadene)、芘和苯并菲衍生出的芳基残基。除非在说明书中另外具体地说明,否则术语“芳基”意在包括任选地被取代的芳基残基。
[0082]“芳烷基”表示式
‑
r
b
‑
r
c
的残基,其中r
b
是如上定义的亚烷基、亚烯基或亚炔基基团,并且r
c
是一个或多个如上定义的芳基残基,例如,苄基、二苯基甲基等。除非在说明书中另外具体地说明,否则芳烷基基团可以任选地被取代。
[0083]“碳环基”、“碳环的环”或“碳环”表示环结构,其中形成环的原子各自是碳。碳环的环在环中可以包含3
‑
20个碳原子。碳环的环包括如本文定义的芳基和环烷基、环烯基和环炔基。除非在说明书中另外具体地说明,否则碳环基基团可以任选地被取代。
[0084]“环烷基”表示仅由碳原子和氢原子组成的稳定的非芳族单环或多环的完全饱和的烃基残基,其可以包括稠合的或桥接的环系,具有3
‑
20个碳原子,优选地具有3
‑
10个碳原子,并且其通过单键连接至分子的其余部分。单环的环烷基残基包括例如环丙基、环丁基、环戊基、环己基、环庚基和环辛基。多环的环烷基残基包括例如金刚烷基、降冰片基、十氢萘基、7,7
‑
二甲基
‑
二环[2.2.1]庚烷基等。除非在说明书中另外具体地说明,否则环烷基基团可以任选地被取代。
[0085]“环烯基”表示仅由碳原子和氢原子组成的稳定的非芳族单环或多环烃基残基,具有一个或多个碳
‑
碳双键,其可以包括稠合的或桥接的环系,具有3
‑
20个碳原子,优选地具有3
‑
10个碳原子,并且其通过单键连接至分子的其余部分。单环的环烯基残基包括例如环戊烯基、环己烯基、环庚烯基、环辛烯基等。多环的环烯基残基包括例如二环[2.2.1]庚
‑2‑
烯基等。除非在说明书中另外具体地说明,否则环烯基基团可以任选地被取代。
[0086]“环炔基”表示仅由碳原子和氢原子组成的稳定的非芳族单环或多环烃基残基,具有一个或多个碳
‑
碳三键,其可以包括稠合的或桥接的环系,具有3
‑
20个碳原子,优选地具有3
‑
10个碳原子,并且其通过单键连接至分子的其余部分。单环的环炔基残基包括例如环庚炔基、环辛炔基等。除非在说明书中另外具体地说明,否则环炔基可以任选地被取代。
[0087]“环烷基烷基”表示式
‑
r
b
‑
r
d
的残基,其中r
b
是如上定义的亚烷基、亚烯基或亚炔基基团,并且r
d
是如上定义的环烷基、环烯基、环炔基残基。除非在说明书中另外具体地说明,否则环烷基烷基基团可以任选地被取代。
[0088]“卤代烷基”表示被如上定义的一个或多个卤素残基取代的如上定义的烷基残基,例如,三氟甲基、二氟甲基、三氯甲基、2,2,2
‑
三氟乙基、1,2
‑
二氟乙基、3
‑
溴
‑2‑
氟丙基、1,2
‑
二溴乙基等。除非在说明书中另外具体地说明,否则卤代烷基基团可以任选地被取代。
[0089]“卤代烯基”表示被如上定义的一个或多个卤素残基取代的如上定义的烯基残基,例如,1
‑
氟丙烯基、1,1
‑
二氟丁烯基等。除非在说明书中另外具体地说明,否则卤代烯基基团可以任选地被取代。
[0090]“卤代炔基”表示被如上定义的一个或多个卤素残基取代的如上定义的炔基残基,例如,1
‑
氟丙炔基、1
‑
氟丁炔基等。除非在说明书中另外具体地说明,否则卤代烯基基团可以任选地被取代。
[0091]“杂环基”、“杂环的环(heterocyclic ring)”或“杂环(heterocycle)”表示由2
‑
12个碳原子和1
‑
6个杂原子组成的稳定的3
‑
20元非芳族环残基,所述杂原子选自氮、氧和硫。杂环基或杂环的环包括如下文定义的杂芳基。除非在说明书中另外具体地说明,否则杂环基残基可以是单环、二环、三环或四环的环系,其可以包括稠合的或桥接的环系;并且杂环基残基中的氮、碳或硫原子可以任选地被氧化;氮原子可以任选地被季铵化;并且杂环基残基可以是部分地或完全地饱和的。这样的杂环基残基的例子包括、但不限于二氧杂环戊烷基、噻吩基[1,3]二硫杂环己基、十氢异喹啉基、咪唑啉基、咪唑烷基、异噻唑烷基、异噁唑烷基、吗啉基、八氢吲哚基、八氢异吲哚基、2
‑
氧代哌嗪基、2
‑
氧代哌啶基、2
‑
氧代吡咯烷基、噁唑烷基、哌啶基、哌嗪基、4
‑
哌啶酮基、吡咯烷基、吡唑烷基、奎宁环基、噻唑烷基、四氢呋喃
基、三硫杂环己基、四氢吡喃基、硫代吗啉基(thiomorpholinyl)、硫吗啉基(thiamorpholinyl)、1
‑
氧代
‑
硫代吗啉基和1,1
‑
二氧代
‑
硫代吗啉基。除非在说明书中另外具体地说明,否则杂环基基团可以任选地被取代。
[0092]“n
‑
杂环基”表示如上定义的杂环基残基,其含有至少一个氮并且其中杂环基残基与分子的其余部分的连接点是通过杂环基残基中的氮原子。除非在说明书中另外具体地说明,否则n
‑
杂环基基团可以任选地被取代。
[0093]“杂环基烷基”表示式
‑
r
b
‑
r
e
的残基,其中r
b
是如上定义的亚烷基、亚烯基或亚炔基链,并且r
e
是如上定义的杂环基残基,且如果杂环基是含氮的杂环基,则所述杂环基可以在氮原子处连接至烷基、烯基、炔基残基。除非在说明书中另外具体地说明,否则杂环基烷基基团可以任选地被取代。
[0094]“杂芳基”表示包含氢原子、1
‑
13个碳原子、1
‑
6个选自氮、氧和硫的杂原子以及至少一个芳族环的5
‑
20元环系残基。为了本发明的目的,杂芳基残基可以是单环、二环、三环或四环环系,其可以包括稠合的或桥接的环系;并且杂芳基残基中的氮、碳或硫原子可以任选地被氧化;氮原子可以任选地被季铵化。例子包括、但不限于氮杂环庚三烯基、吖啶基、苯并咪唑基、苯并噻唑基、苯并吲哚基、苯并二氧杂环戊二烯基、苯并呋喃基、苯并噁唑基、苯并噻唑基、苯并噻二唑基、苯并[b][1,4]二氧杂环庚三烯基、1,4
‑
苯并二氧杂环己烷基、苯并萘并呋喃基、苯并噁唑基、苯并二氧杂环戊二烯基、苯并二噁基、苯并吡喃基、苯并吡喃酮基、苯并呋喃基、苯并呋喃酮基、苯并噻吩基(benzothienyl)(苯并噻吩基(benzothiophenyl))、苯并三唑基、苯并[4,6]咪唑并[1,2
‑
a]吡啶基、咔唑基、噌啉基、二苯并呋喃基、二苯并噻吩基、呋喃基、呋喃酮基、异噻唑基、咪唑基、吲唑基、吲哚基、吲唑基、异吲哚基、吲哚啉基、异吲哚啉基、异喹啉基、吲哚嗪基、异噁唑基、萘啶基、噁二唑基、2
‑
氧代氮杂环庚三烯基、噁唑基、氧杂环丙基、1
‑
氧化(oxido)吡啶基、1
‑
氧化嘧啶基、1
‑
氧化吡嗪基、1
‑
氧化哒嗪基、1
‑
苯基
‑
1h
‑
吡咯基、吩嗪基、吩噻嗪基、吩噁嗪基、酞嗪基、蝶啶基、嘌呤基、吡咯基、吡唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、喹唑啉基、喹喔啉基、喹啉基、奎宁环基、异喹啉基、四氢喹啉基、噻唑基、噻二唑基、三唑基、四唑基、三嗪基和噻吩基(thiophenyl)(即噻吩基(thienyl))。除非在本公开内容中另外具体地说明,否则杂芳基基团可以任选地被取代。
[0095]“n
‑
杂芳基”表示如上定义的杂芳基残基,其含有至少一个氮并且其中杂芳基残基与分子的其余部分的连接点是通过杂芳基残基中的氮原子。除非在说明书中另外具体地说明,否则n
‑
杂芳基基团可以任选地被取代。
[0096]“杂芳基烷基”表示式
‑
r
b
‑
r
f
的残基,其中r
b
是如上定义的亚烷基、亚烯基或亚炔基链,并且r
f
是如上定义的杂芳基残基。除非在说明书中另外具体地说明,否则杂芳基烷基基团可以任选地被取代。
[0097]
本文使用的术语“被取代”意指上述基团(即,烷基、亚烷基、烯基、亚烯基、炔基、亚炔基、烷氧基、烷基氨基、烷基羰基、硫代烷基、芳基、芳烷基、碳环基、环烷基、环烯基、环炔基、环烷基烷基、卤代烷基、杂环基、n
‑
杂环基、杂环基烷基、杂芳基、n
‑
杂芳基和/或杂芳基烷基)中的任一个,其中至少一个氢原子被与非氢原子的键替代,所述非氢原子是诸如、但不限于:卤素原子诸如f、cl、br和i;基团诸如羟基基团、烷氧基基团和酯基基团中的氧原子;基团诸如硫醇基团、硫代烷基基团、砜基团、磺酰基基团和亚砜基团中的硫原子;基团诸
如胺、酰胺、烷基胺、二烷基胺、芳基胺、烷基芳基胺、二芳基胺、n
‑
氧化物、酰亚胺和烯胺中的氮原子;基团诸如三烷基甲硅烷基基团、二烷基芳基甲硅烷基基团、烷基二芳基甲硅烷基基团和三芳基甲硅烷基基团中的硅原子;以及各种其它基团中的其它杂原子。“被取代”还意指上述基团中的任一个,其中一个或多个氢原子被与杂原子的高阶键(例如,双键或三键)替代,所述杂原子是诸如氧代基团、羰基基团、羧基基团和酯基团中的氧;以及基团诸如亚胺、肟、腙和腈中的氮。例如,“被取代”包括上述基团中的任一个,其中一个或多个氢原子被
‑
nr
g
c(=o)or
h
、
‑
nr
g
so2r
h
、
‑
oc(=o)nr
g
r
h
、
‑
or
g
、
‑
sr
g
、
‑
sor
g
、
‑
so2r
g
、
‑
oso2r
g
、
‑
so2or
g
、=nso2r
g
和
‑
so2nr
g
r
h
替代。“被取代”还意指上述基团中的任一个,其中一个或多个氢原子被
‑
c(=o)r
g
、
‑
c(=o)or
g
、
‑
c(=o)nr
g
r
h
、
‑
ch2so2r
g
、
‑
ch2so2nr
g
r
h
替代。在上文中,r
g
和r
h
是相同的或不同的,并且独立地为氢、烷基、烯基、炔基、烷氧基、烷基氨基、硫代烷基、芳基、芳烷基、环烷基、环烯基、环炔基、环烷基烷基、卤代烷基、卤代烯基、卤代炔基、杂环基、n
‑
杂环基、杂环基烷基、杂芳基、n
‑
杂芳基和/或杂芳基烷基。“被取代”进一步意指上述基团中的任一个,其中一个或多个氢原子被与以下基团的键替代:氨基、氰基、羟基、亚氨基、硝基、氧代、硫代(thioxo)、卤素、烷基、烯基、炔基、烷氧基、烷基氨基、硫代烷基、芳基、芳烷基、环烷基、环烯基、环炔基、环烷基烷基、卤代烷基、卤代烯基、卤代炔基、杂环基、n
‑
杂环基、杂环基烷基、杂芳基、n
‑
杂芳基和/或杂芳基烷基基团。此外,前述取代基中的每一个还可以任选地被上述取代基中的一个或多个取代。
[0098]
本文中使用的符号(在下文中可以被称作“连接点键”)表示作为两个化学实体之间的连接点的键,其中一个被描绘为连接至连接点键,且其中另一个不被描绘为连接至连接点键。例如,指示,化学实体“xy”经由连接点键键合至另一个化学实体。此外,可以通过推断来指定与未描绘的化学实体的特定连接点。例如,化合物ch3‑
r3,其中r3是h或推断,当r3是“xy”时,连接点键是与将r3描绘为键合至ch3的键相同的键。
[0099]“任选的”或“任选地”是指,随后描述的情况的事件可以发生或可以不发生,并且所述描述包括其中所述事件或情况发生的情形和其中它不发生的情形。例如,“任选地取代的芳基”是指,所述芳基残基可以被取代或可以不被取代,并且所述描述包括被取代的芳基残基和不具有取代的芳基残基。
[0100]
本发明的化合物或其药学上可接受的盐可以含有一个或多个不对称中心,且因此可以产生对映异构体、非对映异构体和其它立体异构形式,它们可以根据绝对立体化学被定义为(r)
‑
或(s)
‑
,或者对于氨基酸而言被定义为(d)
‑
或(l)
‑
。本发明意在包括所有这样的可能的异构体,以及它们的外消旋的和光学纯的形式,无论它们是否在本文中被具体描述。光学活性的(+)和(
‑
)、(r)
‑
和(s)
‑
、或(d)
‑
和(l)
‑
异构体可以使用手性合成子或手性试剂制备,或使用常规技术(例如,色谱法和分步结晶)拆分。用于制备/分离各对映异构体的常规技术包括从合适的光学纯的前体手性合成,或使用例如手性高压液相色谱法(hplc)拆分外消旋体(或盐或衍生物的外消旋体)。当本文所述的化合物含有烯族双键或其它几何不对称中心时,且除非另有说明,否则意指所述化合物包括e和z几何异构体。同样,也意在包括所有互变异构形式。
[0101]“立体异构体”表示由通过相同键键合的相同原子构成但具有不同三维结构的化合物,所述不同三维结构不可互换。本发明涵盖各种立体异构体及其混合物,并且包括“对映异构体”,其表示两种立体异构体,所述两种立体异构体分子是彼此不可重叠的镜像。
[0102]“互变异构体”表示质子从分子的一个原子转移到同一分子的另一个原子。本发明包括任何所述化合物的互变异构体。
[0103]“药学上可接受的载体、稀释剂或赋形剂”包括、但不限于任何辅助剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增味剂、表面活性剂、润湿剂、分散剂、助悬剂、稳定剂、等渗剂、溶剂或乳化剂,它们已经被美国食品和药品管理局批准为可接受用于用在人类或家养动物中。
[0104]“药学上可接受的盐”包括酸加成盐和碱加成盐。
[0105]“药学上可接受的酸加成盐”表示这样的盐:其保留游离碱的生物学有效性和性能,其在生物学上或其它方面不是不希望的,并且其用以下酸形成:无机酸诸如、但不限于盐酸、氢溴酸、硫酸、硝酸、磷酸等,和有机酸诸如、但不限于乙酸、2,2
‑
二氯乙酸、己二酸、海藻酸、抗坏血酸、天冬氨酸、苯磺酸、苯甲酸、4
‑
乙酰氨基苯甲酸、樟脑酸、樟脑
‑
10
‑
磺酸、癸酸、己酸、辛酸、碳酸、肉桂酸、柠檬酸、环拉酸、十二烷基硫酸、乙烷
‑
1,2
‑
二磺酸、乙磺酸、2
‑
羟基乙磺酸、甲酸、富马酸、半乳糖二酸、龙胆酸、葡庚糖酸、葡糖酸、葡糖醛酸、谷氨酸、戊二酸、2
‑
氧代
‑
戊二酸、甘油磷酸、羟乙酸、马尿酸、异丁酸、乳酸、乳糖酸、月桂酸、马来酸、苹果酸、丙二酸、扁桃酸、甲磺酸、粘酸、萘
‑
1,5
‑
二磺酸、萘
‑2‑
磺酸、1
‑
羟基
‑2‑
萘甲酸、烟酸、油酸、乳清酸、草酸、棕榈酸、扑酸、丙酸、焦谷氨酸、丙酮酸、水杨酸、4
‑
氨基水杨酸、癸二酸、硬脂酸、琥珀酸、酒石酸、硫氰酸、对甲苯磺酸、三氟乙酸、十一烯酸等。
[0106]“药学上可接受的碱加成盐”表示这样的盐:其保留游离酸的生物学有效性和性能,其在生物学上或其它方面不是不希望的。这些盐通过向游离酸加入无机碱或有机碱而制备。衍生自无机碱的盐包括、但不限于钠盐、钾盐、锂盐、铵盐、钙盐、镁盐、铁盐、锌盐、铜盐、锰盐、铝盐等。优选的无机盐是铵盐、钠盐、钾盐、钙盐和镁盐。衍生自有机碱的盐包括、但不限于以下的盐:伯胺、仲胺和叔胺、被取代的胺(包括天然存在的被取代的胺)、环胺和碱性离子交换树脂,诸如氨、异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、二乙醇胺、乙醇胺、地阿诺、2
‑
二甲基氨基乙醇、2
‑
二乙基氨基乙醇、二环己胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、哈胺(hydrabamine)、胆碱、甜菜碱、苯乙苄胺(benethamine)、二苄基乙二胺、乙二胺、葡糖胺、甲基葡糖胺、可可碱、三乙醇胺、氨丁三醇、嘌呤、哌嗪、哌啶、n
‑
乙基哌啶、多胺树脂等。特别优选的有机碱是异丙胺、二乙胺、乙醇胺、三甲胺、二环己胺、胆碱和咖啡因。
[0107]
本文中使用的“受试者”可以是人类、非人灵长类动物、哺乳动物、大鼠、小鼠、牛、马、猪、绵羊、山羊、狗、猫、昆虫等。受试者可以被怀疑患有癌症(诸如血癌)或另一种疾病或病症或处于该风险中。各种癌症的诊断方法和癌症的临床描述是本领域普通技术人员已知的。受试者也可以被怀疑患有感染或异常的心血管功能。
[0108]“药物组合物”表示本发明的化合物和在本领域中被普遍接受用于向哺乳动物(例如,人类)递送生物活性化合物的介质的制剂。这样的介质包括其所有药学上可接受的载体、稀释剂或赋形剂。
[0109]“有效量”表示治疗有效量或预防有效量。“治疗有效量”表示在必要剂量下以及必要时间段下,有效实现期望的治疗结果的量,所述治疗结果是诸如减小的肿瘤尺寸、增加的
寿命或增加的期望寿命。化合物的治疗有效量可根据因素诸如受试者的疾病状态、年龄、性别和重量以及化合物在受试者中引发期望应答的能力而变化。可以调整剂量方案以提供最适治疗应答。治疗有效量也是这样的量:其中治疗有益效果胜过化合物的任何毒性或有害作用。“预防有效量”表示在必要剂量下以及必要时间段下,有效实现期望的预防结果的量,所述预防结果是诸如更小的肿瘤、增加的寿命、增加的期望寿命或预防前列腺癌进展为去势抵抗性(castration
‑
resistant)形式。通常,在疾病之前或在疾病的早期阶段在受试者中使用预防剂量,因此预防有效量可以小于治疗有效量。
[0110]
本文中使用的“治疗(treating)”或“治疗(treatment)”涵盖对患有目标疾病或病症的哺乳动物(优选人类)中的目标疾病或病症的治疗,并且包括(但不限于):
[0111]
1.防止哺乳动物发生该疾病或病症,特别是当这样的哺乳动物易患该病症但尚未被诊断为患有该病症时;
[0112]
2.抑制疾病或病症,即阻止其发展;
[0113]
3.缓解疾病或病症,即造成疾病或病症的消退(范围从降低疾病或病症的严重程度到治愈病症的疾病);或者
[0114]
4.缓解由疾病或病症引起的症状,即在不解决潜在疾病或病症的情况下缓解疼痛。本文中使用的术语“疾病”和“病症”可以互换使用或可以不同,因为特定的疾病或病症可以不具有已知的致病因子(因此病因学尚未确定),且因此尚未被认为是疾病,而只是被认为是不希望的病症或综合征,其中临床医师已经鉴定出一组或多或少特定的症状。
[0115]
贯穿本说明书,术语“约”和/或“大约”可以与数值和/或范围结合使用。术语“约”被理解为是指接近所述值的那些值。例如,“约40[单位]”可以是指在40的
±
25%内(例如,从30到50),在本文值的
±
20%、
±
15%、
±
10%、
±
9%、
±
8%、
±
7%、
±
6%、
±
5%、
±
4%、
±
3%、
±
2%、
±
1%、小于
±
1%或任何其它值或范围内。此外,应考虑到本文提供的术语“约”的定义来理解短语“小于约[值]”或“大于约[值]”。术语“约”和“大约”可以互换使用。
[0116]
贯穿本说明书,为某些数量提供了数字范围。应当理解,这些范围包含在其中的所有子范围。因此,范围“从50到80”包括其中所有可能的范围(例如,51
‑
79、52
‑
78、53
‑
77、54
‑
76、55
‑
75、60
‑
70等)。此外,在给定范围内的所有值可以是由此涵盖的范围的端点(例如,范围50
‑
80包括具有端点的范围诸如55
‑
80、50
‑
75等)。
[0117]
以下是与本发明的化合物以及用于治疗癌症和神经变性疾病的方法有关的各种概念及其实施方案的更详细描述。应当理解,在上面介绍和在下面更详细地讨论的各种概念可以以多种方式中的任何一种来实现,因为所公开的概念不限于任何特定的实现方式。主要为了例证目的而提供特定实现和应用的例子。
[0118]
化合物
[0119]
在本公开内容的某些实施方案中,提供了式(i)的化合物
[0120][0121]
其中
[0122]
x是
‑
c(o)n(r
a1
)
‑
或
‑
n(r
a2
)c(o)
‑
;
[0123]
y是
‑
c1‑6‑
烷基、烷基、
[0124]
z
a
和z
b
各自独立地是ch或n;
[0125]
r
a1
和r
a2
各自独立地是h、
‑
c1‑3烷基、
‑
(ch2)
m
‑
r
c
;
[0126]
r
b
是h、卤素、
‑
oh、
‑
o
‑
c1‑6‑
烷基;
[0127]
r
c
是
‑
oh、
‑
o
‑
烷基、
‑
nh(c1‑3‑
烷基)或
‑
n(c1‑3‑
烷基)2;
[0128]
r
d
是
‑
oh、
‑
ome、
‑
oet、
‑
opr、
‑
o
‑
(ch2)
n
‑
r
e1
、
‑
n(h)
‑
(ch2)
n
‑
r
e2
;或
‑
n(me)
‑
(ch2)
n
‑
r
e2
;
[0129]
r
e1
和r
e2
各自独立地是
‑
oh、
‑
ome、
‑
nh2、
‑
nhme、
‑
nme2、
‑
nhet或
‑
net2;
[0130]
m是1、2或3;且
[0131]
n是2或3,
[0132]
前提条件是,
[0133]
当x是
‑
c(o)n(h)
‑
、y是z
a
是
‑
ch和r
b
是
‑
ome或
‑
oet时,r
d
不是
‑
oh、
‑
o
‑
(ch2)2‑
nme2、
‑
o
‑
(ch2)2‑
net2、
‑
o
‑
(ch2)3‑
nme2、
‑
o
‑
(ch2)3‑
net2或
‑
n(h)
‑
(ch2)2‑
nme2;
[0134]
当x是
‑
c(o)n(h)
‑
、y是z
a
是
‑
ch和r
b
是h时,r
d
不是
‑
oh、
‑
ome、
‑
oet、
‑
o
‑
(ch2)2‑
nme2或
‑
n(h)
‑
(ch2)2‑
nme2;
[0135]
当x是
‑
c(o)n(me)
‑
、y是z
a
是
‑
ch和r
b
是
‑
oet时,r
d
不是
‑
o
‑
(ch2)2‑
nme2;和
[0136]
当x是
‑
c(o)n(me)
‑
、y是z
a
是
‑
ch和r
b
是
‑
oh时,r
d
不是
‑
oh。
[0137]
在某些实施方案中,式(i)不包括具有以下结构的化合物:
[0138]
[0139][0140]
在某些实施方案中,本公开内容提供了式(i)的化合物,其中
[0141]
x是
‑
c(o)n(r
a1
)
‑
或
‑
n(r
a2
)c(o)
‑
;
[0142]
y是
‑
c1‑6‑
烷基、
[0143]
z
a
和z
b
各自独立地是ch或n;
[0144]
r
a1
和r
a2
各自独立地是h、
‑
c1‑3‑
烷基、
‑
(ch2)
m
‑
r
c
;
[0145]
r
b
是h、卤素、
‑
oh、
‑
ome、
‑
oet、
‑
opr、
‑
oipr或obu;
[0146]
r
c
是
‑
oh、
‑
o
‑
烷基或
‑
n(c1‑3烷基)2;
[0147]
r
d
是
‑
oh、
‑
ome、
‑
oet、
‑
o
‑
(ch2)
n
‑
r
e1
、
‑
n(h)
‑
(ch2)
n
‑
r
e2
;或
‑
n(me)
‑
(ch2)
n
‑
r
e2
;
[0148]
r
e1
和r
e2
各自独立地是
‑
oh、
‑
ome、
‑
nh2、
‑
nhme、
‑
nme2、
‑
nhet或
‑
net2;
[0149]
m是1、2或3;且
[0150]
n是2或3。
[0151]
在某些实施方案中,本公开内容提供了式(i)的化合物,其中
[0152]
x是
‑
c(o)n(r
a1
)
‑
或
‑
n(r
a2
)c(o)
‑
;
[0153]
y是me、
[0154]
z
a
和z
b
各自独立地是ch或n;
[0155]
r
a1
和r
a2
各自独立地是h、
‑
c1‑3‑
烷基、
‑
(ch2)
m
‑
r
c
;
[0156]
r
b
是h、卤素、
‑
oh、
‑
ome、
‑
oet、
‑
opr、
‑
oipr或obu;
[0157]
r
c
是
‑
oh、
‑
o
‑
烷基或
‑
n(c1‑3烷基)2;
[0158]
r
d
是
‑
oh、
‑
ome、
‑
oet、
‑
o
‑
(ch2)
n
‑
r
e1
、
‑
n(h)
‑
(ch2)
n
‑
r
e2
;或
‑
n(me)
‑
(ch2)
n
‑
r
e2
;
[0159]
r
e1
和r
e2
各自独立地是
‑
oh、
‑
ome、
‑
nh2、
‑
nhme、
‑
nme2、
‑
nhet或
‑
net2;
[0160]
m是1、2或3;且
[0161]
n是2或3。
[0162]
在式(i)的某些实施方案中,x是
‑
c(o)n(r
a1
)
‑
。在其它实施方案中,x是
‑
n(r
a2
)c(o)
‑
。
[0163]
在式(i)的某些实施方案中,y是
‑
c1‑6‑
烷基、烷基、在其它实施方案中,y是
‑
c1‑6‑
烷基、在其它实施方案中,y是
‑
c1‑6‑
烷基、烷基、在其它实施方案中,y是中,y是在另一个实施方案中,y是在某些实施方案中,y是在具体实施方案中,y是在其它具体实施方案中,y是在其它具
体实施方案中,y是在再其它具体实施方案中,y是在某些实施方案中,y是
‑
c1‑6‑
烷基。在某些实施方案中,所述
‑
c1‑6‑
烷基是甲基、乙基、丙基、异丙基、丁基、戊基或己基。在其它实施方案中,所述
‑
c1‑6‑
烷基是甲基、乙基或丙基。在某些实施方案中,所述
‑
c1‑6‑
烷基是甲基或乙基。在具体实施方案中,所述
‑
c1‑6‑
烷基是甲基。
[0164]
在式(i)的某些实施方案中,z
a
和z
b
是ch。在某些实施方案中,z
a
是n和z
b
是n。在其它实施方案中,z
a
是n和z
b
是ch。在其它实施方案中,z
a
是ch和z
b
是n。
[0165]
在式(i)的某些实施方案中,r
a1
和r
a2
各自独立地是h、
‑
c1‑3‑
烷基、
‑
(ch2)
m
‑
r
c
。在其它实施方案中,r
a1
和r
a2
各自独立地是h或
‑
c1‑3‑
烷基。在某些实施方案中,r
a1
和r
a2
各自独立地是h。在某些其它实施方案中,r
a1
和r
a2
各自独立地是
‑
c1‑3‑
烷基。在某些实施方案中,所述
‑
c1‑3‑
烷基是甲基、乙基或丙基。在其它实施方案中,所述
‑
c1‑3‑
烷基是甲基或乙基。在具体实施方案中,所述
‑
c1‑3‑
烷基是甲基。在某些实施方案中,r
a1
和r
a2
各自独立地是
‑
ch2)
m
‑
r
c
。
[0166]
在式(i)的某些实施方案中,r
b
是卤素、
‑
oh或
‑
o
‑
c1‑3‑
烷基。在其它实施方案中,r
b
是卤素或
‑
o
‑
c1‑3‑
烷基。在其它实施方案中,r
b
是
‑
o
‑
c1‑3‑
烷基。在某些实施方案中,所述
‑
o
‑
c1‑3‑
烷基选自
‑
ome、
‑
oet、
‑
opr或
‑
oipr。在其它实施方案中,所述
‑
o
‑
c1‑3‑
烷基选自
‑
ome、
‑
opr或
‑
oipr。
[0167]
在式(i)的某些实施方案中,r
c
是
‑
oh、
‑
o
‑
烷基、
‑
nh(c1‑3‑
烷基)或
‑
n(c1‑3‑
烷基)2。在其它实施方案中,r
c
是
‑
oh或
‑
o
‑
烷基。在其它实施方案中,r
c
是
‑
nh(c1‑3‑
烷基)或
‑
n(c1‑3‑
烷基)2。在其它实施方案中,r
c
是
‑
n(c1‑3‑
烷基)2。在某些实施方案中,所述c1‑3‑
烷基选自甲基、乙基或丙基。在其它实施方案中,所述c1‑3‑
烷基是甲基或乙基。在具体实施方案中,所述c1‑3‑
烷基是甲基。
[0168]
在式(i)的某些实施方案中,r
d
是
‑
oh、
‑
ome、
‑
oet、
‑
o
‑
(ch2)
n
‑
r
e1
、
‑
n(h)
‑
(ch2)
n
‑
r
e2
;或
‑
n(me)
‑
(ch2)
n
‑
r
e2
。在其它实施方案中,r
d
是
‑
ome、
‑
oet、
‑
o
‑
(ch2)
n
‑
r
e1
、
‑
n(h)
‑
(ch2)
n
‑
r
e2
;或
‑
n(me)
‑
(ch2)
n
‑
r
e2
。在其它实施方案中,r
d
是
‑
ome、
‑
oet或
‑
o
‑
(ch2)
n
‑
r
e1
。在其它实施方案中,
‑
o
‑
(ch2)
n
‑
r
e1
、
‑
n(h)
‑
(ch2)
n
‑
r
e2
;或
‑
n(me)
‑
(ch2)
n
‑
r
e2
。在某些实施方案中,r
d
是
‑
oet、
‑
o
‑
(ch2)
n
‑
r
e1
、
‑
n(h)
‑
(ch2)
n
‑
r
e2
;或
‑
n(me)
‑
(ch2)
n
‑
r
e2
。在其它某些实施方案中,r
d
是
‑
ome、
‑
o
‑
(ch2)
n
‑
r
e1
、
‑
n(h)
‑
(ch2)
n
‑
r
e2
;或
‑
n(me)
‑
(ch2)
n
‑
r
e2
。
[0169]
在式(i)的某些实施方案中,r
e1
和r
e2
各自独立地是
‑
oh或
‑
ome。在其它实施方案中,r
e1
和r
e2
各自独立地是
‑
nh2、
‑
nhme、
‑
nme2、
‑
nhet或
‑
net2。在其它实施方案中,r
e1
和r
e2
各自独立地是
‑
nh2、
‑
nhme或
‑
nme2。在某些实施方案中,r
e1
和r
e2
各自独立地是
‑
nme2或
‑
net2。在具体实施方案中,r
e1
和r
e2
各自独立地是
‑
nme2。
[0170]
在式(i)的某些实施方案中,m是2或3。在其它实施方案中,m是2。在某些实施方案中,m是3。
[0171]
在式(i)的某些实施方案中,n是2。在其它实施方案中,n是3。
[0172]
在式(i)的某些实施方案中,x是
‑
c(o)n(r
a1
)
‑
和r
a1
是h或
‑
c1‑3‑
烷基。在其它实施方案中,x是
‑
c(o)n(r
a1
)
‑
和r
a1
是h或me。在其它实施方案中,x是
‑
c(o)n(r
a1
)
‑
和r
a1
是h。在其它实施方案中,x是
‑
c(o)n(r
a1
)
‑
和r
a1
是
‑
c1‑3‑
烷基。在另一个实施方案中,x是
‑
c(o)n(r
a1
)
‑
和r
a1
是me。
[0173]
在式(i)的某些实施方案中,x是
‑
n(r
a2
)c(o)
‑
和ra2是h或
‑
c1‑3‑
烷基。在其它实施方案中,x是
‑
n(r
a2
)c(o)
‑
和ra2是h或me。在其它实施方案中,x是
‑
n(r
a2
)c(o)
‑
和ra2是h。在其它实施方案中,x是
‑
n(r
a2
)c(o)
‑
和ra2是
‑
c1‑3‑
烷基。在另一个实施方案中,x是
‑
n(r
a2
)c(o)
‑
和ra2是me。
[0174]
在式(i)的某些实施方案中,所述化合物具有下面表1中的结构,或其药学上可接受的盐或溶剂化物。
[0175]
表1
[0176]
[0177]
[0178]
[0179][0180]
根据某些实施方案,所述化合物具有以下结构:
[0181]
或其药学上可接受的盐或溶剂化物。
[0182]
使用方法
[0183]
在某些实施方案中,hat调节剂化合物可以与一种或多种hdac调节剂联合使用以在有此需要的受试者中治疗神经变性疾病。在其它实施方案中,hat活化剂化合物可以与一种或多种hdac抑制剂联合使用以在有此需要的受试者中治疗神经变性疾病。神经变性疾病的非限制性例子包括肾上腺脑白质营养不良(ald)、酒精中毒、亚历山大氏病、阿尔珀斯病、阿尔茨海默氏病、嗜银颗粒病(agd)和球形神经胶质tau病变(globular glial tauopathy)(ggt)、神经原纤维缠结优势型老年性痴呆(neurofibrillary tangle
‑
predominant senile dementia)(现在也被包括在原发性年龄相关的tau病变(part)的分类中)、行为变异型额颞叶痴呆(behavioral variant frontotemporal dementia);语义变异型原发性进行性失语症、不流利的/语法缺失变异型原发性进行性失语症、logopenic变异型原发性进行性失语症、肌萎缩性侧索硬化(lou gehrig氏病)、共济失调毛细血管扩张症、巴藤病(也被称作施
‑
福
‑
舍(spielmeyer
‑
vogt
‑
)
‑
巴藤病)、牛海绵状脑病(bse)、卡纳万病、科凯恩综合征、皮质基底节变性、克罗伊茨费尔特
‑
雅各布病、家族型致死性失眠症、额颞叶变性、亨廷顿病、hiv
‑
相关的痴呆、肯尼迪氏病(kennedy's disease)、克拉伯氏病、露易体痴呆、神经包柔螺旋体病、马查多
‑
约瑟夫病(脊髓小脑性共济失调3型)、多系统萎缩、多发性硬化、发作性睡病、尼曼
‑
皮克病、帕金森病、佩利措伊斯
‑
梅茨巴赫病、皮克病、原发性侧索硬化、朊病毒病、进行性核上性麻痹、雷夫叙姆病、雷特综合征、tau
‑
阳性的额颞叶痴呆、tau
‑
阴性的额颞叶痴呆、桑德霍夫病、希尔德病、恶性贫血继发性脊髓亚急性联合变性(subacute combined degeneration of spinal cord secondary to pernicious anaemia)、spielmeyer
‑
vogt
‑
sjogren
‑
巴藤病(也被称作巴藤病)、脊髓小脑性共济失调(具有不同特征的多种类型)、脊髓性肌萎缩、斯
‑
理
‑
奥(steele
‑
richardson
‑
olszewski)病、脊髓痨和中毒性脑病。
[0184]
在某些实施方案中,所述神经变性疾病选自阿尔茨海默氏病、als、帕金森病和亨廷顿病。在某些实施方案中,所述神经变性疾病是阿尔茨海默氏病。在某些实施方案中,所述神经变性疾病是亨廷顿病。
[0185]
癌症的非限制性例子包括b细胞淋巴瘤、结肠癌、肺癌、肾癌、膀胱癌、t细胞淋巴瘤、骨髓瘤、白血病、慢性髓性白血病、急性髓性白血病、慢性淋巴细胞白血病、急性淋巴细胞白血病、造血瘤形成、胸腺瘤、淋巴瘤、肉瘤、肺癌、肝癌、非霍奇金淋巴瘤、霍奇金淋巴瘤、子宫癌、肾细胞上皮癌(carcinoma)、肝细胞瘤、腺癌、乳腺癌、胰腺癌、肝癌、前列腺癌、头和颈上皮癌、甲状腺上皮癌、软组织肉瘤、卵巢癌、原发性或转移性黑素瘤、鳞状细胞上皮癌、基底细胞上皮癌、脑癌、恶性血管内皮细胞瘤(angiosarcoma)、血管肉瘤
(hemangiosarcoma)、骨肉瘤、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨性肉瘤、脊索瘤、恶性血管内皮细胞瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、睾丸癌、子宫癌、宫颈癌、胃肠癌、间皮瘤、尤因瘤、平滑肌肉瘤、横纹肌肉瘤、结肠上皮癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞上皮癌、基底细胞上皮癌、腺癌、汗腺上皮癌、皮脂腺上皮癌、乳头状上皮癌、瓦尔登斯特伦(waldenstroom)巨球蛋白血症、乳头状腺癌、囊腺癌、支气管上皮癌、胆管上皮癌、绒毛膜癌、精原细胞瘤、胚胎上皮癌、维尔姆斯瘤、肺上皮癌、上皮癌(epithelial carcinoma)、宫颈癌、睾丸肿瘤、神经胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突神经胶质瘤、脑膜瘤、视网膜母细胞瘤、白血病、黑素瘤、神经母细胞瘤、小细胞肺上皮癌、膀胱上皮癌、淋巴瘤、多发性骨髓瘤、滤泡性淋巴瘤和髓样上皮癌。
[0186]
在某些实施方案中,所述癌症是结肠癌、肺癌、肾癌、白血病、cns癌、黑素瘤、卵巢癌、乳腺癌或前列腺癌。
[0187]
在某些实施方案中,所述癌症是结肠癌、肾癌、t细胞白血病、骨髓瘤、白血病、急性髓性白血病、急性淋巴细胞白血病、肾细胞上皮癌、腺癌、胶质母细胞瘤、乳腺上皮癌、前列腺上皮癌或肺上皮癌。
[0188]
在某些实施方案中,所述癌症是霍奇金淋巴瘤、非霍奇金淋巴瘤、b细胞淋巴瘤、t细胞淋巴瘤或滤泡性淋巴瘤。在其它实施方案中,所述b细胞淋巴瘤是弥漫性大b细胞淋巴瘤。在其它实施方案中,所述弥漫性大b细胞淋巴瘤是生发中心衍生的弥散性大b细胞淋巴瘤、活化的b
‑
细胞衍生的(abc)弥漫性大b细胞淋巴瘤或非生发中心弥散性大b细胞淋巴瘤。
[0189]
包括组蛋白乙酰化的表观遗传修饰可能有助于对学习和记忆重要的基因表达变化(science 2010:328(5979),701
‑
702;通过引用整体并入本文)。通过组蛋白酰基转移酶(hat)向组蛋白添加乙酰基会增强基因表达,而它们通过组蛋白脱乙酰基酶(hdac)的除去会减少基因表达。组蛋白乙酰化的减少最近已与年龄诱导的记忆损害和各种神经变性疾病相关联(science 2010:328(5979),701
‑
702;通过引用整体并入本文)。hdac抑制剂已被证实会增强小鼠记忆(nature 459,55
‑
60(2009年5月7日);通过引用整体并入本文)。虽然几种hdac抑制剂的临床试验目前在进行中以尝试防止脱乙酰化,但是通过活化hat来增加组蛋白乙酰化的替代策略还没有被深入研究。在例如以下文献中讨论了组蛋白乙酰化:美国专利公开号2010/0166781;2010/0144885;2009/0076155;neuroscience 2011,194,272
‑
281;和j.phys.chem b 2007,111(17),4527
‑
4534(其中每篇通过引用整体并入本文)。关于神经变性疾病(包括阿尔茨海默氏病)的其它细节可在wo 2011/072243和wo 2012/088420中找到,每篇通过引用整体并入本文。
[0190]
在某些实施方案中,本发明提供了具有组蛋白乙酰基转移酶活性的化合物,其可以与一种或多种hdac调节剂联合使用以治疗具有癌症或神经变性疾病的患者。在某些实施方案中,所述化合物是hat活化剂。在某些实施方案中,所述化合物是hat抑制剂。在某些实施方案中,所述hdac调节剂是hdac活化剂。在某些实施方案中,所述hdac调节剂是hdac抑制剂。在某些实施方案中,所述化合物具有好的hat活化效能、高选择性、合理的药代动力学和/或好的穿过血脑屏障(bbb)的渗透性。在某些实施方案中,这些化合物可用作对ad患者具有减少的副作用的疗法。在某些实施方案中,所述化合物改善ad和阿尔茨海默样病理学中的认知或记忆,以及对患有其它神经变性疾病的受试者具有最小的副作用。在某些实施
方案中,本发明的化合物还可被开发为抗癌疗法。在某些实施方案中,组蛋白蛋白的乙酰化会增加受试者中的基因表达,从而导致增强的记忆和认知。
[0191]
在某些实施方案中,本发明提供了在有此需要的受试者中减少淀粉样蛋白β(aβ)蛋白沉积物的方法,所述方法包括给所述受试者施用hat活化剂和hdac抑制剂。在某些实施方案中,所述受试者表现出异常升高的淀粉样蛋白β斑块水平。在某些实施方案中,所述受试者患有阿尔茨海默氏病、露易体痴呆、包涵体肌炎或脑淀粉样血管病。
[0192]
在某些实施方案中,本发明提供了在有此需要的受试者中减少tau蛋白沉积物的方法,所述方法包括给所述受试者施用hat活化剂和hdac抑制剂。在某些实施方案中,所述受试者表现出异常升高的神经原纤维缠结水平。在某些实施方案中,所述受试者患有阿尔茨海默氏病、tau病变。
[0193]
在其它实施方案中,本发明提供了与一种或多种hdac调节剂组合的hat激动剂作为正常受试者(例如,没有患有神经变性疾病的受试者)的记忆增强剂的用途。在其它实施方案中,本发明提供了与一种或多种hdac调节剂组合的hat激动剂作为老年受试者(例如,>55岁的受试者)的记忆增强剂的用途。在其它实施方案中,本发明提供了与一种或多种hdac调节剂组合的hat激动剂作为与认知减退/损害相关的其它病症的记忆增强剂的用途。在某些实施方案中,所述hdac调节剂是hdac活化剂。在某些实施方案中,所述hdac调节剂是hdac抑制剂。与认知减退/损害相关的病症的非限制性例子包括多种与精神发育迟缓有关的综合征和与学习无能有关的综合征、帕金森病、皮克病、嗜银颗粒病(agd)和球形神经胶质tau病变(ggt)、神经原纤维缠结优势型老年性痴呆(现在也被包括在原发性年龄相关的tau病变(part)的分类中)、行为变异型额颞叶痴呆;语义变异型原发性进行性失语症、不流利的/语法缺失变异型原发性进行性失语症、logopenic变异型原发性进行性失语症、露易体病、肌萎缩性侧索硬化、亨廷顿病、克罗伊茨费尔特
‑
雅各布病、唐氏综合征、多系统萎缩、神经元变性伴脑铁积累i型(哈勒沃登
‑
施帕茨病)、单纯性自主神经衰竭(pure autonomic failure)、rem睡眠行为障碍、轻度认知损害(mci)、脑淀粉样血管病(caa)、轻度认知缺陷、衰老、血管性痴呆合并阿尔茨海默氏病(vascular dementias mixed with alzheimer’s disease)、以异常淀粉样蛋白沉积物为特征的神经变性疾病,及其任意组合。
[0194]
在某些实施方案中,本发明提供了用于鉴定一种或多种hat调节剂和一种或多种hdac调节剂的组合的方法,所述组合可以乙酰化组蛋白蛋白,因此增加受试者中的基因表达,从而导致增强的记忆和认知。在某些实施方案中,本发明提供了用于鉴定一种或多种hat活化剂和一种或多种hdac抑制剂的组合的方法,所述组合可以乙酰化组蛋白蛋白,因此增加受试者中的基因表达,从而导致增强的记忆和认知。
[0195]
为了缩小要在神经变性疾病的动物模型中测试的hat调节剂和hdac调节剂组合的候选物库(candidate pool),所述动物模型是诸如表现出升高的包涵体水平的动物,例如aβ积累动物模型(例如,ad的动物模型),或,例如,或tau积累动物模型(例如tau病变的动物模型),或亨廷顿病的小鼠模型,可以首先基于它们具有的某些特征来筛选或选择hat调节剂或hdac调节剂,所述特征是诸如具有以下一项或多项:不大于约500nm的ec
50
;在体外的组蛋白乙酰化活性;以及穿透bbb的能力。可以首先基于它们具有的某些特征来筛选或选择hat调节剂和hdac调节剂组合,所述特征是诸如在体外具有组蛋白乙酰化活性,或导致与单独的hat调节剂或hdac调节剂的体外组蛋白乙酰化相比增加的体外组蛋白乙酰化。
[0196]
在某些实施方案中,可以在神经变性疾病的动物模型中测试hat调节剂和hdac调节剂组合的候选物库,所述动物模型是诸如、但不限于,表现出升高的包涵体水平的动物,例如aβ积累动物模型(例如,ad的动物模型),或tau积累动物模型(例如tau病变的动物模型),或亨廷顿病的小鼠模型,以确定它们是否增加受试者中的基因表达,从而导致增强的记忆和认知。本文中使用的hat活化剂化合物不一定排除所述化合物还可能能够抑制其它hat的可能性。本文中使用的hdac抑制剂化合物不一定排除所述化合物还可能能够活化其它hat的可能性。
[0197]
在某些实施方案中,本发明的化合物是hat调节剂。出现在本文中的术语“调节”表示蛋白分子的活性或表达的变化。例如,调节可以造成分泌酶蛋白分子的蛋白活性、结合特性或任何其它生物学性能、功能性能或免疫学性能的增加或减少。在某些实施方案中,所述化合物活化hat。在某些实施方案中,所述化合物抑制hat。
[0198]
在某些实施方案中,本发明的化合物是hdac调节剂。出现在本文中的术语“调节”表示蛋白分子的活性或表达的变化。例如,调节可以造成分泌酶蛋白分子的蛋白活性、结合特性或任何其它生物学性能、功能性能或免疫学性能的增加或减少。在某些实施方案中,所述化合物抑制hdac。在某些实施方案中,所述化合物活化hdac。
[0199]
hat调节剂化合物可以是在体内和/或在体外增加hat分子(例如,p300、cbp、gcn5、gcn5l、pcaf或hat1)的活性和/或表达的化合物。hat调节剂化合物可以是经由表达、经由翻译后修饰或通过其它方式对hat蛋白的活性发挥其作用的化合物。在某些实施方案中,hat调节剂化合物使hat蛋白或mrna表达或乙酰基转移酶活性增加至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约97%、至少约99%或100%。
[0200]
hdac调节剂化合物可以是在体内和/或在体外减少hdac分子的活性和/或表达的化合物。hdac调节剂化合物可以是经由表达、经由翻译后修饰或通过其它方式对hdac蛋白的活性发挥其作用的化合物。在某些实施方案中,hdac调节剂化合物使hdac蛋白或mrna表达或脱乙酰基转移酶活性减少至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约97%、至少约99%或100%。
[0201]
通过各种测定可以鉴定结合hat分子(诸如p300、cbp、gcn5、gcn5l、pcaf或hat1)和/或对hat分子的活性或表达具有刺激作用的试验化合物或试剂。所述测定可以是结合测定,其包括直接或间接测量试验化合物或已知的hat配体与hat蛋白的活性位点的结合。所述测定也可以是活性测定,其包括直接或间接测量hat分子的活性。所述测定也可以是表达测定,其包括直接或间接测量hat mrna或蛋白的表达。各种筛选测定可以与体内测定组合,所述体内测定包括在神经变性障碍(诸如、但不限于,ad或亨廷顿病)的动物模型中测量试验化合物对认知和突触功能的影响。所述测定可以是包括测量试验化合物对细胞生存力的影响的测定。在一个实施方案中,所述细胞是癌细胞,诸如、但不限于b
‑
细胞淋巴瘤细胞系或t
‑
细胞淋巴瘤细胞系(例如ly1、ly7、ly10、su
‑
dhl2、hh或h9细胞系)。
[0202]
可以经由如下鉴定hat分子的表达的抑制剂:使hat
‑
阳性的细胞或组织与试验化合物接触,并确定细胞中hat蛋白或hat mrna的表达。可以将在有试验化合物存在下hat分子的蛋白或mrna表达水平与在没有试验化合物存在下hat蛋白的蛋白或mrna表达水平进行
对比。然后可以基于该对比,将试验化合物鉴定为hat蛋白(诸如p300、cbp、gcn5、gcn5l、pcaf或hat1)的表达的抑制剂。换而言之,试验化合物还可以是hat抑制剂化合物(诸如拮抗剂)。
[0203]
也可以经由如下鉴定hat分子的表达的活化剂:使hat
‑
阳性的细胞或组织与试验化合物接触,并确定细胞中hat蛋白或hat mrna的表达。可以将在有试验化合物存在下hat分子的蛋白或mrna表达水平与在没有试验化合物存在下hat蛋白的蛋白或mrna表达水平进行对比。然后可以基于该对比,将试验化合物鉴定为hat蛋白(诸如p300、cbp、gcn5、gcn5l、pcaf或hat1)的表达的活化剂。例如,当在有试验化合物存在下hat蛋白或mrna的表达比没有试验化合物存在下在统计学上或明显地更多时,该化合物被鉴定为hat蛋白或mrna的表达的活化剂。换而言之,试验化合物还可以是hat活化剂化合物(诸如激动剂)。通过本文描述的方法可以确定细胞中hat蛋白或mrna的表达水平。
[0204]
确定试验化合物的结合hat分子、hdac分子或其变体的能力,可以使用实时双分子相互作用分析(bia)来完成[mcconnell,(1992);sjolander,s.,和urbaniczky,c.integrated fluid handling system for biomolecular interaction analysis.anal.chem.1991,63,2338
‑
2345;通过引用整体并入本文]。bia(例如,bia
‑
core
tm
)是用于实时研究生物特异性相互作用的技术,无需标记任何相互作用物。光学现象表面等离子体共振(spr)中的变化可以用作生物分子之间的实时反应的指示。
[0205]
在某些实施方案中,本发明提供了结合hat活化剂蛋白(诸如p300、cbp、gcn5、gcn5l、pcaf或hat1)的化合物。这些化合物可以通过本文描述的筛选方法和测定来鉴定,并且增加hat活化剂蛋白的活性或表达。
[0206]
结合hat分子和/或对hat分子的活性或表达具有刺激作用的试验化合物或试剂可以与一种或多种结合hdac分子的试验化合物或试剂组合。所述测定可以是活性测定,其包括直接或间接测量hat分子和/或hdac分子的活性。所述测定还可以是表达测定,其包括直接或间接测量hat mrna或蛋白和/或hdac mrna或蛋白的表达。各种筛选测定可以与体内测定组合,所述体内测定包括在神经变性障碍(诸如、但不限于,ad或亨廷顿病)的动物模型中测量hat活化剂和hdac抑制剂对认知和突触功能的影响。所述测定可以是包括测量试验化合物对细胞生存力的影响的测定。在一个实施方案中,所述细胞是癌细胞,诸如、但不限于b
‑
细胞淋巴瘤细胞系或t
‑
细胞淋巴瘤细胞系。在一个实施方案中,将组合的hat活化剂和一种或多种hdac抑制剂的影响与单独的hat活化剂或hdac抑制剂的影响进行对比。
[0207]
药物组合物
[0208]
在某些实施方案中,本公开内容提供了包含有效量的式(i)的化合物或其药学上可接受的盐的药物组合物。在某些实施方案中,本文提供的药物组合物包含一种或多种药学上可接受的载体或赋形剂。
[0209]
在不同的实施方案中,本公开内容的药物组合物可以被配制用于在含有药学上可接受的载体、辅助剂和媒介物的制剂中通过多种方式施用,所述方式包括口服地、胃肠外地、通过吸入喷雾、局部地或直肠地。这里使用的术语胃肠外包括使用多种输注技术的皮下、静脉内、肌肉内和动脉内注射。本文所用的动脉内和静脉内注射包括通过导管施用。
[0210]
本领域技术人员基于已知方法可以确定式(i)的化合物、其药学上可接受的盐、酯、前药、水合物、溶剂化物和异构体、或包含式(i)的化合物或其药学上可接受的盐的药物
组合物的有效量。
[0211]
在一个实施方案中,本公开内容的药物组合物或药物制剂包含式(i)的化合物或其药学上可接受的盐和药学上可接受的载体、稀释剂和/或赋形剂。药学上可接受的载体、稀释剂或赋形剂包括、但不限于任何辅助剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增味剂、表面活性剂、润湿剂、分散剂、助悬剂、稳定剂、等渗剂、溶剂或乳化剂,它们已经被美国食品和药品管理局批准为可接受用于用在人类或家养动物中。
[0212]
在一个实施方案中,合适的药学上可接受的载体包括、但不限于惰性固体填充剂或稀释剂和无菌的水性或有机溶液。药学上可接受的载体是本领域技术人员众所周知的,并且包括、但不限于从约0.01至约0.1m和优选地0.05m的磷酸盐缓冲液或0.8%盐水。这样的药学上可接受的载体可以是水性或非水性溶液、悬浮液和乳液。适用于本技术中的非水性溶剂的例子包括、但不限于丙二醇、聚乙二醇、植物油诸如橄榄油和可注射的有机酯诸如油酸乙酯。
[0213]
适用于本技术中的水性载体包括、但不限于水、乙醇、醇/水溶液、甘油、乳液或悬浮液,包括盐水和缓冲介质。口服载体可以是酏剂、糖浆剂、胶囊剂、片剂等。
[0214]
适用于本技术中的液体载体可以被用于制备溶液、悬浮液、乳剂、糖浆剂、酏剂和加压化合物。可以将活性成分溶解或悬浮在药学上可接受的液体载体诸如水、有机溶剂、两者的混合物或药学上可接受的油或脂肪中。液体载体可以含有其它合适的药物添加剂,诸如增溶剂、乳化剂、缓冲剂、防腐剂、甜味剂、矫味剂、助悬剂、增稠剂、着色剂、粘度调节剂、稳定剂或渗透调节剂。
[0215]
适用于本技术中的液体载体包括、但不限于水(部分地含有上述添加剂,例如纤维素衍生物,优选羧甲基纤维素钠溶液)、醇类(包括一元醇和多元醇,例如二醇)及其衍生物和油类(例如分级分离的椰子油和花生油)。对于胃肠外施用,载体还可以包括油性酯诸如油酸乙酯和肉豆蔻酸异丙酯。无菌液体载体对于用于胃肠外施用的包含化合物的无菌液体形式是有用的。本文公开的用于加压化合物的液体载体可以是卤代烃或其它药学上可接受的推进剂。
[0216]
适用于本技术中的固体载体包括、但不限于惰性物质诸如乳糖、淀粉、葡萄糖、甲基纤维素、硬脂酸镁、磷酸二钙、甘露醇等。固体载体可以进一步包括一种或多种充当矫味剂、润滑剂、增溶剂、助悬剂、填充剂、助流剂、压缩助剂(compression aid)、粘合剂或片剂崩解剂的物质;它还可以是包囊材料。在粉剂中,载体可以是与精细粉碎的活性化合物掺混的精细粉碎的固体。在片剂中,将活性化合物与具有必要压制性质的载体以合适比例混合,并且以期望的形状和大小压紧。粉剂和片剂优选地含有至多99%的活性化合物。合适的固体载体包括例如磷酸钙、硬脂酸镁、滑石粉、糖、乳糖、糊精、淀粉、明胶、纤维素、聚乙烯基吡咯烷、低熔点蜡和离子交换树脂。通过任选地与一种或多种助剂一起压缩或模塑,可以制备片剂。通过在合适的机器中压制呈自由流动形式(诸如粉末或颗粒)的活性成分,其任选地与粘合剂(例如,聚维酮、明胶、羟丙基甲基纤维素)、润滑剂、惰性稀释剂、防腐剂、崩解剂(例如,淀粉羟乙酸钠、交联的聚维酮、交联的羧甲基纤维素钠)、表面活性剂或分散剂混合,可以制备压制的片剂。通过在合适的机器中模塑用惰性液体稀释剂润湿的粉末状化合物的混合物,可以制备模铸的片剂。片剂可以任选地被包衣或刻痕,且可以使用例如不同比例的羟丙基甲基纤维素配制以提供期望的释放特性,从而提供其中的活性成分的缓慢释放或控
制释放。可以任选地给片剂提供肠溶包衣,以提供在除胃以外的消化道部分中的释放。
[0217]
适用于本技术中的胃肠外载体包括、但不限于氯化钠溶液、林格氏右旋糖、右旋糖和氯化钠、乳酸盐林格氏溶液和不挥发性油。静脉内载体包括流体和营养补充剂、电解质补充剂诸如基于林格氏右旋糖的那些等。也可以存在防腐剂和其它添加剂,诸如例如,抗微生物剂、抗氧化剂、螯合剂、惰性气体等。
[0218]
适用于本技术中的载体可以根据需要使用本领域中已知的常规技术与崩解剂、稀释剂、造粒剂、润滑剂、粘合剂等混合。还可以使用如本领域中通常已知的不会有害地与化合物反应的方法将载体灭菌。
[0219]
可以将稀释剂添加至本发明的制剂中。稀释剂会增加固体药物组合物和/或组合的体积,并且可以使含有组合物和/或组合的药物剂型对于患者和护理提供者来说更易于处理。用于固体组合物和/或组合的稀释剂包括例如微晶纤维素(例如,avicel)、微细纤维素(microfine cellulose)、乳糖、淀粉、预胶化淀粉、碳酸钙、硫酸钙、糖、葡萄糖结合剂、糊精、右旋糖、磷酸氢钙二水合物、磷酸三钙、高岭土、碳酸镁、氧化镁、麦芽糊精、甘露醇、聚甲基丙烯酸酯(例如,eudragit(r))、氯化钾、粉状纤维素、氯化钠、山梨醇和滑石粉。
[0220]
通过使用本领域众所周知任何常规方法,可以将本发明的药物组合物制备成任何类型的制剂和药物递送系统。本发明的药物组合物可以配制成可注射制剂,其可以通过包括鞘内、心室内、静脉内、腹膜内、鼻内、眼内、肌肉内、皮下或骨内的途径来施用。并且,它也可以口服地或胃肠外地(通过直肠、肠或鼻腔中的粘膜)施用(参见gennaro,a.r.,编(1995)remington's pharmaceutical sciences)。优选地,局部地而非肠内地施用所述组合物。例如,经由靶向药物递送系统诸如蓄池(reservoir)制剂或持续释放制剂可以注射或递送组合物。
[0221]
通过本领域中的任何众所周知的方法可以制备本发明的药物制剂,所述方法是诸如混合、溶解、粒化、糖衣丸制备、磨细、乳化、包囊、包埋或低压冻干工艺。如上所述,本发明的组合物可以包括一种或多种生理上可接受的载体诸如赋形剂和辅助剂,其促进将活性分子加工成用于药物用途的制品。
[0222]
适当的制剂取决于选择的施用途径。对于注射,例如,可以将组合物配制成水溶液,优选地在生理上相容的缓冲液诸如汉克氏溶液、林格氏溶液或生理盐水缓冲液中。对于透粘膜或鼻施用,在制剂中使用适合于要渗透的屏障的穿透剂。这样的穿透剂在本领域内是公知的。在本发明的一个实施方案中,本发明的化合物可以制备成口服制剂。对于口服施用,通过使活性化合物与本领域已知的药学上可接受的载体组合,可以容易地配制化合物。这样的载体使得所公开的化合物能够被配制成用于由受试者口服摄入的片剂、丸剂、糖衣丸、胶囊剂、液体、凝胶、糖浆剂、浆液、混悬剂等。所述化合物也可以被配制在直肠组合物中,诸如栓剂或保留灌肠剂,例如其含有常规栓剂基质,诸如可可脂或其它甘油酯。
[0223]
用于口服使用的药物制品可以作为固体赋形剂来获得,任选地如果需要的话在添加合适的辅助剂之后碾磨所得的混合物并加工颗粒的混合物,以获得片剂或糖衣丸核心。合适的赋形剂具体地可以是:填充剂诸如糖,包括乳糖、蔗糖、甘露醇或山梨醇;纤维素制剂诸如玉米淀粉、小麦淀粉、米淀粉、马铃薯淀粉、明胶、黄芪胶、甲基纤维素、羟丙基甲基
‑
纤维素、羧甲纤维素钠和/或聚乙烯吡咯烷酮(pvp)制剂。并且,可以采用崩解剂,诸如交联的聚乙烯吡咯烷酮、琼脂或海藻酸或其盐诸如海藻酸钠。并且,可以添加润湿剂,诸如十二烷
基硫酸钠等。
[0224]
实施例
[0225]
下面提供实施例以促进本发明的更完整理解。以下实施例举例说明了制造和实践本发明的示例性模式。但是,本发明的范围不限于在这些实施例中公开的具体实施方案,这些实施例仅用于举例说明的目的,因为可以利用替代方法来获得类似的结果。
[0226]
式(i)的化合物的合成
[0227]
式(i)的化合物的一般合成方案
[0228][0229]
方案2
‑
ra010115
[0230][0231]
方案3
[0232][0233]
方案4
[0234][0235]
方案5
[0236][0237]
方案6
[0238][0239]
还使用方案6合成了下述化合物:
[0240]
[0241][0242]
方案7
[0243][0244]
方案8
[0245][0246]
方案9
[0247][0248]
方案10
[0249][0250]
类似的方案可以用于合成:ra013915
[0251][0252]
最终的步骤使用亚硫酰氯、n,n
‑
二乙基乙醇胺、5
‑
氯
‑6‑
(三氟甲基)吡啶
‑2‑
胺
[0253]
和ra013917
[0254][0255]
最终的步骤使用亚硫酰氯、n,n
‑
二乙基乙醇胺、5
‑
氯吡啶
‑2‑
胺。
[0256]
方案11
[0257][0258]
方案12
[0259][0260][0261]
方案13
‑
ra013915的替代合成方案
[0262][0263]
评价式(i)的化合物的生物活性
[0264]
组蛋白乙酰基转移酶(hat)测定:
[0265]
体外乙酰化测定的目的是,测量各种化合物对p300的酶活性。
[0266]
首先,准备药物:
[0267][0268]
其次,将p300在am1缓冲液中稀释到40ng/μl的浓度(在反应中的终浓度为20ng/μl)。这通过将1μl的p300(在0.4μg/μl)稀释到19μl的am1缓冲液中来完成。
[0269]
第三,制备主混合物(master mix)。在低蛋白结合管(thermofisher目录号90410)20μl系统中制备主混合物。
[0270]
[0271]
组分1x在20μl中的最终浓度p300(20ng/μl)2μl 5x hat 缓冲液4μl 化合物2μl0,0.01,1,10,100,500,103,104,105[0272]
在30℃温育反应30分钟。
[0273]
组蛋白3.3(1μg/μl)1μl ac
‑
coa(0.5μm)1μl0.025μmh2o10μl total20μl [0274]
在30℃温育反应1小时。
[0275]
第四,进行蛋白质印迹测定。
[0276]
·
为每个反应加入6.7μl的laemmli样品缓冲液4x(bio
‑
rad laboratories目录号161
‑
0737),并在95℃煮沸样品5min。
[0277]
·
将10μl的每个样品加载到2个tris甘氨酸4
‑
15%凝胶(bio
‑
rad laboratories目录号456
‑
1086)中。运行缓冲液:tris
‑
甘氨酸1x(倒入格子直到没及(writeing)“2个凝胶”)。
[0278]
·
在90v运行1小时(直到凝胶前沿到达格子的绿色线)。
[0279]
·
用来自bio
‑
rad laboratories的turbo
tm
印迹系统(turbo
tm
rta midi pvdf转移试剂盒目录号1704275)进行半干燥转移。
[0280]
·
在甲醇中活化pvdf膜5分钟,并然后在turbo
tm
转移缓冲液中润湿。
[0281]
·
在转移缓冲液中润湿堆叠(stack)。
[0282]
·
在23v 1.3a转移7分钟。
[0283]
·
封闭缓冲液:在tbst(0.1%吐温)中的5%脱脂乳在室温1小时。
[0284]
·
切割膜以得到在17kda的ac
‑
his 3和在300kda的p300。
[0285]
·
与第一抗体一起在4℃温育过夜。
[0286]
·
次日,在tbst(吐温0.1%)中进行3次洗涤10分钟。
[0287]
·
与第二抗体一起在室温温育1小时。
[0288]
·
在tbst(吐温0.1%)中进行3次洗涤5分钟。
[0289]
·
将膜与ecl(supersignal west dura extended duration substrate,来自thermofisher)一起在室温温育5分钟。
[0290]
·
用chemidoc odyssey fc获取图像2分钟。
[0291]
为了检测总h3(负载对照),根据生产商方案用restore
tm
蛋白质印迹剥离缓冲液剥离膜。
[0292][0293][0294]
在人肝微粒体中的稳定性
[0295]
如下面表2中所示,试验了一些化合物在人肝微粒体中的稳定性。
[0296]
实验规程
[0297]
混合性别人肝微粒体(批号1010420)购自xenotech。如下所述制备减去nadph的反应混合物。将试验物以1μm的终浓度加入反应混合物中。对照化合物睾酮在单独的反应中与试验物同时运行。将反应混合物的等分试样(不含辅因子)在37℃的振荡水浴中平衡3分钟。通过加入辅因子引发反应,并将混合物在37℃的振荡水浴中温育。在0、10、20、30和60分钟取出等分试样(100μl)。将试验物和睾酮样品立即与400μl冰冷的含有0.1%甲酸和内标的50/50乙腈(acn)/h2o组合以终止反应。然后将样品混合并离心以沉淀蛋白。使用电喷射电离通过lc
‑
ms/ms测定所有样品。分析条件列于附录1。将与内标的峰面积应答比(parr)与在时间0的parr进行对比,以确定在每个时间点的剩余百分比。使用graphpad软件计算半衰期和清除率,拟合至单相指数式衰减方程式。
[0298]
反应组成
[0299]
肝微粒体0.5mg/ml
[0300]
nadph(辅因子)1mm
[0301]
磷酸钾,ph 7.4 100mm
[0302]
氯化镁5mm
[0303]
试验物1μm
[0304]
附录1.分析方法
[0305]
液相色谱法
[0306]
柱:waters acquity uplc beh phenyl 30
×
2.1mm,1.7m
[0307]
m.p.缓冲液:25mm甲酸铵缓冲液,ph 3.5
[0308]
水性蓄池(a):90%水,10%缓冲液
[0309]
有机蓄池(b):90%乙腈,10%缓冲液
[0310]
流速:0.7ml/分钟
[0311]
梯度程序:
[0312]
时间(min)%a%b0.009910.651990.75199
0.809911.00991
[0313]
总运行时间:1.0分钟
[0314]
自动进样器:2μl注射体积
[0315]
洗涤1:水/甲醇/2
‑
丙醇:1/1/1;含有0.2%甲酸
[0316]
洗涤2:0.1%的甲酸水溶液
[0317]
质谱仪
[0318]
仪器:pe sciex api 4000
[0319]
接口:turbo ionspray
[0320]
模式:多重反应监测
[0321]
方法:1.0分钟持续时间
[0322]
表2
[0323][0324]
基于cl
int
=k/p计算内在清除率(cl
int
),其中k是消除常数,且p是温育中的蛋白浓度。在测试的化合物中,ra013915在人肝微粒体中表现出最好的稳定性,半衰期为32.1分钟。
[0325]
酶活性
[0326]
测试了各种化合物对lys 18和lys 27的酶活性。在下表3中提供了结果。分别指示了活化剂的ec50和抑制剂的ic50。
[0327]
表3
[0328][0329]
[0330][0331]
图1a至25b的图显示了作为表3中所列化合物浓度的函数的赖氨酸残基乙酰化。阴影区域对应于在没有化合物和dmso存在下测量的赖氨酸残基乙酰化的平均值(连续线)及其标准误差范围。重复的次数由“n”表示。
[0332]
针对ad模型的效力试验
[0333]
突触功能障碍是ad的主要标志(histol histopathol,1995.10(2):第509
‑
19页;通过引用整体并入本文)。药物筛选方案的一个方面可以包括测量化合物对突触功能的影响。淀粉样蛋白
‑
β(aβ)是一种有毒肽,其被认为是在阿尔茨海默氏病的早期阶段发生的细微遗忘变化的基础。它损害记忆及其电生理学替代物,长时程增强(ltp)。可以检查ltp,因为它是一类被认为是学习和记忆的基础的突触可塑性。ra010115可以挽救aβ诱导的ltp减少,也可以筛选其它化合物以鉴定可以重建正常ltp的那些。所述化合物可以应用20分钟。可以在没有aβ存在下在切片上进行对照,并用化合物处理小鼠。tau是另一种参与细胞间通讯的肽,并在ad和其它tau病变的动物模型中损害记忆和ltp。图26的图表明,ra010115挽救寡聚体tau(otau)
‑
和寡聚体aβ(oaβ)
‑
诱导的ltp缺乏。在来自灌注otau(50nm)和oaβ(200nm)的wt小鼠的海马切片中的ltp受损,而用ra10115或媒介物处理的切片中没有受损。ltp在用ra010115和otau或oaβ灌注的切片中恢复。水平实心条代表oaβ和otau灌注,而水平虚线条代表ra010115。三个箭头对应于theta
‑
爆发刺激。双因素方差分析媒介物相对于otau:f(1,26)=8.119,p=0.00085;媒介物相对于oaβ:f(1,27)=8.769,p=0.0063;媒介物相对于ra010115+otau:f(1,27)=0.02696,p=0.8708;媒介物相对于ra010115+oaβ:f
(1,27)=0.1802,p=0.6747;媒介物相对于ra010115:f(1,32)=0.8705,p=0.3578;otau相对于oaβ:f(1,25)=0.05339,p=0.8191;otau相对于ra010115+otau:f(1,25)=16.50,p=0.0004;otau相对于ra010115+oaβ:f(1,24)=6.665,p=0.0164;otau相对于ra010115:f(1,30)=8.312,p=0.0072;oaβ相对于ra010115+oaβ:f(1,25)=7.433,p=0.0120;oaβ相对于ra010115+otau:f(1,26)=20.77,p=0.0001;oaβ相对于ra010115:f(1,31)=7.539,p=0.0049;ra010115+oaβ相对于ra010115+otau:f(1,25)=0.1387,p=0.7127。
[0334]
突触可塑性被认为是记忆形成的基础。还在旨在确定化合物是否对两种类型的记忆有益的测定中测试了ra010115,所述两种类型的记忆为短期空间记忆(可以通过2天放射臂水迷宫测试),和情境恐惧记忆(即一类依赖于海马功能并在ad患者中受损的联想记忆)。图27的图表明,ra010115在空间短期记忆的2
‑
天放射臂水迷宫试验中挽救otau
‑
和oaβ诱导的缺陷。rawm的性能在施用oaβ(200nm)otau(500nm)的小鼠中受损。用hat活化剂ra010115(5mg/kg)处理会挽救缺陷。当仅用ra010115或媒介物处理小鼠时,性能没有受损(在第2天在所有组之间重复测量的方差分析:f(5,65)=7.092,p<0.0001。区块(block)10的单因素方差分析:f(5,65)=7.385,p<0.0001;oaβ相对于媒介物和otau相对于媒介物,bonferroni’s p<0.0001;oaβ相对于ra010115+oaβp<0.001,和otau相对于ra010115+otau p<0.05。
[0335]
图28的图表明,ra010115在情境恐惧记忆中挽救otau
‑
和oaβ诱导的缺陷。在电休克后24小时的情境恐惧记忆试验期间对比所有组时,存在统计显著性(所有组之间的方差分析:f(5,57)=5.558p=0.0003)。当将接受ra010115+otau的小鼠与施用otau的动物进行对比(t
‑
检验:t(18)=2.481,p=0.0232)以及将接受ra010115+oaβ的小鼠与施用oaβ的动物进行对比(t
‑
检验:t(20)=3.907,p=0.0009)时,组之间的对比揭示了僵硬行为的统计学显著的差异。此外,otau处理的小鼠表现出的僵硬量在统计上不同于媒介物处理的小鼠(t
‑
检验:t(22)=3.518,p=0.0019),且oaβ处理的小鼠表现出的僵硬量在统计上不同于媒介物处理的小鼠(t
‑
检验:t(22)=3.444,p=0.0023。当仅用ra010115或媒介物处理小鼠时,性能没有受到损害。组之间的基线僵硬没有差异(方差分析:f(5,57)=1.053,p=0.3958)。
[0336]
在图29上显示了对照,其展示了在otau和oaβ存在下在有和没有ra010115存在下在提示性恐惧联想记忆试验中具有平均僵硬的图。该试验排除了对情境恐惧记忆的影响是由于杏仁核参与。在提示性条件试验中在听觉提示之前(提示前,方差分析:f(5,56)=0.7692,p=0.5759)和之后(提示后,方差分析:f(5,56)=0.938,p=0.4637)僵硬行为在组之间没有检测到差异。
[0337]
在图30a和图30b上显示了另一个对照,其展示了在otau和oaβ存在下在有和没有ra010115存在下到达位于水面上方的平台的平均时间和速度。可见平台位置在组间未检测到差异(2因素方差分析:f(5,64)=0.191,p=0.9651),且游泳速度在组间未检测到差异(2因素方差分析:f(5,64)=0.621,p=0.6845)。
[0338]
图31a和图31b显示了在有和没有ra010115存在下在otau和oaβ存在下,小鼠在开放场试验中的表现。绘制了在场地中央花费的时间(a)和进入中央的次数(b),并表明焦虑水平的变化不是化合物的有益效果的原因。如在图31a中所示,在开放场试验的第二天在组间未观察到在中央室中花费的时间的差异(方差分析:f(5,54)=0.1385,p=0.244)。同样
地,在图31b中,在开放场试验的第二天在组间未观察到进入中央的次数的差异(方差分析:f(5,54)=0.205,p=0.0861)。
[0339]
最后,图32表明,尽管存在ra010115,但感觉阈不受otau和oaβ的存在影响,从而提示,该化合物对恐惧记忆的有益作用不是由于小鼠的感知休克的能力的变化,而是由于记忆形成的真正变化。在感觉阈的评估过程中在组间不存在统计上显著的差异(所有组之间的方差分析:第一视觉应答f(5,54)=0.405,p=0.843;运动应答f(5,54)=2.12,p=0.078,和听觉应答f(5,54)=0.738,p=0.599)。
[0340]
ra013915是另一种hat活化剂。图33显示的图表明,该化合物挽救寡聚体tau(otau)
‑
和aβ(oaβ)
‑
诱导的ltp缺乏。与用媒介物处理的切片相比,灌注otau(50nm)和oaβ(200nm)的wt小鼠的海马切片中的ltp受损。ltp在用ra013915和otau或oaβ灌注的切片中恢复。双因素方差分析,媒介物相对于otau:f(1,19)=11.14,p=0.0035;媒介物相对于oaβ:f(1,24)=22.57,p<0.0001;otau相对于ra010115+otau:f(1,15)=5.552,p=0.0325;oaβ相对于ra010115+oaβ:f(1,23)=9.977,p=0.0044;“n”代表每种条件的切片数。
[0341]
尽管在前述示例性实施方案中已经描述和举例说明了本发明,但是应当理解,本公开内容仅仅通过示例的方式做出,并且在不脱离本发明的精神和范围的情况下可以做出本发明的实施细节的许多改变,所述精神和范围仅由所附权利要求限定。可以在本发明的范围和精神内以不同的方式组合和/或重新布置公开的实施方案的特征,以产生也在本发明范围内的其它实施方案。本领域技术人员使用不超过例行实验将会认识到或能够确定本公开内容中具体描述的特定实施方案的众多等同方案。这样的等效方案意图被涵盖在所附权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1