通过靶向驻留在癌细胞上的角蛋白14(KRT14)的细胞外部分治疗或预防癌症的方法与流程
通过靶向驻留在癌细胞上的角蛋白14(krt14)的细胞外部分治疗或预防癌症的方法
1.领域
2.本发明大体上涉及癌症疗法,包括治疗、预防或延缓癌症的发展或转移,以及涉及可用于其的药物。
3.背景
4.本说明书中作者引用的出版物的参考书目明细按字母顺序收集在说明书结尾处。
5.本说明书中对任何之前的出版物(或来源于其的信息)或对任何已知的物质的引用不是并且不应当被视为确认或承认或以任何形式暗示该之前的出版物(或来源于其的信息)或已知的物质形成本说明书涉及的领域中的公知常识的一部分。
6.癌症仍然是影响人类和动物的最重要疾病之一,具有高发病率和高死亡率。例如,卵巢癌是女性中诊断的第九大常见癌症。事实上,卵巢癌是所有妇科癌症中最致命的。在卵巢癌的早期诊断和治疗方面已经花费了大量的资源。尽管外科手术和化学治疗干预有所改善,卵巢癌生存率仍稳定在约25%(vaughan等人(2011)nat rev cancer 11(10):719
‑
725)。
7.超过75%的卵巢癌患者在首次临床就诊时被诊断为患有晚期转移性疾病。治疗很大程度限于攻击性外科手术和化学疗法。然而,超过90%的患者复发,通常在治疗后的第一年内复发。在这些患者的绝大多数中,复发性肿瘤表现出化疗耐受性(chemoresistance)。这种现象限制了其他治疗选择,并且成为卵巢癌死亡率非常高的基础。
8.尽管付出了巨大努力,但在遗传筛查以鉴定潜在治疗靶方面的尝试很大程度上是不成功的。这可能是由于卵巢癌组织的高度异质性本质。
9.角蛋白
‑
14(krt14)是细胞骨架的细胞内蛋白成分,通常在驻留于健康成人组织的肌上皮和上皮龛(niches)中的祖细胞的原始谱系中表达(chu等人(2001)histopathology 39(1):9
‑
16;paraskevopoulou等人(2016)cell cycle15(23):3161
‑
3162)。在肿瘤组织中,krt14标记了控制肿瘤沉积物侵袭到健康组织中的能力的特化细胞的群体(替代地描述为“前导细胞(leader cells)”、“肿瘤干细胞”或“肿瘤起始细胞”)。一系列实体瘤类型(包括乳腺、膀胱和肺实体瘤)的肿瘤侵袭的控制在机制上牵涉表达krt14的细胞。在这些肿瘤中,表达krt14的细胞的存在与肿瘤侵袭潜力以及无病生存和总体生存的降低直接相关(chu等人(2001)上文;cheah等人(2015)proc natl acad sci usa 112(15):4725
‑
4730;volkmer等人(2012)proc natl acad sci usa 109(6):2078
‑
2083;ho等人(2012)nat rev urol 9(10):583
‑
594;cheung等人(2016)proc natl acad sci usa 113(7):e854
‑
863;cheung等人(2013)cell 155(7):1639
‑
1651;papafotiou等人(2016)nat commun 7:11914)。
10.存在对能够改善患者预后和生活质量的治疗方法的迫切需要。
11.概述
12.根据本发明,确定了krt14是在体外卵巢癌细胞侵袭通过间皮层和在体内卵巢肿瘤的成功植入所必需的。本文还确定了krt14在其他癌细胞类型的迁移和侵袭中发挥作用,所述其他癌细胞类型包括结直肠癌细胞、子宫内膜癌细胞、脑癌细胞、乳腺癌细胞和肺癌细
胞。krt14在健康组织中不表达,包括在正常生殖系统诸如卵巢和输卵管中不表达。重要的是,已确定krt14具有存在于雄性和雌性受试者二者中的一系列癌症中的细胞外部分。术语“细胞外”应理解为意指位于细胞的外部、暴露于细胞的外部或以其他方式从细胞的外部可及的krt14的部分、区段(segment)或结构域。
13.因此,本文教导了一种用于治疗或预防哺乳动物受试者(包括人类和动物受试者)中的癌症的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的krt14的细胞外部分或其功能同源物或变体的剂,或诱导癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂在体内产生的剂,所述量有效防止癌细胞侵袭、迁移和/或转移。通过向受试者“施用”包括接触癌细胞。“受试者”可以是雄性或雌性。
14.在实施方案中,癌症是妇科癌症,包括但不限于卵巢癌或卵巢癌的形式或分期。在实施方案中,癌症是子宫内膜癌或结直肠癌。在实施方案中,癌症选自脑癌、膀胱癌、肝癌、乳腺癌、肺癌、胰腺癌、肠癌、结肠癌、胃肠道癌、胃癌、喉癌、子宫内膜癌和结直肠癌。
15.在实施方案中,剂是靶向包含在以下蛋白中的表位的抗体,所述蛋白包含肽序列(以单字母代码)gfgggyggglgaglgggfgggfaggdgl(seq id no:1),或其功能同源物,或最佳比对后与seq id no:1具有至少80%相似性的变体。本文还考虑了充当seq id no:1的拮抗剂或靶向剂的其他剂。seq id no:1代表人类序列。其他物种中的同源物也在本文中被考虑作为治疗和诊断靶。“抗体”包括单克隆抗体、多克隆抗体和结合krt14的抗血清,以及结合krt14的外源部分或其部分的重组形式、片段和衍生物。
16.在本文公开的实施方案中,剂包含免疫球蛋白重链可变结构域(vh)和免疫球蛋白轻链可变结构域(vl),其中vh包含以下:包含seq id no:6的氨基酸序列的互补决定区1(vh cdr1),包含seq id no:7的氨基酸序列的vh cdr2,包含seq id no:8的氨基酸序列的vh cdr3;并且其中vl包含以下:包含seq id no:9的氨基酸序列的互补决定区1(vl cdr1),包含seq id no:10的氨基酸序列的vl cdr2,以及包含seq id no:11的氨基酸序列的vl cdr3。
17.在实施方案中,vh包含:
18.(a)vh框架区1(fr1),所述vh框架区1(fr1)包含与seq id no:12具有至少80%序列同一性的氨基酸序列;
19.(b)vh fr2,所述vh fr2包含与seq id no:13具有至少80%序列同一性的氨基酸序列;
20.(c)vh fr3,所述vh fr3包含与seq id no:14具有至少80%序列同一性的氨基酸序列;和
21.(d)vh fr4,所述vh fr4包含与seq id no:15具有至少80%序列同一性的氨基酸序列;
22.并且vl包含:
23.(e)vl fr1,所述vl fr1包含与seq id no:16具有至少80%序列同一性的氨基酸序列;
24.(f)vl fr2,所述vl fr2包含与seq id no:17具有至少80%序列同一性的氨基酸序列;
25.(g)vl fr3,所述vl fr3包含与seq id no:18具有至少80%序列同一性的氨基酸
序列;和
26.(h)vl fr4,所述vl fr4包含与seq id no:19具有至少80%序列同一性的氨基酸序列。
27.在实施方案中,vh包含与seq id no:3具有至少80%序列同一性的氨基酸序列,并且vl包含与seq id no:5具有至少80%序列同一性的氨基酸序列。
28.在实施方案中,哺乳动物受试者是人类女性或人类男性。然而,本发明扩展至非人类雄性或雌性哺乳动物中的兽医学应用。
29.如本文所教导,鉴定了krt14作为卵巢癌侵袭和沉积的关键早期调节物的新功能。缺乏krt14基因的功能性拷贝的细胞是无侵袭能力的(invasion
‑
incompetent),并且不能在体内建立卵巢肿瘤。用外源添加的靶向seq id no:1的剂靶向由seq id no:1标识的表位完全消除了癌细胞在体外的侵袭能力,模拟了功能性krt14损失的效果。类似地,诱导体内反应,诸如对携带seq id no:1的细胞有特异性的免疫反应,也有效减少癌症发展。
30.在实施方案中,本说明书教导了一种治疗人类受试者中的卵巢癌的方法,该方法包括向受试者施用一定量的靶向驻留在卵巢癌细胞上的由seq id no:1定义的krt14的细胞外部分的抗体,所述量有效防止或减少卵巢癌细胞侵袭、迁移和/或转移。
31.提出了许多其他实体瘤类型(例如,乳腺、膀胱、肺和其他)利用这种krt14介导的侵袭机制,表明抗krt14定向疗法跨越一系列实体瘤类型是广泛适用的。
32.本文实现了靶向seq id no:1或其功能同源物或变体从而消除癌细胞侵袭、迁移和/或转移的药物。在实施方案中,药物包括对seq id no:1或其功能同源物或变体有特异性的抗体。如上文指示的,抗体可以是多克隆或单克隆抗体或包含krt14结合抗体的抗血清,或者可以是合成(例如重组)抗体或前述中任一种的krt14结合片段或衍生物。抗体也可以是软骨动物来源的抗体或其krt14结合片段或衍生物。药物除了是抗体之外,还可以是任何亲和试剂,包括但不限于适体、单特异抗体(monobodies)、anticalin、darpin和纳米抗体等。
33.本发明扩展至联合疗法,其中靶向krt14的剂或诱导体内krt14拮抗剂的剂与另一种抗癌剂和/或放射疗法和/或外科手术干预一起给予。另外剂的实例包括化疗剂,诸如以下中的一种或更多种:更生霉素(dactinomycin)、柔红霉素、多柔比星(阿霉素)、伊达比星和米托蒽醌或基于铂的剂或抗代谢物。抗代谢物是干扰身体化学过程(诸如产生细胞生长和繁殖所需的蛋白、dna和其他化学品)的物质;在癌症治疗中,抗代谢药物破坏dna产生,其进而阻止细胞分裂。实例包括重氮丝氨酸(azaserine)、d
‑
环丝氨酸、霉酚酸、甲氧苄啶、5
‑
氟尿嘧啶、卡培他滨、甲氨蝶呤、吉西他滨、阿糖胞苷(ara
‑
c)和氟达拉滨。可以施用其他免疫试剂,诸如致敏t细胞和细胞因子。联合疗法可以同时提供,或按任一种顺序并在彼此的数秒、数分钟、数小时、数天或数周内依次提供。
34.本公开内容还扩展至与癌细胞上的krt14的细胞外部分特异性结合的剂或其krt14结合片段,其中该剂包含免疫球蛋白重链可变结构域(vh)和免疫球蛋白轻链可变结构域(vl),其中vh包含以下:包含seq id no:6的氨基酸序列的互补决定区1(vh cdr1),包含seq id no:7的氨基酸序列的vh cdr2和包含seq id no:8的氨基酸序列的vh cdr3;并且其中vl包含以下:包含seq id no:9的氨基酸序列的互补决定区1(vl cdr1),包含seq id no:10的氨基酸序列的vl cdr2,以及包含seq id no:11的氨基酸序列的vl cdr3。
35.在实施方案中,vh包含:
36.(a)vh框架区1(fr1),所述vh框架区1(fr1)包含与seq id no:12具有至少80%序列同一性的氨基酸序列;
37.(b)vh fr2,所述vh fr2包含与seq id no:13具有至少80%序列同一性的氨基酸序列;
38.(c)vh fr3,所述vh fr3包含与seq id no:14具有至少80%序列同一性的氨基酸序列;和
39.(d)vh fr4,所述vh fr4包含与seq id no:15具有至少80%序列同一性的氨基酸序列;
40.并且vl包含:
41.(e)vl fr1,所述vl fr1包含与seq id no:16具有至少80%序列同一性的氨基酸序列;
42.(f)vl fr2,所述vl fr2包含与seq id no:17具有至少80%序列同一性的氨基酸序列;
43.(g)vl fr3,所述vl fr3包含与seq id no:18具有至少80%序列同一性的氨基酸序列;和
44.(h)vl fr4,所述vl fr4包含与seq id no:19具有至少80%序列同一性的氨基酸序列。
45.在实施方案中,vh包含与seq id no:3具有至少80%序列同一性的氨基酸序列,并且vl包含与seq id no:5具有至少80%序列同一性的氨基酸序列。
46.氨基酸序列由序列标识号(seq id no)表示。seq id no在数字上对应于序列标识符<400>1(seq id no:1)、<400>2(seq id no:2)等。权利要求之后提供了序列表。
47.表1中提供了整个主题说明书中使用的序列标识符的总结。
48.表1
49.序列标识符的总结
50.seq id no:描述1包含表位的人类krt14的细胞外部分的氨基酸序列2编码单克隆抗体(mab)an
‑
17重链可变区的核酸序列3单克隆抗体an
‑
17的重链可变区的氨基酸序列4编码单克隆抗体an
‑
17的轻链可变区的核酸序列5单克隆抗体an
‑
17的轻链可变区的氨基酸序列6单克隆抗体an
‑
17的重链cdr1的氨基酸序列7单克隆抗体an
‑
17的重链cdr2的氨基酸序列8单克隆抗体an
‑
17的重链cdr3的氨基酸序列9单克隆抗体an
‑
17的轻链cdr1的氨基酸序列10单克隆抗体an
‑
17的轻链cdr2的氨基酸序列11单克隆抗体an
‑
17的轻链cdr3的氨基酸序列12单克隆抗体an
‑
17的重链fr1的氨基酸序列13单克隆抗体an
‑
17的重链fr2的氨基酸序列
14单克隆抗体an
‑
17的重链fr3的氨基酸序列15单克隆抗体an
‑
17的重链fr4的氨基酸序列16单克隆抗体an
‑
17的轻链fr1的氨基酸序列17单克隆抗体an
‑
17的轻链fr2的氨基酸序列18单克隆抗体an
‑
17的轻链fr3的氨基酸序列19单克隆抗体an
‑
17的轻链fr4的氨基酸序列
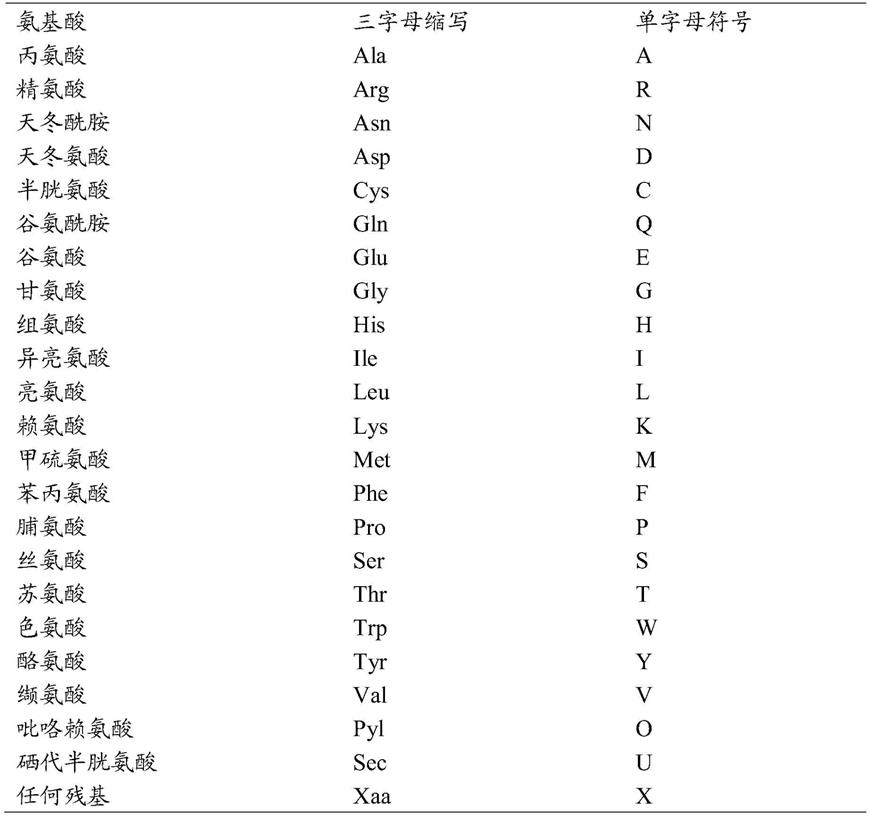
51.氨基酸可以通过名称或通过单字母代码或三字母代码来表示(表2)。
52.表2
53.氨基酸三字母和单字母
[0054][0055]
附图简述
[0056]
一些附图包含颜色表示或实体。彩色照片可根据请求从专利权人或从适当的专利局获得。如果从专利局获得,可能会收取费用。
[0057]
图1的a至c是示出在侵袭性卵巢癌沉积物前缘(leading edge of invasive ovarian cancer deposits)鉴定krt14的照片表示。(a)使用腹膜微环境模型培养卵巢癌球状体(spheroids),并监测通过间皮屏障的侵袭。(b)通过maldi成像质谱评估包含活跃地突破(actively breaching)lp9间皮细胞单层的球状体的冷冻切片,这在侵袭界面处的若干蛋白中鉴定出krt14。(c)扩散的卵巢癌细胞(ovcar4)的krt14免疫染色,示出了定位于侵袭
性伪足(invadopodia)。示出了放大的区域(右上)。krt14染色在黑色背景下呈现绿色。通过dapi进行的核染色为蓝色。
[0058]
图2的a和b是示出体外卵巢癌细胞迁移和侵袭所需的krt14表达的图解和照片表示。在卵巢癌细胞系ovcar4和caov3中使用crispr技术破坏krt14基因表达。示出代表性实验。(a)使用xcelligence测量增殖和侵袭。krt14表达的损失对增殖没有影响,但完全消除了体外通过间皮单层的侵袭。(b)使用体外划痕试验,缺乏krt14的细胞未能过夜修复伤口。
[0059]
图3的a至c是示出体内成功的肿瘤植入所需的krt14表达的照片和图解表示。将表达krt14(“野生型”;wt)或缺乏krt14表达(“krt14
ko”)的鼠id8卵巢癌细胞囊内(intrabursally)植入到野生型c57bl/6小鼠中。使用体内荧光实时监测肿瘤生长。(a)成功地将id8细胞移植到每只小鼠的单个卵巢,并且是可检测到的并且定位于移植部位。4周后,植入了k14
ko
细胞的小鼠失去荧光。(b)在3
‑
4周时,荷有野生型肿瘤细胞的小鼠中的荧光增强;在植入了krt14
ko
细胞的小鼠中,没有检测到类似的荧光增加。(c)在~7周时屠宰小鼠,并且进行尸检。植入了野生型id8细胞的小鼠形成大的原发性卵巢肿瘤,具有对侧卵巢、腹膜壁、肝脏、肠和横膈转移,并在腹腔中显示出腹水的显著积累。与之相比,植入了krt14
ko
细胞的小鼠没有发展出腹水,并且没有观察到肿瘤。在这些小鼠中的尸检时没有检测到肿瘤细胞。
[0060]
图4的a和b是示出krt14的n
‑
末端暴露在细胞表面,并且可接近外源添加的抗体的图解和照片表示。(a)使用针对krt14的n
‑
末端区域的多克隆抗体,对完整的、未透化的(non
‑
permeabilized)卵巢癌细胞(如所指示的身份)进行流式细胞术。30%
‑
50%之间的细胞对于细胞表面krt14是阳性染色的。培养物中完整细胞的免疫染色确认了用抗krt14抗体对细胞的子集进行的染色。(b)测试了针对krt14的n
‑
末端和c
‑
末端中的任一个的抗体在体外抑制卵巢癌细胞侵袭的能力。抗c
‑
末端抗体(c
‑
term)对侵袭没有影响,而抗n
‑
末端抗体(n
‑
term)完全阻断侵袭。外源添加的全长重组krt14蛋白(rk14)单独或与c
‑
term抗体组合使用均没有效果。然而,rk14成功地与n
‑
term抗体竞争,以恢复体外侵袭能力。
[0061]
图5的a至c是示出krt14的n
‑
末端中的单个抗原区域是暴露的并且可以被靶向以阻断体外侵袭的图解和照片表示。(a)使用公众可得的iedb门户(http://tools.iedb.org/bcell/)以计算机预测krt14的n
‑
末端的抗原性和疏水性。预测了5个具有潜在抗原性的区域,并合成了6种相应的肽。(b)使用个体肽进行的竞争测定用于对由多克隆抗体识别的krt14的相关区域作图(map)。包含氨基酸83
‑
110(人类序列)的两种肽,在xcelligence测定中成功地恢复了侵袭能力。(c)在平行伤口愈合实验中,同样的两种肽(#4和#5)成功地与抗n
‑
末端krt14抗体竞争,以恢复细胞迁移并经16小时实现完全伤口闭合。
[0062]
图6的a和b是示出抗血清an
‑
17o20023在体外有效阻断癌细胞侵袭的图解表示。(a)针对特定krt14表位产生的抗血清有效抑制了侵袭,其效力与商业多克隆抗体(sigma sab4501657)相当。(b)抗krt14对侵袭的抑制对细胞活性无影响。
[0063]
图7是示出抗krt14抗体在体外损害非卵巢癌细胞类型迁移的照片表示。抗krt14抗体防止由子宫内膜癌细胞或结直肠癌细胞组成的细胞单层中的伤口闭合。模拟感兴趣的krt14表位的短肽(肽4和肽5)可以有效地竞争抗体结合以在体外重建迁移。
[0064]
图8的a和b是示出鼠卵巢癌细胞的迁移在体外被抗krt14抗体损害的照片和图解表示。(a)抗krt14抗体防止由鼠id8卵巢癌细胞组成的细胞单层中的伤口闭合。模拟感兴趣
的krt14表位的短肽(肽4和肽5)可以有效地竞争抗体结合以在体外重建迁移。(b)rtca分析确认了抗人类krt14抗体在体外阻断鼠卵巢癌细胞侵袭。
[0065]
图9是示出单克隆抗krt14抗体an
‑
17(mab an
‑
17)在体外增加了对铂化学疗法的敏感性。ovcar4卵巢癌细胞与mab an
‑
17、顺铂或两者的组合孵育,并监测细胞增殖经72小时的时间段。与单独使用顺铂相比,用mab an
‑
17加顺铂的组合治疗的细胞显示出明显更低的ic50。尤其,mab an
‑
17显著增强了在亚致死剂量使用的顺铂的毒性(n=3/治疗,平均细胞指数)。
[0066]
图10示出了mab an
‑
17显示出在体外与多种蛋白抗原无交叉反应。蛋白阵列用于鉴定可能被mab an
‑
17识别的任何交叉反应蛋白。没有明显的交叉反应,表明了mab an
‑
17对krt14的高度特异性。
[0067]
图11是示出使用mab an
‑
17检测krt14的蛋白印迹。1:1000至1:10,000的抗体稀释通过蛋白印迹成功检测到krt14蛋白。
[0068]
图12示出mab an
‑
17可以鉴定人类和鼠卵巢癌细胞中的krt14+细胞。ovcar3、caov4、id8和患者来源的3.1937
‑
07细胞系在bd lsrfortessa x
‑
20(bd biosciences)流式细胞仪上使用mab an
‑
17或商购可得的krt14的多克隆抗体(sigma sab4501657)对krt14+细胞群体进行分析。
[0069]
图13示出用mab an17在荷有上皮性卵巢肿瘤的小鼠中的循环肿瘤细胞检测。从12周龄荷id8 irfp720+上皮卵巢肿瘤的小鼠获取心脏血液,并使用抗cd45和mab an
‑
17进行染色。循环id8肿瘤细胞被鉴定为krt14+cd45
‑
细胞,并由irfp720+状态确认。加标(spiked)到血液中的irfp720+id8细胞用作阳性对照。
[0070]
图14示出通过免疫荧光染色对krt14+细胞的检测。癌细胞在完整(左)或透化后(右)与mab an
‑
17孵育,以分别标记表面krt14或细胞内krt14。
[0071]
图15示出使用mab an
‑
17对肿瘤组织进行免疫组织化学染色。染色仅限于肿瘤上皮,并且类似于商购可得的多克隆抗krt14抗体(sigma sab4501657)。
[0072]
图16示出mab an
‑
17的非特异性组织摄取和经7天时间段的清除。用0.5mg/kg(i.p.)的mab an
‑
17注射不具有肿瘤的小鼠,并且通过监测荧光来评估随时间的组织分布。与非靶向的igg
‑
κ同种型对照抗体进行比较。没有观察到mab an
‑
17的非特异性保留,并且两种抗体(mab an
‑
17和对照igg
‑
κ)在7天后几乎检测不到。检查的组织包括生殖器官(卵巢、输卵管、子宫);肠;肝脏;肝脏;肾;脾;肺;心脏;和脑(n=2只动物/组,平均值+/
‑
sd)。每个时间点的测量值针对轴进行偏移,以使重叠的数据集清晰。
[0073]
图17示出mab an
‑
17的非特异性组织摄取和经7天时间段的清除。用0.5mg/kg、1.0mg/kg、2.5mg/kg、5.0mg/kg或10.0mg/kg(i.p.)的mab an
‑
17注射不具有肿瘤的小鼠,并通过监测荧光来评估随时间的组织分布。与非靶向的igg
‑
κ同种型对照抗体进行比较。在评估的任何组织中都没有观察到mab an
‑
17的非特异性保留,7天后mab an
‑
17很大程度上无法检测到。检查的组织包括生殖器官(卵巢、输卵管、子宫);肠;肝脏;肝脏;肾;脾;肺;心脏;和脑(n=2只动物/组,平均值+/
‑
sd)。
[0074]
图18示出mab an
‑
17对肿瘤组织具有高度特异性。具有已建立的原发性卵巢肿瘤的小鼠(n=2/组/时间点)通过腹膜内注射被施用5mg/kg或10mg/kg剂量的mab an
‑
17。对照动物接受相同剂量的同种型匹配对照抗体。施用后第1天、第3天、第5天和第7天,屠宰小鼠,
并通过荧光评估抗体定位(如上文)。荧光表示为随时间的平均辐射荧光强度/单位组织面积。(a)肿瘤特异性荧光信号。(b)非肿瘤生殖组织荧光显示出不存在特异性信号。(c)死后分离的肿瘤与用于比较的非肿瘤生殖组织中mab an
‑
17荧光(红色)的图像(n=2/组/时间点;平均值+/
‑
sd)。
[0075]
图19示出mab an
‑
17的施用导致小鼠中已建立的肿瘤块直接消退。具有已建立的原发性卵巢肿瘤的小鼠(n=10/组)通过腹膜内注射以每周两次5mg/kg剂量施用mab an
‑
17(周一和周四)。对照动物接受同种型匹配的对照抗体,或仅接受pbs媒介物。在3周的持续治疗后,屠宰所有动物并检查,并在死后测量肿瘤质量。60%的接受媒介物或同种型对照抗体的小鼠在屠宰时具有原发性卵巢肿瘤。相比之下,在用mab an
‑
17治疗的小鼠中不能鉴定出肿瘤(平均值+/
‑
sd)。
[0076]
图20示出(a)单克隆抗体an
‑
17(来自克隆an
‑
17a rg4.e5b.a7.b4)的重链可变区(vh)和轻链可变区(vl)的核酸和氨基酸序列和(b)mab an
‑
17的vh和vl氨基酸序列与未重排种系小鼠抗体序列之间的相似性%(使用imgt/v
‑
quest程序)。n/a=不适用;nt=核苷酸。
[0077]
图21示出mab an
‑
17的vh和vl的核酸和氨基酸序列。
[0078]
图22示出mab an
‑
17的vh(a)和vl(b)氨基酸序列,用粗体和加下划线的文本进行注释,以突出显示框架区(fwr)和互补决定区(cdr)。
[0079]
图23示出在体外非卵巢癌细胞(bt16非典型畸胎样横纹肌样(脑)癌、nci
‑
h1573肺腺癌、sj
‑
gbm2原发性多形性胶质母细胞瘤、an3ca子宫内膜癌、sw620结直肠癌和mda
‑
mb
‑
468乳腺癌细胞系)的迁移被mab an
‑
17损害。
[0080]
详细描述
[0081]
在整个说明书中,除非上下文另有要求,词语“包含(comprise)”或诸如“包含(comprises)”或“包含(comprising)”的变化形式将被理解为隐含包括所陈述的要素或整数或方法步骤,或要素或整数或方法步骤的组,但不排除任何其他要素或整数或方法步骤,或要素或整数或方法步骤的组。
[0082]
除非上下文另外清楚地规定,否则如本主题说明书中所用的单数形式“一(a)”、“一(an)”和“该(the)”包括复数方面。因此,例如,提及“癌细胞”包括单个癌细胞,以及两个或更多个癌细胞;提及“表位”包括单个表位,以及两个或更多个表位;提及“本公开内容”包括本公开内容教导的单个和多个方面;等等。术语“发明”涵盖了本文教导和实现的方面。本发明的“形式”涵盖了本文考虑的任何变体和衍生物。本发明的所有方面都跨越权利要求的广度实现。
[0083]
本发明涉及治疗或预防或以其他方式缓解哺乳动物受试者中的癌症的进展的治疗方案。受试者可以是雄性或雌性。进展的缓解包括防止或减少癌细胞侵袭、迁移和/或转移,从而治疗、预防或延缓癌症的发展或降低其转移能力。术语“癌症”和“肿瘤”在本文可互换使用。
[0084]
因此,本文实现了一种治疗或预防哺乳动物受试者中的癌症的方法。该方法包括向哺乳动物受试者施用一种剂,该剂:
[0085]
(i)直接靶向癌细胞上的krt14的细胞外部分或其功能同源物或变体;剂的实例包括抗体,包括直接靶向krt14的细胞外部分的片段和衍生物,以及适当去免疫的抗体或其他
靶向部分或配体;或者
[0086]
(ii)在体内诱导靶向癌细胞上的krt14的细胞外部分或其功能同源物或变体的内源性剂;内源性剂的实例包括但不限于抗体、t细胞和巨噬细胞。
[0087]
在任一情况下,剂或内源性剂诱导携带krt14的细胞外部分的癌细胞的细胞毒性或细胞抑制(cytostasis),从而防止或减少癌细胞侵袭、迁移和/或转移。例如,关于(i),抗体可以结合诱导补体介导的或巨噬细胞或细胞因子介导的细胞溶解或衰老。可选地,抗体或其他靶向剂可以与细胞毒性分子缀合或用于使淋巴细胞致敏。提及“抗体”包括单克隆抗体、多克隆抗体、包含krt
‑
14结合抗体的抗血清,以及与krt14的外源部分或其部分结合的合成或重组形式、片段和衍生物。药物除了是抗体之外,还可以是任何亲和试剂,包括但不限于适体、单特异抗体、anticalin、darpin和纳米抗体等。
[0088]
在实施方案中,人类krt14的细胞外部分由氨基酸序列(以单字母代码)nh2‑
gfgggyggglgaglgggfgggfaggdgl(seq id no:1)定义。
[0089]
本文包括人类或非人类哺乳动物中的功能同源物和/或变体。在实例中,seq id no:1的功能同源物或变体包括含有在最佳比对后与seq id no:1具有至少80%相似性的氨基酸序列的蛋白。“至少80%相似性”包括与seq id no:1具有至少80%、81%、82%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%和100%的相似性或同一性。这样的序列是krt14的细胞外部分的同源物或变体。
[0090]
表3中示出与seq id no:1具有至少约80%相似性的同源物的实例。
[0091]
表3
[0092]
[0093]
[0094]
protocols in molecular biology,john wiley&sons inc的19.3单元中找到。
[0098]
本文使用的术语“序列相似性”和“序列同一性”是指在比较窗上基于一个氨基酸接着一个氨基酸,序列为相同或功能相似或结构相似的程度。因此,“序列同一性百分比”,例如通过以下进行计算:在比较窗上比较两个最佳比对的序列,确定两个序列中出现相同氨基酸残基(例如,ala、pro、ser、thr、gly、val、leu、ile、phe、tyr、trp、lys、arg、his、asp、glu、asn、gln、cys和met)的位置数目以产生匹配位置的数目,将匹配位置的数目除以比较窗中位置的总数目(即,窗尺寸),并将结果乘以100以得到序列同一性百分比。
[0099]
因此,术语“变体”和“衍生物”是指显示出与参考氨基酸序列(即seq id no:1或其子序列)的基本序列同一性或相似性的氨基酸序列。术语“变体”和“衍生物”也包括天然存在的等位基因变体。
[0100]“衍生物”也包括关于seq id no:1或其功能同源物的突变体、片段、部分(part)、部分(portion)或杂交分子。衍生物通常携带但不仅仅携带单个或多于一个氨基酸取代、添加和/或缺失。
[0101]“同源物”包括具有至少约80%相似氨基酸序列的来自另一动物物种或来自同一物种内不同基因座的类似多肽。
[0102]
变体也包括通常为化学类似物的“类似物”。本文考虑的seq id no:1的化学类似物包括但不限于,对侧链的修饰,在肽、多肽或蛋白合成期间掺入非天然氨基酸和/或其衍生物,以及使用交联剂和对蛋白分子或其类似物赋予构象限制的其他方法。
[0103]
本发明考虑的侧链修饰的实例包括通过诸如以下进行的氨基基团的修饰:与乙醛反应,随后用nabh4还原而进行的还原烷化;用甲基乙酰亚胺酯进行的脒基化(amidination);用乙酸酐进行的酰化;用氰酸进行的氨基基团的氨甲酰化;用2,4,6
‑
三硝基苯磺酸(tnbs)进行的氨基基团的三硝基苯甲酰化;用琥珀酸酐和四氢邻苯二甲酸酐进行的氨基基团的酰化;和用吡哆醛
‑5‑
磷酸,随后用nabh4还原进行的赖氨酸的吡哆醇化。
[0104]
可以通过用试剂诸如2,3
‑
丁二酮、苯乙二醛和乙二醛形成杂环缩合产物来修饰精氨酸残基的胍基团。
[0105]
可以通过碳二亚胺活化经由o
‑
酰基异脲形成,随后衍生化,例如,成为相应的酰胺来修饰羧基基团。
[0106]
可以通过以下方法来修饰巯基基团:诸如,用碘乙酸或碘乙酰胺进行的羧甲基化;过甲酸氧化成磺基丙氨酸;用其他硫醇化合物形成混合的二硫化物;与马来酰亚胺、马来酸酐或其他取代的马来酰亚胺反应;使用4
‑
氯汞苯甲酸、4
‑
氯汞苯磺酸、苯基氯化汞、2
‑
氯汞
‑4‑
硝基酚和其他汞制剂形成汞衍生物;在碱性ph用氰酸进行的氨甲酰化。
[0107]
可以通过以下来修饰色氨酸残基:例如,用n
‑
溴代琥珀酰亚胺进行的氧化或用2
‑
羟基
‑5‑
硝基溴化苄或磺酸苯基卤化物进行的吲哚环的烷化。在另一方面,可以通过用四硝基甲烷的硝化来改变酪氨酸残基以形成3
‑
硝基酪氨酸衍生物。
[0108]
可以通过用碘乙酸衍生物进行的烷化或用焦碳酸二乙酯进行的n
‑
乙氧羰化(n
‑
carbethoxylation)来完成组氨酸残基咪唑环的修饰。
[0109]
交联剂可以用于例如使3d构象稳定,使用同双官能交联剂,诸如具有(ch2)
n
间隔基团、n=1至n=6的双官能亚氨基酯、戊二醛、n
‑
羟基琥珀酰亚胺酯,和通常包含氨基反应性部分诸如n
‑
羟基琥珀酰亚胺和另一种基团特异反应性部分诸如马来酰亚胺或二硫基部分
(sh)或碳二亚胺(cooh)的异双官能试剂。此外,肽可以通过以下进行构象上的限制:例如,c
α
和n
α
‑
甲基氨基酸的掺入,氨基酸的c
α
和c
β
原子之间的双键的引入,以及通过引入共价键的环肽或类似物的形成,诸如在n末端和c末端之间、在两个侧链之间或在侧链和n末端或c末端之间形成酰胺键而形成。
[0110]
这样的类似物可用于合成疫苗或产生用作靶向剂的抗体。类似物可能具有诸如增加的血清半衰期的属性。抗体也可以在包含krt14结合抗体的抗血清中。
[0111]
本文教导了一种治疗或预防哺乳动物受试者中的癌症的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的krt14的细胞外部分或其功能同源物或变体的剂,或诱导癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂在体内产生的剂,所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0112]
本文实现了治疗或预防哺乳动物受试者中的癌症的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的由seq id no:1中列出的氨基酸序列或在最佳比对后与seq id no:1具有至少约80%相似性的氨基酸序列所定义的细胞外部分或其功能同源物或变体的剂,或诱导癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂在体内产生的剂,所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0113]
本文还教导了治疗或预防哺乳动物受试者中的癌症的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的由seq id no:1中列出的氨基酸序列所定义的细胞外部分或其功能同源物或变体的剂,或诱导癌细胞上的krt14的细胞外部分或其在癌细胞上的功能同源物或变体的拮抗剂在体内产生的剂,通过所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0114]
本发明还实现了一种用于治疗人类受试者中的卵巢癌的方法,该方法包括向受试者施用一定量的靶向驻留在卵巢癌细胞上的由seq id no:1所定义的krt14的细胞外部分的抗体,所述量有效防止或减少卵巢癌细胞侵袭、迁移和/或转移。药物除了是抗体之外,还可以是任何亲和试剂,包括但不限于适体、单特异抗体、anticalin、darpin和纳米抗体等。
[0115]
术语“向受试者施用”包括通过任何手段接触癌细胞,以使剂和癌细胞上的krt14的细胞外部分接触。哺乳动物受试者可以是雄性或雌性,并且可以是任何年龄。
[0116]
本文鉴定了暴露于细胞表面的krt14蛋白的短表位,并且可用于与外源添加的剂或特异性诱导的内源性分子相互作用。使用识别暴露的序列的抗体或其他靶向剂靶向该区域可以在体外完全防止癌细胞侵袭,模拟了krt14基因消融(ablation)的效果。这些数据表明,krt14代表了用于定向拮抗剂疗法的肿瘤细胞上先前未被识别的并且高度特异的靶。
[0117]
还观察到在小鼠中未能形成实体瘤。缺乏功能性krt14基因的经植入的癌细胞在几周后变得无法检测到。这表明这些癌细胞可能通过,例如免疫介导的清除从动物去除。因此,本文提出使用抗krt14疗法可以促进肿瘤稳定化(通过受损的植入/侵袭)和肿瘤消退。靶向抗krt14疗法具有高癌症治疗潜力,原因如下:
[0118]
(i)抗krt14疗法预期是无毒的,因为krt14没有广泛表达,并且选择了对细胞无毒的拮抗剂;
[0119]
ii)抗krt14疗法适用于疾病的所有分期,适用于靶向原发性沉积物和转移性沉积物二者;
[0120]
iii)随着时间的推移和对化学疗法的反应,表达krt14的细胞被特异性富集;因
此,抗krt14疗法高度适用于已经发展复发性、化疗耐受性疾病并且没有可获得的其他常规治疗选择的患者;
[0121]
iv)抗krt14疗法除了使现有疾病稳定外,还可以潜在地促进肿瘤的消退。
[0122]
抗krt14疗法也有若干另外的应用,包括:
[0123]
i)与细胞毒性“有效载荷(payload)”缀合,用于针对侵袭性癌症干细胞群体的定向疗法;
[0124]
ii)用于car
‑
t疗法,被设计为指导抗肿瘤细胞毒性t细胞破坏肿瘤起始细胞群体;
[0125]
iii)治疗性或预防性疫苗接种;
[0126]
iv)生成兽医学应用中的“去人源化”抗体产生;
[0127]
v)诊疗应用(theranostic applications),例如,以预测治疗反应/化疗耐受性/肿瘤复发或进展。
[0128]
krt14依赖性肿瘤进展也已被鉴定为若干其他实体瘤类型中涉及的关键机制,并且可能代表了成为肿瘤扩散基础的保守机制。因此,抗krt14疗法的应用远远超出了卵巢癌,并可能被证明适用于治疗广泛的实体瘤。如本文使用的,“癌症”是指这样的一组疾病和病症,其特征在于不受控制的细胞生长(例如,肿瘤的形成),而这些细胞没有向特化细胞和不同细胞的任何分化。本文考虑进行治疗的癌症包括,但不限于,并且除了妇科状况诸如卵巢癌之外,abl1原癌基因、aids相关癌症、听神经瘤、急性淋巴细胞白血病、急性髓系白血病、腺样囊性癌、肾上腺皮质癌、特发性髓样化生(agnogenic myeloid metaplasia)、脱发、腺泡状软组织肉瘤、肛门癌、血管肉瘤、再生障碍性贫血、星形细胞瘤、共济失调性毛细血管扩张症、基底细胞癌(皮肤)、膀胱癌、骨癌、肠癌、脑干神经胶质瘤、脑和cns肿瘤、乳腺癌、cns肿瘤、类癌瘤、宫颈癌、儿童脑瘤、儿童癌症、儿童白血病、儿童软组织肉瘤、软骨肉瘤、绒毛膜癌、慢性淋巴细胞白血病、慢性髓系白血病、结直肠癌、皮肤t细胞淋巴瘤、隆突性皮纤维肉瘤、结缔组织增生性小圆细胞肿瘤、导管癌、内分泌癌、子宫内膜癌、室管膜瘤、食管癌、尤因肉瘤、肝外胆管癌、眼癌、黑色素瘤、视网膜母细胞瘤、输卵管癌、范科尼贫血、纤维肉瘤、胆囊癌、胃癌、胃肠癌、胃肠类癌瘤、泌尿生殖系统癌(genitourinary cancer)、生殖细胞肿瘤、妊娠性滋养细胞疾病、神经胶质瘤、妇科癌症、血液学恶性肿瘤、毛细胞白血病、头颈癌、肝细胞癌、遗传性乳腺癌、组织细胞增多症、霍奇金病、人类乳头状瘤病毒、水泡状胎块、高钙血症、下咽癌、眼内黑色素瘤、胰岛细胞癌、卡波西肉瘤、肾癌、朗格汉斯细胞组织细胞增生症、喉癌、平滑肌肉瘤、白血病、利
‑
弗劳梅尼综合征、唇癌、脂肪肉瘤、肝癌、肺癌、淋巴水肿、淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、男性乳腺癌、肾恶性横纹肌样瘤、髓母细胞瘤、黑色素瘤、梅克尔细胞癌、间皮瘤、转移癌、口癌、多发性内分泌肿瘤、蕈样肉芽肿病、骨髓增生异常综合征、骨髓瘤、骨髓增生性病症、鼻癌、鼻咽癌、肾母细胞瘤、神经母细胞瘤、神经纤维瘤病、nijmegen断裂综合征、非黑色素瘤皮肤癌、非小细胞肺癌
‑
(nsclc)、眼部癌症(ocular cancers)、食管癌、口腔癌、口咽癌、骨肉瘤、胰腺癌、鼻旁癌(paranasal cancer)、甲状旁腺癌、腮腺癌、阴茎癌、周围神经外胚层瘤、垂体癌、真性红细胞增多症、前列腺癌、罕见癌及相关病症、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、rothmund
‑
thomson综合征、唾液腺癌、肉瘤、神经鞘瘤、sezary综合征、皮肤癌、小细胞肺癌(sclc)、小肠癌、软组织肉瘤、脊髓肿瘤、鳞状细胞癌(皮肤)、胃癌、滑膜肉瘤、睾丸癌、胸腺癌、甲状腺癌、移行细胞癌(膀胱)、移行细胞癌(肾盂/输尿管)、滋养层癌、尿道癌、泌尿系统癌症、uroplakins、子
宫肉瘤、子宫癌、阴道癌、外阴癌、waldenstrom巨球蛋白血症和维尔姆斯瘤(wilm’s tumor)。子宫内膜癌和结直肠癌也可以被治疗。这些癌症可以影响雄性或雌性受试者,并且也可以根据本发明进行治疗。
[0129]
在实施方案中,癌症为妇科癌症。在实施方案中,妇科癌症是卵巢癌或卵巢癌的分期或形式。可选地,癌症尤其是雄性或雌性受试者中的肝癌、膀胱癌、肺癌、结肠癌、胃肠道癌、肠癌、胰腺癌和/或喉癌和其他癌症。本发明扩展至联合疗法,其中靶向krt14的剂或诱导体内krt14拮抗剂的剂与另一种抗癌剂和/或放射疗法和/或外科手术干预一起给予。在实施方案中,本文公开的方法还包括向受试者施用另外的抗癌剂和/或使患者暴露于免疫疗法、放射疗法和/或外科手术干预。另外的抗癌剂的说明性实例包括化学治疗剂,诸如以下中的一种或更多种:更生霉素、柔红霉素、多柔比星(阿霉素)、伊达比星和米托蒽醌或基于铂的剂或抗代谢物。抗代谢物是干扰身体化学过程(诸如产生细胞生长和繁殖所需的蛋白、dna和其他化学品)的物质;在癌症治疗中,抗代谢物破坏dna产生,其进而阻止细胞分裂。实例包括重氮丝氨酸、d
‑
环丝氨酸、霉酚酸、甲氧苄啶、5
‑
氟尿嘧啶、卡培他滨、甲氨蝶呤、吉西他滨、阿糖胞苷(ara
‑
c)和氟达拉滨。可以施用其他免疫试剂,诸如致敏t细胞和细胞因子。联合疗法可以同时提供,或按任一种顺序并在彼此的数秒、数分钟、数小时、数天或数周内依次提供。在实施方案中,另外的抗癌剂选自由以下组成的组:更生霉素、柔红霉素、多柔比星(阿霉素)、伊达比星和米托蒽醌、基于铂的剂、抗代谢物、致敏t细胞和细胞因子。在实施方案中,抗代谢物选自由以下组成的组:重氮丝氨酸、d
‑
环丝氨酸、霉酚酸、甲氧苄啶、5
‑
氟尿嘧啶、卡培他滨、甲氨蝶呤、吉西他滨、阿糖胞苷(ara
‑
c)和氟达拉滨。
[0130]
在实施方案中,哺乳动物受试者是人类。对于妇科癌症,受试者是人类女性。然而,对于所有其他癌症,受试者可以是人类男性或人类女性。
[0131]
因此,本文教导了一种用于治疗或预防人类受试者中的癌症的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的krt14的细胞外部分或其功能同源物或变体的剂,或诱导癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂在体内产生的剂,所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0132]
本文实现了一种用于治疗或预防人类受试者中的癌症的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的由seq id no:1中列出的氨基酸序列所定义的细胞外部分或其功能同源物或变体的剂,或诱导由所述受试者产生在癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂的剂,所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0133]
本文还教导了用于治疗或预防人类受试者中的癌症的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的由seq id no:1中列出的氨基酸序列或在最佳比对后与seq id no:1具有至少约80%相似性的氨基酸序列所定义的细胞外部分或其功能同源物或变体的剂,或诱导癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂在体内产生的剂,所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0134]
在实施方案中,癌症是卵巢癌,并且受试者是人类女性受试者。
[0135]
因此,本文教导了一种用于治疗或预防人类女性受试者中的卵巢癌的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的krt14的细胞外部分或其功能同源物或变体的剂,或诱导癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂在体
外产生的剂,所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0136]
本文实现了一种用于治疗或预防人类女性受试者中的卵巢癌的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的由seq id no:1中列出的氨基酸序列所定义的细胞外部分或其功能同源物或变体的剂,或诱导所述受试者产生在癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂的剂,所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0137]
本文还教导了用于治疗或预防人类女性受试者中的卵巢癌的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的由seq id no:1中列出的氨基酸序列或在最佳比对后与seq id no:1具有至少约80%相似性的氨基酸序列所定义的细胞外部分或其功能同源物或变体的剂,或诱导癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂在体内产生的剂,所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0138]
本发明还具有兽医学应用,诸如治疗伴侣动物(例如,狗和猫)或其他非人类动物诸如农场动物(例如,马科动物、猪、绵羊、牛、山羊、美洲驼和羊驼)、实验室试验动物(例如,小鼠、兔、豚鼠、仓鼠)和野生圈养动物(例如,袋獾)中的癌症。考虑进行治疗的其他动物包括长臂猿猴、黑猩猩、恒河猴、绿猴、猩猩、狒狒、鼩鼱、大猩猩、刺猬、婴猴、更格卢鼠(kangaroo rat)、野生牦牛、菲律宾眼镜猴、雪貂、大象和蝙蝠。关于马科动物,这些包括马、普氏野马(przewalski horses)、斑马和驴。关于马,这些包括纯血马、温血马、夸特马(quarter horse)和标准马(standard horse),以及马术用马和表演用马。
[0139]
因此,本文教导了一种用于治疗或预防非人类哺乳动物受试者中的癌症的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的krt14的细胞外部分或其功能同源物或变体的剂,或诱导癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂在体内产生的剂,所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0140]
本文还教导了用于治疗或预防非人类哺乳动物受试者中的癌症的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的由seq id no:1中列出的氨基酸序列或在最佳比对后与seq id no:1具有至少约80%相似性的氨基酸序列所定义的细胞外部分或其功能同源物或变体的剂,或诱导癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂在体内产生的剂,所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0141]
本文实现了用于治疗或预防非人类哺乳动物受试者中的癌症的方法,该方法包括向受试者施用一定量的靶向驻留在癌细胞上的由seq id no:1中列出的氨基酸序列所定义的细胞外部分或其功能同源物或变体的剂,或诱导癌细胞上的krt14的细胞外部分或其功能同源物或变体的拮抗剂在体内产生的剂,所述量有效防止或减少癌细胞侵袭、迁移和/或转移。
[0142]
非人类哺乳动物受试者可以是雄性或雌性。在实施方案中,剂是抗体。抗体可以是人类来源的抗体或去免疫抗体或适用于特定哺乳动物受试者的哺乳动物源化抗体(mammalianized antibody)。例如,小鼠抗体可以被人源化用于人类。因此,抗体可以在哺乳动物物种中产生以用于该哺乳动物,或者可以视情况哺乳动物源化或去免疫。为避免疑问,“抗体”可以是多克隆或单克隆抗体或包含以下的抗血清:krt14结合抗体或krt14结合变体或者这些抗体的衍生物或片段或合成形式或重组形式,包括f’(ab)结合片段。药物除了是抗体之外,还可以是任何亲和试剂,包括但不限于适体、单特异抗体、anticalin、
darpin和纳米抗体等。
[0143]
因此,本发明还因此提供了生物化学技术的应用,以使源自一只动物的抗体在相同或不同物种的另一只动物中基本上无免疫原性。该生物化学过程在本文被称为“去免疫化”。本文提及的“去免疫化”包括诸如互补决定区(cdr)接枝、关于免疫相互作用分子的框架区的“重塑”和可变(v)区突变的过程,所有这些都旨在降低免疫相互作用分子(例如抗体)在特定宿主(例如人类受试者)中的免疫原性。在实施方案中,优选的免疫相互作用分子是抗体,诸如对携带krt14的细胞外部分的癌细胞有特异性的多克隆或单克隆抗体。在实施方案中,免疫相互作用分子是单克隆抗体,源自一只动物,并且其在来自相同或不同物种诸如但不限于人类的另一只动物中表现出降低的免疫原性。
[0144]
提及“基本上无免疫原性”包括与亲本抗体,即暴露于去免疫过程之前的抗体相比,降低的免疫原性。术语“免疫原性”包括在宿主动物中引发、诱导或以其他方式促进体液和/或t细胞介导的反应的能力。实用的免疫原性标准包括源自抗体可变(v)区的氨基酸序列与mhc ii类分子相互作用,从而刺激或促进t细胞介导的反应(包括t细胞辅助的体液反应)的能力。
[0145]“抗体”意指免疫球蛋白家族中能够与抗原联合(combining)、相互作用或以其他方式缔合的蛋白。因此,抗体是抗原结合分子。“抗体”是免疫相互作用分子的实例,并且包括多克隆或单克隆抗体或抗血清。在实施方案中,本发明的免疫相互作用分子是单克隆抗体。
[0146]
术语“抗原”在本文中以其最广泛的意义使用,指能够在免疫反应中进行反应和/或诱导免疫反应的物质。提及的“抗原”包括由seq id no:1或其功能同源物或变体定义的抗原决定簇或表位或癌细胞。
[0147]“抗原结合分子”意指对靶抗原(即seq id no:1)具有结合亲和力的任何分子。应当理解,该术语扩展至免疫球蛋白(例如多克隆或单克隆抗体)、免疫球蛋白片段和表现出抗原结合活性的非免疫球蛋白来源的蛋白框架。术语“抗体”和“抗原结合分子”包括这些分子的去免疫形式。
[0148]“抗原决定簇”或“表位”意指这样的krt14部分,所述部分具有可以被免疫反应定向的细胞外结构域。
[0149]
尽管本发明的抗体通常是用于人类的鼠单克隆抗体的去免疫形式,但是本主题发明扩展至用于任何宿主的来自任何来源并且被去免疫的抗体。动物来源和宿主的实例包括人类、灵长类动物、牲畜动物(例如绵羊、牛、马、猪、驴)、实验室试验动物(例如小鼠、兔、豚鼠、仓鼠)和伴侣动物(例如狗、猫)。
[0150]
免疫和后续的单克隆抗体产生可以使用标准方案进行,如例如由和milstein(kohler等人(1975)nature 256:495
‑
499和kohler等人(1976)eur.j.immunol.6(7):511
‑
519;coligan等人current protocols in immunology,1991
‑
1997或toyama等人(1987)monoclonal antibody,experiment manual,由kodansha scientific出版)描述的。本质上,通过标准方法用抗原(即包含seq id no:1或其功能同源物或变体的蛋白或蛋白类似物)免疫动物,以产生产生抗体的细胞,特别是产生抗体的体细胞(例如,b淋巴细胞)。这些细胞然后可以从经免疫的动物中取出进行永生化。抗原可能需要首先与载体缔合。
[0151]“载体”意指具有通常高分子量的任何物质,其与非免疫原性或免疫原性差的物质
(例如半抗原)天然或人工连接以增强该物质的免疫原性。
[0152]
产生抗体的细胞的永生化可以使用本领域熟知的方法进行。例如,永生化可以通过使用epstein
‑
barr病毒(ebv)的转化方法来实现[kozbor等人(1986)methods in enzymology 121:140]。在优选的实施方案中,使用广泛用于产生单克隆抗体的细胞融合方法使产生抗体的细胞永生化(描述于[coligan等人(1991
‑
1997)上文])。在该方法中,具有产生抗体的潜力的产生抗体的体细胞,特别是b细胞,与骨髓瘤细胞系融合。这些体细胞可以源自致敏动物(诸如啮齿动物,包括如小鼠和大鼠)的淋巴结、脾和外周血。在本发明的示例性实施方案中,使用小鼠脾细胞。然而,有可能使用大鼠、兔、绵羊或山羊细胞,或者来自其他动物物种的细胞来代替。
[0153]
已经从淋巴细胞性肿瘤中开发出用于产生杂交瘤的融合程序的特化的骨髓瘤细胞系(kohler等人(1976)上文;kozbor等人(1986)上文;和volk等人(1982)j.virol.42(1):220
‑
227)。
[0154]
许多骨髓瘤细胞系可以用于产生融合的细胞杂交体,包括例如p3x63
‑
ag8、p3x63
‑
ag8.653、p3/ns1
‑
ag4
‑
1(ns
‑
1)、sp2/0
‑
ag14和s194/5.xxo.bu.1。和已经描述了p3x63
‑
ag8和ns
‑
1细胞系(kohler等人(1976)上文)。shulman等人(1978)nature 276:269
‑
270开发了sp2/0
‑
ag14骨髓瘤细胞系。trowbridge(1982)j.exp.med.148(1):220
‑
227报道了s194/5.xxo.bu.1系。
[0155]
生成产生抗体的脾或淋巴结细胞和骨髓瘤细胞的杂交体的方法通常涉及在存在促进细胞膜融合的剂(化学的、病毒的或电的)的情况下,使体细胞与骨髓瘤细胞分别以10:1的比例混合(尽管该比例可以从约20:1至约1:1变化)。已经描述了融合方法(kohler等人(1975)上文、kohler等人(1976)上文、gefter等人(1977)somatic cell genet.3:231
‑
236和volk等人(1982)上文)。这些研究者使用的融合促进剂是仙台病毒和聚乙二醇(peg)。
[0156]
因为融合过程以非常低的频率产生有活力的杂交体(例如,当脾用作体细胞的来源时,大约每1x105个脾细胞仅获得一个杂交体),所以具有从剩余的未融合细胞,特别是未融合骨髓瘤细胞中选择融合细胞杂交体的手段是优选的。在其他所得融合细胞杂交体中检测出期望的产生抗体的杂交瘤的手段也是必要的。通常,融合细胞杂交体的选择通过在支持杂交瘤生长但防止通常会继续无限分裂的未融合骨髓瘤细胞的生长的培养基中培养细胞来完成。融合中使用的体细胞在体外培养中不能维持长期活力,并且因此不会造成问题。在本发明的实例中,使用缺乏次黄嘌呤磷酸核糖基转移酶(hprt阴性)的骨髓瘤细胞。对这些细胞的选择在次黄嘌呤/氨基蝶呤/胸腺嘧啶核苷(hat)培养基中进行,由于脾细胞的hprt阳性基因型,融合细胞杂交体在该培养基中存活。使用具有不同遗传缺陷(药物敏感性等)的骨髓瘤细胞也是可能的,可以针对所述遗传缺陷在支持基因型上有能力(genotypically competent)的杂交体生长的培养基中进行选择。
[0157]
选择性培养融合细胞杂交体需要几周。在这个时间段的早期,有必要鉴定那些产生期望抗体的杂交体,以便可以随后克隆和繁殖它们。通常,约10%的所获得的杂交体产生期望的抗体,尽管约1%至约30%的范围并不罕见。产生抗体的杂交体的检测可以通过若干标准测定方法中的任何一种来实现,包括酶联免疫测定和放射免疫测定技术,如例如,kennet等人(chou等人,美国专利第6,056,957号)中描述的。
[0158]
在选择了期望的融合细胞杂交体并将其克隆成单个产生抗体的细胞系后,就可以
用两种标准方式中的任何一种来繁殖每个细胞系。杂交瘤细胞的悬浮液可以注射到组织相容性动物中。然后被注射的动物会发展肿瘤,该肿瘤分泌由融合细胞杂交体产生的特异性单克隆抗体。可以抽取动物的体液,诸如血清或腹水,以提供高浓度的单克隆抗体。可选择地,可以在实验室培养容器中体外繁殖单个细胞系。包含高浓度的单一特异性单克隆抗体的培养基可以通过倾析、过滤或离心并随后纯化来收获。
[0159]
通过任何合适的免疫检测手段测试细胞系检测出感兴趣的抗原的特异性。例如,可以将细胞系等分到多个孔中并孵育,并且通过酶联免疫吸附测定(elisa)、间接荧光抗体技术等分析来自每个孔的上清液。鉴定出产生能够识别靶抗原但不识别非靶表位的单克隆抗体的一种或更多种细胞系,并且然后直接在体外培养或注射到组织相容性动物中以形成肿瘤,和以产生、收集和纯化所需的抗体。
[0160]
因此,本发明首先提供了与以下蛋白特异性相互作用的单克隆抗体,所述蛋白包含包括seq id no:1的细胞外部分或其变体或其表位。
[0161]
然后通常使单克隆抗体经历去免疫手段。这样的过程可以采取许多形式中的任何一种,包括制备具有与根据本发明制备的单克隆抗体相同或相似的特异性的嵌合抗体。嵌合抗体是其轻链和重链基因通常由来自属于不同物种的免疫球蛋白可变区和恒定区基因通过遗传工程构建而成的抗体。因此,根据本发明,在获得产生期望单克隆抗体的杂交瘤后,就使用技术来产生种间单克隆抗体,其中一个物种的结合区与另一个物种的抗体非结合区组合(liu等人(1987)proc.natl.acad.sci.usa 84:3439
‑
3443)。例如,来自非人类(例如鼠)单克隆抗体的cdr可以被接枝到人类抗体上,从而使鼠抗体“人源化”(欧洲专利公布第0 239 400号、jones等人(1986)nature321:522
‑
525、verhoeyen等人(1988)science 239:1534
‑
1536和richmann等人(1988)nature 332:323
‑
327)。在这种情况下,去免疫过程是人类特有的。更具体地,cdr可以被接枝到具有或不具有人类恒定区的人类抗体可变区上。提供cdr的非人类抗体通常被称为“供体”,并且提供框架的人类抗体通常被称为“接受体”。恒定区不需要存在,但如果它们存在,它们必须与人类免疫球蛋白恒定区基本相同,即至少约85%
‑
90%,优选地约95%或更多相同。因此,人源化抗体的所有部分,除了可能的cdr,都与天然人类免疫球蛋白序列的相应部分基本相同。因此,“人源化抗体”是包含人源化轻链和人源化重链免疫球蛋白的抗体。通过“人源化”的过程,供体抗体被称为“人源化的”,因为所得的人源化抗体预期与提供cdr的供体抗体结合相同的抗原。本文提到的“人源化”包括指对特定宿主(在这种情况下,人类宿主)而言去免疫的抗体。
[0162]
应当理解,去免疫抗体可以具有对抗原结合或其他免疫球蛋白功能基本上没有影响的另外的保守氨基酸取代。
[0163]
可用于产生根据本发明的去免疫抗体的示例性方法描述于例如(richmann等人(1988)上文、chou等人(美国专利第6,056,957号)、queen等人(美国专利第6,180,377号)、morgan等人(美国专利第6,180,377号)和chothia等人(1987)j.mol.biol.196:901)。
[0164]
另一种形式的抗体包括“免疫球蛋白新抗原受体”(ignar),这是一种仅在海洋动物(鲨鱼和鳐鱼)软骨中发现的抗体同种型,其已经进化了数亿年以在血流的高尿素环境中稳定地表达(greenberg等人(1995)nature374:168
‑
173;nuttall等人(2001)mol immunol 38:313
‑
326)。在鲨鱼中,ignar反应是抗原驱动的,并且ignar可变结构域的免疫和幼稚分子文库二者都已构建并成功筛选出抗原特异性结合试剂(greenberg等人(1995)上文;
nuttall等人(2001)上文)。ignar是二价的,但通过显示出与不同数量的恒定结构域附接的两个互补决定区(cdr)环的单个免疫球蛋白可变结构域(~14kda)靶向抗原(nuttall等人(2003)eur j biochem 270:3543
‑
3554;roux等人(1998)proc natl acad sci usa 95:11804
‑
11809)。相比之下,传统的免疫球蛋白(ig)抗体具有可变重(v
h
)+可变轻(v
l
)结构域形式(~26kda),并通过最多6个cdr与抗原结合(chothia等人(1989)nature 342:877
‑
883;padlan(1994)mol immunol 31:169
‑
217)。ignar可变结构域(v
nar
)的小尺寸以及热力学和化学稳定性提供了超过常规抗体的明显优点。此外,小的v
nar
尺寸使得这种特别的抗体结构域能够通过特别长且可变的cdr3环到达隐蔽的抗原表位(greenberg等人1995上文;ewert等人(2002)biochemistry41:3628
‑
2636;nuttall等人(2004)proteins 55:187
‑
197;stanfield等人(2004)science 305:1770
‑
1773;streltsov等人(2004)proc natl acad sci usa101:12444
‑
12449;streltsov等人(2005)protein sci 14:2901
‑
2909)。已鉴定出识别包括以下的多种靶抗原的ignar结构域:恶性疟原虫(p.falciparum)的顶端膜蛋白1(ama
‑
1)(nuttall等人,2004上文);来自牙龈卟啉单胞菌(porphyromonas gingivalis)的kgp蛋白酶(nuttall等人(2002)febs lett516:80
‑
86);霍乱毒素(goldman等人,anal chem 78:8245
‑
8255,2006);tom70线粒体跨膜蛋白(nuttall等人(2003)上文)和溶菌酶(streltsov等人(2004)上文)。
[0165]
ignar或更常规的抗体本身可用作治疗剂或可用于携带细胞毒性分子至癌细胞。它们也可用于诊断。
[0166]
精确和灵敏的结合试剂是基于蛋白的治疗和诊断行业的基石。鉴于全球的高癌症率,对这样的用于治疗和诊断方案的靶向癌症抗原的试剂存在迫切需求。krt14的细胞外部分的鉴定和krt14的作用使得这些治疗和诊断应用的开发得以实现。
[0167]
在另一种实施方案中,剂是包含肽部分的疫苗,该肽部分包含足以产生对携带krt14的细胞外部分的癌细胞的免疫反应的krt14的细胞外部分。
[0168]
疫苗可以是肽疫苗或包含krt14的细胞外部分或krt14类似物和/或seq id no:1的复合物或缀合剂。在实施方案中,疫苗包含肽部分和一种或更多种药学上可接受的载体、稀释剂或赋形剂,所述肽部分包含seq id no:1中列出的氨基酸序列或其功能同源物或其变体,包含在最佳比对后与seq id no:1具有至少80%相似性的肽序列。本发明也实现了包含针对krt14的细胞外部分的抗体的药物组合物。
[0169]
术语“药学上可接受的”是指载体、稀释剂或赋形剂的生理学和药学上可接受的形式。
[0170]
本发明也包括包含反义或正义化合物以下调krt14表达的药物组合物和制剂。本发明的药物组合物可以各种方式施用,取决于是期望局部治疗还是全身治疗以及取决于待治疗的区域。施用可以是局部的(包括阴道和直肠递送)、肺的(例如通过吸入或吹入粉末剂或气雾剂,包括通过雾化器)、气管内、鼻内、表皮和透皮、口服或肠胃外。肠胃外施用包括静脉内、动脉内、皮下、腹膜内或肌肉内注射或输注;或颅内,例如鞘内或脑室内施用。用于局部施用的药物组合物和制剂可包括透皮贴剂、软膏剂、洗剂、乳膏剂、凝胶、滴剂、栓剂、喷雾剂、液体和粉末剂。常规药物载体,水性、粉末或油性基质(bases)、增稠剂等可能是必需的或期望的。本发明的药物制剂可以方便地以单位剂型存在,可以根据制药工业熟知的常规技术制备。这样的技术包括将活性成分与药学载体或者赋形剂缔合的步骤。通常,通过如下
制备制剂:将活性成分与液体载体或细分的固体载体或两者均匀地和紧密地缔合,并且然后如必要的话,使产品成形。在实施方案中,药物组合物还包含另外的抗癌剂,其说明性实例是本领域技术人员已知并在本文别处描述的。在实施方案中,另外的抗癌剂选自由以下组成的组:更生霉素、柔红霉素、多柔比星(阿霉素)、伊达比星和米托蒽醌、基于铂的剂、抗代谢物、致敏t细胞和细胞因子。在实施方案中,抗代谢物选自由以下组成的组:重氮丝氨酸、d
‑
环丝氨酸、霉酚酸、甲氧苄啶、5
‑
氟尿嘧啶、卡培他滨、甲氨蝶呤、吉西他滨、阿糖胞苷(ara
‑
c)和氟达拉滨。
[0171]
也提供了一种快速、有效和灵敏的测定来鉴定癌症,包括妇科癌症,诸如卵巢癌。测定实现癌症并且特别是卵巢癌的早期检测。然而,本发明并不仅限于卵巢癌的早期检测,因为测定可以用于例如妇科癌症的任何分期或其治疗或由其引起的任何并发症。
[0172]
关于“妇科状况”提及的“癌症”包括卵巢癌以及卵巢癌的亚型,诸如黏液性或子宫内膜性卵巢癌,或卵巢癌的分期,诸如i期、ii期、iii期或iv期。术语诸如“卵巢癌”、“上皮性卵巢癌”和“卵巢恶性肿瘤”在本文中可以互换使用。当应用于有症状的女性的诊断时,本发明是有用的,但是同样可以应用于无症状的女性和/或处于发展妇科状况的高风险的女性的诊断。然而,本发明包括雄性和雌性受试者中的广泛癌症。
[0173]
本发明扩展至“配体”或“结合剂”和其他类似术语,指能够特异性或基本特异性(即具有有限的交叉反应性)结合krt14上的细胞外表位的任何化合物、组合物或分子。“结合剂”通常具有单一特异性。然而,本文也考虑了对两个或更多个表位具有多重特异性的结合剂。结合剂(或配体)通常是抗体,诸如单克隆抗体或其衍生物或类似物,但也包括但不限于:fv片段;单链fv(scfv)片段;fab’片段;f(ab’)2片段;人源化抗体和抗体片段;骆驼源化(camelized)抗体和抗体片段;和前述的多价形式。如果合适,也可以使用多价结合试剂,包括但不限于:单特异性或双特异性抗体;诸如二硫键稳定的fv片段、scfv串联体[(scfv)2片段]、双特异抗体(diabodies)、三特异抗体(tribodies)或四特异抗体(tetrabodies),其通常为共价连接的或以其他方式稳定的(即亮氨酸拉链或螺旋稳定的)scfv片段。“结合剂”也包括适体,如本领域所述。
[0174]
合适的抗体的抗原结合片段的其他非限制性实例包括:(i)fd片段;(ii)dab片段;和(iii)由模拟抗体高变区的氨基酸残基组成的最小识别单位(例如,分离的cdr,诸如cdr3肽),或受限制的fr3
‑
cdr3
‑
fr4肽。本公开内容也扩展到其他工程化分子,诸如结构域特异性抗体、单结构域抗体、结构域缺失抗体、嵌合抗体、cdr接枝抗体、单臂抗体、双特异抗体、三特异抗体、四特异抗体、微型抗体(minibodies)、纳米抗体(例如单价纳米抗体、二价纳米抗体等),小模块化免疫药物(small modular immunopharmaceutical,smip)和鲨鱼可变ignar结构域。
[0175]
在实施方案中,抗原结合抗体片段包含至少一个免疫球蛋白可变结构域。可变结构域可以包含任何合适长度或组成的氨基酸序列,并且通常包含与一个或更多个框架序列相邻或同框的至少一个cdr。当抗原结合片段包含v
h
结构域和v
l
结构域时,v
h
和v
l
结构域可以以任何合适的排列相对于彼此定位。例如,可变区可以是二聚的,并且包含v
h
‑
v
h
、v
h
‑
v
l
或v
l
‑
v
l
二聚体。可选地,抗体的抗原结合片段可以包含单体v
h
或v
l
结构域。
[0176]
在一些实施方案中,抗原结合抗体片段可以包含与至少一个恒定结构域共价连接的至少一个可变结构域。可以在抗原结合片段中发现的可变结构域和恒定结构域的非限制
性构型包括:(i)v
h
‑
c
h
1;(ii)v
h
‑
c
h
2;(iii)v
h
‑
c
h
3;(iv)v
h
‑
c
h1‑
c
h
2;(v)v
h
‑
c
h1‑
c
h2‑
c
h
3,(vi)v
h
‑
c
h2‑
c
h
3;(vii)v
h
‑
c
l
;(viii)v
l
‑
c
h
1;(ix)v
l
‑
c
h
2,(x)v
l
‑
c
h
3;(xi)v
l
‑
c
h1‑
c
h
2;(xii)v
l
‑
c
h1‑
c
h2‑
c
h
3;(xiii)v
l
‑
c
h2‑
c
h
3;和(xiv)v
l
‑
c
l
。在可变结构域和恒定结构域的任何构型中,包括上文列出的示例性构型中的任一种中,可变结构域和恒定结构域可以彼此直接连接,或者可以通过完整或部分铰链或接头区域连接。铰链区可以由至少2个(例如,5个、10个、15个、20个、40个、60个或更多个)氨基酸组成,其导致单个多肽分子中相邻可变结构域和/或恒定结构域之间的柔性或半柔性连接。在一些实施方案中,如本文描述的,抗原结合片段可以包含上文列出的可变结构域和恒定结构域构型中的任一种彼此非共价缔合和/或与一个或更多个单体v
h
或v
l
结构域非共价缔合(例如通过一个或多于一个二硫键)的同二聚体或异二聚体(或其他多聚体)。多特异性抗原结合分子通常将包含至少两个不同的可变结构域,其中每个可变结构域能够与不同的抗原或同一抗原上的不同表位特异性结合。任何多特异性抗原结合分子形式,包括双特异性抗原结合分子形式,可以使用本领域可得的常规技术改编以用于本公开内容的抗体的抗原结合片段的背景中。
[0177]
术语“可变区”或“可变结构域”是指参与与靶抗原的结合的免疫球蛋白重链或轻链的结构域。天然免疫球蛋白分子的重链和轻链的可变结构域(分别地,v
h
和v
l
)通常具有相似的结构,每个结构域包括四个保守框架区和三个高变区(hvr)。参见,例如,kindt等人,kuby immunology,第6版,w.h.freeman and co.,第91页(2007)。单个v
h
或v
l
结构域可能足以赋予抗原结合特异性。
[0178]
对于治疗应用,可能期望修饰结合剂以与靶物种相容;即,待施用结合剂的物种。在实施方案中,结合剂是人源化结合剂。
[0179]
在一些实施方案中,如本文描述的,结合剂(包括抗体或其抗原结合片段)的fr,可以与靶物种(即,待施用结合剂的物种)的种系序列的fr相同。在一些实施方案中,fr可以是天然的或人工修饰的。虽然通常期望每个fr序列与源自靶物种的一种或更多种免疫球蛋白分子的fr序列相同,包括在向靶物种的受试者施用后使针对结合分子产生的免疫反应最小化,但在一些实施方案中,结合剂可以包含跨越其一个或更多个fr序列的在来自靶物种的一个或更多个fr中的相应位置处是外来的一个或更多个氨基酸残基。优选地,当结合剂包含跨越其一个或更多个fr序列的在靶物种中的相应位置处是外来的一个或更多个氨基酸残基时,该“外来”氨基酸残基将不会(i)不利地影响结合剂与其靶抗原(krt14)的结合特异性,和/或(ii)当向靶物种的受试者施用时,引起针对结合剂的免疫反应。
[0180]
在本文公开的实施方案中,剂(包括与krt14的细胞外部分结合的抗体及其krt14结合片段,如本文描述的)包含免疫球蛋白重链可变结构域(vh)和免疫球蛋白轻链可变结构域(vl),其中vh包含以下:包含seq id no:6的氨基酸序列的互补决定区1(vh cdr1),包含seq id no:7的氨基酸序列的vh cdr2和包含seq id no:8的氨基酸序列的vh cdr3;并且其中vl包含以下:包含seq id no:9的氨基酸序列的互补决定区1(vl cdr1),包含seq id no:10的氨基酸序列的vl cdr2和包含seq id no:11的氨基酸序列的vl cdr3。
[0181]
在实施方案中,vh包含:
[0182]
(a)vh框架区1(fr1),所述vh框架区1(fr1)包含与seq id no:12具有至少80%序列同一性的氨基酸序列;
[0183]
(b)vh fr2,所述vh fr2包含与seq id no:13具有至少80%序列同一性的氨基酸
序列;
[0184]
(c)vh fr3,所述vh fr3包含与seq id no:14具有至少80%序列同一性的氨基酸序列;和
[0185]
(d)vh fr4,所述vh fr4包含与seq id no:15具有至少80%序列同一性的氨基酸序列;
[0186]
并且vl包括:
[0187]
(e)vl fr1,所述vl fr1包含与seq id no:16具有至少80%序列同一性的氨基酸序列;
[0188]
(f)vl fr2,所述vl fr2包含与seq id no:17具有至少80%序列同一性的氨基酸序列;
[0189]
(g)vl fr3,所述vl fr3包含与seq id no:18具有至少80%序列同一性的氨基酸序列;和
[0190]
(h)vl fr4,所述vl fr4包含与seq id no:19具有至少80%序列同一性的氨基酸序列。
[0191]
在实施方案中,vh包含与seq id no:3具有至少80%序列同一性的氨基酸序列,并且vl包含与seq id no:5具有至少80%序列同一性的氨基酸序列。
[0192]
本公开内容也扩展至与癌细胞上的krt14的细胞外部分特异性结合的剂或其krt14结合片段,其中该剂包含免疫球蛋白重链可变结构域(vh)和免疫球蛋白轻链可变结构域(vl),其中vh包含以下:包含seq id no:6的氨基酸序列的互补决定区1(vh cdr1),包含seq id no:7的氨基酸序列的vh cdr2和包含seq id no:8的氨基酸序列的vh cdr3;并且其中vl包含以下:包含seq id no:9的氨基酸序列的互补决定区1(vl cdr1),包含seq id no:10的氨基酸序列的vl cdr2和包含seq id no:11的氨基酸序列的vl cdr3。
[0193]
在实施方案中,vh包含:
[0194]
(a)vh框架区1(fr1),所述vh框架区1(fr1)包含与seq id no:12具有至少80%序列同一性的氨基酸序列;
[0195]
(b)vh fr2,所述vh fr2包含与seq id no:13具有至少80%序列同一性的氨基酸序列;
[0196]
(c)vh fr3,所述vh fr3包含与seq id no:14具有至少80%序列同一性的氨基酸序列;和
[0197]
(d)vh fr4,所述vh fr4包含与seq id no:15具有至少80%序列同一性的氨基酸序列;
[0198]
并且vl包含:
[0199]
(e)vl fr1,所述vl fr1包含与seq id no:16具有至少80%序列同一性的氨基酸序列;
[0200]
(f)vl fr2,所述vl fr2包含与seq id no:17具有至少80%序列同一性的氨基酸序列;
[0201]
(g)vl fr3,所述vl fr3包含与seq id no:18具有至少80%序列同一性的氨基酸序列;和
[0202]
(h)vl fr4,所述vl fr4包含与seq id no:19具有至少80%序列同一性的氨基酸
序列。
[0203]
在实施方案中,vh包含与seq id no:3具有至少80%序列同一性的氨基酸序列,并且vl包含与seq id no:5具有至少80%序列同一性的氨基酸序列。
[0204]
配体和结合剂可用于在测定中检测携带krt14的细胞的存在。eclia、elisa和luminex labmap免疫测定是检测生物标志物水平的合适测定的实例。在一种实例中,第一结合试剂/抗体附接至表面,并且包含可检测基团的第二结合试剂/抗体与第一抗体结合。可检测基团的实例包括,例如但不限于:荧光染料、酶、用于与第二结合试剂结合的表位(例如,当第二结合试剂/抗体是由荧光标记的抗小鼠抗体检测的小鼠抗体时),例如抗原或结合对的成员,例如生物素。表面可以是平坦表面,诸如在典型的网格型阵列(例如,但不限于96孔板和平坦微阵列)的情况下,或者是非平坦表面,如包被珠阵列技术,其中珠的每个“种类”用例如荧光染料(诸如美国专利第6,599,331号、第6,592,822号和第6,268,222号中描述的luminex技术)或量子点技术(例如,如在美国专利第6,306,610中描述的)标记。这样的测定也可被视为实验室信息管理系统(lims)。
[0205]
如本文使用的,“免疫测定(immunoassay)”是指能够检测和定量期望的生物标志物,即krt14的细胞外部分的免疫测定(immune assays),通常地但不仅仅为夹心测定。
[0206]
提供了用于诊断妇科状况或其他癌症的方法,所述方法通过确定krt14的细胞外部分的存在,并使用细胞外部分的水平作为算法中的第二知识库数据来进行诊断,所述算法用患有已知疾病的患者中的krt14的已知量的第一知识库生成。还提供了检测临床前卵巢癌或其他癌症的方法,所述方法包括确定受试者的样品中krt14的存在和/或速度(velocity)。“速度(velocity)”意指患者的样品中krt14浓度随时间的变化。
[0207]
如上文指示的,妇科状况包括癌症或其并发症。本文使用的术语“癌症”包括所有癌症,包括但不限于“妇科癌症”。在一种实施方案中,妇科癌症包括但不限于输卵管上皮化生(tubal metaplasia)、卵巢浆液性边界性赘生物(ovarian serous borderline neoplasms)、浆液性腺癌、低级别黏液性赘生物和子宫内膜肿瘤。在具体实施方案中,妇科癌症是卵巢赘生物,经历异常的mullerian上皮分化。本文考虑的其他妇科状况包括炎性病症,诸如子宫内膜异位症。如上文指示的,本发明扩展至雄性和雌性受试者的广泛癌症。
[0208]
如本文使用的,术语“样品”意指包含人们希望检测的癌细胞的任何样品,包括但不限于生物体液(包括血液、血浆、血清、腹水)、组织提取物、新鲜收获的细胞和已经在细胞培养物中孵育的细胞的裂解物。在特定实施方案中,样品是妇科组织、血液、血清、血浆或腹水。
[0209]
如上文指示的,“受试者”可以是疑似患有或患有妇科状况或其他癌症的任何哺乳动物,通常是人类。受试者可以被称为患者,并且是疑似患有或患有癌症或处于发展癌症的风险的哺乳动物。术语“状况”也包括由其引起的并发症。
[0210]
术语“对照样品”包括可用于建立来自具有已知疾病状态的受试者的数据的第一知识库的任何样品。
[0211]
本主题发明的方法可用于癌症诸如妇科癌症包括卵巢癌的诊断和分期。本发明也可用于监测状况的进展,以及监测特定治疗是否有效。特别地,所述方法可用于诸如在外科手术、化学疗法、免疫疗法和/或放射疗法之后,确认状况的症状的不存在或缓解。方法还可用于监测化学疗法和异常组织再现。
[0212]
如上文指示的,抗体可用于依赖于生物标志物的抗原决定簇和抗体之间的结合相互作用的许多免疫测定中的任何一种。这样的测定的实例是放射免疫测定、酶免疫测定(例如eclia、elisa)、免疫荧光、免疫沉淀、乳胶凝集、血凝和组织化学测试。抗体可用于检测和定量样品中生物标志物的水平,以确定其在癌症中的作用和诊断癌症。
[0213]
特别地,本发明的抗体也可用于免疫组织化学分析,例如在细胞和亚细胞水平,以检测生物标志物,将其定位于特定细胞和组织,以及特定的亚细胞位置,并定量表达水平。药物除了是抗体之外,还可以是任何亲和试剂,包括但不限于适体、单特异抗体、anticalin、darpin和纳米抗体等。
[0214]
本领域已知的用于使用光和电子显微术定位抗原的细胞化学技术可用于检测携带krt14细胞外结构域的细胞。通常,本发明的抗体可以用可检测物质进行标记,并且基于可检测物质的存在,生物标志物蛋白可以被定位在组织和细胞中。可检测物质的实例包括但不限于以下:放射性同位素(例如,3h、
14
c、
35
s、
125
i、
131
i)、荧光标记物(例如,fitc、罗丹明、镧系元素磷光体(lanthanide phosphor)、发光标记物诸如鲁米诺(luminol);酶标记物(例如,辣根过氧化物酶、β半乳糖苷酶、萤光素酶、碱性磷酸酶、乙酰胆碱酯酶)、生物素基团(其可以通过标记的抗生物素蛋白来检测,例如,包含荧光标志物或可以通过光学方法或量热法来检测的酶活性的链霉抗生物素蛋白)、由第二报告物(例如,亮氨酸拉链对序列、二级抗体的结合位点、金属结合结构域;表位标签)识别的预定的多肽表位。在实施方案中,标记物经由各种长度的间隔臂(spacer arm)附接,以降低潜在的空间位阻。抗体也可以与电子致密的物质偶联,诸如与容易通过电子显微术可视化的铁蛋白或胶体金偶联。
[0215]
抗体或样品可以固定在能够固定细胞、抗体等的载体或固体支持物上。例如,载体或支持物可以是硝化纤维素或玻璃、聚丙烯酰胺、辉长岩和磁铁矿。支持物材料可以具有任何可能的构型,包括球形(例如珠)、柱形(例如试管或孔的内表面,或杆的外表面)或扁平(例如薄片(sheet)、测试条(test strip))。也可以采用间接方法,其中通过引入对与生物标志物蛋白反应的抗体具有特异性的第二抗体来放大初始抗原
‑
抗体反应。举例来说,如果对krt14细胞外结构域具有特异性的抗体是兔igg抗体,则第二抗体可以是用本文描述的可检测物质标记的山羊抗兔丙种球蛋白。
[0216]
当放射性标记用作可检测物质时,krt14生物标志物可以通过放射自显影来定位。放射自显影的结果可以通过经由各种光学方法确定放射自显影中颗粒的密度或通过对颗粒计数来定量。
[0217]
针对krt14的经标记的抗体可用于定位正进行外科手术的患者中的肿瘤组织,即用于成像。通常,对于体内应用,抗体用放射性标记物(例如,碘
‑
123、碘
‑
125、碘
‑
131、镓
‑
67、锝
‑
99和铟
‑
111)标记。标记的抗体制剂可以在组织成像前几小时至四天的时间,在合适的载体中静脉内施用至患者。在此时间段期间,未结合部分从患者清除,并且剩下的抗体只有那些与肿瘤组织缔合的抗体。使用合适的γ照相机检测同位素的存在。标记的组织可以与患者的身体上已知的标志物相关联,以便外科医生精确定位肿瘤的位置。
[0218]
因此,在另一种实施方案中,本发明提供了一种用于检测患者中的癌症的方法,该方法包括:
[0219]
(a)提供来自患者的样品;
[0220]
(b)使样品与结合krt14细胞外表位的剂接触以确定其水平,并对水平进行算法处
理,以提供患者患有癌症的概率指数;和
[0221]
(c)基于概率指数诊断患者患有癌症的风险。
[0222]
在另一种实施方案中,本发明提供了一种用于检测患者中的循环krt14阳性癌细胞的方法,该方法包括:
[0223]
(a)提供来自患者的血液样品;
[0224]
(b)使血液样品与结合krt14细胞外表位的剂接触,以确定样品中krt14阳性癌细胞的存在。
[0225]
本文描述的方法可以通过利用预包装诊断试剂盒来进行,所述预包装诊断试剂盒包含进行本发明的方法中的任一种的必要试剂。例如,试剂盒可以包括针对krt14的细胞外部分的至少一种特异性抗体,其可以方便地用于例如在临床环境中筛选和诊断患者,以及筛选和鉴定那些表现出发展癌症的倾向的个体。试剂盒也包括用于实施本发明的方法的详细说明。
[0226]
本发明还提供了基于算法的筛选测定,以筛选来自患者的样品。通常,输入数据基于krt14的水平进行收集,并经过算法来评估水平的任何升高或降低的统计显著性,然后该信息是输出数据。本发明包括用于评估输入数据的计算机软件和硬件。
[0227]
本发明的测定允许集成到现有的或新开发的病理学架构或平台系统中。例如,本发明考虑了一种允许使用者确定受试者关于癌症或关于其亚型或分期的状态的方法,该方法包括:
[0228]
(a)经由通信网络接收呈krt14的细胞外部分的存在的形式的数据;
[0229]
(b)经由提供疾病指数值的算法处理受试者数据;
[0230]
(c)根据疾病指数值与预定值的比较结果确定受试者的状态;和
[0231]
(d)经由通信网络向使用者传送受试者的状态的指示。
[0232]
在本文公开的另一种实施方案中,提供了一种监测患者中的癌症的方法,该方法包括:
[0233]
(a)提供患者在第一时间点的血液样品;
[0234]
(b)将(a)的样品与结合krt14细胞外表位的剂接触,以确定样品中krt14阳性癌细胞的水平;
[0235]
(c)提供患者在第二时间点的血液样品,其中第一时间点不同于第二时间点;
[0236]
(d)使(c)的样品与结合krt14细胞外表位的剂接触,以确定样品中krt14阳性癌细胞的水平;和
[0237]
(e)确定在第一时间点和第二时间点之间患者中krt14阳性癌细胞的水平是否存在变化;
[0238]
其中在第一时间点和第二时间点之间患者中krt14阳性癌细胞水平的变化指示患者中癌症状态的变化。
[0239]
这样的方法可以合适地用于监测癌症状态或分期的变化(例如,响应于疗法)或检测复发(例如,在肿瘤切除后)。
[0240]
在实施方案中,癌症为妇科癌症。在实施方案中,妇科癌症是卵巢癌或卵巢癌的分期或形式。在另一种实施方案中,癌症选自脑癌、膀胱癌、肝癌、乳腺癌、肺癌、胰腺癌、肠癌、结肠癌、胃肠道癌、胃癌、喉癌、子宫内膜癌和结直肠癌。
[0241]
提到的如上文概述的“算法”或“算法函数”包括多元分析函数的性能。除了上文描述的架构和平台之外,还可以实现一系列不同的架构和平台。应当理解,可以使用适用于实现本发明的任何形式的架构。
实施例
[0242]
本文公开的方面通过以下非限制性实施例进一步描述。可以采用以下材料和方法。
[0243]
细胞培养。细胞系ovcar
‑
4(nih
‑
ovcar4)和caov
‑
3#htb
‑
75购自atcc和nih。ovcar
‑
4细胞维持在roswell park memorial institute培养基
‑
1640(rpmi)(life technologies,21870092)中;caov
‑
3细胞维持在dulbecco改良eagle培养基(dmem)(thermo scientific,#11965118)中;skov3细胞(#htb
‑
77
tm
)维持在dulbecco改良eagle培养基(dmem)/ham’s f
‑
12(dmem/f12)(thermo scientific,#11965118)中;cov362.4,sigma aldrich(sigma#07071904)维持在高葡萄糖dulbecco改良eagle培养基(dmem
‑
hg)中;bt
‑
16非典型畸胎样/横纹肌样瘤(cvcl_m156)和nci
‑
h1573肺腺癌(nci
‑
h1573)二者均维持在rosswel park memorial institute(rpmi);mda
‑
mb
‑
468三阴性乳腺癌细胞(cvcl_0419)维持在dmem中,ane ca(atcc htb
‑
11)维持在eagle最低必需培养基emem中,并且sw 620细胞(atcc ccl
‑
227)维持在leibovitz’s l
‑
15培养基中。所有培养基都补充有10%胎牛血清(fcs)(thermo fisher,#16000044)和1%青霉素
‑
链霉素(thermo scientific,#15240062)。id8小鼠上皮oc细胞系(kathy roby博士,kansas university medical center,kansas city,ka,usa)在含4%胎牛血清(fbs)和1%胰岛素
‑
转铁蛋白
‑
亚硒酸盐(its)和1%青霉素/链霉素(ps)的gibco dmem(thermofisher scientific)中生长。人类间皮细胞系lp9(coriell institutecell repository#ag07086)维持在具有10%v/v fcs、1%v/v青霉素
‑
链霉素、10ng/ml egf和0.4ug/ml氢化可的松的hamsf12/199培养基中。所有细胞系都维持在37℃与5%v/v co2并且在开始所有测定之前使用countess(注册商标)ii fl自动细胞计数仪进行细胞活力计数。在患者同意后,使用建立的纯化方法从恶性腹水获得非黏附性肿瘤细胞(latifi等人(2012)plos one 7(10))并在分析之前通过在mcdb:f12培养基和10%v/v fcs中在低黏附板上培养而维持在低黏附条件下。
[0244]
crispr krt14靶向破坏和krt14过表达。crispr介导的基因沉默按照zhang实验室方案(cong等人(2013)science 339(6121):819
‑
23)进行,每个基因使用3条指导链。在dmem中使用lipofectamine(注册商标)2000转染试剂(invitrogen,#11668019)根据制造商方案用指导链(1
‑
3)、非靶向对照或krt14过表达构建体krt14
oe
(origene#rc214907)转染细胞。转染和12小时恢复时间段后,将细胞传代培养到选择培养基中,并通过添加1μg/ml嘌呤霉素(sigma
‑
aldrich,#p8833)或遗传霉素(商标)选择抗生素(g418硫酸盐)(life technologies australia#10131
‑
035)维持在选择压力下。对细胞进行有限稀释,其中每两天更换一次选择培养基,持续大约两周。扩增单个集落,并且通过蛋白印迹分析测量靶基因的敲低,以及通过sanger测序验证靶基因的敲低。
[0245]
人类组织阵列和免疫组织化学。对购自usbiomax(#ov2085,#ov20811)或在内部产生的组织微阵列(tma)切片(肿瘤和输卵管)进行免疫组织化学,如先前描述的[bilandzic等人(2014)cancer lett 354(1):107
‑
114;rainczuk等人(2013)j proteome res;
salamonsen等人(2013)fertil steril99(4):1086
‑
92](补充数据6和7)。为了抗原取回(antigen retrieval),切片在50mm甘氨酸(ph 3.5)中在90℃孵育10分钟。切片在4℃与rb
‑
krt14抗体(1:100,sigma,sab4501657)和mab an
‑
17(1:500)在0.1%w/v bsa/pbs中孵育过夜。随后的步骤在室温进行,孵育之间用pbs洗涤。切片与山羊抗兔igg过氧化物酶缀合物(1:1000,dako,glostrup,denmark;目录项po448),生物素化兔抗山羊igg抗体(1:1000,vector laboratories cat.no:ba
‑
5000)或生物素化兔抗小鼠igg抗体(1:1000,vector laboratories cat.no:ba
‑
9200)孵育1小时,然后是与vectastain elite abc试剂盒孵育,孵育根据制造商的说明(vector laboratories,burlingame,california)进行。用3,3
′‑
二氨基联苯胺四盐酸盐显影后,抗体结合检测为棕色沉淀,并且将harris苏木精用作复染剂。切片在depex(bdh laboratory supplies,poole,united kingdom)中固定在玻璃盖玻片下。相对于暴露于同种型(igg)对照的平行切片评估阳性免疫染色。肿瘤和基质组织中的免疫染色使用aperio imagescope(v 12.3.3)进行评估,如(rainczuk等人(2013)上文)所描述的。
[0246]
蛋白印迹分析。sds
‑
page和蛋白印迹如前在bilandzic等人(2013)mol endocrinol,2013.27(3):466
‑
79中所描述地进行。使用针对krt14(1:1000,sab4501657)、mab an
‑
17和β
‑
肌动蛋白(1:20,000;sigma
‑
aldrich,castle hill,australia)的抗体探测印迹。使用hrp缀合的山羊抗小鼠、抗兔和驴抗山羊二级抗体(1:50,000;merck millipore,kilsyth,australia)(bilandzic等人(2013)mol endocrinol,2013.27(3):466
‑
79)。使用clarity western ecl印迹底物(biorad#1705061)检测蛋白条带,并使用chemidoc(商标)mp系统(bio
‑
rad#1708280)使蛋白条带可视化。
[0247]
xcelligence实时细胞分析(rtca)。实时细胞分析(rtca)使用xcelligence rtca sp 96孔仪(acea biosciences)进行。在开始之前,通过在无血清培养基中孵育过夜,使细胞系同步于go期。对于增殖测定,细胞以0.5
×
103个细胞/0.14ml/孔进行接种(如实验文本中概述的),并且每5分钟获取阻抗读数持续8小时(以监测细胞黏附),并且随后每15分钟读取阻抗读数持续24小时(以监测细胞增殖)。对于侵袭测定,cim
‑
16孔板的上室(upper chamber)用matrigel基质(sfm中1:10;bd biosciences,san jose,ca)包被。将细胞接种到上室中(如上文),将培养基+/
‑
10%v/v fbs添加至下室。所有测定以一式两份或一式三份进行,进行至少三个独立实验。
[0248]
腹膜微环境模型。为了建立腹膜微环境的模型,通过用matrigel(sfm中1:10;bd biosciences)包被上室,制备两室rtca cim板孔,并且然后添加7
×
104个lp9细胞/孔并监测,直到形成汇合单层(domcke等人(2013)nat commun 4:2126)。球状体(从新鲜患者腹水获得;10个球/孔)接种在上室中的sfm中,并将培养基
±
10%v/v fbs添加到腔室。实时读数用于确定用作maldi成像分析收集点的最佳时间,其中所有样品以一式两孔/实验或一式三孔/实验进行制备。作为另外的对照,我们也使用改良的boyden室并行进行了并行终点侵袭测定(concurrent endpoint invasion assays)。在这种情况下,在接种卵巢癌球状体之前,使用cell trace(商标)cfse标记间皮lp9细胞。使用cytation(商标)3多模式成像仪(biotek instruments,winooski usa),根据球状体下方经csfe标记的间皮细胞的回缩来评估间皮侵袭。
[0249]
制备用于maldi
‑
ims的样品。球状体
‑
间皮界面在thermanox(商标)可分区的
(sectionable)盖玻片上共培养,并在对应于侵袭前、侵袭期间和侵袭后确定的时间点进行琼脂覆盖(通过rtca试验测量)。样品以5μm进行切片,并通过对定期切片的h&e染色来定位侵袭界面。在鉴定后,将通过界面的两个未染色部分置于铟
‑
锡氧化物(ito)载玻片上进行maldi处理(bruker daltonik,gmbh)。
[0250]
maldi ims。使用imageid工作流程(bruker)鉴定卵巢癌
‑
球状体
‑
间皮界面处的胰蛋白酶水解肽。使用imageprep喷雾装置(bruker)通过雾化将胰蛋白酶应用于连续组织切片。样品在加湿的室中消化90分钟,然后使用c18移液管吸头提取和纯化肽。使用ultraflextreme maldi
‑
tof/tof(bruker)和dionex ultimate 3000rslc系统(thermo)进行lc
‑
maldi分析,如所描述的(rainczuk等人(2014)int j cancer 134(3):530
‑
41)。然后,使用fleximaging 4.1(bruker)对随后消化的连续切片进行maldi图像获取,如先前所描述的(rainczuk等人(2014)上文)。使用imageid软件(bruker)对lc
‑
maldi数据和maldi图像数据进行比较和过滤,并在图像数据和lc
‑
maldi分析之间匹配质量峰。峰匹配的质量公差由imageid软件自动计算。
[0251]
甲基纤维素覆盖和球形成。通过胰蛋白酶消化使卵巢癌细胞解离,并重悬于完全细胞培养基中(98%的最低活力,如由countess细胞计数仪确定的)。将2,500个细胞/球覆盖在无血清培养基中的0.25%w/v甲基纤维素(sigma aldrich,castle hill,australia)中,并接种到96孔cellstar(注册的)u底悬浮培养板(greiner bio one,interpath services pty,vic,australia)的单孔中。每种细胞系的球状体聚集和形成使用光学显微镜进行观察,并以规律的间隔成像。使用大口径吸头和离心收集形成的球。
[0252]
间皮移位测定(mesothelial displacement assay)。如上文接种人类间皮细胞系lp9,并在37℃孵育直到形成汇合单层。收集卵巢癌球(如上文),并将16个球接种到包含汇合间皮单层的孔中。使用相差显微术以规律的间隔对间皮移位和生长晕形成(outgrowth)进行成像。
[0253]
体外伤口修复测定。卵巢癌细胞(或其他癌细胞系
‑
bt16、nci
‑
h1573、an3ca、sw620和mda
‑
mb
‑
468)在完全培养基中在12孔板中生长至汇合,然后血清饥饿过夜,以同步于g0。第二天,去除细胞培养基,并通过用附着于吸管的移液管吸头刮擦使细胞单层受伤。非黏附细胞通过用pbs温和洗涤而去除,并换成具有或不具有mab an
‑
17(1μg/ml)或商业krt14多克隆抗体(1μg/ml)的完全生长培养基。伤口区域在相差显微镜(leica)下以范围为0
‑
72h的规律间隔进行成像。在图像系列中使用analysis ls research software(olympus)测量伤口闭合,以确定每天的伤口面积。实验以一式三份进行重复,其中每个生长条件观察至少六个伤口区域。
[0254]
matrigel和胶原i生长晕形成测定:染色和成像。方案改编自nguyen
‑
ngoc等人(2012)proc natl acad sci u s a.109(39):e2595
‑
604。简而言之,收集卵巢癌球状体以产生6个球/基质的悬浮液。球被包埋在3d matrigel(354230;bd biosciences)或鼠尾胶原i(354236;bd biosciences)中。按照nguyen
‑
ngoc等人(2012)上文,在盖玻片载玻片(94.6190.802,starstedt)上的8个孔中设置培养。对于抗体染色,在matrigel或胶原i中培养的球用4%w/v多聚甲醛固定30分钟,在pbs中漂洗两次持续10分钟,用pbs中的0.5%v/v triton x
‑
100透化20分钟,并在pbs中漂洗两次持续10分钟,并在pbs中的10%v/v fbs中在室温封闭2小时,然后与一级抗体(1:1000,抗
‑
n钙黏蛋白抗体[5d5]ab98952 abcam和1:
500,krt14)在4℃孵育过夜。第二天,样品用pbs洗涤三次,并与二级抗体(1:2000,山羊抗兔igg alexa 467,ab150083和1:2000山羊抗小鼠igg alexa488,ab150117)在室温孵育3小时,然后在pbs中漂洗三次持续10min。使用具有gen5 image+软件的cytation(商标)3多模式成像仪(biotek instruments,winooski usa)或nikon c1共聚焦显微镜(monash micro imaging facility,monash)对样品进行成像。
[0255]
实时pcr。使用带5mm不锈钢珠的tissue lyser lt系统和rneasy mini试剂盒(qiagen)从原发性高级别浆液性卵巢肿瘤(n=3)和整个正常卵巢(n=3)中提取总rna。用rneasy mini试剂盒(qiagen)按照制造商的方案从以下提取总rna:生长为单层或球状体(krt14
ko
和野生型系)的卵巢癌细胞系ovcar4和caov3;腹水来源的卵巢癌(n=3)或良性纤维瘤(n=2)球状体;和靶腹膜细胞层lp
‑
9。针对krt14、hnrn、fndc3b、18s、cdca8的正义和反义寡核苷酸引物针对已发表的人类序列设计,并进行验证,如先前描述的(bilandzic等人(2009)mol endocrinol,23(4):539
‑
48)。使用superscript iii逆转录酶(life technologies,grand island,ny)合成cdna。实时pcr样品使用applied biosystems abi sybr mix(scoresby,victoria,australia)制备至10μl的终体积。如先前描述的(bilandzic等人(2009)上文),使用applied biosystems abi 7900ht fast实时机器完成定量实时pcr,所有反应以一式三份进行。基于每种pcr产物的标准曲线,将产量转换为飞克,并且所得的mrna水平被归一化至18s mrna水平/样品。
[0256]
统计分析。使用graphpad prism(版本6;graphpad software inc.,san diego,ca)进行统计分析。如指示的,对于来源于细胞测定的数据,使用单因素或双因素anova与bonferroni、dunnett或tukey事后检验比较平均值。为了确定样品之间mrna表达是否有显著差异,进行了mann
‑
whitney
‑
u检验或非配对t检验。如果p<0.05,平均值被认为是有显著差异的。所有实验独立重复至少三次。
[0257]
kaplan
‑
meier曲线。kaplan
‑
meier在线绘图工具(http://kmplot.com/分析/)用于使用来自15个公共卵巢癌数据集的浆液性卵巢癌患者的mrna数据生成生存曲线,其中最佳截断值由绘图工具自动选择,并计算对数秩、p值和风险比(以及95%置信区间)(lanczky等人(2016)breast cancer res treat.3(160):439
‑
446)。
[0258]
实施例1
[0259]
黏附和增殖不能预测细胞的侵袭能力
[0260]
转移性卵巢癌细胞与作为腹腔和器官衬里的间皮单层相互作用,侵袭并附着于底层基质以建立继发性结节(kenny等人(20017)int j cancer121(7):1463
‑
72;burleson等人(2006)j transl med 4:6;sodek等人(2012)cancer metastasis rev 31(1
‑
2):397
‑
414)。使用原发性的腹水来源的肿瘤细胞,以在体外经延长的时间范围从球状体出现侵袭性丝状伪足来评估间皮移位。在测定开始时,来自良性或恶性样品的球状体具有类似尺寸并且没有显示出明显的形态学差异。所有恶性样品的广泛丝状伪足的生长晕形成和底层间皮层的清除在24小时内发生;相比之下,良性球状体未显示出生长晕形成或侵袭的任何明显证据。缺乏侵袭不是由于失败的黏附或减少的细胞增殖;事实上,在rtca测定中,良性细胞显示出对未包被的和纤连蛋白包被的培养板的相对升高的黏附性,并且获得了比恶性细胞样品更高的增殖指数。这些数据展示出,只有恶性细胞表现出侵袭能力;并且不能从体外的细胞黏附或增殖能力来预测侵袭潜力。
[0261]
实施例2
[0262]
蛋白质组剖析(proteomic profiling)鉴定侵袭界面独特的蛋白
[0263]
之前没有研究直接检查在活跃侵袭的癌细胞和间皮之间的界面处的蛋白。为了评估与侵袭相关的蛋白丰度和定位,在附着于间皮之后,但在侵袭开始之前(如由rtca测定确定的),收获球状体/间皮共培养物。使用平行终点boyden室测定确认在用于maldi ims分析的样品中发生了间皮附着,但未发生侵袭。
[0264]
细胞
‑
球状体界面培养物被包埋在琼脂糖中,切片并通过ihc进行定位(图1a);然后通过ims分析连续切片,以鉴定位于侵袭界面的蛋白。分析也包括来自患有良性纤维瘤的患者的腹水来源的球状体(未示出),以对样品间的异型差异形成对照。maldi ims和随后的lc
‑
maldi
‑
ms/ms鉴定出独特地存在于包含恶性而非良性球状体的共培养物中的处于球状体/间皮界面的26种蛋白。其中存在几种先前被与卵巢癌关联的蛋白(例如hsp90、amh和osm)[vesci等人(2014)int j oncol 45(4):1421
‑
9;liu等人(2013)clin cancer res 19(18):5053
‑
67;kim等人(2014)obstet gynecol sci.57(5):343
‑
57;richards(2013)isrn inflammation 2013:23],验证了所述方法并表明这些蛋白可能在侵袭的早期期间发挥重要作用。进一步限制分析以:(i)仅包括在每个恶性高级别浆液性卵巢癌(hgsc)样品中鉴定出的那些蛋白;和(ii)排除也在间皮细胞单层中鉴定出的蛋白。按照这种高严格性方法,四种蛋白(krt14、hrnr、cdca8和fndc3b)被鉴定为在癌症
‑
间皮界面处所有患者hgsc细胞独特的。对tma的免疫染色和对新鲜冷冻组织的rt
‑
pcr也用于确认与组织学上正常的卵巢组织相比,独立肿瘤组织中的候选物表达和定位。
[0265]
实施例3
[0266]
侵袭界面上的krt14是卵巢癌细胞侵袭所必需的
[0267]
通过蛋白印迹在多个hgsc细胞系(ovcar3、ovcar4和caov3)中检测了hrnr、krt14、cdca8和fndc3b的丰度(domcke等人(2013)上文)。与蛋白质组剖析一致,在癌细胞裂解物中检测到hrnr、krt14和cdca8,但在间皮细胞对照中未检测到。在lp9间皮细胞中检测到fndc3b,并被排除在进一步分析之外。然后使用crispr敲除(caov3和ovcar4细胞系)krt14、cdca8和hrnr,通过测序pcr和蛋白印迹确认它们在克隆群体中的特异性损失。通过rtca测试了功能性krt14、cdca8或hrnr损失对细胞增殖和侵袭的影响。与未处理或非靶向对照相比,缺乏hrnr或cdca8的细胞显示出显著减少的增殖(未示出);相比之下,krt14的损失并不影响增殖(图2),表明它不是肿瘤细胞活力或生长所必需的。cdca8敲除细胞和hrnr敲除细胞二者也都保留了侵袭能力;cdca8敲除细胞显示出与未处理或非靶向细胞相似的侵袭动力学,而hrnr敲除细胞表现出侵袭开始时的滞后。然而,缺乏功能性krt14的细胞显示出侵袭能力的完全丧失(图2a),30h后(或经最长7天的延长时间段)未观察到侵袭。krt14介导的侵袭能力丧失在2d伤口愈合测定中得到确认(图2b),其中krt14敲除(krt14
ko
)细胞未能在48小时后修复受伤的单层。因此,进一步的研究集中于将krt14作为控制恶性卵巢癌细胞的侵袭能力的关键基因。
[0268]
实施例4
[0269]
腹膜微环境模型
[0270]
使用腹膜微环境模型,检测到krt14在侵袭性卵巢癌细胞的“前缘”上转移的最早期时表达。这些细胞被定义为“前导细胞”。在这个模型中,卵巢癌球状体覆盖于建立在cim
‑
16rtca板中的matrigel基质上的间皮单层上。使用xcelligence仪器实时监测球状体附着和通过间皮单层/基质的侵袭,提供侵袭细胞行为的动态快照。
[0271]
来自患有良性(卵巢纤维瘤)或恶性(hgsc)疾病的患者的球状体从腹水分离,并评估侵袭能力。恶性hgsc细胞快速侵袭通过间皮单层,其中所有样品在添加后4h内展示出活跃侵袭。相比之下,从患有良性纤维瘤的患者获得的球状体未能破坏间皮单层。因此,在体外,癌细胞侵袭的开始在接触间皮单层后快速发生,表明了对参与侵袭的早期事件进行分析的时间范围。
[0272]
实施例5
[0273]
实时体外侵袭测定
[0274]
使用实时体外侵袭测定(bilandzic和stenvers(2014)j vis exp 87)以测量通过间皮单层的卵巢癌细胞侵袭,展示出krt14(k14
ko
)的遗传消融完全消除了多种卵巢癌细胞系(cvar4和caov3)的侵袭能力(图2)以及从腹水回收的原发性卵巢癌细胞(n=5)的侵袭能力(数据未示出)。krt14表达的损失对细胞活力和增殖能力没有影响,这与其他研究(papafoliou等人(2016)上文;rock等人(2009)proc natl acad sci usa 106(31):12771
‑
12775)一致。krt14
ko
卵巢癌细胞在伤口愈合测定中也不能修复受损的细胞单层,展示出迁移能力丧失(图2b)。也观察到,培养成为多细胞球状体的krt14
ko
卵巢癌细胞显示出与间皮单层的结合减少,并且未能启动间皮清除(未示出),所述间皮清除是上皮性卵巢癌(eoc)侵袭的关键需求(iwanicki等人(2011)cancer discov 1(2):144
‑
157)。使用同基因卵巢癌小鼠模型的体内研究(roby等人(2000)carcinogenesis 21(4):585
‑
591)展示出囊内植入到小鼠中的krt14
ko
卵巢癌细胞未能建立肿瘤(图3);并且植入了krt14
ko
细胞的小鼠没有发展腹胀或任何其他症状。
[0275]
实施例6
[0276]
迁移性细胞显示出增加的krt14表达
[0277]
在来自包括以下的临床样本的迁移性细胞中测量krt14 mrna表达:(i)原发肿瘤组织;(ii)腹水来源的hgsc细胞;和(iii)良性细胞;(iv)组织学上正常的卵巢;和(v)单独的靶腹膜细胞层lp9(n=3/组)。所有恶性细胞在测定开始时都表达krt14,而在良性纤维瘤、正常卵巢或lp9间皮细胞中未检测到表达。与细胞系一致,仅在恶性样品(即肿瘤组织或腹水来源的)中检测到迁移性细胞;从良性腹水、正常对照或单独的lp9细胞分离的细胞未能侵袭。与原发性肿瘤样品中的迁移前样品相比,已迁移至下室的侵袭细胞中显著富集krt14表达,其中腹水来源的卵巢癌细胞群体显示出最高的krt14 mrna水平。总之,数据表明,虽然krt14对细胞活力或增殖没有影响,但特别需要它以在体外维持迁移性癌细胞子集的侵袭潜力;并且它在活跃侵袭的细胞中显著富集。
[0278]
实施例7
[0279]
krt14被限制于影响球状体组装和黏附至间皮的hgsc细胞的亚群
[0280]
通过免疫染色确定krt14丰度及其在卵巢癌细胞(永生化和原发性腹水来源二者)中的定位。在单层培养物中,krt14被限制于少数分离的细胞,而在低黏附条件下培养的球状体显示krt14免疫染色仅定位于球状体外缘。内部krt14染色的不存在不是由于来自球状体的抗体阻塞(occlusion of antibodies),因为抗n
‑
钙黏蛋白抗体有效地透过而使整个球状体染色。通过检查krt14
ko
和krt14过表达(krt14
oe
)系来评估krt14表达是否是体外球
状体形成所必需的。野生型ovcar4细胞和用非靶向crispr对照转染的细胞在低黏附培养物中在12小时后形成球状体;相比之下,krt14敲除细胞在12小时后仍保持很大程度的分散。然而,延长的孵育(48小时)导致形成具有可与对照比较的尺寸和形态学的球状体。相反,krt14
oe
系快速形成稠密和致密的球,并在12小时培养期后明显展示出原始球的可见生长晕形成。与未处理的对照相比,krt14
ko
球状体在体外具有显著降低的黏附至间皮单层的能力。
[0281]
实施例8
[0282]
krt14+细胞导致侵袭性伪足形成和间皮清除
[0283]
当接种到间皮单层上时,野生型hgsc球状体在24小时内表现出生长晕形成、间皮清除以及广泛的沉积和迁移。过表达k14的细胞使间皮层快速分散并移位;相比之下,krt14
ko
细胞未能破坏间皮单层。为了检查基质类型是否影响侵袭,将球状体(细胞系和腹水来源的hgsc细胞二者)包埋在matrigel或胶原
‑
i基质中,并监测随时间的侵袭性伪足生长晕形成。krt14+侵袭性伪足在胶原i基质中12小时后从野生型球状体中出现,但需要48
‑
72小时(取决于细胞类型)才能在matrigel中变得明显。免疫染色显示krt14+细胞特异性定位于侵袭性伪足,其中非侵袭性球状体核心细胞维持krt14
‑
表型。单层划痕测定确认了这一点,其中krt14+细胞特异性地定位在伤口闭合区域。与它们缺乏侵袭能力一致,krt14
ko
细胞未能在任一基质中形成可见的侵袭性伪足。总之,数据表明krt14表达是活跃侵袭的细胞的特征,并且它的损失显著阻碍了球状体在肿瘤生长晕形成期间播散和使间皮移位的能力。
[0284]
实施例9
[0285]
krt14与肿瘤分期相关,并且与预测卵巢癌患者的无进展生存负相关
[0286]
为了确定krt14表达的临床相关性,对包含多种组织学亚型、卵巢癌级别和分期以及正常卵巢和输卵管切片的组织微阵列(n=292)进行染色以获得krt14丰度和定位。krt14表达通常在正常卵巢(5%,1/20)或输卵管(0%,0/8)组织中检测不到,但在检查的所有卵巢癌亚型中普遍表达。染色定位于肿瘤上皮,在基质组织中几乎没有krt14的证据。特别地,在100%的hgsc组织中均检测到krt14,并且与正常卵巢相比,krt14显著升高(p=0.0362,具有tukeys事后的非配对t检验)。
[0287]
然后在15个公众可得的卵巢癌数据集(http://www.cbioportal.org/)[lanczky等人(2016)上文]中询问了krt14表达和患者预后之间的潜在关联。高krt14表达与降低的无进展生存(pfs)相关(hr 1.17;95%ci1.03
‑
1.33p<0.015),特别是对于诊断为早期(i
‑
ii期)疾病的患者而言是相关的(hr 1.96;95%ci 1.08
‑
3.56p<0.025)。高krt14表达也与基于铂类和紫杉醇的化学疗法后降低的pfs相关(hr 1.27;95%ci 1.07
‑
1.51p<0.006),并且是最优减积(debulk)后pfs的负预测物(hr 1.24;95%ci 1.03
‑
1.5p<0.026)。因此,具有krt14的浅缺失(shallow deletion)的患者对化学疗法更敏感,并表现出改善的对主要疗法的反应。因此,krt14表达是患有高级别浆液性卵巢癌的患者的预后的独立预测物。
[0288]
实施例10
[0289]
植入小鼠中
[0290]
在植入了krt14
ko
细胞的小鼠中,在尸检中没有可检测到肿瘤沉积物,或者甚至荧光肿瘤细胞,表明肿瘤不仅未能植入,而且随后在手术后被清除(图3)。使用完整细胞的流式细胞术和免疫细胞化学染色,观察到krt14的n末端暴露在细胞表面(图4)。与其他研究(papafotiou等人(2016)上文;rock等人(2009)上文)一致,krt14+细胞仅代表肿瘤细胞群
体的子集(图4a)。使用针对krt14的n
‑
末端或c
‑
末端的多克隆抗体,确认了针对n
‑
末端的抗体可以防止体外侵袭,模拟了krt14基因敲除的效果(图4b)。抗c
‑
末端抗体对侵袭没有影响,与充分确定的krt14的c
‑
末端区域的细胞内定位一致(图4b)。外源添加的全长的重组krt14蛋白可以竞争抗体结合,并恢复体外侵袭(图4b)。因此,侵袭能力的损失直接是由于krt14抗体的结合。此外,这种效果通过抗体与krt14的n
‑
末端结合来介导;并且n
‑
末端暴露在细胞的外侧,是抗体结合可接近的。
[0291]
实施例11
[0292]
抗原性和疏水性图
[0293]
抗原性和疏水性图用于以计算机检查krt14的前200个氨基酸(图5a)。预测了五个潜在的抗原区域,并且合成了包含这些区域的六种肽,用于进一步的竞争测定。肽#4和#5对n
‑
末端抗体的阻断在体外恢复了卵巢癌细胞的侵袭(图5b)和迁移(图5c)。尽管被使用的多克隆抗体识别,但肽1、肽2、肽3和肽6未能恢复完全的侵袭和/或迁移能力。基于抗体和肽竞争测定,krt14蛋白的表面暴露区域被定义在氨基序列nh2
‑
gfgggyggglgaglgggfgggfaggdgl(seq id no:1)内。该氨基酸序列已被用于免疫小鼠,用于在完整细胞中产生靶向krt14 n
‑
末端的单克隆抗体。
[0294]
实施例12
[0295]
用于krt14的抗血清
[0296]
功能测试用于评估由发明人针对包含特定krt14表位的蛋白片段产生的内部小鼠抗血清an
‑
17 o20023在体外阻断癌细胞侵袭的能力。
[0297]
实时侵袭测定使用xcelligence实时细胞分析(rtca)dp 6孔仪(acea biosciences)进行。卵巢癌细胞(skov3)通过在无血清培养基(sfm)中孵育而同步于go期,并接种(4x104个细胞/孔)在用matrigel基质(sfm中的1∶10;bd biosciences,san jose,ca)包被的cim
‑
16孔板的上室中。将包含10%v/v fbs的培养基作为化学引诱剂(chemoattractant)添加至下室。将来自小鼠an
‑
17 o20023(在sfm中稀释1∶100)的抗血清、对照血清或商购可得的针对krt14的多克隆抗体(sigma sab4501657;在sfm中1μg/ml)添加至上室,并且每15分钟获取侵袭测量,持续24小时。通过阿尔玛蓝染色评估测定完成时的细胞活力。所有测定以一式两份进行。针对包含特定krt14表位的蛋白片段产生抗血清an
‑
17 o20023。
[0298]
在未处理的和仅血清的对照孔中,接种5小时内观察到侵袭(图6a)。用商购可得的多克隆抗krt14(sigma sab4501657:其可以识别特定krt14表位)显示出对侵袭的抑制。抗血清an
‑
17o20023有效地阻断了体外侵袭,其效力与纯化的抗krt14多克隆抗体相似(图6a),展示出其对靶的有效识别。未经处理的细胞对比对照或抗血清处理的细胞之间在终点的活力没有显著差异(图6b),表明侵袭的缺乏不是由于增殖能力受损。
[0299]
抗血清an
‑
17o20023有效阻断卵巢癌细胞体外侵袭能力,其效力与商业购得的制剂相似。该效果不是由于细胞增殖受损,而是对侵袭有特异性,如先前观察到的。这种抗体适合于正进行的作为先导化合物被表征。
[0300]
实施例13
[0301]
对非卵巢癌细胞的影响
[0302]
抗krt14抗体用于测试其是否能防止来源于其他(非卵巢)实体瘤类型的癌细胞的
侵袭。
[0303]
使用an3ca子宫内膜癌和sw620结直肠癌细胞系进行体外伤口修复测定。细胞在完全培养基中在12孔板中生长至汇合,然后血清饥饿过夜以同步于g0。第二天,去除细胞培养基,并且用附着于吸管的移液管吸头刮擦使细胞单层受伤。非黏附细胞通过用pbs温和洗涤而去除。将细胞孵育在完全生长培养基+/
‑
单独的商业krt14抗体(1μg/ml)或与1μg/ml竞争肽的组合中。伤口区域在相差显微镜(leica)下以范围为0
‑
72小时的规律间隔进行成像。在图像系列中使用analysis ls research software(olympus)测量伤口闭合,以确定每天的伤口面积。实验以一式三份进行重复,其中每个生长条件下观察至少六个伤口区域,数据来自展示的16小时收集点。
[0304]
培养16小时后,在存在抗krt14抗体的情况下,子宫内膜癌和结直肠癌细胞系二者均显示出受损的伤口愈合(图7)。在存在竞争性krt14表位的情况下,伤口愈合能力恢复到未处理的对照中观察到的水平。
[0305]
抗krt14抗体抑制结直肠癌和子宫内膜癌细胞系的迁移行为,类似于卵巢癌细胞中观察到的抑制。如竞争测定证明的,抑制是确定的krt14表位特异的。数据表明,抗体介导的krt14抑制可能充当泛癌(pan
‑
cancer)机制来抑制多种实体瘤类型中的侵袭。
[0306]
实施例14
[0307]
抗体的跨物种作用
[0308]
评估了抗人类krt14抗体防止非人类卵巢癌细胞的侵袭的能力。
[0309]
所有实验均使用鼠id8卵巢癌细胞系进行。实时侵袭测定(按照实施例5)和体外伤口修复测定(按照实施例6)如所描述的进行。
[0310]
对人类krt14表位有特异性的抗krt14抗体在体外有效阻断了小鼠癌细胞的迁移(图8a)。肽竞争测定(如实施例6中描述的)恢复了这些细胞中的迁移能力(图8a),展示出对krt14表位的特异性。
[0311]
实时侵袭测定确认了抗krt14抗体在体外阻断了id8细胞的侵袭(图8b),其效力与在人类细胞系中观察到的类似。
[0312]
krt14的抗原表位展示出跨多个物种的高同源性(>80%)。因此,针对人类表位的抗体可以与非人类蛋白有效结合以抑制体外细胞迁移和侵袭。这些数据表明,抗krt14疗法将适用于跨物种。
[0313]
实施例15
[0314]
mab an
‑
17在体外与标准护理化学疗法协同作用
[0315]
进行了本研究以确定已被证明可损害迁移和侵袭(如本文其他地方所述)的单克隆抗体an
‑
17(mab an
‑
17)对细胞表面抗原krt14的靶向是否会使卵巢细胞对标准一线化学治疗剂顺铂敏感。
[0316]
实时细胞分析(rtca)如先前描述的(pmid:31443478;bilandzic等人,cancers(basel).2019;11(9),e1228)使用xcelligence rtca sp 96孔仪(aceabiosciences)进行。细胞系通过在无血清培养基中过夜孵育而同步于g0,并以0.5
×
103个细胞/0.15ml/孔接种。24小时后,添加单独的顺铂(1.25mg/ml)、单独的mab an
‑
17(1ug/ml)或顺铂加mab an
‑
17的组合。在实验持续期间,每15分钟获取阻抗读数。mab an
‑
17包含分别由seq id no:2和seq id no:4的核酸序列编码的seq id no:3的重链可变区和seq id no:5的轻链可变区(另参
见图21和图22)。
[0317]
以15μg/ml或20μg/ml顺铂处理细胞导致完全的细胞死亡,而1.25μg/ml的剂量是亚致死的,并且细胞继续增殖(图9)。如先前展示的,单独的mab an
‑
17对细胞活力或增殖没有影响。然而,在测试的每种剂量,与单独化学疗法相比,将细胞与mab an
‑
17和顺铂共同孵育显著降低了细胞活力和增殖(图9)。当顺铂以1.25μg/ml的亚致死剂量使用时,观察到最明显的效果;与mab an
‑
17共孵育导致在~50小时后完全的细胞死亡(图9),类似于单独的12倍高的顺铂剂量的效果。因此,mab an
‑
17发挥在体外使细胞对标准铂化学疗法的敏感性增加至少10倍的作用。
[0318]
实施例16
[0319]
mab an
‑
17对一组~10,000种抗原没有显示出可检测到的交叉反应性
[0320]
进行了以下实验以确定mab an
‑
17是否对一组蛋白质抗原显示出任何交叉反应性。
[0321]
使用包含以一式两份点样的9,184个个体重组人类蛋白的invitrogen
tm protoarray
tm
人类蛋白微阵列v5.0(thermofisher scientific,walthamma)对mab an
‑
17抗体反应性进行蛋白质组剖析。所有程序都如先前描述地(pmid:29141850;wilson等人cancer epidemiol biomarkers prev.2018;27(2):183
‑
192)进行。使用在洗涤缓冲液中1:500稀释的mab an
‑
17探测阵列。针对igg重链和轻链的荧光检测抗体来自abcam(#ab150119山羊抗小鼠igg h&l alexa647,预吸附的)在使用前在洗涤缓冲液中稀释至2mg/ml。与单独的检测抗体孵育的单个阵列用作非特异性抗体结合的对照。
[0322]
阵列成像使用fuji fla5100多波长扫描仪如描述的(pmid:29141850;wilson等人cancer epidemiol biomarkers prev.2018;27(2):183
‑
192)进行,使用635nm激发激光和双带通cy3/cy5滤波器。以10μm的分辨率获取图像,其中pmt设置在1000v。阵列对齐、特征提取和数据归一化如先前描述地(pmid:29141850;wilson等人cancer epidemiol biomarkers prev.2018;27(2):183
‑
192)进行。阵列坐标从制造商提供的可下载.gal文件(thermofisher scientific;http://www.lifetechnologies.com/au/en/home/life
‑
science/protein
‑
expression
‑
and
‑
analysis/biomarker
‑
discovery/protoarray/resources/lot
‑
specific
‑
information.html)中获得。
[0323]
图10中示出了个体阵列图像,所述图像示出抗原与mab an
‑
17或单独的二级抗体的反应性。对照和mab an
‑
17处理的阵列之间没有显著差异,表明mab an
‑
17不与所测试的阵列上存在的任何蛋白反应。
[0324]
这些数据展示出mab an
‑
17在体外对其靶抗原(krt14)的高特异性。mab an
‑
17不与阵列上存在的任何抗原、包括若干相关的角蛋白反应。因此,mab an
‑
17显示出对其靶抗原的高亲和力。
[0325]
实施例17
[0326]
mab an
‑
17通过蛋白印迹检测krt14
[0327]
全长的重组krt14蛋白(abcam#ab73637)的1μg等分试样通过sds page分离,并使用标准程序(pmid:23952987)转移至pvdf膜。用mab an
‑
17以1:1000、1:5000和1:10,000的稀释度探测膜。二级抗体是山羊抗小鼠hrp缀合物(1:50,000稀释),其中根据标准方案(pmid:23952987;rainczuk等人,j proteome res.2013;12(9):4074
‑
88)使用化学发光检
测krt14。
[0328]
使用mab an
‑
17作为一级抗体的蛋白印迹成功检测到全长krt14蛋白(图11)。多种稀释度给出了强信号。
[0329]
实施例18
[0330]
mab an
‑
17通过流式细胞术鉴定krt14+前导细胞和循环肿瘤细胞
[0331]
流式细胞术根据标准方案(pmid:30602661)进行,其中使用bd lsrfortessa x
‑
20(bd biosciences)获取数据,并使用flowjo软件v10.5.0(bd biosciences)进行分析。对krt14+细胞群体进行评估的样品包括ovcar3、caov4、id8小鼠卵巢癌细胞、来源于临床样本(指定的#3.1937
‑
07)的腹水来源的卵巢癌细胞和来自荷有12周龄上皮卵巢肿瘤的小鼠的心脏血液。对于细胞系,将1x106个细胞/细胞系与mab an
‑
17(1:200稀释)或作为阳性对照的商购可得的抗krt14多克隆抗体(sigma sab4501657;1:50稀释)在非免疫血清中在室温孵育45min。二级抗体山羊抗小鼠alexa647(mab an
‑
17)或山羊抗兔igg alexa 488(商业ab)1:500稀释并孵育30分钟。对于血液样品,将2x106个细胞与alexa488缀合的mab an
‑
17抗体孵育45分钟。pbs洗涤后,将细胞重悬于pbs/2%fbs中,使用bd lsrfortessa x
‑
20(bd biosciences)流式细胞仪获取数据。
[0332]
通过流式细胞术检测表达krt14的细胞,其中在细胞系(人类
‑
ovcar4,caov4;小鼠
‑
id8)和临床获得的卵巢癌细胞(3:19367
‑
03)中,使用mab an
‑
17进行的检测与商购可得的多克隆抗体sigma sab4501657相比是相似的(图12)。
[0333]
细胞外krt14的表达也标记循环肿瘤细胞(ctc)群体。使用先前在pmid:30602661(wilson等人cancers(basel).2018;11(1),e32)中描述的小鼠卵巢癌模型,ctc专性表达近红外荧光团irfp720。使用mab an
‑
17探测来自患有卵巢癌的小鼠的全血,并通过流式细胞术分析krt14+irfp+细胞。mab an
‑
17能够从全血中正确鉴定出irfp+细胞,展示出其鉴定和捕获ctc的效用。
[0334]
mab an
‑
17通过流式细胞术鉴定krt14+细胞,其灵敏度与商购可得的抗krt14多克隆抗体(sigma sab4501657)相当。此外,mab an
‑
17能够通过流式细胞术从荷有id8 irfp720+上皮卵巢肿瘤的小鼠中检测和分离krt14+ctc。因此,抗krt14结合剂,诸如mab an
‑
17,具有用于诊断和/或预后测试的潜力,包括捕获和分析ctc的潜力。数据也表明,抗krt14结合剂,诸如mab an
‑
17,可用于体内治疗性靶向这些细胞。
[0335]
实施例19
[0336]
mab an
‑
17通过免疫荧光染色检测krt14+细胞
[0337]
将卵巢癌细胞系skov
‑
3、ovcar4和cov362.3接种到96孔黑色荧光成像板上。使用mab an
‑
17对完整的或固定(1%多聚甲醛;pfa)并透化的(0.1%triton x)细胞进行染色。对于固定的细胞,将样品在10%胎牛血清(fbs)中封闭,并且然后用1μg/ml mab an
‑
17在室温染色1小时。随后用pbs洗涤细胞,并用1:2000的alexa
‑
647山羊抗小鼠二级抗体在室温染色1小时。对于完整的细胞,将样品用在含1%fbs的pbs中的1μg/ml与alexa
‑
647缀合的mab an
‑
17于37℃染色2小时,用新鲜的pbs/1%fbs替换培养基,并且立即对细胞成像。使用cytation 3多模式读取仪以4x放大对样品进行成像。
[0338]
在透化的卵巢癌细胞系样品中观察到mab an
‑
17的特异性细胞内胞质定位(图
ex740,em790nm)。光谱解混合和图像分析如先前描述地(pmid:30602661;wilson等人,cancers(basel).2018dec 31;11(1),e32)进行。在每种情况下,从荧光测量值中减去来自媒介物处理的动物的背景平均辐射效率,并绘制所得数据用于比较。
[0353]
在施用0.5mg/kg的单剂量后,将经7天时间段的mab an
‑
17在健康组织(使用无卵巢肿瘤的小鼠)中的定位与非靶向的同种型对照抗体进行比较。在每种情况下,抗体都经荧光标记以便于死后检测。在肠、生殖器官、肝脏、肾、脾、肺和心脏中观察到抗体相关的荧光;在脑中没有检测到荧光(图16)。然而,在mab an
‑
17和同种型对照igg
k
抗体之间没有显著差异,展示出mab an
‑
17没有在所检查的任何健康组织中特异性积累。此外,到第7天,每种抗体已经基本从所有器官中清除(如通过荧光信号的损失来判断的),表明mab an
‑
17不会长期保留(图16)。
[0354]
由于在低剂量时抗体清除看起来在第7天完成,以类似的方式在多个递增剂量(0.5mg/kg至10mg/kg)评价mab an
‑
17从健康组织的清除。甚至在最高剂量(10mg/kg)时,mab an
‑
17在7天后几乎在所有器官中都检测不到,并且通常以低于对照抗体的水平存在(图17)。这些数据表明,mab an
‑
17不表现出在健康组织中的非选择性积累或保留。
[0355]
然后使用5mg/kg和10mg/kg的单剂量评价mab an
‑
17在患有原发性卵巢肿瘤的小鼠中的分布。进行经7天的时间段的评价。在施用后24小时时,mab an
‑
17强烈地定位于肿瘤组织(图18)。与健康组织不同,mab an
‑
17在肿瘤组织中持续存在,并且甚至在7天后仍可检测到(图18)。最初在接受10mg/kg剂量的小鼠中观察到较高的荧光产量;然而,到注射后第3天,无论剂量如何,都检测到类似水平的mab an
‑
17,表明肿瘤可能在5mg/kg剂量时已经饱和。此外,肿瘤组织中的mab an
‑
17检测的初始水平比在没有肿瘤的小鼠的生殖道中检测到的mab an
‑
17的初始水平高2个数量级(比较图18:图a、b、c)。
[0356]
这些数据显示出,mab an
‑
17对肿瘤组织具有特异性,并在施用后在肿瘤部位持续存在至少1周。
[0357]
本文呈现的数据展示出,mab an
‑
17对其靶(krt14)具有高特异性、最小的脱靶效应和在非靶组织中的低保留。在健康的非荷瘤小鼠中,mab an
‑
17没有显示出在健康器官中的任何特异性保留,并且看起来被快速清除。相比之下,mab an
‑
17被特异性地检测到与卵巢肿瘤相关,其在卵巢肿瘤中持续存在至少1周。在任何剂量或任何时间点都没有注意到毒性,表明mab an
‑
17的高特异性赋予在注射时有利的安全性谱。此外,没有达到最大耐受剂量。因此,mab an
‑
17具有良好的安全性谱和对肿瘤组织的高体内特异性。
[0358]
实施例23
[0359]
mab an
‑
17处理在体内成功地使已建立的卵巢肿瘤消退
[0360]
这些实验的目的是确定mab an
‑
17是否可用于影响在同基因小鼠模型中已建立的原发性恶性肿瘤模型中的肿瘤进展。
[0361]
将鼠id8卵巢肿瘤细胞囊内植入到c57bl/6小鼠中,并且允许原发性肿瘤发展经~4周的时间段,如先前描述的(pmid:30602661)。患有原发性肿瘤的小鼠(n=10/组)接受每周两次通过腹腔注射的5mg/kg的mab an
‑
17,持续3周的时间段。对照动物接受等剂量的同种型匹配的对照iggκ抗体(对照组1);或/和等体积的单独的媒介物(pbs)(对照组2)。在3周的每周两次处理(周一和周四)后,将所有小鼠屠宰并评估肿瘤尺寸和重量。另外两只非荷瘤动物用作非外科手术对照。
[0362]
mab an
‑
17的每周两次施用对动物没有可观察到的不良影响,如先前由单剂量实验指示的(上文)。在3周的持续处理后,将所有小鼠屠宰,并且评估mab an
‑
17施用对肿瘤尺寸的影响。在用单独的媒介物处理的小鼠(对照组2)中,6/10动物(60%)患有原发性卵巢肿瘤(图19);类似地,用同种型对照抗体处理的小鼠(对照组1)的6/10动物(60%)也患有原发性肿瘤,展示出非靶向的抗体对肿瘤进展没有影响。
[0363]
当分析接受mab an
‑
17的小鼠时,不能在动物中的右侧卵巢(植入部位)中或右侧卵巢上或其他任何部位鉴定出肿瘤(图19)。此外,从这些小鼠提取的卵巢看起来健康,并且与未处理的非外科手术对照没有可观察到的形态学差异。
[0364]
用mab an
‑
17处理小鼠导致已建立的原发性卵巢肿瘤在3周后完全消退至不可检测到的水平。在处理时间段期间没有注意到不良反应,表明mab an
‑
17的施用是治疗体内已建立的实体瘤的一种安全且高度有效的治疗方法。
[0365]
实施例24
[0366]
mab an
‑
17阻断多种癌细胞中的迁移和侵袭
[0367]
上文概述的实验展示出在卵巢癌、结直肠癌和子宫内膜癌细胞系中mab an
‑
17对细胞迁移和侵袭的抗体特异性抑制。进行以下实验以研究mab an
‑
17对其他癌细胞类型的迁移和侵袭的影响。
[0368]
对以下癌细胞系进行体外伤口修复测定:bt16非典型畸胎样横纹肌样(脑)癌、nci
‑
h1573肺腺癌、sj
‑
gbm2原发性多形性胶质母细胞瘤、an3ca子宫内膜癌、sw620结直肠癌和mda
‑
mb
‑
468乳腺癌。细胞在完全培养基中在12孔板中生长至汇合,并且随后血清饥饿过夜以同步于g0。第二天,去除细胞培养基,并通过用附着于吸管的移液管吸头刮擦使细胞单层受伤。在不存在或存在mab an
‑
17(在1μg/ml)的情况下,通过用磷酸盐缓冲盐水(pbs)温和洗涤去除非黏附细胞,并将完全生长培养基添加至每个孔。每小时对伤口区域进行成像,持续0
‑
24小时。在图像系列中使用analysis ls research software(olympus)测量伤口闭合,以确定每天的伤口面积。实验以一式三份进行重复,其中每个生长条件下观察至少六个伤口区域。
[0369]
如图23中所示,当使用体外伤口修复测定进行攻击(challenged)时,未处理的细胞能够迁移并在16小时后使伤口闭合。相比之下,在相同条件下,用mab an
‑
17处理的所有细胞系都未能使伤口闭合。这些数据展示出,mab an
‑
17抑制癌细胞的细胞迁移和侵袭,与先前在结直肠癌、子宫内膜癌和多种卵巢癌细胞系中显示的类似效果相称。
[0370]
这些数据显示出,krt14的拮抗剂抑制多种癌细胞类型的迁移行为,包括至少卵巢癌、子宫内膜癌、脑癌、肺癌、乳腺癌细胞的迁移行为。这些癌症类型的不同性质表明krt14的拮抗剂,诸如mab an
‑
17,靶向癌细胞中高度保守的途径,并且因此适用于多种肿瘤类型的诊断、预后和治疗。
[0371]
本领域技术人员将理解,除了具体描述的那些,本文描述的公开内容易于进行变化和修改。应理解,本公开内容考虑了所有这样的变化和修改。
[0372]
本公开内容还实现了本说明书中单独地或共同地提到的或指出的所有步骤、特征、组合物和化合物,以及步骤或特征或组合物或化合物的任何两个或更多个的任何和所有组合。
[0373]
参考书目:
[0374]
altschul et al.(1997)nucl.acids.res.25:3389
[0375]
ausubel et al.(1994
‑
1998)in:current protocols in molecular biology,john wiley&sons inc.
[0376]
bilandzic et al.(2009)mol endocrinol,23(4):539
‑
48
[0377]
bilandzic et al.(2013)mol endocrinol,2013.27(3):466
‑
79
[0378]
bilandzic et al.(2014)cancer lett 354(1):107
‑
114
[0379]
bilandzic and stenvers(2014)j vis exp 87
[0380]
burleson et al.(2006)j transl med 4:6
[0381]
cheah et al.(2015)proc natl acad sci usa 112(15):4725
‑
4730
[0382]
cheung et al.(2013)cell 155(7):1639
‑
1651
[0383]
cheung et al.(2016)proc natl acad sci usa 113(7):e854
‑
863
[0384]
chothia et al.(1987)j.mol.biol.196:901
[0385]
chothia et al.(1989)nature 342:877
‑
883
[0386]
chu et al.(2001)histopathology 39(1):9
‑
16
[0387]
coligan et al.current protocols in immunology,1991
‑
1997
[0388]
cong et al.(2013)science 339(6121):819
‑
23
[0389]
domcke et al.(2013)nat comnun 4:2126
[0390]
ewert et al.(2002)biochemistry 41:3628
‑
2636
[0391]
greenberg et al.(1995)nature 374:168
‑
173
[0392]
gefter et al.(1977)somatic cell genet.3:231
‑
236
[0393]
ho et al.(2012)nat rev urol 9(10):583
‑
594
[0394]
iwanicki et al.(2011)cancer discov 1(2):144
‑
157
[0395]
jones et al.(1986)nature 321:522
‑
525
[0396]
kenny et al.(20017)ini j cancer 121(7):1463
‑
72
[0397]
kim et al.(2014)obstet gynecol sci.57(5):343
‑
57
[0398]
kohler et al.(1975)nature 256:495
‑
499
[0399]
kohler et al.(1976)eur.j.immunol.6(7):511
‑
519
[0400]
kozbor et al.(1986)methods in enzymology 121:140
[0401]
lanczky et al.(2016)breast cancer res treat.3(160):439
‑
446
[0402]
latifi et al.(2012)plos one 7(10)
[0403]
liu et al.(1987)proc.natl.acad.sci.usa 84:3439
‑
3443
[0404]
liu et al.(2013)clin cancer res 19(18):5053
‑
67
[0405]
nguyen
‑
ngoc et al.(2012)proc natl acad sci u s a.109(39):e2595
‑
604
[0406]
nuttall et al.(2001)mol immuunol 38:313
‑
326
[0407]
nuttall et al.(2002)febs lett 516:80
‑
86
[0408]
nuttall et al.(2003)eur j biochem 270:3543
‑
3554
[0409]
nuttall et al.(2004)proteins 55:187
‑
197
[0410]
padlan(1994)mol immunol 31:169
‑
217
[0411]
papafotiou et al.(2016)nat commun 7:11914
[0412]
paraskevopoulou et al.(2016)cell cycle 15(23):3161
‑
3162
[0413]
rainczuk et al.(2013)j proteome res
[0414]
rainczuk et al.(2014)int j cancer 134(3):530
‑
41
[0415]
richmann et al.(1988)nature 332:323
‑
327
[0416]
richards(2013)isrn inflammation 2013:23
[0417]
roby et al.(2000)carcinogenesis 21(4):585
‑
591
[0418]
rock et al.(2009)proc natl acad sci usa 106(31):12771
‑
12775
[0419]
roux et al.(1998)proc natl acad sci usa 95:11804
‑
11809
[0420]
salamonsen et al.(2013)fertil steril 99(4):1086
‑
92
[0421]
shulman et al.(1978)nature 276:269
‑
270
[0422]
sodek et al.(2012)cancer metastasis rev 31(1
‑
2):397
‑
414
[0423]
stanfield et al.(2004)science 305:1770
‑
1773
[0424]
streltsov et al.(2004)proc natl acad sci usa 101:12444
‑
12449
[0425]
streltsov et al(2005)protein sci 14:2901
‑
2909
[0426]
toyama et al.(1987)monoclonal antibody,experiment manual,published by kodansha scientific)
[0427]
trowbridge(1982)j.exp.med.148(1):220
‑
227
[0428]
verhoeyen et al.(1988)science 239:1534
‑
1536
[0429]
vesci et al.(2014)int j oncol 45(4):1421
‑9[0430]
volk et al.(1982)j.virol.42(1):220
‑
227
[0431]
volkmer et al.(2012)proc natl acad sci usa 109(6):2078
‑
2083。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1