人源化抗DLL3嵌合抗原受体及其用途的制作方法
人源化抗dll3嵌合抗原受体及其用途
1.相关申请的交叉引用
2.本技术要求于2019年10月31日提交的美国临时申请号62/928,615;2019年9月6日提交的美国临时申请号62/896,790;2019年6月14日提交的美国临时申请号62/861,377;以及2019年4月8日提交的美国临时申请号62/830,598的优先权。各公开内容均通过引用整体并入本文。
发明领域
3.本发明涉及抗dll3嵌合抗原受体(car)、编码car的核酸和表达载体、工程化表达car的t细胞(car
‑
t)和工程化表达car的nk细胞(car
‑
nk)。还提供了car制备方法、car
‑
t/car
‑
nk制备方法以及使用car
‑
t/car
‑
nk治疗与dll3表达相关疾病(包括癌症)的方法。
4.电子提交的序列表的引用
5.该申请包含序列表,该序列表是通过efs
‑
web以ascii格式的序列表电子提交,文件名为“065799.20wo1序列表”,创建日期为2020年3月12日,大小为215kb。通过efs
‑
web提交的序列表是说明书的一部分,并通过引用整体并入本文。
6.发明背景
7.抗癌药物的标准治疗提供了显著获益。最近,免疫肿瘤药物如抗pd
‑
1单抗、抗pd
‑
l1单抗和抗cd3双特异性t细胞衔接器的出现,推动了利用和激活患者免疫系统对抗各种类型癌症的概念。然而,反应不佳、疗效不足和/或安全性问题仍有待解决。car
‑
t(嵌合抗原受体
‑
t)细胞疗法涉及对患者自身的免疫细胞(如t细胞)进行基因工程改造,并将其重新定向到癌细胞上合适的细胞表面抗原(mayor等人,immunotherapy 2016;8:491
‑
494)。该方法已被证明在化疗难治性b细胞恶性肿瘤和其他癌症的患者中取得了成功(pettitt等人,mol ther.2018;26:342
‑
353)。可对t细胞进行改造,使其对一种或多种癌细胞表面靶标/抗原具有特异性,以识别并杀死癌细胞。该过程包括用dna或其他编码嵌合抗原受体(car)的遗传物质转导t细胞,该嵌合抗原受体包括胞外抗原特异性结合域,例如单克隆抗体的一个或多个单链可变片段(scfv)、铰链和跨膜区,以及胞内信号域(包括一个或多个共刺激结构域和一个或多个激活结构域)(kochenderfer等人,nat rev clin oncol.2013;10:267
‑
276)。表达car的免疫细胞,如t细胞和nk细胞,可用于治疗各种疾病,包括粘液瘤和实体瘤。成功的car
‑
t细胞疗法可特异性识别和破坏靶细胞,并维持长期存活和增殖的能力。
8.典型notch配体δ样3(dll3),也称为δ样3或δ样蛋白3,是早期发育期间体节划分所必需的(dunwoodie等人,development 2002;129:1795
‑
806)。与哺乳动物中均反式激活notch受体信号的notch家族配体dll1、dll4、jag1和jag2不同(ntziachristos等人,cancer cell 2014;25(3):318
‑
34),dll3主要定位于高尔基体,不能激活notch信号(chapman等人,hum mol genet 2011;20(5):905
‑
16和geffers等人,j cell biol 2007;178(3):465
‑
76)。在正常发育过程中,dll3通过与notch和dll1相互作用,抑制顺式和反式作用的notch通路激活(chapman等人,hum mol genet 2011;20(5):905
‑
16)。dll3在成人正常组织(脑除外)中通常不存在或以极低水平存在,但在肺癌、睾丸癌、胶质瘤和黑色素瘤样本中过表达
(uhlen等人,science 2017;357(6352):eaan2507)。此外,在小细胞肺癌(sclc)和大细胞神经内分泌癌(lcnec)肿瘤细胞表面可检测到dll3(saunders等人,sci transl med 2015;7(302):302ra136和sharma等人,cancer res.2017;77(14):3931
‑
41),使其成为单克隆抗体治疗癌症的潜在靶点。因此,dll3是car
‑
t细胞疗法治疗和治愈dll3阳性癌症的理想靶标。
9.发明简述
10.在整体方面,本发明涉及诱导t细胞介导癌症杀伤的嵌合抗原受体(car)构建体,其中car构建体包括至少一个特异性结合dll3的抗原结合域、铰链区、跨膜区和胞内信号域。
11.提供了包含编码嵌合抗原受体(car)的核酸序列组成的分离多核苷酸。car可包括(a)包含至少一个特异性结合dll3的抗原结合域的胞外域;(b)铰链区;(c)跨膜区;和(d)胞内信号域。
12.在某些实施方式中,所述的抗原结合域包括重链互补决定区1(hcdr1)、hcdr2、hcdr3、轻链互补决定区1(lcdr1)、lcdr2和lcdr3,其多肽序列为:
13.(1)分别为seq id no:25、26、27、61、62和63;
14.(2)分别为seq id no:28、29、30、64、65和66;
15.(3)分别为seq id no:31、32、33、67、68和69;
16.(4)分别为seq id no:34、35、36、70、71和72;
17.(5)分别为seq id no:37、38、39、73、74和75;
18.(6)分别为seq id no:40、41、42、76、77和78;
19.(7)分别为seq id no:43、44、45、79、80和81;
20.(8)分别为seq id no:46、47、48、82、83和84;
21.(9)分别为seq id no:49、50、51、85、86和87;
22.(10)分别为seq id no:52、53、54、88、89和90;
23.(11)分别为seq id no:55、56、57、91、92和93;或
24.(12)分别为seq id no:58、59、60、94、95和96;
25.其中,所述抗原结合域特异性结合dll3,优选人dll3。
26.在某些实施方式中,所述的抗原结合域包括重链互补决定区1(hcdr1)、hcdr2、hcdr3、轻链互补决定区1(lcdr1)、lcdr2和lcdr3,其多肽序列为:
27.(1)分别为seq id no:97、98、99、133、134和135;
28.(2)分别为seq id no:100、101、102、136、137和138;
29.(3)分别为seq id no:103、104、105、139、140和141;
30.(4)分别为seq id no:106、107、108、142、143和144;
31.(5)分别为seq id no:109、110、111、145、146和147;
32.(6)分别为seq id no:112、113、114、148、149和150;
33.(7)分别为seq id no:115、116、117、151、152和153;
34.(8)分别为seq id no:118、119、120、154、155和156;
35.(9)分别为seq id no:121、122、123、157、158和159;
36.(10)分别为seq id no:124、125、126、160、161和162;
37.(11)分别为seq id no:127、128、129、163、164和165;或
38.(12)分别为seq id no:130、131、132、166、167和168;
39.其中,所述抗原结合域特异性结合dll3,优选人dll3。
40.在某些实施方式中,所述的抗原结合域包含重链可变区,其中所述重链可变区的多肽序列与seq id no.:1、3、5、7、9、11、13、15、17、19、21或23有至少95%、至少96%、至少97%、至少98%,或至少99%相同;或包含轻链可变区,其中所述轻链可变区的多肽序列与seq id no.:2、4、6、8、10、12、14、16、18、20、22或24有至少95%、至少96%、至少97%、至少98%,或至少99%相同。
41.在某些实施方式中,所述的抗原结合域包括:
42.(1)具有seq id no:1多肽序列的重链可变区和具有seq id no:2多肽序列的轻链可变区;
43.(2)具有seq id no:3多肽序列的重链可变区和具有seq id no:4多肽序列的轻链可变区;
44.(3)具有seq id no:5多肽序列的重链可变区和具有seq id no:6多肽序列的轻链可变区;
45.(4)具有seq id no:7多肽序列的重链可变区和具有seq id no:8多肽序列的轻链可变区;
46.(5)具有seq id no:9多肽序列的重链可变区和具有seq id no:10多肽序列的轻链可变区;
47.(6)具有seq id no:11多肽序列的重链可变区和具有seq id no:12多肽序列的轻链可变区;
48.(7)具有seq id no:13多肽序列的重链可变区和具有seq id no:14多肽序列的轻链可变区;
49.(8)具有seq id no:15多肽序列的重链可变区和具有seq id no:16多肽序列的轻链可变区;
50.(9)具有seq id no:17多肽序列的重链可变区和具有seq id no:18多肽序列的轻链可变区;
51.(10)具有seq id no:19多肽序列的重链可变区和具有seq id no:20多肽序列的轻链可变区;
52.(11)具有seq id no:21多肽序列的重链可变区和具有seq id no:22多肽序列的轻链可变区;或
53.(12)具有seq id no:23多肽序列的重链可变区和具有seq id no:24多肽序列的轻链可变区。
54.在某些实施方式中,所述的抗原结合域是人源化的,包含重链可变区,其中所述重链可变区的多肽序列与seq id no:170、175
‑
209或248
‑
255中任一种有至少95%、至少96%、至少97%、至少98%,或至少99%相同;或包含轻链可变区,其中所述轻链可变区的多肽序列与seq id no:171
‑
174、210
‑
240或256
‑
264中任一种有至少95%、至少96%、至少97%、至少98%,或至少99%相同。
55.在某些实施方式中,所述的抗原结合域是人源化的,包括:
56.(1)具有seq id no:170多肽序列的重链可变区和具有seq id no:171多肽序列的
轻链可变区;
57.(2)具有seq id no:170多肽序列的重链可变区和具有seq id no:172多肽序列的轻链可变区;
58.(3)具有seq id no:170多肽序列的重链可变区和具有seq id no:173多肽序列的轻链可变区。
59.(4)具有seq id no:183多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
60.(5)具有seq id no:183多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
61.(6)具有seq id no:184多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
62.(7)具有seq id no:184多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
63.(8)具有seq id no:198多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
64.(9)具有seq id no:200多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
65.(10)具有seq id no:198多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
66.(11)具有seq id no:200多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
67.(12)具有seq id no:201多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
68.(13)具有seq id no:201多肽序列的重链可变区和具有seq id no:230多肽序列的轻链可变区;
69.(14)具有seq id no:201多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
70.(15)具有seq id no:175多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
71.(16)具有seq id no:175多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
72.(17)具有seq id no:175多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
73.(18)具有seq id no:176多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
74.(19)具有seq id no:176多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
75.(20)具有seq id no:176多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
76.(21)具有seq id no:177多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
77.(22)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
78.(23)具有seq id no:178多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
79.(24)具有seq id no:178多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
80.(25)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
81.(26)具有seq id no:177多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
82.(27)具有seq id no:178多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
83.(28)具有seq id no:179多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
84.(29)具有seq id no:179多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
85.(30)具有seq id no:179多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
86.(31)具有seq id no:180多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
87.(32)具有seq id no:180多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
88.(33)具有seq id no:180多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
89.(34)具有seq id no:181多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
90.(35)具有seq id no:181多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
91.(36)具有seq id no:182多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
92.(37)具有seq id no:202多肽序列的重链可变区和具有seq id no:232多肽序列的轻链可变区;
93.(38)具有seq id no:202多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
94.(39)具有seq id no:202多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
95.(40)具有seq id no:203多肽序列的重链可变区和具有seq id no:232多肽序列
的轻链可变区;
96.(41)具有seq id no:203多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
97.(42)具有seq id no:203多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
98.(43)具有seq id no:204多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
99.(44)具有seq id no:208多肽序列的重链可变区和具有seq id no:239多肽序列的轻链可变区;
100.(45)具有seq id no:208多肽序列的重链可变区和具有seq id no:240多肽序列的轻链可变区;
101.(46)具有seq id no:253多肽序列的重链可变区和具有seq id no:261多肽序列的轻链可变区;或
102.(47)具有seq id no:255多肽序列的重链可变区和具有seq id no:263多肽序列的轻链可变区。
103.在某些实施方式中,所述的抗原结合域是特异性结合dll3,优选人dll3的单链可变片段(scfv)。
104.在某些实施方式中,所述的抗原结合域是特异性结合dll3,优选人dll3的人源化单链可变片段(scfv)。
105.在某些实施方式中,所述的单链可变片段(scfv)包含与seq id no:241
‑
247或265
‑
286中任一种有至少95相同%的多肽序列。
106.在某些实施方式中,所述的嵌合抗原受体(car)包含一个或多个抗原结合域。
107.在某些实施方式中,所述的胞内信号域包含一个或多个共刺激结构域以及一个或多个激活结构域。
108.还提供了由本发明的分离多核苷酸编码的嵌合抗原受体(car)。
109.还提供了包含分离多核苷酸的载体,所述分离多核苷酸包含编码本发明car的核酸。
110.还提供了包含本发明的载体的宿主细胞。
111.在某些实施方式中,所述宿主细胞是t细胞,优选人t细胞。在某些实施方式中,所述宿主细胞是nk细胞,优选人nk细胞。例如,t细胞或nk细胞可被工程化表达本发明的car以治疗诸如癌症之类的疾病。
112.还提供了制备表达本发明的嵌合抗原受体(car)的宿主细胞的方法。所述方法包括用包含编码本发明car的分离核酸的载体转导t细胞或nk细胞。
113.还提供了生产本发明的car
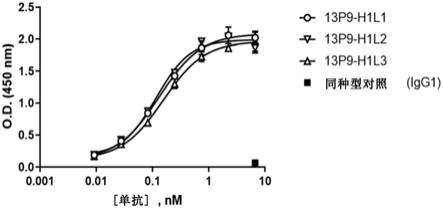
‑
t细胞或car
‑
nk细胞的方法。所述方法包括在生产car
‑
t细胞或car
‑
nk细胞的条件下,培养包含分离多核苷酸的t细胞或nk细胞,其中所述分离多核苷酸包含编码本发明的嵌合抗原受体(car)的核酸,并回收所述car
‑
t细胞或car
‑
nk细胞。
114.还提供了生产包含本发明嵌合抗原受体(car)的rna工程细胞群的方法。所述方法包括将细胞与包含编码本发明嵌合抗原受体(car)的核酸的分离多核苷酸接触,其中所述
分离多核苷酸为体外转录的rna或合成rna。
115.还提供了在需要的受试者中治疗癌症的方法,包括给予受试者本发明的car
‑
t细胞和/或car
‑
nk细胞。所述癌症可以是任何液体瘤或实体瘤,例如,所述癌症可选自(但不限于):肺癌(如小细胞肺癌(sclc))、大细胞神经内分泌癌(lcnec)、胃癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、胶质瘤、胶质母细胞瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性粒细胞白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他液体瘤。还提供了在有需要的受试者中治疗癌症的方法,包括给予受试者本发明的药物组合物。
116.在某些实施方式中,在有需要的受试者中治疗癌症的方法还包括给予需要的受试者能增加表达car分子的细胞效力的药物。
117.在某些实施方式中,在有需要的受试者中治疗癌症的方法还包括给予需要的受试者能改善与施用表达car分子的细胞相关的一种或多种副作用的药物。
118.在某些实施方式中,在有需要的受试者中治疗癌症的方法还包括给予需要的受试者治疗dll3相关疾病的药物。
119.还提供了人源化抗dll3单克隆抗体或其抗原结合片段,所述的抗体或其抗原结合片段包含重链可变区,其中所述重链可变区的多肽序列与seq id no:170、175
‑
209或248
‑
255中任一种有至少95%相同;或包含轻链可变区,其中所述轻链可变区的多肽序列与seq id no:171
‑
174、210
‑
240或256
‑
264中任一种有至少95%相同。
120.在某些实施方式中,所述的人源化抗dll3单克隆抗体或其抗原结合片段包括:
121.(1)具有seq id no:170多肽序列的重链可变区和具有seq id no:171多肽序列的轻链可变区;
122.(2)具有seq id no:170多肽序列的重链可变区和具有seq id no:172多肽序列的轻链可变区;
123.(3)具有seq id no:170多肽序列的重链可变区和具有seq id no:173多肽序列的轻链可变区。
124.(4)具有seq id no:183多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
125.(5)具有seq id no:183多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
126.(6)具有seq id no:184多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
127.(7)具有seq id no:184多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
128.(8)具有seq id no:198多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
129.(9)具有seq id no:200多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
130.(10)具有seq id no:198多肽序列的重链可变区和具有seq id no:231多肽序列
的轻链可变区;
131.(11)具有seq id no:200多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
132.(12)具有seq id no:201多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
133.(13)具有seq id no:201多肽序列的重链可变区和具有seq id no:230多肽序列的轻链可变区;
134.(14)具有seq id no:201多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
135.(15)具有seq id no:175多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
136.(16)具有seq id no:175多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
137.(17)具有seq id no:175多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
138.(18)具有seq id no:176多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
139.(19)具有seq id no:176多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
140.(20)具有seq id no:176多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
141.(21)具有seq id no:177多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
142.(22)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
143.(23)具有seq id no:178多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
144.(24)具有seq id no:178多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
145.(25)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
146.(26)具有seq id no:177多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
147.(27)具有seq id no:178多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
148.(28)具有seq id no:179多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
149.(29)具有seq id no:179多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
150.(30)具有seq id no:179多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
151.(31)具有seq id no:180多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
152.(32)具有seq id no:180多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
153.(33)具有seq id no:180多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
154.(34)具有seq id no:181多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
155.(35)具有seq id no:181多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
156.(36)具有seq id no:182多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
157.(37)具有seq id no:202多肽序列的重链可变区和具有seq id no:232多肽序列的轻链可变区;
158.(38)具有seq id no:202多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
159.(39)具有seq id no:202多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
160.(40)具有seq id no:203多肽序列的重链可变区和具有seq id no:232多肽序列的轻链可变区;
161.(41)具有seq id no:203多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
162.(42)具有seq id no:203多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
163.(43)具有seq id no:204多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
164.(44)具有seq id no:208多肽序列的重链可变区和具有seq id no:239多肽序列的轻链可变区;
165.(45)具有seq id no:208多肽序列的重链可变区和具有seq id no:240多肽序列的轻链可变区;
166.(46)具有seq id no:253多肽序列的重链可变区和具有seq id no:261多肽序列的轻链可变区;或
167.(47)具有seq id no:255多肽序列的重链可变区和具有seq id no:263多肽序列的轻链可变区。
168.在某些实施方式中,所述的人源化抗dll3单克隆抗体或其抗原结合片段能够诱导效应物介导的肿瘤细胞裂解,介导偶联药物的募集,和/或与另一种具有癌症杀伤作用的单克隆抗体或其抗原结合片段形成双特异性抗体。
169.还提供了编码本发明的人源化抗dll3单克隆抗体或其抗原结合片段的分离核酸。
170.还提供了包含编码本发明的人源化抗dll3单克隆抗体或其抗原结合片段的分离核酸的载体。
171.还提供了包含载体的宿主细胞,其中所述的载体包含编码本发明的人源化抗dll3单克隆抗体或其抗原结合片段的分离核酸。
172.还提供了包含本发明的人源化抗dll3单克隆抗体或其抗原结合片段以及药学上可接受的载体的药物组合物。
173.还提供了在需要的受试者中靶向癌细胞表面dll3的方法,包括向需要的受试者给予包含本发明的人源化抗dll3单克隆抗体或其抗原结合片段的药物组合物。
174.还提供了在有需要的受试者中治疗癌症的方法,包括给予受试者包含本发明的人源化抗dll3单克隆抗体或其抗原结合片段的药物组合物。所述癌症可以是任何液体瘤或实体瘤,例如,所述癌症可选自(但不限于):肺癌(如小细胞肺癌(sclc))、大细胞神经内分泌癌(lcnec)、胃癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、胶质瘤、胶质母细胞瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性粒细胞白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他液体瘤。
175.还提供了生产本发明的人源化抗dll3单克隆抗体或其抗原结合片段的方法,包括在生产单克隆抗体或其抗原结合片段的条件下,培养含有编码该单克隆抗体或其抗原结合片段的核酸的细胞,并从细胞或培养物中回收该抗体或其抗原结合片段。
176.还提供了生产包含本发明的人源化抗dll3单克隆抗体或其抗原结合片段的药物组合物的方法,包括混合单克隆抗体或其抗原结合片段与药学上可接受的载体以获得药物组合物。
177.附图简述
178.当结合附图阅读时,将更好地理解上述概要以及后文本技术优选实施例的详细描述。然而,应当理解,本技术不限于附图中所示的精确实施例。
179.图1a
‑
1q显示了人源化单抗在elisa试验中与固定化的重组人dll3的结合。
180.图2a
‑
2i显示了单链可变片段(scfv)在elisa试验中与固定化的重组人dll3蛋白的结合。
181.图3a
‑
3f显示了scfv与稳定表达人dll3的hek293
‑
hudll3细胞的结合。实验通过facs分析进行。
182.图4显示了用抗dll3 scfv组装的car
‑
t细胞的肿瘤细胞杀伤活性。空白转染的t细胞作为对照。
183.发明详述
184.各种出版物、文章和专利在本说明书的背景和全文中进行了引用或描述,这些参考全部通过引用并入本文。对包含在本说明书中的文献、法案、材料、装置、条款等的讨论是为了提供本发明的上下文。此类讨论并不意味着承认上述任一或全部事项构成与本发明公开或权利要求有关的现有技术的一部分。
185.除非另有定义,否则本文所用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同含义。除此之外,本文使用的特定术语具有说明书中规定的含
义。
186.必须指出的是,如本文和所附权利要求中所用,除非上下文另有明确规定,单数形式“一”、“一个”和“该”等包括复数引用。
187.除非另有说明,否则任何数值,如本文所述的浓度或浓度范围,在所有情况下均应理解为被术语“约”修饰。因此,数值通常包括列举值的
±
10%。例如,1mg/ml的浓度包括0.9mg/ml至1.1mg/ml。同样地,1%
‑
10%(w/v)的浓度范围包括0.9%(w/v)
‑
11%(w/v)。如本文所用,除非上下文明确说明,否则数值范围的使用明确包括所有可能的子范围、该范围内的所有单个数值,包括该范围内的整数和数值的分数。
188.除非另有说明,否则应理解在一系列元素之前使用的术语“至少”是指该系列中的每个元素。本领域技术人员将能辨别或能够仅使用常规实验来确定如本文所用的本发明特定实施例的许多等效物。此类等效物也包含在本发明中。
189.如本文所用,术语“包含”、“包含有”、“包括”、“包括有”、“有”、“具有”、“含有”或“含”,或其任何其他变化,将被理解为暗示包含规定的整数或整数组,但不排除任何其他整数或整数组,并且意为非排他性的或开放式的。例如,由一系列元素组成的组合物、混合物、过程、方法、制品或设备并不仅限于这些元素,而是可以包括未明确列出的其他元素或这些组合物、混合物、过程、方法、制品或设备固有的的元素。此外,除非另有明确相反的说明,否则“或”指的是包含性的或而非排除性的或。例如,条件a或b满足以下任一条件:a为真(或存在)且b为假(或不存在),a为假(或不存在)且b为真(或存在),以及a和b都为真(或都存在)。
190.如本文所用,多个列举元素之间的连接术语“和/或”被理解为包含单个以及组合的选择。例如,当两个元素由“和/或”连接时,第一种选择是指第一个元素的适用性,而不包含第二个元素。第二种选择是指第二个元素的适用性,而不包含第一个元素。第三种选择是指包含第一个要素和第二要素一起的适用性。这些选择中的任何一个都应理解为在含义的范围内,满足本文所用术语“和/或”的要求。同时适用这些选择中的多个也被理解为在含义的范围内,满足术语“和/或”的要求。
191.如本文所用,在整个说明书和权利要求书中使用的术语“由
……
组成”或诸如“由
……
构成”、“成为
……
的一部分”的变体表示包括任何列举的整数或整数组,但不得在指定的方法、结构或组成中添加额外的整数或整数组。
192.如本文所用,在整个说明书和权利要求书中使用的术语“基本上由
……
组成”或诸如“基本上由
……
构成”、“基本上成为
……
的一部分”的变体表示包括任何列举的整数或整数组,并且选择性地包括任何列举的整数或整数组,这些整数不会实质性地改变指定方法、结构或组合的基本属性或新特性。参见m.p.e.p.
§
2111.03.
193.如本文所用,“受试者”是指任何动物,优选为哺乳动物,最优选为人。如本文所用,术语“哺乳动物”包括任何哺乳动物。哺乳动物的实例包括但不限于牛、马、羊、猪、猫、狗、小鼠、大鼠、兔、豚鼠、猴、人等,更优选为人。
194.词语“右”、“左”、“下”和“上”表示参考附图中的方向。
195.还应当理解,当提及优选发明的元件尺寸或特征时,本文所用的术语“约”、“大约”、“大致”、“基本上”和类似术语表示所描述的尺寸或特征不是严格的边界或参数,并且不排除在功能上相同或相似的微小变化,上述内容可被本领域普通技术人员理解。包括数值参数的上述指代将至少包括使用本领域中公认的数学和工业原理(例如,修约、测量或其
他系统误差、制造公差等),不会改变最低有效数字的变化。
196.术语“相同”或百分比“同源性”,在两个或多个核酸或多肽序列(例如,包含对dll3和编码dll3的多核苷酸、dll3多肽和编码dll3多肽的多核苷酸具有特异性的抗原结合域的嵌合抗原受体(car))的上下文中,指的是使用以下序列比较算法之一或通过目视检查,进行校准和比较以获得最大相似性时,具有相同或具有特定百分比相同的氨基酸残基或核苷酸的两种或多种序列或子序列。
197.对于序列比较,通常一个序列作为参考序列,与测试序列进行比较。当使用序列比较算法时,将测试和参考序列输入计算机,必要时指定子序列坐标,并指定序列算法程序参数。然后,序列比较算法根据指定的程序参数计算测试序列相对于参考序列的序列同源性百分比。
198.可以对用于比较的序列进行最佳片段比对,例如通过smith和waterman,adv.appl.math.1981;2:482的局部同源算法,或通过needleman和wunsch,j.mol.biol.1970;48:443的同源比对算法,或通过pearson和lipman,proc.nat’l.acad.sci.usa 1988;85:2444的相似性方法检索,或通过这些算法的计算机化实现(gap、bestfit、fasta和tfasta,见于威斯康星遗传学软件包(wisconsin genetics software package),遗传学计算机组,575科学大道,麦迪逊,威斯康星州),或通过目视检查(一般参见f.m.ausubel等人所编“现代分子生物学操作指南”(current protocols in molecular biology)刊于current protocols,greene publishing associates,inc.和john wiley&sons,inc.之间的合资企业,1995增刊(ausubel))。
199.适用于确定序列同源性百分比和序列相似性的算法示例为blast和blast 2.0算法,如altschul等人,j.mol.biol.1990;215:403
‑
410以及altschul等人,nucleic acids res.1997;25:3389
‑
3402中分别所述。进行blast分析的软件可通过国家生物技术信息中心公开获取。该算法首先通过识别查询序列中长度为w的短单词来识别高分序列对(hsp),当与数据库序列中长度相同的单词对齐时,hsps要么匹配,要么满足一些正向阈值评分t。t被称为邻域词评分阈值(altschul等人,同上)。这些初始邻域单词的命中作为启动搜索的种子,以找到包含它们的更长的hsp。只要累积对齐分数可增加,单词命中就沿着每个序列向两个方向扩展,
200.对于核苷酸序列,使用参数m(一对匹配残基的奖励评分;始终>0)和n(不匹配残基的惩罚评分;始终<0)计算累积评分。对于氨基酸序列,使用评分矩阵计算累积评分。当:累积比对评分从其最大达到值下降到数量x;由于一个或多个负评分残基比对的积累,累积评分变为零或更低;或达到任一序列的末端时,停止每个方向的单词命中扩展。blast算法参数w、t和x决定了比对的灵敏度和速度。blastn程序(对于核苷酸序列)默认使用字长(w)为11,预期(e)为10,m=5,n=
‑
4,并比较两条链。对于氨基酸序列,blastp程序使用词长(w)为3、预期(e)为10和blosum62评分矩阵作为默认值(参见henikoff和henikoff,proc.natl.acad.sci.usa 1989;89:10915)。
201.除了计算序列同源性百分比,blast算法还对两个序列之间的相似性进行统计分析(参见例如karlin和altschul,proc.nat’l.acad.sci.usa 1993;90:5873
‑
5787)。blast算法提供的相似性的一个指标是最小和概率(p(n)),它提供了两个核苷酸或氨基酸序列之间偶然匹配的概率指示。例如,如果测试核酸与参考核酸比较中的最小和概率小于约0.1,
优选地小于约0.01,最优选地小于约0.001,则认为该核酸与参考序列相似。
202.如下所述,两个核酸序列或多肽基本相同的另一个迹象是,第一核酸编码的多肽与第二核酸编码的多肽具有免疫交叉反应性。因此,例如两种多肽的差异仅在于保守替换时,第一多肽通常与第二多肽基本相同。另一个表明两个核酸序列基本相同的迹象是,两个分子在严格的条件下发生相互杂交。
203.如本文所用,术语“分离”是指生物组分(如核酸、肽或蛋白质)已被实质性分离、分开生产,或与天然存在该组分的生物体的其他生物组分(即其他染色体、染色体外dna和rna以及蛋白质)进行了分离或纯化。因此,已经“分离”的核酸、肽和蛋白质包括通过标准纯化方法进行纯化了的核酸和蛋白质。“分离”的核酸、肽和蛋白质可以是组合物的一部分,如果组合物不是核酸、肽或蛋白质天然环境的一部分,仍然可以分离。该术语还包括通过在宿主细胞中重组表达而制备的核酸、肽和蛋白质以及化学人工合成的核酸。
204.如本文所用,术语“多核苷酸”,同义词称为“核酸分子”、“核苷酸”或“核酸”,是指任何多聚核糖核苷酸或多聚脱氧核糖核苷酸,可以是未修饰的rna或dna或修饰的rna或dna。“多聚核苷酸”包括但不限于单链和双链dna、由单链和双链区域混合的dna、单链和双链rna以及由单链和双链区域混合的rna、由dna和rna组成的杂交分子(可以是单链,或者更典型的是双链,或者是单链和双链区域的混合物)。此外,“多核苷酸”是指由rna或dna或同时由rna和dna组成的三链区域。多核苷酸一词还包括含有一个或多个修饰碱基的dna或rna以及为稳定性或其他原因修饰了骨架的dna或rna。“修饰的”碱基包括,例如,三糖基化碱基和非常见的碱基,如肌苷。可以对dna和rna进行多种修饰,因此,“多核苷酸”包括通常在自然界中发现的化学修饰、酶修饰或代谢修饰形式的多核苷酸,以及病毒和细胞特有的dna和rna的化学形式。“多聚核苷酸”还包含相对较短的核酸链,通常称为寡核苷酸。
205.如本文所用,术语“载体”是一复制子,其内的另一核酸片段可被操作插入,从而带来片段的复制或表达。
206.如本文所用,术语“宿主细胞”是指包含本发明核酸分子的细胞。“宿主细胞”可以是任何类型的细胞,例如原代细胞、培养细胞或来自细胞系的细胞。在另一优选例中,“宿主细胞”是用本发明的核酸分子转染或转导的细胞。在另一优选例中,“宿主细胞”是这种转染或转导细胞的子代或潜在子代。细胞的子代可能与亲本细胞相同,也可能不相同,例如,由于随后几代中可能发生的突变或环境影响,或核酸分子整合到宿主细胞基因组中。
207.如本文所用,术语“表达”是指基因产物的生物合成。该术语包括基因转录为rna。该术语还包括将rna翻译成一种或多种多肽,并进一步包括所有自然发生的转录后和翻译后修饰。表达的car可以在宿主细胞的细胞质内,可进入细胞外环境,如细胞培养的生长培养基或锚定在细胞膜上。
208.如本文所用,术语“免疫细胞”或“免疫效应细胞”是指参与免疫应答的细胞,例如促进免疫效应应答的细胞。免疫细胞的例子包括t细胞、b细胞、自然杀伤(nk)细胞、肥大细胞和髓源性吞噬细胞。根据特定的实施方式,工程化免疫细胞是t细胞,并且被称为car
‑
t细胞,因为它们被设计成表达本发明的car。
209.如本文所用,术语“工程化免疫细胞”是指一种免疫细胞,也称为一种免疫效应细胞,其通过向细胞的总遗传物质中添加dna或rna形式的额外遗传物质进行了基因修饰。根据本发明的实施例,在本发明中对工程化免疫细胞进行了基因修饰以表达car构建体。
210.嵌合抗原受体(car)
211.如本文所用,术语“嵌合抗原受体”(car)是指至少包含特异性结合抗原或靶目标的胞外结构域、跨膜结构域和胞内t细胞受体激活信号域的重组多肽。car的胞外结构域与靶细胞表面上靶抗原的结合导致car的聚集,并向含有car的细胞传递激活刺激。car调动免疫效应细胞的特异性并触发增殖、细胞因子产生、吞噬、和/或分子产生,所述分子能主要以非依赖性组织相容性(mhc)的方式介导靶抗原表达细胞的死亡。
212.在一方面中,car包含抗原结合域、铰链区、共刺激域、激活域和跨膜区。在一方面,car包含抗原结合域、铰链区、两个共刺激域、激活域和跨膜区。在一方面,car包含两个抗原结合域、铰链区、共刺激区、激活区和跨膜区。在一方面,car包含两个抗原结合域、一个铰链区、两个共刺激域、一个激活域和一个跨膜区。
213.如本文所用,术语“信号肽”是指新生car蛋白氨基末端(n
‑
末端)的先导序列,其共翻译或翻译后将新生蛋白引导至内质网并随后进行表面表达。
214.如本文所用,术语“胞外抗原结合域”、“胞外域”或“胞外配体结合域”是指位于细胞膜外且能够与抗原、靶点或配体结合的car部分。
215.如本文所用,术语“铰链区”是指连接car蛋白两个相邻结构域(例如胞外结构域和跨膜结构域)的car部分。
216.如本文所用,术语“跨膜结构域”是指car的一部分,其延伸穿过细胞膜并将car固定到细胞膜上。“跨膜域”也可以称为“跨膜区”。
217.共刺激域
218.如本文所用,嵌合抗原受体可结合共刺激(信号)结构域以增加其效力。共刺激(信号)结构域可以从共刺激分子衍生而来。共刺激分子是除抗原受体或其配体以外的细胞表面分子,是有效免疫应答所必需的。共刺激域可由共刺激分子衍生,共刺激分子包括但不限于cd28、cd28t、ox40、4
‑
1bb/cd137、cd2、cd3(α、β、δ、ε、γ、ζ)、cd4、cd5、cd7、cd9、cd16、cd22、cd27、cd30、cd33、cd37、cd40、cd45、cd64、cd80、cd86、cd134、cd137、cd154、程序性死亡
‑
1(pd
‑
1)、诱导型t细胞共刺激因子(icos)、淋巴细胞功能相关抗原
‑
1(lfa
‑
1;cd11a和cd18)、cd247、cd276(b7
‑
h3)、light(肿瘤坏死因子超家族成员14;tnfsf14)、nkg2c、igα(cd79a)、dap10、fcγ受体、mhci类分子、tnfr、整合素、信号淋巴细胞活化分子、btla、toll配体受体、icam
‑
1、cds、gitr、baffr、light、hvem(lightr)、kirds2、slamf7、nkp80(klrf1)、nkp44、nkp30、nkp46、cd19、cd8α、cd8β、il
‑
2rβ、il
‑
2rγ、il
‑
7rα、itga4、vla1、cd49a、ia4、cd49d、itga6、vla
‑
6、cd49f、itgad、itgae、cd103、itgal、cd1a、cd1b、cd1c、cd1d、itgam、itgax、itgb1、cd29、itgb2(cd18)、itgb7、nkg2d、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tacti le)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb
‑
a、lyl08)、slam(slamf1、cd150、ipo
‑
3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp
‑
76、pag/cbp、cd19a、cd83配体、细胞因子受体、激活nk细胞受体,或其片段或其任何组合。
219.激活域
220.如本文所用,嵌合抗原受体可包含激活结构域。激活域可包括但不限于cd3。cd3是天然t细胞上t细胞受体的一个元件,已被证明是car中重要的胞内激活元件。在优选实施方式中,cd3为cd3ζ。
221.铰链区
222.如本文所述,嵌合抗原受体可包含铰链区。这是胞外结构域的一部分,有时被称为“间隔区”。可根据本发明使用多种铰链,包括如上文所述的共刺激分子、免疫球蛋白(ig)序列或其他合适的分子,以实现与靶细胞的预期特定距离。在一些实施方式中,整个胞外区域由铰链区组成。
223.跨膜区
224.如本文所用,嵌合抗原受体(car)可包含跨膜区/结构域。car可设计为包含与car胞外结构域融合的跨膜结构域。它同样可以与car的胞内结构域融合。在一个实施例中,使用了与car中的一个结构域天然相关联的跨膜结构域。在某些情况下,可通过氨基酸取代选择或修饰跨膜结构域,以避免此类结构域与相同或不同表面膜蛋白的跨膜结构域结合,从而最小化与受体复合物的其他成员间的相互作用。跨膜结构域可以来自天然或人工合成途径。如果来源是天然的,则该结构域可能来自任何膜结合或跨膜蛋白质。本发明中的特定用途的跨膜区域可衍生自(即包含或工程化自)但不限于cd28、cd28t、ox40、4
‑
1bb/cd137、cd2、cd3(α、β、δ、ε、γ、ζ)、cd4、cd5、cd7、cd9、cd16、cd22、cd27、cd30、cd33、cd37、cd40、cd64、cd80、cd86、cd134、cd137、cd154、程序性死亡
‑
1(pd
‑
1)、诱导性t细胞共刺激因子(icos)、淋巴细胞功能相关抗原
‑
1(lfa
‑
1;cd11a和cd18)、cd247、cd276(b7
‑
h3)、light(肿瘤坏死因子超家族成员14;tnfsf14)、nkg2c、igα(cd79a)、dap10、fcγ受体、mhc i类分子、tnfr、整合素、信号淋巴细胞激活分子、btla、toll配体受体、icam
‑
1、cds、gitr、baffr、light、hvem(lightr)、kirds2、slamf7、nkp80(klrf1)、nkp44、nkp30、nkp46、cd19、cd8
‑
α、cd8
‑
β、il
‑
2r
‑
β、il
‑
2r
‑
γ、il
‑
7r
‑
α、itga4、vla1、cd49a、ia4、cd49d、itga6、vla
‑
6、cd49f、itgad、itgae、cd103、itgal、cd1a、cd1b、cd1c、cd1d、itgam、itgax、itgb1、cd29、itgb2(cd18)、itgb7、nkg2d、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244,2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb
‑
a、lyl08)、slam(slamf1、cd150、ipo
‑
3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp
‑
76、pag/cbp、cd19a、cd83配体、细胞因子受体、激活nk细胞受体、免疫球蛋白,或其片段或其任何组合。
225.免疫细胞
226.根据特定方面,本发明提供了作为免疫细胞的细胞,所述细胞包含分离多核苷酸或包含载体,其中所述载体包含分离多核苷酸,所述分离多核苷酸包含编码本发明car的核苷酸序列。包含本发明分离多核苷酸和/或载体的免疫细胞可称为“工程化免疫细胞”。优选地,工程化免疫细胞来源于人类(在制造重组前为人类来源)。
227.例如,工程化免疫细胞可以是淋巴系细胞。淋巴系细胞的非限制性示例包括t细胞和自然杀伤(nk)细胞。t细胞表达t细胞受体(tcr),大多数细胞表达α和β链,较少细胞表达γ和δ链。用作本发明的工程化免疫细胞的t细胞可以是cd4
+
或cd8
+
,并且可以包括但不限于辅助性t细胞(cd4
+
)、细胞毒性t细胞(也称为细胞毒性t淋巴细胞,ctl;cd8
+
细胞)和记忆t细胞(包括中央记忆t细胞、干细胞样记忆t细胞和效应记忆t细胞)、自然杀伤t细胞、粘膜相关恒定t细胞和γδt细胞。其他示例性免疫细胞包括但不限于巨噬细胞、抗原呈递细胞(apc)或表达细胞介导免疫应答抑制剂的任何免疫细胞,例如,免疫检查点抑制剂途径受体(例如,pd
‑
1)。本发明可用的免疫细胞其前体细胞包括造血干细胞和/或祖细胞。造血干细胞
和/或祖细胞可通过本领域已知的方法从骨髓、脐带血、细胞因子动员后的成人外周血等中获得。免疫细胞被设计成重组表达本发明的car。
228.免疫细胞及其前体细胞可通过本领域已知的方法分离,包括商用方法(参见例如rowland jones等人于1999年在纽约由牛津大学出版社出版的“淋巴细胞:实用方法”(lymphocytes:a practical approach))。免疫细胞或其前体的来源包括但不限于外周血、脐带血、骨髓或其他造血细胞来源。可以采用各种技术分离细胞,以分离或富集所需的免疫细胞。例如,阴性选择方法可用于去除不是所需免疫细胞的细胞。此外,阳性选择方法可用于分离或富集所需免疫细胞或其前体,或可采用阳性和阴性选择方法的组合。如果要分离特定类型的细胞,例如特定t细胞,则可以使用各种细胞表面标记物或标记物组合(例如cd3、cd4、cd8、cd34)来分离细胞。
229.在被给予本发明治疗方法的受试者中,免疫细胞或其前体细胞可以是自体的或非自体的。自体细胞从受试者中分离出来,其中所述受试者将被给予重组表达car的工程化免疫细胞。任选地,细胞可以通过白细胞分离获得,其中白细胞被选择性地从提取的血液中去除,制成重组体,然后重新转移到供体中。或者,可以使用来自非受试者的非自体供体的同种异体细胞。在非自体供体的情况下,对细胞进行分类并与人类白细胞抗原(hla)匹配,以确定合适的相容性水平。对于自体和非自体细胞,细胞可以选择性地冷冻保存,直到准备使用为止。
230.用于分离可用于重组表达本发明car的免疫细胞的各种方法已在前文进行描述,并且可以实用,包括但不限于使用外周供体淋巴细胞(sadelain等人,nat.rev.cancer 2003;3:35
‑
45,morgan等人,science 2006;314:126
‑
9),在肿瘤活检中使用源自肿瘤浸润淋巴细胞(til)的淋巴细胞培养物(panelli等人,j.immunol.2000;164:495
‑
504,panelli等人,j.immunol.2000;164:4382
‑
92),以及通过人工抗原呈递细胞(aapc)或树突状细胞选择性使用体外扩增抗原特异性外周血白细胞(dupont等人,cancer res.2005;65:5417
‑
427;papanicolaou等人,blood 2003;102:2498
‑
505)。在使用干细胞的情况下,可以通过本领域众所周知的方法分离细胞(例如参见klug等人所著于2002年在新泽西州由humana出版社出版的“造血干细胞操作指南”(hematopoietic stem cell protocols);freshney等人所著于2007年由john wiley&sons出版社出版的“人类干细胞培养”(culture of human stem cells))。
231.根据特定实施方式,制备工程化免疫细胞的方法包括转染或转导从个体分离的免疫效应细胞,以使免疫效应细胞表达本发明实施例的一个或多个car。制备用于免疫治疗的免疫细胞方法如wo2014/130635、wo2013/176916和wo2013/176915中所述,其通过引用并入本文。公开了可用于制备工程化免疫细胞的各个步骤,例如在wo2014/039523、wo2014/184741、wo2014/191128、wo2014/184744和wo2014/184143中所述,这些步骤通过引用并入本文。
232.在特定实施方式中,用本发明的car对免疫效应细胞(如t细胞)进行了基因修饰(例如用包含编码car的核酸的病毒载体进行转导),然后在体外激活和扩增。在各种实施方案中,t细胞可在基因修饰之前或之后被激活和扩增以表达car,使用的方法如us6352694、us6534055、us6905680、us6692964、us5858358、us6887466、us6905681、us7144575、us7067318、us7172869、us7232566、us7175843、us5883223、us6905874、us6797514、
us6867041、us2006/121005中所述,其通过引用并入本文。t细胞可以在体外或体内扩增。一般而言,本发明的t细胞可通过与一种表面接触而扩展,该表面附着有刺激cd3/tcr复合物相关信号的试剂和刺激t细胞表面上的共刺激分子的配体。作为非限制性示例,如本文所述,可通过接触抗cd3抗体或其抗原结合片段、或固定在表面上的抗cd3抗体,或通过与蛋白激酶c激活剂(例如苔藓虫素(bryostatin))结合钙离子载体接触,或者通过激活car本身来刺激t细胞群。为了共同刺激t细胞表面的辅助分子,使用了结合辅助分子的配体。例如,在适合条件下,t细胞群可与抗cd3抗体和抗cd28抗体接触以刺激t细胞增殖。适合t细胞培养的条件包括,例如适当的培养基(例如最小基本培养基或rpmi培养基1640或x
‑
vivo 5(龙沙公司)),其可包含增殖和存活所需的因子,包括血清(例如胎牛或人血清)、细胞因子例如il
‑
2、il
‑
7、il
‑
15和/或il
‑
21、胰岛素、ifn
‑
g、gm
‑
csf、tgfβ、和/或本领域技术人员已知的用于细胞生长的任何其他添加剂。在其他实施方式中,可使用诸如us6040177、us5827642和wo2012129514中所述的方法(通过引用并入本文中)激活和刺激t细胞以与饲养细胞和适当的抗体及细胞因子共同增殖。
233.抗体和抗原结合域
234.如本文所用,术语“抗体”在广义上使用,包括免疫球蛋白或抗体分子,包括人源化、复合和嵌合抗体以及单克隆或多克隆抗体片段。一般来说,抗体是对特定抗原具有结合特异性的蛋白质或肽链。抗体结构是众所周知的。根据重链恒定结构域氨基酸序列,免疫球蛋白可分为五大类(即iga、igd、ige、igg和igm)。iga和igg进一步细分为同种型iga1、iga2、igg1、igg2、igg3和igg4。因此,本发明的抗体可以是五个主要类别或相应的子类别中的任何一个。优选地,本发明的抗体为igg1、igg2、igg3或igg4。脊椎动物的抗体轻链可以根据其恒定结构域的氨基酸序列分为两种明显不同的类型之一,即κ和λ。因此,本发明的抗体可包含κ或λ轻链恒定结构域。根据特定实施例,本发明的抗体包括来自大鼠或人类抗体的重链和/或轻链恒定区。除了重链和轻链恒定结构域外,抗体还包含由轻链可变区和重链可变区组成的抗原结合区,每个重链可变区包含三个结构域(即互补性决定区1
‑
3;cdr1、cdr2和cdr3)。轻链可变区域可选地称为lcdr1、lcdr2和lcdr3,重链可变区域可选地称为hcdr1、hcdr2和hcdr3。
235.如本文所用,术语“分离抗体”指一种抗体,其基本上不含具有不同抗原特异性的其他抗体(例如,特异性结合dll3的分离抗体基本上不含不结合dll3的抗体)。此外,分离抗体基本上不含其他细胞材料和/或化学物。
236.如本文所用,术语“单克隆抗体”是指从基本上同质的抗体群体中获得的抗体,即除了可能以少量存在的自然发生的突变外,包含该群体的个体抗体是相同的。本发明的单克隆抗体可通过杂交瘤法、噬菌体显示技术、单淋巴细胞基因克隆技术或重组dna方法制备。例如,单克隆抗体可由杂交瘤产生,所述杂交瘤包括从转基因非人类动物(例如转基因小鼠或大鼠)获得的b细胞,所述b细胞具有包含人类重链转基因和轻链转基因的基因组。
237.如本文所用,术语“抗原结合片段”和/或“抗原结合域”指一种抗体片段,例如,双特异性抗体、fab、fab',f(ab')2、fv片段、二硫键稳定的fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv
‑
dsfv')、二硫键稳定的双特异性抗体(ds diabody),单链抗体分子(scfv)、单域抗体(sdab)、单链抗体二聚体(二价双特异性抗体)、由包含一个或多个cdr的抗体部分形成的多特异性抗体、骆驼化单域抗体、纳米抗体、单域抗体、二价域抗体,或与抗原结合但不包
含完整抗体结构的任何其他抗体片段。抗原结合域能够结合到与亲本抗体结合的相同抗原。根据特定实施方式,抗原结合域包含单链抗体分子(scfv)。
238.如本文所用,术语“单链抗体”指本领域中的常规单链抗体,其包括由约5个至约20个氨基酸的短肽连接的重链可变区和轻链可变区。如本文所用,术语“单域抗体”指本领域中的常规单域抗体,其包括重链可变区和重链恒定区或仅包括重链可变区。
239.如本文所用,术语“人抗体”是指由人产生的抗体或使用本领域已知的任何技术制造的抗体,其具有与由人产生的抗体相对应的氨基酸序列。人抗体的定义包括完整或全长抗体、其片段和/或包含至少一种人类重链和/或轻链多肽的抗体。
240.如本文所用,术语“人源化抗体”和/或“人源化抗原结合域”指经修饰以增加与人抗体和/或人抗原结合域的序列同源性的非人抗体和/或非人抗原结合域,这种情况下抗原结合域的抗原结合特性得以保留,但其在人体内的抗原性降低了。
241.如本文所用,术语“嵌合抗体”和/或“嵌合抗原结合域”指一种抗体和/或抗原结合域,其中免疫球蛋白分子的氨基酸序列源自两种或多种物种。轻链和重链的可变区通常对应地衍生自具有所需特异性、亲和力和潜力的一种哺乳动物(例如,小鼠、大鼠、兔子等)的抗体和/或抗原结合域的可变区,而恒定区对应地源自另一种哺乳动物(例如人类)的抗体和/或抗原结合域的序列,以避免在该物种中引发免疫反应。
242.如本文所用,术语“多特异性抗体”指包含多个免疫球蛋白可变结构域序列的抗体,其中,所述多个免疫球蛋白可变结构域序列的第一免疫球蛋白可变域序列对第一表位具有特异性结合,并且所述多个免疫球蛋白可变结构域序列的第二免疫球蛋白可变域序列对第二表位具有特异性结合。在一实施方式中,第一和第二表位位于相同抗原上,例如,相同蛋白质(或多聚体蛋白质的亚单位)。在一实施方式中,第一和第二表位重叠或基本重叠。在一实施方式中,第一和第二表位不重叠或基本上不重叠。在一实施方式中,第一和第二表位位于不同的抗原上,例如不同的蛋白质(或多聚体蛋白质的不同亚单位)。在一实施方式中,多特异性抗体包含第三、第四或第五免疫球蛋白可变结构域。在一实施方式中,多特异性抗体是双特异性抗体分子、三特异性抗体分子或四特异性抗体分子。
243.如本文所用,术语“双特异性抗体”指结合不超过两个表位或两个抗原的多特异性抗体。一种双特异性抗体,其特征在于,具有对第一表位的特异性结合的第一免疫球蛋白可变域序列和具有对第二表位的特异性结合的第二免疫球蛋白可变域序列。在一实施方式中,第一和第二表位位于相同抗原上,例如,相同蛋白质(或多聚体蛋白质的亚单位)。在一实施方式中,第一和第二表位重叠或基本重叠。在一实施方式中,第一和第二表位位于不同的抗原上,例如,不同的蛋白质(或多聚体蛋白质的不同亚单位)。在一实施方式中,双特异性抗体包括对第一表位具有特异性结合的重链可变域序列和轻链可变域序列,以及对第二表位具有特异性结合的重链可变域序列和轻链可变域序列。在一实施方式中,双特异性抗体包括对于第一表位具有特异性结合的半抗体或其片段,以及对于第二表位具有特异性结合的半抗体或其片段。在一实施方式中,双特异性抗体包含对第一表位具有特异性结合的单链抗体或其片段,以及对第二表位具有特异性结合的单链抗体或其片段。在一实施方式中,第一表位位于dll3上,第二表位位于pd
‑
1、pd
‑
l1、tim
‑
3、lag
‑
3、cd73、apelin、ctla
‑
4、egfr、her
‑
2、cd3、cd19、cd20、cd33、cd47、tip
‑
1、cldn18.2、folr1和/或其他肿瘤相关免疫抑制剂或表面抗原上。
244.如本文所用,术语“dll3”是指早期发育期间体节划分所需的典型δ样notch配体3(dll3),也称为δ样3或δ样蛋白3(dunwoodie等人,development2002;129:1795
‑
806)。与哺乳动物中均反式激活notch受体信号的notch家族配体dll1、dll4、jag1和jag2不同(ntziachristos等人,cancer cell 2014;25(3):318
‑
34),dll3主要定位于高尔基体,不能激活notch信号(chapman等人,hum mol genet 2011;20(5):905
‑
16和geffers等人,j cell biol 2007;178(3):465
‑
76)。在正常发育过程中,dll3通过与notch和dll1相互作用,抑制顺式和反式作用的notch通路激活(chapman等人,hum mol genet 2011;20(5):905
‑
16)。dll3在成人正常组织(脑除外)中通常不存在或以极低水平存在,但在肺癌、睾丸癌、胶质瘤和黑色素瘤样本中过表达(uhlen等人,science 2017;357(6352):eaan2507)。此外,在小细胞肺癌(sclc)和大细胞神经内分泌癌(lcnec)肿瘤细胞表面可检测到dll3(saunders等人,sci transl med 2015;7(302):302ra136和sharma等人,cancer res.2017;77(14):3931
‑
41),使其成为单克隆抗体和/或嵌合抗原受体(car)的潜在靶点用于癌症治疗。术语“人类dll3”指源自人类的dll3。人类dll3的示例性氨基酸序列在genbank accession no.np_058637.1(seq id no:169)中表示。
245.如本文所用,“特异性结合dll3”的抗体和/或抗原结合域指结合dll3(优选人dll3)的抗体和/或抗原结合域,kd值为1
×
10
‑7m或更小,优选地为1
×
10
‑8m或更小,更优选为5
×
10
‑9m或更小,1
×
10
‑9m或更小,5
×
10
‑
10
m或更小,或1
×
10
‑
10
m或更小。术语“kd”指的是离解常数,它是从kd与ka的比率(即kd/ka)中获得的,并表示为摩尔浓度(m)。基于本公开,可以使用本领域的方法确定抗原结合域的kd值。例如,抗体和/或抗原结合域的kd值可通过使用表面等离子体共振来确定,例如通过使用生物传感器系统,例如系统,或通过使用生物膜层干涉技术,例如octet red96系统。
246.抗体和/或抗原结合域的kd值越小,抗体和/或抗原结合域与目标抗原结合的亲和力越高。
247.在一具体方面,本发明涉及包含抗原结合域的嵌合抗原受体(car),其中抗原结合域包含重链互补性决定区1(hcdr1)、hcdr2、hcdr3、轻链互补性决定区1(lcdr1)、lcdr2和lcdr3,具有以下多肽序列:
248.(1)分别为seq id no:25、26、27、61、62和63;
249.(2)分别为seq id no:28、29、30、64、65和66;
250.(3)分别为seq id no:31、32、33、67、68和69;
251.(4)分别为seq id no:34、35、36、70、71和72;
252.(5)分别为seq id no:37、38、39、73、74和75;
253.(6)分别为seq id no:40、41、42、76、77和78;
254.(7)分别为seq id no:43、44、45、79、80和81;
255.(8)分别为seq id no:46、47、48、82、83和84;
256.(9)分别为seq id no:49、50、51、85、86和87;
257.(10)分别为seq id no:52、53、54、88、89和90;
258.(11)分别为seq id no:55、56、57、91、92和93;或
259.(12)分别为seq id no:58、59、60、94、95和96;
260.其中,所述抗原结合域特异性结合dll3,优选人dll3。
261.在另一具体方面中,本发明涉及包含抗原结合域的嵌合抗原受体(car),其中抗原结合域包含重链互补性决定区1(hcdr1)、hcdr2、hcdr3、轻链互补性决定区1(lcdr1)、lcdr2和lcdr3,具有以下多肽序列:
262.(1)分别为seq id no:97、98、99、133、134和135;
263.(2)分别为seq id no:100、101、102、136、137和138;
264.(3)分别为seq id no:103、104、105、139、140和141;
265.(4)分别为seq id no:106、107、108、142、143和144;
266.(5)分别为seq id no:109、110、111、145、146和147;
267.(6)分别为seq id no:112、113、114、148、149和150;
268.(7)分别为seq id no:115、116、117、151、152和153;
269.(8)分别为seq id no:118、119、120、154、155和156;
270.(9)分别为seq id no:121、122、123、157、158和159;
271.(10)分别为seq id no:124、125、126、160、161和162;
272.(11)分别为seq id no:127、128、129、163、164和165;或
273.(12)分别为seq id no:130、131、132、166、167和168;
274.其中,所述抗原结合域特异性结合dll3,优选人dll3。
275.在另一具体方面,本发明涉及包含重链可变区的抗原结合域,所述重链可变区的多肽序列与seq id no.:1、3、5、7、9、11、13、15、17、19、21或23有至少95%、至少96%、至少97%、至少98%,或至少99%相同;或包含轻链可变区,其中所述轻链可变区的多肽序列与seq id no.:2、4、6、8、10、12、14、16、18、20、22或24有至少95%、至少96%、至少97%、至少98%,或至少99%相同。
276.在另一具体方面,本发明涉及抗原结合域,包括:
277.(1)具有seq id no:1多肽序列的重链可变区和具有seq id no:2多肽序列的轻链可变区;
278.(2)具有seq id no:3多肽序列的重链可变区和具有seq id no:4多肽序列的轻链可变区;
279.(3)具有seq id no:5多肽序列的重链可变区和具有seq id no:6多肽序列的轻链可变区;
280.(4)具有seq id no:7多肽序列的重链可变区和具有seq id no:8多肽序列的轻链可变区;
281.(5)具有seq id no:9多肽序列的重链可变区和具有seq id no:10多肽序列的轻链可变区;
282.(6)具有seq id no:11多肽序列的重链可变区和具有seq id no:12多肽序列的轻链可变区;
283.(7)具有seq id no:13多肽序列的重链可变区和具有seq id no:14多肽序列的轻链可变区;
284.(8)具有seq id no:15多肽序列的重链可变区和具有seq id no:16多肽序列的轻链可变区;
285.(9)具有seq id no:17多肽序列的重链可变区和具有seq id no:18多肽序列的轻
链可变区;
286.(10)具有seq id no:19多肽序列的重链可变区和具有seq id no:20多肽序列的轻链可变区;
287.(11)具有seq id no:21多肽序列的重链可变区和具有seq id no:22多肽序列的轻链可变区;或
288.(12)具有seq id no:23多肽序列的重链可变区和具有seq id no:24多肽序列的轻链可变区。
289.在另一具体方面,所述的抗原结合域是人源化的,包含重链可变区,其中所述重链可变区的多肽序列与seq id no:170、175
‑
209或248
‑
255中任一种有至少95%、至少96%、至少97%、至少98%,或至少99%相同;或包含轻链可变区,其中所述轻链可变区的多肽序列与seq id no:171
‑
174、210
‑
240或256
‑
264中任一种有至少95%、至少96%、至少97%、至少98%,或至少99%相同。
290.在另一具体方面,所述的抗原结合域是人源化的,包括:
291.(1)具有seq id no:170多肽序列的重链可变区和具有seq id no:171多肽序列的轻链可变区;
292.(2)具有seq id no:170多肽序列的重链可变区和具有seq id no:172多肽序列的轻链可变区;
293.(3)具有seq id no:170多肽序列的重链可变区和具有seq id no:173多肽序列的轻链可变区。
294.(4)具有seq id no:183多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
295.(5)具有seq id no:183多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
296.(6)具有seq id no:184多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
297.(7)具有seq id no:184多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
298.(8)具有seq id no:198多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
299.(9)具有seq id no:200多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
300.(10)具有seq id no:198多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
301.(11)具有seq id no:200多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
302.(12)具有seq id no:201多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
303.(13)具有seq id no:201多肽序列的重链可变区和具有seq id no:230多肽序列的轻链可变区;
304.(14)具有seq id no:201多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
305.(15)具有seq id no:175多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
306.(16)具有seq id no:175多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
307.(17)具有seq id no:175多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
308.(18)具有seq id no:176多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
309.(19)具有seq id no:176多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
310.(20)具有seq id no:176多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
311.(21)具有seq id no:177多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
312.(22)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
313.(23)具有seq id no:178多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
314.(24)具有seq id no:178多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
315.(25)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
316.(26)具有seq id no:177多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
317.(27)具有seq id no:178多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
318.(28)具有seq id no:179多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
319.(29)具有seq id no:179多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
320.(30)具有seq id no:179多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
321.(31)具有seq id no:180多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
322.(32)具有seq id no:180多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
323.(33)具有seq id no:180多肽序列的重链可变区和具有seq id no:215多肽序列
的轻链可变区;
324.(34)具有seq id no:181多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
325.(35)具有seq id no:181多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
326.(36)具有seq id no:182多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
327.(37)具有seq id no:202多肽序列的重链可变区和具有seq id no:232多肽序列的轻链可变区;
328.(38)具有seq id no:202多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
329.(39)具有seq id no:202多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
330.(40)具有seq id no:203多肽序列的重链可变区和具有seq id no:232多肽序列的轻链可变区;
331.(41)具有seq id no:203多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
332.(42)具有seq id no:203多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
333.(43)具有seq id no:204多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
334.(44)具有seq id no:208多肽序列的重链可变区和具有seq id no:239多肽序列的轻链可变区;
335.(45)具有seq id no:208多肽序列的重链可变区和具有seq id no:240多肽序列的轻链可变区;
336.(46)具有seq id no:253多肽序列的重链可变区和具有seq id no:261多肽序列的轻链可变区;或
337.(47)具有seq id no:255多肽序列的重链可变区和具有seq id no:263多肽序列的轻链可变区。
338.在另一具有方面,所述的抗原结合域是特异性结合dll3,优选人dll3的单链可变片段(scfv)。在某些实施方式中,所述的抗原结合域是特异性结合dll3,优选人dll3的人源化单链可变片段(scfv)。
339.在某些实施方式中,所述的单链可变片段(scfv)包含与seq id no:241
‑
247或265
‑
286中任一种有至少95%、至少96%、至少97%、至少98%,或至少99%相同的多肽序列。在某些实施方式中,所述的单链可变片段(scfv)包含具有选自seq id no:241
‑
247或265
‑
286的氨基酸序列的多肽序列。
340.在另一具体方面,所述的嵌合抗原受体包含一个或多个抗原结合域。
341.在另一具体方面,所述的胞内信号域包含一个或多个共刺激结构域以及一个或多个激活结构域。
342.在另一整体方面,本发明涉及一种分离的多核苷酸,所述分离多核苷酸包含编码嵌合抗原受体(car)的核酸,其中该car包含本发明的抗原结合域。本领域技术人员将理解,可以在不改变蛋白质的氨基酸序列的情况下改变蛋白质的编码序列(例如,替换、删除、插入等)。因此,本领域技术人员将理解,编码本发明抗原结合域的核酸序列可以在不改变蛋白质的氨基酸序列的情况下被改变。
343.在另一整体方面,本发明涉及一种载体,所述载体包含分离多核苷酸,所述分离多核苷酸包含编码car的核酸,其中car包含本发明的抗原结合域。基于本公开当前的情况,本领域技术人员已知的任何载体均可使用,例如质粒、粘粒、噬菌体载体或病毒载体。在一些实施方式中,载体是重组表达载体,例如质粒。该载体可包括用于建立表达载体的常规功能的任何元件,例如,启动子、核糖体结合元件、终止子、增强子、选择性标记和复制起点。启动子可以是组成型、诱导型或抑制型启动子。许多能够将核酸递送到细胞的表达载体在本领域是已知的,并且可在本文中用于在细胞中产生其抗原结合域。根据本发明实施方式,可使用常规克隆技术或人工基因合成来生成重组表达载体。
344.在另一整体方面,本发明涉及一种载体转导的细胞,所述载体转导的细胞包含编码本发明car的分离核酸。术语“转导”或“转染”指外源核酸转移或导入宿主细胞的过程。“转导”细胞是一种已被外源核酸转导的细胞。该细胞包括初级受试细胞及其子代。在某些实施方式中,所述细胞为人car
‑
t细胞,其中所述t细胞经工程化处理以表达本发明的car以治疗诸如癌症等疾病。在某些实施方式中,所述细胞为人car
‑
nk细胞,其中所述nk细胞经工程化处理以表达本发明car以用于治疗诸如癌症等疾病。
345.在另一整体方面,本发明涉及一种制备car
‑
t细胞的方法,所述方法为使用包含编码本发明car的分离核酸的载体转导t细胞。
346.在另一整体方面,本发明涉及一种生产本发明的car
‑
t细胞的方法,包括在生产car
‑
t细胞的条件下,培养包含编码本发明嵌合抗原受体(car)的核酸的t细胞,并回收car
‑
t细胞。
347.在另一整体方面,本发明涉及一种制备car
‑
nk细胞的方法,所述方法为使用包含编码本发明car的分离核酸的载体转导nk细胞。
348.在另一整体方面,本发明涉及一种生产本发明的car
‑
nk细胞的方法,包括在生产car
‑
nk细胞的条件下,培养包含编码本发明嵌合抗原受体(car)的核酸的nk细胞,并回收car
‑
nk细胞。
349.在另一整体方面,本发明涉及一种生成包含本发明嵌合抗原受体(car)的rna工程细胞群的方法。所述方法包括将细胞群与包含编码本发明car的核酸的分离多核苷酸接触,其中所述分离多核苷酸为体外转录的rna或合成rna。
350.在另一整体方面,本发明涉及一种人源化抗dll3单克隆抗体或其抗原结合片段,所述抗体或其抗原结合片段包含重链可变区,其中所述重链可变区的多肽序列与seq id no:170、175
‑
209或248
‑
255中任一种序列有至少95%相同;或包含轻链可变区,其中所述轻链可变区的多肽序列与seq id no:171
‑
174、210
‑
240或256
‑
264中任一种序列有至少95%相同。
351.在另一整体方面,人源化抗dll3单克隆抗体或其抗原结合片段包括:
352.(1)具有seq id no:170多肽序列的重链可变区和具有seq id no:171多肽序列的
轻链可变区;
353.(2)具有seq id no:170多肽序列的重链可变区和具有seq id no:172多肽序列的轻链可变区;
354.(3)具有seq id no:170多肽序列的重链可变区和具有seq id no:173多肽序列的轻链可变区。
355.(4)具有seq id no:183多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
356.(5)具有seq id no:183多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
357.(6)具有seq id no:184多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
358.(7)具有seq id no:184多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
359.(8)具有seq id no:198多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
360.(9)具有seq id no:200多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
361.(10)具有seq id no:198多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
362.(11)具有seq id no:200多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
363.(12)具有seq id no:201多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
364.(13)具有seq id no:201多肽序列的重链可变区和具有seq id no:230多肽序列的轻链可变区;
365.(14)具有seq id no:201多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
366.(15)具有seq id no:175多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
367.(16)具有seq id no:175多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
368.(17)具有seq id no:175多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
369.(18)具有seq id no:176多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
370.(19)具有seq id no:176多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
371.(20)具有seq id no:176多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
372.(21)具有seq id no:177多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
373.(22)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
374.(23)具有seq id no:178多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
375.(24)具有seq id no:178多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
376.(25)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
377.(26)具有seq id no:177多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
378.(27)具有seq id no:178多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
379.(28)具有seq id no:179多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
380.(29)具有seq id no:179多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
381.(30)具有seq id no:179多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
382.(31)具有seq id no:180多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
383.(32)具有seq id no:180多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
384.(33)具有seq id no:180多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
385.(34)具有seq id no:181多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
386.(35)具有seq id no:181多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
387.(36)具有seq id no:182多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
388.(37)具有seq id no:202多肽序列的重链可变区和具有seq id no:232多肽序列的轻链可变区;
389.(38)具有seq id no:202多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
390.(39)具有seq id no:202多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
391.(40)具有seq id no:203多肽序列的重链可变区和具有seq id no:232多肽序列
的轻链可变区;
392.(41)具有seq id no:203多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
393.(42)具有seq id no:203多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
394.(43)具有seq id no:204多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
395.(44)具有seq id no:208多肽序列的重链可变区和具有seq id no:239多肽序列的轻链可变区;
396.(45)具有seq id no:208多肽序列的重链可变区和具有seq id no:240多肽序列的轻链可变区;
397.(46)具有seq id no:253多肽序列的重链可变区和具有seq id no:261多肽序列的轻链可变区;或
398.(47)具有seq id no:255多肽序列的重链可变区和具有seq id no:263多肽序列的轻链可变区。
399.在另一具体方面,人源化抗dll3单克隆抗体或其抗原结合片段能够诱导效应物介导的肿瘤细胞裂解,介导偶联药物的募集,和/或与另一种具有癌症杀伤作用的单克隆抗体或其抗原结合片段形成双特异性抗体。
400.在另一整体方面,本发明涉及一种分离核酸,所述分离核酸编码本发明的人源化抗dll3单克隆抗体或其抗原结合片段。
401.在另一整体方面,本发明涉及一种载体,所述载体包含编码本发明的人源化抗dll3单克隆抗体或其抗原结合片段的分离核酸。
402.在另一整体方面,本发明涉及一种宿主细胞,所述宿主细胞包含载体,所述载体包含编码本发明的人源化抗dll3单克隆抗体或其抗原结合片段的分离核酸。
403.在另一整体方面,本发明涉及一种生产本发明的人源化抗dll3单克隆抗体或其抗原结合片段的方法,包括在生产单克隆抗体或其抗原结合片段的条件下,培养含有编码该单克隆抗体或其抗原结合片段的核酸的细胞,并从细胞或培养物中回收该抗体或其抗原结合片段。
404.药物组合物
405.在另一整体方面,本发明涉及一种药物组合物,其包含本发明的分离多核苷酸、本发明的分离多肽、本发明的宿主细胞和/或本发明的工程免疫细胞以及药学上可接受的载体。
406.在另一整体方面,本发明涉及一种药物组合物,其包含本发明的人源化抗dll3单克隆抗体或其抗原结合片段和药学上可接受的载体。
407.本文所用术语“药物组合物”是指一种产品,其包含本发明的分离多核苷酸、本发明的分离多肽、本发明的宿主细胞和/或本发明的工程免疫细胞以及药学上可接受的载体。本发明的多核苷酸、多肽、宿主细胞和/或工程免疫细胞以及包含它们的组合物也可用于制造用于本文所述治疗性应用的药物。
408.如本文所用,术语“载体”指任何赋形剂、稀释剂、填料、盐、缓冲液、稳定剂、增溶
剂、油、脂质、含脂质囊泡、微球、脂质体包封物或本领域内用于药物制剂的其他众所周知的材料。应理解,载体、赋形剂或稀释剂的特性将取决于特定应用的给药途径。如本文所用,术语“药学上可接受的载体”指一种无毒材料,其不干扰本发明组合物的有效性或本发明组合物的生物活性。根据特定实施方式,基于本公开,任何适于在多核苷酸、多肽、宿主细胞和/或工程免疫细胞药物组合物中使用的药学上可接受的载体,均可用于本发明。
409.具有药学上可接受载体的药学活性成分的配方在本领域是已知的,例如,remington所著的“药学科学与实践”(the science and practice of pharmacy)(例如,2005年的第21版和任何之后的版本)。附加成分的非限制性示例包括:缓冲剂、稀释剂、溶剂、张力调节剂、防腐剂、稳定剂和螯合剂。一种或多种药学上可接受的载体可用于配制本发明的药物组合物。
410.在另一整体方面,本发明涉及一种制备包含本发明的人源化抗dll3单克隆抗体或其抗原结合片段的药物组合物的方法,包括混合单克隆抗体或其抗原结合片段与药学上可接受的载体以获得药物组合物。
411.使用方法
412.在另一整体方面,本发明涉及一种在需要的受试者中治疗癌症的方法,包括向受试者给予本发明的car
‑
t细胞和/或car
‑
nk细胞。癌症可以是任何液体瘤或实体瘤,例如,包括但不限于地选自肺癌(如小细胞肺癌(sclc))、大细胞神经内分泌癌(lcnec)、胃癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、胶质瘤、胶质母细胞瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性粒细胞白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他液体瘤。
413.在另一整体方面,本发明涉及一种在需要的受试者中靶向癌细胞表面dll3的方法,包括向需要的受试者给予包含本发明的人源化抗dll3单克隆抗体或其抗原结合片段的药物组合物。
414.在另一整体方面,本发明涉及一种在需要的受试者中治疗癌症的方法,包括向受试者给予包含本发明的人源化抗dll3单克隆抗体或其抗原结合片段的药物组合物。癌症可以是任何液体瘤或实体瘤,例如,包括但不限于地选自肺癌(如小细胞肺癌(sclc))、大细胞神经内分泌癌(lcnec)、胃癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、胶质瘤、胶质母细胞瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性粒细胞白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他液体瘤。
415.根据本发明实施方式,car
‑
t细胞或car
‑
nk细胞包含治疗有效量的本发明表达的car,药物组合物包含“治疗有效量”的人源化抗dll单克隆抗体或其抗原结合片段。如本文所用,术语“治疗有效量”是指在受试者中引起所需生物或药物反应的活性成分或组分的量。治疗有效量可根据所述目的以经验和常规方式确定。
416.如本文所用于参考的car,治疗有效量指在转导的t细胞或nk细胞中表达的car分子量,其调节需要的受试者的免疫应答。此外,如本文所用于参考的car,治疗有效量是指在转导的t细胞或nk细胞中表达的达到治疗疾病、紊乱或状态效果的car分子量;预防或减缓疾病、紊乱或状态进展的量;或减少或完全缓解与疾病、紊乱或状态相关症状的量。
417.如本文所用于参考的car
‑
t细胞或car
‑
nk细胞,治疗有效量指在需要的受试者中调节免疫应答的car
‑
t细胞或car
‑
nk细胞的量。此外,如本文所用于参考的car
‑
t细胞或car
‑
nk细胞,治疗有效量指达到治疗疾病、紊乱或状态效果的car
‑
t细胞或car
‑
nk细胞的量;预防或减缓疾病、紊乱或状态进展的量;或减少或完全缓解与疾病、紊乱或状态相关症状的量。
418.如本文所用于参考的人源化抗dll3单克隆抗体或其抗原结合片段,治疗有效量指在需要的受试者中调节免疫应答的人源化抗dll3单克隆抗体或其抗原结合片段的量。此外,如本文所用于参考的人源化抗dll3单克隆抗体或其抗原结合片段,治疗有效量指达到治疗疾病、紊乱或状态效果的人源化抗dll3单克隆抗体或其抗原结合片段的量;预防或减缓疾病、紊乱或状态进展的量;或减少或完全缓解与疾病、紊乱或状态相关症状的量。
419.根据特定实施方式,待治疗的疾病、紊乱或状态为癌症,优选地选自肺癌(如小细胞肺癌(sclc))、大细胞神经内分泌癌(lcnec)、胃癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、胶质瘤、胶质母细胞瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性粒细胞白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他液体瘤。
420.根据特定实施方式,治疗有效量是指足以实现以下一种、两种、三种、四种或多种效果的治疗量:(i)降低或改善待治疗疾病、紊乱或状态或相关症状的严重程度;(ii)缩短待治疗的疾病、紊乱或状态或与之相关的症状的持续时间;(iii)防止待治疗的疾病、紊乱或状态或与之相关的症状的进展;(iv)引起待治疗的疾病、紊乱或状态或与之相关的症状消退;(v)预防待治疗疾病、紊乱或状态或与之相关的症状的发展或发作;(vi)防止待治疗的疾病、紊乱或状态或与之相关的症状复发;(vii)减少患有待治疗疾病、紊乱或状态或相关症状的受试者的住院治疗;(viii)缩短患有待治疗疾病、紊乱或状态或相关症状的受试者的住院时间;(ix)增加患有待治疗疾病、紊乱或状态或相关症状的受试者的存活率;(xi)抑制或减轻受试者的待治疗疾病、紊乱或状态或与之相关的症状;和/或(xii)增强或改善另一疗法的预防或治疗效果。
421.治疗有效量或剂量可根据各种因素而变化,如待治疗的疾病、紊乱或状态、给药方式、靶点、受试者的生理状态(包括年龄、体重、健康等)、受试者是人还是动物、是否服用其他药物,以及治疗是预防性的还是治疗性的。最佳治疗剂量是以优化安全性和疗效而测定的。
422.根据特定实施方式,本文所述的组合物被配制成适合于给受试者的预期给药途径。例如,本文所述组合物可配制成适于静脉、皮下或肌肉内给药。
423.本发明的细胞能以本领域技术人员已知的任何方便的方式施用。例如,本发明的细胞可通过雾化吸入、注射、摄食、输血、植入和/或移植给受试者。包含本发明细胞的组合物可经动脉、皮下、皮内、肿瘤内、血管内、髓内、肌肉内、胸膜内、通过静脉内(i.v.)注射或腹腔内给予。在某些实施例中,本发明的细胞可在去除或不去除受试者淋巴的情况下施用。
424.由表达本发明car的本发明的细胞组成的药物组合物可在无菌液体制剂中提供,通常为具有细胞悬浮液的等渗水溶液,或任选地作为乳液、分散液等形式提供,通常将其缓冲至选定的ph值。所述组合物可包含适合细胞完整性和活力以及施用于细胞组合物的载
体,例如水、盐水、磷酸盐缓冲盐水等。
425.根据需要,可通过将本发明的细胞加入适量的适当溶剂和各种其他成分来制备无菌注射溶液。此类组合物可包括药学上可接受的载体、稀释剂或赋形剂,例如无菌水、生理盐水、葡萄糖、右旋糖等,其适于与细胞组合物一起使用并用于给药受试者,例如人。用于提供细胞组合物的合适缓冲液在本领域是众所周知的。所使用的任何载体、稀释剂或添加剂与保持本发明细胞的完整性和活力相容性良好。
426.本发明的细胞可在任何生理上可接受的载体中施用。含有本发明细胞的细胞群可包含纯化的细胞群。本领域技术人员可以使用各种众所周知的方法不难地确定细胞群中的细胞。包含本发明的遗传修饰细胞的细胞群的纯度范围可为约50%至约55%、约55%至约60%、约60%至约65%、约65%至约70%、约70%至约75%、约75%至约80%、约80%至约85%、约85%至约90%,约90%到约95%,或约95%到约100%。本领域技术人员可以不难地调整剂量,例如,纯度的降低可能需要增加剂量。
427.本发明的细胞通常作为剂量给药,剂量基于给药细胞的受试者每千克体重的细胞数(细胞数/千克)。通常,细胞剂量在约104至约10
10
细胞数/千克体重的范围内,例如,约105至约109、约105至约108、约105至约107或约105至约106,取决于给药方式和给药位置。一般而言,在全身给药的情况下,会使用相比区域给药(在肿瘤和/或癌症区域给药本发明的免疫细胞)更高的剂量。示例性剂量范围包括但不限于1
×
104至1
×
108,2
×
104至1
×
108,3
×
104至1
×
108,4
×
104至1
×
108,5
×
104至6
×
108,7
×
104至1
×
108,8
×
104至1
×
108,9
×
104至1
×
108,1
×
105至1
×
108,1
×
105至9
×
107,1
×
105至8
×
107,1
×
105至7
×
107,1
×
105至6
×
107,1
×
105至5
×
107,1
×
105至4
×
107,1
×
105至4
×
107,1
×
105至3
×
107,1
×
105至2
×
107,1
×
105至1
×
107,1
×
105至9
×
106,1
×
105至8
×
106,1
×
105至7
×
106,1
×
105至6
×
106,1
×
105至5
×
106,1
×
105至4
×
106,1
×
105至4
×
106,1
×
105至3
×
106,1
×
105至2
×
106,1
×
105至1
×
106,2
×
105至9
×
107,2
×
105至8
×
107,2
×
105至7
×
107,2
×
105至6
×
107,2
×
105至5
×
107,2
×
105至4
×
107,2
×
105至4
×
107,2
×
105至3
×
107,2
×
105至2
×
107,2
×
105至1
×
107,2
×
105至9
×
106,2
×
105至8
×
106,2
×
105至7
×
106,2
×
105至6
×
106,2
×
105至5
×
106,2
×
105至4
×
106,2
×
105至4
×
106,2
×
105至3
×
106,2
×
105至2
×
106,2
×
105至1
×
106,3
×
105至3
×
106细胞数/千克等。此外,可以对剂量进行调整基于是否正在施用单剂量或多剂量。有效剂量的精确确定可以基于每个受试者的个体因素。
428.如本文所用,术语“治疗”、“诊治”和“医治”均意为指与癌症和/或炎症疾病、炎症紊乱或炎症状态相关的至少一个可测量身体参数的改善或逆转,这在受试者中不必要识别,但能够在受试者中辨别出来。术语“治疗”、“诊治”和“医治”也可以指引起退化、阻断进展或至少减缓疾病、紊乱或状态的进展。在特定实施例中,“治疗”、“诊治”和“医治”指减轻、预防与疾病、紊乱或状态(例如肿瘤或更优选为癌症)相关的一个或多个症状的发展或发作,或缩短其持续时间。在特定实施例中,“治疗”、“诊治”和“医治”指预防疾病、紊乱或状态的复发。在特定实施例中,“治疗”、“诊治”和“医治”指患有该疾病、紊乱或状态的受试者其存活率的增加。在特定实施例中,“治疗”、“诊治”和“医治”指消除受试者中的疾病、紊乱或状态。
429.根据特定实施方式,提供了用于治疗癌症和/或炎症疾病、炎症紊乱或炎症状态的组合物。对于癌症治疗,所提供的组合物可与其他治疗结合使用,包括但不限于化疗、抗
cd20单抗、抗tim
‑
3单抗、抗lag
‑
3单抗、抗egfr单抗、抗her
‑
2单抗、抗cd19单抗、抗cd33单抗、抗cd47单抗、抗cd73单抗、抗claudin18.2单抗、抗apelin单抗、抗tip
‑
1单抗、抗folr1单抗、抗ctla
‑
4单抗、抗pd
‑
l1单抗、抗pd
‑
1单抗、其他免疫肿瘤药物、抗血管生成剂、放射治疗、抗体药物结合物(adc)、靶向治疗或其他抗癌药物。
430.根据特定实施方式,治疗需要的受试者其癌症的方法包括向受试者施用本发明的car
‑
t细胞和/或car
‑
nk细胞以及提高表达car分子的细胞功效的药剂。此类试剂包括但不限于结合cd73、cd39、pd1、pd
‑
l1、pd
‑
l2、ctla4、tim3或lag3的抗体片段,或腺苷a2a受体拮抗剂。
431.根据特定实施方式,治疗有需要的受试者其癌症的方法包括向受试者施用本发明的car
‑
t细胞和/或car
‑
nk细胞,并结合一种能改善与施用表达car分子的细胞相关的一种或多种副作用的药物。此类药物包括但不限于类固醇、tnfα抑制剂或il
‑
6抑制剂。
432.根据特定实施方式,治疗有需要的受试者其癌症的方法包括向受试者施用本发明的car
‑
t细胞和/或car
‑
nk细胞以及治疗与dll3相关疾病的药剂。此类试剂包括但不限于抗dll3单克隆抗体或双特异性抗体。
433.如本文所用,术语“共同给药”在向受试者施用两种或多种疗法的上下文中指使用超过一种的疗法。术语“共同给药”的使用并不限制对受试者进行治疗的顺序。例如,第一疗法(例如,本文所述组合物)可在受试者进行第二治疗之前(例如5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、16小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周之前)、同时或之后(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、16小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周之后)进行。
434.实施方式
435.本发明还提供了以下非限制性实施方式。
436.实施方式1是包含编码嵌合抗原受体(car)的核酸序列的分离多核苷酸,其中car包含:(a)包含至少一个特异性结合dll3的抗原结合域的胞外结构域;(b)铰链区;(c)跨膜区;和(d)胞内信号域。
437.实施方式2是实施方式1的分离多核苷酸,其中抗原结合域包括重链互补决定区1(hcdr1)、hcdr2、hcdr3、轻链互补决定区1(lcdr1)、lcdr2和lcdr3,其多肽序列为:
438.(1)分别为seq id no:25、26、27、61、62和63;
439.(2)分别为seq id no:28、29、30、64、65和66;
440.(3)分别为seq id no:31、32、33、67、68和69;
441.(4)分别为seq id no:34、35、36、70、71和72;
442.(5)分别为seq id no:37、38、39、73、74和75;
443.(6)分别为seq id no:40、41、42、76、77和78;
444.(7)分别为seq id no:43、44、45、79、80和81;
445.(8)分别为seq id no:46、47、48、82、83和84;
446.(9)分别为seq id no:49、50、51、85、86和87;
447.(10)分别为seq id no:52、53、54、88、89和90;
448.(11)分别为seq id no:55、56、57、91、92和93;或
449.(12)分别为seq id no:58、59、60、94、95和96;
450.其中,所述抗原结合域特异性结合dll3,优选人dll3。
451.实施方式3是实施方式1的分离多核苷酸,其中抗原结合域包括重链互补决定区1(hcdr1)、hcdr2、hcdr3、轻链互补决定区1(lcdr1)、lcdr2和lcdr3,其多肽序列为:
452.(1)分别为seq id no:97、98、99、133、134和135;
453.(2)分别为seq id no:100、101、102、136、137和138;
454.(3)分别为seq id no:103、104、105、139、140和141;
455.(4)分别为seq id no:106、107、108、142、143和144;
456.(5)分别为seq id no:109、110、111、145、146和147;
457.(6)分别为seq id no:112、113、114、148、149和150;
458.(7)分别为seq id no:115、116、117、151、152和153;
459.(8)分别为seq id no:118、119、120、154、155和156;
460.(9)分别为seq id no:121、122、123、157、158和159;
461.(10)分别为seq id no:124、125、126、160、161和162;
462.(11)分别为seq id no:127、128、129、163、164和165;或
463.(12)分别为seq id no:130、131、132、166、167和168;
464.其中,所述抗原结合域特异性结合dll3,优选人dll3。
465.实施方式4是实施方式1
‑
3中任一实施方式的分离多核苷酸,其中抗原结合域包含重链可变区,所述重链可变区的多肽序列与seq id no.:1、3、5、7、9、11、13、15、17、19、21或23有至少95%、至少96%、至少97%、至少98%,或至少99%相同;或包含轻链可变区,其中所述轻链可变区的多肽序列与seq id no.:2、4、6、8、10、12、14、16、18、20、22或24有至少95%、至少96%、至少97%、至少98%,或至少99%相同。
466.实施方式5是实施方式1
‑
4中任一实施方式的分离多核苷酸,其中抗原结合域包括:
467.(1)具有seq id no:1多肽序列的重链可变区和具有seq id no:2多肽序列的轻链可变区;
468.(2)具有seq id no:3多肽序列的重链可变区和具有seq id no:4多肽序列的轻链可变区;
469.(3)具有seq id no:5多肽序列的重链可变区和具有seq id no:6多肽序列的轻链可变区;
470.(4)具有seq id no:7多肽序列的重链可变区和具有seq id no:8多肽序列的轻链可变区;
471.(5)具有seq id no:9多肽序列的重链可变区和具有seq id no:10多肽序列的轻链可变区;
472.(6)具有seq id no:11多肽序列的重链可变区和具有seq id no:12多肽序列的轻链可变区;
473.(7)具有seq id no:13多肽序列的重链可变区和具有seq id no:14多肽序列的轻链可变区;
474.(8)具有seq id no:15多肽序列的重链可变区和具有seq id no:16多肽序列的轻
链可变区;
475.(9)具有seq id no:17多肽序列的重链可变区和具有seq id no:18多肽序列的轻链可变区;
476.(10)具有seq id no:19多肽序列的重链可变区和具有seq id no:20多肽序列的轻链可变区;
477.(11)具有seq id no:21多肽序列的重链可变区和具有seq id no:22多肽序列的轻链可变区;或
478.(12)具有seq id no:23多肽序列的重链可变区和具有seq id no:24多肽序列的轻链可变区。
479.实施方式6是实施方式1
‑
4中任一实施方式的分离多核苷酸,其中抗原结合域是人源化的,包含重链可变区,所述重链可变区的多肽序列与seq id no:170、175
‑
209或248
‑
255中任一种有至少95%、至少96%、至少97%、至少98%,或至少99%相同;或包含轻链可变区,所述轻链可变区的多肽序列与seq id no:171
‑
174、210
‑
240或256
‑
264中任一种有至少95%、至少96%、至少97%、至少98%,或至少99%相同。
480.实施方式7是实施方式6的分离多核苷酸,其中抗原结合域是人源化的,包括:
481.(1)具有seq id no:170多肽序列的重链可变区和具有seq id no:171多肽序列的轻链可变区;
482.(2)具有seq id no:170多肽序列的重链可变区和具有seq id no:172多肽序列的轻链可变区;
483.(3)具有seq id no:170多肽序列的重链可变区和具有seq id no:173多肽序列的轻链可变区。
484.(4)具有seq id no:183多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
485.(5)具有seq id no:183多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
486.(6)具有seq id no:184多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
487.(7)具有seq id no:184多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
488.(8)具有seq id no:198多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
489.(9)具有seq id no:200多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
490.(10)具有seq id no:198多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
491.(11)具有seq id no:200多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
492.(12)具有seq id no:201多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
493.(13)具有seq id no:201多肽序列的重链可变区和具有seq id no:230多肽序列的轻链可变区;
494.(14)具有seq id no:201多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
495.(15)具有seq id no:175多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
496.(16)具有seq id no:175多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
497.(17)具有seq id no:175多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
498.(18)具有seq id no:176多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
499.(19)具有seq id no:176多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
500.(20)具有seq id no:176多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
501.(21)具有seq id no:177多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
502.(22)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
503.(23)具有seq id no:178多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
504.(24)具有seq id no:178多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
505.(25)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
506.(26)具有seq id no:177多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
507.(27)具有seq id no:178多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
508.(28)具有seq id no:179多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
509.(29)具有seq id no:179多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
510.(30)具有seq id no:179多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
511.(31)具有seq id no:180多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
512.(32)具有seq id no:180多肽序列的重链可变区和具有seq id no:214多肽序列
的轻链可变区;
513.(33)具有seq id no:180多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
514.(34)具有seq id no:181多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
515.(35)具有seq id no:181多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
516.(36)具有seq id no:182多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
517.(37)具有seq id no:202多肽序列的重链可变区和具有seq id no:232多肽序列的轻链可变区;
518.(38)具有seq id no:202多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
519.(39)具有seq id no:202多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
520.(40)具有seq id no:203多肽序列的重链可变区和具有seq id no:232多肽序列的轻链可变区;
521.(41)具有seq id no:203多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
522.(42)具有seq id no:203多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
523.(43)具有seq id no:204多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
524.(44)具有seq id no:208多肽序列的重链可变区和具有seq id no:239多肽序列的轻链可变区;
525.(45)具有seq id no:208多肽序列的重链可变区和具有seq id no:240多肽序列的轻链可变区;
526.(46)具有seq id no:253多肽序列的重链可变区和具有seq id no:261多肽序列的轻链可变区;或
527.(47)具有seq id no:255多肽序列的重链可变区和具有seq id no:263多肽序列的轻链可变区。
528.实施方式8是实施方式1
‑
7中任一实施方式的分离多核苷酸,其中抗原结合域是特异性结合dll3,优选人dll3的单链可变片段(scfv)。
529.实施方式9是实施方式8的分离多核苷酸,其中单链可变片段(scfv)是人源化的。
530.实施方式10是实施方式8或9的分离多核苷酸,其中单链可变片段(scfv)包含与seq id no:241
‑
247或265
‑
286中任一种有至少95%相同的多肽序列。
531.实施方式11是实施方式1
‑
10中任一实施方式的分离多核苷酸,其中嵌合抗原受体(car)包含一个或多个抗原结合域。
532.实施方式12是实施方式1
‑
11中任一实施方式的分离多核苷酸,其中car的胞内信
号域包含一个或多个共刺激结构域以及一个或多个激活结构域。
533.实施方式13是由实施方式1
‑
12中任一实施方式的分离多核苷酸编码的嵌合抗原受体(car)。
534.实施方式14是包含实施方式1
‑
12中任一实施方式的分离多核苷酸的载体。
535.实施方式15是包含实施方式14的载体的宿主细胞。
536.实施方式16是实施方式15的宿主细胞,其中所述细胞是car
‑
t细胞,优选人car
‑
t细胞。
537.实施方式17是实施方式15的宿主细胞,其中所述细胞是car
‑
nk细胞,优选人car
‑
nk细胞。
538.实施方式18是一种制备表达嵌合抗原受体(car)的宿主细胞的方法,该方法包括用实施方式14的载体转导t细胞。
539.实施方式19是一种生产嵌合抗原受体(car)
‑
t细胞的方法,该方法包括在生产car
‑
t细胞的条件下,培养t细胞,其中所述t细胞包含分离多核苷酸,所述分离多核苷酸包含编码实施方式1
‑
12中任一实施方式的嵌合抗原受体(car)的核酸,并回收所述car
‑
t细胞。
540.实施方式20是一种制备表达嵌合抗原受体(car)的宿主细胞的方法,该方法包括用实施方式14的载体转导nk细胞。
541.实施方式21是一种生产嵌合抗原受体(car)
‑
nk细胞的方法,该方法包括在生产car
‑
nk细胞的条件下,培养nk细胞,其中所述nk细胞包含分离多核苷酸,所述分离多核苷酸包含编码实施方式1
‑
12中任一实施方式的嵌合抗原受体(car)的核酸,并回收所述car
‑
nk细胞。
542.实施方式22是一种生成包含嵌合抗原受体(car)的细胞的方法,该方法包括将细胞与包含编码实施方式1
‑
12中任一实施方式的嵌合抗原受体(car)的核酸的分离多核苷酸接触,其中分离的多核苷酸是体外转录的rna或合成rna。
543.实施方式23是一种在有需要的受试者中治疗癌症的方法,该方法包括给予受试者实施方式15
‑
17中任一实施方式的宿主细胞
544.实施方式24是实施方式23的方法,该方法所述癌症选自:肺癌(如小细胞肺癌(sclc))、大细胞神经内分泌癌(lcnec)、胃癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、胶质瘤、胶质母细胞瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性粒细胞白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他液体瘤。
545.实施方式25是实施方式23或24的方法,还包括给予需要的受试者能增加表达car分子的细胞效力的药物。
546.实施方式26是实施方式23或24的方法,还包括给予需要的受试者能改善与施用表达car分子的细胞相关的一种或多种副作用的药物。
547.实施方式27是实施方式23或24的方法,还包括给予需要的受试者治疗dll3相关疾病的药物。
548.实施方式28是一种人源化抗dll3单克隆抗体或其抗原结合片段,所述的抗体或其抗原结合片段包含重链可变区,所述重链可变区的多肽序列与seq id no:170、175
‑
209或
248
‑
255中任一种序列有至少95%相同;或包含轻链可变区,其中所述轻链可变区的多肽序列与seq id no:171
‑
174、210
‑
240或256
‑
264中任一种序列有至少95%相同。
549.实施方式29是实施方式28的人源化抗dll3单克隆抗体或其抗原结合片段,其中所述的抗体或抗原结合片段包括:
550.(1)具有seq id no:170多肽序列的重链可变区和具有seq id no:171多肽序列的轻链可变区;
551.(2)具有seq id no:170多肽序列的重链可变区和具有seq id no:172多肽序列的轻链可变区;
552.(3)具有seq id no:170多肽序列的重链可变区和具有seq id no:173多肽序列的轻链可变区。
553.(4)具有seq id no:183多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
554.(5)具有seq id no:183多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
555.(6)具有seq id no:184多肽序列的重链可变区和具有seq id no:217多肽序列的轻链可变区;
556.(7)具有seq id no:184多肽序列的重链可变区和具有seq id no:218多肽序列的轻链可变区;
557.(8)具有seq id no:198多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
558.(9)具有seq id no:200多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
559.(10)具有seq id no:198多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
560.(11)具有seq id no:200多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
561.(12)具有seq id no:201多肽序列的重链可变区和具有seq id no:229多肽序列的轻链可变区;
562.(13)具有seq id no:201多肽序列的重链可变区和具有seq id no:230多肽序列的轻链可变区;
563.(14)具有seq id no:201多肽序列的重链可变区和具有seq id no:231多肽序列的轻链可变区;
564.(15)具有seq id no:175多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
565.(16)具有seq id no:175多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
566.(17)具有seq id no:175多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
567.(18)具有seq id no:176多肽序列的重链可变区和具有seq id no:210多肽序列
的轻链可变区;
568.(19)具有seq id no:176多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
569.(20)具有seq id no:176多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
570.(21)具有seq id no:177多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
571.(22)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
572.(23)具有seq id no:178多肽序列的重链可变区和具有seq id no:210多肽序列的轻链可变区;
573.(24)具有seq id no:178多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
574.(25)具有seq id no:177多肽序列的重链可变区和具有seq id no:211多肽序列的轻链可变区;
575.(26)具有seq id no:177多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
576.(27)具有seq id no:178多肽序列的重链可变区和具有seq id no:212多肽序列的轻链可变区;
577.(28)具有seq id no:179多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
578.(29)具有seq id no:179多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
579.(30)具有seq id no:179多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
580.(31)具有seq id no:180多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
581.(32)具有seq id no:180多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
582.(33)具有seq id no:180多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
583.(34)具有seq id no:181多肽序列的重链可变区和具有seq id no:213多肽序列的轻链可变区;
584.(35)具有seq id no:181多肽序列的重链可变区和具有seq id no:214多肽序列的轻链可变区;
585.(36)具有seq id no:182多肽序列的重链可变区和具有seq id no:215多肽序列的轻链可变区;
586.(37)具有seq id no:202多肽序列的重链可变区和具有seq id no:232多肽序列的轻链可变区;
587.(38)具有seq id no:202多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
588.(39)具有seq id no:202多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
589.(40)具有seq id no:203多肽序列的重链可变区和具有seq id no:232多肽序列的轻链可变区;
590.(41)具有seq id no:203多肽序列的重链可变区和具有seq id no:233多肽序列的轻链可变区;
591.(42)具有seq id no:203多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
592.(43)具有seq id no:204多肽序列的重链可变区和具有seq id no:234多肽序列的轻链可变区;
593.(44)具有seq id no:208多肽序列的重链可变区和具有seq id no:239多肽序列的轻链可变区;
594.(45)具有seq id no:208多肽序列的重链可变区和具有seq id no:240多肽序列的轻链可变区;
595.(46)具有seq id no:253多肽序列的重链可变区和具有seq id no:261多肽序列的轻链可变区;或
596.(47)具有seq id no:255多肽序列的重链可变区和具有seq id no:263多肽序列的轻链可变区。
597.实施方式30是实施方式28或29中任一实施方式的人源化抗dll3单克隆抗体或其抗原结合片段,其中所述单克隆抗体或其抗原结合片段能够诱导效应物介导的肿瘤细胞裂解,介导偶联药物的募集,和/或与另一种具有癌症杀伤作用的单克隆抗体或其抗原结合片段形成双特异性抗体。
598.实施方式31是一种分离核酸,其中所述分离核酸编码实施方式28
‑
30中任一实施方式的单克隆抗体或其抗原结合片段。
599.实施方式32是包含实施方式31的分离核酸的载体。
600.实施方式33是包含实施方式32的载体的宿主细胞。
601.实施方式34是一种药物组合物,包含实施方式28
‑
30中任一实施方式的分离单克隆抗体或其抗原结合片段和药学上可接受的载体。
602.实施方式35是一种在需要的受试者中靶向癌细胞表面dll3的方法,包括向需要的受试者给予包含实施方式28
‑
30中任一实施方式的人源化抗dll3单克隆抗体或其抗原结合片段组成的药物组合物。
603.实施方式36是一种在需要的受试者中治疗癌症的方法,包括给予受试者实施方式34的药物组合物。
604.实施方式37是实施方式36的方法,其中所述癌症选自:肺癌(如小细胞肺癌(sclc))、大细胞神经内分泌癌(lcnec)、胃癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、胶质瘤、胶质母细胞瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病
(cll)、慢性粒细胞白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他液体瘤。
605.实施方式38是一种生产实施方式28
‑
30中任一实施方式的单克隆抗体或其抗原结合片段的方法,包括在生产单克隆抗体或其抗原结合片段的条件下,培养含有编码该单克隆抗体或其抗原结合片段的核酸的细胞,并从细胞或培养物中回收该抗体或其抗原结合片段。
606.实施方式39是一种生产包含实施方式28
‑
30中任一实施方式的单克隆抗体或其抗原结合片段的药物组合物的方法,包括混合所述单克隆抗体或其抗原结合片段与药学上可接受的载体以获得药物组合物。
实施例
607.实施例1:特异性结合dll3的抗原结合域的鉴定
608.特异性结合dll3的抗原结合域为抗dll3单抗分离株,测序如2019年4月30日提交的pct专利申请号pct/us2019/029888中所述,该申请通过引用整体并入本文。
609.表1和2中提供了特异性结合dll3的抗原结合域的重链和轻链可变区序列,表3
‑
6中提供了特异性结合dll3的抗原结合域的cdr区。
610.表1:特异性结合dll3的抗原结合域的重链可变区序列
[0611][0612]
vh:重链可变区
[0613]
表2:特异性结合dll3的抗原结合域的轻链可变区序列
[0621]
名称lc cdr1nolc cdr2nolc cdr3no13p9aqninvw61kas62qqgqsypft635a16agnihny64nak65qhfwttpwt6614l22aqsvlyssnqkny67was68hqylssrt6910p18aksvstsgysy70las71qhsrelpyt7213p11aenvgty73gas74gqsysypft753c16aqnvrta76las77lqhwnyplt783i21adhinnw79gat80qqywsipft818h5aksllhsngity82qms83aqnlelpft8415k2aesvdiygnsf85las86qqnnedpwt875a24aksllhsngity88qms89aqnlelplt9015p17aesvdsygnsf91las92qqnhedpwt9315n21aqsllyssnqkny94was95qqyytylt96
[0622]
lc:轻链;cdr:互补决定区;no:seq id no
[0623]
使用imgt方法(lefranc,m.
‑
p.等人,nucleic acids res.1999;27:209
‑
212)确定特异性结合dll3的抗原结合域的lc cdr。
[0624]
表5:特异性结合dll3的抗原结合域的重链cdr区1
‑3[0625]
名称hc cdr1nohc cdr2nohc cdr3no13p9asyvmh97yinpyndatkynekfkg98ggydydgdy995a16aryilh100yinpyndgtkynekfkg101dssgyggayamdf10214l22asyams103ainsnggntyypdtvkd104hrggfyyavdy10510p18agyyid106yiypsngetsynqkfkg107esyamdy10813p11angnhwws109yisssgstdsnpslks110tgtwgyfdy1113c16asyvmh112yvipyndgtkynekfkg113psnwdefdy1143i21anywmn115rihpsdsethynqkfkt116ydgyfay1178h5atfgmgvg118hiwwdddkyynpalks119tydydeyfdy12015k2asywmn121rihpsdsethynqkfrt122edgyywyfdv1235a24adfnmd124dinpnsggtiynqkfkg125wdygnfay12615p17anywmn127rihpsdsethynqkfks128edgyywyfdv12915n21asyams130ainsnggrnyypdtvkd131hrggyyyamdy132
[0626]
hc:重链;cdr:互补决定区;no:seq id no
[0627]
使用kabat(elvin a.kabat等人,免疫学感兴趣的蛋白的序列(sequences of proteins of immunological interest)第5版1991)方法确定特异性结合dll3的抗原结合域的hc cdr。
[0628]
表6:特异性结合dll3的抗原结合域的轻链cdr区1
‑3[0629]
[0630][0631]
lc:轻链;cdr:互补决定区;no:seq id no
[0632]
使用kabat(elvin a.kabat等人,免疫学感兴趣的蛋白的序列,第5版1991)方法确定特异性结合dll3的抗原结合域的lc cdr。
[0633]
实施例2:小鼠抗dll3单抗的人源化
[0634]
如2019年4月30日提交的pct专利申请号pct/us2019/029888中所述,将小鼠抗dll3单抗人源化以降低用于人类患者时的免疫原性潜力,该申请通过引用整体并入本文。人源化vh和vl区序列见表7和表8。人源化vh和vl命名规则如下:13p9
‑
h1指小鼠单抗13p9a人源化vh的h1序列;13p9
‑
l1是指小鼠单抗13p9a的人源化vl的l1序列。所有其他人源化的vh和vl区采用相同的命名规则。
[0635]
表7:抗dll3mab人源化重链可变区序列
[0636]
[0637]
[0638][0639]
表8:抗dll3单抗人源化轻链可变区序列
[0640]
[0641]
[0642][0643]
人源化的vh和vl区分别与人igg1重链和κ轻链的恒定区融合。人源化单抗命名规则如下:13p9
‑
h1l1是指具有13p9
‑
h1重链可变区和13p9
‑
l1轻链可变区的单抗;所有其他人源化单抗均采用相同的命名规则。通过将小鼠抗体的vh和vl区分别与人igg1重链和κ轻链的恒定区融合来制备嵌合抗体。3c16是指使用3c16a制备的嵌合抗体;所有其他嵌合单抗采用相同的命名规则。
[0644]
在elisa试验中测定人源化单抗结合dll3的能力,结果显示于图1a
‑
1q。
[0645]
实施例3:嵌合和人源化单抗转化为单链可变片段(scfv)
[0646]
嵌合和人源化单抗被转化为scfv,每个由一个vh和一个vl组成,中间有一个(g4s)
n
连接肽(其中“n”代表g4s重复的数量)。位于融合蛋白的n端的vh或vl区用以鉴定最有效的scfv设计。设计的scfv序列见表9。scfv命名规则如下:13p9
‑
h1(g4s)3l2是指具有13p9
‑
h1重链可变区、(g4s)3连接肽和13p9
‑
l2轻链可变区的scfv;5a16
‑
h(g4s)3l是指具有5a16a重链可变区、(g4s)3连接肽和5a16a轻链可变区的scfv;所有其他scfv采用相同的命名规则。
[0647]
表9:特异性结合dll3的人源化scfv序列
[0648]
[0649]
[0650]
[0651][0652]
实施例4:scfv的elisa结合分析
[0653]
如2019年4月30日提交的pct申请号pct/us2019/029888中所述,使用elisa方法检测了与一个(g4s)连接肽和人igg4 fc融合的scfv的融合蛋白(从n
‑
末端到c
‑
末端的顺序为scfv、g4s连接肽和fc)结合人dll3的能力,该申请通过引用整体并入本文。elisa测定结果显示在图2a
‑
2i中。
[0654]
实施例5:人源化scfv的facs分析
[0655]
scfv和fc融合蛋白与hek293细胞表面hudll3的结合使用如2019年4月30日提交的pct申请号pct/us2019/029888中所述的方法,通过facs进行测量,该申请以引用方式并入本文中,其整体有一个修改,即碘化丙啶(pi)(赛默飞世尔公司,货号:p3566)与二抗一起添加用以标记死细胞。结合结果显示于图3a
‑
3f。
[0656]
实施例6:包含抗dll3单克隆抗体或其抗原结合片段的嵌合抗原受体构建体的构建
[0657]
为了构建car,使用vh、vl和(g4s)
n
连接肽将单抗转化为scfv,并将scfv融合到源自人cd8α(aa 114
‑
188,boursier jp等人,j biol chem.1993;268(3):2013
‑
20)。car的c端胞内信号域是通过融合cd28(aa 162
‑
202,aruffo a和seed b,proc natl acad sci usa.1987;84(23):8573
‑
7)的胞内共刺激结构域构建的,其后是cd3ζ链的激活域(aa 52
‑
162,letourneur f和klausner rd,proc natl acad sci usa.1991;88(20):8905
‑
9)。将编码car的dna序列组装并克隆到表达载体(逆转录病毒或慢病毒,染色体外载体或整合载体)中,用以使用标准分子生物学克隆技术生成car构建体。
[0658]
实施例7:评估car
‑
t细胞活性的肿瘤细胞杀伤试验
[0659]
根据制造说明书,cd4+/cd8+t细胞用pan t分离试剂盒(美天旎生物技术公司,货号:130
‑
096
‑
535)进行分离,用dynabeads
tm
人t
‑
激活剂cd3/cd28(thermofisher,货号:11131d)在含有10%fbs的aim v培养基(赛默飞世尔公司,货号:12055083)中激活3天。接下来,将活性t细胞在含有10%fbs和300iu/ml il2的aim v培养基(研发系统公司,货号:202
‑
il
‑
050)中连续培养少于一周,并通过电穿孔与13p9
‑
h1(g4s)3l2 car表达质粒瞬时转染,获得car
‑
t细胞。活性t细胞也被空白转染并用作阴性对照。经过48小时的恢复期后,car
‑
t细胞和活性t细胞在试验中用作效应细胞。靶细胞hek293
‑
dll3用cfse(赛默飞世尔公司,货号:c34554)染色,与car
‑
t细胞或活性t细胞以5:1的e/t(效应细胞/靶细胞)比例共培养24小时。接下来,将细胞用pi(赛默飞世尔公司,货号:p3566)和annexin v(biolegend,货号:640924)染色,并通过流式细胞术(attune nxt)进行分析,仅计数cfse阳性细胞。肿瘤细胞裂解百分比计算方法为pi的百分比和/或annexin v阳性细胞的百分比,结果如图4所示。
[0660]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1