使用可吞咽药品递送装置将药品递送到肠道内腔中的治疗剂制剂和方法与流程
使用可吞咽药品递送装置将药品递送到肠道内腔中的治疗剂制剂和方法
1.相关申请的交叉引用
2.本技术要求2019年3月13日提交的美国临时专利申请序列号62/818,053以及2019年3月18日提交的美国临时专利申请序列号62/820,174的优先权和权益;这两项临时专利申请都通过引用方式整体并入本文用于所有目的。
3.本技术还与以下美国专利和专利申请有关:美国专利号8,562,589、8,721,620、8,734,429、8,759,284、8,809,269、9,149,617以及2019年12月31日提交的美国专利申请序列号16/731,834、2018年12月31日提交的美国专利申请序列号62/786,831和2019年2月28日提交的美国专利申请序列号62/812,118,所有这些专利和专利申请与本文引用的任何论文一起通过引用方式完整并入本文用于所有目的。
背景技术:
4.技术领域.本发明的实施方案涉及可吞咽药品递送装置。更具体地,本发明的实施方案涉及用于将药品递送到小肠的可吞咽药品递送装置。
5.虽然近年来用于治疗各种疾病的新药品的开发日益增加,但是许多药品的应用有限,因为它们不能口服。原因有很多,包括:口服耐受性差,并发症包括胃刺激和出血;药品化合物在胃中分解/降解;以及药品吸收差、缓慢或不稳定。常规的替代性药品递送方法诸如静脉内和肌肉内递送有许多缺点,包括来自针刺的疼痛和感染风险、对使用无菌技术的要求以及在患者体内长时间保持iv管线的要求和相关风险。虽然已经采用其他药品递送方法,诸如可植入药品递送泵,但这些方法需要半永久性植入装置,并且仍然可能存在许多iv递送局限性。因此,需要一种用于递送药品和其他治疗剂的改进方法。此外,虽然已经尝试通过口服递送来递送此类药品,但它们具有只能在禁食状态下递送药品的缺点,从而限制了它们对许多患者的实用性。
技术实现要素:
6.本发明的实施方案提供了用于将药品和其他治疗剂递送到体内各个位置的装置、系统、套件和方法。许多实施方案提供了一种用于在胃肠(gi)道内递送药品和其他治疗剂的可吞咽装置。特定实施方案提供了一种用于将药品和其他治疗剂递送到小肠壁和/或周围组织或其他gi器官壁中的可吞咽装置诸如胶囊。本发明的实施方案特别适用于递送在gi道内吸收性差、耐受性差和/或被降解的药品和其他治疗剂。此外,本发明的实施方案可用于递送以前只能或优选地通过静脉内或其他胃肠外施用形式(包括各种非血管注射的施用形式,诸如肌内或皮下注射,这是由于在gi道内降解和/或通过小肠吸收不良)递送的药品和其他治疗剂。在各种实施方案中,此类治疗剂可包括胰岛素(例如,基础胰岛素、重组胰岛素)和各种其他生物治疗剂(也描述为生物制剂),诸如各种免疫球蛋白或包括免疫球蛋白g的抗体。特定实施方案提供了用于递送生物利用度为70%或80%或更高的此类生物制剂的装置和方法。如本文所用,术语“生物治疗剂”(也称为生物制剂)是指由活生物体产生或含
有活生物体组分的产物。它可包括一种或多种形式的胰岛素(诸如基础胰岛素、重组人胰岛素)或一种或多种抗体(包括例如免疫球蛋白g(igg))。它还可包括细胞(诸如各种免疫细胞,例如白血细胞、巨噬细胞、t细胞等)或细胞的组分或片段(诸如血小板)。
7.在本发明的一个方面,本发明提供了一种用于递送到胃肠道(例如,胃、小肠、大肠等)的腔壁或周围组织(例如,腹膜壁或腹膜腔)中的治疗剂制剂,其中该制剂包含治疗有效剂量的至少一种治疗剂,诸如基础胰岛素或其他形式的胰岛素。制剂具有形状和材料一致性,以容纳在可吞咽胶囊或其他可吞咽装置中或者由可吞咽胶囊或其他可吞咽装置保护,并且从胶囊递送到肠壁中,以从肠壁或周围组织(诸如腹膜壁或腹膜腔)内释放治疗剂的剂量。在许多实施方案中,制剂被构造成容纳在可吞咽胶囊中并且可操作地联接到致动器、可扩张构件(例如,球囊)或具有第一构型和第二构型的其他装置中的一种或两种。制剂在第一构型中容纳在胶囊内,并且在第二构型中被推出胶囊并进入肠壁以将治疗剂递送到肠壁中。在变型中,制剂可被构造成部分地容纳在胶囊中或附接或以其他方式设置在胶囊表面上。在这些和相关实施方案中,可通过使用在小肠中降解的可溶解ph敏感涂层来实现或以其他方式促进制剂的释放。
8.在其他实施方案中,本发明提供了一种用于将治疗剂递送到gi道(例如,胃、肠等)中的腔壁中的方法,该方法包括吞咽包括胶囊、致动器和治疗剂制剂的实施方案的药品递送装置。致动器相应gi中的特定位置的条件(例如,ph),以便致动治疗剂制剂到小肠壁中的递送。在具体实施方案中,致动器可包括胶囊上的释放元件或涂层,该释放元件或涂层在胃、小肠、大肠中被选定的ph降解。一旦降解,该元件或涂层通过一种或多种递送方式(诸如通过可操作地联接到组织穿透构件的一个或多个球囊的扩张,所述组织穿透构件包含治疗剂制剂并且被构造成在球囊扩张时穿透并推进到肠壁中)来启动治疗剂制剂的递送。一旦组织穿透构件位于肠壁或周围组织中,它们就降解以将治疗剂释放到血流中。因为本发明的实施方案将治疗剂制剂直接递送到gi道(例如小肠、胃等)的壁或周围组织中,所以在血流或身体其他位置达到治疗剂的最大浓度的时间段(本文描述为t
max
)比当诸如通过肌内或其他皮下注射将治疗剂非血管注射到体内时达到这种最大浓度的相应时间段更短。在各种实施方案中,通过使用本发明的一个或多个实施方案(诸如可吞咽装置的实施方案)将治疗制剂插入肠壁中所实现的t
max
可为通过使用治疗剂的非血管注射所实现的t
max
的80%、50%、30%、20%或甚至10%。
9.在相关实施方案中,本发明提供了治疗制剂以及用于将它们递送到胃肠壁或周围组织中的相关方法,其中可实现递送的一个或多个药代动力学参数。此类参数可包括例如绝对生物利用度、相对生物利用度、t
max
、t
1/2
、c
max
和曲线下面积中的一个或多个。“绝对生物利用度”(表示为百分比)是指相对于由静脉内(iv)剂量确定的药品量,制剂中到达体循环的药品量(如由曲线下面积(auc)确定),其中假定iv剂量为100%生物利用度。“相对生物利用度”(也表示为百分比)是相对于通过相同或不同施用途径递送的相同药品的另一种制剂的药品量,第一制剂中到达体循环的药品量(如由auc测量结果确定)。t
max
是治疗剂在血液流中达到其最大浓度c
max
的时间段,并且
1/2
是治疗剂在血流(或身体其他位置)中的浓度在达到c
max
后达到其初始c
max
值的一半所需的时间段。在特定实施方案(包括例如治疗制剂包含抗体诸如igg的实施方案)中,由本发明的实施方案递送的治疗剂的绝对生物利用度可在约50%至68.3%的范围内,具体值为60.7%。还设想了其他值。而且,用于递送抗体例如igg
的t
max
可为约24小时,而t
1/2
可在约40.7小时至128小时的范围内,具体值为约87.7小时。
10.而且,在相关实施方案中,治疗制剂以及用于将它们递送到小肠壁或周围组织中的相关方法可被构造成产生具有以c
max
或t
max
作为参考点的选定形状的治疗剂的血浆/血液浓度与时间分布。例如,血浆浓度与时间分布可具有上升部分和下降部分,在上升部分期间从治疗剂的递送前浓度到c
max
水平所花的时间(称为上升时间)与在下降部分期间从c
max
水平回到递送前浓度所花的时间(称为下降时间)具有选定比率。在各种实施方案中,上升部分与下降部分的比率可在约1比20、1比10和1比5的范围内。在包含抗体诸如igg的治疗制剂的具体实施方案中,分布中上升时间与下降时间的比率可为约1比9。然而,对于包括重组人胰岛素在内的各种类型的胰岛素,上升时间与下降时间的比率可在约1比2至1比6的范围内,具体实施方案为1:4、1:4.5和1:6。
11.在另一方面,本发明提供了一种用于将药品或其他治疗剂制剂递送到小肠或大肠或者胃肠道的其他器官(诸如胃)的壁中的可吞咽装置。该装置包括尺寸被设定成被吞咽并穿过胃肠道的胶囊、定位在胶囊内用于将胶囊的纵向轴线与小肠的纵向轴线对齐的可展开对齐器、用于将治疗剂递送到肠壁中的递送机构以及用于展开对齐器或递送机构中的至少一者的展开构件。胶囊壁可通过与gi道中的液体接触而降解,但也可包括外部涂层或层,该外部涂层或层仅在小肠中发现的较高ph下降解,并用于在胶囊到达小肠(此时药品递送由涂层的降解启动)之前保护下面的胶囊壁以免在胃内降解。在使用中,此类材料允许在肠道的选定部分(诸如小肠)中靶向递送治疗剂。合适的外部涂层可包括各种肠溶衣,诸如甲基丙烯酸和丙烯酸乙酯的各种共聚物。
12.胶囊的另一个实施方案包括至少一个引导管、定位在至少一个引导管中的一个或多个组织穿透构件、递送构件和致动机构。组织穿透构件通常将包括空心针或其他类似结构,并且将具有内腔以及用于穿透到肠壁中的可选择深度的组织穿透端部。在各种实施方案中,装置可包括第二组织穿透构件和第三组织穿透构件,它们具有设想的附加编号。每个组织穿透构件可包括相同或不同的药品。在具有多个组织穿透构件的优选实施方案中,组织穿透构件可对称地分布在胶囊的周界周围,以便在递送药品期间将胶囊锚固到肠壁上。在一些实施方案中,组织穿透构件的全部或一部分(例如,组织穿透端部)可由药品制剂本身制成。在这些和相关实施方案中,药品制剂可具有被构造成穿透并保留在肠壁中的针或镖状结构(有倒钩或没有倒钩)。
13.组织穿透构件可由各种可生物降解材料(例如,聚环氧乙烷(peo)、plga(聚乳酸
‑
共
‑
乙醇酸)、麦芽糖或其他糖)制成,以便在小肠内降解,从而提供用于在组织穿透构件被保留在肠壁中时将该部件从肠壁分离的故障安全机制。另外,在这些和相关实施方案中,胶囊的可选择部分可由此类可生物降解材料制成,以便允许整个装置可控地降解成较小片。这些实施方案有助于装置穿过gi道并通过gi道排出。在特定实施方案中,胶囊可包括可生物降解材料的接缝,这些接缝可控地降解以将胶囊破碎成具有可选择尺寸和形状的片,以便于通过gi道。可对接缝施加预应力、进行穿孔或以其他方式处理以加速降解。使用可生物降解接缝在gi道中产生可吞咽装置的受控降解这一概念也可应用于其他可吞咽装置(诸如可吞咽相机),以促进穿过gi道并降低装置卡在gi道中的可能性。
14.递送构件被构造成将药品从胶囊推进通过组织穿透构件内腔并进入肠壁、胃壁或gi道的其他腔壁。通常,递送构件的至少一部分可在组织穿透构件内推进。在一个或多个实
施方案中,递送构件可具有活塞或类似结构,该活塞或类似结构的尺寸被设定成适配在递送构件内腔内。递送构件的远侧端部(推进到组织中的端部)可具有柱塞元件,该柱塞元件推进组织穿透构件内腔内的药品并且还与内腔形成密封。柱塞元件可以是一体的或附接到递送构件。优选地,递送构件被构造成在针内腔内行进固定距离,以便将固定或计量剂量的药品递送到肠壁中。这可通过选择以下中的一项或多项来实现:递送构件的直径(例如,直径可以向远侧逐渐变细)、组织穿透构件的直径(可在其远侧端部处变窄)、使用止动件和/或致动机构。对于具有由药品(例如,药品镖)制成的组织穿透构件的装置的实施方案,递送构件适于将镖推出胶囊并推进到组织中。
15.递送构件和组织穿透构件可被构造用于递送液体、半液体或固体形式的药品或所有这三种。固体形式的药品可包括粉末或丸粒。半液体可包括浆液或糊剂。可将药品容纳在胶囊的腔内,或在液体或半液体的情况下将其容纳在封闭贮存器内。在一些实施方案中,胶囊可包括第一药品、第二药品或第三药品(或更多药品)。可将这些药品容纳在组织穿透构件内腔(在固体或粉末的情况下)或胶囊主体内的单独贮存器中。
16.致动机构可联接到组织穿透构件或递送构件中的至少一者。致动机构被构造成将组织穿透构件推进到肠壁中的可选择距离以及推进递送构件以递送药品,然后从肠壁中撤回组织穿透构件。在各种实施方案中,致动机构可包括被构造成由释放元件释放的预簧载机构。合适的弹簧可包括螺旋弹簧(包括圆锥形弹簧)和叶片弹簧,还设想了其他弹簧结构。在特定实施方案中,弹簧可以是锥形的,以将处于压缩状态的弹簧的长度减小到甚至弹簧的压缩长度为约几个线圈(例如,两个或三个)或仅一个线圈的厚度的程度。
17.在特定实施方案中,致动机构包括弹簧、第一运动转换器和第二运动转换器和轨道构件。释放元件联接到弹簧以将弹簧保持在压缩状态,使得释放元件的降解释放弹簧。第一运动转换器被构造成转换弹簧的运动以将组织穿透元件推进到组织中并从组织中撤回。第二运动转换器被构造成转换弹簧的运动以将递送构件推进到组织穿透构件内腔中。运动转换器被弹簧推动并沿着杆或其他轨道构件行驶,该轨道构件用于引导转换器的路径。它们接合组织穿透构件和/或递送构件(直接或间接)以产生期望的运动。它们理想地被构造成将弹簧沿其纵向轴线的运动转换成组织穿透构件和/或递送构件的正交运动,但还设想了在其他方向上的转换。运动转换器可具有楔形、梯形或弯曲形状,还设想了其他形状。在特定实施方案中,第一运动转换器可具有梯形形状并且包括狭槽,该狭槽接合组织穿透构件上的销,该销在狭槽中行驶。狭槽可具有与转换器的整体形状成镜像或以其他方式对应于转换器的整体形状的梯形形状,并且用于在梯形的上坡部分期间推动组织穿透构件,然后在下坡部分期间将其拉回。在一个变型中,运动转换器中的一者或两者可包括凸轮或凸轮状装置,该凸轮或凸轮状装置通过弹簧转动并接合组织穿透和/或递送构件。
18.在其他变型中,致动机构还可包括机电装置或机构,诸如螺线管或压电装置。在一个实施方案中,压电装置可包括具有非展开和展开状态的成形压电元件。该元件可被构造成在施加电压时进入展开状态,然后在移除电压时返回到非展开状态。该实施方案和相关实施方案允许致动机构往复运动,以便推进组织穿透构件然后将其撤回。
19.释放元件联接到致动机构或联接到致动机构的弹簧中的至少一者。在特定实施方案中,释放元件联接到定位在胶囊内的弹簧,以便将弹簧保持在压缩状态。释放元件的降解释放弹簧以致动致动机构。在许多实施方案中,释放元件包括被构造成在暴露于小肠或大
肠中的化学条件(诸如ph)时降解的材料。通常,释放元件被构造成在暴露于小肠中的选定ph(例如,7.0、7.1、7.2、7.3、7.4、8.0或更高)时降解。然而,它还可被构造成响应于小肠中的其他条件而降解。在特定实施方案中,释放元件可被构造成响应于小肠流体中的特定化学条件(诸如在摄入膳食(例如,富含脂肪或蛋白质的膳食)后发生的那些)而降解。
20.可通过选择释放元件的材料、这些材料的交联量以及释放元件的厚度和其他尺寸来实现释放元件由于小肠、胃(或gi道中的其他位置)中的一种或多种条件而发生的生物降解。较少量的交联和/或较薄的尺寸可增加降解的速率,反之亦然。用于释放元件的合适材料可包括可生物降解材料,诸如被构造成在暴露于小肠中的较高ph或其他条件时降解的各种肠溶材料。可使肠溶材料与一种或多种聚合物共聚或以其他方式混合,以获得除生物降解之外的许多特定材料属性。此类属性可包括但不限于刚度、强度、柔韧性和硬度。
21.在特定实施方案中,释放元件可包括膜或塞,其适配在引导管上方或以其他方式阻塞引导管并将组织穿透构件保持在引导管内。在这些和相关实施方案中,组织穿透构件联接到簧载致动机构,使得当释放元件充分降解时,它释放组织穿透构件,然后该组织穿透构件弹出引导管以穿透到肠壁中。在其他实施方案中,释放元件可成形为用作将组织穿透元件保持就位的闩锁。在这些和相关实施方案中,释放元件可位于胶囊的外部或内部。在内部实施方案中,胶囊和引导管被构造成允许肠液进入胶囊内部,以允许释放元件降解。
22.在一些实施方案中,致动机构可借助于传感器(诸如ph传感器或其他化学传感器)来制动,该传感器检测小肠中胶囊的存在并向致动机构(或联接到致动机构的电子控制器)发送信号以致动该机构。ph传感器的实施方案可包括基于电极的传感器或者它可以是基于机械的传感器,诸如在暴露于小肠中的ph或其他化学条件时收缩或扩张的聚合物。在相关的实施方案中,通过使用来自传感器的扩张或收缩的机械运动,可扩张/可收缩传感器还可包括致动机构本身。
23.根据用于检测装置在小肠(或gi道中的其他位置)中的另一个实施方案,传感器可包括应变计或其他压力/力传感器,用于检测胶囊在肠道中的特定位置内经受的蠕动收缩次数。在这些实施方案中,胶囊的尺寸理想地被设定成在蠕动收缩期间被小肠抓住。gi道内的不同位置具有不同的蠕动收缩次数。小肠每分钟收缩12至9次,其中频率随肠的长度降低。因此,根据一个或多个实施方案,蠕动收缩次数的检测不仅可用于确定胶囊是否在小肠中,而且还可用于确定胶囊在肠内的相对位置。
24.作为内部激活药品递送的替代或补充,在一些实施方案中,用户可借助于rf装置、磁装置或本领域已知的其他无线信号发送装置从外部激活致动机构以递送药品。在这些和相关实施方案中,用户可使用手持设备(例如,手持rf设备),该手持设备不仅包括信号发送装置,而且还包括用于在装置处于小肠或gi道中的其他位置时通知用户的装置。后一实施方案可通过在可吞咽装置上包括rf发射器以在装置处于小肠或其他位置时向用户发出信号(例如,通过发出来自传感器的输入)来实现。同一手持设备还可被构造成在致动机构已被激活并且所选的药品被递送时提醒用户。通过这种方式,向用户提供药品已被递送的确认。这允许用户服用其他合适的药品/治疗剂以及做出其他相关决定(例如,糖尿病患者是否要吃饭以及应该吃什么食物)。手持设备还可被构造成向可吞咽装置发送信号以超控致动机构,从而防止延迟或加速药品的递送。在使用中,此类实施方案允许用户基于其他症状和/或患者行为(例如,吃饭、决定去睡觉、锻炼等)进行干预,以阻止、延迟或加速药品的递
送。
25.用户还可在吞咽胶囊后的选定时间段从外部激活致动机构。该时间段可与食物通过用户的gi道移动到gi道中的特定位置(诸如胃、小肠或大肠)的典型传送时间或传送时间范围相关。
26.本发明的另一个方面提供了使用本文所述的可吞咽装置的实施方案递送到小肠壁或周围组织中的治疗剂制剂。制剂包含治疗有效剂量的至少一种治疗剂,例如igg或另一种抗体。而且,它可包括固体、液体或这两者的组合,并且可包括一种或多种药物赋形剂。制剂具有一定的形状和材料一致性,以容纳在可吞咽胶囊的实施方案中,从胶囊递送到肠壁中,并在壁或周围组织内降解以释放该剂量的治疗剂。制剂还可具有可选择的表面积与体积的比率,以增强或以其他方式控制制剂在小肠或其他体腔的壁中降解的速率。在各种实施方案中,制剂可被构造成联接到致动器(诸如释放构件或致动机构),该致动器具有其中将制剂容纳在胶囊中的第一构型以及其中将制剂推出胶囊并推进小肠壁中的第二构型。可以从常规口服递送方法所需的剂量向下滴定制剂中的药品或其他治疗剂的剂量,从而可减少来自药品的潜在副作用。
27.通常,但不一定,制剂将被成形和以其他方式被构造成容纳在组织穿透构件的内腔中,诸如被构造成被推出囊体外并被推进小肠壁中的空心针。而且,制剂本身可包括被构造成被推进小肠或肠道中的其他内腔的壁中的组织穿透构件。组织穿透构件的尖端可具有各种形状,包括具有对称或不对称的锥形或斜角。后面的实施方案可用于将组织穿透构件偏转或引导到特定组织层中,诸如肠壁中。
28.本发明的另一方面提供了使用可吞咽药品递送装置的实施方案将药品和治疗剂递送到gi道的壁中的方法。此类方法可用于递送治疗有效量的多种药品和其他治疗剂。这些包括原本由于在胃中化学分解而需要注射的许多大分子肽和蛋白质,例如生长激素、甲状旁腺激素、胰岛素、干扰素和其他类似化合物。可通过本发明的实施方案递送的合适的药品和其他治疗剂包括各种化疗剂(例如干扰素)、抗生素、抗病毒剂、胰岛素和相关化合物、胰高血糖素样肽(例如,glp
‑
1、艾塞那肽)、甲状旁腺激素、生长激素(例如,ifg(胰岛素样生长因子)和其他生长因子)、抗癫痫剂、免疫抑制剂和抗寄生虫剂(诸如各种抗疟剂)。可根据患者的体重、年龄、病症或其他参数来滴定特定药品的剂量。
29.在本发明的各种方法实施方案中,药品可吞咽药品递送装置的实施方案可用于递送多种药品以治疗多种病症或用于治疗特定病症(例如,蛋白酶抑制剂的混合物以治疗hiv aids)。在使用中,此类实施方案允许患者放弃必须针对一个或多个特定病症服用多种药物的必要性。而且,它们提供了一种用于促进两种或多种药品方案在大约相同的时间被递送并吸收到小肠(因此血流)中的手段。由于化学成分、分子量等的不同,药品可以不同的速率通过肠壁被吸收,从而产生不同的药代动力学分布曲线。本发明的实施方案通过大约同时注射期望的药品混合物来解决这个问题。这进而提高了药代动力学,并因此提高了所选药品混合物的功效。
30.以下编号条款描述了本文描述的发明的其他示例、方面和实施方案:
31.1.一种包含治疗有效量的胰岛素的治疗制剂,所述制剂适于在口服摄入后插入患者的小肠壁或周围组织中,其中在插入后,所述制剂降解以将胰岛素从所述肠壁或周围组织释放到血流中,从而与皮下注射剂量的胰岛素相比产生约72%至129%范围内的相对生
物利用度。
32.2.根据条款1所述的制剂,其中与所述皮下注射剂量的胰岛素相比,所述相对生物利用度在约104%至129%的范围内。
33.3.根据条款1所述的制剂,其中所述周围组织是腹膜或腹膜腔。
34.4.根据条款1所述的制剂,其中所述胰岛素是人重组胰岛素。
35.5.根据条款1所述的制剂,其中所释放的胰岛素表现出约97至181分钟范围内的t
max
。
36.6.根据条款5所述的制剂,其中所释放的胰岛素表现出约139分钟的t
max
。
37.7.根据条款1所述的制剂,其中所述制剂包含约19.3至19.9ru的胰岛素。
38.8.根据条款1所述的制剂,其中所述制剂适于插入所述小肠壁中。
39.9.根据条款1所述的制剂,其中所述制剂的至少一部分呈固体形式。
40.10.根据条款1所述的制剂,其中所述制剂适于在可吞咽胶囊中口服递送。
41.11.根据条款10所述的制剂,其中所述制剂适于可操作地联接到具有第一构型和第二构型的递送装置,所述制剂在所述第一构型中被容纳在所述胶囊内,并且在所述第二构型中被推出所述胶囊并被推进到所述肠壁中。
42.12.根据条款1所述的制剂,其中所述制剂包含可生物降解材料,所述可生物降解材料在所述肠壁内降解以将胰岛素释放到所述血流中。
43.13.根据条款12所述的制剂,其中所述可生物降解材料包括pet、plga、糖或麦芽糖。
44.14.根据条款1所述的制剂,其中所述制剂包含至少一种药物赋形剂。
45.15.根据条款14所述的制剂,其中所述至少一种药物赋形剂包括粘结剂、防腐剂或崩解剂中的至少一种。
46.16.根据条款1所述的制剂,其中所述制剂包括组织穿透构件,所述组织穿透构件被构造成穿透并插入所述gi道的腔壁中。
47.17.根据条款16所述的制剂,其中所述组织穿透构件包含可生物降解材料,所述可生物降解材料在所述肠壁内降解以将所述胰岛素释放到血流中。
48.18.根据条款16所述的制剂,其中所述胰岛素被容纳在成形节段中的所述组织穿透构件中。
49.19.根据条款18所述的制剂,其中所述成形节段具有圆柱或丸粒形状。
50.20.根据条款16所述的制剂,其中所述腔壁包括小肠壁或胃壁。
51.21.一种包含治疗有效量的胰岛素的治疗制剂,所述制剂适于在口服摄入后插入患者肠壁或周围组织中,其中在插入后,所述制剂降解以将胰岛素从所述肠壁或周围组织释放到血流中,从而产生与等同剂量的皮下注射胰岛素相当的葡萄糖降低效果。
52.22.根据条款21所述的制剂,其中所述胰岛素是人重组胰岛素。
53.23.一种包含治疗有效剂量的胰岛素的治疗制剂,所述制剂适于在口服摄入后插入患者的肠壁或周围组织中,其中在插入后,所述制剂降解以将胰岛素从所述肠壁或周围组织释放到所述血流中,从而产生约381至527pm/kg体重/iu胰岛素剂量范围内的血浆胰岛素浓度。
54.24.根据条款23所述的制剂,其中所述胰岛素是人重组胰岛素。
55.25.根据条款23所述的制剂,其中所述血浆胰岛素浓度为约459pm/kg体重/iu胰岛素剂量。
56.26.一种包含治疗有效剂量的胰岛素的治疗制剂,所述制剂适于在口服摄入后插入肠壁或周围组织中,其中在插入后,所述制剂降解以将胰岛素从所述肠壁或周围组织释放到血流中,从而在摄入单糖后将患者的血糖维持在正常血糖水平内。
57.27.根据条款26所述的制剂,其中所述正常血糖水平在约60mg ml至90mg ml的范围内。
58.28.根据条款26所述的制剂,其中所述单糖是右旋糖。
59.29.根据条款26所述的制剂,其中所述胰岛素是人重组胰岛素。
60.30.一种包含胰岛素的治疗制剂,所述制剂适于在口服摄入后插入患者的肠壁或周围组织中,其中在插入后,所述制剂降解以将胰岛素从所述肠壁或周围组织释放到所述患者的血流中,所述释放表现出具有上升部分和下降部分的血浆浓度分布,所述上升部分从胰岛素的释放前水平达到胰岛素的c
max
水平比在所述下降部分中从所述胰岛素的c
max
水平达到所述胰岛素的释放前水平所花的时间快至少约2倍。
61.31.根据条款30所述的制剂,其中所述上升部分从所述胰岛素的释放前水平达到所述胰岛素的c
max
水平比在所述下降部分中从所述胰岛素的c
max
达到所述胰岛素的释放前水平所花的时间快约3至5倍的范围。
62.32.根据条款30所述的制剂,其中所述上升部分从所述胰岛素的释放前水平达到所述胰岛素的c
max
水平比在所述下降部分中从所述胰岛素的c
max
达到所述胰岛素的释放前水平所花的时间快约4.5倍。
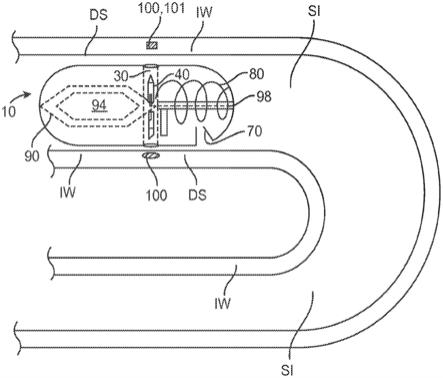
63.33.根据条款30所述的制剂,其中所述周围组织是腹膜或腹膜腔。
64.34.根据条款30所述的制剂,其中所述胰岛素是人重组胰岛素。
65.35.一种用于将胰岛素递送给患者的方法,所述方法包括:
66.提供固体胰岛素剂量;以及在口服摄入后将所述固体剂量胰岛素递送到所述患者的肠壁或周围组织中,其中将所述胰岛素从所述肠壁或周围组织中的所述固体剂量胰岛素释放到所述患者的血流中,从而产生具有上升部分和下降部分的血浆浓度分布,所述上升部分从胰岛素的释放前水平达到胰岛素的c
max
水平比在所述下降部分中从所述胰岛素的c
max
达到所述胰岛素的释放前水平所花的时间快至少约2倍。
67.36.根据条款35所述的方法,其中所述上升部分达到所述胰岛素的c
max
水平比在所述下降部分中从所述胰岛素的c
max
达到所述胰岛素的释放前水平所花的时间快约3至5倍的范围。
68.37.根据条款35所述的方法,其中所释放的胰岛素表现出约97至181分钟范围内的t
max
。
69.38.根据条款35所述的方法,其中所释放的胰岛素表现出约139分钟的t
max
。
70.39.根据条款35所述的方法,其中所述周围组织是腹膜或腹膜腔。
71.40.根据条款35所述的方法,其中所述胰岛素是人重组胰岛素。
72.41.一种用于将胰岛素递送给患者的方法,所述方法包括:提供固体胰岛素剂量;以及在口服摄入后将所述固体剂量胰岛素递送到所述患者的肠壁或周围组织中,其中将所述胰岛素从所述肠壁或周围组织中的所述固体剂量胰岛素释放到所述患者的血流中,从而
与皮下注射剂量的胰岛素相比获得至少约60%的胰岛素绝对生物利用度和约72%至129%范围内的相对生物利用度。
73.42.根据条款41所述的方法,其中所述周围组织是腹膜或腹膜腔。
74.43.根据条款41所述的方法,其中所释放的胰岛素表现出约97至181分钟范围内的t
max
。
75.44.根据条款43所述的方法,其中所释放的胰岛素表现出约139分钟的t
max
。
76.45.根据条款41所述的方法,其中所述胰岛素是人重组胰岛素。
77.46.一种用于将治疗剂递送到患者的胃肠(gi)道的腔壁中的方法,所述方法包括:吞咽药品递送装置,所述药品递送装置具有内部、具有第一构型和第二构型的致动器以及可操作地联接到所述致动器的治疗制剂,所述治疗制剂包含治疗有效剂量的至少一种治疗剂,所述制剂在所述第一构型中容纳在所述装置内部内,并且在所述第二构型中通过在所述制剂上施加力而被推出所述内部并进入所述gi腔壁,以便将所述治疗剂递送到所述腔壁中;以及响应于所述gi腔中的条件而致动所述致动器以将所述治疗剂从所述装置递送到所述gi腔壁中,其中所述装置从所述患者胃中离开与所述致动器在所述患者的小肠中致动之间的时间段不受所述患者的gi道中食物内容物存在的明显影响。
78.47.根据条款46所述的方法,其中所述可吞咽装置包括可吞咽胶囊,并且所述致动器容纳在所述可吞咽胶囊的内部内。
79.48.根据条款47所述的方法,其中所述可吞咽胶囊具有椭圆形状。
80.49.根据条款46所述的方法,其中所述致动器可操作地联接到可扩张构件或可扩张球囊,并且其中所述致动器的致动引起所述可扩张构件或所述可扩张球囊的扩张。
81.50.根据条款46所述的方法,其中所述小肠中的所述条件是选定的ph。
82.51.根据条款50所述的方法,其中所选定的ph高于约7.1。
83.52.一种用于将治疗剂递送到患者的小肠壁中的方法,所述方法包括:吞咽药品递送装置,所述药品递送装置具有内部、具有第一构型和第二构型的致动器以及可操作地联接到所述致动器的治疗制剂,所述治疗制剂包含治疗有效剂量的至少一种治疗剂,所述制剂在所述第一构型中容纳在所述装置内部内,并且在所述第二构型中通过在所述制剂上施加力而被推出所述内部并进入所述gi腔壁,以便将所述治疗剂递送到所述腔壁中;以及响应于所述gi腔中的条件而致动所述致动器以将所述治疗剂从所述装置递送到所述小肠壁中,其中当致动所述致动器时,所述患者没有可察觉的敏化。
84.53.根据条款52所述的方法,其中所述致动器联接到可扩张球囊或其他可扩张递送装置。
85.54.根据条款52所述的方法,其中所述小肠中的所述条件是选定的ph。
86.55.根据条款54所述的方法,其中所选定的ph高于约7.1。
87.下面参考附图更全面地描述本发明的这些和其他实施方案和方面的进一步细节。
附图说明
88.图1a是示出可吞咽药品递送装置的实施方案的横向视图。
89.图1b是示出包括可吞咽药品递送装置的系统的实施方案的横向视图。
90.图1c是示出包括可吞咽药品递送装置和一套使用说明的套件的实施方案的横向
视图。
91.图1d是示出可吞咽药品递送装置的实施方案的横向视图,该可吞咽药品递送装置包括药品贮存器。
92.图2是示出可吞咽药品递送装置的实施方案的横向视图,该可吞咽药品递送装置具有用于将组织穿透构件推进到组织中的簧载致动机构。
93.图3是示出可吞咽药品递送装置的实施方案的横向视图,该可吞咽药品递送装置具有簧载致动机构,该簧载致动机构具有第一运动转换器。
94.图4是示出可吞咽药品递送装置的实施方案的横向视图,该可吞咽药品递送装置具有簧载致动机构,该簧载致动机构具有第一运动转换器和第二运动转换器。
95.图5是示出第一运动转换器和第二运动转换器与组织穿透构件和递送构件的接合的透视图。
96.图6是示出可吞咽药品递送装置的实施方案的横截面视图,该可吞咽药品递送装置具有单个组织穿透构件和用于推进组织穿透构件的致动机构。
97.图7a是示出可吞咽药品递送装置的实施方案的横截面视图,该可吞咽药品递送装置具有多个组织穿透构件和用于推进组织穿透构件的致动机构。
98.图7b是示出图7a的实施方案的组织穿透构件的展开以将药物递送到递送部位并在递送期间将装置锚固在肠壁中的横截面视图。
99.图8a
‑
8c是示出药品递送装置在小肠中的定位和组织穿透构件的展开以递送药品的侧视图;图8a示出了释放元件完好无损情况下在组织穿透构件展开之前小肠中的装置;图8b示出了释放元件被降解并且组织穿透元件被展开情况下小肠中的装置;并且图8c示出了组织穿透元件被缩回并且药品被递送情况下小肠中的装置。
100.图9a示出了可吞咽药品递送装置的实施方案,该可吞咽药品递送装置包括具有可生物降解接缝的胶囊,这些接缝被定位成在gi道中产生胶囊的受控降解。
101.图9b示出了在gi道中降解成较小片之后的图9a的实施方案。
102.图10示出了具有可生物降解接缝的胶囊的实施方案,这些接缝包括孔和/或穿孔以加速胶囊的生物降解。
103.图11是示出可吞咽药品递送装置的实施方案的用途,包括装置在gi道中的传送和装置递送药品的操作。
104.图12a和12b是示出可吞咽药品递送装置的胶囊的实施方案的横向视图,该可吞咽药品递送装置包括帽以及涂有ph敏感的可生物降解涂层的主体,图12a示出了未组装状态的胶囊,并且图12b示出了组装状态的胶囊。
105.图13a和13b示出了包含展开球囊、对齐器球囊、递送球囊和各种连接管的未折叠多球囊组件的实施方案;图13a示出了用于展开球囊的单圆顶构造的组件的实施方案;并且图13b示出了用于展开球囊的双圆顶构造的组件的实施方案。
106.图13c是示出嵌套球囊构造的实施方案的透视图,该嵌套球囊构造可用于本文所述的球囊(包括对齐器球囊)的一个或多个实施方案。
107.图14a
‑
14c是示出多隔室展开球囊的实施方案的侧视图;图14a示出了分离法闭合的非膨胀状态下的球囊;图14b示出了阀打开且化学反应物混合的球囊,并且图14c示出了膨胀状态下的球囊。
108.图15a
‑
15g是示出用于折叠多球囊组件的方法的侧视图,每个图中的折叠构造适用于展开球囊的单圆顶和双圆顶构造,除了图15c涉及双圆顶构造独有的折叠步骤;并且图15d涉及双圆顶构造独有的最终折叠步骤;图15e涉及单圆顶构造独有的折叠步骤,并且图15f和15g是涉及单圆顶构造独有的最终折叠步骤的正交视图。
109.图16a和16b是示出具有附接的递送组件的最终折叠多球囊组件的实施方案的正交视图。
110.图17a和17b是示出插入胶囊中的最终折叠多球囊组件的实施方案的正交透明视图。
111.图18a是组织穿透构件的实施方案的侧视图。
112.图18b是组织穿透构件的实施方案的底视图,示出了组织保持特征的放置。
113.图18c是具有套管针尖端和倒锥形轴的组织穿透构件的实施方案的侧视图。
114.图18d是具有单独药品容纳节段的组织穿透构件的实施方案的侧视图。
115.图18e和8f是示出具有成形药品容纳节段的组织穿透构件的实施方案的组件的侧视图。图18e示出了组装之前的组织穿透构件和成形药品节段;并且图18f示出了组装之后的组织穿透构件和成形药品节段。
116.图19提供了用于组装递送组件的实施方案的部件和步骤的各种视图。
117.图20a
‑
20i提供了示出可吞咽装置将药物递送到肠壁的操作方法的各种视图。
118.图21是示出使用本文所述的可吞咽装置的实施方案(也称为ranipill)递送igg的药代动力学结果和血浆浓度与时间曲线形状的平均血浆浓度与时间图。
119.图22是与静脉内(iv组)和皮下注射(sc组)igg相比,使用ranipill(rani组)递送igg的平均血浆浓度与时间图。
120.图23是用于图22中的平均iv组图的在狗中静脉内注射igg的血浆浓度与时间图。
121.图24是用于图22中的平均sc组图的在狗中皮下注射igg的血浆浓度与时间图。
122.图25是用于图22中的平均rani组图的在狗中使用ranipill递送igg的血浆浓度与时间图。
123.图26是使用ranipill(rani组)和经由皮下注射(sc组)递送人重组胰岛素(hri)的胰岛素平均血浆浓度与时间图。
124.图27是比较在rani组和sc组中递送的hri的正常血糖钳夹实验的葡萄糖(右旋糖)输注速率与时间图。
125.图28是示出在正常血糖钳夹实验期间在rani组中递送的hri的平均血清胰岛素浓度与平均葡萄糖(右旋糖)输注速率之间的相互作用(例如,药代动力学(pk)和药效动力学(pd))的平均血浆胰岛素浓度和葡萄糖输注速率与时间图。
126.图29是示出在正常血糖钳夹实验期间在sc组中递送的hri的平均血清胰岛素浓度与平均葡萄糖(右旋糖)输注速率之间的pk
‑
pd相互作用的平均血浆胰岛素浓度和葡萄糖输注速率与时间图。
具体实施方式
127.本发明的实施方案提供了用于将药物递送到身体中的各个位置的装置、系统和方法。如本文所用,术语“药物”是指任何形式的药物制剂,其可包括药品或其他治疗剂以及一
种或多种药物赋形剂。许多实施方案提供了一种用于在gi道内递送药物的可吞咽装置。特定实施方案提供了一种用于递送药物(诸如胰岛素或用于治疗葡萄糖调节障碍的其他葡萄糖调节剂,或者igg或小肠壁或其他gi器官的其他抗体)的可吞咽装置(诸如胶囊)。如本文所用,“gi道”是指食道、胃、小肠、大肠和肛门,而“肠道”是指小肠和大肠。本发明的各种实施方案可被构造和布置用于将药物递送到肠道以及整个gi道中。在各种实施方案中,递送可如此构造,以便获得一个或多个可选择的药代动力学参数(例如,tmax、绝对生物利用度、相对生物利用度等)以及期望的血浆药品浓度与时间的曲线,如下文更详细描述的。如本文所用,术语“约”和“基本上”旨在解释小差异。当与事件或状况结合使用时,这些术语可指事件或状况准确发生的情况以及事件或状况发生至非常接近的情况。当与数值结合使用时(例如,用于属性、特征、维度、药代动力学参数或其他参数),这些术语可指小于或等于该数值的
±
10%(诸如小于或等于
±
5%、小于或等于
±
4%、小于或等于
±
3%、小于或等于
±
2%、小于或等于
±
1%、小于或等于
±
0.5%、小于或等于
±
0.1%或者小于或等于
±
0.05%)的变化范围值。平均值在所陈述值的10%内,更优选在5%内,并且更优选在2%内。
128.现在参考图1
‑
11,用于将药物100递送到胃肠道(诸如小肠壁或周围组织)中的递送部位ds的装置10的实施方案包括胶囊20,该胶囊包括至少一个引导管30、定位在至少一个引导管中或以其他方式可在至少一个引导管中推进的一个或多个组织穿透构件40、递送构件50、致动机构60和释放元件70。药物100(在本文中描述为制剂100)通常包含至少一种药品或其他治疗剂101,并且可包括本领域已知的一种或多种药物赋形剂。共同地,递送构件50和机构60中的一者或两者可包括用于将药物100递送到肠道壁中的装置。本文设想的其他递送装置包括一个或多个可扩张球囊(例如,递送球囊172)或本文所述的其他可扩张装置/构件。
129.装置10可被构造用于递送液体、半液体或固体形式的药物100或所有这三种。固体形式的药物/制剂100可包括粉末、丸粒或其他成形物质中的一种或多种。半液体形式可包括浆液或糊剂。无论为何种形式,制剂100理想地具有允许药物被推出装置进入肠壁(或gi道中的其他腔壁)然后在肠壁中降解以释放药品或其他治疗剂101的形状和材料一致性。材料一致性可包括制剂(在体液中)的硬度、孔隙率和溶解度中的一种或多种。材料一致性可通过以下中的一项或多项实现:i)用于制备制剂的压实力;ii)使用本领域已知的一种或多种药物崩解剂;iii)使用其他药物赋形剂;iv)制剂的粒度和分布(例如,微粉化颗粒);以及v)使用本领域已知的微粉化和其他颗粒形成方法。适用于制剂100的形状可包括圆柱形、立方体、矩形、圆锥形、球形、半球形以及它们的组合。而且,可选择形状以便限定制剂100的特定表面积和体积,因此限定两者之间的比率。表面积与体积的比率又可用于在gi道内的肠腔壁或其他腔壁内实现选定的降解速率。较大的比率(例如,较大量的每单位体积表面积)可用于实现较快的降解速率,反之亦然。在特定实施方案中,表面积与体积的比率可在约1:1至100:1的范围内,具体实施方案为2:1、5:1、20:1、25:1、50:1和75:1。通常将制剂/药物100预装填在组织穿透构件40的内腔44内,但也可将其容纳在胶囊20的内部24内的其他位置,或在液体或半液体的情况下将其容纳在封闭贮存器27内。可将药物预成形成适配到内腔中或以例如粉末形式装填。通常,装置10将被构造成递送作为药物100的一部分的单一药品101。然而,在一些实施方案中,装置10可被构造用于递送多种药品101,包括可混合到单种或多种药物100中的第一药品、第二药品或第三药品。对于具有多种药物/药品的实施方
案,可将药物容纳在单独的组织穿透构件40中或胶囊20内单独的隔室或贮存器27内。在另一个实施方案中,可将第一剂量102的包含第一药品101的药物100装填到穿透构件40中,并且可将第二剂量103的药物100(包含相同或不同的药品101)涂覆到如在图1b的实施方案中所示的胶囊表面25上。在两种剂量的药物102和103中的药品101可以是相同的或不同的。通过这种方式,可实现相同或不同药品的双峰药代动力学释放。第二剂量103的药物100可具有肠溶衣104,以确保它在小肠中释放并且也实现药物100的定时释放。肠溶衣104可包括本文所述或本领域已知的一种或多种肠溶衣。
130.用于将药物100递送到小肠壁或gi道内的其他位置的系统11可包括装置10,该装置包含用于治疗一种或多种选定病症的一种或多种药物100。在一些实施方案中,该系统可包括本文描述用于与装置10通信的手持设备13,如在图1b的实施方案中所示。系统11还可被构造为套件14,该套件包括包装在包装12中的系统11和一套使用说明15,如在图1c的实施方案中所示。这些说明可向患者指示何时相对于一个或多个事件(诸如摄入膳食或生理测量(诸如血糖、胆固醇等))采用装置10。在此类实施方案中,套件14可包括多个装置10,这些装置根据要治疗的病症包含用于选定的施用时期(例如一天、一周或多周)的药物100方案。
131.胶囊20的尺寸被设定成被吞咽并穿过肠道。也可根据要递送的药品量以及患者的体重和成人与儿科应用对尺寸进行调节。胶囊20包括内部体积24和外表面25,该外表面具有尺寸适于引导管30的一个或多个开孔26。除了装置10的其他部件(例如,致动机构等)外,内部体积还可包括一个或多个隔室或贮存器27。胶囊20的一个或多个部分可由本领域已知的各种生物相容性聚合物(包括各种可生物降解聚合物,其在优选实施方案中可包括plga(聚乳酸
‑
共
‑
乙醇酸))制成。其他合适的可生物降解材料包括本文所述的各种肠溶材料以及丙交酯、乙交酯、乳酸、乙醇酸、对二氧环己酮、己内酯、三亚甲基碳酸酯、己内酯以及它们的共混物和共聚物。如本文进一步详细地描述,在各种实施方案中,胶囊20可包括生物可降解材料的接缝22,以便可控地降解成更容易穿过肠道的较小片23。另外,在各种实施方案中,胶囊可包括各种不透射线或回波材料,用于使用荧光透视、超声或其他医学成像方式定位装置。在具体实施方案中,胶囊的全部或一部分可包括不透射线/回波标记20m,如在图1a和1b的实施方案中所示。在使用中,这些材料不仅允许定位gi道中的装置10,而且还允许确定装置通过gi道的传送时间。
132.在优选实施方案中,组织穿透构件40定位在引导管30内,这些引导管用于引导并支撑构件40推进到组织(诸如小肠壁或gi道的其他部分)中。组织穿透构件40通常将包括空心针或其他类似结构,并且将具有内腔44以及用于穿透到肠壁(iw)中的可选择深度的组织穿透端部45。构件40还可包括用于与本文所述的运动转换器90接合的销41。穿透深度可由构件40的长度、本文所述的运动转换器90的构型以及止动件或凸缘40s在构件40上的放置来控制,在一个实施方案中,该止动件或凸缘可对应于本文所述的销41。药物100通常将通过内腔44递送到组织中。在许多实施方案中,将内腔44用期望的药物100预装填,使用递送构件50或其他推进装置(例如,借助于施加到构件40的可塌缩实施方案的力)来将该期望的药物推出内腔。作为替代方案,可将药物100从胶囊20中的另一位置/隔室推进到内腔44中。在一些实施方案中,组织穿透构件40的全部或一部分可由药物100本身制成。在这些和相关实施方案中,药物可具有被构造成穿透并保留在肠壁(诸如小肠壁)中的针或镖状结构(有
倒钩或没有倒钩)。可根据药物、剂量和期望的肠壁穿透深度来设定镖的尺寸和形状。可使用制药领域已知的各种压缩模制方法将药物100形成为镖、丸粒或其他形状。
133.在各种实施方案中,装置10可包括第二42和第三43组织穿透构件40,如图7a和7b的实施方案中所示,它们具有设想的附加编号。每个组织穿透构件40可用于递送相同或不同的药物100。在优选实施方案中,组织穿透构件40可基本上对称地分布在胶囊20的周界21周围,以便在递送药物100期间将胶囊锚固到肠壁(iw)上。以这种方式锚固胶囊20降低了胶囊因在药物递送期间发生的蠕动收缩而移位或移动的可能性。在具体实施方案中,可将锚固力的量调节为在小肠蠕动收缩期间施加的典型力。可通过将组织穿透构件40中的一些或全部构造成具有弯曲或弓形形状进一步促进锚固。
134.递送构件50被构造成将药物100推进通过组织穿透构件内腔44并进入肠壁(iw)。因此,递送构件50的至少一部分可在组织穿透构件内腔44内推进,因此构件50具有被构造成适配在递送构件内腔44内的尺寸和形状(例如,活塞状形状)。
135.在一些实施方案中,递送构件的远侧端部50d(推进到组织中的端部)可具有柱塞元件51,该柱塞元件推进组织穿透构件内腔44内的药物并且还与内腔形成密封。柱塞元件51可以是一体的或附接到递送构件50。优选地,递送构件50被构造成在针内腔44内行进固定距离,以便将固定或计量剂量的药品递送到肠壁(iw)中。这可通过选择以下中的一项或多项来实现:递送构件的直径(例如,直径可以向远侧逐渐变细)、组织穿透构件的直径(可在其远侧端部处变窄)、使用止动件和/或致动机构。然而,在一些实施方案中,可响应于各种因素诸如gi道中的一个或多个感测条件来原位调节构件50的行程或行进距离。可通过使用联接到致动机构60的机电实施方案的逻辑资源29(包括控制器29c)来实现原位调节。这允许可变剂量的药物和/或药物注射到肠壁中的距离的变化。
136.致动机构60可联接到组织穿透构件40或递送构件50中的至少一者。致动机构被构造成将组织穿透构件40推进到肠壁iw中的可选择距离以及推进递送构件以递送药物100,然后从肠壁中撤回组织穿透构件。在各种实施方案中,致动机构60可包括被构造成由释放元件70释放的簧载机构。合适的弹簧80可包括螺旋弹簧(包括圆锥形弹簧)和叶片弹簧,还设想了其他弹簧结构。在特定实施方案中,弹簧80可以是大致锥形的,以将处于压缩状态的弹簧的长度减小到甚至弹簧的压缩长度为约几个线圈(例如,两个或三个)或仅一个线圈的厚度的程度。
137.在特定实施方案中,致动机构60可包括弹簧80、第一运动转换器90和第二运动转换器94以及轨道构件98,如在图2、图4和图8a
‑
8c的实施方案中所示。释放元件70联接到弹簧80以将弹簧保持在压缩状态,使得释放元件的降解释放弹簧。弹簧80可通过闩锁或其他连接元件81联接到释放元件70。第一运动转换器90被构造成转换弹簧80的运动以将组织穿透构件40推进到肠壁或其他组织中或者从肠壁或其他组织中撤回。第二运动转换器94被构造成转换弹簧80的运动以将递送构件50推进到组织穿透构件内腔44中。运动转换器90和94被弹簧推动并沿着适配到转换器90的轨道构件内腔99中的杆或其他轨道构件98行驶。轨道构件98用于引导转换器90的路径。转换器90和94接合组织穿透构件40和/或递送构件50(直接或间接)以产生期望的运动。它们具有被构造成将弹簧80沿其纵向轴线的运动转换成组织穿透构件40和/或递送构件50的正交运动的形状和其他特征,但还设想了在其他方向上的转换。运动转换器可具有楔形、梯形或弯曲形状,还设想了其他形状。在特定实施方案中,
第一运动转换器90可具有梯形形状90t并且包括狭槽93,该狭槽接合组织穿透构件上的销41,该销在狭槽中行驶,如在图2、图3和图4的实施方案中所示。狭槽93也可具有与转换器90的整体形状成镜像或以其他方式对应于转换器的整体形状的梯形形状93t。狭槽93用于在梯形的上坡部分91期间推动组织穿透构件40,然后在下坡部分92期间将其拉回。在一个变型中,运动转换器90和94中的一者或两者可包括凸轮或凸轮状装置(未示出)。凸轮可通过弹簧80转动,以便接合组织穿透和/或递送构件40和50。可使用本领域已知的各种基于mems的方法来制造包括运动转换器90和94在内的机构60的一个或多个部件(以及装置10的其他部件),以便允许选定量的小型化以适配在胶囊10内。同样如本文所述,它们可由本领域已知的各种可生物降解材料形成。
138.在其他变型中,致动机构60还可包括机电装置/机构,诸如螺线管或压电装置。在一个实施方案中,在机构60中使用的压电装置可包括具有非展开和展开状态的成形压电元件。该元件可被构造成在施加电压时进入展开状态,然后在移除电压或发生电压的其他变化时返回到非展开状态。该实施方案和相关实施方案允许致动机构60往复运动,以便推进组织穿透构件然后将其撤回。可使用电池或基于压电的能量转换器来产生压电元件的电压,该能量转换器通过诸如由于胶囊20周围小肠的蠕动收缩而压缩胶囊所发生的机械变形产生电压。基于压电的能量转换器的进一步描述在美国专利申请序列号12/556,524中发现,该专利申请通过引用方式完整并入本文用于所有目的。在一个实施方案中,组织穿透构件40的展开实际上可由小肠的蠕动收缩触发,小肠的蠕动收缩为压电元件提供了产生电压的机械能。
139.释放元件70通常将联接到致动机构60和/或联接到致动机构的弹簧;但是,还设想了其他构型。在优选实施方案中,释放元件70联接到定位在胶囊20内的弹簧80,以便将弹簧保持在压缩状态85,如在图2的实施方案中所示。释放元件70的降解释放弹簧80以致动致动机构60。因此,释放元件70可用作致动器70a(致动器70还可包括弹簧80和机构60的其他元件)。如下文进一步解释,释放元件70/致动器70a具有其中治疗剂制剂100被容纳在胶囊20内的第一构型以及其中治疗剂制剂从胶囊被推进到小肠壁或肠道中的其他腔壁的第二构型。
140.在许多实施方案中,释放元件70包括被构造成在暴露于小肠或大肠中的化学条件(诸如ph)时降解的材料。通常,释放元件70被构造成在暴露于小肠中的选定ph(例如,7.0、7.1、7.2、7.3、7.4、7.5、7.6、8.0或更高)时降解。释放元件还可被构造成在特定ph范围内(诸如7.0至7.5)降解。在特定实施方案中,可针对要递送的特定药品选择释放元件70降解的ph(本文定义为降解ph),以便在小肠中对应于选定ph的位置处释放药品。此外,对于具有多种药物100的装置10的实施方案,该装置可包括被构造成在第一ph下降解的第一释放元件70(联接到用于递送第一药品的致动机构)和被构造成在第二ph下降解的第二释放元件70(联接用于递送第二药品的致动机构)(对于不同数量的药品,设想了额外数量的释放元件)。
141.释放元件70还可被构造成响应于小肠(或其他gi位置)中的其他条件而降解。在特定实施方案中,释放元件70可被构造成响应于小肠流体中的特定化学条件(诸如在摄入膳食(例如,含有脂肪、淀粉或蛋白质的膳食)后发生的那些)而降解。通过这种方式,药物100的释放可与膳食的消化基本上同步或以其他方式时控。
142.设想了各种方法用于释放元件70的生物降解。在特定实施方案中,可通过以下方法中的一种或多种实现释放元件70由于小肠(或gi道中的其他位置)中的一种或多种条件而发生的生物降解:i)选择释放元件的材料,ii)这些材料的交联量;以及iii)释放元件的厚度和其他尺寸。较少量的交联和/或较薄的尺寸可增加降解的速率,反之亦然。用于释放元件的合适材料可包括可生物降解材料,诸如被构造成在暴露于肠中的较高ph时降解的各种肠溶材料。合适的肠溶材料包括但不限于以下物质:邻苯二甲酸乙酸纤维素、偏苯三酸乙酸纤维素、邻苯二甲酸羟丙基甲基纤维素、聚乙酸乙烯邻苯二甲酸酯、羧甲基乙基纤维素、共聚甲基丙烯酸/甲基丙烯酸甲酯以及本领域已知的其他肠溶材料。可使所选的肠溶材料与一种或多种其他聚合物共聚或以其他方式组合,以获得除生物降解之外的许多其他特定材料属性。此类属性可包括但不限于刚度、强度、柔韧性和硬度。
143.在替代性实施方案中,释放元件70可包括膜或塞70p,其适配在引导管30上方或以其他方式阻塞引导管并将组织穿透构件40保持在引导管内。在这些和相关实施方案中,组织穿透构件40联接到簧载致动机构,使得当释放元件充分降解时,它释放组织穿透构件,然后该组织穿透构件弹出引导管以穿透到肠壁中。在其他实施方案中,释放元件70可成形为用作将组织穿透构件40保持就位的闩锁。在这些和相关实施方案中,释放元件可位于胶囊20的外部或内部。在后一种情况下,胶囊20和/或引导管30可被构造成允许肠液进入胶囊内部,以允许释放元件降解。
144.在一些实施方案中,致动机构60可借助于检测小肠中胶囊存在的传感器67(诸如ph传感器68或其他化学传感器)来致动。传感器67然后可向致动机构60或联接到致动机构60的电子控制器29c发送信号以致动该机构。ph传感器68的实施方案可包括基于电极的传感器或者它可以是基于机械的传感器,诸如在暴露于小肠中的选定ph或其他化学条件时收缩或扩张的聚合物。在相关的实施方案中,通过使用来自传感器的扩张或收缩的机械运动,可扩张/可收缩传感器67还可包括致动机构60本身。
145.根据用于检测小肠(或gi道中的其他位置)中的装置的另一个实施方案,传感器67可包括压力/力传感器,诸如应变计,用于检测胶囊20在肠道中的特定位置内经受的蠕动收缩次数(在此类实施方案中,胶囊20的尺寸理想地被设定成在蠕动收缩期间被小肠抓住)。gi道内的不同位置具有不同的蠕动收缩次数。小肠每分钟收缩12至9次,其中频率随肠的长度降低。因此,根据一个或多个实施方案,蠕动收缩次数的检测不仅可用于确定胶囊20是否在小肠中,而且还可用于确定胶囊在肠内的相对位置。在使用中,这些和相关实施方案允许在小肠中的特定位置处释放药物100。
146.作为内部激活药品递送(例如,使用释放元件和/或传感器)的替代或补充,在一些实施方案中,用户可借助于rf装置、磁装置或本领域已知的其他无线信号发送装置从外部激活致动机构60以递送药物100。在这些和相关实施方案中,用户可使用如在图1b的实施方案中所示的手持通信设备13(例如手持rf设备,诸如手机)来发送信号17或从装置10接收信号。在此类实施方案中,可吞咽装置可包括发射器28,诸如rf收发器芯片或其他类似的通信设备/电路。手持设备13可不仅包括信号发送装置,而且还包括用于在装置10处于小肠或gi道中的其他位置时通知用户的装置。后一实施方案可通过使用联接到发射器28的逻辑资源29(例如,处理器29)以在装置处于小肠或其他位置时向用户发出信号(例如,通过发出来自传感器的输入)以进行检测并发信号来实现。逻辑资源29可包括控制器29c(硬件或软件),
以控制该过程的一个或多个方面。同一手持设备还可被构造成在致动机构60已被激活并且所选的药物100被递送时提醒用户(例如,使用处理器29和发射器28)。通过这种方式,向用户提供药物100已被递送的确认。这允许用户服用其他合适的药品/治疗剂以及做出其他相关决定(例如,糖尿病患者是否要吃饭以及应该吃什么食物)。手持设备还可被构造成向可吞咽装置10发送信号以超控致动机构60,从而防止延迟或加速药物100的递送。在使用中,此类实施方案允许用户基于其他症状和/或患者行为(例如,吃饭、决定去睡觉、锻炼等)进行干预,以阻止、延迟或加速药物的递送。用户还可在吞咽胶囊后的选定时间段从外部激活致动机构60。该时间段可与食物通过用户的gi道移动到gi道中的特定位置(诸如小肠)的典型传送时间或传送时间范围相关。
147.在特定实施方案中,胶囊20可包括可生物降解材料的接缝22,这些接缝可控地降解以将胶囊破碎成具有可选择尺寸和形状的胶囊片23,以便于穿过gi道,如图10a和10b的实施方案中所示。接缝22还可包括用于使流体进入接缝以加速生物降解的孔或其他开口22p,如图10的实施方案中所示。用于加速接缝22生物降解的其他手段可包括对接缝施加预应力和/或在接缝中包括穿孔22f,如在图10的实施方案中所示。在其他实施方案中,接缝22可由通过吸收超声能量(例如高频超声(hifu))而容易降解的材料构成和/或具有通过吸收超声能量而容易降解的结构,从而允许使用外部或内窥镜(或其他微创方法)施用的超声将胶囊降解成较小片。
148.接缝22的合适材料可包括本文所述的一种或多种可生物降解材料,诸如plga、乙醇酸等。可使用聚合物领域已知的各种结合方法诸如模制、热熔结等将接缝22附接到胶囊主体20。另外,对于同样由可生物降解材料制成的胶囊20的实施方案,可通过以下中的一项或多项来实现接缝22的更快生物降解:i)由较快的生物降解材料制成接缝,ii)对接缝施加预应力,或iii)对接缝进行穿孔。使用可生物降解接缝22在gi道中产生可吞咽装置的受控降解这一概念也可应用于其他可吞咽装置诸如可吞咽相机(或其他可吞咽成像装置),以促进穿过gi道并降低这种装置卡在gi道中的可能性。因此,可生物降解接缝22的实施方案可适于可吞咽成像和其他可吞咽装置。
149.本发明的另一个方面提供了使用可吞咽药品递送装置10的一个或多个实施方案将药品和其他治疗剂(药物100的形式)递送到gi道的壁中的方法。现在将描述这种方法的示例性实施方案。所述的药品递送实施方案发生在小肠si中。然而,应当理解,这是示例性的并且本发明的实施方案可用于在gi道中的多个位置(包括胃和大肠)递送药品。为了便于讨论,可吞咽药品递送装置10有时在本文中会被称为胶囊。如上所述,在各种实施方案中,可将装置10包装为密封包装12内的套件11,该密封包装包括装置10和一套使用说明15。如果患者正在使用手持设备13,则可指示患者手动或经由位于说明15或包装12上的条形码18(或其他识别标记18)将数据输入设备13中。如果使用条形码,则患者将使用设备13上的条形码阅读器19来扫描条形码。打开包装12、阅读说明15并输入任何所需的数据之后,患者吞咽可吞咽药品递送装置10的实施方案。取决于药品,患者可结合膳食(之前、期间或之后)或生理测量结果来服用装置10。胶囊20的尺寸被设定成穿过gi道并通过蠕动作用穿过患者的胃s并进入小肠si,如在图11的实施方案中所示的装置10中体现。一旦进入小肠,释放元件70就被小肠中的碱性ph(或小肠特有的其他化学或物理条件)降解,从而根据本发明的一个或多个实施方案致动致动机构60并将药物100递送到小肠si的壁中。对于包括空心针或其
他空心组织穿透构件40的实施方案,通过使用致动机构60将针40推进到肠壁is的粘膜中选定距离来实现药物递送,然后通过推进递送构件50通过针内腔40来注射药物。撤回递送构件50,然后将针40撤回到胶囊的主体内(例如,通过弹簧的回弹),从而使其与肠壁分离。对于具有多个针的装置10的实施方案,第二针42或第三针43也可用于递送额外剂量的相同药品或单独药品101。针推进可基本上同时或顺序进行。在使用多个针的优选实施方案中,针推进可基本上同时进行,以便在药品递送期间将装置10锚固在小肠中。
150.在药物递送之后,装置10然后穿过肠道(包括大肠li)并最终被排出。对于具有可生物降解接缝22或其他可生物降解部分的胶囊20的实施方案,胶囊在肠道中被降解成较小片,以促进穿过肠道并从肠道排出,如在图9a和9b的实施方案中所示。在具有可生物降解组织穿透针/构件40的特定实施方案中,如果针卡在肠壁中,则针生物降解,从而从壁上释放胶囊20。
151.对于包括传感器67的装置10的实施方案,可通过传感器向致动机构60和/或联接到致动机构的处理器29/控制器29c发送信号来实现机构60的致动。对于包括外部致动能力的装置10的实施方案,用户可在吞咽胶囊之后的选定时间段从外部激活致动机构60。该时间段可与食物通过用户的gi道移动到gi道中的特定位置(诸如小肠)的典型传送时间或传送时间范围相关。
152.上述方法的一个或多个实施方案可用于递送包含治疗有效量的多种药品和其他治疗剂101的制剂100以治疗多种疾病和病症。这些包括原本由于在胃中化学分解而需要注射的许多大分子肽和蛋白质。可根据患者的体重、年龄或其他参数来滴定特定药品的剂量。而且,当通过本发明的一个或多个实施方案递送时实现期望效果或治疗效果的药品101(例如,用于血糖调节的胰岛素)的剂量可小于如果通过常规口服递送方式(例如,在胃中消化并通过小肠壁、胃或gi道中的其他位置吸收的可吞咽丸剂)递送药品所需的量。这是因为药品不会被胃中的酸和其他消化液降解,而且全部而不是仅一部分药品被递送到小肠壁(或肠道中的其他内腔,例如大肠、胃等)。取决于药品101,在制剂100中递送的剂量102可在通过常规口服递送(例如,丸剂)递送的剂量的100%至5%的范围内,以实现期望的治疗效果(例如,血糖调节、癫痫调节等),设想了甚至更低的量。可基于特定药品、要治疗的病症以及患者的体重、年龄和病症来滴定特定的剂量减少。对于一些药品(在肠道中的降解水平已知),可采用标准的剂量减少(例如,10%至20%)。对于更容易降解和吸收不良的药品,可使用更大量的剂量减少。通过这种方式,可减少由装置10递送的一种或多种特定药品的潜在毒性和其他副作用(例如,胃痉挛、肠易激、出血等),因为摄入剂量降低。这反过来又提高了患者的依从性,因为患者的副作用的严重性和发生率都降低。采用药品101的剂量减少的实施方案的额外益处包括降低患者对药品产生耐受性(需要更高剂量)的可能性,以及在抗生素的情况下,降低患者产生耐药菌株的可能性。而且,对于经历胃旁路手术以及小肠的部分已被切除或其工作(例如消化)长度被有效缩短的其他手术的患者,可实现其他水平的剂量减少。
153.除了递送单一药品之外,可吞咽药品递送装置10及其使用方法的实施方案可用于递送多种药品以治疗多种病症或用于治疗特定病症(例如,蛋白酶抑制剂以治疗hiv aids)。在使用中,此类实施方案允许患者放弃必须针对一个或多个特定病症服用多种药物的必要性。而且,它们提供了一种用于促进两种或多种药品方案在大约相同的时间被递送
并吸收到小肠(因此血流)中的手段。由于化学成分、分子量等的不同,药品可以不同的速率通过肠壁被吸收,从而产生不同的药代动力学分布曲线。本发明的实施方案通过基本上同时注射期望的药品混合物来解决这个问题。这进而提高了药代动力学,因此提高了所选药品混合物的功效。另外,消除服用多种药品的需要对患有一种或多种长期慢性病的患者(包括认知或身体能力受损的患者)特别有益。
154.在各种应用中,上述方法的实施方案可用于递送包括药品和治疗剂101的制剂100,以提供对多种医学病症和疾病的治疗。可用本发明的实施方案治疗的医学病症和疾病可包括但不限于:癌症、激素病症(例如,甲状腺功能减退/甲状腺功能亢进、生长激素病症)、骨质疏松症、高血压、胆固醇和甘油三酯升高、糖尿病和其他葡萄糖调节障碍、感染(局部或败血症)、癫痫症和其他癫痫病、骨质疏松症、冠状动脉心律失常(房性和室性)、冠状动脉缺血性贫血或其他类似病症。还设想了其他病症和疾病。
155.在许多实施方案中,可无需注射药品或其他治疗剂(或其他非口服递送形式,诸如栓剂)而是仅依赖于递送到小肠壁或gi道的其他部分的治疗剂来进行特定疾病或病症的治疗。类似地,患者不需要服用常规口服形式的药品或其他治疗剂,而是同样仅依赖于使用可吞咽胶囊的实施方案递送到小肠壁中。在其他实施方案中,递送到小肠壁(或其他gi道器官壁)中的治疗剂可结合注射剂量的药剂一起递送。例如,患者可使用可吞咽胶囊的实施方案服用每日剂量的治疗剂,但仅需要每隔几天或当患者的病情需要(例如,高血糖)时服用注射剂量。对于传统上以口服形式递送的治疗剂也是如此(例如,患者可服用可吞咽胶囊并根据需要服用常规口服形式的药剂)。可根据需要滴定在此类实施方案中递送的剂量(例如,吞咽和注射的剂量)(例如,使用标准剂量反应曲线和其他药代动力学方法可用于确定合适的剂量)。而且,对于使用可通过常规口服方式递送的治疗剂的实施方案,可将使用可吞咽胶囊的实施方案递送的剂量滴定至低于通常针对口服递送药剂给出的剂量,因为药剂在胃或肠道的其他部分中具有很少或没有降解(本文同样可应用标准剂量反应曲线和其他药代动力学方法)。
156.现在将参考剂量描述用于治疗各种疾病和病症的包含一种或多种药品或其他治疗剂101的制剂100的各组实施方案。应当理解,包括特定治疗剂和相应剂量的这些实施方案是示例性的,并且制剂100可包含本文所述的许多其他治疗剂(以及本领域已知的那些),这些治疗剂被构造用于使用装置10的各种实施方案递送到肠道中的腔壁(例如,小肠壁)或周围组织(例如,腹膜腔)中。剂量可大于或小于所述的那些,并且可使用本文所述或本领域已知的一种或多种方法进行调节。在一组实施方案中,治疗剂制剂100可包含治疗有效剂量的胰岛素,用于治疗糖尿病和其他葡萄糖调节障碍。胰岛素可以是人的或合成来源的,如本领域所已知的。在一个实施方案中,制剂100可含有约1
‑
10个单位范围(特定范围为2
‑
4、3
‑
9、4
‑
9、5
‑
8或6
‑
7)内的治疗有效量的胰岛素(一个单位是约45.5μg纯结晶胰岛素的生物学当量)。还设想了更大的范围,诸如1至25个单位或1
‑
50个单位。可基于以下因子(本文中为“葡萄糖控制滴定因子”)中的一个或多个来滴定制剂中胰岛素的量:i)患者的病症(例如,1型与ii型糖尿病);ii)患者以前的总体血糖控制水平;iii)患者的体重;iv)患者的年龄;v)剂量的频率(例如,一天一次与多次);vi)一天中的时间(例如,早上与晚上);vii)特定餐点(早餐与晚餐);vii)特定餐点的含量/血糖指数(例如,高脂肪/脂质和糖含量(例如,引起血糖迅速上升的食物)与低脂肪和糖含量);以及viii)患者的整体饮食含量(例如,每天消耗
的糖和其他碳水化合物、脂质和蛋白质的量)。在使用中,包括胰岛素或者用于治疗糖尿病或其他血糖障碍的其他治疗剂的治疗制剂100的各种实施方案允许通过递送更精确控制剂量的胰岛素来改进对血糖水平的控制,而不需要患者自己注射。而且,患者可在进食的同时吞下装置诸如可吞咽装置10或110(含有胰岛素和/或用于治疗糖尿病的其他治疗剂),从而在食物中的葡萄糖或其他糖从小肠释放到血流中时,胰岛素或其他治疗剂从小肠释放到血流中。这种同时或以其他方式在时间上接近的释放允许胰岛素作用于各种受体(例如,胰岛素受体),以在血糖水平由于糖从小肠吸收到血液中而开始升高时增加肌肉和其他组织对葡萄糖的摄取。
157.在另一组实施方案中,治疗剂制剂100可包含治疗有效剂量的一种或多种肠降血糖素,用于治疗糖尿病和其他葡萄糖调节障碍。此类肠降血糖素可包括胰高血糖素样肽1(glp
‑
1)及其类似物以及胃抑制肽(gip)。合适的glp
‑
1类似物包括艾塞那肽、利拉鲁肽、阿必鲁肽和他司鲁泰以及它们的类似物、衍生物和其他功能等效物。在一个实施方案中,制剂100可包含约1
‑
10μg范围内的治疗有效量的艾塞那肽,其中特定范围分别为2
‑
4、4
‑
6、4
‑
8和8
‑
10μg。在另一个实施方案中,制剂100可包含约1
‑
2mg(毫克)范围内的治疗有效量的利拉鲁肽,其中特定范围分别为1.0至1.4、1.2至1.6和1.2至1.8mg。可应用葡萄糖控制滴定因子中的一个或多个来滴定艾塞那肽、利拉鲁肽或其他glp
‑
1类似物或肠降血糖素的剂量范围。
158.在另一组实施方案中,治疗剂制剂100可包含治疗剂的组合,用于治疗糖尿病和其他葡萄糖调节障碍。这种组合的实施方案可包括例如治疗有效剂量的肠降血糖素和双胍化合物。肠降血糖素可包括本文所述的一种或多种glp
‑
1类似物,诸如艾塞那肽,并且双胍可包括二甲双胍(例如,可以由merck sant
é
s.a.s.制造的商标获得)及其类似物、衍生物和其他功能等效物。在一个实施方案中,制剂100可包含约1
‑
10μg范围内的治疗有效量的艾塞那肽和约1
‑
3g范围内的治疗有效量的二甲双胍的组合。还利用用于滴定艾塞那肽(或其他肠降血糖素)和二甲双胍或其他双胍的相应剂量的一个或多个葡萄糖控制滴定因子设想了更小和更大的范围。另外,可将艾塞那肽或其他肠降血糖素和二甲双胍或其他双胍的剂量匹配至改善的患者血糖控制水平(例如,血糖维持在正常生理水平内和/或高血糖和/或低血糖情况的发生率和严重程度降低)持续几小时(例如,12小时)至一天至多天的延长时间,设想了更长的时间。剂量的匹配也可通过使用葡萄糖控制调节因子以及使用糖基化血红蛋白(称为血红蛋白a1c、hba1c、a1c或hb1c)和其他分析物以及与长期平均血糖水平相关的测量结果来长时间监测患者的血糖来实现。
159.可采用和/或修改已知药品递送系统的药品递送组成和组分以用于本文所述的本发明的一些实施方案中。例如,可修改用于用药品贴剂通过皮肤表面递送药品的微针和其他微结构并将其包含在本文所述的胶囊内,并用于将药品制剂递送到胃肠道的腔壁(诸如小肠壁)中。合适的聚合物微针结构可从加利福尼亚州的corium商购获得,诸如microcor
tm
微递送系统技术。还可将microcor
tm
贴剂递送系统(包括药品制剂或组分)的其他组分掺入本文所述的胶囊中。替代性地,可从多个供应商商购获得以配制聚合物或其他药品递送基质与选定药品和其他药品制剂组分的组合,以产生具有理想的药品释放特性的期望形状(诸如本文所述的可释放组织穿透形状)。例如,这些供应商可包括corium、明尼苏达州的surmodics、新加坡的biosensors international等。
160.本文所述的治疗组合物的各种实施方案的一个优点和特征在于保护生物药品有
效载荷(例如治疗肽或蛋白质,例如igg和其他抗体、基础胰岛素和其他类型的胰岛素等)免于通过胃肠(gi)道中的肽酶和蛋白酶的作用而降解和水解。这些酶在整个生命系统中无处不在。gi道尤其富含蛋白酶,其功能是将饮食中的复杂蛋白质和肽分解成较小段,并释放氨基酸,然后氨基酸从肠道吸收。本文所述的组合物被设计成保护治疗肽或蛋白质免受这些gi蛋白酶的作用的影响并将肽或蛋白质有效载荷直接递送到肠壁中。在本文所述的用于保护蛋白质或肽有效载荷免受gi蛋白酶的作用的影响的组合物的各种实施方案中存在两个特征。首先,在某些实施方案中,包含展开引擎和机器的胶囊壳直到其到达十二指肠和十二指肠下段才溶解,这是由于胶囊外表面上的ph敏感性涂层可防止其在胃的低ph下溶解。其次,在某些实施方案中,空心麦芽糖(或其他合适的聚合物)微矛包含实际的治疗肽或蛋白质;麦芽糖(或其他聚合物)微矛被设计成胶囊外壳一溶解就穿透肠肌;并且微矛本身缓慢溶解在肠肌壁中以释放药品有效载荷。因此,肽或蛋白质有效载荷不会暴露于gi蛋白酶的作用,因此不会经由gi道中的蛋白水解进行降解。该特征进而有助于治疗肽或蛋白质的高生物利用度百分比。
161.如上所述,本文所述的实施方案包括包含胰岛素的治疗组合物,用于治疗各种障碍,诸如糖尿病或其他葡萄糖调节障碍。此类组合物使得递送具有理想的药代动力学特性的胰岛素。就这一点而言,值得注意的药代动力学度量包括c
max
,即施用后胰岛素的峰值血浆浓度;tmax,达到c
max
的时间;以及t
1/2
,胰岛素的血浆浓度在达到c
max
后达到其c
max
值的一半所需的时间。可使用本领域已知的标准药代动力学测量技术来测量这些度量。在一种方法中,可在开始和通过使用可吞咽装置或通过非血管注射(例如,皮下注射)施用治疗组合物之后以设定的时间间隔(例如,一分钟、五分钟、1/2小时、1小时等)采集血浆样本。然后可使用一种或多种合适的分析方法(诸如可适于特定药品的gc
‑
质谱、lc
‑
质谱、hplc或各种elisa(酶联免疫吸附测定))来测量血浆中胰岛素的浓度。然后可使用来自血浆样本的测量结果来产生浓度与时间曲线(也称为浓度分布)。浓度曲线的峰值对应于c
max
,并且出现这种情况的时间对应于t
max
。曲线中浓度在达到其最大值(即c
max
)后达到c
max
的一半的时间对应于t
1/2
,该值也称为治疗剂的消除半衰期。用于确定c
max
的开始时间可基于对非血管注射情况进行注射的时间和可吞咽装置的实施方案将一个或多个组织穿透构件(含有药品)推进到小肠或gi道中的其他位置(例如,大肠)中的时间点。在后一种情况下,该时间可使用一种或多种手段确定,包括可吞咽装置的远程控制实施方案,该可吞咽装置响应于外部控制信号(例如,rf信号)而将组织穿透构件展开到肠壁和/或周围组织中,或(对于可吞咽装置的实施方案)在组织穿透构件已经展开时发送rf或其他可在体外检测到的信号。设想了用于检测组织穿透构件展开到小肠中的其他手段,诸如一种或多种医学成像方式,包括例如超声或荧光透视。在这些研究中的任何一项中,可使用合适的动物模型(例如,狗、猪、大鼠等)来模拟人药代动力学反应。
162.本文所述的实施方案包括包含胰岛素的治疗组合物,用于治疗糖尿病或其他葡萄糖调节障碍。此类组合物使得递送具有理想的药代动力学特性的胰岛素。就这一点而言,值得注意的药代动力学度量包括c
max
,即施用后药品的峰值血浆浓度;tmax,达到c
max
的时间;以及t
1/2
,药品的血浆浓度达到其初始值的一半所需的时间。
163.因此,一个实施方案提供了一种包含胰岛素的治疗组合物,该组合物适于在口服摄入后插入胃肠壁(例如,小肠)中,其中在插入后,该组合物将胰岛素从肠壁释放到血流
中,以比血管外注射剂量的胰岛素更快地达到c
max
。在各种实施方案中,治疗胰岛素组合物具有为血管外注射剂量的胰岛素的t
max
的约80%或50%或30%或20%或10%的t
max
。这种血管外注射剂量的胰岛素可以是例如皮下注射或肌内注射。在某些实施方案中,通过将治疗胰岛素组合物插入肠壁(例如,小肠壁)进行递送而获得的c
max
比当口服递送组合物而不插入肠壁中时获得的c
max
大得多,诸如大100或50或10或5倍。在一些实施方案中,治疗胰岛素组合物被构造成产生长期胰岛素释放,诸如具有可选择的t
1/2
的长期胰岛素释放。例如,可选择的t
1/2
可为6或9或12或15或18或24小时。
164.本文所述的各种实施方案提供了一种包含胰岛素的治疗剂组合物(本文也称为制剂或组合物)。组合物适于在口服摄入后插入肠壁中,其中在插入后,该组合物将胰岛素从肠壁释放到血液中,以比血管外注射剂量的治疗剂更快地达到c
max
,也就是说,使插入形式的治疗剂比血管外注射的治疗剂剂量在更短的时间段(例如,更小的t
max
)内达到c
max
。注意,递送到肠壁中的组合物中治疗剂的剂量和通过血管外注射递送的剂量可但不必相当以实现这些结果。在各种实施方案中,组合物被构造成实现为血管外注射剂量的胰岛素的t
max
的约80%或50%或30%或20%或10%的胰岛素的(例如,通过将胰岛素从肠壁(例如小肠壁)释放到血流中)t
max
。这种血管外注射剂量的胰岛素可以是例如皮下注射或肌内注射。在某些实施方案中,通过将治疗剂插入肠壁中进行递送而获得的c
max
比当口服递送治疗剂而不插入肠壁中(例如,通过治疗剂或相关化合物的丸剂或其他常规口服形式)时获得的c
max
大得多,诸如大5、10、20、30、40、50、60、70、80或甚至100倍。在一些实施方案中,治疗胰岛素组合物被构造成产生长期胰岛素释放。而且,该组合物可被构造成产生具有可选择的t
1/2
的长期胰岛素释放。例如,可选择的t
1/2
可为6或9或12或15或18或24小时。
165.在一些实施方案中,治疗剂组合物还可包括治疗有效剂量的肠降血糖素,用于治疗糖尿病或葡萄糖调节障碍。可使用的肠降血糖素包括胰高血糖素样肽
‑
1(glp
‑
1)、glp
‑
1类似物或胃抑制肽(gip)。示例性glp
‑
1类似物包括艾塞那肽、利拉鲁肽、阿必鲁肽和他司鲁泰。可使用任何合适剂量的肠降血糖素;例如,可以约1至10微克范围内的剂量使用艾塞那肽;或者可以约1至2mg范围内的剂量使用利拉鲁肽。
166.各种实施方案还提供了适于在口服摄入后插入胃肠壁(例如小肠或胃壁)中的胰岛素组合物,其中在插入后,该组合物将治疗剂从肠壁释放到血流中,以实现比未插入肠壁中的治疗剂的口服摄入剂量的t
1/2
更大的t
1/2
。例如,插入肠壁中的剂量的t
1/2
可比未插入肠壁中的剂量大100或50或10或5倍。
167.胰岛素组合物可为固体形式,诸如被构造成在肠壁中降解的固体形式组合物,并且该固体形式组合物可具有例如组织穿透特征,诸如尖头尖端。胰岛素组合物可包含至少一种可生物降解材料,并且/或者可包含至少一种药物赋形剂,包括可生物降解聚合物诸如plga或糖诸如麦芽糖。
168.胰岛素组合物可适于在可吞咽胶囊中口服递送。在某些实施方案中,这种可吞咽胶囊可适于可操作地联接到具有第一构型和第二构型的机构,治疗胰岛素组合物在第一构型中被容纳在胶囊内,并且在第二构型中被推出胶囊并被推进到肠壁中。这种可操作地联接的机构可包括可扩张构件、可扩张球囊、阀、组织穿透构件、联接到可扩张球囊的阀或联接到可扩张球囊的组织穿透构件中的至少一种。
169.一些实施方案中,胰岛素组合物可被构造成在组织穿透构件的内腔或其他腔内递
送,并且/或者治疗组合物可被成形为可推进到肠壁中的组织穿透构件。组织穿透构件的尺寸可被设定成完全包含在肠壁内,并且/或者它可包括用于穿透肠壁的组织穿透特征,并且/或者它可包括用于将组织穿透构件保持在肠壁内的保持特征。保持特征可包括例如倒钩。在一些实施方案中,组织穿透构件被构造成通过向组织穿透构件的表面施加力而被推进到肠壁中,并且任选地,组织穿透构件具有足够的刚度以被完全推进到肠壁中,并且/或者穿透构件的表面被构造成可操作地联接到在扩张时施加力的可扩张球囊,并且/或者组织穿透构件被构造成当力的方向改变时从施加力的结构分离。
170.除了上述那些实施方案之外,本发明的各个方面还提供了用于递送药物100的可吞咽递送装置的其他实施方案。根据一个或多个此类实施方案,吞咽递送装置可包括一个或多个可扩张球囊或其他可扩张装置,用于将一个或多个包含药物100的组织穿透构件递送到肠(诸如小肠)壁中。现在参考图12
‑
20,用于将药物100递送到胃肠(gi)道中的递送部位ds的装置110的另一个实施方案可包括将被吞咽并穿过肠道的胶囊120、展开构件130、一个或多个包含药物100的组织穿透构件140、可展开对齐器160和递送机构170。在一些实施方案中,药物100(在本文中也称为制剂100)本身可包括组织穿透构件140。可展开对齐器160定位在胶囊内,并且被构造成将胶囊与肠诸如小肠对齐。通常,这将使胶囊的纵向轴线与肠的纵向轴线对齐;但是,还设想了其他对齐。递送机构170被构造用于将药物100递送到肠壁中,并且通常将包括递送构件172,诸如可扩张构件。展开构件130被构造用于展开对齐器160或递送机构170中的至少一者。如本文将进一步描述,胶囊壁的全部或一部分可通过与gi道中的液体接触而降解,从而允许这些液体触发装置110递送药物100。如本文所用,“gi道”是指食道、胃、小肠、大肠和肛门,而“肠道”是指小肠和大肠。本发明的各种实施方案可被构造和布置用于将药物100递送到肠道以及整个gi道中。
171.包括组织穿透构件140的装置110可被构造用于递送液体、半液体或固体形式的药物100或所有这三种的组合。无论为何种形式,药物100理想地具有允许药物被推出装置110进入肠壁(例如,小肠或大肠)或gi道中的其他腔壁然后在肠壁内降解以释放药品或其他治疗剂101的材料一致性。药物100的材料一致性可包括制剂(在体液中)的硬度、孔隙率和溶解度中的一种或多种。材料一致性可通过选择和使用以下中的一项或多项实现:i)用于制备制剂的压实力;ii)使用本领域已知的一种或多种药物崩解剂;iii)使用其他药物赋形剂;iv)制剂的粒度和分布(例如,微粉化颗粒);以及v)使用本领域已知的微粉化和其他颗粒形成方法。
172.胶囊120的尺寸被设定成被吞咽并穿过肠道。可根据要递送的药品量以及患者的体重和成人与儿科应用对尺寸进行调节。通常,胶囊将具有管状形状,其弯曲端部类似于维生素或胶囊形状。在这些和相关实施方案中,胶囊长度120l可在0.5至2英寸的范围内,直径120d可在0.1至0.5英寸的范围内,设想了其他尺寸。胶囊120包括胶囊壁121w,具有外表面125以及限定内部空间或体积124v的内表面124。在一些实施方案中,胶囊壁121w可包括一个或多个开孔126,这些开孔的尺寸被设定用于向外推进组织穿透构件140。除了装置110的其他部件(例如,可扩张构件等)外,内部体积还可包括一个或多个隔室或贮存器127。
173.胶囊可由制药领域已知的各种可生物降解明胶材料制成,但也可包括各种肠溶衣120c,这些肠溶衣被构造成保护帽以免在胃中降解(由于酸等),然后在小肠或肠道的其他区域中发现的较高ph下降解。在各种实施方案中,胶囊120可由多个部分形成,这些部分中
的一个或多个可以是可生物降解的。在许多实施方案中,胶囊120可由两个部分120p诸如主体部分120p”(本文的主体120p”)和帽部分120p’(本文的帽120p)形成,其中帽适配到主体上,例如通过在主体上方或下方滑动(还设想了其他布置)。一个部分诸如帽120p'的可包括被构造成在第一ph(例如,ph 5.5)以上降解的第一涂层120c’,并且第二部分诸如主体120p”可包括被构造成在第二较高ph值(例如,6.5)以上降解的第二涂层120c”。胶囊120的内表面124和外表面125都涂覆有涂层120c'和120c”,使得胶囊的任一部分都将被基本上保存,直到它接触具有选定ph的流体。对于主体120p”的情况,这允许保持主体120p”的结构完整性,以将球囊172保持在主体部分内并且直到球囊130已经扩张才展开。涂层120c’和120c”可包括各种基于甲基丙烯酸酯和丙烯酸乙酯的涂层,诸如evonik industries以商标名eudragit制造的那些。胶囊120的这些和其他双涂层构造允许胶囊120的一部分中的机构在胶囊的另一部分中的机构之前被致动。这是因为肠液将首先进入较低ph涂层已降解的那些部分,从而致动对此类流体有反应的触发器(例如,可降解阀)。在使用中,胶囊120的此类双涂层实施方案提供了药品到小肠中的特定位置(或gi道中的其他位置)的靶向递送,以及递送过程中改善的可靠性。这是因为特定部件(诸如对齐器160)的展开可被构造成在小肠的上部区域(例如十二指肠)中开始,从而允许胶囊在肠内对齐以最佳地递送药品(例如,递送到肠壁中),以及提供足够的时间来展开/致动其他部件以实现药品到肠壁中的递送,同时胶囊仍在小肠中或其他选定位置。
174.如上所讨论的,胶囊120的一个或多个部分可由本领域已知的各种生物相容性聚合物(包括各种可生物降解聚合物,其在优选实施方案中可包括纤维素、明胶材料plga(聚乳酸
‑
共
‑
乙醇酸))制成。其他合适的可生物降解材料包括本文所述的各种肠溶材料以及丙交酯、乙交酯、乳酸、乙醇酸、对二氧环己酮、己内酯、三亚甲基碳酸酯、己内酯以及它们的共混物和共聚物。
175.在各种实施方案中,胶囊的壁120w可通过与gi道中的液体(例如,小肠中的液体)接触而降解。在优选实施方案中,胶囊壁被构造成在穿过胃期间保持完整,但然后在小肠中降解。在一个或多个实施方案中,这可通过在胶囊壁120w上使用外部涂层或层120c来实现,该外部涂层或层仅在小肠中发现的较高ph下降解,并用于在胶囊到达小肠(此时药品递送过程由如本文所述的涂层的降解启动)之前保护下面的胶囊壁以免在胃内降解。在使用中,此类涂层允许在肠道的选定部分(诸如小肠)中靶向递送治疗剂。
176.类似于胶囊20,在各种实施方案中,胶囊120可包括各种不透射线材料、回波材料或其他材料,用于使用一种或多种医学成像方式(诸如荧光透视、超声、mri等)来定位装置。
177.如本文进一步讨论,在许多实施方案中,展开构件130、递送构件172或可展开对齐器160中的一者或多者可对应于形状和尺寸被设定成适配在胶囊120内的可扩张球囊。因此,为了便于讨论,展开构件130、递送构件172和可展开对齐器160现在将被称为球囊130、160和172;然而,应当理解,还设想了包括各种可扩张装置在内的其他装置用于这些元件,并且这些装置可包括例如各种形状记忆装置(例如,由形状记忆可生物降解聚合物尖顶制成的可扩张篮)、可扩张压电装置和/或具有对应于胶囊120的内部体积124v的扩张形状和尺寸的化学可扩张装置。
178.球囊130、160和172中的一者或多者可包含医疗设备领域已知的各种聚合物。在优选实施方案中,此类聚合物可包括一种或多种类型的聚乙烯(pe),其可对应于低密度pe
(ldpe)、线性低密度pe(lldpe)、中密度pe(mdpe)和高密度pe(hdpe)以及本领域已知的其他形式的聚乙烯。在使用聚乙烯的一个或多个实施方案中,可使用本领域已知的聚合物辐射方法使材料交联。在特定实施方案中,基于辐射的交联可用于通过降低球囊材料的顺应性来控制球囊的膨胀直径和形状。可选择辐射的量以实现特定量的交联,进而为给定的球囊产生特定量的顺应性,例如,可使用增加的辐射来产生更硬的顺应性较低的球囊材料。其他合适的聚合物可包括pet(聚乙烯对苯二甲酸酯)、有机硅和聚氨酯。在各种实施方案中,球囊130、160和172还可包括本领域已知的各种不透射线材料诸如硫酸钡,以允许医生确定球囊的位置和物理状态(例如,未膨胀、膨胀或刺穿)。可使用球囊导管领域已知的各种球囊吹制方法(例如,模具吹制、自由吹制等)将球囊130、160和172制造成具有大约对应于胶囊120的内部体积124v的形状和尺寸。在各种实施方案中,球囊130、160和172中的一个或多个以及各种连接特征(例如,连接管)可具有由单个模具形成的整体结构。采用这种整体结构的实施方案提供了改善的可制造性和可靠性的益处,因为必须在装置110的一个或多个部件之间制造更少的接头。
179.球囊130、160和172的合适形状包括具有锥形或弯曲端部的各种圆柱形状(这种形状的示例包括热狗)。在一些实施方案中,球囊130、160和172中的一个或多个的膨胀尺寸(例如,直径)可大于胶囊120,从而使胶囊脱离膨胀力(例如,由于环向应力)。在其他相关实施方案中,球囊130、160和172中的一个或多个的膨胀尺寸可使得当膨胀时:i)胶囊120与小肠壁充分接触,以引起蠕动收缩,使胶囊周围的小肠收缩,并且/或者ii)允许抹去小肠的褶皱。这两个结果都允许改善胶囊/球囊表面与肠壁之间的接触,以便在胶囊和/或递送球囊172的选定区域上方递送组织穿透构件40。理想地,球囊130、160和172的壁将很薄,并且可具有0.005英寸至0.0001英寸范围内、更优选0.005英寸至0.0001英寸范围内(具体实施方案为0.004、0.003、0.002、0.001和0.0005)的壁厚。另外,在各种实施方案中,球囊130、160或172中的一个或多个可具有嵌套球囊构造,其具有膨胀室160ic和延伸指状物160ef,如在图13c的实施方案中所示。连接膨胀室160ic的连接管163可以很窄以仅允许气体168通过,而联接球囊130的两半的连接管36可以较大以允许水通过。
180.如上所述,对齐器160通常将包括可扩张球囊,并且为了便于讨论,现在将被称为对齐器球囊160或球囊160。可使用上述材料和方法制造球囊160。它具有未扩张和扩张状态(也称为展开状态)。在其扩张或展开状态下,球囊160使胶囊120的长度延伸,使得由小肠si的蠕动收缩施加在胶囊120上的力用于将胶囊120的纵向轴线120la以平行方式与小肠si的纵向轴线lai对齐。这进而用于将组织穿透构件140的轴以垂直方式与肠壁iw的表面对齐,以增强和优化组织穿透构件140穿透到肠壁iw中。除了用于在小肠中对齐胶囊120外,对齐器160还被构造成在递送球囊172膨胀之前将递送机构170推出胶囊120,使得递送球囊和/或机构不被胶囊阻碍。在使用中,对齐器160的这种推出功能改善了治疗剂递送的可靠性,因为在可发生药品递送之前不必等待胶囊的特定部分(例如,覆盖递送机构的那些部分)降解。
181.球囊160可借助于聚合物管或其他流体联接件162(其可包括用于联接球囊160和130的管163和用于联接球囊160和172的管164)流体联接到装置110的一个或多个部件,包括球囊130和172。管163被构造成允许球囊160通过来自球囊130的压力(例如,化学反应物的混合物在球囊130内产生的压力)扩张/膨胀和/或以其他方式允许液体在球囊130与160
之间通过以引发用于使球囊130和160中的一个或两个膨胀的气体产生化学反应。管164将球囊160连接到172,以允许通过球囊160使球囊172膨胀。在许多实施方案中,管164包括或联接到控制阀155,该控制阀被构造成在选定压力下打开,以便控制通过球囊160使球囊172膨胀。因此,管164可包括连接到阀的近侧部分164p以及从阀引出的远侧部分164d。通常,近侧部分164p和远侧部分164d将连接到阀壳体158,如下所述。
182.阀155可包括材料157的三角形或其他形状的节段156,该节段放置在阀壳体158的室158c内(另选地,它可直接放置在管道164内)。节段157被构造成在选定压力下机械降解(例如,撕裂、剪切、分层等),以允许气体通过管164和/或阀室158c。阀155的合适材料157可包括蜂蜡或其他形式的蜡以及医学领域已知的具有可选择的密封力/爆破压力的各种粘合剂。阀配件158通常将包括较薄的圆柱形隔室(由可生物降解材料制成),材料157的节段156放置在该隔室中(如在图13b的实施方案中所示),以便将室158c的壁密封在一起或以其他方式阻碍流体通过该室。阀155的释放压力可通过选择节段156的尺寸和形状中的一者或多者以及选择材料157(例如,诸如粘合强度、剪切强度等的特性)来控制。在使用中,控制阀155允许球囊160和172依次膨胀,使得球囊160在球囊172膨胀之前完全或以其他方式基本上膨胀。这进而允许球囊160在球囊172膨胀之前将球囊172连同递送机构170的其余部分一起推出胶囊120(通常从主体部分120p’推出),使得组织穿透构件140的展开不被胶囊120阻碍。在使用中,这种方法在实现期望的穿透深度和递送包含在胶囊120中的更多数量的穿透构件140方面都改善了组织穿透构件140穿透到肠壁iw中的可靠性,因为这些构件推进到肠壁iw中不被胶囊壁120w阻碍。
183.如上所述,对齐器球囊160的膨胀长度160l足以使胶囊120由于肠的蠕动收缩而变得与小肠的横向轴线对齐。对齐器160的合适的膨胀长度160l可包括在对齐器160膨胀之前介于胶囊120的长度120l的约1/2至两倍之间的范围。对齐器球囊160的合适形状可包括各种细长形状,诸如类似热狗的形状。在具体实施方案中,球囊160可包括第一节段160’和第二节段160”,其中第一节段160’的扩张被构造成将递送机构170推出胶囊120(通常从主体部分推出),并且第二节段160”用于使递送球囊172膨胀。在这些和相关的实施方案中,第一节段160'和第二节段160“可被构造成具有套筒式膨胀,其中第一节段160’首先膨胀以将机构170推出胶囊(通常从主体部分120p’推出),并且第二节段160”膨胀以使递送构件172膨胀。这可通过将第一节段160’构造成具有比第二节段160”更小的直径和体积来实现,使得第一节段160’首先膨胀(由于其体积较小),第二节段160”直到第一节段60’已经基本上膨胀才膨胀。在一个实施方案中,这可通过使用连接节段160’和160”的控制阀155(如上所述)来促进,该控制阀直到在节段160’中达到最小压力才允许气体进入节段160”。在一些实施方案中,对齐器球囊可包含化学反应物,这些化学反应物在与来自展开球囊的水或其他液体混合时反应。
184.在许多实施方案中,展开构件130将包括可扩张球囊,称为展开球囊130。在各种实施方案中,展开球囊30被构造成通过使用气体(例如,由化学物质产生气体169)来促进对齐器球囊160的展开/扩张。气体可通过固体化学反应物165(诸如酸166(例如柠檬酸)和碱166(例如碳酸氢钾、碳酸氢钠等),然后将它们与水或其他含水液体168混合)的反应产生。可以使用化学计量方法选择反应物的量,以在球囊130、160和72中的一个或多个中产生选定的压力。反应物165和液体可单独储存在球囊130和160中,然后响应触发事件(诸如小肠中的
ph条件)而聚集在一起。反应物165和液体168可储存在任一球囊中,然而在优选实施方案中,液体168储存在球囊130中,而反应物165储存在球囊160中。为了允许液体168通过以开始反应和/或产生气体169,球囊130可借助于连接器管163联接到对齐器球囊160,该连接器管通常还包括分离装置150,诸如可降解阀150,如下所述。对于其中球囊130包含液体的实施方案,管163具有足够的直径以允许足够的水从球囊130进入球囊60,以产生期望量的气体来使球囊160以及球囊172膨胀。而且,当球囊130包含液体时,球囊30和管63中的一者或两者被构造成允许液体通过以下一种或多种方式进入球囊160:i)通过小肠在暴露的球囊130上的蠕动收缩而施加到球囊130的压缩力;以及ii)通过毛细管作用将液体芯吸通过管163。
185.管163通常将包括可降解的分离阀或其他分离装置150,该分离装置将球囊130的内容物(例如,水158)与球囊160的内容物(例如,反应物165)分离,直到阀降解。阀150可由诸如麦芽糖的材料制成,该材料可被液态水降解,使得阀在暴露于水以及消化道中的各种液体时打开。它还可由可响应于在肠液中发现较高ph而降解的材料(诸如基于甲基丙烯酸酯的涂层)制成。阀理想地定位在管163上的某一位置,该位置突出到球囊130上方和/或以其他方式充分暴露,使得当帽120p’降解时,阀150暴露于进入胶囊的肠液。在各种实施方案中,阀150可定位成位于球囊130的表面上或甚至突出到其上方(如在图16a和16b的实施方案中所示),使得一旦帽120p'降解,它就清晰地暴露于肠液。本发明的各种实施方案提供了用于分离阀150的多种结构,例如梁状结构(其中阀包括向下压在管163和/或连接节段136上的梁)或套环型结构(其中阀包括位于管163和/或连接节段136上方的套环)。还设想了其他阀结构。
186.球囊130具有展开和非展开状态。在展开状态下,展开球囊130可具有对应于胶囊的端部形状的圆顶形状130d。还设想了展开球囊130的其他形状130s,诸如球形、管形等。反应物165通常将包括至少两种反应物166和167,例如酸(诸如柠檬酸)和碱(诸如碳酸氢钠)。还设想了其他反应物165,包括其他酸(例如乙酸)和碱(例如氢氧化钠)。当阀或其他分离装置150打开后,反应物在液体中混合并产生气体诸如二氧化碳,该气体使对齐器球囊160或其他可扩张构件膨胀。
187.在图13b所示的替代性实施方案中,展开球囊130实际上可包括由管36或其他连接装置136(例如,连接节段)连接的第一球囊130'和第二球囊130”。连接管136通常将包括分离阀150,该分离阀可被如上所述的液体和/或具有特定ph(例如,在小肠中发现的碱性ph(例如,5.5或6.5))的液体降解。两个球囊130’和130”可各自具有半圆顶形状130hs,从而允许它们在扩张状态时适配到胶囊的端部部分中。一个球囊可包含化学反应物165(例如,碳酸氢钠、柠檬酸等),另一个可包含其他液态水168,使得当阀被降解时,这两种成分混合形成气体,该气体使一个或两个球囊130'和130”膨胀,进而使对齐器球囊160膨胀。
188.在又一个替代性实施方案中,球囊130可包括多隔室球囊130mc,其被形成为或以其他方式被构造成具有多个隔室130c。通常,隔室130c将至少包括第一隔室134和第二隔室135,它们被分离阀150或其他分离装置150分开,如在图14a的实施方案中所示。在许多实施方案中,隔室134和135将在它们之间具有至少一个小连接节段136,分离阀150通常将放置在该连接节段处。液体168(通常为水)可设置在第一隔室134内,并且一种或多种反应物165设置在第二隔室135中(它们通常为固体,但也可使用液体),如在图14a的实施方案中所示。
当阀150打开(例如,由于小肠内的流体引起的降解)时,液体168进入隔室135(反之亦然,或者两种情况),反应物165与液体混合并产生气体169(诸如二氧化碳),该气体扩张球囊130,进而可用于扩张球囊160和172中的一个或多个。
189.反应物165通常将至少包括第一反应物166和第二反应物167,例如酸(诸如柠檬酸)和碱(诸如碳酸氢钠或碳酸氢钾)。如本文所讨论,在各种实施方案中,它们可放置在球囊130(包括隔室134和135或半部130'和130”)和球囊160中的一个或多个中。还设想了另外的反应物,包括产生惰性气体副产物的酸和碱的其他组合。对于使用柠檬酸和碳酸氢钠或碳酸氢钾的实施方案,两种反应物(例如,柠檬酸与碳酸氢钾)之间的比率可在约1:1至约1:4的范围内,具体比率为约1:3。理想地,固体反应物165具有很少或没有吸收的水。因此,反应物(诸如碳酸氢钠或碳酸氢钾)中的一种或多种可在放置在球囊130内之前预先干燥(例如,通过真空干燥)。还设想了其他反应物165,包括其他酸(例如乙酸)和碱。可使用特定化学反应的已知化学计量方程以及球囊的膨胀体积和理想气体定律(例如,pv=nrt)来选择特定反应物165(包括反应物的组合)的量,以产生特定压力。在特定实施方案中,可选择反应物的量,以为球囊130、160和172中的一个或多个产生选定压力,从而:i)实现进入肠壁中的特定穿透深度;为球囊130、160和172中的一个或多个产生特定直径;并且iii)对肠壁iw施加选定量的力。在特定实施方案中,可选择反应物(例如,柠檬酸和碳酸氢钾)的量和比率,以在球囊130、160和172中的一个或多个中实现10至15psi范围内的压力,设想了更小和更大的压力。同样可使用已知的化学计量方程来确定实现这些压力的反应物的量和比率。
190.在使用化学反应物165来产生气体169的本发明的各种实施方案中,单独的化学反应物或与展开球囊130组合的化学反应物可包括用于展开对齐器球囊160和包括递送球囊172的递送机构170中的一者或两者的展开引擎180。展开引擎180还可包括使用两个展开球囊130和130”(如图13b所示的双圆顶构型)或如图14a所示的多隔室球囊130mc。本发明的各种实施方案还设想了其他形式的展开引擎180,诸如使用可扩张压电材料(通过施加电压而扩张)、弹簧和其他形状记忆材料以及各种可热扩张材料。
191.可扩张球囊130、160和172中的一个或多个通常还将包括放气阀159,该放气阀用于在膨胀后使球囊放气。放气阀159可包括可生物降解材料,该可生物降解材料被构造成在暴露于小肠中的流体和/或球囊的其中一个隔室中的液体时降解,以便在特定球囊内形成用于气体逸出的开口或通道。理想地,放气阀159被构造成以比阀150更慢的速率降解,以允许在放气阀降解之前有足够的时间使球囊130、160和172膨胀。在隔室化球囊130的各种实施方案中,放气阀159可对应于定位在球囊的端部部分131上的可降解节段139,如在图14a的实施方案中所示。在该实施方案和相关实施方案中,当可降解节段139因暴露于液体而降解时,球囊壁132撕裂或以其他方式分开,从而提供快速放气的高度保证。多个可降解节段139可放置在球囊壁132内的不同位置。
192.在球囊172的各种实施方案中,放气阀159可对应于附接到递送球囊172的端部172e(与联接到对齐器球囊的端部相对)的管阀173,如在图13b的实施方案中所示。管阀173包括具有内腔的空心管173t,该内腔在选定位置173l处被材料173m(诸如麦芽糖)阻塞,该材料在暴露于流体(诸如小肠中的流体)时降解。管173t中的阻塞材料173m的位置173l被选择成在阻塞材料溶解以打开阀173之前为递送球囊172提供足够的时间以使组织穿透构件40膨胀并将其递送到肠壁iw中。通常,这将靠近但不完全在管173t的端部173e,以便允许液
体在到达材料173m之前有时间芯吸到管内腔中。根据一个或多个实施方案,一旦放气阀173打开,它不仅用于使递送球囊172放气,而且使对齐器球囊160和展开球囊130放气,因为在许多实施方案中,所有三个球囊都是流体连接的(对齐器球囊流体连接到递送球囊172,并且展开球囊130连接到对齐器球囊160)。放气阀173的打开可通过将其放置在递送球囊172的端部172e上来促进,该端部通过准器球囊160的膨胀而被迫离开胶囊120,使得放气阀良好地暴露于小肠中的液体。类似的管放气阀173也可定位在对齐器球囊162和展开球囊130中的一者或两者上。在这些后两种情况下,管阀中的阻塞材料可被构造成在一段时间内降解,以允许有足够的时间使递送球囊172膨胀并将组织穿透构件140推进到肠壁中。
193.另外,作为保险放气的进一步支持,一个或多个穿刺元件182可附接到胶囊的内表面124,使得当球囊(例如,球囊130、160、172)完全膨胀时,它接触穿刺元件182并被该穿刺元件刺穿。穿刺元件182可包括来自表面124的具有尖头尖端的短突起。在用于球囊放气的装置的另一个替代性或附加实施方案中,组织穿透构件140中的一个或多个可直接连接到球囊172的壁172w并且被构造成当它们分离时从球囊撕开,从而在该过程中撕裂球囊壁。
194.现在将讨论组织穿透构件140。组织穿透构件140可由各种药品和其他治疗剂101、一种或多种药物赋形剂(例如,崩解剂、稳定剂等)和一种或多种可生物降解聚合物制成。可选择后面的材料以赋予穿透构件期望的结构和材料特性(例如,用于插入肠壁中的柱强度,或用于控制药品释放的孔隙率和亲水性)。现在参考图18a
‑
18f,在许多实施方案中,穿透构件140可被形成为具有轴144和针尖端145或其他尖头尖端145,以便容易地穿透肠壁的组织,如在图18a的实施方案中所示。在优选实施方案中,尖端145具有套管针形状,如在图18c的实施方案中所示。尖端145可包括各种可降解材料(在尖端的主体内或作为涂层),诸如蔗糖或增加尖端的硬度和组织穿透特性的其他糖。一旦放置在肠壁中,穿透构件140就被壁组织内的间质液降解,使得药品或其他治疗剂101溶解在那些流体中并被吸收到血流中。可选择组织穿透构件140的尺寸、形状和化学组成中的一者或多者,以允许药品101在大约几秒、几分钟或甚至几小时内溶解和吸收。在特定实施方案中,溶解速率可通过使用制药领域已知的各种崩解剂来控制。崩解剂的示例包括但不限于各种淀粉(诸如羟基乙酸淀粉钠)和各种交联聚合物(诸如羧甲基纤维素)。崩解剂的选择可针对小肠壁内的环境进行具体调节。
195.组织穿透构件140通常还将包括一个或多个组织保持特征143(诸如倒钩或钩),以在推进后将穿透构件保持在肠壁iw组织或周围组织(例如,腹膜壁)内。保持特征143可以各种图案143p布置以增强组织保持,诸如两个或更多个倒钩对称地或以其他方式围绕并沿着构件轴144分布,如在图18a和18b的实施方案中所示。另外,在许多实施方案中,穿透构件还将包括用于附接到递送机构170上的联接部件的凹槽或其他配合特征146。
196.组织穿透构件140理想地被构造成可拆卸地联接到平台175(或递送机构170的其他部件),使得在组织穿透构件140推进到肠壁中之后,穿透构件与球囊分离。可拆卸性可通过多种方式实现,包括:i)平台175中的开口174与构件轴144之间的紧贴或配合;ii)组织保持特征143在穿透构件140上的构造和放置;以及iii)轴144穿透到肠壁中的深度。使用这些因素中的一个或多个,穿透构件140被构造成由于球囊放气(其中当球囊放气或以其他方式从肠壁拉回时,保持特征143将穿透构件140保持在组织中)和/或通过小肠的蠕动收缩施加在胶囊120上的力而分离。
197.在一个具体实施方案中,组织穿透构件140在肠壁iw或周围组织(例如,腹膜壁)中
的可拆卸性和保持可通过将组织穿透构件轴144构造成具有如图18c的实施方案中所示的倒锥体144t来增强。轴144上的锥体144t被构造成使得从肠壁在轴上施加蠕动收缩力导致轴被迫向内(例如,向内挤压)。这是由于轴锥体144t将横向施加的蠕动力pf转换成正交力of,该正交力的作用是迫使轴向内进入肠壁。在使用中,这种倒锥形轴构造用于将组织穿透构件140保持在肠壁内,以便在球囊172放气时与平台175(或递送机构170的其他部件)分离。在附加实施方案中,具有倒锥形轴的组织穿透构件140还可包括一个或多个保持特征143,以进一步增强组织穿透构件在插入后在肠壁iw内的保持。
198.如上所述,在各种实施方案中,组织穿透构件140可由多种药品和其他治疗剂101(包括各种抗体,诸如igg)制成。同样根据一个或多个实施方案,组织穿透构件可完全由药品/治疗剂101制成或者也可具有其他组成组分,例如各种药物赋形剂(例如,粘结剂、防腐剂、崩解剂等)、赋予期望的机械性能的聚合物等。此外,在各种实施方案中,一个或多个组织穿透构件140可携带与其他组织穿透构件相同或不同的药品101(或其他治疗剂)。前一种构造允许递送较大量的特定药品101,而后一种构造允许大约同时将两种或多种不同的药品递送到肠壁中,以有利于需要大量同时递送多种药品的药品治疗方案。在具有多个递送组件178(例如,两个,球囊172的每个面上一个)的装置110的实施方案中,第一组件178’可携带具有第一药品101的组织穿透构件,并且第二组件178”可携带具有第二药品101的组织穿透构件。
199.通常,由组织穿透构件140携带的药品或其他治疗剂101将与可生物降解材料105混合以形成组织穿透构件140。材料105可包括一种或多种可生物降解聚合物(诸如plga、纤维素)以及糖(诸如麦芽糖)或者本文所述或本领域已知的其他可生物降解材料。在此类实施方案中,穿透构件140可包括药品101和可生物降解材料105的基本上不均匀的混合物。替代性地,组织穿透构件140可包括基本上由可生物降解材料105形成的部分141以及由药品101形成或包含该药品的单独节段142,如在图18d的实施方案中所示。在一个或多个实施方案中,节段142可对应于药品101的丸粒、小块、圆柱或其他成形节段142s。可将成形节段142s预先形成为单独节段,然后将其插入组织穿透构件140中的腔142c中,如在图18e和18f的实施方案中所示。替代性地,可通过将药品制剂100添加到腔142c中来形成节段142s。在将药品制剂100添加到腔142c中的实施方案中,可以粉末、液体或凝胶的形式添加制剂,将其倾倒或注射到腔142c中。成形节段142s可由药品101本身或包含药品101和一种或多种粘结剂、防腐剂、崩解剂和其他赋形剂的药品制剂形成。合适的粘结剂包括聚乙二醇(peg)和本领域已知的其他粘结剂。在各种实施方案中,peg或其他粘结剂可占节段142s的约10%至90%重量百分比范围,胰岛素制剂的优选实施方案为约25%至90%重量百分比。可用于粘结剂的其他赋形剂可包括pla、plga、环糊精、纤维素、甲基纤维素、麦芽糖、糊精、蔗糖和pga。关于节段142中赋形剂的重量百分比的进一步信息可在表1中找到。为了便于讨论,节段142在表中称为丸粒,但是表中的数据也适用于本文所述的节段142的其他实施方案。
200.在各种实施方案中,组织穿透构件140的重量可在约10mg至15mg的范围内,设想了更大和更小的重量。对于由麦芽糖制成的组织穿透构件140的实施方案,重量可在约11mg至14mg的范围内。在各种实施方案中,取决于药品101和期望的递送剂量,构件140中药品的重量百分比可在约0.1%至约15%的范围内。在示例性实施方案中,这些重量百分比对应于由麦芽糖或plga制成的构件140的实施方案,但是它们也适用于制造构件140中所用的任何可
生物降解材料105。可根据期望的剂量调节构件140中药品或其他治疗剂101的重量百分比,以提供药品的结构和化学计量稳定性,以及在血液或其他身体组织中达到期望的药品浓度分布。可使用本领域已知的各种稳定性测试和模型(例如,使用阿伦尼乌斯方程)和/或已知的药品化学降解速率来在重量百分比范围内进行具体调节。表1列出了胰岛素的剂量和重量百分比范围以及可由组织穿透构件140递送的其他药品的数量。在一些情况下,该表列出了剂量的范围以及单个值。应当理解,这些值是示例性的,并且还考虑了本文(包括权利要求书)引用的其他值。此外,本发明的实施方案还考虑了围绕这些值的变化,包括例如
±
1、
±
5、
±
10、
±
25甚至更大的变化。此类变化被认为落入要求保护特定值或值范围的实施方案的范围内。该表还列出了节段142中各种药品和其他治疗剂的药品重量百分比,其中同样为了便于讨论,节段142被称为丸粒。同样,本发明的实施方案考虑了上述变化。
201.表1
[0202][0203][0204]
可使用本领域已知的一种或多种聚合物和药物制造技术来制造组织穿透构件140。例如,药品101(具有或不具有可生物降解材料105)可为固体形式,然后使用模制、压实或其他类似方法并添加一种或多种粘结剂将其形成为组织穿透构件140的形状。替代性地,药品101和/或药品制剂100可为固体或液体形式,然后将其添加到液体形式的可生物降解材料105中,然后使用模制或聚合物领域已知的其他成型方法将该混合物形成为穿透构件140。
[0205]
理想地,在不产生药品(包括诸如各种肽和蛋白质的药品)的任何实质性热降解的温度下形成包括药品或其他治疗剂101和可降解材料105的组织穿透构件140的多个实施方案。这可通过使用本领域已知的室温固化聚合物和室温模制和溶剂蒸发技术来实现。在特定实施方案中,组织穿透构件内热降解药品或其他治疗剂的量理想地小于约10重量%,并且更优选地小于5%,并且还更优选地小于1%。特定药品的热降解温度是已知的或可使用本领域已知的方法确定,然后该温度可用于选择和调节特定聚合物加工方法(例如,模制、固化、溶剂蒸发方法等),以使温度和相关的药品热降解水平最低。
[0206]
将提供对递送机构170的描述。通常,该机构将包括附接到递送球囊172的递送组
件178(包含组织穿透构件140),如在图16a和16b的实施方案中所示。递送球囊的膨胀提供了用于使递送组件172从胶囊向外接合并进入肠壁iw中以便将组织穿透构件140插入壁中的机械力。在各种实施方案中,递送球囊172可具有细长形状,其中两个相对平坦的面172f由铰接的手风琴状主体172b连接。平面172f可被构造成在球囊172扩张时压靠肠壁(iw),以便将组织穿透构件(tpm)140插入肠壁中。tpm 140(本身或作为下面描述的递送组件178的一部分)可定位在球囊172的一个或两个面172f上,以允许在肠壁的相对侧上插入含有tpm 40的药品。球囊172的面172f可具有足够的表面积以允许在每个面上放置多个含有药品的tpm 140。
[0207]
现在参考图19,现在将提供对递送组件178的组装的描述。在第一步骤300中,可将一个或多个组织穿透构件140可拆卸地联接到可生物降解推进结构175,该推进结构可对应于支撑平台175(也称为平台175)。在优选实施方案中,平台175包括一个或多个开口174,用于插入构件140,如步骤300所示。开口174的尺寸被设定成允许在球囊172扩张之前将构件140插入和保持在平台175中,同时允许它们在它们穿透到肠壁中后从平台脱离。然后,可将支撑平台175定位在携带结构176内,如步骤301所示。携带结构176可对应于具有限定腔或开口176c的侧壁176s和底壁176b的阱结构176。理想地使用粘合剂或本领域已知的其他结合方法将平台175附接到底壁176b的内表面。阱结构176可包括各种聚合物材料并且可使用聚合物加工领域已知的真空成型技术形成。在许多实施方案中,可用保护膜177覆盖开口176o,如步骤302所示。保护膜177具有被选择用作屏障的特性,以保护组织穿透构件140免受湿度和氧化的影响,同时仍允许组织穿透构件140穿透膜,如下文所述。膜177可包含各种水和/或不透氧的聚合物,这些聚合物理想地被构造成可在小肠中生物降解和/或惰性地穿过消化道。它还可具有多层结构,其中选择特定层对于给定的物质(例如,氧气、水蒸气等)是不透的。在使用中,采用保护膜177的实施方案用于增加治疗剂101在组织穿透构件140中的保质期,进而增加装置110的保质期。共同地,附接到组织穿透构件140的支撑平台175、阱结构176和膜177可构成递送组件178。可预先制造、储存具有容纳在组织穿透构件40或其他药品递送装置内的一种或多种药品或治疗剂101的递送组件178,随后将其用于在以后制造装置110。可通过用惰性气体诸如氮气填充密封组件178的腔176c来进一步增加组件178的保质期。
[0208]
再次参考图16a和16b,组件178可定位在球囊172的一个或两个面172f上。在优选实施方案中,组件178定位在两个面172f(如图16a所示)上,以便在球囊172的扩张时向肠壁iw的相对侧提供基本上相等的力分布。可使用粘合剂或聚合物领域已知的其他结合方法将组件178附接到面172f。在球囊172扩张时,tpm 140穿透膜177,进入肠壁iw,并通过保持元件143和/或tpm 140的其他保持特征(例如,倒锥形轴144t)保持在那里,使得它们在球囊172放气时与平台175分离。
[0209]
在各种实施方案中,可将球囊130、160和172中的一个或多个以折叠、卷起或其他期望的构型装填在胶囊120内,以节省胶囊的内部体积124v内的空间。可使用预先形成的折痕或医疗球囊领域已知的其他折叠特征或方法进行折叠。在特定实施方案中,可以选定取向折叠球囊130、160和172以实现以下一项或多项:i)节省空间,ii)产生特定膨胀球囊的期望取向;以及iii)有利于期望的球囊膨胀顺序。图15a
‑
15f所示的实施方案示出了折叠方法和各种折叠布置的实施方案。然而,应当理解,这种折叠布置和由此产生的球囊取向是示例
性的,也可使用其他布置。在该实施方案和相关实施方案中,可手动、通过自动机器或两者结合进行折叠。同样在许多实施方案中,可通过使用包括球囊130、160、170、阀室158和各种连接管162的单个多球囊组件7(本文为组件7)来促进折叠,如在图13a和13b的实施方案中所示。图13a示出了具有球囊130的单个圆顶结构的组件7的实施方案,而图13b示出了具有球囊130的双球囊/圆顶构造的组件7的实施方案。组件7可使用聚合物薄膜制成,使用各种真空成型和聚合物加工领域已知的其他相关方法将该聚合物薄膜真空成型为期望的形状。合适的聚合物膜包括厚度在约0.003至约0.010英寸范围内(具体实施方案为0.005英寸)的聚乙烯膜。在优选实施方案中,该组件被制造成具有整体结构,从而消除了结合组件的一个或多个部件(例如,球囊130、160等)的需要。然而,还设想了组件7由多个部分(例如,半部)或部件(例如,球囊)制成,然后使用聚合物/医疗设备领域已知的各种结合方法将它们结合起来。
[0210]
现在参考图15a
‑
15f、16a
‑
16b和17a
‑
17b,在第一折叠步骤210中,将球囊160折叠到阀配件158上,在该过程中将球囊172翻转到阀配件158的相对侧(见图15a)。然后在步骤211中,与球囊160和阀158的折叠组合成直角折叠球囊172(见图15b)。然后,在球囊130的双圆顶实施方案的步骤212中,将球囊130的两个半部130’和130”折叠到彼此上,从而使阀150暴露(见图15c,对于球囊130的单圆顶实施方案,将其折叠到本身上,见图15e)。可进行最终折叠步骤213,由此将折叠的球囊130折叠180
°
到阀配件158和球囊160的相对侧,以产生用于图15e所示的双圆顶构造的最终折叠组件8以及用于图15e和15f所示的单圆顶构造的最终折叠组件8’。然后在步骤214中将一个或多个递送组件178附接到组件8(通常为球囊72的两个面72f),以产生最终组件9(如图16a和16b的实施方案所示),然后将其插入胶囊120中。在插入步骤215之后,具有插入组件9的装置110的最终组装版本在图17a和17b中示出。
[0211]
现在参考图20a
‑
20i,将提供对使用装置110将药物101递送到gi道中的部位(诸如小肠壁或大肠壁)的方法的描述。应当理解,这些步骤及其顺序是示例性的,并且还设想了其他步骤和顺序。在装置110进入小肠si之后,帽涂层120c’被上部小肠中的碱性ph降低,从而导致帽120p’的降解,如图20b中的步骤400中所示。然后将阀150暴露于小肠中的流体,从而导致阀开始降解,如图20c中的步骤401所示。然后,在步骤402中,球囊130扩张(由于气体169的产生),如图20d所示。然后,在步骤403中,球囊160的节段160’开始扩张以开始将组件178推出胶囊主体,如图20e所示。然后,在步骤404中,球囊160的节段160’和160”变得完全膨胀以将组件178完全推出胶囊主体,从而使胶囊长度120l延伸,以便用于将胶囊横向轴线120al与小肠的横向轴线lai对齐,如图20f所示。在此期间,阀155开始因球囊60中增加的压力而失效(由于球囊已经完全膨胀并且气体169没有其他地方可去的事实)。然后,在步骤405中,阀155已经完全打开,从而使球囊172膨胀,然后该球囊将现在完全暴露的组件178(已经被完全推出主体120p”)径向向外推进到肠壁iw中,如图20g所示。然后,在步骤406中,球囊172继续扩张,现在将组织穿透构件推进到肠壁iw中,如图20h所示。然后,在步骤407中,球囊172(连同球囊160和130)已经放气,从而拉回并且使组织穿透构件保持在肠壁iw中。而且,胶囊的主体部分120p”已经与装置110的其他可生物降解部分一起完全降解(由于涂层120c”的降解)。任何未降解的部分由于消化产生的蠕动收缩通过小肠向远侧携带并最终被排出。
[0212]
本发明的药代动力学特征和参数
[0213]
现在参考图21
‑
29,现在将呈现对与本发明的方法和其他实施方案相关的各种药代动力学参数和特征的讨论。具体地,本发明的各种实施方案提供了治疗制剂以及用于将治疗剂递送到gi道的各种腔壁(包括胃壁、肠壁(例如,小肠)或周围组织(例如,腹膜))中的相关方法,其中可实现一个或多个递送药代动力学参数。此类参数可包括但不限于如药代动力学/制药领域已知的绝对生物利用度、相对生物利用度、t
max
、t
1/2
、c
max
和曲线下面积或auc中的一个或多个。“绝对生物利用度”是指相对于静脉内(iv)剂量,制剂中到达体循环的药品量,其中假定iv剂量为100%生物利用度。“相对生物利用度”是指相对于静脉内(iv)剂量,制剂中到达体循环的药品量,t
max
是治疗剂在血流中达到其最大浓度c
max
的时间段,并且t
1/2
是治疗剂在血流(或身体其他位置)中的浓度在达到c
max
后达到其初始c
max
值的一半所需的时间段。
[0214]
实施例1(包括图21
‑
25)提供了药代动力学数据和其他结果,其示出了使用包含igg的治疗制剂(使用本文所述的可吞咽胶囊的实施方案递送给犬)的实施方案来实现上述参数中的一个或多个。如实施例1所示,在治疗制剂包含抗体诸如igg的各种实施方案中,由本发明的实施方案递送的治疗剂的绝对生物利用度可在约50%至68.3%的范围内,具体值为60.7%。还设想了其他值。而且,用于递送抗体例如igg的t
max
可为约24小时,而t
1/2
可在约40.7小时至128小时的范围内,具体值为约87.7小时。
[0215]
现在参考图21,在各种实施方案中,治疗制剂以及用于将它们递送到小肠壁或周围组织中的相关方法可被构造成产生具有以c
max 205或t
max 206或其他药代动力学值作为参考点207的选定形状203的治疗剂的血浆/血液浓度与时间分布200。例如,如图21所示,血浆浓度与时间分布200可具有上升部分210和下降部分220,上升部分210与下降部分220的时间长度具有选定比率。在具体实施方案中,这是在上升部分期间从治疗剂的递送前浓度204到c
max
水平205(该时间对应于t
max
时间206)所花的时间208(也被描述为上升时间208)与在下降部分210期间从c
max
水平205回到递送前浓度204所花的时间209(也被描述为下降时间209)的比率。在各种实施方案中,上升时间208与下降时间209的比率可在约1比20、1比10和1比5的范围内。在包含抗体诸如igg的治疗制剂的具体实施方案中,分布200中上升时间与下降时间的比率可为约1比9,如图21和22所示。设想了其他比率。然而,对于包括重组人胰岛素在内的各种类型的胰岛素,上升时间与下降时间的比率可在约1比2至1比6的范围内,具体实施方案为1:4、1:4.5和1:6。
[0216]
实施例3(包括表8和9以及图26
‑
29)提供了药代动力学和药效学数据和其他结果,其示出了使用包含重组人胰岛素(rhi)的治疗制剂(使用本文所述的可吞咽胶囊的实施方案空肠内递送给猪)来实现上述参数中的一个或多个。如实施例3所述并且如附图所示,在其中治疗制剂包含重组人胰岛素(rhi)的实施方案中,通过可吞咽胶囊的实施方案空肠内递送rhi(rani组)的t
max
为约139
±
42分钟,而皮下注射(sc组)为227
±
24分钟,同时rani和sc组的rhi的平均峰值血清浓度(cmax)分别为516
±
109pm.8和342
±
50pm。当考虑到动物的平均体重和递送的胰岛素的平均单位时,这相当于458pm/kg体重/iu递送的胰岛素剂量。此外,当考虑到该值的相应单位的所有标准误差时,该度量的值范围相当于381至527pm/kg体重/iu递送的胰岛素剂量。对于rani和sc组,使用本文所述的正常血糖钳夹方法获得的胰岛素浓度曲线下面积分别为81
±
10和83
±
18nm/min。这使得相对于通过皮下注射递送的剂量,通过可吞咽胶囊的实施方案空肠内递送的胰岛素的相对生物利用度在72%至129%的
范围内(平均值为104%)。同样,对于rani和sc组,使用正常血糖钳夹方法的血糖输注曲线下面积分别为85
±
4和106
±
10g/min
2。
这些auc值的可比性说明了通过本发明的实施方案(rani组)空肠内递送的胰岛素的血糖降低效果与经由皮下注射递送的胰岛素所达到的效果相当。此外,正常血糖钳夹实验证明了可吞咽胶囊的实施方案能够以将血糖水平维持在60
‑
90mg/ml范围内的方式空肠内递送胰岛素。
[0217]
实施例4(包括表10
‑
11)提供了一项试点irb(研究审查委员会)研究的结果,该研究在10名禁食和10名餐后健康人类志愿者中进行,以检查在有或没有微针或药品有效载荷的情况下施用但确实具有本文所述的基于球囊的展开机构的可吞咽胶囊(ranipill胶囊)的实施方案的耐受性和安全性。胶囊被设计成如本文所述在小肠中对齐和展开,例如机构中的一个或多个球囊在小肠中扩张并展开。它还含有不透射线材料,从而允许:i)在患者的gi道中定位胶囊位置;以及ii)胶囊在小肠内展开,包括胶囊内的可扩张球囊在小肠内扩张并展开。这之后的时间(本文定义为胶囊展开时间或展开时间(也被描述为胶囊激活时间或激活时间))是从胶囊离开胃到随后在小肠中展开之间的时间。使用连续放射摄影成像来确定胶囊在胃中的停留时间和在小肠内的展开时间。胃停留时间和展开时间日期在表10
‑
11中示出。胶囊的平均胃停留时间在餐后状态下为217
±
36分钟,在禁食状态下为100
±
79分钟。两组胶囊的肠道展开时间非常相似(100
±
40分钟与97
±
30分钟)。结果令人惊讶地表明,胶囊展开(包括胶囊展开时间)不受gi道(包括患者的胃和小肠中的一者或两者)中食物存在的明显影响。如本文所用,关于胶囊展开或激活时间,明显影响意味着展开/激活时间的差异小于约20%,更优选地小于约10%,并且还更优选地小于约5%。
[0218]
结果还表明,没有受试者察觉到胶囊的传送、展开或排出,并且所有受试者均顺利排出胶囊残余物,这在胶囊摄入后72
‑
96小时内通过放射摄影证实。具体地,当胶囊的基于球囊的展开机构在小肠中扩张并展开时,没有受试者察觉。
[0219]
结论
[0220]
已经出于说明和描述的目的呈现了对本发明的各种实施方案的前述描述。它并非旨在将本发明限于所公开的精确形式。许多修改、变化和改进对于本领域技术人员来说将是显而易见的。例如,该装置的实施方案可被设定成尺寸和其他方面适于各种儿科和新生儿应用以及各种兽医应用。而且,本领域技术人员将认识到或能够仅使用常规实验来确定本文所述的特定装置和方法的许多等效物。这种效物被认为是在本发明的范围内并且由以下所附权利要求覆盖。
[0221]
来自一个实施方案的要素、特性或动作可容易地重组或用来自其他实施方案的一个或多个要素、特性或动作替换,以形成本发明范围内的许多附加实施方案。此外,被示出或描述为与其他要素组合的要素在各种实施方案中可作为独立要素存在。此外,本发明的实施方案还设想了排除或否定引用要素、特征、化学物、治疗剂、特性、值或步骤,无论在哪里肯定引用所述要素、特征、化学物、治疗剂、特性、值、步骤等。因此,本发明的范围不限于所描述的实施方案的详情,而是仅由所附权利要求限制。
[0222]
实施例
[0223]
参考以下实施例进一步说明本发明的各种实施方案。应当理解,仅出于说明的目的呈现这些实施例,并且本发明不限于其中的信息或细节。
[0224]
实施例1:使用可吞咽胶囊的实施方案递送igg的犬体内研究
[0225]
目的:研究目的是通过本文所述的可吞咽胶囊(也称为ranipill
tm
或ranipill)的实施方案和/或变型在清醒的狗中证明生物治疗分子的口服递送,并评估它们的绝对生物利用度。将人免疫球蛋白g(igg抗体)用作这类分子的代表。
[0226]
材料
[0227]
纯化人igg从美国德克萨斯州的alpha diagnostic international inc.(adi inc.)获得(目录号20007
‑1‑
100),并用于制备本研究中的供试品。igg微片由含有90%(w/w)纯化人igg和10%(w/w)赋形剂的干粉配制批次制备。基于elisa评估的物理特性和蛋白质回收率的接受标准对igg批次进行分析和鉴定。
[0228]
ranipill
tm
胶囊由有效载荷室的多项性能测试制造和鉴定,以评估针展开的压力和速度。另外,进行测试以确定峰值化学反应压力,以建立足够的气压以确保针递送。这些测试验证装置的展开可靠性。当前研究中所用的胶囊批次通过了所有合格测试。本研究中所用的所有供试品及其相应的id号在表2中列出。
[0229]
表2.供试品信息
[0230][0231]
研究方案
[0232]
该研究最初在测试组(即rani组)中进行,其中动物接受由ranipill的实施方案递送的igg,并在10天的时间内收集血液样本。基于该初始经验,随后增加两个另外的组iv(静脉内施用igg)和sc(皮下施用igg),并延长方案持续时间。下面更详细地描述每个组的具体方案。
[0233]
rani组:口服施用一粒ranipill
tm
胶囊(2.4mg igg/微片);n=3。这是要给药的初始组,并在10天内收集血液样本。随后的药品水平分析表明,研究持续时间可能太短,因为所有动物的血清igg浓度尚未完全恢复到基线水平。因此,对于接下来的2组,将收集血液样本的方案延长至14天。
[0234]
sc组:将一片igg微片(2.4mg igg/微片)溶解在1ml注射用无菌水中并皮下施用(sc);n=2
[0235]
iv组:将纯人igg冻干粉(2.4mg igg)溶解在1ml注射用无菌水中并静脉内施用(iv);n=3
[0236]
每组所用的受试者和测试材料的详细信息在表3
‑
5中总结。基于微片重量和微片中igg的百分比计算sc和rani组中向每只动物施用的总igg剂量。在给药前将纯人igg和微片溶解大约30分钟。rani组口服接受一粒胶囊,并通过荧光透视进行监测以确认成功传送到小肠中以及装置展开的时间。
[0237]
表3.rani组的动物和测试材料数据
[0238]
动物id号动物体重(kg)施用的igg剂量(mg)
31075678.12.3331124047.82.3032811338.92.38平均值
±
sd8.1
±
0.042.34
±
0.04
[0239]
表4.sc组的动物和测试材料数据
[0240]
动物id号动物体重(kg)施用的igg剂量(mg)30482428.42.3932836328.42.34平均值
±
sd8.4
±
0.02.37
±
0.04
[0241]
表5.iv组的动物和测试材料数据
[0242]
动物id号动物体重(kg)施用的igg剂量(mg)25071548.72.3929289749.62.4031332238.42.39平均值
±
sd8.3
±
0.62.40
±
0.003
[0243]
结果
[0244]
将对照(iv和sc)组和实验(rani)组动物的血清igg浓度水平相对于时间作图,并在图22
‑
25中示出,图23示出了iv递送的结果,图24示出了sc递送的结果,图25示出了使用ranipill的实施方案进行递送的结果,并且图22示出了所有三组的平均浓度与时间图。根据这些pk(药代动力学)分布,计算药代动力学参数以确定每个剂量组的igg的最大浓度(c
max
)、达到c
max
的时间(称为t
max
)、终点消除半衰期(t
1/2
)和代表随着时间的推移到所花的最后时间点的总药品暴露的重量归一化曲线下面积(auclast),以及从外推到无穷大的重量归一化曲线下面积(aucinf)和生物利用度(%f)。
[0245]
实验组(即rani组)首先给药并收集样本直至第10天。然而,在分析数据时,发现在所有三只动物中仍可检测到可测量的igg血清浓度。基于这些结果,针对随后的iv和sc组,收集样本直至第14天。为了比较给药组群,通过非隔室方法估计血清样本的pk参数。将从给药开始的标称经过时间用于估计各个pk参数。
[0246]
iv施用后igg的血清浓度水平在3.3
±
1小时内达到c
max
,平均浓度为5339
±
179ng/ml。直到第14天检测到可测量水平,平均auc
last
为500800
±
108000ng*h/ml。外推到无穷大时,aucinf显示出相似的值513400
±
111700ng*h/ml,表明样本收集捕获了大部分暴露。平均清除率(cl)相对较低,为0.009
±
0.002ml/min/kg,分布体积(vz)也较低,为0.04
±
0.01l/kg。平均终点消除半衰期为51.5
±
3.3小时。
[0247]
sc组中两只动物的igg血清浓度在120小时时的c
max
为1246ng/ml,在72小时时的c
max
为1510ng/ml,平均t
1/2
为49.9小时。发现平均auc
last
和auc
inf
分别为274200
±
21570和298300
±
46130ng*h/ml。计算出皮下递送的igg的平均生物利用度为50.9%。
[0248]
实验组(即rani组)中的所有动物在十天研究的整个过程中都显示出可测量的igg水平,如图25所示。口服施用胶囊10的实施方案后igg的平均最大浓度(例如,c
max
)在24
±
0小时(因此对应于rani组的t
max
)达到2491
±
425ng/ml。计算出平均auclast和aucinf为327400
±
38820和409700
±
101800ng*h/ml。rani组的t
1/2
在40.7小时至128小时的范围内,
平均值为87.7小时。t
1/2
的这种大范围可表明该组未达到实际的终点消除半衰期。根据外推的aucinf值(aucext),外推的百分比在4.55%至29.1%的范围内,并且3只动物中有2只超过20%。由于这种可变性,使用rani组的auclast和iv施用的aucinf值估计生物利用度(%f)。%f值(即绝对生物利用度)在50.0%至68.3%的范围内,平均值为60.7%。
[0249]
实施例2:使用可吞咽胶囊的实施方案的犬体内安全性研究
[0250]
体内安全性研究是在23只清醒的成年比格犬中进行,使用与上述类似的方案使每只比格犬接受2至18粒胶囊(rani胶囊)。所有胶囊均顺利无痛地通过胃肠道,并在96小时内排出。胶囊的平均胃停留时间为93分钟,随后的平均肠道展开时间为28分钟。
[0251]
实施例3:使用可吞咽胶囊的实施方案与皮下注射递送人重组胰岛素的猪体内研究
[0252]
在17只幼年麻醉猪中进行一项观察性试点研究,用于使用60
‑
80mg/dl正常血糖葡萄糖钳夹方法比较通过可吞咽胶囊(ranipill)的实施方案和皮下注射递送的人重组胰岛素(hri)的血浆浓度和药代动力学。通过内窥镜空肠内方法递送本文定义为ranipill胶囊的可吞咽胶囊。该方法和结果如下描述。
[0253]
测试材料/组
[0254]
将ranipill
tm
胶囊制造成含有剂量为20iu的重组人胰岛素微片,将该微片密封peo针内。重组人胰岛素从制造商imgenex获得(目录号mir
‑
232
‑
250)。胰岛素的一个iu相当于0.0347mg(28iu/mg)。表6和7总结了有关rani和sc组的动物体重、供试品鉴定和剂量数据的信息。
[0255]
将胰岛素如下递送给两组动物:
[0256]
rani组(即ranipill组):空肠内放置含有重组胰岛素微片的ranipill
tm
胶囊(n=8)。
[0257]
sc组:sc施用含有胰岛素微片的微针(n=9)。
[0258]
表6:ranipill组的供试品和动物详情。
[0259]
动物id号动物体重(kg)ranipill胶囊id剂量(iu)1408518.0e2319.51410914.3h4518.31411013.2h4319.31411516.3j6818.41411615.0j4420.21412319.0l2920.01412422.3l220.91412521.4l3820.1平均值
±
sem17.4
±
1.2 19.6
±
0.3
[0260]
表7:sc组的供试品和动物详情。
[0261]
动物id号动物体重(kg)微片id剂量(iu)1400717.16a(#10)18.41400817.36a(#1)17.81403318.57(#12)20.7
1403015.27(#27)20.51403415.27(#22)20.01403715.97(#20)19.81405719.07(#61)20.71405517.57(#36)20.41405817.17(#46)20.1平均值
±
sem17.0
±
0.4 19.8
±
0.3
[0262]
动物准备和研究样本。
[0263]
所描述的所有研究程序均经过biosurg公司的实验动物管理和使用委员会批准,并符合测试设施的标准操作程序。通过肌内注射替来他明和唑拉西泮对体重介于12kg与22kg之间的雌性家猪进行麻醉,将它们插管并维持在麻醉状态下,通过机械动物呼吸机在间歇性正压下递送异氟烷和氧气的混合物。rani组(其中将0.68
±
0.1mg rhi递送到空肠壁中)包括8只猪,重量为17.4
±
1.2kg。对照组中的9只猪(其皮下接受0.69
±
0.1mg rhi)重量为17.0
±
0.4kg。所有动物均经历了中线腹部开腹手术。在8只猪(平均体重=17.4
±
1.2kg)的测试组中,通过以下方式将20iu重组人胰岛素(rhi)注射到空肠壁中:经由1
‑
cm肠切开术将可吞咽胶囊的实施方案插入近侧空肠中,然后允许胶囊被小空肠中的ph条件致动,以便将含有rhi的药品针(例如,组织穿透构件)注射到空肠壁中。9只猪的对照组(17.0
±
0.4kg)接受皮下注射的20iu rhi(sc组)。在两个研究组中,在rhi施用后
‑
20至+420分钟之间,以10分钟的间隔收集一次血液样本,以使用手持式血糖仪(如下所述)测量血糖浓度,并使用elisa方法(如下所述)测量血清胰岛素。
[0264]
正常血糖钳夹方法
[0265]
使用正常血糖钳夹方法,通过滴定通过外周静脉插管输注的50%右旋糖溶液,同时使用手持式onetouch2血糖仪(lifescan,inc.,milpitas,ca
‑
a johnson&johnson company)以10分钟的间隔监测动脉浓度,将动物的血糖浓度保持在60至80mg/dl之间。正常血糖钳夹是一种广泛应用于体内测量胰岛素敏感性的方法(defronzo等人,am j physiol.1979年9月;237(3):e214
‑
23;bergman等人,diabetes metab.1989rev.,5:411
‑
429)。
[0266]
人胰岛素和血糖的定量
[0267]
在rani组注射或皮下注射(sc)rhi之前
‑
20分钟、
‑
10分钟和0分钟收集血液,之后每10分钟收集一次,持续420分钟。使样本在室温下凝结30分钟,然后将其在4℃下以3,000rpm离心10
‑
15分钟。然后使用人胰岛素elisa试剂盒和制造商推荐(alpha)的标准操作程序处理血清等分试样以测量rhi浓度。
[0268]
使用来自alpha diagnostics international的人胰岛素elisa试剂盒(目录号0030n,批号a4262cb)并使用酶联免疫吸附测定(elisa)方法对血清样本中的人胰岛素进行定量。使用试剂盒制造商建议的sop。测定检测范围为6.25至100μiu/ml。使用手持式血糖仪(onetouch ultra ii)进行血糖测量。
[0269]
血液采样和处理以及数据管理
[0270]
diagnostic international inc.,san antonio,tx)。测定检测范围为6.25至100μiu/ml。在两个研究组中,测量并比较以下数据和参数:a)rhi递送与之后420分钟之间胰岛
素和葡萄糖(右旋糖浓度)的血清浓度和曲线下面积(auc),b)rhi的峰值血清浓度(c
max
),以及c)达到rhi的峰值血清浓度的平均时间(t
max
)。
[0271]
统计分析
[0272]
使用student t检验和microsoft excel软件比较rani组与皮下注射(sc)组的研究测量结果(表示为平均值
±
sem)。
[0273]
结果
[0274]
来自hri动物研究的药代动力学(pk)和药效动力学(pd)数据和参数在表8和9中总结,并在图26
‑
29中示出。表中的值表示为平均值
±
sem。sc和rani组的c
max
血清浓度分别为342
±
50pm和516
±
109pm。sc和rani组的auc相当,分别为81
±
10和83
±
18nmol/l/min。与sc组的227
±
24分钟相比,rani组的t
‑
max
为139
±
42分钟。将sc和rani组的动物的血清hri浓度水平相对于时间作图,并在图26中示出。葡萄糖(右旋糖)输注速率(pd)在图27中示出。ranipill和sc组的葡萄糖输注曲线的auc相当,表明通过ranipill递送的胰岛素的生物活性与sc途径相似。rani组和sc组的正常血糖细胞钳夹实验期间pk
‑
pd数据之间的关系分别在图28和29中呈现。
[0275]
表8:来自ranipill和sc组的正常血糖细胞钳夹实验的血清血浆胰岛素浓度和葡萄糖输注速率数据。
[0276][0277]
值为平均值
±
sem
[0278]
表9:ranipill和sc组的pk和pd参数
[0279]
参数sc(n=9)ranipill(n=8)c
max
(pm)342
±
50517
±
109t
max
(分钟)227
±
24139
±
42pk:血清胰岛素的auc(nm.min)81
±
1083
±
18pd:葡萄糖输注速率的auc(g/min2)106
±
1085
±4[0280]
结论:1)在递送到空肠壁中后,rhi的生物活性得以保留,2)与皮下途径相比,空肠壁途径提供了更快的胰岛素生理吸收,以及3)空肠壁递送后,rhi的药代动力学和药效动力学分布表明,可经由本文所述的可吞咽胶囊的实施方案将目前肠胃外施用的药品(诸如基础胰岛素)成功递送到近侧肠壁中。
[0281]
实施例4:人类研究
[0282]
在10名禁食和10名餐后健康人类志愿者中进行一项试点irb(研究审查委员会)研
究,以检查在有或没有微针或药品有效载荷的情况下施用但确实具有本文所述的基于球囊的展开机构的可吞咽胶囊(ranipill胶囊)的实施方案的耐受性和安全性。该装置被设计成如本文所述在小肠中对齐和展开。它还含有不透射线材料,从而允许i)在患者的gi道中定位胶囊位置;以及ii)球囊/装置展开。使用连续放射摄影成像来确定胶囊在胃中的停留时间和在小肠内的展开时间。胃停留时间和展开时间数据分别在下表10和11中示出。胶囊的平均胃停留时间在餐后状态下为217
±
36分钟,在禁食状态下为100
±
79分钟,但两组的肠道展开时间非常相似(100
±
40分钟与97
±
30分钟)。没有受试者察觉到胶囊的传送、展开或排出,并且所有受试者均顺利排出胶囊残余物,这在胶囊摄入后72
‑
96小时内通过放射摄影证实。结果表明,胶囊展开(包括胶囊展开或激活时间)(例如,胶囊离开胃后与在小肠中展开之间的时间)不受gi道(包括胃和小肠中的一者或两者)中食物存在的明显影响。如本文所用,关于展开/激活时间,明显影响意味着展开/激活时间的差异小于约20%,更优选地小于约10%,并且还更优选地小于约5%。它们还表明,患者对胶囊进入、穿过或存在于gi道(包括当胶囊被致动并在小肠中展开时(致动和展开包括一个或多个球囊或其他可扩张装置的扩张))没有可察觉的感觉。
[0283]
表10:ranipill胶囊在禁食与餐后受试者中的胃排空时间
[0284][0285]
表11:ranipill胶囊在禁食与餐后受试者中的内部展开时间
[0286]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1