电外科系统的制作方法
1.本发明涉及一种用于向生物组织供应微波能量并对生物组织执行电穿孔的电外科系统。特别地,电外科系统包括具有用于从治疗区域提取生物组织的导管的电外科器械,以及用于识别所提取的生物组织中特定细胞类型的存在的细胞计数器或细胞分选仪。电外科系统可被布置来消融组织,诸如肿瘤。
背景技术:
2.已经发现电磁(em)能量以及特别是微波和射频(rf)能量因其能够切割、凝结和消融体组织而在电外科手术中是有用的。通常,用于向体组织递送em能量的系统包括具有em能量源的发生器以及连接到发生器以用于将能量递送到组织的电外科器械。常规的电外科器械往往被设计成经皮地插入患者体内。然而,例如如果靶部位是在移动的肺或胃肠(gi)道的薄壁区段中,则可能难以将器械经皮地定位在身体中。其他电外科器械可通过外科窥视装置(例如内窥镜)递送到靶部位,所述外科窥视装置可运行通过身体内的通道,诸如气道或者食道或结肠的内腔。这允许微创治疗,这可降低患者的死亡率并降低术中和术后并发症率。
3.使用微波em能量进行组织消融是基于生物组织主要由水构成的事实。人体软器官组织的水含量通常在70%和80%之间。水分子具有永久电偶极矩,这意味着在整个分子中存在电荷不平衡。这种电荷不平衡使分子响应于由时变电场的施加所产生的力而移动,因为所述分子旋转来使其电偶极矩与所施加的场的极性对准。在微波频率下,快速分子振荡导致摩擦加热以及随之发生的场能以热量的形式耗散。这被称为介电加热。
4.微波消融疗法利用了这一原理,在所述疗法中,靶组织中的水分子通过在微波频率下施加局部电磁场而被快速地加热,从而导致组织凝结和细胞死亡。已知使用微波发射电外科器械来治疗肺和其他器官中的各种疾病。例如,在肺中,微波辐射可用于治疗哮喘并且消融肿瘤或病灶。
5.另一种类型的肿瘤治疗利用称为电穿孔(或电通透)的效应。在此技术中,电脉冲被施加到生物组织以使纳米级孔隙在靶部位处的细胞膜中打开。孔隙允许抗癌药物或通常不能透过细胞膜的其他材料进入细胞。然后孔隙可重新密封以将材料捕捉(trap)在细胞内,在所述细胞处材料可产生治疗效果(例如以杀死细胞)。还已知使用电穿孔在细胞膜中产生永久纳米级孔隙。这些孔隙不重新密封,并且因此破坏细胞内稳态,最终导致细胞死亡。此技术称为不可逆电穿孔或非热不可逆电穿孔。与热消融不同,例如使用微波能量,不可逆电穿孔保留细胞外基质。
6.介电电泳(dep)是当介电粒子经受非均匀电场时,力施用在介电粒子上的现象。这种力不需要粒子带电。所有粒子在电场存在的情况下表现出介电泳活性。然而,力的强度强烈地取决于介质和粒子电学性质、粒子形状和大小,以及电场的频率。因此,特定频率的场可以较大选择性操纵粒子。介电电泳可用于操纵、运输、分离和分选不同类型的粒子。由于生物细胞具有介电性质,因此介电电泳具有医学应用。例如,已经制成将癌细胞与健康细胞
分离的器械。
7.本发明已经鉴于以上考虑而想出。
技术实现要素:
8.最一般地,本发明提供了一种用于向生物组织供应微波能量并对生物组织执行电穿孔的电外科系统。所述系统包括电外科器械,所述电外科器械用于在器械的远端处从治疗区域提取生物组织。所述系统包括细胞计数器或细胞分选仪,所述细胞计数器或细胞分选仪用于识别所提取的生物组织中特定细胞类型或类别(例如癌细胞、健康细胞、癌干细胞)的存在。所述系统进一步被配置来将微波能量从器械辐射到治疗区域中,并在器械处建立电场以对治疗区域中的生物组织进行电穿孔。微波能量可用于执行组织测量、组织消融或药物活化(例如组织加热而不消融)。所执行的电穿孔可以是可逆(又名临时)电穿孔或非热不可逆(又名永久)电穿孔。
9.电外科器械可具有辐射尖端部分,所述辐射尖端部分能够使用微波能量和电穿孔以微创方式执行组织消融。电外科器械可用于分开地(例如循序地)或同时地执行微波消融和电穿孔。辐射尖端部分的尺寸可被设定成适合于通过外科窥视装置插入胰腺中,以提供已知rf消融技术的快速且准确的替代方案。通过实现使用微创手术治疗胰腺内的肿瘤,出于治愈性和姑息性原因使用消融和/或电穿孔治疗可能是可行的选择。
10.尽管本发明可在胰腺方面有特定用途,但本发明也可适用于其他棘手治疗部位,诸如肺、大脑等。本文所公开的器械结构使辐射尖端部分能够具备适当的长度和刚度以供在多种设置中使用。
11.通过结合使用同一器械执行微波消融和电穿孔的能力,可以在电外科手术期间快速改变治疗模式而无需更换器械。微波消融和电穿孔可以互补的方式使用,以便更有效地治疗靶组织和/或使治疗时间最小化。由于辐射尖端部分的小直径,当其用于将微波能量递送到组织中时,辐射尖端部分可能变热。过度加热可能对健康的周围组织造成损害,因此通常需要在施加微波能量之后等待辐射尖端部分冷却下来。使用本发明的器械,可以在微波能量治疗与电穿孔治疗之间交替,以便避免辐射尖端部分的过度加热。这可使总体治疗时间最小化。
12.电外科器械还具有执行组织提取或组织活检的能力。以此方式,可从治疗区域获得生物组织以供细胞计数器或细胞分选仪检查。例如,检查可涉及确定生物组织是否包含一种或多种预定细胞类型,诸如例如:健康细胞、癌细胞、癌干细胞。在一个实施方案中,细胞计数器可能够区分两种或更多种不同的细胞类型或类别,例如,区分健康细胞与癌细胞,或者区分癌干细胞与癌细胞。因此,细胞计数器可用于识别肿瘤的存在。而且,在检测癌细胞时,可将上述微波治疗和/或电穿孔治疗应用于治疗区域,例如,以消融肿瘤。
13.根据本发明的一个实施方案,提供了一种电外科系统,其包括:电外科发生器,所述电外科发生器被布置来供应微波能量和电穿孔信号;电外科器械,所述电外科器械用于插入生物组织中的治疗区域,所述电外科器械包括:同轴电缆,所述同轴电缆连接到所述电外科发生器以接收所述微波能量和所述电穿孔信号,杆状辐射尖端部分,所述杆状辐射尖端部分耦合到所述同轴电缆的远端以接收所述微波能量和所述电穿孔信号,所述辐射尖端部分用于将所述微波能量从其远端辐射到所述治疗区域中并且用于使用所述电穿孔信号
在其远端处建立电场以对所述治疗区域中的生物组织进行电穿孔,以及导管,所述导管用于将生物组织输送离开所述治疗区域;以及细胞计数器,所述细胞计数器与所述导管流体连通以接收生物组织,所述细胞计数器用于检测所接收的生物组织中第一预定细胞类型的存在。注意,检测特定细胞类型的存在可包括能够从一种或多种不同细胞类型中分选或分类该特定细胞类型。例如,可从健康细胞中分选(例如分离)癌细胞,以便检测癌细胞。可保留或丢弃健康细胞。注意,分类“癌细胞”可包括一种或多种不同的细胞类型,但所有细胞类型都是癌性的。而且,分类“健康细胞”可包括一种或多种不同的细胞类型,但所有这些细胞类型都是非癌性的。
14.所述辐射尖端部分可包括:近侧同轴传输线,所述近侧同轴传输线用于接收并输送所述微波能量,所述近侧同轴传输线包括内导体、外导体和将所述内导体与所述外导体分开的介电材料;以及远侧针尖,所述远侧针尖安装在所述近侧同轴传输线的远端处,所述远侧针尖包括从所述近侧同轴传输线的远端沿纵向方向延伸的刚性介电套筒,其中所述杆状辐射尖端部分的直径小于所述同轴电缆的直径,其中所述刚性介电套筒围绕细长导电元件,所述细长导电元件电连接到所述近侧同轴传输线的所述内导体并延伸超过所述近侧同轴传输线的所述外导体的远端,其中所述细长导电元件被配置来作为所述微波能量的半波长变换器操作,从而将所述微波能量从所述远侧针尖辐射到生物组织中,其中所述细长导电元件终止于暴露在远侧针尖的远端上的活性电极处,并且其中所述活性电极与电连接到所述近侧同轴传输线的所述外导体的所述远端的返回电极轴向间隔开,所述活性电极和所述返回电极被配置来在所述远侧针尖处建立用于生物组织的电穿孔的电场。
15.如果远侧针尖的电气长度对应于微波能量的一半波长,则所述远侧针尖可被配置为半波长变换器。将所述远侧针尖配置为半波长变换器的优势在于使在部件之间(例如所述同轴电缆与所述近侧同轴传输线之间以及所述近侧同轴传输线与所述远侧针尖之间)的接口处的反射最小化。由于阻抗的较大变化,后一接口处的反射系数通常较大。半波长配置使这些反射最小化,使得主要反射系数成为近侧同轴传输线与组织之间的接口的反射系数。可将所述近侧同轴传输线的阻抗选择成等于或接近预期组织阻抗,以提供所述微波能量的频率下的良好匹配。
16.由于辐射尖端部分的配置,组织可'看到'同轴传输线的阻抗而不是远侧针尖结构的(较小)阻抗。所述远侧针尖的物理长度不必(实际上将不)对应于自由空间中所述微波能量的半波长,因为可选择所述远侧针尖的形状及其与所述近侧同轴传输线的相互作用来控制所述远侧针尖的物理长度,同时使其能够作为半波长变换器电气式地操作。
17.同轴电缆可被配置来输送电穿孔信号,所述电穿孔信号在被杆状辐射尖端部分接收时,在远侧针尖处建立用于生物组织的电穿孔的电场。活性电极可设置在远侧针尖的表面处。
18.电穿孔波形可包括被配置来打开细胞膜中的孔隙的一个或多个高电压能量脉冲。本发明可用于治疗剂存在于治疗部位处的情形,由此打开细胞膜中的孔隙促进治疗剂进入细胞或使治疗剂能够进入细胞。换句话说,本发明可用于常规电穿孔手术。在一个实施方案中,可通过电外科器械的导管将治疗剂(例如药物或局部化疗)引入治疗部位。
19.替代或另外地,用于电穿孔的能量可被配置来永久地打开孔隙,从而对细胞膜造成不可逆的破坏,从而导致细胞死亡。换句话说,所述器械可用于不可逆电穿孔(ire)。
20.所述电穿孔波形可包括一个或多个快速高电压脉冲。每个脉冲的脉冲宽度可在1ns至10ms的范围内、优选地在1ns至100μs的范围内,尽管本发明不必限于此范围。对于可逆电穿孔,较短持续时间的脉冲(例如等于或小于10ns)可以是优选的。对于不可逆电穿孔,相对于可逆电穿孔,可使用更长持续时间的脉冲或更多脉冲。
21.优选地,每个脉冲的上升时间等于或小于脉冲持续时间的90%,更优选地等于或小于脉冲持续时间的50%,并且最优选地等于或小于脉冲持续时间的10%。对于较短脉冲,所述上升时间可以是大约100ps。在一些实例中,电穿孔波形可以是射频(rf)或低频电磁信号。
22.每个脉冲可具有在10v至10kv的范围内、优选地在1kv至10kv的范围内的幅度。每个脉冲可以是来自接地电位的正脉冲,或者来自接地电位的交替的正负脉冲的序列。
23.电穿孔波形可以是单个脉冲或多个脉冲,例如脉冲周期序列(period train)。波形的占空比可等于或小于50%,例如在0.5%至50%的范围内。
24.在一个实例中,可将在一系列10至100个脉冲中递送的大约200ms的脉冲宽度用于不可逆电穿孔。在一个实例中,电穿孔波形可包括1.5kv幅度的10
×
300μs脉冲,约1分钟的递送间隔内递送三次。此波形可导致肝细胞癌中的细胞凋亡或死亡。
25.电穿孔波形可在取决于期望效果而选择的治疗期期间递送。例如,治疗期可以是较短的,例如小于1秒、或几秒、或约1分钟。替代地,所述治疗期可以是较长的,例如多达一小时。
26.所述同轴电缆可以是可在近端处连接到电外科发生器的常规低损耗同轴电缆。所述同轴电缆可具有通过介电材料与外导体分开的中心导体。所述同轴电缆还可包括用于绝缘并保护电缆的外保护性护套。在一些实例中,保护性护套可由不粘材料制成或涂覆有不粘材料以防止组织粘连到电缆。所述辐射尖端部分位于同轴电缆的远端处,并被连接以接收沿着同轴电缆输送的em能量。
27.近侧同轴传输线可连接到同轴电缆的远端。特别地,近侧同轴传输线的内导体和外导体可分别电连接到同轴电缆的中心导体和外导体。近侧同轴传输线中所使用的材料可与同轴电缆中所使用的材料相同或不同。可选择近侧同轴传输线中所使用的材料以提供近侧同轴传输线的期望柔性和/或阻抗。例如,可选择近侧同轴传输线的介电材料以改进与靶组织的阻抗匹配。
28.可挑选近侧同轴传输线的部件的尺寸,以便为近侧同轴传输线提供与柔性同轴电缆的阻抗相同或接近的阻抗(例如约50ω)。内导体可由具有高导电性的材料(例如银)形成。
29.辐射尖端部分可通过安装在辐射尖端部分与柔性同轴电缆之间的接合点之上的轴环或连接器固定到柔性同轴电缆。轴环可以是导电的,例如由黄铜形成。轴环可将外导体与柔性同轴电缆的外导体电连接。
30.辐射尖端部分的外径小于同轴电缆的外径。这可有利于将辐射尖端部分插入靶组织中,并改进辐射尖端部分的可操作性。此配置可能特别适于治疗胰腺中的肿瘤,因为它可促进辐射尖端部分穿过十二指肠壁插入胰腺中。
31.辐射尖端部分可包括不粘涂层(例如由ptfe制成),以防止组织粘连到辐射尖端部分。不粘涂层可由聚一氯对二甲苯或聚二氯对二甲苯形成。不粘涂层可沿着辐射尖端部分
的除了活性电极和返回电极以外的整个长度形成,活性电极和返回电极被暴露以促进将电穿孔信号高效地递送到组织中。可仅沿着对应于活性消融区(例如沿着从远端向后延伸2cm的区域(除了活性电极和返回电极以外))的长度施加不粘涂层。当针被仅部分涂覆时,针可能不太容易受到热能积聚的影响,这会导致针变热。
32.在一些实施方案中,返回电极可由近侧同轴传输线的外导体的远侧部分形成。以此方式,当辐射尖端部分接收到电穿孔波形时,它可充当双极电穿孔电外科器械。通过将外导体的远侧部分用作返回电极,可将电场定位在远侧针尖周围,使得可在远侧针尖周围的区域中执行电穿孔。外导体的远侧部分可位于近侧同轴传输线的远端处、与远侧针尖相邻。在外导体由镍钛诺或某种其他柔性导电材料形成的情况下,返回电极可包括涂层,所述涂层形成在由与镍钛诺相比具有更高导电性的材料制成的外导体的远侧部分上。所述材料可以是例如银。为了促进电穿孔信号的有效递送,可对活性电极和返回电极进行抛光,即使其尽可能光滑。
33.细长导电元件可沿着其长度辐射微波能量,以消融位于远侧针尖周围的区域中的组织。在一些情况下,细长导电元件可以是内导体的延伸到远侧针尖中的远侧部分。
34.活性电极电连接到细长导电元件。以此方式,电穿孔波形可通过细长导电元件递送到活性电极。活性电极还可用于使辐射尖端部分的微波辐射剖面成形,例如将微波能量的发射集中在远侧针尖周围。
35.在一些实施方案中,活性电极可以是与细长导电元件同心地布置的导电环。换句话说,导电环的中心轴线可与细长导电元件的纵向轴线对准。这可用于将电穿孔波形围绕纵向轴线对称地递送到组织。这还可用于提供轴向对称的微波辐射剖面。
36.导电环可具有穿过其纵向延伸的通道,并且细长导电元件的一部分可包含在所述通道内。以此方式,细长导体可电连接到所述通道内部的活性电极。通道的直径的尺寸可被设定成基本上匹配细长导电元件的外径,使得通道可围绕细长导电元件形成干涉配合。这可用于相对于细长导电元件固定活性电极。
37.在一些实施方案中,远侧针尖可包括安装在导电环的远端处的尖端元件。尖端元件可由介电材料制成。可选择尖端元件的介电材料以改进辐射尖端部分与靶组织之间的阻抗匹配。尖端元件的一部分可在通道内突出,以将尖端元件相对于通道保持在适当位置。
38.尖端元件的远端可以是尖锐的(例如锐化的)。这可有利于将远侧针尖插入靶组织中。例如,这可有利于将所述器械穿过十二指肠或胃壁插入胰腺中。
39.远侧介电套筒可具有穿过其形成以用于接收细长导电元件的内孔。远侧介电套筒可由与近侧同轴传输线中的介电材料不同的材料制成。
40.远侧介电套筒与近侧同轴传输线的介电材料相比具有更高刚度。为远侧介电套筒提供较高的刚度可有利于将远侧针尖插入靶组织中,同时具有较低刚度的近侧同轴传输线可有利于辐射尖端部分的弯曲。这可使器械能够被引导穿过狭窄且蜿蜒的通路,同时仍然能够将其插入靶组织中。例如,近侧同轴传输线的介电材料可由柔性介电材料(例如ptfe)制成,而远侧介电套筒可由例如陶瓷、聚醚醚酮(peek)或玻璃填充的peek制成。远侧针尖的尖端元件可由与远侧介电套筒相同的材料制成。
41.在一些实施方案中,远侧介电套筒可包括氧化锆。发明人已经发现氧化锆为将远侧针尖插入组织中提供了良好的刚度。此外,发明人已经发现使用氧化锆远侧介电套筒可
提供与靶组织的良好阻抗匹配。
42.在一些实施方案中,外导体的远侧部分可上覆于远侧介电套筒的近侧部分。换句话说,远侧介电套筒的近侧部分可包含在外导体的远侧部分内。这可用于加强远侧针尖与近侧同轴传输线之间的连接。
43.外导体的远侧部分上覆于远侧针尖的近侧部分的辐射尖端部分的长度可在近侧传输线与远侧针尖之间形成中间同轴传输线。所述中间同轴传输线与近侧同轴传输线相比可具有更高的介电常数,以允许较小的物理长度,同时获得所需电气长度(半波)。在微波频率下,远侧针尖的远侧部分可充当连接到中间同轴传输线的开放式加载单极。远侧针尖也可视为以开放式同轴单极结束以使消融区成形的单个结构。
44.在一些实施方案中,远侧介电套筒可由一对协作零件形成,所述协作零件中的每个协作零件具有形成在其表面中用于接收细长导体的纵向凹槽。远侧介电套筒的这种结构可促进辐射尖端部分的组装。当协作零件被组装以形成远侧介电套筒时,协作零件中的凹槽可形成接收细长导体的内孔。可使用粘合剂将协作零件固定在一起。
45.在一些实施方案中,近侧同轴传输线的外导体可由镍钛诺形成。例如,外导体可由镍钛诺管形成。发明人已经发现镍钛诺表现出足以传输能够穿透十二指肠壁的力的纵向刚度。此外,镍钛诺的柔性可促进辐射尖端部分的弯曲,使得可将器械引导通过狭窄的弯曲通路。因此,形成由镍钛诺制成的外导体可有利于使用所述器械治疗胰腺中的肿瘤。
46.导电外层可形成在外导体的外表面上,所述导电外层与镍钛诺相比具有更高导电性。导电外层可用于减少辐射尖端部分中微波能量的损耗,以提高向远侧针尖递送微波能量的效率。导电外层的厚度可小于镍钛诺的厚度,以使导电外层对辐射尖端部分的柔性的任何影响最小化。
47.辐射尖端部分可具有等于或大于30mm且优选地40mm但可长达100mm的长度。此长度可使得能够进入胰腺内所有位置处的治疗区域。辐射尖端部分可具有等于或小于1.2mm的最大外径。例如最大外径可与19g(1.067mm)或22g(0.7176mm)相似或相同。这可减小因器械插入而造成的穿透孔或使其最小化,以便不造成愈合的不当延迟。使穿透孔的大小最小化还可避免以下不期望的情形:它愈合开放并在胃肠道与体腔之间造成瘘管或无用通道。
48.在一些实施方案中,内导体可从柔性同轴电缆的远端延伸,内导体电连接到柔性同轴电缆的中心导体,并且内导体的直径可小于柔性同轴电缆的中心导体的直径。这可提高辐射尖端部分的柔性。例如,内导体的直径可以是0.2mm至0.4mm。内导体的直径可考虑到确定沿着辐射尖端部分的损耗(和加热)的主要参数是导体损耗,所述导体损耗是内导体的直径的函数。其他相关参数是远侧介电套筒和近侧同轴传输线的介电材料的介电常数以及用于外导体的直径和材料。
49.在一个实施方案中,导管可与辐射尖端部分成一体。例如,导管可以是内导体和细长导电元件中的中空通道或内孔。而且,在辐射尖端部分包括尖端元件的情况下,导管可以是尖端元件中的中空通道或内孔。此布置提供紧凑系统的优势。这是可实现的,因为在良导体中本文提出的微波能量的趋肤深度(skin depth)足够小,使得内导体和细长导电元件是中空的,而不显著影响所输送的能量。
50.在一个实施方案中,导管包括至少一个管道,所述至少一个管道连接到内导体以用于将生物组织输送离开内孔。
51.在一个实施方案中,导管沿着近侧同轴传输线的轴线延伸并且包括在轴线上的出口。在此实施方案中,同轴电缆可以是侧馈而不是端馈,即连接器可被布置成与近侧同轴传输线成角度,即与结构的长度成90
°
。因此,微波能量和电穿孔信号以一定角度连接到辐射尖端部分,但生物组织与电外科器械的纵向轴线同轴地提取。在替代实施方案中,微波能量和电穿孔信号沿着近侧同轴传输线的轴线(即同轴)馈入辐射尖端部分中,并且使用与近侧同轴传输线的轴线成角度(例如与结构的长度成90
°
)的至少一个管道提取生物组织。因此,微波能量和电穿孔信号与电外科器械的纵向轴线同轴地连接到辐射尖端部分,但生物组织以一定角度提取。
52.所述电外科系统还可包括:外科窥视装置(例如内窥镜),所述外科窥视装置具有用于插入患者体内的柔性插入软线,其中所述柔性插入软线具有沿着其长度延伸的器械通道,并且其中所述电外科器械的尺寸被设定成配合在所述器械通道内。
53.术语“外科窥视装置”可在本文中用于意指设置有插入管的任何外科装置,所述插入管是在侵入性手术期间被引入患者体内的刚性或柔性(例如可转向)导管。所述插入管可包括器械通道和光学通道(例如用于传输光以在插入管的远端处照亮治疗部位和/或捕获治疗部位的图像)。器械通道可具有适合于接收侵入性手术工具的直径。器械通道的直径可以是5mm或更小。在本发明的实施方案中,外科窥视装置可以是启用超声的内窥镜。
54.电外科系统可包括用于控制由电外科发生器供应的微波能量和电穿孔信号的控制器。例如,控制器可用于设置微波能量的功率或频率。而且,控制器可用于设置电穿孔信号的脉冲宽度、脉冲占空比或脉冲幅度。以此方式,控制器提供用于控制(例如测量组织或消融组织的)微波能量和(例如执行可逆电穿孔或不可逆电穿孔的)电穿孔信号的效果的机构。
55.在使用中,由于不同类型的生物组织的阻抗值不同,电外科系统所递送的微波功率可以不同的量反射;这对应于辐射尖端部分与接触组织之间的阻抗失配。当从发生器中选择微波能量的输出功率水平时,可考虑此类反射。替代地,系统可监测并调节递送到电外科器械的功率。例如,系统可包括用于检测从治疗区域反射回来的微波功率的检测器,并且控制器可基于所检测的反射微波功率的变化来调节微波辐射的可控功率水平。
56.电外科器械可具有执行组织测量的能力。测量组织的介电性质的能力(所测量信息)可在第一次将电外科器械插入怀疑存在肿瘤的组织区域中时定位癌组织方面提供显著优势,即可能无需取出多个组织样本。而且,以此方式测量组织性质的能力可降低发生假阴性的风险。具体而言,反射功率的变化(例如从电外科器械与生物组织之间的接口行进回来的微波信号幅值的变化)可指示存在于电外科器械的远端处的材料类型的变化。控制器可被布置来认识到某些预期的例如从健康组织到癌组织的变化。在一个实施方案中,当检测到某种组织类型时,控制器可(例如通过用户接口)通知系统的用户。
57.检测器还可被布置来检测递送到电外科器械的正向功率。控制器因此能够确定递送到生物组织的功率的量。控制器可被布置来基于所检测的正向和反射微波功率来调节微波辐射的可控功率水平,以根据预定能量递送剖面来递送微波能量。控制器可被布置来基于所检测的反射微波功率的变化从多个预定剖面中选择预定能量递送剖面。
58.每个预定能量递送剖面可与组织类型有关。例如,血液的能量递送剖面可被布置来确保递送足够的功率以引起温度升高,从而密封破裂的血管。而且,用于癌组织的能量递
送剖面可被布置来确保递送足够的功率来消融组织。
59.控制器可被布置来测量电外科器械的远端处的生物组织的阻抗的幅值(和/或相位)并且根据所测量阻抗选择预定能量递送剖面。
60.为了确保准确的检测,所述系统可被布置来将反射功率与正向功率隔离。例如,所述系统可包括连接在发生器、器械和检测器之间的环行器,其中来自发生器的微波能量的正向路径从环行器的第一端口传递到第二端口,来自器械的微波能量的反射路径从环行器的第二端口传递到第三端口,并且检测器包括经连接以耦合从环行器的第三端口的功率输出的第一定向耦合器。
61.为了检测正向功率,检测器可包括经连接以将功率输入耦合到环行器的第一端口的第二定向耦合器。
62.为了改进正向路径与反射路径之间的隔离,可将一个或多个附加环行器连接在第二定向耦合器与环行器之间。本发明不限于使用一个或多个环行器来提供正向信号与反射信号之间的必要隔离,即可使用具有高方向性值的定向耦合器,例如波导耦合器。
63.电外科发生器的微波能量源可具有可调输出频率。例如,源中可存在多于一个振荡器,每个振荡器可选择性地连接到放大器。替代地,所述源可包括可变频率发生器。可在使用之前例如取决于要治疗的组织或治疗区域的大小选择频率。控制器可被布置来例如基于反射微波功率的变化调节使用中的频率。
64.所述系统可包括阻抗匹配机构,所述阻抗匹配机构被布置来在外科手术(例如隧穿)期间将电外科器械中的辐射尖端部分的阻抗与器械远端处的生物组织匹配。基于呈现给辐射尖端部分的阻抗变化的阻抗调节和/或能量剖面调节可用于确保在隧穿手术期间创建具有恒定直径的消融轨道。
65.细胞计数器(又名细胞分选仪)可以是介电电泳细胞分选仪,因为细胞计数器使用电磁场通过介电电泳(dep)力选择性地对细胞进行电操纵,使得细胞根据它们对电磁场的磁化率被动态地分选到不同的物理位置或箱中。也就是说,将第一预定细胞类型(例如癌细胞)暴露于特定电磁场可能迫使该细胞采用第一轨迹进入第一物理位置(例如井或箱),而将其他细胞(例如健康细胞)暴露于相同的电磁场可能迫使那些细胞采用第二轨迹进入第二物理位置。以此方式,癌细胞和非癌(例如健康)细胞被分选或分类成组,其中每个组位于不同的位置处。以此方式,识别特定位置(例如第一物理位置)处细胞的存在提供用于确定或检测第一预定细胞类型(例如癌细胞)的存在的机构。
66.而且,细胞计数器可以是细胞识别组件(或模块)的一部分,其功能是从治疗部位提取细胞、准备所提取细胞用于细胞分选,并且然后使用细胞计数器识别第一预定细胞类型的存在。例如,细胞识别组件可包括与导管流体连通(例如连接到导管)的抽吸泵,以便从电外科器械的远端处的治疗区域提取生物组织。而且,细胞识别组件可包括样本发生器,所述样本发生器将来自所提取的生物组织的细胞悬浮在流体中以便产生样本或细胞计数器样本。接下来,将样本提供给细胞计数器,使得可对所提取的生物组织的细胞执行细胞分选,以便确定一种或多种特定细胞类型的存在。在一个实施方案中,细胞计数器被配置来识别癌干细胞。在另一个实施方案中,细胞计数器被配置来区分健康细胞与癌细胞,或癌干细胞与癌细胞。
67.所述系统还可包括与导管流体连通的流体注射机构,其中所述流体注射机构可操
作来将流体(例如药物或局部化疗)注射到治疗区域中。例如,流体注射机构可包括与导管流体连通的罐(或隔室或容器),以及抽吸泵,所述抽吸泵用于将流体从罐注射到电外科器械的远端处的治疗区域中。流体注射机构可共享细胞识别组件中的至少一些部件(例如抽吸泵或容器)。例如,流体线可远离电外科器械延伸并在接合点分支成两条单独的路径。所述接合点可包括一个或多个阀,所述一个或多个阀是(例如通过控制器)可控的以在从电外科器械到细胞计数器(例如用于细胞检测)的第一路径与从流体注射机构到电外科器械(例如用于流体注射)的第二路径之间进行选择。
68.在本文中,术语“内”意指径向上更接近于器械通道和/或同轴电缆的中心(例如轴线)。术语“外”意指在径向上更远离器械通道和/或同轴电缆的中心(轴线)。
69.除非上下文另外指明,否则术语“传导的”在本文中用于意指导电的。
70.在本文中,术语“近侧”和“远侧”是指细长电外科器械的端部。在使用中,近端更接近于用于提供rf和/或微波能量的发生器,而远端离更远离所述发生器。
71.在本说明书中,“微波”可广泛地用于指示400mhz至100ghz的频率范围,但优选地为范围1ghz至60ghz。微波em能量的优选标定频率(spot frequency)包括:915mhz、2.45ghz、3.3ghz、5.8ghz、10ghz、14.5ghz和24ghz。5.8ghz可为优选的。所述装置可以这些微波频率中的多于一个微波频率递送能量。
72.术语“射频”或“rf”可用于指示在300khz与400mhz之间的频率。术语“低频”或“lf”可意指在30khz至300khz范围内的频率。
附图说明
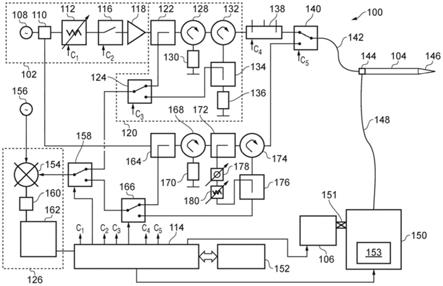
73.以下参考附图论述本发明的实施方案,在附图中:
74.图1是作为本发明的实施方案的电外科系统的示意图;
75.图2(a)是示出作为本发明的实施方案的电外科系统的一部分的框图;
76.图2(b)示出图2(a)的细胞计数器的示意图。
77.图3是根据本发明的实施方案的电外科器械的示意性横截面侧视图;
78.图4(a)是图3电外科器械的远端的示意性横截面侧视图;
79.图4(b)是图3的电外科器械的近端的示意性横截面侧视图;
80.图5示出可在本发明的实施方案中使用的活性电极的示意图;
81.图6示出可在本发明的实施方案中使用的尖端元件的示意图;
82.图7示出可在本发明的实施方案中使用的远侧介电套筒的一部分的示意图;
83.图8是可在本发明中使用的另一个尖端元件的示意性透视图;
84.图9是包括图8的尖端元件的器械的远侧尖端部分的横截面视图;并且
85.图10示出图3的电外科器械的替代近端的示意性横截面侧视图。
具体实施方式
86.在本说明书中,术语消融可指癌组织区域(例如肿瘤)的消融,或者用于密封当电外科器械穿过健康组织层时形成的轨道或通道。后者将通常需要更低的功率水平,并且可使用与在途中观察到的组织阻抗匹配的动态能量来执行轨道消融,以确保在电外科器械穿过组织返回时将受控量的能量射入各种组织类型中。然而,本发明不必限于在动态阻抗匹
配到位的情况下执行受控消融。
87.在一个实施方案中,使用基本上如gb专利申请号1819683.2(通过引用以其整体并入)中所描述的电外科器械。修改此电外科器械,使得其可作为基本上如pct/gb2007/003842(以引用的方式整体并入)中所描述的三功能性天线或者作为基本上如pct/gb2010/001858(以引用的方式整体并入)中所描述的电外科器械执行——例如,将电外科器械修改为包括用于提取活检组织(例如流体或细胞)的通道。此外,然后将所述组合修改为包括细胞识别组件或细胞计数器(又名细胞分选仪),以便可(例如)在健康细胞与癌细胞之间或在癌细胞与癌干细胞之间对通过活检所获得的细胞进行分类。在使用中,电外科器械可用于对细胞执行电穿孔以便将其致敏,即以便打开它们的细胞膜(或孔隙)以使它们对微波能量更敏感。而且,可(例如)通过活检通道将药物(例如局部化疗)递送到致敏细胞,并且然后可使用微波能量来激活化疗。此外,可对细胞执行不可逆电穿孔以消融它们。此外,可使用微波能量执行消融。
88.图1是能够向侵入性电外科器械的远端供应微波能量和用于电穿孔的能量的电外科消融设备1的示意图。系统1包括用于可控地供应微波能量和用于电穿孔的能量的发生器2。用于电穿孔的能量可包括在射频(rf)或低频(lf)带中的脉冲或正弦(例如连续波电磁波)能量。
89.适合于此目的的发生器在wo 2012/076844中有所描述,所述申请以引用的方式并入本文。发生器可被布置来监测从器械接收回的反射信号,以便确定适于递送的功率水平。例如,发生器可被布置来计算在器械的远端处观察到的阻抗,以便确定最佳的递送功率水平。
90.发生器2通过接口电缆4连接到接口接合部6。在所示的实例中,接口接合部6还通过流体流动线7连接到流体系统8。在一些实例中,流体系统8包括收集罐(或容器)和泵。收集罐可用于从靠近远端组件(见下文)的治疗部位收集活检组织(流体或细胞),并且泵可用于将组织样本吸入罐中。此外,流体系统8可包括用于将流体(例如药物或局部化疗)引入治疗部位中的机构。在任何情况下,流体流动线7在接口接合部6与流体系统8之间输送流体。流体系统8还包括细胞计数器或细胞分选仪,用于分选活检组织的细胞以便识别在活检组织中一个或多个特定细胞类型的存在。例如,细胞计数器可被配置来将细胞分类为以下中的一种或多种:健康细胞、癌细胞、癌干细胞。在一个实施方案中,细胞计数器可操作来区分健康细胞与癌细胞,或者癌细胞与癌干细胞。
91.如果需要,则接口接合部6可容纳器械控制机构,所述器械控制机构可通过滑动触发器来操作,例如以控制一根或多根控制线或推杆(未示出)的纵向(来回)移动。如果存在多根控制线,则在接口接合部上可存在多个滑动触发器来提供完全控制。接口接合部6的功能是将来自发生器2、流体系统8和器械控制机构的输入组合到单个柔性轴12中,所述柔性轴12从接口接合部6的远端延伸。
92.柔性轴12可插入穿过外科窥视装置14的器械(工作)通道的整个长度,所述外科窥视装置14在本发明的实施方案中可包括内窥镜超声装置。
93.外科窥视装置14包括主体16,所述主体16具有多个输入端口和一个输出端口,器械用软线20从所述输出端口延伸。器械用软线20包括围绕多个内腔的外护套。多个内腔将各种事物从主体16输送到器械用软线20的远端。多个内腔中的一个内腔是用于接收柔性轴
12的器械通道。其他内腔可包括用于输送光学辐射的通道(例如以在远端处提供照明或从远端采集图像),以及用于输送超声信号的超声信号通道。主体16可包括用于观察远端的目镜22。
94.内窥镜超声装置通常包括在器械用软线的远侧尖端上、超出超声信号通道的出口孔的超声换能器。来自超声换能器的信号可由合适的电缆26沿着器械用软线输送回处理器24,所述处理器24可以已知方式产生图像。器械通道可在器械用软线内成形以引导器械通过超声系统的视野离开器械通道,以提供关于器械在靶部位处的位置的信息。
95.柔性轴12具有远侧组件18(在图1中未按比例绘制),所述远侧组件18被成形为穿过外科窥视装置14的器械通道并且(例如在患者体内)在器械用软线的远端处突出。
96.下文论述的远侧组件18的结构可被特别设计用于与内窥镜超声(eus)装置一起使用,其中远端组件18的最大外径等于或小于2.0mm(例如小于1.9mm(且更优选地,小于1.5mm)),并且柔性轴12的长度可等于或大于1.2m。在一个实施方案中,远端组件18的最大外径为约19g(1.067mm)或22g(0.7176mm)。
97.主体16包括用于连接到柔性轴12的功率输入端口28。如下文所解释,柔性轴12的近侧部分可包括常规同轴电缆,所述常规同轴电缆能够将微波能量和电穿孔能量从发生器2输送到远侧组件18。
98.如上文所论述,期望能够控制器械用软线20的至少远端的位置。主体16可包括控制致动器,所述控制致动器通过一根或多根控制线(未示出)机械地耦合到器械用软线20的远端,所述一根或多根控制线延伸穿过器械用软线20。控制线可在器械通道内或在其自身的专用通道内行进。控制致动器可以是杠杆或可旋转旋钮,或任何其他已知的导管操纵装置。对器械用软线20的操纵可以是软件辅助的,例如,使用从计算机断层扫描(ct)图像组合而成的虚拟三维图。
99.一般而言,远侧组件18(又名针状天线或天线结构)的一个实施方案包括任何合适的天线结构,所述天线结构使微波能量能够在正向和反向方向上转移以实现介电信息的测量,并引起受控组织消融或组织测量,同时允许在不打乱环境设置的情况下提取组织样本(流体或细胞),以允许微波信号传播以进行介电测量或者将足够高水平的微波能量引入生物组织中以引起受控的组织消融。此外,天线结构必须能够使用电穿孔信号建立电场以便执行组织(例如细胞)的电穿孔(例如可逆或不可逆电穿孔)。
100.本发明利用以下事实:天线内的中心导体直径为约0.3
‑
0.5mm,但当操作频率为14.5ghz时,需要仅约0.01mm的壁厚来使几乎所有微波能量能够沿着适当的导电材料流动或进行运输。因此,理论上可去除中心导体的中心以留下可用作可用于将流体注射到治疗部位或从治疗部位提取流体的通道的具有约0.2
‑
0.4mm直径的内孔(或导管),例如,以从固体块内的囊肿或细胞中去除液体。值得注意的是,此通道还可用于将其他流体和/或固体运输进出针状天线。例如用于特定组织标记和/或识别的流体、药物(例如局部化疗)、成像或造影剂。
101.在本说明书中,描述了一种天线结构和系统,其具有执行以下功能的潜力:
102.‑
测量介电信息以确定健康和癌组织的类型、状态和位置,
103.‑
在确信针的尖端位于肿瘤或可能需要治疗的其他生物组织的中心内部的情况下执行穿刺活检,
104.‑
执行穿刺活检并在活检组织上使用细胞分选或细胞计数来识别特定细胞类型(例如癌细胞)的存在,
105.‑
(通过微波能量且通过不可逆电穿孔)可控地消融肿瘤或其他不健康的组织结构和健康组织的小区域(安全切缘),
106.‑
通过可逆电穿孔来可控地致敏细胞以打开它们的细胞膜(或孔隙)并使它们更容易受到微波消融的影响,
107.‑
将药物(例如局部化疗)递送到致敏细胞中,并且然后使用微波能量(例如通过加热而不消融)使药物活化,
108.‑
在治疗过程期间及之后进行进一步穿刺活检,以及
109.‑
在拔针期间可控地消融由针状天线(通过微波能量或通过不可逆电穿孔)形成的通道,以防止接种。
110.涉及组织测量、组织活检和组织消融的组合手术可允许在第一次尝试期间定位癌组织(流体或细胞),并且由于针通道(或轨道)经受受控消融的事实可减轻将癌细胞拖回通道的风险,从而导致可能存在于针状天线的远侧尖端处或周围的任何癌细胞死亡。
111.应注意,此装置可用于执行以上列出的功能的任何组合。例如,所述装置可用于:(i)测量介电信息以确定健康和癌组织的类型、状态和位置;(ii)在定位癌组织时,在确信针的尖端位于肿瘤中心内部的情况下执行穿刺活检;(iii)在活检组织上使用细胞分选或细胞计数来识别特定细胞类型(例如癌干细胞)的存在;(iv)通过可逆电穿孔可控地致敏细胞以打开它们的细胞膜(或孔隙)并使它们更容易受到微波消融的影响;(v)将药物(例如局部化疗)递送到致敏细胞中,并且然后使用微波能量(例如通过加热而不消融)使药物活化;以及(vi)在拔针期间可控地消融由针状天线(通过微波能量或通过不可逆电穿孔)形成的通道,以防止接种。
112.替代或除了从生物系统去除组织之外,还可能期望使用本发明将材料(例如化疗)沉积到生物系统中。在此操作模式下,组织测量和特性特征可用于识别身体的需要高度准确地定位材料(固体或流体)的区域,并且材料可沉积在确切的期望位置(与使用低功率微波频率收发器相关联的特征促进这一点)。例如,本发明的这个方面对于将特定药物或放射性染料沉积到体内可能特别有用。此想法可与近距离放射治疗一起使用。靶向待递送药物的确切位置的能力可在使所需药物的浓度和量最小化方面提供显著优势。
113.还应注意,可使用中心管来吸出或去除经消融的组织以便增大消融区。这在经消融的组织已经烧焦的情况下可能特别有用。一旦已经去除组织,消融过程可以再次开始并且所述过程重复多次。
114.本发明不限于去除与癌性肿瘤相关联的流体或细胞;针状天线可用于从身体的敏感区域去除其他组织,在这些区域中需要准确定位靶组织内部的活检组织。在这些应用中,本发明可仅在测量模式下操作。
115.本发明的特征可以是在消融期间通过活检通道泵吸水或盐水以使针状天线尽可能保持凉爽。在其中期望治疗大病灶的应用中使用此特征可能是有利的。在此情况下,可能需要将微波功率水平从在正常条件下以治疗模式操作(例如,其中要治疗直径大于2cm的球形肿瘤,或者其中需要在较长持续时间内递送功率)时使用的水平增加。例如,可能需要在十分钟内产生高达100w的连续波(cw)功率以治疗(例如)直径为10cm的球形病灶。
116.替代地,活检可用于引入可增强消融效果(例如增加可通过设备实现的消融体积)的材料(例如有损生物相容材料)。针内材料的存在可能不会影响所产生的微波场,因为微波能量仅在内导体的外区段中流动。
117.在一个实施方案中,活检通道可用于在消融期间从针尖抽吸坏死或烧焦的组织。这在实施动态阻抗匹配的情况下可能特别有益,因为它去除原本针必须与之匹配的烧焦的组织。通常,烧焦的组织呈现负载,所述负载与在没有调谐器的情况下针可被设计来与其匹配的负载非常不同。
118.活检设备
119.图2(a)示出整个系统的一部分的框图。此配置实现(i)活检、(ii)通过微波能量的组织消融以及(iii)组织测量,操作模式使用电外科器械104执行,所述电外科器械104可包括上文所提及的远端组件和针状天线。应当理解,如上文所提及,电外科器械104还被配置来执行电穿孔,然而,为清楚起见,图2(a)中未示出实现电穿孔能力所需的设备。
120.设备100包括第一(治疗)通道,所述第一(治疗)通道具有经连接以将微波能量递送到电外科器械104的微波能量电源102。电外科器械104包括导管(未示出),所述导管用于使用抽吸泵106提供的抽吸从治疗部位收集活检组织(流体或细胞)。
121.源102包括振荡器108(例如压控振荡器或介电谐振振荡器),所述振荡器108被布置来以稳定频率(例如14.5ghz)输出信号。振荡器108可以锁相环路配置(未示出)连接到稳定的晶体参考以使其频率保持平稳。振荡器的输出连接到功率分配器110(例如3db分配器)的输入端口,所述功率分配器110在治疗通道与测量通道(下文论述)之间分离输出信号。可能不需要测量通道(即是可选的),因此分配器110可以是可选的。来自治疗通道上的分配器110的输出由可变衰减器112接收,所述可变衰减器112的功能是在来自控制器114的控制信号c1的控制下改变信号的幅度以便可调节地控制治疗通道的总体输出功率水平。来自可变衰减器112的输出由开关116(例如pin二极管开关)接收,所述开关116的功能是在来自控制器114的控制信号c2的控制下调制信号以便启用脉冲操作(或另一调制格式,即一旦已经达到最大值,三角波形或斜坡就会突然下降到零)。其他可能的形状包括:连续波或方波脉冲信号、高斯形状剖面或圆形剖面。来自开关116的输出由功率放大器118(例如mmic放大器阵列)接收,所述功率放大器118的功能是将信号的功率水平放大到适合治疗的水平。功率放大器118的特定实施方案是triquint tga4521
‑
epu mmic,其输出级联连接到更高功率的triquint tga4046
‑
epu mmic的输入。当使用频率高达47ghz的适当驱动信号驱动进入饱和状态时,tga4521
‑
epu装置能够产生15db的增益和23dbm(200mw)的功率水平,并且当使用频率高达46ghz的适当驱动信号驱动进入饱和状态时,tga4046
‑
epu装置能够产生16db的增益和33dbm(2w)的功率水平。在此实施方案中,可使用输出46ghz频率和2dbm输出功率的源振荡器108来驱动系统,以使得以级联布置连接的第二mmic的输出处能够产生2w的功率。源振荡器108可以是通过castle microwave有限公司可获得的装置,零件号:ofd
‑
kf460105
‑
01,其是能够产生高达5dbm的输出功率水平的介电谐振器振荡器,具有
±
25mhz的机械调谐范围、
±
4ppm/摄氏度的频率稳定度以及在100khz偏移下
‑
95dbc/hz的相位噪声。
122.如上文所解释,使用可变衰减器112控制放大器118的功率输入使得能够控制输出功率水平。
123.输出功率水平可基于来自检测器120的信息动态地控制,所述检测器120连接在源
102与电外科器械104之间的治疗通道上。在此实施方案中,检测器120被布置来检测从源102到电外科器械104的正向信号和从电外科器械104行进返回的反射信号两者。在其他实施方案中,检测器可仅检测反射信号。在还另外的实施方案中,可完全省略检测器。
124.检测器120包括经连接以耦合来自放大器118的输出的功率的正向定向耦合器122。耦合器122的耦合端口连接到开关124,所述开关124的功能是在来自控制器114的控制信号c3的控制下选择要输送以供外差检测器126测量的正向耦合或反射耦合的功率。治疗通道上的正向定向耦合器122的输出由第一环行器128的第一端口接收,所述第一环行器128的功能是将从电外科器械104行进返回的反射信号与源102隔离。治疗通道上的正向信号从第一环行器128的第一端口行进到其第二端口,在那里它们被输出。在第一环行器128的第二端口处所接收的任何反射信号行进到第三端口并输出到功率倾卸负载(power dump load)130中。来自第一环行器128的第二端口的输出由第二环行器132的第一端口接收,所述第二环行器132的功能是朝向反射定向耦合器输送反射信号,同时将反射信号与正向信号隔离。治疗通道上的正向信号从第二环行器132的第一端口行进到其第二端口,在那里它们被输出。来自电外科器械104的反射信号在第二环行器132的第二端口处被接收,从那里它们行进到第三端口并被输出。第二环行器132的第三端口的输出由反射定向耦合器134接收,所述反射定向耦合器134的功能是耦合来自反射信号的功率。在穿过耦合器134之后,反射信号被吸收在功率倾卸负载136中。反射功率耦合器134的耦合端口连接到开关124以在被选择时输送到外差检测器126。在此配置中使用两个环行器是有利的,但是本发明不限于使用两个,即可使用一个、三个或更多个。
125.来自治疗通道上的检测器120的输出由阻抗调谐机构138接收,所述阻抗调谐机构138的功能是将治疗通道上的部件的阻抗与电外科器械104在组织中时的阻抗匹配以促进功率高效转移到组织中。阻抗调谐机构138可以是可选的。在此实施方案中,阻抗调谐机构138包括腔体,所述腔体具有可在来自控制器114的控制信号c4的控制下插入其中的三根短截线。阻抗调谐机构138可如wo 2005/115235中所描述。阻抗调谐机构可仅在如下论述的电外科器械的插入(隧穿)期间操作。阻抗调节机构不必限于此配置,即它可包括连接到在功率发生器的输出与天线之间的微带或其他传输线的单个或多个功率变容器或功率pin二极管,或被配置为还可沿着在发生器的输出与天线之间的恒定阻抗微带或其他传输线移动的可变调谐短截线的可变(或可调节)长度的微带(或带状线)。所有调谐位置可通过改变可变短截线的长度来实现,并且其沿着微带或同轴线的移动可限制在所关注频率下的多达加载波长的一半之间。
126.来自阻抗调谐机构138的输出由开关140接收,所述开关140的功能是在来自控制器114的控制信号c5的控制下选择要输入到电外科器械104的治疗通道信号或测量通道信号。此开关可以是波导开关、功率变容器/pin二极管开关、同轴开关等。
127.来自开关140的输出信号通过终止于电外科器械104上的连接器144中的柔性传输电缆142(例如同轴电缆)输送到电外科器械104。电缆142可形成电外科器械104的一部分。连接器144将信号转移到天线(未示出),所述天线包括天线(aerial)(或辐射尖端部分)146,所述天线(或辐射尖端部分)146被布置来从电外科器械104的远端发射微波辐射场。选择微波辐射的频率和发送到电外科器械的信号的功率水平,使得微波辐射场在组织中采用实现系统的各种能力(例如,组织消融、组织测量或使包含在组织内的药物活化(例如化
疗))的配置。
128.电外科器械104中的导管或内孔(未示出)包括在电外科器械104的远端处的一个或多个开口。导管的近端通过运输管道148连接到收集罐或容器150,所述收集罐或容器150用于收集存在于电外科器械104的远端处的活检组织(流体或细胞)。泵106用于沿着电外科器械104内的导管(此处未示出)抽吸组织样本,并通过运输管道148将组织抽吸到罐150中。必须确保系统中不存在泄漏。阀151用于确保组织不能被引导到泵106中。控制器114用于控制泵106的操作。可能期望在组织容器150内部附接流体水平监测器或传感器(未示出)以监测容器内部组织的水平;控制器114可用于处理来自水平监测器或传感器的信号,并且此信息可使用用户接口152显示。控制器114还可用于控制用于清空容器150的阀(未示出)的操作。此阀的操作可基于从水平传感器获得的信息。
129.容器150包括细胞计数器(或细胞分选仪)153,其可操作来将包含在容器150内的细胞分选或分类成不同的组。例如,细胞计数器153可被配置来将来自容器150的细胞分类为以下中的一种或多种:健康细胞、癌细胞、癌干细胞。在一个实施方案中,细胞计数器153可操作来区分健康细胞和癌细胞,或者癌细胞和癌干细胞。此外,容器150和/或细胞计数器153耦合到控制器114,使得控制器114用于基于细胞计数器153所执行的分类或分选来控制系统(例如电外科器械和电外科发生器)的操作。下文参考图2(b)提供细胞计数器153的另外的细节。
130.用户可通过用户接口152与控制器114交互,所述用户接口152可以是触摸屏显示器、膜键盘和lcd/led显示器等。
131.外差检测器126包括混频器154,所述混频器154被布置来接收来自固定频率源156的参考信号和(通过开关158接收)来自检测器120或测量通道上的检测器(下文论述)的测量信号。在混频之后,输出信号穿过滤波器160以允许仅低频差信号可用于以常规方式使用数字信号处理器162测量幅值和可选地相位。还可使用硬件解决方案来实现提取幅值和相位信息,即可使用正交iq混频器。测量结果被发送到控制器114,在那里测量结果被用于与装置的控制相关联的后续操作中。
132.在使用中,从检测器120所产生的信号获得的测量结果提供递送到电外科器械104远端处的生物组织的功率的量的指示。递送功率的变化可指示在电外科器械104远端处的组织的类型的变化。控制器114可基于测量结果来选择能量递送剖面。从根本上来说,微波频率和输出功率水平的组合确定在治疗区域中发生的加热的体积和量。
133.健康细胞所反射的能量的量可不同于癌细胞所反射的能量的量。检测器可检测此变化并且控制器可被布置来认识到给定变化对应于癌细胞的出现。反射能量的量的变化可影响转移到不同细胞类型中的能量的量。所述设备可以是可调节的以说明这个问题。例如,控制器114可使用来自检测器的信号来监测所递送能量的量,并且如果需要的话调节输出功率水平。也可实施动态阻抗匹配以确保反射系数在手术期间保持尽可能接近于零,而不管由于电外科器械的端部与接触组织之间的阻抗失配引起的反射系数的任何变化。
134.振荡器108的频率可以是可调节的,例如取决于治疗区域的大小。在较高频率下,穿透的深度较小。
135.所述设备可用于辅助隧穿过程,即将电外科器械插入治疗区域的过程。电外科器械可被布置来在插入电外科器械时辐射微波能量,以便形成用于供天线插入的通道而不引
起疼痛,从而防止失血并降低患者所经历的不适的程度。在隧穿过程中,期望电外科器械产生具有有限穿透深度的经聚焦热量,以便以产生均匀通道的方式加热组织结构。由于在通向治疗区域的路径上可能存在许多不同的组织结构,因此可能需要设备的灵敏度和功率水平的动态调节。为了促进这一点,可在振荡器108与电外科器械104之间提供测量通道。测量通道的目的是在电外科器械处输出低功率信号,所述低功率信号使得能够测量存在于电外科器械处的任何组织的性质。可基于使用测量通道进行的测量来选择通过治疗通道的信号的功率水平。此布置允许在组织中产生均匀通道。
136.来自测量通道上的分配器110的输出由经连接以耦合来自测量通道的功率的正向定向耦合器164接收。耦合器164的耦合端口连接到开关166,所述开关166的功能是在控制器114的控制下选择要输送以供外差检测器126测量的正向耦合或反射耦合的功率。测量通道上的正向定向耦合器164的输出由环行器168的第一端口接收,所述环行器168的功能是将从电外科器械104行进返回的反射信号与源102隔离。测量通道上的正向信号从环行器168的第一端口行进到其第二端口,在那里它们被输出。在环行器168的第二端口处所接收的任何反射信号行进到第三端口并输出到功率倾卸负载170中。来自环行器168的第二端口的输出由定向耦合器172接收,所述定向耦合器172被配置为正向功率定向耦合器并形成载波消除电路的一部分。来自定向耦合器172的输出馈入环行器174的第一端口中。环行器174的第二端口通过开关140连接到电外科器械104。环行器174的第三端口连接到定向耦合器176的输入,所述定向耦合器176被配置为正向功率定向耦合器并形成载波消除电路的一部分。环行器174的功能是将反射信号朝向外差检测器126输送,同时将反射信号与正向信号隔离。测量通道上的正向信号从第二环行器174的第一端口行进到其第二端口,在那里它们被输出。来自电外科器械104的反射信号在环行器174的第二端口处被接收,从那里它们行进到第三端口并被输出。环行器174的第三端口的输出由定向耦合器176接收,所述定向耦合器176是载波消除电路的一部分。在穿过耦合器176之后,连接到开关166的反射信号在被选择时输送到外差检测器126。
137.除了由环行器168、174提供的隔离之外,载波消除电路也提供隔离。载波消除电路包括正向定向耦合器172、相位调节器178、可调衰减器180和第二正向定向耦合器176。载波消除电路通过从耦合器172的耦合端口获取一部分正向信号并调节相位和功率水平来工作,使得它与通过环行器174的第三端口的任何无用信号具有180
°
异相并具有相同的幅度,以使得能够抵消无用信号分量。使用第二正向耦合器176将载波消除信号注射到环行器174的第三端口的输出中。
138.由于测量通道直接(即不通过耦合器)向外差检测器126提供反射信号,因此在测量通道上递送的功率可以远小于在治疗通道上的功率。
139.开关140、158被布置成一起切换以选择治疗或测量通道。所述设备可在隧穿期间周期性地切换到测量通道以监测电外科器械的远端处的组织。此测量信息可用于实现对递送到所关注生物组织中的能量剖面(在指定持续时间内的功率水平)的适当调节。它也可用作用于匹配电外科器械的端部与接触组织的阻抗的功率匹配网络的调节的基础,即确保反射系数尽可能接近于零。
140.定向耦合器122、134在治疗通道上的布置提供此实施方案的另外的优势。常规地,正向耦合器和反向耦合器插入相同的路径,例如在放大器的输出与电外科器械的输入之
间。这可能限制测量信号的灵敏度(或系统的动态范围),因为无用信号可以与有用(测量)信号具有相似的幅值。当反射信号由于天线与负载阻抗之间的小失配而较小时,这特别地相关。在本发明中,在这种情形下(例如其中系统阻抗为50ω且负载阻抗为46ω(即其中4.17%的入射功率被反射回来))进行测量可能是重要的。这种情况下的问题是,来自解耦端口的在与有用测量信号相反的方向上行进的无用信号可具有与有用信号相似的幅值,因此无法辨别测量信号与噪声信号。在常规系统中,正向信号与反向信号之间的隔离仅取决于定向耦合器的耦合因子(所采样入射功率)和方向性(耦合器区分正向行波和反向行波的程度),并且正向信号与反向信号之间的总隔离度(db)等于耦合因子(db)和方向性(db)的总和。
141.如果反射信号被用于(例如通过控制器114)自动地控制能量递送剖面,则这个问题可能加剧,因为由于测量耦合器与负载之间的路径损耗(即电缆和天线/电外科器械轴的插入损耗等)而导致的正向信号总是多于反射信号的事实,反射信号将被损坏。
142.本发明可在以下布置中克服这些问题:其中通过将正向定向耦合器和反向定向耦合器分别重新定位成在功率放大器(或测量通道中的振荡器)的输出与环行器的第一端口的输入之间以及在循环器的第三端口与功率倾卸负载之间而不存在动态阻抗匹配或调谐。
143.通过在正向信号耦合器与第一环行器的第一端口之间插入一个或多个附加环行器(在第三端口与地之间连接有50个倾卸负载),可实现正向信号与反向信号之间的进一步增加的隔离度或增强的测量灵敏度,其中最后一个循环器用于测量反射信号。每个附加环行器将增加在反向功率信号通过环行器无用功率流隔离损坏正向功率信号方面的隔离,即在无用路径中具有20db隔离度的三个附加环行器将使总体隔离度增加60db。
144.在治疗模式下,用户接口152可指示递送到组织中的能量剂量、治疗时间和任何其他有用和/或相关信息。注意,在治疗模式下,用户接口152可提供关于微波治疗和电穿孔治疗的信息(例如,脉冲宽度、占空比、幅度等)两者。在活检模式下,可期望用户接口152展示由细胞计数器153检测到的细胞类型、容器150中所包含的组织的水平以及泵106何时被激活。在测量模式下,可期望用户接口152展示或显示组织类型和/或组织状态。而且,在活检模式和/或测量模式下,还可期望在检测到癌组织时发出声音警报或使显示器闪烁。
145.如上文所提及,电外科器械104还被配置来执行电穿孔,然而,为清楚起见,图2(a)中未示出实现电穿孔能力所需的设备。在一个实施方案中,用于执行电穿孔的设备是如wo 2012/076844中所描述的发生器的一部分。此设备可以多种方式结合到图2(a)的系统中。例如,所述设备可连接在开关140处,也就是说,开关140可经修改为具有用于将电穿孔信号递送到电外科器械104的附加第三位置。替代地,可将具有两个位置的附加开关插入开关140的远侧,其中一个位置将柔性传输电缆142连接到开关140,而另一个位置将柔性传输电缆142连接到电穿孔设备。在任何情况下,除了微波能量之外,图2(a)的系统可被更新以向电外科器械104提供电穿孔信号。电穿孔信号和微波能量可分开或同时递送到电外科器械104。
146.在图2(a)中,细胞计数器153被包括作为容器150的一部分。然而,在一些其他实施方案中,容器150、泵106、阀151和细胞计数器153中的一者或多者可组合到同一物理设备中。例如,容器150可以是细胞计数器153内的区域(例如检测区域),并且泵106和阀151可以是细胞计数器153的部分,其功能是将细胞从治疗区域汲取到细胞计数器153中以进行分
选。也就是说,容器150、泵106、阀151和细胞计数器153可由连接到控制器114并由其控制的单个设备替换。这种组合(又名细胞识别组件)可具有容器150、泵106、阀151和细胞计数器153的全部或一些能力。因此,细胞识别组件可操作来使用电外科器械104从治疗部位获得活检组织(例如流体和细胞)。细胞识别组件可操作来从活检组织中产生样本并分选样本的细胞以检测一种或多种不同细胞类型(诸如例如癌细胞、癌干细胞、健康细胞、非癌细胞)的存在。此外,细胞识别组件可向控制器114提供检测信号以告知控制器114特定细胞类型(例如癌细胞或癌干细胞)的存在。以此方式,控制器114可基于检测信号执行各种操作,例如,在检测到癌干细胞时,控制器114可控制设备使用特定脉冲剖面执行电穿孔达特定持续时间,和/或以特定功率进行微波消融达特定持续时间。因此,细胞识别组件提供用于检测活检组织中的特定细胞类型并将检测通知控制器114以使得控制器114可基于所述通知来控制系统的机构。
147.如上文参考图2(a)所提及,一些实施方案可包括检测器120,所述检测器120检测由治疗部位处的生物组织反射的微波能量的量的变化。然后控制器114可被配置来认识到给定变化对应于癌细胞的出现。因此,检测器120和控制器114可使用微波能量执行第一检测阶段。此外,实施方案包括细胞识别组件,所述细胞识别组件使用细胞计数器153识别活检样本中某些细胞类型的存在或不存在。因此,细胞识别组件可执行第二检测阶段。例如,第一检测阶段可用于从健康细胞中识别癌细胞,而第二检测阶段可在所识别的癌细胞上执行以便从其他癌细胞中识别癌干细胞。然而,在一些其他实施方案中,第二检测阶段可用于确认第一检测阶段的结果。而且,在一些其他实施方案中,不存在第一检测阶段而仅存在第二检测阶段。
148.在一个实施方案中,图2(a)的系统可被另外配置来通过电外科器械102中的导管和运输管道148将流体(例如药物或化疗)递送到治疗区域。在一个实施方案中,容器150可包含用于储存待递送到治疗区域的流体的隔室(未示出),并且一个或多个阀(未示出)可选择性地打开和关闭从电外科器械到细胞计数器153的用于组织提取的第一路径,以及从隔室到电外科器械的用于流体递送的第二路径。一个或多个阀可能够由控制器114控制。泵106可在反向方向上驱动以便沿着第二路径将流体注射到电外科器械,或者可提供单独的注射泵。在另一个实施方案中,隔室可与容器150分开并且可在可切换接合点(未示出)处与运输管道148接合。可切换接合点可由控制器114控制以选择性地打开和关闭第一路径和第二路径,以实现组织提取和流体递送。在另外的实施方案中,运输管道148与容器150或细胞计数器153之间的连接可以是可释放的,使得运输管道148可与容器150或细胞计数器153分离然后重新附接到隔室,反之亦然。因此,在一个实施方案中,图2(a)的系统具有与电外科器械102的导管流体连通的流体注射机构,使得可将流体(例如药物或化疗)注射到治疗区域中。
149.细胞计数器器械
150.现在将更详细地描述上文参考图2(a)所描述的细胞计数器(或细胞分选仪)153。在一个实施方案中,细胞计数器153可以是流式细胞计数器,其检测并测量一群细胞或粒子的物理和化学特性。在另一个实施方案中,细胞计数器153可以是光谱仪(例如微型光谱仪),例如,其使用拉曼光谱来检测一种或多种特定细胞类型的存在(或区分所述一种或多种特定细胞类型)。
151.在一个实施方案中,细胞计数器153可包括商用现货细胞计数器,诸如来自menarini
‑
silicon biosystems的deparray
tm
系统。
152.在一个实施方案中,可提供样本发生器以产生用于由细胞计数器153分选的样本。样本发生器可以是容器150、细胞计数器153的一部分,或者可以是连接到容器150和细胞计数器153两者的单独元件。在任何情况下,样本发生器通过将来自容器150的细胞悬浮在流体(例如缓冲流体)中来形成用于分析的样本,并且然后将样本提供(例如注射)给细胞计数器153。流体可从流体贮存器提供,所述流体贮存器可以是容器150、细胞计数器153的一部分,或者可以是连接到容器150和细胞计数器153两者的单独元件。在任何情况下,可将样本聚焦以理想地一次使一个细胞流过细胞计数器153的检测区域,在所述检测区域中,基于不同细胞类型(例如癌干细胞与其他细胞)之间的电磁特征的差异执行细胞分选。在结合液体射流(hydro
‑
fluidic)操纵和电磁操纵的实施方案中,细胞根据它们对特定电磁信号的磁化率被动态地分选到不同的物理位置或箱中。具体而言,mhz范围中的电磁场用于使用介电电泳(dep)力选择性地对细胞进行电操纵,如图2(b)所示。图2(b)示出进入细胞计数器153的输入区域182(例如微流体通道)的细胞样本。样本包括包含癌干细胞和一种或多种其他类型的细胞的悬浮液。输入区域182可被配置(例如尺寸被设定)成使得样本的细胞以基本上单列流动。输入区域182与检测区域184流体连通,使得细胞的样本流入检测区域184中。检测区域184包括在第一电极阵列186与第二电极阵列188中间的微流体通道。第一电极阵列186连接到由电子部件(例如包括ac源)组成的第一驱动电路187,而第二电极阵列188连接到由电子部件(例如包括ac电源)组成的第二驱动电路189。第一驱动电路和第二驱动电路可以是同一电子电路的一部分。在任何情况下,第一驱动电路和第二驱动电路向第一阵列和第二阵列施加电磁信号以将细胞样本分选到分选区域190内的特定位置中。具体而言,分选区域190包括第一箱192和第二箱194。进入检测区域184的细胞将被第一阵列和第二阵列由于施加到其上的电磁信号而产生的电磁场偏离(例如移动)。给定细胞的轨迹将取决于细胞的特性(例如所述细胞是否为癌干细胞)和电磁信号。因此,可选择电磁信号使得癌干细胞(例如第一预定细胞类型)跟随第一轨迹进入第一箱192,而非癌干细胞(即不是第一预定细胞类型)跟随第二轨迹进入第二箱194。以此方式,进入细胞计数器153的细胞样本被分选到不同的箱中。然后细胞计数器153可用于通过确定第一箱192中细胞的存在或不存在来检测给定样本中癌干细胞的存在或不存在。此确定可由细胞计数器153本身或由(例如是容器150的一部分的)单独的检测设备来执行。在任何情况下,可产生检测信号来指示癌干细胞的存在和/或不存在。可将此检测信号发送到控制器114,使得系统的操作可基于所述指示。
153.应当理解,在一些实施方案中,可仅提供单个箱,例如箱192。以此方式,可仅收集所关注类型的细胞(例如癌干细胞),而可丢弃所有其他细胞类型。
154.在一个实例中,在隧穿手术期间,电外科器械104可与泵106一起使用(例如由外科医生对患者进行手术)以在容器150中获得第一组活检细胞,并且可使用细胞计数器153来识别第一组活检细胞不包括癌干细胞。在这种情况下,控制器114可(例如通过用户接口152)简单地通知用户尚未检测到癌细胞。因此,用户可有信心将电外科器械104进一步隧穿到患者中。此操作序列可重复一次或多次。在某一时刻,细胞计数器153可检测到癌干细胞的存在并将检测信号传输到控制器114以告知控制器114癌干细胞的存在。在接收到检测信
号时,控制器114可执行多个不同的操作。例如,控制器114可(例如通过用户接口152)通知用户已经检测到癌干细胞。另外地或替代地,控制器114可使用电外科器械104和系统的其他部分来开始某种形式的治疗操作。治疗操作可包括以下中的一者或多者:执行临时电穿孔达第一时间段以打开癌干细胞的孔隙(即致敏癌干细胞);将药物(例如局部化疗)注射到致敏癌干细胞中;使用微波能量使所注射药物活化;使用微波能量消融癌干细胞达第二时间段;以及对癌干细胞执行不可逆电穿孔(即消融细胞)达第三时间段。当然,虽然系统可被配置来在检测到癌干细胞时(例如通过控制器114)自动地执行此类操作,但系统也可以仅(例如通过用户接口152)通知用户癌干细胞的存在,使得用户可手动地执行此类操作。
155.上面的实例集中在区分癌干细胞与其他细胞类型的细胞计数器153上。然而,应当理解,细胞计数器153可被配置来区分其他细胞类型或类别。例如,细胞计数器153可被配置来区分健康细胞与癌细胞,或癌细胞与癌干细胞,或血细胞与脂肪细胞。注意,在此上下文中,表述
‘
被配置来’包括选择用于施加到检测区域184的阵列的特定电磁信号,其将一种细胞类型或类别不同地转向一种或多种其他细胞类型或类别。
156.而且,如上文所论述,在一些其他实施方案中,容器150、泵106、阀151和细胞计数器153中的一者或多者可组合到同一物理设备中。例如,容器150、泵106、阀151和细胞计数器153可由连接到控制器114并由其控制的单个设备(又名细胞识别组件)替换。
157.电外科器械
158.根据本发明的实施方案的电外科器械200在图3和图4中示出。图3示出电外科器械200的远端的示意性横截面侧视图。图4a示出电外科器械200的远侧部分的扩大横截面侧视图,并且图4b示出电外科器械200的近侧部分的扩大横截面侧视图。电外科器械200可提供图1的远侧组件118或图2(a)的电外科器械104。
159.电外科器械200包括柔性同轴电缆202和安装在同轴电缆202的远端处的辐射尖端部分204。同轴电缆202可以是适合于行进穿过外科窥视装置的器械通道的常规柔性50ω同轴电缆。同轴电缆包括由介电材料210隔开的中心导体206和外导体208。同轴电缆202可在近端处连接到电外科发生器以接收微波能量和电穿孔信号。
160.辐射尖端部分204包括近侧同轴传输线212和安装在近侧同轴传输线212的远端处的远侧针尖214。近侧同轴传输线212包括内导体216,所述内导体216在同轴电缆202的远端处电连接到同轴电缆202的中心导体206。内导体216与中心导体206相比具有更小的外径,并且由具有高导电性的材料(例如银)制成。
161.内导体216沿着其近侧部分被近侧介电套筒218围绕。近侧介电套筒可由柔性绝缘材料(例如ptfe等)制成。远侧介电套筒220安装在内导体216的远侧部分之上以形成辐射尖端部分214。远侧介电套筒220由硬质绝缘材料形成,所述硬质绝缘材料与近侧介电套筒218相比具有更高刚度。例如,远侧介电套筒220可由氧化锆制成。
162.近侧同轴传输线212由安装在近侧介电套筒218周围的外导体222完成。外导体222由导电材料制成的柔性管形成。所述管被配置来具有足以传输能够穿透生物组织(例如十二指肠壁)的力的纵向刚度,同时还表现出使器械能够行进穿过外科窥视装置的器械通道的合适的横向挠曲。发明人已经发现镍钛诺是特别适合于外导体222的材料。镍钛诺管可例如在其内表面上包括导电涂层,以便减少沿着近侧同轴传输线212的传输损耗。此涂层可由与镍钛诺相比具有更高导电性的材料(例如银等)形成。
163.内导体216包括中空区段,所述中空区段限定来自组织连接管道101到辐射尖端部分214的远侧尖端之间的接口的内孔(或通道或导管)217,其中生物组织被吸入内导体216中。内导体216还可在其与中心导体206的连接与其与组织连接管道101的连接之间具有实心(即,不中空)区段。内导体216的内孔217具有直径,使得实心区段与内导体216的远侧尖端之间的壁厚使得微波能量的运输不受去除内导体216的中心区段的影响,并且中空区段的壁具有足够的强度来支撑自身并允许在制造器械时容易地组装电外科器械。优选地,内导体216的中空区段的壁厚至少为五或六个趋肤深度厚度,以便确保大部分微波能量被转移。趋肤深度由材料的性质和操作频率确定。例如,内导体216的中空区段的壁厚可以是约五微米。连接管道101将内导体216的内孔217连接到图2(a)的运输管道148,所述运输管道148附接到收集容器150(或细胞识别组件)。管道101可由介电材料或导体制成。优选地,管道101由与介电套筒218的材料相似的材料制成,以便保留同轴结构的特性阻抗并使结构内的不连续性最小化。管道101的位置、大小和材料可能影响在同轴结构中设置的横向电磁(tem)场,但场分布的任何变化可通过在靠近管道101的结构内部包括匹配变换器来补偿;匹配变换器可以是调谐短截线,其可以是导电销或介电柱。如果需要匹配连接管道101的影响的手段,那么匹配结构可简单地是介电套筒218的相对介电常数的变化或插入穿过连接管道101区域中的外导体222的壁的附加销。匹配结构的具体实施方案将取决于电外科器械200的具体几何形状,并且可能需要执行完整电外科器械的电磁场模拟以确定要使用的最佳匹配结构。应注意,对于小型馈送通道217和小型连接管道101,通过将连接管道101包括到结构中所产生的场不连续性将是可忽略不计的,因此可将其忽略。本发明不限于使用单个馈送管道101。可能优选地,使用多个馈送管道以便使活检(或材料)通道217内的流动收缩最小化。例如,可使用四个馈送管道而不是图3所示的单个馈送管道101。可能优选地,布置四个馈送管道以使得管道的总横截面等于活检通道217的横截面以便使可能发生的可能收缩最小化。在此情况下,活检样本(或其他材料)将从外导体222壁中的四个出口(或者在要将材料递送到体内的情况下为入口)采集。可调节馈送管道之间的间距以使由将单个馈送管道101引入系统中而导致的失配最小化,即这可去除对要引入的单独阻抗变换器(或匹配短截线)的需要。
164.外导体222上覆于远侧介电套筒220的近侧部分,以形成近侧同轴传输线212的远侧部分。重叠区域可被认为是中间同轴传输线。由于远侧介电套筒220与近侧介电套筒218相比具有更高的介电常数,外导体222与远侧介电套筒220之间的重叠区域使得能够减小辐射尖端部分212的物理长度同时维持期望的电气长度。可选择外导体222与远侧介电套筒220之间的重叠长度以及远侧介电套筒和近侧介电套筒的介电材料以获得辐射尖端部分212的期望的电气长度。
165.远侧针尖214包括安装在内导体216的远端处的活性电极224。活性电极是圆柱形导电材料(例如黄铜)件,其具有穿过其延伸的中心通道226。图5中更详细地示出活性电极,其示出电极的透视图(a)和电极的横截面侧视图(b)。内导体216的远端突出到通道226内部,在所述通道226内部,内导体216的远端(例如通过钎焊或焊接连接,或使用导电粘合剂)电连接到活性电极224。活性电极的外径基本上匹配远侧介电套筒220的外径,使得远侧针尖214具有光滑的外表面。
166.尖锐的尖端元件228安装在活性电极224的远侧面上,以有利于将器械插入靶组织
中。尖端元件228优选地由与远侧介电套筒220相同的材料(例如氧化锆)制成。尖端元件228在图6中更详细地示出,其示出尖端元件的侧视图(a)、尖端元件的透视图(b)和尖端元件的后视图(c)。尖端元件228的示例性尺寸在图6(a)和图6(c)中示出。尖端元件228具有锥形主体230,所述锥形主体230具有从其近侧延伸的突出部232。突出部232的形状被设定成配合在活性电极224中的通道226内部,以将尖端元件228保持在适当位置。尖端元件228可例如使用粘合剂固定到活性电极224。尖端元件228还具有穿过其延伸的通道235。如在图6b上更具体地看到的,通道235具有入口237和出口238。入口237被布置(例如大小被设定和定位)成与内导体216的内孔217的远端对准,使得通道235提供到内孔217的延伸。出口238示出在尖端元件224的侧面部分上,然而,应当理解,在一些其他实施方案中,出口238可位于尖端元件228的顶点处。因此,通道235可具有或可不具有图3和图4a所示的弯曲。
167.近侧介电套筒218和远侧介电套筒220可形成为在内导体216之上滑动的管。在一个实施方案中,远侧介电套筒220可由安装在内导体216周围的一对协作零件组成。图7示出可用于形成远侧介电套筒220的零件700的实例。图7示出零件的侧视图(a)、零件的透视图(b)和零件的正视图(c)。零件700的示例性尺寸在图7(a)和图7(c)中示出。零件700是具有沿着其长度延伸的纵向凹槽702的半圆柱形刚性介电材料(例如氧化锆)件。可将一对零件700组装在一起以形成远侧介电套筒220,使得每个零件700中的凹槽702一起形成接收内导体216的通道。两个零件700可例如使用粘合剂固定在一起。远侧介电套筒220的这种结构可促进辐射尖端部分212的组装。包括一对协作零件的类似结构也可用于近侧介电套筒218。
168.近侧同轴传输线212通过轴环(或连接器)236固定到同轴电缆202的远端。轴环236可用作径向卷边以将近侧同轴传输线212固定在适当位置。轴环236还被布置来将同轴电缆202的外导体208电连接到近侧同轴传输线212的外导体218。因此,轴环236由导电材料(例如黄铜等)形成。轴环236可提供图2(a)的连接器144的至少一部分。
169.图8和图9示出远侧尖端的替代布置。在此布置中,尖锐的尖端元件和活性电极组合在单个尖端元件250中。尖端元件250包括远侧尖锐尖端252,所述远侧尖锐尖端252例如具有锥形形状、与在其中具有用于接收内导体216的远侧部分的内孔256的近侧圆柱形部分254一体地形成。如前所述,尖端元件250具有内部通道235,所述内部通道235将内导体216的中空内部(即内孔217)与出口238连接。尖端元件250可由单个导电材料(诸如银)件制成。在使用中,微波能量和具有电穿孔波形的能量可从同轴电缆202输送到辐射尖端部分。从同轴电缆202接收的能量可沿着近侧同轴传输线212传输到远侧针尖214,在所述远侧针尖214处能量可被递送到靶组织。
170.在微波能量下,远侧针尖214被布置来作为将微波能量递送到靶组织中的半波长变换器执行。换句话说,远侧针尖214的电气长度可对应于微波能量的一半波长。以此方式,可将微波能量高效地递送到靶组织,以便消融靶组织。
171.微波能量可以脉冲递送,以便在微波消融期间使辐射尖端部分212中的加热最小化。发明人已经发现,下文列出的能量递送循环或剖面可实现微波能量的高效递送,同时使辐射尖端部分212中的加热最小化,然而其他能量递送循环也是可能的:
172.●
10ms微波能量递送,随后90ms关闭(即没有微波能量递送);
173.●
10ms微波能量递送,随后50ms关闭;
174.●
10ms微波能量递送,随后30ms关闭;
175.●
100ms微波能量递送,随后900ms关闭
176.●
100ms微波能量递送,随后500ms关闭;
177.●
100ms微波能量递送,随后300ms关闭;
178.当电穿孔能量被输送到辐射尖端部分时,可在活性电极224与外导体222的远侧部分239(远端)之间建立电场。以此方式,外导体222的最远侧边缘或终端(其可被暴露)可表现为用于电穿孔能量的返回电极。电场可引起位于远侧针尖214周围的组织的电穿孔(例如不可逆电穿孔)。由于活性电极224基本上对称地围绕器械的纵向轴线设置,因此由电穿孔波形引起的电场可以是轴向对称的。在其他实例中,例如通过活性电极的合适配置,治疗区域可以是非对称的。
179.电外科器械200被配置成用作消融装置,以将沿着同轴电缆输送的微波和电穿孔能量递送到生物组织中。电外科器械200被特别设计成适合于插入穿过外科窥视装置(例如内窥镜超声(eus)设备)的器械通道到达治疗部位。治疗部位可以是胰腺,由此外科窥视装置的器械用软线插入十二指肠中,随之电外科器械200延伸以穿透十二指肠壁进入胰腺中到达治疗部位。
180.电外科器械可具有使其适用于这种背景的若干特征。器械的辐射尖端部分212期望地具有等于或大于40mm的长度,其中最大外径为约19g(1.067mm)或22g(0.7176mm)。这可确保针足够长以到达(例如)位于胰腺内的肿瘤,并且可确保穿透孔不会太大以促进愈合。
181.图3示出电外科器械200的示例性尺寸。在第一实例中,由附图标号240指示的对应于近侧介电套筒218的长度的尺寸可以是37.0mm。由附图标号242指示的对应于外导体222与远侧介电套筒220之间的重叠长度的尺寸可以是4.70mm。由附图标号244指示的对应于从外导体222的远端到活性电极224的远端的距离的尺寸可以是3.00mm。在使用图9所示的尖端元件的第二实例中,尺寸240是37.0mm,尺寸242是8.30mm,以及尺寸244是5.00mm。
182.图10示出电外科器械200的近端的替代布置。在此实施方案中,电外科器械200的远端如上述图4(a)中所呈现。注意,远端位于图10的右侧(即与图4(b)相反)。如上文所陈述,电外科器械200具有包括通过介电材料218与内导体216分开的外导体222的同轴馈送结构。内导体216是中空的以限定用于从在器械的远端处的治疗部位去除活检组织(例如细胞或流体)的通道217。然而,在此替代布置中,馈送结构是侧馈,即微波能量从相对于馈送结构的轴线成角度(即与轴线成90
°
)的方向递送到器械200中。如前所述,微波能量从电缆组件202递送;然而,这次电缆202通过连接器300连接到器械200。连接器300可形成图2(a)的连接器144的一部分。连接器300可以是常规的,例如n型、sma型或者以及mcx。连接器300具有从连接器300延伸穿过介电材料218以接触内导体216的中心销302。连接器300还具有与外导体222电接触的导电外套筒304。为了确保能量馈送是有效的,内导体216(302)和外导体222(304)在器械200的近端306处彼此电接触以创建短路条件,并且中心销302在距离短路位置四分之一波长的奇数倍的距离处接触内导体216,以在此点处产生e场最大值。这在图10中示出为参考标记
‘
d’。
183.侧馈布置的优势在于可例如通过附接在器械200的近端306处的柔性提取管101沿着同轴结构的轴线提取活检组织(例如流体或细胞)。因此提取路径可没有锐化边角,这可促进平稳流动。可附接塞子308以围绕器械200与提取管101之间的接口密封从而防止泄漏。
184.在前述描述中、或在以下权利要求中、或在附图中所公开的以其具体形式或根据
用于执行所公开功能的手段,或用于获得所公开结果的方法或过程来表达的特征可单独地或以此类特征的任何组合用于以其多样化的形式实现本发明。
185.虽然已经结合上面描述的示例性实施方案描述了本发明,但是当给出本公开内容时,许多等效修改和变型对于本领域技术人员将是显而易见的。因此,上面阐述的本发明的示例性实施方案被认为是说明性而非限制性的。在不脱离本发明的精神和范围的情况下可对所描述的实施方案作出各种改变。
186.为避免任何疑问,本文提供的任何理论解释都是为了提高读者的理解。发明人不希望受任何这些理论解释的束缚。
187.本文所使用的任何小节标题仅出于组织性目的且不诠释为限制所描述的主题。
188.在包括下面权利要求的整个说明书中,除非上下文另外要求,否则词语“具有(have)”、“包含(comprise)”和“包括(include)”及变型(诸如“具有(having)”、“包含(comprises/comprising)”和“包括(including)”)将理解为隐含包括规定的整数或步骤或整数或步骤的组但不排除任何其它整数或步骤或整数或步骤的组。
189.必须注意,除非上下文另有明确规定,如说明书和所附权利要求中所使用,单数形式“一个”、“一种”和“所述”包括复数指示物。范围可在本文中表达为从“约”一个特定值起和/或到“约”另一个特定值。当表达这种范围时,另一个实施方案包括从所述一个特定值和/或到所述另一个特定值。类似地,在通过使用先行词“约”将值表达为近似值时,将了解具体值形成另一个实施方案。与数值相关的术语“约”是可选的,并且意指(例如)+/
‑
10%。
190.本文使用的词语“优选”和“优选地”是指在一些情况下可以提供某些益处的本发明的实施方案。然而,应了解,在相同或不同情况下其他实施方案也可以是优选的。因此,一个或多个优选实施方案的叙述并不意指或隐含其他实施方案是没有用的,并且不意图将其他实施方案排除在本公开的范围或权利要求的范围之外。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1