抗体药物缀合物的制作方法
抗体药物缀合物
1.以电子形式提交的序列表的引用
2.以电子形式提交的序列表(名称:3817_053pc03_seqlisting_st25;大小:7,104字节,和创建日期:2020年4月22日)的内容通过引用整体并入本文。
技术领域
3.本发明提供包含sting调节剂的抗体药物缀合物。还提供包含所述抗体药物缀合物的组合物。所述化合物和组合物可用于刺激有需要的受试者的免疫反应。
背景技术:
4.抗体药物缀合物(adc)是一类快速发展的靶向治疗剂,代表了有望提高药物的选择性和细胞毒性活性的新方法。这些治疗剂包含抗体(或抗体片段),所述抗体(或抗体片段)可连接至有效负载药物以形成免疫缀合物。抗体使adc定向以与靶向细胞结合。然后adc可内化并释放其有效负载,从而为细胞提供治疗。当adc定向至其靶向细胞时,缀合药物的副作用可能低于当全身性施用同一剂时遇到的副作用。
5.已显示衔接蛋白sting(干扰素基因的刺激剂)在先天免疫系统中发挥作用。sting通路的激活触发免疫反应,使得产生特异性杀伤t细胞,所述特异性杀伤t细胞使肿瘤缩小并可提供长效免疫,从而使肿瘤不再复发。激活的sting通路还通过产生抗病毒和促炎细胞因子来促进抗病毒反应,所述抗病毒和促炎细胞因子对抗病毒并动员先天和适应性免疫系统,最终产生针对致病病毒的长效免疫。增强先天和适应性免疫反应的潜在治疗益处使sting成为药物发现的有吸引力的靶标。环状二核苷酸可能起sting激动剂的作用并且正在临床试验中进行测试。然而,它们的阴离子性质使其膜渗透性差,这可能限制其在细胞内接合sting的能力,经常导致这些化合物在血流中不希望的分布。
6.仍然需要新的sting激动剂以及改进的将其递送至靶向细胞的方法。
技术实现要素:
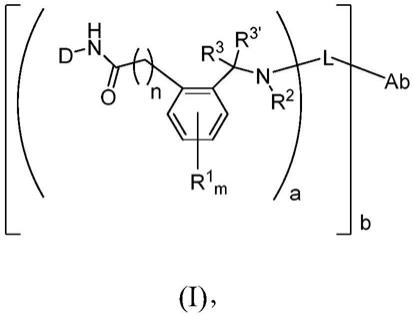
7.在第一方面,本发明提供式(i)化合物:
[0008][0009]
或其药学上可接受的盐,其中:
[0010]
a是1至20的整数;
[0011]
b是1至20的整数;
[0012]
m是0、1、2、3或4;
[0013]
n是0或1;
[0014]
d-nh-是氨基取代的化合物的一部分,其中所述氨基取代的化合物具有式d-nh2;
[0015]
每个r1独立地选自c
1-c4烷基、o-c
1-c4烷基和卤素;
[0016]
r2选自c
1-c4烷基和-(ch2ch2o)
s-ch3;其中s是1至10的整数;
[0017]
r3和r
3'
各自独立地选自氢和c
1-c3烷基;
[0018]
l是可切割接头;并且
[0019]
ab是抗体、抗体片段或抗原结合片段。
[0020]
在第一方面的第一实施方案中,a是1至4的整数;b是1至10的整数;并且m是0。
[0021]
在第一方面的第二实施方案中,a是1至4的整数;m是0;n是0;并且r3和r
3'
各自是氢。
[0022]
在第一方面的第三实施方案中,l是
[0023][0024]
其中:
[0025]
是与氮原子的连接点;
[0026]
是与ab的连接点;
[0027]
t是1至10的整数;
[0028]
w不存在或者是自消性基团;
[0029]
z不存在或者是2至5个氨基酸的肽;
[0030]
u和u'独立地不存在或者是间隔子;并且
[0031]
q是异双官能团;
[0032]
条件是w和z并非同时不存在。
[0033]
在第一方面的第四实施方案中,w是选自以下的自消性基团:
[0034][0035]
其中:
[0036]
是与羰基的连接点;并且
[0037]
是与z的连接点。
[0038]
在第一方面的第五实施方案中,w选自
[0039][0040]
在第一方面的第六实施方案中,w是
[0041]
在第一方面的第七实施方案中,z是能够被酶促切割的肽。在第八实施方案中,z是组织蛋白酶可切割的。在第九实施方案中,z是选自val-cit、cit-val、val-ala、ala-val、phe-lys和lys-phe的二氨基酸肽。在第一方面的第十实施方案中,z是val-ala或ala-val。
[0042]
在第一方面的第十一实施方案中,u和u'独立地不存在或者选自
[0043][0044]
其中:
[0045]
是与z的连接点;
[0046]
是与q的连接点;
[0047]
p是1至6的整数;
[0048]
q是1至20的整数;
[0049]
x是o或-ch
2-;并且
[0050]
每个r独立地是0或1。
[0051]
在第一方面的第十二实施方案中,u'不存在并且u是
[0052][0053]
在第一方面的第十三实施方案中,q是能够经由化学或酶介导的缀合连接至ab的异双官能团。在第十四实施方案中,q选自
[0054][0055]
其中
[0056]
是与u的连接点,或者当u不存在时是与z的连接点;并且
[0057]
是与u'的连接点,或者当u'不存在时是与ab的连接点。
[0058]
在第一方面的第十五实施方案中,本发明提供式(i)化合物或其药学上可接受的盐,其中l是:
[0059][0060]
并且其中t是1;w不存在或者是自消性基团;并且z不存在或者是二氨基酸肽。
[0061]
在第一方面的第十六实施方案中,本发明提供式(i)化合物或其药学上可接受的盐,其中r2是-ch3或-(ch2ch2o)
s-ch3并且s是1至10的整数。
[0062]
在第一方面的第十七实施方案中,本发明提供式(i)化合物或其药学上可接受的盐,其中d-nh2是调节sting活性的氨基取代的化合物。在第一方面的第十八实施方案中,调节sting活性的氨基取代的化合物包含鸟嘌呤或腺嘌呤衍生物。
[0063]
在第十九实施方案中,调节sting活性的氨基取代的化合物是式(ii)化合物:
[0064][0065]
或其药学上可接受的盐,其中:
[0066]
x
10
是sh或oh;
[0067]
x
20
是sh或oh;
[0068]
ya是o、s或ch2;
[0069]
yb是o、s、nh或nra,其中ra是c
1-c4烷基;
[0070]r10
是氢、氟、oh、nh2、orb或nhrb;
[0071]r20
是氢或氟;
[0072]r30
是氢;r
40
是氢、氟、oh、nh2、orb或nhrb;或者r
30
和r
40
一起形成ch2o;
[0073]r50
是氢或氟;
[0074]
rb是c
1-c6烷基、卤代(c
1-c6)烷基或c
3-c6环烷基;
[0075]
环a
10
是任选地被取代的含有1-4个选自n、o或s的杂原子的5元或6元单环杂芳基环,或任选地被取代的含有1-5个选自n、o或s的杂原子的9元或10元双环杂芳基环;其中环a
10
在环中包含至少一个n原子,并且其中yb连接至环a
10
的碳原子;并且
[0076]
环b
10
是任选地被取代的含有2至5个选自n、o或s的杂原子的9元或10元双环杂芳基环;其中环b
10
在环中包含至少两个n原子;
[0077]
条件是环a
10
或环b
10
经由-nh-基团连接至式(i)的羰基。
[0078]
在第二十实施方案中,调节sting活性的氨基取代的化合物是
[0079][0080]
或其药学上可接受的盐,其中是与式(i)的羰基的连接点。
[0081]
在第一方面的第二十一实施方案中,调节sting活性的氨基取代的化合物是式(iii)化合物:
[0082][0083]
或其药学上可接受的盐;其中
[0084]
x
10
是sh或oh;
[0085]
x
20
是sh或oh;
[0086]
yc是o、s或ch2;
[0087]
yd是o、s或ch2;
[0088]b100
是由式(b
1-a)或式(b
1-b)表示的基团:
[0089][0090]r13
、r
14
、r
15
、r
16
和r
17
各自独立地是氢原子或取代基;
[0091]r1000
是氢或连接至式(i)的羰基的键;
[0092]y11
、y
12
、y
13
、y
14
、y
15
和y
16
各自独立地是n或cr
1a
,其中r
1a
是氢或取代基;
[0093]z11
、z
12
、z
13
、z
14
、z
15
和z
16
各自独立地是n或c;
[0094]r105
是氢原子或取代基;
[0095]b200
是由式(b
2-a)或式(b
2-b)表示的基团:
[0096][0097]r23
、r
24
、r
25
、r
26
和r
27
各自独立地是氢原子或取代基;
[0098]r100'
是氢或连接至式(i)的羰基的键;
[0099]y21
、y
22
、y
23
、y
24
、y
25
和y
26
各自独立地是n或cr
2a
,其中r
2a
是氢或取代基;
[0100]z21
、z
22
、z
23
、z
24
、z
25
和z
26
各自独立地是n或c;并且
[0101]r205
是氢原子或取代基;其中r
105
和r
205
各自独立地连接至其分别连接的5元环的2位或3位;
[0102]
条件是:
[0103]b100
或b
200
中的一者经由-nh-基团连接至式(i)的羰基。
[0104]
在第一方面的第二十二实施方案中,调节sting活性的氨基取代的化合物是式(iiia)化合物,
[0105][0106]
或其药学上可接受的盐;其中
[0107]b100
是由式(b
1-a)或式(b
1-b)表示的基团:
[0108][0109]r13
、r
14
、r
15
、r
16
和r
17
各自独立地是氢原子或取代基;
[0110]r1000
是氢或连接至式(i)的羰基的键;
[0111]y11
、y
12
、y
13
、y
14
、y
15
和y
16
各自独立地是n或cr
1a
,其中r
1a
是氢或取代基;
[0112]z11
、z
12
、z
13
、z
14
、z
15
和z
16
各自独立地是n或c;
[0113]r105
是氢原子或取代基;
[0114]b200
是由式(b
2-a)或式(b
2-b)表示的基团:
[0115][0116]r23
、r
24
、r
25
、r
26
和r
27
各自独立地是氢原子或取代基;
[0117]r100'
是氢或连接至式(i)的羰基的键;
[0118]y21
、y
22
、y
23
、y
24
、y
25
和y
26
各自独立地是n或cr
2a
,其中r
2a
是氢或取代基;
[0119]z21
、z
22
、z
23
、z
24
、z
25
和z
26
各自独立地是n或c;并且
[0120]r205
是氢原子或取代基;其中r
105
和r
205
各自独立地连接至其分别连接的5元环的2位或3位;
[0121]
条件是:
[0122]b100
或b
200
中的一者是:
[0123][0124]
其中:
[0125]r18
是氢或c
1-6
烷基;并且
[0126]r19
是卤素原子;
[0127]
并且另一者经由-nh-基团连接至式(i)的羰基。
[0128]
在第一方面的第二十三实施方案中,调节sting活性的氨基取代的化合物是:
[0129][0130]
或其药学上可接受的盐,其中是与式(i)的羰基的连接点。
[0131]
在第二方面,本发明提供式(iv)化合物:
[0132][0133]
或其药学上可接受的盐,其中:
[0134]
a是1至20的整数;
[0135]
b是1至20的整数;
[0136]
k是0、1、2或3;
[0137]
m是0、1、2、3或4;
[0138]
d-nh-是氨基取代的化合物的一部分,其中所述氨基取代的化合物具有式d-nh2;
[0139]
r2选自h、c
1-c4烷基和-(ch2ch2o)
s-ch3;其中s是1至10的整数;
[0140]
r4选自氢和任何天然存在的氨基酸侧链;
[0141]
r5选自c
1-c4烷基和o-c
1-c4烷基;
[0142]
l是可切割接头;并且
[0143]
ab是抗体、抗体片段或抗原结合片段。
[0144]
在第二方面的第一实施方案中,l是
[0145][0146]
其中:
[0147]
是与羰基的连接点;
[0148]
是与ab的连接点;
[0149]
w是自消性基团;
[0150]
z不存在或者是2至5个氨基酸的肽;并且
[0151]
u和u'独立地不存在或者是间隔子;并且
[0152]
q是异双官能团。
[0153]
在第三方面,本发明提供式(v)化合物:
[0154][0155]
或其药学上可接受的盐,其中:
[0156]
d-nh-是
[0157]
x是o或ch2;
[0158]
f是1至10的整数;
[0159]
g是1至20的整数;
[0160]
u和u'独立地不存在或者是间隔子;
[0161]
q是异双官能团;并且
[0162]
ab是抗体,ab是抗体、抗体片段或抗原结合片段。
[0163]
在第三方面的第一实施方案中,x是o。
[0164]
在第四方面,本发明提供式(vi)化合物:
[0165][0166]
或其药学上可接受的盐,其中:
[0167]
a是1至20的整数;
[0168]
m是0、1、2、3或4;
[0169]
n是0或1;
[0170]
d-nh-是氨基取代的化合物的一部分,其中所述氨基取代的化合物具有式d-nh2;
[0171]
每个r1独立地选自c
1-c4烷基、o-c
1-c4烷基和卤素;
[0172]
r2选自c
1-c4烷基和-(ch2ch2o)
s-ch3;其中s是1至10的整数;
[0173]
r3和r
3'
各自独立地选自氢和c
1-c3烷基;
[0174]
l是可切割接头;并且
[0175]
lp是脂质。
[0176]
在第四方面的第一实施方案中,脂质是胆固醇或磷脂。在第四方面的第二实施方案中,脂质是磷脂。在第四方面的第三实施方案中,磷脂选自磷脂酰胆碱、磷脂酰甘油、磷脂酸、磷脂酰乙醇胺、磷脂酰丝氨酸、鞘磷脂、大豆磷脂和蛋黄磷脂。在第四方面的第五实施方案中,磷脂是磷脂酰乙醇胺,其中磷脂酰乙醇胺是1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺。
[0177]
在第四方面的第六实施方案中,本发明提供脂质复合物,其包含式(vi)化合物或其药学上可接受的盐。在第七实施方案中,脂质复合物呈脂质体形式。
[0178]
在第四方面的第八实施方案中,脂质复合物还包含一种或多种磷脂。在第九实施方案中,一种或多种磷脂选自磷脂酰胆碱、磷脂酰甘油、磷脂酸、磷脂酰乙醇胺、磷脂酰丝氨酸、鞘磷脂、大豆磷脂和蛋黄磷脂。在第十实施方案中,磷脂是磷脂酰胆碱,其中磷脂酰胆碱是1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱。
[0179]
在第四方面的第十一实施方案中,脂质复合物还包含脂肪醇和/或胆固醇。
[0180]
在第四方面的第十二实施方案中,脂质复合物还包含至少一种聚乙二醇化脂质。在第十三实施方案中,聚乙二醇化脂质选自聚乙二醇化磷脂和聚乙二醇化二酰基甘油。在第十四实施方案中,聚乙二醇化脂质是n-(羰基-甲氧基聚乙二醇2000)-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺。
[0181]
在第五方面,本发明提供一种药物组合物,所述药物组合物包含本文所述的化合物或复合物或其药学上可接受的盐和一种或多种药学上可接受的载体。
[0182]
在第六方面,本发明提供一种治疗有需要的受试者的癌症的方法,所述方法包括向所述受试者施用药学上可接受量的本文所述的化合物或复合物。
[0183]
在第七方面,本发明提供一种刺激有需要的受试者的免疫反应的方法,所述方法包括向所述受试者施用药学上可接受量的本文所述的化合物或复合物。
附图说明
[0184]
图1绘示经由随机半胱氨酸缀合制备ab-sting激动剂缀合物。
[0185]
图2绘示经由转谷氨酰胺酶缀合制备ab-sting激动剂缀合物。
[0186]
图3绘示经由转谷氨酰胺酶缀合制备ab-sting激动剂缀合物。
[0187]
图4绘示经由分选酶缀合制备ab-sting激动剂缀合物。(seq id3和seq id 4)
[0188]
图5绘示在去污溶酶体测定(tritosomal assay)中adc-1的有效负载释放。
[0189]
图6绘示在去污溶酶体测定中adc-3的有效负载释放。
[0190]
图7绘示在去污溶酶体测定中adc-9的有效负载释放。
[0191]
图8绘示在带有表达gcc的ct26的balb/c小鼠中adc-1的血浆pk(0.1mg/kg有效负载剂量)。
[0192]
图9绘示在带有表达gcc的ct26的balb/c小鼠中adc-8的血浆pk(0.055mg/kg有效负载剂量,释放cdn blq)。
[0193]
图10绘示在带有表达gcc的ct26的balb/c小鼠中adc-9的血浆pk(0.05mg/kg有效负载剂量,释放cdn blq)。
[0194]
图11绘示adc-1在带有表达gcc的ct26的balb/c小鼠中的功效(显示有效负载剂量)。
[0195]
图12绘示adc-5在带有表达gcc的ct26的balb/c小鼠中的功效(显示有效负载剂量)。
[0196]
图13绘示adc-8在带有表达gcc的ct26的balb/c小鼠中的功效(显示有效负载剂量)。
[0197]
图14绘示adc-9在带有表达gcc的ct26的balb/c小鼠中的功效(显示有效负载剂量)。
具体实施方式
[0198]
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的技术人员通常所理解相同的含义。本文提及的所有专利和出版物都通过引用整体并入。
[0199]
除非上下文另有说明,否则单数形式“一个”、“一种”和“所述”包括复数个指示物。
[0200]
除非用例如术语“任一”、“除非”、“可替代地”和具有类似效果的词语明确表示,否则如本文所用的术语“或”是逻辑析取(即和/或)并且不指示排他析取。
[0201]
如本文所用的术语“约”是指
±
10%。
[0202]
抗体药物缀合物
[0203]
在一些实施方案中,本发明提供式(i)化合物,
[0204]
[0205]
或其药学上可接受的盐,其中:
[0206]
a是1至20的整数;
[0207]
b是1至20的整数;
[0208]
m是0、1、2、3或4;
[0209]
n是0或1;
[0210]
d-nh-是氨基取代的化合物的一部分,其中所述氨基取代的化合物具有式d-nh2;
[0211]
每个r1独立地选自c
1-c4烷基、o-c
1-c4烷基和卤素;
[0212]
r2选自c
1-c4烷基和-(ch2ch2o)
s-ch3;其中s是1至10的整数;
[0213]
r3和r
3'
各自独立地选自氢和c
1-c3烷基;
[0214]
l是可切割接头;并且
[0215]
ab是抗体、抗体片段或抗原结合片段。
[0216]
在一些实施方案中,本发明提供式(iv)化合物,
[0217][0218]
或其药学上可接受的盐,其中:
[0219]
a是1至20的整数;
[0220]
b是1至20的整数;
[0221]
k是0、1、2或3;
[0222]
m是0、1、2、3或4;
[0223]
d-nh-是氨基取代的化合物的一部分,其中所述氨基取代的化合物具有式d-nh2;
[0224]
r2选自h、c
1-c4烷基和-(ch2ch2o)
s-ch3;其中s是1至10的整数;
[0225]
r4选自氢和任何天然存在的氨基酸侧链;
[0226]
r5选自c
1-c4烷基和o-c
1-c4烷基;
[0227]
l是可切割接头;并且
[0228]
ab是抗体、抗体片段或抗原结合片段。
[0229]
在一些实施方案中,本发明提供式(v)化合物:
[0230][0231]
或其药学上可接受的盐,其中:
[0232]
d-nh是
[0233]
x是o或ch2;
[0234]
f是1至10的整数;
[0235]
g是1至20的整数;
[0236]
u和u'独立地不存在或者是间隔子;
[0237]
q是异双官能团;并且
[0238]
ab是抗体、抗体片段或抗原结合片段。
[0239]
在式(i)和(iv)的化合物中,氨基取代的化合物d-nh2可为任何含氨基药物。在某些实施方案中,d-nh2是免疫调节剂。如本文所用的术语“免疫调节剂”是指在有需要的受试者中产生免疫反应的化合物。免疫调节剂的实例包括(但不限于)ido抑制剂、mek抑制剂、sting调节剂、ccr4拮抗剂、pd-1/pd-l1抑制剂、tlr7/8激动剂等。在一些实施方案中,d-nh2是sting调节剂。在一些实施方案中,d-nh2包含鸟嘌呤或腺嘌呤衍生物。在一些实施方案中,sting调节剂是下式的环状二核苷酸或环状二核苷酸样化合物(各自为cdn):
[0240][0241]
其中a'和a
″
各自独立地是核苷或其合成类似物;并且q、q'、q2和q
2'
中的每一者独立地是氧或硫。在一些实施方案中,q'和q
2'
是硫。在本发明的范围内的cdn(包括环状二核苷酸和环状二核苷酸样化合物)的实例包括(但不限于)us 9,724,408、us 10,106,574、us 9,549,944、us 9,695,212、us 9,718,848、us 9,994,607、us 10,047,115、us20180230178、us20180064745、us2018028132、us20180002369、us20180186828、us20190016750、us20180162899、us20180369268、us2018273578、us20180092937、wo2017/027646和wo2018/100558内公开的cdn;以及例如c-二-gmp、2'3'-cgamp和sb 11285(spring bank pharmaceuticals)的化合物。
[0242]
在某些实施方案中,sting调节剂是式(ii)化合物:
[0243][0244]
或其药学上可接受的盐,其中:
[0245]
x
10
是-sh或-oh;
[0246]
x
20
是-sh或-oh;
[0247]
ya是-o-、-s-或-ch
2-;
[0248]
yb是-o-、-s-、-nh-或-nr
a-,其中ra是c
1-c4烷基;
[0249]r10
是氢、氟、-oh、-nh2、-orb或-nhrb;
[0250]r20
是氢或氟;
[0251]r30
是氢;r
40
是氢、氟、-oh、-nh2、-orb或-nhrb;或者r
30
和r
40
一起形成-ch2o-;
[0252]r50
是氢或氟;
[0253]
rb是c
1-c6烷基、卤代(c
1-c6)烷基或c
3-c6环烷基;
[0254]
环a
10
是任选地被取代的含有1-4个选自n、o或s的杂原子的5元或6元单环杂芳基环,或任选地被取代的含有1-5个选自n、o或s的杂原子的9元或10元双环杂芳基环;其中环a
10
在环中包含至少一个n原子,并且其中yb连接至环a
10
的碳原子;并且
[0255]
环b
10
是任选地被取代的含有2-5个选自n、o或s的杂原子的9元或10元双环杂芳基环;其中环b
10
在环中包含至少两个n原子。
[0256]
如本文所述,环a
10
和环b
10
可含有一个或多个取代基并且因此可任选地被取代。杂芳基的不饱和碳原子上的合适的取代基包括并且通常选自-卤基、-no2、-cn、-r
+
、-c(r
+
)=c(r
+
)2、-c≡c-r
+
、-or
+
、-sro、-s(o)ro、-so2ro、-so3r
+
、-so2n(r
+
)2、-n(r
+
)2、-nr
+
c(o)r
+
、-nr
+
c(s)r
+
、-nr
+
c(o)n(r
+
)2、-nr
+
c(s)n(r
+
)2、-n(r
+
)c(=nr
+
)-n(r
+
)2、-n(r
+
)c(=nr
+
)-ro、-nr
+
co2r
+
、-nr
+
so2ro、-nr
+
so2n(r
+
)2、-o-c(o)r
+
、-o-co2r
+
、-oc(o)n(r
+
)2、-c(o)r
+
、-c(s)ro、-co2r
+
、-c(o)-c(o)r
+
、-c(o)n(r
+
)2、-c(s)n(r
+
)2、-c(o)n(r
+
)-or
+
、-c(o)n(r
+
)c(=nr
+
)-n(r
+
)2、-n(r
+
)c(=nr
+
)-n(r
+
)-c(o)r
+
、-c(=nr
+
)-n(r
+
)2、-c(=nr
+
)-or
+
、-n(r
+
)-n(r
+
)2、-c(=nr
+
)-n(r
+
)-or
+
、-c(ro)=n-or
+
、-p(o)(r
+
)2、-p(o)(or
+
)2、-o-p(o)-or
+
和-p(o)(nr
+
)-n(r
+
)2,其中r
+
独立地是氢或任选地被取代的脂族基团、芳基、杂芳基、环脂族基团或杂环基,或者两个独立出现的r
+
与其中间原子一起形成任选地被取代的5-7元芳基、杂芳基、环脂族基团或杂环基。在一些实施方案中,r
+
独立地是氢、c
1-6
脂族基团或c
3-6
环脂族基团。每个ro独立地是任选地被取代的脂族基团、芳基、杂芳基、环脂族基团或杂环基。
[0257]
如上文所详述,在一些实施方案中,两个独立出现的r
+
(或本文说明书和权利要求书中类似定义的任何其他变量)与其中间原子一起形成选自以下的单环或双环:3-13元环脂族基团,具有1-5个独立地选自氮、氧或硫的杂原子的3-12元杂环基,6-10元芳基,或具有1-5个独立地选自氮、氧或硫的杂原子的5-10元杂芳基。
[0258]
在一些实施方案中,sting调节剂是式(iia)化合物:
[0259][0260]
或其药学上可接受的盐,其中r
10
和r
40
各自独立地是氢、氟、-oh或-och2cf3并且环a
10
和b
10
是如针对式(ii)化合物所定义,条件是环a
10
或环b
10
经由-nh-基团连接至化合物(i)、(iv)或(v)母体分子部分的羰基。
[0261]
在一些实施方案中,环a
10
是任选地被取代的含有1个、2个或3个氮原子的6元单环杂芳基环。
[0262]
在一些实施方案中,环b
10
是:
[0263][0264]
其中:
[0265]z10
、z
20
、z
30
和z
40
各自独立地是n或cr
200
;
[0266]r210
是氢或c
1-c6烷基、卤代(c
1-c6)烷基或c
3-c6环烷基;
[0267]r230
是氢或-nh2;并且
[0268]r200
、r
220
和r
240
各自独立地是氢、卤素、-oh、-nh2、-cn、c
1-c6烷基、卤代(c
1-c6)烷基或c
3-c6环烷基。
[0269]
在一些实施方案中,sting调节剂是:
[0270][0271]
或其药学上可接受的盐,其中是与母体分子部分的羰基的连接点。
[0272]
在某些实施方案中,sting调节剂是式(x)的环状二核苷酸:
[0273][0274]
或其药学上可接受的盐,其中:
[0275]
由式(a-1)表示的部分结构:
[0276][0277]
是由式(z-a)或式(z-b)表示的部分结构:
[0278][0279]r105
和r
205
各自独立地是羟基或卤素原子;
[0280]b100
是由式(b
1-a)或式(b
1-b)表示的基团:
[0281][0282]r13
、r
14
、r
15
、r
16
和r
17
各自独立地是氢原子或取代基;
[0283]y11
、y
12
、y
13
、y
14
、y
15
和y
16
各自独立地是n或cr
1a
;
[0284]z11
、z
12
、z
13
、z
14
、z
15
和z
16
各自独立地是n或c;
[0285]r1a
是氢原子或取代基;
[0286]b200
是由式(b
2-a)或式(b
2-b)表示的基团:
[0287][0288]r23
、r
24
、r
25
、r
26
和r
27
各自独立地是氢原子或取代基;
[0289]y21
、y
22
、y
23
、y
24
、y
25
和y
26
各自独立地是n或cr
2a
;
[0290]z21
、z
22
、z
23
、z
24
、z
25
和z
26
各自独立地是n或c;
[0291]r2a
是氢原子或取代基;
[0292]
x1和x2各自独立地是氧原子或硫原子;并且
[0293]q1a
、q
2a
、q
3a
和q
4a
各自独立地是氧原子或硫原子;并且
[0294]b100
或b
200
中的一者经由-nh-基团连接至母体结构的5元环。
[0295]
在另一个实施方案中,b
100
或b
200
中的一者是:
[0296][0297]
其中:
[0298]r18
是氢或c
1-6
烷基;并且另一者经由-nh-基团连接至母体结构的5元环;并且
[0299]r19
是卤素原子;并且另一者经由-nh-基团连接至式(i)的羰基。
[0300]
在另一方面,本发明提供如本文所述的抗体药物缀合物。
[0301]
如本文所述,某些r基团选自氢和取代基。取代基的实例包括卤素原子、氰基、硝基、任选地被取代的烃基、任选地被取代的杂环基、酰基、任选地被取代的氨基、任选地被取代的氨甲酰基、任选地被取代的硫代氨甲酰基、任选地被取代的氨磺酰基、任选地被取代的羟基、任选地被取代的氢硫基(sh)和任选地被取代的甲硅烷基。
[0302]
如本文所用,在本说明书中,“烃基”(包括“任选地被取代的烃基”的“烃基”)的实例包括c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-10
环烷基、c
3-10
环烯基、c
6-14
芳基和c
7-16
芳烷基。
[0303]
在本说明书中,“任选地被取代的烃基”的实例包括任选地具有选自以下取代基组a的取代基的烃基,所述取代基组a包括:
[0304]
(1)卤素原子,
[0305]
(2)硝基,
[0306]
(3)氰基,
[0307]
(4)氧代基,
[0308]
(5)羟基,
[0309]
(6)任选地卤化的c
1-6
烷氧基,
[0310]
(7)c
6-14
芳氧基(例如苯氧基、萘氧基),
[0311]
(8)c
7-16
芳烷基氧基(例如苄基氧基),
[0312]
(9)5至14元芳族杂环基氧基(例如吡啶基氧基),
[0313]
(10)3至14元非芳族杂环基氧基(例如吗啉基氧基、哌啶基氧基),
[0314]
(11)c
1-6
烷基-羰基氧基(例如乙酰氧基、丙酰基氧基),
[0315]
(12)c
6-14
芳基-羰基氧基(例如苯甲酰基氧基、1-萘甲酰基氧基、2-萘甲酰基氧基),
[0316]
(13)c
1-6
烷氧基-羰基氧基(例如甲氧基羰基氧基、乙氧基羰基氧基、丙氧基羰基氧基、丁氧基羰基氧基),
[0317]
(14)单-或二-c
1-6
烷基-氨甲酰基氧基(例如甲基氨甲酰基氧基、乙基氨甲酰基氧基、二甲基氨甲酰基氧基、二乙基氨甲酰基氧基),
[0318]
(15)c
6-14
芳基-氨甲酰基氧基(例如苯基氨甲酰基氧基、萘基氨甲酰基氧基),
[0319]
(16)5至14元芳族杂环基羰基氧基(例如烟碱酰基氧基),
[0320]
(17)3至14元非芳族杂环基羰基氧基(例如吗啉基羰基氧基、哌啶基羰基氧基),
[0321]
(18)任选地卤化的c
1-6
烷基磺酰基氧基(例如甲基磺酰基氧基、三氟甲基磺酰基氧基),
[0322]
(19)任选地被c
1-6
烷基取代的c
6-14
芳基磺酰基氧基(例如苯基磺酰基氧基、甲苯磺酰基氧基),
[0323]
(20)任选地卤化的c
1-6
烷基硫基,
[0324]
(21)5至14元芳族杂环基,
[0325]
(22)3至14元非芳族杂环基,
[0326]
(23)甲酰基,
[0327]
(24)羧基,
[0328]
(25)任选地卤化的c
1-6
烷基-羰基,
[0329]
(26)c
6-14
芳基-羰基,
[0330]
(27)5至14元芳族杂环基羰基,
[0331]
(28)3至14元非芳族杂环基羰基,
[0332]
(29)c
1-6
烷氧基-羰基,
[0333]
(30)c
6-14
芳氧基-羰基(例如苯基氧基羰基、1-萘基氧基羰基、2-萘基氧基羰基),
[0334]
(31)c
7-16
芳烷基氧基-羰基(例如苄基氧基羰基、苯乙基氧基羰基),
[0335]
(32)氨甲酰基,
[0336]
(33)硫代氨甲酰基,
[0337]
(34)单-或二-c
1-6
烷基-氨甲酰基,
[0338]
(35)c
6-14
芳基-氨甲酰基(例如苯基氨甲酰基),
[0339]
(36)5至14元芳族杂环基氨甲酰基(例如吡啶基氨甲酰基、噻吩基氨甲酰基),
[0340]
(37)3至14元非芳族杂环基氨甲酰基(例如吗啉基氨甲酰基、哌啶基氨甲酰基),
[0341]
(38)任选地卤化的c
1-6
烷基磺酰基,
[0342]
(39)c
6-14
芳基磺酰基,
[0343]
(40)5至14元芳族杂环基磺酰基(例如吡啶基磺酰基、噻吩基磺酰基),
[0344]
(41)任选地卤化的c
1-6
烷基亚磺酰基,
[0345]
(42)c
6-14
芳基亚磺酰基(例如苯基亚磺酰基、1-萘基亚磺酰基、2-萘基亚磺酰基),
[0346]
(43)5至14元芳族杂环基亚磺酰基(例如吡啶基亚磺酰基、噻吩基亚磺酰基),
[0347]
(44)氨基,
[0348]
(45)单-或二-c
1-6
烷基氨基(例如甲基氨基、乙基氨基、丙基氨基、异丙基氨基、丁基氨基、二甲基氨基、二乙基氨基、二丙基氨基、二丁基氨基、n-乙基-n-甲基氨基),
[0349]
(46)单-或二-c
6-14
芳基氨基(例如苯基氨基),
[0350]
(47)5至14元芳族杂环基氨基(例如吡啶基氨基),
[0351]
(48)c
7-16
芳烷基氨基(例如苄基氨基),
[0352]
(49)甲酰基氨基,
[0353]
(50)c
1-6
烷基-羰基氨基(例如乙酰基氨基、丙酰基氨基、丁酰基氨基),
[0354]
(51)(c
1-6
烷基)(c
1-6
烷基-羰基)氨基(例如n-乙酰基-n-甲基氨基),
[0355]
(52)c
6-14
芳基-羰基氨基(例如苯基羰基氨基、萘基羰基氨基),
[0356]
(53)c
1-6
烷氧基-羰基氨基(例如甲氧基羰基氨基、乙氧基羰基氨基、丙氧基羰基氨基、丁氧基羰基氨基、叔丁氧基羰基氨基),
[0357]
(54)c
7-16
芳烷基氧基-羰基氨基(例如苄基氧基羰基氨基),
[0358]
(55)c
1-6
烷基磺酰基氨基(例如甲基磺酰基氨基、乙基磺酰基氨基),
[0359]
(56)任选地被c
1-6
烷基取代的c
6-14
芳基磺酰基氨基(例如苯基磺酰基氨基、甲苯磺酰基氨基),
[0360]
(57)任选地卤化的c
1-6
烷基,
[0361]
(58)c
2-6
烯基,
[0362]
(59)c
2-6
炔基,
[0363]
(60)c
3-10
环烷基,
[0364]
(61)c
3-10
环烯基,和
[0365]
(62)c
6-14
芳基。
[0366]
在“任选地被取代的烃基”中上文所提及取代基的数量为例如1至5,通常为1至3。当取代基的数量为2或更大时,各个取代基可相同或不同。
[0367]
在本说明书中,“杂环基”(包括“任选地被取代的杂环基”的“杂环基”)的实例包括(i)芳族杂环基,(ii)非芳族杂环基和(iii)7至10元桥接杂环基,其各自含有1至4个选自氮原子、硫原子和氧原子的杂原子作为除碳原子外构成环的原子。
[0368]
在本说明书中,“芳族杂环基”(包括“5至14元芳族杂环基”)的实例包括5至14元(通常5至10元)芳族杂环基,其含有1至4个选自氮原子、硫原子和氧原子的杂原子作为除碳原子外构成环的原子。
[0369]“芳族杂环基”的合适的实例包括5元或6元单环芳族杂环基,例如噻吩基、呋喃基、吡咯基、咪唑基、吡唑基、噻唑基、异噻唑基、噁唑基、异噁唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、1,2,4-噁二唑基、1,3,4-噁二唑基、1,2,4-噻二唑基、1,3,4-噻二唑基、三唑基、四唑基、三嗪基等;和
[0370]
8至14元稠合多环(通常二环或三环)芳族杂环基,例如苯并噻吩基、苯并呋喃基、苯并咪唑基、苯并噁唑基、苯并异噁唑基、苯并噻唑基、苯并异噻唑基、苯并三唑基、咪唑并吡啶基、噻吩并吡啶基、呋喃并吡啶基、吡咯并吡啶基、吡唑并吡啶基、噁唑并吡啶基、噻唑
并吡啶基、咪唑并吡嗪基、咪唑并嘧啶基、噻吩并嘧啶基、呋喃并嘧啶基、吡咯并嘧啶基、吡唑并嘧啶基、噁唑并嘧啶基、噻唑并嘧啶基、吡唑并三嗪基、萘并[2,3-b]噻吩基、吩噁噻基、吲哚基、异吲哚基、1h-吲唑基、嘌呤基、异喹啉基、喹啉基、酞嗪基、萘啶基、喹喔啉基、喹唑啉基、噌啉基、咔唑基、β-咔啉基、菲啶基、吖啶基、吩嗪基、吩噻嗪基、吩噁嗪基等。
[0371]
在本说明书中,“非芳族杂环基”(包括“3至14元非芳族杂环基”)的实例包括3至14元(通常4至10元)非芳族杂环基,其含有1至4个选自氮原子、硫原子和氧原子的杂原子作为除碳原子外构成环的原子。
[0372]“非芳族杂环基”的合适的实例包括3至8元单环非芳族杂环基,例如氮丙啶基、环氧乙烷基、硫杂丙环基(thirranyl)、氮杂环丁基、氧杂环丁基、硫杂环丁基、四氢噻吩基、四氢呋喃基、吡咯啉基、吡咯烷基、咪唑啉基、咪唑烷基、噁唑啉基、噁唑烷基、吡唑啉基、吡唑烷基、噻唑啉基、噻唑烷基、四氢异噻唑基、四氢噁唑基、四氢异噁唑基、哌啶基、哌嗪基、四氢吡啶基、二氢吡啶基、二氢硫代吡喃基、四氢嘧啶基、四氢哒嗪基、二氢吡喃基、四氢吡喃基、四氢硫代吡喃基、吗啉基、硫代吗啉基、氮杂环庚基、二氮杂环庚基、氮呯基、氧杂环庚基、氮杂环辛基、二氮杂环辛基等;和
[0373]
9至14元稠合多环(通常二环或三环)非芳族杂环基,例如二氢苯并呋喃基、二氢苯并咪唑基、二氢苯并噁唑基、二氢苯并噻唑基、二氢苯并异噻唑基、二氢萘并[2,3-b]噻吩基、四氢异喹啉基、四氢喹啉基、4h-喹嗪基、吲哚啉基、异吲哚啉基、四氢噻吩并[2,3-c]吡啶基、四氢苯并氮呯基、四氢喹喔啉基、四氢菲啶基、六氢吩噻嗪基、六氢吩噁嗪基、四氢酞嗪基、四氢萘啶基、四氢喹唑啉基、四氢噌啉基、四氢咔唑基、四氢-β-咔啉基、四氢吖啶基、四氢吩嗪基、四氢硫代呫吨基、八氢异喹啉基等。
[0374]
在本说明书中,“7至10元桥接杂环基”的合适的实例包括奎宁环基和7-氮杂二环[2.2.1]庚基。
[0375]
在本说明书中,“含氮杂环基”的实例包括含有至少一个氮原子作为构成环的原子的“杂环基”。
[0376]
在本说明书中,“任选地被取代的杂环基”的实例包括任选地具有选自上文所提及取代基组a的取代基的杂环基。
[0377]
在“任选地被取代的杂环基”中取代基的数量为例如1至3。当取代基的数量为2或更大时,各个取代基可相同或不同。
[0378]
在本说明书中,“酰基”的实例包括甲酰基、羧基、氨甲酰基、硫代氨甲酰基、亚磺酰基、磺基、氨磺酰基和膦酰基,其各自任选地具有1或2个选自c
1-6
烷基、c
2-6
烯基、c
3-10
环烷基、c
3-10
环烯基、c
6-14
芳基、c
7-16
芳烷基、5至14元芳族杂环基和3至14元非芳族杂环基的取代基,所述取代基各自任选地具有1至3个选自卤素原子、任选地卤化的c
1-6
烷氧基、羟基、硝基、氰基、氨基和氨甲酰基的取代基。
[0379]“酰基”的实例还包括烃-磺酰基、杂环基磺酰基、烃-亚磺酰基和杂环基亚磺酰基。
[0380]
在此,烃-磺酰基意指烃基键结的磺酰基,杂环基磺酰基意指杂环基键结的磺酰基,烃-亚磺酰基意指烃基键结的亚磺酰基,并且杂环基亚磺酰基意指杂环基键结的亚磺酰基。
[0381]“酰基”的合适的实例包括甲酰基、羧基、c
1-6
烷基-羰基、c
2-6
烯基-羰基(例如巴豆酰基)、c
3-10
环烷基-羰基(例如环丁烷羰基、环戊烷羰基、环己烷羰基、环庚烷羰基)、c
3-10
环
烯基-羰基(例如2-环己烯羰基)、c
6-14
芳基-羰基、c
7-16
芳烷基-羰基、5至14元芳族杂环基羰基、3至14元非芳族杂环基羰基、c
1-6
烷氧基-羰基、c
6-14
芳氧基-羰基(例如苯基氧基羰基、萘基氧基羰基)、c
7-16
芳烷基氧基-羰基(例如苄基氧基羰基、苯乙基氧基羰基)、氨甲酰基、单-或二-c
1-6
烷基-氨甲酰基、单-或二-c
2-6
烯基-氨甲酰基(例如二烯丙基氨甲酰基)、单-或二-c
3-10
环烷基-氨甲酰基(例如环丙基氨甲酰基)、单-或二-c
6-14
芳基-氨甲酰基(例如苯基氨甲酰基)、单-或二-c
7-16
芳烷基-氨甲酰基、5至14元芳族杂环基氨甲酰基(例如吡啶基氨甲酰基)、硫代氨甲酰基、单-或二-c
1-6
烷基-硫代氨甲酰基(例如甲基硫代氨甲酰基、n-乙基-n-甲基硫代氨甲酰基)、单-或二-c
2-6
烯基-硫代氨甲酰基(例如二烯丙基硫代氨甲酰基)、单-或二-c
3-10
环烷基-硫代氨甲酰基(例如环丙基硫代氨甲酰基、环己基硫代氨甲酰基)、单-或二-c
6-14
芳基-硫代氨甲酰基(例如苯基硫代氨甲酰基)、单-或二-c
7-16
芳烷基-硫代氨甲酰基(例如苄基硫代氨甲酰基、苯乙基硫代氨甲酰基)、5至14元芳族杂环基硫代氨甲酰基(例如吡啶基硫代氨甲酰基)、亚磺酰基、c
1-6
烷基亚磺酰基(例如甲基亚磺酰基、乙基亚磺酰基)、磺基、c
1-6
烷基磺酰基、c
6-14
芳基磺酰基、膦酰基和单-或二-c
1-6
烷基膦酰基(例如二甲基膦酰基、二乙基膦酰基、二异丙基膦酰基、二丁基膦酰基)。
[0382]
在本说明书中,“任选地被取代的氨基”的实例包括任选地具有1或2个选自c
1-6
烷基、c
2-6
烯基、c
3-10
环烷基、c
6-14
芳基、c
7-16
芳烷基、c
1-6
烷基-羰基、c
6-14
芳基-羰基、c
7-16
芳烷基-羰基、5至14元芳族杂环基羰基、3至14元非芳族杂环基羰基、c
1-6
烷氧基-羰基、5至14元芳族杂环基、氨甲酰基、单-或二-c
1-6
烷基-氨甲酰基、单-或二-c
7-16
芳烷基-氨甲酰基、c
1-6
烷基磺酰基和c
6-14
芳基磺酰基的取代基的氨基,所述取代基各自任选地具有1至3个选自取代基组a的取代基。
[0383]
任选地被取代的氨基的合适的实例包括氨基、单-或二-(任选地卤化的c
1-6
烷基)氨基(例如甲基氨基、三氟甲基氨基、二甲基氨基、乙基氨基、二乙基氨基、丙基氨基、二丁基氨基)、单-或二-c
2-6
烯基氨基(例如二烯丙基氨基)、单-或二-c
3-10
环烷基氨基(例如环丙基氨基、环己基氨基)、单-或二-c
6-14
芳基氨基(例如苯基氨基)、单-或二-c
7-16
芳烷基氨基(例如苄基氨基、二苄基氨基)、单-或二-(任选地卤化的c
1-6
烷基)-羰基氨基(例如乙酰基氨基、丙酰基氨基)、单-或二-c
6-14
芳基-羰基氨基(例如苯甲酰基氨基)、单-或二-c
7-16
芳烷基-羰基氨基(例如苄基羰基氨基)、单-或二-5至14元芳族杂环基羰基氨基(例如烟碱酰基氨基、异烟碱酰基氨基)、单-或二-3至14元非芳族杂环基羰基氨基(例如哌啶基羰基氨基)、单-或二-c
1-6
烷氧基-羰基氨基(例如叔丁氧基羰基氨基)、5至14元芳族杂环基氨基(例如吡啶基氨基)、氨甲酰基氨基、(单-或二-c
1-6
烷基-氨甲酰基)氨基(例如甲基氨甲酰基氨基)、(单-或二-c
7-16
芳烷基-氨甲酰基)氨基(例如苄基氨甲酰基氨基)、c
1-6
烷基磺酰基氨基(例如甲基磺酰基氨基、乙基磺酰基氨基)、c
6-14
芳基磺酰基氨基(例如苯基磺酰基氨基)、(c
1-6
烷基)(c
1-6
烷基-羰基)氨基(例如n-乙酰基-n-甲基氨基)和(c
1-6
烷基)(c
6-14
芳基-羰基)氨基(例如n-苯甲酰基-n-甲基氨基)。
[0384]
在本说明书中,“任选地被取代的氨甲酰基”的实例包括任选地具有1或2个选自c
1-6
烷基、c
2-6
烯基、c
3-10
环烷基、c
6-14
芳基、c
7-16
芳烷基、c
1-6
烷基-羰基、c
6-14
芳基-羰基、c
7-16
芳烷基-羰基、5至14元芳族杂环基羰基、3至14元非芳族杂环基羰基、c
1-6
烷氧基-羰基、5至14元芳族杂环基、氨甲酰基、单-或二-c
1-6
烷基-氨甲酰基和单-或二-c
7-16
芳烷基-氨甲酰基的取代基的氨甲酰基,所述取代基各自任选地具有1至3个选自取代基组a的取代基。
[0385]
任选地被取代的氨甲酰基的合适的实例包括氨甲酰基、单-或二-c
1-6
烷基-氨甲酰基、单-或二-c
2-6
烯基-氨甲酰基(例如二烯丙基氨甲酰基)、单-或二-c
3-10
环烷基-氨甲酰基(例如环丙基氨甲酰基、环己基氨甲酰基)、单-或二-c
6-14
芳基-氨甲酰基(例如苯基氨甲酰基)、单-或二-c
7-16
芳烷基-氨甲酰基、单-或二-c
1-6
烷基-羰基-氨甲酰基(例如乙酰基氨甲酰基、丙酰基氨甲酰基)、单-或二-c
6-14
芳基-羰基-氨甲酰基(例如苯甲酰基氨甲酰基)和5至14元芳族杂环基氨甲酰基(例如吡啶基氨甲酰基)。
[0386]
在本说明书中,“任选地被取代的硫代氨甲酰基”的实例包括任选地具有1或2个选自c
1-6
烷基、c
2-6
烯基、c
3-10
环烷基、c
6-14
芳基、c
7-16
芳烷基、c
1-6
烷基-羰基、c
6-14
芳基-羰基、c
7-16
芳烷基-羰基、5至14元芳族杂环基羰基、3至14元非芳族杂环基羰基、c
1-6
烷氧基-羰基、5至14元芳族杂环基、氨甲酰基、单-或二-c
1-6
烷基-氨甲酰基和单-或二-c
7-16
芳烷基-氨甲酰基的取代基的硫代氨甲酰基,所述取代基各自任选地具有1至3个选自取代基组a的取代基。
[0387]
任选地被取代的硫代氨甲酰基的合适的实例包括硫代氨甲酰基、单-或二-c
1-6
烷基-硫代氨甲酰基(例如甲基硫代氨甲酰基、乙基硫代氨甲酰基、二甲基硫代氨甲酰基、二乙基硫代氨甲酰基、n-乙基-n-甲基硫代氨甲酰基)、单-或二-c
2-6
烯基-硫代氨甲酰基(例如二烯丙基硫代氨甲酰基)、单-或二-c
3-10
环烷基-硫代氨甲酰基(例如环丙基硫代氨甲酰基、环己基硫代氨甲酰基)、单-或二-c
6-14
芳基-硫代氨甲酰基(例如苯基硫代氨甲酰基)、单-或二-c
7-16
芳烷基-硫代氨甲酰基(例如苄基硫代氨甲酰基、苯乙基硫代氨甲酰基)、单-或二-c
1-6
烷基-羰基-硫代氨甲酰基(例如乙酰基硫代氨甲酰基、丙酰基硫代氨甲酰基)、单-或二-c
6-14
芳基-羰基-硫代氨甲酰基(例如苯甲酰基硫代氨甲酰基)和5至14元芳族杂环基硫代氨甲酰基(例如吡啶基硫代氨甲酰基)。
[0388]
在本说明书中,“任选地被取代的氨磺酰基”的实例包括任选地具有1或2个选自c
1-6
烷基、c
2-6
烯基、c
3-10
环烷基、c
6-14
芳基、c
7-16
芳烷基、c
1-6
烷基-羰基、c
6-14
芳基-羰基、c
7-16
芳烷基-羰基、5至14元芳族杂环基羰基、3至14元非芳族杂环基羰基、c
1-6
烷氧基-羰基、5至14元芳族杂环基、氨甲酰基、单-或二-c
1-6
烷基-氨甲酰基和单-或二-c
7-16
芳烷基-氨甲酰基的取代基的氨磺酰基,所述取代基各自任选地具有1至3个选自取代基组a的取代基。
[0389]
任选地被取代的氨磺酰基的合适的实例包括氨磺酰基、单-或二-c
1-6
烷基-氨磺酰基(例如甲基氨磺酰基、乙基氨磺酰基、二甲基氨磺酰基、二乙基氨磺酰基、n-乙基-n-甲基氨磺酰基)、单-或二-c
2-6
烯基-氨磺酰基(例如二烯丙基氨磺酰基)、单-或二-c
3-10
环烷基-氨磺酰基(例如环丙基氨磺酰基、环己基氨磺酰基)、单-或二-c
6-14
芳基-氨磺酰基(例如苯基氨磺酰基)、单-或二-c
7-16
芳烷基-氨磺酰基(例如苄基氨磺酰基、苯乙基氨磺酰基)、单-或二-c
1-6
烷基-羰基-氨磺酰基(例如乙酰基氨磺酰基、丙酰基氨磺酰基)、单-或二-c
6-14
芳基-羰基-氨磺酰基(例如苯甲酰基氨磺酰基)和5至14元芳族杂环基氨磺酰基(例如吡啶基氨磺酰基)。
[0390]
在本说明书中,“任选地被取代的羟基”的实例包括任选地具有选自c
1-6
烷基、c
2-6
烯基、c
3-10
环烷基、c
6-14
芳基、c
7-16
芳烷基、c
1-6
烷基-羰基、c
6-14
芳基-羰基、c
7-16
芳烷基-羰基、5至14元芳族杂环基羰基、3至14元非芳族杂环基羰基、c
1-6
烷氧基-羰基、5至14元芳族杂环基、氨甲酰基、单-或二-c
1-6
烷基-氨甲酰基、单-或二-c
7-16
芳烷基-氨甲酰基、c
1-6
烷基磺酰基和c
6-14
芳基磺酰基的取代基的羟基,所述取代基各自任选地具有1至3个选自取代基组a
的取代基。
[0391]
任选地被取代的羟基的合适的实例包括羟基、c
1-6
烷氧基、c
2-6
烯基氧基(例如烯丙基氧基、2-丁烯基氧基、2-戊烯基氧基、3-己烯基氧基)、c
3-10
环烷基氧基(例如环己基氧基)、c
6-14
芳氧基(例如苯氧基、萘基氧基)、c
7-16
芳烷基氧基(例如苄基氧基、苯乙基氧基)、c
1-6
烷基-羰基氧基(例如乙酰基氧基、丙酰基氧基、丁酰基氧基、异丁酰基氧基、戊酰基氧基)、c
6-14
芳基-羰基氧基(例如苯甲酰基氧基)、c
7-16
芳烷基-羰基氧基(例如苄基羰基氧基)、5至14元芳族杂环基羰基氧基(例如烟碱酰基氧基)、3至14元非芳族杂环基羰基氧基(例如哌啶基羰基氧基)、c
1-6
烷氧基-羰基氧基(例如叔丁氧基羰基氧基)、5至14元芳族杂环基氧基(例如吡啶基氧基)、氨甲酰基氧基、c
1-6
烷基-氨甲酰基氧基(例如甲基氨甲酰基氧基)、c
7-16
芳烷基-氨甲酰基氧基(例如苄基氨甲酰基氧基)、c
1-6
烷基磺酰基氧基(例如甲基磺酰基氧基、乙基磺酰基氧基)和c
6-14
芳基磺酰基氧基(例如苯基磺酰基氧基)。
[0392]
在本说明书中,“任选地被取代的氢硫基”的实例包括任选地具有选自c
1-6
烷基、c
2-6
烯基、c
3-10
环烷基、c
6-14
芳基、c
7-16
芳烷基、c
1-6
烷基-羰基、c
6-14
芳基-羰基和5至14元芳族杂环基的取代基的氢硫基,所述取代基各自任选地具有1至3个选自取代基组a的取代基,和卤化氢硫基。
[0393]
任选地被取代的氢硫基的合适的实例包括氢硫基(-sh)、c
1-6
烷基硫基、c
2-6
烯基硫基(例如烯丙基硫基、2-丁烯基硫基、2-戊烯基硫基、3-己烯基硫基)、c
3-10
环烷基硫基(例如环己基硫基)、c
6-14
芳基硫基(例如苯基硫基、萘基硫基)、c
7-16
芳烷基硫基(例如苄基硫基、苯乙基硫基)、c
1-6
烷基-羰基硫基(例如乙酰基硫基、丙酰基硫基、丁酰基硫基、异丁酰基硫基、戊酰基硫基)、c
6-14
芳基-羰基硫基(例如苯甲酰基硫基)、5至14元芳族杂环基硫基(例如吡啶基硫基)和卤化硫基(例如五氟硫基)。
[0394]
在本说明书中,“任选地被取代的甲硅烷基”的实例包括任选地具有1至3个选自c
1-6
烷基、c
2-6
烯基、c
3-10
环烷基、c
6-14
芳基和c
7-16
芳烷基的取代基的甲硅烷基,所述取代基各自任选地具有1至3个选自取代基组a的取代基。任选地被取代的甲硅烷基的实例包括三-c
1-6
烷基甲硅烷基(例如三甲基甲硅烷基、叔丁基(二甲基)甲硅烷基)。
[0395]
在一些实施方案中,sting调节剂是式(iii)化合物:
[0396][0397]
或其药学上可接受的盐,其中:
[0398]r105
和r
205
各自独立地是羟基或卤素原子;
[0399]b100
是由式(b
1-a)或式(b
1-b)表示的基团:
[0400][0401]r13
、r
14
、r
15
、r
16
和r
17
各自独立地是氢原子或取代基;
[0402]r1000
是氢或连接至式(i)的羰基的键;
[0403]y11
、y
12
、y
13
、y
14
、y
15
和y
16
各自独立地是n或cr
1a
;
[0404]z11
、z
12
、z
13
、z
14
、z
15
和z
16
各自独立地是n或c;
[0405]r105
和r
205
各自独立地是羟基或卤素原子;
[0406]r1a
是氢原子或取代基;
[0407]b200
是由式(b
2-a)或式(b
2-b)表示的基团:
[0408][0409]r23
、r
24
、r
25
、r
26
和r
27
各自独立地是氢原子或取代基;
[0410]r100'
是氢或连接至式(i)的羰基的键;
[0411]y21
、y
22
、y
23
、y
24
、y
25
和y
26
各自独立地是n或cr
2a
;
[0412]z21
、z
22
、z
23
、z
24
、z
25
和z
26
各自独立地是n或c;
[0413]r2a
是氢原子或取代基;
[0414]
x1和x2各自独立地是氧原子或硫原子;并且
[0415]
q1、q2、q3和q4各自独立地是氧原子或硫原子。
[0416]
条件是:
[0417]b100
或b
200
中的一者是:
[0418][0419]
其中:
[0420]r18
是氢或c
1-6
烷基;并且
[0421]r19
是卤素原子,并且b
100
或b
200
中的另一者经由-nh-基团连接至母体结构的5元环。
[0422]
在一些实施方案中,sting调节剂是式(iii)化合物或其药学上可接受的盐,其中r
205
是f并且b
100
是
[0423][0424]
在一些实施方案中,环状二核苷酸是:
[0425][0426]
或其药学上可接受的盐,其中是与母体分子部分的羰基的连接点。
[0427]
基团“l”是可切割接头。如本文所用的术语“接头”是指能够将抗体、抗体片段或抗原结合片段(ab)连接至式(i)和(iv)化合物内的含药物部分的任何化学部分。接头可为支链的,并且可被1至20个含药物部分取代。在一些实施方案中,接头可被1至10个含药物部分取代。在一些实施方案中,接头可被1至5个含药物部分取代。在一些实施方案中,接头可被一个或两个含药物部分取代。在一些实施方案中,接头可被一个含药物部分取代。
[0428]
接头“l”是可切割的。在某些实施方案中,在药物和/或抗体可保持活性的条件下,接头可能易于发生酸诱导的切割、光诱导的切割、酶促切割等。在一些实施方案中,可切割接头可被酶促切割。在一些实施方案中,可切割接头可由蛋白酶、肽酶、酯酶、糖苷酶、磷酸二酯酶、磷酸酶或脂肪酶切割。在一些实施方案中,可切割接头可由蛋白酶切割。蛋白酶的实例包括(但不限于)组织蛋白酶b、vagp四肽等。在某些实施方案中,接头可以是pct公开wo 2018/200812、wo 2018/100558中所公开的那些接头中的任一者,所述pct公开通过引用整体并入本文。
[0429]
在某些实施方案中,“l”具有下式:
[0430][0431]
其中:
[0432]
是与氮原子的连接点;并且
[0433]
是与ab的连接点。
[0434]
在一些实施方案中,“l”具有下式:
[0435][0436]
其中:
[0437]
是与氮原子的连接点;
[0438]
是与抗体的连接点;
[0439]
基团“w”不存在或者是自消性基团。如本文所用的术语“自消性”是指基团经受电子级联从而释放其所连接的基团。在一些实施方案中,自消性基团包括一个或多个可经受1,4-消除、1,6-消除、1,8-消除、1,6-环化消除、1,5-环化消除、1,3-环化消除、分子内5-环外-trig环化和/或6-环外-trig环化的基团。在某些实施方案中,自消性基团可以是pct公开wo 2018/200812、wo 2018/100558中所公开的那些自消性基团中的任一者,所述pct公开通过引用整体并入本文。
[0440]
基团“z”不存在或者是2至5个氨基酸的肽。在某些实施方案中,肽是接头的切割位点,由此在暴露于细胞内蛋白酶(例如溶酶体酶)时促进药物释放(doronina等人(2003)nat.biotechnol.21:778-784)。具有两个氨基酸的肽的实例包括(但不限于)丙氨酸-丙氨酸(ala-ala)、缬氨酸-瓜氨酸(vc或val-cit)、丙氨酸-苯丙氨酸(af或ala-phe);苯丙氨酸-赖氨酸(fk或phe-lys);苯丙氨酸-高赖氨酸(phe-homolys);和n-甲基-缬氨酸-瓜氨酸(me-val-cit)。具有三个氨基酸的肽的实例包括(但不限于)甘氨酸-缬氨酸-瓜氨酸(gly-val-cit)和甘氨酸-甘氨酸-甘氨酸(gly-gly-gly)。上述氨基酸组合还可以相反顺序存在(即cit-val)。
[0441]
本发明的肽可包含天然存在的和/或非天然的氨基酸残基。术语“天然存在的氨基酸”是指ala、asp、cys、glu、phe、gly、his、he、lys、leu、met、asn、pro、gin、arg、ser、thr、val、trp和tyr。作为非限制性实例,“非天然氨基酸”(即氨基酸并非天然存在)包括高丝氨酸、高精氨酸、瓜氨酸、苯甘氨酸、牛磺酸、碘代酪氨酸、硒代-半胱氨酸、正亮氨酸(“nle”)、正缬氨酸(“nva”)、β-丙氨酸、l-或d-萘丙氨酸、鸟氨酸(“orn”)等。肽可经设计和优化以通过特定酶(例如肿瘤相关蛋白酶、组织蛋白酶b、c和d或胞浆素蛋白酶)进行酶促切割。
[0442]
氨基酸还包括天然和非天然氨基酸的d-形式。“d
‑”
表示具有与天然存在(“l
‑”
)氨基酸的构型不同的“d”(右旋)构型的氨基酸。天然和非天然氨基酸可购得(sigma chemical co.,advanced chemtech)或使用本领域已知的方法合成。
[0443]
基团“u”和“u'”独立地不存在或者是间隔子。如本文所用的术语“间隔子”是指用作连接物的化学部分。在本发明中,间隔子可将抗体、抗体片段或抗原片段连接至异双官能团和/或将异双官能团连接至肽“z”,或当“z”不存在时连接至基团“w”。非限制性示例性间隔子包括-nh-、-s-、-o-、-nhc(=o)ch2ch
2-、-s(=o)
2-ch2ch
2-、-c(=o)nhnh-、-c(=o)o-、-c(=o)nh-、-ch
2-、-ch2ch
2-、-ch2ch2ch
2-、-ch2=ch
2-、-c≡c-、-ch=n-o-、聚乙二醇(peg)、
[0444][0445]
在本发明的化合物中,当“u”存在时,其可为被1至10个
“‑
c(o)-w-z
‑”
基团取代的支链基团。在一些实施方案中,“u”被1至5个
“‑
c(o)-w-z
‑”
基团取代。在一些实施方案中,“u”被1或2个
“‑
c(o)-w-z
‑”
基团取代。在一些实施方案中,“u”被1个
“‑
c(o)-w-z
‑”
基团取代。在某些实施方案中,间隔子可为pct公开wo 2018/200812、wo 2018/100558中所公开的那些间隔子中的任一者,所述pct公开通过引用整体并入本文。
[0446]
基团“q”是异双官能团。在本发明中,术语“异双官能团”是指将其作为一部分的接头连接至抗体、抗体片段或抗原结合片段的化学部分。参见例如wo2017/191579。异双官能团的特征为在化学部分的任一端具有不同的反应基团。异双官能团可直接连接至“ab”,或替代地可经由接头“u'”连接。连接至“ab”可经由化学或酶促缀合或二者的组合实现。化学缀合涉及抗体表面上的可及氨基酸残基与“q”或“u'”上的反应柄(reaction handle)的受控反应。化学缀合的实例包括(但不限于)赖氨酸酰胺偶联、半胱氨酸偶联和经由通过遗传工程并入的非天然氨基酸偶联,其中具有期望反应柄的非天然氨基酸残基安装至“ab”上。在酶促缀合中,酶介导接头与抗体、抗体片段或抗原结合片段上的可及氨基残基的偶联。酶促缀合的实例包括(但不限于)使用分选酶的转肽、使用微生物转谷氨酰胺酶的转肽和n-聚糖工程化。化学缀合和酶促缀合也可依序使用。例如,酶促缀合还可用于将独特的反应柄安装在有待用于后续化学缀合的“ab”上。在某些实施方案中,异双官能团可为pct公开wo 2018/200812、wo 2018/100558中所公开的那些异双官能团中的任一者,所述pct公开通过引用整体并入本文。
[0447]
在一些实施方案中,“q”选自
[0448]
其中
[0449]
是与u的连接点,或者当u不存在时是与z的连接点;并且
[0450]
是与u'的连接点,或者当u'不存在时是与ab的连接点。
[0451]
在某些实施方案中,本发明提供式(xx)化合物:
[0452][0453]
或其药学上可接受的盐,其中n、m、a、t、d-nh-、r1、r2、r3、r
3'
、w、z和u如本文所述并且其中q*是能够缀合至抗体、抗体片段或抗原结合片段的反应性官能团。合适的q*基团的实例包括(但不限于)活化羧酸基团,例如酰氯-c(o)-cl和酸酐、卤代乙酰胺、马来酰亚胺、炔烃、环炔烃(例如环辛炔)、氧杂降冰片二烯、降冰片烯、叠氮化物、二芳基四嗪、单芳基四嗪、醛、酮、羟胺、乙烯基砜和氮丙啶。在某些实施方案中,反应性官能团可为pct公开wo 2018/200812、wo 2018/100558中所公开的那些反应性官能团中的任一者,所述pct公开通过引用整体并入本文。
[0454]
基团“ab”是抗体、抗体片段或抗原结合片段。抗体是由免疫系统产生的能够识别并结合至特定抗原的蛋白质。靶抗原通常具有由多种抗体上的cdr识别的多个结合位点,也称为表位。特异性结合至不同表位的每种抗体具有不同的结构。因此,一种抗原可具有一种以上的相应抗体。术语“抗体”在本文中以最广泛含义使用并且具体涵盖单克隆抗体、单结构域抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)和抗体片段,只要其展现期望生物活性即可。抗体可为鼠类、人类、人源化、嵌合或衍生自其他物种。(janeway,c.,travers,
p.,walport,m.,shlomchik(2001)immuno biology,第5版,garland publishing,new york)。
[0455]
如本文所用的术语“抗体”也指全长免疫球蛋白分子或全长免疫球蛋白分子的免疫活性部分,即含有免疫特异性结合目标靶的抗原或其一部分的抗原结合位点的分子,此类靶包括(但不限于)癌细胞或产生与自身免疫疾病相关的自身免疫抗体的细胞。本文所公开的免疫球蛋白可为免疫球蛋白分子的任一类型(例如igg、ige、igm、igd和iga)、类别(例如igg1、igg2、igg3、igg4、iga1和iga2)或子类。免疫球蛋白可衍生自任何物种。然而,在一个方面,免疫球蛋白是人类源、鼠类源或兔源的。
[0456]
术语“单结构域抗体”(也称为纳米抗体)是由分子量为约12kda至约15kda的单个单体可变抗体结构域组成的抗体片段。单体抗体可基于重链可变结构域或轻链。单结构域抗体的实例包括(但不限于)vhh片段和v
nar
片段。参见例如harmsen m.m.等人,applied microbiology and biotechnology 77(1):13-22。
[0457]“抗体片段”包含完整抗体的一部分,通常抗原结合区或其可变区。抗体片段的实例包括fab、fab'、f(ab')2和fv片段;双价抗体;线性抗体;由fab表达文库产生的片段、抗个体基因型(抗id)抗体、cdr(互补决定区)和上述任一者的免疫特异性结合至癌细胞抗原、病毒抗原或微生物抗原的表位结合片段、单链抗体分子;和由抗体片段形成的多特异性抗体。
[0458]“完整抗体”是包含抗原结合可变区以及轻链恒定结构域(cl)和重链恒定结构域ch1、ch2和ch3的抗体。恒定结构域可为天然序列恒定结构域(例如人类天然序列恒定结构域)或其氨基酸序列变体。
[0459]
如本文所用的术语“单克隆抗体”是指从基本上同源的抗体群体获得的抗体,即构成所述群体的个别抗体除可能的天然突变以外是相同的,所述天然突变可以小量存在。单克隆抗体是高度特异性的,针对单一抗原位点。此外,与包括针对不同决定子(表位)的不同抗体的多克隆抗体制剂不同,每种单克隆抗体针对抗原上的单一决定子。除其特异性之外,单克隆抗体的优势在于它们可不受其他抗体污染地合成。修饰词“单克隆”指示抗体的特征为从基本上同源的抗体群体获得并且不应解释为需要通过任何特定方法产生抗体。例如,有待根据本发明使用的单克隆抗体可通过首先由kohler等人(1975)nature256:495阐述的杂交瘤方法制得,或者可通过重组dna方法(参见美国专利第4,816,567号)制得。例如,“单克隆抗体”还可使用clackson等人(1991)nature,352:624-628;marks等人(1991)j.mol.biol.,222:581-597中所述的技术从噬菌体抗体文库分离。
[0460]
单克隆抗体在本文中具体包括其中重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类别或子类的抗体中的相应序列相同或同源,而链的其余部分与衍生自另一物种或属于另一抗体类别或子类的抗体中的相应序列相同或同源的“嵌合”抗体,以及此类抗体的片段,只要其展现期望生物活性即可(美国专利第4,816,567号;和morrison等人(1984)proc.natl.acad.sci.usa,81:6851-6855)。目标嵌合抗体在本文中包括“灵长化”抗体,其包含衍生自非人类灵长类动物(例如旧大陆猴、类人猿等)的可变结构域抗原结合序列和人类恒定区序列。
[0461]
已采用多种方法来产生单克隆抗体(mab)。杂交瘤技术是指产生单一类型的抗体的克隆细胞系,其使用不同物种的细胞,包括小鼠(鼠类)、仓鼠、大鼠和人类。制备mab的另一种方法使用遗传工程,包括重组dna技术。从这些技术制得的单克隆抗体尤其包括嵌合抗
体和人源化抗体。嵌合抗体组合一种以上类型的物种的dna编码区。例如,嵌合抗体可从小鼠获得可变区并且从人类获得恒定区。人源化抗体主要来自人类,即使其含有非人类部分。与嵌合抗体一样,人源化抗体可含有完整人类恒定区。但与嵌合抗体不同,可变区可部分衍生自人类。人源化抗体的非人类合成部分通常来自鼠类抗体中的cdr。无论如何,这些区域对使抗体识别并结合至特定抗原至关重要。尽管可用于诊断学和短期疗法,鼠类抗体在不增加有害免疫原性反应的风险的情况下无法长期施用于人。这种反应称为人类抗小鼠抗体(hama),发生在人类免疫系统将鼠类抗体识别为外源并对其进行攻击时。hama反应可引起毒性休克或甚至死亡。
[0462]
嵌合和人源化抗体通过最小化所施用抗体的非人类部分来降低hama反应的可能性。此外,嵌合和人源化抗体可具有激活二级人类免疫反应(例如抗体依赖性细胞毒性)的额外益处。
[0463]
完整抗体可具有一种或多种“效应功能”,所述效应功能是指归因于抗体的fc区(天然序列fc区或氨基酸序列变体fc区)的那些生物活性。抗体效应功能的实例包括c1q结合;补体依赖性细胞毒性;fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;细胞表面受体(例如b细胞受体;bcr)下调等。
[0464]
取决于完整抗体的重链的恒定结构域的氨基酸序列,完整抗体可指配给不同的“类别”。存在五大类完整抗体:iga、igd、ige、igg和igm,并且这些抗体中的若干可进一步分成“子类”(同种型),例如igg1、igg2、igg3、igg4、iga和iga2。对应于不同类别的抗体的重链恒定结构域分别称为.α.、.δ.、.ε.、.γ.和.μ.。不同类别的免疫球蛋白的亚基结构和三维构型是众所周知的。
[0465]
有用的非免疫反应蛋白、多肽或肽抗体包括(但不限于)转铁蛋白、表皮生长因子(“egf”)、铃蟾素、胃泌素、胃泌素释放肽、血小板源性生长因子、il-2、il-6、转化生长因子(“tgf”)(例如tgf-.α.和tgf-.β.)、牛痘生长因子(“vgf”)、胰岛素和胰岛素样生长因子i和ii、凝集素和来自低密度脂蛋白的缺辅基蛋白。
[0466]
有用的多克隆抗体是衍生自经免疫动物血清的抗体分子的异质群体。可使用本领域众所周知的各种程序来产生针对目标抗原的多克隆抗体。例如,为了产生多克隆抗体,可通过注射目标抗原或其衍生物来免疫各种宿主动物,包括(但不限于)兔、小鼠、大鼠和豚鼠。取决于宿主物种,可使用各种佐剂来增加免疫反应,包括(但不限于)弗氏佐剂(freund's adjuvant)(完全和不完全)、矿物凝胶(例如氢氧化铝)、表面活性物质(例如溶血卵磷脂)、普鲁兰尼克多元醇(pluronic polyol)、聚阴离子、肽、油性乳液、匙孔血蓝蛋白、二硝基酚和潜在有用的人类佐剂如bcg(卡介苗)和细小棒状杆菌。此类佐剂在本领域中也是众所周知的。
[0467]
有用的单克隆抗体是针对特定抗原决定子(例如癌细胞抗原、病毒抗原、微生物抗原、蛋白质、肽、碳水化合物、化学品、核酸或其片段)的抗体的同质群体。针对目标抗原的单克隆抗体(mab)可通过使用本领域中已知的任何技术来制备,所述技术通过培养物中的连续细胞系提供抗体分子的产生。这些技术包括(但不限于)最初由kohler和milstein阐述的杂交瘤技术(1975,nature 256,495-497)、人类b细胞杂交瘤技术(kozbor等人,1983,immunology today 4:72)和ebv杂交瘤技术(cole等人,1985,monoclonal antibodies and cancer therapy,alan r.liss,inc.,第77-96页)。此类抗体可具有任何免疫球蛋白类别,
包括igg、igm、ige、iga和igd和其任何子类。产生本发明中使用的mab的杂交瘤可在体外或体内培养。
[0468]
有用的单克隆抗体包括(但不限于)人类单克隆抗体、人源化单克隆抗体、抗体片段或嵌合人类-小鼠(或其他物种)单克隆抗体。人类单克隆抗体可通过本领域已知的多种技术中的任一者(例如teng等人,1983,proc.natl.acad.sci.u.s.a.80,7308-7312;kozbor等人,1983,immunology today 4,72-79;和olsson等人,1982,meth.enzymol.92,3-16)制得。
[0469]
抗体也可为双特异性抗体。用于制备双特异性抗体的方法是本领域中已知的。全长双特异性抗体的传统产生是基于两个免疫球蛋白重链-轻链对的共表达,其中两条链具有不同的特异性(milstein等人,1983,nature 305:537-539)。由于免疫球蛋白重链和轻链的随机分组,这些杂交瘤(四源杂交瘤)产生10种不同抗体分子的潜在混合物,其中仅一种具有正确的双特异性结构。通常使用亲和色谱步骤来进行适当分子的纯化,这相当麻烦,并且产物产率低。类似程序公开于wo93/08829和traunecker等人,embo j.10:3655-3659(1991)中。
[0470]
根据不同的方法,具有期望结合特异性(抗体-抗原组合位点)的抗体可变结构域融合至免疫球蛋白恒定结构域序列。融合可使用免疫球蛋白重链恒定结构域,包含铰链区、c
h2
区和c
h3
区的至少一部分。第一重链恒定区(c
h1
)可含有轻链结合所需的位点,存在于至少一种融合物中。将具有编码免疫球蛋白重链融合物和(如果需要)免疫球蛋白轻链的序列的核酸插入单独表达载体中,并且共转染至合适的宿主生物体中。在实施方案中,当用于构建的不相等比率的三条多肽链提供最佳产量时,这在调节三个多肽片段的相互比例方面提供很大的灵活性。然而,当至少两条多肽链以相等的比率表达产生高产量时,或当所述比率不特别重要时,可在一个表达载体中插入两条或所有三条多肽链的编码序列。
[0471]
双特异性抗体可在一个臂中具有带有第一结合特异性的杂合免疫球蛋白重链并且在另一个臂中具有杂合免疫球蛋白重链-轻链对(提供第二结合特异性)。这种不对称结构有助于从不期望的免疫球蛋白链组合分离期望的双特异性化合物,这是因为在仅一半的双特异性分子中存在免疫球蛋白轻链提供便捷的分离方式(wo 94/04690;suresh等人,methods in enzymology,1986,121:210;rodrigues等人,1993,j.of immunology 151:6954-6961;carter等人,1992,bio/technology10:163-167;carter等人,1995,j.of hematotherapy 4:463-470;merchant等人,1998,nature biotechnology 16:677-681)。使用此类技术,可制备双特异性抗体以缀合为adc来治疗或预防如本文所定义的疾病。
[0472]
杂合或双功能抗体可以生物(即通过细胞融合技术)或化学(尤其用交联剂或二硫桥形成试剂)方式衍生而来,并且可包含完整抗体或其片段(ep 105360;wo 83/03679;ep 217577)。
[0473]
抗体可为免疫特异性结合至癌细胞抗原、病毒抗原或微生物抗原的抗体或结合至肿瘤细胞或基质的其他抗体的功能活性片段、衍生物或类似物。就此而言,“功能活性”意指片段、衍生物或类似物能够引发抗抗个体基因型抗体,所述抗体所识别的抗原与衍生出片段、衍生物或类似物的抗体所识别的抗原相同。具体来说,在一个示例性实施方案中,免疫球蛋白分子的个体基因型的抗原性可通过缺失框架和cdr序列来增强,所述框架和cdr序列是特异性识别抗原的cdr序列的c末端。为了确定结合抗原的cdr序列,含有cdr序列的合成
肽可通过本领域已知的任何结合测定方法(例如bia core测定)用于与抗原的结合测定(参见例如kabat等人,1991,sequences of proteins of immunological interest,第5版,national institute of health,bethesda,md.;kabat e等人,1980,j.of immunology 125(3):961-969)。
[0474]
其他有用的抗体包括抗体片段,例如(但不限于)f(ab')2片段,其含有可变区、轻链恒定区和重链的ch1结构域(可通过抗体分子的胃蛋白酶消化产生),以及fab片段,其可通过还原f(ab')2片段的二硫桥产生。其他有用的抗体是抗体的重链和轻链二聚体,或其任何最小片段,例如fv或单链抗体(sca)(例如如美国专利第4,946,778号;bird,1988,science 242:423-42;huston等人,1988,proc.natl.acad.sci.usa 85:5879-5883;和ward等人,(1989)nature 334:544-54中所述)或具有与抗体相同的特异性的任何其他分子。
[0475]
此外,重组抗体(例如嵌合和人源化单克隆抗体,包含人类和非人类部分,可使用标准重组dna技术制备)是有用的抗体。嵌合抗体是其中不同部分衍生自不同动物物种的分子,例如具有衍生自鼠类单克隆的可变区和人类免疫球蛋白恒定区的那些分子。(参见例如cabilly等人,美国专利第4,816,567号;和boss等人,美国专利第4,816,397号)。人源化抗体是来自非人类物种的抗体分子,其具有来自非人类物种的一个或多个互补决定区(cdr)和来自人类免疫球蛋白分子的框架区。(参见例如queen,美国专利第5,585,089号)。此类嵌合和人源化单克隆抗体可通过本领域已知的重组dna技术,例如使用以下文献中所述的方法产生:wo 87/02671;ep 184,187;ep 171496;ep 173494;wo 86/01533;美国专利第4,816,567号;ep 12023;berter等人,1988,science 240:1041-1043;liu等人,1987,proc.natl.acad.sci.usa 84:3439-3443;liu等人,1987,j.immunol.139:3521-3526;sun等人,1987,proc.natl.acad.sci.usa 84:214-218;nishimura等人,1987,cancer.res.47:999-1005;wood等人,1985,nature 314:446-449;和shaw等人,1988,j.natl.cancer inst.80:1553-1559;morrison,1985,science 229:1202-1207;oi等人,1986,biotechniques 4:214;美国专利第5,225,539号;jones等人,1986,nature 321:552-525;verhoeyan等人(1988)science 239:1534;和beidler等人,1988,j.immunol.141:4053-4060。
[0476]
使用不能表达内源性免疫球蛋白重链和轻链基因、但可表达人类重链和轻链基因的转基因小鼠,可产生完整人类抗体。用所选抗原(例如本发明的多肽的全部或一部分)以正常方式免疫转基因小鼠。可使用常规杂交瘤技术获得针对抗原的单克隆抗体。转基因小鼠携带的人类免疫球蛋白转基因在b细胞分化期间重排,并随后经受类别转换和体细胞突变。因此,使用这种技术,可产生治疗上有用的igg、iga、igm和ige抗体。关于这种产生人类抗体的技术的综述,参见lonberg和huszar(1995,int.rev.immunol.13:65-93)。关于这种产生人类抗体和人类单克隆抗体的技术和产生此类抗体的方案的详细讨论,参见例如美国专利第5,625,126号;第5,633,425号;第5,569,825号;第5,661,016号;第5,545,806号。其他人类抗体可从例如abgenix,inc.(freemont,calif.)和genpharm(san jose,calif.)购得。
[0477]
可使用称为“指导选择”的技术来产生识别所选表位的完整人类抗体。在这种方法中,使用所选非人类单克隆抗体(例如小鼠抗体)来指导识别相同表位的完整人类抗体的选择。(jespers等人(1994)biotechnology 12:899-903)。人类抗体还可使用本领域已知的多
种技术(包括噬菌体展示文库)产生(hoogenboom和winter,j.mol.biol.,227:381(1991);marks等人,j.mol.biol.,222:581(1991))。
[0478]
抗体可为抗体的融合蛋白或其功能活性片段,例如其中抗体经由共价键(例如肽键)在n末端或c末端与不为抗体的另一种蛋白质(或其部分,例如蛋白质的至少10个、20个或50个氨基酸部分)的氨基酸序列融合。抗体或其片段可在恒定结构域的n末端共价连接至另一种蛋白质。
[0479]
抗体包括经修饰的类似物和衍生物,即通过任何类型分子的共价连接,只要这种共价连接允许抗体保持其抗原结合免疫特异性即可。例如(但不作为限制),抗体的衍生物和类似物包括已经进一步修饰,例如通过糖基化、乙酰化、聚乙二醇化、磷酸化、酰胺化、通过已知的保护/封端基团衍生化、蛋白水解切割、与细胞抗体单元或其他蛋白质的连接等修饰的那些衍生物和类似物。许多化学修饰中的任一者都可通过已知技术进行,包括(但不限于)特定化学切割、乙酰化、甲酰化、衣霉素(tunicamycin)存在下的代谢合成等。此外,类似物或衍生物可含有一种或多种非天然氨基酸。
[0480]
抗体药物缀合物中的抗体包括在与fc受体相互作用的氨基酸残基中具有修饰(例如取代、缺失或添加)的抗体。特别是,抗体包括在鉴定为参与抗fc结构域与fcrn受体之间的相互作用的氨基酸残基中具有修饰的抗体(参见例如wo 97/34631)。对癌细胞抗原具有免疫特异性的抗体可例如从genentech(san francisco,calif.)购得或通过本领域技术人员已知的任何方法(例如化学合成或重组表达技术)产生。编码对癌细胞抗原具有免疫特异性的抗体的核苷酸序列可例如从genbank数据库或类似数据库、文献出版物或通过常规克隆和测序获得。
[0481]
adc的抗体可为单克隆抗体,例如鼠类单克隆抗体、嵌合抗体或人源化抗体。抗体可为抗体片段,例如fab片段。
[0482]
已知用于治疗或预防癌症的抗体可缀合为adc。对癌细胞抗原具有免疫特异性的抗体可购得或通过本领域技术人员已知的任何方法(例如重组表达技术)产生。编码对癌细胞抗原具有免疫特异性的抗体的核苷酸序列可例如从genbank数据库或类似数据库、文献出版物或通过常规克隆和测序获得。可用于治疗癌症的抗体的实例包括(但不限于)人源化抗her2单克隆抗体,用于治疗转移性乳腺癌患者;rituxan.rtm.(利妥昔单抗(rituximab);genentech),它是用于治疗非霍奇金氏淋巴瘤(non-hodgkin's lymphoma)患者的嵌合抗cd20单克隆抗体;ovarex(altarex corporation,ma),它是用于治疗卵巢癌的鼠类抗体;panorex(glaxo wellcome,nc),它是用于治疗结肠直肠癌的鼠类igg
2a
抗体;西妥昔单抗(cetuximab)爱必妥(erbitux)(imclone systems inc.,ny),它是用于治疗表皮生长因子阳性癌症(例如头颈癌)的抗egfr igg嵌合抗体;vitaxin(medimmune,inc.,md),它是用于治疗肉瘤的人源化抗体;campath i/h(leukosite,ma),它是用于治疗慢性淋巴细胞性白血病(cll)的人源化igg1抗体;smart mi95(protein design labs,inc.,ca),它是用于治疗急性骨髓性白血病(aml)的人源化抗cd33 igg抗体;lymphocide(immunomedics,inc.,nj),它是用于治疗非霍奇金氏淋巴瘤的人源化抗cd22 igg抗体;smart id10(protein design labs,inc.,ca),它是用于治疗非霍奇金氏淋巴瘤的人源化抗hla-dr抗体;oncolym(techniclone,inc.,ca),它是用于治疗非霍奇金氏淋巴瘤的放射性标记的鼠类抗hla-dr10抗体;allomune(biotransplant,ca),它是用于治疗霍奇金氏病或非霍奇金氏淋巴瘤
的人源化抗cd2 mab;avastin(genentech,inc.,ca),它是用于治疗肺癌和结肠直肠癌的抗vegf人源化抗体;埃皮托珠单抗(epratuzamab)(immunomedics,inc.,nj和amgen,ca),它是用于治疗非霍奇金氏淋巴瘤的抗cd22抗体;和ceacide(immunomedics,nj),它是用于治疗结肠直肠癌的人源化抗cea抗体。
[0483]
可用于治疗癌症的其他抗体包括(但不限于)针对以下抗原的抗体:ca125(卵巢癌)、ca15-3(癌瘤)、ca19-9(癌瘤)、l6(癌瘤)、lewis y(癌瘤)、lewis x(癌瘤)、甲胎蛋白(癌瘤)、ca 242(结肠直肠癌)、胎盘碱性磷酸酶(癌瘤)、前列腺特异性抗原(前列腺癌)、前列腺酸性磷酸酶(前列腺癌)、表皮生长因子(癌瘤)、mage-1(癌瘤)、mage-2(癌瘤)、mage-3(癌瘤)、mage-4(癌瘤)、抗转铁蛋白受体(癌瘤)、p97(黑色素瘤)、muc1-klh(乳腺癌)、cea(结肠直肠癌)、gp100(黑色素瘤)、mart1(黑色素瘤)、psa(前列腺癌)、il-2受体(t细胞白血病和淋巴瘤)、cd20(非霍奇金氏淋巴瘤)、cd52(白血病)、cd33(白血病)、cd22(淋巴瘤)、人类绒毛膜促性腺激素(癌瘤)、cd38(多发性骨髓瘤)、cd40(淋巴瘤)、粘蛋白(癌瘤)、p21(癌瘤)、mpg(黑色素瘤)和neu致癌基因产物(癌瘤)。一些有用的特异性抗体包括(但不限于)br96 mab(trail,p.a.等人,science(1993)261,212-215)、br64(trail,p a等人,cancer research(1997)57,100-105)、针对cd40抗原的mab(例如s2c6 mab)(francisco,j.a.等人,cancer res.(2000)60:3225-3231)、针对cd70抗原的mab(例如1f6 mab)和针对cd30抗原的mab(例如ac10)(bowen,m.a.等人(1993)j.immunol.,151:5896-5906;wahl等人,2002cancer res.62(13):3736-42)。可使用并且已综述结合至肿瘤相关抗原的许多其他内化抗体(franke,a.e.等人,cancer biother radiopharm.(2000)15:459-76;murray,j.l.,(2000)semin oncol.,27:64-70;breitling,f.和dubel,s.,recombinant antibodies,john wiley,and sons,new york,1998)。
[0484]
结合至与抗原呈递细胞相关的抗原(例如cd40、ox40l、内皮因子、dec-205、4-1bbl、cd36、cd36、cd204、marco、dc-sign、clec9a、clec5a、dectin 2、clec10a、cd206、cd64、cd32a、cd1a、hvem、cd32b、pd-l1、bdca-2、xcr-1和ccr2)的抗体也可缀合为adc。
[0485]
已知用于治疗或预防自身免疫病症的抗体可缀合为adc。自身免疫病症包括全身性红斑狼疮(sle)、类风湿性关节炎、修格兰氏综合征(sjogren's syndrome)、免疫性血小板减少症和多发性硬化。对负责产生自身免疫抗体的细胞的抗原具有免疫特异性的抗体可通过本领域技术人员已知的任何方法(例如化学合成或重组表达技术)获得。sle是由过表达干扰素-α(ifn-.α.)细胞因子基因标记(bennett等人(2003)jour.exp.med.197:711-723)。1型干扰素(ifn-.α./.β.)在狼疮的发病机制中起重要作用(santiago-raber(2003)jour.exp.med.197:777-788)。基因敲除小鼠(-ifn-.α./.β.)显示显著减少的抗红细胞自身抗体、成红细胞增多症、溶血性贫血、抗dna自体、肾病和死亡率。这些结果表明,1型ifn介导鼠类狼疮,并且降低其在人类对应部分中的活性可能是有益的。缀合至双1,8萘二甲酰亚胺药物部分的抗ifn ab可为针对sle和其他自身免疫病症的有效治疗剂。
[0486]
在另一个实施方案中,对治疗自身免疫疾病具有免疫特异性的可用于adc的抗体包括(但不限于)抗核抗体;抗ds dna;抗ss dna、抗心磷脂抗体igm、igg;抗磷脂抗体igm、igg;抗sm抗体;抗线粒体抗体;甲状腺抗体;微粒体抗体;甲状腺球蛋白抗体;抗scl-70;抗jo;抗u1rnp;抗la/ssb;抗ssa;抗ssb;抗壁细胞抗体;抗组蛋白;抗rnp;c-anca;p-anca;抗着丝粒;抗核仁纤维和抗gbm抗体。
[0487]
adc的抗体可结合至在活化淋巴球上表达的受体或受体复合物二者。受体或受体复合物可包括免疫球蛋白基因超家族成员、tnf受体超家族成员、整合素、细胞因子受体、趋化因子受体、主要组织相容性蛋白、凝集素或补体控制蛋白。合适的免疫球蛋白超家族成员的非限制性实例是cd2、cd3、cd4、cd8、cd 19、cd22、cd28、cd79、cd90、cd 152/ctla-4、pd-1和icos。合适的tnf受体超家族成员的非限制性实例是cd27、cd40、cd95/fas、cd134/ox40、cd137/4-1bb、tnf-r1、tnfr-2、rank、taci、bcma、骨保护素、apo2/trail-r1、trail-r2、trail-r3、trail-r4和apo-3。合适的整合素的非限制性实例是cd11a、cd11b、cd11c、cd18、cd29、cd41、cd49a、cd49b、cd49c、cd49d、cd49e、cd49f、cd 103和cd 104。合适的凝集素的非限制性实例是c型、s型和i型凝集素。
[0488]
如本文所用的术语“病毒抗原”包括(但不限于)能够引发免疫反应的任何病毒肽、多肽蛋白(例如hiv gp120、hiv nef、rsv f糖蛋白、流感病毒神经氨酸糖苷酶、流感病毒血球凝集素、htlv tax、单纯疱疹病毒糖蛋白(例如gb、gc、gd和ge)和b型肝炎表面抗原)。如本文所用的术语“微生物抗原”包括(但不限于)能够引发免疫反应的任何微生物肽、多肽、蛋白质、糖、多糖或脂质分子(例如细菌、真菌、致病性原生动物或酵母多肽,包括例如lps和荚膜多糖5/8)。
[0489]
对病毒或微生物抗原具有免疫特异性的抗体可例如从bd biosciences(san francisco,calif.)、chemicon international,inc.(temecula,calif.)或vector laboratories,inc.(burlingame,calif.)购得或通过本领域技术人员已知的任何方法(例如化学合成或重组表达技术)产生。编码对病毒或微生物抗原具有免疫特异性的抗体的核苷酸序列可例如从genbank数据库或类似数据库、文献出版物或通过常规克隆和测序获得。
[0490]
在一些实施方案中,可用于本adc中的抗体是根据本文所公开的方法治疗或预防病毒或微生物感染的那些抗体。可用于治疗病毒感染或微生物感染的抗体的实例包括(但不限于)synagis(medimmune,inc.,md),它是可用于治疗rsv感染患者的人源化抗呼吸道融合病毒(rsv)单克隆抗体;pro542(progenics),它是可用于治疗hiv感染的cd4融合抗体;ostavir(protein design labs,inc.,ca),它是可用于治疗乙型型肝炎病毒的人类抗体;protovir(protein design labs,inc.,ca),它是可用于治疗巨细胞病毒(cmv)的人源化igg抗体;和抗lps抗体。
[0491]
可用于adc中来治疗感染性疾病的其他抗体包括(但不限于)针对来自以下菌株的抗原的抗体:致病性细菌(酿脓链球菌(streptococcus pyogenes)、肺炎链球菌(streptococcus pneumoniae)、淋病奈瑟氏球菌(neisseria gonorrheae)、脑膜炎奈瑟氏球菌(neisseria meningitidis)、白喉棒状杆菌(corynebacterium diphtheriae)、肉毒梭菌(clostridium botulinum)、产气荚膜梭菌(clostridium perfringens)、破伤风梭菌(clostridium tetani)、流感嗜血杆菌(hemophilus influenzae)、肺炎克雷伯氏菌(klebsiella pneumoniae)、欧氏克雷伯氏菌(klebsiella ozaenas)、鼻硬结克雷伯氏菌(klebsiella rhinoscleromotis)、金黄色葡萄球菌(staphylococcus aureus)、霍乱弧菌(vibrio colerae)、大肠杆菌(escherichia coli)、绿脓杆菌(pseudomonas aeruginosa)、胎儿弯曲杆菌(弧菌)(campylobacter(vibrio)fetus)、嗜水产气单胞菌(aeromonas hydrophila)、蜡状杆菌(bacillus cereus)、缓慢爱德华氏菌(edwardsiella tarda)、小肠结肠炎耶氏杆菌(yersinia enterocolitica)、鼠疫耶氏杆菌(yersinia pestis)、假性结
核病耶氏杆菌(yersinia pseudotuberculosis)、痢疾志贺杆菌(shigella dysenteriae)、副痢疾杆菌(shigella flexneri)、宋内氏杆菌(shigella sonnei)、鼠伤寒沙氏杆菌(salmonella typhimurium)、梅毒螺旋体(treponema pallidum)、细弱螺旋体(treponema pertenue)、斑点病密螺旋体(treponema carateneum)、包柔疏螺旋体(borrelia vincentii)、博氏疏螺旋体(borrelia burgdorferi)、出血性黄疸钩端螺旋体(leptospira icterohemorrhagiae)、结核分枝杆菌(mycobacterium tuberculosis)、卡氏肺囊虫(pneumocystis carinii)、土伦病弗朗西斯氏菌(francisella tularensis)、流产布氏杆菌(brucella abortus)、猪布氏杆菌(brucella suis)、地中海热布氏杆菌(brucella melitensis)、支原体属(mycoplasma spp.)、斑疹伤寒立克次体(rickettsia prowazeki)、恙虫热立克次氏体(rickettsia tsutsugumushi)、衣原体属(chlamydia spp.));致病性真菌(粗球孢子菌(coccidioides immitis)、熏烟色曲菌(aspergillus fumigatus)、白色念珠菌(candida albicans)、皮炎芽生菌(blastomyces dermatitidis)、新型隐球菌(cryptococcus neoformans)、荚膜组织浆菌(histoplasma capsulatum));原生动物(溶组织内阿米巴(entomoeba histolytica)、弓虫(toxoplasma gondii)、口腔毛滴虫(trichomonas tenas)、肠滴虫(trichomonas hominis)、阴道毛滴虫(trichomonas vaginalis)、冈比亚锥虫(tryoanosoma gambiense)、罗德西亚锥虫(trypanosoma rhodesiense)、库氏锥虫(trypanosoma cruzi)、黑热病利什曼原虫(leishmania donovani)、热带利什曼原虫(leishmania tropica)、巴西利什曼原虫(leishmania braziliensis)、肺胞囊虫肺炎(pneumocystis pneumonia)、间日疟原虫(plasmodium vivax)、恶性疟原虫(plasmodium falciparum)、三日疟原虫(plasmodium malaria));或蠕虫(helminiths)(蠕形住肠蛲虫(enterobius vermicularis)、鞭形鞭虫(trichuris trichiura)、人蛔虫(ascaris lumbricoides)、旋毛线虫(trichinella spiralis)、粪类圆线虫(strongyloides stercoralis)、日本血吸虫(schistosoma japonicum)、曼森血吸虫(schistosoma mansoni)、埃及血吸虫(schistosoma haematobium)和钩虫(hookworms))。
[0492]
可用于adc中来治疗病毒性疾病的其他抗体包括(但不限于)针对致病性病毒的抗原的抗体,所述致病性病毒包括例如(但不限于):痘病毒科(poxviridae)、疱疹病毒科(herpesviridae)、单纯疱疹病毒1、单纯疱疹病毒2、腺病毒科(adenoviridae)、乳多空病毒科(papovaviridae)、肠病毒科(enteroviridae)、小核醣核酸病毒属(picornaviridae)、细小病毒科(parvoviridae)、呼肠病毒科(reoviridae)、逆转录病毒科(retroviridae)、流感病毒、副流感病毒、流行性腮腺炎、麻疹、呼吸道融合病毒、风疹、虫媒病毒科(arboviridae)、弹状病毒科(rhabdoviridae)、沙粒病毒科(arenaviridae)、甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、戊型肝炎病毒、非甲型/非乙型肝炎病毒、鼻病毒科(rhinoviridae)、冠状病毒科(coronaviridae)、轮状病毒科(rotoviridae)和人类免疫缺陷病毒。
[0493]
术语“氨基酸序列变体”是指氨基酸序列在某种程度上不同于天然序列多肽的多肽。通常,氨基酸序列变体将具有与天然抗体的至少一个受体结合结构域或天然受体的至少一个配体结合结构域至少约70%的序列同一性,并且通常,它们将与此类受体或配体结合结构域的序列至少约80%、更通常至少约90%同源。氨基酸序列变体在天然氨基酸序列的氨基酸序列内的某些位置具有取代、缺失和/或插入。氨基酸由常规名称、单字母和三字
母代码来指定。
[0494]“序列同一性”定义为在比对序列并引入空位(如果需要)以实现最大序列同一性百分比后,在氨基酸序列变体中相同残基的百分比。用于比对的方法和计算机程序在本领域中是众所周知的。一个这种计算机程序是由genentech,inc.设计的“align 2”,其于1991年12月10日在united states copyright office,washington,d.c.20559中提交了用户文件。
[0495]
术语“fc受体”或“fcr”用于阐述结合至抗体fc区的受体。示例性fcr是天然序列人类fcr。此外,fcr可为结合igg抗体的受体(γ受体),并且包括fc.γ.ri、fc.γ.rii和fc.γ.riii子类受体,包括这些受体的等位基因变体和选择性剪接形式。fc.γ.rii受体包括fc.γ.riia(“活化受体”)和fc.γ.riib(“抑制受体”),其具有相似的氨基酸序列,主要区别在于其胞质结构域。活化受体fc.γ.riia在其胞质结构域中含有基于免疫受体酪氨酸的活化基序(itam)。抑制受体fc.γ.riib在其胞质结构域中含有基于免疫受体酪氨酸的抑制基序(itim)。(参见综述m.daeron,annu.rev.immunol.,15:203-234(1997))。fcr综述于ravetch和kinet,annu.rev.immunol.,9:457-92(1991);capel等人,immunomethods,4:25-34(1994);和de haas等人,j.lab.clin.med.,126:330-41(1995)。其他fcr(包括有待将来鉴定的那些fcr)涵盖于本文的术语“fcr”。所述术语还包括新生儿受体fcrn,其负责将母体igg转移至胎儿(guyer等人,j.immunol.,117:587(1976)和kim等人,j.immunol.,24:249(1994))。
[0496]“补体依赖性细胞毒性”或“cdc”是指分子在补体存在下溶解靶标的能力。补体活化途径是通过使补体系统的第一组分(c1q)结合至与同源抗原复合的分子(例如抗体)来起始。为评价补体活化,可进行例如如gazzano-santoro等人,j.immunol.methods,202:163(1996)中所述的cdc测定。
[0497]“天然抗体”通常是约150,000道尔顿的异四聚糖蛋白,由两条相同的轻(l)链和两条相同的重(h)链组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链之间二硫键的数量不同。每条重链和轻链还具有规则间隔的链内二硫桥。每条重链在一端具有可变结构域(vh),其后是许多恒定结构域。每条轻链在一端具有可变结构域(vl)并且在其另一端具有恒定结构域。轻链的恒定结构域与重链的第一恒定结构域对齐,并且轻链可变结构域与重链的可变结构域对齐。认为特定的氨基酸残基形成轻链与重链可变结构域之间的界面。
[0498]
术语“可变”是指可变结构域的某些部分在抗体之间的序列上有很大不同并且用于每种特定抗体对其特定抗原的结合和特异性的事实。然而,可变性并不均匀地分布在抗体的可变结构域中。其集中在轻链和重链可变结构域的称为高变区的三个区段中。可变结构域中更高度保守的部分称为框架区(fr)。天然重链和轻链的可变结构域各自包含四个fr,主要采用.β.-折叠构型,由三个高变区连接,所述高变区形成连接.β.-折叠结构并且在一些情况下形成β-折叠结构的一部分的环。每条链中的高变区由fr紧密连接在一起,并且与另一条链中的高变区一起,有助于形成抗体的抗原结合位点(参见kabat等人(1991)sequences of proteins of immunological interest,第5版,public health service,national institute of health,bethesda,md.)。恒定结构域不直接参与抗体与抗原的结合,但展现各种效应功能,例如抗体参与抗体依赖性细胞毒性(adcc)。
[0499]
术语“高变区”在用于本文中时是指抗体中负责抗原结合的氨基酸残基。高变区通常包含来自“互补决定区”或“cdr”的氨基酸残基(例如轻链可变结构域中的残基24-34(l1)、50-56(l2)和89-97(l3)和重链可变结构域中的31-35(h1)、50-65(h2)和95-102(h3);kabat等人,见上文)和/或来自“高变环”的那些残基(例如轻链可变结构域中的残基26-32(l1)、50-52(l2)和91-96(l3)和重链可变结构域中的26-32(h1)、53-55(h2)和96-101(h3);chothia和lesk(1987)j.mol.biol.,196:901-917)。“框架区”或“fr”残基是除如本文所定义的高变区残基外的那些可变结构域残基。
[0500]
抗体的木瓜蛋白酶消化产生两个相同的抗原结合片段,称为“fab”片段,每个片段具有单个抗原结合位点;和残余“fc”片段,其名称反映了其容易结晶的能力。胃蛋白酶处理产生具有两个抗原结合位点并且仍能够交联抗原的f(ab')2片段。
[0501]“fv”是含有完全抗原识别和抗原结合位点的最小抗体片段。这个区域由紧密、非共价缔合的一个重链可变结构域和一个轻链可变结构域的二聚体组成。在这种构型中,每个可变结构域的三个高变区相互作用以将抗原结合位点限定于vh-vl二聚体的表面上。所述六个高变区共同赋予抗体以抗原结合特异性。然而,即使单个可变结构域(或仅包含三个抗原特异性高变区的fv的一半)还具有识别和结合抗原的能力,但其亲和力低于整个结合位点。
[0502]
fab片段也含有轻链的恒定结构域和重链的第一恒定结构域(ch1)。fab'片段与fab片段的不同之处在于,在重链ch1结构域的羧基末端添加了少量残基,包括来自抗体铰链区的一个或多个半胱氨酸。fab'-sh在本文中是fab'的名称,其中恒定结构域的半胱氨酸残基带有至少一个游离巯基。f(ab')2抗体片段最初是以成对fab'片段的形式产生,所述成对fab'片段之间具有铰链半胱氨酸。抗体片段的其他化学偶联也是已知的。
[0503]
来自任何脊椎动物物种的抗体的“轻链”基于其恒定结构域的氨基酸序列可指配给两种明显不同的类型中的一者,称为κ和λ。
[0504]“单链fv”或“scfv”抗体片段包含抗体的vh和vl结构域,其中这些结构域存在于单个多肽链中。fv多肽可进一步包含vh与vl结构域之间的多肽接头,所述多肽接头使得scfv能够形成抗原结合的期望结构。关于scfv的综述,参见pluckthun,the pharmacology of monoclonal antibodies,第113卷,rosenburg和moore编辑,springer-verlag,new york,第269-315页(1994)。抗erbb2抗体scfv片段阐述于wo 93/16185;美国专利第5,571,894号;和第5,587,458号中。
[0505]
术语“双价抗体”是指具有两个抗原结合位点的小抗体片段,所述片段在同一多肽链(vh-vl)中包含相互连接的可变重链结构域(vh)和可变轻链结构域(vl)。通过使用太短而不能在同一条链上的两个结构域之间配对的接头,结构域被迫与另一条链的互补结构域配对并产生两个抗原结合位点。双价抗体更全面阐述于例如ep 404,097;wo93/11161;和hollinger等人(1993)proc.natl.acad.sci.usa90:6444-6448中。
[0506]
非人类(例如啮齿类动物)抗体的“人源化”形式是嵌合抗体,其含有衍生自非人类免疫球蛋白的最小序列。人源化是将鼠类抗原结合信息转移至非免疫原性人类抗体受体的方法,并产生了许多治疗上有用的药物。人源化方法通常始于将所有六个鼠类互补决定区(cdr)转移至人类抗体框架上(jones等人,(1986)nature 321:522-525)。这些cdr移植的抗体通常不能保持其对抗原结合的原始亲和力,并且事实上,亲和力通常受到严重损害。除了
cdr,也必须并入选择的非人类抗体框架残基,以维持适当的cdr构象(chothia等人(1989)nature342:877)。已显示,将关键的小鼠框架残基转移至人类受体以支持移植cdr的结构构象会恢复抗原结合和亲和力(riechmann等人,(1992)j.mol.biol.224,487-499;foote和winter,(1992)j.mol.biol.224:487-499;presta等人,(1993)j.immunol.151,2623-2632;werther等人,(1996)j.immunol.methods 157:4986-4995;和presta等人(2001)thromb.haemost.85:379-389)。在大多数情况下,人源化抗体是具有期望特异性、亲和力和能力的人类免疫球蛋白(接受者抗体),其中来自接受者的高变区的残基由来自非人类物种(供体抗体)(例如小鼠、大鼠、兔或非人类灵长类动物)的高变区的残基代替。在一些情况下,人类免疫球蛋白的框架区(fr)残基由相应的非人类残基代替。此外,人源化抗体可包含接受者抗体或供体抗体中未发现的残基。进行这些修饰以进一步细化抗体性能。一般来说,人源化抗体将包含基本上所有的至少一个并且通常两个可变结构域,其中所有或基本上所有的高变环对应于非人类免疫球蛋白的高变环,并且所有或基本上所有的fr是人类免疫球蛋白序列的fr。人源化抗体任选地还包含免疫球蛋白恒定区(fc)的至少一部分,通常是人类免疫球蛋白的恒定区。关于更多细节,参见美国专利第6,407,213号;jones等人(1986)nature,321:522-525;riechmann等人(1988)nature 332:323-329;和presta,(1992)curr.op.struct.biol.,2:593-596。
[0507]“亲本抗体”是包含其中一个或多个氨基酸残基由一个或多个半胱氨酸残基代替的氨基酸序列的抗体。亲本抗体可包含天然或野生型序列。相对于抗体的其他天然、野生型或修饰形式,亲本抗体可具有预先存在的氨基酸序列修饰(例如添加、缺失和/或取代)。亲本抗体是针对相关靶抗原。还涵盖针对非多肽抗原(例如肿瘤相关糖脂抗原;参见美国专利第5,091,178号)的抗体。
[0508]“分离的”抗体是已经从其天然环境的组分中鉴定并分离和/或回收的抗体。其天然环境的污染物组分是会干扰抗体的诊断或治疗用途的物质,并且可能包括酶、激素和其他蛋白质或非蛋白质溶质。在某些实施方案中,将抗体纯化(1)至大于95重量%的抗体(如通过lowry方法测定),或大于99重量%,(2)至足以通过使用气相蛋白质测序仪获得至少15个n末端或内部氨基酸序列残基的程度,或(3)在使用考马斯蓝(coomassie blue)或银染色的还原或非还原条件下,通过sds-page达到均质性。分离的抗体包括重组细胞内的原位抗体,这是因为抗体的天然环境的至少一种组分不存在。然而,通常,分离的抗体将通过至少一个纯化步骤来制备。
[0509]“结合”目标分子靶或抗原的抗体是能够以足够的亲和力结合所述抗原的抗体,使得所述抗体可用于靶向表达所述抗原的细胞。
[0510]
术语“治疗(treat)”或“治疗(treatment)”是指治疗性治疗和防护性或预防性措施,其中目标是预防或减缓(减轻)不期望的生理变化或病症,例如癌症的发展或扩散。出于本发明的目的,有益或期望的临床结果包括(但不限于)症状的缓和、疾病程度的减轻、疾病状态的稳定(即不恶化)、疾病进展的延迟或减缓、疾病状态的改善或缓解以及减退(无论是部分抑或全部),无论是可检测到的抑或不可检测到的。“治疗”还可意指与未接受治疗情况下的预期存活期相比,延长存活期。需要治疗的人包括已经患有疾患或病症的人,以及易患疾患或病症的人,或需要预防疾患或病症的人。
[0511]“噬菌体展示”是一种技术,通过所述技术,变体多肽以与外壳蛋白的融合蛋白的
形式展示在噬菌体(例如丝状噬菌体)颗粒表面上。噬菌体展示的一个用途在于以下事实:针对以高亲和力结合至靶分子的那些序列,可快速有效地对随机化蛋白质变体的大文库进行分选。在噬菌体上展示肽和蛋白质文库已用于筛选数百万种多肽,以寻找具有特异性结合性质的多肽。多价噬菌体展示方法已经用于展示小随机肽和小蛋白质,通常经由融合至丝状噬菌体的piii或pviii。wells和lowman,curr.opin.struct.biol.,3:355-362(1992)和其中引用的参考文献。在单价噬菌体展示中,蛋白质或肽文库融合至噬菌体外壳蛋白或其一部分,并在野生型蛋白存在下以低水平表达。相对于多价噬菌体,亲合力效应降低,以使得分选是基于固有的配体亲和力,并且使用噬菌粒载体,这简化了dna操作。lowman和wells,methods:acompanion to methods in enzymology,3:205-0216(1991)。噬菌体展示包括产生抗体样分子的技术(janeway,c.,travers,p.,walport,m.,shlomchik(2001)immunobiology,第5版,garland publishing,new york,第627-628页)。
[0512]“噬菌粒”是质粒载体,其具有细菌复制起点(例如co1e1)以及噬细菌体的基因间区域的拷贝。噬菌粒可用于任何已知的噬细菌体,包括丝状噬细菌体和人字形噬细菌体。质粒通常还含有抗生素抗性的选择性标志物。克隆到这些载体中的dna区段可随着质粒繁殖。当携带这些载体的细胞提供有产生噬菌体颗粒所必需的所有基因时,质粒的复制模式变为滚环复制,以产生质粒dna的一条链的拷贝并包装噬菌体颗粒。噬菌粒可形成感染性或非感染性噬菌体颗粒。该术语包括含有噬菌体外壳蛋白基因或其片段的噬菌粒,所述噬菌体外壳蛋白基因或其片段作为基因融合物连接至异源多肽基因,使得异源多肽展示在噬菌体颗粒的表面上。本文所述的化合物可呈药学上或药学上可接受的盐形式。在一些实施方案中,此类盐衍生自无机或有机酸或碱。关于合适的盐的综述,参见例如berge等人,j.pharm.sci.,1977,66,1-19和remington:the science and practice of pharmacy,第20版,a.gennaro(编辑),lippincott williams&wilkins(2000)。
[0513]
在本发明中,基团“ab”(即抗体、抗体片段和/或抗原片段)可缀合至一个以上的含药物部分。在一些实施方案中,“ab”可缀合至1至20个含药物部分。在一些实施方案中,“ab”可缀合至1至10个含药物部分。在一些实施方案中,“ab”可缀合至1至5个含药物部分。在一些实施方案中,“ab”可缀合至1或2个含药物部分。在一些实施方案中,“ab”可缀合至一个含药物部分。
[0514]
本文所述的化合物可呈药学上或药学上可接受的盐形式。在一些实施方案中,此类盐衍生自无机或有机酸或碱。关于合适的盐的综述,参见例如berge等人,j.pharm.sci.,1977,66,1-19和remington:the science and practice of pharmacy,第20版,a.gennaro(编辑),lippincott williams&wilkins(2000)。
[0515]
合适的酸加成盐的实例包括乙酸盐、己二酸盐、藻酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、丁酸盐、柠檬酸盐、樟脑酸盐、樟脑磺酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡糖庚酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、2-羟基乙磺酸盐、乳酸盐、马来酸盐、甲磺酸盐、2-萘磺酸盐、烟碱酸盐、草酸盐、双羟萘酸盐、果胶酯酸盐、过硫酸盐、3-苯基-丙酸盐、苦味酸盐、新戊酸盐、丙酸盐、琥珀酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐和十一烷酸盐。
[0516]
合适的碱加成盐的实例包括铵盐;碱金属盐,例如钠盐和钾盐;碱土金属盐,例如钙盐和镁盐;有机碱盐,例如二环己胺盐、n-甲基-d-葡萄糖胺;和氨基酸盐,例如精氨酸盐、
赖氨酸盐等。
[0517]
例如,berge列示出下列经fda批准的市售盐:阴离子乙酸盐、苯磺酸盐(besylate、benzenesulfonate)、苯甲酸盐、碳酸氢盐、酒石酸氢盐、溴化物、依地酸钙(乙二胺四乙酸盐)、樟脑磺酸盐(camsylate、camphorsulfonate)、碳酸盐、氯化物、柠檬酸盐、二盐酸盐、依地酸盐(乙二胺四乙酸盐)、乙二磺酸盐(1,2-乙二磺酸盐)、依托酸盐(月桂基硫酸盐)、乙磺酸盐(esylate、ethanesulfonate)、富马酸盐、葡庚糖酸盐(gluceptate、glucoheptonate)、葡萄糖酸盐、谷氨酸盐、对羟乙酰氨基苯胂酸盐(glycollylarsanilate、glycollamidophenylarsonate)、己基间苯二酚盐、哈胺(n,n'-二(脱氢枞酸基)乙二胺)、氢溴酸盐、盐酸盐、羟基萘酸盐、碘化物、羟乙磺酸盐(2-羟基乙磺酸盐)、乳酸盐、乳糖酸盐、苹果酸盐、马来酸盐、杏仁酸盐、甲磺酸盐(mesylate、methanesulfonate)、甲基溴化物、甲基硝酸盐、甲基硫酸盐、粘酸盐、萘磺酸盐(2-萘磺酸盐)、硝酸盐、双羟萘酸盐(pamoate、embonate)、泛酸盐、磷酸盐/二磷酸盐、聚半乳糖醛酸盐、柳酸盐、硬脂酸盐、次乙酸盐、琥珀酸盐、硫酸盐、鞣酸盐、酒石酸盐、茶氯酸盐(8-氯茶碱)和三乙基碘化物;有机阳离子苄星盐(n,n'-二苄基乙二胺)、氯普鲁卡因(chloroprocaine)、胆碱、二乙醇胺、乙二胺、葡甲胺(n-甲基葡糖胺)和普鲁卡因;以及金属阳离子铝、钙、锂、镁、钾、钠和锌。
[0518]
berge另外列示出下列非fda批准的市售(在美国以外)盐:阴离子己二酸盐、藻酸盐、氨基柳酸盐、无水亚甲基柠檬酸盐、槟榔碱、天冬氨酸盐、硫酸氢盐、丁基溴化物、樟脑酸盐、二葡萄糖酸盐、二氢溴化物、二琥珀酸盐、甘油磷酸盐、半硫酸盐、氢氟酸盐、氢碘酸盐、亚甲基双(柳酸盐)、萘二磺酸盐(1,5-萘二磺酸盐)、草酸盐、果胶酯酸盐、过硫酸盐、苯基乙基巴比妥酸盐、苦味酸盐、丙酸盐、硫氰酸盐、甲苯磺酸盐和十一烷酸盐;有机阳离子苯乙苄胺(n-苄基苯乙胺)、克立咪唑(clemizole)(1-对氯苄基-2-吡咯烷-1'-基甲基苯并咪唑)、二乙胺、哌嗪和氨丁三醇(三(羟基甲基)氨基甲烷);以及金属阳离子钡和铋。
[0519]
本文所述的化合物还可包含合适的载体、赋形剂和助剂,其可取决于施用模式而不同。
[0520]
在一些实施方案中,药物组合物可配制成合适的肠胃外剂型。所述制剂可通过本领域已知的各种方法制备。药物组合物可直接施用至血流中、肌肉中或直接施用至器官中。适于肠胃外施用的方式包括静脉内、动脉内、腹膜内、鞘内、脑室内、尿道内、胸骨内、颅内、肌内和皮下。适于肠胃外施用的装置包括针式注射器、无针注射器和输注技术。
[0521]
肠胃外组合物通常是水溶液,其可含有赋形剂,例如盐、碳水化合物和缓冲剂。然而,所述组合物还可配制成无菌非水溶液或干燥形式,与合适的媒介物(例如无菌无热原水)结合使用。
[0522]
使用本领域技术人员熟知的标准技术,可容易地在无菌条件下、例如通过冻干来制备肠胃外组合物。
[0523]
肠胃外施用的组合物可配制成立即释放和/或改进释放。改进释放制剂包括延迟释放、持续释放、脉冲释放、控制释放、靶向释放和程序释放。因此,所述组合物可配制成固体、半固体或触变液体,作为植入的贮库施用,从而提供活性剂的改进释放。
[0524]
肠胃外制剂可与肠胃外剂型中使用的其他合适的药学上可接受的赋形剂混合,例如(但不限于)防腐剂。
[0525]
在另一个实施方案中,药物组合物可配制成合适的口服剂型,例如片剂、胶囊、粉
剂、丸剂、混悬剂、溶液、乳液等。可存在其他合适的载体,例如崩解剂、稀释剂、螯合剂、粘合剂、助流剂、润滑剂、填充剂、增积剂、抗粘剂等。
[0526]
口服剂量制剂还可含有其他合适的药物赋形剂,例如甜味剂、媒介物/润湿剂、着色剂、矫味剂、防腐剂、增粘剂/增稠剂等。
[0527]
本发明的药物组合物的剂量可针对个别患者进行调整。
[0528]
脂质缀合物
[0529]
在某些实施方案中,本发明提供式(vi)化合物,
[0530][0531]
或其药学上可接受的盐,其中:
[0532]
a是1至20的整数;
[0533]
m是0、1、2、3或4;
[0534]
n是0或1;
[0535]
d-nh-是氨基取代的化合物的一部分,其中所述氨基取代的化合物具有式d-nh2;
[0536]
每个r1独立地选自c
1-c4烷基、o-c
1-c4烷基和卤素;
[0537]
r2选自c
1-c4烷基和-(ch2ch2o)
s-ch3;其中s是1至10的整数;
[0538]
r3和r
3'
各自独立地选自氢和c
1-c3烷基;
[0539]
l是可切割接头;并且
[0540]
lp是脂质。
[0541]
在一些实施方案中,d-nh2是sting调节剂。在一些实施方案中,d-nh2是环状二核苷酸(cdn)或cdn样化合物。在一些实施方案中,d-nh2是本文所述式中的一者。
[0542]
在某些实施方案中,本发明提供式(vi)化合物,其中l具有下式
[0543][0544]
其中w、z、t、u、q和u'是如本文所述。
[0545]
在一些实施方案中,式(vi)化合物与脂质复合物缔合。术语“脂质复合物”是药物化合物制备中公认的术语。脂质复合物的特征在于脂质与式(vi)化合物之间的非共价键合。不受特定理论的约束,式(vi)化合物可经由静电相互作用、亲水相互作用、疏水相互作用或其任何组合与脂质复合物缔合。
[0546]
在一些实施方案中,本文所述的脂质复合物采取脂质颗粒的形式。在一个实施方案中,复合物呈脂质纳米颗粒的形式。在一个实施方案中,复合物呈脂质体的形式。在一些实施方案中,本发明的脂质体包括脂质单层或脂质多层。在一些实施方案中,脂质体包括脂质双层和水性核心。在一些实施方案中,脂质体的平均粒径为约5nm至约1μm。在一些实施方
案中,脂质纳米颗粒或脂质体的平均粒径为约5nm至约500nm、约10nm至约150nm和约30nm至约100nm。在一些实施方案中,式(v)化合物驻留于水性核心、脂质双层或其组合中。
[0547]
在某些实施方案中,lp可为胆固醇或磷脂。在一些实施方案中,lp是磷脂。在一些实施方案中,磷脂选自磷脂酰胆碱、磷脂酰甘油、磷脂酸、磷脂酰乙醇胺、磷脂酰丝氨酸、大豆磷脂和蛋黄磷脂。在一些实施方案中,磷脂是磷脂酰乙醇胺。在一些实施方案中,磷脂是1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺。
[0548]
在一些实施方案中,在一些实施方案中,本发明提供包含式(vi)化合物的脂质复合物。在一些实施方案中,脂质复合物可为脂质体。
[0549]
在一些实施方案中,脂质复合物包含约0.5摩尔%至约40摩尔%的式(vi)化合物或其药学上可接受的盐。在一些实施方案中,脂质复合物包含约1摩尔%至约35摩尔%的式(vi)化合物或其药学上可接受的盐。在一些实施方案中,脂质复合物包含约1摩尔%至约30摩尔%的式(vi)化合物或其药学上可接受的盐。在一些实施方案中,脂质复合物包含约1摩尔%至约20摩尔%的式(vi)化合物或其药学上可接受的盐。在一些实施方案中,脂质复合物包含约1摩尔%至约15摩尔%的式(vi)化合物或其药学上可接受的盐。
[0550]
在一些实施方案中,脂质复合物还包含一种或多种额外磷脂。在一些实施方案中,磷脂选自磷脂酰胆碱、磷脂酰甘油、磷脂酸、磷脂酰乙醇胺、磷脂酰丝氨酸、鞘磷脂、大豆磷脂和蛋黄磷脂。
[0551]
在一些实施方案中,脂质复合物包含约30摩尔%至约90摩尔%的一种或多种磷脂。在一些实施方案中,脂质复合物包含约40摩尔%至约85摩尔%的一种或多种磷脂。在一些实施方案中,脂质复合物包含约50摩尔%至约80摩尔%的一种或多种磷脂。
[0552]
在一些实施方案中,脂质复合物还包含脂肪醇或胆固醇。在一些实施方案中,脂质复合物包含约5摩尔%至约35摩尔%的胆固醇。在一些实施方案中,脂质复合物包含约5摩尔%至约30摩尔%的胆固醇。在一些实施方案中,脂质复合物包含约5摩尔%至约25摩尔%的胆固醇。
[0553]
在一些实施方案中,脂质复合物还包含至少一种聚乙二醇化磷脂。在一些实施方案中,至少一种聚乙二醇化脂质是聚乙二醇化磷脂。在一些实施方案中,聚乙二醇化磷脂选自n-(羰基-甲氧基聚乙二醇5000)-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺、n-(羰基-甲氧基聚乙二醇2000)-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺、n-(羰基-甲氧基聚乙二醇2000)-1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺、n-(羰基-甲氧基聚乙二醇5000)-1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺、n-(羰基-甲氧基聚乙二醇2000)-1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺、n-(羰基-甲氧基聚乙二醇5000)-1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺、n-(羰基-甲氧基聚乙二醇2000)-二硬脂酰基-rac-甘油和n-(羰基-甲氧基聚乙二醇5000)-二硬脂酰基-rac-甘油、其药学上可接受的盐或其混合物。在一些实施方案中,聚乙二醇化磷脂是n-(羰基-甲氧基聚乙二醇2000)-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺。
[0554]
在一些实施方案中,脂质复合物包含约0至约6摩尔%的一种或多种聚乙二醇化磷脂。在一些实施方案中,脂质复合物包含约0.5摩尔%至5摩尔%的一种或多种聚乙二醇化磷脂。在一些实施方案中,脂质复合物包含约1摩尔%至5摩尔%的一种或多种聚乙二醇化磷脂。在一些实施方案中,脂质复合物包含约3摩尔%的一种或多种聚乙二醇化磷脂。在一
些实施方案中,脂质复合物包含约4摩尔%的一种或多种聚乙二醇化磷脂。在一些实施方案中,脂质复合物包含约5摩尔%的一种或多种聚乙二醇化磷脂。
[0555]
化合物和组合物的使用方法
[0556]
本文所述的某些化合物是sting激动剂并且因此可用于刺激其受试者中的免疫反应。组合物可用于治疗病毒。
[0557]
本发明的化合物显示sting调节/激动活性。本发明的某些化合物在功效表达、药代动力学(例如吸收、分布、代谢、排泄)、溶解性(例如水溶性)、与其他药物的相互作用(例如药物代谢酶抑制作用)、安全性(例如急性毒性、慢性毒性、遗传毒性、生殖毒性、心脏毒性、致癌性、中枢毒性)和/或稳定性(例如化学稳定性、对酶的稳定性)方面可为优异的,并且可用作药物。
[0558]
本发明的化合物可用于增加哺乳动物(例如小鼠、大鼠、仓鼠、兔、猫、狗、牛、绵羊、猴、人类)中的sting活性。
[0559]
本发明的化合物可用作药物,例如用于防护或治疗可受sting影响的疾病(在本说明书中,有时缩写为“sting相关疾病”)的药剂,所述疾病是例如癌症,例如结肠直肠癌(例如结肠直肠癌、直肠癌、肛门癌、家族性结肠直肠癌、遗传性非息肉性结肠直肠癌、胃肠间质瘤)、肺癌(例如非小细胞肺癌、小细胞肺癌、恶性间皮瘤)、间皮瘤、胰脏癌(例如胰脏导管癌、胰脏内分泌肿瘤)、咽癌、喉癌、食道癌、胃癌(例如乳头状腺癌、粘液腺癌、腺鳞状癌)、十二指肠癌、小肠癌、乳腺癌(例如浸润性导管癌、非浸润性导管癌、炎症性乳腺癌)、卵巢癌(例如卵巢上皮癌、性腺外生殖细胞瘤、卵巢生殖细胞瘤、卵巢低恶性潜能肿瘤)、睾丸肿瘤、前列腺癌(例如激素依赖性前列腺癌、非激素依赖性前列腺癌、去势抗性前列腺癌)、肝癌(例如肝细胞癌、原发性肝癌、肝外胆管癌)、甲状腺癌(例如甲状腺髓质癌)、肾癌(例如肾细胞癌(例如透明细胞肾细胞癌)、肾盂和输尿管的移行细胞癌)、子宫癌(例如宫颈癌、子宫体癌、子宫肉瘤)、妊娠绒毛膜癌、脑肿瘤(例如髓母细胞瘤、神经胶质瘤、松果体星形细胞瘤、毛细胞星形细胞瘤、弥漫性星形细胞瘤、间变性星形细胞瘤、垂体腺瘤)、视网膜母细胞瘤、皮肤癌(例如基底细胞瘤、恶性黑色素瘤)、肉瘤(例如横纹肌肉瘤、平滑肌肉瘤、软组织肉瘤、梭形细胞肉瘤)、恶性骨肿瘤、膀胱癌、血癌(例如多发性骨髓瘤、白血病(例如急性骨髓性白血病)、恶性淋巴瘤、霍奇金氏病、慢性骨髓增生性疾病)、不明原发性癌症;癌症生长抑制剂;癌症转移抑制剂;细胞凋亡促进剂;用于治疗癌前病灶(例如骨髓增生异常综合征)的剂;和诸如此类。
[0560]
在某些实施方案中,本发明的化合物可用作结肠直肠癌、乳腺癌、皮肤癌、恶性淋巴瘤或肺癌的药物。
[0561]
此外,本发明的化合物或本发明的组合剂可与非药物疗法同时使用。确切而言,本发明的化合物或本发明的组合剂可与例如以下的非药物疗法组合:(1)手术,(2)使用血管紧张素ii等的高血压化学疗法,(3)基因疗法,(4)温热疗法,(5)冷冻疗法,(6)激光烧灼和(7)放射疗法。
[0562]
例如,通过在上文所提及手术等之前或之后,或者在其中两种或三种的组合治疗之前或之后使用本发明的化合物,可提供例如预防抗性出现、延长无疾病存活期、抑制癌症转移或复发、延长寿命等的效果。
[0563]
此外,可将用本发明的化合物或本发明的组合剂进行的治疗与支持疗法组合:(i)
针对各种感染性疾病的并发症施用抗生素(例如β-内酰胺型,例如泛孢菌素(pansporin)等;大环内酯型,例如克拉霉素(clarithromycin)等),(ii)施用高热量输液、氨基酸制剂或一般维生素制剂以改善营养不良,(iii)施用吗啡以减轻疼痛,(iv)施用用于改善副作用(例如恶心、呕吐、厌食、腹泻、白细胞减少、血小板减少、血红蛋白浓度降低、脱发、肝病、肾病、dic、发热等)的医药剂,和(v)施用用于抑制癌症等的多重耐药性的医药剂。
[0564]
实施例
[0565]
一般合成方法和中间体
[0566]
本发明的化合物可由本领域的普通技术人员根据本发明和本领域的知识,和/或通过参考下文所示的方案和合成实施例来制备。示例性合成路线阐述于下文方案和实施例中。应理解,在下文方案和实施例中出现的变量(例如“r”基团)应独立于在本技术的其他地方出现的变量来理解。本领域的普通技术人员将容易理解下文所示的方案和实施例说明本文所述化合物的制备的方式。
[0567]
方案1:将羧酸转化成相应酰氯或(异丁基碳酸)丙酸酐的一般路线
[0568][0569]
方案1显示将羧酸i活化成相应酰氯或(异丁基碳酸)丙酸酐(例如ii)的一般路线,其中yc是烷基或芳族链,r6是甲基或含聚醚的烷基链。ii(其中e是oco2ch2ch(ch3)2)的制备可通过在碱存在下用氯甲酸异丁酯处理i来实现。当e是cl时,ii的形成通过用草酰氯或用ghosez试剂处理i来实现(参见α-chloro enamines,reactive intermediates for synthesis:1-chloro-n,n,2-trimethylpropenylamine.haveaux b.等人,org.synth.1980,59,26。)
[0570]
方案2:使用逐步方法将间隔子连接至药物部分中的氨基的一般路线
[0571][0572]
方案2显示将间隔子(例如ii)连接至药物部分(例如iii)中的氨基的一般方法。在化合物iii通过用三甲基氯硅烷和吡啶处理经受全甲硅烷基保护后,使其与活化间隔子ii
反应。用net
3-3hf去除甲硅烷基获得iv。通过用酸(例如tfa或hcl)处理来完成iv的胺的脱保护,并且用活化二肽碳酸酯v处理所得胺盐以提供vi。
[0573]
方案3:使用逐步方法将间隔子连接至药物部分中的氨基的一般路线
[0574][0575]
方案3显示将间隔子(例如ii)连接至药物部分(例如iii-a)中的氨基的一般方法,其中x1和x2是氧、硫或ch2,x3是氮或ch,r3是氢或氟,r4是羟基、氢、氟或与r3一起形成och2,rc是oh或sh,rd是甲基或(ch2)3nhc(o)nh2。在化合物iii-a通过用三甲基氯硅烷和吡啶处理经受全甲硅烷基保护后,使其与活化间隔子ii反应。用net
3-3hf去除甲硅烷基获得iv-a。通过用酸(例如tfa或hcl)处理来完成iv-a的胺的脱保护,并且用活化二肽碳酸酯v处理所得胺盐以提供vi-a。
[0576]
方案4:使用逐步方法将间隔子连接至药物部分中的氨基的一般路线
[0577][0578]
方案4显示遵循方案3中所述的一般方法将间隔子基团(例如ii)连接至药物部分(例如iii-b)中的氨基的一般方法。
[0579]
方案5:产生间隔子肽酰氯的一般路线
[0580][0581]
方案5显示制备酰氯viii的一般方法。使用酸(例如tfa或hcl)对boc-胺i脱保护后,用活化碳酸酯v处理以获得羧酸vii。可通过用草酰氯或磺酰氯处理将vii转化成酰氯viii。
[0582]
方案6:将间隔子连接至药物部分中的氨基的替代性一般路线
[0583][0584]
方案6显示将有效负载iii直接转化成化合物ix的替代性一般方法。在用三甲基氯硅烷进行全甲硅烷基保护后,用酰氯viii处理iii。去除甲硅烷基获得ix。
[0585]
方案7:将间隔子连接至药物部分中的氨基的替代性一般路线
[0586][0587]
方案7显示遵循方案6中所述的一般方法将有效负载iii-a直接转化成化合物ix-a的替代性一般方法。
[0588]
方案8:将间隔子连接至药物部分中的氨基的替代性一般路线
[0589][0590]
方案8显示遵循方案6中所述的一般方法将间隔子连接至药物部分(例如iii-b)中的氨基的替代性一般方法。
[0591]
方案9:制备接头-有效负载的一般路线
[0592][0593]
方案9显示从vi制备接头-有效负载xi的一般方法,其中yd是直链或支链烷基链或聚醚链,并且z是例如马来酰亚胺、bcn或dbco的缀合柄。用酸(例如tfa或hcl)对vi的胺脱保护后接着与活化酯x反应以获得接头-有效负载xi。
[0594]
方案10:制备接头-有效负载的一般路线
[0595][0596]
方案10显示遵循方案9中所述的一般方法从vi-a制备接头-有效负载xi-a的一般方法。
[0597]
方案11:制备接头-有效负载的一般路线
[0598][0599]
方案11显示遵循方案9中所述的一般方法将缀合柄连接至化合物(例如vi-b)的一般方法。
[0600]
方案12:制备接头-有效负载的一般路线
[0601][0602]
方案12显示从iv制备接头-有效负载xi的替代性方法。用酸(例如tfa或hcl)对iv的胺脱保护后接着与xii反应以提供xi。
[0603]
方案13:制备接头-有效负载的一般路线
[0604][0605]
方案13显示遵循方案12中所述的一般方法自iv-a制备接头-有效负载xi-a的替代性方法。
[0606]
方案14:制备接头-有效负载的一般路线
[0607][0608]
方案14显示制备含葡糖醛酸酯的接头有效负载xvi的一般方法。用酸(例如tfa或hcl)对iv的胺脱保护后接着与活化碳酸酯xiii反应以获得xiv。用碱(例如氢氧化锂)进行全乙酸酯水解并去除xiv中的fmoc基团获得xv。用活化缀合柄x处理xv提供含葡糖醛酸酯的接头有效负载xvi。
[0609]
方案15:制备接头-有效负载的一般路线
[0610][0611]
方案15显示遵循方案14中所述的一般方法制备含葡糖醛酸酯的接头有效负载xvi-a的一般方法。
[0612]
方案16:制备接头-有效负载的一般路线
[0613][0614]
方案16显示制备含末端胺的接头有效负载xviii的一般方法,其中ye是直链烷基链或含聚醚的烷基链。用酸(例如tfa或hcl)对vi的胺脱保护后接着与活化缀合柄xvii反应。用酸(例如tfa)去除末端保护基团提供含末端胺的接头有效负载xviii。
[0615]
方案17:制备接头-有效负载的一般路线
[0616][0617]
方案17显示遵循方案16中所述的一般方法制备含末端胺的接头有效负载xviii-a的一般方法。
[0618]
方案18:制备接头-有效负载的一般路线
[0619][0620]
方案18显示制备并入二肽间隔子的接头有效负载(例如xxii)的一般方法,其中r7是氢、烷基或芳族部分。通过用三甲基氯硅烷和吡啶处理对化合物iii进行全面保护,然后用boc-脯氨酸琥珀酰亚胺酯处理。用氟化物源(例如net
3-3hf)去除甲硅烷基获得xix。用酸(例如tfa或hcl)对xix的胺脱保护后接着与琥珀酰亚胺酯活化氨基酸xx反应以获得xxi。用
酸(例如tfa或hcl)对xxi的胺脱保护后接着安装马来酰亚胺柄以提供接头有效负载xxii。
[0621]
方案19:制备接头-有效负载的一般路线
[0622][0623]
方案19显示遵循方案18中所述的一般方法制备接头有效负载(例如xxii-a)的一般方法。
[0624]
示例性adc和中间体的制备
[0625]
定义
[0626]
aa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
使用乙酸铵的lcms方法
[0627]
ac
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸盐
[0628]
acn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙腈
[0629]
atm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
大气压
[0630]
aq
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
水性
[0631]
bcn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二环[6.1.0]壬炔
[0632]
blq
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
低于定量限值
[0633]
bn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
苄基
[0634]
boc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁氧基羰基
[0635]
tbu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁基
[0636]
bz
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
苯甲酰基
[0637]cꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
摄氏度
[0638]
calcd
ꢀꢀꢀꢀꢀꢀꢀꢀ
计算值
[0639]
cbz
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
苄基氧基羰基
[0640]
dar
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
药物抗体比
[0641]
dbco
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二苯并环辛炔
[0642]
dcc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二环己基碳化二亚胺
[0643]
dcm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯甲烷
[0644]
dipea
ꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二异丙基乙胺
[0645]
dmap
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-二甲基氨基吡啶
[0646]
dma
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二甲基乙酰胺
[0647]
dmb
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2,4-二甲氧基苄基
[0648]
dmf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二甲基甲酰胺
[0649]
dmso
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲基亚砜
[0650]
dtt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二硫苏糖醇
[0651]
ε
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
消光系数
[0652]
e 0.1%
ꢀꢀꢀꢀꢀꢀ
0.1%溶液消光系数
[0653]
edc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺
[0654]
edta
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙二胺四乙酸
[0655]
et
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙基
[0656]
etoh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙醇
[0657]
etoac
ꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸乙酯
[0658]
fa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
使用甲酸的lcms方法
[0659]
fmoc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
芴基甲基氧基羰基
[0660]hꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
小时
[0661]
hatu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐
[0662]
hic
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
疏水相互作用色谱
[0663]
hoat
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-羟基-7-氮杂苯并三唑
[0664]
hplc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高压液相色谱
[0665]
hrms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高分辨率质谱
[0666]
ic
50
ꢀꢀꢀꢀꢀꢀꢀꢀ
50%抑制浓度
[0667]
lc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
液相色谱
[0668]
lcms
ꢀꢀꢀꢀꢀꢀꢀꢀ
液相色谱质谱
[0669]
m/z
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
质荷比
[0670]
mhz
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
兆赫兹
[0671]
me
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲基
[0672]
meoh
ꢀꢀꢀꢀꢀꢀꢀꢀ
甲醇
[0673]
μm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
微米
[0674]
min
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
分钟
[0675]
ml
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫升
[0676]
ms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
质谱
[0677]
mwco
ꢀꢀꢀꢀꢀꢀꢀꢀ
分子量截止值
hp1100或agilent 1100系列lc系统上。选择多个梯度和运行时间以最好地表征化合物。流动相是基于acn/水或meoh/水梯度并且含有0.1%甲酸(方法指示为fa)或10mm乙酸铵(方法指示为aa)。使用的溶剂梯度的一个实例是100%流动相a(流动相a=99%水+1%acn+0.1%甲酸)至100%流动相b(流动相b=95%acn+5%水+0.1%甲酸),流速为1ml/min,运行16.5min。
[0707]
在一些情况下,lcms谱记录于连接至agilent 6130质谱仪的agilent 1290infinity uplc系统、连接至waters acquity sq质谱仪的waters acquity uplc系统、或使用反相c18柱的连接至waters micromass zq质谱仪的agilent 1100系列hplc系统上。选择多个梯度和运行时间以最好地表征化合物。流动相是基于acn/水或meoh/水梯度并且含有0.1%甲酸(方法指示为fa)或10mm乙酸铵(方法指示为aa)。使用的溶剂梯度的一个实例是95%流动相a(流动相a=99%水+1%acn+0.1%甲酸)至100%流动相b(流动相b=95%acn+5%水+0.1%甲酸),流速为0.5ml/min,运行5min。
[0708]
制备型hplc:
[0709]
使用18
×
150mm sunfire c-18柱进行制备型hplc分离,使用由322个泵操作的gilson仪器用水-acn梯度洗脱,并且uv/可见光155检测器触发的级分收集设定在200nm与400nm之间。在agilent 1100lc/msd仪器上进行质量门控级分收集。
[0710]
本领域技术人员将认识到,梯度、柱长度和流速的改变是可能的,并且一些条件可能比其他条件更适合化合物表征,这取决于所分析的化学物质。
[0711]
制备型sfc:
[0712]
使用10、20或30mm
×
250mm chiralpak柱(通常为ia、ib、ic、id、ie和if)、10或20mm
×
250mm phenomenex lux cellulose-4或2-乙基吡啶柱进行制备型sfc,用适当百分比的含有0.3%二乙胺、0.3%tea、0.3%甲酸或不含任何酸或碱添加剂的超临界二氧化碳和醇洗脱。典型的等度条件是流速在10-100ml/min范围内并且柱温度为40℃。在jasco sfc制备型纯化系统上进行制备型sfc,uv/可见光触发的级分收集设定在200nm与400nm之间并且背压调节设定为10mpa。
[0713]
本领域的普通技术人员将认识到,梯度、柱长度和流速的改变是可能的,并且一些条件可能比其他条件更适合化合物表征,这取决于所分析的化学物质。
[0714]
分析型sec条件:
[0715]
sec谱是在280nm处记录于具有二极管阵列检测器使用sec柱(通常为tosoh biosep tsk gel,g3000swxl;p/n 8541;250a;5um;7.8mm
×
300mm)的hewlett-packard hp1100或agilent 1100系列lc系统上。流动相为100mm磷酸钠、300mm氯化钠,ph 6.8,10%乙腈(v/v)或1
×
pbs。典型操作是以1ml/min的流速等度运行20min。
[0716]
分析型hic条件:
[0717]
hic谱是在280nm处记录于具有二极管阵列检测器使用hic柱(通常为tosoh butyl-npr,4.6
×
35mm,2.5um,p/n:14947)的hewlett-packard hp1100或agilent 1100系列lc系统上。流动相a为25mm磷酸钠、1.5m硫酸铵,ph 7,并且流动相b为75%25mm磷酸钠,ph 7,25%异丙醇。对于典型20min操作,将在等度流动的初始与最终间隔之间使用95%/5%a/b至100%b的12min线性梯度。
[0718]
lc-qtof条件:
[0719]
lcms谱记录于使用加热至80℃的反相柱(通常为agilent,plrp-s,5μm,2.1mm
×
50mm)的连接至agilent 6545 qtof质谱仪的agilent 1260bioinert系列lc系统上。选择多个梯度和运行时间以最好地表征化合物。流动相是基于acn/水梯度并且含有0.1%甲酸。使用的溶剂梯度的一个实例是95%流动相a(流动相a=99%水+1%acn+0.1%甲酸)至100%流动相b(流动相b=95%acn+5%水+0.1%甲酸),其中条件显示于表1中。
[0720]
表1
[0721]
时间(min)流速(ml/min)a%b%00.35821810.35821820.357030190.5505019.50.51090210.5109021.10.58218220.58218
[0722]
样品是完整或还原的(20ul的1~5mg/ml adc溶液,用4ul的0.5m dtt溶液在37℃下处理30min)。使用agilent bioconfirm软件在适当的质量范围内对原始数据进行解卷积以获得蛋白质分子量,并且使用agilent dar计算器计算dar。
[0723]
lc/ms/ms条件:
[0724]
使用shimadzu uflc lc-20ad xr二元泵和sil-30ac mp自动取样器系统和ab sciex三重四极杆4500esi质谱进行lc/ms/ms分析。
[0725]
通常,将5ul样品等分试样在通过waters xselect c18 csh 3.5u2.1mm id
×
30mm柱后注射至lc/ms/ms中。流动相a含有于水中的0.1%甲酸,并且流动相b含有于5%水和95%乙腈中的0.1%甲酸。总运行时间为3min,流速为1.5ml/min,经1.5min线性梯度从100%a至100%b。最初,仪器在100%水性流动相溶剂下运行0.5min,然后其在下一个1.5min内增加至100%有机溶剂。
[0726]
制备型sec:
[0727]
在具有uv检测器使用sec柱(通常为ge superdex 200increase10/300gl)的gilson制备型hplc系统上进行制备型sec纯化。流动相为1
×
pbs(ph 7.4)。典型运行是以1ml/min的流速等度运行30min。基于uv临限值(在214nm和280nm处)触发级分收集。
[0728]
adc浓度:
[0729]
adc浓度是根据通过nanodrop(2000c;fisher scientific)系数测量的280nm uv吸光度减去相应接头-有效负载构建体的uv吸光度来计算。
[0730]
实施例1
[0731]
n-[(2-氯羰基苯基)甲基]-n-甲基-氨基甲酸叔丁酯(中间体1)
[0732][0733]
步骤1:2-(((叔丁氧基羰基)(甲基)氨基)甲基)苯甲酸
[0734]
向2-[(甲基氨基)甲基]苯甲酸(7.50g,44mmol)于1,4-二噁烷(136ml)和水中的1n氢氧化钠(182ml)中的溶液中添加二碳酸二叔丁酯(19.2g,88mmol)。将反应混合物在室温下搅拌2h。然后将反应混合物浓缩以去除有机溶剂并使用1n hcl将ph调节至ph 3。用etoac(3
×
)萃取粗产物。用盐水洗涤合并的有机相,干燥(na2so4),过滤并蒸发。通过硅胶色谱(0-50%etoac/dcm)纯化粗化合物,得到2-(((叔丁氧基羰基)(甲基)氨基)甲基)苯甲酸(8.88g,75%)。lcms(aa):m/z=264.1(m-h)。
[0735]
步骤2:n-[(2-氯羰基苯基)甲基]-n-甲基-氨基甲酸叔丁酯,中间体1
[0736]
在0℃下,将1-氯-n,n,2-三甲基丙烯基胺(0.52ml,4.0mmol)缓慢添加至2-(((叔丁氧基羰基)(甲基)氨基)甲基)苯甲酸(525mg,2.0mmol)于dcm(16ml)中的溶液中。然后将反应混合物升温至室温并搅拌1h。然后将反应混合物浓缩至干燥,得到粗n-[(2-氯羰基苯基)甲基]-n-甲基-氨基甲酸叔丁酯(中间体1,562mg,100%)。
[0737]
实施例2
[0738]
n-[[2-(2-氯-2-氧代-乙基)苯基]甲基]-n-甲基-氨基甲酸叔丁酯(中间体2)
[0739][0740]
步骤1:2-[2-[[叔丁氧基羰基(甲基)氨基]甲基]苯基]乙酸
[0741]
在室温下,向2-(2-(((叔丁氧基羰基)氨基)甲基)苯基)乙酸(1.50g,5.7mmol)于thf(20ml)中的溶液中添加碘甲烷(2.8ml,45.2mmol)。将反应混合物冷却至0℃并且分3份添加氢化钠(60%分散液于矿物油中,905mg,22.6mmol)。然后将反应混合物在室温下搅拌16h。用水淬灭反应混合物并且通过浓缩去除有机溶剂。使用1n hcl将水相酸化至ph 3并用et2o(2
×
)萃取粗产物。用盐水洗涤合并的有机相,干燥(na2so4),过滤并蒸发,得到2-[2-[[叔丁氧基羰基(甲基)氨基]甲基]苯基]乙酸(1.36g,86%)。lcms(aa):m/z=280.2(m+h)。
[0742]
步骤2:n-[[2-(2-氯-2-氧代-乙基)苯基]甲基]-n-甲基-氨基甲酸叔丁酯,中间体2
[0743]
标题化合物是遵循实施例1的步骤2中所述的程序,用2-[2-[[叔丁氧基羰基(甲基)氨基]甲基]苯基]乙酸(650mg,2.33mmol)开始制备,得到粗中间体2(693mg,100%)。
[0744]
实施例3
[0745]
4-[叔丁氧基羰基(甲基)氨基]丁酸异丁氧基羰基酯(中间体3)
[0746][0747]
步骤1:4-((叔丁氧基羰基)(甲基)氨基)丁酸
[0748]
标题化合物是遵循实施例2的步骤1中所述的程序,使用4-(叔丁氧基羰基氨基)丁酸(2.92g,14.4mmol)代替2-(2-(((叔丁氧基羰基)氨基)甲基)苯基)乙酸制备,得到4-((叔丁氧基羰基)(甲基)氨基)丁酸(2.89g,93%)。lcms(aa):m/z=216.1(m-h)。
[0749]
步骤2:4-[叔丁氧基羰基(甲基)氨基]丁酸异丁氧基羰基酯,中间体3
[0750]
向4-((叔丁氧基羰基)(甲基)氨基)丁酸(360mg,1.57mmol)和三乙胺(0.24ml,1.73mmol)溶解于dcm(7ml)中并且冷却至0℃的溶液中逐滴添加氯甲酸异丁酯(0.22ml,1.73mmol)。完成添加后,将反应混合物在室温下搅拌2h。然后将混合物浓缩至干燥,得到粗4-[叔丁氧基羰基(甲基)氨基]丁酸异丁氧基羰基酯(中间体3,499mg,100%)。
[0751]
实施例4
[0752]
下文所列示的化合物是如实施例3中所述,用表2中所示的起始材料代替4-(叔丁氧基羰基氨基)丁酸来制备。
[0753]
表2
[0754][0755][0756]
实施例5
[0757]
n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}-2-[(甲基氨基)甲基]苯甲酰胺(中间体6)
14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}-2-[(甲基氨基)甲基]苯甲酰胺,中间体6
[0762]
将呈n,n-二乙基乙胺盐形式的[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸叔丁酯(50mg,0.045mmol)添加至圆底烧瓶中并冷却至0℃。然后经由注射器添加三氟乙酸(0.24ml,3.2mmol)和dcm(0.58ml)的溶液,并且将反应混合物在0℃下搅拌30min。然后将反应混合物浓缩至干燥并置于真空下2h,得到呈2,2,2-三氟乙酸盐形式的中间体6(41mg,100%)。lcms(aa):m/z=797.1(m+h)。
[0763]
实施例6
[0764]
[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯,化合物1(c-1)
[0765][0766]
步骤1:[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯,中间体7
[0767]
在室温下,向叔丁基氧基羰基-缬氨酰基-丙氨酰基-(4-氨基苄基)-(4-硝基苯基)碳酸酯(58mg,0.10mmol)和4-二甲基氨基吡啶(12mg,0.10mmol)于dmf(0.38ml)和三乙胺(0.055ml,0.40mmol)中的溶液中添加中间体6(45mg,0.05mmol)于dmf(1.5ml)中的溶液。将反应混合物在室温下搅拌15min。添加celite并将混合物浓缩至干燥。通过反相快速柱色谱(0-40%acn/三乙基乙酸铵水溶液(10mm))纯化吸附至celite上的粗残余物,得到呈n,n-二乙基乙胺盐形式的[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基
甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯(中间体7,10mg,16%)。lcms(aa):m/z=1216.3(m+h)。1h nmr(400mhz,cd3od)δ8.70(s,1h),8.43(brs,1h),8.40(d,j=5.9hz,1h),7.70(d,j=7.5hz,1h),7.56-7.46(m,3h),7.42-7.38(m,1h),7.32-7.19(m,3h),6.84(d,j=5.5hz,1h),6.15(d,j=7.3hz,1h),5.62-5.56(m,1h),5.54-5.48(m,1h),5.08-5.02(m,1h),5.04(s,2h),4.88-4.83(m,1h),4.81-4.76(m,2h),4.53-4.47(m,1h),4.37-4.22(m,3h),4.08-4.03(m,1h),3.92-3.89(m,1h),3.82-3.74(m,1h),2.88(s,3h),2.58-2.30(m,4h),2.10-2.03(m,1h),1.54-1.47(m,1h),1.46-1.44(m,3h),1.44(s,9h),0.98(d,j=6.8hz,3h),0.93(d,j=6.8hz,3h)。
31
pnmr(162mhz,cd3od)δ55.01(s,1p),53.03(s,1p)。
[0768]
步骤2:[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-{[(2s)-2-氨基-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯,中间体8
[0769]
标题化合物是遵循实施例5的步骤2中所述的程序,使用中间体7(10mg,0.008mmol)代替[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸叔丁酯并在室温下搅拌10min来制备,得到呈2,2,2-三氟乙酸盐形式的[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-{[(2s)-2-氨基-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯(中间体8,9mg,100%)。lcms(aa):m/z=1116.3(m+h)。
[0770]
步骤3:[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯,化合物c-1
[0771]
向中间体8(8mg,0.007mmol)和6-马来酰亚胺基己酸n-琥珀酰亚胺基酯(3.1mg,0.010mmol)于thf(0.20ml)和dmf(0.10ml)中的溶液中逐滴添加n,n-二异丙基乙胺(2.5ul,0.014mmol)。将反应混合物在室温下搅拌1h。然后将反应混合物浓缩至干燥,并通过反相快速柱色谱(0-100%acn/乙酸铵水溶液(10mm))纯化粗残余物,得到呈铵盐形式的[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯(c-1,4.2mg,45%)。lcms(aa):m/z=1309.4(m+h)。hrms(m/z):c
55h66n12o18
p2s2的[m+h]
+
计算值1309.3607;实验值1309.3639。
[0772]
实施例7
[0773]
氯甲酸2-[叔丁氧基羰基(甲基)氨基]乙酯(中间体9)
[0774][0775]
步骤1:氯甲酸2-[叔丁氧基羰基(甲基)氨基]乙酯,中间体9
[0776]
向n-(2-羟基乙基)-n-甲基氨基甲酸叔丁酯(296mg,1.69mmol)于冷却至0℃的thf(4.2ml)和n,n-二异丙基乙胺(1ml,5.9mmol)中的溶液中缓慢添加三光气(752mg,2.53mmol)。将反应混合物升温至室温并搅拌1h。将反应混合物过滤,用thf洗涤固体,并将滤液浓缩至干燥,得到粗氯甲酸2-[叔丁氧基羰基(甲基)氨基]乙酯(中间体9,402mg,100%)。
[0777]
实施例8
[0778]
n-[(2-氯羰基苯基)甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(中间体10)
[0779][0780]
步骤1:2-[[[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲氧基羰基-甲基-氨基]甲基]苯甲酸
[0781]
标题化合物是遵循实施例6的步骤1中所述的程序,用2-[(甲基氨基)甲基]苯甲酸hcl(150mg,0.72mmol)代替中间体6开始来制备。在通过硅胶色谱(0-25%meoh/dcm)纯化后,获得2-[[[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲氧基羰基-甲基-氨基]甲基]苯甲酸(306mg,67%)。lcms(aa):m/z=583.4(m-h)。
[0782]
步骤2:n-[(2-氯羰基苯基)甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯,中间体10
[0783]
向2-[[[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲氧基羰基-甲基-氨基]甲基]苯甲酸(295mg,0.50mmol)于冷却至0℃的thf(1.5ml)中的溶液中添加草酰氯(2.0m溶液于dcm中,0.25ml,0.50mmol),然后添加3滴dmf。将反应混合物在0℃下搅拌45min。然后将混合物浓缩至干燥,得到粗中间体10(304mg,100%)。
[0784]
实施例8a
[0785]
(4-氯-4-氧代丁基)甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯(中间体34)
{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯(中间体7)
[0795][0796]
[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯,中间体7
[0797]
标题化合物是遵循实施例5的步骤1中所述的程序,用中间体10代替n-[(2-氯羰基苯基)甲基]-n-甲基-氨基甲酸叔丁酯(中间体1)来制备。通过反相快速柱色谱(0-50%acn/碳酸氢铵水溶液(5mm))纯化粗产物,得到呈铵盐形式的中间体7。然后将此物质溶解于meoh(2ml)中并添加三乙胺(5ml)。将混合物摇晃1min,去除溶剂并冻干过夜,得到呈n,n-二乙基乙胺盐形式的[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯(147mg,48%)。lcms(aa):m/z=1216.3(m+h)。1h nmr与实施例6的步骤1一致。
[0798]
实施例10
[0799]
[2-(氯羰基)苄基]2,5,8,11-四氧杂十三烷-13-基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯(中间体11)
氯羰基苯基)甲基]-n-甲基-氨基甲酸叔丁酯(中间体1)来制备。
[0809]
表3
[0810]
4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨基)-4-氧代丁基]甲基氨基甲酸叔丁酯
[0817]
标题化合物是遵循实施例5的步骤1中所述的程序,分别使用呈钠盐形式的7-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-14-(6-氨基-9h-嘌呤-9-基)-15-氟-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-5-氟-3,7-二氢-4h-吡咯并[2,3-d]嘧啶-4-酮(化合物no.14,参见wo2018100558a2,200mg,0.265mmol)和中间体3(503mg,1.59mmol)代替2-氨基-9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-1,9-二氢-6h-嘌呤-6-酮和中间体1来制备。通过反相快速柱色谱(0-50%acn/碳酸氢铵水溶液(5mm))纯化,获得呈铵盐形式的[4-({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨基)-4-氧代丁基]甲基氨基甲酸叔丁酯(148mg,59%)。lcms(aa):m/z=910.5(m+h)。1h nmr(400mhz,d2o)δ8.70(s,1h),8.34(s,1h),8.01(s,1h),7.28(s,1h),6.56(d,j=16.1hz,1h),6.43(d,j=8.4hz,1h),5.67(dd,j=51.0,3.9hz,1h),5.18-4.99(m,2h),4.82-4.77(m,1h),4.63-4.58(m,1h),4.49-4.38(m,3h),4.31-4.25(m,1h),4.12-4.06(m,1h),3.43-3.36(m,2h),2.88(s,3h),2.73-2.68(m,2h),2.04-1.97(m,2h),1.34(s,9h)。
31
p nmr(162mhz,d2o)δ55.47(s,1p),52.07(s,1p)。
19
f nmr(376mhz,cd3od)δ-165.50(m,1f),-203.45(m,1f)。
[0818]
步骤2:n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}-4-(甲基氨基)丁酰胺,中间体17
[0819]
标题化合物是遵循实施例5的步骤2中所述的程序,使用呈铵盐形式的[4-({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨基)-4-氧代丁基]甲基氨基甲酸叔丁酯(42mg,0.045mmol)代替[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸叔丁酯并在室温下搅拌30min来制备。获得呈2,2,2-三氟乙酸盐形式的n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}-4-(甲基氨基)丁酰胺(中间体17,41mg,100%)。lcms(aa):m/z=810.2(m+h)。
[0820]
实施例13
[0821]
下表5中所列示的化合物是如实施例12中所述,用表4中所示的起始材料代替4-[叔丁氧基羰基(甲基)氨基]丁酸异丁氧基羰基酯(中间体3)来制备。
[0822]
表4
[0823][0824][0825]
*在步骤2中,将1,4-二噁烷中的4m hcl用于脱保护步骤。
[0826]
表5
[0827][0828][0829]
实施例14
[0830]
表7中所列示的化合物是如实施例6中所述,用表6中所示的起始材料代替中间体6来制备。
[0831]
表6
[0832][0833][0834]
*在步骤2中,以2:1的比率(对甲酚:tfa)将对甲酚添加至反应混合物中。
[0835]
表7
[0836][0837]
实施例15
[0838]
表8中所列示的化合物(中间体19)是如实施例6的步骤1中所述,用表中所示的起始材料代替叔丁基氧基羰基-缬氨酰基-丙氨酰基-(4-氨基苄基)-(4-硝基苯基)碳酸酯来制备。
[0839]
表8
[0840][0841]
实施例16
[0842]
表10中所列示的化合物是如实施例6的步骤2和3中所述,用表9中所示的起始材料代替中间体7来制备。
[0843]
表9
[0844][0845]
表10
[0846][0847]
实施例17
[0848]
表12中所列示的化合物是如实施例6的步骤3中所述,用表11中所示的起始材料代替6-马来酰亚胺基己酸n-琥珀酰亚胺基酯来制备。
[0849]
表11
[0850]
[0851][0852]
*使用三乙胺作为碱代替n,n-二异丙基乙胺。
[0853]
表12
[0854]
[0855][0856]
实施例18
[0857]
表14中所列示的化合物是如实施例6的步骤2和3中所述,用表13中所示的起始材料分别代替中间体7和6-马来酰亚胺基己酸n-琥珀酰亚胺基酯来制备。
[0858]
表13
[0859]
[0860]
[0861]
[0862][0863]
*使用三乙胺作为碱代替n,n-二异丙基乙胺。
[0864]
**跳过实施例6中的步骤2。
[0865]
表14
[0866]
[0867]
[0868]
[0869][0870]
实施例19
[0871]
[4-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨基)-2,2-二甲基-4-氧代丁基]
甲基氨基甲酸4-{[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯,化合物20(c-20)
[0872][0873]
步骤1:[4-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨基)-2,2-二甲基-4-氧代丁基]甲基氨基甲酸4-{[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯,化合物20
[0874]
在室温下,向碳酸[4-[[(2s)-2-[[(2s)-2-[6-(2,5-二氧代吡咯-1-基)己酰基氨基]-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(4-硝基苯基)酯(47.9mg,0.037mmol)和1-羟基-7-氮杂苯并三唑(4.08mg,0.03mmol)于dmf(0.60ml)和n,n-二异丙基乙胺(26ul,0.15mmol)中的溶液中添加呈2,2,2-三氟乙酸盐形式的n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}-3,3-二甲基-4-(甲基氨基)丁酰胺(中间体14,20mg,0.02mmol)于dmf(0.54ml)中的溶液。将反应混合物在室温下搅拌16h。添加celite并且将混合物浓缩至干燥。通过反相快速柱色谱(0-100%acn/乙酸铵水溶液(10mm))纯化吸附至celite上的粗残余物,得到呈铵盐形式的[4-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨基)-2,2-二甲基-4-氧代丁基]甲基氨基甲酸4-{[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯(c-20,4mg,17%)。lcms(aa):m/z=1287.4(m-h)。
[0875]
实施例20
[0876]
表16中所列示的化合物是如实施例19中所述,用表15中所示的起始材料a和b分别代替中间体14和碳酸[4-[[(2s)-2-[[(2s)-2-[6-(2,5-二氧代吡咯-1-基)己酰基氨基]-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(4-硝基苯基)酯来制备。
[0877]
表15
[0878][0879][0880]
*在反应中使用1-羟基苯并三唑和三乙胺代替1-羟基-7-氮杂苯并三唑和n,n-二异丙基乙胺。
[0881]
**在反应中使用4-二甲基氨基吡啶和三乙胺代替1-羟基-7-氮杂苯并三唑和n,n-二异丙基乙胺。
[0882]
表16
[0883][0884][0885]
实施例21
[0886]
n-{(2s)-6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-1-[(2,5-二氧代吡咯烷-1-基)氧基]-1-氧代己-2-基}-2,5,8,11,14-五氧杂十七烷-17-酰胺(中间体20)
[0887][0888]
步骤1:(19s)-19-[4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁基]-17-氧代-2,5,8,11,14-五氧杂-18-氮杂二十烷-20-酸
[0889]
向1-[(17-氧代-2,5,8,11,14-五氧杂十七烷-17-基)氧基]吡咯烷-2,5-二酮(4.0g,10.5mmol)于无水dcm(10ml)中的溶液中添加溶解于dmf(40ml)中的(s)-2-氨基-6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酸盐酸盐(3.4g,12.9mmol),然后添加n,n-二异丙基乙胺(6.9ml,42mmol)。将反应混合物在室温下搅拌18h。将反应混合物过滤并浓缩至干燥。通过制备型hplc纯化粗残余物,得到(19s)-19-[4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁基]-17-氧代-2,5,8,11,14-五氧杂-18-氮杂二十烷-20-酸(1.26g,24%)。lcms(aa):m/z=489.3(m+h)。
[0890]
步骤2:n-{(2s)-6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-1-[(2,5-二氧代吡咯烷-1-基)氧基]-1-氧代己-2-基}-2,5,8,11,14-五氧杂十七烷-17-酰胺,中间体20
[0891]
在室温下,向(19s)-19-[4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁基]-17-氧代-2,5,8,11,14-五氧杂-18-氮杂二十烷-20-酸(65mg,0.133mmol)和n,n'-二环己基碳化二亚胺(30mg,0.145mmol)于1,4-二噁烷(0.68ml)中的溶液中添加n-羟基琥珀酰亚胺(15.3mg,0.133mmol)。将反应混合物在室温下搅拌16h。添加celite并将混合物过滤,用1,4-二噁烷冲洗并浓缩至干燥。通过硅胶色谱(0-10%meoh/dcm)纯化吸附至celite上的粗残余物,得到中间体20(14.6mg,19%)。lcms(aa):m/z=586.3(m+h)。
[0892]
实施例22
[0893]
表17中所列示的化合物是如实施例9中所述,用表中所示的起始材料代替中间体10来制备。
[0894]
表17
[0895][0896][0897]
实施例23
[0898]
(2s,3s,4s,5r,6s)-6-{2-[(3-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}丙酰基)氨基]-4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯氧基}-3,4,5-三羟基四氢-2h-吡喃-2-甲酸,化合物24(c-24)
[0899][0900]
步骤1:(2s,3s,4s,5r,6s)-3,4,5-三乙酰氧基-6-{2-[(3-{[(9h-芴-9-基甲氧基)羰基]氨基}丙酰基)氨基]-4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯氧基}四氢-2h-吡喃-2-甲酸甲酯
[0901]
标题化合物是遵循实施例6的步骤1中所述的程序,用中间体6(104mg,0.094mmol)和(2s,3s,4s,5r,6s)-3,4,5-三乙酰氧基-6-[2-[3-(9h-芴-9-基甲氧基羰基氨基)丙酰基氨基]-4-[(4-硝基苯氧基)羰基氧基甲基]苯氧基]四氢吡喃-2-甲酸甲酯(150mg,0.16mmol)(关于合成,参见jeffrey,s.c.等人,bioconjugate chem.2006,17,831-840)开始,使用n,n-二异丙基乙胺作为碱来制备,得到呈铵盐形式的(2s,3s,4s,5r,6s)-3,4,5-三乙酰氧基-6-{2-[(3-{[(9h-芴-9-基甲氧基)羰基]氨基}丙酰基)氨基]-4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯氧基}四氢-2h-吡喃-2-甲酸甲酯(71mg,48%)。lcms(aa):m/z=1570.9(m+h)。
[0902]
步骤2:(2s,3s,4s,5r,6s)-6-{2-[(3-氨基丙酰基)氨基]-4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯氧基}-3,4,5-三羟基四氢-2h-吡喃-2-甲酸,中间体22
[0903]
在室温下,向呈铵盐形式的(2s,3s,4s,5r,6s)-3,4,5-三乙酰氧基-6-{2-[(3-{[(9h-芴-9-基甲氧基)羰基]氨基}丙酰基)氨基]-4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯氧基}四氢-2h-吡喃-2-甲酸甲酯(66mg,0.042mmol)溶解于thf(13ml)中的溶液中添加lioh(0.5m水溶液,1.25ml,0.625mmol)并且将反应混合物搅拌2.5h。用1m hcl将反应混合物中和至ph 7并且将混合物浓缩至干燥。通过反相快速柱色谱(0-30%acn/碳酸氢铵水溶液(5mm))纯化粗残余物,得到呈铵盐形式的中间体22(26mg,50%)。然后将此物质溶解于meoh(5ml)中并添加三乙胺(1ml)。将混合物摇晃1min。去除溶剂并且将所得残余物冻干过夜,得到呈n,n-二乙基乙胺盐形式的(2s,3s,4s,5r,6s)-6-{2-[(3-氨基丙酰基)氨基]-4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯氧基}-3,4,5-三羟基四氢-2h-吡喃-2-甲酸(中间体22,30mg,100%)。lcms(aa):m/z=1209.0(m+h)。
[0904]
步骤3:(2s,3s,4s,5r,6s)-6-{2-[(3-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}丙酰基)氨基]-4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯氧基}-3,4,5-三羟基四氢-2h-吡喃-2-甲酸,化合物24
[0905]
标题化合物是遵循实施例6的步骤3中所述的程序,使用中间体22(24mg,0.02mmol)代替中间体8来制备,得到呈铵盐形式的(2s,3s,4s,5r,6s)-6-{2-[(3-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}丙酰基)氨基]-4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯氧基}-3,4,5-三羟基四氢-2h-吡喃-2-甲酸(c-24,17mg,71%)。lcms(aa):m/z=1402.4(m+h)。hrms(m/z):c
56h65n11o24
p2s2的[m+h]
+
计算值1402.3193;实验值1402.3232。
[0906]
实施例24
[0907]
表18中所列示的化合物(化合物25)是如实施例23的步骤3中所述,用表中所示的起始材料分别代替6-马来酰亚胺基己酸n-琥珀酰亚胺基酯来制备。
[0908]
表18
[0909][0910]
c-25结构:
[0911][0912]
实施例25
[0913]
{2-[(2r)-2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)吡咯烷-1-基]-2-氧代乙基}氨基甲酸4-{[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯,化合物26(c-26)
[0914][0915]
步骤1:2-[[4-[[(2s)-2-[[(2s)-2-[6-(2,5-二氧代吡咯-1-基)己酰基氨基]-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲氧基羰基氨基]乙酸
[0916]
在室温下,向甘氨酸(24mg,0.32mmol)于三乙胺(0.10ml,0.72mmol)、dmf(0.50ml)和dmso(0.50ml)中的溶液中添加碳酸[4-[[(2s)-2-[[(2s)-2-[6-(2,5-二氧代吡咯-1-基)己酰基氨基]-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(4-硝基苯基)酯(220mg,0.34mmol)。将反应混合物在室温下搅拌4h。然后将反应混合物冷却至0℃。添加水(1ml)并通过添加甲酸将溶液酸化至ph 4。将混合物浓缩至干燥,并通过反相快速柱色谱(0-100%acn/甲酸水溶液(0.1%))纯化粗残余物,得到2-[[4-[[(2s)-2-[[(2s)-2-[6-(2,5-二氧代吡咯-1-基)己酰基氨基]-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲氧基羰基氨基]乙酸(87mg,44%)。lcms(aa):m/z=586.3(m-h)。
[0917]
步骤2:{2-[(2r)-2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)吡咯烷-1-基]-2-氧代乙基}氨基甲酸4-{[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯,化合物26
[0918]
在室温下,向2-[[4-[[(2s)-2-[[(2s)-2-[6-(2,5-二氧代吡咯-1-基)己酰基氨基]-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲氧基羰基氨基]乙酸(40mg,0.068mmol)和三乙胺(35ul,0.25mmol)于dmf(1ml)中的溶液中添加1-[双(二甲基氨基)亚甲基]-1h-1,2,
3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(46mg,0.12mmol),并且将反应混合物搅拌10min。然后在室温下向此溶液中逐滴添加呈2,2,2-三氟乙酸盐形式的(2r)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}吡咯烷-2-甲酰胺(中间体15,50mg,0.047mmol)于dmf(0.60ml)中的溶液。将反应混合物在室温下搅拌30min。然后将混合物冷却至0℃,添加水(1ml),并通过添加甲酸将溶液酸化至ph 4。将混合物浓缩至干燥,并通过反相快速柱色谱(0-100%acn/甲酸水溶液(0.1%))纯化粗残余物,得到{2-[(2r)-2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)吡咯烷-1-基]-2-氧代乙基}氨基甲酸4-{[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯(c-26,32mg,50%)。lcms(aa):m/z=1316.4(m+h)。hrms(m/z):c
53h67n13o19
p2s2的[m+h]
+
计算值1316.3666;实验值1316.3705。
[0919]
实施例26
[0920]
(2r)-1-({[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}乙酰基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}吡咯烷-2-甲酰胺,化合物27(c-27)
[0921][0922]
步骤1:{2-[(2r)-2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)吡咯烷-1-基]-2-氧代乙基}氨基甲酸叔丁酯
[0923]
向中间体15(60mg,0.05mmol)和(叔丁氧基羰基)甘氨酸2,5-二氧代吡咯烷-1-基酯(19mg,0.07mmol)于dmf(1.6ml)中的混合物中添加三乙胺(50ul,0.355mmol),并且将反应混合物在室温下搅拌1h。用水淬灭反应混合物,添加celite并将反应混合物浓缩至干燥。通过反相柱色谱(0-100%acn/碳酸氢铵水溶液(5mm))纯化吸附至celite上的粗残余物。将三乙胺(14ul,0.1mmol)添加至产物的水溶液中。冻干过夜,提供呈n,n-二乙基乙胺盐形式的{2-[(2r)-2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)吡咯烷-1-基]-2-氧代乙基}氨基甲酸叔丁酯(49mg,87%)。lcms(aa):m/z=904.4(m+h)。
[0924]
步骤2:(2r)-1-(氨基乙酰基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}吡咯烷-2-甲酰胺
[0925]
向呈n,n-二乙基乙胺盐形式的{2-[(2r)-2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)吡咯烷-1-基]-2-氧代乙基}氨基甲酸叔丁酯(37mg,0.033mmol)于meoh(1ml)中的溶液中添加盐酸(4m溶液于二噁烷中,1ml,4mmol),并且将反应混合物在室温下搅拌1h。然后将反应混合物浓缩至干燥并置于真空下2h,得到呈盐酸盐形式的(2r)-1-(氨基乙酰基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}吡咯烷-2-甲酰胺(37mg,100%)。lcms(aa):m/z=804.2(m+h)。
[0926]
步骤3:(2r)-1-({[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}乙酰基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚乙基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}吡咯烷-2-甲酰胺,化合物27
[0927]
标题化合物是遵循实施例26的步骤1中所述的程序,用呈盐酸盐形式的(2r)-1-(氨基乙酰基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}吡咯烷-2-甲酰胺(30mg,0.027mmol)和(2s)-2-[[(2s)-2-[6-(2,5-二氧代吡咯-1-基)己酰基氨基]-3-甲基-丁酰基]氨基]丙酸(2,5-二氧代吡咯烷-1-基)酯(24mg,0.04mmol)(关于合成,参见us20180015176a1)开始来制备。通过反相快速柱色谱(0-100%acn/甲酸水溶液(0.1%))纯化,得到(2r)-1-({[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}乙酰基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌
呤-2-基}吡咯烷-2-甲酰胺(c-27,20mg,64%)。lcms(aa):m/z=1167.1(m+h)。hrms(m/z):c
45h60n12o17
p2s2的[m+h]
+
计算值1167.3189;实验值1167.3206。
[0928]
实施例27
[0929]
[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(氨基乙酰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯,化合物28(c-28)
[0930][0931]
步骤1:(2-{[(2s)-1-{[(2s)-1-({4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯基}氨基)-1-氧代丙-2-基]氨基}-3-甲基-1-氧代丁-2-基]氨基}-2-氧代乙基)氨基甲酸叔丁酯
[0932]
标题化合物是遵循实施例6的步骤3中所述的程序,用中间体8(23mg,0.016mmol)和(叔丁氧基羰基)甘氨酸2,5-二氧代吡咯烷-1-基酯(11mg,0.039mmol)代替6-马来酰亚胺基己酸n-琥珀酰亚胺基酯开始来制备。将反应混合物在室温下搅拌30min。通过反相快速柱色谱(0-100%acn/三乙基乙酸铵水溶液(10mm))纯化,得到呈n,n-二乙基乙胺盐形式的(2-{[(2s)-1-{[(2s)-1-({4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄
基](甲基)氨甲酰基}氧基)甲基]苯基}氨基)-1-氧代丙-2-基]氨基}-3-甲基-1-氧代丁-2-基]氨基}-2-氧代乙基)氨基甲酸叔丁酯(13mg,57%)。lcms(aa):m/z=1273.1(m+h)。
[0933]
步骤2:[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(氨基乙酰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯,化合物28
[0934]
标题化合物是遵循实施例5的步骤2中所述的程序,用呈n,n-二乙基乙胺盐形式的(2-{[(2s)-1-{[(2s)-1-({4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯基}氨基)-1-氧代丙-2-基]氨基}-3-甲基-1-氧代丁-2-基]氨基}-2-氧代乙基)氨基甲酸叔丁酯(6.6mg,0.005mmol)代替[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸叔丁酯开始来制备。将反应混合物在室温下搅拌5min,得到呈2,2,2-三氟乙酸盐形式的[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(氨基乙酰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯(c-28,5.6mg,91%)。lcms(aa):m/z=1173.3(m+h)。
[0935]
实施例28
[0936]
表20中所列示的化合物是如实施例27中所述,用表19中所示的起始材料代替(叔丁氧基羰基)甘氨酸2,5-二氧代吡咯烷-1-基酯来制备。
[0937]
表19
[0938][0939]
表20
[0940][0941][0942]
实施例29
[0943]
{14-[(2,5-二氧代吡咯烷-1-基)氧基]-14-氧代-3,6,9,12-四氧杂十四烷-1-基}氨基甲酸叔丁酯(中间体23)
[0944][0945]
步骤1:{14-[(2,5-二氧代吡咯烷-1-基)氧基]-14-氧代-3,6,9,12-四氧杂十四烷-1-基}氨基甲酸叔丁酯,中间体23
[0946]
在室温下,向2,2-二甲基-4-氧代-3,8,11,14,17-五氧杂-5-氮杂十九烷-19-酸(120mg,0.32mmol)和1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺(78mg,0.49mmol)溶解于dcm(6.4ml)中的溶液中添加n-羟基琥珀酰亚胺(46mg,0.39mmol)。将反应混合物在室温下搅拌2.5h。用水淬灭反应混合物并用dcm(3
×
)萃取。用盐水洗涤合并的有机相,干燥(na2so4),过滤并蒸发,得到粗{14-[(2,5-二氧代吡咯烷-1-基)氧基]-14-氧代-3,6,9,12-四氧杂十四烷-1-基}氨基甲酸叔丁酯(中间体23,146mg,100%)。lcms(aa):m/z=447.2(m-h)。
[0947]
实施例30
[0948]
n-[(1s)-2-[(2-氯羰基苯基)甲基-[(2,4-二甲氧基苯基)甲基]氨基]-1-甲基-2-氧代-乙基]氨基甲酸叔丁酯(中间体24)
[0949][0950]
步骤1:2-[[(2,4-二甲氧基苯基)甲基氨基]甲基]苯甲酸
[0951]
标题化合物是遵循实施例10的步骤1中所述的程序,用2-羧基苯甲醛(6.0g,40mmol)和2,4-二甲氧基苄基胺(12ml,80mmol)开始来制备,得到2-[[(2,4-二甲氧基苯基)甲基氨基]甲基]苯甲酸(7.6g,61%)。lcms(aa):m/z=302.2(m+h)。
[0952]
步骤2:2-[[[(2s)-2-(叔丁氧基羰基氨基)丙酰基]-[(2,4-二甲氧基苯基)甲基]氨基]甲基]苯甲酸
[0953]
向2-[[(2,4-二甲氧基苯基)甲基氨基]甲基]苯甲酸(380mg,1.26mmol)和三乙胺(0.5ml,3.55mmol)于dmf(6ml)中的溶液中添加(叔丁氧基羰基)-l-丙氨酸2,5-二氧代吡咯烷-1-基酯(640mg,2.2mmol)。添加水(2ml)以帮助溶解反应混合物,将其在室温下搅拌1d。然后将反应混合物浓缩至干燥,并通过反相快速柱色谱(0-100%acn/甲酸水溶液(0.1%))纯化粗残余物,得到2-[[[(2s)-2-(叔丁氧基羰基氨基)丙酰基]-[(2,4-二甲氧基苯基)甲
基]氨基]甲基]苯甲酸(322mg,51%)。lcms(aa):m/z=473.3(m+h)。
[0954]
步骤3:n-[(1s)-2-[(2-氯羰基苯基)甲基-[(2,4-二甲氧基苯基)甲基]氨基]-1-甲基-2-氧代-乙基]氨基甲酸叔丁酯,中间体24
[0955]
标题化合物是遵循实施例1的步骤2中所述的程序,用2-[[[(2s)-2-(叔丁氧基羰基氨基)丙酰基]-[(2,4-二甲氧基苯基)甲基]氨基]甲基]苯甲酸(270mg,0.57mmol)代替2-(((叔丁氧基羰基)(甲基)氨基)甲基)苯甲酸开始来制备,得到粗中间体24(280mg,100%)。
[0956]
实施例31
[0957]
2-({[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}甲基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}苯甲酰胺,化合物31(c-31)
[0958][0959]
步骤1:[(2s)-1-{[(2s)-1-{[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]氨基}-1-氧代丙-2-基]氨基}-3-甲基-1-氧代丁-2-基]氨基甲酸叔丁酯
[0960]
标题化合物是遵循实施例26的步骤1中所述的程序,用中间体16(45mg,0.53mmol)和(叔丁氧基羰基)-l-缬氨酸2,5-二氧代吡咯烷-1-基酯(100mg,0.32mmol)分别代替中间体15和(叔丁氧基羰基)甘氨酸2,5-二氧代吡咯烷-1-基酯开始来制备。通过反相快速柱色谱(0-100%acn/乙酸铵水溶液(10mm))纯化,得到呈铵盐形式的[(2s)-1-{[(2s)-1-{[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]氨基}-1-氧代丙-2-基]氨基}-3-甲基-1-氧代丁-2-基]氨基甲酸叔丁酯(24mg,44%)。lcms(aa):m/z=1053.0(m+h)。
[0961]
步骤2:2-({[(2s)-2-{[(2s)-2-氨基-3-甲基丁酰基]氨基}丙酰基]氨基}甲基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧
基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}苯甲酰胺
[0962]
标题化合物是遵循实施例5的步骤2中所述的程序,用呈铵盐形式的[(2s)-1-{[(2s)-1-{[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]氨基}-1-氧代丙-2-基]氨基}-3-甲基-1-氧代丁-2-基]氨基甲酸叔丁酯(24mg,0.023mmol)代替[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸叔丁酯开始来制备,得到呈2,2,2-三氟乙酸盐形式的2-({[(2s)-2-{[(2s)-2-氨基-3-甲基丁酰基]氨基}丙酰基]氨基}甲基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}苯甲酰胺(24mg,97%)。lcms(aa):m/z=953.1(m+h)。
[0963]
步骤3:2-({[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}甲基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}苯甲酰胺,化合物31
[0964]
标题化合物是遵循实施例6的步骤3中所述的程序,用呈2,2,2-三氟乙酸盐形式的2-({[(2s)-2-{[(2s)-2-氨基-3-甲基丁酰基]氨基}丙酰基]氨基}甲基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}苯甲酰胺(24mg,0.022mmol)代替中间体8开始来制备,得到呈铵盐形式的2-({[(2s)-2-{[(2s)-2-{[6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}甲基)-n-{9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}苯甲酰胺(c-31,6.2mg,23%)。lcms(aa):m/z=1146.1(m+h)。hrms(m/z):c
46h57n11o16
p2s2的[m+h]
+
计算值1146.2974;实验值1146.2998。
[0965]
实施例32
[0966]
碳酸4-{[(2s)-2-{[(2s)-2-{[6-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-6-氧代己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯4-硝基苯酯(中间体25)
[0967][0968]
步骤1:6-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-n-[(2s)-1-{[(2s)-1-{[4-(羟基甲基)苯基]氨基}-1-氧代丙-2-基]氨基}-3-甲基-1-氧代丁-2-基]-6-氧代己酰胺
[0969]
向(2s)-2-氨基-n-[(1s)-2-[4-(羟基甲基)苯氨基]-1-甲基-2-氧代-乙基]-3-甲基-丁酰胺(240mg,0.82mmol)溶解于dmf(2ml)和thf(5.5ml)中的溶液中添加n,n-二异丙基乙胺(0.39ml,2.24mmol)。将反应混合物冷却至0℃并添加1-{[6-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-6-氧代己酰基]氧基}吡咯烷-2,5-二酮(320mg,0.75mmol)。将反应混合物升温至室温并且搅拌30min。用水稀释反应混合物并用etoac(3
×
)萃取。用饱和碳酸氢钠水溶液和盐水洗涤合并的有机相,干燥(na2so4),过滤并蒸发至干燥。通过硅胶色谱(50-100%etoac/dcm)纯化粗残余物,得到6-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-n-[(2s)-1-{[(2s)-1-{[4-(羟基甲基)苯基]氨基}-1-氧代丙-2-基]氨基}-3-甲基-1-氧代丁-2-基]-6-氧代己酰胺(347mg,76%)。lcms(aa):m/z=609.4(m+h)。
[0970]
步骤2:碳酸4-{[(2s)-2-{[(2s)-2-{[6-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-6-氧代己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯4-硝基苯酯,中间体25
[0971]
向6-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-n-[(2s)-1-{[(2s)-1-{[4-(羟基甲基)苯基]氨基}-1-氧代丙-2-基]氨基}-3-甲基-1-氧代丁-2-基]-6-氧代己酰胺(257mg,0.42mmol)于冷却至0℃的thf(4.2ml)和n,n-二异丙基乙胺(0.37ml,2.1mmol)中的溶液中一次性添加氯甲酸4-硝基苯酯(362mg,1.69mmol)。将反应混合物升温至室温并搅拌3h。用水稀释反应混合物并用dcm(3
×
)萃取。用饱和碳酸氢钠水溶液和盐水洗涤合并的有机相,干燥(na2so4),过滤并蒸发至干燥。通过硅胶色谱(0-100%etoac/dcm)纯化粗残余物,得到碳酸4-{[(2s)-2-{[(2s)-2-{[6-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-6-氧代己酰基]氨基}-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯4-硝基苯酯(中间体25,137mg,42%)。lcms(aa):m/z=774.4(m+h)。
[0972]
实施例33
[0973]
表21中所列示的化合物(中间体26)是如实施例32中所述,用表中所示的起始材料代替1-{[6-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-6-氧代己酰基]氧基}吡咯烷-2,5-二酮来制备。
[0974]
表21
[0975][0976]
实施例34
[0977]
(2s)-2-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-4-[(2,5-二氧代吡咯烷-1-基)氧基]-n-(2,5,8,11,14,17,20-七氧杂二十二烷-22-基)-4-氧代丁酰胺(中间体27)和(25s)-25-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸(中间体27a)
氮杂二十七烷-27-酸叔丁酯(2.56g,85%)。
[0983]
步骤3:(25s)-25-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸叔丁酯
[0984]
在0℃下,向(25s)-25-氨基-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸叔丁酯(3.32g,6.5mmol)、4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酸(1.5g,4.91mmol)和1-羟基-7-氮杂苯并三唑(884mg,6.57mmol)于dcm(50ml)中的溶液中添加1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺(1.25g,6.56mmol)和三乙胺(1.26ml,9.1mmol)。将反应混合物升温至室温并搅拌16h。用etoac稀释反应物并添加碳酸钾(20ml,4.0m于水中)。将混合物搅拌15min并将有机相分离,用饱和碳酸氢钠水溶液、盐水洗涤,干燥(na2so4),过滤并蒸发至干燥。通过硅胶色谱(0-10%meoh/dcm)纯化粗残余物,得到(25s)-25-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸叔丁酯(2.27g,44%)。
[0985]
步骤4:(25s)-25-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸
[0986]
标题化合物是遵循实施例5的步骤2中所述的程序,用(25s)-25-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸叔丁酯(278mg,0.35mmol)代替[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸叔丁酯开始来制备。通过硅胶色谱(0-20%meoh/dcm)纯化,得到(25s)-25-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸(中间体27a,180mg,70%)。lcms(aa):m/z=742.4(m+h)。
[0987]
步骤5:(2s)-2-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-4-[(2,5-二氧代吡咯烷-1-基)氧基]-n-(2,5,8,11,14,17,20-七氧杂二十二烷-22-基)-4-氧代丁酰胺,中间体27
[0988]
标题化合物是遵循实施例29中所述的程序,用(25s)-25-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸(60mg,0.08mmol)代替2,2-二甲基-4-氧代-3,8,11,14,17-五氧杂-5-氮杂十九烷-19-酸开始来制备。将反应混合物在室温下搅拌30min,得到(2s)-2-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-4-[(2,5-二氧代吡咯烷-1-基)氧基]-n-(2,5,8,11,14,17,20-七氧杂二十二烷-22-基)-4-氧代丁酰胺(中间体27,68mg,100%)。lcms(aa):m/z=839.4(m+h)。
[0989]
实施例35
[0990]
表23中所列示的化合物是如实施例6的步骤3中所述,用表22中所示的起始材料代替6-马来酰亚胺基己酸n-琥珀酰亚胺基酯来制备。
[0991]
表22
[0992][0993]
*使用三乙胺作为碱代替n,n-二异丙基乙胺。
[0994]
表23
[0995]
[0996][0997]
实施例36
[0998]
{(29s)-30-[(2,5-二氧代吡咯烷-1-基)氧基]-26,30-二氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂三十烷-29-基}氨基甲酸叔丁酯(中间体30)
[0999][1000]
步骤1:(29s)-29-[(叔丁氧基羰基)氨基]-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂三十烷-30-酸
[1001]
标题化合物是遵循实施例21的步骤1中所述的程序,用(s)-3-氨基-2-((叔丁氧基羰基)氨基)丙酸(238mg,1.17mmol)和1-[(26-氧代-2,5,8,11,14,17,20,23-八氧杂二十六烷-26-基)氧基]吡咯烷-2,5-二酮(300mg,0.58mmol)代替(s)-2-氨基-6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酸盐酸盐和1-[(17-氧代-2,5,8,11,14-五氧杂十七烷-17-基)氧基]吡咯烷-2,5-二酮开始,使用dmf作为溶剂并在室温下搅拌2h来制备。通过反相快速柱色谱(0-100%acn/三乙基乙酸铵水溶液(10mm))纯化,得到(29s)-29-[(叔丁氧基羰基)氨基]-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂三十烷-30-酸(344mg,99%)。lcms(aa):m/z=599.4(m+h)。
[1002]
步骤2:{(29s)-30-[(2,5-二氧代吡咯烷-1-基)氧基]-26,30-二氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂三十烷-29-基}氨基甲酸叔丁酯,中间体30
[1003]
标题化合物是遵循实施例21的步骤2中所述的程序,用(29s)-29-[(叔丁氧基羰基)氨基]-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂三十烷-30-酸(100mg,0.166mmol)代替(19s)-19-[4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁基]-17-氧代-2,
5,8,11,14-五氧杂-18-氮杂二十烷-20-酸开始,使用dcm作为溶剂并在室温下搅拌1h来制备。将反应混合物过滤并浓缩,得到粗{(29s)-30-[(2,5-二氧代吡咯烷-1-基)氧基]-26,30-二氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂三十烷-29-基}氨基甲酸叔丁酯(中间体30,116mg,100%)。
[1004]
实施例37
[1005]
n-[[2-[[9-[(2r,3r,5s)-5-[[双(4-甲氧基苯基)-苯基-甲氧基]甲基]-3-羟基-四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(中间体32)
[1006][1007]
步骤1:n-[[2-[[9-[(2r,3r,5s)-3-[叔丁基(二甲基)甲硅烷基]氧基-5-[[叔丁基(二甲基)甲硅烷基]氧基甲基]四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯
[1008]
将2-氨基-9-[(2r,3r,5s)-3-[叔丁基(二甲基)甲硅烷基]氧基-5-[[叔丁基(二甲基)甲硅烷基]氧基甲基]四氢呋喃-2-基]-1h-嘌呤-6-酮(1.62g,3.27mmol)(关于合成,参见prakash,t.p.j.med.chem.2005,48,1199-1210)溶解于无水吡啶中并浓缩至干燥(3
×
3ml),然后置于真空下15min。将残余物在氩气氛下溶解于吡啶(43ml)中并添加中间体10(5.91g,9.80mmol)于吡啶(32ml)中的溶液。将反应混合物在室温下搅拌16h。添加meoh(20ml)并将反应混合物浓缩至干燥。添加meoh(100ml)和氢氧化铵(28-30%水溶液,50ml)并将所得混合物搅拌60min。将反应混合物浓缩至干燥并且将粗残余物吸附至celite上,并通过硅胶色谱(0-100%etoac/己烷)纯化,得到n-[[2-[[9-[(2r,3r,5s)-3-[叔丁基(二甲基)甲硅烷基]氧基-5-[[叔丁基(二甲基)甲硅烷基]氧基甲基]四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧
基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(2.17g,63%)。lcms(aa):m/z=1062.0(m+h)。
[1009]
步骤2:n-[[2-[[9-[(2r,3r,5s)-3-羟基-5-(羟基甲基)四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯
[1010]
向聚丙烯管中添加溶解于thf(27ml)中的n-[[2-[[9-[(2r,3r,5s)-3-[叔丁基(二甲基)甲硅烷基]氧基-5-[[叔丁基(二甲基)甲硅烷基]氧基甲基]四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(2.17g,2.04mmol)。添加三乙胺(2.26ml,16.1mmol),然后添加三乙胺三氢氟酸盐(1.19ml,7.33mmol)并且将反应混合物在室温下搅拌16h。通过添加饱和碳酸氢钠水溶液缓慢淬灭反应混合物并且然后用etoac稀释。分离有机相并用盐水洗涤,干燥(na2so4),过滤并蒸发至干燥。通过硅胶色谱(0-20%meoh/dcm)纯化粗残余物,得到n-[[2-[[9-[(2r,3r,5s)-3-羟基-5-(羟基甲基)四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(1.18g,69%)。lcms(aa):m/z=834.4(m+h)。
[1011]
步骤3:n-[[2-[[9-[(2r,3r,5s)-5-[[双(4-甲氧基苯基)-苯基-甲氧基]甲基]-3-羟基-四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯,中间体32
[1012]
将n-[[2-[[9-[(2r,3r,5s)-3-羟基-5-(羟基甲基)四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(1.13g,1.36mmol)溶解于无水吡啶中并浓缩至干燥(3
×
15ml)。将残余物溶解于吡啶(13.3ml)中并且添加4,4'-二甲氧基三苯甲基氯(650mg,1.9mmol),然后添加4-二甲基氨基吡啶(8mg,0.068mmol)。将反应混合物在室温下搅拌2h。将反应混合物浓缩至干燥并且吸附至celite上,并通过硅胶色谱(0-5%meoh/dcm,含0.5%net3)纯化,得到n-[[2-[[9-[(2r,3r,5s)-5-[[双(4-甲氧基苯基)-苯基-甲氧基]甲基]-3-羟基-四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(中间体32,1.12g,73%)。lcms(aa):m/z=1136.5(m+h)。
[1013]
实施例38
[1014]
[2-({9-[(2s,5s,7r,8r,12ar,14r,15r,15ar)-15-氟-2,10,10-三氧桥-14-(9h-嘌呤-9-基)-2-氢硫基十氢-5,8-亚甲基呋喃并[2,3-m][1,3,6,9,10,11,2]四氧杂硫氮杂磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯或[2-({9-[(2r,5s,7r,8r,12ar,14r,15r,15ar)-15-氟-2,10,10-三氧桥-14-(9h-嘌呤-9-基)-2-氢硫基十氢-5,8-亚甲基呋喃并[2,3-m][1,3,6,9,10,11,2]四氧杂硫氮杂磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯(中间体33)
[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(中间体32,1.1g,0.97mmol)、n-[[(2r,3r,4r,5r)-3-[叔丁基(二甲基)甲硅烷基]氧基-4-氟-5-嘌呤-9-基-四氢呋喃-2-基]甲基]氨基磺酸(4-硝基苯基)酯(667mg,1.17mmol)(关于合成,参见pct公开第pct/ib2019/052364号)、4-二甲基氨基吡啶(122mg,0.97mmol)和分子筛(1.74g)于无水dcm(13.6ml)中的混合物在室温下在氩气下搅拌10min。然后添加三乙胺(0.60ml,4.3mmol)并且将反应混合物在40℃下搅拌16h。将反应混合物过滤并浓缩,并通过反相柱色谱(10-100%acn/碳酸氢铵水溶液(5mm))纯化所得残余物,得到n-[[2-[[9-[(2r,3r,5s)-5-[[双(4-甲氧基苯基)-苯基-甲氧基]甲基]-3-[[(2r,3r,4r,5r)-3-[叔丁基(二甲基)甲硅烷基]氧基-4-氟-5-嘌呤-9-基-四氢呋喃-2-基]甲基氨磺酰基氧基]四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(0.94g,62%)。lcms(aa):m/z=1565.0(m+h)。
[1018]
步骤2:n-[[2-[[9-[(2r,3r,5s)-5-[[双(4-甲氧基苯基)-苯基-甲氧基]甲基]-3-[[(2r,3r,4r,5r)-4-氟-3-羟基-5-嘌呤-9-基-四氢呋喃-2-基]甲基氨磺酰基氧基]四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯
[1019]
向n-[[2-[[9-[(2r,3r,5s)-5-[[双(4-甲氧基苯基)-苯基-甲氧基]甲基]-3-[[(2r,3r,4r,5r)-3-[叔丁基(二甲基)甲硅烷基]氧基-4-氟-5-嘌呤-9-基-四氢呋喃-2-基]甲基氨磺酰基氧基]四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(939mg,0.60mmol)于聚丙烯管中的thf(12ml)中的溶液中添加三乙胺三氢氟酸盐(0.52ml,3.17mmol)和三乙胺(0.98ml,6.95mmol)。将反应溶液在室温下搅拌过夜,然后用二氯甲烷稀释,并相继用饱和nahco3水溶液和盐水洗涤。经无水mgso4干燥有机相,过滤并浓缩。通过反相柱色谱(10-100%acn/碳酸氢铵水溶液(5mm))纯化获得的残余物,得到n-[[2-[[9-[(2r,3r,5s)-5-[[双(4-甲氧基苯基)-苯基-甲氧基]甲基]-3-[[(2r,3r,4r,5r)-4-氟-3-羟基-5-嘌呤-9-基-四氢呋喃-2-基]甲基氨磺酰基氧基]四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(795mg,89%)。lcms(aa):m/z=1452.2(m+h)。
[1020]
步骤3:[(2r,3r,4r,5r)-2-[[[(2r,3r,5s)-2-[2-[[2-[[[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲氧基羰基-甲基-氨基]甲基]苯甲酰基]氨基]-6-氧代-1h-嘌呤-9-基]-5-(羟基甲基)四氢呋喃-3-基]氧基磺酰基氨基]甲基]-4-氟-5-嘌呤-9-基-四氢呋喃-3-基]氧基次膦酸
[1021]
将亚磷酸二苯酯(0.225ml,1.17mmol)添加至n-[[2-[[9-[(2r,3r,5s)-5-[[双(4-甲氧基苯基)-苯基-甲氧基]甲基]-3-[[(2r,3r,4r,5r)-4-氟-3-羟基-5-嘌呤-9-基-四氢呋喃-2-基]甲基氨磺酰基氧基]四氢呋喃-2-基]-6-氧代-1h-嘌呤-2-基]氨甲酰基]苯基]甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯(792mg,0.55mmol)于吡啶(2ml)中的0℃溶液中。完成添加后,将反应混合物在室温下搅拌1h。然后添加三乙胺(0.62ml,4.37mmol)和水(0.51ml,
28.3mmol),并且将反应混合物在室温下再搅拌60分钟,然后浓缩至干燥。然后将残余物溶解于乙酸(1.25ml,21.8mmol)和水(0.33ml,18.6mmol)中并在室温下搅拌1h。通过添加三乙基硅烷(4.3ml,26.2mmol)淬灭反应混合物并在室温下搅拌1h。然后将反应混合物浓缩至干燥,并且通过反相柱色谱(10-100%acn/碳酸氢铵水溶液(5mm))纯化残余物,得到呈铵盐形式的[(2r,3r,4r,5r)-2-[[[(2r,3r,5s)-2-[2-[[2-[[[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲氧基羰基-甲基-氨基]甲基]苯甲酰基]氨基]-6-氧代-1h-嘌呤-9-基]-5-(羟基甲基)四氢呋喃-3-基]氧基磺酰基氨基]甲基]-4-氟-5-嘌呤-9-基-四氢呋喃-3-基]氧基次膦酸(396mg,59%)。lcms(aa):m/z=1213.4(m+h)。
[1022]
步骤4:[2-({9-[(2s,5s,7r,8r,12ar,14r,15r,15ar)-15-氟-2,10,10-三氧桥-14-(9h-嘌呤-9-基)-2-氢硫基十氢-5,8-亚甲基呋喃并[2,3-m][1,3,6,9,10,11,2]四氧杂硫氮杂磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯或[2-({9-[(2r,5s,7r,8r,12ar,14r,15r,15ar)-15-氟-2,10,10-三氧桥-14-(9h-嘌呤-9-基)-2-氢硫基十氢-5,8-亚甲基呋喃并[2,3-m][1,3,6,9,10,11,2]四氧杂硫氮杂磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯,中间体33
[1023]
将氯磷酸二苯酯(0.055ml,0.26mmol)添加至吡啶(1.6ml)中并将此溶液冷却至-35℃。呈铵盐形式的[(2r,3r,4r,5r)-2-[[[(2r,3r,5s)-2-[2-[[2-[[[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲氧基羰基-甲基-氨基]甲基]苯甲酰基]氨基]-6-氧代-1h-嘌呤-9-基]-5-(羟基甲基)四氢呋喃-3-基]氧基磺酰基氨基]甲基]-4-氟-5-嘌呤-9-基-四氢呋喃-3-基]氧基次膦酸(80mg,0.065mmol)于dcm(2.5ml)和吡啶(3.2ml)中的溶液经15min逐滴添加至冷却的反应混合物中。将所得溶液在-35℃下搅拌30min。将固体3h-1,2-苯并二硫醇-3-酮(25mg,0.15mmol)和水(0.056ml)分别添加至冷却的反应混合物中,将其在室温下再搅拌1h。然后将反应溶液在冰浴中冷却至0℃并通过添加硫代硫酸钠水溶液(0.2m水溶液,0.14ml,0.70mmol)淬灭。将混合物在室温下搅拌5min并且在减压下浓缩。通过反相柱色谱(0-50%acn/三乙基乙酸铵水溶液(10mm))纯化所得残余物,得到呈n,n-二乙基乙胺盐形式的[2-({9-[(2s,5s,7r,8r,12ar,14r,15r,15ar)-15-氟-2,10,10-三氧桥-14-(9h-嘌呤-9-基)-2-氢硫基十氢-5,8-亚甲基呋喃并[2,3-m][1,3,6,9,10,11,2]四氧杂硫氮杂磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯或[2-({9-[(2r,5s,7r,8r,12ar,14r,15r,15ar)-15-氟-2,10,10-三氧桥-14-(9h-嘌呤-9-基)-2-氢硫基十氢-5,8-亚甲基呋喃并[2,3-m][1,3,6,9,10,11,2]四氧杂硫氮杂磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯(中间体33,27mg,31%)。lcms(aa):m/z=1227.9(m+h)。1h nmr(400mhz,cd3od)δ9.14(s,1h),8.75(s,1h),8.63(s,1h),8.30(s,1h),7.53-7.36(m,5h),7.34-7.17(m,3h),6.47(d,j=19.3hz,1h),6.16(d,j=5.1hz,1h),5.87-5.82(m,1h),5.76-5.55(m,1h),5.50-5.40(m,1h),5.00(s,2h),4.79-4.75(m,2h),4.68-4.61(m,1h),
4.58-4.47(m,2h),4.44-4.39(m,1h),4.09-4.02(m,1h),3.92-3.89(m,1h),3.67-3.62(m,1h),3.57-3.53(m,1h),3.01-2.94(m,1h),2.87(s,3h),2.74-2.68(m,1h),2.11-2.03(m,1h),1.45-1.43(m,3h),1.44(s,9h),0.98(d,j=6.7hz,3h),0.93(d,j=6.7hz,3h)。
31
pnmr(162mhz,cd3od)δ57.35(s,1p)。
[1024]
实施例38a
[1025]
[4-({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨基)-4-氧代丁基]甲基氨基甲酸4-{[(25s,29s,32s)-25-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-29-异丙基-32-甲基-24,27,30,33-四氧代-2,5,8,11,14,17,20-七氧杂-23,28,31-三氮杂三十三烷-33-基]氨基}苄酯(c-34)
[1026][1027]
向[4-({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨基)-4-氧代丁基]甲基氨基甲酸4-{[(2s)-2-{[(2s)-2-氨基-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯(int-35,17.4mg,0.0154mmol)、1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(3.49mg,0.0182mmol)和(25s)-25-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸(int-27a)(10.4mg,0.0140mmol)的悬浮液中添加dcm(0.37ml)中的三乙胺(0.004ml,0.0266mmol)。将混合物在室温下搅拌20min,然后添加dmf(0.15ml,2.23mmol)。将这种混合物在室温下搅拌2h后,浓缩溶剂。通过反相快速柱色谱(0-50%acn/三乙基乙酸铵水溶液(10mm))纯化粗残余物,得到呈n,n-二乙基乙胺盐形式的[4-({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨基)-4-氧代丁基]甲基
氨基甲酸4-{[(25s,29s,32s)-25-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰基]氨基}-29-异丙基-32-甲基-24,27,30,33-四氧代-2,5,8,11,14,17,20-七氧杂-23,28,31-三氮杂三十三烷-33-基]氨基}苄酯(c-34)(2.0mg,6.9%)。lcms(aa):m/z=926.9(m/2+h)。hrms(m/z):c
80h101
f2n
15o26
p2s2的[m+h]
+
计算值1852.6000;实验值1852.6006。
[1028]
实施例38b
[1029]
{(25s)-27-[(2,5-二氧代吡咯烷-1-基)氧基]-24,27-二氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-25-基}氨基甲酸(1r,8s,9s)-二环[6.1.0]壬-4-炔-9-基甲酯(中间体36)
[1030][1031]
步骤1:(25s)-25-{[(苄基氧基)羰基]氨基}-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸叔丁酯
[1032]
标题化合物是遵循实施例26的步骤1中所述的程序,用(3s)-3-{[(苄基氧基)羰基]氨基}-4-[(2,5-二氧代吡咯烷-1-基)氧基]-4-氧代丁酸叔丁酯(2.2g,5.3mmol)和2,5,8,11,14,17,20-七氧杂二十二烷-22-胺(2.0g,5.9mmol)分别代替中间体15和(叔丁氧基羰基)甘氨酸2,5-二氧代吡咯烷-1-基酯开始来制备。通过硅胶色谱(0-10%meoh/dcm)纯化,得到(25s)-25-{[(苄基氧基)羰基]氨基}-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸叔丁酯(3.8g,100%)。
[1033]
步骤2:(25s)-25-氨基-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸叔丁酯
[1034]
将(25s)-25-{[(苄基氧基)羰基]氨基}-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸叔丁酯(3.8g,5.9mmol)溶解于乙醇(100ml)中。添加钯(10%于碳上,1.38g,1.17mmol)并且将混合物在氢气(15psi)下搅拌3h。将反应混合物过滤,用甲醇洗涤并且将滤液蒸发至干燥,得到(25s)-25-氨基-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸叔丁酯(2.56g,85%)。
[1035]
步骤3:(25s)-25-({[(1r,8s,9s)-二环[6.1.0]壬-4-炔-9-基甲氧基]羰基}氨
基)-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸
[1036]
向(25s)-25-氨基-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸酯(587mg,1.15mmol)于dcm(11.3ml)中的溶液中添加tfa(11.3ml)。将混合物在室温下搅拌1h。将反应物浓缩并与甲苯共沸,并且进一步在高真空上干燥以获得油状粗中间体。在室温下向粗油中间体中添加1-({[(1r,8s,9s)-二环[6.1.0]壬-4-炔-9-基甲氧基]羰基}氧基)吡咯烷-2,5-二酮(279mg,0.959mmol)和dcm(9.8ml)、三乙胺(1.34ml,9.59mmol)。将混合物在室温下搅拌2h。用etoac(50ml)和碳酸钾溶液(10ml,4.0m于水中)稀释反应混合物。用盐水洗涤分离的有机层,经na2so4干燥,过滤,并浓缩。通过反相柱色谱(0-100%acn/碳酸氢铵水溶液(5mm))纯化残余物。在真空中浓缩期望级分,得到(25s)-25-({[(1r,8s,9s)-二环[6.1.0]壬-4-炔-9-基甲氧基]羰基}氨基)-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸(19mg,3.1%产率)。lcms(aa):m/z=629.2(m-h);1h nmr(400mhz,甲醇-d4)δ=4.46(dd,j=5.7,7.4hz,1h),4.25-4.12(m,2h),3.68-3.51(m,28h),3.41-3.34(m,5h),2.80-2.60(m,2h),2.33-2.12(m,4h),1.69-1.54(m,2h),1.40(quin,j=8.7hz,1h),1.02-0.89(m,2h)。
[1037]
步骤4:{(25s)-27-[(2,5-二氧代吡咯烷-1-基)氧基]-24,27-二氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-25-基}氨基甲酸(1r,8s,9s)-二环[6.1.0]壬-4-炔-9-基甲酯(中间体36)
[1038]
标题化合物是遵循实施例29中所述的程序,用(25s)-25-({[(1r,8s,9s)-二环[6.1.0]壬-4-炔-9-基甲氧基]羰基}氨基)-24-氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-27-酸代替2,2-二甲基-4-氧代-3,8,11,14,17-五氧杂-5-氮杂十九烷-19-酸开始来制备。将反应混合物在室温下搅拌30min,得到{(25s)-27-[(2,5-二氧代吡咯烷-1-基)氧基]-24,27-二氧代-2,5,8,11,14,17,20-七氧杂-23-氮杂二十七烷-25-基}氨基甲酸(1r,8s,9s)-二环[6.1.0]壬-4-炔-9-基甲酯(中间体36,22mg,100%)。lcms(aa):m/z=728.4(m+h)。
[1039]
实施例38c
[1040]
表22a中所列示的化合物(中间体37和中间体42)是如实施例10中所述,用步骤1和步骤2中所示的起始材料代替2,5,8,11,14,17,20-七氧杂二十二烷-22-胺(中间体37和中间体42)和(2s,3s,4s,5r,6s)-3,4,5-三乙酰氧基-6-{2-[(3-{[(9h-芴-9-基甲氧基)羰基]氨基}丙酰基)氨基]-4-({[(4-硝基苯氧基)羰基]氧基}甲基)苯氧基}四氢-2h-吡喃-2-甲酸甲酯(中间体42)来制备。
[1041]
表22a
[1042][1043]
*在步骤2中不使用dmap
[1044]
实施例38d
[1045]
[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s,5s)-57-氨基-5-异丙基-2-甲基-4,7-二氧代-10,13,16,19,22,25,28,31,34,37,40,43,46,49,52,55-十六氧杂-3,6-二氮杂五十七烷)-1-酰基]氨基}苄酯(c-37)
[1046][1047]
步骤1:[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(53s,56s)-1-叠氮基-53-异丙基-56-甲基-51,54,57-三氧代-3,6,9,12,15,18,21,24,27,30,33,36,39,42,45,48-十六氧杂-52,55-二氮杂五十七烷-57-基]氨基}苄酯
[1048]
向中间体8(18.68mg,0.01674mmol)、1-[(1-叠氮基-51-氧代-3,6,9,12,15,18,21,24,27,30,33,36,39,42,45,48-十六氧杂五十一烷-51-基)氧基]吡咯烷-2,5-二酮(32.3mg,0.03348mmol)、thf(0.6ml)和dmf(0.2ml)的溶液中添加diea(0.044ml,0.2511mmol)。将混合物在室温下搅拌3h,然后用meoh(5ml)淬灭。蒸发大部分溶剂后,通过反相柱色谱(0-50%acn/碳酸氢铵水溶液(5mm))纯化残余物。将期望级分浓缩并冻干,得到白色粉末状标题化合物(17.8mg,55%)。lcms(aa):m/z=1915(m-h)。
[1049]
步骤2:[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s,5s)-57-氨基-5-异丙基-2-甲基-4,7-二氧代-10,13,16,19,22,25,28,31,34,37,40,43,46,49,52,55-十六氧杂-3,6-二氮杂五十七烷-1-酰基]氨基}苄酯(c-37)
[1050]
向50-ml圆底烧瓶中添加[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(53s,56s)-1-叠氮基-53-异丙基-56-甲基-51,54,57-三氧代-3,6,9,12,15,18,21,24,27,30,33,36,39,42,45,48-十六氧杂-52,55-二氮杂五十七烷-57-基]氨基}苄酯(17.7mg,0.00923mmol)、thf(1.0ml)和三苯基膦(24.2mg,0.0923mmol)。将这
种混合物在室温下搅拌过夜。向反应混合物中添加氢氧化钠(0.0554ml,1.0mol/l水溶液)。将混合物在室温下搅拌1h后,将其浓缩。通过反相柱色谱(0-50%acn/碳酸氢铵水溶液(5mm))纯化残余物。将期望级分收集并冻干,得到白色松散粉末状[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s,5s)-57-氨基-5-异丙基-2-甲基-4,7-二氧代-10,13,16,19,22,25,28,31,34,37,40,43,46,49,52,55-十六氧杂-3,6-二氮杂五十七烷-1-酰基]氨基}苄酯(c-37)(5.7mg,32%)。lcms(aa):m/z=1889(m-h)。hrms(m/z):c
80h124n12o32
p2s2的[m+h]
+
计算值1891.7434;实验值1891.7433。
[1051]
实施例38e
[1052]
n-{(2s)-6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-1-[(2,5-二氧代吡咯烷-1-基)氧基]-1-氧代己-2-基}-2,5,8,11,14,17,20,23-八氧杂二十六烷-26-酰胺(中间体39)
[1053][1054]
步骤1:(28s)-28-[4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁基]-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂二十九烷-29-酸
[1055]
向(2s)-2-氨基-6-(2,5-二氧代吡咯-1-基)己酸盐酸盐(1.05g,4.00mmol)和1-[(26-氧代-2,5,8,11,14,17,20,23-八氧杂二十六烷-26-基)氧基]吡咯烷-2,5-二酮(2.08g,4.04mmol)于吡啶(21.0ml)中的混合物中添加diea(1.43ml,8.20mmol)并且将混合物在室温下搅拌30min,然后冷却至0℃并搅拌过夜。去除挥发性溶剂,并将残余物与甲苯(3
×
20ml)和乙腈(10ml)共沸,得到无色油状(28s)-28-[4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁基]-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂二十九烷-29-酸(4.00g,100%产率)。lcms(aa):m/z=619.3(m-h)。
[1056]
步骤2:n-{(2s)-6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-1-[(2,5-二氧代吡咯烷-1-基)氧基]-1-氧代己-2-基}-2,5,8,11,14,17,20,23-八氧杂二十六烷-26-酰胺(中间体39)
[1057]
将n-羟基琥珀酰亚胺(469mg,4.08mmol)、n,n'-二环己基碳化二亚胺(824mg,4.00mmol)和步骤1的粗(28s)-28-[4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁基]-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂二十九烷-29-酸(4.00g,4.00mmol)于dcm(76.7ml,1200mmol)中的混合物在室温下搅拌16h。过滤从此反应析出的固体并将滤液浓缩,得到粗油状物。通过硅胶色谱(0-20%ipa/dcm)纯化,得到无色油状n-{(2s)-6-(2,5-二
氧代-2,5-二氢-1h-吡咯-1-基)-1-[(2,5-二氧代吡咯烷-1-基)氧基]-1-氧代己-2-基}-2,5,8,11,14,17,20,23-八氧杂二十六烷-26-酰胺(中间体39)(1.70g,52%)。1h nmr(400mhz,甲醇-d4)δppm 1.42-1.55(m,2h)1.64(m,2h)1.81-1.93(m,1h)1.94-2.01(m,1h)2.52(m,2h)2.81-2.86(m,4h)3.36(s,3h)3.51-3.57(m,4h)3.60-3.66(m,26h)3.68-3.76(m,2h)4.03-4.17(m,2h)4.74-4.80(m,1h)6.74-6.86(s,2h)。
[1058]
实施例38f
[1059]
n-{(2s)-6-{[(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙酰基]氨基}-1-[(2,5-二氧代吡咯烷-1-基)氧基]-1-氧代己-2-基}-2,5,8,11,14,17,20,23-八氧杂二十六烷-26-酰胺(中间体40)
[1060][1061]
步骤1:(28s)-28-{4-[(叔丁氧基羰基)氨基]丁基}-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂二十九烷-29-酸
[1062]
标题化合物是遵循实施例38e的步骤1中所述的程序,用n6-(叔丁氧基羰基)-l-赖氨酸(0.49g,1.99mmol)代替(2s)-2-氨基-6-(2,5-二氧代吡咯-1-基)己酸盐酸盐开始来制备。通过反相柱色谱(0-60%acn/甲酸水溶液(0.1%))纯化,得到无色油状(28s)-28-{4-[(叔丁氧基羰基)氨基]丁基}-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂二十九烷-29-酸(1.14g,90%)。lcms(aa):m/z=639.4(m-h)。
[1063]
步骤2:(28s)-28-(4-{[(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙酰基]氨基}丁基)-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂二十九烷-29-酸
[1064]
在室温下,向(28s)-28-{4-[(叔丁氧基羰基)氨基]丁基}-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂二十九烷-29-酸(148mg,0.2310mmol)于dcm(2.0ml)中的溶液中添加tfa(2.0ml)。将混合物在室温下搅拌15min,蒸发,然后与甲苯(
×
3)共蒸发,得到粗tfa盐。将此粗产物在高真空下再干燥2h后,添加dcm(2650mg,2.00ml,31.2mmol)中的马来酰亚胺基乙酸nhs酯(69.89mg,0.2772mmol)和diea(0.121ml,0.6929mmol),并且将此反应物在室温下搅拌16h。蒸发反应混合物。通过反相柱色谱(10-30%acn/乙酸铵水溶液(10mm))纯化,得到油状(28s)-28-(4-{[(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙酰基]氨基}丁基)-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂二十九烷-29-酸(120mg,38%)。lcms(aa):m/z=676.3(m-h)。
[1065]
步骤3:n-{(2s)-6-{[(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙酰基]氨基}-1-[(2,5-二氧代吡咯烷-1-基)氧基]-1-氧代己-2-基}-2,5,8,11,14,17,20,23-八氧杂二十六烷-26-酰胺(中间体40)
[1066]
向含有(28s)-28-(4-{[(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙酰基]氨基}丁基)-26-氧代-2,5,8,11,14,17,20,23-八氧杂-27-氮杂二十九烷-29-酸(311mg,0.459mmol)和dcm(2.94ml)的烧瓶中添加n,n'-二环己基碳化二亚胺(94.7mg,0.459mmol)和n-羟基琥珀酰亚胺(53.9mg,0.459mmol)。将悬浮液在室温下在氩气氛下搅拌1小时。然后将反应混合物冷却至0℃,经由celite过滤并用mecn冲洗。蒸发滤液。将残余物再溶解于dcm中,用水(
×
2)洗涤,用mgso4干燥,并浓缩,得到粘性油状n-{(2s)-6-{[(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙酰基]氨基}-1-[(2,5-二氧代吡咯烷-1-基)氧基]-1-氧代己-2-基}-2,5,8,11,14,17,20,23-八氧杂二十六烷-26-酰胺(中间体40)(300mg,84.4%)。lcms(aa):m/z=773.2(m-h)。
[1067]
实施例38g
[1068]
表22c中所列示的化合物(c-43)是如实施例23的步骤2和步骤3中所述,用表中所示的起始材料代替(2s,3s,4s,5r,6s)-3,4,5-三乙酰氧基-6-{2-[(3-{[(9h-芴-9-基甲氧基)羰基]氨基}丙酰基)氨基]-4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯氧基}四氢-2h-吡喃-2-甲酸甲酯来制备。
[1069]
表22b
[1070][1071]
表22c
[1072][1073]
实施例38h
[1074]
表22d中所列出的化合物中间体-44是如实施例38e中所述,用表22d中所示的起始材料(2r)-2-氨基-6-(2,5-二氧代吡咯-1-基)己酸盐酸盐代替步骤1中的(2s)-2-氨基-6-(2,5-二氧代吡咯-1-基)己酸盐酸盐来制备。
[1075]
表22d
[1076][1077]
实施例39
[1078]
经由随机半胱氨酸缀合制备ab-sting激动剂缀合物的程序(绘示于图1中)
[1079]
向抗gcc抗体(克隆5f9,参见pct公开第wo 2011/050242号,60mg/ml)于50mm组氨酸、100mm精氨酸,ph 6.0缓冲液中的溶液中添加0.5m tris/25mm edta ph 8.0缓冲液,直至溶液的ph为7.5-8.0。向上述溶液中添加tcep(10mm溶液于h2o中,3-5当量)。用氩气吹扫反应混合物并且在室温或37℃下在温和摇晃下温育2h。然后将期望接头-有效负载构建体(10mm溶液于dma中,5-9当量)缓慢添加至上述混合物中。用氩气吹扫反应物并且在37℃下在温和摇晃下再温育1.5-2h。遵循本文所述的制备型sec方法纯化反应混合物以获得adc。如分析方法中所述,通过uv吸光度、分析型sec和lc-qtof分别测定adc浓度、聚集百分比和dar。
[1080]
以上程序可用于制备其他抗体缀合物。
[1081]
实施例40
[1082]
表24中所列示的抗体药物缀合物是如实施例39中所述,使用显示为起始材料的起
始接头-有效负载构建体来制备。
[1083]
表24
[1084][1085]
实施例41
[1086]
经由转谷氨酰胺酶缀合制备ab-sting激动剂缀合物的程序(绘示于图2中)
[1087]
去糖基化:用等体积的ph 7.2pbs稀释抗gcc抗体(克隆5f9,参见pct公开第wo 2011/050242号,60mg/ml)于50mm组氨酸、100mm精氨酸,ph 6.0缓冲液中的溶液。向溶液中添加n-糖苷酶f(new england biolabs,p0704s,500,000单位/ml,300单位/1mg抗体),并且在温和混合下将反应混合物加热至37℃过夜。将所得去糖基化5f9与pbs ph 7.2进行缓冲液交换。
[1088]
转谷氨酰胺酶缀合:向上文制备的pbs中的去糖基化5f9溶液(10~20mg/ml)中添加29-叠氮基-3,6,9,12,15,18,21,24,27-九氧杂二十九烷-1-胺(叠氮基-peg9-胺,broadpharm,bp-23556,40当量)的0.1mdmso溶液,然后添加转谷氨酰胺酶(activa
tm
,ajinomoto,5~10mg/1mg抗体)。在温和混合下将反应混合物加热至37℃过夜。遵循本文所述的制备型sec方法纯化产物,得到5f9-nh-peg-叠氮化物。
[1089]
应变促进的叠氮化物-炔烃环加成:向上文制备的5f9-nh-peg-叠氮化物缀合物的溶液(2~15mg/ml于pbs中)中添加含有应变炔烃的接头-有效负载构建体的4~10mm dmso溶液(3-5当量,其中dmso《总溶剂体积的10%)。将所得溶液在室温下温和搅拌过夜。遵循本文所述的制备型sec方法纯化产物,得到adc。如分析方法中所述,通过uv吸光度、分析型sec和lc-qtof分别测定adc浓度、聚集百分比和dar。
[1090]
以上程序可用于制备其他抗体缀合物。
[1091]
实施例42
[1092]
表25中所列示的抗体药物缀合物是如实施例41中所述,使用在表中显示为起始材
料的起始接头-有效负载构建体来制备。
[1093]
表25
[1094][1095]
实施例43
[1096]
经由转谷氨酰胺酶缀合制备ab-sting激动剂缀合物(绘示于图3中)
[1097]
向pbs中的去糖基化5f9溶液(10~20mg/ml,遵循实施例41中所述的去糖基化程序制备)中添加1m tris、5m nacl,ph 8.0缓冲液(总体积的10~20%)以将ph调节至8.0。向溶液中添加含伯胺的接头-有效负载构建体(20当量)的10mm dmso溶液,然后添加转谷氨酰胺酶(activa
tm
,ajinomoto,100-150mg/1mg抗体)。在温和混合下将反应混合物加热至37℃过夜。使用hitrap蛋白a hp柱(ge healthcare,17-0402-01),通过首先用20mm磷酸盐ph 7.0洗涤,然后用0.1m柠檬酸ph 4.0洗脱adc来纯化产物。
[1098]
以上程序可用于制备其他抗体缀合物。
[1099]
实施例44
[1100]
表26中所列示的抗体药物缀合物是如实施例43中所述,使用在表中显示为起始材料的起始接头-有效负载构建体来制备。
[1101]
表26
[1102][1103]
实施例45
[1104]
2-氨基-n-(2-((2-(2-叠氮基乙酰氨基)乙基)氨基)-2-氧代乙基)乙酰胺
[1105]
[1106]
步骤1:(2,2-二甲基-4,7,10-三氧代-3-氧杂-5,8,11-三氮杂十三烷-13-基)氨基甲酸苄酯
[1107]
在0℃下,向boc-gly-gly-oh(550mg,2.32mmol)、edc
·
hcl(437mg,2.28mmol)和hoat(317mg,2.33mmol)于dmf(8.0ml)中的溶液中添加三乙胺(0.340ml,2.44mmol)。将所得黄色非均相混合物搅拌15min。缓慢添加(2-氨基乙基)氨基甲酸苄酯(500mg,2.44mmol)于dmf(6.0ml)中的溶液。在10min内,将混合物升温至室温并搅拌3天以上。将反应混合物分配于水(100ml)和etoac(50ml)中。用etoac(50ml)萃取分离的水层。用50ml水、然后用盐水洗涤合并的有机层,经na2so4干燥并浓缩。通过硅胶色谱(0-6%meoh/ch2cl2)纯化粗产物,得到白色固体状n-[2-[[2-[2-(苄基氧基羰基氨基)乙基氨基]-2-氧代-乙基]氨基]-2-氧代-乙基]氨基甲酸叔丁酯(617mg,1.51mmol,65%产率)。lcms(fa):m/z=431.2(m+na)。1h nmr(400mhz,dmso-d6)δ7.97-7.97(m,1h),7.86-7.84(m,1h),7.39-7.29(m,5h),7.27-7.24(m,1h),7.01-6.98(m,1h),5.02(s,2h),3.67(d,j=5.62hz,2h),3.58(d,j=5.87hz,2h),3.03-3.18(m,4h),1.39(s,9h)。
[1108]
步骤2:(2-((2-((2-氨基乙基)氨基)-2-氧代乙基)氨基)-2-氧代乙基)氨基甲酸叔丁酯
[1109]
向n-[2-[[2-[2-(苄基氧基羰基氨基)乙基氨基]-2-氧代-乙基]氨基]-2-氧代-乙基]氨基甲酸叔丁酯(615mg,1.51mmol)于乙醇(20.0ml)中的溶液中添加10%pd/c(62.0mg,0.0583mmol)。用h2(1atm)吹扫混合物并在室温下搅拌3h。将celite添加至反应混合物中并且经celite短床过滤浆液。浓缩滤液并通过与甲苯共蒸发、然后高真空干燥残余物,得到灰白色固体状n-[2-[[2-(2-氨基乙基氨基)-2-氧代-乙基]氨基]-2-氧代-乙基]氨基甲酸叔丁酯(407mg,1.48mmol,98.5%产率)。lcms(fa):m/z=275.2(m+h)。1h nmr(400mhz,dmso-d6)δ8.05-7.89(m,1h),7.80-7.63(m,1h),7.08-6.96(m,1h),3.67(d,j=5.75hz,2h),3.56(d,j=5.87hz,2h),3.06(q,j=6.24hz,2h),2.59-2.53(m,2h),1.87-1.61(m,2h),1.39(s,9h)。
[1110]
步骤3:n-[2-[[2-[2-[(2-叠氮基乙酰基)氨基]乙基氨基]-2-氧代-乙基]氨基]-2-氧代-乙基]氨基甲酸叔丁酯
[1111]
将edc
·
hcl(57.6mg,0.300mmol)、hoat(43.6mg,0.320mmol)和2-叠氮基乙酸(27.0μl,0.315mmol)于二氯甲烷(2.70ml)中的混合物搅拌10分钟。在冰浴中冷却混合物,然后添加n-[2-[[2-(2-氨基乙基氨基)-2-氧代-乙基]氨基]-2-氧代-乙基]氨基甲酸叔丁酯(75.0mg,0.273mmol),然后在几分钟内添加n,n-二异丙基乙胺(55.8μl,0.320mmol)。将混合物在0℃下搅拌5min,然后在室温下搅拌过夜。添加水(2ml)和etoac(5ml),并将混合物剧烈搅拌20min。用etoac(25ml)稀释混合物,然后用50%盐水/水(20ml)和盐水洗涤。经na2so4干燥分离的有机层并浓缩。通过硅胶色谱(0-8%meoh/ch2cl2)纯化,得到玻璃固体状n-[2-[[2-[2-[(2-叠氮基乙酰基)氨基]乙基氨基]-2-氧代-乙基]氨基]-2-氧代-乙基]氨基甲酸叔丁酯(88.0mg,0.246mmol,90.1%产率)。lcms(fa):m/z=356.2(m-h)。1h nmr(400mhz,dmso-d6)δ8.16-8.08(m,1h),8.04-7.92(m,1h),7.92-7.81(m,1h),7.05-6.94(m,1h),3.82(s,2h),3.67(d,j=5.62hz,2h),3.58(d,j=5.87hz,2h),3.10-3.19(m,4h),1.39(s,9h)。
[1112]
步骤4:2-氨基-n-[2-[2-[(2-叠氮基乙酰基)氨基]乙基氨基]-2-氧代-乙基]乙酰
胺(中间体34)
[1113]
向n-[2-[[2-[2-[(2-叠氮基乙酰基)氨基]乙基氨基]-2-氧代-乙基]氨基]-2-氧代-乙基]氨基甲酸叔丁酯(86.0mg,0.241mmol)于二氯甲烷(4.0ml)中的溶液中添加三氟乙酸(1.00ml,8.77mmol)。将混合物在室温下搅拌30min。用5ml甲苯稀释混合物并浓缩。将残余物溶于5ml水中并冻干,得到无色糖浆状2-氨基-n-[2-[2-[(2-叠氮基乙酰基)氨基]乙基氨基]-2-氧代-乙基]乙酰胺2,2,2-三氟乙酸盐(102mg,0.275mmol,定量)。lcms(fa):m/z=258.1(m+h)。1h nmr(400mhz,dmso-d6)δ8.55-8.62(m,1h),8.12-8.20(m,1h),8.02-8.09(m,1h),7.90-8.02(m,3h),3.74-3.82(s,2h),3.80(m,2h),3.55-3.68(m,2h),3.11-3.19(m,4h)。
[1114]
实施例46
[1115]
5f9-lpetgg-his6的产生和纯化
[1116]
使用来自thermo fisher目录号a14635的瞬时expi293f哺乳动物蛋白质表达系统试剂盒来产生5f9-lpetgg-his6蛋白,所述瞬时expi293f哺乳动物蛋白质表达系统试剂盒包括expi293ftm细胞、expi293tm表达生长培养基和expifectamine 293tm转染试剂盒。用混合有5.4ml expifectamine 293tm转染试剂的0.666mg轻链dna加0.334mg重链dna转染在5l开孔摇瓶中密度为2.8
×
106个细胞/ml的1.8升expi293ftm细胞,并且在37℃、8%co2温育器中以及100rpm摇晃下温育过夜。第二天,将来自试剂盒的10ml增强剂1和100ml增强剂2添加至烧瓶中。将烧瓶在上述条件下温育并在转染后第5天收获。将细胞在4℃下在9000rpm下旋转沉降10分钟,然后经由0.22μm过滤单元无菌过滤,并储存在4℃下,直至经新鲜填充的30ml mabselect sure lx蛋白质a柱(ge healthcare,目录号17-5474-03)纯化。在使用蠕动泵将上清液装载于柱上后,将树脂用60ml[2柱体积(cv])的低盐缓冲液(25mm柠檬酸三钠ph 7.6,125mm nacl)洗涤,然后用60ml(2cv)的高盐缓冲液(25mm柠檬酸三钠ph 7.6,2m nacl)洗涤,然后再用60ml(2cv)低盐缓冲液洗涤。通过用25mm柠檬酸、125mm nacl ph8至ph2.2进行ph梯度洗脱来洗脱蛋白质,并且收集峰级分。用1m柠檬酸三钠ph8.2中和每个级分,至70mm,约ph 6。汇集主峰(2a5-2c5)中的级分。将汇集的级分浓缩,并使用分子量截止值为50kda的sartorius vivaflow200柱缓冲液交换至25mm柠檬酸钠ph 5.5、125mm nacl缓冲液中。然后经由0.22μm注射器过滤单元过滤样品,等分并储存在-80℃下。最终产量为623mg纯化的5f9-lpetgg-his6抗体,纯度》95%,内毒素为0.64eu/ml。
[1117]
重链序列:
[1118]
mgwsciilflvatatgvhsqvqlqqwgagllkpsetlsltcavfggsfsgyywswirqppgkglewigeinhrgntndnpslksrvtisvdtsknqfalklssvtaadtavyycarergytygnfdhwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkagggslpetgghhhhhh(加下划线处为信号序列)(seq id no.1)
[1119]
轻链序列:
[1120]
mgwsciilflvatatgvhseivmtqspatlsvspgeratlscrasqsvsrnlawyqqkpgqaprlliygastratgiparfsgsgsgteftltigslqsedfavyycqqyktwprtfgqgtnveikrtvaapsvfifppsdeql
ksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(加下划线处为信号序列)(seq id no.2)
[1121]
实施例47
[1122]
经由分选酶缀合制备ab-sting激动剂缀合物的程序(绘示于图4中)
[1123]
分选酶缀合:根据实施例46中所述的程序产生在重链的c末端含有lpetgg-his6的5f9抗体。用50mm hepes、150mm nacl,ph7.45缓冲液稀释在重链的c末端含有lpetg-his6标签的5f9(5f9-lpetgg-his6)于25mm柠檬酸盐、125mm nacl,ph 5.5缓冲液中的溶液,以使得蛋白质的浓度为48μm。向溶液中添加cacl2(4mm水溶液,80~100当量)和2-氨基-n-[2-[2-[(2-叠氮基乙酰基)氨基]乙基氨基]-2-氧代-乙基]乙酰胺(中间体34,800μm溶液于含有0.1%dmso的50mm hepes、150mm nacl,ph 7.45缓冲液中,20当量),然后添加分选酶a q60-k206-p94s-d160n-d165a-k196 his6(如antos,j.m.,ingram,j.,fang,t.,pishesha,n.,truttmann,m.c.,ploegh,h.l.(2017).site-specific protein labeling via sortase-mediated transpeptidation.current protocols in protein science,89,15.3.1-15.3.19中所述表达,2.0μm溶液于50mm hepes、150mm nacl,ph 7.45缓冲液中,0.03当量)。将反应混合物在室温下搅拌4h。通过capturem镍柱(来自takara,用pbs洗涤)、然后透析或遵循本文所述的制备型sec方法纯化产物,得到5f9-lpetg-叠氮化物。
[1124]
应变促进的叠氮化物-炔烃环加成:向上文制备的5f9-lpetgg-nh(ch2)2nhcoch
2-叠氮化物缀合物(2~15mg/ml于pbs中)的溶液中添加含应变炔烃的接头-有效负载构建体的4~10mm dmso溶液(3~5当量,其中dmso《总溶剂体积的10%)。将所得溶液在室温下温和搅拌过夜。遵循本文所述的制备型sec方法纯化产物,得到adc。如分析方法中所述,通过uv吸光度、分析型sec和lc-qtof分别测定adc浓度、聚集百分比和dar。
[1125]
以上程序可用于制备其他抗体缀合物。
[1126]
实施例48
[1127]
表27中所列示的抗体药物缀合物是如实施例47中所述,使用在表中显示为起始材料的起始接头-有效负载构建体来制备。
[1128]
表27
[1129]
起始材料adc产物有效负载dar聚集%产率%c-15adc-12化合物i-5c1.43.6760c-9adc-13化合物i-5c1.8blq66c-13adc-14化合物i-5c1.43.784
[1130]
实施例49
[1131]
生物方案和sting细胞数据
[1132]
去污溶酶体测定条件
[1133]
将测试化合物(dmso中的121um接头-有效负载构建体溶液或pbs中的adc溶液,4.65ul)掺入125ul大鼠肝脏去污溶酶体(购自xenotech)和433ul缓冲剂水溶液(54.7mg/ml磷酸盐、1.7mg/ml edta,ph 6.0)的混合物中,并且将溶液在37℃下温育。在10min和30min、1h、3h、5h和24h取出40ul样品,并于96孔板上用160ul的0.1%甲酸于甲醇中的溶液处理,然后储存在-80℃下。收集最末时间点后,将每个样品解冻并用200ul含有150nm磺胺丁脲(内标)的0.1%甲酸于甲醇中的溶液处理。将样品在4000g下离心10min,并且遵循本文所述的
lc/ms/ms方法进行分析。使用excel-fit程序计算t
1/2
。计算的t
1/2
报告于表28中。如表28中所示,在24h内在此去污溶酶体测定中未观察到来自adc-3的游离有效负载释放,而具有相同有效负载的adc-9成功地释放有效负载并且t
1/2
为7小时,这指示与adc-3相比,adc-9的接头在替代细胞释放条件下可显著改进有效负载解离的速率。
[1134]
表28
[1135]
adc有效负载t
1/2
(小时)adc-1化合物no.142.4adc-3化合物i-5c-*adc-9化合物i-5c7.0adc-15化合物no.142.9adc-16化合物no.143.7
[1136]
*在24h内未观察到游离有效负载释放
[1137]
表28中adc-1、adc-3和adc-9的随时间的有效负载释放的图形表示显示于图5、图6和图7中。
[1138]
血浆稳定性测定条件
[1139]
将测试化合物以10μg/ml的浓度掺入1ml血浆中,然后将5等体积等分试样分配至2ml eppendorf微量离心管(标记为0小时、24小时、48小时、72小时和96小时)中。将时间0样品管立即储存在-80℃下,并且将剩余管在37℃适度摇晃下温育。在其相应时间点从温育器取出等分试样并储存在-80℃下。收集所有样品后,将其在室温下解冻并置于湿冰上。将50μl每个样品一式三份分配至96孔微量滴定板中。用200μl含有50nm内标的冰冷甲醇淬灭样品。将样品涡旋2min,然后以3000rpm离心10min。将185μl上清液转移至干净的注射板上,然后在40℃下在n2气下干燥。用100μl lcms级水重构干燥的样品提取物,然后涡旋1min,为lc-ms/ms分析做准备。
[1140]
在40℃下,通过反相hplc,使用synergi 2.5μ极性-rp 100a c18柱(2.0mm x 30mm)使用由水中的0.1%甲酸(溶剂a)和乙腈中的0.1%甲酸(溶剂b)组成的梯度分离每个样品。使用sciex api 4500qtrap仪器通过阳离子喷雾以多反应监测(mrm)模式检测分析物。不同时间点的人类、灵长类动物和小鼠血浆中的有效负载损失百分比报告于表29中。
[1141]
表29
[1142][1143]
thp1双重lucia报告基因测定条件
[1144]
通过内源人类haq sting基因的稳定双等位基因敲除和人类sting的r232变体的基因敲入从人类thp-1单核球细胞系衍生出thp1-dual
tm
ki-hsting-r232细胞(invivogen#thpd-r232)。在isg54(干扰素刺激基因)最小启动子结合五个ifn刺激的反应元件(isre)的控制下,这些细胞也稳定表达诱导型分泌的lucia荧光素酶报告基因。报告基因的表达允许通过评价lucia荧光素酶的活性来研究ifn调控因子(irf)途径。除人类sting和荧光素酶外,这些细胞被工程化以稳定表达人类鸟苷酸环化酶c(gcc)以允许研究靶介导的irf途径活化。使用非gcc表达载体细胞作为对照。
[1145]
在实验当天,将细胞以15,000个细胞/25μl/孔的密度平铺于白色384孔板(corning 356661)上的生长培养基(rpmi 1640、2mm l-谷酰氨酸、25mm hepes、10%热不活
化胎牛血清、100μg/ml normocin
tm
、100u/ml-100μg/ml青霉素-链霉素、10μg/ml杀稻瘟菌素(blasticidin)、100μg/ml吉欧霉素(zeocin)和1μg/ml嘌呤霉素(puromycin))中。向细胞板投用5μl的gcc靶向adc样品,然后在37℃下温育20小时。在温育结束时,添加10μl/孔的quanti-luc
tm
(invivogen#rep-qlc1),并且立即使用leadseeker测量发光。
[1146]
对于上述测定方法,相对于未经处理和对照处理的样品,计算不同浓度下每种测试adc的发光信号诱导百分比。拟合化合物浓度对信号诱导百分比曲线以产生ec
50
值。本领域技术人员将会理解,作为ec
50
值产生的值受实验变化的影响。观测到的ec
50
和emax报告于表30中。如下表30中所展示,adc-16在载体thp1细胞中比adc-15强效约21倍,这可能归因于从adc-16的细胞内有效负载释放相较于adc-15更快速。
[1147]
表30
[1148][1149]
实施例50
[1150]
小鼠中的药代动力学评估
[1151]
为了在带有表达gcc的ct26结肠癌小鼠肿瘤的balb/c小鼠中进行adc的体内评估,使用6-8周龄的雌性balb/c小鼠(购自jackson laboratory)。ct26.wt亲本细胞是从atcc目录号crl-2638获得。表达gcc的ct26细胞是在takeda通过用含有人类gcc基因的慢病毒载体plenti6.3转导ct26.wt来构建以获得ct26 plenti6.3 gcc克隆a5。使ct26 plenti6.3 gcc克隆a5细胞在无菌条件下于37℃温育器和5%co2下生长12-14天。使细胞生长于含10%胎牛血清的rpmi-1640培养基中。使用0.05%胰蛋白酶/edta使细胞每3-4天传代以分离细胞。在植入当天,将细胞抽出并以0.5
×
106个细胞/100μl的浓度重悬浮于rpm-1640无血清培养基中。通过使用27号针皮下注射至小鼠下侧腹中来植入ct26 plenti6.3 gcc克隆a5细胞
(0.5
×
106个细胞/100μi注射体积/小鼠)。细胞植入后,通过卡尺测量肿瘤并且一旦可触知肿瘤,便立即对小鼠进行每周两次称重。在两个维度上测量肿瘤。使用(l
×
w2)/2计算卡尺测量值。根据实验动物的护理和使用指南(guide for care and use of laboratory animals)以及机构动物护理和使用委员会(institutional animal care and use committee)的规定对小鼠饲喂正常饮食并圈养于spf动物设施中。使动物保持在18-26℃的温度、50
±
20%的相对湿度以及12小时的间歇性光照和黑暗周期下并且随意获得食物和水。
[1152]
当平均肿瘤体积(mtv)达到500-800mm3时,将adc注射至带有ct26-gcc肿瘤的balb/c小鼠(n=3/治疗组)中后,研究adc的药代动力学。在多个时间点采集血清样品并冷冻储存用于分析。
[1153]
在与sciex 6500qtrap质谱仪介接的shimadzu uhplc系统上通过基于2合1免疫捕获的lc/ms测定来测量总抗体和缀合有效负载的小鼠血浆水平。简言之,将小鼠血浆样品与抗人类igg包被的磁珠在室温下一起温育45min,然后通过连续用pbst(pbs缓冲液,ph 7.4,含有0.05%tween 20)和pbs缓冲液洗涤磁珠去除非特异性结合的蛋白质。此后,将裸抗体(dar=0)和adc(dar≥1)二者从磁珠洗脱至0.1%三氟乙酸中。在中和洗脱剂并掺入稳定同位素标记的内标中后,移出一等份样品并用木瓜酶在37℃下消化1小时,然后用于缀合有效负载的lc/ms分析。使剩余样品经受在70℃下胰蛋白酶/lys-c消化1小时,然后用于总抗体的lc/ms分析。
[1154]
也在实施血浆蛋白沉淀后通过lc/ms测量循环中的游离有效负载。简言之,将小鼠血浆与8体积的含有稳定同位素标记的内标的甲醇混合,然后将上清液在40℃下在温和氮气流下蒸发至干燥。最后,将残余物于lc/ms级水中重构,然后进行lc/ms分析。adc-1、adc-8和adc-9的pk概况汇总于表31中。血浆pk的图形表示显示于图12、图13和图14中。如表24中所示,adc-1、adc-8和adc-9的dar值分别为4.5、3.9和4.3,这使得在时间0获得的缀合cdn的摩尔浓度高于图8-图10中的每一者中所示的总ab的摩尔浓度。然而,如图8中所示,adc-1的缀合cdn的摩尔浓度下降快于总ab的摩尔浓度并且两种浓度在第7天合并(导致dar在那天为约1),这指示adc-1的dar由于其接头的稳定性降低而随时间减小。相反,如图9和图10中所示,在整个实验进程中,adc-8和adc-9的缀合cdn的摩尔浓度一直高于其个别总ab的摩尔浓度。另外,如表31中所展示,adc-8和adc-9的缀合有效负载/cdn的半衰期相较于adc-1更长,这可能是adc-8和adc-9中的接头稳定性增强的结果。总之,该实验指示,相对于adc-1的接头,adc-8和adc-9的接头在小鼠血浆中具有改进的稳定性。
[1155]
表31
[1156][1157]
实施例51
[1158]
小鼠中的抗肿瘤活性评估
[1159]
如实施例50中所述生成带有表达gcc的ct26结肠癌小鼠肿瘤的balb/c小鼠。
[1160]
当平均肿瘤体积(mtv)达到约75mm3时,将动物随机分组到若干治疗组(n=8/组)中,并且通过静脉内途径投用一次不同剂量的adc。继续每周两次测量肿瘤。通过测量肿瘤体积并与媒介物治疗的肿瘤比较来评估adc治疗对肿瘤生长的影响。
[1161]
当肿瘤大小达到动物体重的10%体积或在任一方向上达到2cm时,达到功效研究的终点。注射后,还密切监测小鼠的临床衰退体征。如果出于任何原因小鼠显示任何发病体征,包括呼吸窘迫、姿势弯曲、活动性降低、后腿瘫痪、呼吸急促作为胸膜渗出液的体征、体重损失接近20%或15%加其他体征,或者如果其进行正常活动(进食、运动性)的能力受损,则对小鼠实施安乐死。
[1162]
观测到的adc-1、adc-5、adc-8和adc-9的抗肿瘤活性的图形表示分别显示于图7、图8、图9和图10中。
[1163]
脂质缀合物:
[1164]
缩写:
[1165]
aa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
使用乙酸铵的lcms方法
[1166]
ac
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸盐
[1167]
acn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙腈
[1168]
atm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
大气压
[1169]
aq
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
水性
[1170]
bbn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
硼杂双环(3.3.1)壬烷
[1171]
bn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
苄基
[1172]
boc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁氧基羰基
[1173]
(bpin)2ꢀꢀꢀꢀꢀꢀꢀꢀ
双(频哪醇)二硼
[1174]
tbu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁基
[1175]
bz
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
苯甲酰基
[1176]cꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
摄氏度
[1177]
cad
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
带电气溶胶检测
[1178]
cgamp
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
环单磷酸鸟苷-单磷酸腺苷
[1179]
dbad
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
偶氮二甲酸二叔丁酯
[1180]
dbu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1,8-二氮杂双环[5.4.0]十一-7-烯二氯乙酸
[1181]
dca
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯乙酸
[1182]
dce
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯乙烷
[1183]
dcm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯甲烷
[1184]
dead
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
偶氮二甲酸二乙酯
[1185]
diad
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
偶氮二甲酸二异丙酯
[1186]
dipea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二异丙基乙胺
[1187]
dmap
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-二甲基氨基吡啶
[1188]
dmf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二甲基甲酰胺
[1189]
dmso
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲基亚砜
[1190]
dmtr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4,4'-二甲氧基三苯甲基
[1191]
dotma
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1,2-二-o-十八烯基-3-三甲基铵丙烷
[1192]
dppc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱
[1193]
dspc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱
[1194]
et
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙基
[1195]
etoh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙醇
[1196]
etoac
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸乙酯
[1197]
fa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
使用甲酸的lcms方法
[1198]hꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
小时
[1199]
int
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
中间体
[1200]
hplc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高压液相色谱
[1201]
hrms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高分辨率质谱
[1202]
ic
50
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
50%抑制浓度
[1203]
ipa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异丙醇
[1204]
ipc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二异松蒎烯基
[1205]
lcms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
液相色谱质谱
[1206]
lc/ms/ms
ꢀꢀꢀꢀꢀꢀꢀ
液相色谱/串联质谱
[1207]
lda
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二异丙基氨基锂
[1208]
lhmds
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
双(三甲基甲硅烷基)氨基锂
[1209]
m/z
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
质荷比
[1210]
mhz
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
兆赫
[1211]
me
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲基
[1212]
meoh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲醇
[1213]
min
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
分钟
[1214]
ml
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫升
[1215]
mmp
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲基吗啉
[1216]
ms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
质谱
[1217]
nbu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
正丁烷
[1218]
nmp
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-甲基-2-吡咯烷酮
[1219]
nmr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
核磁共振
[1220]
pe
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
石油醚
[1221]
ph
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
苯基
[1222]
psi
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
磅/平方英寸
[1223]
pyr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
吡啶
[1224]
rt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
室温
[1225]
sfc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
超临界流体色谱
[1226]
t3p
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2,4,6-三丙基-1,3,5,2,4,6-三氧杂三磷杂环己烷-2,4,6-三氧化物
[1227]
tda-1
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三[2-(2-甲氧基乙氧基)乙基]胺
[1228]
tbaf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四丁基氟化铵
[1229]
tbs
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁基二甲基甲硅烷基
[1230]
tbtu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
o-(苯并三唑-1-基)-n,n,n',n'-四甲基脲鎓四氟硼酸盐
[1231]
tea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三乙胺
[1232]
tfa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三氟乙酸
[1233]
tidpsi
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1,1,3,3-四异丙基二硅氧烷
[1234]
tips
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三异丙基甲硅烷基
[1235]
thf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四氢呋喃
[1236]
uplc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
超高效液相色谱
[1237]
xantphos
ꢀꢀꢀꢀꢀꢀꢀ
4,5-双(二苯基膦基)-9,9-二甲基呫吨
[1238]
分析方法:
[1239]
nmr条件:
[1240]
除非另有说明,否则nmr谱是在bruker avance iii 400谱仪400mhz 1
h频率上记录。在同一谱仪上分别在162mhz和376mhz下运行
31
p nmr和
19
f nmr谱。除非另有说明,否则所有异核实验是使用1h去耦获取。
[1241]
lcms条件:
[1242]
在使用反相c18柱的连接至micromass质谱仪的hewlett-packard hp1100或agilent 1100系列lc系统上记录lcms谱。选择多个梯度和运行时间以最佳地表征化合物。流动相是基于acn/水或meoh/水梯度并且含有0.1%甲酸(方法指示为fa)或10mm乙酸铵(方法指示为aa)。所用溶剂梯度的一个实例是100%流动相a(流动相a=99%水+1%acn+0.1%甲酸)至100%流动相b(流动相b=95%acn+5%水+0.1%甲酸),以1ml/min的流速运行16.5min。
[1243]
在一些情形下,在连接至agilent 6130质谱仪的agilent 1290infinity uplc系统、连接至waters acquity sq质谱仪的waters acquity uplc系统或使用反相c18柱的连接至waters micromass zq质谱仪的agilent 1100系列hplc系统上记录lcms谱。选择多个梯度和运行时间以最佳地表征化合物。流动相是基于acn/水或meoh/水梯度并且含有0.1%甲酸(方法指示为fa)或10mm乙酸铵(方法指示为aa)。所用溶剂梯度的一个实例是95%流动相a(流动相a=99%水+1%acn+0.1%甲酸)至100%流动相b(流动相b=95%acn+5%水+0.1%甲酸),以0.5ml/min的流速运行5min。
[1244]
制备型hplc:
[1245]
使用用溶剂a(99%10mm乙酸铵/1%乙腈)/溶剂b(5%10mm乙酸铵/95%乙腈)梯度洗脱的phenomenex 5微米c5 21.2
×
250mm使用由322个泵操作的gilson仪器实施制备型hplc,其中uv/可见光155检测器触发的级分收集设定为200nm至400nm。在agilent 1100lc/msd仪器上实施质量门控级分收集。
[1246]
本领域的普通技术人员将认识到,可改变梯度、柱长度和流速并且一些条件可比其他条件更适用于化合物表征,这取决于所分析的化学物质。
[1247]
制备型sfc:
[1248]
使用10mm、20mm或30mm
×
250mm chiralpak柱(通常为ia、ib、ic、id、ie和if)、10mm或20mm
×
250mm phenomenex lux cellulose-4或2-乙基吡啶柱实施制备型sfc,用适当百分比的含有0.3%二乙胺或0.3%tea或0.3%甲酸或不含任何酸或碱添加剂的超临界二氧化碳和醇洗脱。典型的等度条件是10-100ml/min范围内的流速和40℃的柱温度。在a jasco sfc制备型纯化系统上实施制备型sfc,其中uv/可见光触发的级分收集设定为200nm至400nm并且背压调节设定为10mpa。
[1249]
本领域的普通技术人员将认识到,可改变梯度、柱长度和流速并且一些条件可比其他条件更适用于化合物表征,这取决于所分析的化学物质。
[1250]
实施例b的hplc条件:
[1251]
使用具有shiseido 3微米c18 4.6
×
75mm的shimadzu lc-2010c实施hplc分析,用溶剂a(80%水/10%50mm乙酸铵/10%乙腈)/溶剂b(10%50mm乙酸铵/90%乙腈)梯度洗脱,流速为1ml/min,柱温度为40℃并且uv检测在254nm。
[1252]
实施例b的lc/ms/ms条件:
[1253]
使用与ab sciex 4500或ab sciex 5500triple quad质谱连接的shimadzu ultrafast液相色谱和自动取样器或等效系统实施lc/ms/ms分析。
[1254]
为了分析化合物no.14和化合物i-5c,将99%水和1%乙腈中的10mm乙酸铵或水中的0.1%甲酸制备为流动相a溶剂,并且使用5%水和95%乙腈中的10mm乙酸铵或5%水和95%乙腈中的0.1%甲酸作为流动相b溶剂。以1.5ml/min将液相色谱梯度运行3分钟。hplc柱为具有2.1mm id
×
30mm长度的waters xselect c18 csh 3.5微米柱,并且柱温度为室温。
[1255]
为了分析化合物cp-1,将99%水和1%乙腈中的10mm乙酸铵制备为流动相a溶剂,并且将5%水和95%乙腈中的10mm乙酸铵用于流动相b溶剂。以1.5ml/min将液相色谱梯度运行3.5分钟。hpcl柱为osaka soda capcell pak c1 ug120 5微米,2.0mm i.d.
×
35mm长度,并且柱温度为室温。
[1256]
使用analyst软件1.7分析ms/ms峰面积并计算样品的浓度。
[1257]
uplc-cad条件:
[1258]
使用thermo scientific
tm
dionex
tm
corona
tm
veo
tm
rs(快速分离)带电气溶胶检测器和具有ace excel c4 2微米2.1
×
100mm或相似柱的waters acquity uplc系统实施uplc-cad分析,用使用溶剂a(水中的10mm乙酸铵、4l中的2.6ml氢氧化铵)/溶剂b(甲醇中的10mm乙酸铵、4l中的2.6ml 95%氢氧化铵)的梯度方法使用0.8ml/min的流速和35℃的柱温度洗脱。高达
±
20%变化可源自uplc-cad分析。
[1259]
实施例a1
[1260]
[4-({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨基)-4-氧代丁基]甲基氨基甲酸叔丁酯tea盐,中间体-1
[1261][1262]
将化合物no.14(300mg,0.40mmol)溶解于无水吡啶中并浓缩至干燥(5ml
×
3次)。在氩气氛下将残余物溶解于吡啶(6.41ml)中并用以冰水浴冷却的氯三甲基硅烷(0.30ml,2.38mmol)处理。使反应物升温至室温并搅拌2h以产生tms保护的化合物no.14。单独地(在室温下将上述反应物搅拌约30min后),向4-((叔丁氧基羰基)(甲基)氨基)丁酸(520.0mg,2.27mmol)于四氢呋喃(10.7ml)中的冰水浴冷却溶液添加4-甲基吗啉(0.28ml,2.50mmol),然后缓慢添加thf中的氯甲酸异丁酯(0.29ml,2.27mmol)。将浑浊悬浮液升温至室温并搅拌1h,然后经由注射器缓慢添加至上述tms保护的中间体。将反应混合物在室温下搅拌过夜。将meoh(10ml)添加至上述反应混合物中并且将反应混合物浓缩。将残余物再溶解于meoh(3.8ml)中。将三氢氟酸三乙胺(0.26ml,1.59mmol)添加至冰水浴冷却的反应混合物中并且升温至室温并搅拌30min。将反应混合物吸附于硅藻土(1g)上并通过反相快速柱色谱(0-50%acn于三乙基乙酸铵水溶液(10mm)中)纯化,得到呈tea盐形式的中间体-1(214.0mg,48.5%)。lcms(aa):m/z=910.2(m+h)。1h nmr(d2o)δ8.55(s,1h),8.20(s,1h),7.87(s,1h),7.14(d,,j=4.0hz,1h),6.42(d,j=16.0hz,1h),6.29(d,j=8.0hz,1h),5.5d(dd,j=4.0,52.0hz,1h),5.04-4.93(m,1h),4.91-4.86(m,1h),4.66(d,j=4.0hz,1h),4.46(d,j=8.0hz,1h),4.33-4.25(m,3h),4.14(dd,j=4.0,12.0hz,1h),3.94(dd,j=4.0,8.0hz,1h),3.25(br,m,2h),3.05(q,j=8.0hz,15h),2.73(s,3h),2.59-2.54(m,1h),1.90-1.82(m,1h),1.20(s,9h),1.13(t,j=8.0hz,22h)。
31
p nmr(d2o)δ55.46(s,1p),52.06(s,1p)。
19
f nmr(d2o)δ-164.19(s,br,1f),-200.75至-200.99(m,1f)。
[1263]
实施例a2
[1264]
十八烷酸[(2r)-3-[羟基-[2-[[5-[[(1s)-1-[[(1s)-2-[4-(羟基甲基)苯氨基]-1-甲基-2-氧代-乙基]氨甲酰基]-2-甲基-丙基]氨基]-5-氧代-戊酰氧基]氨基]乙氧基]磷酰基]氧基-2-十八酰基氧基-丙基]酯,中间体-2
[1265][1266]
将(2s)-2-氨基-n-[(1s)-2-[4-(羟基甲基)苯氨基]-1-甲基-2-氧代-乙基]-3-甲基-丁酰胺(112.1mg,0.38mmol)悬浮于小瓶中的甲苯中并蒸发至干燥(1ml
×
3)。将残余物溶解于dmf(1.5ml)中并用dipea(88.9ul,0.51mmol)处理。然后将dmf溶液添加至dcm(15ml)中的磷酸[(2r)-2,3-二(十八酰基氧基)丙基]酯2-[[5-(2,5-二氧代吡咯烷-1-基)氧基-5-氧代-戊酰氧基]氨基]乙酯钠(250.0mg,0.25mmol)。将反应混合物在室温下搅拌4h。蒸发大部分溶剂(dcm)并且将残余溶液(dmf)倾倒至冰冷hcl水溶液(0.1n,5ml))中。通过过滤收集固体并且用水(3ml
×
3)和dcm(3ml
×
3)洗涤并在真空下干燥,得到中间体-2(247.0mg,85.2%)。lcms(aa):m/z=1137.8(m+h)。1h nmr(meod/cdcl3)δ7.55(掩蔽于cdcl3峰内,2h),7.29(d,,j=8.0hz,1h),5.25-5.22(m,1h),4.53-4.49(掩蔽于meod残余水峰内,3h),4.40(dd,j=4.0,12.0hz,1h),4.19-4.00(m,6h),3.49-3.39(m,2h),2.35-2.30(m,6h),2.22(t,j=8.0hz,2h),2.17-2.09(m,1h),1.97-1.89(m,2h),1.65-1.58(m,4h),1.45(d,j=8.0hz,3h),1.35-1.28(br,m,56h),0.99-0.97(m,6h),0.89-0.86(6h)。
31
p nmr(meod/cdcl3)δ0.77(s,1p)。
[1267]
实施例a3
[1268]
十八烷酸[(2r)-3-[羟基-[2-[[5-[[(1s)-2-甲基-1-[[(1s)-1-甲基-2-[4-[(4-硝基苯氧基)羰基氧基甲基]苯氨基]-2-氧代-乙基]氨甲酰基]丙基]氨基]-5-氧代-戊酰氧基]氨基]乙氧基]磷酰基]氧基-2-十八酰基氧基-丙基]酯,中间体-3
[1269][1270]
向小瓶中添加中间体-2(247.0mg,0.22mmol)、thf(4.0ml)和dipea(83.3μl,0.48mmol)。在n2气氛下用冰水浴冷却溶液并且然后一次性添加碳酸双(4-硝基苯基)酯(97%,74.9mg,0.24mmol)。将淡黄色溶液在50℃下搅拌1h。再添加碳酸双(4-硝基苯基)酯(97%,145.3mg,0.48mmol)并在50℃下搅拌1h并且然后室温过夜。将反应混合物倾倒至冰冷hcl水溶液(0.05n,30ml)中。通过过滤收集固体并用水(10ml
×
3)和etoac(8ml
×
6)洗涤,
0.91(m,6h),0.85-0.81(m,6h)。
31
p nmr(meod)δ57.00(s,1p),52.26(s,1p),-0.20(s,1p)。
19
f nmr(meod)δ-165.24至-165.46(s,br,1f),-202.98至-203.24(m,1f)。hrms(c
88h138
f2n
13o25
p3s2)预期值:1972.8622;观测值:1972.8674实施例a5
[1275]
{9-[(1r,3r,6r,8r,9r,10r,12r,15r,17r,18r)-9-氟-17-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-18-羟基-3,12-二氧桥-3,12-二氢硫基-2,4,7,11,13,16-六氧杂-3,12-二磷杂三环[13.2.1.0~6,10~]十八烷-8-基]-9h-嘌呤-6-基}氨基甲酸2-[(叔丁氧基羰基)(甲基)氨基]乙酯,中间体-4
[1276][1277]
步骤1:氯甲酸2-[叔丁氧基羰基(甲基)氨基]乙酯(5-a)
[1278]
在-78℃下将含有吡啶(1.26ml)的dcm(100ml)中的(2-羟基乙基)(甲基)氨基甲酸叔丁酯(1.40g,7.99mmol)缓慢添加至甲苯中的15%光气溶液(16ml,22.4mmol)。然后将反应混合物升温至室温并搅拌1.5h。然后将溶剂浓缩至干燥,得到粗5-a(1.90g,100%)。
[1279]
步骤2:{9-[(1r,3r,6r,8r,9r,10r,12r,15r,17r,18r)-9-氟-17-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-18-羟基-3,12-二氧桥-3,12-二氢硫基-2,4,7,11,13,16-六氧杂-3,12-二磷杂三环[13.2.1.0~6,10~]十八烷-8-基]-9h-嘌呤-6-基}氨基甲酸2-[(叔丁氧基羰基)(甲基)氨基]乙酯,中间体-4
[1280]
将化合物no.14(313mg,0.40mmol)溶解于无水吡啶中并浓缩至干燥(3
×
5ml)。在氩气氛下将残余物溶解于吡啶(6.70ml)中并用冰水浴冷却的氯三甲基硅烷(0.378ml,2.97mmol)处理。使反应物升温至室温并搅拌20min以产生呈溶液形式的tms保护的化合物no.14。将5-a(1.90g,7.52mmol)溶解于dcm(12.5ml)中,然后经由注射器添加至上文所提及溶液。将反应混合物在室温下在氩气氛下搅拌16h。然后将反应混合物浓缩至干燥。将meoh(10ml)和氢氧化铵(水中的28-30%溶液,10ml)添加至残余物并搅拌30min。将反应混合物浓缩至干燥并将残余物溶解于meoh(15ml)中。添加三氢氟酸三乙胺(0.12ml,0.75mmol)并且将反应混合物在室温下搅拌30min。将反应混合物浓缩至干燥并使粗残余物吸附至celite上并且通过反相快速柱色谱(0-50%acn于三乙基乙酸铵水溶液(10mm)中)纯化,得到呈tea盐形式的中间体-4(181mg,39.3%)。lcms(aa):m/z=912.3(m+h)。1h nmr(400mhz,dmso-d6)δ12.06(br,s,1h),10.56(br,s,1h),9.16(br,2h),8.62(s,1h),8.52(s,1h),7.89(d,j=4.0hz,1h),7.63(s,1h),6.35(dd,j=4.0和12.0hz,1h),6.26(d,j=8.0hz,1h),5.80(d,j=52.0hz,1h),5.19-5.14(m,1h),4.95-4.93(m,1h),4.79-4.78(m,1h),4.56(br,s,1h),4.33(br,s,1h),4.21-4.12(m,5h),4.00-3.90(m,1h),3.72-3.69(m,1h),3.45-3.43
(m,2h),3.05(br,12h),2.86-2.83(m,3h),1.34(br,9h),.115-1.11(m,18h)。
31
p nmr(dmso-d6)δ54.04(s,1p),47.46(s,1p)。
19
f nmr(dmso-d6)δ-165.06(s,br,1f),-207.23至-207.54(m,1f)
[1281]
实施例a6
[1282]
十八烷酸(2s,5s,19r)-2-{[4-({[{2-[({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨甲酰基)氧基]乙基}(甲基)氨甲酰基]氧基}甲基)苯基]氨甲酰基}-16-羟基-5-异丙基-16-氧桥-4,7,11-三氧代-19-(硬脂酰基氧基)-15,17-二氧杂-3,6,12-三氮杂-16λ~5~-磷杂二十烷-20-基酯,cp-2
[1283][1284]
标题化合物是使用与实施例a4中所示相似的程序使用中间体-4(77.0mg,0.069mmol)代替中间体-1制备,获得呈铵盐形式的cp-2(42.0mg,30.0%)。lcms(aa):m/z=1974.6(m+h)。1h nmr(meod)δ8.52(br,d,j=12.0hz,1h),8.33(br,d,j=8.0hz,1h),7.74(s,1h),7.50(br,d,j=8.0hz 1h),7.40(br,d,j=8.0hz,1h),7.28(br,1h),7.24(br,d,j=8.0hz,1h),7.14(br,d,j=8.0hz,1h),6.43-6.34(m,2h),5.56(d,j=52.0hz,1h),5.17-5.06(m,2h),5.01-4.93(m,3h),4.78-4.76(掩蔽于meod残余水峰内,1h),4.47-4.29(m,8h),4.21(m,1h),4.13-4.09(dd,j=8.0和12.0hz,2h),3.95-3.82(m,5h),3.63-3.58(m,2h),3.33(br,d,j=8.0hz,2h),2.99(s,3h),2.30-2.22(m,6h),2.17(t,d,j=8.0hz,2h),2.10-2.04(m,1h),1.88-1.81(m,2h),1.56-1.48(m,4h),1.49(br,d,j=8.0hz,3h),1.27-1.21(br,m,56h),0.93-0.90(m,6h),0.84-0.81(m,6h)。
31
p nmr(dmso-d6)δ53.64(s,1p),46.87(s,1p),-0.45(s,1p)。
19
f nmr(meod)δ-165.49至-165.66(m,1f),-203.23至-203.70(m,1f)。hr-ms(c
87h136
f2n
13o26
p3s2)预期值:1974.8415;观测值:1974.8455。
[1285]
实施例a7
[1286]
4-(氨基甲基)苯甲酸[4-(羟基甲基)苯基]酯,中间体-5
[1287][1288]
步骤1:4-[(叔丁氧基羰基氨基)甲基]苯甲酸[4-(羟基甲基)苯基]酯
[1289]
向100ml圆底烧瓶中装填4-(boc-氨基甲基)苯甲酸(503.0mg,1.98mmol)、4-羟基苄基醇(97%,304.3mg,2.38mmol)。然后将混合物悬浮于dcm(15ml)中并用1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺(97%,634.3mg,3.96mmol)处理。将反应在室温下维持2h并用
冰冷hcl(0.1n,10ml)洗涤,然后用水(10ml)和饱和nahco3(10ml)洗涤并干燥,并且通过硅胶色谱(0-100%etoac/己烷)纯化,得到7-a(385.0mg,54.4%)。lcms(aa):m/z=356.00(m-h)。1h nmr(dmso-d6)δ8.09(d,j=8.0hz,1h),7.53(t,j=4.0hz,1h),7.47-7.39(m,4h),7.22(d,j=8.0hz,1h),5.25(t,j=8.0hz,1h),4.53(d,j=8.0hz,2h),4.24(br,d,j=4.0hz,2h),1.41(s,9h)。
[1290]
步骤2:4-(氨基甲基)苯甲酸[4-(羟基甲基)苯基]酯,中间体-5
[1291]
将4-[(叔丁氧基羰基氨基)甲基]苯甲酸[4-(羟基甲基)苯基]酯7-a(100.0mg,0.28mmol)溶解于dcm(2ml)中并用tfa(0.8ml,10mmol)在室温下处理30min。通过旋转蒸发去除挥发物并且将残余物再溶解于meoh(2ml)中并在37℃下保持90min。完全去除挥发物后,将残余物与meoh(2ml
×
2)和dcm(4ml
×
2)共蒸发,得到呈tfa盐形式的中间体-5(110.0mg,定量产率)。lcms(aa):m/z=258.20(m+h)。1h nmr(dmso-d6)δ8.37(br,3h),8.19(d,j=8.0hz,2h),7.68(d,j=8.0hz,2h),7.42(d,j=8.0hz,2h),7.24(d,j=8.0hz,2h),4.54(s,2h),4.20(br,s,2h)。
[1292]
实施例a8
[1293]
二硬脂酸(2r)-3-((羟基(2-(5-((4-((4-(羟基甲基)苯氧基)羰基)苄基)氨基)-5-氧代戊酰氨基)乙氧基)磷酰基)氧基)丙烷-1,2-二基酯,中间体-6
[1294][1295]
将4-(氨基甲基)苯甲酸[4-(羟基甲基)苯基]酯三氟乙酸盐(64.1mg,0.17mmol)溶解于dmf(0.8ml)中。将溶液添加至磷酸[(2r)-2,3-二(十八酰基氧基)丙基]酯2-[[5-(2,5-二氧代吡咯烷-1-基)氧基-5-氧代-戊酰氧基]氨基]乙酯钠(113.0mg,0.115mmol)于dcm(3.2ml)中的另一溶液中。然后将dipea(0.04ml,0.23mmol)添加至上述混合物中并在室温下搅拌3.5h。将大部分溶剂(dcm)蒸发并且将残余溶液(dmf)倾倒至冰冷hcl溶液(0.1n,5ml)中。通过过滤收集固体并用冰冷hcl溶液(0.1n,4ml
×
6)和水(3ml
×
6)洗涤并且在真空下干燥,得到中间体-6(106.0mg,83.6%)。lcms(aa):弱信号。1h nmr(meod/cdcl3)δ8.03(d,j=8.0hz,2h),7.31(d,j=8.0hz,4h),7.06(d,j=8.0hz,2h),5.13-5.10(m,1h),4.55(s,2h),4.37(s,2h),4.07-4.05(m,1h),4.07-3.93(m,5h),3.37-3.34(br,2h),2.24-2.13(m,8h),1.86-1.82(m,2h),1.49(br,4h),1.14(br,56h),0.78(m,6h)。
31
pnmr(meod/cdcl3)δ3.06(s,1p)。
[1296]
实施例a9
[1297]
二硬脂酸(2r)-3-((羟基(2-(5-((4-((4-((((4-硝基苯氧基)羰基)氧基)甲基)苯氧基)羰基)苄基)氨基)-5-氧代戊酰氨基)乙氧基)磷酰基)氧基)丙烷-1,2-二基酯,中间
5.10(m,4h),5.08-5.0(m,1h),4.82(m,1h),4.55-4.32(m,9h),4.30(br,1h),4.04-3.98(m,3h),3.96-3.91(m,2h),3.83-3.65(m,2h),3.44(t,j=4.0hz,2h),3.10(br,d,j=12.0hz,3h),2.38-2.28(m,8h),2.02-1.94(m,2h),1.65-1.57(m,4h),1.30(br,56h),0.93-0.90(m,6h)。
31
p nmr(meod)δ57.08(s,1p),52.51(s,1p),0.36(s,1p)。
19
f nmr(meod)δ-165.58至-165.67(m,1f),-203.66至-203.99(m,1f)hr-ms(c
87h128
f2n
11o26
p3s2)预期值:1938.7727;观测值:1938.7713
[1304]
实施例a11
[1305]
[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯,中间体-8
[1306][1307]
步骤1:2-[[[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲氧基羰基-甲基-氨基]甲基]苯甲酸,11-a
[1308]
标题化合物是遵循实施例a4的步骤2中所述的程序,用2-[(甲基氨基)甲基]苯甲酸hcl(150mg,0.72mmol)代替de-boc中间体-1开始来制备。在通过硅胶色谱(0-25%meoh/dcm)纯化后,得到11-a(306mg,67%)。lcms(aa):m/z=583.4(m-h)。
[1309]
步骤2:n-[(2-氯羰基苯基)甲基]-n-甲基-氨基甲酸[4-[[(2s)-2-[[(2s)-2-(叔丁氧基羰基氨基)-3-甲基-丁酰基]氨基]丙酰基]氨基]苯基]甲酯,中间体-8
[1310]
向11-a(295mg,0.50mmol)于冷却至0℃的thf(1.5ml)中的溶液中添加草酰氯(2.0m溶液于dcm中,0.25ml,0.50mmol),然后添加3滴dmf。将反应混合物在0℃下搅拌45min。然后将混合物浓缩至干燥,得到粗中间体-8,将其直接用于下一步骤(304mg,100%)。
[1311]
实施例a12
[1312]
[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯,中间体-9
[1313][1314]
将化合物no.14(107mg,0.117mmol)添加至圆底烧瓶(50ml)中并与无水吡啶(2ml
×
3次)共蒸发。然后将残余物再溶解于无水吡啶(4.26ml,52.7mmol)中并用氯三甲基硅烷(0.121ml,0.934mmol)处理,并在室温下搅拌30min。向上述溶液中添加吡啶(1.89ml,23.4mmol)中的中间体-8(423mg,0.70mmol)且在室温下搅拌过夜。用10ml meoh淬灭反应混合物并搅拌30min,去除所有溶剂,并且添加氢氧化铵(28-30%水溶液,10ml)并搅拌30min。将反应混合物浓缩,得到粗深色固体。将固体再溶解于meoh(1.42ml)中并在0℃下用三乙胺三氢氟酸盐(0.12ml,0.75mmol)处理,并且升温至室温并保持30min。将混合物蒸发并通过反相快速柱色谱(0-50%acn于碳酸氢铵水溶液(5mm)中)纯化,并且进一步通过制备型hplc(phenomenex 5微米c5 21.2
×
250mm,用溶剂a(99%10mm乙酸铵/1%乙腈)/溶剂b(5%10mm乙酸铵/95%乙腈)从60%b至100%b在16min内以20ml/min的流速洗脱)纯化,得到呈铵盐形式的中间体-9。lcms(aa):m/z=1277.8(m+h)。1h nmr(meod)δ8.68(s,1h),8.44(s,1h),7.82(br,d,j=8.0hz,1h),7.77(s,1h),7.52-7.39(m,4h),7.39(s,1h),7.23-7.26(m,3h),6.50-6.43(m,2h),5.74(dd,j=4.0和52.0hz,1h),5.25-5.15(m,1h),5.07-5.04(m,3h),4.93-4.89(m,2h),4.56-4.49(m,2h),4.46-4.39(m,3h),4.30(br,1h),4.03(dd,j=4.0和12.0hz,1h),3.95(d,j=4.0hz,1h),2.95(br,3h),2.13-2.11(m,1h),1.48(d,j=8.0hz,1h),1.45(s,9h),1.00(d,j=4.0hz,3h),0.94(j=4.0hz,3h),
31
pnmr(meod)δ56.91(s,1p),52.36(s,1p)。
19
f nmr(meod)δ-165.65(s,1f),-203.16至-203.35(m,1f)。
[1315]
实施例a13
[1316]
十八烷酸(2s,5s,19s)-2-({4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯基}氨甲酰基)-16-羟基-5-异丙基-16-氧桥-4,7,11-三氧代-19-(硬脂酰基氧基)-15,17-二氧杂-3,6,12-三氮杂-16λ~5~-磷杂二十烷-20-基酯(cp-4)
[1317][1318]
步骤1:[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-{[(2s)-2-氨基-3-甲基丁酰基]氨基}丙酰基]氨基}苄酯(13-a)
[1319]
将中间体-9(56mg,0.045mmol)添加至圆底烧瓶中并冷却至0℃。然后经由注射器添加tfa(0.24ml,3.2mmol)和dcm(0.58ml)的溶液,并且将反应物在0℃下搅拌30min。然后将反应混合物浓缩至干燥并置于真空下2h,得到呈tfa盐形式的13-a(56mg,100%)。lcms(aa):m/z=1177.0(m+h)。
[1320]
步骤2:十八烷酸(2s,5s,19s)-2-({4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15r,15ar,16r)-15-氟-7-(5-氟-4-氧代-3,4-二氢-7h-吡咯并[2,3-d]嘧啶-7-基)-16-羟基-2,10-二氧桥-2,10-二氢硫基八氢-12h-5,8-亚甲基呋喃并[3,2-l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-14-基]-9h-嘌呤-6-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯基}氨甲酰基)-16-羟基-5-异丙基-16-氧桥-4,7,11-三氧代-19-(硬脂酰基氧基)-15,17-二氧杂-3,6,12-三氮杂-16λ~5~-磷杂二十烷-20-基酯,cp-4
[1321]
向13-a(56mg,0.037mmol)和13-b(40.0mg,0.041mmol)于thf(1.4ml)和dmf(0.7ml)中的溶液中逐滴添加n,n-二异丙基乙胺(65ul,0.37mmol)。将反应混合物在室温下搅拌16h。然后将反应混合物浓缩至干燥,并通过制备型hplc(phenomenex 5微米c5 21.2
×
250mm,用溶剂a(99%10mm乙酸铵/1%乙腈)/溶剂b(5%10mm乙酸铵/95%乙腈)从60%b至100%b在16min内以20ml/min的流速洗脱)纯化粗残余物,得到呈铵盐形式的cp-4(32.8mg,42%)。lcms(aa):1/2m/z=1011.1(m+h)。1h nmr(meod)δ8.78(s,1h),8.74(s,1h),7.90-7.88(m,1h),7.78(s,1h),7.64-7.46(m,4h),7.36(s,1h),7.33-7.13(m,3h),6.54-6.48(m,2h),5.79(dd,j=4.0和52.0hz,1h),5.26-5.13(m,2h),5.05-4.99(m,3h),4.84(m,2h,掩蔽于水峰中),4.78-4.77(m,1h),4.59-4.36(m,6h),4.30-4.29(m,1h),4.22-4.17(m,2h),4.03-3.92(m,5h),3.43(t,j=4.0hz,2h),2.96(s,3h),2.89-2.24(m,8h),2.20-2.12(m,1h),1.98-1.90(m,2h),1.67-1.56(m,br,4h),1.48(d,j=8.0hz,3h),1.30(br,56h),1.02-0.99(m,6h),0.93-0.90(m,6h)。
31
p nmr(meod)δ57.47(s,1p),52.87(s,1p),0.12(s,1p)。
19
fnmr(meod)δ-165.91至-166.08(m,1f),-203.70至-203.94(m,1f)。hr-ms(c
92h138
f2n
13o25
p3s2)预期值:2020.8622,观测值:2020.8601。
[1322]
实施例a14
[1323]
[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基]甲基氨基甲酸4-{[(2s)-2-({(2s)-2-[(叔丁氧基羰基)氨基]-3-甲基丁酰基}氨基)丙酰基]氨基}苄酯,中间体-10
[1324][1325]
标题化合物是遵循实施例a12中所述的程序,用呈tea盐形式的2-氨基-9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-1,9-二氢-6h-嘌呤-6-酮(化合物i-5c)(关于合成,参见pct/ib2018/058846)代替化合物i-5c来制备。通过反相快速柱色谱(0-50%acn于碳酸氢铵水溶液(5mm)中)纯化粗产物,得到呈铵盐形式的中间体-10。为了转化盐,然后将此物质溶解于meoh(2ml)中并添加三乙胺(5ml)。将混合物摇晃1分钟,去除溶剂并冻干过夜,得到呈tea盐形式的中间体-10(147mg,48%)。lcms(aa):m/z=1216.3(m+h)。1h nmr(400mhz,meod)δ8.70(s,1h),8.43(brs,1h),8.40(d,j=5.9hz,1h),7.70(d,j=7.5hz,1h),7.56-7.46(m,3h),7.42-7.38(m,1h),7.32-7.19(m,3h),6.84(d,j=5.5hz,1h),6.15(d,j=7.3hz,1h),5.62-5.56(m,1h),5.54-5.48(m,1h),5.08-5.02(m,1h),5.04(s,2h),4.88-4.83(m,1h),4.81-4.76(m,2h),4.53-4.47(m,1h),4.37-4.22(m,3h),4.08-4.03(m,1h),3.92-3.89(m,1h),3.82-3.74(m,1h),2.88(s,3h),2.58-2.30(m,4h),2.10-2.03(m,1h),1.54-1.47(m,1h),1.46-1.44(m,3h),1.44
(s,9h),0.98(d,j=6.8hz,3h),0.93(d,j=6.8hz,3h)。
31
p nmr(162mhz,meod)δ55.01(s,1p),53.03(s,1p)。
[1326]
实施例a15
[1327]
十八烷酸(2s,5s,19r)-16-羟基-2-({4-[({[2-({9-[(2r,5r,7r,8r,10r,12ar,14r,15as,16r)-16-羟基-2,10-二氧桥-14-(嘧啶-4-基氧基)-2,10-二氢硫基十氢-5,8-亚甲基环戊[l][1,3,6,9,11,2,10]五氧杂二磷杂十四熳环-7-基]-6-氧代-6,9-二氢-1h-嘌呤-2-基}氨甲酰基)苄基](甲基)氨甲酰基}氧基)甲基]苯基}氨甲酰基)-5-异丙基-16-氧桥-4,7,11-三氧代-19-(硬脂酰基氧基)-15,17-二氧杂-3,6,12-三氮杂-16λ~5~-磷杂二十烷-20-基酯,cp-5
[1328][1329]
标题化合物是使用类似于实施例a13所示的程序,用中间体-10代替中间体-9开始来制备,获得cp-5(96.0mg,48.8%,2个步骤)。lcms(aa):m/z=1959.8(m+h)。1h nmr(meod)δ8.58(s,1h),8.33(s,1h),8.28(d,j=8.0hz,1h),7.58(d,j=8.0hz,1h),7.45-7.36(m,3h),7.29(t,j=8.0hz,1h),7.14(br,3h),6.72(d,j=8.0hz,1h),6.04(d,j=8.0hz,1h),5.48(br,1h),5.38-5.33(m,1h),5.13-5.08(m,1h),4.94-4.89(m,3h),4.71(掩蔽于meod残余水峰内,1h),4.67(m,2h),4.42-4.38(m,1h),4.34-4.30(m,1h),4.25-4.04(m,5h),3.95-3.91(m,1h),3.87(t,j=8.0hz,2h),3.82-3.78(m,2h),3.69-3.62(m,1h),3.29(t,j=4.0hz,2h),2.77(s,3h),2.47-2.17(m,10h),2.13(t,j=8.0hz,2h),2.05-1.97(m,1h),1.82-1.77(m,2h),1.53-1.43(br,m,4h),1.41-1.38(m,1h),1.34(d,j=8.0hz,3h),1.17(br,56h),0.89-0.86(m,6h),0.80-0.76(m,6h)。
31
p nmr(dmso-d6)δ55.29(s,1p),53.05(s,1p),0.29(s,1p)。hr-ms(c
91h141n12o25
p3s2)预期值:1959.8858,观测值:1959.8886。
[1330]
应理解,实施方式部分而非发明内容和摘要部分旨在用于解释权利要求书。发明内容和摘要部分可阐述如发明人所设想的本发明的一个或多个而非所有示例性实施方案,并且因此不旨在以任何方式限制本发明和所附权利要求。
[1331]
上文已借助于说明指定功能的实现及其关系的功能构建块阐述了本发明。为了描述的方便,本文已经任意定义了这些功能构建块的边界。只要适当地执行指定的功能及其关系,即可限定替代边界。
[1332]
特定实施方案的前述描述将如此充分地揭示本发明的一般性质,使得其他人可通过应用本领域技术内的知识,在不脱离本发明的一般概念的情况下,容易地修改和/或适应此类特定实施方案的各种应用,而无需过度的实验。因此,基于本文呈现的教导和指导,此
类适应和修改旨在处于所公开实施方案的等同物的含义和范围内。应理解,本文的措辞或术语是出于描述的目的而非为了限制,使得本说明书的术语或措辞将由本领域技术人员根据教导和指导来解释。
[1333]
本发明的广度和范围不应受上述示例性实施方案中的任一者的限制,而应仅根据所附权利要求及其等同物来限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1