用于治疗Bcl-2介导的携带Gly101Val突变的癌症的Bcl-2抑制剂的制作方法
用于治疗bcl
‑
2介导的携带gly101val突变的癌症的bcl
‑
2抑制剂
发明领域
1.本发明涉及bcl
‑
2抑制剂在治疗bcl
‑
2介导的携带至少1、2、3、4、5个或所有以下突变的癌症中的用途:(i)gly101val;(ii)asp103tyr;(iii)asp103val;(iv)asp103glu;(v)arg129leu和(vi)ala113gly;其中bcl
‑
2抑制剂为n
‑
(4
‑
羟基苯基)
‑3‑
{6
‑
[((3s)
‑3‑
(4
‑
吗啉基甲基)
‑
3,4
‑
二氢
‑
2(1h)
‑
异喹啉基)羰基]
‑
1,3
‑
苯并间二氧杂环戊烯
‑5‑
基}
‑
n
‑
苯基
‑
5,6,7,8
‑
四氢
‑1‑
中氮茚甲酰胺(化合物a,也称为s55746或bcl201)或5
‑
(5
‑
氯
‑2‑
{[(3s)
‑3‑
(吗啉
‑4‑
基甲基)
‑
3,4
‑
二氢异喹啉
‑
2(1h)
‑
基]羰基}苯基)
‑
n
‑
(5
‑
氰基
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
基)
‑
n
‑
(4
‑
羟基苯基)
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
甲酰胺(化合物b)或其药学上可接受的盐。本发明还涉及包含化合物a或化合物b的药物组合物,其用于治疗bcl
‑
2介导的携带至少1、2、3、4、5个或所有以下突变的癌症:(i)gly101val;(ii)asp103tyr;(iii)asp103val;(iv)asp103glu;(v)arg129leu和(vi)ala113gly。在进一步的实施方案中,bcl
‑
2介导的携带至少1、2、3、4、5个或所有以下突变的癌症:(i)gly101val;(ii)asp103tyr;(iii)asp103val;(iv)asp103glu;(v)arg129leu和(vi)ala113gly是慢性淋巴细胞白血病(cll)。
[0002]
发明背景
[0003]
凋亡或程序性细胞死亡是胚胎发育和组织稳态维持的关键生理过程。凋亡型细胞死亡涉及形态学变化,例如细胞核的凝结、dna断裂以及生化现象,例如半胱氨酸天冬氨酸蛋白酶的活化,其引起细胞的关键结构组分的损伤,从而诱导其分解和死亡。凋亡过程的调节是复杂的,并且涉及几种细胞内信号传导途径的活化或抑制(cory s等人,nature review cancer,2002,2,647
‑
656)。
[0004]
凋亡的失调涉及某些病理学。凋亡增加与神经变性疾病例如帕金森病、阿尔茨海默病和缺血有关。相反,在实现凋亡中的缺陷在癌症及其化学抗性的发展中、在自身免疫疾病、炎性疾病和病毒感染中起重要作用。因此,不存在凋亡是癌症的表型特征之一(hanahan d等人,cell 2000,100,57
‑
70)。bcl
‑
2家族的抗凋亡蛋白与许多病理学相关。bcl
‑
2家族的蛋白参与了许多类型的癌症,例如结肠癌、乳腺癌、小细胞肺癌、非小细胞肺癌、膀胱癌、卵巢癌、前列腺癌、慢性淋巴样白血病、滤泡型淋巴瘤、骨髓瘤和前列腺癌。bcl
‑
2家族的抗凋亡蛋白的过表达涉及肿瘤发生、对化学疗法的抗性和受癌症影响的患者的临床预后。因此,对于抑制bcl
‑
2家族蛋白的抗凋亡活性的化合物存在治疗需求。
[0005]
维奈托克(venetoclax)(也称为abt
‑
199)是选择性bcl
‑
2抑制剂,其抵消bcl
‑
2与仅bh3蛋白的相互作用,从而诱导凋亡。维奈托克被批准(i)治疗有或没有17p缺失的慢性淋巴细胞白血病(cll)或小淋巴细胞淋巴瘤(sll)成人,其已经接受至少一种在先治疗,和(ii)与阿扎胞苷或地西他滨或低剂量阿糖胞苷组合治疗75岁或更大或具有阻止使用标准化学疗法的其它医学病症的新诊断的急性髓样白血病(aml)成人。然而,在cll中观察到显著数量的复发,这表明获得性抗性机制。在其它高亲和力靶向疗法中,已证明靶标的特异性突变是造成抗性的原因(garraway&janne,cancer discovery 2012,2,214
‑
226)。在不同的
维奈托克抗性衍生的白血病和淋巴瘤细胞系中,已经鉴定了影响其疏水沟(hydrophobic groove)的bcl
‑
2突变(fresquet等人,blood 2014,123,4111
‑
4119;tahir等人,bmc cancer,17:399)。bcl
‑
2上的一个突变(在101位甘氨酸被缬氨酸取代:gly101val)最近被证明是临床相关的,因为在来自对维奈托克有抗性的患者的cll样品中被鉴定了。这种gly101val突变与维奈托克结合bcl
‑
2的疏水沟的降低有关并且与维奈托克抗性有关(blombery等人,cancer discovery 2019,9,342
‑
353)。gly101val突变还可以提供阻止临床复发的潜在生物标志。基于这些临床数据,需要鉴定可以用于治疗携带gly101val突变的癌症患者,并且特别是难治性和复发性患者的新的治疗剂。最近,在用维奈托克治疗的cll患者中鉴定了bcl
‑
2中的其它突变,例如asp103tyr(在103位天冬氨酸被酪氨酸取代,也称为d103y)、asp103val(在103位天冬氨酸被缬氨酸取代,也称为d103v)、asp103glu(在103位天冬氨酸被谷氨酸取代,也称为d103e)、ala113gly(在113位丙氨酸被甘氨酸取代,也称为a113g)、arg129leu(在129位精氨酸被亮氨酸取代,也称为r129l)和val156asp(在156位缬氨酸被天冬氨酸取代,也称为v156d),而在单纯的cll患者中不存在(tausch等人,hematologica 2019,9,e434
‑
e437;blombery等人,blood 2020,135(10),773
‑
777)。值得注意的是,基因组分析证明一个cll患者可以携带不同的bcl
‑
2突变(即包括g101v和d103y)。观察到所有突变存在于ngs(next generation sequencing)数据的不同读段中,与它们在不同白血病细胞中的存在(假定杂合性)和突变的互斥性一致(blombery等人,blood 2020,135(10),773
‑
777)。
[0006]
存在第二代bcl
‑
2特异性抑制剂,包括化合物a和化合物b,其与维奈托克相比具有部分重叠但不同的bcl
‑
2疏水沟结合模式。
[0007]
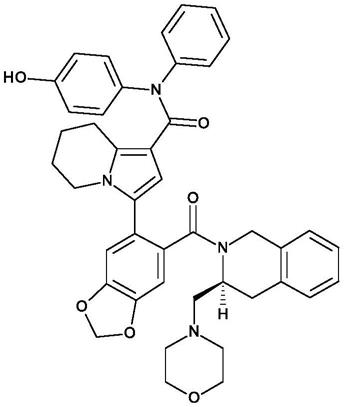
化合物a(也称为s55746或bcl201)的化学结构是:
[0008][0009]
文献中描述了化合物a的制备及其在几种癌症模型中的药理学作用(casara等人,oncotarget 2018,第9卷,第28号,20075
‑
20088和相应的补充信息)。此外,wo 2013/110890中还描述了化合物a和结构接近的类似物、它们作为bcl
‑
2抑制剂用于治疗癌症的用途及其药物制剂,其内容通过引用并入本文。该文献的实施例1中具体公开了化合物a的盐酸盐形式的制备。
[0010]
化合物a占据通常称为s1/2/3的区域,而与维奈托克类似物(souers等人,nature medicine 2013,19,202
‑
208)相较,后者占据蛋白质表面积的更大部分,包括s2/3/4/5。化
合物a与深埋入s2中的残基a149的骨架羰基形成单个氢键。化合物a与bcl
‑
2结合的大小无关的焓效率(0.83)提示最佳极性和范德华相互作用,指示高度特异性结合(casara等人,oncotarget 2018,9,20075
‑
20088)。
[0011]
化合物b的结构是:
[0012][0013]5‑
(5
‑
氯
‑2‑
{[(3s)
‑3‑
(吗啉
‑4‑
基甲基)
‑
3,4
‑
二氢异喹啉
‑
2(1h)
‑
基]羰基}苯基)
‑
n
‑
(5
‑
氰基
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
基)
‑
n
‑
(4
‑
羟基苯基)
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
甲酰胺。
[0014]
wo 2015/011400中描述了化合物b的制备、其作为bcl
‑
2抑制剂用于治疗癌症的用途及其药物制剂,其内容通过引用并入本文。化合物b具体公开于wo 2015/011400的实施例386中,为盐酸盐的形式。它显示了bcl
‑
2特异性bh3
‑
模拟物的所有特点,并且在bcl
‑
2依赖性淋巴样肿瘤异种移植物模型中显示了稳健的抗肿瘤活性,同时不损害血小板。
[0015]
一种假设是,一方面的维奈托克,和另一方面的化合物a或化合物b表现出不同的结合模式。通过测定三种化合物在野生型bcl
‑
2蛋白、gly101val、asp103tyr、asp103val、asp103glu、arg129leu和ala113gly突变体bcl
‑
2蛋白中的不同结合参数来证实这种结构假说。因此,bcl
‑
2蛋白中的突变可能是造成对维奈托克抗性的原因,但不是造成对化合物a或化合物b抗性的原因。更特别地,gly101val突变位于远离化合物a和化合物b的结合位点,与维奈托克相反。此外,asp103tyr突变除去了bcl
‑
2和abt
‑
199之间的关键氢键,从而显著降低了abt
‑
199对含有asp103tyr突变的bcl
‑
2的亲和力。化合物b不与d103发生任何直接相互作用,它与d103相距至少9埃结合,并且因此它对含有asp103tyr突变的bcl
‑
2的亲和力仅受到适度影响。
[0016]
根据本发明的bcl
‑
2抑制剂具有促凋亡特性,使得可以将它们用于涉及凋亡缺陷的病理学中,例如用于治疗癌症以及免疫和自身免疫疾病,并且更特别地用于对由于bcl
‑
2突变影响其疏水沟而导致的对维奈托克有抗性的患者中。
[0017]
概述
[0018]
本发明提供了bcl
‑
2抑制剂,其用于治疗bcl
‑
2介导的携带至少1、2、3、4、5个或所有以下突变的癌症:(i)gly101val;(ii)asp103tyr;(iii)asp103val;(iv)asp103glu;(v)arg129leu和(vi)ala113gly;其中bcl
‑
2抑制剂为化合物a、化合物b或其药学上可接受的盐。特别地,已经发现根据本发明的bcl
‑
2抑制剂对bcl
‑
2 gly101val突变体具有强活性。在野生型bcl
‑
2蛋白和gly101val突变体之间观察到的活性的轻微丧失表明,施用本发明的
bcl
‑
2抑制剂可以在携带gly101val突变的患者中诱导临床相关的响应。另外的细胞研究进一步证实,与表达bcl
‑
2野生型蛋白的细胞系相比,化合物b在包含bcl
‑
2 gly101val突变体的细胞系中仅显示出效力的轻微损失(9至7倍)。更通常的是,考虑到本文公开的生物化学特征,发现化合物b与abt
‑
199相比,对上述一组突变体显示更好的靶上活性。除了生物化学数据,细胞研究进一步证实了在使用过表达bcl
‑
2 asp103tyr的kms
‑
12
‑
pe细胞系的细胞测定中,abt
‑
199和化合物b之间的22倍的效力变化。本公开内容整体上提示,本发明的bcl
‑
2抑制剂,并且更特别是化合物b,在含有至少1、2、3、4、5个或所有以下突变的患者中可能具有有益效果:(i)gly101val;(ii)asp103tyr;(iii)asp103val;(iv)asp103glu;(v)arg129leu和(vi)ala113gly。在一个特别方面,靶向已经获得了进一步进行维奈托克治疗的之前突变之一的cll患者。
[0019]
在另一个方面,本发明涉及敏化患有bcl
‑
2介导的携带至少1、2、3、4、5个或所有以下突变的癌症的患者的方法:(i)gly101val;(ii)asp103tyr;(iii)asp103val;(iv)asp103glu;(v)arg129leu和(vi)ala113gly;所述患者(i)对至少一种抗癌剂是难治的,或(ii)在用抗癌剂治疗后复发,或(i)和(ii)两者,其中所述方法包括给所述患者施用治疗有效量的bcl
‑
2抑制剂。
[0020]
总之,本文所述的发明能够给难治性或复发性癌症患者施用治疗有效量的包含化合物a或化合物b的组合物,所述患者携带至少1、2、3、4、5或所有以下突变:(i)gly101val;(ii)asp103tyr;(iii)asp103val;(iv)asp103glu;(v)arg129leu和(vi)ala113gly;包括对维奈托克抗性的患者。
[0021]
发明详述
[0022]
‘
化合物a’表示n
‑
(4
‑
羟基苯基)
‑3‑
{6
‑
[((3s)
‑3‑
(4
‑
吗啉基甲基)
‑
3,4
‑
二氢
‑
2(1h)
‑
异喹啉基)羰基]
‑
1,3
‑
苯并间二氧杂环戊烯
‑5‑
基}
‑
n
‑
苯基
‑
5,6,7,8
‑
四氢
‑1‑
中氮茚甲酰胺。
[0023]
‘
化合物a,hcl’表示盐酸盐形式的n
‑
(4
‑
羟基苯基)
‑3‑
{6
‑
[((3s)
‑3‑
(4
‑
吗啉基甲基)
‑
3,4
‑
二氢
‑
2(1h)
‑
异喹啉基)羰基]
‑
1,3
‑
苯并间二氧杂环戊烯
‑5‑
基}
‑
n
‑
苯基
‑
5,6,7,8
‑
四氢
‑1‑
中氮茚甲酰胺。
[0024]
‘
化合物b’表示5
‑
(5
‑
氯
‑2‑
{[(3s)
‑3‑
(吗啉
‑4‑
基甲基)
‑
3,4
‑
二氢异喹啉
‑
2(1h)
‑
基]羰基}苯基)
‑
n
‑
(5
‑
氰基
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
基)
‑
n
‑
(4
‑
羟基苯基)
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
甲酰胺。
[0025]
‘
化合物b,hcl’表示5
‑
(5
‑
氯
‑2‑
{[(3s)
‑3‑
(吗啉
‑4‑
基甲基)
‑
3,4
‑
二氢异喹啉
‑
2(1h)
‑
基]羰基}苯基)
‑
n
‑
(5
‑
氰基
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
基)
‑
n
‑
(4
‑
羟基苯基)
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
甲酰胺为盐酸盐形式。
[0026]
‘
化合物b,h2so4’
表示5
‑
(5
‑
氯
‑2‑
{[(3s)
‑3‑
(吗啉
‑4‑
基甲基)
‑
3,4
‑
二氢异喹啉
‑
2(1h)
‑
基]羰基}苯基)
‑
n
‑
(5
‑
氰基
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
基)
‑
n
‑
(4
‑
羟基苯基)
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
甲酰胺为硫酸氢盐的形式。
[0027]
‘
游离分子’和
‘
游离碱’在本文中可互换使用,并且指不是盐形式的化合物a或化合物b。
[0028]“癌症”是指一类疾病,其中一组细胞显示不受控制的生长。癌症类型包括血液学癌症(淋巴瘤和白血病)和实体瘤,包括癌、肉瘤或母细胞瘤。特别地,“癌症”是指白血病、淋
巴瘤或多发性骨髓瘤,并且更特别地是指慢性淋巴细胞白血病、非霍奇金淋巴瘤(包括滤泡性淋巴瘤)或急性髓样白血病。
[0029]
‘
bcl
‑
2介导的癌症’是指其中bcl
‑
2蛋白可以用作凋亡屏障并且促进肿瘤发展和对癌症治疗的抗性的癌症。特别地,
‘
bcl
‑
2介导的癌症’包括以bcl
‑
2蛋白表达的失调为特征的癌症。
[0030]“hp
‑
β
‑
环糊精”也被命名为“羟丙基
‑
β
‑
环糊精”或“2
‑
羟丙基
‑
β
‑
环糊精”或“羟丙基倍他环糊精(hydroxypropylbetadex)”。特别地,hp
‑
β
‑
环糊精以以下产品名称销售:cavitron
tm w7hp7(典型取代度:6.0
‑
8.0;近似分子量:1520),cavitron
tm w7hp5(典型取代度:4.1
‑
5.1;近似分子量:1410),kleptose
tm hpb或kleptose
tm hp。
[0031]
如本文所用,术语
‘
包含’表示
‘
包括’,并且不旨在排除任何另外的组分的存在,除非上下文另外建议,例如当组分一起总计为100%时。
[0032]
如本文所用,术语“治疗”任何疾病或障碍在一个实施方案中指改善疾病或障碍(即减缓或阻止或减少疾病或其至少一种临床症状的发展)。在另一个实施方案中,
‘
治疗’是指减轻或改善至少一种身体参数,包括患者可能无法辨别的那些。在另一个实施方案中,
‘
治疗’是指在身体上(例如可辨别症状的稳定化)、在生理上(例如身体参数的稳定化)或在两者上调节疾病或障碍。
[0033]
如本文所用,“治疗有效量的组合物”是指含有有效剂量的活性成分以对患者产生治疗益处的有效量的本发明组合物。对于化合物a,有用的剂量范围为每天50mg至1500mg,以游离碱表示。根据本发明施用的化合物b的剂量为5mg至1000mg,以游离碱表示。
[0034]
如本文所用,“敏化方法”是指允许改善复发或难治性患者的疾病或障碍(即减缓或阻止或减少疾病或其至少一种临床症状的发展)的治疗方法。在特别的实施方案中,“敏化方法”是指在对现有疗法有抗性的患者中恢复临床响应。
[0035]
如本文所用,“靶向疗法”是指通过干扰癌发生和肿瘤生长所需的特异性靶向分子而不是通过简单地干扰所有快速分裂的细胞(如传统化学疗法)来阻断癌细胞生长的疗法。
[0036]
实施方案
[0037]
下面描述本发明的多个实施例。
[0038]
e1.bcl
‑
2抑制剂,其用于治疗bcl
‑
2介导的携带至少1、2、3、4、5个或所有以下突变的癌症:(i)gly101val;(ii)asp103tyr;(iii)asp103val;(iv)asp103glu;(v)arg129leu和(vi)ala113gly;
[0039]
其中bcl
‑
2抑制剂选自n
‑
(4
‑
羟基苯基)
‑3‑
{6
‑
[((3s)
‑3‑
(4
‑
吗啉基甲基)
‑
3,4
‑
二氢
‑
2(1h)
‑
异喹啉基)羰基]
‑
1,3
‑
苯并间二氧杂环戊烯
‑5‑
基}
‑
n
‑
苯基
‑
5,6,7,8
‑
四氢
‑1‑
中氮茚甲酰胺(化合物a)和5
‑
(5
‑
氯
‑2‑
{[(3s)
‑3‑
(吗啉
‑4‑
基甲基)
‑
3,4
‑
二氢异喹啉
‑
2(1h)
‑
基]羰基}苯基)
‑
n
‑
(5
‑
氰基
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
基)
‑
n
‑
(4
‑
羟基苯基)
‑
1,2
‑
二甲基
‑
1h
‑
吡咯
‑3‑
甲酰胺(化合物b)或其药学上可接受的盐。
[0040]
e2.根据e1的用于治疗bcl
‑
2介导的癌症的bcl
‑
2抑制剂,其中癌症携带gly101val突变。
[0041]
e3.根据e1的用于治疗bcl
‑
2介导的癌症的bcl
‑
2抑制剂,其中癌症携带asp103tyr突变。
[0042]
e4.根据e1的用于治疗bcl
‑
2介导的癌症的bcl
‑
2抑制剂,其中癌症携带asp103val
突变。
[0043]
e5.根据e1的用于治疗bcl
‑
2介导的癌症的bcl
‑
2抑制剂,其中癌症携带asp103glu突变。
[0044]
e6.根据e1的用于治疗bcl
‑
2介导的癌症的bcl
‑
2抑制剂,其中癌症携带arg129leu突变。
[0045]
e7.根据e1的用于治疗bcl
‑
2介导的癌症的bcl
‑
2抑制剂,其中癌症携带ala113gly突变。
[0046]
e8.根据e1至e7中任一项的bcl
‑
2抑制剂,其中bcl
‑
2介导的癌症是慢性淋巴细胞白血病(cll)。可选择的是,bcl
‑
2介导的癌症为急性髓样白血病(aml)、多发性骨髓瘤或非霍奇金淋巴瘤。
[0047]
e9.根据e1至e7中任一项的bcl
‑
2抑制剂,其中化合物a为盐酸盐的形式。
[0048]
e10.根据e1至e7中任一项的bcl
‑
2抑制剂,其中化合物b为硫酸氢盐的形式。
[0049]
e11.根据e1至e7中任一项的bcl
‑
2抑制剂,其中化合物b为盐酸盐的形式。
[0050]
e12.根据e1至e7中任一项的bcl
‑
2抑制剂,其中化合物b为静脉内施用。
[0051]
e13.药物组合物,其包含根据e1至e12中任一项的bcl
‑
2抑制剂,其用于治疗bcl
‑
2介导的携带至少1、2、3、4、5个或所有以下突变的癌症:(i)gly101val;(ii)asp103tyr;(iii)asp103val;(iv)asp103glu;(v)arg129leu和(vi)ala113gly。
[0052]
e14.根据e13的包含bcl
‑
2抑制剂的药物组合物,其用于治疗bcl
‑
2介导的携带gly101val突变的癌症。
[0053]
e15.根据e13的包含bcl
‑
2抑制剂的药物组合物,其用于治疗bcl
‑
2介导的携带asp103tyr突变的癌症。
[0054]
e16.根据e13的包含bcl
‑
2抑制剂的药物组合物,其用于治疗bcl
‑
2介导的携带asp103val突变的癌症。
[0055]
e17.根据e13的包含bcl
‑
2抑制剂的药物组合物,其用于治疗bcl
‑
2介导的携带asp103glu突变的癌症。
[0056]
e18.根据e13的包含bcl
‑
2抑制剂的药物组合物,其用于治疗bcl
‑
2介导的携带arg129leu突变的癌症。
[0057]
e19.根据e13的包含bcl
‑
2抑制剂的药物组合物,其用于治疗bcl
‑
2介导的携带ala113gly突变的癌症。
[0058]
e20.敏化患有bcl
‑
2介导的携带至少1、2、3、4、5个或所有以下突变的癌症的患者的方法:(i)gly101val;(ii)asp103tyr;(iii)asp103val;(iv)asp103glu;(v)arg129leu和(vi)ala113gly;
[0059]
所述患者(a)对至少一种抗癌剂是难治的,或(b)在用抗癌剂治疗后复发,或(a)和(b)两者,其中所述方法包括给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0060]
e21.敏化患有bcl
‑
2介导的携带gly101val突变的癌症的患者的方法,所述患者(i)对至少一种抗癌剂是难治的,或(ii)在用抗癌剂治疗后复发,或(i)和(ii)两者,其中所述方法包括给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0061]
e22.敏化患有bcl
‑
2介导的携带asp103tyr突变的癌症的患者的方法,所述患者
(i)对至少一种抗癌剂是难治的,或(ii)在用抗癌剂治疗后复发,或(i)和(ii)两者,其中所述方法包括给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0062]
e23.敏化患有bcl
‑
2介导的携带asp103val突变的癌症的患者的方法,所述患者(i)对至少一种抗癌剂是难治的,或(ii)在用抗癌剂治疗后复发,或(i)和(ii)两者,其中所述方法包括给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0063]
e24.敏化患有bcl
‑
2介导的携带asp103glu突变的癌症的患者的方法,所述患者(i)对至少一种抗癌剂是难治的,或(ii)在用抗癌剂治疗后复发,或(i)和(ii)两者,其中所述方法包括给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0064]
e25.敏化患有bcl
‑
2介导的携带arg129leu突变的癌症的患者的方法,所述患者(i)对至少一种抗癌剂是难治的,或(ii)在用抗癌剂治疗后复发,或(i)和(ii)两者,其中所述方法包括给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0065]
e26.敏化患有bcl
‑
2介导的携带ala113gly突变的癌症的患者的方法,所述患者(i)对至少一种抗癌剂是难治的,或(ii)在用抗癌剂治疗后复发,或(i)和(ii)两者,其中所述方法包括给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0066]
e27.根据e20至e26中任一项的方法,其中抗癌剂是靶向疗法。
[0067]
e28.根据e27的方法,其中癌症为慢性淋巴细胞白血病(cll)。
[0068]
e29.根据e27或e28中任一项的方法,其中靶向疗法是维奈托克(abt
‑
199)。
[0069]
e30.在患者中治疗bcl
‑
2介导的癌症的方法,所述方法包括以下步骤:
[0070]
(a)从所述患者获得生物样品,并且检测所述生物样品是否包含至少1、2、3、4、5个或所有以下突变:(i)gly101val;(ii)asp103tyr;(iii)asp103val;(iv)asp103glu;(v)arg129leu和(vi)ala113gly;
[0071]
(b)鉴定所述患者为对维奈托克响应的可能性降低;
[0072]
(c)基于由此检测到的突变的存在,给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0073]
e31.在患者中治疗bcl
‑
2介导的癌症的方法,所述方法包括以下步骤:
[0074]
(a)从所述患者获得生物样品,并且检测所述生物样品是否包含gly101val突变;
[0075]
(b)鉴定所述患者为对维奈托克响应的可能性降低;
[0076]
(c)基于gly101val突变的存在,给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0077]
e32.在患者中治疗bcl
‑
2介导的癌症的方法,所述方法包括以下步骤:
[0078]
(a)从所述患者获得生物样品,并且检测所述生物样品是否包含asp103tyr突变;
[0079]
(b)鉴定所述患者为对维奈托克响应的可能性降低;
[0080]
(c)基于asp103tyr突变的存在,给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0081]
e33.在患者中治疗bcl
‑
2介导的癌症的方法,所述方法包括以下步骤:
[0082]
(a)从所述患者获得生物样品,并且检测所述生物样品是否包含asp103val突变;
[0083]
(b)鉴定所述患者为对维奈托克响应的可能性降低;
[0084]
(c)基于asp103val突变的存在,给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0085]
e34.在患者中治疗bcl
‑
2介导的癌症的方法,所述方法包括以下步骤:
[0086]
(a)从所述患者获得生物样品,并且检测所述生物样品是否包含asp103glu突变;
[0087]
(b)鉴定所述患者为对维奈托克响应的可能性降低;
[0088]
(c)基于asp103glu突变的存在,给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0089]
e35.在患者中治疗bcl
‑
2介导的癌症的方法,所述方法包括以下步骤:
[0090]
(a)从所述患者获得生物样品,并且检测所述生物样品是否包含arg129leu突变;
[0091]
(b)鉴定所述患者为对维奈托克响应的可能性降低;
[0092]
(c)基于arg129leu突变的存在,给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0093]
e36.在患者中治疗bcl
‑
2介导的癌症的方法,所述方法包括以下步骤:
[0094]
(a)从所述患者获得生物样品,并且检测所述生物样品是否包含ala113gly突变;
[0095]
(b)鉴定所述患者为对维奈托克响应的可能性降低;
[0096]
(c)基于ala113gly突变的存在,给所述患者施用治疗有效量的根据e1至e12中任一项的bcl
‑
2抑制剂。
[0097]
实施例1:化合物a和化合物b对bcl
‑
2野生型和bcl
‑
2 gly101val突变体的亲和力数据
[0098]
荧光猝灭测定测量以下荧光强度的变化:
[0099]
(i)c
‑
末端cy5
‑
标记的bcl
‑
2野生型蛋白(初级登录号p10415),其具有氨基酸序列(seq id:02):
[0100]
[mghhhhhhhhsaglvprgsmahagrtgydnreivmkyihyklsqrgyewdagdvgaappgaapapgifssqpghtphpaasrdpvartsplqtpaapgaaagpalspvppvvhltlrqagddfsrryrrdfaemssqlhltpftargrfatvveelfrdgvnwgrivaffefggvmcvesvnremsplvdnialwmteylnrhlhtwiqdnggwdafvely],
[0101]
其在c
‑
末端与氨基酸x连接,所述氨基酸x对应于如下定义的半胱氨酸,
[0102]
或者,
[0103]
(ii)bcl
‑
2 gly101val突变体,其具有氨基酸序列(seq id:03):
[0104]
[mghhhhhhhhsaglvprgsmahagrtgydnreivmkyihyklsqrgyewdagdvgaappgaapapgifssqpghtphpaasrdpvartsplqtpaapgaaagpalspvppvvhltlrqavddfsrryrrdfaemssqlhltpftargrfatvveelfrdgvnwgrivaffefggvmcvesvnremsplvdnialwmteylnrhlhtwiqdnggwdafvely],
[0105]
其在c
‑
末端与氨基酸x连接,所述氨基酸x对应于如下定义的半胱氨酸,
[0106]
(其中x=是用来自lumiprobe gmbh目录号13380的磺基
‑
花青5在硫上标记的半胱氨酸)
[0107]
在结合衍生自puma的c
‑
末端标记的肽(初级登录号q9bxh1)后,其具有氨基酸序列(seq id:01):[qwareigaqlrrmaddlnaqy],其在c
‑
末端与氨基酸x’连接,其中x’是用来自aat bioquest目录号2079的tq5ws在硫上标记的半胱氨酸。
[0108]
加入与肽竞争性结合相同位点的化合物将由于荧光猝灭剂的置换而导致蛋白质荧光强度的增加。
[0109]
在dmso中制备各化合物的11点系列稀释液,最终的缓冲条件是10mm 4
‑
(2
‑
羟基乙基)
‑1‑
哌嗪乙磺酸[hepes]、150mm nacl、0.05%tween 20,ph 7.4和5%dmso。在该试验中,终蛋白质浓度为1nm,肽以50nm(bcl
‑
2野生型)或100nm(bcl
‑
2 gly101val)存在。在室温温育试验2小时,然后在biotek synergyneo读板器上测量荧光强度(激发620nm,发射680nm)。使用4参数logistic模型(s形剂量响应模型)用xl
‑
fit软件绘制剂量响应曲线,并且测定荧光强度增加50%的抑制浓度(ic
s0
)。根据cer等人,nucleic acids res,2009,jul 1;37(webserver issue):w441
‑
w445从ic
50
值测定k
i
值。
[0110][0111]
数据表明,与bcl
‑
2野生型蛋白相比,abt
‑
199对bcl
‑
2 gly101val突变体的活性显著丧失,而化合物a和化合物b的亲和力受突变影响轻微。此外,化合物b对bcl
‑
2 gly101val突变体的效力比abt
‑
199强75倍。
[0112]
实施例2:化合物a和化合物b在表达bcl
‑
2野生型或bcl
‑
2 glv101val
[0113]
突变体的修饰细胞中的体外细胞毒性
[0114]
材料和方法
[0115]
细胞系在供应商推荐的培养基中,在37℃的潮湿气氛和5%co2下生长。rs4;11的氨基酸序列(crl1873
tm
)购自american type culture collection(atcc),并且kms
‑
12
‑
pe(acc 606)购自leibniz
‑
institute dsmz(braunschweig,德国)。将含有bcl
‑
2野生型(也称为
‘
bcl
‑
2wt’)和在g101v上突变的bcl
‑
2(也称为
‘
bcl
‑
2 g101v’)的慢病毒颗粒克隆到pclv
‑
cmv
‑
dest
‑
ires
‑
tagrfp中。将慢病毒颗粒(1
×
106)与8μg/ml的polybrene混合,并且通过在32℃的1小时的优化离心感染细胞法(spinoculation)转导,并且温育过夜。kms
‑
12
‑
pe达8天后,rs4;11达21天后;通过facs分选tagrfp阳性细胞。使用抗
‑
flag和抗
‑
bcl2抗体通过免疫印迹来监测bcl2表达。将细胞接种到96孔板中,并且用1:3.16系列稀释的化合物(9个不同浓度)处理。用abt
‑
199、化合物a和化合物b处理72小时后,使用celltiter
‑
试剂评估细胞活力。将结果标准化为无化合物的细胞(对照孔)的活力。c
50
值使用xcell软件中的非线性回归算法计算。
[0116]
结果
[0117]
[0118][0119]
结论
[0120]
这些结果表明,在使用两种不同细胞系的细胞测定中,abt
‑
199和化合物b之间的效力发生了变化。实际上,与过表达bcl
‑
2野生型蛋白的细胞系相比,在过表达bcl
‑
2g101v突变体的细胞系中观察到abt
‑
199的效力显著丧失(取决于细胞系,差异为41至12倍)。相反,化合物b在过表达g101v bcl
‑
2蛋白或野生型蛋白的细胞系之间仅显示9至7倍的差异。尽管化合物b和abt
‑
199在过表达野生型bcl
‑
2的两种细胞系中都表现出相似的效力,但是化合物b在过表达bcl
‑
2 g101v突变体的细胞系中显示比abt
‑
199高5至2倍的效力。
[0121]
实施例3:临床试验方案
[0122]
建立i期、开放标记、非随机、非比较性、多中心研究,以评价在复发或难治性急性髓样白血病、非霍奇金淋巴瘤、多发性骨髓瘤或慢性淋巴细胞白血病(cll)患者中静脉内施用的化合物b。特别地,本研究中包括的cll患者已经从维奈托克治疗且未建立替代疗法中复发或难以治疗(除了治疗失败,例如稳定疾病、无响应、进行性疾病、任何原因导致的死亡),如根据iwcll指南(hallek m等人,blood,2018,第131卷,25,2745
‑
2760)所确定。大约60名患者将参加该研究。该研究被设计成两部分:第一部分用于剂量递增(escalation),第二部分用于剂量扩大(expansion)。
[0123]
主要目的:
[0124]
根据安全性、pk和初步疗效结果确定化合物b在患有急性髓样白血病(aml)、非霍奇金淋巴瘤(nhl)、多发性骨髓瘤(mm)或慢性淋巴细胞白血病(cll)的患者中的安全性(包括剂量限制性毒性(dlt)和最大耐受剂量(mtd))和耐受性以及推荐的ii期剂量(rp2d(s))。
[0125]
次要目的:
[0126]
‑
确定化合物b在血浆和尿中的药代动力学(pk)性质。
[0127]
‑
使用适当的响应标准,对每个评价的群体(aml、nhl、mm、cll)评价化合物b的初步抗肿瘤活性。
[0128]
关于具有突变的cll患者的探索性目的:
[0129]
‑
通过比较以前接受过维奈托克的患有aml或cll的患者在治疗前和治疗中的骨髓抽吸物和血液样品,评估化合物b对含有bcl
‑
2突变(包括gly101val突变和asp103tyr突变)的细胞的效力。突变通过使用droplet digital pcr技术分析患者样品来检测(vogelstein和kinzler,proc.natl.acad.sci.usa 1999 96genetics;olmedillas
‑
l
ó
pez s等人,mol diagn ther.2017oct;21(5):493
‑
510)。
[0130]
试验药物:
[0131]
‑
化合物b将通过中心或外周静脉线路静脉内输注施用。
[0132]
‑
输注溶液将使用20ml小瓶制备,所述小瓶含有150mg如下所述与hp
‑
β
‑
环糊精一起配制的化合物b(以游离碱表示)。
[0133]
‑
可以基于初步安全性和pk数据来调整输注的持续时间。
[0134]
在20ml小瓶中制备溶于hp
‑
β
‑
环糊精的化合物b的冻干物:
[0135]
冻干物在20ml小瓶中制备,其可以在小瓶中重构为通过非肠道途径施用的溶液。它们通过将含有20mg/ml剂量的化合物b(游离碱)的20%cavitron
tm w7hp5溶液冷冻干燥而获得。
[0136]
方法
[0137]
在5l反应器中,称量1500g水。在磁力搅拌下,产生涡流,然后倒入600g cavitron
tm w7hp5中。在环境温度下搅拌介质直到环糊精完全溶解,并且加入68.16g
‘
化合物b,h2so4’
,并且加热溶液至不超过60℃,将混悬液在磁力搅拌下放置数小时,然后使介质的温度恢复至低于30℃。测量如此获得的溶液的ph,然后用缓慢倒入的0.5m naoh溶液将其调节至ph 3.0。在保持磁力搅拌的同时,通过加入水将溶液补充至3l体积。
[0138]
使如此获得的溶液通过0.2μm过滤器。
[0139]
用过滤后的溶液填充20ml小瓶,使得每个小瓶含有至少150mg化合物b(以游离碱表示),并且使样品经历冻干步骤。
[0140]
所得冻干物旨在用于制备用于非肠道施用的药物组合物。
[0141]
剂量分配方法:
[0142]
对于所有适应证组合并且由控制过量用药的剂量递增(ewoc)方法指导的bayesian hierarchical model(bhm)基于循环1期间dlt的出现用于指导剂量递增并且估计mtd。
[0143]
可选择的是,将使用由控制过量用药的剂量递增(ewoc)方法指导的adaptative bayesian hierarchical model(blrm)基于周期1期间dlt的出现进行剂量推荐,并且估计作为单一活性剂施用的化合物b的mtd/rp2d。
[0144]
治疗期:
[0145]
治疗的计划持续时间是直到疾病进展。患者可能由于不可接受的毒性而更早地中断使用研究药物的治疗和/或治疗根据研究者或患者的判断而中断。
[0146]
实施例4:化合物a和化合物b对bcl
‑
2野生型、gly101val突变体、bcl
‑
2 asp103tyr突变体、asp103val突变体、asp103glu突变体;arg129leu突变体和ala113gly突变体的亲和力数据
[0147]
荧光猝灭测定测量以下荧光强度的变化:
[0148]
(i)c
‑
末端cy5
‑
标记的bcl
‑
2野生型蛋白(初级登录号p10415),其具有氨基酸序列(seq id:02):
[0149]
[mghhhhhhhhsaglvprgsmahagrtgydnreivmkkyihyklsqrgyewdagdvgaappgaapapgifssqpghtphpaasrdpvartsplqtpaapgaaagpalspvppvvhltlrqagddfsrryrrdfaemssqlhltpftargrfatvveelfrdgvnwgrivaffefggvmcvesvnremsplvdnialwmteylnrhlhtwiqdnggwdafvely],
[0150]
其在c
‑
末端与氨基酸x连接,所述氨基酸x对应于如下定义的半胱氨酸,
[0151]
或者,
[0152]
(ii)bcl
‑
2 gly101val突变体,其具有氨基酸序列(seq id:03):
[0153]
[mghhhhhhhhsaglvprgsmahagrtgydnreivmkyihyklsqrgyewdagdvgaappgaapapgi
fssqpghtphpaasrdpvartsplqtpaapgaaagpalspvppvvhltlrqavddfsrryrrdfaemssqlhltpftargrfatvveelfrdgvnwgrivaffefggvmcvesvnremsplvdnialwmteylnrhlhtwiqdnggwdafvely],
[0154]
其在c
‑
末端与氨基酸x连接,所述氨基酸x对应于如下定义的半胱氨酸,
[0155]
或者,
[0156]
(iii)bcl
‑
2 asp103tyr突变体,其具有氨基酸序列(seq id:04):
[0157]
[mghhhhhhhhsaglvprgsmahagrtgydnreivmkyihyklsqrgyewdagdvgaappgaapapgifssqpghtphpaasrdpvartsplqtpaapgaaagpalspvppvvhltlrqagdyfsrryrrdfaemssqlhltpftargrfatvveelfrdgvnwgrivaffefggvmcvesvnremsplvdnialwmteylnrhlhtwiqdnggwdafvely],
[0158]
其在c
‑
末端与氨基酸x连接,所述氨基酸x对应于如下定义的半胱氨酸,
[0159]
或者,
[0160]
(iv)bcl
‑
2 asp103val突变体,其具有氨基酸序列(seq id:05):
[0161]
[mghhhhhhhhsaglvprgsmahagrtgydnreivmkyihyklsqrgyewdagdvgaappgaapapgifssqpghtphpaasrdpvartsplqtpaapgaaagpalspvppvvhltlrqagdvfsrryrrdfaemssqlhltpftargrfatvveelfrdgvnwgrivaffefggvmcvesvnremsplvdnialwmteylnrhlhtwiqdnggwdafvely],
[0162]
其在c
‑
末端与氨基酸x连接,所述氨基酸x对应于如下定义的半胱氨酸,
[0163]
或者,
[0164]
(v)bcl
‑
2 asp103glu突变体,其具有氨基酸序列(seq id:06):
[0165]
[mghhhhhhhhsaglvprgsmahagrtgydnreivmkyihyklsqrgyewdagdvgaappgaapapgifssqpghtphpaasrdpvartsplqtpaapgaaagpalspvppvvhltlrqagdefsrryrrdfaemssqlhltpftargrfatvveelfrdgvnwgrivaffefggvmcvesvnremsplvdnialwmteylnrhlhtwiqdnggwdafvely],
[0166]
其在c
‑
末端与氨基酸x连接,所述氨基酸x对应于如下定义的半胱氨酸,
[0167]
或者,
[0168]
(vi)bcl
‑
2 arg129leu突变体,其具有氨基酸序列(seq id:07):
[0169]
[mghhhhhhhhsaglvprgsmahagrtgydnreivmkyihyklsqrgyewdagdvgaappgaapapgifssqpghtphpaasrdpvartsplqtpaapgaaagpalspvppvvhltlrqagddfsrryrrdfaemssqlhltpftarglfatvveelfrdgvnwgrivaffefggvmcvesvnremsplvdnialwmteylnrhlhtwiqdnggwdafvely],
[0170]
其在c
‑
末端与氨基酸x连接,所述氨基酸x对应于如下定义的半胱氨酸,
[0171]
或者,
[0172]
(vii)bcl
‑
2 ala113gly突变体,其具有氨基酸序列(seq id:08):
[0173]
[mghhhhhhhhsaglvprgsmahagrtgydnreivmkyihyklsqrgyewdagdvgaappgaapapgifssqpghtphpaasrdpvartsplqtpaapgaaagpalspvppvvhltlrqagddfsrryrrdfgemssqlhltpftargrfatvveelfrdgvnwgrivaffefggvmcvesvnremsplvdnialwmteylnrhlhtwiqdnggwdafvely],其在c
‑
末端与氨基酸x连接,
[0174]
(其中x=是用来自lumiprobe gmbh目录号13380的磺基
‑
花青5在硫上标记的半胱
asp103val和bcl
‑
2 asp103glu突变体的活性显著丧失,而化合物a和化合物b的亲和力受突变影响轻微。化合物b的亲和力受arg129leu和ala113gly突变的中等影响。尽管如此,化合物b对arg129leu和ala113gly突变体的效力分别比abt
‑
199强12倍和4倍。
[0184]
实施例5:化合物b和abt
‑
199在表达asp103tyr突变体的修饰细胞中的体外细胞毒性
[0185]
材料和方法
[0186]
细胞系在供应商推荐的培养基中,在37℃的潮湿气氛和5%co2下生长。来自leibniz
‑
institute dsmz(braunschweig,germany)的kms
‑
12
‑
pe(acc 606)。将含有在d103y突变的bcl
‑
2的慢病毒颗粒克隆到pclv
‑
cmv
‑
dest
‑
ires
‑
tagrfp中。将慢病毒颗粒(1
×
106)与8μg/ml的polybrene混合,并且通过在32℃的1小时的优化离心感染细胞法转导,并且温育过夜。在8天后,通过facs分选tagrfp阳性
‑
kms
‑
12
‑
pe细胞。使用抗
‑
flag和抗
‑
bcl
‑
2抗体通过免疫印迹监测bcl
‑
2表达。将细胞接种到96孔板中,并且在9个点用1:3.16系列稀释的化合物处理。用abt
‑
199和化合物b处理72小时后,使用celltiter
‑
试剂评估细胞活力。将结果标准化为无化合物的细胞(对照孔)的活力。c
50
值使用xcell软件中的非线性回归算法计算。
[0187]
结果
[0188]
化合物kms
‑
12
‑
pe bcl
‑
2 d103y(c50;nm)化合物b83.7abt
‑
1991830
[0189]
结论
[0190]
这些结果表明,在使用过表达bcl2 d103y的kms
‑
12
‑
pe细胞系的细胞测定中,abt
‑
199和化合物b之间的效力发生了变化。在过表达bcl
‑
2 d103y突变体的细胞系中,化合物b显示比abt
‑
199高约22倍的效力。
[0191]
目前使用相同的方案建立过表达其它bcl
‑
2临床突变体(包括d103v、d103e、r129l和a113g突变体)的细胞系,以评价上述化合物。
[0192]
基于衍生自表达bcl
‑
2突变体的修饰细胞(包括实施例2和5中描述的修饰细胞系)的异种移植物模型的进一步的体内试验可以显示化合物b可以是治疗bcl
‑
2介导的携带bcl
‑
2突变(例如g101v和/或d103y和/或其它)的癌症的有效疗法。
[0193]
通过使用细胞活力测定法测试化合物b在来自cll患者的离体样品中的效力可以获得另外的结果,所述cll患者携带选自g101v、d103y、d103v、d103e、r129l和a113g的bcl
‑
2突变中的至少一种。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1