CD47肿瘤选择性结合的抗体工程的制作方法
cd47肿瘤选择性结合的抗体工程
技术领域
1.本文提供了用于治疗受经历异常增殖的细胞影响的病理状况的肿瘤选择性抗体、药物组合物和方法,所述病理状况包括血液肿瘤状况、血液恶性肿瘤、淋巴组织增殖性病症、b细胞病症、b细胞恶性肿瘤和b细胞淋巴瘤。
2.相关专利申请的交叉引用
3.根据35u.s.c.
§
119(e),本技术拥有2019年4月5日提交的美国临时申请第62/830,335号的优先权,该申请据此全文以引用方式并入本文。
4.序列表
5.即时应用程序包含已通过efs-web以ascii格式提交并据此全文以引用方式并入的序列表。创建于2020年3月26日的ascii副本名为298068-314_sequence_listing.txt,大小为407千字节。
背景技术:
6.在过去的十年中,针对抑制性免疫检查点的阻断剂的使用一直是抗癌治疗中最重要的进展之一(sharpe ah.introduction to checkpoint inhibitors and cancer immunotherapy.immunol rev.2017年3月;276(1):5-8)。ctla-4和pd-1阻断所获得的令人兴奋的结果导致对可在抗癌治疗中靶向的若干先天免疫检查点,特别是调节巨噬细胞功能的途径进行评估。巨噬细胞表达与cd47相互作用的sirpα,cd47是一种遍在表达的蛋白质,介导“不要吃我”信号,其功能是抑制吞噬作用。cd47的表达赋予对巨噬细胞吞噬抗体结合的肿瘤细胞的抵抗力。在没有cd47与sirpα结合的情况下,可以结合巨噬细胞上的fc受体的抗体可以增强这些细胞的吞噬作用。癌细胞已经进化成通过上调这些癌细胞的细胞表面cd47的表达来挟制这种相互作用,从而抵消促吞噬信号并增加逃避先天免疫监视的机会(matlung hl、szilagyi k、barclay na、van den berg tk.the cd47-sirpαsignaling axis as an innate immune checkpoint in cancer.immunol rev.2017年3月;276(1):145-164)。因此,阻断cd47-sirpα相互作用代表一种活化体内肿瘤细胞的吞噬清除的有前景的治疗策略。若干种sirpα
–
cd47阻断剂,包括人源化和全人抗cd47抗体、抗sirpα抗体、与人igg fc部分融合的可溶性sirpα二聚体、不含fc部分的高亲和力单体sirpα和抗cd47抗体(纳米抗体)的骆驼衍生的单体片段,已在体外和临床前研究中显示出针对各种类型人类肿瘤的功效(veillette a、chen a.,sirpα-cd47 immune checkpoint blockade in anticancer therapy.trends in immunology,2018,39(3):173-184)。一些sirpα
–
cd47阻断剂,包括cc-90002(抗cd47)、forty seven的抗cd47(hu5f9-g4)和trillium的sirpα-融合fc,已分别在i期和ii期临床试验中进行了测试(veillette a、tang z.signaling regulatory protein(sirp)α-cd47 blockade joins the ranks of immune checkpoint inhibition.j clin oncol.2019年2月27日:jco190012)。临床上的这些方法受到对联合治疗(例如利妥昔单抗)的需求、使用高亲和力结合剂靶向cd47的组织下沉(即存在与治疗性抗体结合的非肿瘤细胞,从而降低抗体对肿瘤细胞的生物有效性)以及观察到的某些临床
分子的血液学毒性(贫血、嗜中性白细胞减少症和/或血小板减少症)的限制。重要的是,虽然确实探索了蛋白质疗法来治疗多种疾病,但生物制药实体在施用于受试者时可以引发涉及产生抗实体抗体的免疫反应,这会导致功效和/或毒性降低。
技术实现要素:
7.本发明涉及一种抗体,所述抗体包含以低亲和力结合cd47的至少一个fab部分和以高亲和力结合cd20的至少一个fab部分;其中双特异性抗体在肿瘤细胞中选择性地结合cd47并且在正常细胞中基本上不与cd47结合。
8.例如,当通过表面等离子体共振(spr)测量为kd(解离常数)时,本文所描述的以低亲和力结合cd47的fab部分通常表现出约0.1μm和约25μm之间的与cd47的亲和力。本文所描述的以低亲和力结合cd47的fab部分表现出约0.25μm至约20μm的与cd47的亲和力。某些优选的实施方案表现出约0.4μm至约4.0μm的与cd47的亲和力。某些实施方案表现出约1μm至约3.0μm的与cd47的亲和力。在一些实施方案中,例如,结合cd47的fab部分表现出约0.1μm至约5.0μm的与cd47的亲和力。在一些实施方案中,结合cd47的fab部分表现出约0.1μm至约0.2μm、0.3μm、0.4μm、0.5μm、0.6μm、0.7μm、0.8μm、0.9μm、1.0μm、1.1μm、1.2μm、1.3μm、1.4μm、1.5μm、1.7μm、1.8μm、1.9μm、2.0μm、2.1μm、2.2μm、2.3μm、2.4μm、2.5μm、2.6μm、2.7μm、2.8μm、2.9μm、3.0μm、3.1μm、3.2μm、3.3μm、3.4μm、3.5μm、3.6μm、3.7μm、3.8μm、3.9μm、4.0μm、4.1μm、4.2μm、4.3μm、4.4μm、4.5μm、4.6μm、4.7μm、4.8μm、4.9μm或约5.0μm的与cd47的亲和力。
9.在一些实施方案中,结合cd47的fab部分表现出约0.2μm至约4.0μm的与cd47的亲和力。在另外的实施方案中,结合cd47的fab部分表现出约0.5μm至约3.5μm的与cd47的亲和力。在另外的实施方案中,结合cd47的fab部分表现出约1.0μm至约3.0μm的与cd47的亲和力。
10.本发明进一步涉及一种抗体,所述抗体包含结合cd47的至少一个fab部分和结合cd20的至少一个fab部分;其中结合cd47的所述fab部分表现出与cd47的低亲和力;并且,其中结合cd20的所述fab部分表现出与cd20的高亲和力;并且,其中所述双特异性抗体在肿瘤细胞中选择性地结合cd47并且在正常细胞中基本上不与cd47结合;并且,其中所述抗体活化对表达cd20的肿瘤细胞的抗体依赖性细胞吞噬作用。
11.本发明进一步涉及一种抗体,所述抗体包含结合cd47的至少一个fab部分和结合cd20的至少一个fab部分;其中结合cd47的所述fab部分表现出与cd47的低亲和力;并且,其中结合cd20的所述fab部分表现出与cd20的高亲和力;并且,其中所述双特异性抗体在肿瘤细胞中选择性地结合cd47并且在正常细胞中基本上不与cd47结合;并且,其中所述抗体介导表达cd20的肿瘤细胞的补体依赖性细胞毒性(cdc)。
12.本发明进一步涉及一种抗体,所述抗体包含结合cd47的至少一个fab部分和结合cd20的至少一个fab部分;其中结合cd47的所述fab部分表现出与cd47的低亲和力;并且,其中结合cd20的所述fab部分表现出与cd20的高亲和力;并且,其中所述双特异性抗体在肿瘤细胞中选择性地结合cd47并且在正常细胞中基本上不与cd47结合;并且,其中所述抗体介导表达cd20的肿瘤细胞的抗体依赖性细胞毒性(adcc)。
13.本发明进一步涉及本文所描述的igg1 1+1异二聚体的单体元件,所述单体元件含
id no:215、seq id no:217、seq id no:219、seq id no:221、seq id no:223、seq id no:225、seq id no:227、seq id no:229、seq id no:231、seq id no:233、seq id no:235、seq id no:237、seq id no:239、seq id no:241、seq id no:243、seq id no:245、seq id no:247、seq id no:249、seq id no:251、seq id no:253、seq id no:255、seq id no:257、seq id no:259、seq id no:261、seq id no:263、seq id no:265、seq id no:267、seq id no:269、seq id no:271、seq id no:273、seq id no:275、seq id no:277、seq id no:279、seq id no:281、seq id no:283、seq id no:285、seq id no:287、seq id no:289、seq id no:291、seq id no:293、seq id no:295、seq id no:297、seq id no:299、seq id no:301、seq id no:303、seq id no:305、seq id no:307、seq id no:309、seq id no:311、seq id no:313、seq id no:315、seq id no:317、seq id no:319,和seq id no:321组成的组;以及,
18.(ii)重链可变区(vh)区,所述(vh)区选自由seq id no:2、seq id no:4、seq id no:6、seq id no:8、seq id no:10、seq id no:12、seq id no:14、seq id no:16、seq id no:18、seq id no:20、seq id no:22、seq id no:24、seq id no:26、seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38、seq id no:40、seq id no:42、seq id no:44、seq id no:46、seq id no:48、seq id no:50、seq id no:52、seq id no:54、seq id no:56、seq id no:58、seq id no:60、seq id no:62、seq id no:64、seq id no:66、seq id no:68、seq id no:70、seq id no:72、seq id no:74、seq id no:76、seq id no:78、seq id no:80、seq id no:82、seq id no:84、seq id no:86、seq id no:88、seq id no:90、seq id no:92、seq id no:94、seq id no:96、seq id no:98、seq id no:100、seq id no:102、seq id no:104、seq id no:106、seq id no:108、seq id no:110、seq id no:112、seq idno:114、seq id no:116、seq id no:118、seq id no:120、seq id no:122、seq id no:124、seq id no:126、seq id no:128、seq id no:130、seq id no:132、seq id no:134、seq id no:136、seq id no:138、seq id no:140、seq idno:142、seq id no:144、seq id no:146、seq id no:148、seq id no:150、seq id no:152、seq id no:154、seq id no:156、seq id no:158、seq id no:160、seq id no:162、seq id no:164、seq id no:166、seq id no:168、seq idno:170、seq id no:172、seq id no:174、seq id no:176、seq id no:178、seq id no:180、seq id no:182、seq id no:184、seq id no:186、seq id no:188、seq id no:190、seq id no:192、seq id no:194、seq id no:196、seq idno:198、seq id no:200、seq id no:202、seq id no:204、seq id no:206、seq id no:208、seq id no:210、seq id no:212、seq id no:214、seq id no:216、seq id no:218、seq id no:220、seq id no:222、seq id no:224、seq idno:226、seq id no:228、seq id no:230、seq id no:232、seq id no:234、seq id no:236、seq id no:238、seq id no:240、seq id no:242、seq id no:244、seq id no:246、seq id no:248、seq id no:250、seq id no:252、seq idno:254、seq id no:255、seq id no:258、seq id no:260、seq id no:262、seq id no:264、seq id no:266、seq id no:268、seq id no:270、seq id no:272、seq id no:274、seq id no:276、seq id no:278、seq id no:280、seq idno:282、seq id no:284、seq id no:286、seq id no:288、seq id no:290、seq id no:292、seq id no:294、seq id no:296、seq id no:298、seq id no:300、seq id no:302、seq id no:304、seq id no:306、seq id no:308、seq id no:310、seq id no:312、seq id no:314、seq id no:316、seq id no:318、seq id no:320和
seq id no:322组成的组。
19.本发明进一步涉及一种双特异性抗体,其中结合cd20的fab部分包含抗cd20 vl cdr rasssvsyih(cdrl1;seq id no:353)、atsnlas(cdrl2;seq id no:354)、qqwtsnppt(cdrl3;seq id no:355);和vh cdr synmh(cdrh1;seq id no:356)、aiypgngdtsynqkfkg(cdrh2;seq id no:357)、styyggdwyfnv(cdrh3;seq id no:358)。
20.本发明进一步涉及一种双特异性抗体,其中结合cd20的fab部分包含抗cd20 lc(seq id no:331)和抗cd20 hc(seq id no:332)。
21.本发明进一步涉及一种双特异性抗体,其中结合cd47的fab部分包含轻链可变区(vl)区,所述(vl)区包含vl cdr qasqdihryls(cdrl1;seq id no:359)、resrfvd(cdrl2;seq id no:360)和lqydefpyt(cdrl3;seq id no:361);以及重链可变区(vh)区,所述vh区包含vh cdr dyylh(cdrh1;seq id no:362)、widpdqgdtyyaqkfqg(cdrh2;seq id no:363)、aygessypmdy(cdrh3;seq id no:364)。
22.本发明进一步涉及一种双特异性抗体,其中结合cd47的fab部分包含轻链可变区(vl)区,所述(vl)区包含vl cdr rasqdihryls(cdrl1;seq id no:365)、resrfvd(cdrl2;seq id no:366)、lqydefpyt(cdrl3;seq id no:367);以及重链可变区(vh)区,所述vh区包含vh cdr dyylh(cdrh1;seq id no:368)、widpdqgdtyyaqkfqg(cdrh2;seq id no:369)、aygessypmdy(cdrh3;seq id no:370)。
23.本发明进一步涉及一种双特异性抗体,其中结合cd47的fab部分包含轻链可变区(vl)区,所述(vl)区包含vl cdr rasqdihryls(cdrl1;seq id no:371)、ranrlvs(cdrl2;seq id no:372)、lqydefpyt(cdrl3;seq id no:373);以及重链可变区(vh)区,所述vh区包含vh cdr dyylh(cdrh1;seq id no:374)、widpdqgdtyyaqkfqg(cdrh2;seq id no:375)、aygessypmdy(cdrh3;seq id no:376)。
24.本发明进一步涉及一种双特异性抗体,其中结合cd47的fab部分包含vl(seq id no:317);和vh(seq id no:318)。
25.本发明进一步涉及一种双特异性抗体,其中结合cd47的fab部分包含vl(seq id no:319);和vh(seq id no:320)。
26.本发明进一步涉及一种双特异性抗体,其中结合cd47的fab部分包含vl(seq id no:321);和vh(seq id no:322)。
27.本发明进一步涉及一种双特异性抗体,其中结合cd47的fab部分包含lc(seq id no:333)和hc(seq id no:334)。
28.本发明进一步涉及一种双特异性抗体,其中结合cd47的fab部分包含lc(seq id no:335)和hc(seq id no:336)。
29.本发明进一步涉及一种双特异性抗体,其中结合cd47的fab部分包含lc(seq id no:337)和hc(seq id no:338)。
30.此外,本发明涉及一种用于控制肿瘤细胞的药物组合物,用于给药有此需要的患者,所述药物组合物包含本文所描述的双特异性实体。
31.此外,本发明涉及一种用于治疗b细胞病症或b细胞恶性肿瘤的药物组合物,用于给药有此需要的患者,所述药物组合物包含本文所描述的双特异性实体。
32.本发明进一步涉及一种控制肿瘤细胞的方法,所述方法包括向有此需要的患者给
药有效量的本文所描述的双特异性实体。
33.此外,本发明涉及一种治疗b细胞病症或b细胞恶性肿瘤的方法,所述方法包括向有此需要的患者给药有效量的本文所描述的双特异性实体。
附图说明
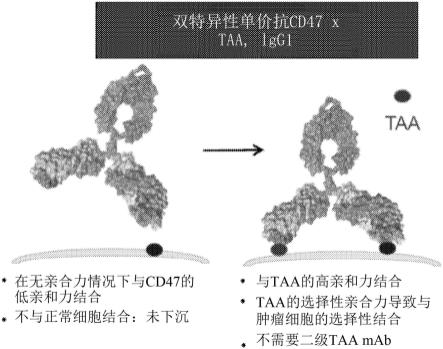
34.图1是本文所描述的双特异性实体的某些属性的示意图,所述双特异性实体被工程改造以克服普遍存在的cd47表达的挑战,包括在无亲合力情况下与cd47的低亲和力结合;与正常细胞的最小结合,即没有组织下沉;与cd20的高亲和力选择性亲合力结合,这导致与肿瘤细胞的选择性结合。taa:肿瘤相关抗原
35.图2示出了示例双特异性实体架构、蛋白质工程特征和若干生物药理学属性。
36.图3a至图3c显示了本文所描述的示例物种双特异性实体诱导巨噬细胞介导的对cd20+cd47+oci-ly3 nhl细胞的吞噬作用。图3a至图3b是根据抗体浓度显示吞噬巨噬细胞的百分比的图。图3c是显示本文所描述的双特异性物种的kd和ec50值的表。
37.图4a至图4c显示了示例双特异性实体(本文所描述的cd47xcd20 igg1物种)展示cdc功能。图4a至图4b是根据抗体浓度显示cdc的图。图4c是显示tpp-1360、tpp-1362和利妥昔单抗的平均ec50值的表。
38.图5a至图5c显示了示例双特异性实体(本文所描述的cd47xcd20 igg1物种)在cd20高nhl细胞中展示有效的adcc功能,即显着高于利妥昔单抗。图5a至图5b是根据抗体浓度显示细胞毒性的图。图5c是显示cd20/cd47比率的表。
39.图6示出了本文所描述的双特异性实体的示例架构以及某些示例的特征。
40.图7显示了本文所描述的示例物种双特异性实体tpp-1360,其将结合信号基本上转移至b细胞,而相当弱地转移至t细胞、单核细胞和nk细胞,与tpp-23(408_437fab(vl:seq id no:899;vh:seq id no:900)与iggl)的结合相比,与血小板或红细胞的结合极少或没有结合,从而说明与人全血中的b细胞的选择性结合。
41.图8示出了本文所描述的示例物种双特异性实体tpp-1360,其被展示为选择性结合cd47
+
/cd20
+
raji细胞但不结合cd47
+
/cd20-人红细胞(rbc)。
42.图9显示,在raji细胞和人rbc的共培养物中,本文所描述的示例物种双特异性实体tpp-1360显示出与cd47
+
/cd20
+
raji细胞的剂量依赖性结合,但不与人rbc结合,即使浓度高达1mg/ml。
43.图10示出了tpp-1360例如有效且完全阻断重组人sirpα-fc与在cd20
+
/cd47
+
淋巴瘤细胞系oci-ly3表面上表达的人cd47的结合。
44.图11示出了tpp-1360例如有效且完全阻断重组人sirpα-fc与在cd20
+
/cd47
+
淋巴瘤细胞系raji表面上表达的人cd47的结合。
45.图12示出了用tpp-1360进行的治疗例如诱导巨噬细胞介导的对cd20
+
恶性b细胞系raji的吞噬作用。
46.图13示出了用tpp-1360进行的治疗例如诱导巨噬细胞介导的对cd20
+
恶性b细胞系oci-ly3的吞噬作用。
47.图14示出了用tpp-1360进行的治疗例如诱导巨噬细胞介导的对cd20
+
恶性b细胞系rec-1的吞噬作用。
48.图15示出了用tpp-1360进行的治疗例如诱导巨噬细胞介导的对cd20
+
恶性b细胞系riva的吞噬作用。
49.图16显示,例如,在raji和oci-ly3细胞中,用tpp-1360进行的治疗比利妥昔单抗触发明显更有效的吞噬作用,这可能是由于通过tpp-1360同时阻断sirpα-cd47相互作用并参与活化受体,诸如fcγr。
50.图17显示了如通过表面等离子体共振(spr)测量的利妥昔单抗和诸如tpp-1360的双特异性抗体例如与raji细胞(cd20+/cd47+)的结合。
51.图18显示了外基质抗体免疫原性量表。
52.图19显示了在raji异种移植模型中用tpp-1362和利妥昔单抗进行的治疗。
53.图20显示了在raji异种移植模型中用tpp-1360和利妥昔单抗进行的治疗。
54.图21示出了tpp-1360和tpp-1362,例如有效且完全阻断重组人sirpα与在cd20
+
/cd47
+
淋巴瘤细胞系oci-ly3表面上表达的人cd47的结合。发现了利妥昔单抗对sirpα结合没有影响。
具体实施方式
55.除非另有定义,否则本文所用的所有技术和科学术语具有与本发明所属领域的技术人员通常所理解相同的含义。本文提及的所有公开案和专利均以引用方式并入。
56.如本文所用,冠词“一(a和an)”可以指代冠词的语法对象中的一个或多于一个(例如至少一个)。
57.如本文所用,“约”通常可以指代考虑到测量性质或精度所测量的量的可接受误差度。示例误差度在给定值或值范围的5%以内。
58.本文描述为“包括”一个或多个特征的实施方案也可以被认为是对“由这些特征组成”和/或“基本上由这些特征组成”的相应实施例的公开。
59.如本文所用,“与cd47的低亲和力”是指当通过spr体外测量为kd时,低于约25μm,例如约0.05μm至约25μm的与cd47的亲和力。
60.如本文所用,“与cd20的高亲和力”是指等于或高于约0.4nm,例如约0.4nm至约12nm的与cd20的亲和力。在一些实施方案中,“与cd20的高亲和力”是指约0.4nm至约5nm的与cd20的亲和力。
61.本文所描述的双特异性实体在肿瘤细胞上选择性地结合cd47并且在正常细胞中基本上不与cd47结合。如本文所用,“基本上不与cd47结合”通常是指在(cd20-/cd47+)正常细胞上结合小于5%的cd47。本文所描述的双特异性实体在(cd20-/cd47+)正常细胞上结合小于2%的cd47。参见实施例5。换句话说,本文所描述的实体通常表现出与(cd20+/cd47+)细胞95%或更高的结合。本文所描述的实体表现出与(cd20+/cd47+)细胞98%或更高的结合。
62.如本文所用,术语“药学上可接受”是指经联邦或州政府的监管机构批准,或在美国药典、欧洲药典或其他普遍认可的药典中列出用于动物,更特别地用于人类。
63.浓度、量、体积、百分比和其他数值可以在本文中以范围形式呈现。还应理解,这种范围形式仅出于方便和简洁而使用,应灵活解释为不仅包括明确列举为范围限制的数值,而且还包括所有单独的数值或包含在该范围内的子范围,如同明确列举每个数值和子范
围。
64.考虑了本发明的抗体的氨基酸序列中的微小变化被本发明所涵盖,条件是氨基酸序列中的变化保持与本文提供的抗体或其抗原结合片段的序列至少75%、至少80%、至少90%、至少95%或至少98%或99%的序列同源性或同一性。
65.本发明的抗体可包括变体,其中来自一个物种的氨基酸残基在保守或非保守位置取代另一物种中的相应残基。在一个实施方案中,非保守位置的氨基酸残基被保守或非保守残基取代。特别地,考虑了保守氨基酸置换。
66.如本文所用,“保守氨基酸置换”是指其中氨基酸残基被具有相似侧链的氨基酸残基置换的保守氨基酸置换。具有相似侧链的氨基酸残基家族已在本领域中定义,包括碱性侧链(例如赖氨酸、精氨酸或组氨酸)、酸性侧链(例如天冬氨酸或谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸或半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸或色氨酸)、β-支链侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香侧链(例如酪氨酸、苯丙氨酸、色氨酸或组氨酸)。因此,如果多肽中的氨基酸被来自同一侧链家族的另一个氨基酸置换,则认为氨基酸取代是保守的。在本发明的抗体中包括保守修饰的变体不排除其他形式的变体,例如多态变体、种间同源物和等位基因。
67.如本文所用,“非保守氨基酸取代”包括其中(i)具有电正性侧链的残基(例如精氨酸、组氨酸或赖氨酸)取代电负性残基(例如谷氨酸或天冬氨酸)或被其取代,(ii)亲水残基(例如丝氨酸或苏氨酸)取代疏水残基(例如丙氨酸、亮氨酸、异亮氨酸、苯丙氨酸或缬氨酸)或被其取代,(iii)半胱氨酸或脯氨酸取代任何其他残基或被其取代,或(iv)具有庞大疏水或芳香侧链的残基(例如缬氨酸、组氨酸、异亮氨酸或色氨酸)取代具有较小侧链的残基(例如丙氨酸或丝氨酸)或无侧链的残基(例如甘氨酸)或被其取代的那些。
68.如本文所用,术语“抗体(antibody和antibodies)”是指常规同种型和单特异性形式以及多价抗体,包括但不限于本领域已知的当前双特异性实体形式以及双特异性抗体,包括但不限于本文另有描述的形式。
69.典型抗体包含至少两条“轻链”(lc)和两条“重链”(hc)。这种抗体的轻链和重链是由若干结构域组成的多肽。每条重链包含重链可变区(本文中缩写为“vh”)和重链恒定区(本文中缩写为“ch”)。重链恒定区包含重链恒定结构域ch1、ch2和ch3(抗体类别iga、igd和igg)和任选的重链恒定结构域ch4(抗体类别ige和igm)。每条轻链包含轻链可变结构域(本文中缩写为“vl”)和轻链恒定结构域(本文中缩写为“cl”)。可变区vh和vl可以进一步细分为高度可变区,称为互补决定区(cdr),其中散布更保守的区,称为框架区(fr)。每个vh和vl由三个cdr和四个fr组成,从氨基末端到羧基末端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的“恒定结构域”不直接参与抗体与靶标的结合,但表现出各种效应子功能。
70.抗体与其靶抗原或表位之间的结合由互补决定区(cdr)介导。cdr是具有高度序列可变性的区域,位于抗体重链和轻链的可变区内,在那里形成抗原结合位点。cdr是抗原特异性的主要决定因素。通常,抗体重链和轻链各自包含三个非连续排列的cdr。抗体重链和轻链cdr3区在根据本发明的抗体的结合特异性/亲和力中起到特别重要的作用,并且因此提供了本发明的另一方面。
71.因此,如本文所用,术语“抗原结合片段”包括抗原结合多肽的任何天然存在或人工构造的构型,该抗原结合多肽包含一个、两个或三个轻链cdr和/或一个、两个或三个重链cdr,其中多肽能够与抗原结合。
72.cdr的序列可以通过参考本领域已知的任何数字系统来鉴定,例如kabat系统(kabat,e.a.等人,sequences of proteins of immunological interest,5th ed.,public health service,national institutes of health,bethesda,md(1991);chothia系统(chothia&,lesk,“canonical structures for the hypervariable regions of immunoglobulins,”j.mol.biol.196,901
–
917(1987));或imgt系统(lefranc等人,“imgt unique numbering for immunoglobulin and cell receptor variable domains and ig superfamily v-like domains,”dev.comp.immunol.27,55
–
77(2003))。根据kabat,本文所示的cdr采用边界,即大小。本文所描述和提及的抗体恒定区的位置编号通常根据kabat。然而,本文所描述的抗cd47 vl和vh区的编号(即抗体残基位置和取代位置)从每个可变区(即vl或vh)的n端残基开始,特别是分别参考seq id no:325和seq id no:326。
[0073]“本文所描述的双特异性实体”通常是指本文所描述的功能定义的抗体、双特异性元件形式、元件序列、抗体和抗体种类。
[0074]
如本文所用,术语“fab部分”或“臂”是指抗体的抗原结合片段,即结合抗原的抗体区域。如本文所用,它包含轻链和重链(vl/vh)各自的一个可变结构域。
[0075]“fab'片段”包含单条轻链和单条重链,但除了ch1和vh之外,“fab'片段”还包含ch1和ch2结构域之间的重链区域,这是形成链间二硫键所需的。因此,两个“fab'片段”可以通过形成二硫键来缔合以形成f(ab')2分子。
[0076]“f(ab')2片段”包含两条轻链和两条重链。每条链包括在两条重链之间形成链间二硫键所必需的恒定区的一部分。
[0077]“fv片段”仅包含重链和轻链的可变区。它不包含恒定区。
[0078]“单结构域抗体”是含有单个抗体结构域单元(例如,vh或vl)的抗体片段。
[0079]“单链fv”(“scfv”)是含有抗体的vh和vl结构域的抗体片段,它们连接在一起形成单链。多肽连接子通常用于连接scfv的vh和vl结构域。
[0080]“串联scfv”,也称为是一种单链fv分子,由两个scfv以串联取向与柔性肽连接子共价结合而形成。
[0081]“双特异性t细胞衔接器”是由单个肽链上的两个单链可变片段(scfv)组成的融合蛋白。scfv中的一个通过cd3受体与t细胞结合,而另一个与肿瘤细胞抗原结合。
[0082]“双体抗体”是小的二价和双特异性抗体片段,其包含连接到同一条多肽链(vh-vl)上的轻链可变域(vl)的重链可变域(vh),该vh-vl由过短而无法允许在同一条链上两个结构域之间配对的肽连接体连接(kipriyanov,int.j.cancer 77(1998),763-772)。这迫使与另一条链的互补结构域配对并促进具有两个功能性抗原结合位点的二聚分子的组装。
[0083]“darpin”是双特异性锚蛋白重复分子。darpin源自天然锚蛋白,其可以在人类基因组中找到,并且是最丰富的结合蛋白类型之一。darpin库模块由天然锚蛋白重复蛋白序列定义,使用229个锚蛋白重复进行初始设计并使用另外2200个进行后续改进。这些模块用作darpin库的构建块。库模块类似于人类基因组序列。一个darpin由4到6个模块组成。因为每个模块为大约3.5kda,所以平均darpin大小为16-21kda。结合剂的选择通过核糖体展示
90002vh作为cc-90002完整hc/iggl(seq id no:328)。
[0092]
cc-90002的vh和vl区均经过工程改造以降低免疫原性,同时保留用于本文所描述的双特异性实体的功能。
[0093]
例如,表明本文所描述和例示的双特异性实体克服了单一药剂抗cd47 mab疗法的挑战。由于与cd47的失调亲和力,本文所描述和提供的cd47xcd20双特异性实体优先与cd20
+
肿瘤相关抗原(taa)细胞结合,从而降低由cd47
+
细胞介导的下沉效应和非肿瘤靶向毒性。细胞效力、体内功效和安全性数据一起表明,例如,本文所描述和例示的cd47xcd20双特异性抗体作为用于cd20阳性b细胞恶性肿瘤的单一药剂提供了独特的选择。
[0094]
图1是本文所描述的双特异性实体的某些属性的示意图,所述双特异性实体被工程改造以克服普遍存在的cd47表达的挑战,包括在无亲合力情况下与cd47的低亲和力结合;与正常细胞的最小结合,即没有组织下沉;与肿瘤相关抗原(taa)cd20的高亲和力选择性亲合力结合,这导致与肿瘤细胞的选择性结合。
[0095]
本文提供的cd47xcd20双特异性抗体可包含来自任何高亲和力cd20结合剂的cd20结合结构域。利妥昔单抗lc(seq id no:329)和hc(seq id no:330)是用于构建本文所描述的双特异性实体的抗cd20元件的优选来源。在某些实施方案中,本文提供的双特异性抗体包含利妥昔单抗vl(seq id no:323)和vh(seq id no:324)之一或两者,或分别包含利妥昔单抗vl cdr:seq id no:353(cdrl1)、seq id no:354(cdrl2)和seq id no:355(cdrl3);以及利妥昔单抗vh cdr:seq id no:356(cdrh1)、seq id no:357(cdrh2)和seq id no:358(cdrh3)。如本文另外描述的抗cd20 igg1 lc和hc恒定区分别与利妥昔单抗vl(seq id no:323)和利妥昔单抗vh(seq id no:324)的羧基末端融合。抗cd20 lc(seq id no:331)优选用于构建本发明的双特异性实体。抗cd20 hc(seq id no:332)优选用于构建本发明的双特异性实体。
[0096]
本文所描述的示例双特异性实体选择性地且安全地靶向cd20+肿瘤细胞,基本上不与外周组织、rbc和血小板中的cd47结合,从而提供延长的半衰期和较低的毒性,并且其中抗体介导肿瘤细胞的补体依赖性细胞毒性(cdc)。
[0097]
双特异性实体优选地具有igg1 1+1异二聚体形式。
[0098]
在某些实施方案中,本文提供的双特异性抗体包含共价连接以形成单个实体的两个抗原结合臂。采用两个fab结构域的igg双特异性抗体需要仔细考虑表达和纯化策略,以确保正确组装所需产品。可以在遗传水平上努力使所需双特异性抗体的表达有所偏向。例如,已经描述了igg fc的ch3结构域中用以驱动fc的异二聚化的取代。此外,杵臼结构策略利用空间位阻在两个不同的fc ch3结构域之间创建互补的不对称分子形貌。本领域已知的其他策略采用静电互补来驱动特异性。或者,可以使用野生型igg支架,并且可以在蛋白质纯化期间分离所得的产物组合以隔离所需的产物。
[0099]
本发明的优选双特异性抗体基本上是天然的人iggl抗体,其由(a)含有一条完整的轻链(lc)和一条完整的重链(hc)的一个抗cd47 iggl(单体)部分以及(b)含有一条完整的轻链(lc)和一条完整的重链(hc)的一个抗cd20 igg1(单体)部分组成。这两个单体形成常规的二聚igg1抗体,其中一个臂(fab1)提供cd47的减弱结合,而另一个臂(fab2)提供与cd20的亲和力结合和亲合力。图2和图6示出了本文所描述的cd47xcd20示例架构和示例蛋白质工程特征。
id no:346包含取代a139w、l143e、k145t、q179e、t371v、l372y、f436a和y438v,其在产生igg1 1+1异二聚体形式期间减少同二聚体的形成。cd47xcd20双特异性抗体
[0110]
启动cd47xcd20双特异性程序以鉴定能够仅在表达cd20的细胞上阻断人类cd47与sirpα结合的治疗性抗体。由该项目产生并在本文中提供的示例以高亲和力与cd20结合,同时表现出与cd47的失调亲和力。一旦与肿瘤细胞上的cd20结合,抗体就可以有效地阻断cd47-sirpα相互作用,并通过igg1 fc共同参与活化效应细胞上的受体fcγr,从而导致活化巨噬细胞介导的吞噬作用和自然杀伤(nk)细胞介导的对肿瘤细胞的细胞毒性。
[0111]
包含源自cc-90002的抗cd47的双特异性抗体
[0112]
cd47表位作图和cc-90002
[0113]
通过以分辨率解析与人cd47胞外结构域复合的非失调亲本版本cc-90002(408_437)fab(vl:seq id no:387;vh:seq id no:388)的晶体结构来确定抗cd47表位。全部三个轻链(lc)cdr(seq id no:347、seq id no:348、seq id no:349)以及重链(hc)cdr2(seq id no:351)和hc cdr3(seq id no:352)参与了与cd47 ecd的大比表面结合。hc cdr与cd47的kgrd环进行多次接触,并且lc cdr与sirpα结合位点重叠,这解释了cc-90002和本文所描述的双特异性实体阻断sirpα结合的能力。
[0114]
本文所描述的cd47xcd20双特异性实体旨在促进对表达cd20和cd47的癌细胞上的cd47-sirpα“不要吃我”信号进行cd20限制性阻断,同时保留cd47+/cd20-正常细胞。蛋白质工程的多个步骤产生了本文所描述的双特异性实体的抗cd47 fab。(1)对cc-90002的vh和vl链均采用蛋白质工程,以降低免疫原性,同时保留功能性;并且(2)还采用蛋白质工程来使cc-90002失调。本文所描述和例示的靶向cd47和cd20的具有与cd47的降低亲和力的iggl双特异性抗体1)通过靶向cd47-sirpα相互作用并参与活化受体fcγr而保持介导抗肿瘤功能的功效;2)使通过抗cd47疗法观察到的靶标介导的下沉效应和毒性最小化;3)将cd47和cd20结合在单个分子中,避免使用2种单克隆抗体联合治疗的需要。
[0115]
蛋白质设计
[0116]
效应抗原cd47的晶体结构与高亲和力抗cd47 fab(cc-90002(408_437vl:seq id no:899;408_437vh:seq id no:900))结合,以指导预测具有一系列低亲和力、良好稳定性和低免疫原性的fab变体的计算机文库的构建。来自该文库的变体表达为具有高亲和力抗cd20 fab(利妥昔单抗(vl:seq id no:323;vh:seq id no:324))的igg1双特异性抗体。
[0117]
使用基于细胞的cd47结合和sirpα阻断试验筛选所得143个物理构建体的选择性和效力,以鉴定在共表达选择性抗原cd20的靶细胞上与效应抗原cd47有效结合,但与仅表达效应抗原cd47的非靶细胞系结合最少的那些变体。
[0118]
示例抗cd47全lc和hc、lc和hc恒定区、vl和vh区以及cdr序列在本文中提供和另外描述,与cc-90002(包括但不限于igg1同种型)相比,它们对cd47的结合亲和力显着降低并且免疫原性降低。如下文所述,igg1 1+1异二聚体形式是优选的,其包含(a)一个抗cd47 igg1(单体)部分,该部分含有一条完整的轻链(lc)和一条完整的重链(hc),以及(b)一个抗cd20 igg1(单体)部分,该部分含有一条完整的轻链(lc)和一条完整的重链(hc)。
[0119]
本发明的抗体包含源自cc-90002的vl和vh氨基酸序列,即分别为seq id no:325和seq id no:326,其中与cd47的结合亲和力显着减弱,即结合cd47的fab部分表现出低亲和力。发现本文所描述的失调抗cd47结合剂筛选中与cd47的一系列亲和力显着降低了与非
靶细胞的结合,并且在与cd20结合后被募集到靶细胞表面时仍然能够以亲合的方式与cd47有效地结合。初始失调的cd47xcd20双特异性先导物以约0.5μm至约2.5μm范围内的亲和力实现了这种选择性。图3a至图3c。例如,测得tpp-1360与人cd47 ecd的亲和力为1.7μm kd,这反映了相对于亲本抗cd47结合剂亲和力降低约350倍。测得tpp-1362与人cd47 ecd的亲和力为796μm kd,这反映了相对于亲本抗cd47结合剂亲和力降低约150倍。本文所描述的失调cd47xcd20双特异性实体表现出亲和力在约0.2μm至约4μm范围内的选择性。
[0120]
本文所描述的双特异性实体在表达cd20的肿瘤细胞上选择性地结合cd47并且在正常细胞中基本上不与cd47结合。例如,在共培养结合试验中,本文所描述的双特异性实体结合raji(cd47+cd20+)与人rbc的比率为约6,000倍。例如,本文所描述的双特异性实体结合人b细胞(cd47+cd20+)与人rbc的比率为约700倍。根据cd20和cd47在肿瘤细胞和正常细胞上的表达水平,本文所描述的双特异性实体的选择水平表现出约400至约8,000倍范围内的选择。因此,假设cd47表达水平固定,随着cd20水平提高,本文所描述的双特异性实体表现出增强的选择性和效力。
[0121]
本发明的示例抗体还包含源自cc-90002的vl和vh区,即分别为seq id no:325和seq id no:326,其中vl、vh或两者包含显着降低所得抗体的免疫原性的一个或多个氨基酸取代。本发明的示例抗体包含源自cc-90002的vl和vh区,即分别为seq id no:325和seq id no:326,其中vl、vh或这两个序列包含降低所得抗体与cd47的结合亲和力并显着降低所得抗体的免疫原性的一个或多个氨基酸取代。
[0122]
因此,本文所描述的源自cc-90002的优选抗体展现相对于vl seq id no:325的1个至7个氨基酸取代;以及相对于vh seq id no:326的1个至11个氨基酸取代。
[0123]
本文进一步考虑并以其他方式在功能上描述了源自cc-90002的抗体,其展现相对于vl seq id no:325的8个氨基酸取代。本文进一步考虑并以其他方式在功能上描述了源自cc-90002的抗体,其展现相对于vl seq id no:325的9个氨基酸取代。本文进一步考虑并以其他方式在功能上描述了源自cc-90002的抗体,其展现相对于vl seq id no:325的10个氨基酸取代。
[0124]
本文进一步考虑并以其他方式在功能上描述了源自cc-90002的抗体,其展现相对于vh seq id no:326的12个氨基酸取代。本文进一步考虑并以其他方式在功能上描述了源自cc-90002的抗体,其展现相对于vh seq id no:326的13个氨基酸取代。本文进一步考虑并以其他方式在功能上描述了源自cc-90002的抗体,其展现相对于vh seq id no:326的14个氨基酸取代。
[0125]
本文提供了一种cd47抗体,其中抗cd47 vl展现相对于seq id no:325的1个至7个氨基酸取代,其中所述氨基酸取代中的至少一(1)个选自由a10s、m11l、k24r、a51e、n52s、l54f和s56d组成的组;并且,抗cd47 vh展现相对于seq id no:326的1个至11个氨基酸取代,其中所述氨基酸取代中的至少一(1)个选自由t14p、q43k、a44g、e59y、d66g、m76t、s84r、s88a、m93v、s102e和t115l组成的组。
[0126]
本文还提供了本文所描述的cd47抗体,其中抗cd47 vl展现相对于seq id no:325的至少一(1)个、至少两(2)个、至少三(3)个、至少四(4)个、至少五(5)个、至少六(6)个或至少七(7)个氨基酸取代,其中氨基酸取代选自由a10s、m11l、k24r、a51e、n52s、l54f和s56d组成的组。
[0127]
本发明涉及本文所描述的抗体,其中抗cd47 vl展现相对于seq id no:325的至少七(7)个氨基酸取代,其中氨基酸取代中的七(7)个是a10s、m11l、k24r、a51e、n52s、l54f和s56d。
[0128]
本发明涉及本文所描述的抗体,其中抗cd47 vh展现相对于seq id no:326的至少一(1)个、两(2)个、三(3)个、四(4)个、五(5)个、六(6)个、七(7)个、八(8)个、九(9)个、十(10)个或十一(11)个氨基酸取代,其中氨基酸取代选自由t14p、q43k、a44g、e59y、d66g、m76t、s84r、s88a、m93v、s102e和t115l组成的组。
[0129]
本发明涉及本文所描述的抗体,其中抗cd47 vh展现相对于seq id no:326的至少十一(11)个氨基酸取代,其中氨基酸取代中的十一(11)个是t14p、q43k、a44g、e59y、d66g、m76t、s84r、s88a、m93v、s102e和t115l。
[0130]
抗cd47 lc(seq id no:335)和hc(seq id no:336)是用于构建本文所描述的双特异性实体的抗cd47元件的优选来源,特别是vl(seq id no:319)和vh(seq id no:320),其分别包含vl cdr seq id no:365(cdrl1)、seq id no:366(cdrl2)和seq id no:367(cdrl3);以及vh cdr seq id no:368(cdrh1)、seq id no:369(cdrh2)和seq id no:370(cdrh3)。取代a10s、m11l、k24r、a51e、n52s、l54f和s56d是实现低cd47结合亲和力并降低免疫原性的关于cc-90002的重要vl(seq id no:319)取代。t14p、q43k、a44g、e59y、d66g、m76t、s84r、s88a、m93v、s102e和t115l是实现低cd47结合亲和力(特别是e59y和s102e)和并降低免疫原性的关于cc-90002的重要vh(seq id no:320)。在某些实施方案中,如本文另外描述的抗cd47 iggl lc和hc恒定区(例如分别为seq id no:339和seq id no:341)与vl(seq id no:319)和vh(seq id no:320)的羧基末端融合。抗cd47 lc(seq id no:335)优选用于构建本发明的双特异性实体。抗cd47 hc(seq id no:336)优选用于构建本发明的双特异性实体。取代q124e、l135w、q160e和t180e是确保在产生igg1 1+1异二聚体形式期间形成正确的lc/hc配对的重要seq id no:335位置。取代q179k、t371v、t389l、k420l和t422w是降低在产生igg1 1+1异二聚体形式期间形成同二聚体的倾向的重要seq id no:336位置。
[0131]
本发明进一步特别涉及一种本文另外描述的抗体,其中抗cd47 vl展现相对于seq id no:325的1个至3个氨基酸取代,其中抗cd47 vl(seq id no:325)中的至少一(1)个、至少两(2)个或至少三(3)个氨基酸取代选自由a10s、m11l和k24r组成的组(例如,seq id no:321);并且,抗cd47 vh展现相对于seq id no:326的1个至11个氨基酸取代,其中抗cd47 vh(seq id no:326)中的至少一(1)个、至少两(2)个、至少三(3)个、至少四(4)个、至少五(5)个、至少六(6)个、至少七(7)个、至少八(8)个、至少九(9)个、至少十(10)个或至少十一(11)个氨基酸取代选自由t14p、q43k、a44g、e59y、d66g、m76t、s84r、s88a、m93v、s102e和t115l组成的组(例如,seq id no:322)。
[0132]
本发明特别涉及一种本文另外描述的抗体,其中抗cd47 vh展现相对于seq id no:326的1个至11个氨基酸取代,其中抗cd47 vh(seq id no:326)中的至少一(1)个、至少两(2)个、至少三(3)个、至少四(4)个、至少五(5)个、至少六(6)个、至少七(7)个、至少八(8)个、至少九(9)个、至少十(10)个或至少十一(11)个氨基酸取代选自由t14p、q43k、a44g、e59y、d66g、m76t、s84r、s88a、m93v、s102e和t115l组成的组(例如,seq id no:322)。
[0133]
抗cd47 lc(seq id no:337)和hc(seq id no:338)是用于构建本文所描述的双特异性实体的抗cd47元件的优选来源,特别是vl(seq id no:321)和vh(seq id no:322),其
分别包含vl cdr seq id no:371、seq id no:372和seq id no:373);以及vh cdr seq id no:374、seq id no:375和seq id no:376。a10s、m11l和k24r是实现低cd47结合亲和力并降低免疫原性的重要vl(seq id no:321)位置。取代t14p、q43k、a44g、e59y、d66g、m76t、s84r、s88a、m93v、s102e和t115l是实现低cd47结合亲和力(特别是e59y和s102e)并降低免疫原性的重要vh(seq id no:322)位置。如本文另外描述的抗cd47 iggl lc和hc恒定区(例如分别为seq id no:339和seq id no:341)与vl(seq id no:321)和vh(seq id no:322)的羧基末端融合。抗cd47 lc(seq id no:337)优选用于构建本发明的双特异性实体。抗cd47 hc(seq id no:338)优选用于构建本发明的双特异性实体。取代q124e、l135w、q160e和t180e是用于降低在产生igg1 1+1异二聚体形式期间形成同二聚体的倾向的重要seq id no:337位置。取代q179k、t371v、t389l、k420l和t422w是用于降低在产生igg1 1+1异二聚体形式期间形成同二聚体的倾向的重要seq id no:338位置。
[0134]
本发明特别涉及一种本文另外描述的抗体,其中抗cd47 vl展现相对于seq id no:325的1个至10个氨基酸取代,其中抗cd47 vl(seq id no:325)中的至少一(1)个、至少两(2)个、至少三(3)个、至少四(4)个、至少五(5)个、至少六(6)个、至少七(7)个、至少八(8)个、至少九(9)个或至少十(10)个氨基酸取代选自由a10s、m11l、k24q、k39d、k42t、k45q、a51e、n52s、l54f和s56d组成的组(例如,seq id no:317);并且抗cd47 vh展现相对于seq id no:326的1个至11个氨基酸取代,其中抗cd47 vh(seq id no:326)中的至少一(1)个、至少两(2)个、至少三(3)个、至少四(4)个、至少五(5)个、至少六(6)个、至少七(7)个、至少八(8)个、至少九(9)个、至少十(10)个或至少十一(11)个氨基酸取代选自由t14p、a44g、e59y、d66g、m76t、s84a、r87t、s88a、m93v、s102e和t115l组成的组(例如,seq id no:318)。
[0135]
本发明特别涉及一种本文另外描述的抗体,其中抗cd47 vh展现相对于seq id no:326的1个至11个氨基酸取代,其中抗cd47 vh(seq id no:326)中的至少一(1)个、至少两(2)个、至少三(3)个、至少四(4)个、至少五(5)个、至少六(6)个、至少七(7)个、至少八(8)个、至少九(9)个、至少十(10)个或至少十一(11)个氨基酸取代选自由t14p、a44g、e59y、d66g、m76t、s84a、r87t、s88a、m93v、s102e和t115l(例如,seq id no:318)组成的组。
[0136]
抗cd47 lc(seq id no:333)和hc(seq id no:334)是用于构建本文所描述的双特异性实体的抗cd47元件的优选来源,特别是vl(seq id no:317)和vh(seq id no:318),其分别包含vl cdr seq id no:359、seq id no:360和seq id no:361);以及vh cdr seq id no:362、seq id no:363和seq id no:364。取代a10s、m11l、k24q、k39d、k42t、k45q、a51e、n52s、l54f和s56d是实现低cd47结合亲和力并降低免疫原性的重要vl(seq id no:317)位置。取代t14p、a44g、e59y、d66g、m76t、s84a、r87t、s88a、m93v、s102e和t115l是实现低cd47结合亲和力(特别是e59y和s102e)并降低免疫原性的重要vh(seq id no:318)位置。如本文另外描述的抗cd47 iggl lc和hc恒定区(例如分别为seq id no:339和seq id no:341)与vl(seq id no:317)和vh(seq id no:318)的羧基末端融合。抗cd47 lc(seq id no:333)优选用于构建本发明的双特异性实体。抗cd47 hc(seq id no:334)优选用于构建本发明的双特异性实体。取代q124e、l135w、q160e和t180e是降低在产生igg1 1+1异二聚体形式期间形成同二聚体的倾向的重要seq id no:333位置。取代q179k、t371v、t389l、k420l和t422w是用于降低在产生igg11+1异二聚体形式期间形成同二聚体的倾向的重要seq id no:334位置。
[0137]
本文中所描述和预期的示例抗体包含抗cd20 vl cdr rasssvsyih(seq id no:353)、atnslas(seq id no:354)、qqwtsnppt(seq id no:355);以及vh cdr synmh(seq id no:356)、aiypgngdtsynqkfkg(seq id no:357)、styyggdwyfnv(seq id no:358)。本文另外描述的示例双特异性抗体包含抗cd20vl(seq id no:323)和vh(seq id no:324)。本文在功能上描述的示例优选物种双特异性抗体包含抗cd20 lc(seq id no:331)和抗cd20 hc(seq id no:332)。源自cc-90002的失调抗cd47 vl/vh fab的161个示例
[0138]
本文进一步提供了源自亲本抗体cc-90002的161个vl和vh fab。对于161个fab中的每一个,vl氨基酸序列作为奇数seq id no 1-321提供;并且vh氨基酸序列作为偶数seq id no 2-322提供。鉴定的fab(vl/vh对)各自编号为相邻的seq id no,即本文公开的对遵循以下模式:seq id no:1/seq id no:2;seq id no:3/seq id no:4,以此类推至seq id no:321/seq id no:322:
[0139]
seq id no:1/seq id no:2;seq id no:3/seq id no:4;seq id no:5/seq id no:6;seq id no:7/seq id no:8;seq id no:9/seq id no:10;seq id no:11/seq id no:12;seq id no:13/seq id no:14;seq id no:15/seq id no:16;seq id no:17/seq id no:18;seq id no:19/seq id no:20;seq id no:21/seq id no:22;seq id no:23/seq id no:24;seq id no:25/seq id no:26;seq id no:27/seq id no:28;seq id no:29/seq id no:30;seq id no:31/seq id no:32;seq id no:33/seq id no:34;seq id no:35/seq id no:36;seq id no:37/seq id no:38;seq id no:39/seq id no:40;seq id no:41/seq id no:42;seq id no:43/seq id no:44;seq id no:45/seq id no:46;seq id no:47/seq id no:48;seq id no:49/seq id no:50;seq id no:51/seq id no:52;seq id no:53/seq id no:54;seq id no:55/seq id no:56;seq id no:57/seq id no:58;seq id no:59/seq id no:60;seq id no:61/seq id no:62;seq id no:63/seq id no:64;seq id no:65/seq id no:66;seq id no:67/seq id no:68;seq id no:69/seq id no:70;seq id no:71/seq id no:72;seq id no:73/seq id no:74;seq id no:75/seq id no:76;seq id no:77/seq id no:78;seq id no:79/seq id no:80;seq id no:81/seq id no:82;seq id no:83/seq id no:84;seq id no:85/seq id no:86;seq id no:87/seq id no:88;seq id no:89/seq id no:90;seq id no:91/seq id no:92;seq id no:93/seq id no:94;seq id no:95/seq id no:96;seq id no:97/seq id no:98;seq id no:99/seq id no:100;seq id no:101/seq id no:102;seq id no:103/seq id no:104;seq id no:105/seq id no:106;seq id no:107/seq id no:108;seq id no:109/seq id no:110;seq id no:111/seq id no:112;seq id no:113/seq id no:114;seq id no:115/seq id no:116;seq id no:117/seq id no:118;seq id no:119/seq id no:120;seq id no:121/seq id no:122;seq id no:123/seq id no:124;seq id no:125/seq id no:126;seq id no:127/seq id no:128;seq id no:129/seq id no:130;seq id no:131/seq id no:132;seq id no:133/seq id no:134;seq id no:135/seq id no:136;seq id no:137/seq id no:138;seq id no:139/seq id no:140;seq id no:141/seq id no:142;seq id no:143/seq id no:144;seq id no:145/seq id no:146;seq id no:147/seq id no:148;seq id no:149/seq id no:150;seq id no:151/seq id no:152;seq id no:153/seq id no:154;seq id no:155/seq id no:156;seq id no:157/seq id no:158;seq id no:159/seq id no:160;seq id no:161/seq id no:
no:83、seq id no:85、seq id no:87、seq id no:89、seq id no:91、seq id no:93、seq id no:95、seq id no:97、seq id no:99、seq id no:101、seq id no:103、seq id no:105、seq id no:107、seq id no:109、seq id no:111、seq id no:113、seq id no:115、seq id no:117、seq id no:119、seq id no:121、seq id no:123、seq id no:125、seq id no:127、seq id no:129、seq id no:131、seq id no:133、seq id no:135、seq id no:137、seq id no:139、seq id no:141、seq id no:143、seq id no:145、seq id no:147、seq id no:149、seq id no:151、seq id no:153、seq id no:155、seq id no:157、seq id no:159、seq id no:161、seq id no:163、seq id no:165、seq id no:167、seq id no:169、seq id no:171、seq id no:173、seq id no:175、seq id no:177、seq id no:179、seq id no:181、seq id no:183、seq id no:185、seq id no:187、seq id no:189、seq id no:191、seq id no:193、seq id no:195、seq id no:197、seq id no:199、seq id no:201、seq id no:203、seq id no:205、seq id no:207、seq id no:209、seq id no:211、seq id no:213、seq id no:215、seq id no:217、seq id no:219、seq id no:221、seq id no:223、seq id no:225、seq id no:227、seq id no:229、seq id no:231、seq id no:233、seq id no:235、seq id no:237、seq id no:239、seq id no:241、seq id no:243、seq id no:245、seq id no:247、seq id no:249、seq id no:251、seq id no:253、seq id no:255、seq id no:257、seq id no:259、seq id no:261、seq id no:263、seq id no:265、seq id no:267、seq id no:269、seq id no:271、seq id no:273、seq id no:275、seq id no:277、seq id no:279、seq id no:281、seq id no:283、seq id no:285、seq id no:287、seq id no:289、seq id no:291、seq id no:293、seq id no:295、seq id no:297、seq id no:299、seq id no:301、seq id no:303、seq id no:305、seq id no:307、seq id no:309、seq id no:311、seq id no:313、seq id no:315、seq id no:317、seq id no:319和seq id no:321;并且抗cd47vh选自由以下各项组成的组:seq id no:2、seq id no:4、seq id no:6、seq id no:8、seq id no:10、seq id no:12、seq id no:14、seq id no:16、seq id no:18、seq id no:20、seq id no:22、seq id no:24、seq id no:26、seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38、seq id no:40、seq id no:42、seq id no:44、seq id no:46、seq id no:48、seq id no:50、seq id no:52、seq id no:54、seq id no:56、seq id no:58、seq id no:60、seq id no:62、seq id no:64、seq id no:66、seq id no:68、seq id no:70、seq id no:72、seq id no:74、seq id no:76、seq id no:78、seq id no:80、seq id no:82、seq id no:84、seq id no:86、seq id no:88、seq id no:90、seq id no:92、seq id no:94、seq id no:96、seq id no:98、seq id no:100、seq id no:102、seq id no:104、seq id no:106、seq id no:108、seq id no:110、seq id no:112、seq id no:114、seq id no:116、seq id no:118、seq id no:120、seq id no:122、seq id no:124、seq id no:126、seq id no:128、seq id no:130、seq id no:132、seq id no:134、seq id no:136、seq id no:138、seq id no:140、seq id no:142、seq id no:144、seq id no:146、seq id no:148、seq id no:150、seq id no:152、seq id no:154、seq id no:156、seq id no:158、seq id no:160、seq id no:162、seq id no:164、seq id no:166、seq id no:168、seq id no:170、seq id no:172、seq id no:174、seq id no:176、seq id no:178、seq id no:180、seq id no:182、seq id no:184、seq id no:186、seq id no:188、seq id no:190、seq id no:192、seq id no:194、
seq id no:196、seq id no:198、seq id no:200、seq id no:202、seq id no:204、seq id no:206、seq id no:208、seq id no:210、seq id no:212、seq id no:214、seq id no:216、seq id no:218、seq id no:220、seq id no:222、seq id no:224、seq id no:226、seq id no:228、seq id no:230、seq id no:232、seq id no:234、seq id no:236、seq id no:238、seq id no:240、seq id no:242、seq id no:244、seq id no:246、seq id no:248、seq id no:250、seq id no:252、seq id no:254、seq id no:255、seq id no:258、seq id no:260、seq id no:262、seq id no:264、seq id no:266、seq id no:268、seq id no:270、seq id no:272、seq id no:274、seq id no:276、seq id no:278、seq id no:280、seq id no:282、seq id no:284、seq id no:286、seq id no:288、seq id no:290、seq id no:292、seq id no:294、seq id no:296、seq id no:298、seq id no:300、seq id no:302、seq id no:304、seq id no:306、seq id no:308、seq id no:310、seq id no:312、seq id no:314、seq id no:316、seq id no:318、seq id no:320和seq id no:322。
[0142]
本发明的cd47xcd20双特异性实体的特性
[0143]
效应抗原cd47的胞外结构域的体外亲和力测量结果最初显示与这些变体的亲和力降低了100-200倍。cd47胞外结构域的体外亲和力测量结果显示,这些变体的亲和力降低了100-500倍。使用这些失调的igg1 1+1异二聚体形式双特异性抗体进行的体内和体外基于细胞的研究证实了基于效应子的细胞杀伤,并且相对于单特异性抗体减少了与非靶细胞类型的结合。抗cd20 vl:seq id no:323;抗cd20 vh:seq id no:324。抗cd20 lc恒定区是seq id no:343。抗cd20 hc恒定区是seq id no:345。
[0144]
本文所描述、例示和要求保护的双特异性实体展现与表达cd20的细胞的选择性结合,例如,其中cd47与巨噬细胞检查点抑制剂——信号调节蛋白α(sirpα)的相互作用被阻断。与单特异性抗cd47方法相比,这种增加的选择性允许使用igg1 fc,其参与活化可结晶片段γ受体(fcγr)以完全增强巨噬细胞吞噬和破坏cd20阳性细胞的能力。与抗cd20抗体利妥昔单抗相比,例如,本文所描述和例示的抗cd47/抗cd20双特异性抗体在体外诱导吞噬作用和adcc方面更有效。
[0145]
体外基于细胞的研究表明,本文所描述的失调的cd47双特异性实体活化抗体依赖性细胞吞噬作用、补体依赖性细胞毒性(cdc)和抗体依赖性细胞毒性(adcc)。参见图4a至图4c和图5a至图5c。此外,食蟹猴(cyno)药代动力学(pk)和探索性毒性(e-tox)研究实验表明,相对于亲本单特异性抗cd47抗体,失调的cd47双特异性抗体可有效消耗b细胞,并减少与食蟹猴红细胞(rbc)的结合,从而基本上证实了本文所描述和要求保护的靶细胞选择性策略的成功和医学价值。本文例示的物种在向非人灵长类动物多次给药后表现出有利的药代动力学和cd20
+
b细胞消耗,对血液学参数的有害影响最小。
[0146]
在具体实施方案中,本文提供的cd47xcd20双特异性,指定为tpp-1360、tpp-1361、tpp-1367和tpp-1362,包含如下重链和轻链序列:tpp-1360包含(cd47 lc seq id no:335;hc seq id no:336)x(cd20 lc seq id no:331;hc seq id no:332)。tpp-1361包含(cd47 lc seq id no:333;hc seq id no:334)x(cd20 lc seq id no:331;hc seq id no:332)。tpp-1367包含(cd47 lc seq id no:337;hc seq id no:338)x(cd20 lc seq id no:331;hc seq id no:332)。tpp-1362包含(cd47 lc seq id no:385;hc seq id no:386)x(cd20 lc seq id no:331;hc seq id no:332)。
[0147]
关于tpp-1362,cd47 vl包含seq id no:383。tpp-1362cd47 vh包含seq id no:384。tpp-1362cd47 vl cdr包含seq id no:377(cdrl1);seq id no:378(cdrl2);和seq id no:379(cdrl3)。tpp-1362cd47 vh cdr包含seq id no:380(cdrh1);seq id no:381(cdrh2);和seq id no:382(cdrh3)。表明本文另外描述的一系列属内的示例双特异性实体表现出通常指示该属的治疗价值的药理学特征。
[0148]
例如,这些高度评价的物种表现出与cd20的高亲和力和与cd47的失调亲和力,显示出有效的cd47阻断、食蟹猴交叉反应性、良好的理化特性(溶解度、稳定性、表达)和低免疫原性预测(epivax)。参见实施例13、图18。igg1异二聚体形式和fc使用标准cho工艺以足够的数量和纯度提供可靠的生产,具有适当的滴度、产量、产品质量和液体配方。这些高度评价的示例物种表现出优于cc-90002的cd20
+
肿瘤细胞的体外吞噬能力和比利妥昔单抗更有效的adcc。这些高度评价的示例物种还表现出外周血和淋巴组织中食蟹猴b细胞的显着减少。这些高度评价的示例物种还表现出最小的下沉效应,不与cd20-cd47
+
健康细胞(rbc和血小板)结合。这些高度评估的示例物种还表现出可接受的pk参数以支持例如每周给药。
[0149]
例如,tpp-1360的rbc结合能力在纯化的人rbc中和人rbc与肿瘤细胞的共培养物中得到了广泛评估。如图8所示,表明tpp-1360选择性结合cd47
+
/cd20
+
raji细胞但不结合cd47
+
/cd20-人rbc。此外,在raji细胞和人rbc的共培养物中,tpp-1360显示出与cd47
+
/cd20
+
raji细胞的剂量依赖性结合,但不与人rbc结合,即使浓度高达1mg/ml。参见图9。相反,cd47野生型/cd20双特异性tpp-2与raji细胞和人rbc均显着结合。此外,tpp-1360不显示与来自多个供体的纯化食蟹猴rbc的结合。
[0150]
tpp-1360,本公开的示例物种双特异性实体,是一流的抗体,共靶向cd47和cd20,设计为以高亲和力结合cd20并以最佳失调亲和力结合cd47。例如,当与表达cd20的细胞结合时,tpp-1360不仅阻断巨噬细胞检查点抑制剂sirpα与cd47的相互作用,而且还参与活化fcγr以完全增强巨噬细胞吞噬和破坏cd20阳性细胞的能力。例如,tpp-1360诱导有效的体外活性,以通过多种作用模式(包括吞噬作用、adcc和cdc)消除癌细胞。tpp-1360,本文所描述的双特异性实体的示例,提供了与利妥昔单抗和cc-90002相比增强的药理学活性。
[0151]
与作为单一药剂的利妥昔单抗或cc-90002相比,本文所描述和要求保护的cd47xcd20双特异性实体表现出增强的吞噬作用。本文所描述的cd47xcd20双特异性实体的吞噬活性通常与它们的cd47结合亲和力相关。本文所描述的cd47xcd20双特异性实体单剂活性在诱导吞噬作用方面相当于cc-90002和利妥昔单抗的组合。
[0152]
与单剂抗cd47活性相比,本文所描述的cd47xcd20双特异性实体在利妥昔单抗敏感和耐药肿瘤细胞中表现出提高的adcc。
[0153]
本文所描述的cd47xcd20双特异性实体在raji nod-scid模型中表现出比利妥昔单抗更好的体内功效。参见实施例15。
[0154]
与利妥昔单抗相比,tpp-1360增强吞噬作用和adcc活性。此外,tpp-1360和本文所描述、例示和要求保护的相关双特异性实体与临床上使用的cd20xcd3双特异性t细胞衔接器(诸如来自regeneron的regn1979或来自roche的mosunetuzumab)有所区分,因为与t细胞活化相比,tpp-1360和相关双特异性实体具有不同的作用模式,包括吞噬作用、adcc和cdc。此外,毒性特征不同于cd20xcd3(潜在的血液毒性与细胞因子释放综合征)。特别是,t细胞衔接器是有效的免疫衔接器,有可能触发表达极低水平靶抗原的非靶细胞凋亡,因此靶抗
原需要具有极高的特异性,或者双特异性抗体的抗靶向臂需要采用掩蔽技术或进行调整以区分靶抗原在正常组织和疾病组织上的表达水平。此外,双特异性抗体的抗cd3部分需要精确调整,以防止由于t细胞的全身活化而导致细胞因子释放。重要的是,tpp-1360,作为本文的代表性示例,在向非人类灵长类动物多次给药后表现出有利的消除动力学,对血液学参数的有害影响最小。本发明的cd47xcd20双特异性抗体尤其被开发为例如对当前疗法难治和/或耐药的b淋巴瘤患者的静脉内(iv)注射治疗。
[0155]
提供本文所描述的双特异性实体用于治疗和/或控制肿瘤、肿瘤细胞、癌症(包括但不限于经历异常增殖、血液肿瘤学病症、血液恶性肿瘤、淋巴组织增殖性病症、b细胞病症、b细胞恶性肿瘤和/或b细胞淋巴瘤的细胞)的方法。本发明的双特异性实体根据抗体作为治疗实体的当前技术状态进行配制和给药。例如,igg1抗体的配制和给药标准是本领域公知的。例如,本文所描述的抗体作为cd20阳性b细胞淋巴瘤患者的静脉内(iv)注射治疗给药。本发明涉及一种控制肿瘤细胞的方法,所述方法包括向有此需要的患者给药有效量的本文所描述的双特异性实体。肿瘤细胞是指癌细胞,包括但不限于经历异常增殖、血液肿瘤学病症、血液恶性肿瘤、淋巴组织增殖性病症、b细胞病症、b细胞恶性肿瘤和b细胞淋巴瘤的细胞。
[0156]
特别提供本文所描述的cd47xcd20双特异性实体以用于治疗b细胞病症或b细胞恶性肿瘤的方法中,所述方法包括向有此需要的患者给药有效量的本文所描述的双特异性实体。
[0157]
对本文所描述的双特异性实体的异速生长和人体药代动力学进行评估。本发明的实体包含失调cd47结合臂和常规cd20(利妥昔单抗)结合臂。鉴于cd47臂的结合亲和力失调,双特异性实体的靶标介导的药物处置(tmdd)可能主要由cd20结合驱动。因此,在某些实施方案中,临床剂量将在目前用于利妥昔单抗的剂量范围内。根据食蟹猴的10mg/kg、20mg/kg和100mg/kg剂量,终末半衰期为大约7天。cd20介导的tmdd基于利妥昔单抗的其他临床前和临床数据。首次人体临床研究是一项开放标签、多中心、1/1b期研究,旨在评估在利妥昔单抗和/或其他靶向cd20的治疗中取得进展的复发性或难治性cd20+nhl受试者的安全性和耐受性。剂量递增从低于1mg/kg开始,然后递增至10mg/kg,这是目前利妥昔单抗的临床剂量。食蟹猴在第1天和第15天以20mg/kg给药两次。发现本文所描述的双特异性实体在nhp etox研究中作为单一药剂具有良好的耐受性,以及与剂量成比例的暴露。本文所描述的双特异性实体的哺乳动物或人剂量在约3mg/kg至约20mg/kg的范围内。此外,本文所描述的双特异性实体的哺乳动物或人剂量特别地在约5mg/kg至约15mg/kg的范围内。本文所描述的双特异性实体的哺乳动物或人剂量也在约7mg/kg和约13mg/kg之间。本文所描述的双特异性实体的给药方案是约每五(5)天一次、或约每周(七(7)天)一次、或约每十(10)天一次、或约每两(2)周一次。
[0158]
本文所描述的双特异性抗体的制造工艺可以遵循典型的中国仓鼠卵巢(cho)制造平台。在这些双特异性抗体的纯化中观察到的常见污染物是半抗体,其需要特定的纯化方案来去除。在中国仓鼠卵巢细胞中表达4链双特异性抗体后,蛋白a用作纯化基于igg的双特异性抗体的第一步。在这第一步之后,通常存在两种物种:所需的4链双特异性抗体和半抗体。在大多数情况下,离子交换色谱法足以分离这两种物种,但在其他情况下可能需要疏水相互作用色谱法。lc的正确配对应通过质谱法进行评估,并且错误组装的杂质应通过其他
蛋白质纯化方法去除,诸如离子交换或疏水相互作用色谱法。在二级纯化方法之后,制备型排阻色谱(sec)可用于抛光和确保构象均匀性,同时缓冲液交换4链双特异性抗体。最终的质量控制应包括分析型sec、质谱法和与不同抗原的体外结合评估,以确保双特异性抗体的构象和化学完整性。参见例如,j.b.ridgway等人,protein eng.9(1996)617
–
621.k.gunasekaran等人,j.biol.chem.285(2010)19637
–
19646。本文所描述的igg1 1+1异二聚体的优选单体元件各自含有在上文讨论并在本文中鉴定的某些lc和hc恒定区序列,以降低在产生igg1 1+1异二聚体形式期间形成同二聚体的倾向。
[0159]
实施例
[0160]
实施例1:cc-90002的失调
[0161]
降低cc-90002(408_437)抗cd47臂的非失调亲本版本亲和力的合理设计是通过与cd47胞外结构域结合的抗cd47 fab的晶体结构实现的。cc-90002结合的表位与结合人cd47的原始鼠抗cd47 2a1的表位相同。参见美国专利第9,045,541号。
[0162]
将2a1的可变结构域人源化,并且最终抗体命名为“qn”,由hc_2.3q和lc_n组成,最终开发为igg4 p/e格式(cc-90002)。通过将残基引入可变重链结构域来进一步修饰qn,以改善无细胞表达,这种hc变体命名为“hc_q_5_mut”。使用免疫原性的计算机建模和计算机预测进一步修饰hc_q_5_mut hc和lc_n来降低其免疫原性,这些hc_q_5_mut hc和lc_n统称为“cd47 2.0”。cd47 2.0lc_1147_2和cd47 2.0hc_434的可变重链结构域和可变轻链结构域中的其他变体被设计用于改善药代动力学,这些变体被称为“cd47 3.0”。wo2016109415(us.20170369572);wo2018009499(us.20190241654);和wo2018183182,它们中的每一个均以引用方式并入本文。
[0163]
抗cd47表位覆盖大比表面,并且轻链(lc)和重链(hc)两者中的残基参与相互作用。
[0164]
为了降低抗cd47臂与cd47的亲和力,使用分子操作环境(moe)建模程序中的“残基扫描”模块对lc和hc两者中的cd47相互作用残基进行计算机诱变。这个过程创建了具有广泛预测亲和力的数千个变体的文库。将每个计算机fab变体建模以计算稳定性的预测变化(dstability)或与cd47 ecd的亲和力变化(daffinity)。使用免疫原性评估软件分析了超过5,000个具有阳性daffinity评分(预测具有相对于亲本fab较低的亲和力)和阴性dstability(预测具有比亲本fab更高的稳定性)的变体,以鉴定预测具有低免疫原性的变体。在这些变体中,选择了143个其cd47的预测kd范围为10nm至1mm的低免疫原性风险的fab变体以进行基于细胞的测试。
[0165]
为了筛选靶细胞选择性抗cd47 fab,将选定的抗cd47 fab变体构建为igg1融合体,并与来自西妥昔单抗的抗egfr臂配对。4链双特异性抗体的正确组装通过所有4条链中存在本文所描述的fab和fc取代来实现。含有143个选定变体的4链双特异性抗体在expi-cho细胞中瞬时表达,并且在单个步骤中使用磁性蛋白a珠纯化双特异性抗体。为了鉴定靶细胞选择性双特异性抗体,用两个实验测试变体。第一个实验测量了失调的抗cd47x抗egfr双特异性抗体结合表达cd47抗原但不表达egfr抗原的非靶标raji细胞系的能力。第二个实验测量了失调的抗cd47x抗egfr双特异性抗体阻断sirpα与表达cd47抗原和egfr抗原的靶标fadu细胞系结合的能力。这些实验产生了一组8个变体,相对于未失调的抗cd47x抗egfr亲本抗体,这些变体与非靶标cd47+/egfr-raji细胞系的亲和力降低了10倍到20倍,但仍然
能够阻断75-90%的sirpα与cd47+/egfr+fadu靶细胞系的结合。
[0166]
使用igg1 fc类似地将利妥昔单抗抗cd20臂与8个失调的抗cd47变体配对。据观察,相对于未失调的cd47xcd20亲本抗体,失调的cd47xcd20双特异性抗体减少与cd47+/cd20-非靶标fadu细胞系的结合,但仍然能阻断75-90%的sirp与cd47和cd20阳性的靶标raji细胞系的结合。
[0167]
对变体的额外可开发性评估导致选择单个抗cd47 fab变体vh e59y/s102e,将其克隆到用于在食蟹猴中进行药代动力学测试的三个cc-90002来源的框架中:tpp-1367、tpp-1360和tpp-1361。
[0168]
实施例2:本文所描述的双特异性实体的spr结合结果的概述
[0169]
表面等离子体共振(spr)实验用于测量tpp-1360和tpp-1362与cd47的亲和力。测试这两种抗体与人cd47和食蟹猴cd47的结合,并且发现这两种抗体不与小鼠cd47结合。测得tpp-1360与人cd47 ecd的亲和力为1.7μm kd,这反映了相对于亲本抗cd47结合剂亲和力降低约350倍。发现tpp-1360与食蟹猴cd47 ecd的亲和力为4.51μm kd。测得tpp-1362与人cd47 ecd的亲和力为0.796μm kd,这反映了相对于亲本抗cd47结合剂亲和力降低约150倍。发现tpp-1362与食蟹猴cd47 ecd的亲和力为2.06μm kd。最后,除了测得的亲和力之外,夹心spr测定还表明两者同时结合cd47和cd20。
[0170]
实施例3:示例双特异性实体的结合和sirpα阻断的剂量反应
[0171]
生成tpp-1360和tpp-1362阻断人sirp
∝
与各种表达cd20的非霍奇金淋巴瘤肿瘤细胞系结合的剂量反应曲线。将细胞系与浓度增加的任一双特异性抗体一起孵育,然后以饱和浓度添加人sirp。除了双特异性抗体外,还包括利妥昔单抗和亲本抗cd47结合剂(tpp-23,即408_437与igg1)以供参考。洗涤细胞,然后用二抗孵育以测量sirpα与肿瘤细胞结合的量。对于细胞系oci-ly3(dlbcl细胞系),发现tpp-1360的ec50=1.30nm,并且发现tpp-1362的ec50=0.70nm。对于raji细胞系(b淋巴细胞伯基特淋巴瘤细胞系),发现tpp-1360的ec50=1.64nm,并且发现tpp-1362的ec50=1.10nm。发现亲本抗cd47,即tpp-23的ic
50
为0.11nm,用于阻断人sirpa与oci-ly3细胞的结合,如图21所示。利妥昔单抗对sirpα结合没有影响。
[0172]
实施例4:吞噬作用的剂量反应
[0173]
生成tpp-1360和tpp-1362活化对各种表达cd20的非霍奇金淋巴瘤肿瘤细胞系的吞噬作用的剂量反应曲线。人单核细胞分化为巨噬细胞,然后将巨噬细胞添加到已与浓度增加的任一双特异性抗体孵育的肿瘤细胞系中。除了双特异性实体外,还包括利妥昔单抗和亲本抗cd47结合剂(tpp-23)以供参考。巨噬细胞和肿瘤细胞的荧光标记用于使用基于图像的定量方法测量吞噬事件的数量。对于oci-ly3细胞系,发现tpp-1360的ic50=1.4nm,并且发现tpp-1362的ic50=0.43nm。对于raji细胞系,发现tpp-1360的ic50=1.8nm,并且发现tpp-1362的ic50=0.37nm。
[0174]
实施例5:人类和食蟹猴rbc的结合研究以及凝血
[0175]
确定某些双特异性实体示例与人和食蟹猴rbc的结合以评估它们的非靶细胞结合潜力。rbc从全血中分离出来,并与浓度增加的示例性双特异性抗体一起孵育。结合表示为在2μg/ml亲本抗cd47结合剂(tpp-23)下观察到的结合量的百分比。在200μg/ml下,tpp-1360和tpp-1361结合<1%的亲本抗cd47与人rbc结合可见的结合率。类似地,在200μg/ml
下,tpp-1360结合<1%的亲本抗cd47与食蟹猴rbc结合可见的结合率。针对tpp-1362在200μg/ml下与食蟹猴rbc的结合观察到更高程度的结合,这显示2-3%的亲本抗cd47结合剂的结合。最后,两个导联的亲本抗cd47结合剂在200μg/ml下均未显示人rbc凝集。类似地,tpp-1360和tpp-1361两者在200μg/ml下均未显示凝集。bric6(一种已知的血凝抗体)用作阳性对照。
[0176]
实施例6:对人pbmc和全血的结合研究
[0177]
评估了本文所描述的双特异性实体物种与人外周血单核细胞(pbmc)的结合。相对于亲本抗cd47结合剂tpp-23和利妥昔单抗,tpp-1360双特异性抗体与所有细胞类型的结合均较少,但b细胞除外,b细胞通过抗cd20 fab部分的存在显着结合。
[0178]
实施例7:第一轮领先食蟹猴pk
[0179]
使用本文所描述的示例双特异性实体物种进行食蟹猴pk实验。食蟹猴在第1天和第15天以20mg/kg给药两次。观察到b细胞耗尽。从这些研究中选择tpp-1360和tpp-1362用于食蟹猴探索性毒理学(e-tox)研究中的进一步研究,如实施例8中所述。
[0180]
实施例8:第二轮领先食蟹猴e-tox
[0181]
使用tpp-1360和tpp-1362进行食蟹猴e-tox实验。对于tpp-1360,食蟹猴以100mg/kg、20mg/kg和10mg/kg的剂量给药,每周一次,持续两周,然后是2周的非给药期。第二tpp-1360臂,每周两次测试10mg/kg,持续两周,然后是两周的非给药期。对于tpp-1362,食蟹猴以60mg/kg、20mg/kg和10mg/kg的剂量给药,每周一次,持续两周,然后是2周的非给药期。第二tpp-1362臂,每周两次测试10mg/kg,持续两周,然后同样是两周的非给药期,在第1天和第15天以20mg/kg给药两次。这些研究表明,tpp-1360具有良好的耐受性,显示出b细胞深度耗尽,并实现了与剂量成比例的暴露,确认未下沉,从而对靶细胞具有选择性。
[0182]
实施例9:体外药理学
[0183]
a.人全血结合
[0184]
为了评估tpp-1360的特异性,首先使用流式细胞术在全血中评估其结合特征。在两个供体中,200nm tpp-1360将结合信号基本上转移到b细胞,而相当弱地转移至t细胞、单核细胞和nk细胞,与血小板或红细胞的结合极少或没有结合,从而说明与人全血中的b细胞的选择性结合。参见图7。
[0185]
图7显示双特异性tpp-1360例如主要与b细胞结合,与列出的其他细胞类型的结合量非常小,这可能是因为cd47的水平高于血细胞上的水平,或者是因为fc的作用,fc可以衔接在nk细胞和单核细胞上表达的fc受体。相反,由于tpp-23中cd47的普遍表达和与cd47的高亲和力,tpp-23(一种高亲和力cd47单特异性抗体)与所有这些细胞类型结合。
[0186]
tpp-1360在人全血中的总体结合特征类似于利妥昔单抗。相反,用作cd47表达对照的亲本cd47 mab tpp-23与人血液中的所有细胞群体显着结合。
[0187]
b.肿瘤细胞结合
[0188]
此外,例如,tpp-1360的rbc结合能力在纯化的人rbc中和人rbc与肿瘤细胞的共培养物中得到了广泛评估。如图8所示,tpp-1360选择性结合cd47
+
/cd20
+
raji细胞但不结合cd47
+
/cd20-人rbc。此外,在raji细胞和人rbc的共培养物中,tpp-1360显示出与cd47
+
/cd20
+
raji细胞的剂量依赖性结合,但不与人rbc结合,即使浓度高达1mg/ml。参见图9。相反,亲本cd47型/cd20双特异性tpp-2与raji细胞和人rbc均显着结合。此外,tpp-1360不显示与来
自多个供体的纯化食蟹猴rbc的结合。
[0189]
c.sirpα竞争
[0190]
在表明了其与cd20
+
/cd47
+
细胞的选择性结合后,使用体外竞争试验评估了tpp-1360拮抗人sirpα与细胞表面cd47相互作用的能力。tpp-1360有效阻断重组人sirpα-fc与在cd20
+
/cd47
+
淋巴瘤细胞系oci-ly3和raji表面上表达的人cd47的结合,平均ec50值分别为1.30nm和1.64nm。参见图10和图11。图10示出了tpp-1360例如有效且完全阻断重组人sirpα-fc与在cd20
+
/cd47
+
淋巴瘤细胞系oci-ly3表面上表达的人cd47的结合的事实。图11示出了tpp-1360例如有效且完全阻断重组人sirpα-fc与在cd20
+
/cd47
+
淋巴瘤细胞系raji表面上表达的人cd47的结合的事实。相比之下,利妥昔单抗和对照双特异性抗体tpp-1480(抗cd20/鸡卵溶菌酶)都不能与人sirpα-fc竞争结合相同的细胞系。本文提供的数据还表明,tpp-1360阻断人sirpα-cd47相互作用的效力低于tpp-23,这与tpp-1360与人cd47的亲和力减弱一致。
[0191]
实施例10:功能活动:人巨噬细胞吞噬作用
[0192]
本实施例表明了tpp-1360触发肿瘤吞噬作用的能力,如通过对标记的巨噬细胞内“吃掉的”cd20
+
cd47
+
肿瘤细胞进行自动计数而在体外测定的。
[0193]
cd20和cd47的表达首先在每个靶标肿瘤细胞系(oci-ly3、raji、rec-1和riva)中通过使用流式细胞术定量抗体结合能力(abc)来验证(denny tn等人,cytometry.1996年12月;26(4):265-74)。所有四种细胞系都表达高水平的cd47和cd20。
[0194]
表1:淋巴瘤细胞表面上的cd47和cd20抗原表达
[0195]
细胞系cd20 abccd47 abcoci-ly3154,000247,000rec-1510,036453,415riva722,000443,000raji522,596213,927
[0196]
abc=抗体结合能力。
[0197]
接下来,将滴定的抗体添加到预分化的巨噬细胞中,然后与用tpp-1360调理的羧基荧光素琥珀酰亚胺酯(csfe)标记的肿瘤细胞共培养。吞噬活性由标记巨噬细胞内标记肿瘤细胞的数量定量确定。在每个cd14别藻蓝蛋白(apc)标记的巨噬细胞中测量绿色强度(cfse),并使用阈值门来鉴定cfse阳性巨噬细胞。在整个实验中观察到大约1000mfi(平均荧光强度)的阈值,方差不超过几百mfi。对于每个样品,吞噬作用的计算百分比确定为:[(cfse阳性巨噬细胞的数量)/(总巨噬细胞的数量)]x 100。在至少两个供体中,用tpp-1360治疗诱导了巨噬细胞介导的四种cd20
+
恶性b细胞系的吞噬作用。图12(raji细胞)、图13(oci-ly3细胞)、图14(rec-1细胞)和图15(riva细胞)显示来自一个供体的代表性数据。计算曲线下面积,然后进行配对t检验以确定tpp-1360与利妥昔单抗相比的统计显着性。参见图16。数据显示在raji和oci-ly3细胞中,用tpp-1360进行的治疗比利妥昔单抗触发明显更有效的吞噬作用,这可能是由于通过tpp-1360同时阻断sirpα-cd47相互作用并参与活化受体,诸如fcγr。
[0198]
实施例11:药代动力学
[0199]
为了确定本文所描述的双特异性实体(抗体物种tpp-1360、tpp-1361、tpp-1362和
tpp-1367)的药代动力学(pk)特征,在小鼠和食蟹猴中进行了非glp研究。使用通过腹膜内(ip)注射给药10mg/kg抗体的原初、雌性、nod/scid小鼠进行单剂量小鼠pk研究。在72小时的过程中进行稀疏pk采样(每个时间点n=4),并且所有动物在整个研究期间都显示出可检测的抗体物种浓度。计算出的半衰期为3.4天,但考虑到采样持续时间可能会被低估。为了评估食蟹猴的pk特征,进行重复剂量探索性毒理学研究,并在第1天和第15天通过iv弹丸注射将20mg/kg的抗体物种给药三只原初雄猴。在重复给药抗体物种后,实现全身暴露,并且在整个研究期间(第15天给药后336小时),在3只猴中的2只的血清中可检测到抗体物种。作为血液学和免疫表型评估的重复剂量研究的一部分,还收集了样品。观察到的b淋巴细胞耗尽表明体内药物功能性。总体上,在单剂量小鼠和重复剂量猴研究中,抗体物种暴露在整个研究过程中均保持不变,两项研究之间报告的半衰期相似,范围为3天至3.5天。
[0200]
实施例12:安全性
[0201]
该系列高度评估的示例物种表现出可接受的毒理学特征,例如,耐受性良好,高达100mg/kg qw,即测试的最高剂量。作为对食蟹猴进行的为期28天的探索性毒理学研究的一部分,对毒代动力学进行了评估。tpp-1360在第1天、第4天、第8天、第11天和第15天以10mg/kg(biw)的剂量水平或在第1天、第8天和第15天以20mg/kg和100mg/kg(qw)的剂量水平通过对食蟹猴(4只/组)iv注射来biw或qw给药。采用夹心elisa法测量血清浓度,夹心elisa法使用抗利妥昔单抗进行捕获并使用山羊抗人igg fc进行检测。在10mg/kg、20mg/kg或100mg/kg的多次iv剂量后,tpp-1360的全身暴露在所有剂量水平下均实现,并在整个研究期间由所有动物维持。在20和100mg/kg剂量组中,tpp-1360表现出线性tk,c
max
和auc
0-168
与剂量大概成比例增加。第一次给药后,在10-100mg/kg剂量范围内清除率相似,表明目标饱和度为10mg/kg剂量。r
auc
值分别表明剂量5和剂量3在10(biw)mg/kg和100(qw)mg/kg剂量组中的一些tpp-1360积累。根据剂量水平和剂量方案,平均计算半衰期范围为2天至4天。在给药前第15天测试的5/8动物和研究第29天测试的5/6动物中检测到抗药物抗体。抗药物抗体确实影响了tpp-1360的暴露,如观察到的ada阳性动物暴露减少所证明。tpp-1360耐受性良好,高达100mg/kg qw,即测试的最高剂量。在10mg/kg biw和≥20mg/kg qw下观察到外周血和多个淋巴组织中b细胞的减少,表明了强大的药效动力学活性。给药10mg/kg biw并不提供超过20mg/kg qw的额外益处。除了对b细胞的影响外,tpp-1360还减少了所有剂量水平下的t细胞和nk细胞、≥20mg/kg qw下的中性粒细胞以及100mg/kg qw下的红细胞。然而,没有观察到与测试物品相关的血小板减少。t细胞、nk细胞、中性粒细胞和红细胞的减少被认为是由tpp-1360的cd47臂介导的,因为这些细胞不表达cd20。
[0202]
实施例13:免疫原性
[0203]
由epivax开发的交互式筛选和蛋白质再造工程介面(ispri)软件是一种用于评估人体内潜在抗体免疫原性的计算机计算方法,并且已知是临床上完善的t细胞依赖性分析工具(图18)。分析了tpp-1360的vh和vl氨基酸序列的推定t效应子和t调节热点,并且发现其免疫原性风险较低。
[0204]
实施例14:raji异种移植模型
[0205]
本文所描述的cd47xcd20双特异性实体在raji nod-scid模型中表现出比利妥昔单抗更好的体内功效。本研究的目的是确定tpp-1360或tpp-1362在表达较低水平cd20和较高水平cd47的raji异种移植模型中的单剂抗肿瘤活性。在雌性nod-scid小鼠的右侧接种
raji细胞。当肿瘤大小约为270mm3时开始给药。tpp-1360和tpp-1362以10mg/kg和30mg/kg的剂量进行测试,每周一次(qw)给药,持续2周。与cd20具有二价性的利妥昔单抗用作具有相同给药范例的比较剂。在研究结束时的第25天,当同种型对照(抗rsv igg1)组中的平均肿瘤体积达到约2000mm3时,确定最终的肿瘤体积减少。在10mg/kg和30mg/kg qw下(肿瘤体积减少52%)观察到tpp-1360的显着(p<0.0001)抗肿瘤活性,并且在10mg/kg qw(肿瘤减少62%)或30mg/kg qw(肿瘤减少64%)下也观察到tpp-1362的显着抗肿瘤活性。(图19至图20)在相同的给药方案中,利妥昔单抗在30mg/kg和10mg/kg下分别显示出33%和38%的tvr。tpp-1360 30mg/kg下qw的抗肿瘤活性显着(p<0.01)优于相应剂量水平下的利妥昔单抗,表明cd47臂对tpp-1360的抗肿瘤活性的作用。tpp-1362 30mg/kg下qw的抗肿瘤活性也显着(p<0.0001)优于相应剂量水平下的利妥昔单抗,表明cd47臂对tpp-1362的抗肿瘤活性的作用。在用同种型对照、tpp-1360、tpp-1362或利妥昔单抗治疗的动物中没有显着的体重减轻。
[0206]
序列表
[0207]
[0208]
[0209]
[0210]
[0211]
[0212]
[0213]
[0214]
[0215]
[0216]
[0217]
[0218]
[0219]
[0220]
[0221]
[0222]
[0223]
[0224]
[0225]
[0226]
[0227]
[0228]
[0229]
[0230]
[0231]
[0232]
[0233]
[0234]
[0235]
[0236]
[0237]
[0238]
[0239][0240]
***
[0241]
本文提及的所有公开案和专利均以引用方式并入。在不脱离本发明的范围和精神的情况下,所描述的主题的各种修改和变化对于本领域技术人员将是显而易见的。尽管已经结合特定实施方案描述了本发明,但应当理解,所要求保护的本发明不应被过度地限制于这些实施方案。实际上,用于实施本发明的各种修改对于本领域技术人员是显而易见的并且意在落入以下权利要求书的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1