用于治疗脱发的组合物的制作方法
用于治疗脱发的组合物
1.相关申请的交叉引用本技术要求2019年8月7日提交的美国临时专利申请序列号62/883,809和2019年9月4日提交的美国临时专利申请序列号62/895,869以及2020年3月23日提交的美国临时专利申请序列号63/100,611的优先权权益,其公开内容通过引用以其整体并入本文。
2.1. 技术领域本发明涉及某些前列腺素类似物单独地或与其它化合物(例如环孢菌素)组合用于预防脱发和/或使毛发生长的用途。本发明还涉及含有前列腺素类似物和环孢菌素的制剂,用于在头皮和身体其它部位上使毛发生长或预防脱发。本发明还涉及用于治疗某些脱发病症(例如雄激素性脱发和斑秃)的制剂和方法。
3.2.
背景技术:
脱发是心理破坏性病况,在男性和女性两者中都引起显著的心理压力。在所有男性中,到30岁有30%,到50岁有50%,而到70岁有80%将经历一些脱发。到60岁时,40%的女性经历脱发。男性(并且特别是青少年)和女性已经报道了由于脱发而对生活质量的负面影响。
4.使毛发生长通常分为四个阶段。使毛发生长初期阶段是活性使毛发生长的阶段,其持续2-6年,但对于头皮毛发通常持续3-5年。在使毛发生长初期期间,毛囊的上皮隔室经历快速增殖,其中在毛球基质细胞和毛囊中的最大增殖假定毛球使毛发生长初期形态。事实上,通过研究毛囊毛球形态可以确定毛发处于哪个阶段。使毛发生长中期阶段是使毛发生长初期阶段和休止期阶段之间的短暂过渡阶段,其对头皮毛发持续7-14天。休止期阶段称为“静止阶段”,在此阶段在毛发最终脱落之前使毛发生长停止,并且通常持续4-8周,并且真皮乳头与毛囊完全分离。第四阶段(其为休止期阶段结束或使毛发生长初期阶段开始)是外生阶段,在此阶段旧毛发脱落。使毛发生长初期阶段再次开始,其中真皮乳头向上移动回到与毛囊相遇,并且在新毛发射出旧毛发的地方,新毛发再次开始生长。
5.在没有脱发病症的人中,头皮上约90%的毛发处于使毛发生长初期阶段,约1-2%的毛发处于使毛发生长中期阶段,并且约8-9%的头皮毛发处于休止期阶段。随着雄激素性脱发的发作,更大比例的毛发处于休止期阶段,并且更少的毛发处于使毛发生长初期阶段。患者的毛囊明显少于没有脱发病症的人,其中典型的秃发者在他们的头皮上具有大约300个毛囊/平方英寸,而没有脱发病症的人将具有约450个毛囊/平方英寸。也许更重要的是,在患有雄激素性脱发的人的活性毛囊中,毛囊中的更多毛发将是毫毛而不是更长、直径更粗且更色素沉着的终毛。此外,毛发数量的增加将处于休止期阶段。
6.3.
技术实现要素:
发明内容包括以下实施方案:1. 用于治疗脱发的组合物,其包含约0.05%-0.1% w/w、w/v或v/v的拉坦前列素或拉坦前列素酸和0.05%-0.1% w/w、w/v或v/v的环孢菌素a和1.0%-15.0% w/w、w/v或v/v的二乙二醇单乙醚。
7.2. 实施方案1所述的组合物,其中所述组合物具有约0.05% w/w、w/v或v/v的拉坦前列素或拉坦前列素酸和约0.06% w/w、w/v或v/v的环孢菌素a和约10% w/w、w/v或v/v的二
乙二醇单乙醚。
8.3. 实施方案2所述的组合物,其进一步包含油醇。
9.4. 组合物,其进一步包含聚乙二醇或丙二醇。
10.5. 用于对经历脱发的患者使毛发生长的组合物,其包含约0.05%-0.1% w/w、w/v或v/v的拉坦前列素或拉坦前列素酸和0.05%-0.1% w/w、w/v或v/v的环孢菌素a和5.0%-15.0% w/w、w/v或v/v的captex 300 ep/nf。
11.6. 实施方案5所述的组合物,其中组合物包含0.06% w/w、w/v或v/v的拉坦前列素或拉坦前列素酸和0.08% w/w、w/v或v/v的环孢菌素a。
12.7. 实施方案6所述的组合物,其进一步包含10% w/w、w/v或v/v的captex 300 ep/nf。
13.8. 用于治疗脱发的组合物,其包含约0.05%-0.1% w/w、w/v或v/v的曲伏前列素或曲伏前列素酸和0.05%-0.1% w/w、w/v或v/v的环孢菌素a。
14.9. 根据实施方案8所述的组合物,其进一步包含选自二乙二醇单乙醚、captex 300 ep/nf、丙二醇和聚乙二醇的一种。
15.10. 根据实施方案1、5、8和9所述的组合物,其进一步包含油酸。
16.11.预防患者脱发的方法,所述方法包括给予需要其的患者根据实施方案1、5、8和9中的一项的制剂。
17.12. 实施方案11所述的方法,其中所述患者患有斑秃,并且将所述制剂一天一次施加到经历脱发的头皮上的区域。
18.13. 实施方案12所述的方法,其中将所述制剂一天两次施加。
19.14. 在患有脱发的患者中引起使毛发生长的方法,所述方法包括给予需要其的患者根据实施方案1、5、8和9中的一项的制剂,并且所述方法下调在所述毛囊毛球区域的t细胞浸润。
20.15. 实施方案14所述的方法,其中与如果所述患者未施加所述制剂相比,通过施加实施方案1、5、8和9中的一项的制剂,所述患者经历使毛发生长至更大的程度。
21.16. 实施方案10-15所述的方法,其中比起如果未施加所述制剂,所述制剂在使毛发生长初期阶段在毛发中保持得更长。
22.17. 实施方案14所述的方法,其中所述患者颠倒显著量的脱发。
23.18. 实施方案14所述的方法,其中所述制剂包含0.06% w/w、w/v或v/v的拉坦前列素酸和0.08% w/w、w/v或v/v的环孢菌素a和药学上可接受的溶剂和渗透增强剂。
24.19. 在患者的头皮上使毛发生长的方法,其中所述制剂包含0.1% w/w、w/v或v/v的拉坦前列素或拉坦前列素游离酸和环孢菌素。
25.20. 实施方案19所述的方法,其中所述环孢菌素为环孢菌素a。
26.21. 用于治疗脱发的组合物,其包含约0.05%-0.1% w/w、w/v或v/v的比马前列素和0.05%-0.1%的环孢菌素a和1.0%-25.0% w/w、w/v或v/v的二乙二醇单乙醚。
27.22. 用于使毛发生长的组合物,其包含约0.05%-0.1% w/w、w/v或v/v的比马前列素和0.05%-0.1%的环孢菌素a和1.0%-15.0% w/w、w/v或v/v的二乙二醇单乙醚。
28.23. 用于治疗脱发或使毛发生长的组合物,其包含约0.05%-0.5% w/w、w/v或v/v的拉坦前列素或拉坦前列素酸和1.0%-7.0% w/w、w/v或v/v的米诺地尔或米诺地尔硫酸盐。
29.24. 实施方案23所述的组合物,其中所述组合物具有约0.1%或0.3% w/w、w/v或v/v的拉坦前列素或拉坦前列素酸和约5.0% w/w的米诺地尔或米诺地尔硫酸盐。
30.25. 实施方案23所述的组合物,其进一步包含选自油醇、乙醇、油酸和二乙二醇单乙醚的一种。
31.26. 实施方案23所述的组合物,其中所述组合物具有选自0.1%、0.2%或0.3% w/w、w/v或v/v的拉坦前列素或拉坦前列素酸的一种和选自4.0%,5.0%、6.0%和7.0% w/w、w/v或v/v的米诺地尔或米诺地尔硫酸盐的一种。
32.27. 用于治疗脱发或使毛发生长的组合物,其包含约0.05%-0.1% w/w、w/v或v/v的比马前列素或比马前列素酸和1.0%-5.0% w/w、w/v或v/v的米诺地尔或米诺地尔硫酸盐。
33.28. 实施方案27所述的组合物,其中所述组合物具有选自0.1%、0.2%和0.3% w/w、w/v或v/v的比马前列素的一种和选自4.0%,5.0%、6.0%和7.0% w/w、w/v或v/v的米诺地尔的一种。
34.29. 实施方案27所述的组合物,其进一步包含油醇、油酸或乙醇。
35.30. 实施方案27所述的组合物,其进一步包含丙二醇或聚乙二醇。
36.31. 用于治疗脱发或使毛发生长的组合物,其包含约0.05%-0.5% w/w、w/v或v/v的曲伏前列素或曲伏前列素游离酸和1.0%-7.0% w/w、w/v或v/v的米诺地尔或米诺地尔硫酸盐。
37.32. 实施方案31所述的组合物,其中所述组合物具有约0.1% w/w、w/v或v/v的曲伏前列素或曲伏前列素游离酸和约5.0% w/w、w/v或v/v的米诺地尔或米诺地尔硫酸盐和至少5% w/w、w/v或v/v的二乙二醇单乙醚。
38.33. 实施方案1-10和20-32中任一项所述的组合物,其中将所述组合物施加到患者眉毛下方的皮肤以引起眉毛生长。
39.34. 实施方案1-10和20-32中任一项所述的组合物,其中将所述组合物施加到患者的上眼睑边缘或下眼睑边缘以引起睫毛生长。
40.35. 实施方案1-32中任一项所述的组合物,其中将所述组合物施加到患者的胡子或胡须下方的皮肤以引起胡子或胡须的使毛发生长。
41.36. 将毫毛转化为终毛的方法,通过向患者的毫毛的部位施加实施方案1-10和21-32所述的制剂。
42.37. 将中间毛发转化为终毛的方法,通过向患者的毫毛的部位施加实施方案23所述的制剂。
43.38. 增加选自毛发的长度、厚度和色素沉着的至少一种的方法,通过向患者的头皮施加实施方案1-10或21-32所述的组合物。
44.39. 实施方案23、27、31或33所述的组合物,其中所述组合物为凝胶。
45.40. 实施方案39所述的组合物,其中以选自一天一次、一天两次或一天三次的一种,将所述凝胶施加到眉毛。
46.41. 实施方案39所述的组合物,其中所述凝胶包含选自羧甲基纤维素钠、透明质酸或碳二亚胺和或其混合物的至少一种。
47.42. 实施方案41所述的组合物,其中所述羧甲基纤维素钠选自低粘度(90,000道尔顿)、中粘度(250,000道尔顿)和高粘度(700,000道尔顿)羧甲基纤维素和/或其混合物。
48.43. 实施方案40和41所述的组合物,其中一天一次或一天两次将所述凝胶施加到眉毛。
49.44. 第一组合物,其包含拉坦前列素或拉坦前列素酸和米诺地尔或米诺地尔硫酸盐,其中与作为单一疗法施加到所述皮肤并且以与在所述第一组合物中相同浓度的拉坦前列素或拉坦前列素酸和米诺地尔或米诺地尔硫酸盐相比,将所述组合物施加到所述皮肤导致使毛发生长更快的发作。
50.45. 实施方案44所述的组合物,其中包含拉坦前列素或拉坦前列素酸和米诺地尔的所述第一组合物以与作为单一疗法单独施加的拉坦前列素或拉坦前列素酸和米诺地尔相同的单独的浓度存在。
51.46. 实施方案44或45所述的组合物,其中将所述组合物施加到选自头皮、眉毛下方的皮肤、上眼睑边缘、下眼睑边缘和面部的一种。
52.47. 第一组合物,其包含拉坦前列素或拉坦前列素酸和米诺地尔或米诺地尔硫酸盐,其中在与它们存在于所述第一组合物中相同的单个浓度下作为单一疗法单独施加到所述皮肤的拉坦前列素或拉坦前列素酸和米诺地尔或米诺地尔硫酸盐相比,将所述第一组合物施加到所述皮肤导致更大的使毛发生长。
53.48. 实施方案47所述的第一组合物,其中当将包含拉坦前列素或拉坦前列素酸和米诺地尔或米诺地尔硫酸盐的所述第一组合物向所述头皮施加、眉毛下方的皮肤、上眼睑边缘、下眼睑边缘和面部时导致使毛发生长,比起在与它们存在于所述第一组合物中相同的浓度下作为单一疗法单独施加的拉坦前列素或拉坦前列素酸和米诺地尔,导致选自更长的毛发的一种。
54.49. 实施方案47所述的第一组合物,其包含拉坦前列素或拉坦前列素酸和米诺地尔或米诺地尔硫酸盐,比起作为单一疗法在相同的浓度下单独施加到所述皮肤的拉坦前列素或拉坦前列素酸和米诺地尔,当施加到所述皮肤时,导致更大的单个毛发直径或圆周。
55.50. 实施方案47所述的第一组合物,其包含拉坦前列素或拉坦前列素酸和米诺地尔或米诺地尔硫酸盐,与作为单一疗法在相同的浓度下单独施加到所述皮肤的施加拉坦前列素或拉坦前列素酸和米诺地尔或米诺地尔硫酸盐相比,当施加到所述皮肤时,导致单个毛发更大的黑色素浓度。
56.51. 第一组合物,其包含曲伏前列素或曲伏前列素游离酸和米诺地尔或米诺地尔硫酸盐,比起单独施加的曲伏前列素或曲伏前列素酸和米诺地尔或米诺地尔硫酸盐,当施加到所述皮肤时,导致使毛发生长,导致更长的毛发,其中与曲伏前列素或曲伏前列素酸和米诺地尔或米诺地尔硫酸盐单一疗法相比,曲伏前列素或曲伏前列素酸和米诺地尔或米诺地尔硫酸盐的浓度在相同的浓度下。
57.52. 实施方案51所述的第一组合物,其包含曲伏前列素或曲伏前列素游离酸和米诺地尔或米诺地尔硫酸盐,其中与它们存在于所述第一组合物中相同的单个浓度下作为单一疗法单独施加到所述皮肤的曲伏前列素或曲伏前列素酸和米诺地尔或米诺地尔硫酸盐相比,将所述第一组合物施加到所述皮肤导致更大的使毛发生长。
58.53. 实施方案51所述的第一组合物,其包含曲伏前列素或曲伏前列素游离酸和米诺地尔或米诺地尔硫酸盐,与它们存在于所述第一组合物中相同的单个浓度下作为单一疗法单独施加到所述皮肤的曲伏前列素或曲伏前列素游离酸和米诺地尔或米诺地尔硫酸盐
相比,当施加到所述皮肤时,导致更大的单个毛发直径或圆周。
59.54. 实施方案47所述的第一组合物,其包含曲伏前列素或曲伏前列素游离酸和米诺地尔或米诺地尔硫酸盐,与作为单一疗法在相同的浓度下单独施加到所述皮肤的施加曲伏前列素或曲伏前列素游离酸和米诺地尔或米诺地尔硫酸盐相比,当施加到所述皮肤时,导致单个毛发更大的黑色素浓度。
60.55. 刺激头皮上的使毛发生长的方法,通过向所述头皮施加选自实施方案1-10或21-32或39-54中的一项的组合物。
61.56. 刺激头皮上的使毛发生长的方法,通过向所述头皮施加选自制剂i-xxxxx中的一项的组合物。
62.57. 刺激毛囊的方法,以增加使毛发生长和一个或多个选自以下的性质:单个毛发长度、单个毛发直径或圆周、单个毛发深度、每个单个毛发的黑色素含量、增加每平方英寸皮肤的终毛与细毛的比率和在施加区域增加深色毛发比灰色毛发,包括在毛囊部位向哺乳动物皮肤施加有效量的组合物,其包含选自实施方案1-10或21-32、39、41或42中的一项或制剂i-xxxxx的一种。
63.58. 刺激毛囊的方法,以增加使毛发生长和一个或多个选自以下的性质:单个毛发长度、单个毛发直径或圆周、单个毛发深度、每个单个毛发的黑色素含量、增加每平方英寸皮肤的终毛与细毛的比率和在施加区域增加深色毛发比灰色毛发,包括在毛囊部位向哺乳动物皮肤施加有效量的组合物,其包含选自制剂i-xxxxx中的一项的一种。
64.59. 实施方案57和58所述的方法,其中将所述组合物施加到选自头皮、眉毛下方的表皮层、下眼睑边缘、上眼睑边缘和面部的一种。
65.60. 用于增加皮肤上的终毛数量的方法,通过在皮肤或表皮上施加有效量的组合物,其包含选自实施方案1-10或21-32或39、41或42中的一项或制剂i-xxxxx的一种。
66.61. 用于增加头皮上的终毛数量的方法,通过向哺乳动物皮肤施加有效量的组合物,其包含选自实施方案1-10或21-32或39、41、42和54中的一项或制剂i-xxxxx的一种。
67.62. 将灰色毛发转化为较深色毛发的方法,通过向哺乳动物皮肤施加有效量的组合物,其包含选自实施方案1-10或21-32或39、41、42和54中的一项或制剂i-xxxxx的一种。
68.63. 将灰色毛发转化为较深色毛发或增加毛发中的黑色素含量的方法,通过接近毛囊向哺乳动物皮肤施加有效量的组合物,其包含选自实施方案1-10或21-32或39-54中的一项或制剂i-xxxxx中的一项的一种。
69.64. 增加单个毛发的黑色素含量的方法,通过接近毛囊向哺乳动物皮肤施加有效量的组合物,其包含选自实施方案1-10或21-32或39-54中的一项或制剂i-xxxxx中的一项的一种。
70.65. 加深单个毛发的方法,通过在具有灰色毛发的皮肤区域中向哺乳动物皮肤施加有效量的组合物,其包含选自实施方案1-10或21-32或39-54中的一项或制剂i-xxxxx中的一项的一种。
71.66. 实施方案64和65所述的方法,其中所述方法增加单个毛发的黑色素含量和角蛋白含量。
72.67. 增加单个毛发的直径或圆周的方法,通过接近毛囊向哺乳动物皮肤施加有效量的组合物,其包含选自实施方案1-10或21-32或39-54中的一项或制剂i-xxxxx中的一项
的一种。
73.68. 增加单个毛发的直径、圆周或长度的方法,通过向毛囊施加有效量的组合物,其包含选自实施方案1-10或21-32或39-54中的一项或制剂i-xxxxx中的一项的一种。
74.69. 实施方案60-68所述的方法,其中将所述组合物施加到选自头皮、眉毛下方的皮肤、上眼睑边缘、下眼睑边缘和面部的一种。
75.70. 实施方案69所述的方法,其中所述哺乳动物是人。
76.71. 预防经历化学疗法的患者脱发的方法,所述方法包括在化学疗法之前、期间或之后,向选自头皮、眉毛下方的表皮层、上眼睑边缘和下眼睑边缘或面部的一种给予选自制剂i-xxxxx或实施方案1-10或21-32或39-54的制剂并施加所述实施方案或制剂。
77.72. 实施方案71所述的方法,其中在患者经历化学疗法治疗之前施加所述制剂以降低脱发的量。
78.73. 实施方案72所述的方法,其中选自在化学疗法治疗之前45天、在化学疗法治疗之前30天、在化学疗法治疗之前25天、在化学疗法治疗之前20天、在化学疗法治疗之前15天、在化学疗法治疗之前10天和在化学疗法治疗之前9、8、7、6、5、4、3、2和1天的一种施加所述制剂。
79.74. 实施方案72或73所述的方法,其中将所述制剂施加选自一天三次、一天两次和一天一次的一种。
80.75. 实施方案71-74所述的方法,其中与不接受制剂达相同的时间段的患者相比,所述患者选自头皮、眉毛、睫毛和面部的至少一种脱发较少。
81.76. 实施方案75所述的方法,其中与不接受制剂的患者相比,所述选自头皮、眉毛、睫毛和面部的至少一种的毛发更长、更深且更粗。
82.77. 实施方案75所述的方法,其中与不接受制剂的患者相比,所述选自头皮、眉毛、睫毛和面部的至少一种的毛发更多。
83.78. 实施方案71所述的方法,其中在患者正接受化学疗法治疗的同时施加所述制剂。
84.79. 实施方案78所述的方法,其中向选自头皮、眉毛、睫毛和面部的至少一种施加所述制剂选自一天三次、一天两次和一天一次的一种。
85.80. 实施方案79所述的方法,其中与不施加制剂的患者相比,所述患者选自头皮、眉毛、睫毛和面部脱发较少。
86.81. 实施方案78和79所述的方法,其中与不接受治疗的患者相比,所述选自头皮、眉毛、睫毛和面部的至少一种的毛发更长、更深、更多且更粗。
87.82. 实施方案78-81所述的方法,其中在接受化学疗法治疗的同时向患者施加所述制剂。
88.83. 段落82所述的方法,其中在完成化学疗法治疗之后向患者施加所述制剂。
89.84. 实施方案83所述的方法,其中在完成化学疗法治疗之后,向患者施加所述制剂选自1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、13个月、14个月、15个月、16个月、17个月、18个月、19个月、20个月、21个月、22个月、23个月和24个月的一种。
90.85. 实施方案84所述的方法,其中在化学疗法治疗之后,与不接受治疗的患者相
比,所述选自头皮、眉毛、睫毛和面部的至少一种的毛发更长、更深、更多且更粗。
91.86. 实施方案84所述的方法,其中比起如果患者不施加制剂,向选自头皮、眉毛、睫毛和面部的一种施加制剂i-xxxxx或实施方案1-10或21-31或39-54导致毛发进入使毛发生长初期阶段更快和/或达更长的持续时间。
92.87. 实施方案85所述的方法,其中比起如果患者不施加制剂,向选自头皮、眉毛、睫毛和面部的一种施加制剂导致毛发进入使毛发生长初期阶段更长。
93.88. 拉坦前列素或拉坦前列素酸和米诺地尔或米诺地尔硫酸盐组合用于治疗患有脱发的患者脱发的用途。
94.89. 实施方案88所述的用途,其中拉坦前列素或拉坦前列素酸以约0.08-0.5% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约2%-8% w/v、w/w或w/v的浓度存在。
95.90. 实施方案89所述的用途,其中拉坦前列素或拉坦前列素酸以约0.1-0.3% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以选自1%、2%、3%、4%、5%、6%、7%、8%、9%和10% w/v、w/w或v/v的一种的浓度存在。
96.91. 实施方案90所述的用途,其中拉坦前列素或拉坦前列素酸以约0.2% w/v、w/w或w/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
97.92. 实施方案90所述的用途,其中拉坦前列素或拉坦前列素以约0.3% w/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
98.93. 实施方案90所述的用途,其中拉坦前列素以约0.8% w/v的浓度存在,并且米诺地尔以约4% w/v的浓度存在。
99.94. 实施方案88-93所述的用途,其中所述脱发为选自头皮毛发、眉毛、睫毛或面部毛发的至少一种。
100.95. 拉坦前列素或拉坦前列素酸和米诺地尔或米诺地尔硫酸盐组合用于患者毛发生长的用途。
101.96. 实施方案95所述的用途,其中所述患者患有脱发。
102.97. 实施方案95所述的用途,其中拉坦前列素或拉坦前列素酸以约0.08-0.5% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约2%-8% w/v、w/w或v/v的浓度存在。
103.98. 实施方案95所述的用途,其中拉坦前列素或拉坦前列素酸以约0.1-0.3% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以4%-7% w/v、w/w或v/v的浓度存在。
104.99. 实施方案95所述的用途,其中拉坦前列素或拉坦前列素酸以约0.2% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约4% w/v、w/w或v/v的浓度存在。
105.100. 实施方案95所述的用途,其中拉坦前列素或拉坦前列素酸以约0.3% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
106.101. 实施方案95所述的用途,其中拉坦前列素或拉坦前列素酸以约0.1% w/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
107.102. 实施方案88-93和97-100所述的用途,其中所述脱发为选自头皮毛发、眉毛、睫毛或面部毛发的至少一种。
108.103. 曲伏前列素或曲伏前列素游离酸和米诺地尔或米诺地尔硫酸盐组合用于治疗患有脱发的患者脱发的用途。
109.104. 实施方案103所述的用途,其中曲伏前列素或曲伏前列素游离酸以约0.08-0.5% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约2%-8% w/v、w/w或v/v的浓度存在。
110.105. 实施方案103所述的用途,其中曲伏前列素或曲伏前列素游离酸以约0.07%-0.3% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以4%-7% w/v、w/w或v/v的浓度存在。
111.106. 实施方案103所述的用途,其中曲伏前列素或曲伏前列素游离酸以约0.2% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
112.107. 实施方案103所述的用途,其中曲伏前列素或曲伏前列素游离酸以约0.3% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
113.108. 实施方案103所述的用途,其中曲伏前列素或曲伏前列素游离酸以约0.1% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
114.109. 实施方案103-108所述的用途,其中所述脱发为选自头皮毛发、眉毛、睫毛或面部毛发的至少一种。
115.110. 曲伏前列素或曲伏前列素游离酸和米诺地尔或米诺地尔硫酸盐组合用于患者毛发生长的用途。
116.111. 实施方案110所述的用途,其中所述患者患有脱发。
117.112. 实施方案111所述的用途,其中曲伏前列素或曲伏前列素游离酸以约0.08-0.5% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约2%-8% w/v、w/w或v/v的浓度存在。
118.113. 实施方案111所述的用途,其中曲伏前列素或曲伏前列素游离酸以约0.1-0.3% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以4%-7% w/v,w/v、w/w或v/v的浓度存在。
119.114. 实施方案95所述的用途,其中曲伏前列素或曲伏前列素游离酸以约0.2% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
120.115. 实施方案95所述的用途,其中曲伏前列素或曲伏前列素以约0.3% w/v、w/w或v/v的浓度存在,并且米诺地尔以约5% w/v、w/w或v/v的浓度存在。
121.116. 实施方案95所述的用途,其中曲伏前列素或曲伏前列素游离酸以约0.07%或0.08% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约4%,5%或6% w/v、w/w或v/v的浓度存在。
122.117. 实施方案103-108所述的用途,其中所述脱发为选自头皮毛发、眉毛、睫毛或面部毛发的至少一种。
123.118. 比马前列素和米诺地尔或米诺地尔硫酸盐组合用于治疗患有脱发的患者脱
发的用途。
124.119. 实施方案118所述的用途,其中比马前列素以约0.08-0.5% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约2%-8% w/v、w/w或v/v的浓度存在。
125.120. 实施方案119所述的用途,其中比马前列素以约0.1-0.3% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以4%-7% w/v、w/w或v/v的浓度存在。
126.121. 实施方案118所述的用途,其中比马前列素以约0.2% w/v,w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
127.122. 实施方案90所述的用途,其中比马前列素以约0.3% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
128.123. 实施方案90所述的用途,其中比马前列素以约0.1% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
129.124. 实施方案119-123所述的用途,其中所述脱发为选自头皮毛发、眉毛、睫毛或面部毛发的至少一种。
130.125. 比马前列素和米诺地尔组合用于患者毛发生长的用途。
131.126. 实施方案95所述的用途,其中所述患者患有脱发。
132.127. 实施方案119所述的用途,其中比马前列素以约0.08-0.5% w/v、w/w或v/v的浓度存在,并且米诺地尔以约2%-8% w/v、w/w或v/v的浓度存在。
133.128. 实施方案127所述的用途,其中比马前列素以约0.08% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以4%-7% w/v、w/w或v/v的浓度存在。
134.129. 实施方案95所述的用途,其中比马前列素以约0.9% w/、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约4% w/v、w/w或v/v的浓度存在。
135.130. 实施方案127所述的用途,其中比马前列素以约0.3% w/v、w/w或v/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约5% w/v、w/w或v/v的浓度存在。
136.131. 实施方案127所述的用途,其中比马前列素以约0.1% w/v的浓度存在,并且米诺地尔或米诺地尔硫酸盐以约4% w/v、w/w或v/v的浓度存在。
137.132. 实施方案126-131所述的用途,其中所述脱发为选自头皮毛发、眉毛、睫毛或面部毛发的至少一种。
138.133. 用于治疗脱发的组合物,其包含约0.05%-0.5 % w/v、w/w或v/v的选自拉坦前列素和拉坦前列素酸的一种和1%-8% w/v、w/w或v/v的米诺地尔。
139.134. 实施方案133所述的组合物,其中所述组合物具有约0.3% w/v、w/w或v/v的拉坦前列素或拉坦前列素酸和约5% w/v、w/w或v/v的米诺地尔或米诺地尔硫酸盐。
140.135. 实施方案133所述的组合物,其中所述组合物具有约0.07% w/v、w/w或v/v的拉坦前列素或拉坦前列素酸和约4-6% w/v、w/w或v/v的米诺地尔或米诺地尔硫酸盐。
141.136. 实施方案133所述的组合物,其进一步包含油醇或乙醇。
142.137. 实施方案136所述的组合物,其进一步包含丙二醇。
143.138. 实施方案133所述的组合物,其中所述脱发是由于雄激素性脱发。
144.139. 实施方案137所述的组合物,其中所述脱发是由于斑秃。
145.140. 实施方案137所述的组合物,其进一步包含乙酸,选自聚山梨醇酯60和聚氧乙烯月桂醇的一种。
146.141. 实施方案134所述的组合物,其进一步包含乙酸,选自聚山梨醇酯60和聚氧乙烯月桂醇的一种。
147.142. 实施方案137所述的组合物,其进一步包含乙醇和选自丙二醇和聚山梨醇酯80的至少一种。
148.143. 实施方案142所述的组合物,其中乙醇以约25%-50% w/v的浓度存在。
149.144. 实施方案143所述的组合物,其中所述组合物进一步包含油醇。
150.145. 实施方案144所述的组合物,其进一步包含二乙二醇单乙醚。
151.146. 实施方案134所述的组合物,其进一步包含乙醇、丙二醇、水和选自苄醇、油酸、油醇和聚氧乙烯月桂醇的至少一种。
152.147. 实施方案135所述的组合物,其中所述组合物包含乙醇、丙二醇、聚山梨醇酯、水和选自乙酸、油酸和油醇的至少一种。
153.148. 实施方案147所述的组合物,其中所述组合物包含约0.1-0.5% w/v、w/w或v/v的乙酸。
154.149. 实施方案147所述的组合物,其中所述组合物包含约5%-60% w/v、w/w或v/v的丙二醇。
155.150. 实施方案133所述的组合物,其中所述组合物包含乙醇、丙二醇、聚山梨醇酯、水和选自乙酸、油酸和油醇的至少一种。
156.151. 在头皮上使毛发生长的方法,通过至少一天一次向头皮施加实施方案134所述的制剂,其中比起不接受制剂的头皮的区域,施加制剂的头皮的区域将使毛发生长至更大的程度。
157.152. 使毛发生长的方法,包括给予皮肤实施方案135所述的制剂,其中比起不接受制剂的头皮的区域,所述制剂引起施加到头皮的区域的休止期阶段的毛发进入使毛发生长初期阶段更快。
158.153. 增强指甲生长或治疗患有脆性指甲综合征的患者的方法,包括给予患者选自实施方案1-10或21-31或35-54的制剂和制剂i-xxxxx,局部施加到患者的手指甲或角质层至少一天一次。
159.154. 实施方案153所述的方法,其中所述方法可用于治疗选自以下的脚指甲或手指甲病症:银屑病甲、银屑病甲营养不良、脆甲综合征、增加甲长度和厚度、甲床炎、甲癣、滋养甲、嵌甲、甲营养不良、甲弯曲、甲脱离、无甲、甲肥厚、甲癣、脆甲症、甲癣、甲床角化、甲脱落、甲沟炎、假单胞菌属、翼状胬肉和翼状胬肉倒伏甲屑、凹甲、甲下血肿或对指甲的其它创伤、叶酸缺乏、白甲病、指甲髌骨综合征、黑甲、蛋白质缺乏、甲脆裂和脱皮、甲基丙烯酸甲酯受损的甲、维生素c缺乏、维生素缺乏、甲癣、与扁平苔癣相关的甲、雷诺氏病、与类风湿性关节炎相关的出血、与某些种类的中毒相关的博氏线和米氏线。
160.155. 在毛囊中和毛囊周围或密切接近毛囊的细胞中在黑素细胞中刺激黑素生成同时引起使毛发生长的方法,通过给予毛囊实施方案1-10或21-31或35-54中的一项或制剂i-xxxxx中的一项,其中与没有将所述实施方案或制剂施加到毛囊相比,所述黑素细胞将以更快的发作进入黑素生成。
161.156. 实施方案155所述的方法,其中与没有将实施方案或制剂局部施加到毛囊相比,所述黑素细胞中的黑素体生产更多的黑色素。
162.157. 实施方案155所述的方法,其中与没有将所述实施方案或制剂施加到毛囊相比,所述黑素细胞中的黑素体生产更多的选自黑色真黑素、褐色真黑素、黄色褐黑素和红褐色褐黑素的一种。
163.158. 使毛发生长的方法,其中与没有施加制剂相比,施加选自实施方案5、6、7、18、19、20、23、24-26、44、45、47、48、49、50、88-93、95、97-101的一种导致较深色的新的使毛发生长。
164.159. 实施方案158所述的方法,其中与在实施方案5、6、7、18、19、20、23、24-26、44、45、47、48、49、50、88-93、95、97-101中相同的组合物但是其中比马前列素更换为在单个实施方案并且在相同的浓度下的拉坦前列素相比,施加选自实施方案5、6、7、18、19、20、23、24-26、44、45、47、48、49、50、88-93、95、97-101的一种导致较深色的新的使毛发生长。
165.160. 实施方案158所述的方法,其中与在实施方案5、6、7、18、19、20、23、24-26、44、45、47、48、49、50、88-93、95、97-101中相同的组合物但是其中曲伏前列素更换为在单个实施方案并且在相同的浓度下的拉坦前列素相比,施加选自实施方案5、6、7、18、19、20、23、24-26、44、45、47、48、49、50、88-93、95、97-101的一种导致较深色的新的使毛发生长。
166.161. 在毛囊中和毛囊周围或密切接近毛囊的细胞中在角质化细胞中刺激角质生成同时引起使毛发生长的方法,通过给予毛囊实施方案1-10或21-31或35-54中的一项或制剂i-xxxxx中的一项,其中与没有所述施加实施方案或制剂相比,所述角质化细胞将以更快的发作进入角质生成和/或更长的持续时间。
167.162. 实施方案161所述的方法,其中与没有将所述实施方案或制剂局部施加到毛囊相比,所述角质化细胞生产直径和/或圆周更粗或更大的毛发。
168.163. 使毛发生长的方法,其中与没有施加制剂相比,施加选自实施方案5、6、7、18、19、20、23、24-26、44、45、47、48、49、50、88-93、95、97-101的一种导致选自直径更粗、更长、更大并且圆周更大的一种的新的使毛发生长。
169.164. 实施方案163所述的方法,其中与在实施方案5、6、7、18、19、20、23、24-26、44、45、47、48、49、50、88-93、95、97-101中相同的组合物但是其中比马前列素更换为在单个实施方案并且在相同的浓度下的拉坦前列素相比,施加选自实施方案5、6、7、18、19、20、23、24-26、44、45、47、48、49、50、88-93、95、97-101的一种导致选自直径更粗、更长、更大并且圆周更大的一种的新的使毛发生长。
170.165. 实施方案163所述的方法,其中与在实施方案5、6、7、18、19、20、23、24-26、44、45、47、48、49、50、88-93、95、97-101中相同的组合物但是其中曲伏前列素更换为在单个实施方案并且在相同的浓度下的拉坦前列素相比,施加选自实施方案5、6、7、18、19、20、23、24-26、44、45、47、48、49、50、88-93、95、97-101的一种导致选自直径更粗、更长、更大并且圆周更大的一种的新的使毛发生长。
171.166. 增加使毛发生长的方法,通过向毛囊施加实施方案1-10或21-32或35-54中的一项或制剂i-xxxxx中的一项并且向毛囊施加红外辐射。
172.167. 实施方案166所述的方法,其中在向毛囊施加实施方案1-10或21-31或35-54或制剂i-xxxxx中的一项之后施加所述红外辐射。
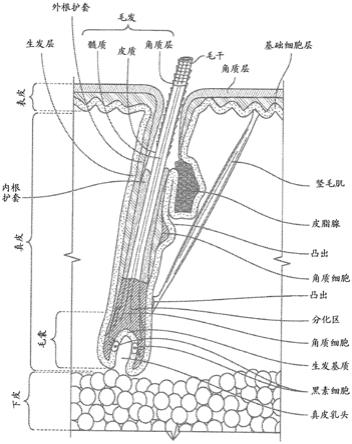
173.168. 实施方案167所述的方法,其中从毛囊上方通过装置施加所述红外辐射选自1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23和24小时的一种的时
间段。
174.169. 组合物,其包含他氟前列素和米诺地尔。
175.170. 用于治疗脱发的组合物,其包含约0.05%-0.3% w/w、w/v或v/v的他氟前列素和1%-5% w/w、w/v或v/v的米诺地尔。
176.171. 实施方案169和170所述的组合物,所述组合物,其进一步包含聚乙二醇或丙二醇和乙醇。
177.172. 实施方案169、170和171所述的组合物,其进一步包含0.1% w/v的他氟前列素和5 % w/v的米诺地尔。
178.173. 用于治疗脱发的组合物,其包含他氟前列素和非那雄胺。
179.174. 实施方案173所述的组合物,其包含0.05% w/v-0.3% w/v的他氟前列素和0.05% w/v-0.3% w/v的非那雄胺。
180.175. 用于治疗脱发的组合物,其包含他氟前列素和环孢菌素。
181.176. 实施方案175所述的组合物,其包含0.05%-0.1% w/w、w/v或v/v的他氟前列素和0.05%-0.1% w/w、w/v或v/v的环孢菌素。
182.177. 实施方案176所述的组合物,其中所述环孢菌素为环孢菌素a。
183.4. 附图说明图1是包括周围组织的毛囊的解剖的描述;图2是使毛发生长的各个阶段的描述;图3是本发明的一种制剂的建议作用机理;图4显示施加制剂xx随后施加制剂xviii的46岁女性患者毛发生长;和,图5显示施加制剂xx随后施加制剂xviii的53岁男性患者毛发生长。
184.5. 具体实施方式a. 前列腺素类似物本发明的前列腺素类似物包括拉坦前列素、比马前列素、曲伏前列素、乌诺前列素异丙酯、那些化合物的游离酸和文献中已知的其它前列腺素类似物。
185.本发明的化合物一般可以由式i表示:其中虚线键表示可以是顺式或反式构型的单键或双键,a为具有2-6个碳原子的亚烷基或亚烯基,该基团可以被一个或多个氧化物基团间断并且被一个或多个羟基、氧代、烷氧基或烷基羧基取代,其中所述烷基包含1-6个碳原子;b为具有3-7个碳原子的环烷基(其可以是未取代的或被选自以下的一种取代:h、甲基或全氟甲基)或芳基(其选自具有4-10个碳原子的烃基芳基和杂芳基,其中杂原子可以
选自氮、氧、卤素原子(例如氟))、具有1-6个碳原子并且任选地被卤素和硫原子取代的低级烷基;x为选自-o(r4)和-n(r4)2(其中r4可以相同或不同并且独立地选自氢、-ch3、任选地被h或-ch3取代的具有1-6个碳原子的低级烷基)、r
5-c-或r
5-o-c-(其中r5为具有1-6个碳原子的低级烷基)的基团;z为=o或表示2个氢基团;r1和r2中的一个为=o、-oh或-o(co)r6基团,并且另一个为-oh或-o(co)r6,或者r1为=o并且r2为h,其中r6为具有1-约20个碳原子的饱和或不饱和的无环烃基或-(ch2)mr7,其中m为0或1-10的整数,并且r7为具有3-7个碳原子的环烷基或如上定义的烃基芳基或杂芳基或其药学上可接受的盐,然而条件是当b未被含杂原子的侧基取代并且z为=o时,则x不是-or4。即,环烷基或烃基芳基或杂芳基不被具有除碳或氢以外的原子的侧基取代。
186.本发明的化合物还可以由以下通式ii表示:其中虚线键表示可以是顺式或反式构型的单键或双键,其中y为0或1,x为0或1,并且x和y不都是1,y为选自烷基、卤素(例如氟、氯等)、硝基、氨基、硫醇、羟基、烷氧基、烷基羧基、卤素取代的烷基(例如全氟甲基、全氟乙基和全氟丙基)的基团,其中所述烷基包含1-6个碳原子,并且n为0或1-约3的整数,并且r3为=o、-oh或-o(co)r6,其中r6如上定义。优选,n为1或2。
187.x为选自-o(r4)和-n(r4)2(其中r4可以相同或不同并且独立地选自氢、-ch3、任选地被h或-ch3取代的具有1-6个碳原子的低级烷基)、r
5-c-或r
5-o-c-(其中r5为具有1-6个碳原子的低级烷基)的基团;z为=o或表示2个氢基团;r1和r2中的一个为=o、-oh或-o(co)r6基团,并且另一个为-oh或-o(co)r6,或者r1为=o并且r2为h,其中r6为具有1-约20个碳原子的饱和或不饱和的无环烃基或-(ch2)mr7,其中m为0或1-10的整数,并且r7为具有3-7个碳原子的环烷基或如上定义的烃基芳基或杂芳基或其药学上可接受的盐,然而条件是当b未被含杂原子的侧基取代并且z为=o时,则x不是-or4。即,环烷基或烃基芳基或杂芳基不被具有除碳或氢以外的原子的侧基取代。
188.化合物还可以由通式(iii)表示。
189.本发明的化合物还可以由通式(iv)表示:或者由通式v表示:在所有上式中,碳5和6之间(c-5)、碳13和14之间(c-13)、碳8和12之间(c-8)和碳10和11之间(c-10)的键上的虚线指示可以是顺式或反式构型的单键或双键。如果使用2条实线,则指示该双键的具体构型。c-9、c-11和c-15位置的阴影线指示α构型。如果要画出β构型,则将使用实心三角形线。
190.y为0或1,x为0或1,并且x和y不都是1,y为选自烷基、卤素(例如氟、氯等)、硝基、氨基、硫醇、羟基、烷氧基、烷基羧基、卤素取代的烷基(例如全氟甲基、全氟乙基和全氟丙基)的基团,其中所述烷基包含1-6个碳原子等,并且n为0或1-约3的整数,并且r3为=o、-oh或-o(co)r6,其中r6如上定义。优选,n为1或2。
191.x为选自-o(r4)和-n(r4)2(其中r4可以相同或不同并且独立地选自氢、-ch3、任选地被h或-ch3取代的具有1-6个碳原子的低级烷基)、r
5-c-或r
5-o-c-(其中r5为具有1-6个碳原子的低级烷基)的基团;z为=o或表示2个氢基团;r1和r2中的一个为=o、-oh或-o(co)r6基团,并且另一个为-oh或-o(co)r6,或者r1为=o并且r2为h,其中r6为具有1-约20个碳原子的饱和或不饱和的
无环烃基或-(ch2)mr7,其中m为0或1-10的整数,并且r7为具有3-7个碳原子的环烷基或如上定义的烃基芳基或杂芳基或其药学上可接受的盐,然而条件是当b未被含杂原子的侧基取代并且z为=o时,则x不是-or4。即,环烷基或烃基芳基或杂芳基不被具有除碳或氢以外的原子的侧基取代。
192.在根据本发明使用的化合物中,预期以α或β构型的具有c-9或c-11或c-15取代基的化合物。如上所述,在本文提供的所有式中,与环戊烷环连接的虚线指示α-构型的取代基。与环戊烷环连接的粗实线指示α-构型的取代基。另外,羟基或其它取代基与c-11和c-15碳原子的虚线连接表示α构型。
193.为了本发明的目的,除非进一步限定,否则术语“烷基”是指具有1-10个碳原子的烷基,术语“环烷基”是指具有3-7个碳原子的环烷基,术语“芳基”是指具有4-10个碳原子的芳基。术语“饱和或不饱和的无环烃基”用于指具有1-约6个(优选1-约4个)碳原子的直链或支链、饱和或不饱和的烃基。这样的基团包括适当长度的烷基、烯基和炔基,并且优选烷基,例如甲基、乙基、丙基、丁基、戊基或己基,或其异构体形式。
194.r6的定义可以包括环状组分-(ch2)mr7,其中n为0或1-10的整数,r7为约3-约7个碳原子的脂族环或芳族或杂芳族环。“脂族环”可以是饱和或不饱和的,并且优选为具有3-7个碳原子(包括端值)的饱和环。作为芳族环,r7优选为苯基,并且杂芳族环具有氧、氮或硫作为杂原子,即r7可以是噻吩基、呋喃基、吡啶基等。优选,m为0或1-4的整数。
195.z为=o或表示2个氢原子。
196.x可以选自-o(r4)和-n(r4)2,其中r4可以相同或不同并且独立地选自氢、-ch3、任选地被h或-ch3取代的具有1-6个碳原子的低级烷基、或,其中r5为具有1-6个碳原子的低级烷基。
197.1) 拉坦前列素拉坦前列素具有以下结构:拉坦前列素是前列腺素类似物,并且实际上是具有其酸形式(拉坦前列素酸)的生物活性的前药:
拉坦前列素是异丙酯,并且是通过r[(3r)-3-羟基-5-苯基戊基]环戊基]庚-5-烯酸转化为拉坦前列素游离酸的前药。拉坦前列素的游离酸形式作为人重组fp受体的fp受体配体,比拉坦前列素的效力高,为200倍。拉坦前列素游离酸是有效的fp受体激动剂,对人fp受体的ec
50
为3.6 nm,这是pgf
2α
效力的两倍。pg类似物酯用于治疗青光眼或升高的iop的功效与游离酸的fp受体结合亲和力密切相关。可以用于本发明的拉坦前列素的其它形式包括15-酮拉坦前列素、15(s)-拉坦前列素、5-反式拉坦前列素、拉坦前列素-d4、拉坦前列素乳醇和拉坦前列素乙基酰胺-d4。
[0198]
拉坦前列素是在水中溶解性差但通常脂溶性的分子。拉坦前列素与比马前列素相比是更加脂溶性的。如果需要不含有机溶剂的拉坦前列素溶液,其可以通过蒸发乙酸甲酯并将纯油直接溶解在水性缓冲液中来制备。拉坦前列素在pbs (ph 7.2)中的溶解度为约50 μg/ml。为了在水性缓冲液中的最大溶解度,应首先将拉坦前列素溶解在乙醇或丙二醇中,然后用选择的水性缓冲液稀释。使用该方法,拉坦前列素在1:4的乙醇:pbs (ph 7.2)溶液中的溶解度为400 μg/ml。在酸性或碱性水性溶液中,拉坦前列素稳定不超过48小时,而在中性水性溶液中,其已显示在室温下稳定长达一个月。拉坦前列素为17-苯基-13,14-二氢前列腺素f2a (17-苯基-13,14-二氢pgf2a)的异丙酯。
[0199]
即使在丙二醇、甲醇、乙醇和2-丙醇中可以使用的最高浓度(5%)下,也可以获得足够量的溶解度。此外,已经注意到拉坦前列素可以溶解在合适的溶解剂例如醇(丙二醇、甲醇、乙醇、2-丙醇)和其它共溶剂例如一些芳族和多元醇(鲸蜡醇、硬脂醇、苄醇、甘油单油酸酯、poe硬脂酸酯、聚氧乙烯月桂醇、1,3-丁二醇、甘油)中。
[0200]
包括15-酮拉坦前列素、15(s)-拉坦前列素、5-反式拉坦前列素、拉坦前列素-d4、拉坦前列素乳醇、拉坦前列素乙基酰胺-d4和拉坦前列素酸的拉坦前列素可以以下列浓度存在于本发明的制剂中:0.001%、0.002%、0.003%、0.004%、0.005%、0.006%、0.007%、0.008%、0.009%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.11%、0.12%、0.13%、0.14%、0.15%、0.16%、0.17%、0.18%、0.19%、0.2%、0.21%、0.22%、0.23%、0.24%、0.25%、0.26%、0.27%、0.28%、0.29%、0.3%、0.31%、0.32%、0.33%、0.34%、0.35%、0.36%、0.37%、0.38%、0.39%、0.4%、0.41%、0.42%、0.43%、0.44%、0.45%、0.46%、0.47%、0.48%、0.49%、0.5%、0.55%、0.6%、0.65%、0.7%、0.75%、0.8%、0.85%、0.9%、0.95%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、6.0%、7.0%、8.0%、9.0%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%和25% w/w、w/v或v/v。
[0201]
包括15-酮拉坦前列素、15(s)-拉坦前列素、5-反式拉坦前列素、拉坦前列素-d4、拉坦前列素乳醇、拉坦前列素乙基酰胺-d4和拉坦前列素酸的拉坦前列素可以单独或与其它前列腺素类似物组合存在于本发明的制剂中。包括15-酮拉坦前列素、15(s)-拉坦前列素、5-反式拉坦前列素、拉坦前列素-d4、拉坦前列素乳醇、拉坦前列素乙基酰胺-d4和拉坦前列素酸的拉坦前列素可以单独或与局部米诺地尔或米诺地尔硫酸盐或局部或口服非那雄胺组合存在于本发明的制剂中。包括15-酮拉坦前列素、15(s)-拉坦前列素、5-反式拉坦前列素、拉坦前列素-d4、拉坦前列素乳醇、拉坦前列素乙基酰胺-d4和拉坦前列素酸的拉坦前列素可以单独或与环孢菌素式i、ii和iii组合存在于本发明的制剂中。
[0202]
2) 曲伏前列素曲伏前列素是合成的前列腺素f类似物和生物活性游离酸的异丙酯。其化学名称为[1r[1α(z),2β(1e,3r*),3α,5α]]-7-[3,5-二羟基-2-[3-羟基-4-[3(三氟甲基)苯氧基]-1-丁烯基]环戊基]-5-庚烯酸,1-甲基乙酯。其分子式为c
26h35
f3o6并且分子量为500.55:曲伏前列素游离酸具有以下结构:曲伏前列素和曲伏前列素游离酸可以以下列浓度存在于本发明的制剂中:0.001%、0.002%、0.003%、0.004%、0.005%、0.006%、0.007%、0.008%、0.009%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.11%、0.12%、0.13%、0.14%、0.15%、0.16%、0.17%、0.18%、0.19%、0.2%、0.21%、0.22%、0.23%、0.24%、0.25%、0.26%、0.27%、0.28%、0.29%、0.3%、0.31%、0.32%、0.33%、0.34%、0.35%、0.36%、0.37%、0.38%、0.39%、0.4%、0.41%、
0.42%、0.43%、0.44%、0.45%、0.46%、0.47%、0.48%、0.49%、0.5%、0.55%、0.6%、0.65%、0.7%、0.75%、0.8%、0.85%、0.9%、0.95%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、6.0%、7.0%、8.0%、9.0%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%和25% w/w、w/v或v/v。
[0203]
曲伏前列素和曲伏前列素游离酸可以单独或与其它前列腺素类似物或其它使毛发生长化合物组合存在于本发明的制剂中。曲伏前列素和曲伏前列素游离酸可以单独或与局部米诺地尔或米诺地尔硫酸盐或局部或口服非那雄胺组合存在于本发明的制剂中。曲伏前列素和曲伏前列素游离酸可以与环孢菌素式i、ii或iii组合。
[0204]
3) 乌诺前列酮异丙酯乌诺前列酮异丙酯具有以下结构:乌诺前列酮异丙酯是转化为具有以下结构的乌诺前列酮游离酸的前药:已经显示虽然乌诺前列酮异丙酯和乌诺前列酮游离酸在降低眼内压方面有效,但是不引起使毛发生长,并且事实上可能抑制使毛发生长(mccarey b. e., kapik b. m., kane f. e. [2004])。报告了使用0.15%乌诺前列酮异丙酯在两个随机临床试验中虹膜色素沉着和睫毛变化的低发生率。(ophthalmology 111,1480-1488)。这证明前列腺素类似物用于使毛发生长的不可预测性,并且许多前列腺素类似物不能使毛发生长并且可能抑制使毛发生长。
[0205]
4) 比马前列素比马前列素是来自一组生物脂质的前列腺酰胺,其与前列腺素相关,但含有末端乙醇酰胺基团,并且其靶向与前列腺素类似物(例如拉坦前列素或曲伏前列素)不同的受体。在技术上,比马前列素不被认为是前列腺素类似物,而是前列腺酰胺。比马前列素可以
由下式表示:比马前列素不是前药,并且不转化为另一种化合物,或者仅少量(低于5%)被认为转化为比马前列素游离酸。比马前列素与其它化合物的不同之处在于它是酰胺:n-乙基酰胺虽然存在比马前列素游离酸:比马前列素被认为作为乙基酰胺而不是游离酸发挥其作为毛发生长剂的生物活性。这与拉坦前列素和曲伏前列素形成对比,拉坦前列素和曲伏前列素是前药并且与比马前列素相比对不同的受体发挥它们的生理作用,这说明在它们刺激使毛发生长的用途中比
马前列素、拉坦前列素、曲伏前列素和乌诺前列酮异丙酯缺乏可预测性。比马前列素和拉坦前列素具有显著不同的溶解度和药理学性质。比马前列素盐形式包括氨丁三醇盐形式。例如,第一次批准使用比马前列素的0.03% w/v的lumigan
®ꢀ
(用于降低升高的眼内压和治疗青光眼的局部溶液)具有0.03% w/v的比马前列素临床浓度。第一次批准使用拉坦前列素的xalatan
®ꢀ
(用于降低升高的眼内压和治疗青光眼的局部溶液)具有0.005% w/v的临床浓度。
[0206]
前列腺酰胺(例如比马前列素)的作用涉及与前列腺素fp受体介导的与配体(例如拉坦前列素和曲伏前列素)的响应不同的机制。已经显示,比马前列素在具有青光眼的升高的眼内压模型的猴子中的作用是拉坦前列素的作用的加合(“additivity of bimatoprost or travoprost to latanoprost in glaucomatous monkey eyes”, gagliuso等人, 2004)。已经证明拉坦前列素与比马前列素之间的药理学区别。发现一些对拉坦前列素无响应的患青光眼的人类患者对比马前列素有降低升高的眼内压的响应(“effect of bimatoprost on patients with primary open-angle glaucoma or ocular hypertension who are nonresponders to latanoprost
”ꢀ
gandolfi 2003)。似乎非常可能拉坦前列素和比马前列素与眼睛和毛囊中的不同受体相互作用。
[0207]
比马前列素和比马前列素游离酸可以以下列浓度存在:0.001%、0.002%、0.003%、0.004%、0.005%、0.006%、0.007%、0.008%、0.009%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.11%、0.12%、0.13%、0.14%、0.15%、0.16%、0.17%、0.18%、0.19%、0.2%、0.21%、0.22%、0.23%、0.24%、0.25%、0.26%、0.27%、0.28%、0.29%、0.3%、0.31%、0.32%、0.33%、0.34%、0.35%、0.36%、0.37%、0.38%、0.39%、0.4%、0.41%、0.42%、0.43%、0.44%、0.45%、0.46%、0.47%、0.48%、0.49%、0.5%、0.55%、0.6%、0.65%、0.7%、0.75%、0.8%、0.85%、0.9%、0.95%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、6.0%、7.0%、8.0%、9.0%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%和25% w/w、w/v或v/v。
[0208]
比马前列素和比马前列素游离酸可以单独或与其它前列腺素类似物组合存在于本发明的制剂中。比马前列素可以与局部米诺地尔或米诺地尔硫酸盐或与局部或口服非那雄胺组合并且可以与环孢菌素i、ii或iii组合。
[0209]
以下美国专利和专利公开通过引用以其整体并入本文:专利号:8,038,988、6,262,105、7,388,029、6,403,649、9,750,750、9,149,484、9,101,550、9,700,503、6,946,120、5,030,442、5,030,442、4,828,837、7,803,357、7,749,489、6,465,514、4,596,812,7,442,369、5,620,980、5,225,189、4,820,512、6,596,266和5,834,014。
[0210]
美国专利公开20160136071、20160228345、20050079139、20100210720、20050079139、20080206156、20080206156和20040082660。
[0211]
b.环孢菌素环孢菌素天然存在,并且在1971年从真菌多孔木霉(tolypocladium inflatum)中分离。环孢菌素是免疫抑制剂,并且用于克罗恩病、肾病综合征、类风湿性关节炎、器官移植以预防排斥和治疗干眼病。环孢菌素是一组具有已知免疫抑制活性的非极性环状寡肽。环
孢菌素a,连同几种其它次要代谢物,以及环孢菌素b、c、d、e、f、g、h、i、j、k、l、m、n、o、p、q、r、s、t、u、v、w、x、y和z已经被鉴定。此外,已经制备了这样的环孢菌素和许多合成类似物的衍生物、盐等,并且可以用于本发明。环孢菌素a和环孢菌素a衍生物治疗各种眼科病况的用途已经成为各种专利的主题,例如美国专利号5,474,979、6,254,860、6,350,442和7,368,436,其各自的公开内容通过引用以其整体并入本文。
[0212]
通常,可商购获得的环孢菌素可以含有几种单个环孢菌素的混合物,它们都具有由11个氨基酸残基组成的环肽结构,其总分子量为约1,200道尔顿,但一些氨基酸具有不同的取代基或构型。因此,本发明还预期不同类型环孢菌素或环孢菌素组分的混合物。本文所用的术语“环孢菌素组分”旨在包括环孢菌素组的任何单个成员、其盐、其衍生物、其类似物及其混合物,以及两种或更多种其单个环孢菌素盐、其衍生物、其类似物及其混合物的混合物。
[0213]
特别优选的环孢菌素组分包括但不限于环孢菌素a、环孢菌素a的衍生物、环孢菌素a的盐等及其混合物。环孢菌素a是特别有用的环孢菌素组分。
[0214]
环孢菌素a的化学结构由式1表示:式i本文所用的术语环孢菌素的“衍生物”是指具有与环孢菌素足够相似结构的化合物,以便以与本组合物和方法中的环孢菌素(例如环孢菌素a)基本相似或基本相同的方式起作用。有用的环孢菌素a衍生物包括但不限于选自((r)-甲硫基-sar)
3-(4'-羟基-meleu)环孢菌素a、((r)-(环)烷硫基-sar)
3-(4'-羟基-meleu)
4-环孢菌素a和((r)-(环)烷硫基-sar)
3-环孢菌素a衍生物的那些。
[0215]
这些环孢菌素衍生物分别由以下通式(ii)和(iii)表示:式ii
式iii其中me为甲基;alk为2-6个c的亚烷基或3-6个c的环亚烷基;r为oh、cooh、烷氧基羰基、-nr1r2或n(r3)-(ch2)-nr1r2;其中r1、r2为h、烷基、3-6个c的环烷基、苯基(任选地被卤素、烷氧基、烷氧基羰基、氨基、烷基氨基或二烷基氨基取代)、苄基或具有5或6个成员和1-3个杂原子的饱和或不饱和的杂环基;或nr1r2为5元或6元杂环,其可以含有另外的n、o或s杂原子并且可以被烷基化;r3为h或烷基并且n为2-4;和烷基部分含有1-4个c。
[0216]
本组合物和方法可以采用任何合适的组合物或组合物的组合来实施,所述组合物包括治疗有效量的环孢菌素组分结合可用于促进使毛发生长的比马前列素、拉坦前列素、拉坦前列素酸和曲伏前列素和曲伏前列素游离酸。当根据本发明将含有环孢菌素的组合物给予人或动物时,环孢菌素组分以足够有效以提供所需治疗作用的量和/或浓度存在。预期环孢菌素组分的混合物。在本发明的一个实施方案中,环孢菌素组分有利地以组合物的约0.01-0.05% w/v、0.05-0.1% w/v、0.1%至约0.5% w/v、0.5%-5% w/v、5%-15% w/v和15%或约
20%或25% w/v范围内的量存在于所述组合物中。
[0217]
在另一个实施方案中,环孢菌素组分以组合物的约0.01%至约5%或约10%或约15重量%的量存在。环孢菌素可以以下列浓度存在:0.001%、0.002%、0.003%、0.004%、0.005%、0.006%、0.007%、0.008%、0.009%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.11%、0.12%、0.13%、0.14%、0.15%、0.16%、0.17%、0.18%、0.19%、0.2%、0.21%、0.22%、0.23%、0.24%、0.25%、0.26%、0.27%、0.28%、0.29%、0.3%、0.31%、0.32%、0.33%、0.34%、0.35%、0.36%、0.37%、0.38%、0.39%、0.4%、0.41%、0.42%、0.43%、0.44%、0.45%、0.46%、0.47%、0.48%、0.49%、0.5%、0.55%、0.6%、0.65%、0.7%、0.75%、0.8%、0.85%、0.9%、0.95%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、6.0%、7.0%、8.0%、9.0%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%和25% w/w、w/v或v/v。
[0218]
环孢菌素(局部和口服两者)以其所有各种形式可以与比马前列素、拉坦前列素、拉坦前列素酸、曲伏前列素、曲伏前列素游离酸、米诺地尔、米诺地尔硫酸盐和口服或局部非那雄胺组合存在。
[0219]
c. 其它毛发生长剂1)米诺地尔:米诺地尔被认为打开三磷酸腺苷(atp)敏感的钾通道,并使血管舒张,允许更多的营养物、血液和氧进入毛囊。在毛囊生长周期的晚期休止期阶段中,位于膨胀区的干细胞分化并重新进入使毛发生长初期阶段。在患有雄激素性脱发的患者中,毛囊变得更小并且使毛发生长初期阶段的持续时间缩短。米诺地尔增加细胞内ca
2+
的量,其可以上调酶三磷酸腺苷(atp)合酶,而与其在atp合成中的作用无关,并促进干细胞分化。理论上米诺地尔诱导的ca
2+
流入可以增加干细胞分化,并且可能是米诺地尔促进使毛发生长的机制中的因素(mechanism of action of minoxidil in the treatment of androgenetic alopecia
…
), a. gren等人, j biol regul homeost agents 31(4):1049-1053 (2017)。
[0220]
有一些证据显示米诺地尔可以引起毛发在休止期阶段脱落,其被使毛发生长初期阶段的更新且更粗的毛发替代。米诺地尔是通过磺基转移酶sult1a1转化为米诺地尔硫酸盐的前药。
[0221]
此外,与米诺地尔相比,米诺地尔硫酸盐是有效得多的毛发生长剂。一些研究推测毛囊中和毛囊周围的酶sult1a1的量决定个体是否对米诺地尔响应良好。米诺地尔可以与比马前列素、拉坦前列素,15-酮拉坦前列素、15(s)-拉坦前列素、5-反式拉坦前列素、拉坦前列素-d4、拉坦前列素乳醇、拉坦前列素乙基酰胺-d4和拉坦前列素酸、曲伏前列素和曲伏前列素游离酸组合,理论上引起更快地进入使毛发生长初期阶段并延长使毛发生长初期阶段。米诺地尔也可以与环孢菌素组合。米诺地尔可以以下列浓度与那些化合物组合:0.001%、0.002%、0.003%、0.004%、0.005%、0.006%、0.007%、0.008%、0.009%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.11%、0.12%、0.13%、0.14%、0.15%、0.16%、0.17%、0.18%、0.19%、0.2%、0.21%、0.22%、0.23%、0.24%、0.25%、0.26%、0.27%、0.28%、0.29%、0.3%、0.31%、0.32%、0.33%、0.34%、0.35%、0.36%、0.37%、0.38%、0.39%、0.4%、0.41%、0.42%、0.43%、0.44%、0.45%、0.46%、0.47%、0.48%、0.49%、0.5%、0.55%、0.6%、0.65%、0.7%、0.75%、0.8%、0.85%、0.9%、0.95%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、5.5%、6.0%、6.5%、7.0%、7.5%、8.0%、8.5%、9.0%、9.5%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%和25% w/w、w/v或v/v。
[0222]
2) 非那雄胺
非那雄胺(c
23h36
n2o2),也称为(1s,3as,3bs,5ar,9ar,9bs,11as)-n-叔丁基-9a,11a-二甲基-7-氧代-1,2,3,3a,3b,4,5,5a,6,9b,10,11-十二氢茚并[5,4-f]喹啉-1-甲酰胺,是最初用于治疗男性前列腺肥大的5α-还原酶抑制剂。口服非那雄胺通过将包括在前列腺和头皮中的二氢睾酮(dht)的产生减少约70%而起作用。已经有一些使用局部非那雄胺成功地使头皮使毛发生长的报道。非那雄胺可以与本发明的前列腺素类似物(包括比马前列素、拉坦前列素和曲伏前列素及其类似物)组合。
[0223]
非那雄胺可以与比马前列素、拉坦前列素,15-酮拉坦前列素、15(s)-拉坦前列素、5-反式拉坦前列素、拉坦前列素-d4、拉坦前列素乳醇、拉坦前列素乙基酰胺-d4和拉坦前列素酸、曲伏前列素和曲伏前列素酸组合,理论上引起更快地进入使毛发生长初期阶段并延长使毛发生长初期阶段。非那雄胺可以与米诺地尔、米诺地尔硫酸盐或环孢菌素组合。非那雄胺可以以下列浓度与那些化合物组合:0.001%、0.002%、0.003%、0.004%、0.005%、0.006%、0.007%、0.008%、0.009%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.11%、0.12%、0.13%、0.14%、0.15%、0.16%、0.17%、0.18%、0.19%、0.2%、0.21%、0.22%、0.23%、0.24%、0.25%、0.26%、0.27%、0.28%、0.29%、0.3%、0.31%、0.32%、0.33%、0.34%、0.35%、0.36%、0.37%、0.38%、0.39%、0.4%、0.41%、0.42%、0.43%、0.44%、0.45%、0.46%、0.47%、0.48%、0.49%、0.5%、0.55%、0.6%、0.65%、0.7%、0.75%、0.8%、0.85%、0.9%、0.95%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、5.5%、6.0%、6.5%、7.0%、7.5%、8.0%、8.5%、9.0%、9.5%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%和25% w/w、w/v或v/v。
[0224]
定义术语“气溶胶泡沫”是包括液体可发泡组合物和推进剂液体的产品,填充到加压容器中,所述加压容器配备有阀系统、在容器顶部的喷嘴和从阀系统延伸到容器底部的汲取管。当阀打开时,液体推进剂上的压力立即降低,并且其开始蒸发,在容器的顶部形成高压气体层。该高压气体层将液体产品以及一些液体推进剂向上推动到汲取管并通过喷嘴推
出。当液体流过喷嘴时,液体推进剂蒸发成气体,并且在该过程中在液体产品中形成推进剂气泡,产生泡沫。
[0225]
化合物的“有效量”是足以有助于治疗、预防或降低疾病的一个或多个症状的量。当提及疾病治疗时,“有效量”也可以称为“治疗有效量”。“降低”一个或多个症状(和该短语的语法等同物)是指降低一个或多个症状的严重性或频率,或消除一个或多个症状。药物或制剂的“预防有效量”是当给予受试者时将具有预期的预防作用的药物或制剂的量,例如,预防或延迟疾病、病症或病况的发作(或复发),或降低疾病、病症或病况或其症状发作(或复发)的可能性。完全的预防作用不一定通过给予一个剂量而发生,并且可以仅在给予一系列剂量之后发生。因此,预防有效量可以在一次或多次给予中给予。
[0226]“乳液”在常规意义上是指两种或更多种不混溶的液体组分的混合物,一种组分(例如,本文所述的治疗性脂质或其包括表面活性剂的混合物)分散在另一种组分(例如,本文所述的组合物的水性组分)中。术语“亚微米乳液”是指含有最长尺寸小于约1微米的组分的乳液。
[0227]“使毛发生长(growing hair)”或“使毛发生长(grow hair)”是指与不施加本发明的药物和/或制剂的使毛发生长速率相比,引起使毛发生长增加。
[0228]“毛发”可以是毫毛,其是细的、薄的、非色素沉着的短毛,其中毛发毛球位于真皮的表面。处于生长阶段的中间毛发在毫毛(“幼小”或未成熟)毛发(例如在脸上)和生长的成熟毛发阶段(例如头皮上的毛发)之间。终毛是粗的、色素沉着的、长的毛发,其中毛囊的毛球位于真皮深处。随着脱发的发展,在接近秃顶的区域发生转变,其中毛发本身从终毛变为毫毛类型。
[0229]“脱发”可以指斑秃、雄激素性脱发、男性型脱发、女性型脱发、休止期脱发、使毛发生长初期脱发、头癣、瘢痕性脱发、扁平苔癣、盘状红斑狼疮、毛囊炎秃发、头皮解剖性蜂窝组织炎、中央离心瘢痕性脱发、额部纤维化脱发、疏松的使毛发生长初期综合征、毛干异常、退化型脱发、雄激素性脱发、拔毛癖、由于化学疗法引起的脱发、由于感染剂引起的脱发、结节性脆发和衰老性脱发。
[0230]“毛囊的部位”是指含有毛囊的皮肤区域(头皮、眉毛、眼睑边缘、面部等)。
[0231]“非气溶胶、非喷涂泡沫”是包含可发泡液体组合物的产品,将其填充到非加压容器中,所述非加压容器配备有机械泵、空气室、混合室、形成泡沫的筛网和从机械泵延伸到容器底部的汲取管。当机械泵启动时,迫使可发泡液体组合物沿汲取管向上进入混合室,在那里它与来自空气室的空气以预定比率混合以形成泡沫。正是泵的启动使空气和液体可发泡组合物加压并引起湍流混合,以在可发泡液体组合物中形成气泡,产生泡沫。然后,当泡沫在通过喷嘴分配出来之前通过筛网时,泡沫从混合室中被均化成细小均匀的气泡。因此,这是将液体产品以泡沫形式推出容器的非推进剂方法。容器的连续状态的主要区别在于,在气溶胶泡沫容器中,在容器被密封之后,推进剂流体(通常为压缩气体或液化气体)在高压下被泵送到容器中,并且被连续地保持在加压状态,而在非气溶胶、非喷涂泡沫的容器中形成鲜明对比,容器内的空气恒定地处于大气压下。
[0232]“药学上可接受的载体”或“药学上可接受的赋形剂”是指可用于制备药物组合物的载体或赋形剂,其通常安全、无毒并且在生物学上或其它方面都不是不期望的,并且包括对于兽医用途以及人类药物用途可接受的载体或赋形剂。如在说明书和权利要求书中使用
的“药学上可接受的载体/赋形剂”包括一种和多于一种这样的赋形剂。
[0233]
术语“药学上可接受的盐”是指包括活性化合物的盐,其根据本文所述化合物上发现的特定取代基,用相对无毒的酸或碱制备。当本发明的化合物含有相对酸性的官能团时,通过使中性形式的这样的化合物与足量的所需碱纯的或在合适的惰性溶剂中接触,可以获得碱加成盐。药学上可接受的碱加成盐的实例包括钠、钾、钙、铵、有机氨基或镁盐,或类似的盐。当本发明的化合物含有相对碱性的官能团时,通过使中性形式的这样的化合物与足量的所需酸纯的或在合适的惰性溶剂中接触,可以获得酸加成盐。药学上可接受的酸加成盐的实例包括衍生自无机酸的那些,所述无机酸如盐酸、氢溴酸、硝酸、碳酸、一氢碳酸、磷酸、一氢磷酸、二氢磷酸、硫酸、一氢硫酸、氢碘酸或亚磷酸等,以及衍生自相对无毒的有机酸的盐,所述有机酸如乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸、草酸、甲磺酸等。还包括氨基酸的盐,例如精氨酸盐等,以及有机酸的盐,例如葡糖醛酸或半乳糖醛酸等。参见例如berge等人,
ꢀ“
pharmaceutical salts”, journal of pharmaceutical science, 1977, 66, 1-19。关于合适的药学上可接受的盐的其它信息可以在remington's pharmaceutical sciences, 第17版, mack publishing company, easton, pa, 1985中找到,其通过引用并入本文。本发明的某些具体化合物含有碱性和酸性官能团两者,其允许化合物转化为碱加成盐或酸加成盐。
[0234]“防止脱发”是指与如果不施加本发明的制剂相比,减缓或预防脱发。本发明的方法和组合物可以用于预防脱发、治疗脱发、治疗或增厚稀疏毛发、眉毛脱落、睫毛或面部毛发脱发,并且可以用于治疗所有类型的脱发,通过使头皮、眉毛、睫毛或面部毛发上的毛发变深或增加深色毛发与灰色毛发的比率而将毫毛转变为终毛或增加毛发中黑色素含量。
[0235]
术语“前药”根据其普通的通常含义使用,并且旨在是指需要化学或酶转化以在产生药理学作用之前在体内释放活性母体药物的化合物。
[0236]
术语“可溶性”是指溶剂溶解与其药理学作用相关的量的活性药物成分的能力。
[0237]
术语“溶剂”和“溶剂系统”定义了制剂的一种组分,含有api的液相或半固体相。
[0238]
术语“稳定的”和“稳定性”在本文用于与药物产品的贮存期限相关,并且与活性药物成分或制剂的物理变化、降解或化学分解相关,这限制了产品的贮存期限。
[0239]
当两种药物以增强或放大一种或多种作用的方式相互作用时,或以两种不同的作用机制相互作用时,两种药物之间,例如固定组合中的“协同作用”可以发生,或者其中两种不同的作用机制在组合时产生比单独施加的药物或连续施加的两种药物更大的治疗影响或功效,或当药物作为那些药物的单一疗法提供时避免或降低不想要的副作用。协同作用的负面作用是禁忌症的一种形式,例如当使用多于一种影响中枢神经系统(cns)的抑制药物(例如酒精和安定)时。在描述复杂系统如何操作时也注意到了“协同作用”。例如,生物系统可以以非线性方式对扰动作出反应,使得结果可以大于单个组分变化的总和。
[0240]
在描述本发明时,协同作用是指在本发明的方法和组合物中使用的两种活性药物的组合实现了例如刺激哺乳动物(例如人)的毛发(例如头皮毛发、眉毛或睫毛)的生长的结果,该结果大于在相同条件下单独使用活性药物作为单一疗法时实现的结果。因此,为了确定在本发明范围内的组合,可以简单地将两种药物的组合所实现的结果与单独使用每种单个药物所实现的结果进行比较。
[0241]
在本文所述的方法的上下文中的术语“局部”在常规意义上涉及化合物或药物组合物的给予,将所述化合物或药物组合物掺入合适的药物载体中并在受试者的局部治疗部位给予。因此,术语“局部药物组合物”包括其中通过与局部治疗部位(例如皮肤、头皮、眉毛、眼睑边缘、面部)直接接触而外部给予化合物的那些药物形式。术语“局部表皮药物组合物”是指适于针对皮肤的表皮层(例如眼睑、眉毛、头皮或身体)给予的药物组合物。术语“局部给予”是指通过与局部治疗部位直接接触而在外部给予。术语“局部表皮给予”是指通过与表皮直接接触而外部给予。
[0242]
术语“治疗(treat)”、“治疗(treating)”或“治疗(treatment)”可以指在损伤、病理或病况的治疗或改善中成功的任何标志,包括任何客观或主观参数,例如减轻;缓解;减少症状或使损伤、病理或病况对患者更耐受;减缓退化或衰退的速率;使退化的终点不太使人衰弱;改进患者的身体或精神健康。症状的治疗或改善可以基于客观或主观参数;包括身体检查、神经精神检查和/或计算机化成像系统的结果。例如,本文呈现的某些方法通过降低脱发的发生率,抑制其症状和/或原因并引起新的使毛发生长而成功地治疗脱发。
[0243]
毛发的解剖学和毛发生长毛囊的孔仅占据人类皮肤总表面积的约0.1%,而毛囊在人类头皮上可能占据高达总表面积的10% (schaefer, h.等人(1990)
ꢀ“
follicular penetration
”ꢀ
(第163-173页) (1990))。通常,毛囊开口导致上皮表面不具有表面皮肤的保护性角质层。因此,毛囊和皮脂腺显著有助于透皮药物递送。因此,亲水性药物可以以高通量渗透,并且通常通过毛囊内途径,沿着内部和外部途径护套的接合处,并且通过外部途径护套快速扩散到真皮中。与亲脂性药物的较短时间相比,亲水性药物的头皮皮肤渗透的较长的滞后时间表明亲水性药物经由上层真皮的渗透是限速步骤。亲脂性药物的渗透途径可能是沿着内部和外部护套的接合处。
[0244]
与毛囊相关的皮脂腺释放皮脂形成毛囊中亲脂性材料的类脂途径(ebling等人,1991)。还认为亲脂性渗透剂的渗透途径是经皮途径。因此,通过头皮皮肤的角质层也是重要的途径,但是一些药物可能使用经毛囊途径。位于毛囊中的皮脂还在外根护套中的药物渗透中起重要作用。人类毛囊的直径可以在5 μm-80 μm变化,其可能影响经毛囊渗透。
[0245]
某些渗透增强剂和溶剂有助于使脂质在角质层的细胞间通道中流体化。渗透剂和药物通过头皮皮肤的渗透被认为与快速渗透进入毛囊和快速扩散通过外根护套进入真皮有关,而药物的经皮渗透主要经由微通道。亲水性药物也经由外根护套快速扩散到真皮中,但是亲水性药物经由上部真皮的渗透可能是限速步骤并且相对缓慢。
[0246]
人头皮使毛发生长初期毛囊被认为在真皮乳头和毛球周围的cts中表达前列腺素受体的基因和蛋白质,但不在上皮角质化细胞或毛发毛球的黑素细胞中表达。一种理论是,一些前列腺素类似物结合毛发毛球中调节性真皮乳头中细胞的质膜上的特异性受体,其可能刺激细胞内信号传导途径,导致使毛发生长和减少脱发。例如,尽管不希望受任何理论的束缚,前列腺素类似物(例如拉坦前列素)通过将毛发从静止休止期阶段转变到使毛发生长初期阶段、缩短开始使毛发生长初期阶段的时间并延长使毛发生长初期阶段可以增加毛发数量,这引起使毛发生长得更长。在患有雄激素性脱发的患者中,与未患有雄激素性脱发的患者相比,使毛发生长初期阶段的持续时间减少,并且毛囊在休止期阶段度过更多的时间。拉坦前列素、曲伏前列素和比马前列素,在不同程度上,还可以刺激黑素细胞中的黑素生成
和在真皮乳头中发现的角质生成,这导致较深色毛发,在单个毛发中表达更多的黑色素,并且还增加单个毛发直径和真皮乳头的尺寸,这进而导致比如果不用拉坦前列素、曲伏前列素和比马前列素治疗的毛发更长、更深且更粗的毛发数量增加。并且尽管已经报道比马前列素可以在真皮乳头中诱导某些信号,这是其在生长睫毛中的用途的原因,但是比马前列素(其是前列腺酰胺)被认为具有与前列腺素类似物分开的受体系统,并因此具有不同的作用机制(khidir,
ꢀ“
the prostamide-related glaucoma therapy
ꢀ…”ꢀ
faseb, 27[2]: 557-567 [2013年2月])。
[0247]
角质化细胞在称为表皮的皮肤最外层中发现。角质化细胞也在皮肤的基底层中发现。角质化细胞构成表皮的约95%。角质化细胞经历角质化并形成皮肤的表层。这些表面角质化细胞不断被衍生自为基底层的表皮最下层的有丝分裂细胞的细胞所替代。基底层中的细胞有时称为基底角质化细胞或基底细胞。表皮约0.2 mm厚。在表皮内,角质化细胞排列在四个不同的层中,称为基底层、棘层、颗粒层和角质层。位于基底层的黑素细胞不经历角质化,而是产生黑色素。黑色素以称为黑素体的小颗粒形式积累,黑素体转移到树突中,然后转移到角质化细胞中。角质化细胞和黑素细胞与真皮成纤维细胞一起位于毛囊中。表皮和毛囊的稳态主要由角质化细胞和黑素细胞之间的细胞相互作用调节。角质化细胞通过细胞间旁分泌信号传导刺激黑素细胞功能,例如黑素生成、增殖、分化和树突形成。hirobe,
ꢀ“
keratinocytes regulate the function of melanocytes
”ꢀ
dermatolgica sinica, 第32卷, 第200-204页 (2014)。理论上前列腺素类似物(例如拉坦前列素或曲伏前列素)可以作用于制造毛发的角质化细胞和生产色素的黑素细胞。前列腺素类似物可能直接作用于角质化细胞以使单个毛发直径更粗,并作用于黑素细胞以使毛发更深,或者更确切地说,使个体使用者的毛发颜色更正常。这也可能通过经由位于毛发毛球中心的毛囊基部的真皮乳头,通过由未定义的毛囊信号传导系统导致的对角质化细胞和/或黑素细胞的旁分泌信号的间接作用而发生。
[0248]
眉毛眉毛的脱落(也称为萎缩)的特征在于缺乏生长或眉毛脱落。眉毛的脱落可能具有美容、功能和社会/心理后果。根据研究,亚洲患者的头皮毛发直径通常比眉毛粗,而白种患者则相反(gandelman m. a technique for reconstruction of eyebrows and eyelashes. semin plast surg. 19:153-8 (2005))。眉毛通常在侧面比在中间更不密集,这导致眉毛的脱发并且在侧面部分更引人注意。眉毛可以大致分成三个区域。内侧三分之一通常在眼眶边缘下方,其中该区域中的毛发竖直定向。中间的三分之一沿着眼眶边缘,其中毛发倾斜地或水平地定向。侧面三分之一通常位于眼眶边缘上方。
[0249]
眉毛的萎缩可以由疾病(例如皮肤病、内分泌病(例如甲状腺病))以及由心理病症(例如拔毛癖和化学疗法)引起。遗传也可以在病况(例如先天性发育不全)中发挥作用。眉毛的萎缩可以是物理创伤(例如烧伤)、美容手术(例如纹身)的并发症和移植引起的并发症。
[0250]
睫毛睫毛通过防止外来颗粒和物体进入眼睛来保护眼睛,起到功能性和保护性机制。在大多数培养物中,长睫毛通常被认为比短睫毛更有吸引力。在大多数哺乳动物中,眼睛周围的神经系统更容易被刺激以保护眼睛。睫毛脱落称为睫毛稀少症,其包括特发性稀少症、
化学疗法诱导的稀少症、斑秃和甲状腺功能减退。睫毛长度很大程度上与年龄成比例,其中较年轻的人具有较长的睫毛,而老年人具有较短的睫毛。目前用于睫毛稀少症的治疗包括latisse
®
,其是0.03% w/v的比马前列素溶液,并且施加到上眼睑边缘。
[0251]
化学疗法化学疗法诱导的脱发主要是由于化疗剂损伤毛囊,导致全部或不完全的脱发。脱发发生在约65%的化学疗法患者中。脱发通常遍及全身,并且不限于头皮,并且包括睫毛和眉毛。由于化学疗法引起的脱发可能是心理破坏性的,并且已经被一些患者描述为他们疾病的持续提醒,并且可能导致失去控制的感觉和增加的社会隔离(beisecker, analee等人, side effects of adjuvant chemotherapy, pycho-oncology, 1997, 83-93-6)。聚焦小组也已经证明睫毛和眉毛的脱落比头皮毛发的脱发在心理上更具破坏性。
[0252]
其它非化学疗法药物也可以引起脱发,例如抗凝血剂、口服避孕药、类维生素a、抗甲状腺药物和干扰素。通常,化学疗法诱导的脱发是由对毛囊中快速分裂细胞的毒性引起的。在使毛发生长初期期间,毛囊的上皮隔室经历快速增殖,其中在毛球基质细胞中具有最大的增殖。当将化疗剂给予患者时,细胞有丝分裂可能突然停止,导致脱发,因为部分角质化的毛干弱化并导致脱发。这称为使毛发生长初期脱发。化疗剂也可能引起毛囊中细胞的凋亡(程序性细胞死亡)。通常,当化学疗法结束时,使毛发生长恢复,但在一些患者中,可能需要数年或数个完整的毛发周期来实现患者在化学疗法之前经历的相同水平的使毛发生长。通常,新毛发是毫毛而不是终毛。本说明书中描述的制剂和方法可以在头皮、面部、眉毛、睫毛和全身的化学疗法之前或期间使用,以预防脱发,并且还可以在化学疗法之后使用,以使毛发再生长并将毛发周期转变为使毛发生长初期阶段,并延长使毛发生长初期阶段,产生更长、更深且更粗的睫毛、眉毛、头皮毛发和面部毛发。
[0253]
媒介物表1列出了溶剂和渗透增强剂:
溶剂和渗透增强剂可以以下列浓度存在:制剂的0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、6.0%、7.0%、8.0%、9.0%、10% w/w、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、
28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99% w/w、w/v或v/v。
[0254]
卡波姆的浓度可以是约0.05-3.0% w/w;肉豆蔻酸异丙酯的浓度为约0.1-约10% w/w;peg 40蓖麻油的浓度为约0.1-20% w/w;羧甲基纤维素的浓度为0.1-5.0% w/w;乙醇的浓度为约1-约70% w/w;二乙二醇单乙醚的浓度为约1.0-约50% w/w;聚山梨醇酯20的浓度为约0.1-约5.0% w/w;聚山梨醇酯40的浓度为约0.1-约5.0% w/w;聚山梨醇酯60的浓度为约0.1-约5.0% w/w;甘油的浓度为约1.0-约30% w/w;聚山梨醇酯80的浓度为约0.1-约5.0% w/w;ppg-5鲸蜡醇聚醚-20的浓度为约0.1-约5.0% w/w;油酸的浓度为约0.1-约5.0% w/w;异硬脂酸异硬脂基酯的浓度为约0.1-约10% w/w;二丙二醇二甲醚的浓度为约1-约50% w/w;二乙二醇的浓度为约1-约50% w/w;二丙二醇的浓度为约1-约50% w/w;辛酸/癸酸的浓度为约0.1-约10% w/w;苄醇的浓度为约0.1-约2.0% w/w;硅酮的浓度为约0.1-约10% w/w;peg 40蓖麻油的浓度为约0.1-20% w/w;peg 35蓖麻油的浓度为约0.1-20% w/w;油醇的浓度为约0.1-10% w/w;甘油单油酸酯的浓度为约0.1-10% w/w;和/或水的浓度为约0-约90% w/w。
[0255]
实施例:制剂i0.05% w/v的拉坦前列素;0.06% w/v的环孢菌素a;10.0% w/v的二乙二醇单乙醚;5.0% w/v的油醇;和,适量水至总量100%。
[0256]
制剂ii0.08% w/v的拉坦前列素;0.1% w/v的环孢菌素a;15.0% w/v的二乙二醇单乙醚;5% w/v的peg;6.0% w/v的油醇;和,适量水至总量100%。
[0257]
制剂iii0.08% w/v的拉坦前列素;0.1% w/v的环孢菌素a;15.0% w/v的二乙二醇单乙醚;5% w/v的peg;6.0% w/v的油醇;和,适量水至总量100%。
[0258]
制剂iv0.06% w/v的比马前列素;
0.08% w/v的环孢菌素a;10.0% w/v的甘油单油酸酯;5.0% w/v的油酸;5% w/v的乙醇;和,适量水至总量100%。
[0259]
制剂v0.08% w/v的比马前列素;0.1% w/v的环孢菌素a;10.0% w/v的二乙二醇单乙醚;5.0% w/v的油酸;5.0% w/v的油醇;和,适量水至总量100%。
[0260]
制剂vi0.08% w/v的拉坦前列素或拉坦前列素酸;0.08% w/v的环孢菌素a;10.0% w/v的聚乙二醇;10.0% w/v的二乙二醇单乙醚;5.0% w/v的油醇;和,适量水至总量100%。
[0261]
制剂vii0.05% w/v的比马前列素;0.07% w/v的环孢菌素a;10.0% w/v的油醇;10.0% w/v的二乙二醇单乙醚;和,适量水至总量100%。
[0262]
制剂viii0.05% w/v的拉坦前列素或拉坦前列素酸;0.08% w/v的环孢菌素a;5.0% w/v的二乙二醇单乙醚;10.0% w/v的captex 300 ep/nf;10.0% w/v的peg;和,适量水至总量100%。
[0263]
制剂ix0.06% w/v的乌诺前列酮异丙酯游离酸;0.08% w/v的环孢菌素a;5.0% w/v的二乙二醇单乙醚;10.0% w/v的captex 300 ep/nf;10.0% w/v的peg;和,适量水至总量100%。
[0264]
制剂x0.07% w/v的曲伏前列素或曲伏前列素游离酸;0.08% w/v的环孢菌素a;5.0% w/v的二乙二醇单乙醚;10.0% w/v的captex 300 ep/nf;10.0% w/v的peg;和,适量水至总量100%。
[0265]
制剂xi0.1% w/v的比马前列素;0.05% w/v的环孢菌素a;20% w/v的2-(2-乙氧基乙氧基)-乙醇;5% w/v的丙二醇;3% w/v的油酸;和,适量水至总量100%。
[0266]
制剂xii0.1% w/v的拉坦前列素;0.05% w/v的环孢菌素a;20% w/v的2-(2-乙氧基乙氧基)-乙醇;5% w/v的丙二醇;3% w/v的油酸;和适量水至总量100%。
[0267]
制剂xiii0.1% w/v的拉坦前列素;5.0% w/v的米诺地尔;10% w/v的2-(2-乙氧基乙氧基)-乙醇;5% w/v的丙二醇;3% w/v的油酸;和,适量水至总量100%。
[0268]
制剂xiv0.1% w/v的拉坦前列素;5.0% w/v的米诺地尔或米诺地尔硫酸盐;20% w/v的2-(2-乙氧基乙氧基)-乙醇;5% w/v的丙二醇;3% w/v的油酸;和,适量水至总量100%。
[0269]
制剂xv0.1% w/v的拉坦前列素;2.0% w/v的米诺地尔或米诺地尔硫酸盐;20% w/v的2-(2-乙氧基乙氧基)-乙醇;
5% w/v的丙二醇;3% w/v的油酸;和,适量水至总量100%。
[0270]
制剂xvi0.1% w/v的比马前列素;5.0% w/v的米诺地尔;20% w/v的2-(2-乙氧基乙氧基)-乙醇;5% w/v的丙二醇;3% w/v的油酸;和,适量水至总量100%。
[0271]
制剂xvii0.1% w/v的曲伏前列素;5.0% w/v的米诺地尔;20% w/v的2-(2-乙氧基乙氧基)-乙醇;5% w/v的丙二醇;3% w/v的油酸;和,适量水至总量100%。
[0272]
制剂xviii0.1% w/v的拉坦前列素;5.0% w/v的米诺地尔;30.0% w/v的乙醇;50% w/v的丙二醇;和,适量水至总量100%。
[0273]
制剂xviiii0.1% w/v的拉坦前列素;5.0% w/v的米诺地尔;30.0% w/v的乙醇;50% w/v的丙二醇;3% w/v的二乙二醇单乙醚;2% w/v的油醇;和,适量水至总量100%。
[0274]
制剂xx0.3% w/v的拉坦前列素;5.0% w/v的米诺地尔;30.0% w/v的乙醇;50% w/v的丙二醇;和,适量水至总量100%。
[0275]
制剂xxi5.0% w/v的米诺地尔或米诺地尔硫酸盐;
0.05% w/v的拉坦前列素;30.0% w/v的乙醇;50% w/v的丙二醇;和,适量水至总量100%。
[0276]
制剂xxii5.0% w/v的米诺地尔;0.05% w/v的拉坦前列素;30.0% w/v的乙醇;50% w/v的丙二醇;和,适量水至总量100%。
[0277]
制剂xxiii5.0% w/v的米诺地尔;0.008% w/v的拉坦前列素;30.0% w/v的乙醇;50% w/v的丙二醇;适量水。
[0278]
制剂xxiv5.0% w/v的米诺地尔;0.007% w/v的拉坦前列素;30.0% w/v的乙醇;50% w/v的丙二醇;和,适量水至总量100%。
[0279]
制剂xxv5.0% w/v的米诺地尔;0.005% w/v的拉坦前列素;30.0% w/v的乙醇;50% w/v的丙二醇;和,适量水至总量100%。
[0280]
制剂xxvi3.0% w/v的非那雄胺;0.1% w/v的拉坦前列素;30.0% w/v的乙醇;50% w/v的丙二醇;和,适量水至总量100%制剂xxvii5.0% w/v的非那雄胺;0.3% w/v的拉坦前列素;30.0% w/v的乙醇;50% w/v的丙二醇;和,
适量水至总量100%。
[0281]
制剂xxviii5.0% w/v的非那雄胺;0.3% w/v的比马前列素;30.0% w/v的乙醇;50% w/v的丙二醇;和,适量水至总量100%。
[0282]
制剂xxviiii5.0% w/v的非那雄胺;0.1% w/v的比马前列素;30.0% w/v的乙醇;50% w/v的丙二醇;和,适量水至总量100%。
[0283]
制剂xxx5.0% w/v的非那雄胺;0.1% w/v的曲伏前列素;30.0% w/v的乙醇;50% w/v的丙二醇;和,适量水至总量100%。
[0284]
制剂xxxi5.0% w/v的非那雄胺;0.3% w/v的曲伏前列素;30.0% w/v的乙醇;50% w/v的丙二醇;和,适量水至总量100%。
[0285]
制剂xxxii0.1% w/v的拉坦前列素;47% w/v的乙醇;0.4% w/v的聚山梨醇酯60;1% w/v的聚乙烯月桂醇;0.3% w/v的乙酸;10% w/v的丙二醇;和,适量水至总量100%。
[0286]
制剂xxxiii0.3% w/v的拉坦前列素;47% w/v的乙醇;0.4% w/v的聚山梨醇酯60;1% w/v的聚乙烯月桂醇;0.3% w/v的乙酸;
10% w/v的丙二醇;和,适量水至总量100%。
[0287]
制剂xxxiv0.08 % w/v的拉坦前列素;4.0% w/v的米诺地尔;50% w/v的丙二醇;30% w/v的乙醇;3% w/v的transcutol;2% w/v的油醇;0.5% w/v的poe 40;和,适量水至总量100%。
[0288]
制剂xxxv0.08 % w/v的拉坦前列素;4.0% w/v的米诺地尔;50% w/v的丙二醇;30% w/v的乙醇;3% w/v的transcutol;2% w/v的油醇;和,适量水至总量100%。
[0289]
制剂xxxvi0.1% w/v的拉坦前列素;47% w/v的乙醇;0.4% w/v的聚山梨醇酯60;1% w/v的聚乙烯月桂醇;0.3% w/v的乙酸;2.0% w/v的油酸;10% w/v的丙二醇;和,适量水至总量100%。
[0290]
非气溶胶、非喷涂泡沫泵和容器在另一个实施方案中,使用非气溶胶、非喷涂泡沫泵分配包装在非加压容器中的液体制剂的最终产品,所述液体制剂包含比马前列素/米诺地尔或曲伏前列素/米诺地尔或拉坦前列素/米诺地尔或比马前列素/非那雄胺或曲伏前列素/非那雄胺或拉坦前列素/非那雄胺或其药学上可接受的盐的活性成分组合。非气溶胶、非喷涂泡沫泵提供测量剂量的泡沫的安全和简单分配,所述泡沫含有液体制剂,所述液体制剂包含药物组合或其盐,其容易地施加到头皮、眉毛、睫毛或面部。非气溶胶、非喷涂泡沫泵被校准以递送足够体积的泡沫。本文公开的另外的目的是在可重复使用且非加压的容器中提供液体制剂,所述容器可以被制造成圆柱形或非圆柱形形状并且不含推进剂。
[0291]
因此,本实施方案不采用含有典型推进剂的加压容器,所述推进剂例如液化石油气(丙烷、异丁烯和正丁烷的混合物)、氯氟烃(cfc)和二甲醚,它们是易燃、有害和有毒的挥
发性有机化合物(voc)。本实施方案在可重复使用的容器中安全地运输、存储和分配。产品和产品部件的再利用对于环境是极其重要的。
[0292]
泡沫制剂泡沫制剂,其包含比马前列素/米诺地尔或曲伏前列素/米诺地尔或拉坦前列素/米诺地尔或比马前列素/非那雄胺或曲伏前列素/非那雄胺或拉坦前列素/非那雄胺或其药学上可接受的盐的活性成分组合。优选,表面活性剂的量为约2-10%。可以使用阴离子、阳离子、非离子或两性表面活性剂和非离子嵌段共聚物的任何组合。优选,可以使用乙氧基化的甘油酯、乙氧基化的脱水山梨糖醇酯、聚乙氧基化的和/或氢化蓖麻油、非离子嵌段共聚物和两性表面活性剂。特别优选的表面活性剂可以选自:peg 40氢化蓖麻油;peg 40硬脂酸酯;聚山梨醇酯20;椰油酰胺丙基甜菜碱;甘油椰油酸酯;peg 6辛酸/癸酸甘油酯;泊洛沙姆f 68;和饱和磷脂c6-c10。
[0293]
制剂xxxvii (喷涂溶液)米诺地尔5.0% w/v (活性物);拉坦前列素0.1% w/v或0.3% w/v (活性物);1,2-丙二醇60.5% w/v (溶剂);乙醇10.2% w/v (溶剂);乳酸2.5% w/v (酸化剂);香精0.06 % w/v (芳香/香精);和去离子水适量至总量100% (溶剂)。
[0294]
制剂xxxv的生产流程如下:1:分别称重和制备米诺地尔、拉坦前列素和其它赋形剂;2:将已经分别称重的1,2-丙二醇、乳酸、乙醇和去离子水放置在生产容器中并混合至少5分钟;3:将先前称重的米诺地尔放置在不锈钢生产容器中并混合至少15分钟以便溶解,随后加入先前称重的拉坦前列素(在预先称重的注射器中以确保油的适当转移);4:加入香精并混合;5:在目标体积下进行填充,并将最终产品包装和装箱。
[0295]
制剂xxxviii;米诺地尔2/拉坦前列素0.1喷剂米诺地尔2% w/v (活性物);拉坦前列素0.1% w/v或0.3% w/v (活性物);1,2-丙二醇65.9% w/v (溶剂/赋形剂);乙醇5.2% w/v (溶剂);乳酸2.5% w/v (酸化剂);香精0.06% w/v (芳香/香精);和,去离子水适量(溶剂)。
[0296]
制剂的生产流程与制剂xxxvii相同。
[0297]
制剂xxxix:米诺地尔5/拉坦前列素0.1或0.3泡沫米诺地尔5.0% w/v (活性物);拉坦前列素0.1% w/v或0.3% w/v (活性物);1,2-丙二醇51.5% w/v (溶剂/赋形剂);peg 20油基醚 0.5% w/v (表面活性剂);plantacare 1200* 10.5% w/v (表面活性剂);
komperlan kd** 3% w/v (表面活性剂);乙醇5.2% w/v (溶剂) (ep);乳酸2.4% w/v (酸化剂) (ep);香精0.06% w/v (芳香/香精[ep]);和,去离子水21.8%溶剂(ep)。
[0298]
*月桂基糖苷**椰油酰胺dea=椰油脂肪酸二乙醇胺制剂的生产流程如下:分别称重和制备米诺地尔、拉坦前列素和其它赋形剂,将已经分别称重的1,2-丙二醇、乳酸、乙醇和去离子水放置在生产容器中并混合至少5分钟,将先前称重的米诺地尔放置在不锈钢生产容器中并混合至少15分钟以便溶解,随后加入先前称重的拉坦前列素。将先前称重的peg 20油基醚、plantacare 1200和komperlan kd加入到不锈钢生产容器中并溶解,加入香精并混合。在目标体积下进行填充,并将最终产品包装和装箱。
[0299]
制剂xxxx:米诺地尔2.0%/拉坦前列素0.1 %泡沫米诺地尔2% w/v;拉坦前列素0.1% w/v或0.3% w/v;1,2-丙二醇51.% w/v (溶剂/赋形剂);peg 20油基醚 0.5% w/v (表面活性剂);plantacare 1200 10.5% w/v (表面活性剂);komperlan kd 3% w/v (表面活性剂);乙醇5.2% w/v (溶剂);乳酸2.4% w/v (酸化剂);香精0.06% w/v的9 w/v (芳香/香精);和,适量去离子水。
[0300]
制剂xxxxi (洗剂)米诺地尔5 % w/v;拉坦前列素0.1%或0.3% w/v;乙醇60.3% w/v;聚山梨醇酯60 0.4% w/v;聚氧乙烯月桂醇1.00% w/v;乙酸0.6 % w/v;和,纯净水至总量100%。
[0301]
最终配制的溶液的表观ph应为6.24。
[0302]
制剂xxxxii米诺地尔5% w/v;拉坦前列素0.1%或0.3% w/v;鲸蜡醇2.20% % w/v;硬脂醇1.00% w/v;乙醇51.8 % w/v;
聚山梨醇酯60 0.4% % w/v;聚氧乙烯月桂醇1.00% % w/v;丙二醇5.00% % w/v;推进剂p75 4.30% % w/v;乙酸适量至ph 6.0;和,纯净水至总量100%。
[0303]
制剂xxxxiii (洗剂)米诺地尔8% w/v;拉坦前列素0.3%或0.1% w/v;乙醇50.5% w/v;聚山梨醇酯60 0.4% w/v;聚氧乙烯月桂醇1.00% w/v;乙酸适量至ph 6.0;丙二醇7.3% w/v;苄醇5% w/v;和,纯净水至总量100%。
[0304]
制剂xxxxiv(溶液)拉坦前列素0.1%、0.2%或0.3% w/v;米诺地尔5% w/v;乙醇51% w/v;聚山梨醇酯60 0.4% w/v;月桂醇聚醚-12 1% w/v;冰醋酸0.3% w/v;丙二醇7.5% w/v;苄醇5% w/v;和,纯净水至总量100%。
[0305]
ph为约6.24。
[0306]
制剂xxxxv米诺地尔8% w/v;拉坦前列素0.3%或0.1% w/v;乙醇50.0% w/v;聚山梨醇酯60 0.4% w/v;聚氧乙烯月桂醇1% w/v;乙酸适量至ph 6.0 w/v;丙二醇10% w/v;苄醇5% w/v;和,纯净水至总量100%制剂xxxxvi (洗剂)米诺地尔5% w/v;
拉坦前列素0.1%或0.3% w/v;乙醇47.50% w/v;聚山梨醇酯60 0.4% w/v;聚氧乙烯月桂醇1.00% w/v;乙酸适量至ph 6.0;苄醇5% w/v;和,纯净水至总量100%。
[0307]
制剂xxxxvii米诺地尔5% w/v;拉坦前列素0.1% w/v;乙醇47% w/v;聚山梨醇酯60 0.4% w/v;聚氧乙烯月桂醇1% w/v;乙酸1% w/v;丙二醇10% w/v;苄醇5% w/v;和,纯净水适量至总量100%。
[0308]
制剂xxxxviii米诺地尔5% w/v;拉坦前列素0.3% w/v;乙醇44.2% w/v;聚山梨醇酯60 0.4% w/v;聚氧乙烯月桂醇1% w/v;乙酸0.3% w/v;丙二醇30% w/v;苄醇2% w/v;和,纯净水适量至总量100%。
[0309]
制剂xxxxix米诺地尔5% w/v;拉坦前列素0.3% w/v;乙醇46% w/v;聚山梨醇酯60 0.4% w/v;聚氧乙烯月桂醇1% w/v;乙酸0.3% w/v;丙二醇30% w/v;苄醇10% w/v;和,纯净水适量至总量100%。
[0310]
制剂xxxxx米诺地尔硫酸盐4% w/v;
拉坦前列素0.08% w/v;乙醇30% w/v;丙二醇50% w/v;油醇2% w/v;transcutol 3%;和,纯净水适量至总量100%。
[0311]
对于单次使用的制剂,可以消除苄醇将最终制剂xxxxiv-xxxxx的表观ph调节至6.0-6.5,并且用丙二醇取代。
[0312]
其它实施方案:其它制剂包括组合物,其包含至多5% w/w的米诺地尔、约0.1% w/w的拉坦前列素;约0.15% w/w的卡波姆;约0.22% w/w的三乙胺(tea);约15.0% w/w的乙醇;约10.0% w/w的二乙二醇单乙醚;约4.0% w/w的聚山梨醇酯20;和约70.5% w/w的水。
[0313]
组合物,其包含至多5% w/w的米诺地尔、约0.1% w/w的拉坦前列素;约0.10% w/w的卡波姆;约0.035% w/w的naoh;约15.0% w/w的乙醇;约10.0% w/w的二乙二醇单乙醚;和约74.8% w/w的水。
[0314]
组合物,其包含至多5% w/w的米诺地尔、约0.1% w/w的拉坦前列素;约0.125% w/w的卡波姆;约0.18% w/w的tea;约30.0% w/w的乙醇;约20.0% w/w的二乙二醇单乙醚;和约49.59% w/w的水。
[0315]
组合物,其包含至多5% w/w的米诺地尔、约0.1% w/w的拉坦前列素;约0.10% w/w的卡波姆;约0.15% w/w的tea;约30.0% w/w的乙醇;约20% w/w的丙二醇;和约49.7% w/w的水。
[0316]
组合物,其包含至多5% w/w的米诺地尔、约0.1% w/w的拉坦前列素;约0.20% w/w的卡波姆;约0.22% w/w的tea;约60.0% w/w的乙醇;约5.0% w/w的甘油;和约34.48% w/w的水。
[0317]
组合物,其包含至多5% w/w的米诺地尔、约0.1% w/w的拉坦前列素;约0.25% w/w的卡波姆;约0.38% w/w的tea;约60.0% w/w的乙醇;约4.0% w/w的聚山梨醇酯20;和约35.27% w/w的水。
[0318]
组合物或溶液,其包含4% w/v的米诺地尔、0.08% w/v的拉坦前列素、50% w/v的丙二醇、30% w/v的乙醇、3% w/v的transcutol、2% w/v的油醇、0.5% w/v的聚氧乙烯40和适量水至总量100%。
[0319]
组合物或溶液,其包含4% w/v的米诺地尔、0.08% w/v的拉坦前列素、50% w/v的丙二醇、30% w/v的乙醇、3% w/v的transcutol、2% w/v的油醇和适量水至总量100%。
[0320]
组合物,其包含至多5% w/w的米诺地尔、约0.1% w/w的拉坦前列素;约0.25% w/w的卡波姆;约0.38% w/w的tea;约50.0% w/w的乙醇;约10% w/w的二乙二醇单乙醚;约4.0% w/w的聚山梨醇酯20;和约35.27% w/w的水。
[0321]
将两种不溶性药物(例如米诺地尔和拉坦前列素)一起配制成单一的水性组合物是极其具有挑战性的。两种化合物在水中的溶解度都差,并且需要高浓度的溶剂和/或助溶剂以将两种化合物保持在溶液中,特别是在通常为2-7% w/v的非常高浓度的米诺地尔的溶液中。此外,注意到,许多客户发现通用rogaine
®
制剂令人不愉快或无法忍受,因为其是粘
性的,并且许多使用者感觉其留下粘性或油腻的残余物,这降低了患者依从性。这被认为主要是由于以50% w/v存在的丙二醇,这是溶解高浓度的米诺地尔所必需的,米诺地尔通常为5% w/v,是非常不溶的物质。已经发现,加入低浓度的二乙二醇单乙醚和油醇使溶液的粘性较低,并且使溶液的触感和感觉更舒适。还令人惊讶地发现,加入这些化合物不仅确实产生感觉更好的制剂,而且加入这些化合物(特别是低浓度的二乙二醇单乙醚和油醇)产生在使毛发生长方面优异的更有效的制剂。尽管不希望受任何理论的束缚,据信二乙二醇单乙醚和油醇的组合在某些浓度下协同作用,增加活性剂(例如拉坦前列素和米诺地尔)的皮肤渗透,并且使毛囊和角质层的脂质流体化,并使两种活性剂在体内更可溶,这通过增加活性剂的生物利用度使制剂更有效。拉坦前列素大部分是脂溶性的,这允许其渗透进入表皮的毛囊。然而,当与某些溶剂(例如二乙二醇单乙醚和油醇)组合使用时,制剂在剥落孔衬里中变得更有效,松散堵塞物,去除杂质,并允许制剂更自由地渗透。可以说,通过弱化细胞胶,剥落打开毛囊和孔。这将解释与含有二乙二醇单乙醚和油醇的相同制剂相比,这些制剂的功效增加。
[0322]
在一些实施方案中,组合物包含水、米诺地尔、浓度为约0.01% w/w至约0.4% w/w或约0.05-0.3% w/w或约0.1-0.3% w/w的拉坦前列素。米诺地尔以约0.5-10% w/w或约1-6% w/w或约2-5% w/w或约5% w/w的量包含,并且含有一种或多种选自以下的化合物:浓度为约0.5% w/w至约1% w/w的十八醇十六醇、浓度为约1% w/w至约3% w/w(优选约2% w/w)的甘油单油酸酯、浓度为约1% w/w至约3% w/w(优选约2% w/w)的油醇、浓度为约30% w/w至约75% w/w的乙醇、浓度为约10% w/w至约25% w/w的丙二醇、浓度为约0.5% w/w至约2% w/w(优选约1% w/w)的苄醇、浓度为约0.15% w/w的卡波姆、浓度为约0.16% w/w的三乙醇胺和浓度为约0.5% w/w至约10% w/w(优选2% w/w)的甘油。
[0323]
在一些实施方案中,组合物包含水、米诺地尔、浓度为约0.01-0.5% w/w或约0.05-4% w/w或约0.1-0.5% w/w的拉坦前列素。米诺地尔以约0.5-10% w/w或约1-6% w/w,更多的或约2-5% w/w或约5% w/w的量包含,并且含有一种或多种选自以下的化合物:浓度为约1% w/w至约25% w/w(优选约10% w/w)的transcutol、浓度为约1% w/w至约25% w/w的丙二醇、浓度为约1% w/w至约3% w/w(优选约2% w/w)的甘油单油酸酯、浓度为约1% w/w至约3% w/w(优选约2% w/w)的油醇、浓度为约30% w/w至约75% w/w的乙醇、浓度为约10% w/w至约25% w/w的丙二醇、浓度为约0.5% w/w至约2% w/w(优选约1% w/w)的苄醇、浓度为约0.15% w/w至约0.2% w/w的卡波姆、浓度为约0.16% w/w三乙醇胺和浓度为约0.5% w/w至约10% w/w(优选2% w/w)的甘油。
[0324]
除了在以上段落中指定的那些以外,一些实施方案还可以包含一种或多种另外的成分,其中所述一种或多种成分选自浓度为约1% w/w至约5% w/w(优选2% w/w)的亚油酸、浓度在0.1% w/w至约0.5% w/w之间(优选0.2% w/w)的月桂基硫酸钠和浓度在0.1% w/w至约0.5% w/w之间(优选0.2% w/w)的多库酯钠。
[0325]
在一些实施方案中,组合物包含水、米诺地尔、浓度为约0.01-5% w/w或约0.05-4% w/w或约0.1-0.3% w/w或约0.1% w/w/0.2% w/w或0.3% w/w的拉坦前列素或曲伏前列素。米诺地尔以约0.5-10% w/w或约1-6% w/w或约2-5% w/w或约5% w/w的量包含,并且含有一种或多种选自以下的化合物:浓度为约1% w/w至约25% w/w(优选约10% w/w)的transcutol、浓度为约1% w/w至约25% w/w的丙二醇、浓度为约1% w/w至约3% w/w(优选约2% w/w)的甘
油单油酸酯、浓度为约1% w/w至约3% w/w(优选约2% w/w)的油酸、浓度为约1% w/w至约3% w/w(优选约2% w/w)的亚油酸、浓度为约30% w/w至约75% w/w的乙醇、浓度为约10% w/w至约25% w/w的丙二醇、浓度为约0.5% w/w至约2% w/w(优选约1% w/w)的苄醇、浓度为约0.15% w/w至约0.2% w/w的卡波姆、浓度为约0.16% w/w的三乙醇胺、浓度为约0.5% w/w至约10% w/w(优选约2% w/w)的甘油、浓度为约0.05% w/w至约5% w/w(优选约1% w/w)的精油、浓度为约0.5% w/w至约5% w/w(优选约1% w/w)的柠檬烯、浓度为约0.5% w/w至约5% w/w(优选约1% w/w)的香橙醇、浓度为约0.5% w/w至约5% w/w(优选约1% w/w)的桉树脑、浓度为约0.5% w/w至约5% w/w(优选约2% w/w)的水杨酸辛酯、浓度为约0.5% w/w至约5% w/w(优选约2% w/w)的dmso、浓度为约0.01% w/w至约1% w/w(优选约0.2% w/w)的ddab、浓度为约0.01% w/w至约5% w/w(优选约2% w/w)的牛去氧胆酸钠、浓度为约0.01% w/w至约1% w/w(优选约0.2% w/w)的多库酯钠、浓度为约1% w/w至约30% w/w(优选约25% w/w)的肉豆蔻酸肉豆蔻基酯、浓度为约1% w/w至约5% w/w(优选约2% w/w)的聚山梨醇酯80、浓度为约40% w/w至约80% w/w(优选约73.5% w/w)的环甲基聚硅氧烷中的硅酮弹性体、浓度为约1% w/w至约20% w/w(优选约8% w/w)的dow silky wax 10、浓度为约1% w/w至约20% w/w(优选约8% w/w)的肉豆蔻酸异丙酯。
[0326]
在一些实施方案中,组合物包含水;米诺地尔或非那雄胺、拉坦前列素或曲伏前列素,例如其中拉坦前列素或局部非那雄胺的浓度为约0.01% w/w至约0.5% w/w,优选约0.05-0.45% w/w或约0.075-0.4% w/w,更优选约0.1-0.3% w/w,最优选的值为0.1% w/w、0.2% w/w或0.3% w/w。米诺地尔或非那雄胺以约0.5-10% w/w或约1-6% w/w或约2-5% w/w或约5% w/w的量包含;和一种或多种选自以下的化合物:乙醇,例如浓度在0.01% w/w至约89% w/w之间;丙二醇,例如浓度在0.01% w/w至约89% w/w之间;二乙二醇单乙醚,例如浓度在0.01 % w/w至约89% w/w之间;苄醇,例如浓度在0.01% w/w至约89% w/w之间;和一种或多种脂肪酸和/或脂肪酯赋形剂,例如浓度在0.01% w/w至约10% w/w之间。在一些实施方案中,脂肪酸可以包括一种或多种c8-c28脂肪酸,并且其可以是饱和的、单不饱和的或多不饱和的。在一些实施方案中,饱和脂肪酸可以是硬脂酸。在一些实施方案中,单不饱和脂肪酸可以是油酸。在一些实施方案中,多不饱和脂肪酸可以是亚油酸。在一些实施方案中,脂肪酯可以包括一种或多种c8-c28脂肪酸,并且其可以是饱和的、单不饱和的或多不饱和的。在一些实施方案中,饱和脂肪酯可以是甘油单硬脂酸酯。在一些实施方案中,单不饱和脂肪酯可以是甘油单油酸酯。在一些实施方案中,多不饱和脂肪酯可以是亚油酸的乙酯。
[0327]
优选的组合物包含米诺地尔或非那雄胺、拉坦前列素或曲伏前列素、油醇、乙醇和丙二醇。拉坦前列素或曲伏前列素以约0.01-0.5% w/w或约0.05-0.4% w/w或约0.1-0.3% w/w,或最优选约0.1% w/w、0.2% w/w或0.3% w/w的量包含。米诺地尔或非那雄胺以约0.5-10% w/w或约1-6% w/w或约2-5% w/w或约5% w/w的量包含。油醇以约1-10% w/w的量包含。乙醇以约50-80% w/w的量包含。丙二醇以15-15% w/w的量包含。
[0328]
通过局部施加用于使毛发生长的特别优选的组合物的实例包含游离形式的米诺地尔或非那雄胺、拉坦前列素或曲伏前列素或其药学上可接受的盐,其中拉坦前列素或曲伏前列素以约0.1% w/w至约4% w/w的量包含;米诺地尔或非那雄胺以约0.5-10% w/w(优选约1-6% w/w,更优选约2-5% w/w,最优选的值为5% w/w)的量包含;至少一种选自脂肪酸、脂肪酸醇和脂肪酯的第一化合物,其中所述组合物配制用于局部给予皮肤。
[0329]
在一些实施方案中,第一化合物为脂肪酸。脂肪酸可以是饱和或不饱和的。在一些实施方案中,脂肪酸选自硬脂酸、油酸、亚油酸及其混合物。在一些实施方案中,第一化合物为脂肪酯。脂肪酯可以是饱和或不饱和的。脂肪酯可以选自甘油单硬脂酸酯、甘油单油酸酯和亚油酸的乙酯。在一些实施方案中,组合物包含至少两种第一化合物。组合物可以包含至少一种脂肪酸和至少一种脂肪酯的混合物。第一化合物可以具有12-24个碳原子。组合物可以进一步包含至少一种选自乙醇、丙二醇、二乙二醇单乙醚和苄醇的第二化合物。组合物可以进一步包含至少一种第三化合物,所述第三化合物选自萜烯、封闭剂、表面活性剂、亚砜、环醚、酰胺、胺和二甲基氨基丙酸衍生物。在一些实施方案中,萜烯选自萜品油烯、柠檬烯、香橙醇和桉树脑。在一些实施方案中,封闭剂选自硅酮、矿物油和水不溶性聚合物。在一些实施方案中,表面活性剂选自聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯80、十二烷基硫酸钠、月桂基硫酸钠、dmso和多库酯钠。在一些实施方案中,二甲基氨基丙酸衍生物为2-二甲基氨基丙酸十二烷基酯。组合物可以包含约0.01% w/w至约4% w/w量的拉坦前列素。更优选,组合物可以包含约0.05% w/w至约0.5% w/w量的拉坦前列素。最优选,组合物可以包含约0.1% w/w量的拉坦前列素。在一些实施方案中,米诺地尔以约0.5-10% w/w (优选约1-6% w/w,更优选约2-5% w/w,最优选的值为5% w/w)的量包含。组合物为选自溶液、凝胶、软膏、泡沫、膜、擦剂、霜剂、洗发剂、洗剂、糊剂、凝胶剂、喷涂剂和气溶胶的一种的形式。在一些实施方案中,将组合物包装在具有用于施加到皮肤的施加器的试剂盒中。
[0330]
本发明的组合物和制剂可以使用以下一般程序来制造:在烧杯中合并非水性组分(例如,拉坦前列素、曲伏前列素、米诺地尔、非那雄胺乙醇、乙二醇),并使用推进器类型顶置式混合器搅拌,直至溶液澄清。将水加入到非水性混合物中,随后加入增稠剂。在增稠剂分散后,加入碱以中和聚合物,并且将溶液增稠为凝胶其它期望的组合物。例如,在烧杯中合并乙醇、米诺地尔和拉坦前列素,并使用推进器类型顶置式混合器搅拌,直至溶液澄清。然后将该混合物加入到非水性成分中以形成非水性混合物。在单独的容器中,将增稠剂分散在水中以形成水性混合物,然后将其加入到非水性混合物中。在非水性混合物和水性混合物混合后,加入碱以中和聚合物,并且将溶液增稠为凝胶。
[0331]
本发明的组合物可以使用以下一般程序来制造:在配备用于混合的合适的介质罐中称重乙醇,然后将比马前列素、拉坦前列素或曲伏前列素加入到乙醇中,并以中速搅拌直到溶解。在单独的混合槽中,加入米诺地尔、二乙二醇单乙醚、油醇、丙二醇和任选的poe 40,并混合直至溶剂分散。然后将乙醇/(比马前列素、拉坦前列素或曲伏前列素)溶液加入到非水性溶液中并混合,直到组分均匀混合(混合约5分钟)。如果需要凝胶,则向上述混合物中加入预先分散在水中的卡波姆增稠剂并混合直至充分分散,一旦分散,加入碱以将溶液增稠为凝胶。
[0332]
如下制备局部0.05% w/w的拉坦前列素/5% w/w的米诺地尔霜剂:在70-80℃的温度下将中等粘度的羧甲基纤维素和鲸蜡一起熔化。依次加入丙二醇、聚山梨醇酯80、拉坦前列素、米诺地尔和transcutol,保持在75-80℃的温度下。将防腐剂(例如对羟基苯甲酸甲酯)缓慢加入到羧甲基纤维素和鲸蜡的熔化物中,同时持续搅拌。在另外搅拌下继续加入至少30分钟,直到温度降至40-45℃。最后,加入足够的水以使最终重量达到1000 gm,并且搅拌制剂以保持均匀性直到冷却和凝结。
[0333]
一旦配制,制剂可以每天、每月或每年连续施加。
[0334]
实施例i患有斑秃的42岁白种人一天两次,2ml/天,将制剂viii的制剂施加到其头皮上脱发明显的区域,呈现为约四分之一大小的小块脱发。在施加30天后,患者头皮毛囊中的t细胞浸润将更少,并且患者的毛发将开始在小块上生长。
[0335]
实施例ii患有雄激素性脱发的32岁男性至少一天一次(1ml/天)将配方vi的制剂施加到其头皮上脱发的区域。45天连续施加后,引起脱发的潜在的自身免疫响应的严重性将减小,并且毛发将开始在患者的头皮上在脱发区域中再生长。
[0336]
实施例iii患有休止期脱发的43岁女性一天两次将配方xvii的制剂施加到其头皮。35天每天施加后,患者的毛发将开始在患者的头皮上在患者遭受脱发的区域中再生长。患者将不经历来自将制剂xvii施加到头皮的副作用。
[0337]
实施例iv患有稀疏眉毛的62岁女性使用施用器一天一次将制剂xxii施加到其眉毛。在45-90天内,患者将经历眉毛毛发的增加的生长,比起未施加制剂xxii的眉毛毛发,其更长、更粗且更深。
[0338]
实施例v53岁男性在他左前臂和右前臂下侧剃去约1英寸
×
1英寸区域。去除表皮上方的所有毛发。对患者每天一次向左前臂施加约0.5 ml的制剂xi,但是留下右前臂未经治疗。20天后,左前臂上的毛发更多、更长、更深且更粗,与之相比,右前臂上的毛发不多、更短、更浅且不那么粗。30天后,左前臂上的毛发更多、更长、更深且更粗,与之相比,右前臂上的毛发不多、更短、更浅且不那么粗。患者未经历副作用。
[0339]
实施例vi53岁男性在他左膝和右膝上方剃去4英寸
×
2英寸区域,以去除表皮上方的所有毛发,并且一天一次将配方xi的制剂施加到左膝上方的剃去的区域,而一天一次将5%的米诺地尔通用rogaine
®
溶液施加到右膝上方。20天后,左膝上方的剃去的区域的使毛发生长比右膝上方的剃去的区域稍微更大(更多毛发、更长的毛发且更粗)。30天后,左膝上方的区域的毛发比右膝上方的区域更长、更深且更粗。45天后,左膝上方的毛发比用5%的米诺地尔rogaine
®
溶液治疗的左膝上方的区域显著更长、直径更粗、更深且更多。患者未经历副作用。
[0340]
实施例vii54岁白种人男性在他大腿上剃去3个1英寸
×
1英寸正方形区域(区域#1-#3),2个并排并且1个在下面。去除表皮上方的所有毛发。区域#1和区域#2经治疗,而区域#3不接受制剂并且用作对照。对患者每天向区域#1施加约1/3 ml的制剂xx,并且向区域#2施加1/3毫升的制剂xviii。区域#3不接受治疗并且用作对照。30天后,与对照(区域#3)相比,区域1和区域2两者具有显著的使毛发生长,毛发更长、更深且更粗。30天后,关于毛发的长度或深度或厚度,区域#1和区域#2之间似乎没有显著的差异。然而,区域#1和区域#2比区域#3具有显著更多的使毛发生长。60天后,区域#1和区域#2两者具有显著的使毛发生长,但是关于长
度、厚度和深度,两个区域之间的差异不显著的,其中区域#1比区域#2多约10%毛发且毛发更长。关于深度和厚度,区域#1和区域#2之间似乎没有差异。
[0341]
实施例viii大致相应于hamilton norwood scale阶段iv的头顶秃了的53岁白种人男性以约1 ml/天向其头顶和头的前部一天一次施加制剂xx。在第75天,患者转换为制剂xviii。90天后,患者的头顶经历显著的再生长,其中约40-50%的变秃区域减少,在该区域中有新的使毛发生长(参见图5)。大多数新的使毛发生长是患者天然发色的较深色毛发,并且在经治疗的区域中深色毛发与灰色毛发的总比率显著增加。与他头顶变秃区域中的毫毛相比,新的毛发更长、更深且更粗。患者在施加制剂的他头的前部经历显著的再生长。患者未经历副作用。
[0342]
实施例ix54岁男性在他膝上方的大腿上剃去3个约2英寸
×
3英寸区域,其中毛发紧密向下至表皮的表面剃去。两个区域在左大腿上分隔开几英寸的距离,并且一个区域在他右大腿上。不向受试者的区域#1施加制剂并且留下该区域未经治疗,以约0.3 ml/天向区域#2施加通用5%的米诺地尔rogaine
®
溶液,并且以约0.3 ml/天向区域#3施加米诺地尔/拉坦前列素制剂(制剂xviii)。约15天后,未经治疗的区域显示一些使毛发生长,而与区域#1相比,区域#2和区域#3经历更显著的使毛发生长。区域#2和区域#3在毛发数量和长度上非常类似,但是区域#3的毛发似乎稍微更深且更粗。在第30天,所有三个区域经历再生长,其中与区域#1相比,区域#2和区域#3具有显著更大的毛发数量,其更长、更深且直径更大。在第30天,区域#2和区域#3的毛发数量大致相同,但是区域#3的毛发似乎比区域#2稍微更深且更粗。在第45天,区域1具有再生长,约一半的毛发再生长,但是不如区域#2和区域#3显著。在第45天,区域#3具有比区域#2显著更多的毛发,其中与区域#2相比,具有更大的长度、深度和厚度。
[0343]
实施例x54岁男性患者在他大腿上剃去三个区域(约1英寸
×
1英寸),使得去除真皮上方的那些区域的所有毛发。一天一次,患者开始在区域#1上施加制剂xxxv,然后向区域#2施加相同但不含拉坦前列素的制剂(4% w/v的米诺地尔溶液),并且向区域#3施加与制剂xxxv相同但不含米诺地尔的制剂(0.08% w/v的拉坦前列素溶液)。15天后,与区域#2和区域#3相比,区域#1具有较早开始毛发生长并且经历更大的再生长和较早开始毛发生长,因为在表皮上方存在更多的使毛发生长,比区域#2和区域#3具有更大的厚度且更大的深度。在第15天,在区域#2和区域#3之间,关于毛发数量、毛发的长度、毛发的厚度或毛发的深度,在使毛发生长之间几乎没有差异至没有差异。到第30天,与区域#2和区域#3相比,区域#1具有更多的再生长,与区域#3相比,具有更多的毛发、更长的毛发、更粗的毛发且更深的毛发。与区域#2和区域#3相比,区域#1更快开始毛发生长并且具有更大的毛发生长。患者未经历副作用。
[0344]
实施例xi相应于ludwig scale的阶段i的患有变秃和稀疏毛发的46岁白种人女性沿着她头顶在她头上一天两次以约2 ml/天施加制剂xx,施加约30天。在约第31天,患者开始一天一次(1 ml/天)沿着她头顶向她的头施加制剂xviii。到第45天,患者的头顶已经显著地填充为她初始发色的新的使毛发生长,其中深色毛发与灰色毛发的比率显著增加,其中与灰色
毛发相比,具有更多她初始发色的深色毛发(参见图4)。与她现有的毛发相比,新的使毛发生长的单个毛发还更粗。患者未经历副作用。
[0345]
实施例xii54岁患者在他手臂上剃去三个区域(约1英寸
×
1英寸),使得去除表皮表面上方的所有毛发。一天一次,患者在区域#1上施加制剂xviii,在区域#2上施加与制剂xviii相同但不含拉坦前列素的溶液,并且在区域#3上施加与制剂xviii相同但不含米诺地尔的溶液。15天后,比起区域#2和区域#3,区域#1较早开始毛发生长并且具有更多的使毛发生长(在表皮上方更多的使毛发生长、更长、更深且更粗)。到第30天,趋势继续,其中与区域#2和区域#3相比,区域#1经历显著的再生长。到第45天,与区域#2或区域#3相比,区域#1具有几乎完全长黑。与区域#2相比,区域#3具有稍微更深且更粗的毛发,但是区域#2生长比区域#3稍微更长。然而,区域#1具有更多的生长,比区域#3具有更长、更深且更粗的毛发,并且比区域#2具有更长的毛发。
[0346]
实施例xiii54岁患者通过在他上部大腿上剃去三个区域(约1英寸
×
1英寸)而去除毛发,使得从这些区域去除所有毛发。一天一次,对患者在区域#1上施加制剂xviii,在区域#2上施加制剂xxxv,并且在区域#3上不施加制剂。15天后,与区域#3相比,区域#1和区域#2两者经历显著的再生长。与区域#3相比,区域#1和区域#2中的毛发更长、更深、更粗且更多。到第30天,与区域#3相比,区域#1和区域#2两者具有显著的再生长,与区域#3相比,具有更多的毛发、更长的毛发、更粗的毛发且更深的毛发。到第45天,区域#1和区域#2两者是几乎完全长黑,并且比起区域#1或#2,区域#3具有显著较少的使毛发生长。在区域#1和区域#2之间,使毛发生长没有差异。患者未经历副作用。
[0347]
实施例xiv54岁患者通过剃去三个区域(约1英寸
×
1英寸)去除毛发,两个区域在他右小腿上,而一个区域在他左小腿上,使得去除在这些区域中在表皮上方的所有毛发。一天一次,对患者在区域#1(他左小腿上的区域)上施加制剂xviii,在他右(less)小腿上的区域#2上不施加制剂,并且在区域#3上施加制剂xix。15天后,与区域#2相比,区域#1和区域#3两者经历显著的再生长,其中比起区域#2,区域#3具有更多的使毛发生长(更多的毛发、更长且更粗)。到第30天,与区域#2相比,区域#1和区域#3两者具有显著的再生长,与区域#3相比,具有更多的毛发、更长的毛发、更粗的毛发且更深的毛发。到第30天,区域#3具有显著更多的使毛发生长,比起区域#2,具有更多、更长且更深的毛发,多约20%。患者未经历副作用。
[0348]
实施例xv62岁白种人女性沿着她头顶具有稀疏毛发。患者开始施加制剂xx,一天两次,约2 ml/天(通过沿着头顶喷涂1 ml/天,一天两次)。在第27天,患者转换到制剂xviii,一天一次施加,通过每天在她头顶上喷涂约1 ml的制剂。患者喷涂制剂xviii达30天。在第73天,患者毛发沿着头顶已显著长黑,具有更粗且更饱满的毛发,在头顶上具有使毛发生长,但是还未完全填充进去。
[0349]
实施例xvi沿着她头顶具有稀疏毛发的59岁白种人女性开始施加制剂xx,一天两次,约2 ml/天(通过在脱发的头皮的区域上喷涂1 ml/天,一天两次)。31天后,患者转换到制剂xviii,
一天一次施加,通过每天喷涂约1 ml的制剂。患者喷涂制剂xviii达78天。在第108天,患者的毛发沿着头顶具有显著的再生长。
[0350]
实施例xvii沿着她前额和太阳穴患有脱发的64岁白种人女性开始施加制剂xx,一天两次,约2 ml/天(通过在脱发的头皮的区域上喷涂1 ml/天,一天两次)。在第30天,患者转换到制剂xviii,一天一次施加,通过每天喷涂约1 ml的制剂。到第106天,患者沿着她前额和太阳穴经历显著的新的使毛发生长,比起在治疗前在那些区域中的现有的毛发,其中毛发更深且更粗。
[0351]
实施例xviii在他头顶上患有轻微变秃的26岁白种人男性开始施加制剂xx,一天两次,约2 ml/天(通过在脱发的头皮的区域上喷涂1 ml/天,一天两次)。在第29天,患者转换到制剂xviii,一天一次施加,通过每天喷涂约1 ml的制剂。在第99天,患者在他头顶上经历增加的使毛发生长,并且变秃区域不太可见。
[0352]
实施例xix在他头顶上具有显著变秃的44岁白种人男性大致相应于norwood-hamilton评分iv。患者开始施加制剂xx,一天两次,约2 ml/天(通过在脱发的头皮的区域上喷涂1 ml/天,一天两次)。在第29天,患者转换到制剂xviii,一天一次施加,通过每天喷涂约1 ml的制剂。在118第天,患者的毛发在头顶上具有显著长黑,比起在治疗前在相同区域中的毛发,其中毛发更深且更粗。到第108天,约一半的头顶生长有终毛,在这里以前不存在毛发或毫毛。
[0353]
实施例xx沿着她头顶患有稀疏毛发的59岁女性患者大致相应于ludwig scale的i-2或i-3,开始施加制剂xx,一天两次,约2 ml/天(通过在脱发的头皮的区域上喷涂1 ml/天,一天两次)。在第30天,患者转换到制剂xx,一天两次,约2 ml/天(通过在脱发的头皮的区域上喷涂1 ml/天,一天两次)。在第99天,头顶更粗并且更饱满,其中大多数头顶覆盖有新的毛发,比起在治疗前在相同区域中的毛发,其更粗。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1