含有抗ANGPTL3抗体的稳定制剂的制作方法
含有抗angptl3抗体的稳定制剂
相关申请的交叉引用
1.本技术于2020年5月24日提交作为pct国际专利申请,并要求于2019年5月24日提交的美国临时专利申请第62/852,643号的优先权,其全部内容通过引用并入本文。
技术领域
2.本发明涉及治疗性抗体制剂领域。更具体地,本发明涉及包含与人血管生成素样(蛋白)3(angptl3)特异性结合的人抗体的药物制剂领域。
背景技术:
3.治疗性大分子(例如,抗体)必须以这样的方式配制,即不仅使分子适合施用于患者,而且在储存和随后使用期间保持它们的稳定性。例如,液体溶液中的治疗性抗体易于降解、聚集或发生不需要的化学修饰,除非该溶液被适当地配制。液体制剂中抗体的稳定性不仅取决于制剂中使用的赋形剂的种类,还取决于赋形剂相对于彼此的量和比例。此外,在制备液体抗体制剂时,除了稳定性之外,还必须考虑其他因素。这些其他考虑因素的例子包括溶液的粘度和给定制剂可以适应的抗体浓度,以及制剂的可视质量或吸引力。因此,在配制治疗性抗体时,必须非常小心以得到保持稳定、含有足够浓度抗体、并具有合适的粘度以及使该制剂能够方便地施用于患者的其他特性的制剂。
4.血管生成素样蛋白3(angptl3)的抗体是需要适当配制的治疗相关大分子的一个例子。抗angptl3抗体在临床上可用于治疗与脂质代谢相关的疾病或病症、心血管疾病或病症以及与血管生成相关的疾病或病症。
5.人angptl3的氨基酸和核苷酸序列分别显示在seq id nos:161和162中。示例性抗angptl3抗体描述于例如us 9,018,356b2、wo2008/073300和us 7,935,796中。
6.尽管抗angptl3抗体是已知的,但本领域仍然需要足够稳定且适合施用于患者的包含此类抗体的新型药物制剂。发明概述
7.对于许多商业化的单克隆抗体,终产品的呈现形式取决于给药方法。一种这样的方法是基于患者对自我给药和较少给药频率的偏好。皮下注射自我给药是一种针对许多疾病的长期治疗而开发的胃肠外产品的优选施用方式。皮下(sc)注射需要以≤2ml总体积,优选≤1ml总体积来给药。较低频率的给药则要求每剂具有较高的药物浓度以及相应地,较高的蛋白质浓度制剂。因此,为了能够较低频率给药,需要可以在1ml中递送高浓度的药物(每剂》150mg)。高浓度制剂还可以实现更小的给药体积。例如,要将15mg/kg的药物递送给100kg的患者,即1500mg的药物,则需要150ml的10mg/ml制剂,而仅需要10ml的150mg/ml制剂。因此,高浓度制剂是优选的,因为它们能够实现小注射体积。
8.重要的是考虑这种较高蛋白质浓度制剂的稳定性和粘度。由于蛋白质浓度和粘度之间呈指数关系,蛋白质浓度的小差异可对粘度产生很大影响,并影响患者递送药物的能力。描述粘度(y轴)相对于蛋白质浓度(x轴)的曲线的陡度可受到添加赋形剂,尤其是那些
增加(例如,糖)或降低(例如,盐)粘度的赋形剂,和温度的影响。此外,粘度与通过注射器递送药物的能力直接相关。维持力(sustaining force)是连续分配预充式注射器内容物所需的力。可以使用注射器推力测试仪(instron)测量。维持力和粘度之间的关系是线性的。
9.使用预充式注射器或自动注射器进行自我给药,需要制剂具有低粘度(典型地小于约20厘泊)。因此,需要鉴定降低粘度的赋形剂并评估它们对抗体(特别是抗angptl3抗体)制剂的流变学特性和稳定性的影响。该数据可用于开发具有可接受粘度的基于氨基酸的高浓度液体制剂,用于预充式注射器和装置开发。
10.本发明通过提供包含与人血管生成素样蛋白3(angptl3)特异性结合的全人单克隆抗体的稳定药物制剂,满足了上述需要。h4h1276s是一种靶向angptl3的全人单克隆抗体,angptl3是一种重要的蛋白质,可在活性形式时抑制脂蛋白脂肪酶(lpl)。h4h1276s对angptl3的抑制可恢复lpl活性并促进甘油三酯和vldl的加工。因此,h4h1276s潜在地适用于多种疾病途径,包括严重的高甘油三酯血症和纯合子家族性高胆固醇血症。
11.一方面,本发明提供了一种稳定的低粘度高浓度液体药物制剂,其包含:(i)与人血管生成素样蛋白3(angptl3)特异性结合的人抗体;(ii)缓冲剂;(iii)有机共溶剂;(iv)至少一种粘度调节剂。在一个实施方案中,稳定的高浓度液体药物制剂进一步包含至少一种氨基酸。在另一个实施方案中,制剂包含稳定剂。另一方面,本发明提供了一种稳定的低粘度高浓度液体药物制剂,其包含:(i)特异性结合人血管生成素样蛋白3(angptl3)的人抗体;(ii)缓冲剂;(iii)有机共溶剂;(iv)至少两种粘度调节剂。在一个实施方案中,所述稳定的高浓度液体药物制剂进一步包含至少一种氨基酸。在另一个实施方案中,制剂包含稳定剂。术语“粘度调节剂”包括降低粘度的物质或赋形剂。
12.在多个实施方案中,以约5
±
0.75mg/ml至约250
±
37.5mg/ml的浓度提供抗体。在一个实施方案中,抗体以12.5mg/ml
±
1.85mg/ml或约12.5mg/ml的浓度提供。在另一个实施方案中,抗体以25mg/ml
±
3.75mg/ml或约25mg/ml的浓度提供。在另一个实施方案中,抗体以50mg/ml
±
7.5mg/ml或约50mg/ml的浓度提供。在另一个实施方案中,抗体以100mg/ml
±
15mg/ml或约100mg/ml的浓度提供。在一个实施方案中,抗体以150mg/ml
±
22.5mg/ml或约150mg/ml的浓度提供。在另一个实施方案中,抗体以165mg/ml
±
24.75mg/ml或约165mg/ml的浓度提供。在另一个实施方案中,抗体以175mg/ml
±
26.25mg/ml或约175mg/ml的浓度提供。在另一个实施方案中,抗体以200mg/ml
±
30mg/ml或约200mg/ml的浓度提供。
13.在某些实施方案中,制剂包含美国专利号9,018,356b2中公开的任何一种抗angptl3抗体,该专利在此全文并入本文。在某些实施方案中,抗angptl3抗体包含:(a)重链可变区(hcvr),所述hcvr包含重链互补决定区1、2和3(hcdr1-hcdr2-hcdr3),其分别包含seq id no:68、seq id no:70和seq id no:72的序列;(b)轻链可变区(lcvr),所述lcvr包含轻链互补决定区1、2和3(lcdr1-lcdr2-lcdr3),其分别包含seq id no:76、seq id no:78和seq id no:80的序列。在一个实施方案中,抗体包含:包含氨基酸序列seq id no:66的hcvr和包含氨基酸序列seq id no:74的lcvr。在另一个实施方案中,抗体包含与seq id no:66具有至少约90%序列同一性的hcvr和与seq id no:74具有至少约90%序列同一性的lcvr。在另一个实施方案中,抗体包含与seq id no:66具有至少约95%序列同一性的hcvr和与seq id no:74具有至少约95%序列同一性的lcvr。
14.在一个实施方案中,液体制剂的ph值为ph 6.0
±
0.5,ph 6.0
±
0.4,ph 6.0
±
0.3,
ph 6.0
±
0.2,ph 6.0
±
0.1,ph 6.0
±
0.05,ph 6.0
±
0.01,或ph 6.0。在一个实施方案中,液体制剂的ph值为约ph 6.0
±
0.3。
15.在一个实施方案中,缓冲剂是组氨酸。在某些实施方案中,组氨酸的浓度为5mm
±
1mm至50mm
±
10mm,优选5mm
±
1mm至25mm
±
5mm。在一个实施方案中,组氨酸的浓度为10mm
±
2mm或10mm
±
1mm或约10mm。在另一个实施方案中,组氨酸的浓度为20mm
±
4mm或20mm
±
2mm或约20mm。在另一个实施方案中,组氨酸的浓度为40nm
±
8mm或40nm
±
4mm或约40nm。
16.在某些实施方案中,有机共溶剂是含有聚氧乙烯部分的非离子聚合物。在一个实施方案中,有机溶剂是表面活性剂。在一些实施方案中,有机共溶剂是聚山梨酯、泊洛沙姆188和聚乙二醇3350中的任何一种或多种。在一个实施方案中,有机共溶剂是聚山梨酯80。在一个实施方案中,有机共溶剂是聚山梨酯20。
17.在一个实施方案中,有机共溶剂的浓度为约0.01%
±
0.005%至约1%
±
0.5%“重量/体积”或“w/v”,其中,例如,0.1g/ml=10%和0.01g/ml=1%。在某些实施方案中,有机溶剂是浓度为0.05%
±
0.025%至0.5%
±
0.25%(w/v)的聚山梨酯。在一个实施方案中,有机共溶剂是聚山梨酯80,其浓度为0.2%
±
0.1%w/v,或约0.2%。在另一个实施方案中,有机共溶剂是聚山梨酯80,其浓度为0.1%
±
0.05%w/v或约0.1%w/v。在一个实施方案中,有机共溶剂为聚山梨酯20,其浓度为0.2%
±
0.1%w/v,或约0.2%。在另一个实施方案中,有机共溶剂是聚山梨酯20,其浓度为0.1%
±
0.05%w/v或约0.1%w/v。
18.在某些实施方案中,稳定剂被包含在制剂中。在一个实施方案中,稳定剂是糖。在另一个实施方案中,糖是蔗糖。在多个实施方案中,稳定剂的浓度为1%
±
0.2%w/v至20%
±
4%w/v,5%
±
1%w/v至15%
±
3%w/v,或1%
±
0.2%至10%
±
2%w/v。在一个实施方案中,稳定剂是浓度为5%
±
1%w/v或约5%w/v的蔗糖。在另一个实施方案中,稳定剂是浓度为9%
±
1.8%w/v或约9%w/v的蔗糖。在另一个实施方案中,稳定剂是浓度为10%
±
2%w/v或约10%w/v的蔗糖。
19.在一个实施方案中,至少一种氨基酸被包括在制剂中。在一个实施方案中,氨基酸是l-脯氨酸。在某些实施方案中,氨基酸的浓度为1%
±
0.2%至5%
±
1%w/v。在一个实施方案中,氨基酸是浓度为1.5%
±
0.3%或约1.5%的脯氨酸。在一个实施方案中,氨基酸是浓度为3%
±
0.6%或约3%的脯氨酸。
20.在一个实施方案中,至少一种粘度调节剂是选自以下的赋形剂:精氨酸-hcl、氯化钠、组氨酸-hcl、乙酸钠、氯化钙、氯化镁、乙酸钙和乙酸镁。在一个实施方案中,粘度调节剂是精氨酸-hcl。在某些实施方案中,粘度调节剂的浓度为25mm至约75mm。在一个实施方案中,粘度调节剂是浓度为50mm至约75mm的精氨酸-hcl。
21.在某些实施方案中,液体药物制剂在25℃的粘度小于或等于约20厘泊
±
10%。在某些实施方案中,25℃的粘度在1.0厘泊
±
10%和20厘泊
±
10%之间。在某些实施方案中,液体药物制剂的粘度≤15厘泊。在某些实施方案中,液体药物制剂的粘度≤20厘泊。在某些实施方案中,液体药物制剂的粘度≤10厘泊。在某些实施方案中,25℃的粘度为5厘泊
±
10%,6.0厘泊
±
10%,7.0厘泊
±
10%,7.1厘泊
±
10%,7.2厘泊
±
10%,7.9厘泊
±
10%,8.3厘泊
±
10%,9.0厘泊
±
10%,9.6厘泊
±
10%,10.0厘泊
±
10%,10.6厘泊
±
10%,11.4厘泊
±
10%,11.6厘泊
±
10%,11.8厘泊
±
10%,12.0厘泊
±
10%,13.0厘泊
±
10%,14.0厘泊
±
10%,15.0厘泊
±
10%,或16厘泊
±
10%。
22.一方面,本发明提供了一种稳定的低粘度液体药物制剂,其包含:(i)5
±
0.75mg/ml至250
±
37.5mg/ml的特异性结合人angptl3的人抗体;(ii)0mμ至40
±
8mm的组氨酸;(iii)0%至0.5%
±
0.25%(w/v)的聚山梨酯80;(iv)50
±
10mm至75
±
15mm的精氨酸-hcl;(v)0至5%
±
1%的脯氨酸,ph约5.3至约6.7;其中抗angptl3抗体包含重链可变区(hcvr)和轻链可变区(lcvr),所述hcvr/lcvr组合包含重链和轻链互补决定区(hcdr1-hcdr2-hcdr3/lcdr1-lcdr2-lcdr3),其分别包含氨基酸序列seq id nos:68
–
70
–
72/seq id nos:76
–
78
–
80。在一个实施方案中,抗angptl3抗体包含重链可变区(hcvr)和轻链可变区(lcvr),其分别包含seq id no:66和seq id no:74的氨基酸序列。在某些实施方案中,抗体包含选自由人igg1、igg2、igg3和igg4同种型组成的组的fc区。在一个实施方案中,抗体包含人igg4同种型。
23.在某些实施方案中,本发明提供了一种稳定的、低粘度的液体药物制剂,其包含:(i)5
±
0.75mg/ml至250
±
37.5mg/ml的特异性结合人angptl3的人抗体;(ii)0mμ至40
±
8mm的组氨酸;(iii)0%至0.5%
±
0.25%(w/v)的聚山梨酯80;(iv)50
±
10mm至75
±
15mm的精氨酸-hcl;和(v)0至5%
±
1%的脯氨酸,ph约5.3至约6.7;其中抗angptl3抗体包含hcvr和lcvr,其中hcvr与seq id no:66具有至少约90%的序列同一性和/或lcvr与seq id no:74具有至少约90%的序列同一性。
24.在某些实施方案中,本发明提供了一种稳定的、低粘度的液体药物制剂,其包含:(i)5
±
0.75mg/ml至250
±
37.5mg/ml的特异性结合人angptl3的人抗体;(ii)0mμ至40
±
8mm的组氨酸;(iii)0%至0.5%
±
0.25%(w/v)的聚山梨酯80;(iv)50
±
10mm至75
±
15mm的精氨酸-hcl;和(v)0至5%
±
1%的脯氨酸,ph约5.3至约6.7;其中抗angptl3抗体包含hcvr和lcvr,其中hcvr包含具有不超过五个氨基酸取代的seq id no:66的氨基酸序列,并且其中lcvr包含具有不超过两个氨基酸取代的seq id no:74的氨基酸序列。
25.在某些实施方案中,任何前述方面的制剂具有选自由以下组成的组的属性:(i)制剂对于如本文所述的在25℃,5℃,-20℃,-30℃和-80℃的长期储存是稳定的;(ii)制剂对如本文所述的搅动胁迫是稳定的;(iii)制剂是低粘度的(粘度小于约20厘泊,优选小于约15厘泊);(iii)如本文所述,即使制剂赋形剂浓度有高达
±
50%的变化,制剂仍是稳定的;(iv)制剂与生理条件等渗;(iv)制剂对皮下递送装置和程序是稳定且相容的;(v)制剂在预充式注射器中长期储存是稳定的。
26.在此方面的某些实施方案中,本发明提供了一种稳定的液体制剂,其包含:(i)5
±
0.75mg/ml至250
±
37.5mg/ml的特异性结合人angptl3的人抗体;(ii)5mμ
±
1mm至20
±
4mm的组氨酸;(iii)0.05%
±
0.025%至0.3%
±
0.15%(w/v)的聚山梨酯80;(iv)50
±
5mm至75
±
7.5mm的精氨酸-hcl;(v)1%
±
0.2%至5%
±
1%的脯氨酸,ph值约6.0,其中该抗体包含hcvr/lcvr,该hcvr/lcvr包含seq id no:66/74的氨基酸序列对。在一个实施方案中,此方面的稳定液体制剂具有小于约20cp的粘度。在另一个实施方案中,此方面的稳定液体制剂具有小于约15cp的粘度。
27.在此方面的一个实施方案中,稳定的液体制剂包含(i)50
±
7.5mg/ml的抗angptl3抗体;(ii)10
±
2mm的组氨酸;(iii)0.1%
±
0.05%(w/v)的聚山梨酯80;(iv)3%
±
0.6%的脯氨酸;(v)70
±
5mm的精氨酸-hcl,ph 6.0
±
0.3,其中抗体包含hcvr/lcvr,所述hcvr/lcvr包含seq id no:66/74的氨基酸序列对。
28.在另一个实施方案中,稳定的液体制剂包含(i)100
±
15mg/ml的抗angptl3抗体;(ii)10
±
2mm的组氨酸;(iii)0.1%
±
0.05%(w/v)的聚山梨酯80;(iv)3%
±
0.6%的脯氨酸;(v)70
±
5mm的精氨酸-hcl,ph 6.0
±
0.3,其中抗体包含hcvr/lcvr,所述hcvr/lcvr包含seq id no:66/74的氨基酸序列对。
29.在另一个实施方案中,稳定的液体制剂包含(i)150
±
22.5mg/ml的抗angptl3抗体;(ii)10
±
2mm的组氨酸;(iii)0.1%
±
0.05%(w/v)的聚山梨酯80;(iv)70
±
5mm的精氨酸-hcl;(v)3%
±
0.6%的脯氨酸,ph 6.0
±
0.3,其中抗体包含hcvr/lcvr,该hcvr/lcvr包含seq id no:66/74的氨基酸序列对。在本文公开的制剂的一个实施方案中,粘度小于约20厘泊,在另一实施方案中,小于约15厘泊。
30.在此方面的另一个实施方案中,稳定的液体制剂包含(i)175
±
26.25mg/ml的抗angptl3抗体;(ii)10
±
2mm的组氨酸;(iii)0.1%
±
0.05%(w/v)的聚山梨酯80;(iv)70
±
5mm的精氨酸-hcl;(v)3%
±
0.6%的脯氨酸,ph 6.0
±
0.3,其中抗体包含hcvr/lcvr,该hcvr/lcvr包含seq id no:66/74的氨基酸序列对。
31.在此方面的另一个实施方案中,稳定的液体制剂包含(i)200
±
30.00mg/ml的抗angptl3抗体;(ii)10
±
2mm的组氨酸;(iii)0.1%
±
0.05%(w/v)的聚山梨酯80;(iv)70
±
5mm的精氨酸-hcl;(v)3%
±
0.6%的脯氨酸,ph 6.0
±
0.3,其中抗体包含hcvr/lcvr,该hcvr/lcvr包含seq id no:66/74的氨基酸序列对。
32.在本文公开的制剂的一个实施方案中,制剂还包含5%
±
1%(w/v)的蔗糖。
33.在一个实施方案中,制剂在45℃储存21天后,≥约95%的抗体是天然的,并且≥约45%的抗体是主要电荷形式。在一个实施方案中,制剂在5℃储存36个月后,》约98%的抗体是天然的,并且》约55%的抗体是主要电荷形式。在一个实施方案中,制剂在-20℃储存9个月后,》约98%的抗体是天然的,并且》约61%的抗体是主要电荷形式。在一个实施方案中,制剂在-30℃储存36个月后,》约98%的抗体是天然的,并且》约56%的抗体是主要电荷形式。
34.单克隆抗体的阳离子交换色谱洗脱曲线通常包括三个峰:早洗脱峰和晚洗脱峰(即,分别地所谓的酸性和碱性变体),以及称为主峰(或主电荷形式或变体)的丰度最大的峰(中间)。
35.在一个方面,在容器中提供前述任一方面的液体药物制剂。在一个实施方案中,容器是聚碳酸酯小瓶。在另一个实施方案中,容器是玻璃小瓶。在一个实施方案中,玻璃小瓶是具有碳氟化合物涂覆的丁基橡胶塞的1型硼硅酸盐玻璃小瓶。在另一个实施方案中,容器是微型输注器(microinfuser)。在另一个实施方案中,容器是注射器。在另一个实施方案中,容器是预充式注射器。在一个实施方案中,注射器包括碳氟化合物涂覆的柱塞。在某些实施方案中,注射器是1ml或2.25ml长玻璃注射器,含有少于约十亿分之500的钨,配备有27-g针头、碳氟化合物涂层的丁基橡胶塞、和不含乳胶的非细胞毒性橡胶针帽。在一个特定实施方案中,注射器是配备有27-g薄壁针头、flurotec涂层的4023/50橡胶塞和fm 27橡胶针帽的1ml长玻璃注射器。在另一个具体实施方案中,注射器是装有27-g针头的1ml或3ml塑料注射器。在一个实施方案中,塑料注射器由becton dickinson分销。在另一个实施方案中,容器是带有涂层的4432/50氯化丁基塞的1型透明玻璃小瓶。
36.一方面,本发明提供了一种药盒,其包含前述任一方面的药物组合物、容器和使用
说明书。在一个实施方案中,容器是预充式注射器。在一个实施方案中,注射器是配备有27-g薄壁针头、flurotec涂层的4023/50橡胶塞和fm 27橡胶针帽的nuova ompi 1ml或2.25ml长玻璃注射器。
37.在某些实施方案中,本发明提供包含稳定液体药物制剂的预充式注射器,该制剂包含:(i)5
±
0.75mg/ml至250
±
37.5mg/ml的特异性结合人angptl3的人抗体;(ii)5mμ
±
1mm至20
±
4mm的组氨酸;(iii)0.05%
±
0.025%至0.3%
±
0.15%(w/v)的聚山梨酯80;(iv)50
±
10mm至75
±
15mm的精氨酸-hcl;(v)1%
±
0.2%至5%
±
1%的脯氨酸,ph 6.0
±
0.3,其中抗体包含hcvr/lcvr,该hcvr/lcvr包含seq id no:66/74的氨基酸序列对;其中所述制剂具有选自由以下组成的组的属性:(i)在5℃储存36个月后,≥约98%的抗体为天然形式;(ii)在5℃储存36个月后,≥约55%的抗体为主要电荷变体;(iii)制剂对搅动胁迫具有稳定性,其中在透明玻璃小瓶中经过120分钟搅动胁迫后,≥98%的抗体为天然形式。
38.在某些实施方案中,本发明提供了一种稳定的液体药物制剂,其包含:(i)5
±
0.75mg/ml至250
±
37.5mg/ml的特异性结合人angptl3的人抗体;(ii)5mμ
±
1mm至20
±
4mm的组氨酸;(iii)0.05%
±
0.025%至0.3%
±
0.15%(w/v)的聚山梨酯80;(iv)50
±
10mm至75
±
15mm的精氨酸-hcl;(v)1%
±
0.2%至5%
±
1%的脯氨酸,ph 6.0
±
0.3,其中抗体包含hcvr/lcvr,该hcvr/lcvr包含seq id no:66/74的氨基酸序列对;其中所述制剂具有选自由以下组成的组的属性:(i)制剂对于在皮下和/或静脉内递送装置中的使用而言是稳定且相容的;(ii)制剂对于用本领域已知的标准稀释剂(例如,0.9%氯化钠或5%葡萄糖)稀释,是化学和物理稳定的;(iii)制剂对预充式注射器或自动注射器形式是稳定的;(iv)制剂与标准输注泵(例如蠕动泵、流体容积泵(fluid displacement pump))是相容的。
39.从后续的详细描述中,其他实施方案将是明显的。附图简述
40.图1图解描述了h4h1276s浓度对粘度的影响。
41.图2显示的表格总结了ph对45℃温育28天的150mg/ml h4h1276s的稳定性的影响。
a.
如果样品为透光到微不透光,基本上没有可见颗粒,无色到淡黄色,则样品在颜色和视觉外观上是合格的。
b.
报告为相对于起始材料的纯度变化。在所有5种制剂中,起始材料(无温育)包含≥98.4%的se-uplc天然峰以及≥62.7%的cex-uplc主峰。cex-uplc,阳离子交换超高效液相色谱;fdg,制剂开发组别;hmw,高分子量;lmw,低分子量;od,光密度;rp-uplc,反相超高效液相色谱;se-uplc,尺寸排阻超高效液相色谱。
42.图3显示的表格总结了聚山梨酯80对(120分钟涡旋)搅动后150mg/ml h4h1276s稳定性的影响。
a.
如果样品为透光到微不透光,基本上没有可见颗粒,无色到淡黄色,则样品在颜色和视觉外观上是合格的。
b.
报告为相对于起始材料的纯度变化。在所有12种制剂中,起始材料(无温育)包含≥98.4%的se-uplc天然峰以及≥62.7%的cex-uplc主峰。cex-uplc,阳离子交换超高效液相色谱;fdg,制剂开发组别;hmw,高分子量;lmw,低分子量;od,光密度;rp-uplc,反相超高效液相色谱;se-uplc,尺寸排阻超高效液相色谱。
43.图4显示的表格总结了聚山梨酯80浓度对45℃温育28天后150mg/ml h4h1276s稳定性的影响。
a.
如果样品为透光到微不透光,基本上没有可见颗粒,无色到淡黄色,则样品在颜色和视觉外观上是合格的。
b.
报告为相对于起始材料的纯度变化。在所有5种制剂中,起始材料(无温育)包含≥98.4%的se-uplc天然峰以及≥62.7%的cex-uplc主峰。cex-uplc,阳
离子交换超高效液相色谱;fdg,制剂开发组别;hmw,高分子量;lmw,低分子量;od,光密度;rp-uplc,反相超高效液相色谱;se-uplc,尺寸排阻超高效液相色谱。
44.图5显示的表格总结了聚山梨酯80浓度对150mg/ml h4h1276s在搅动(涡旋120分钟)或在45
°
温育28天后的亚可见颗粒形成的影响。
a.
使用ecd(μm)≥5.00、纵横比(aspect ratio)《0.85和忽略边缘粒子过滤器(ignore edge particle filter),过滤数据。cex-uplc,阳离子交换超高效液相色谱;fdg,制剂开发组别;hmw,高分子量;lmw,低分子量;od,光密度;rp-uplc,反相超高效液相色谱;se-uplc,尺寸排阻超高效液相色谱。
45.图6显示的表格总结了蔗糖和脯氨酸对h4h1276s在-20℃温育9个月后的稳定性的影响。
a.
对应于175mg/ml h4h1276s、10mm组氨酸,ph 6.0、70mm精氨酸-hcl制剂。
b.
如果样品为透光到微不透光,基本上没有可见颗粒,无色到淡黄色,则样品在颜色和视觉外观上是合格的。
c.
报告为相对于起始材料的纯度变化。在所有5种制剂中,起始材料(无温育)包含≥98.4%的se-uplc天然峰以及≥62.7%的cex-uplc主峰。cex-uplc,阳离子交换超高效液相色谱;fdg,制剂开发组;hmw,高分子量;lmw,低分子量;od,光密度;rp-uplc,反相超高效液相色谱;se-uplc,尺寸排阻超高效液相色谱。
46.图7显示的表格总结了蔗糖和脯氨酸对h4h1276s在8个冻/融循环后的稳定性的影响。
a.
对应于175mg/ml h4h1276s、10mm组氨酸,ph 6.0、70mm精氨酸-hcl制剂。
b.
如果样品为透光到微不透光,基本上没有可见颗粒,无色到淡黄色,则样品为在颜色和视觉外观上合格的。
c.
报告为相对于起始材料的纯度变化。在所有5种制剂中,起始材料(无温育)包含≥98.4%的se-uplc天然峰和≥62.7%的cex-uplc主峰。cex-uplc,阳离子交换超高效液相色谱;fdg,制剂开发组别;hmw,高分子量;lmw,低分子量;od,光密度;rp-uplc,反相超高效液相色谱;se-uplc,尺寸排阻超高效液相色谱。
47.图8显示的表格总结了蔗糖和脯氨酸对h4h1276s在45
°
温育21天后的稳定性的影响。
a.
对应于175mg/ml h4h1276s、10mm组氨酸,ph 6.0、70mm精氨酸-hcl制剂。
b.
如果样品是透光到微不透光,基本上没有可见颗粒,无色到淡黄色,则样品是颜色和视觉外观合格的。
c.
报告为相对于起始材料的纯度变化。在所有5种制剂中,起始材料(无温育)包含≥98.4%的se-uplc天然峰和≥62.7%的cex-uplc主峰。cex-uplc,阳离子交换超高效液相色谱;fdg,制剂开发组别;hmw,高分子量;lmw,低分子量;od,光密度;rp-uplc,反相超高效液相色谱;se-uplc,尺寸排阻超高效液相色谱。
48.图9显示的表格总结了蔗糖和脯氨酸对h4h1276s在-30℃温育36个月后的稳定性的影响。
a.
如果样品是透光到微不透光,基本上没有可见颗粒,无色到淡黄色,则样品是颜色和视觉外观合格的。
b.
报告为相对于起始材料的纯度变化。对于两种制剂,起始材料(无温育)包含98.8%的se-uplc天然峰;以及根据cex-uplc测定,对于蔗糖制剂,59.2%的主峰,和对于脯氨酸制剂,60.0%的主峰。cex-uplc,阳离子交换超高效液相色谱;fdg,制剂开发组别;hmw,高分子量;lmw,低分子量;od,光密度;rp-uplc,反相超高效液相色谱;se-uplc,尺寸排阻超高效液相色谱。
49.图10显示的表格总结了蔗糖和脯氨酸对h4h1276s在5℃温育36个月后的稳定性的影响。
a.
如果样品是透光到微不透光,基本上没有可见颗粒,无色到淡黄色,则样品是颜色和视觉外观合格的。
b.
报告为相对于起始材料的纯度变化。对于两种制剂,起始材料(无温育)包含98.8%的se-uplc天然峰;以及根据cex-uplc测定,对于蔗糖制剂,59.2%的主峰,和对
于脯氨酸制剂,60.0%的主峰。
c.
报告三个独立样品的平均值。cex-uplc,阳离子交换超高效液相色谱;fdg,制剂开发组别;hmw,高分子量;lmw,低分子量;od,光密度;rp-uplc,反相超高效液相色谱;se-uplc,尺寸排阻超高效液相色谱。
50.图11图解描绘了先导制剂的粘度与h4h1276s浓度的关系。
51.图12a和12b图示了h4h1276s浓度、温度和粘度之间的关系。150mg/ml h4h1276s处的星形和圆圈点也对应于5℃的推荐储存温度(圆圈)或25℃的推荐施用温度(星形)。165mg/ml h4h1276s处的星形和圆圈点对应于+10%制造规格的制剂。图12a的制剂是10mm组氨酸、70mm精氨酸-hcl、5%蔗糖和0.1%聚山梨酯80,ph 6。图12b的制剂是10mm组氨酸、70mm精氨酸-hcl、3%脯氨酸和0.1%聚山梨酯80,ph 6。
52.图13a和13b的柱状图显示了,降低粘度的赋形剂的筛选结果。在图13a中,针对添加到基础制剂中的各种赋形剂,测量了粘度,并针对一些选项,调整了ph。在图13b中,针对添加到不同基础制剂中的各种赋形剂,测量了粘度。
53.图14的柱形图显示了,在45℃温育21天后,对于各种赋形剂,hmw物质的相对增加(量化为百分比)。
54.图15a和15b的柱形图(图15a)和线形图(图15b),描绘了含有降低粘度的赋形剂的h4h1276s制剂的稳定性。在图15a中,对于不同浓度的蔗糖和/或l-脯氨酸,在含有70mm arg-hcl vs.25mm mg(oac)2的制剂中,测量了hmw和酸性物质以及粘度的相对增加。在图15b中,根据hmw物质百分比随时间的变化,测量了冷冻储存稳定性(-20℃)。
55.图16a和16b是显示温度、h4h1276s浓度和粘度的等值线图,此三者彼此相关。图16a针对含有10mm组氨酸,ph 6、70mm arg-hcl和3%(w/v)脯氨酸的制剂;图16b针对含有10mm组氨酸,ph 6、70mm arg-hcl和5%(w/v)蔗糖的制剂。
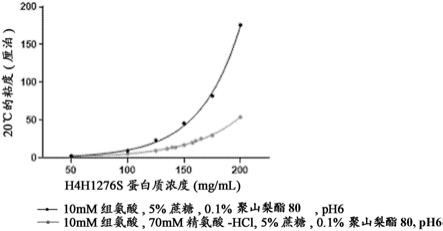
56.图17图示了在20℃下粘度与h4h1276s浓度的关系。将粘度绘制为蛋白质浓度的函数。使用graphpad prism将数据拟合成指数曲线。该方程可用于根据已知浓度来预测粘度,这对于定义制造规格是有用的。发明详述
57.在描述本发明制剂和方法之前,应当理解本发明不限于所描述的特定制剂和方法以及实验条件,因为这样的制剂和方法和条件可以变化。还应理解,本文中使用的术语仅用于描述特定实施方案的目的,而非旨在限制,本发明的范围将仅由所附权利要求限制。
58.除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同含义。如本文所用,术语“约”,当用于具体述及的数值或数值范围时,表示该数值可与所述及的值相差不超过1%。例如,如本文所用,表述“约100”包括99和101以及其间的所有值(例如,99.1、99.2、99.3、99.4等)。现描述优选的方法和材料,但在实践或测试本发明时可以使用与本文所述的那些相似或等效的任何方法和材料。本文提及的所有出版物通过引用整体并入本文。定义
59.如本文所用,表述“药物制剂”是指至少一种活性成分(例如,能够在人或非人动物中发挥生物学效应的小分子、大分子、化合物等)和至少一种非活性成分的组合,其中,所述非活性成分,当与所述活性成分或一种或多种其他的非活性成分组合时,适用于对人类或非人类动物的治疗性施用。如本文所用,除非另外特别指明,否则术语“制剂”是指“药物制
剂”。本发明提供包含至少一种治疗性多肽的药物制剂。根据本发明的某些实施方案,治疗性多肽是抗体、或其抗原结合片段,其与人血管生成素样蛋白3(angptl3)特异性结合。
60.如本文所用,术语“人血管生成素样蛋白3”或“hangptl3”是指,具有seq id no:162所示核酸序列和seq id no:161的氨基酸序列的angptl3,或其生物活性片段。
61.如本文所用,术语“抗体”旨在指由四个多肽链(即,通过二硫键相互连接的两条重(h)链和两条轻(l)链)组成的免疫球蛋白分子。每条重链由重链可变区(hcvr)和重链恒定区(ch;由结构域ch1、ch2和ch3组成)组成。每条轻链由轻链可变区(lcvr)和轻链恒定区(c
l)
组成。hcvr和lcvr可以进一步细分为高变区,称为互补决定区(cdr),其间散布着更保守的区域,称为框架区(fr)。每个hcvr和lcvr由三个cdr和四个fr组成,从氨基端到羧基端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。
62.取代一个或多个cdr残基或省略一个或多个cdr也是可能的。科学文献中已经描述,在抗体中,对于结合而言,一个或两个cdr可以是非必需的。padlan,et al.(1995faseb j.9:133-139),根据已发表的晶体结构,分析了抗体与其抗原之间的接触区域,并得出结论,只有大约五分之一到三分之一的cdr残基与抗原实际接触。padlan还发现,在许多抗体中,一个或两个cdr不具有与抗原接触的氨基酸(也参见vajdos等,2002 j mol biol 320:415-428)。
63.不接触抗原的cdr残基可以通过分子建模和/或经验从位于chothia cdrs之外的kabat cdrs区域中鉴定。如果一个cdr或其(一个或多个)残基可以被省略,则通常可以用在另一人抗体序列或此类序列的共有序列中位于相应位置的氨基酸对其进行取代。在cdrs中的取代位置和取代的氨基酸也可以凭经验选择。经验性取代可以是保守的或非保守的取代。
64.如本文所用,术语“人抗体”旨在包括具有源自人种系免疫球蛋白序列的可变区和恒定区的抗体。本发明的人mab可以包括不是由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变),例如在cdr中,特别是在cdr3中。然而,如本文所用,术语“人抗体”不旨在包括其中源自另一哺乳动物物种(例如,小鼠)种系的cdr序列已移植到人fr序列上的mab。
65.与相应的种系序列相比,本文公开的全人抗hangptl3抗体可以在重链和轻链可变结构域的框架和/或cdr区中包含一个或多个氨基酸取代、插入和/或缺失。通过将本文公开的氨基酸序列与可从例如公共抗体序列数据库获得的种系序列进行比较,可以容易地确定此类突变。本文所述的抗体及其抗原结合片段可以源自本文公开的任何氨基酸序列,其中一个或多个框架和/或cdr区内的一个或多个氨基酸被突变为所述抗体所源自的种系序列的相应残基、或突变为另一人种系序列的相应残基、或突变为相应种系残基的保守氨基酸取代(此类序列变化在本文中统称为“种系突变”)。
66.本领域普通技术人员,从本文公开的重链和轻链可变区序列开始,可以容易地产生包含一个或多个种系回复单突变或其组合的多种抗体和抗原结合片段。在某些实施方案中,vh和/或vl结构域内的所有框架和/或cdr残基均回复突变为抗体所来源的原始种系序列中的残基。在其他实施方案中,仅某些残基回复突变为原始种系序列,例如仅在fr1的前8个氨基酸内或在fr4的后8个氨基酸内发现突变残基,或仅在cdr1、cdr2或cdr3内发现突变残基。在其他实施方案中,框架和/或cdr残基中的一个或多个被突变为不同种系序列(即,
与抗体最初来自的种系序列不同的种系序列)的相应残基。
67.此外,本文描述的抗体可在框架和/或cdr区内包含两个或更多个种系突变的任何组合,例如,其中某些残基突变为特定种系序列的相应残基,而与原始种系序列不同的某些其他残基被保持或被突变为不同种系序列的相应残基。一旦获得了包含一个或多个种系突变的抗体和抗原结合片段后,可以很容易地测试其的一种或多种所需特性,例如改进的结合特异性、增加的结合亲和力、改进或增强的拮抗或激动生物学特性(视情况而定)、降低的免疫原性等。以这种一般方式获得的抗体和抗原结合片段包括在本发明内。
68.本发明还包括抗angptl3抗体,其包含本文公开的任何hcvr、lcvr和/或cdr氨基酸序列的变体,所述变体具有一个或多个的保守取代。例如,本发明包括具有这样的hcvr、lcvr和/或cdr氨基酸序列的抗angptl3抗体,其中所述hcvr、lcvr和/或cdr氨基酸序列,相对于本文公开的任何hcvr、lcvr和/或cdr的氨基酸序列,具有例如10个或更少、8个或更少、6个或更少、4个或更少、2个或1个的保守氨基酸取代。在一个实施方案中,hcvr包含其中具有10个或更少的保守氨基酸取代的seq id no:66的氨基酸序列。在另一个实施方案中,hcvr包含其中具有8个或更少的保守氨基酸取代的seq id no:66的氨基酸序列。在另一个实施方案中,hcvr包含其中具有6个或更少的保守氨基酸取代的seq id no:66的氨基酸序列。在另一个实施方案中,hcvr包含其中具有4个或更少的保守氨基酸取代的seq id no:66的氨基酸序列。在又一个实施方案中,hcvr包含其中具有2个或1个保守氨基酸取代的seq id no:66的氨基酸序列。在一个实施方案中,lcvr包含其中具有10个或更少的保守氨基酸取代的seq id no:74的氨基酸序列。在另一个实施方案中,lcvr包含其中具有8个或更少的保守氨基酸取代的seq id no:74的氨基酸序列。在另一个实施方案中,lcvr包含其中具有6个或更少的保守氨基酸取代的seq id no:74的氨基酸序列。在另一个实施方案中,lcvr包含其中具有4个或更少的保守氨基酸取代的seq id no:74的氨基酸序列。在又一个实施方案中,lcvr包含其中具有2个或1个保守氨基酸取代的seq id no:74的氨基酸序列。
69.除非另有具体说明,否则本文所用的术语“抗体”应理解为涵盖,包含两条免疫球蛋白重链和两条免疫球蛋白轻链的抗体分子(即“全抗体分子”)以及其抗原结合片段。如本文所用,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”等,包括可以特异性结合抗原以形成复合物的、任何天然存在的、可通过酶学方法获得的、合成的或基因工程改造的多肽或糖蛋白。抗体的抗原结合片段可以使用任何合适的标准技术例如蛋白水解消化从例如完整抗体分子衍生,或通过涉及操作和表达编码抗体可变结构域和(任选地)恒定结构域的dna的重组基因工程技术来获得。这样的dna是已知的和/或容易从例如商业来源、dna文库(包括例如噬菌体展示抗体文库)获得,或者可以合成。所述dna可以通过化学或分子生物学技术进行测序和操作,例如,将一个或多个可变和/或恒定结构域排列成合适的构型,或引入密码子、产生半胱氨酸残基、修饰、添加或删除氨基酸,等等。
70.抗原结合片段的非限制性实例包括:(i)fab片段;(ii)f(ab')2片段;(iii)fd片段;(iv)fv片段;(v)单链fv(scfv)分子;(vi)dab片段;(vii)模拟抗体高变区的由氨基酸残基组成的最小识别单元(例如,分离的互补决定区(cdr),例如cdr3肽)、或受约束的fr3-cdr3-fr4肽。其他工程分子,例如结构域特异性抗体、单域抗体、结构域缺失抗体、嵌合抗体、cdr移植抗体、双链抗体(diabody)、三链抗体(triabody)、四链抗体(tetrabody)、微型抗体、纳米抗体(例如单价纳米抗体、二价纳米抗体等)、小模块化免疫药物(smip)和鲨鱼可
angptl3活性的抗体)旨在指,如通过本领域已知的标准体外测定试验评估,与angptl3结合导致angptl3的至少一种生物活性的直接抑制的抗体。术语“中和”、“抑制”、“阻断”和“消除”在本文中可互换使用.“非阻断性”抗体是指,如通过标准体外测定试验评估,其与angptl3的结合不直接阻断angptl3的靶活性的抗体,但该抗体仍可以是“干扰性”抗体,即,所述抗体与angptl3的结合导致对angptl3在体内的至少一种生物活性的间接抑制、降低、减弱或其他干扰,例如通过增强angptl3从循环中的清除来实现所述干扰。angptl3从循环中的清除可以通过至少两种非阻断性抗体的组合来特别增强。angptl3的生物活性的中和、抑制、消除、降低、减弱或干扰可以通过本领域已知的几种标准体外或体内测定试验中的一种或多种,测量angptl3生物活性的一个或多个指标来评估。
79.如本文所用,术语“表面等离子体共振”是指,例如可以使用biacore
tm
系统(pharmacia biosensor ab,uppsala,sweden和piscataway,n.j.),允许在生物传感器基质中通过检测蛋白质浓度的变化来分析实时生物特异性相互作用的光学现象。
80.术语“表位”是与抗体结合的抗原区域。表位可定义为结构性或功能性。功能性表位通常是结构表位的一个子集,并且具有直接促成相互作用的亲和力的那些残基。表位也可以是构象的,即由非线性氨基酸组成。在某些实施方案中,表位可以包括构成分子的化学活性表面基团的决定簇,例如氨基酸、糖侧链、磷酰基或磺酰基,并且在某些实施方案中,可以具有特定的三维结构特征和/或特定的电荷特性。
81.术语“基本同一”或“基本相同”在提及核酸或其片段时表示,当所述核酸或其片段与另一核酸(或其互补链)在具有适当的核苷酸插入或缺失下进行最佳比对时,在至少约90%,更优选至少约95%、96%、97%、98%或99%的核苷酸碱基中存在核苷酸序列同一,如下所述,可以通过任何熟知的序列同一性算法测量,例如fasta、blast或gap。
82.当应用于多肽时,术语“基本相似”或“基本相似的”是指,两个肽序列,在例如通过程序gap或bestfit使用默认空位权重进行最佳比对时,共享至少90%的序列同一性,甚至更优选至少95%、98%或99%的序列同一性。优选地,不相同的残基位置因保守氨基酸取代而不同。“保守氨基酸取代”是其中一个氨基酸残基被另一个具有类似化学性质(例如,电荷或疏水性)的侧链(r基团)的氨基酸残基取代。一般而言,保守氨基酸取代基本上不会改变蛋白质的功能特性。在两个或多个氨基酸序列因保守置换而彼此不同的情况下,可以向上调整相似性百分比或程度以校正置换的保守性质。进行这种调整的手段是本领域技术人员公知的。参见,例如,pearson(1994)methods mol.biol.24:307-331。具有类似化学性质的侧链的氨基酸的组的例子包括1)脂族侧链:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;2)脂族-羟基侧链:丝氨酸和苏氨酸;3)含酰胺侧链:天冬酰胺和谷氨酰胺;4)芳族侧链:苯丙氨酸、酪氨酸、色氨酸;5)碱性侧链:赖氨酸、精氨酸、组氨酸;6)酸性侧链:天冬氨酸和谷氨酸,和7)含硫侧链:半胱氨酸和甲硫氨酸。优选的保守氨基酸取代基团是:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸、谷氨酸-天冬氨酸和天冬酰胺-谷氨酰胺。或者,保守取代是在gonnet et al.(1992)science 256:1443 45公开的pam250对数似然矩阵中具有正值的任何变化。“适度保守”取代是在pam250对数似然矩阵中具有非负值的任何变化。
83.通常使用序列分析软件测量多肽的序列相似性。蛋白质分析软件使用分配给各种取代、缺失和其他修饰(包括保守氨基酸取代)的相似性量度,来匹配相似序列。例如,gcg软
件包含gap和bestfit等程序,可以使用默认参数来确定密切相关的多肽之间的序列同源性或序列同一性,例如来自不同生物物种的同源多肽或野生型蛋白质和其突变蛋白之间的序列同源性或序列同一性。参见例如gcg版本6.1。多肽序列也可以使用fasta(gcg 6.1版中的一个程序)与默认或推荐参数进行比较。fasta(例如,fasta2和fasta3)提供查询和搜索序列之间最佳重叠区域的比对和序列同一性百分比(pearson(2000)同上引文)。当将本发明的序列与包含来自不同生物体的大量序列的数据库进行比较时,另一个优选算法是计算机程序blast,尤其是blastp或tblastn,其中使用默认参数。参见,例如altschul et al.(1990)j.mol.biol.215:403 410和(1997)nucleic acids res.25:3389 402。
84.短语“治疗有效量”是指,施用后产生所需的效果的量。确切的量将取决于治疗目的、治疗对象的年龄和尺寸、给药途径等,并且本领域技术人员可以使用已知技术确定(参见,例如,lloyd(1999)the art,science and technology of pharmaceutical compounding)。生物等效物
85.本文所述的抗hangptl3抗体和抗体片段涵盖,具有与所述mab的氨基酸序列不同的氨基酸序列但保留结合人angptl3的能力的蛋白质。当与亲本序列相比时,此类变体mab和抗体片段包含一个或多个氨基酸的添加、缺失或取代,但表现出与所述mab的生物活性基本等同的生物活性。同样,本文所述的编码抗hangptl3抗体的dna序列涵盖这样的序列,所述序列与所公开的序列相比包含一个或多个核苷酸添加、缺失或取代,但编码与本文所述的抗hangptl3抗体或抗体片段基本上生物等效的抗hangptl3抗体或抗体片段。上文讨论了此类变体氨基酸和dna序列的实例。
86.两种抗原结合蛋白或抗体被认为是生物等效的,例如,如果它们是药物等效物或药物替代物,即,当在相似实验条件下以相同摩尔剂量进行单剂或多剂给药时,它们的吸收速率和吸收程度不显示显著差异。某些抗体如果它们就吸收程度而言是等同的但就吸收速率而言不等同,但由于如下原因仍可被认为是生物等效时,将被视为等效物或药物替代物,其中所述原因是,这种吸收速率的差异是有意为之并反映在标签中的差异,并且所述差异对于(例如在长期使用时)获得有效的体内药物浓度而言不是必需的,并且被认为对于所研究的特定药物产品在医学上是无关紧要的。在一个实施方案中,如果两种抗原结合蛋白在安全性、纯度和效力上没有临床意义的差异,则它们是生物等效的。
87.在一个实施方案中,如果患者可以在参考产品和生物产品之间转换一次或多次而没有预期的副作用风险增加,包括免疫原性的临床显著变化,或与没有这种转换的继续治疗相比,无有效性降低,则两种抗原结合蛋白是生物等效的。
88.在一个实施方案中,如果两种抗原结合蛋白针对(一种或多种)使用条件通过(一种或多种)共同作用机制(就这些机制的已知程度而言)发挥作用,则它们是生物等效的。
89.可以通过体内和体外方法证明生物等效性。生物等效性测量包括,例如,(a)人体或其他哺乳动物的体内试验,其中抗体或其代谢物在血液、血浆、血清或其他生物体液中的浓度作为时间的函数进行测量;(b)与人类体内生物利用度数据相关并可合理预测所述体内生物利用度数据的体外试验;(c)在人类或其他哺乳动物中进行的体内试验,其中抗体(或其靶标)的适当急性药理作用作为时间的函数被测量;(d)可以建立抗体的安全性、有效性或生物利用度或生物等效性的良好对照临床试验。
hcdr3/lcdr1-lcdr2-lcdr3结构域。
103.h4h1276s的全长序列如下:重链序列(seq id no:195)evqlvesgggviqpggslrlscaasgftfddyamnwvrqgpgkglewvsaisgdggstyyadsvkgrftisrdnsknslylqmnslraedtaffycakdlrntifgvvipdafdiwgqgtmvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk轻链序列(seq id no:196)diqmtqspstlsasvgdrvtitcrasqsirswlawyqqkpgkapklliykasslesgvpsrfsgsgsgteftltisslqpddfatyycqqynsysytfgqgtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
104.包含在本发明药物制剂中的抗体或其抗原结合片段的量,可以根据制剂所需的具体特性以及制剂预期应用的具体情况和目的而变化。在某些实施方案中,药物制剂是液体制剂,其可含有5
±
0.75mg/ml至250
±
37.5mg/ml的抗体;10
±
1.5mg/ml至240
±
36mg/ml抗体;20
±
3.0mg/ml至230
±
34.5mg/ml抗体;25
±
3.75mg/ml至240
±
36mg/ml抗体;50
±
7.5mg/ml至230
±
34.5mg/ml抗体;60
±
9mg/ml至240
±
36mg/ml抗体;70
±
10.5mg/ml至230
±
34.5mg/ml抗体;80
±
12mg/ml至220
±
33mg/ml抗体;90
±
13.5mg/ml至210
±
31.5mg/ml抗体;100
±
15mg/ml至200
±
30mg/ml抗体;110
±
16.5mg/ml至190
±
28.5mg/ml抗体;120
±
18mg/ml至180
±
27mg/ml抗体;130
±
19.5mg/ml至170
±
25.5mg/ml抗体;140
±
21mg/ml至160
±
24mg/ml抗体;150
±
22.5mg/ml抗体;或175
±
26.25mg/ml抗体。例如,本发明的制剂可包含约5mg/ml;约10mg/ml;约15mg/ml;约20mg/ml;约25mg/ml;约30mg/ml;约35mg/ml;约40mg/ml;约45mg/ml;约50mg/ml;约55mg/ml;约60mg/ml;约65mg/ml;约70mg/ml;约75mg/ml;约80mg/ml;约85mg/ml;约90mg/ml;约95mg/ml;约100mg/ml;约105mg/ml;约110mg/ml;约115mg/ml;约120mg/ml;约125mg/ml;约130mg/ml;约135mg/ml;约140mg/ml;约145mg/ml;约150mg/ml;约155mg/ml;约160mg/ml;约165mg/ml;约170mg/ml;约175mg/ml;约180mg/ml;约185mg/ml;约190mg/ml;约195mg/ml;约200mg/ml;约205mg/ml;约210mg/ml;约215mg/ml;约220mg/ml;约225mg/ml;约230mg/ml;约235mg/ml;约240mg/ml;约245mg/ml;或约250mg/ml与人angptl3特异性结合的抗体或其抗原结合片段。在一个实施方案中,本发明的制剂包含约150mg/ml的抗人anptl3抗体或其抗原结合片段。赋形剂和ph
64.本发明的药物制剂包含一种或多种赋形剂。如本文所用,术语“赋形剂”是指添加到制剂中以提供所需稠度、粘度或稳定作用的任何非治疗剂。
106.在某些实施方案中,本发明的药物制剂包含至少一种有机共溶剂,其类型和量可以在剧烈处理或搅动(例如,涡旋)的条件下稳定抗hangptl3抗体。在一些实施方案中,“稳定”是指,防止在剧烈处理过程中形成超过抗体总量(以摩尔计)3%的聚集抗体。在一些实施方案中,剧烈处理是将含有抗体和有机共溶剂的溶液涡旋约60分钟或约120分钟。
107.在某些实施方案中,有机共溶剂是非离子表面活性剂,例如烷基聚(环氧乙烷)。可
包含在本发明制剂中的特定非离子表面活性剂包括例如聚山梨酯类化合物,例如聚山梨酯20、聚山梨酯28、聚山梨酯40、聚山梨酯60、聚山梨酯65、聚山梨酯80、聚山梨酯81和聚山梨酯85;泊洛沙姆类化合物,例如泊洛沙姆181、泊洛沙姆188、泊洛沙姆407;或聚乙二醇(peg)。聚山梨酯20也称为吐温20、脱水山梨糖醇单月桂酸酯和聚氧乙烯脱水山梨糖醇单月桂酸酯。泊洛沙姆188也称为pluronic f68。在某些实施方案中,本发明制剂中包含的有机共溶剂是聚山梨酯80。
108.包含在本发明药物制剂中的非离子表面活性剂的量可以根据制剂所需的具体性质以及制剂旨在应用的具体情况和目的而变化。在某些实施方案中,制剂可包含0.01%
±
0.005%至0.5%
±
0.25%的表面活性剂。例如,本发明的制剂可包含约0.005%;约0.01%;约0.02%;约0.03%;约0.04%;约0.05%;约0.06%;约0.07%;约0.08%;约0.09%;约0.1%;约0.11%;约0.12%;约0.13%;约0.14%;约0.15%;约0.16%;约0.17%;约0.18%;约0.19%;约0.20%;约0.21%;约0.22%;约0.23%;约0.24%;约0.25%;约0.26%;约0.27%;约0.28%;约0.29%;约0.30%;约0.35%;约0.40%;约0.45%;约0.46%;约0.47%;约0.48%;约0.49%;约0.50%;约0.55%;或约0.575%的聚山梨酯20或聚山梨酯80。在某些实施方案中,本发明制剂包含约0.1%(w/v)的聚山梨酯80。
109.本发明的药物制剂还可以包含一种或多种稳定剂,其类型和量可以在热胁迫条件下稳定抗hangptl3抗体。在一些实施方案中,“稳定”的意思是当含有抗体和热稳定剂的溶液在约45℃保持多达约28天时,一定显著百分比的抗体处于天然构象。在一些实施方案中,“稳定”的意思是,当含有抗体和热稳定剂的溶液在约45℃保持多达约28天时,不显著百分比的抗体发生聚集。如本文所用,“天然”是指通过大小排阻确定的抗体的主要形式,其通常是抗体的完整单体。术语“天然”还指抗体的非聚集和非降解形式。
110.在某些实施方案中,热稳定剂是糖例如蔗糖,其包含在制剂中的量可以根据使用制剂的具体情况和预期目的而变化。在某些实施方案中,制剂可含有约1%至约15%的糖;约2%至约14%的糖;约3%至约13%的糖;约4%至约12%的糖;约5%至约12%的糖;约6%至约11%的糖;约7%至约10%的糖;约8%至约11%的糖;或约9%至约11%的糖。例如,本发明的药物制剂可包含4%
±
0.8%;5%
±
1%;6%
±
1.2%;7%
±
1.4%;8%
±
1.6%;9%
±
1.8%;10%
±
2%;11%
±
2.2%;12%
±
2.4%;13%
±
2.6%;或约14%
±
2.8%的糖(例如蔗糖)。在某些实施方案中,本发明制剂不包含糖。
111.本发明药物制剂还可包含缓冲剂或缓冲系统,其用于维持稳定的ph并帮助稳定抗hangptl3抗体。在一些实施方案中,“稳定”的意思是当含有抗体和缓冲剂的溶液在约45℃保持多达约28天时抗体的聚集量最小化。在一些实施方案中,“稳定”的意思是当含有抗体和缓冲剂的溶液在约45℃保持多达约28天时,如通过尺寸排阻色谱法确定,天然构象的抗体的量最大化。“天然”或“天然构象”是指,未聚集或降解的抗体级分。这通常通过测量抗体实体的相对大小的测定试验来确定,例如尺寸排阻色谱测定。未聚集且未降解的抗体在等于天然抗体的级分洗脱,通常是主要的洗脱级分。聚集的抗体在显示比天然抗体大的级分洗脱。降解的抗体在显示比天然抗体小的级分洗脱。
112.在一些实施方案中,“稳定”的意思是,当含有抗体和缓冲剂的溶液在约45℃保持多达约28天后,通过阳离子交换色谱确定,至少约46%的抗体为其主要电荷形式。“主要电荷”或“主要电荷形式”是指,在主峰中从离子交换树脂洗脱的抗体级分,通常在其一侧为更“碱性”的峰且另一侧为更“酸性”的峰。
113.本发明的药物制剂可以具有约5.2至约6.4的ph。例如,本发明的制剂可具有约5.5;约5.6;约5.7;约5.8;约5.9;约6.0;约6.1;约6.2;约6.3;约6.4;或大约6.5的ph值。在一些实施方案中,ph为6.0
±
0.4;6.0
±
0.3;6.0
±
0.2;6.0
±
0.1;约6.0;或6.0。
114.在一些实施方案中,缓冲剂或缓冲系统包含至少一种缓冲剂,其缓冲范围与ph 5.5-7.4的范围完全或部分重叠。在某些实施方案中,缓冲剂包括组氨酸缓冲剂。在某些实施方案中,组氨酸以5mm
±
1mm至15mm
±
3mm;6mm
±
1.2mm至14mm
±
2.8mm;7mm
±
1.4mm至13mm
±
2.6mm;8mm
±
1.6mm至12mm
±
2.4mm;9mμ
±
1.8mm至11mm
±
2.2mm;10mm
±
2mm;或约10mm的浓度存在。在某些实施方案中,缓冲系统包含10mμ
±
2mm的组氨酸,ph为6.0
±
0.3。
115.本发明的药物制剂还可以包含一种或多种赋形剂,其用于维持含有高浓度抗angptl3抗体药物物质(例如,通常约150mg/ml抗体)的制剂的降低粘度或降低所述制剂的粘度。在某些实施方案中,所述至少一种粘度调节剂选自:精氨酸-hcl、氯化钠、组氨酸-hcl、乙酸钠(ph 5)、氯化钙、氯化镁、乙酸钙和乙酸镁。在某些实施方案中,本发明的制剂包含精氨酸hcl。
116.在某些实施方案中,药物制剂包含至少一种氨基酸。在某些实施方案中,氨基酸是脯氨酸,并且本发明的药物制剂含有脯氨酸,优选为l-脯氨酸,浓度为1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%或5%。在一些实施方案中,制剂包含足以将液体制剂的粘度维持在小于20
±
3厘泊,小于15
±
2.25厘泊,或小于11
±
1.65厘泊的量的脯氨酸。在一些实施方案中,制剂包含足以将粘度保持在等于或低于15
±
2.25厘泊的量的脯氨酸。在某些实施方案中,制剂可含有约1%至约5%的脯氨酸;约2%至约4%脯氨酸;或约3%脯氨酸。例如,本发明的药物制剂可包含1%
±
0.2%;1.5%
±
0.3%;2%
±
0.4%;2.5%
±
0.5%;3%
±
0.6%;3.5%
±
0.7%;4%
±
0.8%;4.5%
±
0.9%;或约5%
±
1%脯氨酸。
117.在抗体纯化过程中,可能需要或必须用一种缓冲剂交换另一种缓冲剂以获得合适的赋形剂浓度、抗体浓度、ph等。缓冲剂交换可以通过例如超滤/渗滤(uf/df),使用例如半透切向流过滤膜,来完成。然而,使用此类技术有可能导致gibbs-donnan效应[bolton et al.,2011,biotechnol.prog.27(1):140-152]。蛋白质浓缩过程中膜在产物侧的正电荷的积累通过正离子优先移动到膜的另一侧而被电平衡。这种现象的潜在后果是某些成分(例如组氨酸、l-脯氨酸等)的最终浓度可能低于这些成分的预期目标浓度,这是由于在uf/df步骤中带正电荷的渗滤缓冲剂赋形剂对带电荷的抗体蛋白的静电排斥作用。因此,本发明包括其中例如组氨酸和/或l-脯氨酸的浓度由于gibbs-donnan效应而不同于本文所述的量或范围的制剂。
[0118]
体积排斥描述了高度浓缩的样品的行为,其中溶液总体积的显著部分被溶质,尤其是大分子如蛋白质占据,从而将溶剂排除在这个空间之外。然后,这将减少可用于溶解其他溶质的溶剂总体积,可能导致跨超滤膜的不等分配。因此,本发明包括其中例如组氨酸和/或l-脯氨酸的浓度可能由于体积排斥效应而不同于本文所述的量或范围的制剂。
[0119]
在本发明制剂的制造过程中,制剂的组成可能发生变化。这些变化可涉及活性成分的浓度、赋形剂的浓度和/或制剂的ph值。由于任何这些参数的变化都可能影响药品的稳定性或效力,因此进行了确定可接受范围(par)研究,以评估在规定范围内的组成变化是否会影响抗体的稳定性或效力。因此,本发明包括包含抗angptl3抗体的制剂,所述抗体在赋
形剂浓度变化不超过50%时是稳定的且保持效力。例如,本文包括抗angptl3抗体制剂,其中所述制剂的稳定性和效力不受抗体、组氨酸、精氨酸-hcl,和/或聚山梨酯浓度
±
10%,
±
20%,
±
30%,
±
40%或
±
50%变化的影响。药物制剂的稳定性和粘度
[0120]
本发明的药物制剂通常表现出高水平的稳定性。术语“稳定”,如本文用于药物制剂时,是指药物制剂中的抗体在规定条件下储存后仍保持了可接受程度的化学结构或生物学功能。即使其中包含的抗体在储存规定的一段时间后未保持其100%的化学结构或生物学功能,但制剂也可是稳定的。在某些情况下,储存规定时间后抗体的结构或功能保持约90%、约95%、约96%、约97%、约98%或约99%,可被视为是“稳定”的。
[0121]
稳定性可以例如通过确定在规定温度下储存规定一段时间后保留在制剂中的天然抗体的百分比来量度。天然抗体的百分比尤其可以通过尺寸排阻色谱法(例如尺寸排阻超高效液相色谱[se-uplc])来确定,由此天然意味着未聚集和未降解的。“可接受程度的稳定性”,如在本文中所使用的,是指在给定温度下储存规定的一段时间后,可以在制剂中检测到至少90%的天然形式的抗体。在某些实施方案中,在规定的温度下储存规定的一段时间后,可以在制剂中检测到至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的天然形式的抗体。用于测定稳定性的规定时间可以是至少14天、至少28天、至少1个月、至少2个月、至少3个月、至少至少4个月,至少5个月,至少6个月,至少7个月,至少8个月,至少9个月,至少10个月,至少11个月,至少12个月,至少18个月,至少24个月或更长时间。在评估稳定性时可用于储存药物制剂的规定温度可以是,从约-80℃到约45℃的任何温度,例如储存在约-80℃、约-30℃、约-20℃、约0℃、约4
°‑
8℃、约5℃、约25℃、约35℃、约37℃或约45℃。例如,如果在5℃储存6个月后,通过se-uplc检测到超过约95%、96%、97%或98%的天然抗体,则可以认为药物制剂是稳定的。如果在25℃储存6个月后,通过se-uplc检测到超过约95%、96%、97%或98%的天然抗体,也可以认为药物制剂是稳定的。如果在45℃储存28天后,通过se-uplc检测到大于约89%、90%、91%、92%、93%、94%、95%或96%的天然抗体,也可以认为药物制剂是稳定的。如果在-20℃储存12个月后,通过se-uplc检测到超过约96%、97%或98%的天然抗体,也可以认为药物制剂是稳定的。如果在-30℃储存12个月后,通过se-uplc检测到超过约96%、97%或98%的天然抗体,也可以认为药物制剂是稳定的。如果在-80℃储存12个月后,通过se-uplc检测到超过约96%、97%或98%的天然抗体,也可以认为药物制剂是稳定的。
[0122]
特别地,稳定性可以通过在规定温度下储存规定时间后测定制剂中形成聚集体的抗体的百分比来量度,其中稳定性与形成的聚集体的百分比成反比。聚集的抗体的百分比尤其可以通过尺寸排阻色谱法(例如尺寸排阻超高效液相色谱[se-uplc])来确定。“可接受程度的稳定性”,如本文所用的,是指在规定的温度下储存规定的一段时间后在制剂中检测到至多5%的抗体为聚集形式(也称作高分子量
–
hmw
–
形式)。在某些实施方案中,可接受程度的稳定性是指,可以在规定的温度下储存规定的一段时间后在制剂中可以检测到最多约5%、4%、3%、2%、1%、0.5%或0.1%的抗体为聚集体。用于测定稳定性的规定时间可以是至少2周、至少28天、至少1个月、至少2个月、至少3个月,至少4个月,至少5个月,至少6个月,至少7个月,至少8个月,至少9个月,至少10个月,至少11个月,至少12个月,至少18个月、至少24个月或更长时间。评价稳定性时可以用于储存药物制剂的温度,可以是约-80℃至约45
℃的任何温度,例如储存在约-80℃、约-30℃、约-20℃、约0℃、约4℃-8℃、约5℃、约25℃、约35℃、约37℃或大约45℃。例如,如果在5℃储存12个月后,检测到少于约2%、1%、0.5%或0.1%的抗体为聚集形式,则可以认为药物制剂是稳定的。如果在25℃储存3个月后,检测到少于约4%、3%、2%、1%、0.5%或0.1%的抗体为聚集形式,则也可以认为药物制剂是稳定的。如果在45℃储存28天后,检测到少于约10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、或0.5%的抗体为聚集形式,则也可以认为药物制剂是稳定的。如果在-20℃、-30℃或-80℃储存三个月后,检测到少于约3%、2%、1%、0.5%或0.1%的抗体为聚集形式,则也可以认为药物制剂是稳定的。
[0123]
特别地,稳定性可以通过确定在离子交换过程中在比抗体的主要级分(“主要电荷形式”)更酸性的级分(“酸性形式”)中迁移的抗体的百分比来量度,其中稳定性与酸性形式的抗体的百分比成反比。不希望受理论束缚,抗体的脱酰胺可导致抗体带更多负电荷并因此相对于未脱酰胺的抗体具有更多酸性(参见,例如robinson,n.,protein deamidation,pnas,april 16,2002,99(8):5283-5288)。“酸化”抗体的百分比尤其可以通过离子交换色谱法(例如阳离子交换超高效液相色谱法[cex-uplc])来确定。“可接受程度的稳定性”,如在本文中所使用的,是指在规定的温度下储存规定一段时间后,在制剂中检测到至多45%的抗体为更酸性的形式。在某些实施方案中,可接受程度的稳定性是指,在规定的温度下储存规定的一段时间后,可以在制剂中检测到至多约40%、35%、30%、25%、20%、15%、10%、5%、4%、3%、2%、1%、0.5%或0.1%的抗体为酸性形式。在一个实施方案中,可接受程度的稳定性是指,在规定的温度下储存规定的一段时间后,可以在制剂中检测到少于30%、25%、20%、15%、10%、5%、4%、3%、2%、1%、0.5%或0.1%的抗体为酸性形式。用于测量稳定性的规定时间可以是至少2周、至少28天、至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月,至少7个月,至少8个月,至少9个月,至少10个月,至少11个月,至少12个月,至少18个月,至少24个月,或更多。评估稳定性时可以用于储存药物制剂的温度,可以是约-80℃至约45℃的任何温度,例如储存在约-80℃、约-30℃、约-20℃、约0℃、约4℃-8℃、约5℃、约25℃或约45℃。例如,如果在-80℃、-30℃或-20℃储存三个月后少于约30%、29%、28%、27%、26%、25%、24%、23%,22%,21%,20%,19%,18%,17%,16%,15%,14%,13%,12%,10%,9%,8%,7%,6%5%、4%、3%、2%、1%、0.5%或0.1%的抗体为更酸性的形式,则可以认为药物制剂是稳定的。如果在5℃储存六个月后,少于约32%、31%、30%、29%、28%、27%、26%、25%、24%、23%、22%,21%,20%,19%,18%,17%,16%,15%,14%,13%,12%,10%,9%,8%,7%,6%,5%4%、3%、2%、1%、0.5%或0.1%的抗体为更酸性的形式,则可以认为药物制剂是稳定的。如果在25℃储存六个月后,少于约43%、42%、41%、40%、39%、38%、37%、36%、35%、34%、33%,32%,31%,30%,29%,28%,27%,26%,25%,24%,23%,22%,21%,20%,19%,18%,17%,16%,15%,14%,13%,12%,10%,9%,8%,7%,6%,5%,4%,3%,2%,1%,0.5%或0.1%的抗体为更酸性的形式,则也可以认为药物制剂是稳定的。如果在45℃储存28天后,可以检测到少于约49%、48%、47%、46%、45%、44%、43%、42%、41%、40%、39%,38%,37%,36%,35%,34%,33%,32%,31%,30%,29%,28%,27%,26%,25%,24%,23%,22%,21%,20%,19%,18%,17%,16%,15%,14%,13%,12%,10%,9%,8%,7%,6%,5%、4%、3%、2%、1%、0.5%或0.1%的抗体为更酸性的形式,则也可以认为药物制剂是稳定的。
[0124]
其他方法可用于评估本发明制剂的稳定性,例如使用差示扫描量热法(dsc)以确定热稳定性,使用受控搅动以确定机械稳定性,以及通过在约350nm或约405nm处的吸光度来测定溶液浊度。例如,如果在约5℃至约25℃储存6个月或更长时间后,相对于零时制剂的od
405
,制剂的od
405
变化小于约0.05(例如,0.04、0.03、0.02、0.01,或更小),则可以认为本发明制剂是稳定的。
[0125]
测量抗体与其靶标的生物活性或结合亲和力也可用于评估稳定性。例如,如果在例如5℃、25℃、45℃等温度储存规定的一段时间(例如,1至12个月)后,制剂中所包含的抗angptl3抗体结合angptl3的亲和力为所述储存前抗体的结合亲和力的至少90%、95%或更多,则本发明制剂可以被认为是稳定的。结合亲和力可以通过例如elisa或表面等离子体共振来确定。生物活性可以通过angptl3活性测定法来确定,例如将表达angptl3的细胞与包含抗angptl3抗体的制剂接触。可以直接测量抗体与此类细胞的结合,例如通过facs分析。或者,可以在抗体存在下测量angptl3系统的下游活性,并与抗体不存在时angptl3系统的活性进行比较。在一些实施方案中,angptl3可以是细胞内源的。在其他实施方式中,angptl3可以是在细胞中异位表达的。
[0126]
用于评估制剂中抗体稳定性的另外的方法在以下呈现的实施例中展示。
[0127]
在某些实施方案中,本发明的液体药物制剂可以表现出低至中等水平的粘度。如本文所用,“粘度”可以是“运动粘度”或“绝对粘度”。“运动粘度”是流体在重力影响下的流动阻力的量度。当体积相等的两种流体置于相同的毛细管粘度计中并允许在重力作用下流动时,粘性流体比粘性较小的流体流过毛细管所需的时间更长。例如,如果一种流体需要200秒完成流动,而另一种流体需要400秒,则在运动粘度上第二种流体的粘度是第一种流体的两倍。“绝对粘度”,有时称为动力或简单粘度,是运动粘度和流体密度的乘积(绝对粘度=运动粘度x密度)。运动粘度的维度是l2/t,其中l是长度,t是时间,一般,运动粘度以厘沲(cst)表示。运动粘度的si单位是mm2/s,即1cst,绝对粘度以厘泊(cp)单位表示。绝对粘度的si单位是毫帕斯卡-秒(mpa-s),其中1cp=1mpa-s。
[0128]
如本文所用,关于本发明的流体制剂,低粘度水平将表现出小于约20厘泊(cp)的绝对粘度。例如,本发明的流体制剂将被认为具有“低粘度”,如果当使用标准粘度测量技术测量时,制剂表现出约20cp、约19cp、约18cp、约15cp、约12cp、约10cp、约9cp、约8cp或更小的绝对粘度。如本文所用,中等水平的粘度,就本发明的流体制剂而言,将表现出介于约35cp和约20cp的绝对粘度。例如,本发明的流体制剂将被认为具有“中等粘度”,如果当使用标准粘度测量技术测量时,制剂表现出约34cp、约33cp、约32cp、约31cp、约30cp、约29cp、约28cp、约27cp、约26cp、约25cp、约24cp、约23cp、约22cp、约21cp、约20cp、约19cp、18cp、约17cp、约16cp或约15.1cp的绝对粘度。
[0129]
如以下实施例中所示,本发明人令人惊奇地发现,包含高浓度抗人angptl3抗体(例如,从约50mg/ml到至少250mg/ml)的低粘度液体制剂,可以通过用约1%至约5%的脯氨酸来配制抗体并且不需要稳定剂如蔗糖来获得。此类制剂对于处理过程中的胁迫以及在45℃至-80℃的温度范围内的储存而言是稳定的(如本文所证实),并且显示出低于约15cp的粘度。示例性制剂
[0130]
根据本发明的一个方面,药物制剂是稳定的、低粘度的、通常生理学等渗的液体制
剂,其包含:(i)特异性结合人angptl3的人抗体或其抗原结合片段(例如,h4h1276s),浓度为约25至约250mg/ml;(ii)在大约ph 6.0
±
0.3提供足够缓冲的缓冲系统;(iii)保护抗体结构完整性的有机共溶剂;(iv)粘度调节剂,所述粘度调节剂是降低粘度的赋形剂。根据本发明的另一方面,药物制剂是稳定的、低粘度的、通常生理学等渗的液体制剂,其包含:(i)与人angptl3特异性结合的人抗体或其抗原结合片段(例如h4h1276s),浓度为约25至约250mg/ml;(ii)可在约ph 6.0
±
0.3提供足够缓冲的缓冲系统;(iii)保护抗体结构完整性的有机共溶剂;(iv)粘度调节剂,所述粘度调节剂是降低粘度的赋形剂;(iv)在皮下施用的方便体积内保持粘度易于注射的氨基酸。
[0131]
根据一个实施方案,稳定的低粘度药物制剂包含:(i)特异性结合人angptl3的人igg4抗体,其包含seq id no:68的hcdr1、seq id no:70的hcdr2、seq id no:72的hcdr3、seq id no:76的lcdr1、seq id no:78的lcdr2和seq id no:80的lcdr3,浓度为25mg/ml
±
7.5mg/ml;(ii)10mm
±
2mm的组氨酸,其在ph 6.0
±
0.3起缓冲作用;(iii)0.1%w/v
±
0.05%w/v的聚山梨酯80;(iv)70
±
5mm的精氨酸-hcl;(v)约3%(w/v)
±
0.6%的l-脯氨酸。在另一个实施方案中,抗体包含:包含seq id no:66/74的氨基酸序列对的hcvr/lcvr。
[0132]
根据另一个实施方案,稳定的低粘度药物制剂包含:(i)特异性结合人angptl3的人igg4抗体,其包含seq id no:68的hcdr1、seq id no:70的hcdr2、seq id no:72的hcdr3、seq id no:76的lcdr1、seq id no:78的lcdr2和seq id no:80的lcdr3,浓度为50mg/ml
±
7.5mg/ml;(ii)10mm
±
2mm的组氨酸;(iii)0.1%
±
0.05%(w/v)的聚山梨酯80;(iv)3%
±
0.6%的脯氨酸;和(v)70
±
5mm的精氨酸-hcl,ph 6.0
±
0.3。在另一个实施方案中,抗体包含:包含seq id no:66/74的氨基酸序列对的hcvr/lcvr。
[0133]
根据另一个实施方案,稳定的低粘度药物制剂包含:(i)特异性结合人angptl3的人igg4抗体,其包含seq id no:68的hcdr1、seq id no:70的hcdr2、seq id no:72的hcdr3、seq id no:76的lcdr1、seq id no:78的lcdr2和seq id no:80的lcdr3,浓度为100mg/ml
±
15mg/ml;(ii)10mm
±
2mm的组氨酸;(iii)0.1%
±
0.05%(w/v)的聚山梨酯80;(iv)3%
±
0.6%的脯氨酸;和(v)70
±
5mm的精氨酸-hcl,ph 6.0
±
0.3。在另一实施方案中,抗体包含:包含seq id no:66/74的氨基酸序列对的hcvr/lcvr。
[0134]
根据另一个实施方案,稳定的低粘度药物制剂包含:(i)特异性结合人angptl3的人igg4抗体,其包含seq id no:68的hcdr1、seq id no:70的hcdr2、seq id no:72的hcdr3、seq id no:76的lcdr1、seq id no:78的lcdr2和seq id no:80的lcdr3,浓度为150mg/ml
±
22.5mg/ml;(ii)10mm
±
2mm的组氨酸;(iii)0.1%
±
0.05%(w/v)的聚山梨酯80;(iv)70
±
5mm的精氨酸-hcl;和(v)3%
±
0.6%的脯氨酸,ph 6.0
±
0.3。在另一个实施方案中,抗体包含:包含seq id no:66/74的氨基酸序列对的hcvr/lcvr。在本文公开的制剂的一些实施方案中,粘度小于约20厘泊;在再一些实施方案中,制剂的粘度小于约15厘泊。
[0135]
根据另一个实施方案,稳定的低粘度药物制剂包含:(i)特异性结合人angptl3的人igg4抗体,其包含seq id no:68的hcdr1、seq id no:70的hcdr2、seq id no:72的hcdr3、seq id no:76的lcdr1、seq id no:78的lcdr2和seq id no:80的lcdr3,浓度为175mg/ml
±
26.25mg/ml;(ii)10mm
±
2mm的组氨酸;(iii)0.1%
±
0.05%(w/v)的聚山梨酯80;(iv)70
±
5mm的精氨酸-hcl;和(v)3%
±
0.6%的脯氨酸,ph 6.0
±
0.3。在另一个实施方案中,抗体包含:包含seq id no:66/74的氨基酸序列对的hcvr/lcvr。
junior
tm
(novo nordisk,copenhagen,denmark),bd
tm
笔(becton dickinson,franklin lakes,nj),optipen
tm
,optipen pro
tm
,optipen starlet
tm
,以及opticlik
tm
(sanofi-aventis,frankfurt,germany)。可以在本发明药物组合物的皮下递送中应用的一次性笔或自动注射器递送装置的实例包括但不限于,solostar
tm
笔(sanofi-aventis),flexpen
tm
(novo nordisk),和kwikpen
tm
(eli lilly),sureclick
tm
自动注射器(amgen,thousand oaks,ca),penlet
tm
(haselmeier,stuttgart,germany),epipen(dey,l.p.),和humira
tm
笔(abbott labs,abbott park,il)。
[0143]
本文还考虑使用微型输注器来递送本发明的药物制剂。如本文所用,术语“微型输注器”是指设计成在较长时间段内(例如,约10、15、20、25、30或更多分钟)缓慢施用较大体积(例如,多达大约2.5ml或更多)的治疗性制剂的皮下递送装置。参见,例如,u.s.6,629,949;us 6,659,982;和meehan et al.,j.controlled release 46:107-116(1996)。微型输注器特别适用于递送包含在高浓度(例如,约100、125、150、175、200或更多mg/ml)或粘性溶液中的大剂量治疗性蛋白质。
[0144]
在一些实施方案中,任一前述方面的稳定液体药物制剂包含在无菌玻璃小瓶中并且作为iv输注给药。
[0145]
在一个实施方案中,容器是20ml的1型透明硼硅酸盐玻璃小瓶。在某些实施方案中,容器是带有涂层的4432/50丁基橡胶塞的2ml或3ml的1型硼硅酸盐玻璃小瓶。
[0146]
在一个实施方案中,包含约25mg/ml或50mg/ml的mab1的本发明液体药物制剂用于静脉内施用,所述药物制剂可以包含在玻璃小瓶中。
[0147]
在一些实施方案中,本发明提供一种自动注射器,其包含本文所述的任何液体制剂。在一些实施方案中,本发明提供了包含稳定液体制剂的自动注射器,所述稳定液体制剂包含约50mg/ml、约100mg/ml、约150mg/ml或约175mg/ml的mab1、约10mm的组氨酸,ph约6.0、约70mm精氨酸-hcl、约3%脯氨酸和约0.1%聚山梨酯80。
[0148]
在一些实施方案中,本发明提供一种包含本文所述的任何液体制剂的预充式注射器。在一些实施方案中,本发明提供包含稳定液体制剂的预充式注射器,所述稳定液体制剂包含约50mg/ml、约100mg/ml、约150mg/ml或约175mg/ml的mab1、约10mm的组氨酸,ph约6.0、约70mm精氨酸-hcl、约3%脯氨酸和约0.1%聚山梨酯80。在某些实施方案中,注射器是1ml或2.25ml长的玻璃注射器,装有27号薄壁针头、碳氟化合物涂层的橡胶柱塞和橡胶针头护罩。
[0149]
在一个实施方案中,在预充式注射器中在不超过约2ml的体积中含有约175mg/ml
±
26.25mg/ml mab1的液体药物制剂,进行皮下施用。在某些实施方案中,注射器是1ml或2.25ml长的玻璃注射器,装有27号薄壁针头、碳氟化合物涂覆的橡胶柱塞和橡胶针头护罩。在一个实施方案中,注射器是配备有27号针头、fm27橡胶针头护罩和涂层的4023/50橡胶柱塞的ompi 1ml长玻璃注射器。
[0150]
在一个实施方案中,在预充式注射器中在约1至约2ml的体积中含有约150mg/ml
±
22.5mg/ml mab1的液体药物制剂,进行皮下施用。在一个实施方案中,注射器是1ml或2.25ml长的玻璃注射器,带有27号薄壁针头、氟碳化合物涂层的橡胶柱塞和橡胶针头护罩。
在一个实施方案中,注射器是配备有27号针头、fm27橡胶针头护罩和涂层的4023/50橡胶柱塞的ompi 1ml长玻璃注射器。药物制剂的治疗应用
[0151]
本发明的药物制剂尤其可用于治疗、预防或改善与angptl3活性相关的任何疾病或病症,包括由angptl3介导的疾病或病症。可使用本发明制剂治疗的疾病或病症是,与未经抗hangptl3抗体治疗相比,可以通过去除、抑制、减少或以其他方式干扰angptl3活性而得到改善、缓解、抑制或预防、或降低发生率的任何疾病或病症(例如,angptl3介导的疾病或病症)。
[0152]
可使用本发明制剂治疗的疾病或病症的实例包括但不限于,那些涉及脂质代谢的疾病或病症,例如高脂血症、高脂蛋白血症和血脂异常,包括致动脉粥样硬化性血脂异常、糖尿病性血脂异常、高甘油三酯血症,包括具有tg》1000mg/dl的严重高甘油三酯血症、高胆固醇血症、乳糜微粒血症、混合性血脂异常(肥胖、代谢综合征、糖尿病等)、脂质营养不良、脂肪萎缩等,所述疾病或病症可以由例如如下引起:降低的lpl活性和/或lpl缺乏,降低的ldl受体(ldlr)活性和/或ldl受体缺乏(例如,具有ldlr-/-的纯合子家族性高胆固醇血症)、apoc2改变、apoe缺乏、apob增加、极低密度脂蛋白(vldl)产生增加和/或消除减少、某些药物治疗(例如,糖皮质激素治疗引起的血脂异常)、任何遗传倾向、饮食、生活方式等。本发明制剂还可预防或治疗与高脂血症、高脂蛋白血症和/或血脂异常相关或由其引起的疾病或病症,包括但不限于心血管疾病或病症,例如动脉粥样硬化、动脉瘤、高血压、心绞痛、中风、脑血管疾病、充血性心力衰竭、冠状动脉疾病、心肌梗塞、外周血管疾病等;急性胰腺炎;非酒精性脂肪性肝炎(nash);血糖紊乱,如糖尿病;肥胖症等。
[0153]
可使用本发明制剂治疗的疾病或病症的其他实例包括,癌症/肿瘤以及非瘤性血管生成相关疾病或病症,包括眼部血管生成性疾病或病症,例如年龄相关性黄斑变性、视网膜中央静脉阻塞或视网膜分支静脉阻塞、糖尿病性视网膜病、早产儿视网膜病等,炎性疾病或病症,例如关节炎、类风湿性关节炎(ra)、银屑病等。
实施例
[0154]
提供以下实施例是为了向本领域普通技术人员提供关于如何实施和使用本发明的方法和组合物的完整公开和描述,并不旨在限制本发明的范围。尽管已努力确保所用数字(例如数量、温度等)的准确性,但应考虑到一些实验误差和偏差。除非另有说明,份数为摩尔份数,分子量为平均分子量,温度为摄氏度,压力为大气压或接近大气压。实施例1:开发抗angptl3抗体制剂
[0155]
对于后期临床开发,计划较高剂量的iv和sc施用。因此,进行了制剂开发研究,目的是开发可用于iv或sc注射的150mg/ml液体制剂。为通过一次或两次sc注射递送高达450mg的h4h1276s剂量,高浓度液体制剂是必需的。对于iv给药,高浓度液体制剂也是有利的,因为它允许向iv输液袋添加更小体积的dp。这支持每kg患者体重多达15mg h4h1276s的剂量应用。
[0156]
冻干h4h1276s制剂的初始制剂开发活动是在低蛋白质浓度(5-50mg/ml h4h1276s)下进行的,包括评估缓冲剂、ph、有机共溶剂、表面活性剂和蔗糖以鉴定增强蛋白质稳定性的赋形剂。基于从初始制剂开发中获得的知识,针对150mg/ml液体制剂的制剂开
发活动涉及评估粘度降低赋形剂、ph、表面活性剂和热稳定剂,以鉴定在150至200mg/ml h4h1276s的较高蛋白浓度下可以增强蛋白质稳定性并同时保持溶液具有可接受粘度的赋形剂。
[0157]
在整个制剂开发过程中,采用三种主要的蛋白质胁迫条件(代表超出抗体药物产品在处理、制造、运输、储存和标签过程中将会遭遇的条件的极端处理条件)来开发和优化抗体制剂并评估潜在的真实世界胁迫对药品稳定性的影响。这些胁迫条件包括:
·
在室温下搅动(涡旋)蛋白质溶液。玻璃小瓶中的涡旋超出蛋白质处理和制造过程中会出现的搅动。
·
相对于建议的dp储存条件(2℃-8℃),在升高的温度(37℃、40℃或45℃)下温育蛋白质溶液。
·
使蛋白质经受多个冻融循环。由于蛋白质在dp的制造过程中将经历至少一个冻融循环,多个冻融循环可以模拟并超出蛋白质预期将经历的该实际胁迫。抗angptl3抗体:抗angptl3抗体描述于us 9,018,356 b2中,其整体地并入本文。以下实施例中使用的示例性抗体是全人抗angptl3抗体h4h1276s(如'356中所公开),其包含:含有seq id no:66/74的重链可变区/轻链可变区hcvr/lcvr氨基酸序列对;包含seq id no:68/70/72/76/78/80的重链和轻链互补决定区cdr序列;并且在本文中也称为“mab1”。实施例2:示例性制剂
[0158]
在某些实施方案中,mab1被配制成含有5mg/ml
±
0.75mg/ml至250mg/ml
±
45.0mg/ml的mab1、10mm
±
2mm组氨酸、0.1%
±
0.05%w/v聚山梨酯、50至75mm精氨酸-hcl、和1%
±
0.02%至5%
±
1%w/v脯氨酸,ph 6.0
±
0.3的缓冲水溶液制剂。示例性制剂包括:150mg/ml h4h1276s、10mm组氨酸,ph 6.0、70mm精氨酸-hcl、0.1%(w/v)聚山梨酯80和3%(w/v)脯氨酸。实施例3:用于评估制剂稳定性的方法
[0159]
制剂的物理稳定性是指诸如颜色、外观、ph、浊度和蛋白质浓度等特性。化学稳定性是指蛋白质的高分子量(hmw)形式、低分子量(lmw)形式、电荷变体和其他化学修饰的形成。使用以下测定法评估抗体药物产品(例如,h4h1276s)的物理和化学稳定性:
·
目视检查颜色和外观(可以检测溶液中可见颗粒的存在)
·
ph
·
通过405nm处的光密度(od)增加来测量浊度
·
通过micro-flow imaging
tm
(mfi)进行亚可见微粒分析
·
通过反相超高效液相色谱(rp-uplc)测定蛋白质浓度,报告为相对于起始材料的蛋白质回收百分比
·
通过以下测定法测量纯度:-体积排阻超高效液相色谱(se-uplc)-还原和非还原微芯片毛细管电泳-十二烷基硫酸钠(mce-sds)
·
电荷变体分析:-阳离子交换uplc(cex-uplc)-成像毛细管等电聚焦(icief)
·
通过生物测定法确定功效:-每个样品的相对效力由生物测定法确定,定义为:(ic50参考样品/ic50样品)*100%。储存稳定性样品的测量功效必须在参考标准品的测量功效的50%至150%以内。
[0160]
对于制剂的化学稳定性,评估蛋白质的共价修饰形式(例如共价聚集体、切割产物或电荷变体形式)和非共价修饰形式(例如非共价聚集体)的形成。较高和较低分子量的降解产物可以通过se-uplc和mce-sds方法与天然抗体分离。实施例4:选择粘度降低试剂
[0161]
为了理解粘度如何受h4h1276s浓度增加的影响,在10mm组氨酸,ph 6.0、5%蔗糖和0.1%聚山梨酯80中制备了具有不同蛋白质浓度的制剂。该制剂等同于用于初始临床研究中iv给药的人类首次(fih)制剂。在20℃测量每个样品的粘度,结果如图1(上方曲线)所示。在150mg/ml时测得的粘度大于40厘泊(cp),这显著高于20cp的目标可接受粘度。因此,考虑需要使用降低粘度的赋形剂来实现具有150mg/ml的靶蛋白质浓度和可接受粘度的制剂。
[0162]
为了鉴定合适的降低粘度的赋形剂,检查了所选赋形剂对h4h1276s制剂粘度的影响。包括的赋形剂是精氨酸-hcl、氯化钠、组氨酸-hcl、乙酸钠、氯化钙、氯化镁、乙酸钙和乙酸镁。添加70mm精氨酸-hcl在测试的所有蛋白质浓度下降低了粘度(图1,下方曲线)。与其他赋形剂相比,发现精氨酸-hcl在降低粘度方面最有效。此外,它对稳定性的影响最小。下表1中总结了为降低粘度而测试的赋形剂。选择精氨酸-hcl进行其他开发研究,因为它提供了足够的粘度降低。随后的制剂开发研究包括70-75mm精氨酸-hcl,以确定最佳ph值、表面活性剂浓度和热稳定剂。表1:为粘度降低测试的赋形剂总结赋形剂浓度范围对粘度的影响对稳定性的影响精氨酸-hcl50-75mm显著降低微小氯化钠50-75mm显著降低微小组氨酸-hcl40-65mm降低未测乙酸钠,ph 540-60mm显著降低降低的稳定性氯化钙25mm显著降低微小氯化镁25mm显著降低微小乙酸钙25mm显著降低微小乙酸镁25mm显著降低微小实施例5:ph选择
[0163]
通过将150mg/ml h4h1276s在45℃、在不同ph范围、在10mm组氨酸与5%(w/v)蔗糖或2%(w/v)脯氨酸中温育28天,在液体制剂中检查了ph值对h4h1276s热稳定性的影响。蔗糖和脯氨酸被认为是潜在的热稳定剂并被包括在内,由此可以用更能代表最终制剂的制剂组合物研究缓冲剂和ph值的影响。根据se-uplc和cex-uplc分析的结果(表2,如图2所示),较高的ph值可最小化hmw物质的形成,而较低的ph值可最小化电荷变体的形成。选择ph 6.0的组氨酸缓冲剂作为制剂缓冲剂,因为它提供了hmw物质形成和电荷变体形成之间的最佳平衡。实施例6:表面活性剂浓度优化
[0164]
表面活性剂经常被添加到抗体制剂中以保护蛋白质免于搅动诱导的聚集。在开发
初始可冻干制剂时,当搅动50mg/ml h4h1276s时观察到hmw物质形成。添加0.1%(w/v)聚山梨酯80保护h4h1276s免受搅动引起的不稳定性。然而,蛋白质浓度、热稳定剂含量和其他赋形剂的存在会影响蛋白质对搅动胁迫的敏感性。因此,评估了保护150mg/ml h4h1276s免受搅动胁迫所需的聚山梨酯80的最小量。在存在5%蔗糖、2%蔗糖和1.3%脯氨酸或2%脯氨酸(%w/v)的情况下检测了浓度为0.0%、0.02%、0.05%和0.1%(%w/v)的聚山梨酯80。样品被配制在ph 6的10mm组氨酸和70mm精氨酸中,以更代表最终制剂。结果总结在表3、4和5中(分别如图3、4和5所示)。
[0165]
当搅动120分钟(表3,如图3所示)时,观察到不含表面活性剂的制剂中hmw物质显著增加(4.8-6.3%)。添加0.02%(w/v)聚山梨酯80不足以保护h4h1276s免受搅动引起的不稳定性,而0.05%(w/v)聚山梨酯80及以上提供了充分的稳定性,无论制剂中包含何种热稳定剂。数据表明,需要至少0.05%(w/v)的聚山梨酯80来保护h4h1276s免受搅动引起的不稳定性,并且使用至少0.05%(w/v)的聚山梨酯80,搅动引起的不稳定性不受热稳定剂选择的影响。在45℃温育时,添加聚山梨酯80不会影响h4h1276s的hmw物质的形成,无论制剂中包含何种热稳定剂(表4,如图4所示)。对于不含热稳定剂的制剂,hmw物质自t=0的相对变化与具有聚山梨酯的制剂是相当的。对于具有仅蔗糖、蔗糖和脯氨酸、或仅脯氨酸的制剂,hmw物质的增加分别为3.1-3.2%、3.5-3.8%和3.8-4.1%。
[0166]
当在热稳定剂组之间进行比较时,h4h1276s在与蔗糖一起配制(与脯氨酸相比)并在胁迫条件下温育时表现出适度改善的稳定性。然而,这种差异未被认为是有意义的。对于所有评估的制剂,电荷变体分布自t=0的总相对变化的差异被认为在测定试验的变异性范围内。使用mfi评估搅动和45℃温育对颗粒形成的影响,结果如表5所示(如图5所示)。颗粒形成没有可辨别的趋势,表明颗粒形成不受包括在制剂中的聚山梨酯80或热稳定剂的浓度的影响。尽管在0.05%(w/v)聚山梨酯浓度下实现了稳定,但选择了0.1%(w/v)聚山梨酯80作为表面活性剂浓度。该较高浓度的聚山梨酯可确保制剂的稳健性,具有与0.05%(w/v)聚山梨酯制剂相当的稳定性,可以在稀释到iv袋时提供额外的稳定性。实施例7:热稳定剂的影响
[0167]
可以添加稳定剂到抗体制剂中以增加蛋白质在液体制剂中和冷冻储存期间的稳定性。在之前的制剂中,蔗糖被包括在内作为热稳定剂。然而,蔗糖也会增加溶液的粘度。因此,脯氨酸作为热稳定剂被评价,希望它能影响蛋白质的溶解度和胶体稳定性,以提高单克隆抗体产品制剂的储存稳定性,而不增加最终制剂的粘度(下表6)。表6:具有不同浓度的蔗糖和脯氨酸的h4h1276s制剂在20℃的粘度
[0168]
为了支持选择用于批量配制的药物物质组合物(bulk formulated drug substance composition)的组分并评估在该制剂中存在热稳定剂的需要,175mg/ml h4h1276s在10mm组氨酸ph 6.0和70mm精氨酸-hcl(无蔗糖或脯氨酸)中的稳定性,通过评估在-20℃的冷冻储存稳定性和冻/融稳定性(在-30℃冷冻并在室温融化)来评估(表7和8(分别显示在图6和7))。尽管-30℃是配制的药物物质的预期长期储存条件,但评估了在-20℃的冷冻储存稳定性,作为用于制剂开发的加速冷冻储存条件。在-20℃温育9个月后,观察到hmw物质增加了7.2%(表7,如图6所示)。虽然在8个冻融循环后观察到此制剂的hmw物质的小增加(表8,如图7所示),但-20℃冷冻储存稳定性数据表明需要热稳定剂来支持长期的批量药物物质的冷冻保存。
[0169]
为了鉴定和优化液体制剂中(一种或多种)热稳定剂的浓度,在10mm组氨酸ph 6、70mm精氨酸-hcl和0.1%(w/v)聚山梨酯80中配制150mg/ml h4h1276s并在45℃与不同浓度的蔗糖和脯氨酸温育以评估蛋白质稳定性。制剂也在-20℃温育,并进行冻融循环(-30℃冷冻;室温融化)以比较冷冻储存稳定性(这是支持批量配制的药物物质储存所需的)。聚山梨酯80被包括在这些制剂中,以更能代表最终产品制剂。在t=0时测量所有样品在20℃的粘度,并总结在上表6中。表6说明用脯氨酸替代蔗糖以浓度依赖的方式降低粘度,表明如果对稳定性没有负面影响,含有脯氨酸的制剂对于最终产品可能是有利的。
[0170]
与脯氨酸相比,当用蔗糖进行配制并在45℃温育21天时,h4h1276s表现出了适度改善的稳定性(表9,如图8所示)。对于5%蔗糖制剂,hmw物质形成自t=0的总相对变化为2.7%,而对于2%脯氨酸制剂,hmw物质自t=0的总相对变化为3.3%。这种差异不被认为是有意义的。在所评估的不这些同制剂之间电荷变体自t=0的此总相对变化差异被认为在测定试验的变异性范围之内。
[0171]
当在-20℃温育或进行8个冻融循环(-30℃冷冻;室温融化)后,对于含有蔗糖和/或脯氨酸的所有制剂,任何质量属性均未观察到有意义的变化(表7和8,如图6和7所示)。概括起来,当在加速或胁迫储存条件下储存时,含脯氨酸制剂相对于含蔗糖制剂表现出了较低的粘度和相当的稳定性。根据这些结果,选择了两种先导制剂:1)150mg/ml h4h1276s、10mm组氨酸ph 6.0、70mm精氨酸-hcl、0.1%(w/v)聚山梨酯80和5%(w/v)蔗糖;2)150mg/ml h4h1276s、10mm组氨酸ph 6.0、70mm精氨酸-hcl、0.1%(w/v)聚山梨酯80和3%(w/v)脯氨酸。脯氨酸浓度略有增加,以确保在代表性的长期储存条件下有足够的蛋白质稳定性。实施例8:制剂选择
[0172]
检查了长期稳定性以比较两种先导制剂(参见上面的实施例7)的稳定性情况。收集了-30℃的稳定性数据以评估批量配制的药物物质的长期储存(表10,如图9所示)。收集了5℃的稳定性数据以评估药品(drug product)的长期储存(表11,如图10所示)。这些数据表明,两种先导制剂获得等同的稳定性谱。
[0173]
粘度、蛋白质浓度和温度之间的关系用于促进选择可在一系列蛋白质浓度和温度下递送的制剂。考虑了蛋白质浓度对最终制剂粘度的影响、以及赋形剂如何影响这种关系。同样,就a)撤药和/或给药(大约室温);b)批量制造工艺步骤(通常约15-25℃);和c)储存,考虑了温度。
[0174]
为了指导最终制剂的选择并更好地表征热稳定剂对粘度的影响,在两种先导制剂(10mm组氨酸,ph 6.0,70mm精氨酸-hcl,0.1%(w/v)聚山梨酯80和5%(w/v)蔗糖;和10mm组氨酸,ph 6、70mm精氨酸-hcl、0.1%(w/v)聚山梨酯80和3%(w/v)脯氨酸)中,配制了具有不同浓度h4h1276s的制剂。在5℃至35℃的温度测量了粘度。图11说明了两种制剂在20℃下的粘度与h4h1276s浓度的关系。与含蔗糖制剂(图11的顶部曲线)相比,含脯氨酸制剂(图11的底部曲线)在多个h4h1276s浓度下始终具有较低的粘度。
[0175]
这种趋势在较低温度下甚至更加明显(图12a和12b)。数据表明,含有3%(w/v)脯氨酸的制剂(图12b)提供了被认为可接受的粘度值的更宽操作空间。由于两种先导制剂的稳定性相当,并且含脯氨酸制剂具有有利的粘度特征,因此选择含有3%(w/v)脯氨酸的制剂用于最终药物产品配制。
[0176]
最终的h4h1276s液体药物产品制剂包含150mg/ml h4h1276s、10mm组氨酸、70mm精氨酸-hcl、3%(w/v)脯氨酸和0.1%(w/v)聚山梨酯80,ph 6.0。在开发过程中确定的主要降解途径是高分子量物质和电荷变体。制剂的最终渗透压约为480mosm/kg,粘度约为15厘泊(20℃),适合临床使用。
[0177]
下表12总结了为临床前(glp毒理学)和临床应用开发的h4h1276s制剂。表12:用于glp毒理学研究的h4h1276s制剂和h4h1276s临床dp制剂的组成实施例9:h4h1276s药物产品的稳定性研究总结
[0178]
进行研究以评价h4h1276s 150mg/ml药物产品(dp)的储存和加速稳定性(数据未显示)。就如下各项评估了稳定性:颜色和外观、浊度(405nm处od增加)、ph、通过mfi检测颗
粒物、通过rp-uplc(反相超高效液相色谱)检测总蛋白质回收百分比、通过非还原和还原mce-sds(微芯片毛细管电泳-十二烷基硫酸钠)测定百分比纯度,通过se-uplc(尺寸排阻超高效液相色谱)测定百分比纯度,通过cex-uplc(阳离子交换超高效液相色谱)进行电荷变体分析,通过icief(成像毛细管等电聚焦)进行电荷变体分析,和通过生物测定法测定相对效力百分比。
[0179]
用于储存和加速稳定性研究的dp,通过将5.0ml配制的药物物质(fds)温育在20ml的1型透明玻璃小瓶中来制造。h4h1276s dp在5℃储存至少12个月后在物理和化学上是稳定的。在任何监测的属性上都没有检测到物理或化学稳定性的明显变化。
[0180]
随后在25℃/60%相对湿度(加速稳定性)或45℃(胁迫稳定性)下温育。选择这些加速和胁迫条件来阐明h4h1276s的降解途径。至于加速稳定性研究,在25℃/60%rh下3个月后,检测到明显形成hmw物质和电荷变体。在25℃/60%rh下温育1个月后,没有观察到明显的hmw物质形成或电荷变体形成,表明h4h1276s dp可以短时间暴露于室温。在加速条件下温育后,h4h1276s保持效力,如通过生物测定法分析确定的。
[0181]
在45℃温育,在短至7天内,导致了hmw物质和电荷变体的显著形成,说明hmw物质的增加和电荷变体的形成是h4h1276s dp的主要降解途径。发现h4h1276s dp在搅动(在环境温度下涡旋)120分钟或进行8个冻融循环(-30℃冷冻并在室温融化)时在物理和化学上是稳定的。在任何监测的属性上都没有检测到物理或化学稳定性的明显变化。
[0182]
来自dp储存加速和胁迫稳定性研究的结果表明,h4h1276s 150mg/ml dp在制造和储存过程中将是稳定的。此外,h4h1276s制剂可以承受短时间暴露于室温,而不会危害物理或化学稳定性。h4h1276s 150mg/ml dp优选在2℃至8℃储存,并限制暴露在高于2℃至8℃的温度下。实施例10:h4h1276s的基于氨基酸的高浓度液体药物产品的开发,从赋形剂筛选到流变特性表征
[0183]
h4h1276s被冻干,然后用含有期望赋形剂的溶液重构为较高的蛋白质浓度。预冻干制剂含有4ml 87.5mg/ml h4h1276s、10mm组氨酸ph 6和2.5%(w/v)蔗糖。冻干饼含有350mg固体h4h1276s。用2-2.4ml溶液重构冻干饼以产生160-175mg/ml(标称)的最终h4h1276s浓度。调整重构溶液,使得最终样品含有20mm组氨酸,ph 6,以及5%(w/v)蔗糖和测试赋形剂。为了将ph值从6调节到5,将乙酸盐缓冲剂加入到重构溶液中,使得最终的乙酸盐浓度为40mm。
[0184]
为了研究含有降低粘度的赋形剂的h4h1276s制剂的加速和冷冻储存稳定性,使用rheosense粘度计在20℃测量测试制剂的粘度。测试制剂在2ml玻璃小瓶中在以下条件下温育:(i)45℃温育0、7、14和21天;(ii)-20℃温育0、1、2、3、6和9个月;(iii)5℃、-30℃和-80℃温育0和3个月。通过sec分析所得物质的聚集体含量并通过cex分析电荷变体的形成。
[0185]
为了理解具有降低粘度的h4h1276s制剂在蛋白质浓度、温度和粘度之间的关系,制备了含有以下赋形剂组合的200mg/ml h4h1276s制剂。所有制剂均含有10mm组氨酸ph6和0.1%(w/v)聚山梨酯80:
·
5%(w/v)蔗糖
·
5%(w/v)蔗糖,70mm l-arg-hcl
·
3%(w/v)蔗糖,1.3%(w/v)脯氨酸,70mm l-arg-hcl
·
3%(w/v)脯氨酸
·
3%(w/v)脯氨酸,70mm l-arg-hcl。用相应的制剂缓冲剂将200mg/ml制剂稀释至50-200mg/ml的蛋白质浓度。在rheosense粘度计上在5-35℃的温度对每种制剂进行了粘度测量。最后,在graphpad prism和minitab中进行数据分析。
[0186]
降低粘度的赋形剂的筛选结果显示在图13a和13b中。对于图13a,在重构时,基础制剂含有175mg/ml h4h1276s、20mm组氨酸ph 6、0.1%(w/v)聚山梨酯80、5%(w/v)蔗糖。为了达到ph 5的溶液,添加乙酸盐,终浓度为40mm。含有40mm乙酸盐ph 6.0的等效制剂具有64.1厘泊的粘度,表明添加乙酸盐和将ph值调节至5.0两者均可以降低h4h1276s制剂的粘度。对于图13b,在重构时,基础制剂含有165mg/ml h4h1276s、20mm组氨酸/40mm乙酸盐,ph 5.0、0.1%(w/v)聚山梨酯80和5%(w/v)蔗糖。
[0187]
一价和二价盐(l-arg-hcl,nacl,cacl2,mgcl2,ca(oac)2,mg(oac)2)的添加降低了h4h1276s制剂的粘度。通过将ph值从6调节到5,h4h1276s制剂的粘度也降低。最后,蔗糖增加了h4h1276s制剂的粘度,而l-脯氨酸不影响该粘度。
[0188]
在45℃温育21天后高分子量(hmw)物质的形成如图14所示。包含各种vr(降低粘度)赋形剂的所选h4h1276s制剂在45℃温育并通过sec分析聚集体含量。将样品自t=0的hmw物质的相对增加绘制为制剂的函数。在加速条件(45℃持续21天)下,观察到以下情况:
·
l-arg-hcl对hmw物质形成几乎没有影响;
·
降低h4h1276s制剂的ph导致了增加的hmw物质形成;
·
与含有l-arg-hcl和nacl的制剂相比,在含有cacl2和mgcl2的制剂中hmw物质的相对增加是相似的;
·
l-脯氨酸作为热稳定剂起作用并减少了hmw物质的形成;以及
·
与l-arg-hcl制剂相比,含有ca(oac)2和mg(oac)2的制剂具有减少的hmw物质形成。因此,选择了在ph 6缓冲剂(更好的加速稳定性)中的l-arg-hcl或mg(oac)2(实质性的粘度降低)作为进一步开发的先导粘度降低剂。
[0189]
包含降低粘度的赋形剂的h4h1276s制剂的稳定性总结在图15a和15b中。含有70mm l-arg-hcl或25mm mg(oac)2的150mg/ml h4h1276s制剂与各种浓度的蔗糖和/或l-脯氨酸一起配制。调整浓度以达到约300mm的渗透压以维持等渗性。在175mg/ml h4h1276s,制备了仅包含l-arg-hcl或mg(oac)2的制剂。对于图15a(描绘了在45℃温育21天后h4h1276s的降解),样品在45℃温育并通过sec分析了聚集体含量和通过cex分析了酸性电荷变体的形成。将样品自t=0的hmw或酸性物质的相对增加绘制为制剂的函数。对于图15b(描绘了h4h1276s的冷冻储存稳定性),样品在-20℃温育9个月,并通过sec分析聚集体含量。hmw物质的百分比被绘制为时间的函数。测试制剂也在-80℃、-30℃和5℃温育3个月(数据未显示)。对于任何制剂,在-80℃下均未观察到hmw物质的变化。在5℃或-30℃,不含热稳定剂的制剂具有增加的hmw物质含量。
[0190]
mg(oac)2制剂在加速储存条件下的稳定性略低于那些含有l-arg-hcl的制剂,其中hmw物质和酸性物质的形成均增加。用l-脯氨酸替代蔗糖以浓度依赖性方式降低粘度。添加蔗糖、l-脯氨酸或两种赋形剂的组合,充分地保护了h4h1276s免于在-20℃形成hmw物质。
因此,选择70mm l-arg-hcl作为进一步开发的先导降粘剂。所提供的数据支持使用mg(oac)2作为备用赋形剂。
[0191]
蛋白质浓度、温度和粘度之间的关系显示在图16a和16b中。这些图显示了粘度与蛋白质浓度和温度的等值线图。等值线图是在minitab中生成的。在对应于150mg/ml和165mg/ml(或150mg/ml+10%)h4h1276s的点上的形状代表,在5℃的推荐储存温度(圆圈)或在25℃的推荐施用温度(星形)。
[0192]
在20℃下粘度和蛋白质浓度之间的关系显示在图17中。将粘度绘制为蛋白质浓度的函数,使用graphpad prism将数据拟合成指数曲线。该公式可用于根据已知浓度预测粘度,这对于定义最终产品的制造规格和为工艺开发提供信息是有用的。用于含有3%l-脯氨酸和70mm l-arg-hcl的制剂的公式为:粘度=0.444e
0.023[h4h1276s]
。
[0193]
上述等值线图和图形支持以下观察结果:与含蔗糖的制剂相比,含l-脯氨酸的制剂在具有或不具有70mm l-arg-hcl时在多个h4h1276s浓度(和温度;数据未显示)下始终具有较低的粘度。
[0194]
含有5%蔗糖和3%l-脯氨酸组合的制剂的粘度对蛋白质浓度曲线(在20℃),与3%脯氨酸制剂非常相似。事实上,这两种制剂之间的区别在较低温度和较高蛋白质浓度下更为明显。这些制剂的等值线图有细微但清晰的差异(数据未显示)。
[0195]
当考虑温度和制造规格两者时,l-脯氨酸制剂提供了被认为对于sc给药可接受的粘度值的更宽操作空间(图16a)。
[0196]
选择含有150mg/ml h4h1276s、10mm组氨酸,ph 6以及70mm l-arg-hcl和3%脯氨酸的基于氨基酸的制剂用于h4h1276s dp开发。
[0197]
含有蔗糖和l-脯氨酸组合的制剂被淘汰,不再进一步开发,因为它在冷冻储存稳定性方面没有提供优势(见上文)。
[0198]
因此,本文发现了对粘度、蛋白质浓度和温度之间关系的透彻理解,这可以为决策提供信息并促进选择在储存时稳定并可在预充式注射器或自动注射器中递送的制剂。考虑到dp的制造规格和与工艺相关的制造步骤(即,批量药物物质),理想地应在一系列蛋白质浓度下考虑粘度,并选择位于粘度与蛋白质浓度曲线下端的靶浓度。实施例11:与静脉递送装置的相容性
[0199]
为了在临床环境中递送,150mg/ml h4h1276s dp可以在含有生理盐水的静脉(iv)袋中稀释以用于iv给药,临床剂量为5mg/kg和15mg/kg。评估了h4h1276s的使用期间稳定性以支持临床剂量的iv给药。检测了两种混合浓度,0.5mg/ml h4h1276s和20mg/ml h4h1276s,以尝试将可能在临床环境中施用的低浓度和高浓度混合物都涵盖在内。
[0200]
为了评估使用包含在线过滤器的iv泵和输液器自iv袋的混合物的递送,测试了由聚氯乙烯(pvc)和邻苯二甲酸二(2-乙基己基)酯(dehp)制成的含有生理盐水的iv袋和两种常用的输液泵(蠕动泵和流体容积泵)。还评估了几种包含基本材料(具有dehp的pvc、具有totm的pvc、和聚乙烯)和0.2μm聚醚砜在线过滤器的输液器。测定试验
[0201]
h4h1276s混合物与iv给药装置中使用的材料的相容性,使用以下测定试验进行评估:
·
目视检查颜色和外观
·
ph
·
通过405nm的光密度(od)增加来测量浊度
·
通过光遮蔽(hiac)对混合物进行亚可见颗粒分析
·
通过反相高效液相色谱(rp-uplc)测定蛋白质浓度
·
通过se-uplc测定纯度
··
通过生物测定法测定效力:使用生物测定法确定每个样品的相对效力,并定义为:(ic50参考样品/ic50样品)
×
100%。储存稳定性样品的测量效力必须在参考标准的测量效力的50-150%以内。研究方案
[0202]
100ml含有h4h1276s dp的生理盐水iv袋经受多种胁迫条件以评估h4h1276s在混合物中和在静脉内递送时是否稳定。含有混合物的iv袋最初在5℃保持24小时;然后将袋子在25℃温育至少8小时。在这些温育完成后,将每个待评估的输液器连接到iv袋,接触混合物,并在环境温度下保持1小时。然后将每种混合物以25ml/hr或500ml/hr的速率泵送通过相应的输液器。在临床上,可能使用稀释在100ml或250ml iv袋中的dp来给药。对于此相容性研究,使用了100ml的iv袋来测试每个剂量。研究结果
[0203]
在盐水中稀释的0.5mg/ml和20mg/ml h4h1276s,在所有测试条件下是物理和化学稳定的,包括以下条件:i)在iv袋中5℃放置24小时,ii)在iv袋中25℃放置8小时,和iii)在测试的所有输液器中在室温下放置1小时。
[0204]
此外,当使用各种输液泵以25ml/hr和500ml/hr的速率泵送通过每个评估的输液器时,h4h1276s混合物也是稳定的。通过目视检查或浊度测量,未检测到沉淀物。溶液的ph值稳定,没有观察到蛋白质浓度的明显下降。通过尺寸排阻超高效液相色谱(se-uplc)测定,在该相容性研究中未观察到高或低分子量物质的相对百分比发生明显变化。与t=0相比,在样品以500ml/hr泵送通过输液器后,如通过hiac分析确定的,未观察到亚可见颗粒水平的有意义的变化。最后,如生物测定法所确定的,所有测试的样品都保持了效力。
[0205]
这些数据支持以下临床剂量制备和给药:
·
由具有dehp的pvc制成的生理盐水iv袋,与用于iv给药的h4h1276s是相容的。
·
h4h1276s可以在含有生理盐水的pvc iv袋中被稀释到低至0.5mg/ml的浓度用于iv给药;
·
h4h1276s可以在含有生理盐水的pvc iv袋中被稀释到高至20.0mg/ml的浓度用于iv给药;
·
生理盐水中的h4h1276s混合物在pvc iv袋中在5℃温育长达24小时和在25℃温育8小时后是稳定的。稀释的h4h1276s混合物可以在配制的四小时内给药。
·
生理盐水中的h4h1276s混合物可以使用标准输液泵给药;
·
h4h1276s混合物的施用,可以使用由含dehp的pvc、含totm的pvc或聚乙烯组成的输液器;
·
h4h1276s混合物与在线0.2μm聚醚砜过滤器的使用兼容;
·
h4h1276s混合物可以以25至500ml/hr流速给药。实施例12:h4h1276s药物产品的进一步稳定性研究
[0206]
h4h1276s制剂在-20℃和5℃长期储存长达36个月,并分析稳定性。
[0207]
首先,制剂为150mg/ml h4h1276s、10mm组氨酸,ph 6.0、70mm精氨酸-hcl、3%(w/v)脯氨酸和0.1%(w/v)聚山梨酯80。在带有聚硅氧烷衬里的封口的5ml nalge-nunc经伽马辐照的聚碳酸酯小瓶中,2.0ml填充体积。表13:研究h4h1276s的配制药物物质在-20℃储存的稳定性
[0208]
接下来,制剂为150mg/ml h4h1276s药物产品、10mm l-组氨酸,ph 6.0、70mm精氨酸-hcl、3%(w/v)l-脯氨酸和0.1%(w/v)聚山梨酯80。在20ml的1型透明玻璃小瓶中填充体积为5.0ml,并带有20mm涂层的west s2-451 4432/50gry b2-40瓶塞。表14:h4h1276s药物产品在5℃储存的稳定性研究
[0209]
配制的药物物质在-20℃储存长时间(多达36个月),药物产品在5℃储存长时间(多达24个月)。如表13和14所示,配制的h4h1276s显示出稳定性,例如,在整个储存时间长度范围内,所有测试中的值都保持在可接受的范围内。实施例13:容器
[0210]
用于临床开发和产品商业化的抗体药物产品的主要容器是预充式注射器,其呈现形式可以为用于自我注射的独立注射器,或并入到用于自我给药的自动注射器装置中。也可以开发在玻璃小瓶中的抗体制剂(用于静脉输注递送)。
[0211]
本发明的范围不受本文描述的具体实施方案的限制。实际上,除了这里描述的实施方案之外,根据前面的描述和附图,本领域技术人员将明了可以对于本发明进行的各种修改。这些修改旨在落入所附权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1