用于治疗针对病毒转移载体具有预先存在的免疫力的对象的方法与流程
用于治疗针对病毒转移载体具有预先存在的免疫力的对象的方法
1.相关申请
2.本技术根据35u.s.c.
§
119(e)要求2019年4月28日提交的美国临时申请序列号62/839,771、2019年10月21日提交的美国临时申请序列号62/924,103和2020年2月26日提交的美国临时申请序列号62/981,555的优先权权益;其各自的全部内容通过引用并入本文。
背景技术:
3.本发明至少部分地涉及用于施用与包含免疫抑制剂的合成纳米载体混合的病毒载体的方法和相关组合物。在一些实施方案中,本文中提供的方法和组合物实现了提高的转基因表达和/或降低的针对病毒载体的免疫应答,例如下调的免疫应答,例如在针对病毒载体具有预先存在的免疫力的对象中。
4.发明概述
5.在一个方面,提供了方法,其包括向对象施用与病毒载体混合的包含免疫抑制剂的合成纳米载体。在一个实施方案中,对象针对病毒载体的病毒抗原具有预先存在的免疫力。
6.在本文中提供的任一种方法的一个实施方案中,对象是本应由于对象中针对病毒载体的预先存在的免疫力水平而将被排除在用病毒载体进行的治疗之外的对象。在本文中提供的任一种方法的一个实施方案中,对象是这样的对象:其预先存在的免疫力(例如抗病毒载体抗体)的效价或水平超过了适合于用病毒载体(例如aav载体)(例如未与包含免疫抑制剂的合成纳米载体混合的)进行的治疗的阈值水平。阈值可以是本文中提供的或以其他方式被本领域普通技术人员(例如临床医师)理解的预先存在的免疫力水平中的任一种。
7.在本文中提供的任一种方法的一个实施方案中,对象是儿童对象或青少年对象。在本文中提供的任一种方法的一个实施方案中,对象是针对病毒载体的一种或更多种抗原具有母源转移的抗体的儿童对象或青少年对象。在本文中提供的任一种方法的一个实施方案中,对象是新生儿。在本文中提供的任一种方法的一个实施方案中,对象是针对病毒载体的一种或更多种抗原具有母源转移的抗体的新生儿。
8.在本文中提供的任一种方法的一个实施方案中,预先存在的免疫力包括针对病毒载体的预先存在的抗体,例如中和抗体。在本文中提供的任一种方法的一个实施方案中,预先存在的免疫力包括针对病毒载体的预先存在的抗体,例如中和抗体与总抗aav衣壳抗体的组合。在本文中提供的任一种方法的一个实施方案中,预先存在的免疫力包括针对病毒载体的预先存在的抗体,例如中和抗体与抗aav衣壳igg抗体的组合。在本文中提供的任一种方法的一个实施方案中,针对病毒载体的预先存在的免疫力包括预先存在的抗体,例如中和抗体、抗aav igg和抗aav衣壳igm抗体的组合。在本文中提供的任一种方法的一个实施方案中,预先存在的免疫力包括针对病毒载体的病毒衣壳的预先存在的抗体。
9.在本文中提供的任一种方法的一个实施方案中,所述方法还包括在对象中确定预先存在的免疫力水平,例如在施用病毒载体之前。在本文中提供的任一种方法的一个实施
方案中,对象针对病毒载体的病毒抗原具有中等水平的预先存在的免疫力。在本文中提供的任一种方法的一个实施方案中,所述方法还包括在向对象施用病毒载体之前在对象中测量预先存在的抗病毒载体抗体的水平。在一个实施方案中,对象是这样的对象:其抗病毒载体抗体的效价或水平超过了适合于用病毒载体(例如aav载体)(例如未与包含免疫抑制剂的合成纳米载体混合的)进行的治疗的阈值水平。阈值可以是本文中提供的或以其他方式被本领域普通技术人员(例如临床医师)知晓的预先存在的免疫力水平中的任一种。在本文中提供的任一种方法的一个实施方案中,所述方法还包括将在对象中确定的预先存在的免疫力水平与阈值水平进行比较。
10.在一个方面,提供了方法,其包括向对象施用与病毒载体混合的包含免疫抑制剂的合成纳米载体,其中病毒载体的量小于当病毒载体未与包含免疫抑制剂的合成纳米载体一起施用时提高病毒载体的转基因表达的量。在一个方面,提供了方法,其包括向对象施用与病毒载体混合的包含免疫抑制剂的合成纳米载体,其中病毒载体的量小于当病毒载体未与包含免疫抑制剂的合成纳米载体伴随施用时提高病毒载体的转基因表达的量。在一个方面,提供了方法,其包括向对象施用与病毒载体混合的包含免疫抑制剂的合成纳米载体,其中病毒载体的量小于当病毒载体未与包含免疫抑制剂的合成纳米载体混合施用时提高病毒载体的转基因表达的量。在本文中提供的任一种方法的一个实施方案中,作为施用对象的对象是第一对象并且与另一量的比较是基于向第二对象施用另一量进行的。
11.在本文中提供的任一种方法的一个实施方案中,第一对象针对病毒载体的病毒抗原具有预先存在的免疫力,并且第二对象针对病毒载体的病毒抗原也具有预先存在的免疫力。
12.在一个方面,方法包括向对象施用与病毒载体混合的包含免疫抑制剂的合成纳米载体,其中包含免疫抑制剂的合成纳米载体的量高于当包含免疫抑制剂的合成纳米载体与病毒载体一起施用于针对病毒载体的病毒抗原不具有预先存在的免疫力的对象时提高病毒载体的转基因表达和/或导致降低针对病毒载体的病毒抗原的免疫应答(例如抗体)的量。在本文中提供的任一种方法的一个实施方案中,作为施用对象的对象是第一对象并且与另一量的比较是基于向第二对象施用另一量进行的。在本文中提供的任一种方法的一个实施方案中,第一对象针对病毒载体的病毒抗原具有预先存在的免疫力,而第二对象针对病毒载体的病毒抗原不具有预先存在的免疫力。
13.在本文中提供的任一种方法的一个实施方案中,包含免疫抑制剂的合成纳米载体先前未曾施用于第一和/或第二对象,或者包含免疫抑制剂的合成纳米载体和病毒载体先前未曾伴随地施用于第一和/或第二对象,或者包含免疫抑制剂的合成纳米载体和病毒载体先前未曾混合地施用于第一和/或第二对象。
14.在所提供的任一种方法的一个实施方案中,病毒载体的剂量相比于以其他方式被预期为是导致相同或相似水平的效力(例如相同或相似水平的转基因表达)所必需的剂量是更低的剂量。在所提供的任一种方法的一个实施方案中,病毒载体的剂量是至少1倍、2倍、3倍、4倍、5倍或更多倍少。在本文中提供的任一种方法的一个实施方案中,上述剂量是对于病毒载体的至少一次或更多次所有给药的剂量。
15.在所提供的任一种方法的一个实施方案中,包含免疫抑制剂的合成纳米载体的剂量相比于以其他方式被预期为当递送至针对病毒载体不具有预先存在的免疫力的对象时
导致相同或相似水平的效力所必需的剂量是更高的剂量。在所提供的任一种方法的一个实施方案中,包含免疫抑制剂的合成纳米载体的剂量是至少2倍或3倍或更多倍高。在本文中提供的任一种方法的一个实施方案中,上述剂量是对于包含免疫抑制剂的合成纳米载体的至少一次或更多次所有给药的剂量。
16.在本文中提供的任一种方法的一个实施方案中,病毒载体和包含免疫抑制剂的合成纳米载体的至少或仅第一施用是病毒载体和包含免疫抑制剂的合成纳米载体的混合组合物。在本文中提供的任一种方法的一个实施方案中,病毒载体和包含免疫抑制剂的合成纳米载体的每次施用都是病毒载体和包含免疫抑制剂的合成纳米载体的混合组合物。在所提供的任一种方法的一个实施方案中,将病毒载体和包含免疫抑制剂的合成纳米载体混合用于每次共施用。
17.在本文中提供的任一种方法的一个实施方案中,将包含免疫抑制剂的合成纳米载体与病毒载体混合,并将混合物作为至少第一共施用施用于对象。
18.在本文中提供的任一种方法的一个实施方案中,将包含免疫抑制剂的合成纳米载体与病毒载体混合,并将混合物作为至少第一和第二共施用施用于对象。
19.在本文中提供的任一种方法的一个实施方案中,将包含免疫抑制剂的合成纳米载体与病毒载体混合,并将混合物作为至少第一、第二和第三共施用施用于对象。
20.在所提供的任一种方法的一个实施方案中,与病毒载体混合的包含免疫抑制剂的合成纳米载体的施用和/或至少一个重复剂量是通过静脉内施用。
21.在所提供的任一种方法的一个实施方案中,病毒载体包含一个或更多个表达控制序列。在所提供的任一种方法的一个实施方案中,一个或更多个表达控制序列包括肝特异性启动子。在所提供的任一种方法的一个实施方案中,一个或更多个表达控制序列包括组成型启动子。
22.在所提供的任一种方法的一个实施方案中,所述方法用于肝中的转基因表达。
23.在所提供的任一种方法的一个实施方案中,所述方法还包括在一个或更多个时间点在对象中评估针对病毒载体的转基因表达、igm和/或igg应答、和/或中和抗体应答。在所提供的任一种方法的一个实施方案中,评估igm和/或igg应答和/或中和抗体的时间点中的至少一个在共施用之后。
24.在所提供的任一种方法的一个实施方案中,病毒载体是逆转录病毒载体、腺病毒载体、慢病毒载体或腺相关病毒载体。
25.在所提供的任一种方法的一个实施方案中,病毒载体是腺相关病毒载体。在所提供的任一种方法的一个实施方案中,腺相关病毒载体是aav1、aav2、aav5、aav6、aav6.2、aav7、aav8、aav9、aav10或aav11腺相关病毒载体。在所提供的任一种方法或组合物的一个实施方案中,病毒载体(例如aav载体)是重组的、合成的、经改造的或嵌合的载体。
26.在所提供的任一种方法的一个实施方案中,与病毒载体混合的包含免疫抑制剂的合成纳米载体和/或一次或更多次后续伴随施用或者一个或更多个重复剂量的免疫抑制剂是nf-kb途径的抑制剂。在所提供的任一种方法的一个实施方案中,共施用和/或重复剂量的免疫抑制剂是mtor抑制剂。在所提供的任一种方法的一个实施方案中,mtor抑制剂是雷帕霉素或雷帕霉素类似物。
27.在所提供的任一种方法的一个实施方案中,免疫抑制剂与合成纳米载体偶联。在
所提供的任一种方法的一个实施方案中,免疫抑制剂包封在合成纳米载体中。
28.在所提供的任一种方法的一个实施方案中,与病毒载体混合的包含免疫抑制剂的合成纳米载体和/或一次或更多次后续伴随施用或者一个或更多个重复剂量的合成纳米载体包括脂质纳米粒、聚合物纳米粒、金属纳米粒、基于表面活性剂的乳剂、树枝状聚合物、巴基球、纳米线、病毒样颗粒或者肽或蛋白质颗粒。
29.在所提供的任一种方法的一个实施方案中,合成纳米载体包括聚合物纳米粒。在所提供的任一种方法的一个实施方案中,聚合物纳米粒包括聚酯、与聚醚连接的聚酯、聚氨基酸、聚碳酸酯、聚缩醛、聚缩酮、多糖、聚乙基唑啉或聚乙烯亚胺。在所提供的任一种方法的一个实施方案中,聚合物纳米粒包括聚酯或与聚醚连接的聚酯。在所提供的任一种方法的一个实施方案中,聚酯包括聚(乳酸)、聚(乙醇酸)、聚(乳酸-共-乙醇酸)或聚己内酯。在所提供的任一种方法的一个实施方案中,聚合物纳米粒包括聚酯和与聚醚连接的聚酯。在所提供的任一种方法的一个实施方案中,聚醚包括聚乙二醇或聚丙二醇。
30.在所提供的任一种方法的一个实施方案中,使用动态光散射获得的合成纳米载体的群体的粒度分布的均值为直径大于110nm。在所提供的任一种方法的一个实施方案中,直径大于150nm。在所提供的任一种方法的一个实施方案中,直径大于200nm。在所提供的任一种方法的一个实施方案中,直径大于250nm。在所提供的任一种方法的一个实施方案中,直径小于5μm。在所提供的任一种方法的一个实施方案中,直径小于4μm。在所提供的任一种方法的一个实施方案中,直径小于3μm。在所提供的任一种方法的一个实施方案中,直径小于2μm。在所提供的任一种方法的一个实施方案中,直径小于1μm。在所提供的任一种方法的一个实施方案中,直径小于750nm。在所提供的任一种方法的一个实施方案中,直径小于500nm。在所提供的任一种方法的一个实施方案中,直径小于450nm。在所提供的任一种方法的一个实施方案中,直径小于400nm。在所提供的任一种方法的一个实施方案中,直径小于350nm。在所提供的任一种方法的一个实施方案中,直径小于300nm。
31.在所提供的任一种方法的一个实施方案中,基于合成纳米载体之间的平均值,合成纳米载体中包含的免疫抑制剂的负载为0.1%至50%(重量/重量)。在所提供的任一种方法的一个实施方案中,负载为0.1%至40%。在所提供的任一种方法的一个实施方案中,负载大于4%但小于40%。在所提供的任一种方法的一个实施方案中,负载为2%至25%。
32.在所提供的任一种方法的一个实施方案中,合成纳米载体的群体的纵横比大于或等于1∶1、1∶1.2、1∶1.5、1∶2、1∶3、1∶5、1∶7或1∶10。
33.在所提供的任一种方法的一个实施方案中,病毒载体的转基因编码本文中提供的任一种蛋白质,例如酶。
34.在所提供的任一种方法的一个实施方案中,对象是需要表达由病毒载体的转基因编码的蛋白质的对象。
35.在所提供的任一种方法的一个实施方案中,对象是患有甲基丙二酸血症(methylmalonic acidemia)或otc缺乏症的对象。
36.附图简述
37.图1示出了来自人供体8、31、35、44和45的血清中的中和活性和igg抗aav抗体的水平。将中和活性以条绘制为萤光素酶表达(归一化的rlu),其中高水平的萤光素酶表达对应于低的中和抗体活性,并且低水平的萤光素酶表达对应于高的中和抗体活性。将抗aav igg
中和抗体以线绘制。
38.图2示出了用含有中和抗体的人血清处理初始小鼠,然后注射aav-seap载体或者aav-seap载体与包含雷帕霉素的合成纳米载体(即一些附图中的immtor)。注射之后测量血清seap活性。条上方的数字表示未施用包含雷帕霉素的合成纳米载体的小鼠与施用了包含雷帕霉素的合成纳米载体的小鼠之间血清seap活性的变化。虚线用于将血清seap活性水平归一化。
39.图3示出了用与1∶100稀释的含有抗aav中和抗体的血清混合的aav-seap载体或者用aav-seap载体与包含雷帕霉素的合成纳米载体注射初始小鼠。条上方的数字表示相对于未注射血清的小鼠的血清seap活性水平。虚线用于将血清seap活性水平归一化。
40.图4示出了在用anc80-mut处理的mck-mut小鼠的后代中的母源转移的抗anc80 igg。
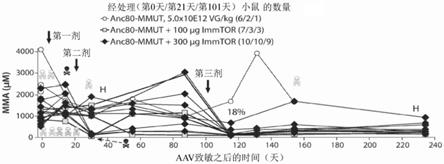
41.图5示出了具有预先存在的母源转移的抗anc80 igg:mma的mck-mut小鼠中的高剂量anc80-mut和immtor。
42.图6示出了具有预先存在的母源转移的抗anc80 igg:mma的mck-mut小鼠中的高剂量anc80-mut和immtor。
43.图7示出了具有预先存在的母源转移的抗anc80 igg:mma的mck-mut小鼠中的高剂量anc80-mut和immtor。
44.图8(图8a至8b)示出了用anc80-mut
±
immtor重复处理的具有预先存在的母源转移的抗anc80 igg的mck-mut小鼠的存活。
具体实施方式
45.在详细描述本发明之前,应理解,本发明不限于特别示例的材料或工艺参数,因为其当然可变化。还应理解,本文中使用的术语仅用于描述本发明的特定实施方案的目的,并且不旨在限制使用替代术语来描述本发明。
46.本文(无论是上文还是下文)中引用的所有出版物、专利和专利申请,均通过引用整体并入本文以用于所有目的。通过引用的这样的并入并不旨在承认本文中引用的任何并入的出版物、专利和专利申请构成现有技术。
47.除非另有明确规定,否则本说明书和所附权利要求中使用的没有数量词修饰的名词包括复数指示物。例如,提及“聚合物”包括两种或更多种这样的分子的混合物或者不同分子量的单一聚合物种类的混合物,提及“合成纳米载体”包括两种或更多种这样的合成纳米载体的混合物或者多种这样的合成纳米载体,提及“dna分子”包括两种或更多种这样的dna分子的混合物或者多种这样的dna分子,提及“免疫抑制剂”包括两种或更多种这样的免疫抑制剂分子的混合物或者多种这样的免疫抑制剂分子等。
48.本文中使用的术语“包括”或其变化形式如“包含”或“含有”应解读为表示包括任何所列举的整体(例如特征、要素、特性、属性、方法/过程步骤或限制)或整体(例如特征、要素、特性、属性、方法/过程步骤或限制)的组,但不排除任何其他的整体或整体的组。因此,本文中使用的术语“包括”是包括性的,并且不排除另外的未列举的整体或方法/过程步骤。
49.在本文中提供的任一种组合物和方法的实施方案中,“包含”可用“基本上由...组成”或“由...组成”代替。短语“基本上由...组成”在本文中用于要求指定的整体或步骤以
及不会实质性影响要求保护之发明的特征或功能的那些。本文中使用的术语“由...组成”用于表示只存在列举的整体(例如特征、要素、特性、属性、方法/加工步骤或限制)或整体(例如特征、要素、特性、属性、方法/加工步骤或限制)的组。
50.a.引言
51.病毒载体,例如基于腺相关病毒(adeno-associated virus,aav)的那些,已经在治疗应用(例如基因治疗)中显示出巨大的潜力。然而,病毒载体在基因治疗和其他应用中的使用已受到了限制,例如由于病毒抗原暴露导致的预先存在的免疫力。针对aav的预先存在的抗体可在对天然存在的野生型aav感染做出应答时形成,或者通过从aav致敏的母亲将抗体母源转移至她的新生儿而形成。实际上,针对病毒载体的预先存在的免疫力可导致针对病毒载体的免疫应答和病毒载体效力的降低,例如,如转基因表达降低所示。针对病毒载体的细胞免疫应答和体液免疫应答二者均可降低效力和/或降低使用这样的治疗剂的能力。这些免疫应答包括抗体、b细胞和t细胞应答,并且可对病毒载体的病毒抗原(例如病毒衣壳或包被蛋白,或其肽)具有特异性。本发明人已令人惊讶地发现,包含免疫抑制剂的合成纳米载体可与病毒载体组合使用,甚至在针对病毒载体的病毒抗原具有预先存在的免疫力的那些对象中。如本文中提供的包含免疫抑制剂的合成纳米载体可允许用病毒载体治疗这样的对象。
52.本发明人还令人惊讶地发现,与病毒载体混合的包含免疫抑制剂的合成纳米载体可在对象中实现提高的转基因表达,例如在针对病毒载体具有预先存在的免疫力的对象中。当病毒载体的施用是第一次施用时,免疫应答降低和/或转基因表达的这样的改善是显著的。
53.另外,还令人惊讶地发现,虽然包含免疫抑制剂的合成纳米载体与病毒载体的这样的混合施用在病毒载体的第一次施用时实现了改善的转基因表达,但混合对于包含免疫抑制剂的合成纳米载体与病毒载体的后续施用的效力不是必需的。
54.另外,已令人惊讶地发现,包含免疫抑制剂的合成纳米载体与病毒载体的这样的混合施用可用于实现病毒载体的剂量降低而不降低转基因表达。施用降低剂量的病毒载体可减轻与施用病毒载体相关的不期望的影响。
55.此外,已令人惊讶地发现,更高剂量的包含免疫抑制剂的合成纳米载体还可有助于在针对病毒载体具有预先存在的免疫力的对象中实现病毒载体的有效施用。
56.因此,本发明人已令人惊讶和出乎意料地发现上述问题和限制可通过实施本文中公开的本发明来克服。提供了方法和组合物,其给出了对有效使用病毒载体进行治疗的前述障碍的解决方案。本文中提供了用于用包含本文中提供的任一种病毒载体构建体的病毒载体来治疗对象的方法和组合物,所述病毒载体例如与包含免疫抑制剂的合成纳米载体混合。所提供的方法和相关组合物可允许更广泛和改善的病毒载体的使用并且可导致不期望的免疫应答降低和/或导致改善的效力,例如通过提高的转基因表达。
57.下面将更详细地描述本发明。
58.b.定义
[0059]“施用”意指以药理学有用的方式向对象提供或分配物质。该术语旨在包括“导致施用(causing to be administered)”。“导致施用”意指直接或间接地导致、督促、鼓励、协助、诱导或指导另一方施用所述物质。除非另有说明,否则当涉及施用之间的时期时,该时
期是施用的开始之间的时间。
[0060]
本文中使用的“混合”是指将两种或更多种组分混合,使得两种或更多种组分一起存在于组合物中,并且施用所述组合物向对象提供了所述两种或更多种组分。本文中提供的任一种方法的任一种共施用可作为混合物施用。在一些实施方案中,混合两种组分包括溶解、分散、混悬、组合、结合或共混两种组分,例如病毒转移载体和包含免疫抑制剂的合成纳米载体。混合方法是本领域技术人员已知的,并且包括但不限于标准的药物混合方法,例如液体-液体混合、粉末-粉末混合、液体-粉末混合。在一些实施方案中,所得混合物是均质混合物;即,病毒载体可与包含免疫抑制剂的合成纳米载体均匀混合。在另一些实施方案中,所得混合物是异质混合物,即病毒载体与包含免疫抑制剂的合成纳米载体不均匀混合。
[0061]
在所提供的任一种方法的一些实施方案中,与病毒载体混合的包含免疫抑制剂的合成纳米载体之后是与病毒载体伴随的包含免疫抑制剂的合成纳米载体的一次或更多次施用和/或与病毒载体混合的包含免疫抑制剂的合成纳米载体的一次或更多次后续施用(分别为一次或更多次后续伴随施用或者一个或更多个重复剂量)。在所提供的任一种方法的一些实施方案中,包含免疫抑制剂的合成纳米载体与病毒载体的后续伴随施用或重复剂量在施用与病毒载体混合的包含免疫抑制剂的合成纳米载体之后1周、2周、3周、1个月、2个月或更长时间施用。
[0062]
在如本文中所提供的用于施用于对象的组合物的情况下,“有效量”是指在该对象中产生一种或更多种期望的结果(例如,降低或消除针对病毒载体的免疫应答(例如igm和/或igg免疫应答)和/或有效或提高的转基因表达)的组合物的量。有效量可用于体外或体内目的。对于体内目的,该量可以是临床医生认为对于可能由于施用病毒载体而经历不期望的免疫应答的对象可具有临床益处的量。在本文中提供的任一种方法中,所施用的组合物可以是本文中提供的任一种有效量。
[0063]
有效量可涉及降低不期望的免疫应答的水平,尽管在一些实施方案中,其涉及完全阻止不期望的免疫应答。有效量还可涉及延迟不期望的免疫应答的发生。有效量也可以是导致期望的治疗终点或期望的治疗结果的量。在所提供的任一种组合物和方法的一些实施方案中,有效量是其中期望的免疫应答(例如降低或消除针对病毒载体的免疫应答,例如igm和/或igg应答)和/或产生有效或提高的转基因表达的量。可通过常规方法来监测前述任一项的实现。
[0064]
当然,有效量将取决于所治疗的特定对象;病症、疾病或障碍的严重程度;个体患者参数包括年龄、身体状况、尺寸和体重;治疗的持续时间;并行治疗(如果有的话)的性质;具体施用途径以及在健康从业者的知识和专业之内的类似因素。这些因素是本领域普通技术人员公知的并且仅用常规实验就可解决。
[0065]
在所提供的任一种方法或组合物的一些实施方案中,与在针对病毒载体的病毒抗原具有预先存在的免疫力的对象中相比,在针对病毒载体的病毒抗原不具有预先存在的免疫力的对象中,不与包含免疫抑制剂的合成纳米载体一起施用的病毒载体的有效量更少。在所提供的任一种方法或组合物的一些实施方案中,在对象中,例如在针对病毒载体的病毒抗原具有预先存在的免疫力的对象中,当与包含免疫抑制剂的合成纳米载体混合施用时病毒载体的有效量小于当未与包含免疫抑制剂的合成纳米载体混合(例如伴随地但未混合地施用)或者不与包含免疫抑制剂的合成纳米载体一起时病毒载体的有效量。在一些实施
方案中,对象先前未曾施用包含免疫抑制剂的合成纳米载体和/或病毒载体。
[0066]“评估免疫应答”是指体外或体内免疫应答的水平、存在或不存在、降低、提高等的任何测量或确定。这样的测量或确定可对获自对象的一个或更多个样品进行。这样的评估可用本文中提供的任一种方法或本领域中已知的其他方法(包括基于elisa的测定)进行。评估可以是评估例如来自对象的样品中抗体(例如igm和/或igg抗体,例如对病毒载体具有特异性那些)的数量或百分比。评估还可以是评估与免疫应答相关的任何作用,例如测量细胞因子、细胞表型等的存在或不存在。本文中提供的任一种方法可包括或还包括评估针对病毒载体或其抗原的免疫应答的步骤。评估可直接或间接进行。所述术语旨在包括导致、督促、鼓励、协助、诱导或指导另一方评估免疫应答的行为。
[0067]
除非另有说明,否则本文中使用的“平均”是指算术平均值。
[0068]“伴随地”意指以在时间上相关,优选地在时间上充分相关的方式向对象施用两种或更多种物质/试剂以在免疫应答中提供调节,并且甚至更优选地,组合施用两种或更多种物质/试剂。在一些实施方案中,伴随施用可包括在指定时间段内,优选在1个月内,更优选在1周内,还更优选在1天内,并且甚至更优选在1小时内施用两种或更多种物质/试剂。在一些实施方案中,物质/试剂可重复地伴随施用;即,在多于一次时机下进行伴随施用,例如在实施例中所提供的。
[0069]“偶联”或“偶联的”(等)意指一个实体(例如部分)与另一实体化学地缔合。在所提供的任一种方法或组合物的一些实施方案中,偶联是共价的,意指在两个实体之间存在共价键的情况下发生连接。在一些非共价实施方案中,非共价偶联由非共价相互作用介导,所述非共价相互作用包括但不限于电荷相互作用、亲和相互作用、金属配位、物理吸附、主客体相互作用(host-guest interaction)、疏水相互作用、tt堆积相互作用、氢键键合相互作用、范德华相互作用、磁性相互作用、静电相互作用、偶极-偶极相互作用,和/或其组合。在所提供的任一种方法或组合物的一些实施方案中,包封是偶联的一种形式。
[0070]“剂量”是指用于以给定时间施用于对象的药理学和/或免疫学活性物质的特定量。通常,除非另有提供,否则在本发明的方法和组合物(包括药盒)中,包含免疫抑制剂的合成纳米载体和/或病毒载体的剂量是指合成纳米载体中包含的免疫抑制剂的量和/或病毒载体的量。或者,在提及包含免疫抑制剂的合成纳米载体的剂量的情况下,所述剂量可基于提供期望的免疫抑制剂的量的合成纳米载体的数量来施用。当在重复给药的情况下使用剂量时,剂量是指每个重复剂量的量,其可相同或不同。
[0071]“包封”意指将物质的至少一部分封装在合成纳米载体中。在所提供的任一种方法或组合物的一些实施方案中,物质完全封装在合成纳米载体中。在所提供的任一种方法或组合物的另一些实施方案中,包封的物质中的大部分或全部不暴露于合成纳米载体外部的局部环境。在所提供的任一种方法或组合物的另一些实施方案中,不超过50%、40%、30%、20%、10%或5%(重量/重量)暴露于局部环境。包封不同于吸收,吸收是将物质的大部分或全部置于合成纳米载体的表面上,并使物质暴露于合成纳米载体外部的局部环境。
[0072]“表达控制序列”是可影响表达的任何序列,并且可包括启动子、增强子和操纵子。载体内的表达控制序列或控制元件可促进合适的核酸转录、翻译、病毒包装等。通常来说,控制元件顺式地起作用,但它们也可反式地起作用。在所提供的任一种方法或组合物的一个实施方案中,表达控制序列是启动子,例如组成型启动子或组织特异性启动子。“组成型
启动子”,也称为普遍存在(ubiquitous)或混杂(promiscuous)启动子,是被认为通常具有活性并且对某些细胞不具有排他性或优先性的那些。“组织特异性启动子”是在特定细胞类型或组织中具有活性的那些,这样的活性可以是特定细胞类型或组织独有的。在本文中提供的任一种核酸或病毒载体中,启动子可以是本文中提供的任一种启动子。在本文中提供的任一种核酸或病毒载体中,启动子可以是肝特异性启动子。
[0073]“针对病毒载体的免疫应答”等是指针对病毒载体的任何不期望的免疫应答,例如抗体(例如,igm或igg)或细胞应答。在一些实施方案中,不期望的免疫应答是针对病毒载体或其抗原的抗原特异性免疫应答。在一些实施方案中,免疫应答对病毒载体的病毒抗原具有特异性。在另一些实施方案中,免疫应答对由病毒载体的转基因编码的蛋白质或肽具有特异性。在一些实施方案中,免疫应答对病毒载体的病毒抗原具有特异性,而对由病毒载体的转基因编码的蛋白质或肽没有特异性。
[0074]
在一些实施方案中,对象中的降低的抗病毒载体应答包括:相比于在没有如本文中所提供的施用的情况下将病毒载体施用于另一对象(例如测试对象)之后使用获自所述另外的对象的生物样品所测量的抗病毒载体免疫应答,在如本文中所提供的施用之后使用获自该对象的生物样品所测量的降低的抗病毒载体免疫应答。在一些实施方案中,所述抗病毒载体免疫应答是:相比于在没有如本文中所提供的施用的情况下将病毒载体施用于另一对象(例如测试对象)之后对获自所述另外的对象的生物样品进行病毒载体体外攻击之后所检测的抗病毒载体免疫应答,在如本文中所提供的施用之后对该对象的生物样品进行随后的病毒载体体外攻击之后获自该对象的生物样品中的降低的抗病毒载体免疫应答。在另一些实施方案中,可在另一对象中(例如在来自测试对象的样品中)评估免疫应答,其中预期具有或不具有成比例改变(scaling)的其他对象的结果将指示所讨论的对象中正在发生或已经发生的状况。在一些实施方案中,对象中的降低的抗病毒载体应答包括:相比于使用在不同的时间点(例如在没有如本文中所提供的施用的时间,例如在如本文中所提供的施用之前)获自该对象的生物样品所测量的抗病毒载体免疫应答,在如本文中所提供的施用之后使用获自该对象的生物样品所测量的降低的抗病毒载体免疫应答。
[0075]“免疫抑制剂”意指可引起致耐受性作用的化合物,优选通过其对apc的作用。致耐受性作用通常是指apc或其他免疫细胞全身和/或局部的调节,其以持久的方式降低、抑制或防止针对抗原的不期望免疫应答。在所提供的任一种方法或组合物的一个实施方案中,免疫抑制剂是引起apc促进一种或更多种免疫效应细胞中的调节性表型的免疫抑制剂。例如,调节性表型的特征可以是:抑制抗原特异性cd4+t细胞或b细胞的产生、诱导、刺激或募集;抑制抗原特异性抗体的产生,treg细胞(例如,cd4+cd25highfoxp3+treg细胞)的产生、诱导、刺激或募集等。这可以是cd4+t细胞或b细胞转化为调节性表型的结果。这也可以是在其他免疫细胞(例如cd8+t细胞、巨噬细胞和inkt细胞)中诱导foxp3的结果。在所提供的任一种方法或组合物的一个实施方案中,免疫抑制剂是在apc处理抗原之后影响apc的应答的免疫抑制剂。在所提供的任一种方法或组合物的另一个实施方案中,免疫抑制剂不是干扰抗原处理的免疫抑制剂。在所提供的任一种方法或组合物的另一个实施方案中,免疫抑制剂不是凋亡信号传导分子。在所提供的任一种方法或组合物的另一个实施方案中,免疫抑制剂不是磷脂。
[0076]
免疫抑制剂包括但不限于:他汀类;mtor抑制剂,例如雷帕霉素(rapamycin)或雷
帕霉素类似物(即,rapalog);tgf-β信号传导剂;tgf-β受体激动剂;组蛋白脱乙酰酶抑制剂,例如曲古抑菌素a(trichostatin a);皮质类固醇;线粒体功能抑制剂,例如鱼藤酮(rotenone);p38抑制剂;nf-κβ抑制剂,例如6bio、地塞米松(dexamethasone)、tcpa-1、ikk vii;腺苷受体激动剂;前列腺素e2激动剂(pge2),例如米索前列醇(misoprostol);磷酸二酯酶抑制剂,例如磷酸二酯酶4抑制剂(pde4),例如咯利普兰(rolipram);蛋白酶体抑制剂;激酶抑制剂;g蛋白偶联受体激动剂;g蛋白偶联受体拮抗剂;糖皮质激素;类视黄醇;细胞因子抑制剂;细胞因子受体抑制剂;细胞因子受体激活剂;过氧化物酶体增殖物激活受体拮抗剂;过氧化物酶体增殖物激活受体激动剂;组蛋白脱乙酰酶抑制剂;钙调磷酸酶抑制剂;磷酸酶抑制剂;pi3kb抑制剂,例如tgx-221;自噬抑制剂,例如3-甲基腺嘌呤;芳烃受体抑制剂;蛋白酶体抑制剂i(psi);和氧化的atp,例如p2x受体阻断剂。免疫抑制剂还包括:ido、维生素d3、视黄酸、环孢素例如环孢素a、芳烃受体抑制剂、白藜芦醇(resveratrol)、硫唑嘌呤(aza)、6-巯基嘌呤(6-mp)、6-硫鸟嘌呤(6-tg)、fk506、萨菲菌素a、沙美特罗、霉酚酸酯(mmf)、阿司匹林和其他cox抑制剂、尼氟酸、雌三醇和雷公藤内酯。另一些示例性免疫抑制剂包括但不限于:小分子药物、天然产物、抗体(例如抗cd20、cd3、cd4的抗体)、基于生物制剂的药物、基于碳水化合物的药物、rnai、反义核酸、适配体、甲氨蝶呤、nsaid;芬戈莫德(fingolimod);那他珠单抗(natalizumab);阿仑单抗(alemtuzumab);抗cd3;他克莫司(fk506)、阿巴西普(abatacept)、贝拉西普(belatacept)等。本文中使用的“雷帕霉素类似物”是指在结构上与雷帕霉素(西罗莫司)(的类似物)相关的分子。雷帕霉素类似物的一些实例包括但不限于:坦罗莫司(cci-779)、依维莫司(rad001)、地磷莫司(ap-23573)和佐他莫司(abt-578)。雷帕霉素类似物的一些另外的实例可见于例如wo公开wo 1998/002441和美国专利号8,455,510,其雷帕霉素类似物通过引用整体并入本文。其他免疫抑制剂是本领域技术人员已知的,并且本发明不限于此方面。在所提供的任一种方法或组合物的一些实施方案中,免疫抑制剂可包含本文中提供的任一种试剂,例如前述的任一种。
[0077]“提高转基因表达”是指提高对象中病毒载体的转基因表达水平,所述转基因由病毒载体递送。在一些实施方案中,可通过测量对象中多种目的组织或系统中的转基因蛋白质浓度来确定转基因表达的水平。或者,当转基因表达产物是核酸时,可通过转基因核酸产物来测量转基因表达的水平。可例如通过测量获自对象的样品中转基因表达的量并将其与先前样品进行比较来确定提高的转基因表达。样品可以是组织样品。在一些实施方案中,可使用流式细胞术测量转基因表达。在另一些实施方案中,可在另一对象(例如在来自测试对象的样品)中评估提高的转基因表达,其中预期具有或不具有成比例改变的其他对象的结果将指示所讨论的对象中正在发生或已经发生的状况。本文中提供的任一种方法可导致提高的转基因表达。
[0078]
当免疫抑制剂包含在合成纳米载体中时,例如当与其偶联时,“负载”是基于整个合成纳米载体中物质的总干配方重量的合成纳米载体中免疫抑制剂的量(重量/重量)。通常来说,这样的负载计算为合成纳米载体群体的平均值。在所提供的任一种方法或组合物的一个实施方案中,合成纳米载体的平均负载为0.1%至99%。在所提供的任一种方法或组合物的另一个实施方案中,负载为0.1%至50%。在所提供的任一种方法或组合物的另一个实施方案中,负载为0.1%至20%。在所提供的任一种方法或组合物的另一个实施方案中,负载为0.1%至10%。在所提供的任一种方法或组合物的另一个实施方案中,负载为1%至
10%。在所提供的任一种方法或组合物的另一个实施方案中,负载为7%至20%。在所提供的任一种方法或组合物的另一个实施方案中,合成纳米载体群体的平均负载为至少0.1%、至少0.2%、至少0.3%、至少0.4%、至少0.5%、至少0.6%、至少0.7%、至少0.8%、至少0.9%、至少1%、至少2%、至少3%、至少4%、至少5%、至少6%、至少7%、至少8%、至少9%、至少10%、至少11%、至少12%、至少13%、至少14%、至少15%、至少16%、至少17%、至少18%、至少19%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%。在所提供的任一种方法或组合物的另一个实施方案中,合成纳米载体群体的平均负载为0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%。在任一种上述实施方案的一些实施方案中,合成纳米载体群体的平均负载不超过25%。在所提供的任一种方法或组合物的一些实施方案中,如本领域中已知的那样计算负载。
[0079]“合成纳米载体的最大尺寸”意指沿合成纳米载体的任何轴测量的纳米载体的最大尺寸。“合成纳米载体的最小尺寸”意指沿合成纳米载体的任何轴测量的合成纳米载体的最小尺寸。例如,对于球形合成纳米载体,合成纳米载体的最大尺寸和最小尺寸将基本上相同,并且将是其直径的尺寸。类似地,对于立方形合成纳米载体,合成纳米载体的最小尺寸将是其高度、宽度或长度中的最小者,而合成纳米载体的最大尺寸将是其高度、宽度或长度中的最大者。在一个实施方案中,基于样品中合成纳米载体的总数,该样品中合成纳米载体中的至少75%、优选至少80%、更优选至少90%的最小尺寸等于或大于100nm。在一个实施方案中,基于样品中合成纳米载体的总数,该样品中合成纳米载体中的至少75%、优选至少80%、更优选至少90%的最大尺寸等于或小于5μm。优选地,基于样品中合成纳米载体的总数,该样品中合成纳米载体中的至少75%、优选至少80%、更优选至少90%的最小尺寸大于110nm、更优选大于120nm、更优选大于130nm并且还更优选大于150nm。合成纳米载体的最大尺寸与最小尺寸的纵横比可根据实施方案而变化。例如,合成纳米载体的最大尺寸与最小尺寸的纵横比可以是1∶1至1,000,000∶1、优选1∶1至100,000∶1、更优选1∶1至10,000∶1、更优选1∶1至1000∶1、还更优选1∶1至100∶1并且还更优选1∶1至10∶1不等。优选地,基于样品中合成纳米载体的总数,该样品中合成纳米载体中的至少75%、优选至少80%、更优选至少90%的最大尺寸等于或小于3μm、更优选等于或小于2μm、更优选等于或小于1μm、更优选等于或小于800nm、更优选等于或小于600nm并且还更优选等于或小于500nm。在一些优选的实施方案中,基于样品中合成纳米载体的总数,该样品中合成纳米载体中的至少75%、优选至少80%、更优选至少90%的最小尺寸等于或大于100nm、更优选等于或大于120nm、更优选等于或大于130nm、更优选等于或大于140nm,并且还更优选等于或大于150nm。在一些实施方案中,可通过将合成纳米载体悬浮在液体(通常为水性)介质中并使用动态光散射(dynamic light scattering,dls)(例如,使用brookhaven zetapals仪器)来获得合成纳米载体尺寸(例如,有效直径)的测量。例如,可将合成纳米载体的悬浮液从水性缓冲液稀释到纯水中,以实现约0.01至0.1mg/ml的最终合成纳米载体悬浮液浓度。经稀释的悬浮液可直接在合适的吸收池内制备或转移到合适的吸收池中用于dls分析。然后,可将吸收池放置在dls中,使其平衡至受控温度,并随后基于介质黏度和样品折射率的合适输入扫描足够的时间以获得稳定且可再现的分布。然后,报告有效直径或分布的平均值。确定高纵横比或非球形合成纳
米载体的有效尺寸可需要放大技术(例如电子显微术)以获得更准确的测量。合成纳米载体的“尺寸”或“大小”或“直径”意指例如使用动态光散射获得的颗粒尺寸分布的平均值。
[0080]“先前未曾施用”是指从未施用于对象或未在将在用于施用病毒载体以进行治疗的给药方案开始时产生药效学作用的时间范围内施用的组合物。
[0081]“可药用赋形剂”或“可药用载体”意指与药理学活性物质一起使用以配制组合物的药理学惰性物质。可药用赋形剂包括本领域中已知的多种物质,包括但不限于糖类(例如葡萄糖、乳糖等)、防腐剂(例如抗微生物剂)、重构助剂、着色剂、盐水(例如磷酸盐缓冲盐水)和缓冲剂。
[0082]“重复剂量”或“重复给药”等意指在物质或一组物质的较早剂量或给药之后向对象施用相同物质的至少一个额外剂量或给药。虽然物质可相同,但是重复剂量或给药中的物质的量可不同。
[0083]“针对病毒载体的病毒抗原的预先存在的免疫力”是指对象中存在抗体、t细胞和/或b细胞,这些细胞先前已通过先前暴露于病毒载体的抗原或先前暴露于交叉反应性抗原(包括但不限于其他病毒)而引发。在本文中提供的任一种方法的一个实施方案中,预先存在的免疫力是针对病毒载体的病毒衣壳。该术语还意在包括针对病毒载体的病毒抗原具有母源转移的抗体的对象,并且因此,本文中提供的对象包括针对病毒载体具有母源转移的抗体的新生儿。在本文中提供的任一种方法的一个实施方案中,预先存在的免疫力包括针对病毒载体的预先存在的抗体,例如中和抗体。在本文中提供的任一种方法的一个实施方案中,预先存在的免疫力包括针对病毒载体的预先存在的抗体,例如中和抗体与总抗aav衣壳抗体的组合。在本文中提供的任一种方法的一个实施方案中,预先存在的免疫力包括针对病毒载体的预先存在的抗体,例如中和抗体与抗aav衣壳igg抗体的组合。在本文中提供的任一种方法的一个实施方案中,针对病毒载体的预先存在的免疫力包括预先存在的抗体,例如中和抗体、抗aav igg和抗aav衣壳igm抗体的组合。在本文中提供的任一种方法的一个实施方案中,针对病毒载体的母源转移的抗体包括针对病毒载体的中和抗体。
[0084]
在一些实施方案中,这种预先存在的免疫力处于预期会导致干扰病毒载体效力的抗病毒载体免疫应答的水平。在一些实施方案中,这种预先存在的免疫力处于本应将对象排除在用病毒载体进行的治疗之外的水平。在本文中提供的任一种方法的一个实施方案中,针对病毒载体的病毒抗原的预先存在的免疫力水平足以中和25%、30%、40%、50%、60%、70%的病毒载体,例如aav,以1∶5的效价转导。在本文中提供的任一种方法的一个实施方案中,针对病毒载体的病毒抗原的预先存在的免疫力水平足以中和25%、30%、40%、50%、60%、70%的病毒载体,例如aav,以1∶10的效价转导。在本文中提供的任一种方法的一个实施方案中,针对病毒载体的病毒抗原的预先存在的免疫力水平足以中和25%、30%、40%、50%、60%、70%的病毒载体,例如aav,以1∶20的效价转导。在本文中提供的任一种方法的一个实施方案中,针对病毒载体的病毒抗原的预先存在的免疫力水平足以中和25%、30%、40%、50%、60%、70%的病毒载体,例如aav,以1∶100的效价转导。在本文中提供的任一种方法的一个实施方案中,针对病毒载体的病毒抗原的预先存在的免疫力水平足以以1∶5、1∶10、1∶20、1∶50、1∶100的效价中和50%。在本文中提供的任一种方法的一个实施方案中,对象具有任一种前述水平的预先存在的免疫力。在本文中提供的任一种方法的一个实施方案中,前述任一种为阈值水平。
[0085]
在一些实施方案中,这种预先存在的免疫力处于预期在后续暴露于病毒载体之后会导致抗病毒载体免疫应答的水平。可通过确定存在于来自对象的样品(例如血液样品)中的针对病毒载体的抗体(例如中和抗体)的水平来评估预先存在的免疫力。用于评估抗体(例如中和抗体)水平的测定在本文中至少在实施例中进行了描述,并且也是本领域普通技术人员已知的。这样的测定可以是基于细胞的测定。用于评估抗体(例如igm或igm或中和抗体)水平的测定。这样的测定可以是elisa测定。也可通过确定在体内或体外用由apc呈递的病毒载体抗原或者在mhc i类或mhc ii类分子上呈递的病毒抗原表位刺激的免疫细胞(例如b或t细胞)的抗原回忆应答(recall response)来评估预先存在的免疫力。用于抗原特异性回忆应答的测定包括但不限于elispot、胞内细胞因子染色、细胞增殖和细胞因子产生测定。通常来说,这些和其他测定是本领域普通技术人员已知的。在一些实施方案中,针对病毒载体的病毒抗原不表现出预先存在的免疫力的对象是抗病毒载体抗体(例如中和抗体,或者记忆b或t细胞)水平被认为是阴性的对象。在另一些实施方案中,针对病毒载体的病毒抗原不表现出预先存在的免疫力的对象是具有比平均阴性对照高不超过3个标准差的抗病毒载体应答的水平的对象。
[0086]“对象”意指动物,包括温血哺乳动物,例如人和灵长类;禽类;驯养的家养或农场动物,例如猫、狗、绵羊、山羊、牛、马和猪;实验动物,例如小鼠、大鼠和豚鼠;鱼;爬行动物;动物园动物和野生动物;等。如本文中所用,对象可需要本文中提供的任一种方法或组合物。如本文中所用,对象是具有母源转移的抗体的新生儿,或者是在其中的预先存在的免疫力水平本应将对象排除在用病毒载体进行的治疗之外的对象。本文中提供的“第二对象”或“另一对象”是指与不同于向其提供施用的对象的另一对象。该对象可以是任何其他对象,例如测试对象,该对象可以是相同或不同的物种。在一些实施方案中,该第二对象是针对病毒载体具有预先存在的免疫力的对象。在一些实施方案中,该第二对象是针对病毒载体不具有预先存在的免疫力的对象。在另一些实施方案中,该第二对象是施用了病毒载体而没有包含免疫抑制剂的合成纳米载体或者不存在以相同的方式(不同的方式,例如伴随但不混合)施用的包含免疫抑制剂的合成纳米载体的对象。在所提供的任一种方法或组合物的一些实施方案中,当第二对象或其他对象是不同物种时,该量可成比例改变为适合于对象物种接受施用,该经成比例改变的量可用作如本文中所提供的总量。例如,可使用异速成比例改变或其他成比例改变方法。可使用本领域普通技术人员已知或本文中其他地方提供的常规方法来评估第二对象或其他对象中的免疫应答以及转基因表达。本文中提供的任一种方法可包括或还包括在本文中所述的第二对象或其他对象中确定这些量的一种或更多种。
[0087]“合成纳米载体”意指在自然界中未发现并且具有至少小于或等于5微米大小的一个尺寸的离散物体。一般来说包含白蛋白纳米粒作为合成纳米载体,然而在某些实施方案中,合成纳米载体不包含白蛋白纳米粒。在一些实施方案中,合成纳米载体不包含壳聚糖。在另一些实施方案中,合成纳米载体不是基于脂质的纳米粒。在另外的实施方案中,合成纳米载体不包含磷脂。
[0088]
合成纳米载体可以是但不限于以下一种或多种:基于脂质的纳米粒(在本文中也称为脂质纳米粒,即构成其结构的大部分物质是脂质的纳米粒)、聚合物纳米粒、金属纳米粒、基于表面活性剂的乳剂、树枝状聚合物、巴基球、纳米线、病毒样颗粒(即主要由病毒结构蛋白构成但不具有感染性或感染性低的颗粒)、基于肽或蛋白质的颗粒(在本文中也称为
蛋白质颗粒,即构成其结构的大部分物质是肽或蛋白质的颗粒)(例如白蛋白纳米粒)和/或使用纳米材料的组合产生的纳米粒(例如脂质-聚合物纳米粒)。合成纳米载体可以是多种不同的形状,包括但不限于球形、立方形、棱锥形、长方形、圆柱形、环形等。根据本发明的合成纳米载体包含一个或更多个表面。可适用于本发明实践的示例性合成纳米载体包括:(1)gref等的美国专利5,543,158中公开的生物可降解纳米粒,(2)saltzman等的公开的美国专利申请20060002852的聚合物纳米粒,(3)desimone等的公开的美国专利申请20090028910的光刻法构建的纳米粒,(4)von andrian等的wo 2009/051837的公开内容,(5)penades等的公开的美国专利申请2008/0145441中公开的纳米粒,(6)de los rios等的公开的美国专利申请20090226525中公开的蛋白质纳米粒,(7)sebbel等的公开的美国专利申请20060222652中公开的病毒样颗粒,(8)bachmann等的公开的美国专利申请20060251677中公开的核酸连接的病毒样颗粒,(9)wo2010047839a1或wo2009106999a2中公开的病毒样颗粒,(10)p.paolicelli et al.,“surface-modified plga-based nanoparticles that can efficiently associate and deliver virus-like particles”nanomedicine.5(6):843-853(2010)中公开的纳米沉淀纳米粒,(11)美国公开2002/0086049中公开的凋亡细胞、凋亡小体或者合成或半合成模拟物,或(12)look et al.,nanogel-based delivery of mycophenolic acid ameliorates systemic lupus erythematosus in mice”j.clinical investigation 123(4):1741-1749(2013)的那些。
[0089]
在一些实施方案中,最小尺寸等于或小于约100nm、优选等于或小于100nm的根据本发明的合成纳米载体不包含具有激活补体之羟基的表面,或者作为替代包含基本上由不是激活补体之羟基的部分组成的表面。在一个优选的实施方案中,最小尺寸等于或小于约100nm、优选等于或小于100nm的根据本发明的合成纳米载体不包含显著激活补体的表面,或者作为替代包含基本上由不会显著激活补体的部分组成的表面。在一个更优选的实施方案中,最小尺寸等于或小于约100nm、优选等于或小于100nm的根据本发明的合成纳米载体不包含激活补体的表面,或者作为替代包含基本上由不会激活补体的部分组成的表面。在一些实施方案中,合成纳米载体排除病毒样颗粒。在一些实施方案中,合成纳米载体的纵横比可大于或等于1∶1、1∶1.2、1∶1.5、1∶2、1∶3、1∶5、1∶7或大于1∶10。
[0090]“病毒载体的转基因”或“转基因”等是指使用病毒载体转运到细胞中的核酸物质,并且优选在一些实施方案中,一旦在细胞中,其被表达以分别产生蛋白质或核酸分子,例如用于如本文中所述的治疗应用。“表达的”或“表达”等是指在转基因转导入细胞并由转导细胞加工之后,合成功能性(即,对于期望目的具有生理活性)基因产物。这样的基因产物在本文中也称为“转基因表达产物”。因此,表达的产物是由转基因编码的所得蛋白质或核酸,例如反义寡核苷酸或治疗性rna。
[0091]“病毒载体”意指基于病毒的递送系统,其可将或将有效负载(例如核酸)递送至细胞。通常来说,该术语是指具有病毒组分(例如衣壳和/或包被蛋白)的病毒载体构建体,其可包含或的确还包含有效负载(并且已经如此适应)。在一些实施方案中,有效负载编码转基因。在一些实施方案中,转基因是编码本文中提供的蛋白质(例如治疗性蛋白质、dna结合蛋白质或内切核酸酶)的转基因。在另一些实施方案中,转基因编码指导rna、反义核酸、snrna、rnai分子(例如,dsrna或ssrna)、mirna或三链体形成寡核苷酸(triplex-forming oligonucleotide,tfo)等。在另一些实施方案中,有效负载是核酸,其本身是治疗剂,并且
不需要表达所递送的核酸。例如,核酸可以是sirna,例如合成的sirna。
[0092]
在一些实施方案中,有效负载还可编码其他组分,例如末端反向重复(inverted terminal repeat,itr)、标志物等。有效负载还可包含表达控制序列。表达控制dna序列包括启动子、增强子和操纵子,并且一般基于其中利用表达构建体的表达系统进行选择。在一些实施方案中,选择启动子和增强子序列用于提高基因表达的能力,同时可选择操纵子序列用于调节基因表达的能力。在一些实施方案中,有效负载还可包含有利于并优选促进宿主细胞中的同源重组的序列。
[0093]
示例性表达控制序列包括启动子序列,例如巨细胞病毒启动子;劳斯肉瘤病毒启动子;和猿猴病毒40启动子;以及在本文中其他地方公开或本领域中已知的任何其他类型的启动子。通常来说,启动子有效地连接编码期望的表达产物的序列的上游(即5’)。有效负载还可包含可操作地连接编码序列的下游(即3’)的合适的多腺苷酸化序列(例如,sv40或人生长激素基因多腺苷酸化序列)。
[0094]
通常来说,将病毒载体改造以能够将一种或更多种期望核酸转导入细胞。此外,应理解,对于本文中提供的治疗应用,病毒载体优选是复制缺陷型的。病毒载体可基于但不限于:逆转录病毒(例如,鼠逆转录病毒、禽逆转录病毒、莫洛尼鼠白血病病毒(momulv)、哈维鼠肉瘤病毒(hamusv)、鼠乳腺肿瘤病毒(mumtv)、长臂猿白血病病毒(galv)和劳斯肉瘤病毒(rous sarcoma virus,rsv))、慢病毒、疱疹病毒、腺病毒、腺相关病毒、甲病毒等。另一些实例在本文中其他地方提供或是本领域中已知的。病毒载体可基于病毒的天然变体、毒株或血清型,例如本文中所提供的那些的任一种。病毒载体也可基于通过分子进化选择的病毒(参见,例如,j.t.koerber et al,mol.ther.17(12):2088-2095和美国专利号6,09,548)。病毒载体可基于但不限于腺相关病毒(aav),例如aav8或aav2。病毒载体还可以基于anc80。因此,本文中提供的aav载体或anc80载体分别是基于aav或anc80的病毒载体,并且具有病毒组分(例如衣壳和/或包被蛋白),因此其可包装用于递送核酸物质。aav载体的另一些实例包括但不限于:基于aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、rh10、rh74或aav-2i8或其变体的那些。病毒载体还可以是经改造的的载体、重组载体、突变体载体或杂交体载体。产生这样的载体的方法对于本领域普通技术人员而言是明显的。在一些实施方案中,病毒载体是“嵌合病毒载体”。在这样的一些实施方案中,这意味着病毒载体由源自多于一种病毒或病毒载体的病毒组分构成。参见,例如,pct公开wo01/091802和wo14/168953,以及美国专利号6,468,771。这样的病毒载体可以是,例如,aav8/anc80或aav2/anc80病毒载体。
[0095]
另外的病毒载体元件可顺式或反式地起作用。在一些实施方案中,病毒载体包含:载体基因组,其还包含靶(供体)序列的5’或3’端侧翼的一个或更多个末端反向重复序列(itr);促进转录的表达控制元件(例如,启动子或增强子);内含子序列;填充(stuffer)/填充(filler)多核苷酸序列(通常,惰性序列);和/或位于靶(供体)序列的3’端的poly(a)序列。
[0096]
c.用于本发明方法的组合物
[0097]
重要的是,本文中提供的方法和组合物提供了将病毒载体施用于针对病毒载体的病毒抗原具有预先存在的免疫力的对象和/或通过施用病毒载体的改善的作用。因此,本文中提供的方法和组合物可用于用病毒载体治疗对象,包括具有母源转移的抗体的新生儿和
本应由于预先存在的免疫力水平而将被排除在用病毒载体进行的治疗之外的对象。这样的病毒载体可用于递送核酸用于多种目的,包括用于基因治疗等。如上所述,针对病毒载体的预先存在的免疫力可不利地影响其效力并且还可干扰其的再施用。重要的是,已经发现本文中提供的方法和组合物通过实现改善的转基因表达和/或降低针对病毒载体的免疫应答克服了前述障碍。本发明人已令人惊讶地发现,与病毒载体混合的包含免疫抑制剂的合成纳米载体可在对象中实现改善的转基因表达,例如在针对病毒载体具有预先存在的免疫力的对象中,例如在病毒载体先前未曾施用于对象的情况下。另外,还令人惊讶地发现,虽然包含免疫抑制剂的合成纳米载体与病毒载体的这样的混合施用在病毒载体的第一次施用时在对象中实现了改善的转基因表达,但混合对于包含免疫抑制剂的合成纳米载体与病毒载体的后续施用的效力不是必需的。此外,已经发现更高剂量的包含免疫抑制剂的合成纳米载体也可允许治疗具有预先存在的免疫力的对象。
[0098]
同样如上所述,已经发现包含免疫抑制剂的合成纳米载体与病毒载体的混合施用可用于实现病毒载体的剂量降低而不降低转基因表达。
[0099]
转基因
[0100]
病毒载体的有效负载可以是转基因。例如,转基因可编码期望的表达产物,例如多肽、蛋白质、蛋白质混合物、dna、cdna、功能性rna分子(例如rnai、mirna)、mrna、rna复制子或其他目的产物。
[0101]
例如,转基因的表达产物可以是对对象(例如患有疾病或病症的对象)有益的蛋白质或其部分。蛋白质可以是胞外、胞内或膜结合蛋白质。例如,转基因可编码酶、血液衍生物、激素、淋巴因子(例如白介素和干扰素)、促凝剂、生长因子、神经递质、肿瘤抑制剂、载脂蛋白、抗原和抗体。对象可患有或怀疑患有疾病或病症,其中对象的内源性形式的蛋白质有缺陷或以有限量产生或完全不产生。在所提供的任一种方法或组合物的另一些实施方案中,转基因的表达产物可以是对对象有益的基因或其部分。
[0102]
治疗性蛋白质的一些实例包括但不限于:可输注或可注射的治疗性蛋白质、酶、酶辅因子、激素、血液或凝血因子、细胞因子和干扰素、生长因子、脂肪因子等。
[0103]
可输注或可注射的治疗性蛋白质的一些实例包括:例如,托珠单抗(roche/)、α-1抗胰蛋白酶(kamada/aat)、(affymax和takeda,合成肽)、白蛋白干扰素α-2b(novartis/zalbin
tm
)、(pharming group,c1抑制剂替代治疗)、替莫瑞林(tesamorelin)(theratechnologies/egrifta,合成生长激素释放因子)、奥瑞珠单抗(ocrelizumab)(genentech,roche和biogen)、贝利尤单抗(belimumab)(glaxosmithkline/)、培戈洛酶(pegloticase)(savient pharmaceuticals/krystexxa
tm
)、他利苷酶α(taliglucerase α)(protalix/uplyso)、阿加糖酶α(shire/)和维拉苷酶α(shire)。
[0104]
酶的一些实例包括溶菌酶、氧化还原酶、转移酶、水解酶、裂解酶、异构酶、天冬酰胺酶、尿酸酶、糖苷酶、蛋白酶、核酸酶、胶原酶、透明质酸酶、肝素酶、类肝素酶、激酶、磷酸酶、溶素和连接酶。酶的另一些实例包括用于酶替代治疗的那些,包括但不限于:伊米苷酶(imiglucerase)(例如,cerezyme
tm
)、α-半乳糖苷酶a(α-gal a)(例如,阿加糖酶β,
factor-9,gdf9)、肝细胞生长因子(hepatocyte growth factor,hgf)、肝癌源性生长因子(hepatoma-derived growth factor,hdgf)、胰岛素样生长因子(insulin-like growth factor,igf)、迁移刺激因子、肌生成抑制蛋白(gdf-8)、神经生长因子(nerve growth factor,ngf)以及其他神经营养因子、血小板源性生长因子(platelet-derived growth factor,pdgf)、血小板生成素(thrombopoietin,tpo)、转化生长因子α(transforming growth factor alpha,tgf-α)、转化生长因子β(transforming growth factor beta,tgf-β)、肿瘤坏死因子-α(tumour necrosis factor-alpha,tnf-α)、血管内皮生长因子(vascular endothelial growth factor,vegf)、wnt信号传导途径、胎盘生长因子(placental growth factor,plgf)、[(胎牛促生长素)](foetal bovine somatotrophin,fbs)、il-1、il-2、il-3、il-4、il-5、il-6和il-7。
[0109]
脂肪因子的一些实例包括瘦素和脂连蛋白。
[0110]
治疗性蛋白质的一些另外的实例包括但不限于:受体、信号传导蛋白、细胞骨架蛋白、支架蛋白、转录因子、结构蛋白、膜蛋白、胞质蛋白、结合蛋白、核蛋白、分泌蛋白、高尔基蛋白、内质网蛋白、线粒体蛋白和囊泡蛋白等。
[0111]
转基因可以是编码酶以治疗以下疾病的转基因:代谢性肝病,例如非酒精性脂肪性肝病(nonalcoholic fatty liver disease,nafld)和非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,nash);或者遗传性代谢紊乱,例如阿拉日耶综合征(alagille syndrome)、α-1抗胰蛋白酶缺乏症、克里格勒-纳贾尔综合征(crigler-najjar syndrome)、半乳糖血症、戈谢病(gaucher disease)、吉尔伯特综合征(gilbert syndrome)、血色素沉着病、溶酶体酸性脂肪酶缺乏症(lysosomal acid lipase deficiency,lal-d)、有机酸血症、瑞氏综合征(reye syndrome)、i型糖原贮积病、尿素循环障碍和威尔逊病(wilson’s disease)。在本文中提供的任一种方法的一个实施方案中,对象是患有前述任一种的对象。例如,对象可以是患有有机酸血症,例如甲基丙二酸血症(methylmalonic acidemia,mma)或尿素循环障碍(例如鸟氨酸氨甲酰酶缺乏症)的对象。因此,在一些实施方案中,转基因编码甲基丙二酰辅酶a变位酶(methylmalonoyl-coa mutase,mut)或鸟氨酸转氨甲酰酶(ornithine transcarbamylase,otc)。
[0112]
在所提供的任一种方法或组合物的一个实施方案中,表达产物可用于破坏、校正/修复或替换靶基因或靶基因的一部分。例如,成簇规律间隔短回文重复序列/cas(crispr/cas)系统可用于精确的基因组编辑。在该系统中,可通过指导rna(短rna)编程单个crispr相关核酸酶(cas核酸酶)以识别包含含有短碱基序列重复的dna基因座的特定dna靶标。每个crispr基因座侧翼为源自病毒基因组物质的间隔区dna的短片段。在最常见的系统ii型crispr系统中,间隔区dna与反式激活rna(tracrna)杂交,在那里其被加工成crispr-rna(crrna),然后与cas核酸酶缔合,形成启动rnase iii加工并导致外来dna降解的复合物。靶序列优选在其3’端包含前间区序列邻近基序(protospacer adjacent motif,pam)序列以被识别。该系统可以以多种方式修饰,例如合成的指导rna可与crispr载体融合,并且多种不同的指导rna结构和元件是可能的(包括发夹和支架序列)。
[0113]
在所提供的任一种方法或组合物的一些实施方案中,转基因序列可以编码crispr/cas系统的任何一种或更多种组分,例如报道序列,其在表达时产生可检测的信号。这样的报道序列的一些实例包括但不限于:β-内酰胺酶、β-半乳糖苷酶(lacz)、碱性磷酸
酶、胸苷激酶、绿色荧光蛋白(green fluorescent protein,gfp)、氯霉素乙酰转移酶(chloramphenicol acetyltransferase,cat)、萤光素酶、膜结合蛋白(包括例如cd2、cd4、cd8)和流感血凝素蛋白。其他报道分子是本领域普通技术人员已知的。
[0114]
在所提供的任一种方法或组合物的另一个实例中,转基因可编码rna产物,例如trna、dsrna、核糖体rna、催化性rna、sirna、rnai、mirna、小发夹rna(shrna)、反式剪接rna和反义rna。例如,可产生特定的rna序列以抑制或消除对象中靶向的核酸序列的表达。合适的靶序列包括例如肿瘤靶标和病毒疾病。
[0115]
在所提供的任一种方法或组合物的一些实施方案中,转基因序列可编码在表达时产生可检测信号的报道序列,或者转基因序列可编码可用于产生疾病动物模型的蛋白质或功能性rna。在所提供的任一种方法或组合物的另一个实例中,转基因编码旨在用于研究目的的蛋白质或功能性rna,例如旨在产生携带转基因的体细胞转基因动物模型,例如以研究转基因产物的功能。在所提供的任一种方法或组合物的另一些实施方案中,这样的表达产物旨在用于治疗。转基因的其他用途对于本领域普通技术人员而言是明显的。
[0116]
转基因的序列还可包含表达控制序列。表达控制序列包括启动子、增强子和操纵子,并且一般基于其中利用表达构建体的表达系统进行选择。在所提供的任一种方法或组合物的一些实施方案中,选择启动子和增强子序列用于提高基因表达的能力,同时可选择操纵子序列用于调节基因表达的能力。通常来说,启动子序列位于编码期望的表达产物的核酸序列的上游(即5’),并且与邻近序列有效地连接,从而相比于没有启动子的表达的量提高表达的期望产物的量。通常位于启动子序列上游的增强子序列可进一步提高期望产物的表达。在所提供的任一种方法或组合物的一些实施方案中,增强子序列可位于启动子的下游和/或转基因内。转基因还可包含有利于并优选促进宿主细胞中的同源重组和/或包装的序列。转基因还可包含在宿主细胞中复制所必需的序列。
[0117]
示例性表达控制序列包括肝特异性启动子序列和组成型启动子序列,例如本文中可提供的任何序列。另一些组织特异性启动子包括眼、视网膜、中枢神经系统、脊髓等。普遍存在或混杂启动子和增强子的一些实例包括但不限于:巨细胞病毒(cytomegalovirus,cmv)立即早期启动子/增强子序列、劳斯肉瘤病毒(rsv)启动子/增强子序列、以及在多种哺乳动物细胞类型中有活性的其他病毒启动子/增强子、或在自然界中不存在的合成元件(参见,例如,boshart et al,cell,41:521-530(1985))、sv40启动子、二氢叶酸还原酶(dihydrofolate reductase,dhfr)启动子、胞质β-肌动蛋白启动子和磷酸甘油激酶(phosphoglycerol kinase,pgk)启动子。
[0118]
操纵子,或可调节元件,响应于信号或刺激,这可提高或降低可操作连接的核酸的表达。诱导型元件是响应于信号或刺激而提高可操作连接的核酸的表达的那些,例如激素诱导型启动子。抑制型元件是响应于信号或刺激而降低可操作连接的核酸的表达的那些。通常来说,抑制型和诱导型元件按比例地响应于存在的信号或刺激的量。在所提供的任一种方法或组合物中转基因可包含这样的序列。
[0119]
转基因还可包含可操作地连接编码序列的下游(即3’)的合适的多腺苷酸化序列。
[0120]
递送转基因(例如用于基因治疗)的方法是本领域中已知的(参见,例如,smith.int.j.med.sci.1(2):76-91(2004);phillips.methods in enzymology:gene therapy methods.vol.346.academic press(2002))。本文中所述的任一种转基因可使用
本领域中已知的方法并入本文中所述的任一种病毒载体中,参见,例如美国专利号7,629,153。
[0121]
病毒载体
[0122]
病毒已经进化出了专门的机制以将它们的基因组转运到它们所感染的细胞内;基于这样的病毒的病毒载体可定制以转导用于特定应用的细胞。可如本文中提供的使用的病毒载体的实例是本领域中已知的或在本文中所述的。合适的病毒载体包括例如:逆转录病毒载体、慢病毒载体、基于单纯疱疹病毒(herpes simplex virus,hsv)的载体、基于腺病毒的载体、基于腺相关病毒(aav)的载体和aav-腺病毒嵌合载体。
[0123]
本文中提供的病毒载体可基于逆转录病毒。逆转录病毒是单链正义rna病毒。可操作逆转录病毒载体以使病毒不能复制。因此,认为逆转录病毒载体特别可用于体内稳定的基因转移。逆转录病毒载体的一些实例可见于例如美国公开号20120009161、20090118212和20090017543,病毒载体及其制备方法通过引用整体并入本文。
[0124]
慢病毒载体是可用于产生本文中提供的病毒载体的逆转录病毒载体的实例。慢病毒的一些实例包括:hiv(人)、猿猴免疫缺陷病毒(simian immunodeficiency virus,siv)、猫免疫缺陷病毒(feline immunodeficiency virus,fiv)、马感染性贫血病毒(equine infectious anemia virus,eiav)和绵羊髓鞘脱落病毒(visna virus)(绵羊慢病毒)。慢病毒载体的一些实例可见于例如美国公开号20150224209、20150203870、20140335607、20140248306、20090148936和20080254008,病毒载体及其制备方法通过引用整体并入本文。
[0125]
基于单纯疱疹病毒的病毒载体也适合于本文中提供的用途。许多复制缺陷型hsv载体包含缺失,以去除一个或更多个立即早期基因以阻止复制。对于基于hsv的载体的描述,参见例如美国专利号5,837,532、5,846,782、5,849,572和5,804,413,以及国际专利申请wo 91/02788、wo 96/04394、wo 98/15637和wo 99/06583,其对病毒载体及其制备方法的描述通过引用整体并入。
[0126]
病毒载体可基于腺病毒。病毒载体可基于的腺病毒可来自任何来源、任何亚组、任何亚型、亚型混合物或任何血清型。例如,腺病毒可以是亚组a(例如,血清型12、18和31)、亚组b(例如,血清型3、7、11、14、16、21、34、35和50)、亚组c(例如,血清型1、2、5和6)、亚组d(例如,血清型8、9、10、13、15、17、19、20、22至30、32、33、36至39和42至48)、亚组e(例如,血清型4)、亚组f(例如,血清型40和41)、未分类的血清组(例如,血清型49和51)或任何其他腺病毒血清型。腺病毒血清型1至51可从美国典型培养物保藏中心(american type culture collection)(atcc,manassas,va.)获得。非组c腺病毒以及甚至非人腺病毒可用于制备复制缺陷型腺病毒载体。非组c腺病毒载体、产生非组c腺病毒载体的方法和使用非组c腺病毒载体的方法公开于例如,美国专利号5,801,030、5,837,511和5,849,561,以及国际专利申请wo 97/12986和wo 98/53087。任何腺病毒、甚至嵌合腺病毒可用作腺病毒载体的病毒基因组的来源。例如,人腺病毒可用作复制缺陷型腺病毒载体的病毒基因组的来源。腺病毒载体的另一些实例可见于美国公开号20150093831、20140248305、20120283318、20100008889、20090175897和20090088398,其对病毒载体及其制备方法的描述通过引用整体并入。
[0127]
本文中提供的病毒载体也可基于腺相关病毒(aav)。aav载体对于用于治疗应用
(例如本文所述的那些)特别令人感兴趣。对于基于aav的载体的描述,参见例如美国专利号8,679,837、8,637,255、8,409,842、7,803,622和7,790,449,以及美国公开号20150065562、20140155469、20140037585、20130096182、20120100606和20070036757。aav载体可以是重组aav载体。aav载体还可以是自互补(self-complementary,sc)aav载体,其描述于例如美国专利公开2007/01110724和2004/0029106,以及美国专利号7,465,583和7,186,699中,其中病毒载体及其制备方法通过引用整体并入。
[0128]
病毒载体可基于的腺相关病毒可以是任何血清型或血清型混合物。aav血清型包括aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10和aav11。例如,当病毒载体基于血清型的混合物时,病毒载体可包含取自一种aav血清型(例如选自aav血清型1、2、3、4、5、6、7、8、9、10和11中的任一种)的衣壳信号序列和来自不同血清型(例如选自aav血清型1、2、3、4、5、6、7、8、9、10和11中的任一种)的包装序列。因此,在本文中提供的任一种方法或组合物的一些实施方案中,aav载体是基于aav 2/8的载体。在本文中提供的任一种方法或组合物的另一些实施方案中,aav载体是基于aav 2/5的载体。
[0129]
在所提供的任一种方法或组合物的一些实施方案中,病毒载体所基于的病毒可以是合成的,例如anc80。
[0130]
在所提供的任一种方法或组合物的一些实施方案中,病毒载体是aav/anc80载体,例如aav8/anc80载体或aav2/anc80载体。
[0131]
载体可基于的另一些病毒包括:aav1、aav3、aav4、aav5、aav6、aav7、aav9、aav10、aav11、rh10、rh74或aav-2i8,以及其变体。
[0132]
本文中提供的病毒载体也可基于甲病毒。甲病毒包括:辛德毕斯(sindbis)(和veev)病毒、奥拉病毒(aura virus)、巴班肯病毒(babanki virus)、巴马森林病毒(barmah forest virus)、贝巴鲁病毒(bebaru virus)、卡巴斯欧病毒(cabassou virus)、基孔肯雅病毒(chikungunya virus)、东部马脑炎病毒(eastern equine encephalitis virus)、沼泽地病毒(everglades virus)、摩根堡病毒(fort morgan virus)、盖塔病毒(getah virus)、高地j病毒(highlands j virus)、孜拉加奇病毒(kyzylagach virus)、马亚罗病毒病毒(mayaro virus)、me tri病毒(me tri virus)、米德尔堡病毒(middelburg virus)、莫斯达斯佩德拉斯病毒(mosso das pedras virus)、穆坎布病毒(mucambo virus)、恩杜穆病毒(ndumu virus)、奥尼永尼永病毒(o
′
nyong-nyong virus)、那皮舒纳病毒(pixuna virus)、里奥内格罗病毒(rio negro virus)、罗斯河病毒(ross river virus)、鲑鱼胰腺病病毒(salmon pancreas disease virus)、塞姆利基森林病毒(semliki forest virus)、南方象海豹病毒(southern elephant seal virus)、图那特病毒(tonate virus)、特罗卡拉病毒(trocara virus)、乌纳病毒(una virus)、委内瑞拉马脑炎病毒(venezuelan equine encephalitis virus)、西部马脑炎病毒(western equine encephalitis virus)和瓦塔罗阿病毒(whataroa virus)。甲病毒载体的一些实例可见于美国公开号20150050243、20090305344和20060177819;载体及其制备方法通过引用整体并入本文。
[0133]
本文中提供的任一种病毒载体可用于本文中提供的任一种方法。
[0134]
免疫抑制剂
[0135]
免疫抑制剂包括但不限于:他汀类;mtor抑制剂,例如雷帕霉素或雷帕霉素类似物;tgf-β信号传导剂;tgf-β受体激动剂;组蛋白脱乙酰酶(histone deacetylase,hdac)抑
制剂;皮质类固醇;线粒体功能抑制剂,例如鱼藤酮;p38抑制剂;nf-κb抑制剂;腺苷受体激动剂;前列腺素e2激动剂;磷酸二酯酶抑制剂,例如磷酸二酯酶4抑制剂;蛋白酶体抑制剂;激酶抑制剂;g蛋白偶联受体激动剂;g蛋白偶联受体拮抗剂;糖皮质激素;类视黄醇;细胞因子抑制剂;细胞因子受体抑制剂;细胞因子受体激活剂;过氧化物酶体增殖物激活受体拮抗剂;过氧化物酶体增殖物激活受体激动剂;组蛋白脱乙酰酶抑制剂;钙调磷酸酶抑制剂;磷酸酶抑制剂和氧化的atp。免疫抑制剂还包括:ido、维生素d3、环孢素a、芳烃受体抑制剂、白藜芦醇、硫唑嘌呤、6-巯基嘌呤、阿司匹林、尼氟酸、雌三醇、雷公藤甲素(tripolide)、白介素(例如il-1、il-10)、环孢素a、靶向细胞因子或细胞因子受体的sirna等。
[0136]
他汀类的一些实例包括:阿托伐他汀(atorvastatin)(他汀类的一些实例包括:阿托伐他汀(atorvastatin)()、西立伐他汀(cerivastatin)、氟伐他汀(fluvastatin)()、西立伐他汀(cerivastatin)、氟伐他汀(fluvastatin)(xl)、洛伐他汀(lovastatin)(xl)、洛伐他汀(lovastatin)()、美伐他汀(mevastatin)匹伐他汀(pitavastatin)瑞舒伐他汀(rosuvastatin)瑞舒伐他汀和辛伐他汀(simvastatin)
[0137]
mtor抑制剂的一些实例包括:雷帕霉素及其类似物(例如,ccl-779、rad001、ap23573、c20-甲代烯丙基雷帕霉素(c20-marap)、c16-(s)-丁基磺酰氨基雷帕霉素(c16-bsrap)、c16-(s)-3-甲基吲哚雷帕霉素(c16-irap)(bayle et al.chemistry&biology 2006,13:99-107))、azd8055、bez235(nvp-bez235)、大黄根酸(大黄酚)、地磷莫司(mk-8669)、依维莫司(rad0001)、ku-0063794、pi-103、pp242、替西罗莫司、和wye-354(可从selleck,houston,tx,usa获得)。
[0138]
tgf-β信号传导剂的一些实例包括:tgf-β配体(例如激活素a、gdf1、gdf11、骨形态发生蛋白、nodal、tgf-β)及其受体(例如acvr1b、acvr1c、acvr2a、acvr2b、bmpr2、bmpr1a、bmpr1b、tgfβri、tgfβrii)、r-smads/co-smads(例如,smad1、smad2、smad3、smad4、smad5、smad8)和配体抑制剂(例如卵泡抑素、头蛋白(noggin)、脊索素(chordin)、dan、lefty、ltbp1、thbs1、饰胶蛋白聚糖(decorin))。
[0139]
线粒体功能抑制剂的一些实例包括:苍术苷(atractyloside)(二钾盐)、豆氨酸(bongkrekic acid)(三铵盐)、羰基氰化物间氯苯腙(carbonyl cyanide m-chlorophenylhydrazone)、羧基苍术苷(carboxyatractyloside)(例如来自胶苍术(atractylis gummifera))、cgp-37157、(-)-鱼藤素(例如来自绢毛萌豆(mundulea sericea))、f16、己糖激酶ii vdac结合结构域肽、寡霉素、鱼藤酮、ru360、sfk1和缬氨霉素(例如来自灰色链霉菌(streptomyces fulvissimus))(emd4biosciences,usa)。
[0140]
p38抑制剂的一些实例包括:sb-203580(4-(4-氟苯基)-2-(4-甲基亚磺酰基苯基)-5-(4-吡啶基)1h-咪唑)、sb-239063(反式-1-(4-羟基环己基)-4-(氟苯基)-5-(2-甲氧基-嘧啶-4-基)咪唑)、sb-220025(5-(2氨基-4-嘧啶基)-4-(4-氟苯基)-1-(4-哌啶基)咪唑)和arry-797。
[0141]
nf(例如nk-κβ)抑制剂的一些实例包括:ifrd1、2-(1,8-萘啶-2-基)-苯酚、5-氨基水杨酸、bay 11-7082、bay 11-7085、cape(咖啡酸苯乙酯)、马来酸二乙酯、ikk-2抑制剂iv、imd0354、乳胞素、mg-132[z-leu-leu-leu-cho]、nfκb激活抑制剂iii、nf-κb激活抑制剂ii、jsh-23、小白菊内酯(parthenolide)、苯基胂氧化物(pao)、ppm-18、吡咯烷二硫代氨基甲酸铵盐、qnz、ro 106-9920、楝酰胺(rocaglamide)、楝酰胺al、楝酰胺c、楝酰胺i、楝酰胺j、洛克米兰醇(rocaglaol)、(r)-mg-132、水杨酸钠、雷公藤内酯(pg490)和蟛蜞菊内酯(vedelolactone)。
[0142]
腺苷受体激动剂的一些实例包括cgs-21680和atl-146e。
[0143]
前列腺素e2激动剂的一些实例包括e-前列腺素2和e-前列腺素4。
[0144]
磷酸二酯酶抑制剂(非选择性和选择性抑制剂)的一些实例包括:咖啡因、氨茶碱、ibmx(3-异丁基-1-甲基黄嘌呤)、副黄嘌呤、己酮可可碱、可可碱、茶碱、甲基化黄嘌呤、长春西汀、ehna(赤式-9-(2-羟基-3-壬基)腺嘌呤)、阿那格雷(anagrelide)、依诺昔酮(enoximone)(perfan
tm
)、米力农(milrinone)、左西孟旦(levosimendon)、松叶菊碱(mesembrine)、异丁司特(ibudilast)、吡拉米特(piclamilast)、木犀草素(luteolin)、屈他维林(drotaverine)、罗氟司特(roflumilast)(daxas
tm
,daliresp
tm
)、西地那非(sildenafil)他达那非(tadalafil)伐地那非(vardenafil)乌地那非(udenafil)、阿伐那非(avanafil)、淫羊藿苷(icariin)、4-甲基哌嗪和吡唑并嘧啶-7-1。
[0145]
蛋白酶体抑制剂的一些实例包括:硼替佐米(bortezomib)、双硫仑(disulfiram)、表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallate)和盐孢菌酰胺a(salinosporamide a)。
[0146]
激酶抑制剂的一些实例包括:贝伐单抗(bevacizumab)、bibw 2992、西妥昔单抗(cetuximab)伊马替尼(imatinib)曲妥珠单抗(trastuzumab)吉非替尼(gefitinib)雷珠单抗(ranibizumab)哌加他尼(pegaptanib)、索拉非尼(sorafenib)、达沙替尼(dasatinib)、舒尼替尼(sunitinib)、埃罗替尼(erlotinib)、尼罗替尼(nilotinib)、拉帕替尼(lapatinib)、帕尼单抗(panitumumab)、凡德他尼(vandetanib)、e7080、帕唑帕尼(pazopanib)和木利替尼(mubritinib)。
[0147]
糖皮质激素的一些实例包括:氢化可的松(皮质醇)、醋酸可的松、泼尼松、泼尼松龙、甲基泼尼松龙、地塞米松、倍他米松、曲安西龙、倍氯米松、醋酸氟氢可的松、醋酸去氧皮质酮(doca)和醛固酮。
[0148]
类视黄醇的一些实例包括:视黄醇、视黄醛、维a酸(视黄酸,)、异维a酸酸阿利维a酸依曲替酯(etretinate)(tegison
tm
)及其代谢物阿曲汀
他扎罗汀(tazarotene)贝沙罗汀(bexarotene)和阿达帕林(adapalene)
[0149]
细胞因子抑制剂的一些实例包括:il1ra、il1受体拮抗剂、igfbp、tnf-bf、尿调节素(uromodulin)、α-2-巨球蛋白、环孢素a、喷他脒(pentamidine)和己酮可可碱
[0150]
过氧化物酶体增殖物激活受体拮抗剂的一些实例包括:gw9662、pparγ拮抗剂iii、g335和t0070907(emd4biosciences,usa)。
[0151]
过氧化物酶体增殖物激活受体激动剂的一些实例包括:吡格列酮(pioglitazone)、环格列酮(ciglitazone)、氯贝特(clofibrate)、gw1929、gw7647、l-165,041、ly 171883、pparγ激活剂、fmoc-leu、曲格列酮(troglitazone)和wy-14643(emd4biosciences,usa)。
[0152]
组蛋白脱乙酰酶抑制剂的一些实例包括:异羟肟酸(或异羟肟酸盐)例如曲古柳菌素a、环状四肽(cyclic tetrapeptide)(例如trapoxin b)和缩酚酸肽(depsipeptide),苯甲酰胺,亲电酮(electrophilic ketone),脂肪酸化合物例如丁酸苯酯和丙戊酸,异羟肟酸例如伏立诺他(vorinostat)(saha)、贝利司他(belinostat)(pxd101)、laq824和潘比司他(panobinostat)(lbh589),苯甲酰胺例如恩替诺特(entinostat)(ms-275)、ci994和莫西司他(mgcd0103),烟酰胺,nad的衍生物,二氢香豆素,萘并吡喃酮和2-羟基萘醛。
[0153]
钙调磷酸酶抑制剂的一些实例包括:环孢素、吡美莫司(pimecrolimus)、伏环孢素(voclosporin)和他克莫司(tacrolimus)。
[0154]
磷酸酶抑制剂的一些实例包括:bn82002盐酸盐、cp-91149、花萼海绵诱癌素a(calyculin a)、斑蝥酸(cantharidic acid)、斑蝥素(cantharidin)、氯氰菊酯(cypermethrin)、乙基-3,4-脱质抑素(ethyl-3,4-dephostatin)、福司曲星钠盐(fostriecin sodium salt)、maz51、甲基-3,4-脱质抑素(methyl-3,4-dephostain)、nsc 95397、去甲斑蝥素(norcantharidin)、来自东海原甲藻(prorocentrum concavum)的冈田酸(okadaic acid)铵盐、冈田酸、冈田酸钾盐、冈田酸钠盐、苯基胂氧化物、多种磷酸酶抑制剂混合物、蛋白磷酸酶1c、蛋白磷酸酶2a抑制蛋白、蛋白磷酸酶2a1、蛋白磷酸酶2a2和原钒酸钠。
[0155]
合成纳米载体
[0156]
本文中提供的方法包括施用包含免疫抑制剂的合成纳米载体。通常来说,免疫抑制剂是除构成合成纳米载体结构的物质之外的要素。例如,在所提供的任一种方法或组合物的一个实施方案中,其中合成纳米载体由一种或更多种聚合物构成,免疫抑制剂是除了所述一种或更多种以外的化合物,并且在所提供的任一种方法或组合物的一些实施方案中,其与所述一种或更多种聚合物连接。在其中合成纳米载体的物质也导致致耐受性作用的一些实施方案中,免疫抑制剂是除导致致耐受性作用的合成纳米载体物质之外还存在的要素。
[0157]
根据本发明可使用广泛多种的合成纳米载体。在一些实施方案中,合成纳米载体
是球体或球状体。在一些实施方案中,合成纳米载体是平的或片状的。在一些实施方案中,合成纳米载体是立方体或立方体的。在一些实施方案中,合成纳米载体是卵形体或椭圆形体。在一些实施方案中,合成纳米载体是圆柱体、锥体或棱锥形体。
[0158]
在一些实施方案中,期望使用在大小或形状方面相对均匀的合成纳米载体群体,使得每个合成纳米载体具有相似的特性。例如,基于合成纳米载体的总数,所提供的任一种组合物或方法的合成纳米载体的至少80%、至少90%或至少95%的最小尺寸或最大尺寸落在合成纳米载体的平均直径或平均尺寸的5%、10%或20%内。
[0159]
合成纳米载体可以是实心的或中空的,并且可包含一个或更多个层。在一些实施方案中,每个层相对于另外的层具有独特的组成和独特的特性。仅给出一个实例,合成纳米载体可具有核/壳结构,其中核是一个层(例如聚合物核),并且壳是第二层(例如脂质双层或单层)。合成纳米载体可包含多个不同的层。
[0160]
在一些实施方案中,合成纳米载体可任选地包含一种或更多种脂质。在一些实施方案中,合成纳米载体可包含脂质体。在一些实施方案中,合成纳米载体可包含脂质双层。在一些实施方案中,合成纳米载体可包含脂质单层。在一些实施方案中,合成纳米载体可包含胶束。在一些实施方案中,合成纳米载体可包含由脂质层(例如脂质双层、脂质单层等)包围的包含聚合物基质的核。在一些实施方案中,合成纳米载体可包含由脂质层(例如,脂质双层、脂质单层等)包围的非聚合物的核(例如,金属颗粒、量子点、陶瓷颗粒、骨颗粒、病毒颗粒、蛋白质、核酸、碳水化合物等)。
[0161]
在另一些实施方案中,合成纳米载体可包含金属颗粒、量子点、陶瓷颗粒等。在一些实施方案中,非聚合物合成纳米载体是非聚合物组分的聚集体,例如金属原子(例如金原子)的聚集体。
[0162]
在一些实施方案中,合成纳米载体可任选地包含一种或更多种两亲性实体。在一些实施方案中,两亲性实体可促进具有提高的稳定性、改善的均一性或提高的黏度的合成纳米载体的产生。在一些实施方案中,两亲性实体可与脂质膜(例如,脂质双层、脂质单层等)的内表面缔合。本领域中已知的许多两亲性实体适合用于制备根据本发明的合成纳米载体。这样的两亲性实体包括但不限于:磷酸甘油酯;磷脂酰胆碱;二棕榈酰磷脂酰胆碱(dppc);二油基磷脂酰乙醇胺(dope);二油基丙基三乙基铵(dotma);二油酰磷脂酰胆碱;胆固醇;胆固醇酯;二酰基甘油;琥珀酸二酰基甘油酯;二磷脂酰甘油(dppg);己烷癸醇;脂肪醇例如聚乙二醇(peg);聚氧乙烯-9-月桂醚;表面活性脂肪酸,例如棕榈酸或油酸;脂肪酸;脂肪酸单甘油酯;脂肪酸甘油二酯;脂肪酸酰胺;脱水山梨糖醇三油酸酯(85)甘胆酸盐;脱水山梨糖醇单月桂酸酯(20);聚山梨酯20(20);聚山梨酯60(60);聚山梨酯65(65);聚山梨酯80(80);聚山梨酯85(85);聚氧乙烯单硬脂酸酯;表面活性素;泊洛沙姆;脱水山梨糖醇脂肪酸酯,例如脱水山梨醇三油酸酯;卵磷脂;溶血卵磷脂;磷脂酰丝氨酸;磷脂酰肌醇;鞘磷脂;磷脂酰乙醇胺(脑磷脂);心磷脂;磷脂酸;脑苷脂;磷酸二鲸蜡酯;二棕榈酰磷脂酰甘油;硬脂胺;十二烷基胺;十六烷基胺;乙酰棕榈酸酯;甘油蓖麻油酸酯;硬脂酸十六烷基酯;豆蔻酸异丙酯;泰洛沙泊;聚(乙二醇)5000-磷脂酰乙醇胺;聚(乙二醇)400单硬脂酸酯;磷脂;具有高表面活性剂性质的合成和/或天然洗涤剂;脱氧胆酸盐;环糊精;离液盐;离子配对剂;及其组合。两亲性实体组分可以是不同的两亲性实体的混合物。本领域技术人员将认识到,这是具有
表面活性剂活性的物质的示例性而非全面的列举。任何两亲性实体可用于产生根据本发明使用的合成纳米载体。
[0163]
在一些实施方案中,合成纳米载体可任选地包含一种或更多种碳水化合物。碳水化合物可以是天然的或合成的。碳水化合物可以是衍生化的天然碳水化合物。在某些实施方案中,碳水化合物包括单糖或二糖,其包括但不限于:葡萄糖、果糖、半乳糖、核糖、乳糖、蔗糖、麦芽糖、海藻糖、纤维二糖、甘露糖、木糖、阿拉伯糖、葡糖醛酸、半乳糖醛酸、甘露糖醛酸、葡糖胺、半乳糖胺和神经氨酸。在某些实施方案中,碳水化合物是多糖,其包括但不限于:短梗霉聚糖(pullulan)、纤维素、微晶纤维素、羟丙基甲基纤维素(hpmc)、羟基纤维素(hc)、甲基纤维素(mc)、葡聚糖、环葡聚糖、糖原、羟乙基淀粉、角叉菜胶、糖基(glycon)、直链淀粉(amylose)、壳聚糖、n,o-羧甲基壳聚糖、藻胶和藻酸、淀粉、壳多糖、菊粉、魔芋、葡甘露聚糖、石耳葡聚糖、肝素、透明质酸、凝胶多糖和黄原胶。在一些实施方案中,合成纳米载体不包含(或特别排除)碳水化合物,例如多糖。在某些实施方案中,碳水化合物可包括碳水化合物衍生物,例如糖醇,其包括但不限于:甘露糖醇、山梨糖醇、木糖醇、赤藓糖醇、麦芽糖醇和乳糖醇。
[0164]
在一些实施方案中,合成纳米载体可包含一种或更多种聚合物。在一些实施方案中,合成纳米载体包含为非甲氧基封端的普朗尼克聚合物的一种或更多种聚合物。在一些实施方案中,构成合成纳米载体的聚合物的至少1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%或99%(重量/重量)是非甲氧基封端的普朗尼克聚合物。在一些实施方案中,构成合成纳米载体的所有聚合物是非甲氧基封端的普朗尼克聚合物。在一些实施方案中,合成纳米载体包含为非甲氧基封端的聚合物的一种或更多种聚合物。在一些实施方案中,构成合成纳米载体的聚合物的至少1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%或99%(重量/重量)是非甲氧基封端的聚合物。在一些实施方案中,构成合成纳米载体的所有聚合物是非甲氧基封端的聚合物。在一些实施方案中,合成纳米载体包含不含普朗尼克聚合物的一种或更多种聚合物。在一些实施方案中,构成合成纳米载体的聚合物的至少1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%或99%(重量/重量)不包含普朗尼克聚合物。在一些实施方案中,构成合成纳米载体的所有聚合物不包含普朗尼克聚合物。在一些实施方案中,这样的聚合物可被涂层(例如脂质体、脂质单层、胶束等)包围。在一些实施方案中,合成纳米载体的要素可与聚合物连接。
[0165]
可通过多种方法中的任一种将免疫抑制剂与合成纳米载体偶联。通常来说,连接可以是免疫抑制剂与合成纳米载体之间结合的结果。这种结合可导致免疫抑制剂与合成纳米载体的表面连接和/或被包含(包封)在合成纳米载体内。然而,在一些实施方案中,由于合成纳米载体的结构,免疫抑制剂被合成纳米载体包封,而不是与合成纳米载体结合。在一些优选的实施方案中,合成纳米载体包含本文中提供的聚合物,并且免疫抑制剂与聚合物连接。
[0166]
当由于免疫抑制剂和合成纳米载体之间的结合而发生连接时,连接可通过偶联部分来发生。偶联部分可以是免疫抑制剂通过其与合成纳米载体结合的任何部分。这样的部
分包括使免疫抑制剂与合成纳米载体(共价或非共价地)结合的共价键(例如酰胺键或酯键)以及单独分子。这样的分子包括接头或聚合物或其单元。例如,偶联部分可包含免疫抑制剂与其静电结合的带电聚合物。作为另一个实例,偶联部分可包含与其共价结合的聚合物或其单元。
[0167]
在一些优选的实施方案中,合成纳米载体包含本文中提供的聚合物。这些合成纳米载体可以是完全聚合物,或者其可以是聚合物与其他物质的混合物。
[0168]
在一些实施方案中,合成纳米载体的聚合物缔合以形成聚合物基质。在这些实施方案的一些中,组分(例如免疫抑制剂)可与聚合物基质的一种或更多种聚合物共价缔合。在一些实施方案中,共价缔合由接头介导。在一些实施方案中,组分可与聚合物基质的一种或更多种聚合物非共价缔合。例如,在一些实施方案中,组分可包封在聚合物基质内、被聚合物基质包围和/或分散在整个聚合物基质中。作为替代或补充,组分可通过疏水相互作用、电荷相互作用、范德华力等与聚合物基质中的一种或更多种聚合物缔合。用于由此形成聚合物基质的广泛多种的聚合物和方法是常规已知的。
[0169]
聚合物可以是天然或非天然(合成)聚合物。聚合物可以是均聚物或包含两种或更多种单体的共聚物。就序列而言,共聚物可以是随机的、嵌段的、或包含随机和嵌段序列的组合。通常来说,根据本发明的聚合物是有机聚合物。
[0170]
在一些实施方案中,聚合物包括聚酯、聚碳酸酯、聚酰胺、或聚醚、或其单元。在另一些实施方案中,聚合物包括聚(乙二醇)(peg)、聚丙二醇、聚(乳酸)、聚(乙醇酸)、聚(乳酸-共-乙醇酸)、或聚己内酯、或其单元。在一些实施方案中,优选地,聚合物是生物可降解的。因此,在这些实施方案中,优选地,如果聚合物包括聚醚,例如聚(乙二醇)或聚丙二醇或其单元,则聚合物包括聚醚和生物可降解聚合物的嵌段共聚物,使得聚合物是生物可降解的。在另一些实施方案中,聚合物不仅仅包括聚醚或其单元,例如聚(乙二醇)或聚丙二醇或其单元。
[0171]
适用于本发明的聚合物的另一些实例包括但不限于:聚乙烯、聚碳酸酯(例如聚(1,3-二氧六环-2酮))、聚酸酐(例如聚(癸二酸酐))、聚富马酸丙酯(polypropylfumerate)、聚酰胺(例如聚己内酰胺)、聚缩醛、聚醚、聚酯(例如,聚丙交酯、聚乙交酯、聚丙交酯-共-乙交酯、聚己内酯、聚羟基酸(例如聚(β-羟基链烷酸酯)))、聚(原酸酯)、聚氰基丙烯酸酯、聚乙烯醇、聚氨酯、聚磷腈、聚丙烯酸酯、聚甲基丙烯酸酯、聚脲、聚苯乙烯、和聚胺、聚赖氨酸、聚赖氨酸-peg共聚物和聚(乙烯亚胺)、聚(乙烯亚胺)-peg共聚物。
[0172]
在一些实施方案中,根据本发明的聚合物包含已由美国食品和药物管理局(food and drug administration,fda)根据21c.f.r.
§
177.2600批准用于人的聚合物,包括但不限于:聚酯(例如,聚乳酸、聚(乳酸-共-乙醇酸)、聚己内酯、聚戊内酯、聚(1,3-二氧六环-2酮));聚酸酐(例如,聚(癸二酸酐));聚醚(例如,聚乙二醇);聚氨酯;聚甲基丙烯酸酯;聚丙烯酸酯;和聚氰基丙烯酸酯。
[0173]
在一些实施方案中,聚合物可以是亲水的。例如,聚合物可包含阴离子基团(例如磷酸根基团、硫酸根基团、羧酸根基团);阳离子基团(例如季铵基团);或极性基团(例如,羟基、巯基、胺基)。在一些实施方案中,包含亲水性聚合物基质的合成纳米载体在合成纳米载体内产生亲水性环境。在一些实施方案中,聚合物可以是疏水性的。在一些实施方案中,包含疏水性聚合物基质的合成纳米载体在合成纳米载体内产生疏水性环境。聚合物的亲水性
或疏水性的选择可对并入合成纳米载体内的物质的性质具有影响。
[0174]
在一些实施方案中,聚合物可用一个或更多个部分和/或官能团进行修饰。根据本发明可使用多种部分或官能团。在一些实施方案中,聚合物可用聚乙二醇(peg)、用碳水化合物和/或用来自于多糖的非环状聚缩醛进行修饰(papisov,2001,acs symposium series,786:301)。某些实施方案可使用gref等的美国专利号5543158或von andrian等的wo公开wo 2009/051837的一般教导来进行。
[0175]
在一些实施方案中,聚合物可用脂质或脂肪酸基团修饰。在一些实施方案中,脂肪酸基团可以是丁酸、己酸、辛酸、癸酸、月桂酸、豆蔻酸、棕榈酸、硬脂酸、花生酸、山嵛酸或木蜡酸中的一种或更多种。在一些实施方案中,脂肪酸基团可以是棕榈油酸、油酸、反型异油酸、亚油酸、α-亚油酸、γ-亚油酸、花生四烯酸、鳕油酸、花生四烯酸、二十碳五烯酸、二十二碳六烯酸或芥酸中的一种或更多种。
[0176]
在一些实施方案中,聚合物可以是聚酯,包括:包含乳酸和乙醇酸单元的共聚物,例如聚(乳酸-共-乙醇酸)和聚(丙交酯-共-乙交酯),在本文中统称为“plga”;和包含乙醇酸单元的均聚物,在本文中称为“pga”,以及包含乳酸单元的均聚物,例如聚-l-乳酸、聚-d-乳酸、聚-d,l-乳酸、聚-l-丙交酯、聚-d-丙交酯和聚-d,l-丙交酯,在本文中统称为“pla”。在一些实施方案中,示例性聚酯包括例如:聚羟基酸;peg共聚物以及丙交酯和乙交酯的共聚物(例如pla-peg共聚物、pga-peg共聚物、plga-peg共聚物)及其衍生物。在一些实施方案中,聚酯包括例如:聚(己内酯)、聚(己内酯)-peg共聚物、聚(l-丙交酯-共-l-赖氨酸)、聚(丝氨酸酯)、聚(4-羟基-l-脯氨酸酯)、聚[α-(4-氨基丁基)-l-乙醇酸]及其衍生物。
[0177]
在一些实施方案中,聚酯可以是plga。plga是乳酸和乙醇酸的生物相容性和生物可降解的共聚物,并且多种形式的plga特征在于乳酸:乙醇酸的比例。乳酸可以是l-乳酸、d-乳酸或d,l-乳酸。plga的降解速率可通过改变乳酸∶乙醇酸的比例来调节。在一些实施方案中,根据本发明待使用的plga特征在于约85∶15、约75∶25、约60∶40、约50∶50、约40∶60、约25∶75或约15∶85的乳酸∶乙醇酸比例。
[0178]
在一些实施方案中,聚合物可以是一种或更多种丙烯酸类聚合物。在某些实施方案中,丙烯酸类聚合物包括例如:丙烯酸和甲基丙烯酸共聚物、甲基丙烯酸甲酯共聚物、甲基丙烯酸乙氧基乙酯、甲基丙烯酸氰基乙酯、甲基丙烯酸氨基烷基酯共聚物、聚(丙烯酸)、聚(甲基丙烯酸)、甲基丙烯酸烷基酰胺共聚物、聚(甲基丙烯酸甲酯)、聚(甲基丙烯酸酐)、甲基丙烯酸甲酯、聚甲基丙烯酸酯、聚(甲基丙烯酸甲酯)共聚物、聚丙烯酰胺、甲基丙烯酸氨基烷基酯共聚物、甲基丙烯酸缩水甘油酯共聚物、聚氰基丙烯酸酯,以及包含一种或更多种前述聚合物的组合。丙烯酸聚合物可包括具有低含量的季铵基团的丙烯酸酯和甲基丙烯酸酯的完全聚合的共聚物。
[0179]
在一些实施方案中,聚合物可以是阳离子聚合物。通常来说,阳离子聚合物能够缩合和/或保护核酸的带负电荷的链。含胺聚合物例如聚(赖氨酸)(zauner et al.,1998,adv.drug del.rev.,30:97;and kabanov et al.,1995,bioconjugate chem.,6:7)、聚(乙烯亚胺)(pei;boussif et al.,1995,proc.natl.acad.sci.,usa,1995,92:7297)和聚(酰氨基胺)树枝状聚合物(kukowska-latallo et al.,1996,proc.natl.acad.sci.,usa,93:4897;tang et al.,1996,bioconjugate chem.,7:703;and haensler et al.,1993,bioconjugate chem.,4:372)在生理ph下带正电荷,与核酸形成离子对。在一些实施方案
中,合成纳米载体可不包含(或可排除)阳离子聚合物。
[0180]
在一些实施方案中,聚合物可以是带有阳离子侧链的可降解聚酯(putnam et al.,1999,macromolecules,32:3658;barrera et al.,1993,j.am.chem.soc.,115:11010;kwon et al.,1989,macromolecules,22:3250;lim et al.,1999,j.am.chem.soc.,121:5633;和zhou et al.,1990,macromolecules,23:3399)。这些聚酯的实例包括:聚(l-丙交酯-共-l-赖氨酸)(barrera et al.,1993,j.am.chem.soc.,115:11010)、聚(丝氨酸酯)(zhou et al.,1990,macromolecules,23:3399)、聚(4-羟基-l-脯氨酸酯)(putnam et al.,1999,macromolecules,32:3658;和lim et al.,1999,j.am.chem.soc.,121:5633)和聚(4-羟基-l-脯氨酸酯)(putnam et al.,1999,macromolecules,32:3658;和lim et al.,1999,j.am.chem.soc.,121:5633)。
[0181]
这些和其他聚合物的特性及其制备方法是本领域中公知的(参见例如美国专利6,123,727;5,804,178;5,770,417;5,736,372;5,716,404;6,095,148;5,837,752;5,902,599;5,696,175;5,514,378;5,512,600;5,399,665;5,019,379;5,010,167;4,806,621;4,638,045和4,946,929;wang et al.,2001,j.am.chem.soc.,123:9480;lim et al.,2001,j.am.chem.soc.,123:2460;langer,2000,acc.chem.res.,33:94;langer,1999,j.control.release,62:7;和uhrich et al.,1999,chem.rev.,99:3181)。更一般地,用于合成某些合适聚合物的多种方法描述于concise encyclopedia of polymer science and polymeric amines and ammonium salts,由goethals编辑,pergamon press,1980;principles of polymerization by odian,john wiley&sons,第四版,2004;contemporary polymer chemistry by allcock et al.,prentice-hall,1981;deming et al.,1997,nature,390:386;以及美国专利6,506,577、6,632,922、6,686,446和6,818,732中。
[0182]
在一些实施方案中,聚合物可以是直链或支链聚合物。在一些实施方案中,聚合物可以是树枝状聚合物。在一些实施方案中,聚合物可基本上彼此交联。在一些实施方案中,聚合物可基本上不交联。在一些实施方案中,聚合物可无需进行交联步骤来根据本发明使用。还应理解,合成纳米载体可包含前述任一种嵌段共聚物、接枝共聚物、共混物、混合物和/或加合物以及其他聚合物。本领域技术人员将认识到,本文中列出的聚合物代表可根据本发明使用的聚合物的示例性而非全面的列举。
[0183]
在一些实施方案中,合成纳米载体不包含聚合物组分。在一些实施方案中,合成纳米载体可包含金属颗粒、量子点、陶瓷颗粒等。在一些实施方案中,非聚合物合成纳米载体是非聚合物组分的聚集体,例如金属原子(例如金原子)的聚集体。
[0184]
根据本发明的组合物可包含可药用赋形剂,例如防腐剂、缓冲剂、盐水或磷酸盐缓冲盐水。可使用常规药物制造和复配技术制备组合物以获得可用的剂型。在一个实施方案中,将组合物与防腐剂一起悬浮在无菌注射用盐水溶液中。
[0185]
d.使用和制备组合物的方法
[0186]
可用本领域普通技术人员已知或本文中其他地方描述的方法制备病毒载体。例如,可使用例如在美国专利号4,797,368和laughlin et al.,gene,23,65-73(1983)中所述的方法来构建和/或纯化病毒载体。
[0187]
例如,可在补充细胞系(complementing cell line)中以适当的水平产生复制缺
陷型腺病毒载体,所述补充细胞系提供不存在于复制缺陷型腺病毒载体中但是病毒繁殖所需的基因功能,从而产生高滴度的病毒载体储液。补充细胞系可补充由早期区、晚期区、病毒包装区、病毒相关rna区或其组合编码的至少一种复制必需基因功能的缺陷,包括所有腺病毒功能(例如,以使腺病毒扩增子能够增殖)。补充细胞系的构建涉及标准分子生物学和细胞培养技术,例如以下中所述的那些:sambrook et al.,molecular cloning,a laboratory manual,第2版,cold spring harbor press,cold spring harbor,n.y.(1989),和ausubel et al.,current protocols in molecular biology,greene publishing associates and john wiley&sons,new york,n.y.(1994)。
[0188]
用于产生腺病毒载体的补充细胞系包括但不限于:hek 293细胞(描述于例如graham et al.,j.gen.virol.,36,59-72(1977))、per.c6细胞(描述于例如国际专利申请wo 97/00326以及美国专利号5,994,128和6,033,908)和293-orf6细胞(描述于例如国际专利申请wo 95/34671和brough et al.,j.virol.,71,9206-9213(1997))。在一些情况下,互补细胞不会补充所有需要的腺病毒基因功能。可使用辅助病毒以提供不由细胞或腺病毒基因组编码的反式基因功能,以使得能够复制腺病毒载体。可使用由例如以下中所述的材料和方法来构建、扩增和/或纯化腺病毒载体:美国专利号5,965,358、5,994,128、6,033,908、6,168,941、6,329,200、6,383,795、6,440,728、6,447,995和6,475,757,美国专利申请公开号2002/0034735 a1,以及国际专利申请wo 98/53087、wo 98/56937、wo 99/15686、wo 99/54441、wo 00/12765、wo 01/77304和wo 02/29388,以及本文中确定的其他参考文献。可以使用例如美国专利号5,837,511和5,849,561以及国际专利申请wo 97/12986和wo 98/53087中所述的方法来产生非组c腺病毒载体(包括腺病毒血清型35载体)。
[0189]
可使用重组方法产生病毒载体,例如aav载体。例如,所述方法可包括培养宿主细胞,所述宿主细胞包含编码aav衣壳蛋白或其片段的核酸序列;功能性rep基因;由aav末端反向重复序列(itr)和转基因构成的重组aav载体;和足够的辅助功能,以允许将重组aav载体包装到aav衣壳蛋白中。在一些实施方案中,病毒载体可包含选自以下的aav血清型的末端反向重复序列(itr):aav1、aav2、aav5、aav6、aav6.2、aav7、aav8、aav9、aav10、aav11及其变体。
[0190]
待在宿主细胞中培养以在衣壳中包装病毒载体的组分可反式地提供给宿主细胞。或者,可由稳定的宿主细胞提供任一种或更多种所需的组分(例如,重组aav载体、rep序列、cap序列和/或辅助功能),所述稳定宿主细胞已使用本领域技术人员已知的方法被改造以包含一种或更多种所需组分。最合适地,这样的稳定的宿主细胞可包含在诱导型启动子的控制下的所需组分。然而,所需组分也可在组成型启动子的控制下。可使用任何合适的遗传元件来将产生病毒载体所需的重组病毒载体、rep序列、cap序列和辅助功能递送到包装宿主细胞。所选择的遗传元件可通过任何合适的方法(包括本文中所述的那些)递送。其他方法对于核酸操作技术人员是已知的,并且包括遗传工程、重组工程和合成技术。参见例如,sambrook et al,molecular cloning:a laboratory manual,cold spring harbor press,cold spring harbor,n.y。类似地,产生raav病毒粒子的方法是公知的,并且合适方法的选择不是对本发明的限制。参见例如,k.fisher et al,j.virol.,70:520-532(1993)和美国专利号5,478,745。
[0191]
在一些实施方案中,可使用三重转染方法(例如,如美国专利号6,001,650、美国专
利号6,593,123、以及x.xiao et al,j.virol.72:2224-2232(1998)和t.matsushita et al,gene ther.5(7):938-945(1998)中详细描述的,其涉及三重转染方法的内容通过引用并入本文)来产生重组aav转移载体。例如,通过用待包装入aav颗粒的重组aav转移载体(包含转基因)、aav辅助功能载体和附属功能载体转染宿主细胞可以产生重组aav。一般来说,aav辅助功能载体编码aav辅助功能序列(rep和cap),其反式地作用于多产的aav复制和衣壳化。优选地,aav辅助功能载体支持高效的aav载体产生,而不产生任何可检出的野生型aav病毒粒子(即,包含功能rep和cap基因的aav病毒粒子)。附属功能载体可编码用于非aav来源的病毒和/或细胞功能的核苷酸序列,aav依赖于所述功能以复制。附属功能包括aav复制所需的那些功能,包括但不限于参与aav基因转录激活、阶段特异性aav mrna剪接、aav dna复制、cap表达产物的合成和aav衣壳组装的那些部分。基于病毒的附属功能可来源于任何已知的辅助病毒,例如腺病毒、疱疹病毒(除了单纯疱疹病毒1型)和痘苗病毒。
[0192]
用于产生病毒载体的其他方法是本领域中已知的。此外,病毒载体可商购获得。
[0193]
关于与免疫抑制剂偶联的合成纳米载体,将组分连接至合成纳米载体的方法可能是有用的。
[0194]
在一些实施方案中,用于将组分连接至例如合成纳米载体的方法可能是有用的。在某些实施方案中,连接可以是共价接头。在一些实施方案中,根据本发明的免疫抑制剂可通过由叠氮化物基团与包含炔基团的免疫抑制剂的1,3-偶极环加成反应或通过炔与包含叠氮化物基团的免疫抑制剂的1,3-偶极环加成反应所形成的1,2,3-三唑接头共价连接至外表面。这样的环加成反应优选在cu(i)催化剂以及合适的cu(i)-配体和还原剂的存在下进行以将cu(ii)化合物还原为催化活性cu(i)化合物。这种cu(i)催化的叠氮化物-炔环加成(cu(i)-catalyzed azide-alkyne cycloaddition,cuaac)也可以称为点击反应。
[0195]
另外地,共价偶联可包含共价接头,包括酰胺接头、二硫接头、硫醚接头、腙连接头、酰肼接头、亚胺或肟接头、脲或硫脲接头、脒接头、胺接头和磺酰胺接头。
[0196]
酰胺接头通过一种组分(例如免疫抑制剂)上的胺与第二组分(例如纳米载体)上的羧酸基团之间的酰胺键来形成。接头中的酰胺键可使用任何常规的酰胺键形成反应用适当保护的氨基酸和活化羧酸(例如n-羟基琥珀酰亚胺活化的酯)来制备。
[0197]
二硫接头通过在例如r1-s-s-r2形式的两个硫原子之间形成二硫(s-s)键来制备。二硫键可通过包含巯基/硫醇基团(-sh)的组分与另一活化的巯基或者包含巯基/硫醇基团的组分与包含活化巯基的组分的巯基交换而形成。
[0198]
三唑接头(特别是其中r1和r2可以是任何化学实体的形式的1,2,3-三唑)通过连接到第一组分的叠氮化物与连接到第二组分(例如免疫抑制剂)的末端炔的1,3-偶极环加成反应来制备。1,3-偶极环加成反应在具有或不具有催化剂下(优选具有cu(i)-催化剂下)进行,其通过1,2,3-三唑官能团连接两种组分。该化学由sharpless et al.,angew.chem.int.ed.41(14),2596,(2002)和meldal,et al,chem.rev.,2008,108(8),2952-3015详细描述,并且通常被称为“点击”反应或cuaac。
[0199]
硫醚接头通过形成例如r1-s-r2形式的硫-碳(硫醚)键来制备。硫醚可通过用第二
组分上的烷基化基团(例如卤化物或环氧化物)使一种组分上的巯基/硫醇(-sh)基团烷基化来制备。硫醚接头也可通过一种组分上的巯基/硫醇基团与包含作为迈克尔受体的马来酰亚胺基团或乙烯基砜基团的第二组分上的缺电子烯基团的迈克尔加成(michael addition)形成。在另一种方式中,硫醚接头可通过一种组分上的巯基/硫醇基团与第二组分上的烯基的自由基巯基-烯反应来制备。
[0200]
腙接头通过一种组分上的酰肼基团与第二组分上的醛/酮基团的反应来制备。
[0201]
酰肼接头通过一种组分上的肼基团与第二组分上的羧酸基团的反应形成。这样的反应通常使用类似于形成酰胺键的化学进行,其中羧酸用活化试剂活化。
[0202]
亚胺或肟接头通过一种组分上的胺或n-烷氧基胺(或氨氧基)基团与第二组分上的醛基或酮基的反应形成。
[0203]
脲或硫脲接头通过一种组分上的胺基与第二组分上的异氰酸酯或硫代异氰酸酯基团的反应来制备。
[0204]
脒接头通过一种组分上的胺基与第二组分上的酰亚胺酯基团的反应来制备。
[0205]
胺接头通过一种组分上的胺基与第二组分上的烷基化基团(例如卤化物、环氧化物或磺酸酯基)的烷基化反应来制备。或者,胺接头也可通过用合适的还原剂(例如氰基硼氢化钠或三乙酰氧基硼氢化钠)将一种组分上的胺基与第二组分上的醛基或酮基还原胺化来制备。
[0206]
磺酰胺接头通过一种组分上的胺基与第二组分上的磺酰卤(例如磺酰氯)基团的反应来制备。
[0207]
砜接头通过亲核试剂与乙烯基砜的迈克尔加成制备。乙烯基砜或亲核试剂可在纳米载体的表面上或与组分连接。
[0208]
组分也可通过非共价缀合方法缀合。例如,带负电荷的免疫抑制剂可通过静电吸附与带正电荷的组分缀合。包含金属配体的组分也可通过金属-配体配合物与金属配合物缀合。
[0209]
在一些实施方案中,在组装合成纳米载体之前,组分可与聚合物(例如聚乳酸嵌段-聚乙二醇)连接,或者合成纳米载体可在其表面上形成具有反应性或可活化基团。在后一种情况下,组分可制备有与合成纳米载体的表面所呈递的连接化学物质相容的基团。在另一些实施方案中,可使用合适的接头使肽组分与vlp或脂质体连接。接头是能够使两个分子偶联在一起的化合物或试剂。在一个实施方案中,接头可以是如hermanson2008中所述的同双官能或异双官能试剂。例如,可在edc的存在下用同双官能接头己二酸二酰肼(adh)处理表面上包含羧基的vlp或脂质体合成纳米载体,以形成具有adh接头的相应合成纳米载体。然后使所得的adh连接的合成纳米载体通过纳米载体上的adh接头的另一端与包含酸基团的肽组分缀合,以产生相应的vlp或脂质体肽缀合物。
[0210]
在一些实施方案中,制备了在聚合物链末端包含叠氮化物或炔基团的聚合物。然后以多个炔或叠氮化物基团位于纳米载体表面的方式用该聚合物制备合成纳米载体。或者,合成纳米载体可通过其他途径制备,并且随后用炔或叠氮化物基团官能化。在炔(如果聚合物包含叠氮化物)或叠氮化物(如果聚合物包含炔)的存在下制备组分。然后使组分在有或者没有催化剂的情况下通过1,3-偶极环加成反应与纳米载体反应,所述催化剂通过1,4-二取代的1,2,3-三唑接头使组分与颗粒共价连接。
[0211]
如果组分是小分子,则在组装合成纳米载体之前使组分与聚合物连接可能是有利的。在一些实施方案中,还可能有利的是制备具有表面基团的合成纳米载体,其用于通过使用这些表面基团使组分与合成纳米载体连接,而不是使组分与聚合物连接然后在合成纳米载体的构建中使用该聚合物缀合物。
[0212]
对于可用的缀合方法的详细描述,参见hermanson g t“bioconjugate techniques”,第二版academic press,inc.出版,2008。除了共价连接之外,组分可通过吸附连接至预先形成的合成纳米载体,或者其可在形成合成纳米载体期间通过包封连接。
[0213]
可使用本领域中已知的广泛多种方法制备合成纳米载体。例如,合成纳米载体可通过例如以下的方法形成:纳米沉淀、使用流体通道的流聚焦、喷雾干燥、单和双乳液溶剂蒸发、溶剂萃取、相分离、研磨、微乳化操作、微米制造、纳米制造、牺牲层、简单和复杂的凝聚,以及本领域普通技术人员公知的其他方法。作为替代或补充,已经描述了用于单分散半导体、传导性、磁性、有机和其他纳米材料的水性和有机溶剂合成(pellegrino et al.,2005,small,1:48;murray et al.,2000,ann.rev.mat.sci.,30:545;和trindade et al.,2001,chem.mat.,13:3843)。在文献中已经描述了另外的方法(参见例如doubrow,ed.,“microcapsules and nanoparticles in medicine and pharmacy,”crc press,boca raton,1992;mathiowitz et al.,1987,j.control.release,5:13;mathiowitz et al.,1987,reactive polymers,6:275;和mathiowitz et al.,1988,j.appl.polymer sci.,35:755;美国专利5578325和6007845;p.paolicelli et al.,“surface-modified plga-based nanoparticles that can efficiently associate and deliver virus-like particles”nanomedicine.5(6):843-853(2010))。
[0214]
可使用多种方法如所期望地将物质包封到合成纳米载体中,所述方法包括但不限于:c.astete et al.,“synthesis and characterization of plga nanoparticles”j.biomater.sci.polymer edn,vol.17,no.3,pp.247-289(2006);k.avgoustakis“pegylated poly(lactide)and poly(lactide-co-glycolide)nanoparticles:preparation,properties and possible applications in drug delivery”current drug delivery 1:321-333(2004);c.reis et al.,“nanoencapsulation i.methods for preparation of drug-loaded polymeric nanoparticles”nanomedicine 2:8-21(2006);p.paolicelli et al.,“surface-modified plga-based nanoparticles that can efficiently associate and deliver virus-like particles”nanomedicine.5(6):843-853(2010)。可使用适合于将物质包封到合成纳米载体中的其他方法,包括但不限于2003年10月14日授权的unger的美国专利6,632,671中公开的方法。
[0215]
在某些实施方案中,合成纳米载体通过纳米沉淀法或喷雾干燥制备。可改变用于制备合成纳米载体的条件以产生期望尺寸或特性(例如,疏水性、亲水性、外部形态、“黏性”、形状等)的颗粒。制备合成纳米载体的方法和使用的条件(例如,溶剂、温度、浓度、空气流量等)可取决于待与合成纳米载体连接的物质和/或聚合物基质的组成。
[0216]
如果通过任何上述方法制备的合成纳米载体的尺寸范围在所期望范围之外,则可例如使用筛子对合成纳米载体的尺寸进行调整。
[0217]
合成纳米载体的要素可例如通过一个或更多个共价键与整个合成纳米载体连接,或者可通过一个或更多个接头连接。合成纳米载体官能化的其他方法可修改自saltzman等
2016/0128987 a1中的任一种方法产生,所描述的这样的产生方法和所得的合成纳米载体通过引用整体并入本文。在本文中提供的任一种方法或组合物中,包含免疫抑制剂的合成纳米载体是这样并入的合成纳米载体。immtor,即包封雷帕霉素的生物可降解的pla+pla-peg纳米粒,是指这样的合成纳米载体的一个实例(kishimoto tk,maldonado ra.nanoparticles for the induction of antigen-specific immunological tolerance.front immunol.2018;9:230.sands e,kivitz aj,dehaan w,et al.update of sel-212 phase 2 clinical data in symptomatic gout patients:svp-rapamycin combined with pegadricase mitigates immunogenicity and enables sustained reduction of serum uric acid levels,low rate of gout flares and monthly dosing.海报展示于:2018年美国风湿病学会/生殖健康专业人员协会(american college of rheumatology/association of reproductive health professionals,acr/arhp)年会;2018年10月19日至24日;chicago,il。海报#2254)。
[0228]
实施例2:混合aav载体与包含免疫抑制剂的合成纳米载体在具有抗aav抗体的小鼠中挽救了转基因表达
[0229]
检查了混合的aav载体与包含雷帕霉素的合成纳米载体(例如immtor纳米粒)在具有抗aav抗体的小鼠中挽救转基因表达的能力。首先,在体外测定中筛查来自正常人供体的血清中是否存在针对aav的预先存在的中和抗体和igg抗体。简而言之,将huh7肝来源细胞与aav8-萤光素酶在存在来自正常人供体的血清的情况下一起孵育。在转导huh7细胞之后评估萤光素酶表达。用来自人供体8的血清孵育的细胞显示出高水平的萤光素酶活性,表明不存在显著水平的中和抗体。相比之下,用来自人供体45的血清孵育的细胞显示出很少或没有萤光素酶表达,表明存在高水平的中和抗体。同样,用来自人供体44的血清孵育的细胞也显示出很少的萤光素酶表达,表明存在中高水平的中和抗体。用来自人供体31和35的血清孵育的细胞显示出中等水平的萤光素酶表达,表明存在中等水平的中和抗体。发现基于上述功能性中和抗体测定的中和抗体的预测水平与观察到的抗aav igg抗体水平相关(图1)。
[0230]
通过静脉内注射将80微升(80μl)来自人供体8、31、35、44和45的血清转移到单独的小鼠中。约24小时之后,向小鼠注射5.0e11vg/kg的aav8-seap载体或者与100μg包含雷帕霉素的合成纳米载体(例如immtor纳米粒)混合的5.0e11vg/kg的aav8-seap载体。12天之后,从小鼠中收集血清并测量血清seap活性水平。
[0231]
结果示出于图2中。接受来自人供体8的血清随后接受aav8-seap载体的小鼠显示出与仅接受aav8-seap的对照小鼠相似的seap活性水平,证实了来自人供体8的血清没有显著水平的中和抗aav8抗体(将供体8的空心条与对照“无血清”的空心条进行比较)。接受来自人供体31和35的血清随后接受aav8-seap载体的小鼠显示出相对于无血清对照小鼠约46至47%的seap活性,证实了在来自人供体31和35的血清中存在中等程度的中和抗体(将供体31和35的空心条与对照“无血清”的空心条进行比较)。然而,发现了在接受来自人供体31和35的血清的小鼠中,混合包含雷帕霉素的合成纳米载体(例如immtor纳米粒)与aav8-seap载体增强了seap转基因表达和活性水平,其与仅接受aav8-seap载体的无血清对照小鼠的相当(将供体31和35的实心条与对照“无血清”的空心条进行比较)。这些结果表明,将包含雷帕霉素的合成纳米载体(例如immtor纳米粒)与第一剂aav8-seap载体混合可在具有
中等水平中和抗体的小鼠中挽救转基因表达和活性。
[0232]
实施例3:混合aav载体与包含免疫抑制剂的合成纳米载体在注射了抗aav抗体的初始小鼠中挽救转基因表达
[0233]
将aav8-seap载体与等体积的50μg包含雷帕霉素的合成纳米载体(例如immtor纳米粒)或盐水在室温下混合20分钟,然后与1∶100稀释的正常、初始小鼠血清或含有抗aav抗体的小鼠血清在室温下混合1小时。将所得混合物注射到初始小鼠中,并且33天之后测量seap转基因的血清表达。将seap转基因的血清表达与注射了未与血清混合的aav8-seap载体的对照小鼠进行比较。
[0234]
结果示出于图3中。注射了与不含抗aav抗体的正常血清混合的aav8-seap载体的小鼠显示出与对照小鼠相当的血清seap活性,并且注射了与含有抗aav抗体的血清混合的aav8-seap载体的小鼠显示出与对照小鼠相比降低的seap血清活性。相比之下,发现在与含有抗aav抗体的血清混合之前,混合50μg包含雷帕霉素的合成纳米载体(例如immtor纳米粒)与aav8-seap载体将seap表达挽救至与无血清对照相当的水平。
[0235]
实施例4:包含免疫抑制剂的合成纳米载体改善了母源转移的抗体
[0236]
检查了包含雷帕霉素的合成纳米载体(例如immtor纳米粒)在携带母源转移的抗aav抗体的小鼠中挽救转基因表达的能力。使用了缺乏甲基丙二酰辅酶a变位酶(mut)表达而在肌特异性启动子下表达mut转基因的亚效小鼠(hypomorphic mice)(mck-mut小鼠)(manoli et al.,2018)。这些小鼠表现出严重形式的甲基丙二酸血症。雄性和雌性纯合mck-mut小鼠接受了用aav anc80-haat-mut载体进行的基因治疗,以纠正肝中mut基因表达的缺乏。然后饲养小鼠,并且来自其后代的所有新生幼崽都携带预先存在的抗anc80抗体,其很可能是从母体子宫内转移的(图4)。
[0237]
在约26日龄时,mck-mut小鼠仍显示出显著水平的母源转移的抗anc80抗体。将小鼠随机化并用单独的或者与100μg或300μg包含雷帕霉素的合成纳米载体(例如immtor纳米粒)混合的5.0e12 vg/kg anc80-mut处理。用单独的anc80-mut处理的四只小鼠中有两只在基因转移之后的几天内死亡。用与100μg包含雷帕霉素的合成纳米载体(例如immtor纳米粒)混合的anc80-mut处理的五只小鼠中有三只在基因转移之后不久死亡。此外,用与300μg包含雷帕霉素的合成纳米载体(例如immtor纳米粒)混合的anc80-mut处理的所有七只动物均存活。这些数据表明,混合包含雷帕霉素的合成纳米载体(例如immtor纳米粒)与第一剂aav anc80-haat-mut载体以剂量依赖性方式增强了小鼠的存活。
[0238]
实施例5:包含免疫抑制剂的合成纳米载体在用anc80 aav-mut载体处理的具有母源转移的抗体的甲基丙二酸血症小鼠模型中的作用
[0239]
总共产生了23只针对anc80具有预先存在的igg的mck-mmut小鼠。其中,6只小鼠用5
×
1012vg/kg的aav anc80-mmut处理,7只小鼠用相同剂量的与100μg immtor纳米粒混合的aav anc80-mmut处理,以及10只小鼠用相同剂量的与300μg immtor混合的aav anc80-mmut处理。
[0240]
如通过pmma水平所测量的,没有任何组在初始处理之后显示出益处。此外,用单独的anc80-mmut处理的6只小鼠中的4只以及用与100μg immtor纳米粒混合的anc80-mut处理的7只小鼠中的4只在基因转移之后不久死亡。同时,用与300μg immtor纳米粒混合的anc80-mut处理的组中的所有10只小鼠均存活了21天,在该时间点对所有存活小鼠施用第
二次处理。这次,用与300μg immtor混合的anc80-mut处理的小鼠约一半在第二次基因转移之后9天时显示出pmma水平显著降低,而用与100μg immtor混合的anc80-mut处理的组中剩余的3只小鼠中有一只也显示出pmma降低。在用单独的anc80-mmut处理的剩余两只小鼠没有任何益处,其中这些小鼠中的一只在几天内死于该疾病。
[0241]
用与300μg immtor混合的anc80-mut处理的10只小鼠中有9只存活了超过三个月,在该时间点它们表现出高度可变的pmma水平,并在初始治疗之后101天时进行第三次处理。这种干预导致该组所有小鼠pmma水平显著降低(至18%,与处理之前相比),以及同样在用与100μg immtor混合的anc80-mut处理的所有存活小鼠中pmma水平显著降低。在用单独的anc80-mmut处理的单个存活小鼠中未观察到任何益处,并且它很快就死于该疾病。
[0242]
总的来说,在用与300μg immtor混合的anc80-mut处理的组与用单独的anc80-mut处理的组(p<0.0001)或用与100μg immtor混合的anc80-mut处理的组(p<0.05)之间的存活存在统计学显著性差异。
[0243]
此外,几乎所有(9/10)用与300μg immtor混合的anc80-mut处理的小鼠均显示出直到研究的第115天(即,三个治疗之后)都没有从头形成anc80 igg。这些数据表明,混合包含雷帕霉素的合成纳米载体(例如immtor纳米粒)与第一剂aav anc80-haat-mmut载体以剂量依赖性方式增强了小鼠的存活,并在重复施用之后改善了pmma的水平。数据示出于图5至8中。
[0244]
因此,在第一剂anc80-mut与合成纳米载体混合的情况下,在再治疗之后,观察到血清mma部分降低(在用anc80-mut+300μg immtor处理的小鼠中)。此外,在用anc80-mut+300μg immtor处理的小鼠中在第二再治疗之后,结果显示出血清mma的一致降低。用混合了包含免疫抑制剂的合成纳米载体的anc80-mut重复处理的具有预先存在的母源转移的抗anc80 igg的mck-mut小鼠具有更高的早期存活率。由于施用包含免疫抑制剂(例如雷帕霉素)的合成纳米载体,在具有母源转移的抗anc80 igg的小鼠中预先存在的体液免疫并不排除用病毒载体进行的治疗。数据还表明,更高剂量的包含免疫抑制剂的合成纳米载体可实现早期存活,并且在重复施用时提供治疗效力,同时延迟igg的从头形成。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1