用于稳定包含药物的水性组合物pH的方法与流程
用于稳定包含药物的水性组合物ph的方法
技术领域
1.本公开涉及用于稳定包含药物的水性组合物ph的方法,所述方法包括加入添加剂以防止药物的氧化。特别地,本公开涉及用于稳定包含皮质类固醇的水性组合物ph的方法,所述方法包括加入添加剂以防止皮质类固醇的氧化。本公开还涉及包含皮质类固醇和防止皮质类固醇氧化的添加剂的组合物。
背景技术:
2.眼病是世界性的问题:估计全世界约2亿8500万人有视力受损。在美国,210万美国人被诊断为年龄相关性黄斑变性(amd),270万美国人被诊断为青光眼,770万美国人被诊断为糖尿病性视网膜病,2400万美国人被诊断为白内障。
3.大多数眼部病症可被治疗和/或管理以减少负面影响,包括全盲。然而,由于难以将有效剂量的药物递送至眼中目标组织,目前对眼部病症的治疗受到限制。在目前的治疗中,滴眼液的局部施用是对眼睛给药的优选方式,这是由于滴眼液与其他眼部给药途径(诸如玻璃体内注射和植入)相比的方便性和安全性(le souriais,c.,acar,l.,zia,h.,sado,p.a.,needham,t.,leverge,r.,1998.ophthalmic drug delivery systems-recent advances.progress in retinal and eye research 17,33-58)。药物主要通过被动扩散从眼睛表面转运到眼睛和周围组织中,其中根据fick定律,药物通过溶解的药物分子梯度被带至眼中。被动药物扩散进入眼睛受到三个主要障碍的阻碍(gan,l.,wang,j.,jiang,m.,bartlett,h.,ouyang,d.,eperjesi,f.,liu,j.,gan,y.,2013.recent advances in topical ophthalmic drug delivery with lipid-based nanocarriers.drug discov.today 18,290-297;loftsson,t.,sigurdsson,h.h.,konradsdottir,f.,gisladottir,s.,jansook,p.,stefansson,e.,2008.topical drug delivery to the posterior segment of the eye:anatomical and physiological considerations.pharmazie 63,171-179;urtti,a,2006.challenges and obstacles of ocular pharmacokinetics and drug delivery.adv.drug del.rev.58,1131-1135)。
4.最近,申请人已经描述了含有地塞米松的基于环糊精的滴眼液的制备和测试(wo2018/100434,johannesson,g.,moya-ortega,m.d.,asgrimsdottir,g.m.,lund,s.h.,thorsteinsdottir,m.,loftsson,t.,stefansson,e.,2014.kinetics of y-cyclodextrin nanoparticle suspension eye drops in tear fluid.acta ophthalmologica 92,550-556;thorsteinn loftsson and einar stefansson,cyclodextrin nanotechnology for ophthalmic drug delivery,美国专利号7,893,040(2011年2月22日);thorsteinn loftsson and einar stefansson,cyclodextrin nanotechnology for ophthalmic drug delivery,美国专利号8,633,172(2014年1月21日);thorsteinn loftsson and einar stefansson,cyclodextrin nanotechnology for ophthalmic drug delivery美国专利号8,999,953(2015年4月7日))。
5.这些研究表明含有活性成分的基于环糊精的滴眼液有希望用于治疗眼部病症。
6.然而,在某些储存条件下,例如当在低密度聚乙烯(ldpe)小瓶中储存数月时,具有活性成分的基于环糊精的滴眼液的ph不稳定且随时间降低。因此,希望开发稳定这些水性组合物ph的方法,以防止ph降低。
7.发明简述
8.本公开的第一个目标是用于稳定包含药物的水性组合物ph的方法,所述方法包括加入添加剂以防止药物的氧化。
9.发明人惊讶地发现,向水溶液添加防止药物氧化的添加剂可防止ph降低,尤其是在长期贮存期间。
10.本公开的第二个目标是包含皮质类固醇、环糊精和防止皮质类固醇氧化的添加剂的水性组合物,其中所述添加剂以0.15%(w/v)-0.6%(w/v),例如0.15%(w/v)-0.45%(w/v),优选0.2%(w/v)-0.4%(w/v)的浓度存在于组合物中。
11.本公开的第三个目标是添加剂用于防止皮质类固醇氧化以稳定包含皮质类固醇的水性组合物ph的用途。
12.本公开的第四个目标是用于稳定包含药物的水性组合物ph的方法,所述方法包括使用氧吸收剂来防止药物的氧化。
13.发明详述
14.定义
15.如本文所用,术语“基于组合物体积的化合物x的重量%”,也缩写为“%w/v”,对应于添入100ml组合物中的化合物x的量(以g计)。
16.如本文所用,“眼部病症”是影响或涉及眼睛,眼睛的一部分或区域,或周围组织(诸如泪腺)的疾病、病痛或其他病症。广义地说,眼睛包括眼球和构成眼球的组织和流体,眼周肌肉(诸如斜肌和直肌),在眼球内或邻近眼球和周围组织的视神经部分(诸如泪腺和眼睑)。
17.如本文所用,“眼前部病症”是影响或涉及前眼部(即眼的前部)区域或部位(诸如眼周肌肉、眼睑、泪腺或眼球组织或流体,其位于晶状体囊或睫状肌后壁的前部)的疾病、病痛或病症。
18.因此,眼前部病症主要影响或涉及以下的一种或多种:结膜、角膜、前房、虹膜、晶状体或晶状体囊,以及血管化或支配前眼部区域或部位的血管和神经。眼前部病症在本文中也被认为扩展至泪器。特别地,分泌泪液的泪腺,以及将泪液输送到眼睛表面的排泄管。
19.此外,眼前部病症影响或涉及后房,其位于视网膜之后但在晶状体囊后壁之前。
20.眼前部病症包括疾病、病痛或病症,例如,无晶状体;假晶状体;散光;眼睑痉挛;白内障;结膜疾病;结膜炎;角膜疾病;角膜溃疡;干眼综合征;眼睑疾病;泪器疾病;泪管阻塞;近视;老花眼;瞳孔障碍;屈光异常和斜视。青光眼也可被认为是眼前部病症,因为青光眼治疗的临床目标可为降低眼前房中水性流体的高血压(即降低眼内压)。
21.眼前部病症还包括眼前部炎症,如白内障手术后的炎症、青光眼、前房炎症,中央黄斑水肿。
[0022]“眼后部病症”是主要影响或涉及后眼部区域或部位的疾病、病痛或病症,所述眼后部区域或部位诸如脉络膜或巩膜(在穿过晶状体囊后壁的平面后方的位置)、玻璃体、玻璃体腔、视网膜、视神经(即视神经盘)以及血管化或支配后眼部区域或部位的血管和神经。
[0023]
因此,眼后部病症可包括疾病、病痛或病症,例如黄斑变性(诸如非渗出性年龄相关性黄斑变性和渗出性年龄相关性黄斑变性);脉络膜新生血管;急性黄斑神经视网膜病变;黄斑水肿(诸如囊样黄斑水肿和糖尿病性黄斑水肿);白塞病、视网膜病症、糖尿病性视网膜病(包括增生性糖尿病性视网膜病);视网膜动脉闭塞性疾病;视网膜中央静脉阻塞(crvo);葡萄膜炎性视网膜病;视网膜脱离;影响眼后部部位或位置的眼外伤;由眼部激光治疗引起或影响的眼后部病症;由光动力疗法引起或影响的眼后部病症;光凝术;辐射视网膜病变;视网膜前膜疾病;视网膜分支静脉阻塞;前部缺血性视神经病;非视网膜病糖尿病性视网膜功能障碍,色素性视网膜炎和青光眼。青光眼可被认为是眼后部病症,因为治疗目标是防止由于视网膜细胞或视神经细胞(即神经保护)的损伤或丧失而导致的视力丧失或减少其发生。
[0024]
如本文所用,术语“微粒”是指直径d
50
为约1μm-约200μm的颗粒。术语“纳米颗粒”是指直径d
50
小于1μm的颗粒。在示例性实施方案中,所述直径可为d
50
,为1μm或更大至约200μm;术语“纳米颗粒”是指d
50
小于约1μm的颗粒。
[0025]
术语“微悬浮液”是指包含悬浮在液相中的固体复合物微粒的组合物。
[0026]
如本文所用,表述“防止药物的氧化”是指防止或延迟药物的氧化。
[0027]
稳定包含药物的水性组合物ph的方法
[0028]
本公开首先涉及用于稳定包含药物的水性组合物ph的方法,所述方法包括加入添加剂以防止药物的氧化。本公开还涉及通过该方法获得的、包含药物及防止药物氧化的添加剂的水性组合物。
[0029]
防止药物氧化的添加剂可在药物之前或之后添加到水性组合物中。
[0030]
药物
[0031]
本公开的水性组合物包含药物。在本公开的上下文中,药物是眼用药物,即当以足够的量向患有眼部病症的患者施用时表现出治疗效果的化合物。
[0032]
在一个实施方案中,药物是皮质类固醇,其包括糖皮质激素和盐皮质激素。有利地,药物选自倍他米松型皮质类固醇,其为具有c
16
甲基取代的糖皮质激素。倍他米松型皮质类固醇包括阿氯米松、倍氯米松、倍他米松、氯倍他松、氯可托龙、脱氧米松、地塞米松、二氟可龙、氟米松、氟可龙、氟泼尼定、氟替卡松、卤米松和莫米松。优选地,药物是地塞米松。
[0033]
在具体的实施方案中,药物易于氧化,这意味着药物可通过氧化途径降解。在某些情况下,这种氧化的降解产物是酸性降解产物,且加入防止药物氧化的添加剂防止酸性降解产物的形成。
[0034]
本公开的水性组合物中药物的浓度可以为约0.1mg/ml-约100mg/ml,特别地为约1mg/ml-约100mg/ml,特别地为约1mg/ml-约50mg/ml,更特别地为约1mg/ml-约40mg/ml,甚至更特别地为约5mg/ml-约35mg/ml,还更特别地为约10mg/ml-约30mg/ml。本公开的水性组合物中药物的浓度可为约5mg/ml-约30mg/ml,特别地为约10mg/ml-约25mg/ml。
[0035]
水性组合物中药物的量可以为,基于组合物的体积,以药物的重量计0.5-5%,特别地为1-4%,更特别地为1.5-3%。
[0036]
环糊精
[0037]
水性组合物可包含环糊精。水性组合物中环糊精的量可以为,基于组合物的体积,以环糊精重量计1-35%,特别地为5-30%,更特别地为10-27%,甚至更特别地为12-25%的
cyclodextrin on drug solubilization.journal of inclusion phenomena and macrocyclic chemistry 68,229-236)。溶解的药物/环糊精复合物的低浓度阻碍含有药物/环糊精复合物的纳米颗粒和微粒的形成。此外,其他赋形剂,诸如用于稳定纳米悬浮液和微悬浮液的水溶性聚合物,可与环糊精形成复合物,因此甚至进一步阻碍药物/环糊精复合物的形成。
[0041]
此前,申请人已经描述了基于环糊精的滴眼液的制备和测试,所述滴眼液在环糊精纳米颗粒中含有地塞米松(johannesson,g.,moya-ortega,m.d.,asgrimsdottir,g.m.,lund,s.h.,thorsteinsdottir,m.,loftsson,t.,stefansson,e.,2014.kinetics ofγ-cyclodextrin nanoparticle suspension eye drops in tear fluid.acta ophthalmologica 92,550-556;thorsteinn loftsson and einar stefansson,cyclodextrin nanotechnology for ophthalmic drug delivery,美国专利号7,893,040(2011年2月22日);thorsteinn loftsson and einar stefansson,cyclodextrin nanotechnology for ophthalmic drug delivery,美国专利号8,633,172(2014年1月21日);thorsteinn loftsson and einar stefansson,cyclodextrin nanotechnology for ophthalmic drug delivery美国专利号8,999,953(2015年4月7日)),多佐胺(johannesson,g.,maya-ortega,m.d.,asgrimsdottir,g.m.,lund,s.h.,thorsteinsdottir,m.,loftsson,t.,stefansson,e.,2014.kinetics ofγ-cyclodextrin nanoparticle suspension eye drops in tear fluid.acta ophthalmologica 92,550-556;gudmundsdottir,b.s.,petursdottir,d.,asgrimsdottir,g.m.,gottfredsdottir,m.s.,hardarson,s.h.,johannesson,g.,kurkov,s.v.,jansook,p.,loftsson,t.,stefansson,e.,2014.γ-cyclodextrin nanoparticle eye drops with dorzolamide:effect on intraocular pressure in man.j.ocul.pharmacol.ther.30,35-41),厄贝沙坦(muankaew,c.,jansook,p.,stefansson,e.,loftsson,t.,2014.effect ofγ-cyclodextrin on solubilization and complexation of irbesartan:influence of ph and excipients.int j pharm 474,80-90),替米沙坦(c.muankaew,p.jansook,h.h.t.loftsson,2016,cyclodextrin-based telmisartan ophthalmic suspension:formulation development for water-insoluble drugs.int.j.pharm.507,21-31)和环孢菌素a(s.j
ó
hannsd
ó
ttir,p.jansook,e.stefansson,t.loftsson,2015,development of a cyclodextrin-based aqueous cyclosporin a eye drop formulation.int.j.pharm.493(1-2),86-95)。研究表明,纳米颗粒增加了药物与眼表面的接触时间和药物的眼部生物利用度。药物/环糊精纳米颗粒和微粒不仅保留在眼睛表面,且还提高药物在水性泪液中的溶解度。由药物/γ-环糊精复合物组成的纳米颗粒和微粒已证明是将药物局部递送至眼中的特别有效的药物载体。
[0042]
本公开的组合物可包含含有药物和环糊精的固体复合物。包含药物和环糊精的复合物可称为“药物/环糊精复合物”。当药物为皮质类固醇时,包含皮质类固醇和环糊精的复合物可称为“皮质类固醇/环糊精复合物”。当药物为地塞米松且环糊精为γ-环糊精时,包含地塞米松和γ-环糊精的复合物可称为“地塞米松/γ-环糊精复合物”。
[0043]
本公开的组合物的固体复合物可以为复合物聚集体。复合物聚集体可对应于多种复合物聚集体,特别地为包含药物和环糊精的多种包合复合物,通常是包含药物和γ-环糊
精的复合物。
[0044]
根据一个实施方案,本公开的水性组合物为微悬浮液。
[0045]
特别地,本公开的水性组合物包含直径d
50
小于约100μm,特别地约1μm-约100μm的固体复合物。在一个实施方案中,直径d
50
可在约1μm-约25μm,特别地约1μm-约20μm,更特别地约1μm-约10μm,甚至更特别地约2μm-约10μm,还更特别地约2μm-约5μm或约3μm-约8μm的范围内。颗粒或复合物的直径和/或尺寸可根据本领域普通技术人员已知的任何方法测量。例如,通过激光衍射粒度分析测量直径d
50
。通常,存在有限的技术用于测量/评估环糊精/药物颗粒或复合物直径和/或尺寸。特别地,本领域普通技术人员知道,物理性质(例如粒度、直径、平均直径、平均粒度等)通常使用这种有限的,典型的已知技术来评价/测量。例如,该已知技术在int.j.pharm.493(2015),86-95中描述,其全文引用的方式并入本文。此外,这种有限的,已知的测量/评估技术是本领域已知的,如其他技术参考文献所证明的,例如欧洲药典(2.9.31particle size analysis by laser diffraction,2010年1月),以及saurabh bhatia,nanoparticles types,classification,characterization,fabrication methods and drug delivery applications,chapter 2,natural polymer drug delivery systems,pp.33-94,springer,2016,其也通过引用整体并入本文。
[0046]
欧洲药典(01/2008:1163)教导了悬浮液形式的滴眼液应符合以下要求:对于每10μg固体活性物质,不超过约20个颗粒具有大于约25μm的最大尺寸,且这些颗粒不超过约2个具有大于约50μm的最大尺寸。没有颗粒可具有大于约90μm的最大尺寸。本公开的水性组合物符合欧洲药典(01/2008:1163)的要求。
[0047]
通常,推荐将水性滴眼悬浮液中的粒度保持为最小,优选低于约10μm,以防止眼睛刺激。此外,水悬浮液中的沉降速率与粒径成比例,假定所有其他因素保持恒定,大颗粒的沉降速率比小颗粒的沉降速率快。
[0048]
特别地,组合物中60-95重量%,更特别地70-90重量%的药物可以是药物和环糊精的固体复合物的形式。
[0049]
甚至更特别地,组合物中5-40重量%,特别地10-30重量%的药物可以是溶解形式。溶解形式包括溶解在液相中的未复合药物和溶解在液相中的药物与环糊精的复合物以及由药物/环糊精复合物聚集体组成的水溶性纳米颗粒。
[0050]
优选地,组合物中0%-0.5%(以重量计)的药物可以为未复合的固体形式。因此,本公开的组合物可基本上不含固体未复合的药物颗粒。
[0051]
在一个实施方案中,微混悬剂可包含约70%-约99%的微粒形式的药物和约1%-约30%的纳米颗粒形式的药物。更特别地,微混悬剂可包含约80%-约95%的直径为约1μm-约10μm的微粒的药物,以及约20%-约5%的纳米颗粒的药物。微混悬剂可包含约80%的直径为约1μm-约10μm的微粒的药物,以及约20%的纳米颗粒的药物。
[0052]
在另一个实施方案中,微混悬剂可包含约40%-约99%的微粒的药物和约1%-约60%的纳米颗粒的药物或水溶性药物/环糊精复合物。特别地,微混悬剂可包含约80%-约95%的直径为约1μm-约10μm的微粒的药物,以及约5%-约20%的纳米颗粒的药物或水溶性活性药物成分/环糊精复合物。
[0053]
根据优选的实施方案,水性组合物包含药物/环糊精复合物,优选皮质类固醇/环糊精复合物,更优选地塞米松/γ-环糊精复合物。
[0054]
包含药物/环糊精复合物的组合物的实例公开于wo2018/100434中,其通过引用并入本文。
[0055]
防止药物氧化的添加剂
[0056]
水性组合物包含防止药物氧化的添加剂。申请人惊讶地发现,添加防止药物氧化的添加剂可稳定水性组合物的ph,并防止ph下降。
[0057]
在优选的实施方案中,防止药物氧化的添加剂选自抗氧化剂、氧清除剂及其混合物。
[0058]
抗氧化剂典型地包括酚类抗氧化剂和还原剂。酚类抗氧化剂是与自由基反应、阻断氧化反应的空间位阻酚类。在酚类抗氧化剂中,可列举丁基羟基茴香醚(bha)、丁基羟基甲苯(bht)、叔丁基对二苯酚(tbhq)或3,4-二羟基苯甲酸、十二烷基3,4,5-三羟基苯甲酸酯(没食子酸月桂酯)。还原剂是具有比其要防止氧化的药物更低的氧化还原电位的化合物。还原剂从介质中清除氧气,从而延迟或防止氧化。在还原剂中,可列举硫代硫酸钠(sts)或其他具有抗氧化性质的工业食品防腐剂。抗氧化剂的实例还包括水溶性天然抗氧化剂,诸如抗坏血酸、苹果酸、柠檬酸、酒石酸、乳酸和其他有机酸及其衍生物。其他抗氧化剂可进一步选自已知的食品抗氧化剂。
[0059]
在具体的实施方案中,防止药物氧化的添加剂是硫代硫酸钠。
[0060]
在另一个具体的实施方案中,防止药物氧化的添加剂选自硫代硫酸钠、甲硫氨酸、3,4-二羟基苯甲酸、柠檬酸钠、苹果酸、抗坏血酸钠、酒石酸、α-硫代甘油、丁基羟基茴香醚、没食子酸月桂酯、乳酸、叔丁基对苯二酚及其盐或衍生物,或其混合物。更优选地,所述添加剂选自硫代硫酸钠、甲硫氨酸(典型地,l-甲硫氨酸)、3,4-二羟基苯甲酸、柠檬酸钠(例如柠檬酸钠三元脱水物)、苹果酸(典型地,dl-苹果酸、抗坏血酸钠(例如(+)-l-抗坏血酸钠)、酒石酸(典型地,dl-酒石酸)、α-硫代甘油和丁基羟基茴香醚,甚至更优选地,所述添加剂选自硫代硫酸钠、甲硫氨酸和3,4-二羟基苯甲酸。当然,所述抗氧化剂的混合物可作为添加剂加入以防止药物的氧化。
[0061]
可以至少0.05%(w/v)的浓度,优选0.05%(w/v)-1%(w/v),更优选0.1-0.5%,还更优选0.2%(w/v)-0.4%(w/v)的浓度加入防止药物氧化的添加剂,典型地为硫代硫酸钠、甲硫氨酸或3,4-二羟基苯甲酸。防止药物氧化的添加剂,典型地,硫代硫酸钠,可以以0.2%(w/v)-0.3%(w/v)的浓度加入。
[0062]
如本文所用,0.3%(w/v)硫代硫酸钠的浓度对应于不含水的硫代硫酸钠。这相当于0.471g/100ml硫代硫酸钠五水合物。对于其他抗氧化剂,通常在水性组合物中可使用摩尔当量的0.3%硫代硫酸钠。
[0063]
组合物的ph
[0064]
有利地,包含药物的水性组合物的ph为4-9,优选5-8。通常,包含药物的水性组合物的ph是生理ph。
[0065]
有利地,包含皮质类固醇的水性组合物的ph为4-8,优选4.5-6。
[0066]
在具体的实施方案中,根据ich指南,当在25℃,40%相对湿度下储存时,水性组合物的ph在4-8,优选在4.5-6稳定超过6个月,优选超过9个月。
[0067]
水性组合物
[0068]
有利地,水性组合物是眼科可接受的介质。术语“眼科可接受的介质”是指适用于
组合物的眼部施用的介质。眼科可接受的介质优选为液体。
[0069]
水性组合物可包含有机溶剂。在本发明中,水性组合物优选不包含有机溶剂。
[0070]
在具体实施方案中,眼科可接受的介质不包含除水之外的任何其他溶剂。因此,眼科可接受的介质可对应于水性滴眼液载体。在具体的实施方案中,水性组合物是无缓冲的水性滴眼液载体。
[0071]
根据具体的实施方案,水性组合物包含水和任选的选自下组的添加剂:防腐剂、稳定剂、电解质及其组合。特别地,眼科可接受的介质可以包含防腐剂。
[0072]
防腐剂可用于限制组合物中的细菌增殖。防腐剂的实例是苯扎氯铵、氯丁醇、硫柳汞、乙酸苯汞、硝酸苯汞、对羟基苯甲酸甲酯、苯乙醇及其组合。本公开的组合物中防腐剂的量可以为,基于组合物的体积,以防腐剂的重量计0-1%,特别地为0.001-0.5%,更特别地为0.005-0.1%,甚至更特别地0.01-0.04%。在优选的实施方案中,水性组合物不含防腐剂。
[0073]
特别地,水性组合物可包含稳定剂。合适的稳定剂的实例是依地酸二钠。本公开的组合物中稳定剂的量可以为,基于组合物的体积,以稳定剂的重量计0-1%,特别地为0.01-0.5%,更特别地为0.08-0.2%。
[0074]
特别地,眼科可接受的介质可包含电解质。电解质尤其可用于使组合物等渗。合适的电解质的实例包括氯化钠、氯化钾及其组合。优选地,电解质是氯化钠。本公开的组合物中电解质的量可以为,基于组合物的体积,以电解质的重量计0-2%,特别地为0.1-1.5%,更特别地为0.2-1%。
[0075]
水性组合物可进一步包含聚合物。特别地,所述聚合物可以是水溶性聚合物。此外,所述聚合物可以是粘度增强聚合物。术语“粘度增强聚合物”是指增加液体粘度的聚合物。聚合物增加本公开的组合物的粘度。粘度的增加导致组合物的物理稳定性提高。因此,当组合物包含聚合物时,其较不易于发生固体复合物的沉降。因此,聚合物可被认为是聚合物稳定剂。特别地,聚合物可以是表面活性聚合物。术语“表面活性聚合物”是指表现出表面活性剂性质的聚合物。表面活性聚合物可以例如包含接枝到亲水性主链聚合物上的疏水性链;接枝到疏水性主链上的亲水链;或交替的亲水和疏水片段。前两种类型称为接枝共聚物,第三种类型称为嵌段共聚物。
[0076]
在一个实施方案中,本公开的眼用组合物包含选自下组的聚合物:聚氧乙烯脂肪酸酯;聚氧乙烯烷基苯基醚;聚氧乙烯烷基醚;纤维素衍生物诸如烷基纤维素、羟烷基纤维素和羟烷基烷基纤维素;羧乙烯基聚合物诸如卡波,例如carbopol 971和carbopol 974;聚乙烯聚合物;聚乙烯醇;聚乙烯吡咯烷酮;聚氧丙烯和聚氧乙烯的共聚物;泰洛沙泊;及其组合。
[0077]
合适的聚合物的实例包括但不限于聚乙二醇单硬脂酸酯、聚乙二醇二硬脂酸酯、羟丙基甲基纤维素、羟丙基纤维素、聚乙烯吡咯烷酮、聚氧乙烯月桂基醚、聚氧乙烯辛基十二烷基醚、聚氧乙烯硬脂基醚、聚氧乙烯肉豆蔻基醚、聚氧乙烯油基醚、失水山梨糖醇酯、聚氧乙烯十六烷基醚(例如聚西托醇1000)、聚氧乙烯蓖麻油衍生物、聚氧乙烯失水山梨糖醇脂肪酸酯(例如tween 20和tween 80(ici specialty chemicals));聚乙二醇类(例如carbowax 3550和934(union carbide))、聚氧乙烯硬脂酸酯、羧甲基纤维素钙、羧甲基纤维素钠、甲基纤维素、羟乙基纤维素、羟丙基甲基纤维素、纤维素、聚乙烯醇(pva)、泊洛沙姆
(例如普朗尼克f68和fi08、其为环氧乙烷和环氧丙烷的嵌段共聚物);泊洛沙胺(例如tetronic 908,也称为泊洛沙胺908,其为衍生自环氧丙烷和环氧乙烷与乙二胺(basf wyandotte corporation,parsippany,n.j.)依次加成的四官能嵌段共聚物);tetronic 1508(t-1508)(basf wyandotte corporation),tritons x-200,其为烷基芳基聚醚磺酸盐(rohm和haas);peg-衍生的磷脂、peg-衍生的胆固醇、peg-衍生的胆固醇衍生物、peg-衍生的维生素a、peg-衍生的维生素e、乙烯基吡咯烷酮和乙酸乙烯酯的无规共聚物,其组合等。
[0078]
根据本公开的聚合物的特别优选的实例是泰洛沙泊以及聚氧丙烯和聚氧乙烯的共聚物。
[0079]
更特别地,聚氧丙烯和聚氧乙烯的共聚物可以是包含亲水嵌段-疏水嵌段-亲水嵌段构型的三嵌段共聚物。
[0080]
在一个实施方案中,本公开的组合物包含泊洛沙姆的聚合物。泊洛沙姆可包括本领域已知的任何类型的泊洛沙姆。泊洛沙姆包括泊洛沙姆101、泊洛沙姆105、泊洛沙姆108、泊洛沙姆122、泊洛沙姆123、泊洛沙姆124、泊洛沙姆181、泊洛沙姆182、泊洛沙姆183、泊洛沙姆184、泊洛沙姆185、泊洛沙姆188、泊洛沙姆212、泊洛沙姆215、泊洛沙姆217、泊洛沙姆231、泊洛沙姆234、泊洛沙姆235、泊洛沙姆237、泊洛沙姆238、泊洛沙姆282、泊洛沙姆284、泊洛沙姆288、泊洛沙姆331、泊洛沙姆333、泊洛沙姆334、泊洛沙姆335、泊洛沙姆338、泊洛沙姆401、泊洛沙姆402、泊洛沙姆403、泊洛沙姆407、泊洛沙姆105苯甲酸酯和泊洛沙姆182二苯甲酸酯。泊洛沙姆的商品名也称为普朗尼克(pluronic),诸如普朗尼克10r5、普朗尼克17r2、普朗尼克17r4、普朗尼克25r2、普朗尼克25r4、普朗尼克31 r1、普朗尼克f 108、普朗尼克f 108、普朗尼克f 108、普朗尼克f 108nf、普朗尼克f 127、普朗尼克f 127 nf、普朗尼克f 127、普朗尼克f 127、普朗尼克f 38,普朗尼克f 38、普朗尼克f 68、普朗尼克f 77、普朗尼克f 87、普朗尼克f 88、普朗尼克f 98、普朗尼克l 10、普朗尼克l 101、普朗尼克l 121、普朗尼克l 31、普朗尼克l 3s。普朗尼克l 43、普朗尼克l 44、普朗尼克l 61、普朗尼克l 62、普朗尼克l 62lf、普朗尼克l 620、普朗尼克l 64,普朗尼克l 81、普朗尼克l 92、普朗尼克l 44、普朗尼克n 3、普朗尼克p 103、普朗尼克p 104、普朗尼克p 85、普朗尼克p 123、普朗尼克p 65、普朗尼克p 84、普朗尼克p 85,其组合等。
[0081]
作为稳定剂特别有用的聚合物是泊洛沙姆。泊洛沙姆可以包括本领域已知的任何类型的泊洛沙姆。泊洛沙姆包括泊洛沙姆101、泊洛沙姆105、泊洛沙姆108、泊洛沙姆122、泊洛沙姆123、泊洛沙姆124、泊洛沙姆181、泊洛沙姆182、泊洛沙姆183、泊洛沙姆184、泊洛沙姆185、泊洛沙姆188、泊洛沙姆212、泊洛沙姆215、泊洛沙姆217、泊洛沙姆231、泊洛沙姆234、泊洛沙姆23s、泊洛沙姆237、泊洛沙姆238、泊洛沙姆282、泊洛沙姆284、泊洛沙姆288、泊洛沙姆331、泊洛沙姆333、泊洛沙姆334、泊洛沙姆33s、泊洛沙姆338、泊洛沙姆401、泊洛沙姆402、泊洛沙姆403、泊洛沙姆407、泊洛沙姆105苯甲酸酯和泊洛沙姆182二苯甲酸酯。泊洛沙姆的商品名也称为普朗尼克,诸如普朗尼克10r5、普朗尼克17r2、普朗尼克17r4、普朗尼克25r2、普朗尼克25r4、普朗尼克31 r1、普朗尼克f 108铸造固体表面活性剂、普朗尼克f 108nf、普朗尼克f 108锭剂、普朗尼克f 108nf颗粒泊洛沙姆338、普朗尼克f 127、普朗尼克f 127 nf、普朗尼克f 127 nf 500 bht颗粒、普朗尼克f 127 nf颗粒泊洛沙姆407、普朗尼克f 38、普朗尼克f 38锭剂、普朗尼克f 68、普朗尼克f 68锭剂、普朗尼克f 68 lf锭剂、普朗尼克f 68 nf、普朗尼克f 68 nf颗粒泊洛沙姆188、普朗尼克f 77、普朗尼克f 77微锭剂、
普朗尼克f 87、普朗尼克f 87 nf、普朗尼克f 87 nf颗粒泊洛沙姆237、普朗尼克f 88、普朗尼克f 88锭剂、普朗尼克f 98、普朗尼克l 10、普朗尼克l 101、普朗尼克l 121、普朗尼克l 31、普朗尼克l 35、普朗尼克l 43、普朗尼克l 44nf泊洛沙姆124、普朗尼克l 61、普朗尼克l 62、普朗尼克l 62 lf、普朗尼克l 620、普朗尼克l 64、普朗尼克l 81、普朗尼克l 92、普朗尼克l44 nf inh表面活性剂泊洛沙姆124 view、普朗尼克n3、普朗尼克p 103、普朗尼克p 104、普朗尼克p 105、普朗尼克p 123表面活性剂、普朗尼克p 65、普朗尼克p 84、普朗尼克p 85,其组合等。特别地,所述聚合物是泊洛沙姆407。
[0082]
与本文所述的组合物和方法相容的其他聚合稳定剂是泰洛沙泊。在优选的实施方案中,稳定剂和助溶剂为泰洛沙泊,其为含有甲醛和环氧乙烷的4-(1,1,3,3-四甲基丁基)苯酚聚合物。
[0083]
本公开还涉及用于稳定包含皮质类固醇/环糊精复合物的水性组合物ph的方法,所述方法包含添加抗氧化剂以防止皮质类固醇的氧化,例如一种或多种如前章节所述的抗氧化剂,典型地硫代硫酸钠。
[0084]
本公开还涉及用于稳定包含药物的水性组合物ph的方法,所述方法包含使用氧吸收剂以防止药物的氧化。所述包含药物的水性组合物可储存在小瓶中,且小瓶可包装在含有氧吸收剂的密封袋中,典型地为铝袋。有利地,氧吸收剂含有铁颗粒。
[0085]
包含皮质类固醇的水性组合物
[0086]
本公开还涉及包含皮质类固醇、环糊精和防止皮质类固醇氧化的添加剂的水性组合物,其中所述添加剂(例如前章节所述的还原剂、水溶性天然抗氧化剂或酚类抗氧化剂,典型地,硫代硫酸钠)以0.15%(w/v)-0.45%(w/v),且优选地0.2%(w/v)-0.4%(w/v)的浓度存在于组合物中。防止皮质类固醇氧化的添加剂(例如前章节所述的还原剂、水溶性天然抗氧化剂或酚类抗氧化剂,典型地,硫代硫酸钠)可以0.2%(w/v)-0.3%(w/v)的浓度存在。
[0087]
皮质类固醇
[0088]
皮质类固醇包括糖皮质激素和盐皮质激素。有利地,皮质类固醇选自倍他米松型皮质类固醇,其为具有c
16
甲基取代的糖皮质激素。倍他米松型皮质类固醇包括阿氯米松、倍氯米松、倍他米松、氯倍他松、氯可托龙、脱氧米松、地塞米松、二氟可龙、氟米松、氟可龙、氟泼尼定、氟替卡松、卤米松和莫米松。优选地,药物是地塞米松。
[0089]
在具体的实施方案中,皮质类固醇易于氧化,这意味着皮质类固醇可通过氧化途径降解。在某些情况下,这种氧化的降解产物是酸性降解产物,且防止药物氧化的添加剂的添加防止酸性降解产物的形成。
[0090]
本公开的水性组合物中皮质类固醇的浓度可为约0.1mg/ml-约100mg/ml,特别地约1mg/ml-约100mg/ml,特别地约1mg/ml-约50mg/ml,更特别地约1mg/ml-约40mg/ml,甚至更特别地约5mg/ml-约35mg/ml,还更特别地约10mg/ml-约30mg/ml。本公开的水性组合物中皮质类固醇的浓度可为约5mg/ml-约30mg/ml,特别地约10mg/ml-约25mg/ml。
[0091]
水性组合物中皮质类固醇的量可以为,基于组合物的体积,以皮质类固醇的重量计0.5-5%,特别地为1-4%,更特别地为1.5-3%。
[0092]
环糊精
[0093]
水性组合物包含环糊精。水性组合物中环糊精的量可以为,基于组合物的体积,以环糊精的重量计1-35%,特别地为5-30%,更特别地为10-27%,甚至更特别地为12-25%。
水性组合物中环糊精的量可以为,基于组合物的体积,以环糊精的重量计10-25%,特别地为12-20%。在采用地塞米松为药物的某些实施方案中,水性组合物中环糊精(典型地γ-环糊精)的量为10-25%,地塞米松的量为1.5%。在其他实施方案中,水性组合物中环糊精(典型地γ-环糊精)的量可以为20-25%,例如23%,特别地与2.0-3.5%的地塞米松,优选与约3%的地塞米松组合。
[0094]
皮质类固醇可形成如上所述的皮质类固醇/环糊精复合物。
[0095]
防止皮质类固醇氧化的添加剂
[0096]
水性组合物包含防止皮质类固醇氧化的添加剂。申请人惊讶地发现,添加防止氧化的添加剂稳定水性组合物的ph,并防止ph下降。
[0097]
在优选的实施方案中,防止皮质类固醇氧化的添加剂选自抗氧化剂、氧清除剂及其混合物。
[0098]
抗氧化剂包括酚类抗氧化剂和还原剂,诸如水溶性天然抗氧化剂或其他已知的食品抗氧化剂。
[0099]
酚类抗氧化剂中,可列举丁基羟基茴香醚(bha)、丁基羟基甲苯(bht)、叔丁基对苯二酚(tbhq)或3,4-二羟基苯甲酸、十二烷基3,4,5-三羟基苯甲酸酯(没食子酸月桂酯)。还原剂是具有比其要防止氧化的药物更低的氧化还原电位的化合物。还原剂从介质中清除氧气,从而延迟或防止氧化。还原剂中,可列举硫代硫酸钠(sts)。抗氧化剂的实例还包括水溶性天然抗氧化剂,诸如抗坏血酸、苹果酸、柠檬酸、酒石酸、乳酸和其他有机酸及其衍生物。
[0100]
其他抗氧化剂可选自已知的食品或化妆品抗氧化剂。
[0101]
在具体的实施方案中,防止药物氧化的添加剂是硫代硫酸钠。
[0102]
在另一个具体实施方案中,防止药物氧化的添加剂选自硫代硫酸钠、甲硫氨酸、3,4-二羟基苯甲酸、柠檬酸钠、苹果酸、抗坏血酸钠、酒石酸、α-硫代甘油、丁基羟基茴香醚、没食子酸月桂酯、乳酸、叔丁基对苯二酚及其盐或衍生物。更优选地,所述添加剂选自硫代硫酸钠、甲硫氨酸(典型地为l-甲硫氨酸)、3,4-二羟基苯甲酸、柠檬酸钠(例如柠檬酸三钠二水合物)、苹果酸(典型地,dl-苹果酸、抗坏血酸钠(例如(+)-l-抗坏血酸钠)、酒石酸(典型地,dl-酒石酸)、α-硫代甘油和丁基羟基茴香醚,甚至更优选地,所述添加剂选自硫代硫酸钠、甲硫氨酸和3,4-二羟基苯甲酸。当然,所述抗氧化剂的混合物可作为添加剂加入以防止药物的氧化。
[0103]
组合物的ph
[0104]
有利地,包含皮质类固醇的水性组合物的ph为4-8,优选4.5-6。
[0105]
在具体的实施方案中,根据ich指南,当在25℃,40%相对湿度下储存时,水性组合物的ph为4-8,优选在4.5-6稳定超过6个月,优选超过9个月。
[0106]
水性组合物
[0107]
有利地,如上所述,水性组合物是眼科可接受的介质。
[0108]
在特别优选的实施方案中,水性组合物包含:
[0109]-1-4%的地塞米松,例如1.5%-3%的地塞米松;
[0110]-1-35%的γ-环糊精,例如5-25%的γ-环糊精;
[0111]-2.2-2.8%的聚合物,或2.8-3.2%,例如2.5%或3.0%的聚合物,典型地泊洛沙姆;
[0112]-0-0.2%的稳定剂,例如0.1%的稳定剂,典型地,依地酸二钠;
[0113]-0.15-0.45%的防止皮质类固醇氧化的添加剂,例如0.2%-0.4%或0.2%-0.3%的防止皮质类固醇氧化的添加剂,典型地为酚类抗氧化剂或还原剂,诸如水溶性天然抗氧化剂,且更优选硫代硫酸钠、l-甲硫氨酸或3,4-二羟基苯甲酸;
[0114]-0-1%的电解质,例如0.57%的电解质,典型地氯化钠;以及
[0115]-水;
[0116]
其中%是基于组合物体积的重量%。
[0117]
包含皮质类固醇、环糊精和防止皮质类固醇氧化的添加剂的水性组合物可储存在塑料小瓶中,通常是ldpe小瓶或玻璃小瓶。
[0118]
含有地塞米松的优选水性组合物
[0119]
在特定的实施方案中,水性组合物包含以下或基本上由以下组成:
[0120]-1-4%的地塞米松,例如1.5%-3%的地塞米松;
[0121]-1-35%的γ-环糊精,例如5-25%的γ-环糊精;
[0122]-0-0.2%的稳定剂,例如0.1%的稳定剂,典型地,依地酸二钠;
[0123]-0-1%的电解质,例如0.57%的电解质,典型地,氯化钠;以及
[0124]-水;
[0125]
其中%是基于组合物体积的重量%。
[0126]
在具体的实施方案中,用于如本说明书中所述的水性组合物包含以下或基本上由以下组成:
[0127]-1-4%的地塞米松,例如1.5%-3%的地塞米松;
[0128]-1-35%的γ-环糊精,例如5-25%的γ-环糊精;
[0129]-任选地2.2-2.8%的聚合物或2.8%-3.2%的聚合物,例如聚合物的2.5%或3.0%的聚合物,典型地,泊洛沙姆;
[0130]-0-0.2%的稳定剂,例如0.1%的稳定剂,典型地,依地酸二钠;
[0131]-0%-0.8%的防止地塞米松氧化的添加剂,例如0.1%-0.5%或0.2%-0.4%的防止皮质类固醇氧化的添加剂,典型地,酚类抗氧化剂或还原剂,诸如水溶性天然抗氧化剂,且更优选硫代硫酸钠、l-甲硫氨酸或3,4-二羟基苯甲酸;
[0132]-0-1%的电解质,例如0.57%的电解质,典型地氯化钠;以及
[0133]-水;
[0134]
其中%是基于组合物体积的重量%。
[0135]
更具体地,特别优选的实施方案是包含以下或基本上由以下组成的滴眼液制剂:
[0136]-1.5%的地塞米松;
[0137]-14%的γ-环糊精;
[0138]-2.5%的泊洛沙姆;
[0139]-0-0.2%的稳定剂,例如0.1%的依地酸二钠;
[0140]-0-1%的电解质,例如0.57%的氯化钠;
[0141]-0%-0.6%的防止地塞米松氧化的添加剂,例如0.2%-0.4%的防止皮质类固醇氧化的添加剂,典型地酚类抗氧化剂或还原剂,诸如水溶性天然抗氧化剂,且更优选硫代硫酸钠、l-甲硫氨酸或3,4-二羟基苯甲酸;以及
[0142]-水;
[0143]
其中%是基于组合物体积的重量%。
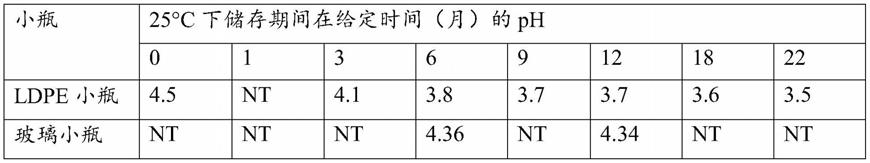
[0144]
典型地,滴眼液制剂具有以下组分:
[0145]-1.5%的地塞米松;
[0146]-14%的γ-环糊精;
[0147]-2.5%的泊洛沙姆;
[0148]-0.1%的依地酸二钠;
[0149]-0.57%的氯化钠;以及
[0150]-0.2%-0.4%的硫代硫酸钠;
[0151]-水;
[0152]
另一个特定的实施方案是包含以下或基本上由以下组成的滴眼液制剂:
[0153]-3%的地塞米松;
[0154]-1-35%的γ-环糊精,例如20-25%的γ-环糊精;
[0155]-任选地2.8-3.2%的聚合物,例如3.0%的聚合物,典型地,泊洛沙姆;
[0156]-0-0.2%的稳定剂,例如0.1%的稳定剂,典型地,依地酸二钠;
[0157]-0%-0.6%的防止地塞米松氧化的添加剂,例如0.1%-0.5%或0.2%-0.4%的防止皮质类固醇氧化的添加剂,典型地为酚类抗氧化剂或还原剂,诸如水溶性天然抗氧化剂,且更优选硫代硫酸钠、l-甲硫氨酸或3,4-二羟基苯甲酸;
[0158]-0-1%的电解质,例如0.57%的电解质,典型地,氯化钠;以及
[0159]-水;
[0160]
其中%是基于组合物体积的重量%。
[0161]
另一个特定的实施方案是包含以下或基本上由以下组成的滴眼液制剂:
[0162]-3%的地塞米松;
[0163]-20-25%的γ-环糊精;
[0164]-任选地2.8-3.2%的泊洛沙姆;例如3.0%的泊洛沙姆;
[0165]-0-0.2%的稳定剂,例如0.1%的依地酸二钠;
[0166]-0-1%的电解质,例如0.57%的氯化钠;
[0167]-0%-0.6%的防止地塞米松氧化的添加剂,例如0.1%-0.5%或0.2%-0.4%的防止皮质类固醇氧化的添加剂,典型地为酚类抗氧化剂或还原剂,诸如水溶性天然抗氧化剂,且更优选硫代硫酸钠、l-甲硫氨酸或3,4-二羟基苯甲酸;以及
[0168]-水;
[0169]
其中%是基于组合物体积的重量%。
[0170]
典型地,滴眼液制剂具有以下组分:
[0171]-3%的地塞米松;
[0172]-20-25%的γ-环糊精;例如23%的γ-环糊精;
[0173]-2.8-3.2%的泊洛沙姆;
[0174]-0.1%的依地酸二钠;
[0175]-0.57%的氯化钠;以及
[0176]-0.2%-0.4%的硫代硫酸钠;典型地,0.3%的硫代硫酸钠,
[0177]-水;
[0178]
所有上述制剂或水性组合物有利地不含防腐剂。
[0179]
用作滴眼液的最终制剂是微混悬剂,其包含地塞米松和γ-环糊精的复合物聚集体。典型地,组合物中60-95重量%,更特别地70-90重量%的地塞米松可以为地塞米松和γ-环糊精的固体复合物形式。
[0180]
制备此类制剂的方法包含以下步骤:
[0181]
a)将在眼科可接受的介质中的地塞米松与其他赋形剂混合并加热直到地塞米松基本上溶解在眼科可接受的介质中;例如在80℃-110℃的温度下至少60分钟,
[0182]
b)将γ环糊精悬浮在眼科可接受的介质中以形成悬浮液并加热所述悬浮液直至环糊精基本上溶解在眼科可接受的介质中;
[0183]
c)在低于120℃的温度t1下混合步骤a)和b)的组合物,并在低于120℃的温度t1下将混合物加热t时间;以及
[0184]
d)将所得溶液冷却至温度t2以获得包含地塞米松和环糊精(优选γ环糊精)固体复合物的水性组合物。
[0185]
在上述制备方法中,地塞米松可任选地与其他赋形剂一起,悬浮在不含环糊精的眼科可接受的介质中。所得悬浮液可具有乳状外观。γ环糊精可单独地悬浮在不含活性药物成分的眼科可接受的介质中。所得悬浮液可具有乳状外观。这两种悬浮液可通过例如在高压釜中121℃下加热20分钟来加热或灭菌。然后将两种悬浮液或热溶液混合在一起,加热混合物直至形成地塞米松和γ-环糊精的复合物。所得溶液可以以足以产生包含固体活性药物成分/γ-环糊精复合物的微混悬剂的速率冷却。
[0186]
制备微悬浮液的详细方法也描述于wo2018100434中。
[0187]
如上所述的微混悬剂是稳定的且可用作滴眼液制剂。
[0188]
在具体的实施方案中,所述含有1.5%(w/v)的水性组合物是不含防腐剂的眼用微混悬剂。它们可以以0.5ml填充体积的单位剂量存在,例如在ldpe塑料材料中。所得悬浮液可在低于25℃的环境温度下储存,并储存至少2、3、6、12、18或24个月。
[0189]
包含皮质类固醇的水性组合物的用途
[0190]
本公开的水性组合物可用于治疗眼部病症,特别是眼前部病症或眼后部病症,更特别地为葡萄膜炎、黄斑水肿、黄斑变性、视网膜脱离、眼部肿瘤、真菌或病毒感染、多灶性脉络膜炎、糖尿病性视网膜病、增生性玻璃体视网膜病(pvr)、交感性眼炎、vogt koyanagi-harada(vkh)综合征、组织胞浆菌病、葡萄膜扩散和血管闭塞。本公开的水性组合物可特别地用于治疗葡萄膜炎、黄斑水肿、糖尿病性视网膜病、增生性玻璃体视网膜病(pvr)和血管闭塞。
[0191]
根据本公开的包含地塞米松的水性组合物可特别地用于治疗黄斑水肿。在这种情况下,根据本公开的包含地塞米松的水性组合物可以每天三次以1滴组合物的量局部施用于眼睛。所述组合物中地塞米松的量可以为,基于组合物的体积,以地塞米松的重量计1-5%,特别地为1.5%-3%。
[0192]
本公开的包含地塞米松的组合物不需要像已知的局部地塞米松组合物那样频繁地施用,即每天六次1滴组合物。实际上,由于组合物的粘度,与增加药物的生物利用度的已知组合物相比,本公开的组合物的固体复合物在眼睛表面上表现出更长的接触时间。
[0193]
本公开还包涵了本公开的水性组合物作为滴眼液的用途。
[0194]
在一个实施方案中,根据本公开的包含地塞米松的水性组合物可以特别地用于治疗视网膜中央静脉阻塞或眼部炎症,如白内障手术后的炎症、青光眼、前房炎症、中央黄斑水肿。
[0195]
本公开还涉及本公开的水性组合物在制备用于治疗眼部病症的药物中的用途,特别为眼前部病症或眼后部病症。本公开的水性组合物可特别地用于制备用于治疗视网膜中央静脉阻塞或眼部炎症的药物,如白内障手术后的炎症、青光眼、前房炎症、中央黄斑水肿。
[0196]
本公开还涉及用于治疗眼部病症的方法,特别地为眼前部病症或眼后部病症,所述方法包括向有需要的受试者,优选人类施用治疗有效量的本公开的水性组合物。
[0197]
如本文所用,术语“治疗”包括逆转、减轻、抑制此术语所适用的疾病、功能紊乱或病症,或此类疾病、功能紊乱或病症的一种或多种症状或表现的进展,预防或降低其可能性。预防是指不发生引起疾病、功能紊乱、病症或其症状或表现,或其严重程度的恶化。因此,本发明公开的化合物可预防性施用以预防或减少疾病、功能紊乱或病症的发生或复发。
[0198]
如本文所用,术语“治疗有效量”是指将引起受试者的生物学或医学响应的药物的量,例如改善症状、缓解病症、减缓或延迟疾病进展,或预防疾病。
[0199]
优选的含有地塞米松的滴眼液制剂的用途
[0200]
如上所述的含有地塞米松的水性组合物和滴眼液制剂优选用于治疗或预防
[0201]-糖尿病性黄斑水肿;
[0202]-眼部手术后的炎症,典型地白内障手术后;
[0203]-眼部手术后囊样黄斑水肿;
[0204]-急性前葡萄膜炎;
[0205]-干眼病和眼睑炎;
[0206]-其他急性或慢性眼部炎性疾病,诸如移植物抗宿主病(gvhd)、春季结膜炎、翼状胬肉、霰粒肿或过敏性结膜炎;
[0207]-角膜移植后控制炎症和预防排斥;或者,
[0208]-影响眼后段的非感染性葡萄膜炎的治疗。
[0209]
这些用途的具体实施方案在下节中更详细地描述。
[0210]
治疗糖尿病性黄斑水肿的方法
[0211]
本公开的滴眼液制剂已在患有此类病症的患者中进行了在临床试验测试,且结果在实施例中提供。特别地,已展示了用1.5%(w/v)地塞米松的滴眼液制剂治疗糖尿病性黄斑水肿的功效。
[0212]
更具体地,本文提供了在有需要的受试者中治疗糖尿病性黄斑水肿的方法,所述方法包含向所述受试者的受影响的眼睛局部施用治疗有效量的包含1.5%(w/v)地塞米松的滴眼液制剂(典型地,如上所述的优选制剂之一),优选以一天一滴、两滴、三滴、四滴、五滴或六滴的剂量,例如持续至少6周、7周、8周、9周、10周、11周或12周的时间。
[0213]
在该方法的优选实施方案中,用于上述方法的滴眼液制剂包含以下或基本上由以下组成:
[0214]-1.5%的地塞米松;
[0215]-14%的γ-环糊精;
[0216]-2.5%的泊洛沙姆;
[0217]-0-0.2%的稳定剂,例如0.1%的依地酸二钠;
[0218]-0-1%的电解质,例如0.57%的氯化钠;
[0219]-0%-0.6%的防止地塞米松氧化的添加剂,例如0.1%-0.5%或0.2%-0.4%的防止皮质类固醇氧化的添加剂,典型地为硫代硫酸钠;
[0220]
以及
[0221]-水;
[0222]
其中%是基于组合物体积的重量%。
[0223]
在该方法的优选实施方案中,用于上述方法的滴眼液制剂包含以下或基本上由以下组成:
[0224]-3%的地塞米松;
[0225]-20%-25%的γ-环糊精;例如,23%的γ-环糊精;
[0226]-2.5%的泊洛沙姆;
[0227]-0-0.2%的稳定剂,例如0.1%的依地酸二钠;
[0228]-0-1%的电解质,例如0.57%的氯化钠;
[0229]-0%-0.6%的防止地塞米松氧化的添加剂,例如0.1%-0.5%或0.2%-0.4%的防止皮质类固醇氧化的添加剂,典型地,硫代硫酸钠;
[0230]
以及
[0231]-水;
[0232]
其中%是基于组合物体积的重量%。
[0233]
典型地,患有dme的患者在上述治疗12周后,通过sd-oct评估的中央黄斑厚度(cmt)可显著降低,例如,从基线测量超过10%cmt,cmt为如下实施例中所述地测定。
[0234]
此外,患有dme的患者,在上述治疗12周后,针孔视敏度可从基线提高到至少3个etdrs字母(letters)。针孔视敏度可如以下实施例中所述地测定。
[0235]
本治疗特别可用于对vegf抑制剂治疗没有响应或响应不足的患者(vegfi初始患者(vegfipatients))和/或不支持糖尿病性黄斑水肿的侵入性治疗的患者。
[0236]
因此,在用于治疗糖尿病性黄斑水肿的上述方法的特定实施方案中,患者选自由于糖尿病性黄斑水肿而在受影响的眼睛中具有视网膜增厚的vegfi初始患者。
[0237]
典型地,患者是人患者,更具体地是成人患者。
[0238]
治疗眼部手术后炎症的方法
[0239]
还显示了用1.5%(w/v)地塞米松的滴眼液制剂治疗眼部手术后,特别地为白内障手术后(白内障术后)的炎症和/或疼痛的功效。
[0240]
因此,在此提供了在有需要的受试者中治疗眼睛手术后(特别地白内障手术后(白内障术后))炎症的方法,所述方法包含向所述受试者的受影响的眼睛局部施用治疗有效量的滴眼药制剂,其包含1.5%(w/v)或3%(w/v)地塞米松(典型地如上所述的优选制剂),优选地,一天给药一滴或两滴,例如持续至少1-6周的时间。
[0241]
在该方法的优选实施方案中,用于上述方法的滴眼液制剂包含以下或基本上由以下组成:
[0242]-1.5%的地塞米松;
[0243]-14%的γ-环糊精;
[0244]-2.5%的泊洛沙姆;
[0245]-0-0.2%的稳定剂,例如0.1%的依地酸二钠;
[0246]-0-1%的电解质,例如0.57%的氯化钠;
[0247]-0%-0.6%的防止地塞米松氧化的添加剂,例如0.1%-0.5%或0.2%-0.4%的防止皮质类固醇氧化的添加剂,典型地,硫代硫酸钠;
[0248]
以及
[0249]-水;
[0250]
其中%是基于组合物体积的重量%。
[0251]
典型地,在眼睛手术后(例如白内障手术)后,具有疼痛和炎症的患者,在上述治疗的15天后,眼睛的疼痛和炎症可以显著减少或消除。疼痛可通过数值疼痛等级来确定,如下文实施例中所述。炎症可如下文实施例中所述的,测定前房细胞的细胞计数和闪辉。
[0252]
典型地,患者是人患者,更具体地是成人患者。
[0253]
防止皮质类固醇氧化的添加剂的用途
[0254]
本公开还涉及添加剂防止皮质类固醇氧化以稳定包含皮质类固醇的水性组合物ph的用途。
具体实施方式
[0255]
实施例1:水性地塞米松滴眼液制剂
[0256]
制备具有根据表1的组合物的水性地塞米松滴眼液。
[0257]
表1:水性地塞米松滴眼液组合物
[0258]
组分数量(%w/v)地塞米松1.50γ-环糊精14.00依地酸二钠0.10泊洛沙姆4072.50氯化钠0.57注射用水足量100.00
[0259]
如下制备滴眼液:
[0260]
a部分:在80℃下将依地酸二钠、泊洛沙姆407和氯化钠溶解在纯水中。在即将灭菌之前将地塞米松添加到赋形剂混合物中。
[0261]
b部分:在80℃下将γ-环糊精单独悬浮在纯水中。
[0262]
将a部分和b部分在121℃下灭菌15分钟。灭菌后,在95℃下将b部分加入至a部分中。搅拌15分钟后,将溶液快速冷却至室温(20分钟内),形成混浊的悬浮液。
[0263]
然后将悬浮液填充并密封到玻璃小瓶或低密度聚乙烯(ldpe)小瓶中。
[0264]
在25℃下储存期间测量玻璃小瓶和ldpe小瓶中的滴眼液的ph。结果示于表2。
[0265]
表2:储存期间滴眼液的ph。nt代表未测试。
[0266][0267]
这些结果表明,当滴眼液储存在ldpe小瓶中时,ph随时间下降,而在玻璃小瓶中,ph保持稳定。
[0268]
实施例2:含有硫代硫酸钠(sts)的水性地塞米松滴眼液制剂
[0269]
制备含有不同百分比(%)的硫代硫酸钠的滴眼液。该滴眼液的组合物示于表3中。添加硫代硫酸钠:
[0270]-至根据表1(实施例2a)的水性滴眼液制剂,或
[0271]-在该水性滴眼液制剂的制备过程中(实施例2b)。在这种情况下,根据实施例1中描述的方法制备滴眼液,在a部分中添加硫代硫酸钠,以及依地酸二钠、泊洛沙姆407和氯化钠。
[0272]
表3含有sts的水性地塞米松滴眼液组合物
[0273]
组分数量(%w/v)地塞米松1.50γ-环糊精14.00硫代硫酸钠0.05-0.6依地酸二钠0.10泊洛沙姆4072.50氯化钠0.57注射用水足量至100.00
[0274]
还制备了具有0.3%硫代硫酸钠(对应于0.471g硫代硫酸钠五水合物)和不同百分比地塞米松和γ-环糊精的滴眼液。该滴眼液的组合物示于表4和5中。在水性滴眼液制剂的制备过程中添加硫代硫酸钠:根据实施例1中描述的方法制备滴眼液,在a部分中添加硫代硫酸钠,以及依地酸二钠、泊洛沙姆407和氯化钠。
[0275]
表4:水性2.5%(w/v)地塞米松滴眼液组合物
[0276]
组分数量(%w/v)地塞米松2.50γ-环糊精22.00硫代硫酸钠0.30依地酸二钠0.10泊洛沙姆4072.50氯化钠0.57注射用水足量100.00
[0277]
表5水性3.0%(w/v)地塞米松滴眼液组合物
[0278]
组分数量(%w/v)地塞米松3.00
γ-环糊精25.00硫代硫酸钠0.30依地酸二钠0.10泊洛沙姆4073.0氯化钠0.57注射用水足量100.00
[0279]
实施例3:含有sts的水性地塞米松滴眼液的稳定性研究
[0280]
1.氧热应力试验
[0281]
在氧气和热应力测试后,测量含有sts的滴眼液制剂的ph。将实施例2a和2b的滴眼液转移到10ml玻璃小瓶中,其中用氮气或氧气吹扫,或用大气储存。将所有小瓶置于高压釜中并运行0-4个加热循环(每个加热循环:121℃20分钟)。在每个循环后测量所有小瓶的ph,结果示于表6(实施例2a)和7(实施例2b)中。
[0282]
表6:高压灭菌0-5个循环后,不同浓度硫代硫酸钠滴眼液制剂的ph(实施例2a)
[0283][0284]a该样品错误地没有被从高压釜中取出
[0285]b由于样品在2个循环后没有从高压釜中取出,其进行了额外的循环。
[0286]
表7.在高压灭菌0-5个循环后,具有不同浓度硫代硫酸钠的滴眼液制剂(实施例2b)的ph。在高压灭菌之前用氧气吹扫样品。
[0287][0288]
这些结果表明抗氧化剂sts的添加防止了滴眼液制剂ph的降低。滴眼液制剂因此更稳定。
[0289]
2.12个月内的ph测量
[0290]
根据ich指南(25℃/40%rh和40℃/nmt25%rh),含有0.3%sts的滴眼液制剂(实施例2b),装入ldpe小瓶中并放入含有空气或氧气的密封铝袋中,在受控的温度和湿度下测量ph 12个月。结果显示在表8中。
[0291]
表8.含有0.3%sts的滴眼液制剂的ph。
[0292][0293]
这些研究表明抗氧化剂sts的添加防止了滴眼液制剂的ph降低。滴眼液制剂因此稳定至少6个月。
[0294]
实施例4:含有酚类抗氧化剂的水性地塞米松滴眼液制剂
[0295]
将0.02%的丁基羟基茴香醚(bha)或丁基羟基甲苯(bht)添加至根据表1的水性滴眼液制剂中。
[0296]
将0.005g的bha溶解在10μl乙醇中,然后添加到制剂中以达到0.02%(w/v)的浓度。将0.005g的bht溶解在50μl乙醇中,然后添加至制剂中以达到0.02%(w/v)的浓度。
[0297]
将滴眼液转移至10ml玻璃小瓶中,其中用氮气或氧气吹扫,或用大气储存。将所有小瓶置于高压釜中并运行0-3个加热循环(每个加热循环:121℃ 20分钟)。在每个循环后测量所有小瓶的ph,结果示于表9中。
[0298]
表9.在高压灭菌0-3个循环后,具有0.02%bha或bht的滴眼液制剂的ph
[0299][0300]
这些结果表明添加酚类抗氧化剂防止滴眼液制剂ph的降低。滴眼液制剂因此更稳定。
[0301]
实施例5:使用本公开的滴眼液制剂(具有1.5%w/v地塞米松)的临床研究
[0302]
缩写
[0303]
·
ac:前房
[0304]
·
ae:不良事件
[0305]
·
ancova:协方差分析
[0306]
·
bcva:最佳矫正视力
[0307]
·
bid:每天两次(来自拉丁语“bis in die)”[0308]
·
cmt:中央黄斑厚度
[0309]
·
etdrs:糖尿病视网膜病变早期治疗研究
[0310]
·
hba1c:血红蛋白a1c
[0311]
·
iop:眼压
[0312]
·
logmar:最小分辨角对数
[0313]
·
qd:每天一次(来自拉丁语“quaque die”)
[0314]
·
sd-oct:谱域光学相干层析成像
[0315]
·
teae:治疗突发性不良事件
[0316]
·
usp:美国药典
[0317]
计分和测量量表及方法
[0318]
·
前房细胞和闪辉
[0319]
如观察到≤10个细胞,前房细胞计数记录为实际观察到的细胞数,(仅计数白细胞;红细胞和色素细胞不计数)。(jabs,d.a.,r.b.nussenblatt,j.t.rosenbaum and g.standardization of uveitis nomenclature working(2005)."standardization of uveitis nomenclature for reporting clinical data.results of the first international workshop."am j ophthalmol 140(3):509-516)
[0320]
表10:
[0321][0322]
量表基于(jabs,mussenblatt et al.2005)。
[0323]
·
眼痛
[0324]
患者用从0到10的数字疼痛评分量表评估眼痛(mccaffery,m.and a.beebe(1994)."pain:clinical manual for nursing practice."nurs stand 9(11):55)
[0325]
检查员询问患者以下问题:
[0326]
在0至10的量表中,其中0是无疼痛,而10是可能的最严重或无法忍受的疼痛,请在量表上标记此时最能描述手术*的眼睛感觉到的疼痛或不适的数字。量表的中部(约5)可用于描述“中度疼痛”。仅允许整数评分。
[0327]
临床研究1:地塞米松的水性药物制剂(1.5%w/v)在治疗糖尿病性黄斑水肿中的用途
[0328]
这是一项前瞻性,多中心,随机,双盲,平行组,介质悬浮型-对照研究。144名合格的受试者以2:1的比例随机;一组的受试者接受1滴包括1.5%(w/v)地塞米松的眼用微混悬剂,每天3次(每8小时),持续12周(99名受试者),并且另一组的受试者接受介质滴眼液,每天3次(每8小时),持续12周(45名受试者)。主要疗效终点为12周时糖尿病视网膜病的早期治疗研究(etdrs)bcva与基线相比的平均变化。次要终点包括在第2、4、8、12和16周时,与基线相比通过谱域光学相干断层扫描(sd-oct)评估的中央黄斑厚度(cmt)的平均变化。安全性终点包括不良事件、安全性实验室测试、裂隙灯检查参数表明对研究药物的眼部毒性,眼压和散瞳间接检眼镜。
[0329]
功效结果
[0330]
·
最佳矫正视力
[0331]
在第12周时,etdrs bcva字母得分中自基线的平均变化在具有本公开的滴眼液制剂的测试组中比在介质组中高;2.9(70%ci:2.13,3.65)vs 1.7(70%ci:0.66,2.72)。ancova结果证明了另一种假设,并证实了根据本公开的包含地塞米松的滴眼液制剂在α为0.15时优于介质滴眼液。
[0332]
·
中央黄斑厚度
[0333]
与第12周之前的介质组相比,在使用本公开的滴眼液制剂的测试组中观察到从基线的平均cmt的更大降低。
[0334]
从第2周到第12周,在研究眼cmt降低中观察到从基线的统计学高度显著的ls平均差异,有利于测试组;ls第12周均值差异;-36.77(70%ci:-53.58,-19.95),p值=0.01。
[0335]
具有多重插补的基线调整ancova的结果也显示滴眼液制剂在第12周时改善cmt方面优于介质组(α为0.15时)。
[0336]
安全性结果
[0337]
相比介质组中的受试者,接受地塞米松眼用微混悬剂的组中更高比例的受试者报告了治疗突发ae(70名[70.0%]受试者经历134次teae,而24名[53.3%]受试者经历50次teae)。
[0338]
相比介质组中的受试者,地塞米松眼用微混悬剂组中更高比例的受试者报告了严重teae(11名[11.1%]受试者经历14次严重teae,而1名[2.2%]受试者经历1次teae)。在两个治疗组中,这些严重teae与研究药物无关。
[0339]
临床研究2:地塞米松的水性药物制剂(1.5%w/v)在治疗白内障手术后的疼痛和炎症中的用途
[0340]
这是一项多中心,随机,双盲,安慰剂(介质)-对照研究,设计用于评价在治疗白内障手术后的炎症和疼痛中,与安慰剂相比,本公开中公开的滴眼液制剂(含有1.5%w/v地塞米松)的功效和安全性。
[0341]
受试者以1:1:1随机以接受含有地塞米松qd(一天一次)和安慰剂qd,bid(一天两次)或安慰剂bid的滴眼液制剂。在研究中,受试者眼睛bid给药1滴,持续14天,在眼睛手术后一天开始。分级的主要功效指标为1)在访视6(第15天)不存在前房细胞(即评分为“0”)和2)在访视4(第4天)不存在疼痛(即评分为“0”)。安全性指标包括etdrs图表上测得的从基线的针孔va变化(无任何其他校正),iop基线变化和不良事件(ae)率。
[0342]
功效结果
[0343]
在第6次访视时(第15天),与安慰剂(10名受试者不存在ac细胞[19.6%])相比,qd(26名受试者不存在ac细胞[51.0%],p=0.0009)和bid(34名受试者不存在ac细胞[66.7%],p《0.0001)的前房细胞缺失的数量显著较高。在第4次访视时,与安慰剂(23名受试者[45.1%])相比,qd(37名受试者[72.5%],p=0.0049)和bid(32名受试者[62.7%],p=0.0738)的受试者无疼痛的数量显著较高。
[0344]
总之,已实现了主要功效终点,且结果表明,在减少有前房细胞的受试者数量和具有白内障手术后疼痛的受试者的数量方面,qd或bid给药显著优于安慰剂。
[0345]
安全性结果
[0346]
总体而言,与任一测试组相比,安慰剂组报告了较高比例的teae,包括眼部teae。结果表明所测试的含有地塞米松的滴眼液制剂是安全的和良好耐受的。
[0347]
实施例6:替代抗氧化剂的筛选研究
[0348]
为本研究的目的,制备一组含有不同量抗氧化剂的测试制剂。通过将如表xx所列的某些抗氧化剂添加至实施例1的表1所述的制剂中来制备测试制剂。
[0349]
将抗氧化剂的浓度确定为与0.3%w/v硫代硫酸钠等摩尔量。
[0350]
将制备的测试制剂调节至ph 5(4.9-5.1)并在环境空气(不通入氧气)下高压灭菌两次。在第二次高压灭菌循环后,测量样品的ph。关于所用抗氧化剂的信息,浓度和ph测量结果示于表11中。
[0351]
[0352][0353]
考虑的抗氧化剂可基于其稳定制剂的效率分为几组(参见表12)。
[0354][0355]
来自a、b和c组的抗氧化剂显示对制剂ph稳定性的积极作用,而d组的代表没有作用。
[0356]
研究结果讨论
[0357]
为便于解释所获得的结果,所述研究的应力条件应转化为当前使用的滴眼液制剂长期稳定性项目的条件。为此目的,将研究的储存在玻璃容器中的储备制剂的ph下降值与在25℃下储存在不含抗氧化剂(sts)的ldpe塑料容器中的临床批次的ph下降曲线进行比较。
[0358]
我们发现,不同热应力测试的结果揭示了可用于在长期储存期间抑制ocs-01制剂的ph降低的替代抗氧化剂。
[0359]
·
抗氧化剂诸如l-甲硫氨酸、3,4-二羟基苯甲酸、柠檬酸钠、dl-苹果酸、(+)-l-抗坏血酸钠、dl-酒石酸、α-硫代甘油、没食子酸月桂酯、乳酸和叔丁基对苯二酚可在25℃下储存至少1年期间稳定制剂。
[0360]
·
1100 eu、丁基羟基茴香醚、丁基羟基甲苯和硫代硫酸钠可用作合适抗氧化剂使制剂在25℃下储存长达2年。
[0361]
·
所提及的抗氧化剂有效的最大储存时间未进行研究,而且可能超过上述得出的
储存时间。
[0362]
总之,在筛选的抗氧化剂中,硫代硫酸钠是稳定1.5%地塞米松眼用混悬液ph的最佳抗氧化剂。
[0363]
其他的抗氧化剂显示出对1.5%地塞米松眼用混悬液的稳定特性。它们对于稳定ph可能不如sts有效,但当在25℃下储存在塑料/ldpe容器中时,其可能能够获得2年的稳定性。这些抗氧化剂包括l-甲硫氨酸、3,4-二羟基苯甲酸、柠檬酸钠、dl-苹果酸、(+)-l-抗坏血酸钠、dl-酒石酸、α-硫代甘油、没食子酸月桂酯、乳酸和叔丁基对苯二酚、1100eu(d-α-生育酚乙酸酯)、丁基羟基茴香醚(bha)、丁基羟基甲苯(bht)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1