降低Tau(τ)蛋白和/或磷酸化Tau(τ)蛋白的浓度的方法
降低tau(
τ
)蛋白和/或磷酸化tau(
τ
)蛋白的浓度的方法
技术领域
1.本公开涉及降低患有阿尔茨海默病(ad)的人或动物受试者的靶细胞中tau(τ)蛋白和/或磷酸化tau(τ)蛋白的浓度的方法。本公开扩展至生物药剂的用途,该生物药剂包括(i).37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)和/或其片段,或者(ii).用于表达lrp/lr的转染剂,该生物药剂用于降低患有阿尔茨海默病(ad)的人或动物受试者的靶细胞中tau(τ)蛋白和/或磷酸化tau(τ)蛋白的浓度。
背景技术:
2.阿尔茨海默病(ad)是导致老年人痴呆的最常见的神经退行性疾病。目前,全世界约有5000万人患有ad。此疾病是两种神经病理学特征的结果,即由淀粉样蛋白β(aβ)肽的聚集引起的细胞外淀粉样蛋白斑块和由过度磷酸化tau(τ)蛋白积累引起的细胞内神经原纤维缠结。
3.β(β)和γ(γ)分泌酶对淀粉样前体蛋白(app)的序贯切割引起4kda aβ的脱落,4kda aβ聚集形成淀粉样斑块。常规上,大多数ad相关联的研究均针对aβ。tau(τ)是微管相关联的蛋白,其通常起到稳定微管的作用。tau(τ)的过度磷酸化引起其与微管分离,最终导致细胞死亡。与aβ和tau(τ)神经病理学相关联的生化途径大不相同,且成功针对一种的治疗方法不一定在另一种上取得成功。
4.ad的特征在于神经元回路的破坏、突触的丧失和由于两种神经病理学因素引起的神经毒性,即:淀粉样斑块和神经原纤维缠结。淀粉样蛋白斑由淀粉样蛋白β(aβ)肽的细胞外聚集引起,而神经原纤维缠结由过度磷酸化tau(τ)的细胞内积累而形成。细胞外淀粉样斑块具有神经毒性并在神经元之间集聚,破坏它们的功能并导致细胞凋亡。同时,神经原纤维缠结在与记忆有关的特定大脑区域中积累并阻断微管运输系统,这损害突触通讯。总体而言,这些药剂能够损害大脑的许多区域,这最终导致死亡。
5.37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)的下调尤其在us 9,365,647b2中作为降低aβ的解决方案被提供,该专利以引用方式完全并入本文。
6.本公开寻求减轻本领域已知的缺点和/或提供降低患有阿尔茨海默病(ad)的人或动物受试者的靶细胞中的tau(τ)蛋白和/或磷酸化tau(τ)蛋白的浓度的方法。
技术实现要素:
7.根据本公开的第一方面,提供降低患有阿尔茨海默病(ad)的人或动物受试者的靶细胞中的tau(τ)蛋白和/或磷酸化的tau(τ)蛋白的浓度的方法,该方法包含以下步骤:
8.(i)通过采用转染剂来转染细胞以产生37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)和/或其片段;或者
9.(ii)向细胞提供lrp/lr和/或其片段,
10.使得在使用时,步骤(i)或(ii)提供靶细胞中lrp/lr的过表达以及端粒酶逆转录酶(htert)的伴随增加,进而导致靶细胞中的tau(τ)蛋白和/或磷酸化tau(τ)蛋白的浓度的
降低。
11.靶细胞典型地可包括患有ad的人或动物的脑细胞。靶细胞可包括神经细胞。靶细胞可包括神经元细胞和胶质细胞。胶质细胞可包括室管膜细胞、星形胶质细胞、小胶质细胞和少突胶质细胞。
12.转染剂和/或lrp/lr和/或lrp/lr的片段可作为被配制成药物组合物的递送工具提供,该药物组合物可进一步包括用于肠胃外或非肠胃外施用于受试者的药物载体。递送工具可适于有利于部位特异性递送。递送工具可包含在药物载体中、分散在药物载体中或被药物载体包围以形成药物组合物。药物载体可用于肠胃外或非肠胃外施用于受试者。递送工具可适于有利于部位特异性递送。药物载体可适于有利于部位特异性递送。
13.非肠胃外施用可包括但不限于以下组中的至少一种:口服、鼻腔、直肠、阴道、眼部和透皮施用。典型地,非肠胃外施用可为口服。肠胃外施用可包括静脉内、皮下和肌肉内施用中的至少一种。典型地,肠胃外施用可为经静脉内。
14.转染剂可为pcineo-molrp::flag质粒。
15.lrp/lr可包含如seq id no:1或seq id no:2或其片段中列出的肽/蛋白序列表。
16.seq id no:1可为人lrp/lr的肽/蛋白序列并且可具有以下序列:
17.msgaldvlqmkeedvlkflaagthlggtnldfqmeqyiykrksdgiyiinlkrtweklll
18.aaraivaienpadvsvissrntgqravlkfaaatgatpiagrftpgtftnqiqaafrepr
19.llvvtdpradhqplteasyvnlptialcntdsplryvdiaipcnnkgahsvglmwwmlar
20.evlrmrgtisrehpwevmpdlyfyrdpeeiekeeqaaaekavtkeefqgewtapapefta
21.tqpevadwsegvqvpsvpiqqfptedwsaqpatedwsaaptaqatewvgattdws
22.seq id no:2可为小鼠(小白鼠(mus musculus))lrp/lr的肽/蛋白序列并且可具有以下序列:
23.msgaldvlqmkeedvlkflaagthlggtnldfqmeqyiykrksdgiyiinlkrtweklll
24.aaraivaienpadvsvissrntgqravlkfaaatgatpiagrftpgtftnqiqaafrepr
25.llvvtdpradhqplteasyvnlptialcntdsplryvdiaipcnnkgahsvglmwwmlar
26.evlrmrgtisrehpwevmpdlyfyrdpeeiekeeqaaaekavtkeefqgewtapapefta
27.aqpevadwsegvqvpsvpiqqfptedwsaqpatedwsaaptaqatewvgattews
28.应当理解,lrp/lr是高度保守的,并且为了实施在本文所描述、说明和/或例示的本发明,也可利用seq id no:1和seq id no:2的同源物或片段,和/或片段的同源物。
29.lrp/lr可包含与如seq id no:1或seq id no:2或其片段中列出的序列具有至少80%同源性的肽/蛋白序列表。
30.lrp/lr可包含同源物或其片段,以及片段的同源物,其中lrp/lr可包含如seq id no:1或seq id no:2中列出的肽/蛋白序列表。
31.lrp/lr的肽/蛋白序列或其同源物或片段,或片段的同源物可与附加蛋白序列、氨基酸序列、肽、蛋白或抗体结合、键合、连接、缀合或缔合。可选地,和/或附加地,lrp/lr的肽/蛋白序列可形成更大和/或更长的肽/蛋白序列的一部分。在本发明的某一实施方案中,lrp/lr可与flag蛋白结合,或键合,或连接,或缀合,或缔合,使得在使用时,lrp/lr可用flag标记。flag蛋白可包括肽/蛋白序列,该序列至少包括序列基序dykddddk(seq id no:3)。
32.应当理解,转染细胞以产生37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)和/或片段的步骤可经由本领域已知的程序进行,包括将转染剂引入细胞。转染细胞的步骤可上调lrp/lr以引起lrp/lr的过表达。
33.肽/蛋白序列表的片段的示例性实施方案例示为对应于seq id no:1的102至295的片段的seq id no:4和/或对应于seq id no:2的102至295的片段的seq id no:5。
34.seq id no:4可为人lrp/lr片段的肽/蛋白序列并且可具有以下序列:
35.rftpgtftnqiqaafrepr
36.llvvtdpradhqplteasyvnlptialcntdsplryvdiaipcnnkgahsvglmwwmlar
37.evlrmrgtisrehpwevmpdlyfyrdpeeiekeeqaaaekavtkeefqgewtapapefta
38.tqpevadwsegvqvpsvpiqqfptedwsaqpatedwsaaptaqatewvgattdws
39.seq id no:5可为小鼠lrp/lr片段的肽/蛋白序列并且可具有以下序列:
40.rftpgtftnqiqaafrepr
41.llvvtdpradhqplteasyvnlptialcntdsplryvdiaipcnnkgahsvglmwwmlar
42.evlrmrgtisrehpwevmpdlyfyrdpeeiekeeqaaaekavtkeefqgewtapapefta
43.aqpevadwsegvqvpsvpiqqfptedwsaqpatedwsaaptaqatewvgattews。
44.该方法通常扩展至靶细胞中lrp/lr表达的上调。
45.本公开的第一方面的方法可包括步骤(iii),其中步骤(iii)包括:
46.(iii)在患有阿尔茨海默病(ad)的人或动物受试者中持续和/或重复步骤(i)和/或步骤(ii)达第一时段。
47.步骤(iii)可每周进行达第一时段。步骤(iii)可每天进行达第一时段。步骤(iii)可每天、每周、每月或在上述时间之间(包括上述时间)的任意时段进行。第一时段可为至少六(6)个月。第一时段可为至少12个月。
48.本公开的第一方面的方法可包括步骤(iv),其中步骤(iv)包括:
49.(iv)在步骤(i)、(ii)和(iii)中的任一个完成之前,或者在步骤(i)、(ii)和(iii)中的任一个完成之后,进一步可选地连同步骤(i)、(ii)和(iii)中的任一个,下调lpr/lr。
50.通过提供人或动物受试者抗37kda/67kda层粘连蛋白受体(lrp/lr)特异性抗体(或其片段)以使得结合发生在37kda/67kda层粘连蛋白受体(lrp/lr)的表面表位和抗37kda/67kda层粘连蛋白受体(lrp/lr)特异性抗体(或其片段)之间,从而引起人或动物中淀粉样蛋白β(aβ)肽的浓度降低,步骤(iv)提供阿尔茨海默病的联合治疗。
51.步骤(iv)可以可选地或附加地包括向人或动物受试者提供核苷酸序列,优选seq id no:6和/或seq id no:7的shrna,使得结合发生在37kda/67kda层粘连蛋白受体(lrp/lr)的mrna和shrna之间,从而引起37kda/67kda层粘连蛋白受体(lrp/lr)下调,进而导致人或动物中淀粉样蛋白β(aβ)肽的浓度降低。
52.seq id no:6可为gcucgugcaa uuguugccau u。该序列可用于智人rna。
53.seq id no:7可为ggcagugacc aaggaggaau u。该序列可用于智人rna。
54.步骤(iv)下调lrp/lr,这引起aβ减少。aβ脱落的减少可为相对于正常健康人或动物的aβ脱落的减少,或者它可为相对于患有ad的人或动物的aβ脱落的减少。
55.在步骤(i)、(ii)和(iii)中的任一个或所有之前、期间或之后提供步骤(iv)是反直觉的。步骤(i)至(iii)上调lrp/lr,从而引起tau(τ)蛋白和/或磷酸化tau(τ)蛋白的浓度
降低。众所周知,与aβ和tau(τ)神经病理学相关联的生化途径大不相同,且成功针对一种的治疗方法不一定在另一种上取得成功。
56.如本文所描述,经由上调和下调lrp/lr对aβ和tau(τ)神经病理学的伴随和/或序贯治疗为减轻aβ和tau(τ)神经病理学的缺点提供令人惊讶和出乎意料的解决方案。技术人员不会考虑上调lrp/lr来减轻阿尔茨海默病(ad),且当然也不会考虑联合疗法,其包括lrp/lr的伴随和/或序贯上调和下调。
57.应当理解,关于使用抗37kda/67kda层粘连蛋白受体(lrp/lr)特异性抗体的下调,37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)(或其片段)的表面表位和抗体之间的结合引起aβ脱落的减少。
58.抗37kda/67kda层粘连蛋白受体(lrp/lr)特异性抗体或其片段可针对作为37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)的细胞表面蛋白来产生。在一个优选的实施方案中,抗体针对lrp/lr或针对与lrp/lr具有80%或更高同源性的蛋白产生。抗体或其片段可为f(ab')2片段、fab片段scfv、双特异性scfv、三特异性scfv、单链或串联双抗体、单域抗体(dab)、微型抗体或分子识别单元(mru)。此外,抗体或其片段可为单价的、二价的或多价的。抗体或其片段可附加地包含至少一个进一步的抗原相互作用位点和/或至少一个进一步的效应结构域。在本发明的优选实施方案中,抗体或其片段可为抗层粘连蛋白受体特异性抗体,优选抗lrp/lr特异性抗体,进一步优选igg1-is18。
59.在本公开的优选实施方案中,用于减少由β(β)和γ(γ)分泌酶对app的蛋白水解切割引起的aβ脱落的方法,该方法包含将lrp/lr与iggl-is18或其任何片段接触,使得在lrp/lr和iggl-is18或其任何片段之间发生结合,从而引起aβ脱落减少。
60.应当理解,37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)(或其片段)的mrna与核苷酸序列的结合下调37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr),使得与常规生理功能相比,存在于靶细胞上的lrp/lr蛋白更少,并且其中所述结合位点的减少引起aβ蛋白的浓度降低。
61.优选地,在结合发生在核苷酸序列,优选seq id no:6或7的shrna与mrna之间时,此类结合在核苷酸序列和lrp mrna之间。在本发明的优选实施方案中,aβ蛋白的浓度降低。降低的aβ量引起人和/或动物细胞,优选神经元细胞中的细胞外aβ斑块沉积减少,从而经由aβ神经病理学生化途径治疗和/或预防阿尔茨海默病(ad)。aβ浓度的降低可为相对于正常健康人或动物的aβ浓度的降低,或者其可为相对于患有ad的人或动物的aβ浓度的降低。
62.根据本公开的第二方面,提供生物药剂,其包括(i)37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)和/或其片段和/或(ii)用于表达37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)和/或其片段的转染剂,该生物药剂用于降低患有阿尔茨海默病(ad)的人或动物受试者的靶细胞中tau(τ)蛋白和/或磷酸化tau(τ)蛋白的浓度,其中lrp/lr和/或其片段用于施用于对其有需要的受试者的靶细胞。靶细胞典型地可包括患有ad的人或动物的脑细胞。靶细胞可包括神经细胞。靶细胞可包括神经元细胞和胶质细胞。胶质细胞可包括室管膜细胞、星形胶质细胞、小胶质细胞和少突胶质细胞。
63.生物药剂可包括递送工具。递送工具可包含在药物载体中、分散在药物载体中或被药物载体包围。药物载体可用于肠胃外或非肠胃外施用于受试者。递送工具可适于有利
于部位特异性递送。药物载体可适于有利于部位特异性递送。包含在递送工具中的生物药剂可一起提供药物组合物,该递送工具又包含在药物载体中、分散在药物载体中或被药物载体包围。
64.lrp/lr可封装到递送工具中。封装可使用纳米颗粒进行。典型地,递送工具可分散在药物载体内或被药物载体包围。
65.纳米颗粒可用第一官能团官能化。第一官能团可为但不限于以下组中的至少一种:化学、生化和生物部分。该部分可充当配体以确保在靶细胞处的位点特异性递送。药物载体可包括第二官能团。第二官能团可为但不限于以下组中的至少一种:化学、生化和生物部分。化学部分可包括有机、无机部分或有机和无机部分的组合。生化部分可包括但不限于以下组中的至少一种:氨基酸、肽、多肽、寡肽、蛋白、酶、抗体和编码上述任一种的rna或dna序列。
66.典型地,使用时的第一官能团充当配体以有利于递送工具的位点特异性递送。应当理解,官能团可根据脑中的不同细胞而不同。在使用时,第一官能团与靶位点键合,或连接,或缀合,或缔合。药物载体的第二官能团可进一步帮助位点特异性递送。
67.可提供生物药剂或药物组合物用于肠胃外或非肠胃外施用于受试者。
68.非肠胃外施用可包括但不限于以下组中的至少一种:口服、鼻腔、直肠、阴道、眼部和透皮施用。典型地,非肠胃外施用可为口服。肠胃外施用可包括静脉内、皮下和肌肉内施用中的至少一种。典型地,肠胃外施用可为经静脉内。
69.在用于非肠胃外递送时,生物药剂可适于穿过血脑屏障。
70.生物药剂可进一步包括抗氧化剂,使得在靶细胞处使用时,抗氧化剂清除活性氧物质。
71.生物药剂可进一步包括活性药物成分(api)。api可包括但不限于以下抗阿尔茨海默病药物组中的至少一种:多奈哌齐、利斯的明、加兰他敏、美金刚及其组合。申请人设想其他抗ad药物。
72.lrp/lr可包含如seq id no:1或seq id no:2中列出的肽/蛋白序列表,或如上文中列出的其片段,和/或如seq id no:4或seq id no:5中列出的其片段。flag可包含如上文所定义的如seq id no:3中列出的肽/蛋白序列表。
73.药物载体可为聚合载体基质。聚合载体基质可包括聚合纳米颗粒。聚合纳米颗粒可包括合成或天然聚合物。聚合纳米颗粒可为可生物降解的,以在使用时降低对所述聚合纳米颗粒的免疫原性反应的风险。聚合纳米颗粒可生物相容,以降低对所述聚合纳米颗粒的任何免疫原性反应的风险。
74.聚合纳米颗粒可具有刺激响应性,使得在使用时纳米颗粒在暴露于某些刺激时经历构象变化以有利于将生物药剂提供到其靶位点。纳米颗粒可对包括例如ph、温度和电流的刺激做出响应。
75.取决于特定的靶位点,聚合纳米颗粒可为疏水的或亲水的。
76.聚合纳米颗粒可经交联。典型地,交联剂用于交联。然而,交联可通过紫外线(u.v.)照射的方式发生。
77.聚合纳米颗粒可被冻干。冻干通常提供孔隙率,以有利于生物药物活性物质(在这种情况下为lrp/lr或lrp/lr的转染剂)从纳米颗粒胶囊扩散到目标部位。
78.聚合纳米颗粒可为选自但不限于以下组中的任一种或多种:聚丙烯酸树脂、阿拉伯树胶、角叉菜胶、纤维素、羟丙基纤维素(hpc)、甲基纤维素(mc)、羟丙基甲基纤维素(hpmc)、聚乳酸-共-乙醇酸(plga)、甲壳素、果胶、支链淀粉、天然橡胶、聚乙烯、聚丙烯、聚苯乙烯、聚酰胺、聚丙烯腈、聚氯乙烯、聚乙烯醇(pva)、聚乙二醇(peg)、聚环氧乙烷(peo)、聚(d-丙交酯)(pdla)、聚乳酸(plla)、聚半乳糖醛酸酯、甲基纤维素(聚缩醛)、聚(ε-己内酯)、磷脂、多糖、聚阴离子多糖、羧甲基纤维素、羧甲基直链淀粉、6-硫酸软骨素、硫酸皮肤素、肝素、硫酸肝素、聚(甲基丙烯酸羟乙酯)、胶原蛋白、纤维蛋白原、白蛋白、纤维蛋白、丙烯酰胺、羟丙基甲基丙烯酰胺基共聚物、聚丙烯酰胺、聚(n-异丙基丙烯酰胺)(pnipaam)、聚乙烯吡咯烷酮、聚(甲基丙烯酸-g-乙二醇)、聚(n-2-羟丙基甲基丙烯酰胺)、聚(乙醇酸)(pga)、聚(乳酸)(pla)、壳聚糖、聚(2-羟乙基甲基丙烯酸酯)(hema)、聚腈(polyphazene)、磷酸胆碱、透明质酸(ha)、羟乙基甲基丙烯酸酯(hema)、亚甲基双丙烯酰胺(mbaam)、聚(丙烯酸)(paac)、聚丙烯酰胺(paam)、聚丙烯腈(pan)、聚环氧丁烷(pbo)、聚己内酯(pcl)、聚(乙烯亚胺)(pei)、聚(甲基丙烯酸乙酯)(pema)、富马酸丙烯酯(pf)、聚(甲基丙烯酸葡萄糖乙酯)(pgema)、聚(羟基丁酸酯)(phb)、聚(甲基丙烯酸羟乙酯)(phema)、聚(羟丙基甲基丙烯酰胺)(phpma)、聚(甲基丙烯酸甲酯)(pmma)、聚(n-乙烯基吡咯烷酮)(pnvp)、聚(环氧丙烷)(ppo)、聚(醋酸乙烯酯)(pvac)、聚(乙烯胺)、硫酸软骨素、硫酸葡聚糖、聚赖氨酸、明胶、羧甲基甲壳素、葡聚糖、琼脂糖、普鲁兰多糖、聚酯、peg-pla-peg、peg-plga-peg、peg-pcl-peg、pla-peg-pla、聚(pf-共-eg)、聚(peg/pbo-对苯二甲酸酯)、peg-双-(pla-丙烯酸酯)、peg6cds、peg-g-聚(aam-共-乙烯胺)、聚(nipaam-共-aac)、聚(nipaam-共-ema)、pnvp、聚(mma-共-hema)、聚(an-共-烯丙基磺酸酯)、聚(双羧基-苯氧基-磷腈)、聚(gema-硫酸酯)、聚(peg-共-肽)、海藻酸酯-g-(peo-ppo-peo)、聚(plga-共-丝氨酸)、胶原-丙烯酸酯、藻酸盐、藻酸盐-丙烯酸酯、聚(hpma-g-肽)、ha-g-nipaam和聚(乙烯基甲醚)(pvme),和/或上述任一种或多种的衍生物。
79.在本公开的示例性实施方案中,聚合纳米颗粒可为聚(乳酸-共-乙醇酸)(plga)纳米颗粒。
80.plga可生物降解、生物相容并且可穿过血脑屏障(bbb)。
81.生物药剂可进一步包含细胞色素p450 3a4(cyp3a4)的抑制剂。细胞色素p450 3a4(cyp3a4)抑制剂可选自由以下组成的组:聚乙二醇、聚胺、聚甲基丙烯酸甲酯及其衍生物,其中抑制剂以一定量存在,该量有效地基本上抑制生物药物和/或api被系统前代谢,从而引起更高的生物药物和/或api的生物利用度。
82.生物药剂可进一步包含p-糖蛋白(p-gp)外排泵抑制剂。
83.在其中生物药剂被配制用于口服递送的某一实施方案中,该生物药剂可进一步包括在其周围的包衣,优选肠溶包衣。包衣在使用时可防止生物药剂在胃中降解。
84.包衣可包括细胞色素p450 3a4(cyp3a4)抑制剂和/或p-糖蛋白(p-gp)外排泵抑制剂。
85.lrp/lr可包含如seq id no:1或seq id no:2或其片段中列出的肽/蛋白序列表。lrp/lr可包含与如seq id no:1或seq id no:2或其片段中列出的序列具有至少80%同源性的肽/蛋白序列表。lrp/lr可包含同源物或其片段,以及片段的同源物,其中lrp/lr可包含如seq id no:1或seq id no:2中列出的肽/蛋白序列表。
86.seq id no:1可为人lrp/lr的肽/蛋白序列并且可具有以下序列:
87.msgaldvlqmkeedvlkflaagthlggtnldfqmeqyiykrksdgiyiinlkrtweklll
88.aaraivaienpadvsvissrntgqravlkfaaatgatpiagrftpgtftnqiqaafrepr
89.llvvtdpradhqplteasyvnlptialcntdsplryvdiaipcnnkgahsvglmwwmlar
90.evlrmrgtisrehpwevmpdlyfyrdpeeiekeeqaaaekavtkeefqgewtapapefta
91.tqpevadwsegvqvpsvpiqqfptedwsaqpatedwsaaptaqatewvgattdws
92.seq id no:2可为小鼠(小白鼠)lrp/lr的肽/蛋白序列并且可具有以下序列:
93.msgaldvlqmkeedvlkflaagthlggtnldfqmeqyiykrksdgiyiinlkrtweklll
94.aaraivaienpadvsvissrntgqravlkfaaatgatpiagrftpgtftnqiqaafrepr
95.llvvtdpradhqplteasyvnlptialcntdsplryvdiaipcnnkgahsvglmwwmlar
96.evlrmrgtisrehpwevmpdlyfyrdpeeiekeeqaaaekavtkeefqgewtapapefta
97.aqpevadwsegvqvpsvpiqqfptedwsaqpatedwsaaptaqatewvgattews
98.应当理解,lrp/lr是高度保守的,并且为了实施在本文所描述、说明和/或例示的本公开,也可利用seq id no:1和seq id no:2的同源物或片段,和/或片段的同源物。
99.lrp/lr的肽/蛋白序列或其同源物或片段,或片段的同源物可与附加蛋白序列、氨基酸序列、肽、蛋白或抗体结合、键合、连接、缀合或缔合。
100.可选地和/或附加地,lrp/lr的肽/蛋白序列可形成更大和/或更长的肽/蛋白序列的一部分。在本发明的某一实施方案中,lrp/lr可与flag蛋白结合,或键合,或连接,或缀合,或缔合,使得在使用时,lrp/lr可用flag标记。flag蛋白可包括肽/蛋白序列,该序列至少包括序列基序dykddddk(seq id no:3)。申请人设想采用其他标签。
101.肽/蛋白序列表的片段的示例性实施方案例示为对应于seq id no:1的102至295的片段的seq id no:4和/或对应于seq id no:2的102至295的片段的seq id no:5。
102.seq id no:4可为人lrp/lr片段的肽/蛋白序列并且可具有以下序列:
103.rftpgtftnqiqaafrepr
104.llvvtdpradhqplteasyvnlptialcntdsplryvdiaipcnnkgahsvglmwwmlar
105.evlrmrgtisrehpwevmpdlyfyrdpeeiekeeqaaaekavtkeefqgewtapapefta
106.tqpevadwsegvqvpsvpiqqfptedwsaqpatedwsaaptaqatewvgattdws
107.seq id no:5可为小鼠lrp/lr片段的肽/蛋白序列并且可具有以下序列:
108.rftpgtftnqiqaafrepr
109.llvvtdpradhqplteasyvnlptialcntdsplryvdiaipcnnkgahsvglmwwmlar
110.evlrmrgtisrehpwevmpdlyfyrdpeeiekeeqaaaekavtkeefqgewtapapefta
111.aqpevadwsegvqvpsvpiqqfptedwsaqpatedwsaaptaqatewvgattews。
112.生物药剂可进一步包括下调lrp/lr以引起aβ蛋白下调的工具,从而在使用时提供允许顺序或同时上调lrp/lr和下调lrp/lr的治疗方案,如上面的第一方面所述。用于下调的此工具可包括如上文中本公开的第一方面中所提供的抗层粘连蛋白受体特异性抗体(优选iggl-is18)和/或核苷酸(优选具有seq id no:6和/或seq id no:7的shrna)。
113.转染剂可为pcineo-molrp::flag质粒。
114.生物药剂可进一步包括下调lrp/lr以引起aβ蛋白下调的工具,从而在使用时提供允许顺序或同时上调lrp/lr和下调lrp/lr的治疗方案,如上面的第一方面所述。用于下调
no:1或seq id no:2中列出的肽/蛋白序列表。
139.lrp/lr的肽/蛋白序列或其同源物或片段,或片段的同源物可与附加蛋白序列、氨基酸序列、肽、蛋白或抗体结合、键合、连接、缀合或缔合。可选地,和/或附加地,lrp/lr的肽/蛋白序列可形成更大和/或更长的肽/蛋白序列的一部分。在本发明的某一实施方案中,lrp/lr可与flag蛋白结合,或键合,或连接,或缀合,或缔合,使得在使用时,lrp/lr可用flag标记。flag蛋白可包括肽/蛋白序列,该序列至少包括序列基序dykddddk(seq id no:3)。
140.应当理解,转染细胞以产生37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)和/或片段的步骤可经由本领域已知的程序进行,包括将转染剂引入细胞。转染细胞的步骤可上调lrp/lr以引起lrp/lr的过表达。
141.肽/蛋白序列表的片段的示例性实施方案例示为对应于seq id no:1的102至295的片段的seq id no:4和/或对应于seq id no:2的102至295的片段的seq id no:5。
142.seq id no:4可为人lrp/lr片段的肽/蛋白序列并且可具有以下序列:
143.rftpgtftnqiqaafrepr
144.llvvtdpradhqplteasyvnlptialcntdsplryvdiaipcnnkgahsvglmwwmlar
145.evlrmrgtisrehpwevmpdlyfyrdpeeiekeeqaaaekavtkeefqgewtapapefta
146.tqpevadwsegvqvpsvpiqqfptedwsaqpatedwsaaptaqatewvgattdws
147.seq id no:5可为小鼠lrp/lr片段的肽/蛋白序列并且可具有以下序列:
148.rftpgtftnqiqaafrepr
149.llvvtdpradhqplteasyvnlptialcntdsplryvdiaipcnnkgahsvglmwwmlar
150.evlrmrgtisrehpwevmpdlyfyrdpeeiekeeqaaaekavtkeefqgewtapapefta
151.aqpevadwsegvqvpsvpiqqfptedwsaqpatedwsaaptaqatewvgattews。
152.该方法通常扩展至靶细胞中lrp/lr表达的上调。
153.本公开的第三方面的方法可包括步骤(iii),其中步骤(iii)包括:
154.(iii)在患有阿尔茨海默病(ad)的人或动物受试者中持续和/或重复步骤(i)和/或步骤(ii)达第一时段。
155.步骤(iii)可每周进行达第一时段。步骤(iii)可每天进行达第一时段。
156.步骤(iii)可每周进行达第一时段。步骤(iii)可每天进行达第一时段。步骤(iii)可每天、每周、每月或在上述时间之间(包括上述时间)的任意时段进行。第一时段可为至少六(6)个月。第一时段可为至少12个月。
157.本公开的第一方面的方法可包括步骤(iv),其中步骤(iv)包括:
158.(iv)在步骤(i)、(ii)和(iii)中的任一个完成之前,或者在步骤(i)、(ii)和(iii)中的任一个完成之后,进一步可选地连同步骤(i)、(ii)和(iii)中的任一个,下调lpr/lr。
159.通过提供人或动物受试者抗37kda/67kda层粘连蛋白受体(lrp/lr)特异性抗体(或其片段)以使得结合发生在37kda/67kda层粘连蛋白受体(lrp/lr)的表面表位和抗37kda/67kda层粘连蛋白受体(lrp/lr)特异性抗体(或其片段)之间,从而引起人或动物中淀粉样蛋白β(aβ)肽的浓度降低,步骤(iv)提供阿尔茨海默病的联合治疗。
160.步骤(iv)可以可选地或附加地包括向人或动物受试者提供核苷酸序列,优选seq id no:6和/或seq id no:7的shrna,使得结合发生在37kda/67kda层粘连蛋白受体(lrp/
lr)的mrna和shrna之间,从而引起37kda/67kda层粘连蛋白受体(lrp/lr)下调,进而导致人或动物中淀粉样蛋白β(aβ)肽的浓度降低。
161.seq id no:6可为gcucgugcaa uuguugccau u。该序列可用于智人rna。
162.seq id no:7可为ggcagugacc aaggaggaau u。该序列可用于智人rna。
163.步骤(iv)下调lrp/lr,这引起aβ减少。aβ脱落的减少可为相对于正常健康人或动物的aβ脱落的减少,或者它可为相对于患有ad的人或动物的aβ脱落的减少。
164.在步骤(i)、(ii)和(iii)中的任一个或所有之前、期间或之后提供步骤(iv)是反直觉的。步骤(i)至(iii)上调lrp/lr,从而引起tau(τ)蛋白和/或磷酸化tau(τ)蛋白的浓度降低。众所周知,与aβ和tau(τ)神经病理学相关联的生化途径大不相同,且成功针对一种的治疗方法不一定在另一种上取得成功。
165.如本文所描述,经由上调和下调lrp/lr对aβ和tau(τ)神经病理学的伴随和/或序贯治疗为减轻aβ和tau(τ)神经病理学的缺点提供令人惊讶和出乎意料的解决方案。技术人员不会考虑上调lrp/lr来减轻阿尔茨海默病(ad),且当然也不会考虑联合疗法,其包括lrp/lr的伴随和/或序贯上调和下调。
166.应当理解,关于使用抗37kda/67kda层粘连蛋白受体(lrp/lr)特异性抗体的下调,37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)(或其片段)的表面表位和抗体之间的结合引起aβ脱落的减少。
167.抗37kda/67kda层粘连蛋白受体(lrp/lr)特异性抗体或其片段可针对作为37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)的细胞表面蛋白来产生。在一个优选的实施方案中,抗体针对lrp/lr或针对与lrp/lr具有80%或更高同源性的蛋白产生。抗体或其片段可为f(ab')2片段、fab片段scfv、双特异性scfv、三特异性scfv、单链或串联双抗体、单域抗体(dab)、微型抗体或分子识别单元(mru)。此外,抗体或其片段可为单价的、二价的或多价的。抗体或其片段可另外包含至少一个进一步的抗原相互作用位点和/或至少一个进一步的效应结构域。在本发明的优选实施方案中,抗体或其片段可为抗层粘连蛋白受体特异性抗体,优选抗lrp/lr特异性抗体,进一步优选igg1-is18。
168.在本公开的优选实施方案中,用于减少由β(β)和γ(γ)分泌酶对app的蛋白水解切割引起的aβ脱落的方法,该方法包含将lrp/lr与iggl-is18或其任何片段接触,使得在lrp/lr和iggl-is18或其任何片段之间发生结合,从而引起aβ脱落减少。应当理解,37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)(或其片段)的mrna与核苷酸序列的结合下调37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr),使得与常规生理功能相比,存在于靶细胞上的lrp/lr蛋白更少,并且其中所述结合位点的减少引起aβ蛋白的浓度降低。
169.优选地,在结合发生在核苷酸序列,优选seq id no:6或7的shrna与mrna之间时,此类结合在核苷酸序列和lrp mrna之间。在本发明的优选实施方案中,aβ蛋白的浓度降低。降低的aβ量引起人和/或动物细胞,优选神经元细胞中的细胞外aβ斑块沉积减少,从而经由aβ神经病理学生化途径治疗和/或预防阿尔茨海默病(ad)。aβ浓度的降低可为相对于正常健康人或动物的aβ浓度的降低,或者其可为相对于患有ad的人或动物的aβ浓度的降低。
170.根据本公开的第四方面,提供(i).37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)和/或其片段,或(ii).用于表达lrp/lr的转染剂在用于制备用于降
低患有阿尔茨海默氏病(ad)的人或动物受试者的靶细胞中tau(τ)蛋白和/或磷酸化tau(τ)蛋白浓度的药物组合物中的用途。(i).37kda/67kda层粘连蛋白受体前体/高亲和力层粘连蛋白受体(lrp/lr)和/或其片段,或(ii).用于表达lrp/lr的转染剂如上文所描述。药物组合物可如上文所描述。
171.提供基本上如本文所描述和/或例示和/或说明的本公开的第一至第四方面中的任一个或多个。
附图说明
172.下面将仅通过实例并参考附图来描述本公开的实施方案,其中:
173.图1示出hek-293细胞内的lrp/lr和tau(τ)定位和共定位。此图说明lrp/lr(绿帧b)和tau(τ)(红帧a)之间的共定位。a)hek-293细胞中的内源性tau含量水平。tau定位于细胞质。b)hek-293细胞中的内源性lrp/lr含量水平。lrp/lr定位于细胞质、细胞核和细胞表面。c、i)细胞核用dapi(蓝色)染色。共定位发生在核周隔室中的lrp/lr和的tau之间,由合并图像中的黄色荧光(d),如白色区域(e)和2d细胞荧光图的第三象限中的荧光(f)表示。g)cf 647
tm
仅对照。h)fitc仅对照。合并图像(j)、共定位图像(k)和2d细胞荧光图(l)显示阴性对照之间没有共定位。所有图像均使用添加放大倍数为630的airyscan
tm
的zeiss lsm 780显微镜拍摄。比例尺代表20μm。
174.图2示出细胞内lrp/lr和tau(τ)之间fret的流式细胞术分析。未染色hek-293细胞的荧光强度(深蓝色直方图-i)与仅用cf
tm 647二抗标记的细胞的荧光强度(黄色直方图-ii)以及含有感兴趣蛋白的细胞的荧光强度叠加;prpc、cat和tau用cf
tm 647(a、c、e)标记。b)lrp/lr-pe和prpc-cf
tm 647(阳性对照)的共标记(粉色直方图-iii)。d)lrp/lr-pe和cat-cf
tm 647(阴性对照)的共标记(绿色直方图-iv)。f)lrp/lr-pe和tau-cf
tm 647的共标记(红色直方图
–
v)。每个图均是一个代表性图像。进行三次生物学复制。
175.图3示出lrp::flag在用pcineo-molrp-flag质粒转染的hek-293和sh-sy5y细胞中的过表达。泳道1-3:未转染的细胞。泳道4-6:转染的细胞。a)lrp::flag(hrp)在转染的hek-293细胞中检测到,但在未转染的hek-293细胞中未检测到,b)lrp::flag(cy3)在转染的shsy-5y细胞中检测到,但在未转染的sh-sy5y细胞未检测到。β-肌动蛋白(hrp)用作上样对照。n=3次生物性重复。
176.图4示出lrp::flag在hek-293和sh-sy5y细胞中的过表达降低总tau以及磷酸化tau的含量水平。a、b)总tau减少45%,磷酸-tau(ps404)减少68%和磷酸-tau(pt231)减少98%在转染的hek-293细胞中被观察到。c、d)总tau减少35%,磷酸-tau(ps404)减少63%和磷酸-tau(pt231)减少92%在转染的sh-sy5y细胞中被观察到。a、c)证实在用pcineo-molrp-flag质粒稳定转染后hek-293和sh-sy5y细胞过表达lrp::flag。lrp::flag仅在转染的hek-293细胞中被检测到(a)。lrp::flag仅在转染的shsy-5y细胞中被检测到(c)。a、c)β-肌动蛋白用作上样对照。执行的光密度分析是相对于设定为100%的非转染hek-293(b)和sh-sy5y(c)细胞进行的。误差条代表标准偏差,n=3次生物性重复。*p:0.05,**p:0.01,***p:0.001;学生t检验。
177.图5示出转染和未转染的hek-293和sh-sy5y细胞中tau和磷酸-tau的细胞内表达。b、e)细胞核由dapi(蓝色)染色。a、b)总tau的表达在转染的hek-293和转染的sh-sy5y细胞
中降低。总tau(红色)的内源性含量水平(a)。用pcineo-molrp-flag质粒转染后总tau(红色)的含量水平(d)。总tau与dapi染色的合并(c、f)。c、d)磷酸-tau(ps404)的表达在转染的hek-293和转染的sh-sy5y细胞中降低。磷酸-tau(ps404)(红色)的内源性含量水平(a)。用pcineo-molrp-flag质粒转染后磷酸-tau(ps404)(红色)的含量水平(d)。磷酸-tau(ps404)与dapi染色的合并(c、f)。e、f)磷酸-tau(pt231)的表达在转染的hek-293和转染的sh-sy5y细胞中降低。磷酸-tau(pt231)(红色)的内源性含量水平(a)。用pcineo-molrp-flag质粒转染后磷酸-tau(pt231)(红色)的含量水平(d)。磷酸-tau(pt231)与dapi染色的合并(c、f)。所有图像均在添加airyscan
tm
的情况下以630倍放大率拍摄。比例尺代表20μm。
178.图6示出lrp::flag过表达使hek-293和sh-sy5y细胞中的htert和磷酸化tert含量水平增加。a、b)htert增加120%和磷酸化tert增加112%在转染的hek-293细胞中被观察到。c、d)htert增加125%和磷酸化tert增加96%在转染的sh-sy5y细胞中被观察到。β-肌动蛋白用作上样对照。执行的光密度分析是相对于设定为100%的非转染hek-293(b)和sh-sy5y(d)细胞进行的。误差条代表标准偏差,n=3次生物性重复。*p:0.05,**p:0.01,***p:0.001;学生t检验。
179.图7示出aβ
42
在转染和未转染的hek-293细胞中的细胞内表达。aβ
42
的表达在转染的hek-293细胞中降低。a)aβ
42
的内源性含量水平。aβ
42
定位于细胞质和细胞表面。d)用pcineo-molrp-flag质粒转染后aβ
42
的含量水平。b、e)细胞核由dapi染色。c、f)aβ
42
与dapi染色的合并。所有图像均使用添加放大倍数为630的airyscan
tm
的zeiss lsm 780显微镜拍摄。比例尺代表20μm。
180.图8示出lrp::flag在hek-293和sh-sy5y细胞中的过表达降低prpc含量水平。a1、b1)泳道1-3:未转染的细胞。泳道4-6:转染的细胞。β-肌动蛋白(hrp)用作上样对照。执行的光密度分析相对于设定为100%的未转染的hek-293(a2)和sh-sy5y(b2)细胞。误差条代表标准偏差,n=3次生物性重复。*p:0.05,**p:0.01,***p:0.001;学生t检验。
181.图9示出ad细胞培养模型中lrp::flag过表达的所提出机制。a)lrp和tau之间的直接相互作用:细胞质lrp::flag的增加可通过lrp和tau的直接相互作用稳定微管。b)aβ
42-prp
c-过度磷酸化的tau级联反应:lrp::flag过表达降低aβ
42
和prpc的含量水平,这可有助于减少磷酸化的tau。c)增加的htert:lrp::flag过表达增加htert含量水平,这传递神经保护作用,因为它能够防止氧化应激。增加的htert含量水平也可降低细胞间aβ
42
和磷酸化tau的含量水平,然而,确切的机制未知。lrp::flag过表达还引起衰老标记蛋白γh2ax和β-半乳糖苷酶减少。虚线和问号指示未知机制。
具体实施方式
182.以引用方式且为避免不必要的重复,以上发明内容的内容在本文完整重复。
183.应当理解,lrp/lr是高度保守的,并且为了实施在本文所描述、说明和/或例示的本公开,也可利用seq id no:1和seq id no:2的同源物或片段,和/或片段的同源物。
184.基本上相同的序列也可经采用。如本文所用,基本上相同的序列是与参考序列差异在于仅一个或多个保守取代基,或一个或多个非保守取代基,其位于序列的位置的缺失或插入,该缺失或插入不破坏或显著降低表达的多肽或由核酸分子编码的多肽中的一种或多种的活性。
185.在下面的实例中,转染剂是pcineo-molrp::fla g质粒。应当理解,申请人设想用于上调靶细胞中lrp/lr表达的另一种转染剂。本公开的详细示例性实施方案(其不限制本公开的范围)在下文的实施例中提供。
186.ad的两种主要神经病理学具有截然不同的生化途径,并且表现在非常不同的位置。淀粉样蛋白β(aβ)的聚集是细胞外的,而神经原纤维缠结来自细胞内过度磷酸化tau(τ)的积累。因此,对于本领域技术人员而言,在某一治疗方案已被示出成功治疗淀粉样蛋白β(aβ)的聚集时,并不存在合理的预期,即某一治疗方案在针对tau(τ)方面取得成功。同样,针对aβ的不成功方案预期不在tau(τ)方面取得成功。本文所描述的本公开是令人惊讶和出乎意料的。
187.tan(τ)
188.tau(τ)是微管相关蛋白,其功能是刺激微管蛋白组装成微管。此外,一旦组装微管,tau(τ)会结合并稳定微管。因为这些微管位于细胞骨架轨道上,所以它们介导重要的细胞过程,诸如营养物质和神经递质的运输。六种不同的tau(τ)异构体存在于成人大脑中且它们以不同的效率刺激微管组装。在健康细胞中,tau(τ)磷酸化含量水平受到高度调节并调节微管可塑性、运动活动和轴突运输以及轴突生长。
189.然而,在ad中,tau(τ)过度磷酸化并形成缠结,从而破坏神经元细胞的内部结构。此外,特定位点诸如s262、s356和s422处的tau(τ)磷酸化会抑制过度磷酸化tau(τ)被蛋白酶识别的能力,从而使其免于蛋白酶体降解。因此,tau(τ)的过度磷酸化能够以多种方式诱导ad病理。首先,此过度磷酸化可诱导tau(τ)从轴突错配到树突棘,从而引起运输受阻和棘丢失。还已知过度磷酸化的tau(τ)与驱动蛋白相关蛋白、c-jun n端激酶相互作用蛋白(jip1)相互作用并损害驱动蛋白复合物的形成。此复合物在介导轴突运输方面很重要。最后,在此过度磷酸化导致tau(τ)与微管分离并扩散到细胞质中时,神经原纤维缠结形成。这引起细胞骨架轨道解体,从而抑制重要的细胞过程,诸如营养物质和神经递质的运输,这最终导致细胞死亡。因此,tau(τ)的过度磷酸化负面影响突触健康、质膜细胞信令和dna保护免受细胞压力源,所有这些均可有助于神经变性的发展或进展。观察的痴呆程度与脑组织中存在的神经原纤维缠结的数量相关。
190.tau(τ)蛋白上约有80个假定的丝氨酸、苏氨酸或酪氨酸磷酸化位点。因此,tau磷酸化的正常含量水平是tau激酶和tau磷酸酶之间动态相互作用的结果。tau激酶诸如糖原合酶激酶3(gsk3)和细胞周期蛋白依赖性蛋白激酶5(cdk5)用于磷酸化tau(τ),而磷酸酶诸如蛋白磷酸酶2a和2b(pp2a和pp2b)则逆转此磷酸化。在tau(τ)病理中,cdk5对tau(τ)的先前磷酸化增强其随后被gsk3的磷酸化。然后gsk3磷酸化影响tau(τ)与微管结合的残基。残基苏氨酸231、丝氨酸396和丝氨酸404在此作用中尤为重要。此外,为了形成tau聚合物,可需要gsk3对tau(τ)进行磷酸化。在ad中,cdk5可被上调,而pp2a通常被下调。因为pp2a具有广泛的底物特异性,pp2a的下调可引起若干其他神经元蛋白诸如β-微管蛋白和β-连环蛋白的过度磷酸化,这通过抑制这些分子的组装而进一步加剧神经元损伤。
191.淀粉样蛋白β(aβ)
192.虽然aβ是正常的生理肽并存在于健康细胞中,但其功能未知,但它与神经元的存活和活力有关。它是通过淀粉样前体蛋白(app)的序贯裂解产生的。在健康细胞中,app可通过两种不同的途径来加工,即非淀粉样蛋白生成和淀粉样蛋白生成加工。在非淀粉样蛋白
生成途径中,app依次被α-分泌酶和γ-分泌酶裂解以产生sappα(可溶性非致病蛋白)和称为p3的肽。重要的是,α-分泌酶对app的初始切割发生在aβ氨基酸序列内,从而阻止aβ的产生。然而,在淀粉样蛋白形成期间,β-分泌酶和γ-分泌酶对app的序贯切割产生aβ和app胞内结构域(aicd)。在ad中,此淀粉样蛋白生成途径的滥用或aβ清除率的下降引起aβ肽浓度增加,从而引起疾病的发展。存在大量证据表明aβ是ad的主要病理因子;然而,此假设仍存在局限性。
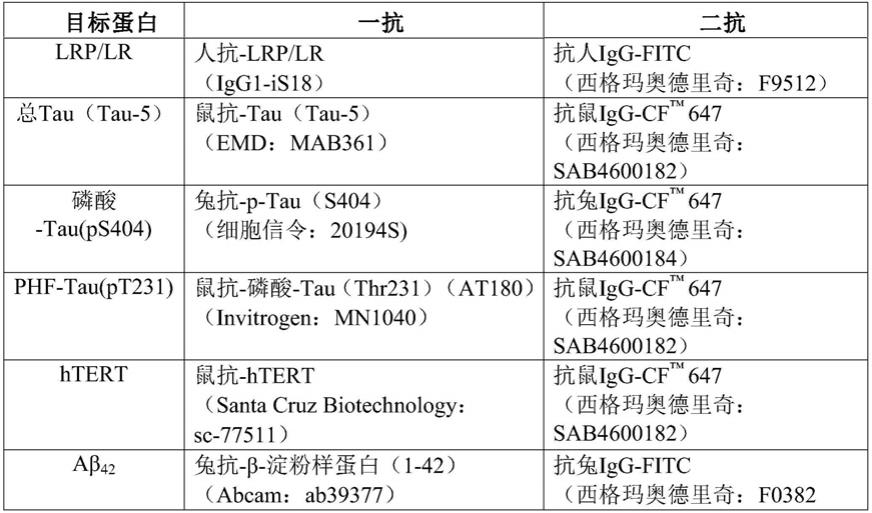
193.由淀粉样蛋白加工形成的aβ单体然后以各种方式错误折叠、结合和聚集。特别是可溶性aβ
42
寡聚体在细胞中积累,因为它们比其他同种型具有更高聚集倾向。此异构体还具有比其他aβ异构体更高的神经毒性。因此,斑块由于aβ的此聚集而形成,并且是ad中出现的初始神经元丢失的原因。此外,这些斑块能够干扰神经元间突触信号并诱导大脑炎症,从而激活免疫反应。这些免疫细胞会在分解和消化受损神经元时进一步加剧疾病。为了使ad进展,aβ
42
需要与脂质膜和细胞受体相互作用。这些aβ
42
寡聚体与神经元细胞的质膜缔合,从而引起膜变形和离子通道形成。这引起钙(ca
2+
)离子流入,这破坏突触可塑性并增强线粒体通透性,从而引起细胞毒性。事实上,ca
2+
含量水平的不稳定触发自由基形成、脂质过氧化和细胞凋亡,这可有助于细胞毒性。
194.端粒酶
195.端粒酶是核糖核蛋白,负责调节增殖潜力并防止致瘤细胞、种系细胞和永生化细胞的衰老。它由两个基本亚基等组成。在人类中,这些亚基包括:hterc,其含有催化逆转录酶亚基htert读取的端粒rna模板。这些亚基共同作用以使端粒在3
′‑5′
方向上延伸。htert是端粒酶活性的限制因素。这是由于其与hterc相比,表达水平较低,且因此作为端粒酶活性的主要调节因子。这就是说,端粒酶在细胞核内完成其核心功能,在其中端粒酶延长并维持端粒长度。此维持不仅允许正常细胞过程的持续,而且还改善细胞的整体增殖潜力。
196.除了端粒延伸之外,端粒酶/htert还具有除端粒维持之外的端粒外功能。
197.端粒酶延伸的染色体末端(称为端粒)由基因组ttaggg重复序列和相关蛋白结构组成。这些重复序列和相关蛋白一起“加盖”线性真核染色体以用于保护。这些端粒相关蛋白中的一些包括trf1、trf2和pot1。这些蛋白与端粒相互作用并相互形成“庇护所”复合物。
198.此复合物有利于端粒折叠形成端粒环(t-loop)以防止端粒降解。也就是说,端粒及其相关蛋白在防止基因组dna损伤方面发挥着重要作用。此外,这些端粒结构还有助于区分正常染色体和双链断裂。此损伤由在滞后链合成期间生成间隙的dna聚合酶不完全复制性质造成。
199.此外,dna合成遵循单向路径(3
′
到5
′
),从而引起dna末端无法完全复制,也称为“末端复制问题”。因此,端粒及其延伸可防止遗传信息的丢失,从而确保基因组稳定性且进而确保细胞活力。
200.本公开的非限制性方面
201.它先前已在国际专利申请第pct/ib2012/054968(wo2013/042053)号中示出端粒酶生物学在阿尔茨海默病(ad)中起作用。在此,使用抗lrp/lr抗体和shrna的lrp/lr受体阻断和/或下调lrp/lr有效地阻止aβ脱落。还示出敲低lrp/lr可使细胞免受aβ2-prpc介导的细胞毒性。
202.有趣的是,lrp/lr的过表达通过与端粒酶的相互作用阻止aβ的脱落,并且体内
lrp/lr敲低减少淀粉样蛋白斑块。
203.据提出,tau(τ)过度磷酸化依赖于aβ聚集,且aβ减少可有助于减少过度磷酸化的tau(τ)。因此,尽管在生化上非常不同,但有迹象表明存在β淀粉样蛋白和tau沉积之间的相互关联。
204.申请人经由使用pcineo-molrp-flag质粒转染hek-293细胞来上调lrp/lr。在lrp::flag的过表达引起体外总tau(τ)和磷酸化tau(τ)含量水平降低时,申请人感到惊讶。tau(τ)的此减少也被观察到伴随端粒酶(特别是htert)活性的增加。这与现有技术中的建议和动机形成对比。
205.lrp/lr和tau(τ)被看到在核周隔室中共定位,并且共振能量转移(fret)证实它们直接相互作用。此后,用pcineo-molrp-flag质粒转染sh-sy5y和hek-293细胞,以便过表达lrp::flag。总tau(τ)和磷酸化tau(τ)的减少在过表达lrp::flag的细胞中被观察到,这已使用蛋白印迹分析和共聚焦显微镜得到证实。磷酸化tau(τ)的此减少指示过度磷酸化tau(τ)的减少。也存在htert含量水平的伴随增加,这通过蛋白印迹来确定,这可在不限于理论的情况下使受ad影响的细胞免受细胞毒性。
206.此外,aβ和prpc(两种tau蛋白病相关蛋白)的含量水平也显示出降低。这与现有技术的教导相反,在其中lrp/lr敲低引起aβ脱落减少。这指示作用机制复杂且未被很好地理解。这些蛋白是引起tau(τ)的过度磷酸化的信号级联反应的一部分。总的来说,这些结果表明lrp::flag的过表达为ad和其他蛋白病提供治疗策略。
207.体外和体内研究均示出,抗lrp/lr特异性抗体igg1-is18可通过降低ad中的aβ含量水平来阻止神经变性。因此,有益的是,使用lrp::flag过表达和lrp/lr的igg1-is18阻断来检查联合治疗,这以其他方式会是反直觉的。此治疗方式可针对ad的多于一个方面,从而改善治疗的结果。还需要探索递送机制以确保肝脏首过和/或血脑屏障在需要时穿过。设想联合治疗,包括同时或依次上调和下调lrp/lr。
208.申请人相信,在本文所描述的本公开的主题至少减轻现有技术中已知的缺点中的一个。
209.非限制性实例
210.实验程序
211.细胞培养
212.细胞培养是体外模型,其试图模拟细胞生长的体内条件,从而允许研究细胞的生化和生物过程。使用以下细胞系:
213.sh-sh5y:来自西格玛奥德里奇(sigma aldrich)的人神经母细胞瘤细胞。hek-293:来自美国菌种保藏中心(atcc)的人胚胎肾细胞。sh-sy5y细胞是常用于研究神经退行性疾病的神经元细胞,而hek-293细胞则被用作对照,因为它们表达神经元标记物并具有可检测水平的端粒酶活性。
214.细胞在含有高葡萄糖(4.5g/l)和4mm l-谷氨酰胺(hyclone)的细胞培养基(dulbecco’s modified eagle medimn(dmem))中培养:ham's f12与1mm l-谷氨酰胺(hyclone)的比例为1:1。此外,培养基补充有15%胎牛血清(fbs)(hyclone)和2%青霉素/链霉素(biowest)。将细胞在37℃和5%co2的加湿培养箱中培养,以实现最佳增殖。
215.为了维持细胞系,在细胞达到70-80%的汇合度时进行传代。首先,细胞用磷酸盐
缓冲盐水(pbs)来洗涤,且然后在37℃下用胰蛋白酶温育5分钟,以便从细胞培养瓶中分离细胞。此后,添加总体积为10ml的新鲜培养基,以便灭活胰蛋白酶。然后将细胞以1:2的比例(sh-sh5y)或1:10的比例(hek-293)分开,并且再次将新鲜培养基添加至总体积为10ml。
216.此外,制备细胞原液以便冷冻保存细胞。在胰蛋白酶消化后,将细胞以5000rpm速度离心10分钟。然后将细胞沉淀重新悬浮在80%fbs和20%二甲基亚砜(dmso)(默克密里博(merck millipore))的混合物中并在-70℃下储存。对汇合度为70-80%的细胞执行细胞收获,以便为下游应用收集样品。在胰蛋白酶消化后,细胞在5000rpm下离心10分钟。此后,将颗粒储存在-20℃以备用。
217.添加airyscan
tm
的共聚焦显微镜
218.共聚焦显微镜是定性技术,其允许确定荧光标记蛋白的定位。执行此技术以确定lrp/lr和tau(τ)是否共定位并确认lrp/lr和htert之间的共定位。
219.细胞生长至70-80%的汇合度,将500μl接种到总体积为3ml的6孔板内的显微镜盖玻片上。此后,将细胞在加湿培养箱中培养24小时以达到50-70%的汇合度。在温和搅拌下执行所有进一步的步骤。细胞用pbs中的4%甲醛(vwf)固定20分钟。为了观察细胞的细胞内结构,将它们在pbs中用0.25%triton x-100(西格玛奥德里奇)透化20分钟。然后将细胞在pbs中的0.5%牛血清白蛋白(bsa)(amresco)中封闭20分钟,然后加入一抗(1:200的0.5%bsa的pbs溶液)。细胞在4℃下温育过夜。第二天,将盖玻片用pbs洗涤5分钟,然后与适当异硫氰酸荧光素(fitc)偶联或cf
tm 647偶联二抗(1:500的0.5%bsa的pbs溶液)温育并在黑暗中温育一小时。所用的一抗和二抗均列于表1中。然后将细胞用0.1μg/ml 4',6-二脒基-2-苯基吲哚(dapi)(西格玛奥德里奇)在黑暗中复染5分钟,以对细胞核染色。然后清洗盖玻片并使用fluoromount
tm aqueous mounting medium(西格玛奥德里奇)将该盖玻片封固在干净显微镜载玻片上。将载玻片在室温下温育1.5小时,以使封固剂凝固。所有图像均是在室温下使用zeiss lsm 780共聚焦显微镜以630倍放大率获取的。此外,airyscan
tm
用于将分辨率从200nm增加到140nm。
220.表1:用于共聚焦显微镜的抗体
221.222.共振能量转移(fret)的流式细胞术分析
223.fret是非常灵敏的技术,其用于评估体外蛋白相互作用。在此技术中,只有当荧光染料彼此之间的距离在1-10nm以内时,才发生能量的非辐射转移。这种依赖于距离的能量转移发生在供体和受体分子之间。在此实验中,供体/受体对藻红蛋白(pe)/别藻蓝蛋白(apc)用于免疫标记感兴趣蛋白。pe由488nm氩激光激发并以575nm发射。因此,可使用accuri c6 flow cytometer(bd biosciences)的fl2滤光片组进行检测。cf
tm 647(其为apc同类产品)由650nm氖/氦激光器激发并以660nm发射,并且可使用fl4滤光片组进行检测。使用fl3滤光片组评估感兴趣蛋白之间fret的存在。在此通道内,用488nm氩激光器实现激发并在660nm下检测发射。cf
tm 647不会被488nm激光激发,且因此在此通道内不显示荧光。然而,如果cf
tm 647靠近pe,它可经由fret间接激发,从而引起fl3中的荧光发射增强。因此,fl3被认为是pe/apc fret检测的最佳通道。
224.hek-293细胞在评估前在无血清培养基中温育3小时。然后,通过以1200rpm离心10分钟分离和收获细胞。细胞用pbs洗涤两次。所有洗涤步骤均在5000rpm下进行5分钟。然后将细胞在4%甲醛中于4℃下温育20分钟以固定它们。此后,将细胞以5000rpm离心10分钟以去除甲醛。因为tau是细胞内蛋白,所以通过在0.1%triton x-100的pbs溶液中于4℃下温育细胞20分钟来使细胞通透化。再次,将细胞以5000rpm离心10分钟以去除triton x-100。细胞用pbs洗涤一次且然后在0.5%bsa的pbs溶液中室温封闭10分钟。此后,加入一抗(在0.05%bsa的pbs溶液中1:100)并将细胞在室温下温育2小时。然后细胞用pbs洗涤一次且用0.5%bsa的pbs溶液洗涤一次。此后,加入二抗(在0.05%bsa的pbs溶液1:100中1:100)并将细胞再次在室温下温育2小时。所用的一抗和二抗均列于表2中。然后将细胞用pbs洗涤两次并重悬于pbs中以用于检测。执行三次生物学复制且每个样品分析15000个细胞。通过使用prpc作为阳性对照(因为lrp/lr以高亲和力与prpc结合),而氯霉素乙酰转移酶(cat)作为阴性对照(因为lrp/lr已被示出不与其结合)来研究该测定的功效。
225.制备以下样品:
226.1.未染色的细胞
227.2.仅用抗人pe标记的细胞
228.3.仅用抗小鼠cf
tm 647标记的细胞
229.4.仅用抗兔cf
tm 647标记的细胞
230.5.igg1-is18-pe标记细胞(lrp/lr检测)
231.6.用抗prp
c-cf
tm 647标记的细胞(prpc检测)
232.7.用抗cat-cf
tm 647标记的细胞(cat检测)
233.8.用抗tau-cf
tm 647标记的细胞(tau检测)
234.9.用igg1-is18-pe和抗prp
c-cf
tm 647标记的细胞(阳性对照)
235.10.用igg1-is18-pe和抗cat-cf
tm 647标记的细胞(阴性对照)
236.11.用igg1-is18-pe和抗tau-cf
tm 647标记的细胞
237.表2:用于共振能量转移(fret)的抗体
[0238][0239]
lrp::flag的稳定过表达
[0240]
为了确定lrp::flag过表达对tau(τ)含量水平的影响,用质粒pcineo-molrp-flag转染细胞(参见vana和weiss,a trans-dominant negative 37kda/67kda laminin receptor mutant impairs prpsc propagation in scrapie-infected neuronal cells.j mol biol 358:57-66,2006,其以引用方式并入本文)。培养细胞直至达到40-50%汇合度。然后使用xfect
tm
转染试剂(takara)转染细胞。简而言之,将5μg质粒dna与100μl xfect reaction buffer和1.5μl xfect polymer混合并在室温下温育10分钟。这允许亲脂性纳米颗粒复合物在构建体周围形成。然后,将混合物加入细胞中,之后温育三天。此后,执行培养基更换并允许细胞增殖两天,使细胞有足够的时间从转染过程中恢复并产生lrp::flag蛋白。然后,使用抗生素遗传霉素作为选择性处理。最初,施用高浓度的抗生素(6000-8000ng/μl),直至所有未转染的细胞均死亡。此后,将细胞在2000-4000ng/μl的遗传霉素中培养,以确保维持lrp::flag表达。在遗传霉素处理六周后实现稳定转染。
[0241]
蛋白印迹
[0242]
二喹啉甲酸(bca)测定
[0243]
执行bca测定是为了定量蛋白提取后细胞裂解物中存在的总蛋白浓度。这确保相等蛋白浓度用于后续十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)和蛋白印迹程序。蛋白中存在的肽键导致bca中的cu
2+
离子还原为cu
+
离子,这引起比色变化,其可使用elisa酶标仪来测量。
[0244]
如上文所述收获细胞。此后,将它们在冷放射免疫沉淀(ripa)缓冲液中温育10分钟以便裂解细胞。细胞裂解物用蒸馏水1:5稀释且将25μl上样到96孔板上的各个孔中,一式三份。将样品在200μl 98%bca和2%硫酸铜(ii)(cuso4)中于37℃下温育20分钟。已知浓度的bsa用于构建标准曲线。bsa标准品通过稀释来制备,以产生稀释度范围0mg/ml至1mg/ml,增量为0.2mg/ml。此后,将25μl一式三份上样到相同板上并在相同混合物中温育。此后,使用go elisa酶标仪(赛默科技(thermo scientific))在562nm波长下测量板。然后从bsa标准曲线外推总蛋白浓度。
[0245]
sds-page和蛋白印迹
[0246]
使用sds-page以按大小分离整个蛋白提取物,从而可评估目标蛋白的大致大小。此后,经由蛋白印迹将蛋白转移到膜上。蛋白印迹使用特异性抗体来免疫检测和定量目标蛋白的蛋白含量水平。
[0247]
使用12%(w/v)tris-hcl凝胶执行sds-page程序,从而允许解析10-200kda的蛋白。一式三份测定所有样品。将loading buffe(40mm二硫苏糖醇)添加至可溶性蛋白样品中并在上样前在95℃下加热5分钟。总共10μg(β-肌动蛋白)、30μg(lrp::flag)和60μg(tau、磷
酸-tau(ps404)、磷酸-tau(pt231)、htert、磷酸-tert(ps824)和prpc)然后在凝胶上分离。将预染的分子量标记上样到每块凝胶上。
[0248]
蛋白在1x电泳缓冲液(25mm tris、192mm甘氨酸和0.1%sds)中在150v下分离约1小时。此后,使用半干转移装置将分离的蛋白转移到聚偏二氟乙烯(pvdf)膜上。使用1x转移缓冲液(20%甲醇的25mm tris和192mm甘氨酸溶液)在300mv下执行转移45-50分钟。蛋白在0.4%甲醛中固定在膜上30分钟。然后将膜在3%bsa的0.1%pbs-tween溶液中封闭一小时,以防止非特异性抗体结合。根据表3,将膜与一抗在4℃下温育过夜。第二天,执行五次0.1%pbs-吐温洗涤,每次5分钟以去除任何未结合的抗体。然后将膜在室温下与如表3的适当辣根过氧化物酶(hrp)偶联的二抗一起温育1小时。再次,如上所述用0.1%pbs-吐温洗涤膜。然后将膜与赛默科技化学发光底物一起温育,该底物与hrp酶反应形成可使用辐射暴露进行检测的沉淀物。然后,使用bio-rad geldoc xr imager对膜成像。在sh-sy5y细胞中,使用以下项检测lrp::flag:与荧光探针偶联的小鼠抗作为非特异性结合的抗小鼠hrp抗体(abcam:ab97023)的cy3(西格玛奥德里奇:a-9594)(表3.3)。因此,该印迹未用化学发光底物处理,而是使用cy3荧光在geldoc上观察。然后,使用bio-radimage lab 4.0软件分析印迹并执行光密度测定以获得相对于上样对照β-肌动蛋白的蛋白含量水平。
[0249]
表3:用于蛋白印迹的抗体
[0250]
[0251][0252]
统计分析
[0253]
所有实验执行一式三份,允许计算标准偏差并执行统计分析。所得数据的所有统计分析均使用microsoft excel 2016(微软公司(microsoft corporation))进行。执行结果分析以便确定收集的结果是否显著相关。双尾学生t检验在95%的置信区间下执行。*p《0.05的值被认为是显著的,而**p《0.01和***p《0.001的值分别被认为是非常显著和高度显著的。
[0254]
结果
[0255]
lrp/lr与tau(τ)和htert共定位
[0256]
为了确定lrp/lr是否与tau(τ)相互作用,研究这些蛋白的亚细胞定位很重要。因为htert与lrp/lr相互作用且在tau蛋白病中起作用,所以还检查其定位。
[0257]
共聚焦显微镜以执行确定lrp/lr和tau(τ)是否共定位(图1)。合并的图(图1:d、j)代表红色tau(帧a)或htert信号与绿色lrp/lr信号(帧b)的合并,其中黄色区域(帧d和j)代表重叠。共定位图(图1:e、k)清楚地以白色标记重叠区域,使共定位更容易可视化。最后,2d细胞荧光图(图1:f、l)是激光信号的图示,其中第三象限中的对角线代表蛋白的强烈共定位。因此,如图1所见,lrp/lr和tau(τ)共定位于hek-293细胞的核周隔室。因此,这些蛋白可相互缔合。
[0258]
图1说明lrp/lr(绿色帧b)和tau(τ)(红色帧a)之间的共定位。帧a)hek-293细胞中的内源性tau含量水平。tau(τ)定位于细胞质。帧b)hek-293细胞中的内源性lrp/lr含量水平。lrp/lr定位于细胞质、细胞核和细胞表面。帧c、i)细胞核由dapi(蓝色)染色。共定位发生在核周隔室中的lrp/lr和的tau(τ)之间,由合并帧中的黄色荧光(d)表示,如白色区域帧(e)和如2d细胞荧光图帧的第三象限中的荧光(f)。g)仅cf647
tm
对照。帧h)仅fitc对照。合并图像帧(j)、共定位图像帧(k)和2d细胞荧光图帧(l)示出阴性对照之间无共定位。所有图像均使用添加放大倍数为630的airyscan
tm
的zeiss lsm 780显微镜拍摄。比例尺代表20μm。
[0259]
lrp/lr和tau(τ)直接相互作用
[0260]
因为lrp/lr示出与tau(τ)共定位,所以通过检测两种免疫标记蛋白之间是否发生fret来研究蛋白是否直接相互作用。如前所述,如果荧光染料彼此相距在1-10nm范围内,则会在荧光染料之间发生能量的非辐射转移,称为fret(1948年),从而允许评估蛋白
相互作用。
[0261]
采用流式细胞术来检查hek-293细胞中的fret。accuri c6 flow cytometer(bd biosciences)的fl3滤光片用于确定目标蛋白之间fret的存在(图2)。在此通道内,受体cf
tm 647不显示出荧光,但如果它靠近供体pe,则可被fret间接激发。因此,fl3通道中荧光的变化指示感兴趣蛋白之间的相互作用。
[0262]
因此,在细胞用lrp/lr-pe和tau-cf
tm 647来共标记时,cf
tm 647荧光强度中观察到的变化(图2:f)示出这两种蛋白之间发生fret。因此,lrp/lr和tau(τ)相距在10nm以内且可得出蛋白相互作用的可能性很高的结论。在此实验中,prpc用作阳性对照,因为lrp/lr以高亲和力与其结合,而cat用作阴性对照,因为lrp/lr已被示出不与其结合。cf
tm 647荧光染料不会被488nm激光激发且也不在fl3通道中显示出荧光发射,因为用抗体标记的蛋白(prpc、cat和tau)的荧光强度能够叠加在未染色细胞的荧光强度上(图2:a、c、e)。在用lrp/lr-pe和prp
c-cf
tm 647对细胞共标记后(图2:b),存在cf
tm 647直方图沿fl3荧光强度轴的变化,这指示这些蛋白之间的相互作用。相比之下,在用lrp/lr-pe和cat-cf
tm 647共标记后(图2:d),cf
tm 647直方图没有变化,因此未观察到对cf
tm 647发射的影响。
[0263]
图2示出细胞内lrp/lr和tau(τ)之间fret的流式细胞术分析。未染色hek-293细胞的荧光强度(深蓝色直方图-i)叠加到仅用cf
tm 647二抗标记的细胞(黄色直方图-ii)以及其中感兴趣蛋白;prpc、cat和tau用cf
tm 647(a、c、e)标记的细胞的荧光强度。b)lrp/lr-pe和prp
c-cf
tm 647(阳性对照)的共标记(粉色直方图-iii)。d)lrp/lr-pe和cat-cf
tm 647(阴性对照)的共标记(绿色直方图-iv)。f)lrp/lr-pe和tau-cf
tm 647的共标记(红色直方图
–
v)。每个图均是代表性图像。进行三次生物学复制。
[0264]
证实hek-293和sh-sy5y细胞中的lrp::flag过表达
[0265]
用pcineo-molrp-flag质粒稳定转染hek-293和sh-sy5y细胞。这样做是为了通过过表达lrp::flag来增加细胞中的总lrp含量水平。为清楚起见,用pcineo-molrp-flag质粒转染的细胞将被鉴定为转染细胞,而未用质粒转染的细胞将被鉴定为非转染细胞。
[0266]
蛋白印迹用于确定细胞是否已成功用质粒转染(图3)。转染细胞中lrp::flag蛋白的检测表明hek-293(图3:a)和sh-sy5y(图3:b)细胞均被稳定转染。
[0267]
lrp::flag的过表达降低总tau(τ)和磷酸tau含量水平
[0268]
用pcineo-molrp-flag质粒稳定转染hek-293和sh-sy5y细胞以诱导lrp::flag的过表达。蛋白印迹证实hek-293和sh-sy5y细胞的转染(图2a;c)。确认转染两种细胞系后,利用蛋白印迹确定lrp::flag过表达对总tau蛋白和磷酸化tau蛋白含量水平的影响(图2a;c)。在转染的hek-293(图2b)和转染的sh-sy5y细胞(图2d)中分别观察到总tau含量水平显著降低45%和35%。因为不可能在体外研究tau的过度磷酸化,所以使用两种抗体,它们在两个不同磷酸化位点(ps404和pt231)靶向tau。在转染的hek-293细胞中,s404磷酸化的tau含量水平显著降低68%,而t231磷酸化的tau含量水平显著降低98%(图2b)。在转染的sh-sy5y细胞中,分别观察到蛋白含量水平显著降低63%(磷酸-taups404)和92%(磷酸-taupt231)(图2d)。因为存在tau蛋白病的两个主要原因,所以在这两个位点处的磷酸化降低可指示过度磷酸化tau蛋白的可能降低。通过使用共聚焦显微镜,磷酸化tau的这种减少也在hek-293和sh-sy5y细胞的细胞质和细胞核中被观察到。因此,lrp::flag的过表达可降低tau的整体过度磷酸化。
[0269]
共聚焦显微镜进一步用于分析细胞内tau(τ)和磷酸tau(τ)的表达,因为这些蛋白通常存在于细胞质和细胞核中(图5)。合并的图代表红色染色(代表tau或磷酸tau)与蓝色核dapi染色的合并。这些结果证实,相对于非转染细胞,转染细胞中所有细胞位置的总tau和磷酸化tau减少。
[0270]
图5示出转染和未转染的hek-293和sh-sy5y细胞中tau和磷酸-tau的细胞内表达。b、e)细胞核由dapi(蓝色)染色。a、b)总tau的表达在转染的hek-293和转染的sh-sy5y细胞中降低。总tau(红色)的内源性含量水平(a)。用pcineo-molrp-flag质粒转染后总tau(红色)的含量水平(d)。总tau与dapi染色的合并(c、f)。c、d)磷酸-tau(ps404)的表达在转染的hek-293和转染的sh-sy5y细胞中降低。磷酸-tau(ps404)(红色)的内源性含量水平(a)。用pcineo-molrp-flag质粒转染后磷酸-tau(ps404)(红色)的含量水平(d)。磷酸-tau(ps404)与dapi染色的合并(c、f)。e、f)磷酸-tau(pt231)的表达在转染的hek-293和转染的sh-sy5y细胞中降低。磷酸-tau(pt231)(红色)的内源性含量水平(a)。用pcineo-molrp-flag质粒转染后磷酸-tau(pt231)(红色)的含量水平(d)。磷酸-tau(pt231)与dapi染色的合并(c、f)。所有图像均在添加airyscan
tm
的情况下以630倍放大率拍摄。比例尺代表20μm。
[0271]
图9示出转染和未转染的hek-293和sh-sy5y细胞中tau和磷酸-tau的细胞内表达。b、e)细胞核由dapi(蓝色)染色。a、b)总tau的表达在转染的hek-293和转染的sh-sy5y细胞中降低。总tau(红色)的内源性含量水平(a)。用pcineo-molrp-flag质粒转染后总tau(红色)的含量水平(d)。总tau与dapi染色的合并(c、f)。c、d)磷酸-tau(ps404)的表达在转染的hek-293和转染的sh-sy5y细胞中降低。磷酸-tau(ps404)(红色)的内源性含量水平(a)。用pcineo-molrp-flag质粒转染后磷酸-tau(ps404)(红色)的含量水平(d)。磷酸-tau(ps404)与dapi染色的合并(c、f)。e、f)磷酸-tau(pt231)的表达在转染的hek-293和转染的sh-sy5y细胞中降低。磷酸-tau(pt231)(红色)的内源性含量水平(a)。用pcineo-molrp-flag质粒转染后磷酸-tau(pt231)(红色)的含量水平(d)。磷酸-tau(pt231)与dapi染色的合并(c、f)。
[0272]
lrp::flag的过表达增加总htert含量水平
[0273]
最近还发现lrp/lr与抗衰老相关蛋白端粒酶和htert相互作用[36]。在ad中,神经元细胞的端粒严重缩短,因为aβ的积累,其能够抑制端粒酶的活性。此外,htert不存在于受过度磷酸化tau影响的细胞中。因为已知lrp/lr和端粒酶在ad的aβ方面均起作用,所以假设它们也可能在tau蛋白病变中起作用。众所周知,lrp::flag的过表达增加hek-293细胞和sh-sy5y细胞中的htert含量水平。还表明,此增加引起端粒酶活性增加[36、58]。因此,蛋白印迹经执行以检查lrp::flag过表达对htert含量水平的影响,以及htert的活性形式,磷酸化tert(ps824)(图6a;c),因为这指示端粒酶活性增加。在转染的hek-293(图6b)和sh-sy5y(图6d)细胞中,分别观察到htert含量水平显著增加120%和125%。磷酸化tert含量水平的显著增加在两种细胞系中也被观察到,其中在转染的hek-293细胞中增加112%(图6b),而在转染的sh-sh5y细胞中增加96%(图6d)。
[0274]
表4:转染的sh-sy5y细胞中磷酸tert与htert的比率。相对于设定为1的htert含量水平执行分析。n=3次生物性重复。*p:0.05,**p:0.01,***p:0.001
[0275]
[0276]
lrp::flag的过表达降低aβ表达和prpc含量水平
[0277]
使用共聚焦显微镜研究aβ
42
表达。
[0278]
与未转染的细胞相比,aβ
42
表达的总体下降在转染的hek-293细胞中被观察到(图7)。合并的图代表绿色染色(代表aβ
42
)与蓝色dapi核染色的合并。因此,aβ
42
表达的减少可有助于磷酸化tau(τ)的减少。
[0279]
图7aβ
42
在转染和未转染的hek-293细胞中的细胞内表达。aβ
42
的表达在转染的hek-293细胞中降低。a)aβ
42
的内源性含量水平。aβ
42
定位于细胞质和细胞表面。d)用pcineo-molrp-flag质粒转染后aβ
42
的含量水平。b、e)细胞核由dapi染色。c、f)aβ
42
与dapi染色的合并。所有图像均使用添加放大倍数为630的airyscan
tm
的zeiss lsm 780显微镜拍摄。比例尺代表20μm。
[0280]
使用蛋白印迹法研究lrp::flag的过表达对prpc的影响(图8:a1和b1)。
[0281]
内源性prpc可以三种异构体存在:非糖基化、单糖基化和双糖基化,且因此大小范围从约20kda到约35kda。在hek-293细胞中,双糖基化形式和单糖基化形式均可见(图8:a1),而在sh-sy5y细胞中,仅可见单糖基化形式(图8:b1)。需注意,糖基化对于在朊病毒中编码品系信息不是必需的且prpc糖型比率在不同大脑区域和细胞系中不同。因此,总的差异是检查的prpc。
[0282]
总prpc分别显著降低34%(图8:a2)和39%在转染的hek-293和sh-sy5y细胞两者中被观察到(图8:b2)。此减少在aβ
42
和prpc之间的信号转导通路中可很重要,这可引起tau过度磷酸化的减少。
[0283]
图8示出lrp::flag在hek-293和sh-sy5y细胞中的过表达降低prpc含量水平。a1、b1)泳道1-3:未转染的细胞。泳道4-6:转染的细胞。β-肌动蛋白(hrp)用作上样对照。执行的光密度分析相对于设定为100%的未转染的hek-293(a2)和sh-sy5y(b2)细胞。误差条代表标准偏差,n=3次生物性重复。*p:0.05,**p:0.01,***p:0.001;学生t检验。
[0284]
关于实验结果的进一步评论:
[0285]
针对lrp/lr下调的研究已成功阻止aβ脱落并使细胞免受aβ诱导的细胞毒性。这些观察结果也已在体内得到证实,其中用抗lrp/lr抗体igg1-is18(其阻断细胞表面lrp/lr)治疗的阿尔茨海默病(ad)转基因小鼠示出淀粉样蛋白斑块生成减少,短期记忆和学习记忆也有相应的改善。
[0286]
然而,未知lrp/lr上调是否对ad的另一种神经病理学因子(过度磷酸化的tau)有影响。在本文证明,lrp/lr直接与tau相互作用并且lrp::flag的过表达降低总tau含量水平和磷酸化tau含量水平。这并不意外。此外,lrp::flag过表达增加htert和磷酸化tert含量水平,同时prpc含量水平降低。
[0287]
最初,共聚焦显微镜用于确定lrp/lr和tau是否在hek-293细胞中共定位,因为这是蛋白之间可能相互作用的先决条件。如图所示,观察到lrp/lr和tau在细胞核和细胞质区域中的共定位。此后,fret经执行以确定这些蛋白是否直接相互作用。观察到的荧光位移指示这些蛋白彼此相距在10nm以内。因此,我们的结果表明lrp/lr和tau直接相互作用。lrp/lr参与tau的主要功能;在健康细胞中组装和维持微管。
[0288]
为了研究lrp/lr是否在tau蛋白病变中起作用,用pcineo-molrp-flag构建体稳定转染hek-293和sh-sy5y细胞,以诱导lrp::flag过表达。此过表达对总tau蛋白和磷酸化tau
蛋白含量水平的影响经使用蛋白印迹来确定。磷酸化tau(ps404和pt231)的显著减少在两种细胞系中均被观察到。在这两个位点观察到的磷酸化减少可指示过度磷酸化的tau减少。共聚焦显微镜证实,磷酸化tau的这种减少在两种细胞系的细胞质和细胞核中均被观察到。tau的过度磷酸化是ad中的主要问题,因为它形成缠结,通过使细胞骨架轨道不稳定,该缠结破坏神经元细胞的内部结构。因此,在两个tau磷酸化位点(ps404和pt231)中观察到的显著减少引起过度磷酸化tau的聚集量减少,从而减少对神经元细胞的损伤。因为已知此聚集引起细胞骨架轨道解体,所以过度磷酸化tau的减少阻碍细胞骨架解体并改善重要细胞过程,诸如轴突运输,从而在ad患者体内使神经元保持正常功能。特别是,已知在本文研究的在s404和t231处tau的磷酸化负面影响tau蛋白与微管的结合,从而使它们不稳定并抑制细胞骨架信令和运输。
[0289]
t231突变的n18神经母细胞瘤细胞消除丝氨酸/苏氨酸激酶gsk3对tau的磷酸化,指示在t231处的磷酸化在tau的过度磷酸化中起重要作用。因此,在这些位点处的磷酸化减少阻止tau解离并促进微管蛋白聚合和组装成微管。因此,细胞的结构完整性将维持不变且它们的信令和运输能力将保持完整,使它们能够更好地抵抗ad的破坏性影响。特别是,dna损伤修复蛋白可被运送到细胞毒性位点以便拯救细胞。ad中存在的细胞毒性引起的dna损伤经由氧化应激导致神经元凋亡。
[0290]
此外,tau的过度磷酸化能够通过隔离fyn激酶来增强aβ细胞毒性。因此,fyn被重新分配到神经元,从而其可加强神经递质谷氨酸的兴奋性毒性信令,谷氨酸被熟知可增强aβ寡聚体的细胞毒性。因此,磷酸化tau的减少和由此产生的神经原纤维缠结的减少既可减轻细胞毒性,也可使dna修复发生。总体而言,观察到的磷酸化tau蛋白的减少可为ad发展和进展的缓解因子。本文提供的联合疗法可有效地改善ad。
[0291]
此外,总tau含量水平的降低在两种分析的细胞系中均被观察到。野生型tau对微管和细胞信令的功能至关重要,因此总tau的减少可有害于细胞。然而,已经看到在用aβ
42
处理后lrp::flag过表达使细胞免受细胞毒性。虽然lrp::flag的过表达并不专门针对磷酸化tau,但它似乎对磷酸化形式有更显著的影响。lrp-层粘连蛋白相互作用也可影响tau的磷酸化,特别是当lrp/lr被示出与tau直接相互作用时。此外,已知lrp/lr和粘着斑激酶(fak)在lrp/lr与层粘连蛋白结合后相互作用。事实上,在用aβ处理的神经元中,除了增加tau的磷酸化外,fak的磷酸化也增加且fak和fyn激酶之间的关联也增加。综上所述,已知这些增加会增强ad中的细胞毒性。因此,lrp和fak之间的相互作用以及后续信令通路诸如pi3-激酶/akt和mapk的激活可影响ad中tau的磷酸化。
[0292]
lrp::flag过表达对htert含量水平以及htert的活性形式、磷酸化tert(ps824)的影响指示端粒酶活性增加。htert和磷酸化tert(ps824)含量水平的显著增加在两种细胞系中均被观察到。htert的增加诱导/引起端粒酶活性的相应增加。然而,为了有活性,htert必须存在于细胞核中。因此,为了发生全长120kda htert变体的核定位,它首先在丝氨酸残基227和/或824处通过pi3-激酶/akt信令进行磷酸化。这表明端粒酶活性的增加不仅是htert含量水平增加的结果,也是htert输入细胞核的结果。
[0293]
事实上,通过比较hek-293和sh-sy5y细胞中的磷酸化tert和htert含量水平,很明显并非所有htert均被转化为磷酸化tert。因此,此htert可参与端粒外功能。值得注意,htert对ros的保护功能。在细胞处于氧化应激时,htert能够迁移到线粒体,这允许htert与
mtdna相互作用以传递保护。在ad中,由于线粒体功能障碍,大脑中的能量产生受到影响。此功能障碍可增加ros的产生,这已被示出促进tau的过度磷酸化,但尚未确定这是如何发生的。相比之下,tau的过度磷酸化和神经原纤维缠结的形成也损害线粒体沿微管的运动。在神经元中,线粒体分布在代谢需求高的轴突区域诸如突触和活跃的生长锥或分支。因此,atp耗竭可发生在轴突和树突的其他区域,这加剧突触功能障碍。重要的是,在ad中,htert的缺失已被示出增加神经元中线粒体超氧化物的含量水平,且体内表达的截短tau随着时间的推移通过积累ros而产生增加的氧化应激。此外,已经观察到病理性tau和htert相互排斥,从而表明可防止表达htert的神经元发展tau病理。lrp::flag过表达引起细胞质和细胞核中htert的增加,且正是细胞质和细胞核的这种增加可对应于htert的端粒外功能的增加。因此,在ad中,观察到的htert增加(特别是在细胞质中)改善线粒体功能并防止ros产生。此外,核htert能够调节炎症和增殖通路,诸如wnt和nf-κb。因此,观察到的核htert增加将经由这些途径调节促增殖和抗炎基因,这可防止细胞凋亡并帮助ad中的细胞存活。因此,通过增加端粒酶活性和端粒延长,通过减少ros产生从而改善线粒体功能,以及通过调节细胞存活途径,htert的增加可通过多种方式阻止细胞周期停滞和细胞凋亡。总体而言,htert的增加减缓tau蛋白病变和ad的进展。
[0294]
总prpc和磷酸化tau的减少在过表达lrp::flag的细胞中被观察到。观察到的prpc减少可有益于防止发生在ad后期的aβ-prpc信令级联。因此,lrp::flag过表达能够降低磷酸化的tau、aβ
42
和prpc含量水平。这些蛋白在ad进展过程中彼此相互作用,其中aβ
42
与prpc结合,从而引起细胞毒性和aβ
42
脱落增加,这导致tau过度磷酸化和神经原纤维缠结的形成。同样重要的是要注意,lrp::flag不影响prp
sc
含量水平,其是朊病毒疾病诸如克雅氏病的病原体。
[0295]
lrp/lr和tau共享相同的亚细胞位置并直接相互作用。因此,细胞质lrp可通过其与tau肽结合来帮助稳定微管。lrp::flag过表达引起磷酸化tau和prpc含量水平降低。总体而言,lrp::flag的过表达能够降低在ad中观察到的细胞毒性作用。此外,htert含量水平在lrp::flag过表达后增加且因此可提供针对由tau过度磷酸化引起的细胞毒性的防护。通过ab介导的细胞毒性的拯救机制和磷酸化tau含量水平的降低(可分别由增加的htert和降低的prpc含量水平介导),lrp::flag充当ad治疗的潜在替代治疗工具。因此,lrp含量水平的升高是治疗ad和其他蛋白病的潜在治疗策略。
[0296]
图9示出ad细胞培养模型中lrp::flag过表达的所提出机制。a)lrp和tau之间的直接相互作用:细胞质lrp::flag的增加可通过lrp和tau的直接相互作用稳定微管。b)aβ
42-prp
c-过度磷酸化的tau级联反应:lrp::flag过表达降低aβ
42
和prpc的含量水平,这可有助于减少磷酸化的tau。c)增加的htert:lrp::flag过表达增加htert含量水平,这传递神经保护作用,因为它能够防止氧化应激。增加的htert含量水平也可降低细胞间aβ
42
和磷酸化tau的含量水平,然而,确切的机制未知。lrp::flag过表达还引起衰老标记蛋白γh2ax和β-半乳糖苷酶减少。虚线和问号指示未知机制。
[0297]
进行中的实验
[0298]
体内研究在进行中。检查tau(τ)转基因小鼠,诸如p301s品系在体内提高lrp的效果。这些小鼠表达突变的人类微管相关蛋白tau(mapt),从而引起它们在新大脑皮层、脑杏仁核、海马体、脑干和脊髓中形成神经原纤维缠结样包裹体。因此,它们在八个月时表现出
神经元损失和脑萎缩。lrp::flag可作为质粒鼻腔注射,以确保有效递送至大脑。可选地,lrp::flag序列可插入病毒载体来递送,优选经口服。
[0299]
此外,体外和体内研究表明,抗lrp/lr特异性抗体igg1-is18可通过降低ad中的aβ含量水平来阻止神经变性。提供联合治疗,该治疗使用lrp::flag过表达和lrp/lr的igg1-is18阻断以及如本文所教导的上调。此治疗将针对ad的多个方面,从而改善治疗结果。
[0300]
根据本文第一至进一步方面的lrp/lr或质粒可被封装在亲脂性复合物或纳米颗粒内,这既可保护药物,又可使其穿过细胞的质膜。此外,大脑特异性配体可附着到活性分子上,以确保药物不扩散到身体的其他任何地方。
[0301]
虽然本公开的主题已经相对于特定实施方案和/或其实例被详细描述,但是应当理解,本领域技术人员在理解前述内容之后可容易地想到这些实施方案的变更、变型和等同物的情况。因此,本公开的范围应被评估为权利要求书及其任何等同物的范围,权利要求书附在本文之后。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1