无色甲基硫堇鎓的治疗相互作用的制作方法
1.本发明总体上涉及治疗阿尔茨海默病或轻度认知损害的方法,所述方法适于避免治疗剂组合之间的负面相互作用或适于增强治疗剂效果。
背景技术:
2.目前可用于治疗阿尔茨海默病(ad)的唯一治疗是对症治疗。其中使用最广泛的是乙酰胆碱酯酶抑制剂(achei),其通过慢性增加突触间隙中乙酰胆碱(ach)的水平起作用。在实验模型中,胆碱能功能主要与选择性注意相关(botly和de rosa,2007;2008;sarter等人,2016),并且对更广泛基础的功能损害/改善量度并不特别敏感(综述于(klinkenberg和blokland,2010;robinson等人,2011)中)。类似的考虑也适用于美金刚,所述美金刚也以非特异性方式调节脑功能(gastambide等人,2012;ding等人,2018)。这些治疗的治疗益处的持续时间相对较短(courtney等人,2004),只有小于30%的患者在开始治疗后12个月继续使用achei(mauskopf等人,2005;singh等人,2005;raina等人,2008)。在任何情况下,相当大比例的ad患者都没有得到治疗,在美国约有44%(koller等人,2016)并且在英国约有77%(martinez等人,2013)。在法国,由于“医疗福利不足并且由于副作用的危险性”,这些药物的报销已经被撤回(krolak-salmon等人,2018)。较低的医疗使用率和患者依从性是由于较低的感知功效和副作用,暂时症状改善后的衰退速率与没有治疗的情况下发生的衰退速率没有区别(courtney等人,2004)。因此,普遍认为对于开发能够减缓ad进展的治疗存在大的未满足的医疗需求。一份柳叶刀神经病学委员会(lancet neurology commission)的报告(winblad等人,2016)指出,
“…
尚无治疗方法能够阻止或逆转已经确立的ad的潜在病理。事实上,针对ad的有效的疗法可能是现代医学面临的最大未满足需求。”上一次批准用于ad的新治疗是在2003的美金刚(等人,2009)。从2002年至2012年,已有289项临床试验处于2期或3期,总失败率为99.6%(cummings等人,2014)。自2012年以来,靶向β-淀粉样蛋白病理进展的各个方面的试验又失败了19次(panza等人,2019)。
3.尽管可用的对症治疗存在局限性,但是几乎所有目前正在进行或最近完成的旨在测试新治疗方法的后期临床试验都是在大多数受试者继续接受对症治疗的患者群体中进行的(panza等人,2019)。这在一定程度上是由伦理问题决定的,即如果随机分配到安慰剂组,参与可能冗长的临床试验的患者将不能接受任何治疗。进一步的考虑是未经证实的假设,即对症治疗不会干扰靶向潜在病理的治疗,因为它们的作用模式不同。
4.甲基硫堇鎓(methylthioninium)(mt)在体外充当τ蛋白聚集抑制剂(wischik等人,1996;harrington等人,2015),溶解阿尔茨海默病脑组织的phf(wischik等人,1996)并且在与人类口服给药一致的脑浓度下降低转基因小鼠τ蛋白转基因模型中的τ蛋白病理和相关行为缺陷(melis等人,2015a;baddeley等人,2015)。
5.无色甲基硫堇鎓双(氢甲烷磺酸盐)(lmtm;usan名称氢甲基硫堇甲磺酸盐)被开发为在ad中靶向τ蛋白病理性聚集的治疗(wischik等人,2018)。甲基硫堇鎓(mt)部分可以以氧化(mt
+
)和还原(lmt)形式存在。lmtm是lmt的稳定盐,所述盐具有比氧化的mt
+
形式更好的
药物特性(baddeley等人,2015;harrington等人,2015)。我们最近报道了lmt(而不是mt
+
)是体外阻断τ蛋白聚集的活性物质(al-hilaly等人,2018)。lmt在体外在无细胞和基于细胞的测定中阻断τ蛋白聚集(harrington等人,2015;al-hilaly等人,2018),并且在体内在τ蛋白转基因小鼠模型中以临床相关剂量减少了τ蛋白聚集病理和相关的行为缺陷(melis等人,2015a)。lmt还分解从ad脑组织分离的成对螺旋细丝(phf)的τ蛋白,将所述τ蛋白转化为易受蛋白酶影响的形式(wischik等人,1996;harrington等人,2015)。
6.mt部分还具有一系列其他潜在的有益特性。一段时间以来,人们已经知道,在低浓度(10-100nm)时,它通过充当电子转移链中的补充电子载体来增强线粒体活性。mt部分经历使用nadh作为辅助因子由复合物i催化的氧化还原循环,由此所述mt部分接受电子,电子随后转移到复合物iv(atamna等人,2008;atamna等人,2012)。它还能够诱导线粒体生物发生并且在体内激活nrf2介导的氧化应激反应元件(stack等人,2014)。其他活性包括通过抑制小胶质细胞激活和增加自体吞噬在脑中发挥神经保护作用(zhao等人,2016)。mt部分已显示经由以10-20nm的浓度范围增强自体吞噬来增加体内病理性τ蛋白的清除(congdon等人,2012)。因此,除了溶解adτ蛋白聚集体之外,lmtm还具有解决目前被认为具有治疗ad的潜力的许多途径的许多互补性作用(oz等人,2009;schirmer等人,2011)。
7.尽管口服给予lmtm产生了体外和体内活性足够的脑水平(baddeley等人,2015),但是如果作为在两种大3期临床试验中对于对症治疗的附加治疗,它具有最小的表观功效(gauthier等人,2016;wilcock等人,2018)。然而,在接受lmtm作为单一疗法的受试者中,治疗导致认知和功能下降的明显减缓、通过mri测量的脑萎缩的进展速率降低以及通过fdg-pet测量的葡萄糖摄取减少(gauthier等人,2016;wilcock等人,2018)。当这些结局与可以从参与试验的受试者获得的群体药代动力学数据组合分析时,发现lmtm产生浓度依赖性效果,无论单独采用还是与对症治疗组合都是如此。然而,单一疗法受试者中的治疗效果明显大于lmtm与对症治疗组合的治疗效果。
8.wo 2008/155533涉及用于治疗mci的含有mt的化合物。
9.wo 2009/060191涉及用于神经变性障碍的推定治疗的临床试验设计。特别设想可以将接受活性物对症治疗的受试者纳入试验。
10.wo 2018/019823描述了使用含有甲基硫堇鎓(mt)的化合物治疗神经变性障碍的新型方案。该公开案总结了早先披露的含有mt的化合物,并且特别是用于治疗包括ad和轻度认知损害(mci)的此类障碍的“lmtx”化合物。wo 2018/019823确定了两个关键因素。第一个与mt化合物的剂量相关,并且第二个是它们与对症治疗的相互作用。
11.wo 2020/020751描述了lmt化合物的新型给药方案,所述给药方案使体内mt浓度超过展现治疗功效所需的mt浓度的受试者的比例最大化。
技术实现要素:
12.进行本发明的研究旨在了解负责上文讨论的作为对症治疗附加物的lmtm的功效降低的机制。在这些研究中,将良好表征的τ蛋白转基因小鼠模型(1系,“l1”;(melis等人,2015b))与野生型小鼠进行比较。
13.我们证明,在表达构成ad缠结丝的短τ蛋白片段的τ蛋白转基因小鼠中,仅给予lmtm增加了海马体乙酰胆碱(ach)水平、谷氨酸从突触体制备物中的释放、多个脑区域中的
突触小泡蛋白水平和线粒体复合物iv活性,降低了τ蛋白病理,恢复基底前脑中胆碱乙酰转移酶(chat)的免疫反应性,并且逆转了空间学习的缺陷。
14.发现用利凡斯的明的慢性预治疗减少或消除了几乎所有这些影响,除了减少τ蛋白聚集病理和恢复基底前脑中的chat免疫反应性。在野生型小鼠中,lmtm对海马体ach和突触小泡蛋白水平的影响也降低。
15.因此,临床观察到的胆碱酯酶抑制剂对lmtm功效的干扰也可以在τ蛋白转基因小鼠模型中重现,并且在较小程度上在野生型小鼠中重现。
16.我们观察到,用对症药物的预治疗在多个脑功能水平下改变了脑对跨不同递质系统和细胞区室的lmtm的广泛反应。负面相互作用没有单一的位点。相反,由胆碱酯酶功能降低诱导的慢性神经元激活在多个神经元系统中产生补偿性稳态下调。这具有减少与τ蛋白聚集病理减少相关的对lmtm的广泛治疗反应的效果。
17.重要的是,由于干扰是由对先前的对症治疗的稳态反应决定的,因此类似地受到作为对现有对症治疗的“附加物”测试的其他药物的干扰是合理的,不论所述其他药物预期的治疗靶标或作用方式如何。本发明概述概括了主要结果,所述主要结果现在提供了一个工作模型来解释对症治疗的干扰。换句话说,可以预期任何激活性预治疗都会产生稳态补偿性下调性反应,如果第二种治疗也是激活性的,所述稳态补偿性下调性反应将减弱所述第二种治疗的有效性。
18.我们进行的实验是为了模拟这样一种临床情况,其中在已经接受对症治疗的患者中添加lmtm。然而,所述模型的另一个含义与在上述对症治疗之前开始lmtm(或其他治疗剂)的治疗相关。如果通过首先出现的治疗来确定稳态下调,则合理的是尽管如果之后作为“附加”疗法引入可以在一定程度上减少附加的对症治疗的反应,但是lmtm的治疗效果是主导的。
19.进行了另外的实验以确定治疗18个月后lmtm停药的效果。在这些实验中,根据患者是否已经以现有对症疗法(achei,美金刚“achmem”)的附加或单一疗法接受lmtm将患者组进行分组。根据wo2020/020751中所述的药代动力学建模,根据受试者是否接受了暴露于mt的较高的cmax或较低的cmax,进行进一步分组。
20.出乎意料的是,高cmax附加组实际上显示出了在lmtm停药后adas-cog的出乎意料的改善,这与lmtm治疗期间的疾病调节效果一致,这导致对仅对症治疗的反应改善。此发现对使用lmtm和achmem组合疗法具有潜在的影响-例如,在已经证明对achmem无反应的患者组中,lmtx的疾病调节效果实际上可以增强对achmem的反应(特别是一旦中止lmtx),并且特别是与轻度ad受试者中的adas-cog相关。这具有效用,因为许多患者对ach抑制剂治疗无反应(例如30%-40%,或更多-参见mcgleenon bm,dynan kb,passmore ap.acetylcholinesterase inhibitors in alzheimer's disease.br j clin pharmacol.1999;48(4):471-480.doi:10.1046/j.1365-2125.1999.00026.x)。
21.因此,本公开文本涉及治疗阿尔茨海默病或轻度认知损害的方法,其中在施用与含有mt和不含有mt的化合物二者相关的活性治疗剂之前主动控制治疗剂的顺序例如以防止稳态下调。在某些实施方案中,如上所讨论的用神经递质调节化合物的疗法(如乙酰胆碱或谷氨酸神经递质的活性的调节剂)可以随后与含有mt或不含有mt的化合物治疗组合或在所述含有mt或不含有mt的化合物治疗之后进行。
22.本公开文本还利用本发明的与临床试验设计相关的发现。
23.因此,在一方面提供了一种治疗性治疗受试者的阿尔茨海默病或轻度认知损害的方法,所述方法包括向所述受试者施用治疗性的含有甲基硫堇鎓(mt)的化合物,
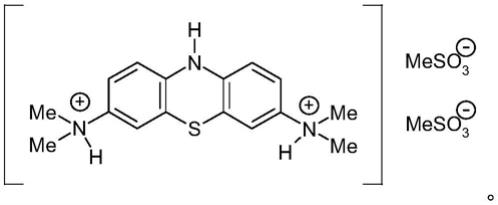
24.其中所述含有mt的化合物是具有下式的lmtx化合物:
[0025][0026]
其中hna和hnb(如果存在)中的每一个均是质子酸,所述质子酸可以是相同或不同的,
[0027]
并且其中p=1或2;q=0或1;n=1或2;(p+q)
×
n=2,或其水合物或溶剂化物,
[0028]
其中所述受试者选自下组:
[0029]
(i)在历史上未接受过用神经传递调节化合物的治疗的受试者,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂;或
[0030]
(ii)在历史上已经接受过用神经传递调节化合物的治疗,但是在用所述lmtx化合物治疗之前至少3、4、5、6、7或8周停止所述治疗的受试者,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂;
[0031]
其中将用lmtx的所述治疗性治疗维持治疗时间范围,不伴随神经传递调节化合物的共施用,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂
[0032]
随后;
[0033]
用lmtx与神经传递调节化合物共施用治疗,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂,
[0034]
其中在所述治疗性化合物与所述神经传递调节化合物共施用之前的治疗时间范围是至少2个月。
[0035]
在另一方面提供了一种治疗性治疗受试者的阿尔茨海默病或轻度认知损害的方法,所述方法包括向所述受试者施用不含有mt的治疗性化合物,
[0036]
其中所述受试者选自下组:
[0037]
(i)在历史上未接受过用神经传递调节化合物的治疗的受试者,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂;或
[0038]
(ii)在历史上已经接受过用神经传递调节化合物的治疗,但是在用所述lmtx化合物治疗之前至少3、4、5、6、7或8周停止所述治疗的受试者,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂;
[0039]
其中将用所述治疗性化合物的所述治疗性治疗维持治疗时间范围,不伴随神经传递调节化合物的共施用,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂
[0040]
任选地随后;
[0041]
用所述治疗性化合物与神经传递调节化合物共施用治疗,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂,
[0042]
其中在所述治疗性化合物与所述神经传递调节化合物共施用之前的治疗时间范围是至少2个月。
[0043]
在另一方面提供了一种用于评估不含有mt的化合物的功效的方法,所述化合物推定对受试者的阿尔茨海默病或轻度认知损害具有治疗作用,所述方法包括以下步骤:
[0044]
(a)选择仅由以下组成的受试者组:
[0045]
(i)在历史上未接受过用神经传递调节化合物的治疗的受试者,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂;和
[0046]
(ii)在历史上已经接受过用神经传递调节化合物的治疗,但是在所述评估之前至少3、4、5、6、7或8周停止所述治疗的受试者,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂;
[0047]
(b)根据可能的疾病进展的基线指标将所述受试者组分为至少2个亚组,
[0048]
(c)用不含有mt的化合物治疗每个受试者组的成员持续治疗时间范围,
[0049]
(d)为每个治疗的患者组得出心理测量结局量度和任选地生理结局量度,
[0050]
(e)将在(d)中的结局与所述亚组的比较剂组进行比较,所述比较剂组任选地是安慰剂或最小功效比较剂组,
[0051]
(f)使用在(e)中的比较得出不含有mt的化合物的功效量度。
[0052]
在这些方面,如果存在历史治疗,则在治疗或评估前3、4、5或6周或更长时间停止,最优选在治疗或评估前6周停止。
[0053]
在这些方面,在共施用的情况下,在所述治疗性化合物与所述神经传递调节化合物共施用之前的治疗时间范围优选是至少2、3、4、5或6个月,最优选至少6个月。
[0054]
在另一方面提供了一种治疗性治疗受试者的阿尔茨海默病或轻度认知损害的方法,所述方法包括向所述受试者施用治疗性化合物,
[0055]
其中所述受试者正在接受用神经传递调节化合物的治疗,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂;
[0056]
其中将用所述治疗性化合物的所述治疗性治疗维持第一治疗时间范围,伴随神经传递调节化合物的共施用,在所述治疗时间范围期间,所述神经传递调节化合物的剂量减少至零,随后
[0057]
将用所述治疗性化合物的治疗持续第二治疗时间范围,不伴随神经传递调节化合物的共施用,
[0058]
其中所述第一治疗时间范围是在2周与8周之间,
[0059]
其中所述第二治疗时间范围是至少3个月,更优选至少6个月或至少12个月。
[0060]
所述第一治疗时间范围可以更优选地在3周与8周之间,例如3至6周,或约1或2个月。优选地,剂量的减少是稳定的,例如在此期间呈线性,以便所述受试者不会暴露于突然的停药。
[0061]
通过“逐步调整”使所述受试者脱离神经传递调节化合物(例如achei或n-甲基-d-天冬氨酸受体拮抗剂),基于本文的公开内容,可以预期对症稳态反应可最终被对治疗性化合物(可含有mt,或含有其他物质)的反应替代。
[0062]
在另一方面提供了一种治疗性治疗受试者的阿尔茨海默病或轻度认知损害的方法,
[0063]
以对用神经传递修饰化合物治疗无反应选择所述受试者,所述神经传递修饰化合物是乙酰胆碱或谷氨酸神经递质活性的调节剂,
[0064]
所述方法包括向所述受试者施用治疗性的含有甲基硫堇鎓(mt)的化合物,
[0065]
其中所述含有mt的化合物是具有下式的lmtx化合物:
[0066][0067]
其中hna和hnb(如果存在)中的每一个均是质子酸,所述质子酸可以是相同或不同的,
[0068]
并且其中p=1或2;q=0或1;n=1或2;(p+q)
×
n=2,或其水合物或溶剂化物,
[0069]
随后用所述神经传递调节化合物治疗。
[0070]
所述阿尔茨海默病可以是轻度阿尔茨海默病。可以使用ltmx持续治疗时间范围,伴随神经传递调节化合物的共施用,随后不用所述lmtx的情况下用神经传递调节化合物治疗,其中任选地共施用的治疗时间范围是至少2个月,但是可以是至少6、12或18个月,例如长达24个月。
[0071]
因此,提供了lmtx化合物(或lmtx化合物与神经传递调节化合物的组合)用以增强受试者(特别是原本被认为对这种神经传递调节化合物无反应的受试者)对神经传递调节化合物的反应性的用途。
[0072]
现在将更详细地讨论本发明的一些方面和实施方案。
[0073]
患者选择
[0074]
如上所解释的,根据上下文,与本发明相关的选择涉及受试者和他们关于先前暴露于作为乙酰胆碱或谷氨酸神经递质的活性的调节剂的神经传递调节化合物的状态。此类化合物是achei或n-甲基-d-天冬氨酸受体拮抗剂美金刚。乙酰胆碱酯酶抑制剂的例子包括多奈哌齐(aricept
tm
)、利凡斯的明(exelon
tm
)或加兰他敏(reminyl
tm
)。nmda受体拮抗剂的例子是美金刚(ebixa
tm
,namenda
tm
)。
[0075]
在一些方面,受试者组对于这些其他治疗可能完全是初试,并且历史上没有接受其中一项或全部两项。
[0076]
在其他方面,受试者组历史上可能已经接受这些治疗中一项或全部两项,但是在用根据本发明的mt化合物治疗之前,将所述药物治疗停用至少2、3、4、5、6、7、8、12或16周,或任选地至少1、2、3、4、5或6个月等。“停止”意指在某个时间点停止,或稳定逐步调整至零。
[0077]
在其他方面,可能存在治疗性化合物和神经传递调节化合物的共施用的初始阶段,如上所解释的,在此期间神经传递调节化合物的剂量被“逐步降低”至零。
[0078]
在其他方面,可以以对用神经传递调节化合物治疗没有反应选择受试者组,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂,所述没有反应即对这些对症治疗中的一项或全部两项没有显示出任何显著的临床益处,通常在这种情况下,所述药物将被认为不适合患者组,但是如本文所解释的,先前用lmtx治疗或与lmtx的组合治疗可能会为以后使用这些对症治疗创造效用。
[0079]
本发明的方面包括根据这些标准选择受试者组的活动步骤。这种主动选择通常将涉及对受试者或护理人员的具体询问,和适当的行动,包括(1)排除,如果受试者要继续用神经传递调节化合物治疗而无法在用所述治疗剂的第一时间范围之前或期间停止,或(2)接受,如果他们对该治疗是初试的,或者能够在施用所述治疗剂之前或在如上所解释的其中神经传递调节化合物的剂量“逐步降低”至零的共施用期间停止治疗足够长的时间。
[0080]
组合疗法
[0081]
在本发明中,存在至少一个时间范围,在所述时间范围期间用治疗性化合物(可能含有mt或可能不含有mt)进行治疗而不伴随对症治疗(神经传递调节化合物)的治疗。
[0082]
这种治疗可以是单一疗法,即没有其他活性物治疗,或者它可以是组合疗法(具有又另一种活性物治疗,例如非对症治疗)。
[0083]
在初始治疗之后,治疗性化合物可以与对症治疗(神经传递调节化合物)组合(或重组合)。
[0084]
因此,术语“治疗”包括“组合”治疗,其中将用于治疗相关疾病的两种或更多种治疗例如依序或同时组合。
[0085]
在组合治疗中,药剂(即,例如如本文所述的含有mt或不含有mt的化合物加上一种或多种其他药剂)可以同时或依序施用,并且可以以单独变化的剂量方案和经由不同途径施用。例如,当依序施用时,可以以紧密的间隔(例如,经5-10分钟的时间段)或以更长的间隔(例如,间隔1、2、3、4或更多个小时,或在需要时甚至更长时间的间隔)施用所述药剂,精确的剂量方案与所述一种或多种治疗剂的特性相称。
[0086]
因此,在一个实施方案中,在未接受achei或美金刚(一段时间)的受试者中开始或继续施用mt化合物,但是然后开始或在用mt化合物治疗一段时间后(例如在用mt化合物治疗大约2个月或更优选6个月后)重新开始用此类achei或美金刚治疗的治疗。
[0087]
通常,当医生判断这种对症共治疗将有益于受试者时,将开始(或重新开始)这种对症共治疗。
[0088]
疾病调节和对症治疗
[0089]
在本发明的方法中,治疗性的含有mt或不含有mt的化合物优选是“疾病调节性”(或推定的“疾病调节性”)的,因为在作用上与对症治疗不同。
[0090]
例如,可以在开始时推断此特性,例如,基于对所讨论的障碍的病因的已知或预期影响。
[0091]
在初始治疗期后,对症药剂在不影响基础疾病过程的情况下推迟或减轻疾病的症状,并且不改变更长期衰退的速率。如果停药后,患者恢复到未经治疗时的状态,则所述治疗被认为是对症的(cummings,j.l.(2006)challenges to demonstrating disease-modifying effects in alzheimer's disease clinical trials.alzheimer's and dementia,2:263-271)。
[0092]
achei和n-甲基-d-天冬氨酸受体拮抗剂美金刚是对症治疗的例子。τ蛋白聚集抑制剂是疾病调节性治疗的例子。
[0093]
疾病调节也可以从临床证据中推断出来,例如如果患者在停止治疗后恢复到他们未经治疗时的状态,则所述治疗可被认为是对症的,而不是疾病调节性的。可替代地(与试验相关),如果晚期随机接受活性物治疗的患者永远无法赶上早期随机接受活性物治疗的
患者,则所述治疗被认为调节了疾病。
[0094]
lmtx化合物
[0095]
本发明的一些方面涉及“lmtx”化合物,例如在wo 2007/110627或wo 2012/107706中所述的类型。
[0096]
因此,所述化合物可以选自下式的化合物、或其水合物或溶剂化物:
[0097][0098]hn
a和hnb(如果存在)中的每一个均是质子酸,所述质子酸可以是相同或不同的。
[0099]“质子酸”意指在水溶液中的质子(h
+
)供体。因此,质子酸中的a-或b-是共轭碱。因此,质子酸在水中的ph小于7(即,水合氢离子的浓度大于10-7
摩尔/升)。
[0100]
在一个实施方案中,所述盐是具有下式的混合盐,其中ha和hb是不同的单质子酸:
[0101][0102]
然而,优选地所述盐不是混合盐,并且具有下式:
[0103][0104]
其中hnx中的每一个均是质子酸,如二质子酸或单质子酸。
[0105]
在一个实施方案中,所述盐具有下式,其中h2a是二质子酸:
[0106][0107]
优选地,所述盐具有下式,其是双单质子酸:
[0108][0109]
可以存在于本文使用的lmtx化合物中的质子酸的例子包括:
[0110]
无机酸:氢卤酸(例如,hcl、hbr)、硝酸(hno3)、硫酸(h2so4)
[0111]
有机酸:碳酸(h2co3)、乙酸(ch3cooh)、甲磺酸、1,2-乙二磺酸、乙磺酸、萘二磺酸、对甲苯磺酸,
[0112]
优选的酸是单质子酸,并且盐是双(单质子酸)盐。
[0113]
优选的mt化合物是lmtm:
[0114][0115]
无水盐具有大约477.6的分子量。基于lmt核心的分子量是285.1,在本发明中使用该mt化合物的重量因子是1.67。“重量因子”意指含有纯mt的化合物与其含有的mt的重量的相对重量。
[0116]
可以计算例如本文的mt化合物的其他重量因子,并且可以由此计算相应的剂量范围。
[0117]
因此,本发明涵盖大约0.8至33mg/天的lmtm的总日剂量。
[0118]
更优选利用大约6至12mg/天的lmtm总剂量,其对应于约3.5至7mg mt。
[0119]
其他示例性lmtx化合物如下。还示出了它们的分子量(无水)和重量因子:
[0120]
[0121][0122][0123]
在本文描述的本发明的各个方面(在它们涉及含有mt的化合物时),其可以任选地
是上述那些化合物中的任一种:
[0124]
在一个实施方案中,它是化合物1。
[0125]
在一个实施方案中,它是化合物2。
[0126]
在一个实施方案中,它是化合物3。
[0127]
在一个实施方案中,它是化合物4。
[0128]
在一个实施方案中,它是化合物5。
[0129]
在一个实施方案中,它是化合物6。
[0130]
在一个实施方案中,它是化合物7。
[0131]
在一个实施方案中,它是化合物8。
[0132]
或者所述化合物可以是任何这些的水合物、溶剂化物或混合盐。
[0133]
lmtx剂量
[0134]
基于使用lmtm治疗疾病的先前的和并发的结果,可以得出结论,在2-80或100mg/天范围内的mt剂量对于本文所述的疾病可能是有益的。
[0135]
与疾病的治疗相关的lmtm的浓度-反应的更具体进一步的分析支持以下观点:优选剂量是至少2mg/天,并且在20-40mg/天或20-60mg/天范围内的剂量预期将最大化认知益处,然而同时保持了与最小副作用的良好耐受相关的理想特性。
[0136]
因此在一个实施方案中,所述总mt剂量可以是从大约2、2.5、3、3.5、4mg中的任一者至大约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59或60mg中的任一者。
[0137]
示例性剂量是2至60mg。
[0138]
示例性剂量是20至40mg。
[0139]
进一步的示例性剂量是8或16或24mg/天。
[0140]
本发明的受试者可以是成年人,并且本文所述的剂量以该基础为前提(典型体重50至70kg)。如果需要,可以通过使用受试者重量因子将相应剂量用于此范围之外的受试者,因而受试者体重除以60kg以提供该个体受试者的乘积因子。
[0141]
如本领域技术人员所理解的,对于给定的日剂量,更频繁的给药将导致更大的药物积累。
[0142]
诸位发明人已经得出mt的估计积累因子如下:
[0143]
给药观察到的mt血浆积累相对积累每日一次1.29
外推
1每日两次1.471.13每日三次1.651.28
[0144]
例如,考虑总日剂量是3.5至7mg mt:
[0145]
当以单一日剂量给予时,这可等同于血浆中mt的积累是4.5至8
[0146]
当分成每日两次时,这可等同于血浆中mt的积累是5.1至10.3
[0147]
当分成每日三次时,这可等同于血浆中mt的积累是5.8至11.6
[0148]
因此,在本发明的某些实施方案中,当更频繁地给药时(例如每日两次[b.i.d.]或每日三次[t.i.d.]),mt化合物的每日总给药量可以更低。
[0149]
在一个实施方案中,以大约9mg每日一次、4mg每日两次、2.3mg每日三次(基于lmtm的重量)施用lmtm。
[0150]
在一个实施方案中,以大约34mg每日一次、15mg每日两次、8.7mg每日三次(基于lmtm的重量)施用lmtm。
[0151]
受试者口服施用本发明的mt化合物或包含它的组合物。
[0152]
在一些实施方案中,将所述mt化合物以包含如本文所述的lmtx化合物和药学上可接受的载体、稀释剂或赋形剂的组合物施用。
[0153]
如本文所用的术语“药学上可接受的”涉及适用于与有关受试者的组织接触使用而没有过多的毒性、刺激性、过敏反应或其他问题或并发症,与合理的益处/风险比相称的化合物、成分、材料、组合物、剂型等。在与配制品的其他成分相容的意义上,每种载体、稀释剂、赋形剂等也必须是“可接受的”。
[0154]
在几个公开案例如wo 2007/110627、wo 2009/044127、wo 2012/107706、wo 2018019823和wo 2018041739中描述了包含lmtx盐的组合物。
[0155]
在一些实施方案中,所述组合物是这样一种组合物,所述组合物包含如本文所述的至少一种lmtx化合物,以及本领域技术人员熟知的一种或多种其他药学上可接受的成分,包括但不限于药学上可接受的载体、稀释剂、赋形剂、佐剂、填充剂、缓冲剂、防腐剂、抗氧化剂、润滑剂、稳定剂、增溶剂、表面活性剂(例如,润湿剂)、掩蔽剂、着色剂、调味剂和甜味剂。
[0156]
在一些实施方案中,所述组合物还包含其他活性药剂。
[0157]
合适的载体、稀释剂、赋形剂等可以在标准药学文献中找到。参见例如,handbook of pharmaceutical additives,第2版(编辑m.ash和i.ash),2001(synapse information resources,inc.,美国纽约恩迪科特),remington's pharmaceutical sciences,第20版,pub.lippincott,williams&wilkins,2000;和handbook of pharmaceutical excipients,第2版,1994。
[0158]
在一些实施方案中,所述组合物是片剂。
[0159]
在一些实施方案中,所述组合物是胶囊。
[0160]
在一些实施方案中,所述胶囊是明胶胶囊。
[0161]
在一些实施方案中,所述胶囊是hpmc(羟丙基甲基纤维素)胶囊。
[0162]
在一些实施方案中,所述单位中mt的量是2至60mg。
[0163]
在一些实施方案中,所述单位中mt的量是10至40或10至60mg。
[0164]
在一些实施方案中,所述单位中mt的量是20至40或20至60mg。
[0165]
示例性剂量单位可以含有2至10mg的mt。
[0166]
进一步示例性的剂量单位可以含有2至9mg的mt。
[0167]
进一步示例性的剂量单位可以含有3至8mg的mt。
[0168]
进一步优选的剂量单位可以含有3.5至7mg的mt。
[0169]
进一步优选的剂量单位可以含有4至6mg的mt。
[0170]
在一些实施方案中,所述量是约2、2.5、3、3.5、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20mg的mt。
[0171]
使用本文描述或解释的重量因子,本领域技术人员可以选择适当量的含有mt的化
合物用于口服配制品。
[0172]
如以上所解释的,lmtm的mt重量因子是1.67。由于使用单一或简单分数量的活性成分是便利的,非限制性示例性lmtm剂量单位可以包括约3、3.5、4、5、6、7、8、9、10、15、16、17、34、50、63mg等。
[0173]
不含有mt的化合物
[0174]
本发明的一些方面涉及不含有甲基硫堇鎓(mt)的用于或旨在用于治疗阿尔茨海默病或轻度认知损害的治疗性化合物。
[0175]
此类化合物可旨在是疾病调节性的或对症的。ad中已经被靶向以进行疾病调节的主要病理是τ蛋白和淀粉样蛋白。此类药物包括旨在减少淀粉样蛋白-β(aβ)产生、促进aβ清除的那些药物,以及用以增加τ蛋白调节和抑制聚集的药物。
[0176]
报道的适用于此类治疗的化合物的非限制性例子如下:
[0177]
靶向淀粉样蛋白-β(aβ)加工的药物
[0178]
影响aβ的药物包括bace抑制剂、免疫治疗方法(被动免疫疗法和主动免疫疗法)、α-分泌酶抑制剂或调节剂、γ-分泌酶激活剂和aβ聚集抑制剂(包括金属螯合剂(如pbt2))(panza等人,2019)。
[0179]
靶向τ蛋白的药物
[0180]
靶向τ蛋白的药物包括τ蛋白聚集的抑制剂(例如道诺霉素、刚果红、蒽醌、苯并噻唑、花青染料、苯基噻唑基-酰肼、n-苯胺、绕丹宁、多酚、卟啉、喹喔啉、氨基噻吩并哒嗪、橄榄油刺激醛、姜黄素及其他);微管稳定剂(例如埃博霉素d、dictyostatin;tpi-287);防止τ蛋白磷酸化的激酶抑制剂(例如替德谷司、硒酸钠、licl);乙酰化抑制剂(双水杨酸酯);去糖基化抑制剂(mk8719);和磷酸二酯酶4抑制剂(bpn14770)(congdon和sigurdsson,2015;尤其参见图4)。此外,τ蛋白免疫治疗方法正在临床试验中(例如aadvac1、aci-35、rg7345)。
[0181]
靶向基于神经再生的策略的药物包括例如基于睫状神经营养因子的肽(kazim和iqbal,2017)。
[0182]
具有多个推定的ad相关靶标的药物,如迪姆朋(dimebon)(或拉曲吡啶(latrepirdine))(ustyugov等人,2018)。
[0183]
另一种提出的针对ad的治疗方法是经由mirna抑制剂(jaber等人,2019)来靶向突触通信、装配和增强的aβ或τ蛋白清除方面的缺陷、神经营养支持的缺陷、神经炎症信号传导的扩散和先天性免疫反应的改变。mirna抑制剂是特异性抑制细胞中的内源性mirna功能的单链经修饰rna。神经mirna参与突触发育的各个阶段,包括树突生成(涉及mir-132、mir-134和mir-124)、突触形成和突触成熟(其中mir-134和mir-138被认为参与其中)。
[0184]
对ad具有对症效果的药物
[0185]
尽管较不优选地,本发明原则上也可以应用于疗法,即使不是疾病调节性的疗法也可以。例如,可能原本会受本文所述的稳态反应影响的不同的对症治疗,例如精神兴奋药,如安非他明(参见例如dolder,christian r.,lauren nicole davis,和jonathan mckinsey.“use of psychostimulants in patients with dementia.”annals of pharmacotherapy 44.10(2010):1624-1632.)。
[0186]
mci
[0187]
轻度认知损害被fda认为是有效的疾病靶标。它是通过具有尚未符合痴呆诊断的
临床标准的小程度认知损害而定义的。
[0188]
综合征性mci的代表性标准包括以下所列的特征:
[0189]
a.患者既不是正常的也不是痴呆的。
[0190]
b.有证据表明通过以下显示的认知恶化:客观测量的随时间的衰退和/或通过自我和/或信息提供者结合客观认知测试(例如,如果有记忆的话二次测试)得出的衰退的客观报告。
[0191]
c.保留日常生活的活动,并且复杂的工具性功能完整或受损较小。
[0192]
(还参见winblad,b.等人(2004)“mild cognitive impairment-beyond controversies,towards a consensus:report of the international working group on mild cognitive impairment.”j.intern.med.256:240-246)。
[0193]
如上所述,术语“痴呆”是指最广泛意义上的精神病症,如american psychiatric association:diagnostic and statistical manual of mental disorders,fourth edition,washington,d.c.,1994(“dsm-iv”)中所定义的。dsm-iv定义了“痴呆”,如表征为多种认知缺陷(包括记忆损害),并且根据假定的病因列出了各种痴呆。dsm-iv阐述了此类诊断、分类和治疗痴呆和相关精神障碍的普遍接受的标准。
[0194]
本发明可优选用于的mci受试者可以是小于或等于mmse 24、25、26、27、28或29,更优选小于或等于mmse 24、25、26,最优选小于或等于mmse 24或25的那些。下文更详细地讨论mmse测试。
[0195]
本发明的另一方面涉及如本文所述的治疗性化合物,用于如上所述的方法(例如治疗性治疗受试者的阿尔茨海默病或轻度认知损害的方法)或评估所述化合物的功效的方法中,其中所述化合物推定对受试者的阿尔茨海默病或轻度认知损害具有治疗作用。
[0196]
本发明的另一方面涉及本文所述的治疗性化合物在制造用于此类方法中的药剂中的用途。
[0197]
本发明的某些方面涉及用于评估不含有甲基硫堇鎓(mt)的化合物的功效的方法,所述化合物推定对受试者的ad或mci具有治疗作用。
[0198]
wo 2009/060191涉及用于神经变性障碍的推定治疗方法的临床试验设计,并且通过与此类试验的一般实施和分析手段相关的交叉引用具体地并入本文。
[0199]
本发明的方法通常涉及用于测试药物(或推定的药物,例如研究性药物产品(imp))的临床试验,但所述药物也可用于管理疗法,由此测试或比较采用所述药物的新治疗方案的功效。
[0200]
因此,本文所述的方法可用于进行临床试验,或用于提供用于进行所述试验的系统。
[0201]
此类系统可用于评估不含有甲基硫堇鎓(mt)的化合物的功效,所述化合物推定对受试者的阿尔茨海默病或轻度认知损害具有治疗作用,所述系统包括以下步骤:
[0202]
(a)选择仅由以下组成的受试者组:
[0203]
(i)在历史上未接受过用神经传递调节化合物的治疗的受试者,所述神经传递调节化合物是乙酰胆碱或谷氨酸神经递质的活性的调节剂;和
[0204]
(ii)在历史上已经接受过用神经传递调节化合物的治疗,但是在所述评估之前至少3、4、5、6、7或8周停止所述治疗的受试者,所述神经传递调节化合物是乙酰胆碱或谷氨酸
神经递质的活性的调节剂;
[0205]
(b)根据可能的疾病进展的基线指标将所述受试者组分为至少2个亚组,
[0206]
(c)选择治疗时间范围,在所述时间范围内,每个受试者组的成员将用不含有mt的化合物治疗,
[0207]
(d)选择针对每个治疗的患者组和所述亚组的比较剂组得出的心理测量结局量度和任选地生理结局量度,所述比较剂组任选地是安慰剂或最小功效比较剂组,
[0208]
由此药物的功效量度可以从治疗的患者组和比较剂组的比较中得出。
[0209]
所述方法特别适用于提供适合于满足适当的市场监管标准的临床功效的证据,所述标准例如如美国食品和药品管理局(us food and drug administration,fda)或欧洲药品评价机构(european agency for the evaluation of medicinal products,emea)所要求的。受试者组和可能疾病进展的预测指标
[0210]
受试者组通常将是使用常规标准(例如,国家神经和沟通障碍和中风研究所-阿尔茨海默病及相关障碍协会(national institute of neurological and communicative disorders and stroke-alzheimer’s disease and related disorders association)[nincds-adrda];dsm-iv等)诊断为患有相关障碍的患者。
[0211]
dsm-iv阐述了此类诊断、分类和治疗痴呆和相关精神障碍的普遍接受的标准。
[0212]
在本发明的方法中,将受试者组本身根据可能的疾病进展的基线指标进行分层。这进而可以根据疾病的严重程度进行评估。
[0213]
优选地,在ad中,使用所谓的临床痴呆评定(cdr)量表评估疾病的严重程度(hughes,c.p.,berg,l.,danziger,w.l.,coben,l.a.,martin,r.l.(1982)a new clinical scale for the staging of dementia.british journal of psychiatry,140:566-572;morris,j.c.(1993)the clinical dementia rating(cdr):current version and scoring rules.neurology,43:2412-2414)。
[0214]
cdr可以任选地通过结构化临床检查(例如简短版本的camdex)通知(roth,m.,tym,e.,mountjoy,c.q.,huppert,f.a.,hendrie,h.,verma,s.&goddard,r.(1986)camdex.a standardised instrument for the diagnosis of mental disorder in the elderly with special reference to the early detection of dementia.british journal of psychiatry,149:698-709)。可替代地,可以通过如由hughes等人(1982)或morris(1993)定义的结构化精神病面谈通知。
[0215]
例如,亚组可以由具有1(轻度亚组)或2(中度亚组)cdr评定的受试者形成。
[0216]
还可以例如使用wo 02/075318中描述的“braak分级”方法评估疾病的严重程度。然后可以从具有高达1、2、3和4级等的braak分级的受试者形成亚组。
[0217]
如上所述,与他们先前对某些对症治疗的暴露相关而另外地主动选择受试者组。
[0218]
通常将平行地测试所述亚组。
[0219]
治疗时间范围
[0220]
可以根据亚组的疾病的严重程度选择与ad或mci相关的治疗时间范围。根据本发明的临床试验的典型的时间范围可以是多于或等于12周、16周、24周、25周、36周、50周、100周(或多于或等于3个月、4月、6个月、9个月、12个月、24个月等)。根据如此选择的时间范围,本发明提供了使用新量度或分析得出更准确的药物功效量度。
cognitive responses to rivastigmine treatment in alzheimer's disease.neuroreport;13:83-87)的用途通常是本领域熟知的。
[0235]
基于磁共振的结构成像是对患有疑似阿尔茨海默痴呆的患者进行临床评估的一个组成部分。内侧颞叶结构的萎缩被认为是处于轻度认知损害阶段的有效诊断标志。此外,全脑和海马体萎缩率是神经变性的灵敏标志(frisoni等人,2010,nature reviews neurology 6:67-77)。相反,使用磁共振成像检测到的脑室扩大也可用于度量阿尔茨海默病的进展(nestor等人,2008,brain 131:2443-2454)。
[0236]
应当理解,除了这些技术之外,可以采用允许直接测量脑中的病理负荷的任何其他适用的方法。
[0237]
比较剂组
[0238]
在亚组随机分组后,将选择每个亚组中的一些受试者进行比较剂治疗。优选地,这将是试验的安慰剂(非治疗)或最小功效比较剂组。然而,在停止已经存在的治疗是不合伦理的情况下,可替代的设计涉及随机化到接受可替代的活性物治疗组(单一地或以预定组合的形式)中。
[0239]
最终功效量度
[0240]
通常,这最终将基于心理测量结局,基于用于比较相关治疗组和安慰剂组的适当统计学方法。这可以任选地是ancova或如果需要实现更多能力则为线性混合效应方法(petkova,e.和teresi,j.(2002)some statistical issues in the analysis of data from longitudinal studies of elderly chronic care populations.psychosomatic medicine,64:531-547),如以下实施例中所示。生理结局量度也可用于最终分析。鉴于本公开文本,本领域技术人员可以选择在这方面展现出功效的合适临床终点。
[0241]
具体而言,在随机接受某指定剂量的活性物治疗的受试者与接受比较剂治疗、剂量或安慰剂的受试者之间存在统计学显著差异的情况下,可以证明功效。
[0242]
本文所述的治疗性化合物(例如限定剂量的含有mt的化合物加上任选的其他成分)可以连同它们的治疗性或预防性用途(例如它们在如上所讨论的单一疗法或组合疗法中的用途)的说明书一起提供于带标签的包装中。
[0243]
在一个实施方案中,包装是瓶,如在制药领域中熟知的。典型的瓶可以由药典级hdpe(高密度聚乙烯)制成,其具有儿童防护的hdpe推锁封口并且含有硅胶干燥剂,所述硅胶干燥剂存在于小袋或罐中。所述瓶本身可以包括标签,并且包装在纸板容器中,其中具有根据所述方法使用的说明书和任选地所述标签的其他拷贝。
[0244]
在一个实施方案中,包装或小包是泡罩包装(优选地具有铝腔和铝箔),因此基本上不透水。在这种情况下,包装可以包装在纸板容器中,其中具有给我们的说明书以及在容器上的标签。
[0245]
所述标签或说明书可以提供关于如本文所述的组合物的最大允许日剂量-例如基于每日一次、每日两次或每日三次-的信息。
[0246]
所述标签或说明书可以提供关于建议的治疗持续时间的信息。
[0247]
盐和溶剂化物
[0248]
虽然本文所述的含有lmtx的化合物本身是盐,但它们也可以以混合盐的形式(即,本发明的化合物与另一种盐组合)提供。此类混合盐旨在涵盖在术语“及其药学上可接受的
盐”中。除非另有规定,否则对特定化合物的提及还包括其盐。
[0249]
本发明的化合物也可以以溶剂化物或水合物的形式提供。术语“溶剂化物”在本文中以常规含义使用,是指溶质(例如,化合物、化合物的盐)和溶剂的复合物。如果溶剂是水,则溶剂化物可以方便地称为水合物,例如,一水合物、二水合物、三-水合物、五水合物等。除非另有规定,否则对化合物的提及还包括其溶剂化物和任何水合物形式。
[0250]
当然,化合物的盐的溶剂化物或水合物也涵盖在本发明中。
[0251]
治疗和预防
[0252]
如本文所用,在治疗病症的上下文中的术语“治疗”通常涉及治疗和疗法,无论是对人还是动物(例如,在兽医应用中),其中实现了一些希望的治疗效果,例如病症进展的抑制,并且包括进展速率的降低、进展速率的停止、病症的消退、病症的改善和病症的治愈。
[0253]
本发明还涵盖作为预防措施的治疗。
[0254]
如本文所用,术语“治疗有效量”涉及本发明的化合物或者包含所述化合物的材料、组合物或剂型的这样的量,所述量当根据所希望的治疗方案施用时有效产生与合理的效益/风险比相称的一些所希望的治疗效果。所述治疗性化合物通常将以“治疗有效量”或“预防有效量”施用。
[0255]
如本文所用,术语“预防有效量”涉及本发明的化合物或者包含所述化合物的材料、组合物或剂型的这样的量,所述量当根据所希望的治疗方案施用时有效产生与合理的效益/风险比相称的一些所希望的预防效果。
[0256]
在本说明书的上下文中,“预防”不应被理解为限制完全成功,即完全保护或完全预防。相反,在本上下文中的预防是指在检测到症状病症之前施用的措施,其目的是通过帮助延迟、减轻或避免此特定病症而保持健康。
[0257]
本文引用了许多专利和出版物,以便更全面地描述和公开本发明以及本发明所属领域的现状。在本文中这些参考文献中的每一篇都通过引用以其整体并入本公开文本,其程度如同每篇单独的参考文献被具体和单独地指示通过引用并入。
[0258]
贯穿本说明书及其后的权利要求,除非上下文另有要求,否则词语“包含(包括)(comprise)”以及变型如“包含(包括)(comprises)”或“包含(包括)(comprising)”应当被理解为是指包含一个提及的整体或步骤或者多个整体或步骤的组,但不排除任何其他整体或步骤或者多个整体或步骤的组。
[0259]
必须指出,如在说明书和所附权利要求中所用,单数形式“一个/一种(a/an)”和“所述(the)”包括复数指示物,除非上下文另外清楚地规定。因此,例如,对“一种药物载体”的提及包括两种或更多种这此类载体的混合物等。
[0260]
范围在本文中通常表达为从“约”一个特定值和/或至“约”另一个特定值。当表达这样的范围时,另一个实施方案包括从一个特定值和/或至另一个特定值。类似地,当通过使用先行词“约”将值表达为近似值时,将理解所述特定值形成另一个实施方案。
[0261]
本文中的任何子标题仅出于便利而被包括,并且不应被解释为以任何方式限制本公开文本。
[0262]
现在将参考以下非限制性附图和实施例进一步描述本发明。本领域技术人员根据这些内容将会想到本发明的其他实施方案。
[0263]
本文引用的所有参考文献的公开文本,因为本领域技术人员可以使用它们来实施
本发明,因此通过交叉引用特此具体地并入本文。
附图说明
[0264]
图1.在采用8mg/天剂量的lmtm并且按与ad标记治疗的联合药疗状态进行分类的患有轻度至中度ad的患者中在65周内在adas-cog量表上的药代动力学-药效学反应。
[0265]
图2.在野生型小鼠中仅lmtm或在用利凡斯的明慢性预治疗后的lmtm对乙酰胆碱的海马体水平(a)或免疫组织化学测量为海马体、视皮层、斜角带和隔膜的均值的突触小泡蛋白水平(b)的治疗效果。(**,p《0.01;***,p《0.001)。
[0266]
图3.在τ蛋白转基因l1小鼠中仅lmtm或用利凡斯的明慢性预治疗后的lmtm对免疫组织化学测量为海马体、视皮层、斜角带和隔膜的平均值的(a)snare复合蛋白(snap25、突触融合蛋白和vamp2)水平和(b)α-突触核蛋白水平的治疗效果。(*,p《0.05;***,p《0.001;****,p《0.0001)。
[0267]
图4.在τ蛋白转基因l1小鼠中,仅lmtm或在用利凡斯的明慢性预治疗后的lmtm对相对于脑线粒体中的柠檬酸合成酶活性测量的复合物iv活性的治疗效果。(*,p《0.05)。
[0268]
图5.与媒介物治疗的野生型小鼠相比,在τ蛋白转基因l1小鼠中,仅lmtm或在用利凡斯的明慢性预治疗后的lmtm对斜角带垂直部中τ蛋白免疫反应性水平(相对光密度)(a)和对于胆碱乙酰转移酶有免疫反应性的神经元(b)的治疗效果。(*,p《0.05;**,p《0.01;***,p《0.001)。
[0269]
图6.lmt的治疗效果的总结图解,其中通过用乙酰胆碱酯酶抑制剂(achei)利凡斯的明(特别关注线粒体代谢和突触前蛋白的变化)和τ蛋白聚集抑制剂活性的慢性预治疗使所述治疗效果经受动态调节。与achei组合治疗不会损害lmt对τ蛋白聚集病理的影响。相比之下,所述组合防止了在仅用lmtm治疗后会出现的突触蛋白增加、ach释放和复合物iv活性增加。
[0270]
图7.在研究开始时在5.5月龄的雌性1系小鼠中,美金刚和lmtm组合施用对问题解决缺陷的影响。将美金刚以20mg/kg施用,以及将lmtm以15mg/kg施用。在美金刚加lmtm治疗6周之前,将小鼠用媒介物或美金刚治疗5周,其中将小鼠在第10周和第11周内在水迷宫任务中进行测试。
[0271]
图8.在18个月的lmtm 8mg/天单一疗法后停药(adas-cog)。如可以在高暴露(cmax)组中的受试者中观察到的,在lmtm停药后继续以相同的速率衰退(变化=0.73;p值=0.1651)。这支持了lmtx治疗期后在认知衰退速率方面的持续疾病调节性变化。
[0272]
暴露于较低暴露量的受试者出现大幅衰退(变化=2.29;p值=0.0011),这意味着在该组中的lmtx益处可能至少部分是对症的,并且因此不是持久的。
[0273]
图9.在18个月的作为现有对症疗法(achei,美金刚)的“附加物”的lmtm 8mg/天后停药(adas-cog)。如可以在高暴露(cmax)组中的受试者中观察到的,在lmtm停药后显示改善(变化=-0.98;p值=0.0021)。这与lmtm治疗(导致对仅对症治疗的改善的反应)期间的疾病调节效果一致,或者与在lmtx治疗期期间由lmtm展现的对对症治疗的负面影响一致。
[0274]
暴露于较低暴露量的受试者在停药后继续以相同的速率衰退(变化=0.51;p值=0.0855)。
实施例
[0275]
实施例1-提供含有mt的化合物
[0276]
用于化学合成本文描述的含有mt的化合物的方法是本领域已知的。例如:
[0277]
化合物1至7的合成可以根据wo2012/107706中描述的方法或类似于那些的方法进行。
[0278]
化合物8的合成可以根据wo2007/110627中描述的方法或类似于那些的方法进行。
[0279]
实施例2-在τ蛋白转基因小鼠模型中lmtm与对症治疗之间的干扰的研究
[0280]
图1展示了在lmtm与对症治疗组合后建立的干扰。
[0281]
我们已经在充分表征的τ蛋白转基因小鼠模型(1系,“l1”;(melis等人,2015b))中进行了工作,目的是了解负责lmtm作为对症治疗的附加物的功效降低的机制。
[0282]
总之,我们的发现表明,稳态机制在不同水平的脑功能下使多个神经元系统下调,以补偿通过对症治疗诱导的慢性药理活化。
[0283]
与仅给予lmtm相比,如果针对慢性的先前暴露于乙酰胆碱酯酶抑制剂的背景给予lmtm,则此下调的效果是减少神经递质释放、降低突触蛋白的水平、降低线粒体功能和减少行为益处。因此,首先在临床上看到的治疗功效的干扰具有可以在τ蛋白转基因小鼠模型中重现的明确的神经药理学基础。
[0284]
重要的是,我们已经确认的稳态效应可能与在ad或mci中进行的疾病调节试验或实际上其他类型的治疗性化合物试验(不需限于τ蛋白聚集抑制剂)具有更普遍的相关性。
[0285]
在一些本发明的研究中使用的l1小鼠模型中,在nmri小鼠品系中存在在thy 1启动子的控制下的涵盖2n4rτ蛋白同种型的残基296-390的三重复τ蛋白片段的过表达(wo2002/059150)。此片段对应于在phf的蛋白水解稳定核心内首先鉴定的τ蛋白区段(wischik等人,1988a;wischik等人,1988b),并且涵盖最近通过对在ad中的phf和匹克病中的τ蛋白细丝的低温电子显微镜确认的片段306-378(fitzpatrick等人,2017;falcon等人,2018)。
[0286]
l1小鼠模型的另外的特征包括在基础前脑区域中胆碱乙酰转移酶的神经元免疫反应性的突出损失,以及在新皮质和海马体中乙酰胆碱酯酶的相应减少,指示乙酰胆碱减少。与来自野生型小鼠的脑突触小体制备物的谷氨酸释放相比,来自l1小鼠的脑突触小体制备物的谷氨酸释放减少大约50%。因此,在这些方面,l1小鼠还模拟了作为ad特征的胆碱能(mesulam,2013;pepeu and grazia giovannini,2017)和谷氨酸能(revett等人,2013)功能方面的神经化学损害。
[0287]
鉴于在神经递质功能方面的这些损害,l1小鼠模型示出了在突触蛋白的整合中的扰动。在野生型小鼠中对于基础前脑(斜角带垂直部)中的多种突触蛋白的定量免疫组织化学显示,包含snare复合物(例如snap-25、突触融合蛋白、vamp2;综述于li和kavalali,2017中)的蛋白质与囊泡糖蛋白突触小泡蛋白和α-突触核蛋白水平通常存在高度的相关性。这些相关性在l1小鼠中在很大程度上丧失(表1)。剩余的唯一相关性是在突触小泡蛋白、突触融合蛋白与vamp2之间。因此,突触囊泡蛋白水平不再与snare复合物的蛋白质或α-突触核蛋白定量相关。这表明l1小鼠的τ蛋白寡聚物病理干扰了突触中的囊泡与膜停靠蛋白之间的功能整合。
[0288]
表1.在(a)野生型小鼠或(b)τ蛋白转基因l1小鼠中免疫化学测量的在基础前脑
(斜角带垂直部)中的一系列突触前蛋白水平之间的相关性。通过线性回归分析的相关性的显著性表示为*p《0.05;**p《0.01;-在p=0.05时无显著性。
[0289][0290]
实施例3-实验范式、结果和讨论
[0291]
实验范式
[0292]
将用于研究对症治疗与lmtm之间的负相互作用的治疗时间表设计为模拟这样一种临床情况,其中受试者在接受lmtm之前首先用胆碱酯酶抑制剂或美金刚进行了慢性治疗。在下文中,我们总结了针对achei利凡斯的明获得的一些关键结果。
[0293]
将野生型小鼠和l1小鼠(每组n=7-16)通过灌饲用利凡斯的明(0.1或0.5mg/kg/天)或美金刚(2或20mg/kg/天)或媒介物预治疗5周。对于接下来的6周,将lmtm(5和15mg/kg)或媒介物也通过灌饲添加到这种每日治疗方案中。在第10周和第11周期间使用在旷场水迷宫的问题解决任务测试动物行为,并且然后处死用于免疫组织化学分析和其他组织分析。
[0294]
将剂量从小鼠转换为人需要考虑许多因素。虽然在血浆中的亲本mt的c
max
水平方面,在小鼠中5mg/kg/天对应于在人中大约8mg/天,但是此剂量是对病理和行为的效果的阈值。在l1小鼠模型中完全有效的lmtm通常需要15mg/kg/天的较高剂量(melis等人,2015a)。与人(在老年人中37小时)相比,这可能与在小鼠(4小时)中mt的更短的半衰期相关。将用于免疫组织化学的组织切片用抗体标记并且使用图像j处理以用光密度测定法确定蛋白质表达。将数据作为无单位的z得分转换呈现。
[0295]
为了测量海马体中的乙酰胆碱(ach)水平,在将动物(野生型或l1)用或不用利凡斯的明(0.5mg/kg/天)进行先前的治疗2周后,将所述动物用lmtm(5mg/kg/天持续2周)治
疗。将利凡斯的明用alzet微型泵皮下施用,而将lmtm通过口服灌饲施用。在海马体中使用植入的微透析探针和细胞外液的hplc分析测量ach的水平。
[0296]
将数据作为组平均值和均值的标准误差呈现,并且使用参数统计来分析,其中α设置为0.05。
[0297]
根据作为英国科学程序法(uk scientific procedures act,1986)下有项目许可证的当地伦理批准的欧洲共同体理事会(european communities council)指令(63/2010/eu),并且根据德国动物保护法(tierschutzgesetz)和波兰动物保护法进行动物实验。
[0298]
结果
[0299]
在野生型小鼠中用lmtm和利凡斯的明治疗的效果
[0300]
仅用lmtm治疗的效果或在慢性利凡斯的明背景中用lmtm治疗的效果总结于表2中。
[0301]
在野生型小鼠中,lmtm治疗后在海马体中的基础ach水平显著增加到2倍,并且当将小鼠用利凡斯的明进行先前的治疗后,所述小鼠接受lmtm时所述水平具有30%减少(图2a)。
[0302]
在仅用lmtm治疗后,在海马体、视皮层、斜角带和隔膜中测量的突触小泡蛋白水平也增加到3倍,并且当在用利凡斯的明的先前治疗的背景下给予lmtm时具有相同幅度的统计学显著降低(图2b)。
[0303]
表2.在野生型小鼠中仅给予lmtm(5或15mg/kg/天)或在用利凡斯的明(0.1或0.5mg/kg/天)慢性预治疗后给予lmtm的治疗效果的总结以近似大约的百分比给出以指示量表和变化方向。黑色表示的数字表示达到统计学显著性的治疗效果,
“‑”
指示无效。
[0304][0305]
在τ蛋白转基因l1小鼠中用lmtm和利凡斯的明治疗的效果
[0306]
与野生型小鼠相比,仅lmtm的激活效果和与利凡斯的明组合的抑制效果在τ蛋白转基因l1小鼠中更大并且更广泛(参见表3)。仅lmtm导致在海马体中的ach释放、从脑突触体制备物中的谷氨酸释放、突触小泡蛋白水平、线粒体复合体iv活性和行为变化方面的显著增加。当lmtm之前是慢性利凡斯的明时,没有观察到这些影响。事实上,在snare复合蛋白(图3a)和突触核蛋白(图3b)的情况下,通过所述组合导致的减少达到低于在不存在lmtm治疗的情况下所见的水平。
[0307]
表3.在l1小鼠中仅给予lmtm(5或15mg/kg/天)或在用利凡斯的明(0.1或0.5mg/kg/天)慢性预治疗后给予lmtm的治疗效果的总结以近似大约的百分比给出以指示量表和
变化方向。黑色数字表示达到统计显著性的治疗效果,灰色数字是方向性的,以及n/a表示结果尚不可用。
[0308][0309][0310]
在来自τ蛋白转基因l1小鼠的脑线粒体中,仅给予lmtm导致显著增强的复合物iv活性。用利凡斯的明的慢性预治疗也消除了这种影响(图4)。
[0311]
与对神经递质释放、突触蛋白水平和线粒体复合物iv活性的影响相比,用利凡斯的明慢性预治疗对lmtm作为τ蛋白聚集抑制剂的主要作用没有影响。如所预期的,通过光密度测量的针对phf的核心τ单元的免疫反应性在τ蛋白转基因l1小鼠中升高,并且在用lmtm治疗后降低(图5a)。相反,在l1小鼠中chat阳性神经元计数减少,并且通过用lmtm治疗恢复(图5b)。如果在用利凡斯的明慢性治疗后给予lmtm,这两种效应在l1小鼠中持续存在。
[0312]
实施例3的讨论
[0313]
这里呈现的结果表明,在人中当lmtm作为对症治疗的附加物给予时,所述lmtm功效的降低可以在野生型小鼠模型和τ蛋白转基因小鼠模型二者中再现。因此,它基于神经药理学机制,所述机制具有改变脑对疾病调节性治疗(如lmtm)如何反应的作用。结果暗示,lmtm作为单一疗法或附加疗法的临床反应的差异可能由这两种情况下lmtm的潜在的神经药理学差异解释(gauthier等人,2016;wilcock等人,2018)。基于以下假设的可替代解释:接受对症治疗的患者与出于多种原因未接受治疗的患者在某种程度上有所不同。在这两个患者组之间基线严重程度的微小和可变差异已显示不能解释治疗反应的差异(gauthier等人,2016;wilcock等人,2018)。当在分析中考虑到基线的严重程度时,adni计划(schneider等人,2011)中接受治疗的和未接受治疗的mci患者中衰退速率的明显差异消失(wilcock等人,2018)。未治疗的患者并未真正患有ad或患有不同形式的ad的假设也与参与3期试验的受试者的基线神经影像学数据不一致(wilcock等人,2018)。最后,如图1中对认知衰退数据的总结,我们最近表明,在单一疗法和附加疗法的受试者中存在相似的浓度-反应关系,但是单一疗法对所有临床和神经影像学结局的治疗影响始终较大。
[0314]
我们现在报告的结果表明,在野生型小鼠和τ蛋白转基因小鼠中,通过lmtm治疗产生了两种类型的效果:受通过先前暴露于胆碱酯酶抑制剂的动态调节影响的那些,和不受先前暴露影响的那些。在τ蛋白转基因小鼠中,可以调节的治疗效果包括在海马体中的ach释放的增加、突触蛋白的变化、线粒体复合物iv活性的增加和行为损害的逆转。不受药理调节影响的治疗效果仅是对τ蛋白聚集病理的主要影响及其对神经元功能的即时影响,如例
如通过在基础前脑中的胆碱乙酰转移酶表达的恢复测量的。
[0315]
在图6中总结了两类lmtm治疗效果。
[0316]
受药理调节影响的效果本身具有两种类型:通过对τ蛋白聚集病理的效果而增强的那些,和在野生型小鼠中也观察到的那些。在我们所测量的结果中,在野生型小鼠中仅给予lmtm的正向治疗效果包括海马体中ach水平的增加,以及在多个脑区中的突触小泡蛋白水平的增加。因此,在缺乏τ蛋白聚集病理的野生型小鼠中lmtm治疗能够以治疗相关剂量激活神经元功能。
[0317]
突触小泡蛋白的增加表示突触囊泡的数量或大小的增加,所述突触囊泡是经由动作电位激活后从突触前释放神经递质所需要的。因此,突触小泡蛋白水平的增加显现与支持认知和其他精神功能所需的许多神经递质的增加相关。
[0318]
虽然据报道,mt部分是弱胆碱酯酶抑制剂(pfaffendorf等人,1997;deiana等人,2009),但是这不太可能是负责ach水平增加的机制。
[0319]
具体地,使用东莨菪碱(scopolamine)增加ach水平(通过阻断m2/m4负反馈受体)的另外的实验表明,通过lmtm产生的增加小于仅用利凡斯的明观察到的增加,并且表明所述组合在野生型小鼠中又是抑制性的。在这些实验中使用的胆碱酯酶抑制的条件下(非常少量的胆碱酯酶抑制剂,100纳摩尔利凡斯的明,添加到灌注液中),在海马体中ach水平升高,并且当它们足够强烈上升时,它们通过激活m2/m4亚型的突触前毒蕈碱型受体(所谓的负反馈受体)限制了另外的ach释放。
[0320]
在这种情况下,向灌注流体中添加东莨菪碱(1μm)阻断了这些突触前受体,并且结果是ach水平升高3-5倍。在这些实验中lmtm不与另外的利凡斯的明累加的事实支持lmtm与利凡斯的明具有不同的作用机制的结论。换句话说,尽管lmtm已经被描述为在高浓度下为胆碱酯酶的弱抑制剂,但是目前的效果似乎与胆碱酯酶抑制不相关,因为与少量利凡斯的明没有累加效应。
[0321]
理论上,可能会通过突触前线粒体活性的增加来解释ach和突触小泡蛋白水平的增加,因为已知mt部分增强了线粒体复合物iv活性(atamna等人,2012),并且线粒体在突触前功能的稳态调节中具有重要作用(devine和kittler,2018)。特别地,mt部分被认为通过充当复合物i与复合物iv之间的电子穿梭来增强氧化磷酸化(atamna等人,2012)。mt部分的氧化还原电位是大约0mv,在复合物i(-0.4mv)与复合物iv(+0.4mv)之间的氧化还原电位的中间。
[0322]
然而,在lmtm治疗后,在野生型小鼠中的复合物iv活性的直接测量没有显示出任何增加。在野生型小鼠中lmtm的激活效果也与空间识别记忆的改善不相关。
[0323]
在野生型小鼠的脑中,用利凡斯的明的慢性预治疗抑制了海马体中的胆碱能激活,并且更普遍降低了突触小泡蛋白水平。这种效果显然不依赖于lmtm对τ蛋白聚集病理的影响,因为在野生型小鼠中没有病理。相反,它们指向广泛的稳态下调,抵消了合并各自具有激活效果的两种药物对神经元功能的效果。据推测,避免在突触间隙中ach的水平过量的主要机制将是ache活性增加。由于利凡斯的明对这种控制系统产生慢性损害,因此以其他方式通过lmtm激活的途径受到抑制以便保护胆碱能和其他神经元系统中的稳态。因此,如果脑已经通过胆碱酯酶抑制剂而经受慢性刺激,则lmtm诱导的作用经受动态下调。
[0324]
尽管定性相似,但是仅给予lmtm的效果在τ蛋白转基因l1小鼠中更为突出且范围
更广。对此最可能的解释是lmtm将对τ蛋白寡聚物的抑制作用与不依赖于τ蛋白的固有激活作用组合在一起。lmtm治疗后τ蛋白寡聚物水平的降低促进了更显著的突触功能激活和神经递质(如ach和谷氨酸)释放。同样,lmtm逆转了在τ蛋白转基因l1小鼠中观察到的空间记忆缺陷(melis等人,2015a)。当在慢性利凡斯的明的背景上引入lmtm时看到的负面影响显现只是反映了仅lmtm时观察到的激活的逆转。
[0325]
τ蛋白寡聚物对突触蛋白的功能发挥的有害影响很容易理解为是直接干扰突触囊泡的停靠、膜融合和神经递质释放的结果。在τ蛋白转基因l1小鼠中,突触囊泡蛋白水平不再与snare复合物的蛋白质或α-突触核蛋白定量相关,这意味着在突触处的囊泡蛋白与膜停靠蛋白之间的功能整合的丧失。这一后果可以直接被视为谷氨酸从来自τ蛋白转基因小鼠的突触体制备物中释放受损,并且在用lmtm治疗后恢复正常的谷氨酸释放。
[0326]
负责lmtm的线粒体效应的机制更为复杂。mt部分被认为通过充当复合物i与复合物iv之间的电子穿梭物来增强氧化磷酸化(atamna等人,2012)。mt部分的氧化还原电位是大约0mv,在复合物i(-0.4mv)与复合物iv(+0.4mv)之间的氧化还原电位的中间。然而,在从野生型小鼠分离的脑线粒体中,lmtm对复合物iv活性没有影响。相比之下,在τ蛋白转基因l1小鼠中观察到了强烈的影响。这表明τ蛋白寡聚物干扰了线粒体代谢。最近已经表明,c末端截短型τ蛋白既与线粒体外膜结合,又进入线粒体的膜间隙(cieri等人,2018)。从ad患者脑组织中分离的截短型phf-τ蛋白与以下形成抗sds复合物:线粒体外膜中的电压依赖性阴离子选择性通道蛋白(vdac;以前称为孔蛋白),以及还有在膜间隙中的atp合酶亚基9和复合物iii的核心蛋白2(wischik等人,1997)。这些结合相互作用可能对线粒体中电子传递链的功能发挥有害,并且lmtm在减少线粒体内和周围τ蛋白寡聚物积累方面的作用可促成在l1小鼠中观察到的复合物iv的激活。
[0327]
目前尚不清楚利凡斯的明治疗导致的稳态下调可能如何影响线粒体功能。已知线粒体经由ca
2+
水平缓冲和atp生成充当突触功能的重要稳态调节因子(devine和kittler,2018)。
[0328]
引人注目的是,在多个脑功能水平下在不同的递质系统和细胞区室中可以观察到lmtm的正面效果,以及通过抗胆碱酯酶的预治疗对所述效果的逆转或抑制。这暗示了没有负责lmtm治疗反应的干扰的单个位点。而是负面相互作用显现是多个神经元系统中的广义稳态下调的一部分,其补偿由乙酰胆碱酯酶的阻断造成的慢性药理学活化。
[0329]
图7中示出了用美金刚的结果,并且示出了与用抗胆碱酯酶的预治疗类似的图。这是如预期的,因为对于两种药物类别,临床上观察到的lmtm功效的干扰非常相似。
[0330]
更一般地说,影响lmtm治疗的干扰对lmtm具有特异性是不太可能的。任何对突触功能具有激活影响的治疗(无论是通过减少初级病理还是通过另一种机制)都可能经受类似的干扰,因为它主要通过预先存在的对症治疗驱动。
[0331]
因此,如果淀粉样蛋白聚集体的清除导致突触激活,如marsh,j,alifragis,p(2018)已经提出的,则可以推断出对症治疗将也会干扰临床上展现这一效果的能力。
[0332]
进一步的考虑是,如果lmtm治疗是主要的并且在较晚的时间添加对症治疗,我们已经证明的稳态下调是否以相同的方式运作。我们迄今为止进行的实验最初是为了模拟这样一种临床情况,其中在已经接受对症治疗的患者中添加lmtm。如果通过首先出现的治疗来确定稳态下调,则合理的是尽管可以在一定程度上减少附加的对症治疗的反应,但是
disease(ad)neuropathology using anti-microrna(am)strategies.molecular neurobiology.https://doi.org/10.1007/s12035-019-1632-0.
[0349]
kazim,sf,iqbal,k.2017.chapter 2-neural regeneration as a disease-modifying therapeutic strategy for alzheimer’s disease.in neuroprotection in alzheimer's disease[ed.gozes,i.].pp.3-29academic press
[0350]
panza,f,lozupone,m,logroscino,g,imbimbo,bp(2019)a critical appraisal of amyloid-β-targeting therapies for alzheimer disease.nat rev neurol 15:73-88
[0351]
ustyugov,a,shevtsova,e,ashraf,gm,tarasov,vv,bachurin,so,aliev,g(2018)new therapeutic property of dimebon as a neuroprotective agent.current medicinal chemistry 25:5315-5326
[0352]
al-hilaly,y.k.,pollack,s.j.,rickard,j.e.,simpson,m.,raulin,a.-c.,baddeley,t.,et al.(2018).cysteine-independent inhibition of alzheimer's disease-like paired helical filament assembly by leuco-methylthioninium(lmt).j.mol.biol.430,4119-4131.doi:10.1016/j.jmb.2018.08.010.
[0353]
atamna,h.,mackey,j.,and dhahbi,j.m.(2012).mitochondrial pharmacology:electron transport chain bypass as strategies to treat mitochondrial dysfunction.biofactors 38,158-166.doi:10.1002/biof.197.
[0354]
baddeley,t.c.,mccaffrey,j.,storey,j.m.d.,cheung,j.k.s.,melis,v.,horsley,d.,et al.(2015).complex disposition of methylthioninium redox forms determines efficacy in tau aggregation inhibitor therapy for alzheimer’s disease.j.pharmacol.exptl.therapeutics 352,110-118.doi:10.1124/jpet.114.219352.
[0355]
callaway,n.l.,riha,p.d.,bruchey,a.k.,munshi,z.,and gonzalez-lima,f.(2004).methylene blue improves brain oxidative metabolism and memory retention in rats.pharmacol.biochem.behav.77,175-181.
[0356]
callaway,n.l.,riha,p.d.,wrubel,k.m.,mccollum,d.,and gonzalez-lima,f.(2002).methylene blue restores spatial memory retention impaired by an inhibitor of cytochrome oxidase in rats.neurosci.lett.332,83-86.
[0357]
deiana,s.,harrington,c.r.,wischik,c.m.,and riedel,g.(2009).methylthioninium chloride reverses cognitive deficits induced by scopolamine:comparison with rivastigmine.psychopharmacology 202,53-65.doi:10.1007/s00213-008-1394-2.
[0358]
devine,m.j.,and kittler,j.t.(2018).mitochondria at the neuronal presynapse in health and disease.nat.rev.neurosci.19,63-80.doi:10.1038/nrn.2017.170.
[0359]
fitzpatrick,a.w.p.,falcon,b.,he,s.,murzin,a.g.,murshudov,g.,garringer,h.j.,et al.(2017).cryo-em structures of tau filaments from alzheimer’s disease.nature 547,185-190.doi:10.1038/nature23002.
[0360]
gauthier,s.,feldman,h.h.,schneider,l.s.,wilcock,g.k.,frisoni,g.b.,
hardlund,j.h.,et al.(2016).efficacy and safety of tau-aggregation inhibitor therapy in patients with mild or moderate alzheimer's disease:a randomised,controlled,double-blind,parallel-arm,phase 3 trial.lancet 388,2873-2884.doi:10.1016/s0140-6736(16)31275-2.
[0361]
gonzalez-lima,f.,and bruchey,a.k.(2004).extinction memory by the metabolic enhancer improvement methylene blue.learning&memory 11,633-640.
[0362]
harrington,c.r.,storey,j.m.d.,clunas,s.,harrington,k.a.,horsley,d.,ishaq,a.,et al.(2015).cellular models of aggregation-dependent template-directed proteolysis to characterize tau aggregation inhibitors for treatment of alzheimer's disease.j.biol.chem.290,10862-10875.doi:10.1074/jbc.m114.616029.
[0363]
husain,m.,and mehta,m.a.(2011)cognitive enhancement by drugs in health and disease.trends cognitive sci.15,28-36.
[0364]
li,y.and kavalali,e.t.(2017).synaptic vesicle-recycling machinery components as potential therapeutic targets.pharmacol.rev.69,141-160.
[0365]
maier,l.j.,ferris,j.a.,and winstock,a.r.(2018).pharmacological cognitive enhancement among non-adhd individuals—a cross-sectional study in 15 countries."int.j.drug policy 58,104-112.
[0366]
martinez,j.l.,jr.,jensen,r.a.,vasquez,b.j.,mcguiness,t.,and mcgaugh,j.l.(1978).methylene blue alters retention of inhibitory avoidance responses.physiological psychology 6,387-390.
[0367]
marsh,j,alifragis,p(2018)synaptic dysfunction in alzheimer's disease:the effects of amyloid beta on synaptic vesicle dynamics as a novel target for therapeutic intervention.neural regen.res.13:616-623.
[0368]
melis,v.,magbagbeolu,m.,rickard,j.e.,horsley,d.,davidson,k.,harrington,k.a.,et al.(2015a).effects of oxidized and reduced forms of methylthioninium in two transgenic mouse tauopathy models.behav.pharmacol.26,353-368.doi:10.1097/fbp.0000000000000133.
[0369]
melis,v.,zabke,c.,stamer,k.,magbagbeolu,m.,schwab,k.,marschall,p.,et al.(2015b).different pathways of molecular pathophysiology underlie cognitive and motor tauopathy phenotypes in transgenic models for alzheimer's disease and frontotemporal lobar degeneration.cell.mol.life sci.72,2199-2222.doi:10.1007/s00018-014-1804-z.
[0370]
mesulam,m.m.(2013).cholinergic circuitry of the human nucleus basalis and its fate in alzheimer's disease.j.comp.neurol.521,4124-4144.doi:10.1002/cne.23415.
[0371]
pepeu,g.,and grazia giovannini,m.(2017).the fate of the brain cholinergic neurons in neurodegenerative diseases.brain res.1670,173-184.doi:10.1016/j.brainres.2017.06.023.
[0372]
pfaffendorf,m.,bruning,t.a.,batink,h.d.,and van zwieten,p.a.(1997).the interaction between methylene blue and the cholinergic system.br.j.pharmacol.122,95-98.doi:10.1038/sj.bjp.0701355.
[0373]
revett,t.j.,baker,g.b.,jhamandas,j.,and kar,s.(2013).glutamate system,amyloid beta peptides and tau protein:functional interrelationships and relevance to alzheimer disease pathology.j.psychiat.neurosci.38,6-23.doi:10.1503/jpn.110190.
[0374]
riha,p.d.,bruchey,a.k.,echevarria,d.j.,and gonzalez-lima,f.(2005).memory facilitation by methylene blue:dose-dependent effect on behavior and brain oxygen consumption.eur.j.pharmacol.511,151-158.
[0375]
wilcock,g.k.,gauthier,s.,frisoni,g.b.,jia,j.,hardlund,j.h.,moebius,h.j.,et al.(2018).potential of low dose leuco-methylthioninium bis(hydromethanesulphonate)(lmtm)monotherapy for treatment of mild alzheimer’s disease:cohort analysis as modified primary outcome in a phase 3 clinical trial.j.alzheimer's dis.61,635-657.doi:10.3233/jad-170560.
[0376]
wischik,c.m.,edwards,p.c.,lai,r.y.k.,roth,m.,and harrington,c.r.(1996).selective inhibition of alzheimer disease-like tau aggregation by phenothiazines.proc.natl.acad.sci.u.s.a.93,11213-11218.doi:10.1073/pnas.93.20.11213.
[0377]
wischik,c.m.,novak,m.,edwards,p.c.,klug,a.,tichelaar,w.,and crowther,r.a.(1988a).structural characterization of the core of the paired helical filament of alzheimer disease.proc.natl.acad.sci.u.s.a.85,4884-4888.doi:10.1073/pnas.85.13.4884.
[0378]
wischik,c.m.,novak,m.,h.c.,edwards,p.c.,runswick,m.j.,jakes,r.,et al.(1988b).isolation of a fragment of tau derived from the core of the paired helical filament of alzheimer disease.proc.natl.acad.sci.u.s.a.85,4506-4510.doi:10.1073/pnas.85.12.4506.
[0379]
wischik,c.m.,schelter,b.o.,wischik,d.j.,storey,j.m.d.,and harrington,c.r.(2018).modeling prion-like processing of tau protein in alzheimer’s disease for pharmaceutical development.j.alzheimer's dis.62,1287-1303.doi:10.3233/jad-170727.
[0380]
wrubel,k.m.,barrett,d.,shumake,j.,johnson,s.e.,and gonzalez-lima,f.(2007).methylene blue facilitates the extinction of fear in an animal model of susceptibility to learned helplessness.neurobiol.learning memory 87,209-217.
[0381]
zoellner,l.a.,telch,m.,foa,e.b.,farach,f.j.,mclean,c.p.,gallop,r.,et al.(2017).enhancing extinction learning in posttraumatic stress disorder wwith brief daily imaginal exposure and methylene blue:a randomized controlled trial.j.clin.psychiat.78,e782-e789.doi:10.4088/jcp.16m10936.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1