用于活性成分控释的包含木葡聚糖和醇的凝胶形式的药物组合物的制作方法
用于活性成分控释的包含木葡聚糖和醇的凝胶形式的药物组合物
发明领域
1.本发明涉及包含药物活性成分的凝胶组合物。
2.该组合物包含浓度为组合物总重量0.1%-10.0%的木葡聚糖和浓度为组合物总重量5.0-50.0%的醇。
3.本发明还描述了制备组合物的方法和所述组合物在治疗其中活性成分的控释是有用的病理学中的用途。该组合物可以包含一种或多种药物或营养活性成分,并且可以通过非肠道、皮下、阴道、口含、口服、局部或直肠途径施用。该组合物可以通过使用适合的医疗装置施用。
4.本领域的状态
5.wo 2009/028764描述了用于释放蛋白质的凝胶,其得自在具有盐析特性的盐的存在下大分子与热可逆多糖的复合物。所得制剂在室温下为液体,注射时变成凝胶,蛋白质从凝胶中释放出来。
6.wo 1999/059549描述了基于包含治疗蛋白质和金属离子的藻酸酯的可注射水凝胶。
7.us 2002/0019336描述了包含粘多糖、例如硫酸软骨素或透明质酸软骨素的组合物,该组合物可用于蛋白质的释放,并且随着ph值的变化而形成凝胶。
8.miyazaki s.等人在j contr rel 56,75,1998中描述了从通过酶-部分降解的在水中或ph 7.2的磷酸盐缓冲液中浓度为1%-2%重量的木葡聚糖得到的热可逆凝胶中释放吲哚美辛。
9.kant a.等人在pharmacology在线2:28,2011中描述了凝胶的原位形成,其中凝胶的形成取决于温度、ph、离子和紫外线的存在,从而能够以受控方式释放活性成分。凝胶可以由合成或天然聚合物形成,并且可以通过口服、眼部、直肠、阴道或注射途径施用。该文献报道了当木葡聚糖在水溶液中被β-半乳糖苷酶部分降解时,得到的产物具有热可逆凝胶的性质,其中凝胶的形成通过从高温冷却而发生。这种现象在使用天然木葡聚糖时不会发生。
10.如ep 3173067中所述,原位凝胶可以包含用于将活性成分释放入粘膜的粘膜粘附聚合物。
11.ep 1898876描述了包含浓度为0.05%-5.0%重量的木葡聚糖的水溶液和浓度为10.0%-70.0%重量的甘油的粘膜粘附组合物,其中所述粘膜粘附组合物为溶液、阴道栓、凝胶、阴道灌洗液和喷雾剂。该专利没有描述原位凝胶的形成。
12.jp 6490134描述了凝胶组合物,其包含木葡聚糖和至少一种糖和/或醇的水溶液。所述组合物包含浓度为0.1%-15.0%重量的木葡聚糖,量为10.0%-50.0%重量的选自二元、三元、四元、五元和六元醇的醇,以及水溶性聚合物。所述的组合物是指用于美容化妆品和食品用途的凝胶组合物,其目的在于在其储存过程中维持得到的凝胶。
13.todaro s.等人chem.in eng.trans.2016;49:289-294描述了用高能辐射解聚的木葡聚糖的流变特性。解聚的木葡聚糖级分通过ft-ir和不同浓度乙醇存在下凝胶的形成
表征。
14.pasta s.等人在“i materialibiocompatibili per la medicina/biomaterials for medicine”2014(2014-01-01),universitasstudiorum,xp055676486,369-370页中描述了当天然或解聚的木葡聚糖与以4:1的相对比例混合时形成凝胶,并且认为这种凝胶可用于人体应用中的组织改造。
15.在制药领域,越来越需要找到能够随时间以受控方式释放活性成分的新药物组合物,例如将血浆浓度维持在有效水平,从而导致随时间施用次数减少。
16.鉴于此,本发明的目的在于凝胶形式的控释药物或营养组合物,其包含一种或多种活性成分。该凝胶直接在天然聚合物、木葡聚糖和醇的接触处形成。包含活性药物成分的药物凝胶组合物可以通过在使用前、原位或用于制备在室温储存或冷藏的药物产品时混合各组分得到。
17.发明概述
18.本发明涉及包含药物活性成分的凝胶形式的控释组合物。
19.该组合物包含木葡聚糖、伯醇和一种或多种活性成分。
20.本发明公开了凝胶形式的控释组合物,其包含一种或多种药物活性成分、木葡聚糖和伯醇,其中木葡聚糖的浓度为组合物总重量的0.1%-10.0%。该组合物包含伯醇,其选自2-(2-乙氧基乙氧基)乙醇乙醇、丙醇、丁醇、鲸蜡醇、硬脂醇和鲸蜡硬脂醇。
21.在一个目的中,伯醇为2-(2-乙氧基乙氧基)乙醇
22.本发明的组合物可以包含一种或多种药物活性成分,其选自抗炎剂、抗真菌剂、抗生素、模拟抗生素、生长因子、消毒剂、抗癌剂、蛋白质、肽、保湿剂、天然成分或它们的混合物。
23.在一个方面,该组合物包含量为组合物总重量0.1%-10.0%的木葡聚糖、5.0%-50.0%的2-(2-乙氧基乙氧基)乙醇,以及药物活性成分。该组合物用于以受控方式释放具有局部和/或全身作用的活性成分。
24.本发明还描述了获得组合物的方法,该方法包括制备纯化木葡聚糖的水溶液,浓度为0.1%-10.0%重量,以及伯醇溶液,浓度为5.0%-50.0%重量,其中活性成分可以包含在两种溶液中,取决于溶解度。
25.发明详述
26.本发明描述了凝胶形式的控释组合物,其中凝胶包含药物活性成分,其以受控和有效方式释放。
27.本发明的组合物是通过将木葡聚糖(xg)的水溶液与醇、例如伯醇混合而得到。包含药物活性成分的药物凝胶组合物可以通过在即将使用前、原位或用于制备在室温下储存或冷藏的药物产品时混合两种组分得到。
28.组合物中包含的活性药物成分可以根据其溶解度的不同包含在木葡聚糖的水溶液中或醇溶液中,没有任何限制。活性成分也可以原样储存或稀释在含或不含木葡聚糖的水溶液中,并且在施用时包含在凝胶中。
29.通过混合木葡聚糖和伯醇形成凝胶组合物,所述伯醇选自:2-(2-乙氧基乙氧基)
乙醇、乙醇、丙醇、丁醇、鲸蜡醇、硬脂醇和鲸蜡硬脂醇。
30.在优选的方面,描述了由包含药物活性成分的木葡聚糖和2-(2-乙氧基乙氧基)乙醇组成的凝胶组合物。
31.木葡聚糖是来源于罗望子种子的多糖,并且由(1-4)-β-d-葡聚糖链组成,其中(1-6)-α-d-木糖键部分被(1-2)-β-d-半乳木糖代替。木葡聚糖当被β-半乳糖苷酶部分降解时在水中形成热可逆凝胶,并且所得产物在稀释的水溶液中具有在可逆热条件下胶凝的性质。当半乳糖去除超过35%时,就有可能形成凝胶。此外,转变温度与聚合物浓度和半乳糖去除成反比。这样的行为使用天然木葡聚糖不会发生。木葡聚糖可以通过从植物中提取得到,所述植物例如豌豆植物、大豆、稻、竹子或罗望子种子。来源于罗望子种子的木葡聚糖具有约5,000-1,000,000da的分子量。聚合物优选通过用碱性溶液提取得到,然后通过沸水提取、离心和灭菌过滤进一步纯化。
32.本发明的组合物中包含的木葡聚糖是天然木葡聚糖,未被酶降解,根据ep 1898876中所述的纯化方法纯化,并且以组合物总重量0.1%-10.0%的浓度包含。
33.通过混合浓度为0.1%-10.0%重量的木葡聚糖的水溶液和浓度为组合物总重量5.0-50.0%的伯醇得到的凝胶组合物以受控方式释放活性成分,所述伯醇选自2-(2-乙氧基乙氧基)乙醇、乙醇、丙醇、丁醇、鲸蜡醇、硬脂醇和鲸蜡硬脂醇。
34.根据本发明,通过混合浓度为0.1%-10.0%重量的木葡聚糖的水溶液和浓度为组合物总重量20.0-50.0%的伯醇得到凝胶组合物,所述伯醇选自2-(2-乙氧基乙氧基)乙醇、乙醇、丙醇、丁醇、鲸蜡醇、硬脂醇和鲸蜡硬脂醇。
35.通过混合浓度为0.1%-10.0%重量的木葡聚糖的水溶液和浓度为组合物总重量5.0-50.0%的2-(2-乙氧基乙氧基)乙醇得到的凝胶组合物以受控方式释放活性成分。
36.组合物包含浓度为组合物总重量0.1%-10.0%的木葡聚糖和浓度为组合物总重量20.0%-30.0%的2-(2-乙氧基乙氧基)乙醇。
37.组合物包含浓度为组合物总重量1.0%-5.0%的木葡聚糖和浓度为组合物总重量20.0%-50.0%的2-(2-乙氧基乙氧基)乙醇。
38.组合物包含浓度为组合物总重量1.0%-5.0%的木葡聚糖和浓度为组合物总重量20.0%-30.0%的2-(2-乙氧基乙氧基)乙醇。
39.通过改变组合物中木葡聚糖和2-(2-乙氧基乙氧基)乙醇的量,能够得到不同量的凝胶,其特征在于不同的稠度和能够随时间调节活性成分的释放。本发明的组合物能够具有灵活性的基质,可用于根据活性成分、待治疗的病理学和递送部位提供受控释放。
40.已经发现,向浓度为0.1%-10.0%重量的木葡聚糖的水溶液中添加浓度为5.0%-50.0%重量的伯醇、特别是2-(2-乙氧基乙氧基)乙醇在小于20秒内、特别是1-10秒形成凝胶。
41.该组合物包含浓度为0.1%-10.0%重量、优选0.5%-8.0%重量、更优选组合物总重量1.0%-5.0%的木葡聚糖。包含浓度为0.1%-10.0%重量的木葡聚糖和浓度为5.0%-50.0%重量的2-(2-乙氧基乙氧基)乙醇的组合物的特征在于与包含相同浓度的木葡聚糖(xg)和仲醇的组合物得到的流变学行为相比具有不同的流变学行为。
42.包含浓度为0.1%-10.0%重量的木葡聚糖和浓度为20.0%-50.0%重量的2-(2-乙氧基乙氧基)乙醇的凝胶组合物形成相对于组合物重量大于50.0%重量百分比的凝胶。
此外,通过包含浓度为0.1%-10.0%的木葡聚糖和浓度为20.0%-50.0%的2-(2-乙氧基乙氧基)乙醇的组合物形成的凝胶的量大于以相同浓度从包含木葡聚糖和仲醇例如丙二醇的组合物中得到的凝胶的量。
43.木葡聚糖的量小于0.1%形成的凝胶的量相对于溶液重量小于10.0%。
44.包含浓度为2.0%-50%重量的木葡聚糖和浓度为20.0%-50.0%(w/w)的2-(2-乙氧基乙氧基)乙醇的组合物形成从溶液中分离的凝胶,其量大于溶液重量的60.0%。
45.根据本发明,组合物可以包含4%(w/w)的木葡聚糖和50%(w/w)的2-(2-乙氧基乙氧基)乙醇。
46.根据本发明,组合物可以包含浓度为组合物总重量2.0%(w/w)-5.0%(w/w)的木葡聚糖和浓度为组合物总重量20.0%(w/w)-30.0%(w/w)的2-(2-乙氧基乙氧基)乙醇。
47.包含浓度为1.0%-5.0%重量的木葡聚糖和浓度为20.0%-50.0%(w/w)的仲醇例如丙二醇的组合物形成从溶液中分离的凝胶,其量小于溶液重量的50.0%,并且凝胶形成需要比使用2-(2-乙氧基乙氧基)乙醇更长的时间。
48.通过混合浓度为5.0%-50.0%(w/w)的2-(2-乙氧基乙氧基)乙醇和浓度为0.1%-10.0%(w/w)的木葡聚糖的水溶液得到的凝胶组合物通过在小于20秒、优选小于10秒内混合它们得到。
49.流变学参数可用于定义液体或固体的特性。即,分别称作储能模量和损耗模量的模量g’和g”是频率依赖性材料函数。g’代表固体行为,g”代表液体行为。g’根据通常的弹性行为与变形对应,g”依据通常的液体行为。
50.本发明的凝胶形式的组合物的特征在于储能模量(g’)大于损耗模量(g”)。
51.包含浓度为0.1%-10.0%重量的木葡聚糖和5.0%-50.0%重量的2-(2-乙氧基乙氧基)乙醇的组合物的特征在于g’值随着频率的降低而降低。该特征在24小时后也得以维持。
52.本发明的组合物的特征在于在t0时的g’值为2000pa-500 pa,所施加的频率为100拉德/秒-0.1拉德/秒。
53.本发明的组合物的特征在于24小时(t24)后的g’值为3000pa-1000pa,所施加的频率为100拉德/秒-0.1拉德/秒。
54.当施加频率为100拉德/秒-0.1拉德/秒的应力时,包含浓度为0.1%-10.0%重量的木葡聚糖和5.0%-50.0%(w/w)的2-(2-乙氧基乙氧基)乙醇的组合物的特征在于在零时(t0)的g”值为500pa-100 pa。
55.包含浓度为0.1%-10.0%(w/w)的木葡聚糖和5.0%-50.0%(w/w)的2-(2-乙氧基乙氧基)乙醇的组合物的特征在于在t24时的g”值为300pa-100pa,所施加的频率为100拉德/秒-0.1拉德/秒。
56.包含上述浓度的木葡聚糖和仲醇例如丙二醇的组合物的特征在于g’值低于g”值并且两者均低于在t0时包含木葡聚糖和2-(2-乙氧基乙氧基)乙醇的组合物中得到的值。包含丙二醇的凝胶形成时间比包含2-(2-乙氧基乙氧基)乙醇的凝胶时间长,并且形成的凝胶的特征在于弱形式。这一结果通过g’值证实,其在t0和24小时后低于用2-(2-乙氧基乙氧基)乙醇获得的那些值。
57.包含浓度为0.1%-10.0%重量的木葡聚糖和浓度为5.0%-50.0%重量的2-(2-乙
氧基乙氧基)乙醇的组合物的特征在于在t0时的粘度值大于使用包含相同浓度的木葡聚糖和丙二醇的组合物得到的那些粘度值。
58.当施加具有剪切率0-95sec-1
的剪切应力时,包含浓度为0.1%-10.0%重量的木葡聚糖和浓度为5.0%-50.0%重量的2-(2-乙氧基乙氧基)乙醇的组合物在t0时的特征在于粘度值范围为1
×
10
10-2
×
103mpa。
59.当施加具有剪切率0-95sec-1
的剪切应力时,包含浓度为0.1%-10.0%重量的木葡聚糖和浓度为5.0%-50.0%重量的2-(2-乙氧基乙氧基)乙醇的组合物在24小时后的特征在于粘度值为3
×
10
7-1
×
103mpa
·
s。
60.包含相同浓度的木葡聚糖和仲醇例如丙二醇的比较组合物在t0显示粘度值低于包含2-(2-乙氧基乙氧基)乙醇的组合物中得到的那些值。该组合物的粘度值即使在24小时后也比包含2-(2-乙氧基乙氧基)乙醇的组合物的粘度值低至少一个数量级。
61.包含浓度为0.1%-10.0%重量的木葡聚糖和5.0%-50.0%重量的2-(2-乙氧基乙氧基)乙醇的组合物可以包括其它可以减缓活性成分释放的醇或酯。此类添加剂可以是例如天然或合成的聚合物,可溶于水或水不溶性蜡。这些化合物在水溶液中相对于木葡聚糖的重量比可以在1:50至10:1。
62.木葡聚糖水溶液与2-(2-乙氧基乙氧基)乙醇混合时形成凝胶。因此,可将两种溶液保存在适合的容器内备用,并且通过混合木葡聚糖和2-(2-乙氧基乙氧基)乙醇制备,以在作用部位形成凝胶。通过使用系统或具有包含两种溶液的两个通道或两个腔室的医疗装置在期望的部位形成能够释放活性成分的凝胶,可以将两种组分递送至该部位。取决于其在水中的溶解度,活性物质可以包括在木葡聚糖的水溶液中或2-(2-乙氧基乙氧基)乙醇的醇溶液中。
63.制备本发明组合物的方法包含下列步骤:
[0064]-制备纯化木葡聚糖的水溶液,浓度为0.1%-10.0%重量,将所得木葡聚糖溶液加入至浓度为5.0%-50.0%重量的伯醇溶液中,其中活性成分可以包含在两种溶液中,取决于其溶解度。
[0065]
溶液在使用时、使用前或凝胶制剂储存期期间混合。
[0066]
包含浓度为0.1%-10.0%重量的木葡聚糖和5.0%-50.0%重量的2-(2-乙氧基乙氧基)乙醇和药物或营养成分的凝胶组合物(其中这些成分即刻包含在凝胶中)有利于它们的稳定性,避免可能的降解问题。
[0067]
包含0.1%-10.0%重量的木葡聚糖和5.0%-50.0%重量的2-(2-乙氧基乙氧基)乙醇的凝胶组合物可以包含一种或多种药物活性成分,其选自抗炎剂、抗真菌剂、抗生素、模拟抗生素、生长因子、消毒剂、抗癌剂、蛋白质、肽、保湿剂和天然成分或它们的混合物。
[0068]
凝胶组合物可用于释放肽、蛋白质和如果与其它赋形剂一起配制则在储存时可能降解的任何其它活性成分。
[0069]
施用可以通过肠道(口服、舌下、直肠)、非肠道(皮下、皮内)、经皮途径进行。组合物也可以通过阴道、鼻或通过口咽粘膜施用。
[0070]
例如,该组合物可以用于施用易于到达受影响部位的药物,例如受到炎症或感染、损伤、脱水影响的部位。该组合物还可以包含例如重组蛋白,例如人重组干扰素(rifn)、rifnα、rifnβ和rifnγ、g-csf,其中释放以受控方式进行,施用量完全回收。本发明的组合
物以受控方式释放活性成分的能力已经通过使用ifnα2b作为活性成分的示例性试验得到证实,如下所述。在1、3、5、24和48小时后测量系统释放的活性ifn的量。测量显示,5小时后释放的ifn总量为约26%,24小时后释放的ifn总量为约60%,并且48小时后ifn完全释放。这种在24和48小时内发生的释放能够以较少的施用量始终具有有效量的活性成分血浆浓度。
[0071]
本发明还提供了用于递送本文所述方法的试剂盒。该试剂盒包含在适合的包装中的治疗剂剂量。
实施例
[0072]
实施例1:使用2-(2-乙氧基乙氧基)乙醇的木葡聚糖凝胶形成的测定
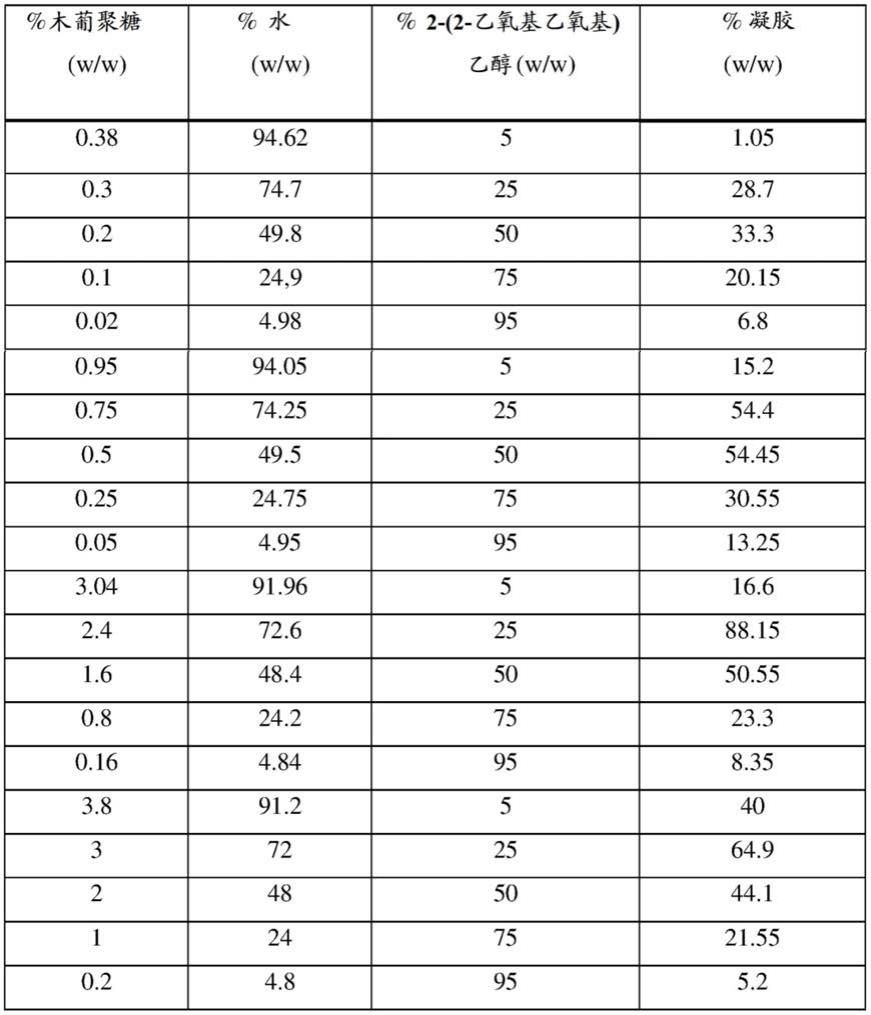
[0073]
制备浓度为0.4%、1.0%、3.2%和4.0%重量的木葡聚糖水溶液。
[0074]
通过在水中混合必需量的木葡聚糖并且保持搅拌直至完全溶解制备木葡聚糖溶液。
[0075]
以表中所示浓度将木葡聚糖溶液与丙二醇在刻度试管中混合。混合两种液体后的10秒内,观察到凝胶形成。进一步目视评价,在溶液离心后测定凝胶量并且评价溶液中凝胶的百分比。
[0076]
下表显示各组分的相对量:溶液中存在的木葡聚糖、水和2-(2-乙氧基乙氧基)乙醇,以及混合后形成的凝胶量。得到形成的凝胶相对于溶液总量的百分比。
[0077]
表1
[0078][0079]
实施例2:使用丙二醇的木葡聚糖凝胶形成的测定(比较例)
[0080]
制备浓度为0.4%、1.0%、3.2%和4.0%重量的木葡聚糖水溶液。以表中所示浓度,将该溶液与丙二醇混合。通过在水中混合必需量的木葡聚糖并且混合直至完全溶解制备木葡聚糖溶液。
[0081]
以表中所示浓度将木葡聚糖溶液与丙二醇在刻度试管中混合。进一步目视评价,在溶液离心后测定凝胶量并且评价溶液中凝胶的百分比。
[0082]
下表报告各组分的相对量:溶液中木葡聚糖、水和丙二醇,以及混合后形成的凝胶量。得到形成的凝胶相对于溶液总量的百分比。
[0083]
表2
[0084][0085]
实施例3:木葡聚糖和2-(2-乙氧基乙氧基)乙醇组合物的模量g’和g”的测定
[0086]
将体积为40ml浓度为3.2%(w/w)的木葡聚糖水溶液与10ml 2-(2-乙氧基乙氧基)乙醇混合。将溶液加载到两个注射器上并且直接挤出到流变仪板上并且进行分析。g’和g”的测量通过antoonpaar mcr101流变仪在37℃的温度条件使用50mm平锥得到。g’和g”的测量在t0和t24进行。
[0087]
表3报告了当施加的应力增加时模量g’和g”的值。
[0088]
表3
[0089][0090]
实施例4:包含木葡聚糖和丙二醇的组合物的储能模量(g’)和损耗模量(g”)的测定(比较例)
[0091]
本实施例如实施例3进行,并且测定通过混合40ml 3.2%(w/w)木葡聚糖水溶液与10ml 2-(2-乙氧基乙氧基)乙醇得到的组合物的储能模量(g’)和损耗模量(g”)的值。
[0092]
表4显示t0时和24小时(t24)后测定的模量g’和g”的值。
[0093]
表4
[0094][0095]
实施例5:包含木葡聚糖和2-(2-乙氧基乙氧基)乙醇的组合物的粘度测定
[0096]
粘度值通过具有50mm平锥几何形状的antoon paar mcr101流变仪得到,并且在37℃进行测量。表5报告了在时间t0和24小时后通过将40ml的3.2%(w/w)木葡聚糖水溶液与10ml 2-(2-乙氧基乙氧基)乙醇混合得到的组合物的粘度值。
[0097]
表5
[0098][0099]
实施例6:包含木葡聚糖和丙二醇的组合物的粘度测定(比较例)
[0100]
粘度值通过具有50mm平锥几何形状的antoon paar mcr101流变仪得到,并且在37℃进行测量。
[0101]
表6报告了在时间t0和24小时后通过将40ml的3.2%(w/w)木葡聚糖水溶液与10ml丙二醇混合得到的组合物的粘度值。
[0102]
表6
[0103][0104]
实施例7:重组干扰素(rifn α2b)从木葡聚糖-2-(2-乙氧基乙氧基)乙醇凝胶中的释放测定
[0105]
在ph 7的4%重量的木葡聚糖溶液中制备包含2.6
×
108iu/mg的重组ifnα2b溶液;将单元组成报道在表7中。
[0106]
表7
[0107]
[0108][0109]
凝胶中的rifn α2b具有25,000,000iu/ml的浓度,使得挤出的凝胶中存在20,000,000iu。
[0110]
在双室注射器中,将2ml表7的包含木葡聚糖的溶液装载至一个室中,并且将0.5ml的2-(2-乙氧基乙氧基)乙醇装载至另一个室中。从注射器挤出后,凝胶在不到10秒内即刻形成。
[0111]
为了评估ifn的释放,将凝胶置于2%(w/w)培养基(mem)中,在37℃恒温并且通过细胞病变效应(cpe)的生物学测试进行评估。
[0112]
表8
[0113]
时间(hrs)iu/ml总iu释放的iu/h03,90678,113/164,4711,293,3271,293,3273226,4804,597,9701,532,6575291,9776,134,4051,226,88124672,36014,034,027584,751481,097,95723,218,341483,71572755,75517,472,241242,67096899,44921,101,890219,811168842,35520,859,456124,163
[0114]
体外释放动力学表明,ifn在24至48小时完全释放,100%回收。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1