使用生物相容性聚合物的组织纤维化抑制剂的制作方法
1.本发明涉及用于外科手术后的组织的纤维化抑制剂。更具体地,本发明涉及以使用生物相容性聚合物为特征的纤维化抑制剂,其也可用于抑制组织粘连的发生。
背景技术:
2.纤维化是结缔组织在组织中积累的现象,并且是结缔组织如主要由胶原组成的细胞外基质在组织中过量产生和积累的结果。在心脏、肺、肝、胰腺、肾等中观察到纤维化。其中,心脏中的纤维化导致心肌硬化并损害心脏功能,尽管纤维化可防止心肌细胞死亡后心脏的心破裂。当心脏功能障碍持续时,发生心脏的扩大以补偿心脏功能障碍。因此,控制纤维化是相当重要的。当对器官如心外膜(心脏表面)或组织的表面施加物理应力如自体组织和人造物体或化学反应时,组织表面上的纤维形成增加,以致组织扩大。在再手术中,特别是再次心脏手术中,由于纤维化,心外膜的可视性明显变差,冠状动脉的走向变得不清楚,因此存在引起心脏之类的器官和血管或组织损伤的风险。尚未发现任何纤维化抑制剂可满足外科医生的需要。因此,需要生产可抑制器官或组织的表面,特别是心外膜表面的纤维化的纤维化抑制剂。
3.除纤维化外,可能导致器官或组织损伤的另一风险是手术后的组织粘连。手术后的组织粘连发生在各种领域,包括心脏病学以及消化系统手术、矫形外科、妇产科、眼科等。例如,腹部手术后腹腔中的粘连是一种生理生物修复反应,且难以绝对防止粘连的发生。手术后发生的粘连有一定的频率引起粘连性肠梗阻。据信,这种频率在一定程度上与手术持续时间和出血量成比例。为了防止或减少粘连的发生,需要通过外科医生的小心的手术操作来使分离/出血和手术持续时间最小化、防止术中污染以及最大限度减少残留异物、使用可吸收的缝合线、进行适当的引流、防止感染、进行术后早期活动等。在紧急污染手术中,还需要进行充分的腹腔内冲洗和体位改变,并在手术后使用抗生素。但是,尽管这些对策在一定程度上对预防粘连性肠梗阻有效,但不可能通过这些对策完全预防肠梗阻的发生(非专利文献1)。
4.根据最近的研究,据称:间皮细胞——其是覆盖体腔如胸腔、心包和腹腔的表面的膜状组织——在手术应激部位产生白细胞介素-6;中性粒细胞通过白细胞介素-6的作用产生肿瘤坏死因子tnf-α和转化生长因子tgf-β;且间皮细胞通过这种tgf-β的作用被纤维化替代以充当粘连形成的主体(非专利文献2)。
5.在心脏病学领域,手术后心外膜与胸壁的粘连或心包与心外膜的粘连增加在再手术过程中损伤心脏或大血管的风险(非专利文献3)。
6.在心脏手术中,使用自体心包。但是,当仅使用自体心包无法实现闭合时,使用各种类型的心包替代物。心包替代物的实例包括牛心包、硅酮涂覆的聚酯织物和聚四氟乙烯(ptfe)片(非专利文献4)。
7.在心内直视手术后人体的心包缺损部位,为了避免在术后急性期的心脏压塞期间和在术后晚期的再手术中的胸骨切开术中发生对心脏和大血管的损伤,经常使用厚度为
0.1mm的ptfe片作为心包替代物。在长期术后晚期的再手术的结果与在心脏被自体心包覆盖的情况下的手术结果相当不同。不可吸收的ptfe片——其具有生物组织无法侵入的结构——在再手术的过程中可容易地除去。但是,ptfe片的心脏侧和胸骨侧都被纤维组织覆盖到无法确认各纤维组织的解剖结构的程度。特别是在发现由残留病灶造成的负担的情况下,明显出现纤维组织的增厚。当在初次手术中在心脏表面的宽面积上增补片材时,难怪即使没有给出缩窄性心包炎(cp)的诊断,也观察到任何舒张衰竭(非专利文献5)。此外,关于该情况的实验数据也是公开已知的(非专利文献6至8)。
8.当ptfe片作为心包替代物移植时,强烈观察到由异物反应诱发的炎症证据,炎症反应在移植后4周变得显著,在移植后12周减弱。作为移植的结果,在ptfe片的心外膜侧形成非常厚的纤维结缔组织膜。这种ptfe片是有用的,因为该片材覆盖心脏和大血管以致当再手术变得必要时进行胸骨切开术的过程中不会损伤心脏和大血管。但是,在ptff片中,问题是当再手术不必要时ptfe片中的异物反应的影响,特别是舒张衰竭,包括cp。当ptfe片被移除时,可识别由该片材界定的区域,因此ptfe片通常被认为很少引起周围组织的炎症。但是,实际上,ptfe片很可能引起炎性反应(非专利文献5)。此外,还报道了由ptfe片引起的心外膜纤维化损害心脏的可视性(非专利文献9)。
9.心外膜的纤维化不仅由ptfe片诱发,还由切除自体心包时的心包缺损情况或自体心包闭合情况诱发。在使用兔模型的实验中,已经报道了在膨体聚四氟乙烯(eptfe)闭合情况和切除自体心包时的心包缺损情况中的纤维化的发生(非专利文献10)。在使用犬模型的实验中,已经报道了在eptfe闭合情况和自体心包闭合情况中的纤维化的发生(非专利文献11)。
10.同时,也已经报道了作为生物组织粘合剂的纤维蛋白胶用于粘连抑制用途的情况(非专利文献12和13)。但是,纤维蛋白胶无法完全抑制组织的粘连(专利文献1至3),因此尚未解决外科医生担心的严重问题。
11.脱细胞生物组织和脱细胞器官(下面统称为“脱细胞组织”)是通过从人体或不同物种的动物的生物组织或器官中除去细胞组分而制成的基质,并且已作为可用于移植或再生医学的细胞支架材料或伤口愈合促进材料受到关注。生物组织中除细胞外的组分,即细胞外基质(ecm),就其结构和组成而言在生物物种间是保守的,并且清楚地发现该组分在几乎所有生物物种间不诱发免疫排斥。此外,还众所周知,ecm参与细胞的分化,并且据报道在特定组织中的ecm上培养的细胞分化成该组织的细胞。根据这些发现,构成ecm的脱细胞组织在移植后不发生免疫排斥,并预计将通过受体的细胞再生(非专利文献14)。
12.现有技术文献专利文献专利文献1: jp-t-11-502431专利文献2: jp-a-2001-327592专利文献3: jp-t-2003-500170专利文献4: jp-4092397专利文献5: jp-a1-2008-111530专利文献6: jp-a-2009-50297非专利文献
非专利文献1: tsuneo fukushima等人, surgical therapy, 2006;94(6):919-924非专利文献2: uyama n.等人, sci rep. 2019;26;9(1):17558非专利文献3: dobell ar.等人, ann thorac surg.1984;37:273-8非专利文献4: ozeren m.等人, cardiovasc. surg. 2002;10(5):489-493非专利文献5: tetsuya kitagawa, pediatric cardiology and cardiac surgery. 2004;20(6):632-633非专利文献6: liermann a.等人, helv chir acta. 1992;58:515-519非专利文献7: muralidharan s.等人, j biomed mater res. 1991;25:1201-1209非专利文献8: bunton rw.等人, j thorac cardiovasc surg. 1990;100:99-107非专利文献9: jukka t.等人, interactive cardiovascular and thoracic surgery. 2011;12(2):270-272非专利文献10: kaushal s.等人, thorac cardiovasc surg. 2011;141:789-795非专利文献11: naito y.等人, j thorac cardiovasc surg. 2008;135:850-856非专利文献12: takamichi sato等人, obstetrics and gynecology, 1990;57(12):2398-2404非专利文献13: kiyoshi okuda等人, the world of obstetrics and gynecology, 1993;45(9):759-764非专利文献14: akio kishida, organ biology, 2018;25(1):27-34非专利文献15: singelyn j.m.等人, biomaterials, 2009, 30, 5409-5416非专利文献16: singelyn j.m,等人, j. am. coll. cardiol., 2012, 59, 751-763非专利文献17: sonya b.等人, sci. transl. med., 2013, 5, 173ra25非专利文献18: sasaki s.等人, mol. vis., 2009, 15, 2022-2028非专利文献19: yoshihide h.等人, biomaterials, 2010, 31, 3941-3949非专利文献20: seiichi f.等人, biomaterials, 2010, 31, 3590-3595非专利文献21: negishi j.等人, j. artif. organs, 2011, 14, 223-231非专利文献22: hirashima m.等人, j. biochem., 2016, 159, 261-270非专利文献23: meta a.等人, j. biosci. bioeng, 2015, 120, 432-437。
13.发明概述本发明要解决的问题本发明要解决的问题是(1)抑制器官或组织表面的纤维化,特别是(2)抑制心外膜表面的纤维化,并提供可解决这些问题的纤维化抑制剂。另一个问题是通过抑制纤维化而预防和减少后续粘连的发生,以避免在再手术过程中器官或组织的损伤。
14.问题的解决方案
本发明人已经进行了广泛而深入的研究。结果,本发明人发现了一种纤维化抑制剂,通过其将生物相容性聚合物固定到要抑制组织纤维化的组织上,由此抑制该组织的纤维化,并且他们已经发现该纤维化抑制剂可解决这些问题。
15.本发明包括以下方面:(1) 组织纤维化抑制剂,其包含生物相容性聚合物。
16.(2) 根据(1)的纤维化抑制剂,其中所述生物相容性聚合物是纤维蛋白或糊精凝胶。
17.(3) 组织纤维化抑制试剂盒,其包含生物相容性聚合物和细胞支架材料的组合。
18.(4) 根据(3)的纤维化抑制试剂盒,其中将所述生物相容性聚合物固定到要抑制组织纤维化的一个组织上,并对其它组织中的组织缺损部位用所述细胞支架材料进行修复(prosthesis)。
19.(5) 根据(3)或(4)的纤维化抑制试剂盒,其中所述生物相容性聚合物是纤维蛋白或糊精凝胶。
20.(6) 根据(3)至(5)任一项的纤维化抑制试剂盒,其中所述细胞支架材料是脱细胞组织。
21.(7) 根据(6)的纤维化抑制试剂盒,其中所述脱细胞组织是通过将选自小肠粘膜下层、心包、膀胱、羊膜、硬脑膜、腹膜、大网膜、横膈膜、筋膜、真皮和皮肤的生物组织脱细胞制成的组织。
22.(8) 根据(3)至(7)任一项的纤维化抑制试剂盒,其促进所述细胞支架材料的自组织。
23.(9) 根据(3)至(8)任一项的纤维化抑制试剂盒,其中要抑制组织纤维化的组织是心外膜。
24.(10) 组织纤维化抑制试剂盒,其包含生物相容性聚合物和心包替代物的组合。
25.(11) 根据(10)的纤维化抑制试剂盒,其中将所述生物相容性聚合物固定到要抑制组织纤维化的一个组织上,并对其它组织中的组织缺损部位用所述心包替代物进行修复。
26.(12) 根据(10)或(11)的纤维化抑制试剂盒,其中所述生物相容性聚合物为纤维蛋白或糊精凝胶。
27.(13) 根据(10)至(12)任一项的纤维化抑制试剂盒,其中所述心包替代物是脱细胞组织。
28.(14) 根据(13)的纤维化抑制试剂盒,其中所述脱细胞组织是通过将选自小肠粘膜下层、心包、膀胱、羊膜、硬脑膜、腹膜、大网膜、横膈膜、筋膜、真皮和皮肤的生物组织脱细胞制成的组织。
29.(15) 根据(10)至(14)任一项的纤维化抑制试剂盒,其促进所述心包替代物的自组织。
30.(16) 根据(10)至(15)任一项的纤维化抑制试剂盒,其中要抑制组织纤维化的组织是心包。
31.(17) 粘连屏障试剂盒(adhesion barrier kit),其中将生物相容性聚合物固定到要抑制组织纤维化的一个组织上,并对其它组织中的组织缺损部位用细胞支架材料或心
包替代物进行修复。
32.(18) 根据(17)的粘连屏障试剂盒,其中所述生物相容性聚合物是纤维蛋白或糊精凝胶。
33.(19) 根据(17)的粘连屏障试剂盒,其中所述细胞支架材料或所述心包替代物是脱细胞组织。
34.(20) 根据(19)的粘连屏障试剂盒,其中所述脱细胞组织是通过将选自小肠粘膜下层、心包、膀胱、羊膜、硬脑膜、腹膜、大网膜、横膈膜、筋膜、真皮和皮肤的生物组织脱细胞制成的组织。
35.(21) 根据(17)至(20)任一项的粘连屏障试剂盒,其促进所述细胞支架材料或所述心包替代物的自组织。
36.(22) 根据(17)至(21)任一项的粘连屏障试剂盒,其中要抑制粘连的组织是心外膜。
37.发明效果根据本发明的纤维化抑制剂具有抑制器官或组织的表面的纤维化的效果。本发明的纤维化抑制剂抑制器官或组织的表面,特别是心外膜表面的纤维化,以改进心外膜的可视性,并由此可减少在再手术的过程中心脏或血管的损伤。此外,本发明的纤维化抑制剂可抑制诱发纤维化的炎性反应。因此,该纤维化抑制剂还有望具有减少与炎性反应相关的粘连的效果,并可用作粘连抑制剂。
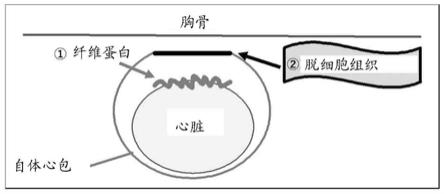
38.附图简述图1是显示在观察3个月后兔心脏纤维化模型(纤维化抑制剂组)的评估的照片。
39.图2是显示在观察3个月后兔心脏纤维化模型(纤维化抑制试剂盒组)的评估的照片。
40.图3是显示在观察3个月后兔心脏纤维化模型(对照组/心包缺损)的评估的照片。
41.图4是显示在观察3个月后兔心脏纤维化模型(对照组/自体心包闭合)的评估的照片。
42.图5是显示在观察3个月后兔心脏纤维化模型(脱细胞组织单独组)的评估的照片。
43.图6显示使用纤维化抑制试剂盒和粘连屏障试剂盒的方法的一个实例(一种情况,其中(1)将纤维蛋白施加和固定到心脏的心外膜上,然后(2)将脱细胞组织缝合和固定到位于心外膜和胸骨之间的心包缺损部位上)。
44.图7是显示在观察3个月后兔心脏模型(纤维化抑制试剂盒和粘连屏障试剂盒组)的病理学的照片。
45.图8是显示在观察3个月后兔心脏模型(脱细胞组织单独组)的病理学的照片。
46.图9是显示在观察3个月后兔心脏模型(纤维蛋白-(脱细胞组织)复合组)的病理学的照片。
47.本发明的实施方案本发明包括:可用作纤维化抑制剂的生物相容性聚合物;和细胞支架材料。
48.本文所用的术语“生物相容性聚合物”是指在体内产生较少免疫反应的聚合物。生物相容性聚合物的实例包括但不限于藻酸、甲壳素、壳聚糖、糖胺聚糖、胶原、硫酸软骨素、纤维素、明胶、葡聚糖、糊精、糖蛋白、透明质酸、纤维蛋白原、纤维蛋白、纤连蛋白、肝素和类
肝素。作为生物相容性聚合物,纤维蛋白或糊精凝胶特别优选。
49.本文所用的术语“细胞支架材料”是指促进细胞粘附/增殖的材料。
50.脱细胞组织可通过从动物(供体)收集生物组织和然后对生物组织施以脱细胞处理而获得。通过对生物组织施以脱细胞处理,可从生物组织中除去来自供体的细胞或病原体(病毒、细菌)。因此,即使将生物组织移植到与供体物种不同物种的动物中时,也可抑制异源免疫反应的发生。由于这些原因,对用于收集生物组织的动物的类型没有特别限制。同时,优选容易地获得生物组织。因此,动物优选是非人类动物,特别优选哺乳类家畜或禽类家畜。哺乳类家畜的实例包括牛、马、骆驼、美洲驼、驴、牦牛、绵羊、猪、山羊、鹿、羊驼、犬、貉、鼬、狐狸、猫、兔、仓鼠、豚鼠、大鼠、松鼠和浣熊。禽类家畜的实例包括长尾鹦鹉、鹦鹉、鸡、鸭、火鸡、鹅、珍珠鸡、雉鸡、鸵鸟和鹌鹑。在这些动物中,从可得性的角度看,猪是优选的。
51.生物组织的实例是具有细胞外基质结构并可经受脱细胞处理的组织。组织的实例是选自小肠粘膜下层、膀胱、羊膜、硬脑膜、腹膜、横膈膜、筋膜、真皮、皮肤、肝、肾、尿管(urinary duct)、尿道、舌、扁桃体、食道、胃、大网膜、小肠、大肠、肛门、胰腺、心脏、心包、血管、脾、肺、脑、骨、脊髓、软骨、睾丸、子宫、输卵管、卵巢、胎盘、角膜、骨骼肌、腱、神经等的组织。当脱细胞组织具有片状形式时,脱细胞组织可容易地施加到活体中。因此,该组织的一个优选实例是选自小肠粘膜下层、膀胱、羊膜、硬脑膜、腹膜、大网膜、横膈膜、筋膜、真皮和皮肤的组织。不具有片状形式的脱细胞组织并非不可接受,因为脱细胞组织只是必须加工成片状形式。
52.作为从动物中收集生物组织的方法,可使用适合于供体的动物物种或生物组织的方法。对从动物中收集的生物组织施以脱细胞处理。对脱细胞处理没有特别限制,只要可除去源自供体的细胞或病原体。该方法的实例包括用表面活性剂处理(非专利文献15至21、专利文献4至6),并可根据供体的动物物种和生物组织的类型适当地选择该方法。
53.在将生物相容性聚合物与脱细胞组织合并时,可通过生物相容性聚合物自身的凝胶化实现生物相容性聚合物固定到要抑制组织纤维化的组织上。用于固定作为生物相容性聚合物之一的纤维蛋白的方法的实例包括:其中通过将纤维蛋白施加到组织上而将纤维蛋白固定到要抑制组织纤维化的该组织上的方法;和其中通过将作为纤维蛋白组成成分的粉末(纤维蛋白原粉末、凝血酶粉末)喷洒到组织上而将纤维蛋白固定到该组织上的方法。例如,当心包在心脏手术中缺损时,心外膜等的纤维化成为问题。为了抑制心外膜的纤维化,实例是将纤维蛋白固定到心外膜上,同时将脱细胞组织缝合和固定到为减少与胸骨的接触而保留的自体心包上。将纤维蛋白固定到要抑制组织纤维化的组织,更具体是心外膜上,同时对位于心外膜和胸骨之间的心包缺损部位用脱细胞组织进行修复。以这种方式,可发挥作为纤维化抑制试剂盒的作用。在纤维蛋白的固定中,有可能首先施加纤维蛋白原或凝血酶的任一种,接下来施加另一种,或者也可能同时施加这两种。也可选择使用喷雾装置的喷雾施加。当观察到透明凝胶的轻微混浊时,纤维蛋白的固定完成。如上所述,要抑制组织纤维化的组织的实例是心外膜。但是,组织的实例不限于心外膜。除心外膜外,相信可在肺等的组织中抑制纤维化的发生。
54.在施加纤维蛋白时纤维蛋白原或凝血酶的浓度不受特别限制,只要可形成纤维蛋白。例如,纤维蛋白原的浓度为4 mg/ml至160 mg/ml,优选10 mg/ml至80 mg/ml。例如,凝血
酶的浓度为1 u/ml至1200 u/ml,优选60 u/ml至600 u/ml。
55.纤维蛋白是由纤维蛋白原与作为酶的凝血酶的相互作用形成的胶样凝结物,并且是可用于组织闭合、器官中的受损部位的粘合、止血等的药物产品。对纤维蛋白的类型没有特别限制,并且可以是其中组成成分如纤维蛋白原和凝血酶源自血液的纤维蛋白,或可通过重组技术制备。一个优选实例是用于组织粘合的bolheal(注册商标,km biologics co., ltd.)。
56.本发明还包括一种纤维化抑制试剂盒,其中分开制备纤维蛋白和脱细胞组织。配置该试剂盒以便医师在使用时施加纤维蛋白和脱细胞组织。当脱细胞组织是冻干的时,用溶剂浸渍脱细胞组织以复原脱细胞组织并将复原的脱细胞组织施加到受累部位。因此,该试剂盒可包括用于复原的溶剂。
57.对用于制作心脏纤维化模型的动物没有特别限制,并优选是兔,更优选5至6月龄的日本白兔。在模型的制作中,在麻醉下通过切口打开动物的胸腔,然后使金属剥离器(raspatory)与心脏或心外膜接触。与金属剥离器接触的持续时间不受特别限制,例如为10至20分钟。在用金属剥离器处理后,心脏可用干燥器(通过供应空气)干燥。
58.评估纤维化抑制的方法的一个实例是通过目视观察评级。例如,在评估心外膜中的纤维化抑制的情况下,可通过评级为纤维化等级0(没有观察到纤维化)、纤维化等级1(可目视观察心包)和纤维化等级2(无法目视观察心外膜)而进行评估。在这种评估方法中,可根据是否能够目视观察心外膜上的血管来进行确定。当心外膜变白并且无法观察到血管时,可确定没有令人满意地抑制纤维化。此外,也可优选使用其中将纤维化等级2的区域与对照组进行比较以评估纤维化抑制效果的方法。
59.本文所用的词语“细胞支架材料或心包替代物的自组织”是指在将人工材料等移植到活体内之后,人工材料等重建到组织如自体组织中,随之减少免疫反应。
实施例
60.下面通过实施例更详细描述本发明,但无论如何无意限制本发明的范围。
61.实施例1纤维化抑制剂和纤维化抑制试剂盒的纤维化抑制效果:作为脱细胞组织,使用脱细胞的猪小肠粘膜下层、脱细胞的胎兔皮和脱细胞的兔心包。
62.作为生物相容性聚合物,使用纤维蛋白。关于血源性纤维蛋白,在用于组织粘合的bolheal(注册商标,km biologics co., ltd.)中通过使用纤维蛋白原冻干粉和纤维蛋白原溶解(dissolution)来制备纤维蛋白原溶液。在用于组织粘合的bolheal(注册商标,km biologics co., ltd.)中通过使用凝血酶冻干粉和凝血酶溶解(dissolution)来制备凝血酶溶液。使用重组纤维蛋白原(非专利文献22)和重组凝血酶(非专利文献23)制备重组纤维蛋白,重组纤维蛋白原和重组凝血酶都由km biologics co., ltd.通过基因工程技术制成。作为糊精凝胶,使用adspray(注册商标,terumo corporation)。当透明凝胶轻微混浊时,确认纤维蛋白的固定完成,并且当形成含微气泡的白色凝胶时,确认糊精的固定完成。
63.使用5至6月龄的雄性日本白兔制作心脏纤维化模型。在用甲苯噻嗪和盐酸氯胺酮麻醉下将气管内导管插入气管,然后连接到人工呼吸机。围绕第二至第五肋软骨的缺口切
开一部分(5 cm)胸骨。将紧挨切开的胸腔部分下方的心包(2.0 cm
ꢀ×ꢀ
1.5 cm)切开。使心外膜与金属剥离器接触10分钟。缝合并闭合切开的胸腔伤口中的胸骨、肌肉和皮肤。适当的评估时机被认为是在组织中的炎症结束且纤维化完成之后的时间。然后,以将动物以常规方式饲养3个月、然后切开胸腔并肉眼评估心外膜的纤维化等级的方式进行长期评估。
64.纤维化根据以下标准评级:纤维化等级0: 没有观察到纤维化。
65.纤维化等级1: 可目视观察心外膜。
66.纤维化等级2: 无法目视观察心外膜。
67.可通过将纤维化等级2的区域与对照组进行比较来确定纤维化抑制效果。根据以下公式计算纤维化等级2的区域(%):(纤维化等级2的面积)/(心包缺损部位的面积)
ꢀ×ꢀ
100。
68.在实施例1中,比较和评估以下试验组。
69.(1) 纤维化抑制剂组(血源性纤维蛋白)(2) 纤维化抑制试剂盒组(血源性纤维蛋白和脱细胞的猪小肠粘膜下层)(3) 纤维化抑制试剂盒组(重组纤维蛋白和脱细胞的猪小肠粘膜下层)(4) 纤维化抑制试剂盒组(重组纤维蛋白和脱细胞的胎兔皮)(5) 纤维化抑制试剂盒组(重组纤维蛋白和脱细胞的兔心包)(6) 纤维化抑制试剂盒组(糊精凝胶和脱细胞的猪小肠粘膜下层)(7) 对照组(心包缺损)(8) 对照组(自体心包闭合)(9) 脱细胞组织单独组(脱细胞的猪小肠粘膜下层)(10) 纤维蛋白-脱细胞组织复合组(血源性纤维蛋白与脱细胞的猪小肠粘膜下层复合)。
70.组(1)至(6)是本发明的组,组(7)至(10)是对照组。关于用于(1)至(5)的纤维蛋白施加方法,将纤维蛋白原溶液和凝血酶溶液混合在一起并使用施加装置将所得混合物施加到心包缺损部位的心外膜上,其中纤维蛋白原溶液和凝血酶溶液的最终浓度分别是40 mg/ml和125 u/ml,并固定施加的溶液。用于(6)的糊精凝胶制备方法和糊精凝胶施加方法如adspray的包装说明书中规定的进行。关于用于(2)至(6)和(9)的脱细胞组织施加方法,以将脱细胞组织固定到位于心外膜和胸骨之间的心包缺损部位的方式将脱细胞组织缝合和固定(修复)到剩余自体心包上。关于用于(2)至(6)的施加顺序,将纤维蛋白或糊精凝胶固定到心外膜上,随后将脱细胞组织缝合和固定(修复)到自体心包上。组(7)至(10)是在各组中不施加纤维化抑制剂的组。组(10)是其中纤维蛋白与脱细胞组织复合的组。将纤维蛋白原溶液和凝血酶溶液混合在一起并将所得混合物施加到脱细胞组织的两面以使这些组分与彼此复合,并以将所得产物固定到位于心外膜和胸骨之间的心包缺损部位的方式将所得产物缝合和固定(修复)到剩余自体心包上。评估结果显示在表1中。
71.由上述结果显而易见,当使用作为本发明的产品的纤维化抑制剂和纤维化抑制试剂盒时,确认优异的纤维化抑制效果。在本发明的各纤维化抑制剂中,在将(3) 纤维化抑制试剂盒组(重组纤维蛋白和脱细胞的猪小肠粘膜下层)与(7) 对照组(心包缺损)比较时,通过wilcoxon秩和检验证实显著性差异(p 《 0.01)。在将(1) 纤维化抑制剂组(血源性纤维蛋白)、(2) 纤维化抑制试剂盒组(血源性纤维蛋白和脱细胞的猪小肠粘膜下层)、(4)纤维化抑制试剂盒组(重组纤维蛋白和脱细胞的胎兔皮)和(5) 纤维化抑制试剂盒组(重组纤维蛋白和脱细胞的兔心包)各自与(7) 对照组(心包缺损)比较时,证实显著性差异(p 《 0.05)。在将(3) 纤维化抑制试剂盒组(重组纤维蛋白和脱细胞的猪小肠粘膜下层)与(8) 对照组(自体心包闭合)比较时,证实显著性差异(p 《 0.05)。在将(2) 纤维化抑制试剂盒组(血源性纤维蛋白和脱细胞的猪小肠粘膜下层)、(3) 纤维化抑制试剂盒组(重组纤维蛋白和脱细胞的猪小肠粘膜下层)、(4) 纤维化抑制试剂盒组(重组纤维蛋白和脱细胞的胎兔皮)和(5) 纤维化抑制试剂盒组(重组纤维蛋白和脱细胞的兔心包)各自与(10) 纤维蛋白-脱细胞组织复合组(血源性纤维蛋白与脱细胞的猪小肠粘膜下层复合)比较时,证实显著性差异(p 《 0.01)。在将(1) 纤维化抑制剂组(血源性纤维蛋白)和(6) 纤维化抑制试剂盒组(糊精凝胶和脱细胞的猪小肠粘膜下层)各自与(10) 纤维蛋白-脱细胞组织复合组(血源性纤维蛋白与脱细胞的猪小肠粘膜下层复合)比较时,证实显著性差异(p 《 0.05)。
72.实施例2粘连屏障试剂盒的粘连抑制效果:作为脱细胞组织,使用脱细胞的猪小肠粘膜下层、脱细胞的胎兔皮和脱细胞的兔心包。
73.作为生物相容性聚合物,使用纤维蛋白。关于血源性纤维蛋白,在用于组织粘合的
bolheal(注册商标,km biologics co., ltd.)中通过使用纤维蛋白原冻干粉和纤维蛋白原溶解(dissolution)来制备纤维蛋白原溶液。在用于组织粘合的bolheal(注册商标,km biologics co., ltd.)中通过使用凝血酶冻干粉和凝血酶溶解(dissolution)来制备凝血酶溶液。使用重组纤维蛋白原(非专利文献22)和重组凝血酶(非专利文献23)制备重组纤维蛋白,重组纤维蛋白原和重组凝血酶都由km biologics co., ltd.通过基因工程技术制成。作为糊精凝胶,使用adspray(注册商标,terumo corporation)。当透明凝胶轻微混浊时,确认纤维蛋白的固定完成,并且当形成含微气泡的白色凝胶时,确认糊精的固定完成。
74.使用5至6月龄的雄性日本白兔制作心脏组织粘连模型。在用甲苯噻嗪和盐酸氯胺酮麻醉下将气管内导管插入气管,然后连接到人工呼吸机。围绕第二至第五肋软骨的缺口切开一部分(5 cm)胸骨。将紧挨切开的胸腔部分下方的心包(2.0 cm
ꢀ×ꢀ
1.5 cm)切开。使心外膜与金属剥离器接触10分钟。缝合并闭合切开的胸腔伤口中的胸骨、肋骨、肌肉和皮肤。适当的评估时机被认为是在组织中的炎症结束且粘连完成之后的时间。然后,以将动物以常规方式饲养3个月、然后切开胸腔并评估心外膜损伤部位(abraded site)的粘连的方式进行长期评估。
75.粘连根据下示标准评级,取决于在心外膜损伤部位的粘连的分离程度。
76.粘连等级0: 无粘连粘连等级1: 轻度粘连(粘连不需要钝性分离以分开重建的心包与胸骨或心外膜之间的空间)粘连等级2: 中度粘连(粘连需要钝性分离以分开重建的心包与胸骨或心外膜之间的空间)粘连等级3: 重度粘连(粘连需要锐性分离以分开重建的心包与胸骨或心外膜之间的空间)。
77.通过将粘连等级0的心外膜区域和粘连等级3的心外膜区域与对照组进行比较来确定粘连抑制效果。根据以下公式计算粘连等级0的心外膜区域(%):(粘连等级0的心外膜面积)/(心包缺损部位的面积)
ꢀ×ꢀ
100。
78.根据以下公式计算粘连等级3的心外膜区域(%):(粘连等级3的心外膜面积)/(心包缺损部位的面积)
ꢀ×ꢀ
100。
79.在实施例2中,比较和评估以下试验组。
80.(1) 粘连屏障试剂盒组(血源性纤维蛋白和脱细胞的猪小肠粘膜下层)(2) 粘连屏障试剂盒组(重组纤维蛋白和脱细胞的猪小肠粘膜下层)(3) 粘连屏障试剂盒组(重组纤维蛋白和脱细胞的胎兔皮)(4) 粘连屏障试剂盒组(重组纤维蛋白和脱细胞的兔心包)(5) 粘连屏障试剂盒组(糊精凝胶和脱细胞的猪小肠粘膜下层)(6) 对照组(心包缺损)(7) 对照组(自体心包闭合)(8) 纤维蛋白-脱细胞组织复合组(血源性纤维蛋白与脱细胞的猪小肠粘膜下层复合)。
81.组(1)至(5)是本发明的组,组(6)至(8)是对照组。关于用于(1)至(4)的纤维蛋白施加方法,将纤维蛋白原溶液和凝血酶溶液混合在一起并使用施加装置将所得混合物施加
和固定到心包缺损部位的心外膜上,其中纤维蛋白原溶液和凝血酶溶液的最终浓度分别是40 mg/ml和125 u/ml。用于(5)的糊精凝胶制备方法和施加方法如adspray的包装说明书中规定的进行。关于用于(1)至(5)的脱细胞组织施加方法,将脱细胞组织缝合和固定(修复)到剩余自体心包上,以固定到位于心外膜和胸骨之间的心包缺损部位上。关于用于(1)至(5)的施加顺序,将纤维蛋白或糊精凝胶固定到心外膜上,随后将脱细胞组织缝合和固定到自体心包上。组(6)至(8)是在各组中不施加粘连屏障试剂盒的组。组(8)是其中纤维蛋白与脱细胞组织复合的组。将纤维蛋白原溶液和凝血酶溶液混合在一起并将所得混合物施加到脱细胞组织的两面以使这些组分与彼此复合,并以将所得产物固定到位于心外膜和胸骨之间的心包缺损部位的方式将所得产物缝合和固定(修复)到剩余自体心包上。评估结果显示在表2中。
82.由上述结果显而易见,当使用作为本发明的产品的粘连屏障试剂盒时,确认长期优异的粘连抑制效果。比较心外膜中的粘连等级0的区域(%)。结果,当在(3) 粘连屏障试剂盒组(重组纤维蛋白和脱细胞的胎兔皮)与(6) 对照组(心包缺损)之间进行比较时,通过wilcoxon秩和检验证实本发明的粘连屏障试剂盒中的显著性差异(p 《 0.01)。在将(1) 粘连屏障试剂盒组(血源性纤维蛋白和脱细胞的猪小肠粘膜下层)和(2) 粘连屏障试剂盒组(重组纤维蛋白和脱细胞的猪小肠粘膜下层)各自与(6) 对照组(心包缺损)比较时,证实显著性差异(p 《 0.05)。在将(3) 粘连屏障试剂盒组(重组纤维蛋白和脱细胞的胎兔皮)与(7) 对照组(自体心包闭合)比较时,证实显著性差异(p 《 0.05)。在将(1) 粘连屏障试剂盒组(血源性纤维蛋白和脱细胞的猪小肠粘膜下层)和(2) 粘连屏障试剂盒组(重组纤维蛋白和脱细胞的猪小肠粘膜下层)各自与(8) 纤维蛋白-脱细胞组织复合组(血源性纤维蛋白
与脱细胞的猪小肠粘膜下层复合)比较时,证实显著性差异(p 《 0.05)。比较心外膜中的粘连等级3的区域(%)。结果,在将(1) 粘连屏障试剂盒组(血源性纤维蛋白和脱细胞的猪小肠粘膜下层)、(2) 粘连屏障试剂盒组(重组纤维蛋白和脱细胞的猪小肠粘膜下层)、(3) 粘连屏障试剂盒组(重组纤维蛋白和脱细胞的胎兔皮)、(4) 粘连屏障试剂盒组(重组纤维蛋白和脱细胞的兔心外膜)和(5) 粘连屏障试剂盒组(糊精凝胶和脱细胞的猪小肠粘膜下层)各自与(6) 对照组(心包缺损)比较时,通过wilcoxon秩和检验证实本发明的粘连屏障试剂盒中的显著性差异(p 《 0.01)。在将(2) 粘连屏障试剂盒组(重组纤维蛋白和脱细胞的猪小肠粘膜下层)与(7) 对照组(自体心包闭合)比较时,证实显著性差异(p 《 0.05)。
83.实施例3通过纤维化抑制试剂盒和粘连屏障试剂盒促进脱细胞组织的自组织:作为脱细胞组织,使用脱细胞的猪小肠粘膜下层。
84.作为生物相容性聚合物,使用纤维蛋白。关于血源性纤维蛋白,在用于组织粘合的bolheal(注册商标,km biologics co., ltd.)中通过使用纤维蛋白原冻干粉和纤维蛋白原溶解(dissolution)来制备纤维蛋白原溶液。在用于组织粘合的bolheal(注册商标,km biologics co., ltd.)中通过使用凝血酶冻干粉和凝血酶溶解(dissolution)来制备凝血酶溶液。使用重组纤维蛋白原(非专利文献22)和重组凝血酶(非专利文献23)制备重组纤维蛋白,重组纤维蛋白原和重组凝血酶都由km biologics co., ltd.通过基因工程技术制成。当透明凝胶轻微混浊时,确认纤维蛋白的固定完成,并且当形成含微气泡的白色凝胶时,确认糊精的固定完成。
85.使用兔心脏模型评估脱细胞组织的自组织。使用5至6月龄的雄性日本白兔。在用甲苯噻嗪和盐酸氯胺酮麻醉下将气管内导管插入气管,然后连接到人工呼吸机。围绕第二至第五肋软骨的缺口切开一部分(5 cm)胸骨。将紧挨切开的胸腔部分下方的心包(2.0 cm
ꢀ×ꢀ
1.5 cm)切开。使心外膜与金属剥离器接触10分钟。缝合并闭合切开的胸腔伤口中的胸骨、肋骨、肌肉和皮肤。为了长期评估,将兔子常规饲养3个月、然后切开胸腔以收集脱细胞组织。为了评估脱细胞组织的强度,评估收集时脱细胞组织的破裂。根据以下公式计算破裂发生率(%):(在收集时发生脱细胞组织破裂的个体数)/(各试验组中的个体数)
ꢀ×ꢀ
100。
86.制作收集的脱细胞组织的组织病理学标本,然后进行he染色。以这种方式评估自组织程度。结果的病理学照片显示在图7至9中。
87.在实施例3中,评估以下试验组。
88.(1) 纤维化抑制和粘连屏障试剂盒组(血源性纤维蛋白和脱细胞的猪小肠粘膜下层)(2) 脱细胞组织单独组(脱细胞的猪小肠粘膜下层)(3) 纤维蛋白-脱细胞组织复合组(血源性纤维蛋白与脱细胞的猪小肠粘膜下层复合)。
89.关于在(1)和(2)中施加脱细胞组织的方法,将脱细胞组织缝合和固定(修复)到剩余自体心包上,以将脱细胞组织固定到位于心外膜和胸骨之间的心包缺损部位上。组(3)是其中将纤维蛋白与脱细胞组织复合的组。以将复合产物固定到位于心外膜和胸骨之间的心包缺损部位上的方式将复合产物缝合和固定(修复)到剩余自体心包上。评估的结果显示在
表3中。
90.由上述结果显而易见,证实作为本发明的产品的纤维化抑制和粘连屏障试剂盒可促进脱细胞组织的自组织以重建具有适当强度的自体心包样组织。
91.工业适用性本发明可用作器官或组织的表面的纤维化抑制剂,也可用于抑制组织粘连。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1