环二核苷酸的新用途的制作方法
1.在第一方面中,本发明涉及环二核苷酸化合物,特别是用于诱导或促进个体免疫反应的方法中的c-di amp,其中所述个体为新生儿或婴儿。根据本发明的化合物尤其可用于治疗性或预防性疫苗接种。在另一方面中,提供了药物组合物,其包含根据本发明的作为辅助剂的化合物、如本文所定义的、尤其用作用于未出生儿童、新生儿和婴儿的疫苗中的佐剂的药物活性成分。最后,本发明涉及一种试剂盒,其包含作为佐剂的根据本发明的化合物、作为活性疫苗接种组分的包含抗原结构的抗原,尤其涉及所述试剂盒在预防或治疗疾病中的用途。
背景技术:
2.早期免疫接种是一项重要的公共卫生任务,但仍然是一个具有挑战性的领域。新生儿的不成熟免疫反应增加了他们对典型感染和机会性感染的易感性,这进而导致每年至少550万新生儿感染。新生儿在出生后的头几个月确实特别容易受到威胁生命的感染。在这方面,新生儿疫苗接种是克服早期感染引起的发病率和死亡率的关键性全球战略。
3.生命的新生儿期是免疫接种的机会窗,特别是因为皮肤和粘膜等屏障对疫苗抗原更具渗透性,且相关微生物群发育不足。令人关注的是,最近文献报道,新生儿疫苗也可以针对疫苗无效疾病提供保护,特别是在伴随母乳喂养的情况下(alam,m.j.,等人,2015,vaccine 33(1):18-21.doi:10.1016/j.2014.10.075)。然而,由于不成熟抗原呈递细胞(apcs)的高频率以及新生儿体内存在的th2和th1 7细胞因子分布增加,据推测,在新生儿和婴儿期接种疫苗可能导致免疫功能下降,而不是对接种疫苗的新生儿产生保护。
4.已经表明,在新生儿或婴儿期施用初次剂量的疫苗可以降低对生命后期免疫增强的免疫反应,从而降低保护作用(carazo perez,s.,et al.,2017,clin infection dis.doi:10.1093/cid/cix510)。失败的疫苗接种试验也支持了这一观点,在该试验中使用能够产生良好抗体免疫反应但没有细胞毒性反应的佐剂已经导致婴儿呼吸道合胞病毒(rsv)疫苗完全失败。此外,已有报道,使用明矾基佐剂增加了新生儿潜在不良反应的风险(shaw,c.a.和l.tomljenovic.2013,immunol res 56(2-3):304-16.doi:10.1007/sl2026-013-8403-1)。还已表明,这些佐剂并不产生细胞毒性t淋巴细胞(ctl)或产生得非常少。在这方面,进而证明ctl能够抑制rsv疫苗增强疾病(olson,m.r.和s.m.varga.2007,j immunol 179(8):5415-24);值得注意的是,ctl是新生儿中几种具有功能的免疫反应特征之一,并且可以通过接种疫苗来增强(参见hermann,e.等人,2002,blood 100(6):2153-8)。因此,在促进th1和ctl反应的同时提高抗体产生的佐剂的可用性将是开发新生儿疫苗的宝贵资产。
5.关于影响疫苗,新生儿和婴儿疫苗接种是通过向6至48个月大的婴儿群体施用两剂疫苗来实现的(grohskopf,l.a.等人,2017.mmwr recomm rep 66(2):1-20.doi:10.15585/mmwr.rr6602a1),而同样的疫苗只对成人施用一次。这种婴儿缺乏免疫原性的部分原因是,基于成人免疫系统生产的疫苗存在误靶或缺乏佐剂,其中体液反应与保护相关。
从成人外推到儿童-婴儿疫苗接种环境部分解释了以前的疫苗接种失败原因。事实上,用于成人的参数和标准不适合诱导和评估早期免疫或对其不是最优的。在其他高危人群(如老年人)中进行的试验也证明了这一点。
6.wo 2014/099824a1涉及哺乳动物环二核苷酸信号通路的药物靶向性。wo 2007/054279a2公开了环二核苷酸及其共轭物作为佐剂及其在药物组合物中的用途。ebensen t.等人(2011,vaccine 29,5210-5220)表明,双-(3
′
,5
′
)-环二聚腺苷单磷酸是一种强力的th1/th2/th17促进性粘膜佐剂。ebensen t.等人(2007,vaccine,25(8),1464-1469)表明,细菌第二信使环digmp显示了有效的佐剂特性:
7.libanova m.等人(2010,vaccine,28,2249-2258)描述了环二核苷酸家族成员双-(3
′
,5
′
)环二聚肌苷单磷酸作为粘膜佐剂发挥了有效的活性。
8.也就是说,目前迫切需要针对新生儿和婴儿疫苗接种的疫苗策略来解决反应性和缺乏免疫原性的问题。特别地,需要为新生儿和婴儿疫苗接种定制新的佐剂。这一点尤其如此,因为用于成人的参数和标准不适合诱导和评估早期免疫或对其不是最佳的。新生儿和婴儿的免疫系统的特点是母体抗体和单纯生成新生儿和婴儿的t细胞和b细胞记忆,因此,与年龄较大的儿童和成人相比,通过接种该人群获得足够的适应性免疫。
9.目前,儿童免疫接种计划从出生后第一个月内开始接种乙型肝炎疫苗,出生后两个月后继续进行疫苗接种。
10.几乎所有的疫苗都通过诱导血清或粘膜抗体来起作用,尤其是在缺乏在先的抗原暴露而限制t细胞反应有效性的婴幼儿如此。新生儿apc对多种刺激的反应受损是开发感染性新生儿疫苗需要克服的关键障碍。
11.目前,疫苗市场上只有一种用于新生儿施用的乙型肝炎疫苗。给予出生剂量的无硫柳汞单价乙型肝炎疫苗是为了防止乙型肝炎病毒(hbv)从携带者母亲垂直传播,同时也防止携带者在出生后的头几个月在家庭或其他与hbv密切接触的人群中横向传播。当新生儿生理稳定时,优选在出生后24小时内,通过肌肉注射给予出生剂量。佐剂在疫苗开发中很重要。然而,对成人有效的佐剂可能不需要激活早期免疫系统的特定要求。在一些研究中,不同佐剂的新生儿佐剂性包括tlr4(吡喃葡糖基脂质佐剂角鲨烯乳剂)、tlr9(ic31和caf01)激动剂,它们都是诱导生发中心(gcs),并能够刺激成年小鼠对流感血凝素(ha)的有效抗体反应。只有ha/caf01诱导显著更高和持续的体液反应,使新生儿b细胞在单次给药后已经分化为gcs。
12.对于新生儿,已证明含有简单铝盐的疫苗。最近,复合铝盐已在美国和其他国家获准用于婴儿、六周龄大的、更大儿童和成人的疫苗。然而,这些分子没有在新生儿身上进行测试,或者在新生儿条件下没有有效的使用方法。
13.环二核苷酸(cdn)被描述为免疫调节免疫反应中有用的佐剂。例如,ep 1 959 989 b1描述了使用环二核苷酸作为治疗性或预防性疫苗接种的佐剂。此外,其他环状二核苷酸作为免疫调节组分已有十多年的历史。cdn也被描述为代表治疗各种疾病的积极原则。
14.描述了环二磷酸腺苷(cda)的变体,包括硫代磷酸盐衍生物。例如,存在gsk的产品adus 100,即一种c-di-amp的硫代二磷酸盐类似物,也称为c-di-amp(rprp)。此外,描述了本领域中的氟化c-di-amp。不仅描述了c-di-amp的类似化合物,还描述了c-di-gmp的类似化合物或c-di-agmp组合。
15.然而,大多数市售cdn的问题在于体内长期维持的问题,因为这些化合物并不是自然代谢的。这不仅是目前市售cdn化合物的问题,也是其他佐剂存在的问题。例如,明矾,一种非常古老的公知佐剂,由于是被封装的,所以保留在疫苗接种者体内,因此在多年后仍能在疫苗接种者体内检测到明矾。
16.因此,需要疫苗接种策略和化合物,以允许对未出生的儿童、新生儿和婴儿接种促进免疫反应的适当组合物,尤其是适当的佐剂。
技术实现要素:
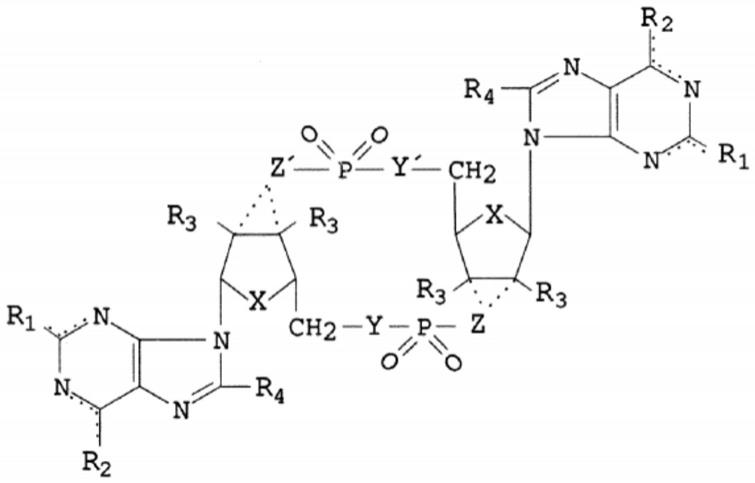
17.在第一方面,本发明涉及一种式(i)化合物:
[0018][0019]
其中
[0020]
x彼此独立地选自s、n、o、ch2;
[0021]
y、y’彼此独立地选自nh、ch2、o;
[0022]
z、z’彼此独立地选自nh、ch2、o;
[0023]
r1彼此独立地选自氢或o或不存在;
[0024]
r2彼此独立地选自nh2、o、h或氢;
[0025]
如果z或z’与c原子之间存在共价键,或为氢、oh、卤素、直链或支链c
1-c6烷基,或可任选被取代的直链或支链c
1-c6烷氧基,则r3彼此独立地不存在;
[0026]
r4彼此独立地选自氢、卤素或可任选被取代的直链或支链c
1-c6烷基;
[0027]
...是单键或双键;
[0028]
或其缀合物,及其盐或溶剂化物,用于诱导或促进个体免疫反应的方法,其中所述个体为未出生儿、新生儿或婴儿。
[0029]
具体而言,本发明涉及c-di-amp(cda)作为佐剂在疾病预防性或治疗性治疗中的用途,尤其是在新生儿或婴儿的治疗性或预防性疫苗接种中的用途。在另一方面,本发明涉及包含根据式i的环二核苷酸(特别是cda)的药物组合物。该药物组合物特别可用作未出生儿、新生儿和婴儿的疫苗。
[0030]
最后,本发明包括试剂盒及其用途,所述试剂盒包括作为佐剂的根据本发明的式i
的cdn、包含作为活性疫苗接种成分的抗原结构的抗原,以及任选的药学上可接受载体、稀释剂、防腐剂、佐剂、本发明中定义的其他化合物、免疫调节剂或赋形剂。
[0031]
此外,本发明描述了在疾病的预防性或治疗性治疗期间或作为治疗性或预防性疫苗接种期间诱导或促进免疫反应的方法。所述方法包括向个体(即未出生儿、新生儿或婴儿)施用式i化合物(尤其是cda)作为佐剂的步骤,具体而言,施用该化合物的用途是佐剂与抗原的组合。
附图说明
[0032]
图1:小鼠抗原特异性细胞因子对新生儿接种不同佐剂的反应。a)使用ova抗原和佐剂(r848和cda)的不同疫苗接种策略。新生小鼠接受一次首剂(6-9天大),然后接受两次增强剂量(左图,新生儿首剂+2次增强)。或者,跳过新生儿首剂(中图,幼儿首剂+增强)或成年小鼠接受三剂(右图,成年首剂+2次增强)。b)venn图,描绘了在体外重新刺激脾细胞和表面及细胞内细胞因子染色后通过流式细胞术测量的数百万细胞产生cd4 t淋巴细胞细胞因子的数量。白色数字为四倍和三倍细胞因子产生者,被视为疫苗效力的指标(即il-2、ifn-g和tnf-a的产生者)。a)中描述的处理方法与下栏中的图表相对应,其在该处为r848或cda佐剂。c)venn图,描绘了单个或多个细胞内细胞因子染色阳性的cd8 t淋巴细胞数量。白细胞数是分析的数百万细胞的四倍或三倍细胞因子产生者。结果为每组3-5只小鼠的平均值。
[0033]
图2:新生儿接种cda疫苗诱导b细胞活化和成熟。初始剂量后新生小鼠活化b细胞的百分比。a)来自cda+ova或单独接种ova的wt(b6)或ifnar1-/-(ifn受体ko)小鼠的cd69+b细胞或b)cd86+b细胞的频率,以确定b细胞成熟对cda诱导的ifn-a/b的依赖性。结果来自3个独立实验中的一个代表性实验。通过非配对学生t检验,差异不显著(p<0.05)。
[0034]
图3:新生儿接种cda疫苗对成年小鼠具有保护作用。
[0035]
经鼻接种cda+ova、r848+ova、ova或pbs(对照)的小鼠经受h1n1 pr8流感a/wsn/33(wsn)-ova(i)病毒105pfu攻击,该病毒在血凝素结构域中表达siinfekl肽。a)从攻击(challenge)前采集的血液用elisa法测量血清中的抗原特异性igg。作为新生儿接种cda+ova疫苗的小鼠显示出比其他疫苗接种显著更高的滴度。b)在感染后的14天内,记录体重减轻情况,作为保护的反向相关物,其中只在pbs组和r848组中发现死亡动物(图b中的反向交叉)。c)在cda+ova疫苗接种动物和其他治疗组之间的48小时最大体重减轻组间的差异显著。经非配对t检验,差异显著(p<0.05)。结果为来自两个实验中的一个代表性实验的每组3-5只小鼠的平均值。
具体实施方式
[0036]
在第一方面,本发明涉及一种式(i)化合物:
[0037][0038]
其中
[0039]
x彼此独立地选自s、n、o、ch2;
[0040]
y、y’彼此独立地选自nh、ch2、o;
[0041]
z、z’彼此独立地选自nh、ch2、o;
[0042]
r1彼此独立地选自氢或o或不存在;
[0043]
r2彼此独立地选自nh2、o、h或氢;
[0044]
如果z或z’与c原子之间存在共价键,或为氢、oh、卤素、直链或支链c
1-c6烷基,或可任选被取代的直链或支链c
1-c6烷氧基,则r3彼此独立地不存在;
[0045]
r4彼此独立地选自氢、卤素或可任选被取代的直链或支链c
1-c6烷基;
[0046]
...是单键或双键;
[0047]
或其缀合物,及其盐或溶剂化物,用于诱导或促进个体免疫反应的方法,其中所述个体为未出生儿、新生儿或婴儿。
[0048]
如本文所用的,术语
″
新生儿
″
指新生儿个体。在人类中,新生儿是指从出生到六个月大的新生儿。
[0049]
如本文所用的,术语
″
婴儿
″
指年轻的个体(儿童)。在人类中,婴儿是指6个月至6岁的儿童。
[0050]
如本文所用的,术语
″
(多个)未出生儿
″
是指尚未出生但在其母亲子宫内的个体。
[0051]
优选地,个体是人。
[0052]
术语
″
佐剂
″
是指在对活性抗原的免疫过程中添加和/或共同配制的物质,即激发所需免疫反应以增强或诱导或调节针对活性抗原的体液和/或细胞介导(细胞)免疫反应的物质。优选地,如本文所述的,佐剂能够增强或诱导先天免疫反应。
[0053]
术语
″
治疗
″
或
″
治疗
″
是指旨在对个体(如哺乳动物,例如人(通常称为患者)或动物)的状况产生有益变化的过程。例如,有益的改变可以包括以下一项或多项:功能恢复、症状减轻、疾病、紊乱或症状进展的限制或延迟或预防、限制或延迟患者症状、疾病或紊乱的恶化。这类治疗通常包括给药等。
[0054]
特别地,治疗或处理包括个体接种疫苗。
[0055]
如本文所用的,术语
″
聚乙二醇化
″
是指化合物部分与包含至少一个聚亚烷基单元的共轭部分的共轭,具体而言,术语聚乙二醇化是指化合物部分与具有至少一个聚乙二醇单元的共轭部分的共轭。
[0056]
如本文所用的,术语
″
共轭物
″
是指包含共轭部分和化合物部分的化合物。该化合物部分为式(i)中的任一种。术语
″
共轭部分
″
是指连接到化合物式(i)的部分。共轭部分旨在增加本文所公开化合物的适用性。
[0057]
如本文所用,术语
″
抗原结构
″
或
″
抗原
″
是指能够引起细胞或体液免疫反应的结构。抗原结构也称为表位,是由mhc或mhc样分子呈现的抗原部分。此外,表位或抗原结构代表由针对所述抗原的抗体所识别的抗原部分。
[0058]
如本文所用,术语
″
调节免疫反应
″
、
″
诱导免疫反应
″
或
″
促进免疫反应
″
是指免疫反应的当前状态的任何变化。免疫反应可被调节、诱导或促进,从而诱导反应或增强或降低预先存在的免疫反应。此外,可通过将免疫反应从更具体液性的免疫反应转变为更具细胞性的免疫反应(或反之亦然)来调节、诱导或促进免疫反应。
[0059]
此外,免疫反应的调节、诱导或促进可包括先天免疫反应的激活或增强。
[0060]
如本文所用的,本文中可互换使用的术语
″
个体
″
或
″
受试者
″
是指需要治疗或预防的新生儿或婴儿。优选地,受试者是哺乳动物,尤其优选人类。术语
″
动物
″
不包括术语
″
人
″
。
[0061]
如本文所用的,术语
″
载体
″
是指稀释剂、佐剂(除本文所述的式(i)的佐剂之外)、赋形剂或载剂。
[0062]
术语
″
可被取代
″
是指用直链或支链c1至c6烷基或直链或支链c1至c6烷氧基和/或卤素、羟基或羧基取代。
[0063]
在一个实施方案中,根据式(i)的化合物为c-di-amp。在另一个实施方案中,该化合物为式(i)化合物的共轭物,即c-di-amp的共轭物,其共轭部分为甲氧基聚乙二醇羰基残基。
[0064]
如本文所用的,术语
″
cdn
″
或
″
环状二核苷酸
″
是指式(i)化合物,除非另有说明。
[0065]
如本文所用的,术语
″
cda
″
指环状di-amp或c-di-amp,除非另有说明。具体而言,cda或c-di-amp是指非氟代和/或非硫代cda分子。
[0066]
磷酸盐和糖部分之间的键可通过糖残基的c3原子(3’)或c2原子(2’)连接。即,根据式(i)的化合物可为2’,2
’‑
cdn、3’,2
’‑
cdn、2’,3
’‑
cdn或3’,3
’‑
cdn,例如2’,2
’‑
c-di-amp、3’,2
’‑
c-di-amp、2’,3
’‑
c-di-amp或3’,3
’‑
c-di-amp。在式(i)中,z或z’与糖部分位置2和3处的o之间的虚线表明可能存在或不存在共价键。键合是通过糖部分的c2或c3原子进行的。当磷酸根部分通过c3原子键合时,在c3处不存在r3,在c2处存在r3。也就是说,r3存在于未与磷酸根部分连接的c原子处。
[0067]
在本发明的一个实施方案中,根据本发明的化合物用作疾病预防或治疗中的佐剂。在这方面,疾病的预防性治疗尤其指疫苗接种的实施方案。即,根据本发明的化合物用于未出生儿、新生儿或婴儿的治疗性或预防性疫苗接种。
[0068]
出乎意料地,本发明人认识到,根据本发明的化合物可用于激发、诱导或促进未出生儿、新生儿或婴儿的免疫反应。即,首次证明根据本发明的cdn,即根据式(i)的化合物,尤其是cda在人类未出生儿、新生儿和婴儿中获得佐剂免疫原性。在实施例中证明,cda对人脐血来源的细胞具有刺激能力,并且cda佐剂配方在新生儿模型中的免疫原性和效力优于
r848(代表新生儿佐剂的金标准)。
[0069]
具体而言,与其他已知佐剂如c-gamp相比,式(i)cdn在未出生儿、新生儿和婴儿体内诱发实质性免疫反应。此外,已知根据本发明的化合物代表在人体内代谢的化合物,因此,不代表对个体有胁迫的化合物,在包括明矾或氟代或硫代cdn在内的其他佐剂中也是如此。
[0070]
在另一个实施方案中,本发明涉及根据本发明用作粘膜佐剂的化合物,特别是用于鼻内、nalt内(intra-rectal)、口服、直肠内、滤泡内、经滤泡内、肺内、支气管内、鞘内、结膜内、阴道内或尿道内施用,经乳管或吸入给药。
[0071]
或者,根据本发明的化合物用于肠胃外施用,特别是皮下、静脉、皮内、滤泡内或肌肉内施用。
[0072]
技术人员清楚地知道适当的施用重量和所需剂量。这对于根据本发明待治疗的个体即新生儿和婴儿尤其如此。
[0073]
在未出生儿的情况下,例如,通过脐带或其他合适的方式对孕妇进行施用。
[0074]
在一个实施方案中,该化合物是式i化合物与共轭部分的共轭物,该共轭部分为水溶性和生理耐受性聚合物。
[0075]
具体而言,如本文指出的共轭物的共轭部分可优选包含以下式的至少一个聚亚烷基二醇单元的共轭部分:
[0076]
x
1-[(chr
11
)
x-o]
n-(z)
y-[0077]
其中
[0078]
x1是氢或烃,其可含有杂原子;例如c1-c6烷氧基
[0079]
z是二价连接基团,例如c=o或chr
11
;
[0080]r11
独立地为氢、oh、or
12
或co-r
13
中的任何一种;
[0081]r12
独立地为氢或直链或支链c1-c6烷基链中的任何一种;
[0082]r13
独立地为氢、oh、or
12
或nr
14r15
中的任何一种;
[0083]r14
和r
15
独立地为氢或可含有杂原子且可形成环的烃中的任何一种;
[0084]
n为1至100的整数;
[0085]
x独立地为1至10的整数;
[0086]
y为0至10的整数。
[0087]
n可以优选为2至50的整数,如2至10,特别是3至5。
[0088]
x可以优选为2、3或4的整数,特别是2。
[0089]
y可以优选为1至5的整数,特别是1至3,在另一优选实施例中,y可以优选为0。
[0090]
x1可以优选为0r
16
、n(r
16
)2、sr
16
或coor
16
,其中每个r
16
各自为氢、苄基或直链或支链c
1-c6烷基链。优选地,x1为c
1-c6直链或支链烷氧基,如甲氧基、乙氧基或丙氧基。
[0091]
r11可优选为氢原子。
[0092]
因此,上述聚亚烷基乙二醇单元可优选包含乙二醇、丙二醇或丁二醇的亚单元-[(chr
11
)x-o]n或其组合。每个聚亚烷基乙二醇单元的链长可在1到100个亚单元的范围内,优选2到50个亚单元,例如2到10个亚单元,尤其是在3到5个亚单元的范围内。
[0093]
特别优选地,共轭部分可以是甲氧基聚亚烷基乙二醇-羰基残基,其中亚烷基部分是乙烯或丙烯部分。
[0094]
因此,优选地,共轭物可以为聚乙二醇化形式,以增加在亲水性溶剂和亲水性环境中的溶解度。此外,共轭部分允许保护化合物部分,即活性粘膜佐剂部分,防止酶降解、由于ph值变化引起的结构修饰、机械去除等。因此,主要增加化合物的稳定性。共轭的另一个有益效果是增加个体体内的保留时间,例如延迟肾脏排泄,同时所述生物体具有良好的耐受性,例如非免疫原性。此外,所述共轭物,尤其是聚乙二醇化共轭物提高所述化合物的生物利用度,并允许减少给个体施用的剂量。
[0095]
具体而言,共轭部分可包含至少两条具有聚亚烷基乙二醇单元的链。也就是说,共轭物可以是支链化合物,其中每个臂包含聚亚烷基乙二醇单元。特别优选其中聚亚烷基二醇单元为聚乙烯、聚丙烯或聚丁烯二醇单元的共轭部分。
[0096]
在特别优选的实施方案中,根据式(i)的化合物部分可优选地与共轭部分共价连接,共轭部分为支链部分,其中至少两个臂含有聚乙二醇单元,该聚乙二醇单元具有3到5个乙二醇亚基,并且在聚乙烯基的自由端具有甲氧基。具体而言,支链部分包括4或6个臂,每个臂具有3个乙二醇亚基和聚乙二醇自由端的甲氧基。
[0097]
具体而言,共轭物的特征在于,共轭部分为4臂peg((s)-10-氨基-6,9,13,16-四氧基-n,n’,8,14-四氧基-1-基)-5,8,14,17-四氮杂蒽-1,21-二胺)、6臂peg或8臂peg,另见wo 2004/108634 a2。
[0098]
共轭部分可包含聚亚烷基乙二醇单元,该单元是连接两个或多个根据本发明的环状二核苷酸化合物的连接基团。优选地,聚亚烷基乙二醇单元是包含2到20个乙二醇亚单元如4、6、8、10或12个亚单元的聚乙烯单元。
[0099]
式(i)化合物或其共轭物可为其药学上可接受的无毒盐的形式。式(i)的盐包括添加酸的盐,例如与无机酸(如盐酸、硫酸、硝酸和磷酸)或有机酸(例如乙酸、丙酸、马来酸、油酸、棕榈酸、柠檬酸、琥珀酸、酒石酸、富马酸、谷氨酸、泛酸、十二烷基磺酸、甲磺酸和邻苯二甲酸)的盐。
[0100]
此外,根据本发明使用的化合物为根据式(i)的化合物,其中嘌呤残基为腺嘌呤、黄嘌呤或次黄嘌呤残基或其组合,具体而言,两种嘌呤残基均为腺嘌呤。
[0101]
此外,在本发明的一个实施方案中,化合物为式(i)化合物,其中r3为oh基团,x为氧原子,y、y’、z和z’为氧。
[0102]
特别优选的是,根据本发明的有用化合物为式(i)化合物,其为环状双(3
’‑5’
)二烯基酸(环状di-amp或cda)、c-di-imp或c-iamp、或其盐或溶剂化物、或其共轭物、或所述化合物的组合。值得注意的是,根据本发明还可以使用环状di-amp硫代磷酸盐、c-di-imp硫代磷酸盐和c-iamp硫代磷酸盐或其盐或溶剂化物、或其共轭物、或所述化合物的组合。
[0103]
在另一方面,本发明涉及一种药物组合物,其包含如本文中所定义的式(i)化合物作为根据本发明使用的佐剂、药物活性成分和任选的药学上可接受的载体、稀释剂、防腐剂、除本文定义的式(i)化合物之外的佐剂、免疫调节剂或赋形剂。例如,活性成分是活性疫苗成分,其包含包如下形式的至少一种或多种不同抗原:肽、蛋白质、多糖、糖脂或编码它们的dna或细菌菌蜕、病毒体或减毒疫苗或其混合物。
[0104]
优选地,抗原是肿瘤抗原或源自传染源的抗原。传染源包括通常通过穿过粘膜进入个体机体的传染源。
[0105]
包含根据本发明的佐剂、活性疫苗组分、任选附加载体、稀释剂、防腐剂、除根据本
发明的佐剂以外的佐剂、免疫调节剂或赋形剂的药物组合物可另外包含组分、类似化合物如一种或多种抗炎分子、抗血管生成分子、细胞毒性分子、免疫调节分子,优选趋化因子、细胞因子、cd40配体、共刺激分子或抗体或其混合物。
[0106]
然而,如本文所定义的用作佐剂的式(i)化合物、其共轭盐及其溶剂化物也可以是在适合于肠胃外给药(尤其是皮下、静脉、皮内或肌肉内给药)的制剂中提供的药物组合物的组分。
[0107]
此外,根据本发明的化合物和共轭物可用于肿瘤治疗,包括用于肿瘤治疗和移植中过继细胞转移的自体细胞的体外产生或体外引发。此外,佐剂可用于诱导对微生物组分(如内毒素)的交叉耐受,以防止感染性休克或由微生物组分诱发的其他严重形式的疾病。
[0108]
如本文所述的,可使用生理上可接受的载体向患者施用药物组合物。在特定实施例中,术语
″
药学上可接受
″
指经监管机构或其他公认药典批准用于动物,尤其是用于人类。术语
″
载体(carrier)
″
指用于施用治疗药物的稀释剂、佐剂、赋形剂或媒介(vehicle)。这种药物载体(carrier)可以是无菌液体,例如水和油,包括石油、动物、植物或合成来源的油,如花生油、大豆油、矿物油、芝麻油等。当药物组合物经静脉施用时,水是优选的载体。盐水溶液和葡萄糖和甘油水溶液也可用作液体载体,尤其是可注射溶液。合适的药用赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙烯、乙二醇、水、乙醇等。如果需要,该组合物还可含有少量润湿剂或乳化剂或ph缓冲剂。这些组合物可以采取溶液、悬浮液、乳液、片剂、药丸、胶囊、粉末、缓释制剂等形式。该组合物可用传统粘合剂和载体(如甘油三酯)配制成栓剂。口服制剂可包括标准载体,如药物级甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、镁、碳酸盐等。e.w.martin的
″
雷明顿药学
″
(第18版,mack出版公司,宾夕法尼亚州伊斯顿(1990))中描述了合适的药物载体示例。药品应与施用模式相适应。
[0109]
典型地,药学上或治疗上可接受的载体是不干扰活性成分的生物活性的有效性且对宿主或患者无毒的载体介质。
[0110]
在另一优选实施方案中,根据常规程序将该组合物配制成适于向人类静脉施用的药物组合物。通常,用于静脉施用的组合物是无菌等渗水缓冲液中的溶液。必要时,该组合物还可包括溶解剂和局部麻醉剂(例如利多卡因),以缓解注射部位的疼痛。通常,成分以单位剂型单独供应或混合供应,例如,作为干燥的冻干粉末或无水浓缩物,置于气密性容器如指示活性剂的量的安瓿或香囊中。在通过输液施用组合物的情况下,可使用含有无菌药物级水或生理盐水的输液瓶进行配药。在通过注射施用组合物的情况下,可提供一安瓿无菌注射用水或生理盐水,以便在施用前混合成分。
[0111]
用于本发明的药物组合物可配制成中性或盐形式。药学上可接受的盐包括与阴离子如源自盐酸、磷酸、乙酸、草酸、酒石酸等的阴离子形成的盐,以及与阳离子如源自钠、钾、铵、钙、氢氧化铁、异丙胺、三乙胺、2-乙基氨基乙醇、组氨酸、普鲁卡因等的阳离子形成的盐。
[0112]
应用于本发明组合物的
″
治疗或药学有效量
″
是指足以诱导所需生物结果的组合物的量。该结果可以缓解疾病的体征、症状或病因,或任何其他生物学系统的期望变化。在本发明中,结果通常涉及对感染的免疫反应增加或对炎症过程的反应得到抑制。
[0113]
可选地,体外分析可用于帮助确定最佳剂量范围。配方中使用的精确剂量还取决
于给药途径和疾病或紊乱的严重程度,并应根据医生的判断和每位患者的情况决定。有效剂量可根据体外或动物模型试验系统得出的剂量-反应曲线外推获得。优选地,直接施用或与佐剂组合施用药物组合物。
[0114]
术语
″
施用
″
是指向个体施用治疗有效剂量的上述药物组合物。
″
治疗有效量
″
是指产生所给效果的剂量。确切剂量将取决于治疗目的,并且将由本领域技术人员使用已知技术来确定。如本领域所知和上文所述的,可能需要对全身与局部给药、年龄、体重、一般健康、性别、饮食、施用时间、药物相互作用和病情严重程度进行调整,并且将通过本领域技术人员的常规实验来确定。
[0115]
此外,所述药物组合物可另外包含组分,例如一种或多种抗炎分子、抗血管生成分子、细胞毒性分子、免疫调节分子等化合物,优选趋化因子、细胞因子、cd40配体、共刺激分子或抗体或其混合物。
[0116]
此外,本文所述的药物组合物的特征在于,药物组合物的组分与物理粒子(优选微粒、纳米粒子、脂质体、iscom、共聚物和/或生物粒子,优选细菌鬼魂)相结合和/或并入和/或包覆。
[0117]
根据本发明的药物或根据本发明的供使用的化合物可在适用于人类治疗和兽医应用的方法中使用,特别是用于人类应用的方法中。如本文所述的,具有所需治疗活性的用于本文所述用途的化合物可以如本文所述以生理上可接受的载体施用至患者。根据引入方式的不同,化合物可以如下所述以多种方式配制。制剂中治疗活性化合物的浓度可在约0.1-100wt%之间变化。在治疗性或预防性疫苗接种中用作佐剂的药剂可单独施用或与其他治疗组合施用。
[0118]
如上文所述,可通过多种方式施用药物组合物,包括但不限于口服、皮下、静脉内、动脉内、血管内、髓内、鞘内、脑室内、鼻内、结膜、支气管内、经皮、直肠内、腹腔内、肌肉内、肺内、阴道内、直肠内或眼内。在一些实例中,例如,在伤口和炎症的治疗中,药学有效剂可直接作为溶液干喷剂施用。
[0119]
主治医师和临床因素将决定给药方案。例如,典型剂量可在0.001至1000μg范围内;然而,设想低于或高于该示例性范围的剂量,特别是考虑到上述因素的情况下如此。
[0120]
在另一方面,本发明涉及该化合物或本文所定义的用于控制人类或动物群体生育能力的药物制剂中的盐或其溶剂化物的用途。
[0121]
最后,本发明涉及包含根据本发明的化合物或其盐或溶剂化物作为佐剂和抗原的试剂盒,所述抗原包含抗原结构和任选的药学上可接受的载体、稀释剂、防腐剂、根据本发明的共轭物之外的佐剂、免疫调节剂或赋形剂以及用于制备疫苗的说明书。
[0122]
在本发明的一个实施方案中,如本文所定义的用于使用的药物组合物是用作新生儿和婴儿疫苗的药物组合物。
[0123]
在一个实施方案中,活性成分为抗原,抗原为肿瘤抗原或源自传染源的抗原,用于预防或治疗传染病、感染性休克、癌症、肿瘤、自身免疫性疾病、过敏或慢性或急性炎症过程。
[0124]
在另一实施方案中,所述药物组合物是如本文所定义的供使用的药物组合物,其中所述方法中的所述用途还包括当所述疫苗包含一种或多种选择用于刺激的抗原以及对表达一种或多种抗原的病原体的免疫反应时向受试者施用一种或多种疫苗。
[0125]
根据本发明的药物组合物可以是包含灭活或减毒细菌或包含目标抗原的病毒、纯化抗原、重组工程化以表达和/或分泌抗原的活病毒或细菌递送载体的疫苗、包含装载抗原或转染含有编码抗原的核酸的组合物的细胞抗原呈递细胞(apc)载体、脂质体抗原递送载体或编码抗原的裸核酸载粒。
[0126]
根据本发明的药物组合物在一个实施方案中是一种联合的组合物,用于同时、单独或顺序地预防或治疗传染病、癌症、肿瘤、自身免疫疾病或过敏或慢性或急性炎症过程,或用于控制人类或动物群体的生育能力。
[0127]
此外,本发明涉及一种试剂盒,其包含如本文所定义的式(i)化合物作为佐剂、抗原或抗原组合物,所述抗原或抗原组合物包含作为活性成分的抗原结构,特别是作为活性疫苗接种组分的抗原结构,以及任选的医药上可接受的载体、稀释剂、防腐剂,除本文定义的通式(i)化合物以外的佐剂、免疫调节剂或赋形剂。
[0128]
最后,本发明描述了通过接种预防性或治疗性治疗未出生儿、新生儿和婴儿的方法。所述方法包括将根据式i的化合物,尤其是cda,投与未出生的婴儿或新生儿,作为用活性成分治疗所述未出生的儿童、新生儿或婴儿的佐剂的步骤,带有活性疫苗成分,用于预防或治疗未出生的婴儿、新生儿或婴儿,特别是用于疫苗接种目的。
[0129]
本技术人员清楚地知道施用所述组分的合适剂量和方法。
[0130]
如前所述,该方法可包括治疗孕妇的未出生婴儿。技术人员了解适当的规则和相应的剂量。
[0131]
本发明的描述和示例公开并涵盖了这些和其他实施例。在不限制本发明的情况下,将通过示例的方式进一步描述本发明。
[0132]
实施例
[0133]
方法
[0134]
动物
[0135]
wt c57bl/6和ifnarl-/-小鼠在亥姆霍兹感染研究中心(hzi)培育。所有动物均为c57bl/6背景,并在特定的无病原体条件下饲养。所有实验均按照《德国动物保护法》(tierschg bgbi.i s 1105;25.05.1998)进行,并经下萨克森州动物实验伦理委员会以及负责的州办公室(下萨克森州消费者保护和食品安全办公室)批准,许可证编号为33.11.42502-04-105/07和33.4-42502-04-13/1281。
[0136]
成人和脐血
[0137]
从健康志愿者中采集成人外周血作为对照。脐血是在妇女诊所(布伦瑞克中央医院)健康新生儿捐献者分娩后立即通过脐带静脉穿刺获得的。
[0138]
已获得父母签署的知情同意书,确保我们的研究不涉及对所含遗传物质的进一步修改或治疗用途。枸橼酸盐抗凝脐血袋(法国macopharma)在体外试验前储存在室温下。
[0139]
使用人类血液的体外检测
[0140]
成人或脐带血与37℃热rpmi 1640培养基(gibco)以1∶1混合,并根据前述方法(dowling,d.j.等人,2013,plos one 8(3):e58164)与佐剂和对照物一起孵育。简而言之,将20μl佐剂10x分四次添加到180μl稀释血液中(在96u形孔板中),并在37℃、5%co2下培养6h。通过流式细胞术在多重阵列(biolegend)或用于il-1β的elisa读卡器(ebioscience)中对上清液进行分析。
[0141]
疫苗接种
[0142]
我们评估了cda在粘膜或皮下接种疫苗后促进新生儿抗原特异性免疫反应的能力。为此目的,小鼠用首剂/增强方案(两次增强剂量)通过s.c.或i.n.途径进行免疫接种,免疫接种间隔为两周。新生儿(7-9天大)接种(6μl)cda+ova、r848+ova、单独ova或对照缓冲液。或者,跳过新生儿剂量,并在幼龄时(21-23天)给予首剂,以确定新生儿剂量的有效性。在一个不同的测试b细胞活化环境中,新生小鼠接种一次,并在接种后14天取样。小鼠接受的剂量包括20μg ova(endograde,hyglos gmbh,德国)和7.5μg cda(invivogen,法国)。对照组接受pbs(hyglos,德国)。间隔2-3周后,对接种疫苗的小鼠进行t细胞反应测试或进行病原体攻击(每组n=3-5,实验总是进行两次)。
[0143]
淋巴细胞分离、细胞内细胞因子染色
[0144]
在细胞过滤器上通过机械破坏使脾脏和ln均质化。红细胞用ack缓冲液溶解。用pbs洗涤淋巴细胞,并通过ls柱(miltenyi,德国)上的阳性选择或体外再刺激对随后的亚群分离进行计数。对于细胞内细胞因子染色,淋巴细胞在抗原(ova,20μg/ml)或培养基(对照)存在下培养过夜。在抗原刺激的最后6小时内,用布雷费尔丁(5μg/ml)和莫能菌素(6μg/ml)处理细胞。在4℃条件下,用表面受体特异性抗体和活/死细胞标记物对细胞进行30分钟染色(见下面的试剂)。然后在pbs中洗涤细胞,在1%多聚甲醛中固定,并在4℃下用0.5%皂甙和0.5%牛血清白蛋白(bsa)在pbs中渗透1小时。在4℃下用细胞因子特异性抗体(见试剂)在渗透溶液中进行细胞内染色45分钟。
[0145]
病毒攻击(viral challenge)
[0146]
在麻醉(异氟醚)作用下,接种疫苗的动物和对照组接受h1 n1 pr8流感a/wsn/33(wsn)-ova(i)菌株的105pfu注射,该菌株在血凝素内表达来自ova的mhcl类限制性siinfekl免疫显性肽(topham,d.j.等人,2001,j immunol 167(12):6983-90)。在感染后的最初12-15天内,每天监测体重和健康参数(如立毛和运动能力)。
[0147]
数据处理
[0148]
通过facsdiva软件(bd biosciences,美国)在lsr fortessa上获取流式细胞术数据,并通过flowjo软件(flowjo,llc,美国)进行分析。其他数据使用microsoft excel和graphpad prism 5统计软件(graphpad software.inc.,美国)进行分析。通过使用graphpad prism 5的非配对student t检验对所有观察到的差异进行统计学显著性检验,p<0.05。
[0149]
试剂
[0150]
bsa购自roth(karlsruhe,德国),皂苷购自serva(heidelberg,德国),活死紫外蓝染色和cfse购自molecular probes(eugene,俄勒冈州)。抗小鼠抗体:cd3(克隆500a2,v500结合)和抗il-2(克隆jes6-5fi4,apc-cy7结合)得自bd bioscience(美国);抗cd4(克隆rm4-5,结合pe-cy7)、抗tnf-a(克隆mpg-xt22,结合percp-ef710)、抗il-4(克隆11b11,结合apc)购自ebioscience inc.(美国);抗cd8(克隆53-6.7,结合bv650)、抗ifn-γ(克隆xmg1.2,结合bv711和bv785)得自biolegend(美国)。il-1β elisa试剂盒购自affymetrix(ebioscience)。多重人类细胞因子检测试剂盒,人类th细胞因子面板legendplex购自biolegend。r848和cda购自invivogen。
[0151]
统计分析
[0152]
使用student t检验(graphpad prism)分析不同实验组之间观察到的差异的统计学显著性。差异在p<0.05时被认为是显著的。
[0153]
结果
[0154]
cda刺激来自人类脐血的细胞上的th1细胞因子谱。
[0155]
评估人类新生儿佐剂免疫原性的成熟方法之一是使用脐血作为替代物(dowling,d.j.等人,2013,plos one 8(3):e58164.doi:)。因此,为了评估新生儿cda诱导的分泌性细胞因子谱,我们将脐血和成人血在佐剂和对照物存在下培养6小时。采用基于珠的多重免疫分析阵列检测上清液中的细胞因子。我们发现,与r848或r848培养基相比,cda处理脐血时,tnf-a和ifn-y(由t辅助细胞1-th1-细胞产生的细胞因子)的浓度更高。然而,在测试成人血液时,没有观察到这些差异。我们还检测到较高浓度的il-6、il-21和il-10(属于t卯泡辅助因子-tfh-分化谱的细胞因子)。在测试成人血液时,得到了略微相似的结果。有趣的是,cda对辅助性t细胞2和17(th2和th17)产生的细胞因子的刺激比r848治疗后以及成人和脐血对照细胞中观察到的更温和。cda治疗后,th17细胞因子尤其减少,脐血样本中的il-9也略有减少,与成人血液中的其他治疗相比,这种差异更加明显。值得注意的是,cda增加了th1细胞因子的分泌,这对抵消出生时存在的th2偏倚很重要(debock,i.等人,2013,jimmunol 191(3):1231-9.doi:10.4049/jimmuol.1203288).有趣的是,通过elisa,我们发现在成人和脐血中,cda处理的血液中的促炎细胞因子如il-1b与r848相比略有下降。
[0156]
cda辅助新生儿剂量在抗原特异性t细胞中诱导多种细胞因子产生物。
[0157]
上述体外方法作为用于评估候选佐剂刺激不同类型细胞后促进的细胞因子谱的初次筛选是非常有用的。然而,它不能够准确预测佐剂的重要效应器功能,例如ctl刺激能力、靶细胞亚群和提供保护性免疫的能力。因此,对新生小鼠进行免疫,以评估cda在主动接种环境中的体内表现。为此,一组小鼠在出生后第7天(疫苗接种计划的第0天)接受新生儿首剂,然后在疫苗接种计划的第14天和第28天进行两次增强,第二组小鼠在出生后第21天(幼龄,疫苗接种计划的第14天)接受首剂,然后在第28天进行一次增强,第三组小鼠在成年时(超过8周)接受首剂,然后在14天和28天后进行两次增强(图1a)。为了评估疫苗接种的有效性,通过细胞内细胞因子染色和流式细胞术评估cd4
+
和cd8
+
t细胞群中细胞因子产生者的频率。据描述,t细胞产生多种细胞因子(尤其是il-2、ifn-γ和tnf-α)与疫苗保护效力相关(darrah,p.a.等人,2007,nat med 13(7):843-50.doi.10.1038/nml592)。因此,通过流式细胞术分析t细胞产生单个细胞因子或组合(阳性事件/百万)的频率(图1b、c)。接受r848作为
″
金标准
″
佐剂的群体也使用了相同的疫苗接种计划,该佐剂已被广泛用于促进新生儿免疫(zhang,x.,n.等人,2014年,j infect dis 210(3):424-34.doi.10.1093/infdis/jiu103)。尽管有人声称r848在新生儿中使用时能激发有效的免疫力(holbrook,b.c.等人,2017,immunology doi:10.1111/imm.12845),但我们发现,在我们的实验环境中,r848的使用并没有显著增加表达ifn-γ、tnf-α和il-2的多功能t细胞的频率。此外,当使用新生儿剂量的r848时,与跳过该剂量的治疗或成人对照组相比,产生四种分析细胞因子(ifn-γ、tnf-α、il-17和il-2)的任何可能组合的cd4
+
t细胞的存在确实减少了(图1a)。相比之下,与跳过新生儿剂量的组相比,使用新生儿剂量的cda佐剂疫苗增加了三倍、双倍和单细胞因子产生的频率。有趣的是,当使用cda作为佐剂时,新生儿首剂比后期首剂能更好地刺激多功能t细胞(图1b,上半部分)。与其他治疗相比,在第6-9天皮下(s.c.)接种卯清蛋白(ova)+
cda或明矾也会导致cda+ova接种动物的cd4
+
t细胞中产生三重细胞因子的数量增加。
[0158]
为了更准确地描述新生儿细胞免疫反应,在cd8
+
t细胞中测量细胞内细胞因子的产生。多功能cd8
+
细胞仅在小鼠接受ova+cda新生儿首剂时受到刺激(图1c左上角)。当动物成年后接种疫苗时,对任何特定细胞因子或其组合的反应都更强(图2c,右上角)。相比之下,当r848用作新生儿佐剂时,与跳过新生儿剂量的组相比,多功能cd8
+
t细胞减少。以与接受cda作为佐剂的组相似的方式,当小鼠成年后接种疫苗时,对任何考虑的细胞因子组合的反应都更强(图1c,下部)。值得注意的是,在评估新生儿首剂生成产生ifn-γ、tnf-α和il-2的多功能cd8
+
t细胞能力时,尽管这两种佐剂在成人中促进了类似的免疫反应,但在新生儿年龄时,只有cda增加了三重细胞因子产生的频率(图1b、c)。
[0159]
cda佐剂新生儿疫苗诱导b细胞活化和成熟。
[0160]
确定疫苗效力的一个关键特征也是b细胞的激活。重要的是,新生儿b细胞通过il-10感染时减轻炎症的能力受i型干扰素(ifn-α/p)调节(zhang,x.等人,2007,j exp med 204(5):1107-18.doi.1084/jem.20062013)。也有报道称,ifn-α/β对新生儿b细胞的激活和发育是必要的(jans,j.等人,2017,jallergy clin immunal 139(6):1997-2000.e4.doi:10.1016/j.jaci.2016.10.032)。为了评估cda介导的ifn-α/β生成是否对接种后的b细胞成熟是必要的,我们用cda+ova、ova单独或载体对照接种wt和ifnar1-/-新生小鼠。新生小鼠在出生后7-9天通过i.n.途径接种疫苗,并在接种后14天进行安乐死,以测量ova体外再刺激后b淋巴细胞的发育和激活。我们观察到,与所有其他治疗组相比,接种cda+ova的wt小鼠在抗原特异性再刺激脾细胞后存活的b细胞数量显著更高(数据未显示)。重要的是,与其他组相比,接种cda+ova的wt小鼠的b细胞亚群上激活标记物cd69和表面成熟标记物cd86的表达增强(图2a、b)。虽然新生儿之间的差异在统计学上不显著,但在首剂和强化疫苗接种计划后,成人中保持趋势并获得显著性。这表明,新生儿接种cda可触发b细胞激活和发育所必需的ifn-α/β依赖机制。
[0161]
新生儿cda疫苗接种可促进成年小鼠的保护性免疫反应。
[0162]
为了评估我们研究结果的生物学意义,新生小鼠接种cda作为佐剂,对照组接种r848作为对照新生儿佐剂(levy,o.等人,2004,j immunol 173(7):4627-34)。按照图2a所示的方案对小鼠进行接种,该方案包括在生命的第7天(接种计划的第0天)进行一次初始免疫,然后在接种计划的第14天和第28天进行两次强化。接种疫苗后,用表达h1n1流感病毒的重组ova肽(topham,见上图)攻击小鼠,并在感染后对小鼠进行监测14天。为了确定新生儿接种cda后体液反应是否更强,在h1n1攻击之前,在小鼠血清中测量ova特异性igg滴度。新生儿接种cda+ova可产生最高的抗原特异性igg滴度,不仅与单独接种ova和pbs对照组相比,而且与使用r848接种的小鼠中观察到的滴度相比,该滴度显著更高(图3a)。值得注意的是,对照组和r848组在攻击后每组有1只小鼠死亡;然而,仅在ova组或cda+ova组中未观察到死亡。接种cda+ova的小鼠在攻击后的14天内体重保持并增加(图3b)。相比之下,接种tlr7-8激动剂r848、单独ova或pbs的小鼠在治疗期间体重减轻,尤其是在攻击后第7天和第9天(图3b、c)。cda所提供的保护也显著高于其中跳过了新生儿剂量的基于cda的疫苗接种所提供的保护(数据未显示)。cda与其他佐剂和对照组之间的保护差异在最大体重减轻的48小时内显著(图3c)。
[0163]
讨论
[0164]
由于上呼吸道感染在出生后第一年的发病率高,以及与针疫苗接种相关的创伤,i.n.递送疫苗是一种很有吸引力的免疫策略。因此,我们使用i.n.施用的粘膜佐剂,其疫苗接种效力不限于此施用途径(也进行了皮下疫苗接种,其中我们的佐剂显示出优于明矾盐)。我们之前已经证明,cda是一种有效的自然存在的佐剂,其能够引发强烈的免疫激活,不仅导致体液反应,还导致细胞反应(ebensen,t.等人,2011年,vaccine 29(32):5210-20.doi:10.1016/j.vaccine.2011.05.02610.1016/j.vaccine.2011.05.026.epub 2011年5月25日)。细胞反应还包括诱导ctl成分,其存在和效力取决于ifn-α/β的刺激及其交叉启动能力(lirussi,d.等人,2017,ebiomedicine 22:100-111.doi:10.1016/j.ebiom.2017.07.016)。因此,与大多数疫苗佐剂相比,cda的主要优势之一是它能够产生体液抗体反应以及细胞ctl反应。在这方面,证明了新生儿apc在mhc i类抗原处理和呈递以及进一步刺激ctl反应方面具有能力。为了测定cda疫苗促进的细胞因子谱,我们在体外评估了cda刺激成人血和脐血(作为新生儿代用品)后诱导的细胞因子产生模式。我们观察到cda比对照组和r848诱导更高浓度的th1和tfh细胞因子。这些发现通过小鼠模型在体内得到进一步证实。由于婴儿疫苗接种的首剂有效性是一个有争议的问题(carazo perez等人,2017,见上文),我们测量了其中在体内跳过新生儿剂量时细胞因子分泌的差异。所获得的结果表明,虽然含有
″
金标准
″
佐剂r848的新生儿剂量对多种细胞因子产生者有负面影响,但以cda作为佐剂的新生儿剂量在作为首剂时具有有益影响。此外,我们能够证实,在cda处理的人脐血中检测到的细胞因子谱在体内为多种细胞因子产生者所保持。这种效应是cdn相对于tlr激动剂的一个优势特征,因为前者具有其信号通路和分子靶点在小鼠和人类之间保持不变,而tlr激动剂则没有。我们在这里证明,这些特性不仅在早期(新生儿期)保持不变,而且cda的性能也优于其他建议的新生儿佐剂。在评估体液反应时,我们发现,新生儿接种cda后,抗原特异性igg的滴度高于使用r848观察到的滴度。与这种增强的抗体产生一致,我们证明cda在接种疫苗后早期促进新生儿和成人年龄段b细胞的激活。cda对b细胞的激活也依赖于i型干扰素信号。除r848外,其他tlr激动剂如mpla和cpg作为新生儿佐剂也显示出良好的效果。与接受mpla或cpg作为佐剂的小鼠相比,新生儿接种cda+ova可促进更高的抗原特异性igg滴度和抗攻击性(数据未显示)。
[0165]
已有研究表明,尽管新生儿的大多数适应性免疫功能都存在缺陷,但ctl反应通常在新生儿年龄就已形成。因此,促进ctl反应产生的佐剂对于新生儿疫苗接种是非常理想的。此处的结果表明,cda能够促进保护性ctl反应,能够保护表达cd8限制性表位的转基因流感病毒,并且这种ctl反应依赖于新生儿首剂剂量的施用。在我们的实验系统中,新生儿施用tlr7/8激动剂r848作为佐剂会在免疫后产生有害影响。相比之下,cda介导的免疫刺激效应触发保护性免疫。总之,我们的数据支持cda作为新生儿佐剂的一种有前途的作用,它可以作为新生儿和婴儿疫苗的一种工具,以减少抗原负荷或实现保护性免疫所需的剂量。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1