胃肠健康组合物的制作方法
1.本发明总体涉及用于改善胃肠健康的组合物,涉及为该用途配制的营养和/或膳食补充剂,以及涉及该组合物和/或补充剂用于胃肠重编程的用途。
背景技术:
2.胃肠疾病
3.胃肠疾病和病症例如肠易激综合征(ibs)和炎性肠病(ibd)由许多不同的驱动因素包括微生物、免疫、遗传和环境因素的相互作用引起(bernstein cn,2010)。胃肠细菌的微生态失调发挥粘膜炎症、免疫破坏和粘膜损伤的下游作用(bernstein cn,2010)。ibd和ibs的胃肠病症具有共同的疾病特征,例如改变的微生物组、受损的肠功能和粘膜损伤。这两种疾病之间的区别因素是观察到的炎症水平;ibs与以慢性炎症为特征的ibd相比具有较低级炎症。目前对ibd的治疗方法是抑制炎症,目的是诱导和维持缓解。相反,治疗ibs的胃肠病学家主要治疗腹痛、腹胀和交替便秘和腹泻的症状。目前用于治疗ibd和ibs的治疗方法具有较高的治疗失败率。
4.因此,本领域对可成功治疗和/或缓解或消除ibd和ibs患者的这些病症及其症状而不遭受目前观察到的高治疗失败率的产品存在未满足的医学需求。
5.因此,本发明的一个目的是提供胃肠膳食补充剂,其可以至少以某种方式致力于解决这种未满足的需求和/或将至少向公众提供有用的选择。
6.在参考专利说明书、其它外部文件或其它信息源的本说明书中,这通常是出于提供讨论本发明特征的上下文的目的。除非另外具体说明,否则对这些外部文件的引用不应被解释为承认这些文件或这些信息源在任何权限中是现有技术或形成本领域公知常识的一部分。
技术实现要素:
7.在一个方面,本发明涉及包括以下组分的组合物:
8.(a)菠萝蛋白酶,
9.(b)一种或多种scfa或其酯,
10.(c)l-苏氨酸,和
11.(d)维生素d或其代谢物。
12.另一方面,本发明涉及包括约1至约10g本发明组合物的口服剂型。
13.另一方面,本发明涉及基本上由本发明的组合物组成的口服剂型,其中组合物的至少两种组分包括在延迟释放制剂中。
14.在另一方面,本发明涉及预防、治疗或控制ibd或ibs的方法,其包括向有需要的受试对象施用治疗有效量的本发明的组合物或口服剂型。
15.在另一方面,本发明涉及至少部分缓解ibd或ibs的至少一种症状的方法,其包括向有需要的受试对象施用治疗有效量的本发明的组合物或口服剂型。
16.在另一方面,本发明涉及改善与ibd或ibs相关的至少一种参数的方法,其包括向有需要的受试对象施用治疗有效量的本发明的组合物或口服剂型。
17.在另一方面,本发明涉及减少细菌附着至有需要的受试对象的胃肠道细胞的方法,其包括使细菌与有效量的本发明的组合物或口服剂型接触。
18.在另一方面,本发明涉及减少细菌侵入有需要的受试对象的胃肠道细胞的方法,其包括使细菌与有效量的本发明的组合物或口服剂型接触。
19.在另一方面,本发明涉及在有需要的受试对象中增加胃肠粘膜层的方法,包括向受试对象施用治疗有效量的本发明的组合物或口服剂型。
20.在另一方面,本发明涉及改善有需要的受试对象的胃肠屏障完整性的方法,其包括向受试对象施用治疗有效量的本发明的组合物。
21.在另一方面,本发明涉及恢复有需要的受试对象的微生物组的体内稳态的方法,其包括向受试对象施用治疗有效量的本发明的组合物。
22.在另一方面,本发明涉及治疗有需要的受试对象的胃肠炎症的方法,其包括向受试对象施用治疗有效量的本发明的组合物。
23.本发明的其它方面可从以下仅作为示例并参考附图给出的描述中变得显而易见。
附图说明
24.现在将仅通过示例并参考附图来描述本发明,其中:
25.图1——transwell侵袭实验的描述。通过将caco-2-bbe1细胞以5
×
105个细胞/孔接种到24孔transwell插入板(4.67cm2,0.4μm孔径)上来建立transwell侵袭实验。每3天更换细胞培养基,直到细胞完全分化[跨上皮电阻(ter)值≥1100/cm2]。为了测试细菌的易位或处理对细胞因子释放的影响,将细菌或处理物置于顶区室中。
[0026]
图2——garp和菠萝蛋白酶对tnfα从thp-1巨噬细胞释放的影响。将thp-1细胞以1
×
106细胞/cm2接种到24孔板中。通过用200nm pma处理48h来分化巨噬细胞。48h后,洗涤巨噬细胞并在pma和无抗生素培养基中生长24h,然后开始实验。在加入garp
±
0-80μg/ml菠萝蛋白酶(0-107pg/巨噬细胞)之前立即用50ng/ml的lps刺激巨噬细胞。未刺激的孔用作比较对照以证实lps刺激的有效性。8h后,除去培养基并用elisa定量tnfα。每个数据点是5-10次独立实验的平均值
±
sd。
[0027]
图3——garp和菠萝蛋白酶对il-8从与lps刺激的thp-1巨噬细胞共孵育的极化的caco-2单层释放的影响。通过将caco-2-bbe1细胞以5
×
105个细胞/孔接种到24孔transwell插入板(4.67cm2,0.4μm孔径)上来建立transwell侵袭实验。每3天更换细胞培养基直到细胞完全分化(ter值≥1100/cm2)。在单独的24孔板中,以1
×
106细胞/孔接种thp-1单核细胞,并用200nm pma分化48h,然后在实验前在正常培养基中培养24h。在用rpmi1640替换所有培养基后,将含有caco-2分化单层的所有transwell插入物上样到含有分化thp-1细胞的孔中。在评价不同菠萝蛋白酶制剂的抗炎作用的实验中,将0.25ml测试样本应用于顶面24h,同时将50ng/ml的lps加入到该模型的基底侧。孵育24h后,收集顶面的培养物上清液,用il-8elisa测定il-8。每个数据点是5次独立实验的平均值
±
sd。
[0028]
图4——garp(无菠萝蛋白酶)防止细菌诱导的ter损失。
[0029]
通过将5
×
105个caco-2细胞接种到已经用matrigel基底膜基质预包被的12mm的
transwell细胞培养插入物的顶面上建立m-细胞模型。细胞维持14-18天,直到ter》600ω/transwell(相当于300ωcm2组织单层)。在共培养当天,收获raji b细胞,再悬浮于完全dmem中,并将5
×
105个细胞添加到基础transwell区室中。共培养物维持4-6天,直到产生m-细胞。通过将细菌以30的moi加入到transwell插入物的顶孔中4h,用aiec hm605感染m-细胞模型。4h后,洗涤细胞并用100μg/ml庆大霉素孵育以杀死任何残留的细菌。此时,将无菠萝蛋白酶garp置于细胞上,以2h的间隔测定所有单层的ter直至12h,每1h直至4h计数基孔中的细菌。
[0030]
当aiec hm605悬浮在正常培养基(
○‑○
)或garp(无菠萝蛋白酶,)中并应用于m-细胞模型时,garp制剂对细胞层的完整性提供保护作用。以garp形式施用于细胞单层的细菌对细胞层完整性的影响与dmem/无细菌对照(
●‑●
)相似。每个数据点是4次独立测定的平均值
±
sd。
[0031]
图5——garp中菠萝蛋白酶对形成凝胶的粘蛋白基因表达的影响的滴定。
[0032]
通过将合并的细胞(6.4
×
104细胞/ml)接种到每个烧瓶总共5ml的25cm2中来建立75:25caco-2/ht-29共培养物。接种后15天,将共培养物单层用5ml测试溶液处理24h。在暴露于菠萝蛋白酶、苏氨酸、丁酸钠、维生素d3和两种不同的garp制剂24h后,使用qpcr研究muc基因的表达。数据点是12次(dmem)或6次独立测定的平均值
±
sem。
[0033]
图6——garp中菠萝蛋白酶对膜相关粘蛋白表达的影响的滴定。
[0034]
通过将合并的细胞(6.4
×
104细胞/ml)接种到每个烧瓶总共5ml的25cm2中来建立75:25caco-2/ht-29共培养物。接种后15天,将共培养物单层用5ml测试溶液处理24h。在暴露于菠萝蛋白酶、苏氨酸、丁酸钠、维生素d3和两种不同的garp制剂24h后,使用qpcr研究muc基因的表达。数据点是12次(dmem)或6次独立测定的平均值
±
sem。
[0035]
图7——garp中菠萝蛋白酶对分泌的粘蛋白表达的影响的滴定。
[0036]
通过将合并的细胞(6.4
×
104细胞/ml)接种到每个烧瓶总共5ml的25cm2中来建立75:25caco-2/ht-29共培养物。接种后15天,将共培养物单层用5ml测试溶液处理24h。在暴露于菠萝蛋白酶、苏氨酸、丁酸钠、维生素d3和两种不同的garp制剂24h后,使用qpcr研究muc基因的表达。数据点是12次(dmem)或6次独立测定的平均值
±
sem。
[0037]
图8——维生素d3和l-苏氨酸对粘蛋白基因表达的影响
[0038]
通过将合并的细胞(6.4
×
104细胞/ml)接种到每个烧瓶总共5ml的25cm2中来建立75:25caco-2/ht-29共培养物。接种后15天,将共培养物单层用5ml测试溶液处理24h。在暴露于苏氨酸维生素d3 24h后,使用qpcr研究muc基因的表达。数据点代表平均值
±
sem(其中n=6)
[0039]
图9-9a:l-苏氨酸对muc2和muc7表达的影响
[0040]
通过将合并的细胞(6.4
×
104细胞/ml)接种到每个烧瓶总共5ml的25cm2中来建立75:25caco-2/ht-29共培养物。接种后15天,将共培养物单层用5ml测试溶液处理24h。在暴露于l-苏氨酸24h后,使用qpcr研究muc基因的表达。数据点是12次(dmem)或6次独立测定的平均值
±
sem。
[0041]
9b:维生素d3对muc2和muc7表达的影响。数据点表示平均值
±
sem(其中n=6)。
[0042]
图10——10a:不同维生素d3和苏氨酸浓度对muc2表达的影响;10b:不同维生素d3和苏氨酸浓度对muc7表达的影响。
[0043]
数据点代表平均值
±
sem(n=6),其中所有数据点与无处理对照显著不同(p《0.05,student t检验)。
[0044]
图11——在2,4,6-三硝基苯磺酸(tnbs)小鼠模型中评价garp。
[0045]
通过在50%乙醇中的tnbs(5%w/v)的直肠植入,在5周龄的c56/bl/6小鼠中诱发2,4,6-三硝基苯磺酸(tnbs)结肠炎。图11概述了治疗时间表和实验过程。
[0046]
图12——比较实验终点时体重的变化。
[0047]
在c56/bl/6小鼠中诱导结肠炎,在疾病诱导后4天开始每日治疗。小鼠口服施用菠萝蛋白酶(75mg/kg)
±
15mg/kg薄荷醇和/或直肠施用garp。每天测量体重,其中通过将终点体重与基线第4天体重(刚好在治疗开始之前)来确定体重的实验终点变化。每个点代表5-9只动物的平均值
±
sd。
[0048]
图13——比较含有75mg/kg菠萝蛋白酶和15mg/kg薄荷醇的制剂与载体(vehicle)对照的效果。在c56/bl/6小鼠中诱导结肠炎,并且在疾病诱导后4天开始每日治疗。治疗是口服载体(vehicle)(
●‑●
),75mg/kg菠萝蛋白酶的水溶液(
○‑‑○
),75mg/kg菠萝蛋白酶+15mg/kg薄荷醇的口服载体(vehicle)或75mg/kg菠萝蛋白酶+15mg/kg薄荷醇的口服载体(vehicle)和garp经直肠给药(
△‑‑‑△
)。每个点代表8-9只动物的平均值
±
sd。
[0049]
图14——比较garp制剂和载体(vehicle)对照对内窥镜评分降低的影响。在c56/bl/6小鼠中诱导结肠炎,并且在疾病诱导后4天开始每日治疗。每个点代表5-9只动物的平均值
±
sd。*表示与口服或直肠载体(vehicle)对照相比时的统计显著性。
[0050]
图15——实验性结肠炎中的疾病活性。(a)结肠长度,(b)结肠重量,(c)结肠重量/长度比。在c56/bl/6小鼠中诱导结肠炎,并且在疾病诱导后4天开始每日治疗。在实验终点,将动物安乐死,取出结肠,称重并测量。数据表示为平均值
±
sem(n=5-9只动物)。
[0051]
图16——内窥镜评分。在c56/bl/6小鼠中诱导结肠炎,并且在疾病诱导后3天开始每日治疗。每个柱代表治疗组在第11天内窥镜评分的平均改善。相对于安慰剂的动物数量、平均值、标准偏差和统计显著性的值显示在括号中,平均值显示在每个条的顶部。显示的治疗是口服和直肠联合口服载体(vehicle)(n=34,x 3.00,σ2.00),150mg/kg菠萝蛋白酶水溶液(n=8,x=5.00,σ=1.41,p=0.0036),150mg/kg菠萝蛋白酶+15mg/kg薄荷醇的口服载体(vehicle)和garp经直肠施用(n=11,x=4.73,σ=2.42,p=0.0294),150mg/kg菠萝蛋白酶+15mg/kg薄荷醇的口服载体(vehicle)和2mg/kg泼尼松龙和garp经直肠施用(n=7,x=4.86,σ=1.36,p=0.0080),2mg/kg泼尼松龙经直肠施用(n=12,x=4.25,σ=2.38,p=0.0445)和garp经直肠施用的garp(n=19,x
■
=4.42,σ=2.32,p=0.0167)。
[0052]
图17——含有菠萝蛋白酶和薄荷醇的肠溶衣a型片剂的溶出曲线。将根据实施例13的方法制备的菠萝蛋白酶/薄荷醇小片置于usp溶出测试条件下,并证明在酸阶段具有可接受的稳定性,随后从相当于胃后清除的ph开始持续释放并持续超过3h。
[0053]
图18——含有丁酸钠、苏氨酸和维生素d3的肠溶衣b型片剂的溶出曲线。使根据实施例13的方法制备的小片经受改进的usp溶出试验条件,其中使组合物暴露于酸(1n hcl)1h,ph6.2的缓冲液(1h)和ph7.4的缓冲液(5h)。该图显示在酸性和ph6.2阶段中可接受的稳定性,随后在相当于在下部小肠和大肠中观察到的ph的ph7.4开始持续释放。
[0054]
图19——组织学评分。诱导结肠炎并将来自实施例11和12的经处理的c56/bl/6小鼠在处理后安乐死并将结肠切片用于组织病理学分析。每个柱代表治疗组的平均组织病理
学评分。相对于安慰剂的动物数、平均值、标准偏差和统计显著性的值显示在括号中。治疗为安慰剂(n=16,x
■
4.4,σ2.2),garp(n=10,x
■
2.5,σ2.4,p=0.034),泼尼松龙(n=10,x
■
3.5,σ2.5,p=0.196),150mg/kg菠萝蛋白酶+garp(n=10,x
■
=1.8,σ=2.6,p=0.012),150mg/kg菠萝蛋白酶+garp+泼尼松龙(n=7,x
■
=2.0,σ=1.5,p=0.005),75mg/kg菠萝蛋白酶+garp(n=8,x
■
=2.1,σ=2.8,p=0.045)。
具体实施方式
[0055]
定义
[0056]
提供以下定义以更好地定义本发明并作为本领域普通技术人员在实践本发明时的指导。
[0057]
除非另有限定,本文所用的所有技术和科学术语具有与本发明所属领域的普通技术人员之一理解的相同的含义。
[0058]
还据信,本发明的实践可以使用本领域已知的标准细胞生物学,微生物学,分子生物学,药理学和生物化学方案和程序来进行,并且如例如在本发明所属领域中相关的许多普遍可用的参考材料中所描述的。
[0059]
术语“食品”是指任何物质,无论是加工的,半加工的或未加工的,其旨在被包括人在内的动物消耗,并且包括但不限于固体和半固体食品、饮品、饮料和口香糖。本发明的食品组合物包括本文所述的组合物与食品的组合。
[0060]
术语“膳食补充剂”是指旨在补充膳食的产品,其包括一种或多种以下成分:酶、维生素、矿物质、草药、代谢物、提取物等。膳食补充剂通常不旨在用作一餐的唯一物品,而是可以独立于任何食品来消费。本发明的膳食补充剂包括本文所述的组合物与一种或多种膳食补充剂的组合。
[0061]
术语“医疗食品”是指配制为在执业医师的监督下被肠内(例如,经由喂食或鼻胃管)摄取或施用的食品。医疗食品用于饮食管理具有不同营养需求的病症。医疗食品的实例包括但不限于单一来源的营养产品、口服补液溶液和旨在用于代谢病症的饮食管理的产品。本文所考虑的医疗食品包括配制为医疗食品的本文所述的组合物。
[0062]
一种或多种可消耗赋形剂可存在于本文所述的营养制剂、食品组合物、膳食补充剂或医疗食品中。这些可消耗的赋形剂可以包括载体(carrier)、稀释剂、粘合剂、胶粘剂、润滑剂、增塑剂、崩解剂、着色剂、填充剂、调味剂、甜味剂、缓冲剂、吸收剂等,这对于本领域技术人员是显而易见的。
[0063]
可用于本文所述的组合物和口服剂量的粘合剂的实例包括纤维素衍生物如乙基纤维素、羟丙基纤维素或羟丙基甲基纤维素、聚维酮、交聚维酮、制药釉、树胶、乳衍生物如乳清和酪蛋白、淀粉和淀粉衍生物。甜味剂可以包括基于二肽的甜味剂、水溶性天然甜味剂和人工甜味剂。调味剂可以包括合成的和天然的调味油,包括薄荷油、留兰香油、肉桂油、冬青油;天然和人造水果香料,例如柑橘油、包括柠檬、酸橙、葡萄柚和橙,以及水果香精、包括樱桃、菠萝、草莓、覆盆子、苹果等。填充物质可包括葡萄糖、蔗糖、乳糖、淀粉、明胶和二氧化硅。所有上述粘合剂、甜味剂、调味剂和填充物质都是,而非限制性的。
[0064]
本文所用的术语“不同类型的丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒”及其语法变体是指本文所述的作为“类型”(包括本文所述的a型、b型和c型)的给定丸剂、片剂、
小片剂、胶囊、颗粒剂、颗粒或微粒配制成包括或基本上由不同组分组成,然后将每种类型中包括的组分递送至肠的不同部分并在肠的不同部分中具有活性。在一个实施方案中,肠的不同部分是十二指肠和结肠。
[0065]
本文所用的术语“治疗(treat)”、“治疗(treating)”和“治疗(treatment)”是指减少、缓解、改善、控制、预防、抑制、停止或逆转由ibd和/或ibs引起的或与ibd和/或ibs相关的症状(包括与ibd和/或ibs相关的或与ibd和/或ibs有关的症状)的治疗措施。如本领域技术人员已知的,受试对象可以表现出与ibd和/或ibs相关的一种或多种症状的可观察的或可测量的(统计学显著的)减少,如指示改善。
[0066]
本文所用的术语“有效量”是指有效防止、延迟,减少,稳定,改善或治疗本领域已知的和/或本文所述的ibd和/或ibs的至少一种症状的量。在一些实施方案中,有效量是与未治疗的对照或安慰剂治疗的对照相比足以实现统计学上不同的结果的量。
[0067]
本文所述的组合物的“治疗有效量”是足以实现正在治疗或待治疗的与ibd和/或ibs相关的至少一种症状的至少减轻或足以实现具有治疗有益效果的症状的改变的量。本文考虑的症状变化的实例包括胃肠炎症的减少,胃肠粘膜层厚度的增加和/或胃肠屏障完整性的改善,但不限于此。
[0068]
如本文所用,在受试对象给药疗法的上下文中,术语“管理(manage)”、“管理(managing)”和“管理(management)”是指受试对象从疗法得到的有益效果,而不导致病症的治愈。例如,病症的管理包括防止病症恶化。
[0069]
本文所用的术语“预防(prevent)”、“预防(preventing)”和“预防(prevention)”在受试对象给药疗法的上下文中是指预防或抑制由给药疗法引起的病症的复发、发作或发展。
[0070]
术语“约”当与所引用的数字指示结合使用时意指所引用的数字指示加上或减去高达所引用的数字指示的10%。例如,“约100”是指90至110,“约6”是指5.4至6.6。
[0071]
本说明书中使用的术语“包括(comprising)”是指“至少部分由
…
组成(consisting at least in part of)”。当解释本说明书中包括该术语的语句时,在每个语句中以该术语开头的特征都需要存在,但是也可以存在其它特征。相关术语如“包括(comprise)”和“包括(comprised)”以相同的方式解释。
[0072]
如本文所用短语“基本上由...组成(consisting essentially of)”是指特定的材料或步骤,以及不会对要求保护的发明的基本和新颖特征产生实质性影响的材料或步骤。
[0073]
本文所用的术语“由
…
组成(consisting of)”是指所要求保护的发明的指定材料或步骤,不包括权利要求中未指定的任何要素、步骤或成分。
[0074]
本文公开的数值范围(例如,1至10)的引用也包括该范围内的所有有理数(例如,1、1.1、2、3、3.9、4、5、6、6.5、7、8、9和10)以及该范围内的任何有理数范围(例如,2至8、1.5至5.5和3.1至4.7),因此,本文明确公开的所有范围的所有子范围在此明确公开。这些仅是具体意图的实例,并且所列举的最低值与最高值之间的数值的所有可能组合应被视为以类似方式在本技术中明确陈述。
[0075]
说明
[0076]
胃肠疾病和病症如肠易激综合征(ibs)和炎性肠病(ibd)由个体中的许多不同因
素引起,包括微生物、免疫、遗传和环境因素。
[0077]
这三种因素导致ibd、ibs和相关症状的引发和慢性持续,相关症状例如排便习惯改变(即腹泻、便秘或其混合)、腹痛和腹胀:
[0078]
——胃肠道微生物稳态丧失
[0079]
——粘膜损伤
[0080]
——炎症。
[0081]
目前在市场上可获得的包括膳食补充剂在内的产品很少能成功地重新建立胃肠微生物组的体内平衡、减轻炎症和促进粘膜愈合。重建微生物组体内平衡被认为有益于降低与腹泻、炎症、肥胖、糖尿病、心血管疾病相关的疾病作用(vamanu,2018)。
[0082]
然而,本发明人现在已经发现了一种药物组合物,其共同作用以作用于所有这三种致病因素,提供对慢性肠道病症如ibd和ibs的有效控制。
[0083]
本文公开了胃肠重编程产品(garp)。garp是本发明人专门开发的全天然膳食产品,以支持和维持胃肠健康。本文所述的garp可配制为或包括在膳食补充剂、医疗食品或药品中,用于解决与胃肠病症相关的主要潜在因素。不希望受理论的束缚,本发明人相信,garp通过支持个体的胃肠微生物群和恢复正常的微生物肠道功能而起作用。此外,制剂组分减轻炎症,对于恢复胃肠道的正常功能是关键的。
[0084]
因此,在一个方面,本发明涉及包括以下组分的组合物:
[0085]
(a)菠萝蛋白酶,
[0086]
(b)一种或多种scfa或其酯,
[0087]
(c)选自由l-苏氨酸、l-色氨酸、l-精氨酸、l-谷氨酰胺和l-甲硫氨酸及其组合组成的组的一种或多种氨基酸
[0088]
(d)维生素d或其代谢物。
[0089]
在一个实施方案中,组合物基本上由以下组分组成:
[0090]
(a)菠萝蛋白酶,
[0091]
(b)一种或多种scfa或其酯,
[0092]
(c)选自由l-苏氨酸、l-色氨酸、l-精氨酸、l-谷氨酰胺和l-甲硫氨酸及其组合组成的组的一种或多种氨基酸
[0093]
(d)维生素d或其代谢物。
[0094]
在一个实施方案中,(c)包括或基本上由一种或多种选自l-色氨酸、l-精氨酸、l-谷氨酰胺和l-甲硫氨酸及其组合的氨基酸组成。
[0095]
在一个实施方案中,(c)包括或基本上由l-色氨酸、l-精氨酸、l-谷氨酰胺和l-甲硫氨酸组成。在一个实施方案中,(c)包括或基本上由l-精氨酸、l-谷氨酰胺和l-甲硫氨酸组成。在一个实施方案中,(c)包括或基本上由l-色氨酸、l-谷氨酰胺和l-甲硫氨酸组成。在一个实施方案中,(c)包括或基本上由l-色氨酸、l-精氨酸和l-甲硫氨酸组成。在一个实施方案中,(c)包括或基本上由l-色氨酸、l-精氨酸和l-谷氨酰胺组成。
[0096]
在一个实施方案中,(c)包括或基本上由l-色氨酸和l-精氨酸组成。在一个实施方案中,(c)包括或基本上由l-色氨酸和l-谷氨酰胺组成。在一个实施方案中,(c)包括或基本上由l-色氨酸和l-甲硫氨酸组成。在一个实施方案中,(c)包括或基本上由l-精氨酸和l-谷氨酰胺组成。在一个实施方案中,(c)包括或基本上由l-精氨酸和l-甲硫氨酸组成。在一个
实施方案中,(c)包括或基本上由l-谷氨酰胺和l-甲硫氨酸组成。
[0097]
在一个实施方案中,(c)包括或基本上由l-色氨酸、l-精氨酸、l-谷氨酰胺或l-甲硫氨酸组成。
[0098]
在另一方面,本发明涉及包括以下组分的组合物:
[0099]
(a)菠萝蛋白酶,
[0100]
(b)一种或多种scfa或其酯,
[0101]
(c)l-苏氨酸,和
[0102]
(d)维生素d或其代谢物。
[0103]
在一个实施方案中,组合物基本上由以下组分组成:
[0104]
(a)菠萝蛋白酶,
[0105]
(b)一种或多种scfa或其酯,
[0106]
(c)l-苏氨酸,和
[0107]
(d)维生素d或其代谢物。
[0108]
在一个实施方案中,(c)中的l-苏氨酸被一个或多个选自l-色氨酸、l-精氨酸、l-谷氨酰胺和l-甲硫氨酸组成的组的不同氨基酸取代。
[0109]
在一个实施方案中,组合物包括至少一种另外的氨基酸组分:l-色氨酸、l-精氨酸、l-谷氨酰胺或l-甲硫氨酸或其任何组合。
[0110]
在一个实施方案中,组合物基本上由以下组分组成:菠萝蛋白酶、scfa、l-苏氨酸和维生素d或其代谢物。
[0111]
在一个实施方案中,一种或多种scfa或其酯是丁酸、丙酸或乙酸、或其生理学上可接受的盐。优选地,scfa是丁酸钠、丁酸钙、丙酸钠或乙酸钠,优选丁酸钠。
[0112]
在一个实施方案中,组合物基本上由以下组分组成:菠萝蛋白酶、丁酸盐,优选丁酸钠、l-苏氨酸和维生素d或其代谢物。
[0113]
在一个实施方案中,组合物包括作为组分的:薄荷醇。
[0114]
在一个实施方案中,组合物是膳食补充剂、营养品或食品。在一个实施方案中,食品是医疗食品。
[0115]
在一个实施方案中,组合物包括一种或多种为可消耗赋形剂的附加组分。
[0116]
组分
[0117]
本发明人惊奇地确定,本发明组合物的各种组分协同作用以恢复正常的胃肠功能,减少ibd和ibs的症状,特别是腹泻。
[0118]
菠萝蛋白酶是得自菠萝(ananus comosus)茎的蛋白水解提取物的总称。术语“菠萝蛋白酶”也用于指菠萝中存在的两种主要蛋白水解酶-茎菠萝蛋白酶(cas 37189-34-7/ec 3.4.22.32)和果实菠萝蛋白酶(ec 3.4.22.33)。虽然名称反映了它们在植物中的主要位置,但两种酶都存在于茎菠萝蛋白酶的提取物中。除了茎菠萝蛋白酶和果实菠萝蛋白酶,菠萝蛋白酶可以含有蛋白酶ananain、cosmosain和canazain,以及少量的其它化合物。
[0119]
菠萝蛋白酶提取物的制备是通过将菠萝的皮、茎、叶和其它不可食用的部分混合,并过滤混合物以获得含有可溶性菠萝蛋白酶的液体,然后可以将其纯化、分馏、浓缩和/或干燥。菠萝蛋白酶可以用离子交换层析分馏。与主要吸收峰相关的级分级分进行sds-page以分离和鉴定单独的酶。
[0120]
如本文所用,术语“菠萝蛋白酶”是指从菠萝茎获得的蛋白水解酶的提取物,包括粗提取物、纯化提取物或其任何级分或级分的组合。
[0121]
虽然菠萝蛋白酶尚未被美国食品和药品管理局批准用于治疗任何胃肠病症,但它是众所周知的膳食补充剂,被建议用作消化助剂和一般的抗炎剂。它还被建议用于支持身体对应激的反应、帮助蛋白质的消化、减少鼻和鼻窦的肿胀、去除烧伤后死亡和损伤的组织、松弛肌肉、预防肺水肿、刺激肌肉收缩和缩短分娩时间;以及治疗关节疼痛、鼻窦感染、过敏、哮喘、癌症、静脉曲张、痔疮、尿路感染、支气管炎、痛风、发热和腕管综合症。
[0122]
本发明的组合物将菠萝蛋白酶与降低炎性胃肠疾病ibd和ibs的三种致病因素的特定药剂组合。
[0123]
在一个实施方案中,组合物是包括约50mg至约2500mg、优选约250至约2250mg、约500至约2000mg、约750至约1750mg、约1000至约1600mg、约1300至约1550mg、约1400至约1500mg、约1420至约1460mg、优选约1440mg的菠萝蛋白酶的单位剂型。在一个实施方案中,组合物包括约1440mg,优选约1030mg,优选约720mg菠萝蛋白酶。
[0124]
在一个实施方案中,组合物是包括约460mg至约500mg菠萝蛋白酶,优选约480mg菠萝蛋白酶的单位剂型。
[0125]
在一个实施方案中,组合物是包括460mg至500mg菠萝蛋白酶,优选480mg菠萝蛋白酶的单位剂型。
[0126]
在一个实施方案中,组合物是包括50mg至2500mg、优选250至2250mg、500至2000mg、750至1750mg、1000至1600mg、1300至1550mg、1400至1500mg、1420至1460mg、优选1440mg、1030mg、优选720mg菠萝蛋白酶的单位剂型。在一个实施方案中,组合物包括1440mg,优选1030mg,优选720mg菠萝蛋白酶。
[0127]
短链脂肪酸(scfa)是大量营养素如植物多糖的微生物发酵的终产物,不能被缺乏必需的糖苷水解酶和多糖裂解酶的人消化。微生物组提供缺失的酶,产生可促进肠上皮屏障完整性的scfa。scfa如丁酸盐也可帮助恢复肠道微生物稳态。
[0128]
增加的scfa浓度促进有益细菌的再生长,有益细菌通过抑制nf-κb和减少促炎细胞因子来减少炎症。
[0129]
术语“短链脂肪酸”和“scfa”是指含有2至7个碳原子的弱酸,但也包括特定碱酸的阴离子和盐形式。关于阴离子,scfa包括醋酸酯、丁酸酯、丙酸酯、戊酸酯、己酸酯、异丁酸酯、2-甲基异丁酸酯和异戊酸酯。用于本发明组合物的scfa盐包括碱金属(例如na和k)和碱土金属(例如mg和ca)。
[0130]
术语“其scfa酯”是指scfa的酯。用于本发明组合物的scfa酯包括甲基、乙基等。
[0131]
存在于本发明的组合物中的scfa和选择的氨基酸促进肠粘膜的再生,从而恢复胃肠道和肠道微生物组的完整性。
[0132]
在一个实施方案中,组合物是包括约45至1800mg scfa、优选约75至1650mg、约250至1500mg、约500至1400mg、约750至1500mg、约1000至1400mg、约1100至1300mg、优选约1200mg scfa的单位剂型。在一个实施方案中,组合物包括约1200mg,优选约600mg,优选约300mg scfa。
[0133]
在一个实施方案中,组合物是包括45至1800mg scfa、优选75至1650mg、250至1500mg、500至1400mg、750至1500mg、1000至1400mg、1100至1300mg、优选1200mg scfa的单
位剂型。在一个实施方案中,组合物包括1200mg,优选600mg,优选300mg scfa。
[0134]
在一个实施方案中,组合物是包括约45至1800mg丁酸钠、丙酸钠或乙酸钠,优选约75至约1650mg、约250至约1500mg、约500至约1400mg、约750至约1500mg、约1000至约1400mg、约1100至约1300mg、优选约1200mg丁酸钠的单位剂型。在一个实施方案中,组合物包括约1200mg、优选约600mg、优选约300mg丁酸钠、丙酸钠或乙酸钠,优选丁酸钠。
[0135]
在一个实施方案中,组合物是包括45至1800mg丁酸钠、丙酸钠或乙酸钠,优选75至1650mg、250至1500、500至1400、750至1500、1000至1400、1100至1300mg、优选1200mg丁酸钠的单位剂型。在一个实施方案中,组合物包括1200mg、优选600mg、优选300mg丁酸钠、丙酸钠或乙酸钠,优选丁酸钠。
[0136]
在一个实施方案中,组合物是包括约600mg丁酸钠的单位剂型。在一个实施方案中,组合物是包括600mg丁酸钠的单位剂型。
[0137]
包括l-苏氨酸作为本文所述组合物的组分。苏氨酸是用于蛋白生物合成的必需氨基酸,产生胶原并可有益于免疫健康。
[0138]
另外的氨基酸也可包括在本文所述的组合物中。在一些实施方案中,组合物中的l-苏氨酸可被选自l-色氨酸、l-谷氨酰胺、l-精氨酸和l-甲硫氨酸组成的组的另一种氨基酸取代。不希望受理论束缚,本发明人相信组合物中选自l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸和l-甲硫氨酸的每种氨基酸及其任意组合可减少炎症和/或促进粘膜愈合。优选地,氨基酸是l-苏氨酸。与菠萝蛋白酶结合,这些氨基酸还可以减少促炎症细胞因子,促炎症细胞因子促进微生物组的逆转并减少炎症。
[0139]
在一个实施方案中,组合物为包括约67.5至约2700mg、优选约112.5至约2250mg、约250至约2000mg、约500至约1900mg、约900至约1800mg,优选约1800mg的l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合的单位剂型。在一个实施方案中,所述组合物包括约1800mg、优选约900mg,优选约450mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任意组合。
[0140]
在一个实施方案中,所述组合包括约67.5至约2700mg、优选约112.5至约2250mg、约250至约2000mg、约500至约1900mg、约900至约1800mg、优选约1800mg l-苏氨酸的单位剂型。在一个实施方案中,所述组合物包括约1800mg、优选约900mg、优选约450mg l-苏氨酸。
[0141]
在一个实施方案中,组合物是包括67.5至2700mg、优选112.5至2250mg、250至2000mg、500至1900mg、900至1800mg,优选1800mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合的单位剂型。在一个实施方案中,组合物包括1800mg、优选900mg,优选450mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合。
[0142]
在一个实施方案中,组合物是包括67.5至2700mg、优选112.5至2250mg、250至2000mg、500至1900mg、900至1800mg、优选1800mg l-苏氨酸的单位剂型。在一个实施方案中,组合物包括1800mg、优选900mg、优选450mg l-苏氨酸。
[0143]
维生素d作为组分包括在本文所述的组合物中。维生素d具有抗炎作用,并且还可以帮助将微生物组移回体内稳态,以及收紧胃肠道的i细胞之间的间隙连接,这降低了肠道渗透性。
[0144]
术语“维生素d”是指一组脂溶性开环甾类化合物,包括维生素d2(麦角钙化醇)和
维生素d3-1,25-二羟基维生素d3(胆钙化醇);没有下标的维生素d是指d2或d3或两者。两种形式的维生素d统称为钙化醇。维生素d的活性代谢物称为阿法骨化醇,其不需要肾中的第二羟基化步骤。
[0145]
在一个实施方案中,组合物是包括约4至约150μg、约6.5至约140μg、约13至约130μg、约25至约120μg、约35至约110μg、约50至约105μg、优选约100μg、优选约50μg、优选约25μg、优选约12.5μg维生素d的单位剂型。
[0146]
在一个实施方案中,组合物是包括约4至150μg、6.5至140μg、13至130μg、25至120μg、35至110μg、50至105μg、优选100μg、优选50μg、优选25μg、优选12.5μg维生素d的单位剂型。
[0147]
在一个实施方案中,维生素d是胆钙化醇(维生素d3)。
[0148]
薄荷醇可以作为组分包括在本文所述的组合物中,其可以是合成制备的有机化合物或由薄荷油如薄荷得到的有机化合物。薄荷叶和来自薄荷的精油都用于健康目的。
[0149]
在一个实施方案中,组合物是包括约3至约150mg、优选约6至约145mg、约12至约140mg、约24至约135mg、48至约130mg、约60至约125mg、约80至约120mg、约90至约110mg、约100mg、优选约96mg薄荷醇的单位剂型。在一个实施方案中,组合物包括约100、优选约96、优选约50mg、优选约48mg薄荷醇。
[0150]
在一个实施方案中,组合物是包括3至200mg、优选6至150mg、12至145mg、24至140mg、48至135mg、60至130mg、80至120mg、90至110mg、100mg、优选96mg薄荷醇的单位剂型。在一个实施方案中,组合物包括100、优选96、优选50mg、优选48mg薄荷醇。
[0151]
在一个实施方案中,薄荷醇是l-薄荷醇。在一个实施方案中,薄荷醇是d-薄荷醇。
[0152]
本文公开的组合物可以单位剂型存在,并且可以通过制剂和药学领域熟知的任何方法制备。术语“单位剂型”意指待给予患者的单一剂量,其中所有活性剂和非活性成分在合适的系统中组合,使得单一剂量可在单一容器或包装中获得,其中包括整个“单位剂型”。“单位剂型”不包括从两个或多个容器或包装中将任何组分混合在一起。
[0153]
单位剂型的典型实例是用于口服给药如本文所述的组合物(即,口服剂型)的丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒,或包括单位剂量的如本文所述的组合物(即,局部剂型)的透皮贴剂。单位剂型的这些实例不旨在以任何方式进行限制,而仅仅代表单位剂型药学领域中的典型实例。
[0154]
因此,在另一方面,本发明涉及用于治疗或预防ibd或ibs的单位剂型,其包括约1至约10g的本发明组合物。在一个实施方案中,单位剂型是口服剂型。
[0155]
在一个实施方案中,口服剂型包括约1至约8g、约1至约7g、约1至约6g、约1至约5g、约1至约4g、约1至3g的组合物。在一个实施方案中,口服剂型包括1至8g、1至7g、1至6g、1至5g、1至4g、1至3g的组合物。
[0156]
在一个实施方案中,口服剂型包括约4g至约4.5g组合物、优选约4.22g组合物。
[0157]
在一个实施方案中,口服剂型包括4g至4.5g组合物、优选4.22g组合物。
[0158]
在一个实施方案中,口服剂型包括约2g至约2.5g组合物、优选约2.21g组合物。
[0159]
在一个实施方案中,口服剂型包括2g至2.5g组合物、优选2.21g组合物。
[0160]
在一个实施方案中,口服剂型基本上由约1至约8g、约1至约7g、约1至约6g、约1至约5g、约1至约4g、约1至3g的组合物组成。在一个实施方案中,口服剂型基本上由1至8g、1至
7g、1至6g、1至5g、1至4g、1至3g组合物组成。
[0161]
在一个实施方案中,口服剂型基本上由约1至约10g组合物、约1.25至约8g、优选约1.5至约6g组合物组成。在一个实施方案中,口服剂型基本上由1至10g组合物、1至8g、优选1.5至6g组合物组成。
[0162]
在一个实施方案中,口服剂型基本上由约4g至约4.5g组合物、优选约4.22g组合物组成。
[0163]
在一个实施方案中,口服剂型基本上由4g至4.5g组合物、优选4.22g组合物组成。
[0164]
在一个实施方案中,口服剂型基本上由约2g至约2.5g组合物、优选约2.21g组合物组成。
[0165]
在一个实施方案中,口服剂型基本上由2g至2.5g组合物、优选2.21g组合物组成。
[0166]
在一个实施方案中,口服剂型包括50-2500mg菠萝蛋白酶、优选720mg菠萝蛋白酶、45-1800mg丁酸钠、优选300mg丁酸钠、67.5-2700mg l-苏氨酸、优选450mg l-苏氨酸、4-150μg维生素d,优选25μg维生素d和任选的3-150mg薄荷醇,优选48mg薄荷醇。
[0167]
在一个实施方案中,口服剂型包括约460mg至约500mg菠萝蛋白酶,优选约480mg菠萝蛋白酶、约550mg至约650mg丁酸钠,优选约600mg丁酸钠、约850mg l-苏氨酸至约950mg l-苏氨酸,优选约900mg l-苏氨酸、约10μg维生素d至约15μg维生素d,优选约12.5μg维生素d、和任选约65mg薄荷醇至约75mg薄荷醇,优选约70mg薄荷醇。
[0168]
在一个实施方案中,口服剂型包括460mg至500mg菠萝蛋白酶,优选480mg菠萝蛋白酶、550mg至650mg丁酸钠,优选600mg丁酸钠、850mg l-苏氨酸至950mg l-苏氨酸,优选900mg l-苏氨酸、10μg维生素d至15μg维生素d,优选12.5μg维生素d、和任选地65mg薄荷醇至75mg薄荷醇,优选约70mg薄荷醇。
[0169]
在一个实施方案中,口服剂型基本上由约460mg至约500mg菠萝蛋白酶,优选约480mg菠萝蛋白酶、约550mg至约650mg丁酸钠,优选约600mg丁酸钠、约850mg l-苏氨酸至约950mg l-苏氨酸,优选约900mg l-苏氨酸、约10μg维生素d至约15μg维生素d,优选约12.5μg维生素d和任选约65mg薄荷醇至约75mg薄荷醇,优选约70mg薄荷醇组成。
[0170]
在一个实施方案中,口服剂型基本上由460mg至500mg菠萝蛋白酶,优选480mg菠萝蛋白酶、550mg至650mg丁酸钠,优选600mg丁酸钠、850mg l-苏氨酸至950mg l-苏氨酸,优选900mg l-苏氨酸、10μg维生素d至15μg维生素d,优选12.5μg维生素d和任选的65mg薄荷醇至75mg薄荷醇,优选约70mg薄荷醇组成。
[0171]
在一个实施方案中,口服剂型包括约700mg至约740mg菠萝蛋白酶,优选约720mg菠萝蛋白酶、约550mg至约650mg丁酸钠,优选约600mg丁酸钠、约850mg l-苏氨酸至约950mg l-苏氨酸,优选约900mg l-苏氨酸、约10μg维生素d至约15μg维生素d,优选约12.5μg维生素d、和任选约100mg薄荷醇至约110mg薄荷醇,优选约105mg薄荷醇。
[0172]
在一个实施方案中,口服剂型包括700mg至740mg菠萝蛋白酶,优选720mg菠萝蛋白酶、550mg至650mg丁酸钠,优选600mg丁酸钠、850mg l-苏氨酸至950mg l-苏氨酸,优选900mg l-苏氨酸、10μg维生素d至15μg维生素d,优选12.5μg维生素d、和任选100mg薄荷醇至110mg薄荷醇,优选105mg薄荷醇。
[0173]
在一个实施方案中,口服剂型基本上由约700mg至约740mg菠萝蛋白酶,优选约720mg菠萝蛋白酶、约550mg至约650mg丁酸钠,优选约600mg丁酸钠、约850mg l-苏氨酸至约
950mg l-苏氨酸,优选约900mg l-苏氨酸、约10μg维生素d至约15μg维生素d,优选约12.5μg维生素d和任选约100mg薄荷醇至约110mg薄荷醇,优选约105mg薄荷醇组成。
[0174]
在一个实施方案中,口服剂型基本上由700mg至740mg菠萝蛋白酶,优选720mg菠萝蛋白酶、550mg至650mg丁酸钠,优选600mg丁酸钠、850mg l-苏氨酸至950mg l-苏氨酸,优选900mg l-苏氨酸、10μg维生素d至15μg维生素d,优选12.5μg维生素d和任选100mg薄荷醇至110mg薄荷醇,优选105mg薄荷醇组成。
[0175]
在一个实施方案中,口服剂型被配制成每位受试对象每天两次给药4.22克的剂型。在该实施方案中,口服剂量提供薄荷醇140mg、菠萝蛋白酶960mg、苏氨酸1800mg、丁酸钠1200mg和胆钙化醇25微克的总日剂量。
[0176]
在另一个实施方案中,口服剂型被配制成每位受试对象每天两次给药2.21克。在该实施方案中,口服剂量提供薄荷醇70mg、菠萝蛋白酶480mg、苏氨酸900mg、丁酸钠600mg和胆钙化醇12.5微克的总日剂量。
[0177]
在一个实施方案中,口服剂型包括至少一种包括靶向小肠的1440mg菠萝蛋白酶和288mg薄荷醇的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合,和至少一种包括结肠靶向剂量的1200mg丁酸(钠盐)、1800mg l-苏氨酸和0.025mg维生素d3的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合。
[0178]
在一个实施方案中,口服剂型包括至少一种包括靶向小肠的约480mg菠萝蛋白酶和约70mg薄荷醇的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合,和至少一种包括结肠靶向剂量的约600mg丁酸(钠盐)、约900mg l-苏氨酸和约0.0125mg维生素d3的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合。
[0179]
在一个实施方案中,口服剂型包括至少一种包括靶向小肠的480mg菠萝蛋白酶和70mg薄荷醇的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合,和至少一种包括结肠靶向剂量的600mg丁酸(钠盐)、900mg l-苏氨酸和0.0125mg维生素d3的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合。
[0180]
在一个实施方案中,口服剂型基本上由至少一种包括靶向小肠的约480mg菠萝蛋白酶和约70mg薄荷醇的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合,和至少一种包括结肠靶向剂量的约600mg丁酸(钠盐)、约900mg l-苏氨酸和约0.0125mg维生素d3的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合组成。
[0181]
在一个实施方案中,口服剂型基本上由至少一种包括靶向小肠的480mg菠萝蛋白酶和70mg薄荷醇的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合,和至少一种包括结肠靶向剂量的600mg丁酸(钠盐)、900mg l-苏氨酸和0.0125mg维生素d3的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合组成。
[0182]
在一个实施方案中,口服剂型包括至少一种包括靶向小肠的约960mg菠萝蛋白酶和约140mg薄荷醇的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合,和至少一种包括结肠靶向剂量的约1200mg丁酸(钠盐)、约1800mg l-苏氨酸和约0.025mg维生素d3的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合。
[0183]
在一个实施方案中,口服剂型包括至少一种包括靶向小肠的960mg菠萝蛋白酶和140mg薄荷醇的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合,和至少一种包括结肠靶向剂量的1200mg丁酸(钠盐)、1800mg l-苏氨酸和0.025mg维生素d3的肠溶
衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合。
[0184]
在一个实施方案中,口服剂型基本上由至少一种包括靶向小肠的约960mg菠萝蛋白酶和约140mg薄荷醇的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合,和至少一种包括结肠靶向剂量的约1200mg丁酸(钠盐)、约1800mg l-苏氨酸和约0.025mg维生素d3的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合组成。
[0185]
在一个实施方案中,口服剂型基本上由至少一种包括靶向小肠的960mg菠萝蛋白酶和140mg薄荷醇的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合,和至少一种包括结肠靶向剂量的1200mg丁酸(钠盐)、1800mg l-苏氨酸和0.025mg维生素d3的肠溶衣丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任意组合组成。
[0186]
在一个实施方案中,口服剂型提供了包括在肠微生物组中的每个肠上皮细胞和细菌的组分浓度,如表1所示。
[0187]
在一个实施方案中,口服剂型包括一种或多种丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒或其任何组合。
[0188]
在一个实施方案中,口服剂型包括组合物,所述组合物包括或基本上由两种不同类型的丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒组成,其中每种不同类型被配制为将其内容物释放到胃肠道的不同部分。在一个实施方案中,胃肠道的不同部分是十二指肠(本文也称为“肠上段”)和结肠(本文也称为“肠下段”)。
[0189]
申请人惊奇地发现,当组合物的组分被配制成两种不同类型的丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒(本文称为a型和b型)时,本发明的组合物的功效增加,其中每种类型被配制用于将其中所含的组分递送至肠的特定部分。
[0190]
在一个实例中,组合物的组分通过同时作用以减少肠上段(a型)中的疼痛,整个上肠和肠下段(a型)中的炎症和恢复肠下段(b型)中的紧密连接功能和粘蛋白产生而一起作用以缓解ibd和/或ibs的症状。在小鼠(实施例11和12)和组织病理学(实施例14)中获得的改进的内窥镜检查结果中可以清楚地看到申请人设计的该方法的意想不到的益处。
[0191]
在一个实施方案中,两种不同类型的丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒是a型和b型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒,其中所述a型和b型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒各自包括组合物的至少一种组分,优选至少两种组分。
[0192]
在一个实施方案中,a型和b型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒各自包括至少一种彼此不同的所述组合物组分,优选至少两种彼此不同的所述组合物组分。
[0193]
在一个实施方案中,a型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒包括或基本上由菠萝蛋白酶组成。在一个实施方案中,a型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒包括薄荷醇。
[0194]
在一个实施方案中,a型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒包括一定量的菠萝蛋白酶,其在受试对象的回肠/小肠中提供约10至40fg/细菌、约15至35fg/细菌、约20至30fg/细菌、优选约28fg/细菌、优选约25fg/细菌、优选约20fg/细菌的菠萝蛋白酶剂量。在一个实施方案中,剂量是有效剂量。
[0195]
在一个实施方案中,a型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒包括一定量
苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任意组合、丁酸钠和维生素d组成。
[0210]
在一个实施方案中,b型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒基本上由l-苏氨酸、丁酸钠和维生素d组成。在一个实施方案中,维生素d是维生素d3。
[0211]
在一个实施方案中,维生素d是维生素d3。
[0212]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由约67.5至约2700mg、优选约112.5至约2250mg、约250至约2000mg、约500至约1900mg、约900至约1800mg、优选约1800mg的l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任意组合组成。在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由约1800mg、优选约900mg、优选约450mg的l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任意组合组成。
[0213]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由约67.5至约2700mg、优选约112.5至约2250mg、约250至约2000mg、约500至约1900mg、约900至约1800mg、优选约1800mg l-苏氨酸组成。在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由约1800mg、优选约900mg、优选约450mg l-苏氨酸组成。
[0214]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由67.5至2700mg、优选112.5至2250mg、250至2000mg、500至1900mg、900至1800mg、优选1800mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合组成。在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由1800mg、优选900mg、优选450mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任意组合组成。
[0215]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由67.5至2700mg、优选112.5至2250mg、250至2000mg、500至1900mg、900至1800mg、优选1800mg l-苏氨酸组成。在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由1800mg,优选900mg,优选450mg l-苏氨酸组成。
[0216]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由约45-1800mg丁酸钠,优选约75至约1650mg、约250至约1500mg、约500至约1400mg、约750至约1500mg、约1000至约1400mg、约1100至约1300mg、优选约1200mg丁酸钠组成。在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括约1200mg、优选约600mg、优选约300mg丁酸钠。
[0217]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由45至1800mg丁酸钠、优选75至1650mg、250至1500mg、500至1400mg、750至1500mg、1000至1400mg、1100至1300mg、优选1200mg丁酸钠组成。在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由1200mg、优选600mg、优选300mg丁酸钠组成。
[0218]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由约4至约150μg、约6.5至约140μg、约13至约130μg、约25至约120μg、约35至约110μg、约50至约105μg、优选约100μg维生素d组成。
[0219]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本
上由4至150μg、6.5至140μg、13至130μg、25至120μg、35至110μg、50至105μg、优选100μg维生素d组成。
[0220]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由约1至约50μg维生素d、优选约10至约40μg、约20至约30μg、优选约25μg维生素d组成。
[0221]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由1至50μg维生素d、优选10至40μg、20至30μg、优选25μg维生素d组成。
[0222]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由约5至约30μg维生素d、优选约10至约25μg、约12至约13μg、优选约12.5μg维生素d组成。
[0223]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括或基本上由5至30μg维生素d、优选10至25μg、12至13μg、优选12.5μg维生素d组成。
[0224]
在一个实施方案中,维生素d是胆钙化醇(维生素d3)。
[0225]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒可包括b1和b2型亚型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒。
[0226]
在一个实施方案中,b1型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒中包括的l-苏氨酸和丁酸钠组分,b2型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒中包括的维生素d组分。
[0227]
包括b1和b2亚型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的另外的实施方案在本文中被具体考虑为本文所述的所有具体实施方案的选择,并且针对b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒列出。
[0228]
在一些实施方案中,丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒的a型和/或b型修饰以用于一种或多种组分的差异释放,包括持续释放和延迟释放。本领域技术人员可以根据本领域已知和描述的任何改进释放剂型设计口服剂型(参见例如美国专利7,108,865,其公开内容在此引入作为参考)。
[0229]
在一些实施方案中,丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒包括水溶性、水不溶性或肠溶衣。
[0230]
在胃的ph下相对不溶和不可渗透,但在小肠和结肠的ph下更可溶和可渗透的肠溶性和其它ph敏感性聚合物包括聚丙烯酰胺、邻苯二甲酸酯衍生物如碳水化合物的酸邻苯二甲酸酯、直链淀粉乙酸邻苯二甲酸酯、乙酸邻苯二甲酸纤维素、其它纤维素酯邻苯二甲酸酯、纤维素醚邻苯二甲酸酯、羟丙基纤维素邻苯二甲酸酯、羟丙基乙基纤维素邻苯二甲酸酯、羟丙基甲基纤维素邻苯二甲酸酯、甲基纤维素邻苯二甲酸酯、聚乙酸乙烯邻苯二甲酸酯、聚乙酸乙烯邻苯二甲酸氢酯、纤维素乙酸钠邻苯二甲酸酯、淀粉酸邻苯二甲酸酯、苯乙烯-马来酸邻苯二甲酸二丁酯共聚物、苯乙烯-马来酸聚乙酸乙烯邻苯二甲酸酯共聚物、苯乙烯和苹果酸共聚物、聚丙烯酸衍生物如丙烯酸和丙烯酸酯共聚物、聚甲基丙烯酸及其酯、聚丙烯酸甲基丙烯酸共聚物、虫胶、乙酸乙烯酯和巴豆酸共聚物。优选的ph敏感性聚合物包括虫胶;邻苯二甲酸酯衍生物,特别是邻苯二甲酸乙酸纤维素、聚乙酸乙烯酯邻苯二甲酸酯和邻苯二甲酸羟丙基甲基纤维素;聚丙烯酸衍生物,特别是与丙烯酸和丙烯酸酯共聚物共混的聚甲基丙烯酸甲酯;以及乙酸乙烯酯和巴豆酸共聚物。
[0231]
在一个实施方案中,a型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒包括肠溶
衣。在一个实施方案中,肠溶衣在a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒上形成外层。在一些实施方案中,肠溶衣包括在a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的内层中。
[0232]
在一个实施方案中,a型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒与在小肠上部释放其中包括的组分的赋形剂一起配制。在一个实施方案中,赋形剂包括一种或多种稀释剂、粘合剂、润滑剂和崩解剂。
[0233]
在一个实施方案中,稀释剂是微晶纤维素或磷酸二钙二水合物或其组合。在一个实施方案中,崩解剂是交聚维酮或交联羧甲基纤维素钠或其组合。在一个实施方案中,聚合物是羟丙基甲基纤维素或邻苯二甲酸羟丙基甲基纤维素hp 55或eudragit l100-55。在一个实施方案中,润滑剂是硬脂酸镁或滑石或其组合。
[0234]
在一个实施方案中,b型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒与在小肠下部释放其中包括的组分的赋形剂一起配制。在一个实施方案中,赋形剂包括一种或多种稀释剂、粘合剂、润滑剂和崩解剂。
[0235]
在一个实施方案中,稀释剂是微晶纤维素或磷酸二钙二水合物或其组合。在一个实施方案中,崩解剂是交聚维酮或交联羧甲基纤维素钠或其组合。在一个实施方案中,聚合物是羟丙基甲基纤维素或乙基纤维素或eudragit s100或虫胶或eudraguard生物。在一个实施方案中,润滑剂是硬脂酸镁或滑石或其组合。
[0236]
在一个实施方案中,b型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒包括肠溶衣。在一个实施方案中,肠溶衣在b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒上形成外层。在一些实施方案中,肠溶衣包括在b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的内层中。
[0237]
重要的是,将肠溶衣设计成在受试对象胃肠(gi)道区域在发明人确定的最佳位置从丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒中溶解,以将其中包括的组合物的组分释放到胃肠道中。
[0238]
在一个实施方案中,肠溶衣在约ph6.0从a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒中溶解。在一个实施方案中,ph《ph6.0。
[0239]
在一个实施方案中,肠溶衣在预定的ph下从a型微粒中溶解。在一个实施方案中,预定ph为约ph6.0。在一个实施方案中,预定ph》ph6.0。
[0240]
在一个实施方案中,配制肠溶衣以将菠萝蛋白酶和薄荷醇从a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒释放到受试对象的回肠/小肠中。
[0241]
在一个实施方案中,肠溶衣在受试对象的回肠/小肠中从a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒中溶解,释放菠萝蛋白酶和薄荷醇。
[0242]
在一个实施方案中,肠溶衣在中性ph下从b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒中溶解。在一个实施方案中,ph》ph6.5。在一个实施方案中,ph为约7.0。
[0243]
在一个实施方案中,肠溶衣在预定的ph下从b型微粒溶解。在一个实施方案中,预定ph是中性ph。在一个实施方案中,ph》ph6.5。在一个实施方案中,ph为约7.0。
[0244]
在一个实施方案中,配制肠溶衣以从接近和/或在受试对象结肠中的丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒中释放l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合、丁酸钠和维生素d。
[0245]
在一个实施方案中,配制肠溶衣以从接近和/或在受试对象结肠中的丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒中释放l-苏氨酸、丁酸钠和维生素d。
[0246]
在一个实施方案中,肠溶衣从接近和/或在受试对象结肠中的b型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒中溶解,释放l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任意组合、丁酸钠和维生素d。
[0247]
在一个实施方案中,肠溶衣从接近和/或在受试对象结肠中的b型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒中溶解,释放l-苏氨酸、丁酸钠和维生素d。
[0248]
在一些实施方案中,肠溶衣被设计成将组合物的组分递送至胃肠道的预定区域。在一些实施方案中,肠溶衣将组合物的组分递送至胃肠道的预定区域。
[0249]
在一些实施方案中,肠溶衣被设计为在预定的ph下在受试对象的胃肠道内从丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒中溶解以释放包括在其中的组合物的组分。在一些实施方案中,肠溶衣在预定ph下在受试对象的胃肠道内溶解。
[0250]
在一些实施方案中,配制a型和/或b型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒以将有效量的组合物的至少一种,优选至少两种,优选至少三种,优选至少四种,优选五种组分递送至受试对象胃肠道中的细菌。
[0251]
在一些实施方案中,不同类型的丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒在肠溶衣溶解后将有效量的组合物的至少一种,优选至少两种,优选至少三种,优选至少四种,优选五种组分递送至受试对象胃肠道中的细菌。
[0252]
在一些实施方案中,有效量的递送包括递送至受试对象的回肠/小肠。在一些实施方案中,在受试对象的回肠/小肠中,有效量是10至40fg/细菌、15至35fg/细菌、20至30fg/细菌、优选28fg/细菌、优选25fg/细菌的菠萝蛋白酶。
[0253]
在一个实施方案中,有效量是受试对象回肠/小肠中10至40fg/细菌、15至35fg/细菌、20至30fg/细菌、优选28fg/细菌、优选25fg/细菌、优选20fg/细菌的菠萝蛋白酶。
[0254]
在一些实施方案中,有效量的递送包括递送至受试对象的结肠。在一些实施方案中,有效量是受试对象回肠/小肠中25至125pg/回肠肠上皮细胞(pg/ie)、50至100pg/ie、60至90pg/ie、70至80pg/ie、优选75pg/ie的菠萝蛋白酶。
[0255]
在一个实施方案中,至少第一个丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒包括足以在受试对象的回肠/小肠中提供25至125pg/回肠肠上皮细胞(pg/ie)、50至100pg/ie、60至90pg/ie、70至80pg/ie、优选75pg/ie的有效剂量的量的菠萝蛋白酶。
[0256]
如本领域技术人员将理解的,药物领域技术人员可以通过遵循肠溶衣的指导原则,例如根据常规制剂实践,制备将在胃肠道中的预定位置溶解的多种不同类型的肠溶衣,参见例如(allen)和(encyclopaedia of pharmaceutical technology),其通过引用并入本文。据信这种肠溶衣的制备在本领域的技术范围内。例如,本文所述的组合物经配制以促进将溴灵靶向递送至结肠。结肠靶向口服药物发现系统是本领域熟知的(amidon,2016)。
[0257]
本技术提供关于本发明的组合物的组分将在受试对象的胃肠道中释放的实质公开内容。因此,相信本领域技术人员可以按照本技术公开内容中提供的指导结合公知常识配制合适的肠溶衣以将菠萝蛋白酶和薄荷醇成分释放至受试对象的回肠/小肠。
[0258]
例如,组合物的组分可以分散在任何药学上可接受的载体(carrier)中,其可以是立即释放或缓慢释放载体(carrier)。载体(carrier)可包括如本领域已知的微晶纤维素
(mcc)、葡聚糖、玉米淀粉、面粉、滑石、蔗糖、甘露醇、乳糖、碳酸钙、聚乙烯吡咯烷酮(pvp)、聚环氧乙烷、羟丙基甲基纤维素(hpmc)、羟丙基纤维素(hpc)、聚乙烯醇(pva)等。
[0259]
在一个非限制性实例中,可以将载体(carrier)压缩成固体或半固体,然后用聚合物包衣包被以改变组分的释放曲线。包衣可包括水溶性聚合物,包括聚乙烯吡咯烷酮(pvp)、聚乙烯聚吡咯烷酮(交聚维酮)或聚乙二醇、或水不溶性聚合物,包括纤维素醚、纤维素酯、乙酸纤维素、乙基纤维素、聚乙酸乙烯酯、基于丙烯酸乙酯和甲基丙烯酸甲酯的中性共聚物、具有季铵基团的丙烯酸酯和甲基丙烯酸酯的共聚物、ph不敏感的甲基丙烯酸铵共聚物、及其混合物。包衣还可以包括甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基甲基纤维素(hpmc)、羟丙基纤维素(hpc)或这些天然聚合物的组合。例如,甲基纤维素与羟丙基甲基纤维素(hpmc)组合使用是众所周知的。
[0260]
各种口服剂型的标准成分和制备方法描述于“雷明顿:药学的科学和实践,”通过引用并入本文。另外的赋形剂包括但不限于润滑剂、崩解剂等。
[0261]
在一个实施方案中,本发明的组合物包括本文所述的单位剂型,优选本文所述的口服剂型,其在单个容器中包括本文所述的a型和b型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒的混合物。
[0262]
在一个实施方案中,本发明的组合物包括本文所述的单位剂型,优选本文所述的口服剂型,其在单个容器中包括本文所述的a型或b型丸剂、片剂、小片剂、胶囊、颗粒剂、颗粒或微粒。
[0263]
在一个实施方案中,容器是小袋。在一个实施方案中,混合物悬浮在载体(carrier)中。在一个实施方案中,载体(carrier)是消耗性含水液体,其选自水、果汁、人造果汁、人工调味的饮料、动物乳、乳清、基于乳清的饮料、植物乳和坚果乳组成的组。在一个实施方案中,载体(carrier)是可消耗的凝胶。在一个实施方案中,消耗性凝胶是酸奶。
[0264]
在一个实施方案中,口服剂型包括a型和b型颗粒或微粒,优选微粒。
[0265]
在一个实施方案中,口服剂型包括a型或b型颗粒或微粒,优选微粒。
[0266]
在一个实施方案中,口服剂量包括悬浮微粒。在一个实施方案中,悬浮微粒悬浮在液体或凝胶中。
[0267]
在一个实施方案中,口服剂量包括分散的微粒。在一个实施方案中,分散的微粒分散在粉末中。
[0268]
在一个实施方案中,口服剂量包括在单个容器中的a型和b型微粒的混合物。在一个实施方案中,混合物悬浮在载体(carrier)中。在一个实施方案中,载体(carrier)是消耗性液体,其选自水、果汁、人造果汁、人工调味的饮料、动物乳、植物乳、坚果乳、乳清和基于乳清的饮料组成的组。在一个实施方案中,载体(carrier)是可消耗的凝胶。在一个实施方案中,消耗性凝胶是酸奶。
[0269]
在一个实施方案中,受试对象是哺乳动物。在一个实施方案中,受试对象是人。受试对象可以是任何受试对象,包括男性、女性、成人、老年或儿科受试对象。在一些实施方案中,受试对象已经临床诊断为ibd,特别是溃疡性结肠炎或克罗恩病。本文还考虑了在哺乳动物中的兽医用途。因此,在一些实施方案中,受试对象是非人哺乳动物。在一个实施方案中,非人哺乳动物是猫或狗。
[0270]
另一方面,本发明涉及基本上由本发明的组合物组成的口服剂型,其中组合物的
至少两种组分包括在延迟释放制剂中。
[0271]
本文特别考虑的本发明的口服剂型的实施方案基本上由其中组合物的至少两种组分包括在延迟释放制剂中的本发明的组合物组成,是本文公开的本发明的方面内考虑的所有实施方案,其为包括(a)-(d)的组合物和包括约1至约6g本发明的组合物的口服剂型。
[0272]
在另一个方面,本发明涉及单位剂型,优选口服剂型,其包括或基本上由表1中列出的组分组成,所述组分的量优选以总剂量/80kg人(mg/天)显示,其中所述组分包括在所示的a型或b型中,其中a型和b型分别靶向小肠和大肠或被配制用于分别在小肠和大肠中释放所示的组分。
[0273]
表1-garp组分
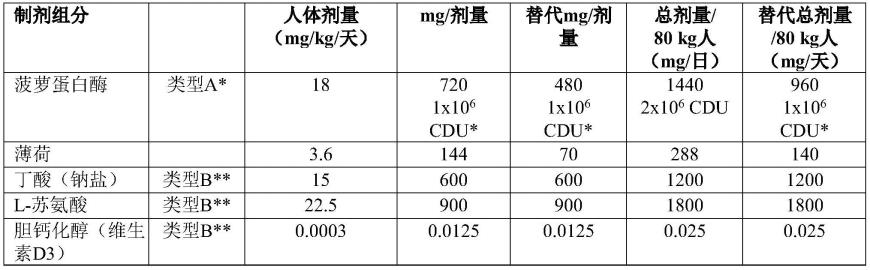
[0274][0275]
*如本文所考虑的a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒。
[0276]
***如本文所考虑的b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒。
[0277]
在另一方面,本发明涉及包括作为离散部分的a型和b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的单位剂型,其中
[0278]
a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括菠萝蛋白酶并且被配制用于将菠萝蛋白酶释放至受试对象的小肠,其中a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒任选地包括薄荷醇,以及
[0279]
b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由丁酸钠和一种或多种l-苏氨酸,l-色氨酸,l-谷氨酰胺,l-精氨酸或l-甲硫氨酸和维生素d组成,并且b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒被配制用于在受试对象的肠下段中释放。
[0280]
在另一方面,本发明涉及包括作为离散部分的a型和b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的单位剂型,其中
[0281]
a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由720mg的菠萝蛋白酶组成,并且配制用于将所述菠萝蛋白酶释放到受试对象的所述小肠中,其中所述a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒任选地包括144mg的薄荷醇,并且,
[0282]
b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由600mg丁酸钠、900mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合,以及0.0125mg维生素d组成,并且配制用于将丁酸钠、l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合,以及维生素d释放至受试对象的下肠道。
[0283]
在另一方面,本发明涉及包括作为离散部分的a型和b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的单位剂型,其中
[0284]
a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由720mg的菠萝蛋白酶组
成,并且配制用于将所述菠萝蛋白酶释放到受试对象的所述小肠中,其中所述a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒任选地包括105mg的薄荷醇,并且,
[0285]
b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由600mg丁酸钠、900mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合,以及0.0125mg维生素d组成,并且配制用于将丁酸钠、l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合,以及维生素d释放至受试对象的下肠道。
[0286]
在另一方面,本发明涉及包括作为离散部分的a型和b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的单位剂型,其中
[0287]
a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由480mg的菠萝蛋白酶组成,并且配制用于将所述菠萝蛋白酶释放到受试对象的所述小肠中,其中所述a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒任选地包括70mg的薄荷醇,并且,
[0288]
b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由600mg丁酸钠、900mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合,以及0.0125mg维生素d组成,并且配制用于将丁酸钠、l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合,以及维生素d释放至受试对象的下肠道。
[0289]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由600mg丁酸钠、900mg l-苏氨酸和0.0125mg维生素d组成。
[0290]
在另一方面,本发明涉及包括作为离散部分的a型和b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的单位剂型,其中
[0291]
a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由1440mg的菠萝蛋白酶组成,并且配制用于将所述菠萝蛋白酶释放到受试对象的所述小肠中,其中所述a型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒任选地包括288mg的薄荷醇,并且,
[0292]
b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由1200mg丁酸钠、1800mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合,以及0.025mg维生素d组成,并且配制用于将丁酸钠、l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合,以及维生素d释放至受试对象的下肠道。
[0293]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由1200mg丁酸钠、1800mg l-苏氨酸和0.025mg维生素d组成。
[0294]
在一个实施方案中,a型和b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒具有彼此相似的大小和特征,并且可以根据待治疗的病症的阶段以任何有用的比例混合。
[0295]
在一个实施方案中,a型和b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒以1.94a部分对2.28b部分(w/w,以mg计)的比例混合,提供薄荷醇70:菠萝蛋白酶480:苏氨酸900:丁酸钠600:胆钙化醇0.0125的组分比例。
[0296]
在另一个实施方案中,a型和b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒以2.91a部分对2.28b部分(w/w,以mg计)的比例混合,提供薄荷醇105:菠萝蛋白酶720:苏氨酸900:丁酸钠600:胆钙化醇0.0125的组分比例。
[0297]
本发明人还意外地发现,包括丁酸钠、l-苏氨酸和维生素d的组合物通过促进与胃肠功能障碍相关的损害的愈合而意外地有效治疗ibd/ibs的症状。当如本文所述一起使用时,这些组分、丁酸钠、l-苏氨酸和维生素d,协同作用以增加涉及肠道完整性的几种粘蛋白
基因的表达,维持肠道微生物组多样性和预防炎症。在实施例10中给出的结果中可以看到这种效果。当组分单独给药时,这些相同的基因不受影响。在实施例11中发现了丁酸钠,苏氨酸和维生素d3的组合在小鼠模型中有效治疗结肠炎的进一步证明。如在用tnbs诱导后7天所测量的,所述实验中的小鼠表现出损害评分显著降低135%。从实施例12获得的结果进一步证明丁酸钠,苏氨酸和维生素d3的组合在治疗tnbs诱导的损害中具有与2mg/kg泼尼松龙相似的功效。
[0298]
因此,在另一方面,本发明涉及包括丁酸钠、l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸中的一种或多种和维生素d的组合物。
[0299]
在一个实施方案中,组合物基本上由丁酸钠和l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸和维生素d中的一种或多种组成。
[0300]
在一个实施方案中,组合物被配制用于将丁酸钠、l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合和维生素d释放至受试对象的肠下段。
[0301]
在一个实施方案中,当施用组合物时,向受试对象的肠下段施用丁酸钠、l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合和维生素d。
[0302]
在一个实施方案中,组合物包括丁酸钠、l-苏氨酸和维生素d。
[0303]
在一个实施方案中,组合物基本上由丁酸钠、l-苏氨酸和维生素d组成。
[0304]
在另一方面,本发明涉及包括600mg丁酸钠、900mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任意组合和0.0125mg维生素d的组合物。
[0305]
在一个实施方案中,组合物包括600mg丁酸钠,900mg l-苏氨酸和0.0125mg维生素d。
[0306]
在一个实施方案中,组合物基本上由600mg丁酸钠、900mg l-苏氨酸和0.0125mg维生素d组成。
[0307]
在一个实施方案中,组合物被配制用于将丁酸钠、l-苏氨酸和维生素d释放至受试对象的肠下段。
[0308]
在一个实施方案中,组合物在施用时将丁酸钠、l-苏氨酸和维生素d施用至受试对象的肠下段。
[0309]
在另一方面,本发明涉及包括1200mg丁酸钠、1800mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任意组合和0.025mg维生素d的组合物。
[0310]
在一个实施方案中,组合物包括1200mg丁酸钠、1800mg l-苏氨酸和0.025mg维生素d。
[0311]
在一个实施方案中,组合物基本上由1200mg丁酸钠、1800mg l-苏氨酸和0.025mg维生素d组成。
[0312]
在一个实施方案中,组合物被配制用于将丁酸钠、l-苏氨酸和维生素d释放至受试对象的肠下段。
[0313]
在一个实施方案中,组合物在施用时将丁酸钠、l-苏氨酸、维生素d施用至受试对象的肠下段。
[0314]
本文特别考虑的与包括和/或基本上由丁酸钠、l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合和维生素d组成的组合物有关的本发明各方面的实施方案是本文描述的与单位剂型和口服剂型有关的所有实施方案,包括其测定、配制和给药。
[0315]
在另一方面,本发明涉及包括b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的单位剂型,其中
[0316]
b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括丁酸钠和一种或多种l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸和维生素d。
[0317]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由丁酸钠和一种或多种l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸和维生素d组成。
[0318]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒被配制用于将丁酸钠和l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸和维生素d中的一种或多种释放到受试对象的肠下段。
[0319]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒被配制用于将丁酸钠和l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸和维生素d中的一种或多种释放到受试对象的肠下段。
[0320]
在一个实施方案中,当施用单位剂型时,将b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒施用至受试对象的肠下段。
[0321]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括丁酸钠、l-苏氨酸和维生素d。
[0322]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由丁酸钠、l-苏氨酸和维生素d组成。
[0323]
在一个实施方案中,单位剂型是本文所述的口服剂型。
[0324]
在另一方面,本发明涉及包括b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的单位剂型,其中
[0325]
b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由600mg丁酸钠、900mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任意组合和0.0125mg维生素d组成。
[0326]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括600mg丁酸钠、900mg l-苏氨酸和0.0125mg维生素d。
[0327]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由600mg丁酸钠、900mg l-苏氨酸和0.0125mg维生素d组成。
[0328]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒被配制用于将丁酸钠、l-苏氨酸和维生素d释放至受试对象的肠下段。
[0329]
在一个实施方案中,当施用单位剂型时,将b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒施用至受试对象的肠下段。
[0330]
在一个实施方案中,单位剂型是本文所述的口服剂型。
[0331]
在另一方面,本发明涉及包括b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒的单位剂型,其中
[0332]
b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由1200mg丁酸钠、1800mg l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任意组合和0.025mg维生素d组成。
[0333]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒包括1200mg丁酸钠、1800mg l-苏氨酸和0.025mg维生素d。
[0334]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒基本上由1200mg丁酸钠、1800mg l-苏氨酸和0.025mg维生素d组成。
[0335]
在一个实施方案中,b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒被配制用于将丁酸钠、l-苏氨酸和维生素d释放至受试对象的肠下段。
[0336]
在一个实施方案中,当施用单位剂型时,将b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒施用至受试对象的肠下段。
[0337]
本文特别考虑的本发明上述相关组合物和b型丸剂、片剂、小片剂、颗粒剂、胶囊、颗粒或微粒(包括丁酸钠、l-苏氨酸、l-色氨酸、l-谷氨酰胺、l-精氨酸或l-甲硫氨酸或其任何组合和维生素d和/或基本上由其组成)的方面的实施方案是本文提出的涉及单位剂型和口服剂型的所有实施方案,单位剂型和口服剂型包括如本文所述的剂型的剂量、制剂和给药。
[0338]
方法
[0339]
在另一方面,本发明涉及减少细菌附着至受试对象的胃肠道细胞的方法,其包括使细菌与有效量的本发明的组合物、单位剂型或或口服剂型接触。
[0340]
在另一方面,本发明涉及减少细菌侵入受试对象的胃肠道细胞的方法,其包括使细菌与有效量的本发明的组合物、单位剂型或或口服剂型接触。
[0341]
在另一方面,本发明涉及改善受试对象的胃肠屏障完整性的方法,其包括向有需要的受试对象施用治疗有效量的本发明的组合物、单位剂型或口服剂型。
[0342]
在一方面,本发明涉及预防、治疗或控制ibd或ibs的方法,其包括向有需要的受试对象施用治疗有效量的本发明的组合物、单位剂型或口服剂型。
[0343]
在另一方面,本发明涉及至少部分缓解ibd或ibs的至少一种症状的方法,其包括向有需要的受试对象施用治疗有效量的本发明的组合物、单位剂型或口服剂型。
[0344]
在一个实施方案中,至少一种症状选自包括腹泻、腹痛、腹部绞痛、发烧、疲劳、恶心、气胀、气胀、体重减轻、食欲减退和血便的组。
[0345]
在另一方面,本发明涉及改善与ibd或ibs相关的至少一种参数的方法,其包括向有需要的受试对象施用治疗有效量的本发明的组合物、单位剂型或口服剂型。
[0346]
在一个实施方案中,与ibd或ibs相关的至少一个参数选自包括以下的组:
[0347]
●
炎症标志物如il-6、il-8、il-17a、il-17f、il-18、il-21、il-22、tl1a、tgf-β、icam-1、ifn-γ、madcam-1和e-选择蛋白的循环血清水平
[0348]
●
粪便炎症标志物如钙卫蛋白、乳铁蛋白和溶菌酶
[0349]
●
血清氧化应激标志物如氧化ldl、血清氧化性和f2-异前列素的循环水平
[0350]
●
粪便样本中的生物病原体,例如属于变形菌门肠杆菌科大肠杆菌的细菌、变形菌门肠杆菌科克雷伯氏菌属、变形菌门假单胞菌科假单胞菌属、变形菌门肠杆菌科沙门氏菌属、变形菌门脱硫弧菌科沃兹沃氏菌(bilophilia wadsworthia)、变形菌门脱硫弧菌科脱硫弧菌属、变形菌门脱硫弧菌科脱硫单胞菌属、变形菌门弯曲杆菌科简明弯曲菌、变形菌门弯曲杆菌科空肠弯曲杆菌、拟杆菌门拟杆菌科肠毒素脆弱类杆菌、放线菌红蝽菌科atopobium parvulum和厚壁菌门梭菌科艰难梭菌。
[0351]
在上述方面中:
[0352]
在一个实施方案中,受试对象患有溃疡性结肠炎。在一个实施方案中,受试对象患有克罗恩病。在一个实施方案中,受试对象患有ibs。在一个实施方案中,给药是口服给药。
[0353]
在一个实施方案中,在餐前约20-90min,优选约30-60min,优选约45min给药。在一个实施方案中,在餐前20-90min,优选30-60min,优选45min给药。
[0354]
在一个实施方案中,在膳食前每天给药一次至五次,优选在膳食前每天给药三次,优选在膳食前每天给药两次。在一个实施方案中,给药在早餐和午餐之前。在一个实施方案中,给药在早餐和晚餐之前。
[0355]
在一个实施方案中,在餐后约20-90min,优选约30-60min,优选约45min给药。在一个实施方案中,在餐后20-90min,优选30-60min,优选45min给药。
[0356]
在一个实施方案中,在进餐后每天给药一次至五次,优选在进餐后每天给药三次,优选在进餐后每天给药两次。在一个实施方案中,是在早餐和午餐之后给药。在一个实施方案中,是在早餐和晚餐之后给药。
[0357]
需要预防,治疗或控制ibd或ibs的受试对象是诊断患有这种病症,易患这种病症和/或处于这种病症的风险中,或已经从这种病症恢复或从这种病症缓解的受试对象。由于遗传和/或环境因素,受试对象可能易患该病症和/或处于该病症的风险中。
[0358]
有效预防,治疗或控制所述病症的本文所述的组合物、单位剂型或口服剂型的量将随病症的性质和严重程度以及施用提取物的途径,以及受试对象的特定因素如他们的年龄、体重、性别和既往病史而变化。
[0359]
通常,用于治疗急性病症的组合物或剂型将包括比用于治疗慢性病症的更大量的本发明的菠萝蛋白酶组合物、单位剂量或口服剂量。与本发明的技术人员结合本发明的公开内容,认为可实现针对急性或慢性病症的特定剂型的制剂。
[0360]
在一些实施方案中,受试对象是非人哺乳动物。
[0361]
在一个实施方案中,给予非人哺乳动物包括本文所述的组合物或单位剂型的给药,其包括或基本上由本文所述的口服剂型组成。
[0362]
在一个实施方案中,给予非人哺乳动物的口服剂型包括约1至约50mg菠萝蛋白酶、优选约5至约25mg、约7至约20mg、约9至约18mg、约10至约15mg、约13mg菠萝蛋白酶/kg受试对象。
[0363]
在一个实施方案中,给予非人哺乳动物的口服剂型包括约9mg/kg、约13mg或约18mg菠萝蛋白酶/kg受试对象。
[0364]
在一个实施方案中,给予非人哺乳动物的口服剂型包括1至50mg菠萝蛋白酶、优选5至25mg、7至20mg、9至18mg、10至15mg或13mg菠萝蛋白酶/kg受试对象。
[0365]
在一个实施方案中,给予非人哺乳动物的口服剂型包括9mg/kg、13mg或18mg菠萝蛋白酶/kg受试对象。
[0366]
在一个实施方案中,口服剂型是基于从本文考虑的人剂量的技术上可接受的转换,使用行业指南“估计成人健康志愿者治疗药物初始临床试验中的最大安全起始剂量(estimating the maximum safe starting dose in initial clinical trials for therapeutics in adult healthy volunteers)”2005年7月由美国卫生和公众服务部食品和药物管理中心出版,用于药物评价和研究(cder),(其全部内容通过引用并入本文)。
[0367]
在一个实施方案中,将以mg/kg计的人剂量乘以1.8以提供以mg/kg计的狗剂量。
[0368]
在一个实施方案中,非人哺乳动物是家养宠物。在一个实施方案中,家养宠物选自狗、猫、大鼠、小鼠、仓鼠、豚鼠、雪貂和沙鼠组成的组。在一个实施方案中,家养宠物是狗。在一个实施方案中,家庭宠物是猫。在参考专利说明书、其它外部文件或其它信息源的本说明书中,这通常是出于提供讨论本发明特征的上下文的目的。除非另有明确说明,否则对此类外部文献的引用不应被解释为承认此类文献;或者,这种信息源在任何管辖范围内都是现有技术,或者形成本领域公知常识的一部分。
[0369]
现在将参考以下实施例以非限制性方式说明本发明。
[0370]
1.实施例
[0371]
一般方法
[0372]
巨噬细胞细胞培养:将人单核细胞thp-1细胞在rpmi 1640培养基中培养,该培养基经修饰含有2mm l-谷氨酰胺、10mm hepes、1mm丙酮酸钠、4500mg/l葡萄糖和1500mg/l碳酸氢钠、并补充有10%fbs、100u/ml青霉素、100mg/ml链霉素、5mmβ-巯基乙醇。细胞密度从未超过1
×
106/ml。为了诱导分化,将thp-1细胞以5-10
×
105细胞/cm2接种到24孔板中,并用200nm pma处理48h。48h后,洗涤巨噬细胞并在pma和无抗生素培养基中生长24h,然后开始实验。将细胞培养物在潮湿的5%co2培养箱中在37℃下孵育。所有实验均在10-30代内的细胞上进行。
[0373]
caco-2细胞培养:使人结肠直肠腺癌细胞系caco-2-bbe1生长并维持在补充有10%v/v胎牛血清(fbs)、4mm l-谷氨酰胺、100u/ml青霉素和100mg/ml链霉素的dulbecco改良eagle培养基(dmem)中。在解冻后12代内对caco-2-bbe1细胞进行所有实验。将细胞培养物在潮湿的5%co2培养箱中在37℃下孵育。
[0374]
caco-2:ht-29-mtx 75:25共培养:该共培养模型用于模拟人结肠上皮(hilgendorh c,2000)。将caco-2细胞(第8代)和ht29-mtx细胞(第9代)以75:25的比例在含有10%fbs的dmem中合并。将合并的细胞(6.4
×
104细胞/ml)接种到每个烧瓶总共5ml的25cm2中。将共培养物在37℃下在5%co2气氛中孵育,每48h更新培养基。在接种后15天,将共培养物单层在dmem中洗涤三次并用5ml预热的测试溶液替换,然后孵育24h。
[0375]
菌株和生长条件:将hm 95、hm605、hm 615和hm484的aiec菌株在lb肉汤中培养。所有细菌在37℃下在空气中生长过夜,随后在新鲜培养基中1:100稀释,然后再孵育2h。在通过在ab
600nm
测量0.8证实的对数中期实验中使用细菌。
[0376]
跨上皮电阻(ter)测量:通过测量ter值来确定caco-2单层的完整性。紧密连接用作旁细胞扩散的屏障,其中ter指示上皮细胞之间的完整性水平(mynott tl,1999)。在测量ter之前,将细胞培养物平衡至室温30min。使用millicell-ers仪器(millipore,eschborn,germany)测量ter。
[0377]
细胞因子和tnf-α定量:使用市售elisa试剂盒测定il-8、il-6和tnf-α的水平。在孵育结束时,收集顶端和基底侧培养基,在400gav下离心5min并且将上清液冷冻在-80℃下直至分析。对冷冻上清液进行不超过一次重复/解冻循环。所有elisa均按照制造商说明执行。
[0378]
caco-2/thp-1巨噬细胞共培养系统的炎症模型:将caco-2-bbe1细胞以5
×
105个细胞/孔接种到24孔transwell插板(4.67cm2,0.4μm孔径)上。每3天更换细胞培养基直到细
胞完全分化(ter》1200/cm2)。在单独的24孔板中,以1
×
106细胞/孔接种thp-1单核细胞,并用200nm pma分化48h,然后在实验前在正常培养基中培养24h。在用rpmi1640替换所有培养基后,将含有caco-2分化单层的所有transwell插入物上样到含有分化thp-1细胞的孔中。在评价不同菠萝蛋白酶制剂的抗炎作用的实验中,将0.25ml测试样本应用于顶面24h,同时将50ng/ml的lps加入到该模型的基底侧。孵育24h后,收集顶面的培养物上清液测定il-8。
[0379]
用炎症介质lps、tnf-α、ifn-β刺激的caco-2极化单层的炎症模型:如前所述生成极化的caco-2模型。当细胞培养物达到》1000/cm2的基线ter时,通过将含有50ng/ml ifn-β,10μg/ml lps和5ng/ml tnfα的0.6ml添加到基底侧区室中来刺激单层。在加入刺激混合物后立即将0.25ml的garp
±
0-80μg/ml菠萝蛋白酶应用于顶端区室。孵育24h后,收集顶面的培养物上清液用于定量il-8。
[0380]
庆大霉素保护试验——细菌摄取、存活和复制的测定:用每个巨噬细胞30个细菌的感染复数(moi)感染thp1细胞。孵育3h后,除去培养基,加入含有100μg/ml庆大霉素的新鲜细胞培养基以杀死细胞外细菌。为了测定细胞内细菌的数目,在1和3h时,除去培养基,向各孔中加入0.5ml的1%triton x-100的去离子水溶液,保持5min,以裂解thp-1细胞。该浓度的triton x-100对细菌活力至少30min没有影响。将样本混合,稀释并接种在lb琼脂平板上以测定从裂解的单层中回收的菌落形成单位(cfu)的数目。将1h时的胞内细菌数量与rpmi无处理对照进行比较,并将其视为粘附细菌。细菌复制表示为感染后4h回收的细菌相对于庆大霉素处理1h后回收的细菌数量的平均百分比,定义为100%。
[0381]
基因表达的定量聚合酶链反应(qpcr)分析
[0382]
在rna提取之前,通过在4℃下以5,000g离心5min来收集细胞。将细胞团块在冰冷的pbs中洗涤三次,然后再悬浮于500μl冰冷的pbs中。使用purelink rna微型试剂盒提取每个样本2
×
106个细胞的总rna,使用高容量cdna rt试剂盒将1.5μg rna(a260/a280比率介于2.00和2.20之间)逆转录成cdna。使用powerup sybr green master预混液定量目的基因的表达。简言之,在使用biomek-4000自动液体处理器(beckman coulter,brea,ca,usa)的microamp光学384孔反应板中使用20ng cdna和500n m引物建立一式三份qpcr反应。在viia7实时pcr系统(thermo fisher scientific)中在以下条件下进行扩增:95℃持续20s,接着40个循环的95℃持续1s和60℃持续20s;以及熔融曲线阶段:95℃,15s;60℃,60s。使用前述2-δδct方法,使用quantstudio软件v1.3(applied biosystems)分析qpcr的结果。相对基因表达值通过使用gapdh和18s作为多个内源基因表达值标准化。
[0383]
统计分析。除非另有说明,结果由具有3个技术重复的3个独立实验(n=3)产生。用microsoft excel进行数据分析。使用sigmaplotv11说明结果,结果之间的变化表示为标准偏差(sd)。除非另有说明,使用sigmaplot v11通过单向anova和事后dunnett检验对数据进行统计学分析。p≤0.05的值被认为具有统计学显著性。值≤0.05-0.001无图形差异
[0384]
实施例1:组分和剂量建模
[0385]
本文所述的本发明组合物的组分列于下表2中,包括它们的来源。在一些实施方案中,通过将菠萝蛋白酶与表2a或2b中所示量的其余成分混合来制备组合物。
[0386]
表2a-组分
[0387][0388]
表2b:组合物
[0389][0390]
在garp给药后到达回肠和结肠的本发明组分的潜在剂量的建模。
[0391]
剂量调整建模
[0392]
为了确定在概念证明体外研究中待测试的菠萝蛋白酶的剂量范围,开发了以下胃肠分布模型。
[0393]
假设:
[0394]
●
小于1%的口服生物利用度
[0395]
●
菠萝蛋白酶片在回肠液中快速均匀溶解
[0396]
●
当菠萝蛋白酶进入结肠时保持其完整的生物活性
[0397]
●
菠萝蛋白酶在结肠中的混合是均匀的,并且不作为梯度混合物出现
[0398]
表2c:胃肠分布模型
[0399][0400]
回肠中的肠上皮细胞:为了计算回肠表面,我们认为它是长度为3m,直径为2cm的圆柱体(sender,2016)。然后,考虑到环状襞,总表面增加3倍(mudie dm,2014)。cattaneo和baratta(borley,2005),估计每个绒毛1000
±
3.4个细胞。由于有13
±
1villi/mm2,覆盖它们的细胞总数估计为1.35
×
10
10
。如果我们认为它们代表覆盖每个绒毛的12/50的隐窝(sender,2016)(teodori,1987),并且隐窝和绒毛的估计数目大致相同(sender,2016),则覆盖隐窝的细胞总数为3.24
±
0.14
×
109。因此,计算得到的总肠上皮细胞数为1
×
10
10
/3m
回肠。
[0401]
结肠中的肠上皮细胞:为了计算结肠的表面,我们认为它是长度为1.5m,直径为7.5cm的圆柱体(cattaneo l,1989),并且它是小肠的1/30(weiss l,1981),因为它缺乏绒毛。因此,每1.5m结肠的总肠上皮细胞数为3.3
×
108。
[0402]
回肠中菠萝蛋白酶的浓度:如果给60kg的人口服1.5g的回肠/结肠靶向的菠萝蛋白酶和一杯水,那么菠萝蛋白酶将以94
±
24ml(weiss l,1981)或16mg/ml分配。在该浓度下,假定菠萝蛋白酶片在回肠中完全溶解,每个细菌的最大暴露量为170fg/细菌。
[0403]
结肠中菠萝蛋白酶的浓度:如果给60kg的人口服1.5g的回肠/结肠靶向的菠萝蛋白酶,那么菠萝蛋白酶将分布在400ml的结肠液中或40μg/ml。在该浓度下,假定菠萝蛋白酶完全混入结肠液中,每个细菌的最大暴露量为38fg/细菌。
[0404]
每回肠肠上皮细胞的菠萝蛋白酶浓度:如果给60kg的人口服1.5g的回肠/结肠靶向的菠萝蛋白酶和一杯水,那么菠萝蛋白酶将以94
±
24ml(weiss l,1981)或16mg/ml分配。在该浓度下,假定菠萝蛋白酶片在回肠中完全溶解,每个肠上皮细胞的最大暴露量为150pg/肠上皮细胞。
[0405]
每个结肠肠上皮细胞的菠萝蛋白酶浓度:如果给60kg的人口服1.5g的回肠/结肠靶向的菠萝蛋白酶,那么菠萝蛋白酶将分布在400ml的结肠液中或40μg/ml。在该浓度下,假定菠萝蛋白酶完全混入结肠液中,每个细菌的最大暴露量为4.5ng/肠上皮细胞。
[0406]
使用上述模型,如果80kg的人服用靶向小肠的肠溶包衣的1440mg菠萝蛋白酶和288mg薄荷醇的总日剂量和靶向结肠的1200mg丁酸(钠盐)、1800mg的l-苏氨酸和0.025mg维生素d3的剂量,则肠微生物含有的每个肠上皮细胞和细菌将达到以下浓度(表3)。
[0407]
表3:每种garp制剂组分可达到的回肠和结肠浓度总结
[0408][0409]
在本文所述的体外实验中确定观察到的治疗有效剂量。
[0410]
表4概括了所观察到的各garp制剂组分的治疗有效剂量。
[0411]
表4:各garp制剂组分的观察到的治疗有效量的总结
[0412][0413]
注:不相关是指特定制剂组分对从ibd和ibs患者获得的aiec不发挥任何抗附着或抗侵袭作用。不希望受理论束缚,本发明人承认*未在体外测试,但公开的文献表明190mg-240/天(35%肠溶包衣的540mg/天薄荷油)将达到上述回肠和结肠浓度。
[0414]
总之,本发明人相信除了在回肠中需要达到的模拟薄荷醇剂量之外,本文所述的garp制剂将成功地在回肠和结肠中达到治疗剂量。
[0415]
实施例2:评价菠萝蛋白酶预处理对thp-1巨噬细胞中的粘附侵袭性大肠杆菌(aiec)的侵袭和细胞内增殖的影响
[0416]
在这些研究中,用菠萝蛋白酶预处理细菌。
[0417]
巨噬细胞培养
[0418]
将人单核细胞thp-1细胞(atcc tib-202)在rpmi 1640培养基中培养,该培养基经修饰含有2mm l-谷氨酰胺、10mm hepes、1mm丙酮酸钠、4500mg/l葡萄糖和1500mg/l碳酸氢钠、并补充有10%fbs、100u/ml青霉素、100mg/ml链霉素、5mmβ-巯基乙醇。细胞密度从未超过1
×
106/ml。为了诱导分化,将thp1细胞以1
×
105细胞/cm2接种到24孔板中,并用200nm pma处理48h。48h后,洗涤巨噬细胞并在pma和无抗生素培养基中生长24h,然后开始实验。
[0419]
菌株和生长条件
[0420]
hm 605aiec(来自cd患者),hm 615aiec(来自cd患者)和hm484大肠杆菌(分离自ibs患者)在营养琼脂上生长过夜,并悬浮在无菌盐水中,并在室温下放置24h,因为已发现这使菌毛表达最大化(hm martin,2004)。在实验当天,将细菌在室温下以300gav离心15min,并在处理或对照培养基中重悬至1.4
×
107细菌/ml。处理总结在表5中。
[0421]
表5——用菠萝蛋白酶预处理细菌
[0422][0423]
将细菌在37℃下持续振荡孵育2h。在孵育结束时,用rpmi洗涤细菌3次,然后再悬浮于thp-1培养基中至终浓度为1.4
×
107细菌/ml。
[0424]
通过庆大霉素保护试验测量细菌摄取、存活和复制试验
[0425]
用每个巨噬细胞30个细菌的感染复数(moi)感染thp1细胞。孵育3h后,除去培养基,加入含有100μg/ml庆大霉素的新鲜细胞培养基以杀死细胞外细菌。为了测定细胞内细菌的数目,在1和3h时,除去培养基,向各孔中加入0.5ml的1%triton x-100的去离子水溶液,保持5min,以裂解thp-1细胞。该浓度的triton x-100对细菌活力至少30min没有影响。将样本混合,稀释并接种在lb琼脂平板上以测定从裂解的单层中回收的菌落形成单位(cfu)的数目。将1h时的胞内细菌数量与rpmi无处理对照进行比较,并将其视为粘附细菌。细菌复制表示为感染后4h回收的细菌相对于庆大霉素处理1h后回收的细菌数量的平均百分比,定义为100%。
[0426]
结果/讨论:
[0427]
在hm605和hm484细菌的情况下,≥20fg/细菌的菠萝蛋白酶浓度能够抑制thp-1巨噬细胞的细菌侵入(表6)。用菠萝蛋白酶预处理细菌在抑制细胞内增殖方面效果较差。
[0428]
表6:garp中菠萝蛋白酶预处理aiec抑制它们对thp-1巨噬细胞的侵袭
[0429][0430]
将来自表5的数据插入到本文所述的基于肠上皮细胞/cm2和细菌/肠上皮细胞的胃肠分布模型中,发明人相信人将需要867mg/80kg的回肠靶向(小肠靶向?)的菠萝蛋白酶以实现20fg/细菌的有效剂量。在一个实施方案中,本文所述的组合物提供1440mg回肠靶向
菠萝蛋白酶的总日剂量。
[0431]
实施例3:菠萝蛋白酶预处理aiec以及对caco-2肠上皮细胞中aiec的侵袭和细胞内增殖的作用
[0432]
细胞培养
[0433]
将caco-2-bbe1肠上皮细胞以2
×
105个细胞/cm2接种于24孔板中并生长至汇合。在开始实验前24h,细胞在抗生素培养基中生长。在实验当天,将hm605和hm484大肠杆菌在室温下以300gav离心15min,并在caco-2培养基
±
20-640μg/ml菠萝蛋白酶中重悬至1.4
×
107细菌/ml。将细菌在37℃下持续振荡孵育2h。在孵育期结束时,用dmem洗涤细菌3次,然后再悬浮于caco-2培养基中至终浓度为1.4
×
107细菌/ml。然后如前所述进行庆大霉素保护试验。为了模拟肠道环境,进行了一系列实验,其中将细菌重悬于含有20-640μg/ml菠萝蛋白酶的禁食状态模拟肠液(rieder f,2012)中。
[0434]
结果/讨论:
[0435]
在hm605和hm484细菌的情况下,≥20fg/细菌的菠萝蛋白酶浓度能够抑制细菌侵入肠上皮细胞和细胞内增殖(表7)。
[0436]
模拟肠液中细菌的预处理增加(20fg增加至28fg)实现相同水平的细菌侵入和细胞内增殖抑制所需的菠萝蛋白酶浓度。因此,当使用本文所述的胃肠暴露模型时,合适的患者剂量将为800mg/60kg/天,以达到20fg菠萝蛋白酶/细菌。
[0437]
表7:在garpv1中用菠萝蛋白酶预处理aiec抑制caco-2肠上皮细胞的侵袭
[0438][0439]
将来自表7的数据插入到本文所述的基于肠上皮细胞/cm2和细菌/肠上皮细胞的胃肠分布模型中,发明人认为合适的患者剂量将是1067mg/80kg/天的针对小肠的菠萝蛋白酶,以达到28fg/细菌的有效剂量。
[0440]
实施例4——含有菠萝蛋白酶的garp有效抑制tnfα从lps刺激的thp-1巨噬细胞的释放
[0441]
巨噬细胞培养
[0442]
将人单核细胞thp-1细胞(atcc tib-202)在rpmi 1640培养基中培养,该培养基经修饰含有2mm l-谷氨酰胺、10mm hepes、1mm丙酮酸钠、4500mg/l葡萄糖和1500mg/l碳酸氢钠、并补充有10%fbs、100u/ml青霉素、100mg/ml链霉素、5mmβ-巯基乙醇。细胞密度从未超
过1
×
106/ml。为了诱导分化,将thp1细胞以5
×
105细胞/cm2接种到96孔板中,并用200nm pma处理48h。48h后,洗涤巨噬细胞并在pma和无抗生素培养基中生长24h,然后开始实验。transwells如图1所示。处理示于表8中。
[0443]
表8——菠萝蛋白酶处理评价含有菠萝蛋白酶的garpv1对从thp-1巨噬细胞释放促炎细胞因子的作用
[0444][0445]
将测试化合物和对照施用于细胞,其中使用未刺激的培养物作为对照,用50ng/ml的lps刺激巨噬细胞。8h后,除去培养基,用elisa定量tnfα。
[0446]
结果/讨论:
[0447]
如图2所示,菠萝蛋白酶能够抑制tnfα从已经用lps刺激的thp-1巨噬细胞的释放。当与rpmi对照相比时,在高于13pg/巨噬细胞的菠萝蛋白酶浓度下,tnfα的释放受到显著抑制(p《0.001,曼惠特尼秩和检验)。
[0448]
结论:
[0449]
不希望受理论束缚,本发明人相信他们使用胃肠分布模型的建模显示,如果人要服用800mg肠溶包衣的菠萝蛋白酶,那么暴露量将是75pg/细胞/回肠肠上皮细胞和4500pg/细胞/结肠。
[0450]
实施例5——含有菠萝蛋白酶的garp抑制il-8从与lps刺激的thp-1巨噬细胞共孵育的极化的caco-2单层的释放
[0451]
使用最常用于评价食品和药品的工业标准模型,研究了菠萝蛋白酶对il-8释放的影响。顶区室代表管腔(git的液体和粘膜)
[0452]
共培养细胞培养
[0453]
将caco-2细胞以1
×
106个细胞/孔接种到transwell插板(1.12cm2,0.4μm孔径)上,每3天更换细胞培养基直至细胞完全分化(ter值》1200
×
cm2),并在解冻后12代内以传代次数使用细胞。在单独的12孔板中,以8.5
×
105细胞/孔接种thp-1单核细胞,并用200nm pma分化48h,然后在实验前在正常培养基中培养24h。在用rpmi1640替换所有培养基后,将其上负载有caco-2细胞的transwell插入物上样至含有thp-1细胞的孔中。当细胞培养物达到》1000cm2的基线ter时,通过将含有50ng/ml ifn-β,10μg/ml lps和5ng/ml tnfα的0.6ml添加到基底侧区室中来刺激单层。在加入刺激混合物后立即将0.25ml的garp
±
0-80μg/ml菠萝蛋白酶(0-20μg/肠上皮细胞)应用于顶端区室。孵育24h后,收集顶面和基底侧的培养物上清液测定il-8。
[0454]
结果/讨论:
[0455]
如图3所示,菠萝蛋白酶能够抑制与lp刺激的thp-1巨噬细胞共培养的caco-2细胞
释放il-8。经18
±
6不含菠萝蛋白酶的garpv1能够抑制il-8的释放。
[0456]
实施例6——评价含有菠萝蛋白酶的garpv1对肠完整性恢复的作用,如通过跨上皮电阻(ter)测量的。
[0457]
临床前研究已经显示维生素d3和丁酸钠在调节紧密间隙连接中是有效的(kong j,2008)(ma x,2012),该发现在它们作为garp制剂的一部分的选择中起作用。为了确定garpv1是否能够恢复肠道完整性,用hm605 aiec
±
garp感染m细胞/caco-2transwell模型,并在感染后2天监测ter。
[0458]
m细胞/caco-2模型
[0459]
如前所述生长和维持caco2-cl1细胞。将人伯基特淋巴瘤细胞系raji b维持在补充有10%fbs、8mm l-谷氨酰胺、100u/ml青霉素和100mg/ml链霉素的rpmi-1640培养基中。将raji b细胞以3
×
105/ml接种,每第三天使细胞悬浮液沉降。用新鲜培养基替换三分之二的培养基。每第9天,细胞以1:3分裂。将所有细胞保持在37℃,5%co2,潮湿气氛中。
[0460]
通过将5
×
105个caco-2细胞接种到已经用matrigel基底膜基质预包被的12mm的transwell细胞培养插入物的顶面上建立m-细胞模型并且dmem培养基置于基底侧区室。细胞维持14-18天,直到ter》600ω/transwell(相当于300ωcm2组织单层)。在共培养当天,收获raji b细胞,再悬浮于完全dmem中,并将5
×
105个细胞添加到基础transwell区室中。重要的是,共培养后,每天更换顶端和基础培养基,注意不要干扰raji b细胞。共培养物维持4-6天,直到产生m-细胞。在transwell插入物上也产生平行的caco2-cl1单培养物(在基底区室中没有raji b细胞)并按照m-细胞维持。全程测量ter以监测成功的单层生成。
[0461]
具有aiec hm605的m细胞模型的感染
[0462]
先前已经报道hm 615aiec引起caco-2和t84单层中紧密细胞连接的破坏并诱导细胞死亡(bailey jr,2011)。为了再现该效果,当已经产生m细胞模型时(第20-24天,取决于ter何时伴随下降),然后将培养基改变为不含抗生素,并将细菌以30的moi加入transwell插入物的顶端孔中4h。4h后,洗涤细胞并用100μg/ml庆大霉素孵育以杀死任何残留的细菌。此时,将无菠萝蛋白酶garp置于细胞上,以2h的间隔测定所有单层的ter直至12h,每1h直至4h计数基孔中的细菌。
[0463]
结果/讨论:
[0464]
aiec感染后胃肠上皮细胞层的恢复
[0465]
当aiec hm605悬浮在正常培养基(无处理对照)或garp(无菠萝蛋白酶)中并应用于m细胞模型时,garp制剂对细胞层的完整性提供保护作用(图4)。
[0466]
实施例7——不含菠萝蛋白酶的不同胃肠重编程组合物的抗炎活性的比较。
[0467]
使人结肠直肠腺癌细胞系c2bbe1生长并维持在补充有10%v/v胎牛血清(fbs)、4mm l-谷氨酰胺、100u/ml青霉素和100mg/ml链霉素的dulbecco改良eagle培养基(dmem)中。在解冻后12代内对c2bbe1细胞进行所有实验。将caco-2细胞以5
×
105个细胞/孔接种到transwell插板(0.33cm2,0.4μm孔径)上,每3天更换细胞培养基直至细胞完全分化(起始平均值ter 1121
±
196cm2;平均
±
sd),并在解冻后12代内以传代次数使用细胞。
[0468]
在评价菠萝蛋白酶或各种garp制剂的抗炎作用的实验中,将0.25ml测试样本应用于顶面24h,同时将0.6ml含有50ng/ml ifn+10μg/ml lps+5ng/ml tnf的混合物加入到该模型的基底侧。孵育24h后,收集顶面的培养物上清液,并通过elisa定量il-8。
[0469]
表9概述了制剂组分的不同排列和组合,测试了它们抑制il-8从lps、tnf-α、ifn-β刺激的极化的caco-2单层释放的能力,如前所述。
[0470]
表9
[0471]
制剂丁酸钠l-thrl-trpl-glul-argl-met胆钙化醇
ꢀꢀꢀꢀꢀꢀꢀꢀ
garpv1-1 4002004004004000.48garpv1-6
ꢀꢀꢀꢀꢀꢀ
0.48garpv1-5
ꢀꢀꢀꢀꢀ
4000.48garpv1-2
ꢀꢀ
2004004004000.48garpv1-3
ꢀꢀꢀ
4004004000.48garpv5200400
ꢀꢀꢀꢀ
0.48garpv6200400200
ꢀꢀꢀ
0.48garpv1-4
ꢀꢀꢀꢀ
4004000.48garpv8400400
ꢀꢀ
400 0.48garpv44004004004004004000.48garpv13400400 4004004000.48garpv12400400400 4004000.48garpv12004002004004004000.48garpv3400400400
ꢀꢀꢀ
0.48garpv11400400400400 4000.48garpv7400400 400
ꢀꢀ
0.48garpv9400400
ꢀꢀꢀ
4000.48garpv2400400
ꢀꢀꢀꢀ
0.48garpv10400400400400400 0.48
[0472]
结果/讨论:
[0473]
表10中的数据证实,与标准生长培养基(dmem)相比,不含菠萝蛋白酶的garp可显著降低il-8的释放,p《0.001。当将所有的garp制剂与原始的garpv1进行比较时,没有统计学上的显著差异,但是当将最高的抗炎活性评级为最低的抗炎活性时,可以进行如表11中所示的一般特异性观察。
[0474]
表10——各种garp制剂和各制剂组分的il-8抑制能力
[0475][0476]
*数据是11次独立实验的平均值和标准偏差。曼惠特尼秩和t检验
[0477]
**数据是3次独立实验的平均值和标准偏差。曼惠特尼秩和t检验
[0478]
表11——不含菠萝蛋白酶的各种garp制剂的等级
[0479][0480]
当将所有的garp制剂从最高的抗炎活性分级为最低的抗炎活性时,本发明人相信可以进行一些具体的观察(表11)。即,丁酸钠、l-苏氨酸和胆钙化醇都与更好的抗炎作用相关,并且通常,使用含有l-谷氨酰胺和l-色氨酸的制剂观察到更高的抗炎作用。
[0481]
本文提供的实施例证实了菠萝蛋白酶是如本文所述的garp膳食补充剂的关键抗炎组分,其中作为唯一药剂,菠萝蛋白酶抑制il-8分泌70
±
7(平均值
±
sem)。不希望受理论束缚,本发明人相信本文所述的garp制剂的其它组分(丁酸钠,氨基酸和维生素d3)充当细胞能量和粘蛋白合成前体的来源,其增强菠萝蛋白酶的抗炎活性。这些实验证实了以前公开的研究,即每种制剂组分本身表现出低水平的抗炎活性。在一个实施方案中,本文所述的garp制剂包括或基本上由80μg/ml菠萝蛋白酶、400μg/ml丁酸钠、400μg/ml的l-苏氨酸和
0.48μg/ml维生素d3组成。
[0482]
实施例8——不同胃肠重编程组合物与80μg/ml(相当于40pg/细胞)菠萝蛋白酶的抗炎活性的比较。
[0483]
为了确定任何一种garp制剂是否对菠萝蛋白酶的抗炎活性产生了加和或协同作用,在加入80μg/ml菠萝蛋白酶(相当于20pg/细胞)后对每种制剂进行再测试。
[0484]
方法学
[0485]
使人结肠直肠腺癌细胞系c2bbe1生长并维持在补充有10%v/v胎牛血清(fbs)、4mm l-谷氨酰胺、100u/ml青霉素和100mg/ml链霉素的dulbecco改良eagle培养基(dmem)中。在解冻后12代内对c2bbe1细胞进行所有实验。将caco-2细胞以5
×
105个细胞/孔接种到transwell插板(0.33cm2,0.4μm孔径)上,每3天更换细胞培养基直至细胞完全分化(起始平均值ter 1121
±
196cm2;平均
±
sd),并在解冻后12代内以传代次数使用细胞。
[0486]
在评价菠萝蛋白酶或各种garp制剂的抗炎作用的实验中,将0.25ml测试样本应用于顶面24h,同时将0.6ml含有50ng/ml ifn+10μg/ml lps+5ng/ml tnf的混合物加入到该模型的基底侧。孵育24h后,收集顶面的培养物上清液,并通过elisa定量il-8。
[0487]
结果/讨论:
[0488]
表12显示了向实施例7中测试的制剂中加入80μg/ml菠萝蛋白酶(相当于40pg/细胞)的结果。菠萝蛋白酶抑制il-8分泌的能力增加了30-70%。
[0489]
表12——各种garp制剂加80μg/ml菠萝蛋白酶和各制剂组分的il-8抑制能力
[0490]
[0491][0492]
*数据是11次独立实验的平均值和标准偏差。曼惠特尼秩和t检验
[0493]
**数据是3次独立实验的平均值和标准偏差。曼惠特尼秩和t检验
[0494]
当将含有菠萝蛋白酶的制剂分级时,观察到最佳的抗炎作用,如表13所示。
[0495]
表13
[0496][0497]
数字单位为ug;例如,200μg;400ug;0/48ug
[0498]
实施例9——garp及其各个制剂组分对粘蛋白toll样受体和促炎基因表达的影响的定量。
[0499]
如本文先前所述建立75:25caco-2/ht-29共培养物,并使用qpcr研究暴露于菠萝蛋白酶,苏氨酸,丁酸钠,维生素d3和两种不同的garp制剂24h对以下muc基因表达的影响。在24h处理结束时,收集25cm2烧瓶中的上清液,并如本文先前所述用胰蛋白酶消化共培养物单层。
[0500]
[0501]
[0502][0503]
当解释基因表达数据时,muc基因及其相关粘蛋白分为:
[0504]
●
分泌型粘蛋白
[0505]
●
膜相关粘蛋白
[0506]
●
非胶凝粘蛋白
[0507]
分泌型粘蛋白
[0508]
muc2、muc5ac、muc5b、muc6和muc19充当分泌的细胞外粘性分泌物。参考图5总结了不同浓度的菠萝蛋白酶溶解在以靶向结肠的garp制剂组分丁酸钠、l-苏氨酸和维生素d3中的作用。
[0509]
表14概括了每种粘蛋白与ibs或ibd之间的关联。
[0510]
表14——列出的每种粘蛋白与ibs或ibd之间的关联的总结
[0511]
[0512][0513]
已发现muc2基因和蛋白表达在ibd和ibs中显著下调并且被认为是维持粘膜屏障的关键粘蛋白。其在与粘蛋白muc2连接的聚糖中的含量充当细菌的营养物,但也充当结合位点,并且诱导特定微生物物种的选择,所述微生物物种对于维持完整性,稳态和肠功能是必需的。如图6所示,garp中20μg/ml和40μg/ml菠萝蛋白酶都能够将基因表达增加5至25倍。
[0514]
muc6在ibd和ibs中也被下调。在菠萝蛋白酶浓度为≥
±
10μg/ml时,如果不与菠萝蛋白酶协同(garpv1),garp制剂组分似乎累加地起作用以显著增加muc6的表达达30倍。
[0515]
muc19表达尚未在ibs或ibd中表征。在≥10μg/ml的菠萝蛋白酶时,garpv1制剂组分似乎对菠萝蛋白酶的活性发挥和累加作用。
[0516]
膜相关粘蛋白
[0517]
muc1-4、muc12、muc15-17和muc20被认为是糖萼中膜相关的粘蛋白。参考图6总结了不同浓度的菠萝蛋白酶溶解在以靶向结肠的garp制剂组分丁酸钠、l-苏氨酸和维生素d3中的作用。
[0518]
表15概括了每种粘蛋白与ibs或ibd之间的关联。
[0519]
表15——列出的各粘蛋白与ibs或ibd之间的关联的总结
[0520]
[0521][0522]
除了muc1基因表达之外,在菠萝蛋白酶浓度≥10μg/ml下,garp/菠萝蛋白酶制剂似乎显著增加muc3、muc4和muc15的表达。考虑到这些粘蛋白在ibd中和在ibs中的一些实施例中减少,这些数据表明,garp产品可能能够刺激粘蛋白的产生,这可能导致肠稳态的重建。通常,结肠靶向的garpv1制剂比garpv2表现更好,目前正在进行蛋白研究和粘蛋白定量工作以证实该观察结果。
[0523]
muc13、muc16和muc17表达在ibd中增加。在菠萝蛋白酶浓度≥
±
20μg/ml下,garpv2/菠萝蛋白酶制剂能够显著降低基因表达。
[0524]
非胶凝粘蛋白
[0525]
muc7和muc8是非形成凝胶的粘蛋白,其在ibd或ibs中没有很好地表征。参考图7,菠萝蛋白酶浓度≥10μg/ml能够显著增加基因表达。
[0526]
不希望受理论束缚,本发明人相信,本文提供的muc基因表达数据表明,菠萝蛋白酶和结肠靶向制剂组分在garp膳食补充剂中的浓度将足以刺激粘蛋白基因表达,这又预期促进粘膜愈合。
[0527]
实施例10——garp产品的粘膜愈合能力:证明l-苏氨酸和维生素d3之间的协同关系。
[0528]
细胞系和caco-2的建立:ht-29-mtx 75:25共培养物(模拟结肠)
[0529]
使人结肠直肠腺癌细胞系caco-2-bbe1(获自利物浦大学的barry campbell教授)生长并维持在补充有10%v/v胎牛血清(fbs)、4mm l-谷氨酰胺、100u/ml青霉素和100mg/ml链霉素的dulbecco改良eagle培养基(dmem)中。在解冻后12代内对caco-2-bbe1细胞进行所有实验。将细胞培养物在潮湿的5%co2培养箱中在37℃下孵育。将细胞保持在37℃,5%co2气氛的孵育箱中,每48h更换培养基。在80%汇合时,用10ml的1%胰蛋白酶-edta(sigma-aldrich)分离细胞5min,然后加入40ml含有10%fbs的dmem以终止胰蛋白酶消化。通过离心(200g,5min)沉淀细胞悬浮液,并重悬于含10%fbs的新鲜dmem中,然后以1:4稀释度传代培养到新烧瓶中。
[0530]
该共培养模型用于模拟人结肠上皮。将caco-2细胞(第8代)和ht29-mtx细胞(第9
代)以75:25的比例在含有10%fbs的dmem中合并。将合并的细胞(6.4
×
104细胞/ml)接种到每个烧瓶总共5ml的25cm2中。将共培养物在37℃下在5%co2气氛中孵育,每48h更新培养基。在接种后15天,将共培养物单层在dmem中洗涤三次并用5ml预热的测试溶液替换,然后孵育24h。
[0531]
caco-2的治疗:ht-29-mtx 75:25共培养物
[0532]
在处理前一天制备胆钙化醇(vd3)和l-苏氨酸(l-thr)(sigma-aldrich)在培养基中的测试溶液。接种后15天,以每小时间隔用培养基洗涤共培养物单层三次,然后用5ml预热的测试溶液替换,然后孵育24h。
[0533]
基因表达的定量聚合酶链反应(qpcr)分析
[0534]
在24h处理结束时,收集25cm2烧瓶中的上清液,并如前所述用胰蛋白酶消化共培养物单层。通过在4℃以5,000g离心5min收集细胞。用冰冷的pbs洗涤三次后,将细胞重悬于500μl冰冷的pbs中。使用purelink rna微型试剂盒(invitrogen)提取每个样本2
×
106个细胞的总rna。对于实时pcr分析,使用高容量cdna rt试剂盒(applied biosystems,foster city,ca,usa)将1.5μg的rna(a260/a280比率在2.00和2.20之间)逆转录成cdna。
[0535]
人muc2和muc7基因在caco-2:ht-29-mtx 75:25共培养物中的表达使用powerup sybr green master预混液(applied biosystems)定量。用于检测muc2表达的引物(正向,5
’‑
cgaaaccacggccacaacgt-3’(seq id no:3);反向,5
’‑
gaccacggccccgttaagca-3’(seq id no:4))和muc7(正向,5
’‑
gcaactaccctagacccatca-3’(seq id no:15);反向,5
’‑
taggtgtggtaattggggcag-3’(seq id no:16)购自sigma-aldrich。使用biomok-4000自动液体处理器(beckman coulter,brea,ca,usa),在microamp光学384孔反应板(applied biosystems)上用20ng cdna和500nm引物一式三份建立10μl qpcr反应。在viia7实时pcr系统(thermo fisher scientific)中在以下条件下进行扩增:95℃持续20s,接着40个循环的95℃持续1s和60℃持续20s;以及熔融曲线阶段:95℃,15s;60℃,60s。使用前述2-δδct方法,使用quantstudio软件v1.3(applied biosystems)分析qpcr的结果。相对基因表达值通过使用gapdh和18s作为多个内源基因表达值标准化。
[0536]
结果
[0537]
当解释基因表达数据时,将muc基因及其相关粘蛋白分成三类:
[0538]
●
分泌型粘蛋白
[0539]
●
膜相关粘蛋白
[0540]
●
非胶凝粘蛋白
[0541]
分泌型粘蛋白
[0542]
muc2、muc5ac、muc5b、muc6和muc19充当分泌的细胞外粘性分泌物。表16概括了每种粘蛋白与ibs或ibd之间的关联。
[0543]
表16——每种粘蛋白与ibs或ibd之间的关联的总结
[0544][0545]
膜相关粘蛋白
[0546]
muc1-4、muc12、muc15-17和muc20被认为是糖萼中膜相关的粘蛋白。表17概括了每种粘蛋白与ibs或ibd之间的关联。
[0547]
表17——每种粘蛋白与ibs或ibd之间的关联的总结
[0548][0549]
非胶凝粘蛋白
[0550]
muc7和muc8是非形成凝胶的粘蛋白,其在ibd或ibs中没有很好地表征。参考下图8,其显示l-苏氨酸和维生素d3的组合对上述muc基因产生的协同效应。
[0551]
作为单一药剂的l-苏氨酸(400μg/ml)对所测试的任何muc基因的表达不发挥统计学上显著的作用。表18总结了i)维生素d3和ii)0.48μg/ml维生素d3和400μg/ml l-苏氨酸的组合对muc基因表达的影响。
[0552]
表18——维生素d3和l-苏氨酸的组合的作用的总结
[0553]
[0554][0555]
协同效应以粗体文本突出显示。
[0556]
通过滴定l-苏氨酸和维生素d3进一步研究了l-苏氨酸和维生素d3通过增加muc15、muc2、muc6、muc19、muc7和muc8的表达而出乎意料地协同作用的证据。muc2和muc7表达用作示例性粘蛋白基因。
[0557]
如图9a和9b所示,单独地,l-苏氨酸和维生素d3对muc2(主要分泌的,在胃肠道中形成凝胶的粘蛋白)或muc7(非形成凝胶的粘蛋白)的表达没有发挥主要作用。
[0558]
在ibs和ibd中,muc2基因、基因、蛋白和粘蛋白的表达降低,这导致改变的肠完整性和发育不良的微生物组,这些因素导致全身性炎症。
[0559]
当将维生素d3从0-0.48μg/ml与0-800μg/ml的l-苏氨酸组合进行滴定时,显然在≥
±
0.053μg/ml的维生素d3时,l-苏氨酸的浓度是影响muc2和muc7基因表达增加的主要因素(图10a和10b)。
[0560]
实施例11——菠萝蛋白酶和garp可以减少tnbs结肠炎模型中的内窥镜疾病
[0561]
在tnbs小鼠模型中评价garp
[0562]
通过在50%乙醇中的tnbs(5%w/v)的直肠植入,在5周龄的c56/bl/6小鼠中诱发2,4,6-三硝基苯磺酸(tnbs)结肠炎。将动物随机分成治疗组,并如图11所示进行治疗。
[0563]
完成了8个治疗组(健康对照n=4,8-9只动物/tnbs组)。治疗组的详细描述提供在表19中。
[0564]
表19——治疗组的详细描述
[0565]
[0566][0567][0568]
使用了以下内窥镜评分系统:i)评分5-7=轻度疾病,ii)评分8-11=中度疾病和iii)评分12-15=重度疾病。人群基线疾病严重程度为:
[0569]
●
轻度:34%(21/62只动物)
[0570]
●
中度:62%(38/62只动物)
[0571]
●
重度:4%(3/62只动物)
[0572]
8.1:安全性
[0573]
在本研究中随机化的最初72只动物中,10只动物被排除在分析之外,因为它们在开始治疗之前死于麻醉并发症或失去》20%的身体。研究中的死亡总结在表20中。
[0574]
表20——研究中的死亡总结
[0575][0576]
由于体重减轻而被安乐死的动物看上去很好并且功能正常,但是由于伦理准则,动物被安乐死。参见图12,其比较了从治疗第0天到实验终点(第7天)的体重变化。
[0577]
在实验终点体重中显示出任何显著差异的仅有的组是:
[0578]
●
口服载体(vehicle)中的tnbs-75mg/kg菠萝蛋白酶/15mg/kg薄荷醇:当与水或口服载体(vehicle)中的75mg/kg菠萝蛋白酶相比时,口服载体(vehicle)中的75mg/kg菠萝蛋白酶/15mg/kg薄荷醇使终点重量减少9%(p=0.024)。
[0579]
●
tnbs-75mg/kg菠萝蛋白酶/15mg/kg薄荷醇在口服载体(vehicle)中和garp在直肠载体(vehicle)中:当相比于75mg/kg菠萝蛋白酶在水、口服或直肠载体(vehicle)中时;75mg/kg菠萝蛋白酶/15mg/kg薄荷醇/直肠garp使终点重量减少5-12%(p=0.001)。
[0580]
当在治疗期间比较这些组时,动物保持其原始重量,如图13所示。
[0581]
已发表的研究发现,给小鼠施用10mg/kg的l-薄荷醇增加了核心温度,棕色脂肪组织中的解偶联蛋白1表达,非颤动生热活性和胰岛素敏感性,导致体重增加减少。在garp产品中,小鼠每天接受15mg/kg,这可以解释观察到的体重增加的缺乏。未观察到毒性。
[0582]
疗效
[0583]
参考图14,比较了第0天(治疗前)至第7天(实验终点)的内窥镜评分变化。在以下治疗组中观察到统计学显著差异:
[0584]
●
garp产品的结肠靶向组分(直肠植入的丁酸钠/l-苏氨酸/维生素d3):通过内窥镜评分定量的结肠炎显著减少。与直肠载体(vehicle)对照相比,garp改善了135%的内窥镜评分(p=0.018,n=8)
[0585]
●
口服施用的菠萝蛋白酶/薄荷油与garp产品的结肠靶向组分(直肠植入的丁酸钠/l-苏氨酸/维生素d3):当与口服和直肠载体(vehicle)对照相比时,该制剂使内窥镜评分提高了148%(p=0.012,n=9)。
[0586]
●
在水中口服施用的菠萝蛋白酶:当与口服载体(vehicle)对照相比时,菠萝蛋白酶将内窥镜评分提高了65%(p=0.038,n=8)。
[0587]
当比较粪便硬度、受累区域的范围、粘膜表面的粒度、血管模式的变化和结肠壁的增厚等个体参数时,治疗组之间没有显著差异。
[0588]
参考图15,其比较了不同处理和对照载体(vehicle)对结肠长度、结肠重量和结肠重量/长度比的影响。在治疗组之间没有观察到显著差异。
[0589]
结论:
[0590]
不含菠萝蛋白酶的garp产品(直肠植入的丁酸钠/l-苏氨酸/维生素d3)的结肠靶向组分显著改善了实验性结肠炎。口服给药的菠萝蛋白酶/薄荷醇的加入在结肠炎模型中发挥轻微的累加效应,这并不显著好于单独的garp。注意到口服载体(vehicle)中的菠萝蛋白酶不如水中的菠萝蛋白酶表现得好,发明人认为口服载体(vehicle)的一些组分可能干扰菠萝蛋白酶在小肠和大肠中的释放。据信提供本文所述的组合物和制剂的菠萝蛋白酶和/或任何组分的释放的具体制剂在用于递送至胃肠系统的药物制剂领域的技术人员的技能范围内,也如本文别处所述。
[0591]
实施例12——菠萝蛋白酶和garp可减少tnbs结肠炎模型中的内窥镜疾病,而没有与泼尼松龙的耐药相互作用。
[0592]
已知泼尼松龙具有55种主要的、390种中等的和39种次要的药物相互作用。其中已知的副作用是与几种常见成分如缓冲剂的相互作用,其可损害泼尼松龙的吸收。草药是广受欢迎的药物,越来越多的患者使用草药,他们通常不建议临床医生同时使用。因此,医生和临床医生认识到存在已知的或潜在的药物-草药相互作用,并且对其进行筛选。这个概念可以合理地扩展到非基于草药的营养剂。与肠易激综合征和炎性肠病特别相关的是皮质类固醇控制炎症的一般用途。根据miller[miller lg“草药医学:选定的临床考虑重点是已知或潜在的药物-草药相互作用(herbal medicinals:selected clinical considerations focusing on known or potential drug-herb interactions)”arch intern med 158(1998):2200-11],作为这种药物-草药相互作用的基础的理论关注是免疫刺激剂草药将抵消或最小化皮质类固醇的免疫抑制作用。根据这些考虑,本发明人检验了在存在和不存在本文所述制剂的情况下泼尼松龙的作用。
[0593]
通过以与实施例11相同的方式施用tnbs诱导小鼠结肠炎。三天后,通过内窥镜对损害进行评分,用i).150mg/kg菠萝蛋白酶水溶液,ii).150mg菠萝蛋白酶和直肠施用的苏氨酸/丁酸钠/维生素d3,iii).2mg/kg口服泼尼松龙,或iv).150mg菠萝蛋白酶和直肠给药的苏氨酸/丁酸钠/维生素d3加2mg/kg口服泼尼松龙处理动物。在第11天测量内窥镜评分,并计算第3天和第11天之间的内窥镜评分变化(图16)。表21显示了上述组的内窥镜评分变化和相对于安慰剂的统计显著性。
[0594]
表20——内窥镜评分
[0595][0596]
本例中#garp=苏氨酸/丁酸钠/维生素d3
[0597]
组为i)安慰剂,ii)口服150mg菠萝蛋白酶水溶液,iii)口服150mg菠萝蛋白酶&15mg/kg薄荷醇加garp直肠给药,iv)口服150mg菠萝蛋白酶&15mg/kg薄荷醇加garp和2mg/kg泼尼松龙直肠给药,v)2mg/kg泼尼松龙直肠给药,和vi)garp直肠给药。garp是185mg/kg丁酸钠、280mg/kg苏氨酸和3.84微克/kg维生素d3。人用等效剂量为菠萝蛋白酶960mg/80kg人);薄荷醇100mg/80kg人);苏氨酸1800mg/80kg人);丁酸钠1200mg/80kg人)和维生素d3 25微克/80kg人)。将苏氨酸、丁酸钠和维生素d3配制并作为直肠管饲法施用在结肠顶部以模拟在结肠中释放的制剂;即,以实现对下部肠的给药。不能使用本文所述的组合物的人用制剂,因为小鼠结肠的ph低于人的ph并且通过时间更短,这意味着目标人用制剂在动物研究中将不释放内容物,因为制剂将快速通过小鼠胃肠道并且将不能达到侵蚀释放所需的保护包衣所需的ph。
[0598]
从本文提供的结果,本发明人相信,显然包括丁酸钠,l-苏氨酸和维生素d的制剂不干扰泼尼松龙的功效,并且在该实验中,1)单独的菠萝蛋白酶,2)单独的苏氨酸/丁酸酯/维生素d3,和3)口服菠萝蛋白酶/薄荷醇加直肠给药的苏氨酸/丁酸酯/维生素d3的组合与2mg/kg泼尼松龙一样有效。
[0599]
实施例13——剂型的配制
[0600]
a部分片剂/小片剂/胶囊/组分:
[0601]
目的是开发含有比例为6.8:1(
±
30%,即4.75:1至8.85:1)的菠萝蛋白酶和薄荷醇的稳定肠溶衣小片制剂。通过直接压缩方法制备所开发的制剂。
[0602]
最终制造配方
[0603][0604]
制造程序:
[0605]
1.薄荷醇预混物:将薄荷醇在70℃加热下熔化。将fujisil加入到熔融的薄荷醇中并在加热下搅拌。继续搅拌直至形成自由流动的粉末。
[0606]
2.将aerosil 200、fujicalin和薄荷醇预混物在10l八角混合器中以15rpm共混15min。
[0607]
3.将菠萝蛋白酶、avicel smcc 90、klucel exf和交聚维酮通过连接至机械筛的#40astm筛分,并与步骤2材料一起在30l八角形混合器中以15rpm共混15min。
[0608]
4.硬脂酸镁通过#60astm筛分。
[0609]
5.润滑:将步骤4的材料加入到步骤3的材料中,并在30l八角形混合器中以15rpm共混5min。
[0610]
6.压缩:使用2.50
×
2.50mm圆形双凸形多头冲头将润滑的共混物压制成小片。
[0611]
7.密封包衣:向eudraguard对照中加入所需量的纯净水。在搅拌下加入methocel e5优质lv和滑石。在整个包衣操作中继续搅拌。在自动片剂包衣机中将悬浮液喷雾到核心片剂床上。
[0612]
8.肠溶衣:在搅拌下将甘油加入到eudraguard对照中。在搅拌下将所需量的纯净水加入到eudraguard对照和甘油混合物中。将海藻酸钠和滑石在塑料袋中共混并缓慢加入到上述混合物中而不形成团块。将所需量的色淀着色剂用少量水匀化并在搅拌下加入悬浮液中。在包衣操作之前继续搅拌3h。
[0613]
压缩参数:
[0614][0615]
根据菠萝蛋白酶的稳定性曲线选择直接压片策略。由于薄荷醇在低温薄荷醇在migloyl中的溶解,在蜡中包埋或薄荷醇在维生素e中的胶束的替代方法,但由于薄荷醇在低温下的升华倾向,将吸附技术用于薄荷醇。
[0616]
根据标准usp方法用ii型设备usp29nf24《711》对小片进行溶出试验。将小片在0.1n盐酸中搅拌1h,然后调节至ph6.8,保持5h。在ph调节前时间0,30min、60min取样,然后在调节后+30min、+60min和此后每小时取样。分析菠萝蛋白酶并将滴度对时间作图,如图17所示。
[0617]
b部分片剂/小片剂/胶囊/组分:
[0618]
药物产品被设计为用于在小肠和结肠区域的下部递送药物的小片。该产品设计为物理和化学稳定的,并且在其保存期限内具有效力。开发制剂和方法以确保符合所有质量标准的一致产品。苏氨酸与丁酸钠的比率为1.5:1
±
30%,即(1.05:1至1.95:1)。
[0619]
制造配方
[0620]
[0621][0622]
*添加10%过量,**添加20%过量
[0623]
制造工艺:
[0624]
1.筛分:将丁酸钠、l-苏氨酸、微晶纤维素、无水磷酸二钙(a tab)、交聚维酮(kollidon cl)通过astm#24目。
[0625]
2.粘合剂溶液:将丁基化羟基甲苯、维生素d3、聚维酮k90 f加入异丙醇中并继续搅拌直至形成澄清溶液。
[0626]
3.将上述物质通过湿法制粒合并,并将产物在流化床干燥器上干燥,然后研磨并用硬脂酸镁筛分。
[0627]
4.压缩:使用2.50
×
2.50mm圆形双凸形多头冲头将共混物压制成小片。
[0628]
5.密封包衣:应用在异丙醇/二氯甲烷密封涂层中的羟丙基甲基纤维素。
[0629]
6.eudraguard生物分散:将eudraguard生物、水和plasacryl t20分散体喷雾到密封的小片上。
[0630]
7.eudraguard对照分散体:将甘油、eudraguard对照、藻酸钠和滑石混合形成分散体,将其包衣到小片上。
[0631]
压缩参数:
[0632][0633]
根据标准usp方法用ii型设备usp29nf24《711》对小片进行溶出试验。将小片在0.1n盐酸中搅拌1h,然后调节至ph6.2达1h,最后调节至ph7.4达4h。在ph调节前时间0和60min,然后在第二次ph调节前+60min,以及最后+30min、+60min和此后每小时取样。分析丁酸盐,滴定度对时间作图,如图18所示。
[0634]
成品制剂:
[0635]
a部分和b部分小片具有相似的大小和特征,并且可以根据待治疗病症的阶段以任何有用的比例混合。在目前的临床试验中,它们以1.94:2.28w/w的比例混合,这提供了薄荷醇70:菠萝蛋白酶480:苏氨酸900:丁酸钠600:胆钙化醇0.0125的组分比例。2.91a部分w/w
与2.28b部分w/w的交替比率提供薄荷醇105:菠萝蛋白酶720:苏氨酸900:丁酸钠600:胆钙化醇0.0125的组分比率,以及比率。
[0636]
在当前临床试验中提供给患者的剂量为4.22克,每天两次,提供薄荷醇140mg、菠萝蛋白酶960mg、苏氨酸1800mg、丁酸钠1200mg和胆钙化醇25微克的总日剂量;或2.21克,每天两次,提供薄荷醇70mg、菠萝蛋白酶480mg、苏氨酸900mg、丁酸钠600mg和胆钙化醇12.5微克的总日剂量。剂量的填充公差为
±
15%。
[0637]
实施例14——实施例11和12中治疗后切片的组织学评分
[0638]
在tnbs小鼠模型中评价garp
[0639]
实施例11和12评价了小鼠模型中tnbs诱导的结肠炎中的garp表现方面。报告了不同治疗组在第11天相对于第3天的内窥镜评分和安乐死动物切除结肠的重量、长度和重量与长度比的影响。
[0640]
在该实施例中,结肠被固定、染色和切片,然后通过显微镜以盲法评价。不仅检查结肠的活动性疾病,还检查从疾病中恢复的证据,并根据以下标准进行评分。对评分员进行一式三份不知情的评分,在6个类别的每一个中最大评分为3。
[0641]
结肠炎组织学评分
[0642]
结肠炎活性(基于严重度0-3)
[0643]
多血管性(血管开放)
[0644]
单核细胞的存在(结构也消失)
[0645]
上皮细胞增生(细长隐窝和绒毛)
[0646]
上皮损伤(上皮连续性丧失)
[0647]
中性粒细胞的存在
[0648]
淋巴聚集物(评分0-2)0、1-2、》2
[0649]
收集数据并通过学生t检验分析相对于安慰剂对照的显著性。汇总统计报告在下表中,每组的平均数据减去健康对照的平均值(σ=1.7)在图19中制图。
[0650][0651]
数据表明,泼尼松龙治疗显示出改善愈合的趋势,而无论泼尼松龙的存在与否,两
种浓度的garp(苏氨酸/丁酸酯/维生素d)和完全制剂显示出组织学评分的统计学显著改善。
[0652]
不希望受理论的束缚,本发明人相信,本说明书中提供的数据表明,结肠靶向的garp组分和小肠靶向的菠萝蛋白酶/薄荷醇的使用可以为结肠炎的治疗提供意想不到的和令人惊讶的强健的治疗益处。
[0653]
参考文献
[0654]
allen,e.a.(未注明日期).《雷明顿药物科学》(remington's pharmaceutical sciences),第22版,isbn 978-0-85711-062-6.
[0655]
amidon,s.b.(2016).《结肠靶向口服给药系统:设计趋势和方法》(colon-targeted oral drug delivery systems:design trends and approaches).aaps pharmscitech,16,no.4,731
–
741.
[0656]
bernstein cn,f.m.(2010).《010年世界胃肠病学组织ibd诊断和管理实践指南》(world gastroenterology organization practice guidelines for the diagnosis and management of ibd in 2010).inflamm bowel dis.,16(1),112-24.
[0657]
borley,n.(2005).《空肠和回肠.格雷解剖学:临床实践的解剖学基础》(jejunum and ileum.gray’s anatomy:the anatomical basis of clinical practice),39,1167
–
1172.
[0658]
cattaneo l,b.l.(1989).stereogrammi di anatomia dell’uomo:aspetti istologici,3.《制药技术百科全书》(encyclopaedia of pharmaceutical technology).(未注明日期).
[0659]
hilgendorh c,l.h.(2000).《药学科学杂志》(journal of pharmaceutical sciences),89,no.1,63-7.
[0660]
hm martin,b.c.(2004).《肠胃病学》(gastroenterology),127,80-93.
[0661]
jr bailey,c.p.(2011).《公共科学图书馆
·
综合》(plos one),6(10).
[0662]
kong j,z.z.(2008).维生素d受体在维持肠黏膜屏障完整性方面的新作用(novel role of the vitamin d receptor in maintaining the integrity of the intestinal mucosal barrier).《美国生理学、胃肠和肝脏生理学杂志》(am j physiol gastrointest liver physiol.),294,g208-16.
[0663]
ma x,f.p.(2012).《畜牧学杂志》(j.anim.sci.),90,266
–
268.
[0664]
mudie dm,e.a.(2014).《分子药剂学》(mol.pharmaceutics)2014,11,3039-3047.
[0665]
mynott tl,l.a.(1999).《免疫学杂志》(j immunol),163(5),2568-75.
[0666]
rieder f,k.t.-h.(2012).ecco(iii)第二届科学研讨会的结果:肠道愈合的基本机制(results of the 2nd scientific workshop of the ecco(iii):basic mechanisms of intestinal healing).《克罗恩与结肠炎杂志》(j crohns colitis).,6,373-85.
[0667]
sender,e.a.(2016).《公共科学图书馆
·
生物学》(plos biology).doi:10.1371/journal.pbio.1002533august 19,2016
[0668]
teodori,u.(1987).《国际医学杂志》(trattato di medicina interna).roma:societa`editrice universo.
[0669]
vamanu,e.(2018).《当前药物设计》(current pharmaceutical design)(第24
卷).
[0670]
weiss l,g.r.(1981).istologia.bologna:zanichelli.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1