RI-标记的人源化抗体的制作方法
ri-标记的人源化抗体
技术领域
1.本发明涉及与放射性核素螯合的螯合剂与黏蛋白亚型5ac特异性人源化抗体的缀合物、含有它的放射性药物及其用途。
背景技术:
2.黏蛋白是由动物的上皮细胞等分泌的黏液的主要组分,并且是一种具有100-1000万的分子量的含有大量糖的糖蛋白。黏蛋白包括由上皮细胞等产生的分泌性黏蛋白和膜结合的黏蛋白,后者具有疏水性跨膜位点并在与细胞膜结合时存在。黏蛋白的核心蛋白统称为muc,且已知存在至少20种编码核心蛋白的基因。它们中的一种黏蛋白亚型5ac (muc5ac)属于分泌性黏蛋白。
3.muc5ac在正常组织的胃和气管中表达,并已经报道了在胰腺癌中的超表达。还已经报道了在甲状腺癌、肝癌、结肠直肠癌、胃癌、尿道上皮癌、乳腺癌、宫颈癌、卵巢癌、子宫内膜癌和胆管癌中的超表达。作为muc5ac的抗体,已经报道了使用从人胰腺癌细胞系sw1990的异种移植物(xenograft)纯化的胰腺癌黏蛋白级分作为抗原制备的小鼠抗体(非专利文献1),以及基于其生产的嵌合抗体(专利文献1、2、非专利文献2、3)和人源化抗体(专利文献3、4)。
4.抗体被用作用于检测靶分子的试剂、诊断剂或通过利用抗体对靶分子的特异性来治疗疾病的药物产品。为了进一步改善检测性能和治疗效果,关于与放射性核素和药物结合的抗体的研究正在进行着。非专利文献1已经报道了使用由
131
i标记的小鼠抗体对胰腺癌模型小鼠的放射免疫治疗,所述
131
i是发射β-射线的核素。非专利文献3已经报道了使用由
111
in标记的嵌合抗体对胰腺癌患者的spect成像,所述
111
in是发射γ-射线的核素。专利文献3和4描述了用
90
y、
111
in等标记的muc5ac-特异性的人源化抗体。
5.文件列表专利文献专利文献1: jp-a-h7-203974专利文献2: jp-a-h11-5749专利文献3: wo 2013/157102专利文献4: wo 2013/157105非专利文献非专利文献1: japanese journal of cancer research, 87, 977-984, 1996非专利文献2: japanese journal of clinical medicine第64卷特刊1, 2006, 第274-278页非专利文献3: japanese journal of cancer research, 90, 1179-1186, 1999。
技术实现要素:
6.本发明的目的在于提供一种用放射性核素标记的抗-muc5ac人源化抗体,其在对黏蛋白亚型5ac (muc5ac)的特异性和在肿瘤中的积聚方面具有优越性。
7.本发明的发明人考虑到上述问题已经进行了深入研究。结果,他们已成功地生产了与放射性核素(其为一种金属核素)螯合的螯合剂与由特定氨基酸序列组成的抗-muc5ac人源化抗体的缀合物,发现所述缀合物在对muc5ac的特异性和在肿瘤中的积聚方面具有优越性,并证实了其效果,其导致完成了本发明。
8.在本发明的一个实施方案中,将与放射性核素螯合的螯合剂和抗体的缀合物作为所述缀合物提供,其中所述放射性核素是发射α粒子或正电子的金属核素,且所述人源化抗体特异性地结合muc5ac。
9.根据本发明,可以提供用放射性核素标记的且在对muc5ac的特异性和在肿瘤中的积聚方面具有优越性的抗-muc5ac人源化抗体,以及所述抗体的用途。
附图说明
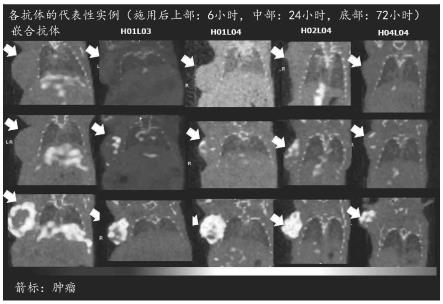
10.图1显示了使用各种
111
in-标记的抗体的spect-ct成像的结果。显示了
111
in-标记的抗体的spect图像。
11.图2显示了显示在各种
111
in-标记的抗体的spect图像中在每个时间点对肿瘤和肝进行voi(感兴趣体积,三维roi)分析的结果的图。
12.图3是显示了施用各种
111
in-标记的抗体以后168小时的生物分布(biodistribution)和排泄途径的结果的图。
13.图4是显示了通过体外arg确定的各种
111
in-标记的抗体的结合能力的结果的图像。
14.图5显示了显示通过体外arg确定的各种
111
in-标记的抗体的定量结合能力的结果的图。
15.图6是显示了在施用225ac-标记的单价抗体以后,在荷瘤小鼠中的肿瘤体积的时间过程(time-course)变化的图。
16.图7是显示了在施用
225
ac-标记的单价抗体以后,荷瘤小鼠的体重的时间过程变化的图,如与施用前体重作为1.0的相对值所示的。
17.图8是显示了在施用
225
ac-标记的单价抗体以后,在荷瘤小鼠中的肝毒性和肾毒性的结果的图。
18.图9是显示了在施用
225
ac-标记的单价抗体以后,在荷瘤小鼠中的血液毒性(白细胞计数、血小板计数)的结果的图。
19.图10是显示了在施用高剂量的
225
ac-标记的单价抗体以后,在荷瘤小鼠中的肿瘤体积的时间过程变化的图。
20.图11是显示了在施用高剂量的
225
ac-标记的单价抗体以后,荷瘤小鼠的体重的时间过程变化的图,如与施用前体重作为1.0的相对值所示的。
21.图12是显示了在施用高剂量的
225
ac-标记的抗体以后,在荷瘤小鼠中的肝毒性和肾毒性的确认结果的图。
22.图13是显示了在施用高剂量的
225
ac-标记的抗体以后,在荷瘤小鼠中的血液毒性
(白细胞计数、血小板计数)的确认结果的图。
23.图14是显示了在施用
225
ac-标记的单价抗体或
225
ac-标记的二价抗体以后,在荷瘤小鼠中的肿瘤体积的时间过程变化的图。
24.图15是显示了在施用
225
ac-标记的单价抗体或
225
ac-标记的二价抗体以后,荷瘤小鼠的体重的时间过程变化的图,如与施用前体重作为1.0的相对值所示的。
25.图16是显示了在施用
225
ac-标记的单价抗体或
225
ac-标记的二价抗体以后,在荷瘤小鼠中的肝毒性的结果的图。
26.图17是显示了在施用
225
ac-标记的单价抗体或
225
ac-标记的二价抗体以后,在荷瘤小鼠中的肾毒性的结果的图。
27.图18是显示了在施用
225
ac-标记的单价抗体或
225
ac-标记的二价抗体以后,在荷瘤小鼠中的血液毒性(白细胞计数)的结果的图。
28.图19是显示了在施用
225
ac-标记的单价抗体或
225
ac-标记的二价抗体以后,在荷瘤小鼠中的血液毒性(血小板计数)的结果的图。
29.图20是显示了在施用
111
in-标记的单价或二价抗体后20、68和188小时的生物分布中,在每个器官中每单位重量的放射性量(%id/g)的结果的图。
30.图21是显示了在施用
111
in-标记的单价或二价抗体后20、68和188小时的生物分布中,在肿瘤、血液、排泄的尿、排泄的粪便以及排泄的尿和排泄的粪便的总和中的放射性等级的时间过程变化的图。
31.图22a评价了
89
zr-标记的抗-muc5ac人源化抗体在人(
‑■‑
、
∙∙∙■∙∙∙
)血浆和小鼠(
‑●‑
、
∙∙∙●∙∙∙
)血浆中的稳定性。将各种
89
zr-标记的抗体与人或小鼠血浆混合,并于37℃温育。所述图显示了在每个时间推移点放射化学纯度的时间过程变化。上部图片显示了使用
89
zr-标记的dota-bn-dbco制备的
89
zr-标记的抗-muc5ac人源化抗体的结果(在温育以后24小时、48小时、168小时和378小时),且下部图片显示了使用
89
zr-标记的dotaga-dbco制备的
89
zr-标记的抗-muc5ac人源化抗体的结果(在温育以后24小时、168小时和336小时)。
32.图22b评价了
225
ac-标记的抗-muc5ac人源化抗体在人(
‑■‑
、
∙∙∙■∙∙∙
)血浆和小鼠(
‑●‑
、
∙∙∙●∙∙∙
)血浆中的稳定性。将各种
225
ac-标记的抗体与人或小鼠血浆混合,并于37℃温育。所述图显示了在每个时间推移点放射化学纯度的时间过程变化。上部图片显示了使用
225
ac-标记的dota-bn-dbco制备的
225
ac-标记的抗-muc5ac人源化抗体的结果(在温育以后21小时、115小时、140小时和168小时),且下部图片显示了使用
225
ac-标记的dotaga-dbco制备的
225
ac-标记的抗-muc5ac人源化抗体的结果(在温育以后48小时、168小时和336小时)。
33.图23是显示了通过体外arg确定的每种
89
zr-标记的抗体的结合能力的结果的图像。
34.图24是显示了通过体外arg确定的
225
ac-标记的抗体的结合能力的结果的图像。
35.图25是显示了在施用每种
89
zr-标记的抗体以后48小时pet-ct成像的结果的图像。
36.图26是显示了在使用
89
zr-标记的dota-bn-dbco (
‑■‑
)和
89
zr-标记的dotaga-dbco (
∙∙∙●∙∙∙
)制备的各种
89
zr-标记的抗体的spect图像中,在每个时间点(12、48、84、168和252小时)肿瘤(上图)、心(中图)和肝(下图)的voi (感兴趣体积、三维roi)分析的结果的图。
37.图27是显示了在施用使用
89
zr-标记的dota-bn-dbco (
‑●‑
)和
89
zr-标记的dotaga-dbco (
∙∙∙●∙∙∙
)制备的各种
89
zr-标记的抗体以后,从在肿瘤和肝中在每个时间点(12、48、84、168和252小时)的积聚计算肿瘤-肝比率的结果的图。
38.图28a显示了显示在施用使用
89
zr-标记的dota-bn-dbco (
‑■‑
)和
89
zr-标记的dotaga-dbco (
∙∙∙●∙∙∙
)制备的各种
89
zr-标记的抗体20、68和188小时以后的生物分布中,在每个器官中每单位重量的放射性量(%id/g)的结果的图。上部图片显示了肿瘤的结果,且下部图片显示了血液学结果。
39.图28b显示了显示在施用使用
89
zr-标记的dota-bn-dbco (
‑■‑
)和
89
zr-标记的dotaga-dbco (
∙∙∙●∙∙∙
)制备的各种
89
zr-标记的抗体20、68和188小时以后的生物分布中,在每个器官中每单位重量积聚的放射性量(%id/g)的结果的图。上部图片显示了肝的结果,且下部图片显示了肾的结果。
40.图28c显示了显示在施用使用
89
zr-标记的dota-bn-dbco (
‑■‑
)和
89
zr-标记的dotaga-dbco (
∙∙∙●∙∙∙
)制备的各种
89
zr-标记的抗体20、68和188小时以后的生物分布中,在每个器官中每单位重量的放射性量(%id/g)的结果的图。上部图片显示了心的结果,且下部图片显示了肺的结果。
41.图28d显示了显示在施用使用
89
zr-标记的dota-bn-dbco (
‑■‑
)和
89
zr-标记的dotaga-dbco (
∙∙∙●∙∙∙
)制备的各种
89
zr-标记的抗体20、68和188小时以后的生物分布中,在每个器官中每单位重量的放射性量(%id/g)的结果的图。分别显示了脾和胰的结果。
42.图29是显示了在施用使用
89
zr-标记的dota-bn-dbco (
‑■‑
、
‑□‑
)和
89
zr-标记的dotaga-dbco (
∙∙∙●∙∙∙
,
ꢀ∙∙∙○∙∙∙
)制备的各种
89
zr-标记的抗体以后,排泄的粪便(
‑□‑
、
∙∙∙○∙∙∙
)和排泄的尿(
‑■‑
、
∙∙∙●∙∙∙
)的积聚的放射性等级(%id)的时间过程变化的图。
43.图30显示了显示在施用的放射性5 kbq/小鼠或10 kbq/小鼠,向荷瘤小鼠施用使用
225
ac-标记的dotaga-dbco制备的
225
ac-标记的抗体以后,肿瘤体积(a)和体重(b)的时间过程变化的图。
44.图31是显示了在施用使用
225
ac-标记的dotaga-dbco制备的
225
ac-标记的抗体以后,在荷瘤小鼠中血液毒性(白细胞计数)的结果的图。
45.图32是显示了在施用使用
225
ac-标记的dotaga-dbco制备的
225
ac-标记的抗体以后,在荷瘤小鼠中血液毒性(血小板计数)的结果的图。
46.图33是显示了在施用使用
225
ac-标记的dotaga-dbco制备的
225
ac-标记的抗体以后,在荷瘤小鼠中肝毒性(alt、ast)的结果的图。
47.图34是显示了在施用使用
225
ac-标记的dotaga-dbco制备的
225
ac-标记的抗体以后,在荷瘤小鼠中肾毒性(bun)的结果的图。
48.图35显示了使用[
89
zr]随机-dfo-抗-muc5ac人源化抗体的随着时间的过去的spect-ct成像的结果。
[0049]
图36是显示了在[
89
zr]随机-dfo-抗-muc5ac人源化抗体的spect图像中,在每个时间点肿瘤(
‑●‑
)、心(血液) (
∙∙∙■∙∙∙
)和肝(
∙∙∙
δ
∙∙∙
)的voi (感兴趣体积、三维roi)分析的结果的图。
具体实施方式
[0050]
除非另外指出,否则在本说明书中使用的术语可以以本领域中普遍使用的含义使用。
[0051]
(1)缀合物1本发明提供了与放射性核素螯合的螯合剂(在下文中也被称作本发明的螯合剂)和抗体的缀合物(在下文中也被称作本发明的缀合物),其中前述放射性核素是发射α粒子的金属核素,且前述抗体是特异性地结合muc5ac的人源化抗体。
[0052]
(1-1)放射性核素在本发明的缀合物中所含的放射性核素是发射α粒子的金属核素。所述金属核素可以是在放射性金属的衰变过程中发射α粒子的任何核素。具体地,优选地使用
212
bi、
213
bi、
227
th、
225
ac等。更优选的是
227
th或
225
ac,并且进一步优选的是
225
ac (锕-225)。
[0053]
通过使用加速器如回旋加速器、线性加速器等的已知方法,可以产生本发明中的发射α粒子的金属核素。例如,通过使用回旋加速器用质子照射
226
ra靶,通过(p,2n)的核反应,可以产生
225
ac。通过从靶分离和纯化,可以纯化产生的发射α粒子的金属核素。例如,通过用酸等溶解含有
225
ac的靶,向溶液中添加碱以沉淀含有
225
ac的盐,并分离和纯化盐,可以得到纯化的
225
ac。通过使核素经受必要的化学处理以获得适合用于ri标记的化学形式,可以将以所述方式纯化的发射α粒子的核素用于ri标记。
[0054]
(1-2)抗体在本发明的缀合物中所含的抗体是特异性地结合muc5ac的人源化抗体(在下文中也被称作在本发明中使用的人源化抗体)。所述抗体没有特别限制,只要它是具有特异性地结合muc5ac的能力的人源化抗体。所述抗体优选地具有稳定的物理性质,并且在肿瘤积聚方面是优越的。所述抗体可以作为其抗原结合片段使用,且这样的实施方案也被包括在本发明中。具体而言,它含有下文所述的特定重链可变区和特定轻链可变区,并且在期望时,可以含有适当的重链恒定区和适当的轻链恒定区。在本说明书中,“抗原结合片段”意指由在本发明中使用的人源化抗体的一部分组成并具有对muc5ac的结合能力的抗体片段。在构成抗原结合片段的多肽中所含的氨基酸的数目没有特别限制,只要它具有对muc5ac的结合能力。
[0055]
优选作为在本发明中使用的人源化抗体的重链可变区的氨基酸序列如下所示。重链可变区1 (h01)、重链可变区2 (h02)、重链可变区3 (h03)和重链可变区4 (h04)分别对应于本说明书所附序列表中的seq id no: 1
ꢀ‑ꢀ
4。带下划线的部分是cdr位点。
[0056]
[重链可变区1 (h01)][重链可变区2 (h02)]
[重链可变区3 (h03)][重链可变区4 (h04)]优选作为在本发明中使用的人源化抗体的轻链可变区的氨基酸序列如下所示。轻链可变区1 (l01)、轻链可变区2 (l02)、轻链可变区3 (l03)和轻链可变区4 (l04)分别对应于本说明书所附序列表中的seq id no: 5
ꢀ‑ꢀ
8。带下划线的部分是cdr位点。
[0057]
[轻链可变区1 (h01)][轻链可变区2 (h02)][轻链可变区3 (h03)][轻链可变区4 (h04)]换而言之,在本发明中优选的人源化抗体的重链可变区由seq id no: 1至seq id no: 4中任一个所示的氨基酸序列组成,且轻链可变区由seq id no: 5至seq id no: 8中任一个所示的氨基酸序列组成。也就是说,在本发明中使用的人源化抗体由上述四个重链可变区(h01
ꢀ‑ꢀ
h04)和四个轻链可变区(l01
ꢀ‑ꢀ
l04)的组合组成。
[0058]
在本发明中的优选人源化抗体具有重链可变区h01、h03或h04和作为轻链可变区的l01
ꢀ‑ꢀ
l04中的任一个。
[0059]
在本发明中最优选的人源化抗体具有重链可变区h01和轻链可变区l03。
[0060]
在本发明中的人源化抗体的重链可变区不限于由seq id no: 1至seq id no: 4中所示的氨基酸序列定义的那些,并且还包括维持功能的变体。也就是说,由与seq id no: 1至seq id no: 4中所示的氨基酸序列具有不小于90%、优选地不小于95%、进一步优选地不小于98%、最优选地不小于99%的序列同一性的氨基酸序列组成的突变重链可变区也用作要在本发明中使用的人源化抗体的重链可变区,只要它在与本发明中的轻链可变区组合时可以结合muc5ac。
[0061]
在本说明书中,氨基酸序列的同一性指两种感兴趣的蛋白之间的氨基酸序列的同一性,并通过使用相应技术领域已知的数学算法制备的氨基酸序列的最佳比对中匹配的氨基酸残基的百分比(%)来表示。通过目检和数学计算可以确定氨基酸序列的同一性,并可以使用本领域技术人员已知的同源性搜索程序(例如,blast、fasta)或序列比对程序(例如,clustalw)或遗传信息处理软件(例如,genetyx [注册商标])等进行计算。具体而言,使用在ddbj (日本dna数据库(dna databank of japan))的网站上公开的系统分析程序clustalw (http://clustalw.ddbj.nig.ac.jp/index.phplang=ja),通过初始设定条件(版本2.1,比对类型:慢,dna权重矩阵(weight matrix):gonnet, 缺口开放(gap open): 10, 缺口延伸(gap extension): 0.1),可以确定在本说明书中的氨基酸序列的同一性。
[0062]
此外,作为要在本发明中使用的人源化抗体的重链可变区,由seq id no: 1至seq id no: 4中所示的氨基酸序列组成的突变重链可变区,其中不超过10个、优选地不超过8个、进一步优选地不超过5个、最优选地不超过3个氨基酸被缺失、取代或取代,也被用作要在本发明中使用的人源化抗体的重链可变区,只要它在与本发明中的轻链可变区组合时可以结合muc5ac。
[0063]
要在本发明中使用的人源化抗体的轻链可变区不限于在seq id no: 5至seq id no: 8中所示的氨基酸序列,并且还包括维持功能的变体。也就是说,由与seq id no: 5至seq id no: 8中所示的氨基酸序列具有不小于90%、优选地不小于95%、进一步优选地不小于98%、最优选地不小于99%的序列同一性的氨基酸序列组成的突变轻链可变区也用作要在本发明中使用的人源化抗体的轻链可变区,只要它在与本发明中的重链可变区组合时可以结合muc5ac。
[0064]
此外,作为要在本发明中使用的人源化抗体的轻链可变区,由seq id no: 5至seq id no: 8中所示的氨基酸序列组成的突变轻链可变区,其中不超过10个、优选地不超过8个、进一步优选地不超过5个、最优选地不超过3个氨基酸被缺失、取代或取代,也被包括在要在本发明中使用的人源化抗体的轻链可变区中,只要它在与本发明中的重链可变区组合时可以结合muc5ac。
[0065]
要在本发明中使用的人源化抗体可以通过本领域中通常执行的方法或与其类似的方法来生产。具体而言,可以执行以下步骤。
[0066]
由于要在本发明中使用的人源化抗体的重链可变区和轻链可变区的氨基酸序列公开在seq id no: 1至seq id no: 8中,所以构建编码基于氨基酸序列信息得到的抗体的核酸,并将其插入合适的表达载体中。除了编码要在本发明中使用的人源化抗体的核酸外,表达载体还可以任选地含有:kozak序列,以提高翻译效率;信号序列,其在引入宿主时促进要在本发明中使用的人源化抗体向培养基中的分泌;启动子序列,等。可以用在本发明中的载体可以选自相应技术领域中常用的那些,且质粒载体pcdna3.4是优选的。表达载体向宿主细胞中的引入没有特别限制。作为将基因引入细胞中的方法,可以使用在相应技术领域中常规使用的方法,例如,本领域技术人员已知的方法,诸如磷酸钙方法、电穿孔方法、脂转染方法和deae-葡聚糖方法。使用脂转染方法的引入方法是特别优选的,如在以下实施例中执行的。作为用于所述目的的宿主细胞,可以使用在相应技术领域中常规使用的那些。这样的宿主细胞的例子包括cho细胞、293细胞、大肠杆菌(escherichia coli)、毕赤酵母属(pichia)酵母、sf9细胞等。目前,用于表达感兴趣的蛋白的表达系统试剂盒也是商购可得
的。在以下实施例中使用的expicho系统(thermo fisher scientific)对于快速地且可靠地表达感兴趣的蛋白而言是特别优选的。
[0067]
可以如下得到要在本发明中使用的人源化抗体:将编码要在本发明中使用的人源化抗体的核酸插入表达载体中,通过含有所述核酸的表达载体将所述核酸引入宿主细胞,在引入所述核酸后培养所述宿主细胞,和通过纯化方法诸如层析等从其培养物上清液中得到本发明的人源化抗体。在所述方法中,通过培养宿主细胞,在培养物上清液中分泌要在本发明中使用的人源化抗体。通过使用纯化方法诸如层析等,可以从培养物上清液中得到要在本发明中使用的人源化抗体或其抗原结合片段。作为层析的方法,可以使用相应技术领域中已知的各种方法,诸如亲和层析、离子交换层析、尺寸排阻层析等。在以下实施例中使用的使用a蛋白柱的亲和层析是特别优选的。
[0068]
另外,上述人源化抗体可以是多克隆抗体或单克隆抗体。
[0069]
(1-3)螯合剂在本发明中,螯合剂没有特别限制,只要它在其结构中具有放射性核素所配位的位点。优选地,它具有使得能够形成抗体与螯合位点的缀合物的取代基,所述螯合位点是放射性核素所配位的位点。螯合位点的例子包括cb-te2a (1,4,8,11-四氮杂双环[6.6.2]十六烷-4,11-二乙酸)、cdta (环己烷-反式-1,2-双胺四乙酸)、cdtpa (4-氰基-4-[[(十二烷硫代)硫代甲基]硫代]-戊酸)、dota (1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸)、dotma ((1r,4r,7r,10r)-α,α’,α”,α
’”‑
四甲基-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸)、dotam (1,4,7,10-四(氨基甲酰基甲基)-1,4,7,10-四氮杂环十二烷)、dota-ga (α-(2-羧乙基)-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸)、dotp (((1,4,7,10-四氮杂环十二烷-1,4,7,10-四基)四(亚甲基))四膦酸)、dotmp (1,4,7,10-四氮杂环十二烷-1,4,7,10-四(亚甲基膦酸))、dota-4amp (1,4,7,10-四氮杂环十二烷-1,4,7,10-四(乙酰氨基亚甲基膦酸)、d02p (四氮杂环十二烷二甲烷膦酸)、去铁胺(dfo)、dtpa (甘氨酸, n,n-双[2-[双(羧甲基)氨基]乙基]-)、dtpa-bma (5,8-双(羧甲基)-11-[2-(甲氨基)-2-氧代乙基]-3-氧代-2,5,8,11-四氮杂十三烷-13-酸)、edta (2,2’,2
’’
,2
’’’‑
(乙烷-1,2-二基双(氮烷三基))四乙酸)、nota (1,4,7-三氮杂环壬烷-1,4,7-三乙酸)、notp (1,4,7-三氮杂环壬烷-1,4,7-三基三(亚甲基膦酸)、tetpa (1,4,8,11-四氮杂环十四烷-1,4,8,11-四丙酸)、teta (1,4,8,11-四氮杂环十四烷-n,n’,n
’’
,n
’’’‑
四乙酸)、ttha (3,6,9,12-四(羧甲基)-3,6,9,12-四氮杂十四烷二酸)、heha (1,2,7,10,13-六氮杂环十八烷-1,4,7,10,13,16-六乙酸)、1,2-hopo (n,n’,n”,n
’”‑
四(1,2-二氢-1-羟基-2-氧代吡啶-6-羰基)-1,5,10,14-四氮杂十四烷)、pepa(1,4,7,10,13-五氮杂环十五烷-n,n’,n”,n
’”
,n
””‑
五乙酸)、h4octapa (n,n
’‑
双(6-羧基-2-吡啶基甲基)-乙二胺-n,n
’‑
二乙酸)、h2bispa2 (6,6
’‑
({9-羟基-1,5-双(甲氧羰基)-2,4-二(吡啶-2-基)-3,7-二氮杂双环[3.3.1]壬烷-3,7-二基}双(-亚甲基))吡啶二羧酸)、h2dedpa (1,2-[{6-(羧基)-吡啶-2-基}-甲氨基]乙烷)、h2macropa (6-(1,4,10,13-四氧杂-7,16-二氮杂环十八烷-n,n
’‑
甲基)吡啶甲酸)、h5decapa (n,n
”‑
双(6-羧基-2-吡啶基甲基)-二亚乙基三胺-n,n’,n
”‑
三乙酸)、h6phospa (n,n
’‑
(亚甲基膦酸酯)-n,n
’‑
[6-(甲氧羰基)吡啶-2-基]-甲基-1,2-二氨基乙烷)、hp-d03a (羟丙基四氮杂环十二烷三乙酸)和卟啉。优选地具有从下式(a)表示的化合物衍生出的结构。
[0070]
其中在式(a)中,r
11
、r
13
和r
14
各自独立地是由-(ch2)
p
cooh、-(ch2)
p
c5h5n、-(ch2)
p
po3h2、-(ch2)
p
conh2或-(chcooh)(ch2)
p
cooh组成的基团,r
12
和r
15
中的一个是氢原子、羧基基团或具有2或3个碳原子的羧基烷基基团,另一个是用于与前述抗体缀合的取代基,p是不小于0且不超过3的整数,当r
12
是用于与前述抗体缀合的取代基时,r
15
是氢原子,且当r
12
不是用于与前述抗体缀合的取代基时,r
15
是用于与前述抗体缀合的取代基。
[0071]
由式(a)表示的特定结构的例子包括从以下式(a-1)至(a-12)表示的化合物衍生出的结构。
[0072]
在螯合位点和使得能够与抗体形成缀合物的取代基之间的连接位点从稳定性方面看优选地是酰胺键或硫脲键,更优选酰胺键。
[0073]
例如,通过使上述式(a-10)或(a-11)的n-羟基琥珀酰亚胺酯(nhs)基团或上述(a-12)的2,6-二氧四氢-2h-吡喃基基团与伯胺反应,可以形成酰胺键。通过使上述式(a-2)、(a-3)的化合物的异硫氰酸酯基团与伯胺或马来酰亚胺基团反应,可以形成硫脲键。
[0074]
在本发明的缀合物中,可以给每一个抗体分子提供至少不少于一个分子、优选不少于1个分子且不超过8个分子的螯合剂。为了维持抗体本身的活性(抗原识别作用、中和作用、补体激活作用和/或调理素作用),优选地将螯合剂位点特异性地引入抗体的fc区(恒定区)中。在本发明中,优选地给每一个抗体分子提供一个或两个分子的螯合剂。
[0075]
在本发明的缀合物中,螯合剂可以通过接头连接至抗体。接头的例子包括被取代的或未取代的烷基基团、被取代的或未取代的杂烷基基团、聚乙二醇(peg)基团、肽、糖链、二硫化物基团、这些的组合等。
[0076]
优选地,螯合剂通过接头位点特异性地修饰抗体,更优选地在fc区中。在所述情况
下,接头含有由下式(i)表示的由不少于13个且不超过17个氨基酸残基组成的肽(在下文中也被称作“抗体修饰肽”),且可以使用由交联剂修饰的抗体修饰肽与抗体之间的交联反应形成的那种。在式(i)的解释中,氨基酸序列的纸张表面的左侧指示n-末端侧,且氨基酸序列的纸张表面的右侧指示c-末端侧。当螯合剂通过作为接头的抗体修饰肽连接至抗体时,螯合剂和抗体修饰肽连接的位置没有特别限制。例如,它可以直接地或间接地连接在抗体修饰肽的n-末端或c-末端,优选在n-末端。此外,抗体修饰肽的c-末端可以通过例如酰胺化等进行修饰以提高其稳定性等。
[0077]
(xa)-xaa1-(xb)-xaa2-(xc)-xaa3-(xd)
∙∙∙
(i)在式(i)中,xa、xb、xc和xd各自分别是a数目的连续x、b数目的连续x、c数目的连续x和d数目的连续x,x是在侧链中既不具有巯基也不具有卤乙酰基的氨基酸残基,a、b、c和d各自独立地是不小于1且不超过5的整数,且满足a+b+c+d≤14,xaa1和xaa3各自独立地是从在侧链中具有巯基的氨基酸衍生出的氨基酸残基,或者一个是从在侧链中具有巯基的氨基酸衍生出的氨基酸残基且另一个是从在侧链中具有卤乙酰基的氨基酸衍生出的氨基酸残基,且xaa1和xaa3连接,且xaa2是赖氨酸残基、精氨酸残基、半胱氨酸残基、天冬氨酸残基、谷氨酸残基、2-氨基辛二酸或二氨基丙酸,且被交联剂修饰。
[0078]
在上述式(i)中可能被包含在x中的氨基酸残基的例子包括从氨基酸诸如甘氨酸、丙氨酸、苯丙氨酸、脯氨酸、天冬酰胺、天冬氨酸、谷氨酸、精氨酸、组氨酸、丝氨酸、苏氨酸、酪氨酸、甲硫氨酸等衍生出的那些,且x可能是由相同类型的氨基酸或不同类型的氨基酸组成的氨基酸残基。
[0079]
在式(i)中,a、b、c和d没有特别限制,只要它们是上述范围内的数字。从肽和抗体之间结合的稳定性方面看,要满足a+b+c+d≤14,且a优选地是不小于1且不超过3的整数,b优选地是不小于1且不超过3的整数,c优选地是不小于3且不超过5的整数,且d优选地是不小于1且不超过3的整数。
[0080]
xaa1和xaa3是从在侧链中具有巯基的氨基酸衍生出的氨基酸残基,且可以相同或不同。在侧链中具有巯基的氨基酸的例子包括半胱氨酸和高半胱氨酸。这样的氨基酸残基优选地通过二硫键键合,或硫化物基团优选地通过下式(4)所示的接头与其键合。在式(4)中,折线指示与硫化物基团的结合部分。
[0081]
代替xaa1和xaa3的上述组合,xaa1和xaa3中的一个可以是从在侧链中具有巯基的氨基酸衍生出的氨基酸残基,且另一个可以是从在侧链中具有卤乙酰基的氨基酸衍生出的氨基酸残基。这些通过硫醚键键合。卤乙酰基基团的末端被卤素诸如碘等取代,并且通过与另一个侧链中的巯基反应而消除卤素,由此形成硫醚键。
[0082]
由式(i)表示的抗体修饰肽的氨基酸序列的具体例子包括在wo 2016/186206、wo 2017/217347和wo 2018/230257中描述的肽,且也可以使用这些。
[0083]
在这些中,抗体修饰肽的氨基酸序列优选地具有下述序列(1)
ꢀ‑ꢀ
(14)中的任一个,更优选下述序列(1)、(2)、(13)或(14)。在下述氨基酸序列(1)
ꢀ‑ꢀ
(14)中,(xaa2)是赖氨酸残基、半胱氨酸残基、天冬氨酸残基、谷氨酸残基、2-氨基辛二酸或二氨基丙酸,且(xaa1)和(xaa3)各自是高半胱氨酸残基。在下述氨基酸序列(1)
ꢀ‑ꢀ
(14)中,除了(xaa1)、(xaa2)和(xaa3)以外的氨基酸用单字母缩写指示。
[0084]
(1-4)缀合物的生产方法本发明的缀合物的生产方法包括两个步骤,它们是缀合螯合剂和抗体的缀合步骤,以及形成放射性核素和螯合剂的复合物的复合物形成步骤。缀合步骤可以在复合物形成步骤之前或复合物形成步骤之后进行。
[0085]
在缀合步骤中,使用用于抗体化学修饰的各种方法。具体地,可以提及方法(a)
ꢀ‑ꢀ
(f):(a)胺偶联方法(通过使用具有被n-羟基琥珀酰亚胺(nhs)基团激活的羧基的螯合剂或螯合物来修饰抗体的赖氨酸残基的氨基的方法)(b)用于用具有可与sh基团反应的马来酰亚胺基团的螯合剂或接头修饰巯基(sh)基团的方法,所述巯基(sh)基团通过部分地还原在抗体铰链部位处的多肽链之间的二硫键(ss键)而生成(c)用于用具有马来酰亚胺基团的螯合剂或接头修饰通过基因工程通过氨基酸突变新引入抗体中的半胱氨酸的方法(d)用于通过使用点击反应(click reaction)用具有炔(例如,二苄基环辛炔(dibensylciclooctene): dbco)的螯合剂或接头修饰通过基因工程通过氨基酸突变新引入抗体中的赖氨酸叠氮化物的叠氮化物基团的方法(e)用于通过使用转谷氨酰胺酶用具有赖氨酸侧链的螯合剂或接头修饰引入在抗体特定位置的谷氨酰胺的方法
(f)用于用具有前述(i)中所示抗体修饰肽的螯合剂或接头位点特异性地修饰抗体的fc区的方法在复合物形成步骤中,使螯合剂与放射性核素螯合(复合物形成)。从提高复合物形成效率的观点看,这里使用的放射性核素优选以允许电离的方式使用,更优选以离子的形式使用。在复合物形成步骤中,只要可以与放射性核素形成复合物,向螯合剂添加放射性核素的顺序就无关紧要。例如,将放射性金属离子溶解在主要由水组成的溶剂中的溶液可以用作放射性核素。
[0086]
在复合物形成以后,可以使用滤过过滤器、膜过滤器、填充了各种填料的柱、层析等纯化所得到的复合物。
[0087]
在本发明的缀合物的生产方法中,缀合步骤优选在复合物形成步骤之后进行。
[0088]
在更优选的实施方案中,在复合物形成步骤(a)中,在放射性核素和螯合剂之间形成复合物,所述螯合剂具有能够进行点击反应的第一原子团作为取代基,用于使得能够与抗体形成缀合物。然后,在缀合步骤(b)中,使用前述(i)所示的抗体修饰肽和具有能够进行点击反应的第二原子团的抗体修饰接头,在肽修饰的抗体(其中fc区被位点特异性地修饰)和螯合剂(具有在步骤(a)中获得的形成的复合物)之间进行点击反应,以获得本发明的缀合物。
[0089]
在下面详细描述步骤(a)和(b)。
[0090]
作为能够进行点击反应的第一原子团和第二原子团的组合,根据点击反应的类型选择适当的组合。例如,可以提及炔和叠氮化物的组合、1,2,4,5-四嗪和烯的组合等。在这些原子团中,第一原子团具有上述原子团组合中的一个,且第二原子团具有与上述原子团组合中的第一原子团不同的一个原子团。为了实现螯合剂和抗体的稳定性以及其结合效率的提高,螯合接头优选地是炔且抗体修饰接头优选地是叠氮化物,或螯合接头优选地是1,2,4,5-四嗪且抗体修饰接头优选地是烯。通过这样的原子团组合的点击反应的具体例子包括husgen环化加成反应、反电子需求的第尔斯-阿尔德反应等。
[0091]
能够进行点击反应的原子团组合的具体例子包括,如在下式中所示的,含有二苄基环辛炔(dbco)作为第一原子团的炔的原子团(式(1a))和含有叠氮化物基团作为第二原子团的叠氮化物的原子团(式(2a))的组合,以及含有1,2,4,5-四嗪作为第一原子团的原子团(式(1b))和含有反-环辛烯(tco)作为第二原子团的烯的原子团(式(2b))的组合。优选的是式(1a)和式(2a)的组合。
[0092]
其中r1是与螯合剂的连接位点,且r2是与抗体中的抗体修饰肽的连接位点。
[0093]
其中r3和r4中的一个是与任何一种螯合剂或抗体中的抗体修饰肽的连接位点,且另一个是氢原子、甲基基团、苯基基团或吡啶基基团,且r5取决于r3或r4是与任何一种螯合剂或抗体中的抗体修饰肽的连接位点。
[0094]
当使用含有由上述式(1a)表示的二苄基环辛炔(dbco)作为第一原子团的炔的原子团时,可以提及各种商购可得的dbco试剂。具体而言,可以选择例如dbco-c6-酸、二苄基环辛炔-胺、二苄基环辛炔马来酰亚胺、dbco-peg酸、dbco-peg-nhs酯、dbco-peg-醇、dbco-peg-胺、dbco-peg-nh-boc、羧基罗丹明-peg-dbco、磺基罗丹明(sulforhodamine)-peg-dbco、tamra-peg-dbco、dbco-peg-生物素、dbco-peg-dbco、dbco-peg-马来酰亚胺、tco-peg-dbco、dbco-mpeg等,且优选地使用二苄基环辛炔马来酰亚胺。
[0095]
在步骤(a)中,更优选地,使用具有由下式(ii)表示的结构的螯合剂。
[0096]
a-b-c
∙∙∙
(ii)在式(ii)中,a是由下式(iia)表示的螯合位点。
[0097]
在式(iia)中,ra、rb和rc各自独立地是由-(ch2)
p
cooh、-(ch2)
p
c5h5n、-(ch2)
p
po3h2、-(ch2)
p
conh2或-(chcooh)(ch2)
p
cooh组成的基团,p是不小于0且不超过3的整数,rd和re中的一个是与b的结合位点(*),且另一个是氢原子或由-(ch2)
p
cooh、-(ch2)
p
c5h5n、-(ch2)ppo3h2、-(ch2)
p
conh2或-(chcooh)(ch2)
p
cooh组成的基团,且p是不小于0且不超过3的整数。
[0098]
在式(ii)中,b由下式(iib)表示。
[0099]
在式(iib)中,la和lb各自独立地是至少含有酰胺键或硫脲键和不少于1个且不超过50个碳原子的结合接头(bond linker),t是不小于0且不超过30的整数,s是0或1,* 是与a的结合位点,且** 是与c的结合位点。
[0100]
在式(ii)中,c是由下式(iic)表示的炔衍生物或由式(iid)表示的四嗪衍生物。
[0101]
在式(iic)中,x是chrk-**或n-**,y是chrk或c=o,rk独立地是氢原子或具有不小于1个且不超过5个碳原子的烷基基团,当x是chrk-**且y是chrk时,那么rk部分可以连接以形成环烷基基团,rf、rg、rh和ri各自独立地是氢原子、卤素原子或具有不小于1个且不超过5个碳原子的烷基基团,rf和rg可以连接,或rh和ri可以连接以形成烃环,** 是与b的结合位点,在式(iid)中,** 是与b的结合位点,且rj是氢原子、甲基基团、苯基基团或吡啶基基团。
[0102]
作为在步骤(a)中使用的螯合剂,更优选的是上述式(iia)的dota衍生物,其中ra至rd是-(ch2)
p
cooh,p是1,re是与b的结合位点;或do3a衍生物或dotaga衍生物,其中ra至rc是-(ch2)pcooh,p是1,rd是与b的结合位点(*),且re是氢原子。
[0103]
在式(ii)中,进一步更优选的是dota-pegt-dbco衍生物,其中a是上述dota衍生物,在b中,la是含有硫脲键且具有不少于1个且不超过50个碳原子的结合接头,s是0或1,当s是1时,t是不小于0且不超过30的整数,lb是含有酰胺键或硫脲键且具有不少于1个且不超过50个碳原子的结合接头,且c是由式(iic)表示的炔衍生物,其中,在式(iic)中,x是n-**,y是chrk,rk是氢原子,rf和rg连接以形成苯环,rh和ri连接以形成苯环,且** 是与b的结合位点;或dota-pegt-tz衍生物,其中,在b中,la是含有硫脲键且具有不少于1个且不超过50个碳原子的结合接头,s是0或1,当s是1时,t是不小于0且不超过30的整数,lb是含有酰胺键或硫脲键且具有不少于1个且不超过50个碳原子的结合接头,且c是由式(iid)表示的四嗪衍生物。
[0104]
在式(ii)中,进一步更优选的是do3a-pegt-dbco衍生物,其中a是上述do3a衍生物,在b中,la是含有酰胺键或硫脲键且具有不少于1个且不超过50个碳原子的结合接头,s是0或1,当s是1时,t是不小于0且不超过30的整数,lb是含有酰胺键且具有不少于1个且不超过50个碳原子的结合接头,且c是由式(iic)表示的炔衍生物,其中,在式(iic)中,x是n-**,y是chrk,rk是氢原子,rf和rg连接以形成苯环,rh和ri连接以形成苯环,且** 是与b的结合位点。
[0105]
在式(ii)中,进一步更优选的是dotaga-pegt-dbco衍生物,其中a是上述dotaga衍生物,在b中,la是含有酰胺键或硫脲键且具有不少于1个且不超过50个碳原子的结合接头,s是0或1,当s是1时,t是不小于0且不超过30的整数,lb是含有酰胺键或硫脲键且具有不少于1个且不超过50个碳原子的结合接头,且c是由式(iic)表示的炔衍生物,其中,在式(iic)中,x是n-**,y是chrk,rk是氢原子,rf和rg连接以形成苯环,rh和ri连接以形成苯环,且** 是与b的结合位点。
[0106]
在作为螯合位点/放射性核素的螯合剂和放射性核素的摩尔比中,下限优选地不小于10/1,更优选地不小于100/1,进一步优选地不小于500/1,且上限优选地不超过10000/
1,更优选地不超过8000/1,进一步优选地不超过7000/1。例如,不小于100/1且不超过7000/1的范围是优选的,且不小于500/1且不超过7000/1的范围是更优选的。
[0107]
复合物形成反应优选地在溶剂中进行。作为溶剂,可以使用水,盐水,诸如乙酸钠缓冲液、乙酸铵缓冲液、磷酸盐缓冲液、磷酸缓冲盐水、三羟甲基氨基甲烷缓冲液(tris缓冲液)、4-(2-羟乙基)-1-哌嗪乙磺酸缓冲液(hepes缓冲液)、四甲基乙酸铵缓冲液等的缓冲液,等。
[0108]
虽然溶剂的量没有特别限制,但从生产步骤的可行性方面看,在步骤(a)开始时的下限不小于0.01 ml,优选地不小于0.1 ml,更优选地不小于1.0 ml,进一步优选地不小于10 ml,进一步更优选地不小于100 ml,且上限优选地不超过1000,更优选地不超过100 ml,进一步优选地不超过10 ml,进一步更优选地不超过1.0 ml。例如,它是在不小于0.01 ml且不超过100 ml的范围内。
[0109]
作为复合物形成反应的反应混合物中螯合剂的浓度,从期望的螯合剂的得率方面看,在步骤(a)开始时的下限各自独立地优选地不小于0.001 μmol/l,更优选地不小于0.01 μmol/l,进一步优选地不小于0.1 μmol/l,更优选地不小于1 μmol/l,且上限优选地不超过1000 μmol/l,更优选地不超过100 μmol/l,进一步优选地不超过10 μmol/l。例如,它是在不小于1 μmol/l且不超过100 μmol/l的范围内。
[0110]
复合物形成反应的温度可以是例如室温(25℃)或在加热条件下。为了同时实现螯合剂分解的抑制和复合物形成效率的提高,下限优选地不小于20℃,更优选地不小于30℃,进一步优选地不小于35℃,进一步更优选地不小于37℃,特别优选地不小于45℃。上限优选地不超过150℃,更优选地不超过120℃,进一步优选地不超过100℃,进一步更优选地不超过90℃。例如,不小于30℃且不超过100℃的范围是优选的,且不小于35℃且不超过90℃的范围是更优选的。
[0111]
作为反应时间,应满足前述反应温度,且下限优选地不小于5分钟,更优选地不小于10分钟,进一步优选地不小于20分钟,进一步更优选地不小于30分钟,特别优选地不小于45分钟,且上限优选地不超过180分钟,更优选地不超过150分钟,进一步优选地不超过120分钟,进一步更优选地不超过90分钟,特别优选地不超过60分钟。例如,不小于10分钟且不超过150分钟的范围是优选的,且不小于10分钟且不超过60分钟的范围是更优选的。
[0112]
要在步骤(b)中使用的抗体是肽修饰的抗体,其中使用前述(i)中所示的抗体修饰肽和具有能够进行点击反应的第二原子团的抗体修饰接头位点特异性地修饰如上述“(1-2)抗体”中详细描述的人源化抗体的fc区(恒定区)。
[0113]
抗体修饰肽可以使用氨基酸的组合(不论天然的氨基酸还是非天然的氨基酸),通过经历肽合成方法如液相合成方法、固相合成方法、自动肽合成方法、基因重组方法、噬菌体展示方法等来生产。在肽的合成中,在必要的场合,可以保护要使用的氨基酸的官能团。这些方法可以根据例如wo 2017/217347和wo 2018/230257中描述的方法来执行。
[0114]
抗体修饰接头可以是其中抗体修饰肽和由下式(s1)表示的接头发生键合的接头。
[0115]
*-((l1)
m-z)
k-l
2-ag2∙∙∙
(s1)其中*是与肽的n-末端或c-末端的结合位点,l1是聚乙二醇(peg)的接头部分,m是不小于1且不超过50的整数,
z是结合(l1)m和l2的第二接头部分,k是0或1,l2是第二peg接头部分,且ag2是第二原子团。
[0116]
在前述式(s1)中,z的结构没有特别限制,只要它是使(l1)m和l2相互结合的接头结构,并且包括例如由不少于1个且不超过5个氨基酸残基组成的氨基酸序列。在所述情况下,在z中包含的氨基酸序列优选地含有半胱氨酸残基,并且更优选地通过由半胱氨酸残基的巯基和马来酰亚胺基团之间的键形成的硫醚基键合至l2。
[0117]
在本发明中,构成l2的peg接头部分优选地具有下式(p2)所示的结构。在式(p2)中,n是优选地不小于1且不超过50、更优选地不小于1且不超过20、进一步优选地不小于2且不超过10、进一步更优选地不小于2且不超过6的整数。
[0118]
peg接头部分的结构的一端可以被衍生自商购可得的聚乙二醇化(pegylation)试剂的结构或衍生自通常用于聚乙二醇化的试剂的结构修饰。尽管没有特别限制,但其例子包括衍生自二甘醇酸或其衍生物、以及马来酰亚胺或其衍生物的结构。
[0119]
作为将前述第二原子团引入抗体修饰接头的方法,可以提及包括下述的引入方法:通过前述方法获得具有期望的氨基酸序列的抗体修饰肽,将肽溶解在含有加溶剂和还原剂以及在必要的场合酸的溶液中,将含有叠氮化物基团或反-环辛烯(tco)作为第二原子团的原子团的有机溶剂溶液添加到溶液中,并在室温搅拌混合物。
[0120]
当引入含有叠氮化物基团的原子团作为第二原子团时,根据常规方法,通过使用商购可得的叠氮化物基团引入试剂将叠氮化物基团直接引入肽的n-末端或c-末端,或者,可以通过前述接头结构引入含有叠氮化物基团的原子团。要使用的叠氮化物基团引入试剂的例子包括甲硅烷基叠氮化物、磷酸叠氮化物、烷基铵叠氮化物、无机叠氮化物、磺酰叠氮化物、peg叠氮化物等。
[0121]
当引入含有tco的原子团作为第二原子团时,根据常规方法,通过使用含有tco的商购可得的点击化学试剂将tco直接引入肽的n-末端或c-末端,或者,可以通过前述接头结构引入含有tco的原子团。
[0122]
将抗体修饰肽与抗体结合以得到肽修饰的抗体的方法可以使用例如交联剂来执行。交联剂是用于通过共价键连接抗体修饰肽和抗体的化学物质。其例子包括优选含有两个或更多个琥珀酰亚胺基基团的交联剂,诸如戊二酸二琥珀酰亚胺酯(dsg)、辛二酸二琥珀酰亚胺酯(dss)等,由含有两个或更多个亚氨酸部分的化合物组成的交联剂,诸如己二亚氨酸二甲酯等,或其盐,由具有二硫键的化合物组成的交联剂,诸如3,3'-二硫代双丙亚氨酸二甲酯、二硫代双琥珀酰亚胺基丙酸等,或其盐,等。使用这样的交联剂,可以在抗体修饰肽中xaa2的氨基酸残基和抗体之间引起交联反应。当例如将本发明的人源化抗体用作抗体时,抗体中的交联反应位点特异性地发生在xaa2的氨基酸残基和根据本发明的人源化抗体中的eu编号的lys252残基之间。这些lys残基存在于本发明的人源化抗体的fc区中。
[0123]
将抗体修饰肽与抗体结合的方法可以例如通过下述执行:于不小于10℃且不超过30℃,将前述抗体修饰肽、抗体、交联剂和必要时的催化剂分散在适当的缓冲液中。反应时间可以是约不小于10分钟至2小时。作为抗体/肽的下限,在肽与抗体反应时的摩尔比优选地不小于1/5、更优选地不小于1/3、进一步优选地不小于1/1.5,且上限优选地不超过20/1、更优选地不超过10/1、进一步优选地不超过5/1、进一步更优选地不超过1/1、特别优选地不超过1/1.7。例如,不小于1/5且不超过20/1的范围是优选的,且不小于1/1.5且不超过1/1.7的范围是更优选的。
[0124]
通过上述步骤获得的肽修饰抗体是混合物,所述混合物含有任意比例的其中一个抗体修饰肽分子结合一个抗体分子的抗体(在下文中被称作“单价抗体”)和其中两个抗体修饰肽分子结合一个抗体分子的抗体(在下文中被称作“二价抗体”)。这可以按现状用于后来的步骤,或将未修饰的抗体、单价抗体和二价抗体通过诸如滤过过滤器、膜过滤器、填充了各种填料的柱、各种层析等的方法分离和纯化,并且仅具有任何价的抗体可以经历后来的步骤。当通过纯化不能将未修饰的抗体与具有其它价的抗体分离时,可以使含有这些的混合物经历后来的步骤。
[0125]
当分离和纯化未修饰的抗体、单价抗体和二价抗体时,可以使用上述纯化方法中的任一种用于分离和纯化。优选使用填充了各种填料的柱,并且更优选使用填充了适合于分离和纯化蛋白(诸如抗体等)的填料的柱。
[0126]
适合于分离和纯化蛋白(诸如抗体等)的填料没有特别限制,只要它是这样的填料:其中免疫球蛋白结合蛋白被固定化在由水不溶性基质组成的载体上并且其特异性地结合抗体。免疫球蛋白结合蛋白的例子包括a蛋白、g蛋白、l蛋白等。这些免疫球蛋白结合蛋白可能是基因工程重组体。重组免疫球蛋白结合蛋白的例子包括基因工程a蛋白、基因工程g蛋白和融合的a蛋白结构域和g蛋白结构域。在本发明中,作为适合于至少分离和纯化单价抗体和二价抗体的填料,a蛋白是更优选的,和基因工程a蛋白是更优选的。如本文中所使用的,a蛋白和g蛋白是可以特异性地结合抗体分子igg的蛋白分子,并取决于分离的微生物的来源中的差异分类为a蛋白(金黄色葡萄球菌(staphylococcus aureus))或g蛋白(链球菌:链球菌属(streptococcus))。基因工程a蛋白是这样的a蛋白,其中已经将至少一个氨基酸突变引入a蛋白的任何igg结合结构域(e、d、a、b和c结构域)的氨基酸残基中。在本发明中,优选的是这样的基因工程a蛋白,其中已经引入至少一个氨基酸突变的结构域是多聚化的,更优选的是这样的基因工程a蛋白,其中已经引入a蛋白的至少一个氨基酸突变的a、b或c结构域是多聚化的,且进一步更优选的是多聚化成不小于二聚体且不超过五聚体的基因工程a蛋白。氨基酸突变可以衍生自氨基酸序列或在基因的转录翻译步骤中编码氨基酸的碱基序列的任何突变诸如取代、缺失、插入等。其例子没有特别限制,包括在wo 2003/080655、wo 2011/118699等中描述的基因工程a蛋白。
[0127]
将免疫球蛋白结合蛋白固定在其上的水不溶性基质的例子包括无机载体诸如玻璃珠、硅胶等,有机载体诸如合成的聚合物(例如,交联聚乙烯醇、交联聚丙烯酸酯、交联聚丙烯酰胺、交联聚苯乙烯)和多糖(例如,晶态纤维素、交联纤维素、交联琼脂糖、交联葡聚糖),以及从这些的组合获得的有机-有机、有机-无机缀合物载体等,等。
[0128]
填充了前述基因工程a蛋白作为填料的柱是商购可得的,例如,作为kaneka corporation的kancap (注册商标)系列(kaneka kancapa预装柱)、ge healthcare的
hitrap (注册商标)系列(hitrap mabselect, hitrap mabselect sure, hitrap mabselect xtra)、ge healthcare的hiscreen系列(hiscreen mabselect sure)、tosoh corporation的toyopearl (注册商标)系列(toyopearl af-rprotein a-650f)等。
[0129]
以下举例来说解释在步骤(b)中用于点击反应的肽修饰的抗体的分离和纯化。
[0130]
在抗体修饰步骤和抗体纯化步骤之后在步骤(b)中使肽修饰的抗体经历点击反应,在抗体修饰步骤中,通过提供了抗体修饰肽的接头(抗体修饰接头)位点特异性地修饰抗体的fc区获得修饰的抗体,在抗体纯化步骤中,使用在其上固定化了免疫球蛋白结合蛋白的上述载体纯化修饰的抗体。此外,抗体纯化步骤进一步包括保留保留在载体上的修饰的抗体的保留步骤、洗涤未保留在载体上的修饰的抗体的洗涤步骤以及洗脱在保留步骤中保留在载体上的修饰的抗体的洗脱步骤。
[0131]
更具体地,在抗体修饰步骤中,修饰的抗体作为含有未被抗体修饰接头修饰的未修饰的抗体、单价抗体和二价抗体的混合物获得,并且在抗体纯化步骤中,利用未修饰的抗体、单价抗体和二价抗体与免疫球蛋白结合蛋白的相互作用的差异,分别洗脱含有相对大量未修饰的抗体和单价抗体的第一抗体组合物和含有相对大量二价抗体的第二抗体组合物。即,在抗体纯化步骤中的保留步骤和洗涤步骤中,洗脱含有相对大量与免疫球蛋白结合蛋白具有低相互作用程度的肽修饰的抗体(二价抗体)的第二抗体组合物,并且在抗体纯化步骤中的洗脱步骤中,洗脱含有相对大量与免疫球蛋白结合蛋白具有高相互作用程度的肽修饰的抗体(未修饰的抗体和单价抗体)的第一抗体组合物。如本文中所使用的。“含有相对大量未修饰的抗体和单价抗体”意指,在第一抗体组合物中所含的未修饰的抗体和单价抗体的总量大于在抗体组合物中所含的二价抗体的总量,优选地未修饰的抗体和单价抗体的总量是抗体组合物中所含的未修饰的抗体和修饰的抗体的总量(100%)的不小于55%、不小于63%、不小于70%、不小于80%或不小于90%。另外,“含有相对大量二价抗体”意指,在第二抗体组合物中所含的二价抗体的量大于抗体组合物中所含的单价抗体的量,优选地二价抗体的量是抗体组合物中所含的未修饰的抗体和修饰的抗体的总量(100%)的不小于55%、不小于63%、不小于70%、不小于80%或不小于90%。
[0132]
在保留步骤中,将含有在抗体修饰步骤中获得的未修饰的抗体、单价抗体和二价抗体的混合物的溶液添加到柱中,且保留在载体上的未修饰的抗体和单价抗体被保留在柱上,而未保留在载体上的二价抗体被允许流过。在保留步骤中流过的溶液构成第二抗体组合物的一部分。为了促进未修饰的抗体和单价抗体在柱上的保留并防止这些的聚集或变性,优选用适当的稀释溶剂稀释肽修饰的抗体的混合溶液,并将其添加到柱中。稀释溶剂没有特别限制,只要肽修饰的抗体溶解且不易在溶剂中聚集或变性,且可以使用水,盐水,诸如乙酸钠缓冲液、乙酸铵缓冲液、磷酸盐缓冲液、磷酸缓冲盐水、2-氨基-2-(羟甲基)丙烷-1,3-二醇(tris)缓冲液、2-[4-(2-羟乙基)-1-哌嗪基]-乙磺酸(hepes)缓冲液等的缓冲液,等。优选使用上述缓冲液中的任一种,更优选乙酸钠缓冲液。当将缓冲液用作稀释溶剂时,缓冲剂的浓度不小于10 mmol/l、优选地不小于15 mmol/l、更优选地不小于20 mmol/l作为下限,且不超过1000 mmol/l、优选地不超过500 mmol/l、更优选地不超过100 mmol/l作为上限。此外,为了减少二价抗体和抗体修饰肽与柱载体的非特异性结合,洗脱溶剂可以含有添加剂诸如氯化钠、氯化钾等。在洗脱溶剂中所含的添加剂的浓度没有特别限制,且可以是例如0.15 mol/l。
[0133]
在洗涤步骤中,使用洗涤溶剂从柱洗脱保留在柱中的修饰的抗体。在上述保留步骤中流过柱的溶液和在洗涤步骤中从柱洗脱的溶液含有相对大量的二价抗体,且因此,这些可以组合并用作第二抗体组合物。
[0134]
洗涤溶剂没有特别限制,只要肽修饰的抗体溶解且不易在溶剂中聚集或变性,并且它是具有适当ph缓冲容量的缓冲液,并可以使用诸如乙酸钠缓冲液、乙酸铵缓冲液、磷酸盐缓冲液、磷酸缓冲盐水、2-氨基-2-(羟甲基)丙烷-1,3-二醇(tris)缓冲液、2-[4-(2-羟乙基)-1-哌嗪基]-乙磺酸(hepes)缓冲液等缓冲液的,等。优选使用前述缓冲液或者的任一种,更优选乙酸钠缓冲液。用作洗涤溶剂的缓冲剂的浓度不小于20 mmol/l、优选地不小于30 mmol/l作为下限,且不超过200 mmol/l、优选地不超过70 mmol/l作为上限。洗涤溶剂的ph不小于4.0、优选地不小于4.5、更优选地不小于4.8作为下限,且不超过7.4、优选地不超过6.0、更优选地不超过5.2作为上限。此外,为了减少二价抗体和抗体修饰肽与柱载体的非特异性结合,洗脱溶剂可以含有添加剂诸如氯化钠、氯化钾等。洗脱溶剂中所含的添加剂的浓度没有特别限制,且可以是例如0.15 mol/l。
[0135]
在洗脱步骤中,使用洗脱溶剂从柱洗脱保留在载体上的修饰的抗体。即,通过使用洗脱溶剂从柱洗脱含有相对大量未修饰的抗体和单价抗体的第一抗体组合物。
[0136]
作为洗脱溶剂,可以使用缓冲液诸如乙酸钠缓冲液、乙酸铵缓冲液、柠檬酸盐缓冲液等。此外,为了减少与抗体修饰接头、未修饰的抗体和修饰的抗体柱载体的非特异性结合,洗脱溶剂可以含有添加剂诸如氯化钠、氯化钾等。洗脱溶剂中所含的添加剂的浓度没有特别限制,且可以是例如0.15 mol/l。
[0137]
当洗脱溶剂含有缓冲剂时,缓冲剂的浓度不小于20 mmol/l、优选地不小于30 mmol/l作为下限,且不超过200 mmol/l、优选地不超过70 mmol/l作为上限。此外,为了减弱未修饰的抗体和单价抗体与免疫球蛋白结合蛋白之间的相互作用,并防止抗体的变性和聚集,洗脱溶剂的ph不小于ph 3.0作为下限,且不超过ph 4.2作为上限。
[0138]
在抗体纯化步骤中获得的第一抗体组合物或第二抗体组合物可以按现状在后来的步骤(b)中用于点击反应,或可以在调整所含的肽修饰的抗体的蛋白浓度后用于步骤(b)中的点击反应。
[0139]
在螯合剂中所含的能够进行点击反应的第一原子团和肽修饰的抗体中所含的能够进行点击反应的第二原子团之间进行在步骤(b)中的点击反应。通过这样的点击反应,形成连接螯合剂和抗体的结合基团(能够与抗体缀合的取代基)。
[0140]
当肽修饰的抗体和在步骤(a)中获得的复合物能够发生点击反应时,这些的添加顺序无关紧要。例如,将复合物和肽修饰的抗体中的一种添加到含有溶剂的反应容器中,并且然后添加另一种以执行反应,或者将螯合剂和抗体中的一种分散在溶剂中,并将另一种添加到分散体中以执行反应。另一方面,可以同时将这些添加到含有溶剂的反应容器中以执行反应。
[0141]
作为要用于步骤(b)中点击反应的溶剂,可以使用含有水的溶剂。例如,可以使用水,盐水,诸如乙酸钠缓冲液、乙酸铵缓冲液、磷酸盐缓冲液、磷酸缓冲盐水、tris缓冲液、hepes缓冲液、四甲基乙酸铵缓冲液等的缓冲液,等。当使用缓冲液时,为了同时实现复合物和抗体的稳定性以及这些的结合效率,在25℃的ph优选地定到不小于4.0且不超过10.0,进一步优选地不小于5.5且不超过8.5。
[0142]
虽然反应混合物的量没有特别限制,但从生产步骤的可行性方面看,在步骤(b)开始时的下限优选地不小于0.001 ml,更优选地不小于0.01 ml,进一步优选地不小于0.1 ml,进一步更优选地不小于1 ml,且上限优选地不超过1000 ml,更优选地不超过100 ml,进一步优选地不超过10 ml,进一步更优选地不超过1 ml。例如,不小于0.001 ml且不超过1000 ml的范围是优选的,且不小于0.1 ml且不超过10 ml的范围是更优选的。
[0143]
作为在反应混合物中的螯合剂和抗体的浓度,各自独立地,在步骤(b)开始时的下限优选地不小于0.001 μmol/l,更优选地不小于0.01 μmol/l,进一步优选地不小于0.1 μmol/l,进一步更优选地不小于1.0 μmol/l,且上限优选地不超过1000 μmol/l,更优选地不超过100 μmol/l。例如,从期望的缀合物的得率方面看,不小于0.1 μmol/l且不超过1000 μmol/l的范围是优选的,且不小于1 μmol/l且不超过100 μmol/l的范围是更优选的。
[0144]
为了防止抗体的非故意的变性并提高反应效率,在步骤(b)中点击反应的反应温度的上限优选地不超过50℃,更优选地不超过40℃。只要反应继续进行,反应温度的下限没有特别限制,且优选地不小于15℃。在上述反应温度的条件下,点击反应的反应时间优选地不小于5分钟,更优选地不小于10分钟,优选地不超过24小时,更优选地不超过20小时。例如,不小于5分钟且不超过24小时的范围是优选的,且不小于10分钟且不超过20小时的范围是更优选的。
[0145]
所获得的缀合物可以按现状使用,或者使用滤过过滤器、膜过滤器、填充了各种填料的柱、层析等进行纯化。
[0146]
在通过步骤(a)和(b)产生的缀合物中,用螯合剂对特异性地结合muc5ac的人源化抗体的特定位点(例如,抗体的fc区的赖氨酸残基)进行特异性修饰。所述缀合物包含每一个抗体分子一个或两个上述螯合剂分子。螯合剂通过接头位点特异性地修饰本发明抗体的fc区。所述接头由连接至螯合剂的螯合接头、连接至所述接头的第一原子团、可以与所述第一原子团进行点击反应的第二原子团以及连接至所述第二原子团的抗体修饰接头(包括由上述式(i)表示的抗体修饰肽)构成。因此,所述接头具有衍生自第一原子团和第二原子团的化学结构。作为这样的化学结构,可以考虑由下式(10a)或(10b)表示的含有三唑骨架的结构,或由下式(10c)表示的含有哒嗪骨架的结构。由于式(10a)和式(10b)是异构体,可以以任何比例包含它们。
[0147]
在式(10a)和式(10b)中,r
1a
是与螯合接头的结合位点,且r
2a
是与抗体修饰接头的结合位点。在式(10c)中,r
3a
和r
4a
中的一个是氢原子、甲基基团、苯基基团或吡啶基基团,且另一个是与螯合接头的结合位点,且r
5a
是与抗体修饰接头的结合位点。
[0148]
(1-5)放射性药物通过前述(1-4)的方法生产的缀合物也可以按现状或在纯化后用于制备含有缀合物作为活性成分的放射性药物。放射性药物指含有本发明的缀合物,即,用放射性核素(发射α粒子的金属核素)标记的抗-muc5ac人源化抗体或其衍生物,且处于适合于施用给主体身体的形式的组合物。例如,通过将通过上述方法生产的本发明的缀合物溶解在主要由水组成且与活体基本等渗的溶剂中,可以生产放射性药物。在所述情况下,放射性药物优选为水溶液的形式,并必要时可以含有其它药学上可接受的组分。将有效量的放射性药物口服地或肠胃外地如静脉内地、皮下地、腹膜内地、肌内地等施用给活体,并用于疾病治疗、疾病诊断、病变检测等。
[0149]
如本文中所使用的,施用主体为人或动物,诸如小鼠、大鼠、猴、豚鼠、黑猩猩、绵羊、山羊、狗、猫、猪、牛科动物、马等,但没有特别限制。优选的是人。
[0150]
作为优选的靶疾病,可以提及癌症。通过本发明要治疗和诊断的癌症的例子包括胰腺癌、甲状腺癌、肝癌、结肠直肠癌、胃癌、尿道上皮癌、乳腺癌、宫颈癌、卵巢癌和子宫内膜癌,且具体地,向胰腺癌的应用是优选的。
[0151]
通过本发明要治疗和诊断的癌症的例子还包括胆管癌。
[0152]
有多篇报道称,muc5ac是ca19-9的抗原载体(plоs one (2011年12月, 第6卷,第12期,e29180, p1-10))。因此,本发明要治疗的癌症的例子还包括超表达ca19-9的胆道癌、子宫癌、肺癌和食管癌,并且这些可以被有效治疗。
[0153]
如本文中所使用的,“有效量”是可以在施用主体中提供有用治疗效果的量。要施用给主体的有效量取决于主体的类型、主体的体重、施用的剂型(片剂、注射液等)和途径(口服施用、肠胃外施用等)、疾病(例如,癌症)的严重性等而变化。医生和兽医可以考虑这些因素并确定适当的有效量。
[0154]
通过选择具有治疗效果的放射性核素,本发明的缀合物可以用于靶向放射性核素疗法(ri内部疗法)。在ri内部疗法中,静脉内地或口服地施用放射性药物,所述放射性药物积聚在病变部位,诸如原发癌病变或转移性病变,且病变部位的癌细胞被放射性药物发射的辐射破坏。因此,本发明的缀合物可以优选地用于癌症的ri内部疗法。在所述情况下,根据活性成分的有效性,施用形式和途径,疾病(特别是癌症)的进展阶段,患者的体形、体重、年龄,以及对于所述疾病要联合使用的其它治疗剂的种类和量,适当地选择要施用的放射性量和药物剂量。通常,一次可以施用不超过250 kbq/kg。甚至在一次不超过80 kbq/kg的剂量也可以显示出效果。
[0155]
此外,作为本发明的另一个实施方案,可以制备含有前述缀合物作为活性成分的放射性药物并用于上述癌症的ri内部疗法中的癌症诊断,在所述缀合物中,仅放射性核素从发射α粒子的核素替换为发射正电子或γ-射线的放射性核素(
68
ga、
64
cu、
86
y、
89
zr、
111
in)。本发明的用于癌症诊断的放射性药物可以用于在进行癌症的ri内部疗法之前的诊断,或可以用于在进行癌症的ri内部疗法之后的诊断。当用于在进行癌症的ri内部疗法之前的诊断时,它可以用于确定是否使用具有发射α粒子的金属核素的本发明的缀合物进行癌症的ri内部疗法的治疗选择。此外,当用于在进行癌症的ri内部疗法之后的诊断时,它可以用于确定使用具有发射α粒子的金属核素的本发明的缀合物进行癌症的ri内部疗法的效果,以及优化治疗方案诸如增加或减少剂量等。
[0156]
(2)缀合物2在另一个实施方案中,本发明提供了与放射性核素螯合的螯合剂和抗体的缀合物,其中上述放射性核素是发射正电子的金属核素,且上述抗体是特异性地结合muc5ac的人源化抗体。
[0157]
除了螯合剂中的放射性核素是发射正电子的金属核素以外,在上述“(1)缀合物1”中的相同定义适用。
[0158]
发射正电子的金属核素可以是在放射性金属的衰变过程中发射带正电荷的电子(正电子)的核素。详细地,优选地使用
68
ga、
64
cu、
86
y、
89
zr等,且更优选的是
89
zr (锆-89)。用发射正电子的核素标记的抗体可以适当地用于pet (正电子成像术)检查。
[0159]
另外,使用发射正电子的核素作为放射性核素的缀合物2还可以用作放射性药物用于使用利用发射α粒子的核素作为放射性核素的上述缀合物1的ri内部疗法的癌症诊断。在所述情况下,药物的剂量没有特别限制,只要它是对于在pet检查中描述疾病(特别是癌症)病变必需和足够的量。优选地,根据疾病(特别是癌症)的进展阶段,患者的体形、体重、年龄,以及对于所述疾病要联合使用的其它治疗剂的种类和量,适当选择剂量。
[0160]
根据上述的本发明的实施方案,提供了在对muc5ac的特异性和在肿瘤中的积聚方面具有优越性的用放射性核素、特别是发射α粒子的核素标记的抗-muc5ac抗体,特别是人源化抗体。
[0161]
此外,根据本发明的实施方案,提供了ri-标记的抗-muc5ac抗体,其使得能够实现癌症诊断和/或癌症治疗用于实现治疗诊断学(theranostics)。
[0162]
本发明的上述实施方案包括以下技术思想。
[0163]
[1]与放射性核素螯合的螯合剂和抗体的缀合物,其中所述放射性核素是发射α粒子的金属核素,且所述抗体是特异性地结合muc5ac的人源化抗体。
[0164]
[2]上述[1]的缀合物,其中所述抗体是具有重链可变区和轻链可变区的人源化抗体,所述重链可变区由下述组成(1)在seq id no:1中所示的氨基酸序列(h01),(2)在seq id no:2中所示的氨基酸序列(h02),(3)在seq id no:3中所示的氨基酸序列(h03),或(4)在seq id no:4中所示的氨基酸序列(h04),所述轻链可变区由下述组成(5)在seq id no:5中所示的氨基酸序列(l01),(6)在seq id no:6中所示的氨基酸序列(l02),(7)在seq id no:7中所示的氨基酸序列(l03),或(8)在seq id no:8中所示的氨基酸序列(l04)。
[0165]
[3]上述[2]的缀合物,其中所述抗体是具有下述的人源化抗体:(1)由在seq id no: 1中所示的氨基酸序列组成的重链可变区(h01),和(7)由在seq id no: 7中所示的氨基酸序列组成的轻链可变区(l03)。
[0166]
[4]上述[1]至[3]中的任一条的缀合物,其中所述发射α粒子的金属核素是锕-225。
[0167]
[5]上述[1]至[4]中的任一条的缀合物,其包含每1个抗体分子不小于1个螯合剂
分子且不超过8个螯合剂分子。
[0168]
[6]上述[1]至[5]中的任一条的缀合物,其中所述螯合剂通过接头位点特异性地修饰所述抗体的fc区。
[0169]
[7]上述[6]的缀合物,其中所述接头包含由不少于13个且不超过17个氨基酸残基组成且由下式(i)表示的抗体修饰肽;(xa)-xaa1-(xb)-xaa2-(xc)-xaa3-(xd)
∙∙∙
(i)其中xa、xb、xc和xd各自分别是a数目的连续x、b数目的连续x、c数目的连续x和d数目的连续x,x是在侧链中既不具有巯基也不具有卤乙酰基的氨基酸残基,a、b、c和d各自独立地是不小于1且不超过5的整数,且满足a+b+c+d≤14,xaa1和xaa3各自独立地是从在侧链中具有巯基的氨基酸衍生出的氨基酸残基,且它们通过二硫键连接或它们的硫化物基团通过接头连接,或者一个是从在侧链中具有巯基的氨基酸衍生出的氨基酸残基且另一个是从在侧链中具有卤乙酰基的氨基酸衍生出的氨基酸残基,且它们通过硫醚键连接,且xaa2是赖氨酸残基、精氨酸残基、半胱氨酸残基、天冬氨酸残基、谷氨酸残基、2-氨基辛二酸或二氨基丙酸。
[0170]
[8]上述[7]的缀合物,其中所述抗体修饰肽是式(i),其中xaa2是赖氨酸残基。
[0171]
[9]上述[7]或[8]的缀合物,其中所述抗体修饰肽包含由在seq id no: 10中所示的氨基酸序列(其中xaa2是赖氨酸残基)组成的抗体修饰肽。
[0172]
[10]上述[1]至[9]中的任一条的缀合物,其中所述螯合剂具有从由下式(a)表示的化合物或其盐衍生出的结构:其中在式(a)中,r
11
、r
13
和r
14
各自独立地是由-(ch2)
p
cooh、-(ch2)
p
c5h5n、-(ch2)
p
po3h2、-(ch2)
p
conh2或-(chcooh)(ch2)
p
cooh组成的基团,r
12
和r
15
中的一个是氢原子、羧基基团或具有2或3个碳原子的羧基烷基基团,另一个是用于与所述抗体缀合的取代基,p是不小于0且不超过3的整数,当r
12
是用于与所述抗体缀合的取代基时,r
15
是氢原子,且当r
12
不是用于与所述抗体缀合的取代基时,r
15
是用于与所述抗体缀合的取代基。
[0173]
[11]上述[6]至[10]中的任一条的缀合物,其中所述螯合剂通过接头位点特异性地修饰所述抗体的fc区,所述接头具有通过点击反应形成的连接的基团。
[0174]
[12]上述[11]的缀合物,其中所述接头具有连接所述螯合剂和所述通过点击反应形成的连接的基团的螯合接头以及连接所述抗体和所述通过点击反应形成的连接的基团的抗体修饰接头,且所述通过点击反应形成的连接的基团包含由下式(10a)表示的含有三唑骨架的结构或含有哒嗪骨架的结构:
其中r
1a
是与所述螯合接头的结合位点,且r
2a
是与所述抗体修饰接头的结合位点。
[0175]
[13]包含上述[1]至[12]中的任一条的缀合物作为活性成分的放射性药物。
[0176]
[14]用于癌症的ri内部疗法的上述[13]的放射性药物。
[0177]
[15]在ri内部疗法中以一次不超过250 kbq/kg的剂量施用给主体的上述[14]的放射性药物。
[0178]
[16]上述[15]的放射性药物,其中所述剂量是一次不超过80 kbq/kg。
[0179]
[17]使用上述[14]至[16]中的任一条的放射性药物在ri内部疗法中用于癌症诊断的放射性药物,所述放射性药物是包含与放射性核素螯合的螯合剂和抗体的缀合物的放射性药物,其中所述抗体是特异性地结合muc5ac的人源化抗体。
[0180]
[18]与放射性核素螯合的螯合剂和抗体的缀合物,其中所述放射性核素是发射正电子的金属核素,且所述抗体是特异性地结合muc5ac的人源化抗体。
[0181]
[19]上述[18]的缀合物,其中所述抗体是具有重链可变区和轻链可变区的人源化抗体,所述重链可变区由下述组成(1)在seq id no:1中所示的氨基酸序列(h01),(2)在seq id no:2中所示的氨基酸序列(h02),(3)在seq id no:3中所示的氨基酸序列(h03),或(4)在seq id no:4中所示的氨基酸序列(h04),所述轻链可变区由下述组成(5)在seq id no:5中所示的氨基酸序列(l01),(6)在seq id no:6中所示的氨基酸序列(l02),(7)在seq id no:7中所示的氨基酸序列(l03),或(8)在seq id no:8中所示的氨基酸序列(l04)。
[0182]
[20]上述[19]的缀合物,其中所述抗体是具有下述的人源化抗体:(1)由在seq id no: 1中所示的氨基酸序列组成的重链可变区(h01),和(7)由在seq id no: 7中所示的氨基酸序列组成的轻链可变区(l03)。
[0183]
[21]上述[18]至[20]中的任一条的缀合物,其中所述发射正电子的金属核素是锆-89。
[0184]
[22]上述[18]至[21]中的任一条的缀合物,其包含每1个抗体分子1-8个螯合剂分子。
[0185]
[23]上述[18]至[21]中的任一条的缀合物,其中所述螯合剂通过接头位点特异性地修饰所述抗体的fc区。
[0186]
[24]上述[23]的缀合物,其中所述接头包含由不少于13个且不超过17个氨基酸残
基组成且由下式(i)表示的抗体修饰肽;(xa)-xaa1-(xb)-xaa2-(xc)-xaa3-(xd)
∙∙∙
(i)其中xa、xb、xc和xd各自分别是a数目的连续x、b数目的连续x、c数目的连续x和d数目的连续x,x是在侧链中既不具有巯基也不具有卤乙酰基的氨基酸残基,a、b、c和d各自独立地是不小于1且不超过5的整数,且满足a+b+c+d≤14,xaa1和xaa3各自独立地是从在侧链中具有巯基的氨基酸衍生出的氨基酸残基,且它们通过二硫键连接或它们的硫化物基团通过接头连接,或者一个是从在侧链中具有巯基的氨基酸衍生出的氨基酸残基且另一个是从在侧链中具有卤乙酰基的氨基酸衍生出的氨基酸残基,且它们通过硫醚键连接,且xaa2是赖氨酸残基、精氨酸残基、半胱氨酸残基、天冬氨酸残基、谷氨酸残基、2-氨基辛二酸或二氨基丙酸。
[0187]
[25]上述[24]的缀合物,其中所述抗体修饰肽是式(i),其中xaa2是赖氨酸残基。
[0188]
[26]上述[24]或[25]的缀合物,其中所述抗体修饰肽包含由在seq id no: 10中所示的氨基酸序列(其中xaa2是赖氨酸残基)组成的抗体修饰肽。
[0189]
[27]上述[18]至[26]中的任一条的缀合物,其中所述螯合剂具有从由下式(a)表示的化合物或其盐衍生出的结构:其中在式(a)中,r
11
、r
13
和r
14
各自独立地是由-(ch2)
p
cooh、-(ch2)
p
c5h5n、-(ch2)
p
po3h2、-(ch2)
p
conh2或-(chcooh)(ch2)
p
cooh组成的基团,r
12
和r
15
中的一个是氢原子、羧基基团或具有2或3个碳原子的羧基烷基基团,另一个是用于与所述抗体缀合的取代基,p是不小于0且不超过3的整数,当r
12
是用于与所述抗体缀合的取代基时,r
15
是氢原子,且当r
12
不是用于与所述抗体缀合的取代基时,r
15
是用于与所述抗体缀合的取代基。
[0190]
[28]包含上述[18]至[27]中的任一条的缀合物作为活性成分的放射性药物。
[0191]
[29]用于生产上述[1]至[12]和[18]至[27]中的任一条的缀合物的方法,其包括将与放射性核素螯合的螯合剂和抗-muc5ac抗体缀合以产生所述螯合剂和所述抗-muc5ac抗体的缀合物的缀合步骤。
[0192]
[30]上述[29]的生产方法,其中所述螯合剂连接至螯合接头,所述抗-muc5ac抗体具有被提供了抗体修饰肽的抗体修饰接头特异性地修饰的fc区,且所述螯合接头和所述抗体修饰接头通过在缀合步骤中进行点击反应而连接。
[0193]
[31]修饰的抗体,其具有被提供了抗体修饰肽的抗体修饰接头特异性地修饰的抗体的fc区,其中所述抗体是抗-muc5ac抗体,且所述抗体修饰接头具有原子团以通过点击反
应连接至与放射性核素螯合的螯合剂的螯合接头。
[0194]
[32]用于生产修饰的抗体的方法,其中所述抗体的fc区被提供了抗体修饰肽的抗体修饰接头特异性地修饰,所述方法包括用提供了抗体修饰肽的接头位点特异性地修饰所述抗体的fc区以产生修饰的抗体的抗体修饰步骤,和使用在其上面固定了免疫球蛋白结合蛋白的载体纯化所述抗体的抗体纯化步骤,其中所述抗体是抗-muc5ac抗体。
[0195]
[33]上述[32]的生产方法,其中所述免疫球蛋白结合蛋白是a蛋白或基因工程a蛋白。
[0196]
[34]上述[32]或[33]的生产方法,其中使用填充了载体的柱进行所述抗体纯化步骤。
[0197]
[35]上述[32]至[34]中的任一条的生产方法,其中所述抗体纯化步骤包括:将所述修饰的抗体保留在所述载体上的保留步骤,和洗脱被保留在所述载体上的修饰的抗体的洗脱步骤。
[0198]
[36]上述[35]的生产方法,其中在所述抗体修饰步骤中,所述修饰的抗体作为含有未被所述抗体修饰接头修饰的未修饰的抗体、相对于一个抗体分子用一个抗体修饰接头分子修饰的单价抗体,和相对于一个抗体分子用两个抗体修饰接头分子修饰的二价抗体的混合物获得,和在所述抗体纯化步骤中,利用所述未修饰的抗体、所述单价抗体和所述二价抗体与免疫球蛋白结合蛋白的相互作用中的差异,分别获得含有相对大量所述未修饰的抗体和所述单价抗体的第一抗体组合物和含有相对大量所述二价抗体的第二抗体组合物。
[0199]
[37]用于生产缀合物的方法,其包括执行上述[32]至[36]中的任一条的生产方法以获得修饰的抗体的修饰的抗体生产步骤,和将所述修饰的抗体和与放射性核素螯合的螯合剂缀合以产生所述螯合剂和所述修饰的抗体的缀合物的缀合步骤。
[0200]
[38]上述[37]的生产方法,其中在所述修饰的抗体生产步骤中获得所述第一抗体组合物,其中未被所述抗体修饰接头修饰的未修饰的抗体和相对于一个抗体分子被一个抗体修饰接头分子修饰的单价抗体的总和的比例大于相对于一个抗体分子被两个抗体修饰接头分子修饰的二价抗体,和在所述缀合步骤中形成所述螯合剂和所述单价抗体的缀合物。
[0201]
[39]上述[37]的生产方法,其中在所述修饰的抗体生产步骤中获得所述第二抗体组合物,其中相对于一个抗体分子被两个抗体修饰接头分子修饰的二价抗体的比例大于未被所述抗体修饰接头修饰的未修饰的抗体和相对于一个抗体分子被一个抗体修饰接头分子修饰的单价抗体的总和,和在所述缀合步骤中形成所述螯合剂和所述二价抗体的缀合物。
[0202]
[40]上述[37]至[39]中的任一条的生产方法,其中所述螯合剂连接至所述螯合接头,且所述螯合接头和所述抗体修饰接头通过在所述缀合步骤中执行点击反应而连接。
[0203]
[41]用于生产与放射性核素螯合的螯合剂和抗体的缀合物的试剂盒,其包括(1)能够螯合放射性核素的螯合剂和(2)抗-muc5ac抗体,其中所述缀合物是上述[1]至[12]和
[18]至[27]中的任一条的缀合物。
[0204]
[42] [41]的试剂盒,其进一步包括(1)能够进行点击反应的第一原子团和(2)能够进行点击反应的第二原子团。
[0205]
[43] [41]的试剂盒,其进一步包括能够与所述螯合剂螯合的放射性核素。
[0206]
根据上述[14]的放射性药物, 由于含有特异性地结合muc5ac的人源化抗体和发射α粒子的金属核素的缀合物作为活性成分被包含,所以当用于癌症的ri内部疗法时,它在表达muc5ac的肿瘤中特异性积聚,并可以在不影响正常细胞的情况下在肿瘤细胞上特异性地照射α粒子,从而获得更高的安全性和更高的治疗效果。
[0207]
根据上述[28]的放射性药物,由于它包含含有特异性地结合muc5ac的人源化抗体和发射正电子的金属核素的缀合物作为活性成分,所以它适合于pet检查。另外,由于它表现出与上述[14]的用于ri内部疗法的放射性药物相同的积聚性质,所以它可以有效地用作表达muc5ac的癌症的ri内部疗法的诊断放射性药物。
[0208]
根据上述[29]的用于生产缀合物的上述方法,由于它包括将与放射性核素螯合的螯合剂和抗-muc5ac抗体缀合的缀合物形成步骤,所以通过在不使抗-muc5ac抗体经历螯合步骤(这是对于抗体的更严格条件)的情况下防止抗体变性,可以有效地获得缀合物。
[0209]
根据上述[30]的用于生产缀合物的方法,由于在缀合物形成步骤中包括点击反应,所以可以在极温和的室温条件下在缓冲溶液中形成缀合物,并且可以在不使抗-muc5ac抗体变性的情况下有效地获得缀合物。
[0210]
根据上述[31]的修饰的抗体,由于抗-muc5ac抗体的fc区被抗体修饰接头特异性地修饰,所以修饰的抗体可以在不损害抗-muc5ac抗体的抗原结合能力的情况下用于相对于与放射性核素螯合的螯合剂的点击反应。
[0211]
根据上述[32]所述的用于生产修饰的抗体的方法,由于它包括用提供了抗体修饰肽的接头位点特异性地修饰抗-muc5ac抗体的fc区以获得修饰的抗体的抗体修饰步骤以及通过使用在其上面固定了免疫球蛋白结合蛋白的载体纯化前述抗体的抗体纯化步骤,所以可以进一步提高修饰的抗体的纯度。
[0212]
根据上述[38]或[39]的用于生产缀合物的方法,由于使用抗体缀合物执行缀合物形成步骤,其中所述单价抗体或所述二价抗体的比例高于另一种的比例,所以结合抗-muc5ac抗体的螯合剂的数目可以根据目的进行调整,并且可以以更高纯度获得具有期望的价的缀合物。
[0213]
根据上述[41]的试剂盒,由于[1]至[12]和[18]至[27]中的任一条的缀合物可以在使用时通过使能够螯合放射性核素的螯合剂和抗体与所述放射性核素在要求的时间发生反应来制备,所以在不损害放射性核素的半衰期和抗体活性的情况下的有效的治疗或诊断是可能的。
[0214]
根据上述[42]的试剂盒,由于分别提供了含有能够螯合放射性核素的螯合剂和用于点击反应的原子团的缀合物以及含有抗体和用于点击反应的原子团的缀合物,所以[1]至[12]和[18]至[27]中的任一条的缀合物可以在使用时通过在要求的时间用螯合剂螯合放射性核素及其点击反应来制备,并且在不损害放射性核素的半衰期和抗体活性的情况下的有效的治疗或诊断是可能的。
[0215]
在下面通过参考实施例等详细解释本发明。本发明不限于此。
[0216]
[实施例]生产实施例1:抗-muc5ac人源化抗体的生产在考虑适合在cho细胞中表达的密码子选择的同时,将向其添加信号序列的各个可变区的氨基酸序列和各个恒定区的氨基酸序列转化成碱基序列。将kozak序列添加到信号序列的起始密码子位点,并将终止密码子添加到恒定区的c-末端侧。此外,将限制酶位点添加到kozak序列的上游和终止密码子的下游,以便可以将它们引入哺乳动物细胞表达质粒(pcdna3.4)的表达基因转移位点。通过化学合成来制备以这种方式设计的每种dna片段。通过融合pcr连接含有可变区(要成为期望的h链和期望的l链)的dna片段以及含有恒定区的dna片段。
[0217]
使制备的各种抗体基因经历限制酶处理,并然后纯化。类似地,将哺乳动物细胞瞬时表达质粒(pcdna3.4)也用相同的限制酶处理,并然后纯化。将两种片段以适当的混合比例混合并连接。将连接反应溶液与大肠杆菌dh5α感受态细胞混合以进行转化。使所得转化体经历菌落pcr、单菌落分离、从小规模培养基中的质粒提取,以及对插入部分进行核苷酸测序。选择质粒(大肠杆菌克隆),其中全长设计的抗体基因以预期方向以设计的序列(大肠杆菌克隆)正确地插入。使所选大肠杆菌克隆经历大规模培养,并进行质粒提取和纯化,包括内毒素除去步骤。通过测量在260 nm处的吸光度,计算纯化的质粒的浓度。
[0218]
使用expicho系统(thermo fisher scientific)进行通过cho细胞的瞬时表达。从每个制备的h链表达质粒和每个制备的l链表达质粒中,选择一个h链和一个l链以实现期望的组合,通过脂转染方法转染,培养并补料。在从转染起7天-13天后,回收培养基。将离心和过滤后的培养物上清液加入a蛋白柱,并通过一般亲和柱层析(在吸附后洗涤、用酸性缓冲液洗脱、中和洗脱物)纯化抗体。通过测量在280 nm处的吸光度,计算纯化的抗体的浓度。
[0219]
使用上述方法制备以下抗-muc5ac人源化抗体。分配给重链可变区和轻链可变区的组合的抗体编号如下所示。
[0220]
抗体1: h01l03抗体2: h01l04抗体3: h02l04抗体4: h04l04如本文中所使用的,h01、h02和h04分别为seq id no: 1、seq id no: 2和seq id no: 4中所示的重链可变区,l03和l04分别为seq id no: 7和seq id no: 8中所示的轻链可变区。在以下实施例中使用的抗体是重链恒定区1 (seq id no: 25)和轻链恒定区1 (seq id no: 26),以及上述抗体1至抗体4的重链可变区和轻链可变区的组合。
[0221]
生产实施例2:通过肽接头进行的位点特异性抗体修饰(1)抗体修饰步骤通过在wo 2017/217347中所述的方法生产抗体修饰肽,以获得由下式(p3)表示的含有17个氨基酸残基的肽。所述肽的氨基酸序列与其中seq id no: 10的xaa2为赖氨酸残基的序列相同,且赖氨酸残基的侧链末端氨基被r1所示的结构修饰。此外,两个半胱氨酸残基彼此形成二硫键,并且通过具有二甘醇酸和八个pegs的接头结构向肽的n-末端添加乙基叠氮化物作为含有叠氮化物基团的原子团,其为第二原子团。
[0222]
其中在式(p3)中,gly是甘氨酸,pro是脯氨酸,asp是天冬氨酸,cys是半胱氨酸,ala是丙氨酸,tyr是酪氨酸,his是组氨酸,glu是谷氨酸,leu是亮氨酸,val是缬氨酸,trp是色氨酸,phe是苯丙氨酸。
[0223]
在乙酸钠缓冲液(ph 6.0)中的所述肽和在生产实施例1中生产的抗-muc5ac人源化抗体(抗体1)的混合物于室温反应30分钟以产生含有肽修饰的抗体的溶液。所述肽修饰的抗体具有被上述肽位点特异性地修饰的抗体的fc区。
[0224] (2)肽修饰的抗体分离步骤将肽修饰的抗体用1 mol/l乙酸钠缓冲液(ph 6.0)稀释,添加至a蛋白柱(由ge healthcare制造,hitrap mabselect sure),且含有0.15 mol/l氯化钠的0.05 mol/l乙酸钠缓冲液(ph 5.7) 流过。回收被两个肽分子修饰的肽修饰的抗体(在下文中也被称作“二价抗体”),并调节浓度,从而使得回收的级分中所含的二价抗体的浓度为15 mg/ml。此后,含有0.15 mol/l氯化钠的0.05 mol/l乙酸钠缓冲液(ph 3.5)流入a蛋白柱,回收被一个肽分子修饰的肽修饰的抗体(在下文中也被称作“单价抗体”),并调节浓度,从而使得回收的级分中所含的单价抗体的浓度为15 mg/ml。
[0225]
实施例1:
225
ac-标记的抗-muc5ac人源化抗体(
225
ac-标记的单价抗体)的生产
‑ꢀ
1(1)螯合剂合成步骤在所述实施例中使用的螯合位点(由iris biotech gmbh制造)的结构显示在下式(l1-3)中。将螯合位点溶解在作为溶剂的0.1 mol/l乙酸钠缓冲液(ph 6.0)中以产生含有1.7 mmol/l螯合位点的溶液。使所述溶液(0.005 ml)和作为放射性金属来源的含有
225
ac离子的溶液(0.2 mol/l盐酸水溶液, 放射性浓度300 mbq/ml,从oak ridge national laboratory生产的产品制备, 液体量: 0.005 ml) 1.5 mbq (通过从在试验日期和时间的放射性量的衰减计算)的反应混合物在加热条件下反应以产生
225
ac复合物溶液。螯合位点和放射性金属离子的摩尔比为螯合位点:
225
ac离子= 约2000:1,且将反应混合物的加热温度定到70℃,且将加热时间定到90分钟。
[0226]
通过以下方法测量所获得的
225
ac复合物的放射化学纯度。也就是说,通过薄层层
析(由agilent制造,型号:sgi0001,展开剂:乙腈/水混合溶液(体积比1:1))使
225
ac复合物溶液的一部分展开,并然后通过放射γ-tlc分析仪(由raytest制造,modelgitastar)进行测量。在起点附近检测到的峰的放射性(计数)相对于检测到的总放射性(计数)的百分比被定义为
225
ac复合物的放射化学纯度(%)。结果,
225
ac复合物的放射化学纯度为86%。获得的
225
ac复合物溶液直接用于紧接的标记步骤。
[0227]
(2)标记步骤将在生产实施例2中获得的单价抗体的洗脱物和在前述步骤(1)中获得的
225
ac复合物的溶液各自加入含有0.02mol/l(20mm)抗坏血酸的0.09mol/l乙酸钠缓冲液中,并于37℃进行点击反应120分钟以产生
225
ac-标记的单价抗体。
225
ac复合物的量和肽修饰的抗体的量分别为44μmol和46μmol,且第一原子团(dbco)和第二原子团(叠氮化物)的摩尔比为约1:1。
[0228]
此外,将通过于37℃反应2小时获得的
225
ac-标记的单价抗体的溶液使用超滤过滤器(由merck制造,型号:ufc505096)纯化,并经历后来的实验。在纯化后
225
ac-标记的单价抗体的放射化学纯度(通过从在试验日期和时间的放射性量的衰减计算的放射性量:0.303mbq)为93%,且放射化学得率为39%。如本文中所使用的,放射化学纯度是与
225
ac-标记的单价抗体对应的峰的放射性计数与当通过薄层层析分析时的薄层平板的总放射性计数之比(%),且放射化学得率是通过γ-射线分光计(ge半导体检测器:gmx10p4-70(由ortec制造),多通道分析仪:m7-000(由seikoeg&g制造),数据处理:spectrumnavigator:ds-p300(由seikoeg&g制造)和gammastudio:ds-p600(由seikoeg&g制造))测量的从
225
ac-标记的单价抗体的放射性计数计算的放射性量与从在标记过程开始时的放射性计数计算的放射性量之比(%)。
[0229]
实施例2:
225
ac-标记的抗-muc5ac人源化抗体(
225
ac-标记的单价抗体)的生产-2(1)螯合剂合成步骤在所述实施例中使用的螯合位点的结构显示在下式(l1-4)中。根据在wangh,wangr,caik,heh,liuy,yenj等人.selectiveinvivometaboliccell-labeling-mediatedcancertargeting.natchembiol.apr;13(4):415-424.(2017)中描述的方法,生产由式(l1-4)所示的dota-bn-dbco。将螯合位点溶解在作为溶剂的0.1mol/l乙酸钠缓冲液(ph6.0)中以产生含有1.7mmol/l螯合位点的溶液。使所述溶液(0.0025ml)和作为放射性金属来源的含有
225
ac离子的溶液(0.2mol/l盐酸水溶液,放射性浓度432mbq/ml,由oakridgenationallaboratory制造,液体量:0.0025ml)1.08mbq(通过从在试验日期和时间的放射性量的衰减计算)和0.1mol/l乙酸钠缓冲液(ph6.0,0.0375ml)的反应混合物在加热条件下反应以产生
225
ac复合物溶液。螯合位点和放射性金属离子的摩尔比为螯合位点:
225
ac离子=约2000:1,且将反应混合物的加热温度定到70℃,且将加热时间定到90分钟。
[0230]
通过以下方法测量所获得的
225
ac复合物的放射化学纯度。也就是说,通过薄层层析(由agilent制造,型号:sgi0001,展开剂:乙腈/水混合溶液(体积比1:1))使
225
ac复合物溶液的一部分展开,并然后通过放射γ-tlc分析仪(由raytest制造,modelgitastar)进行测量。在起点附近检测到的峰的放射性(计数)相对于检测到的总放射性(计数)的百分比被定义为
225
ac复合物的放射化学纯度(%)。结果,
225
ac复合物的放射化学纯度为98%。获得的
225
ac复合物溶液直接用于紧接的标记步骤。
[0231]
(2)放射性标记步骤将在生产实施例2中获得的单价抗体的洗脱物和在前述步骤(1)中获得的
225
ac复合物的溶液各自于37℃进行点击反应120分钟以产生
225
ac-标记的单价抗体。
225
ac复合物的量和肽修饰的抗体的量分别为44μmol和46μmol,且第一原子团(dbco)和第二原子团(叠氮化物)的摩尔比为约1:1。
[0232]
此外,向通过于37℃反应120分钟获得的
225
ac-标记的单价抗体的溶液中加入含有20mmol/l抗坏血酸的90mmol/l乙酸钠缓冲液(ph6.0),并将混合物使用超滤过滤器(由merck制造,型号:ufc505096)纯化,并经历后来的实验。在纯化后
225
ac-标记的单价抗体的放射化学纯度(通过从在试验日期和时间的放射性量的衰减计算的放射性量:0.231mbq)为86%,且放射化学得率为21%。如本文中所使用的,放射化学纯度是与
225
ac-标记的单价抗体对应的峰的放射性计数与当通过薄层层析分析时的薄层平板的总放射性计数之比(%),且放射化学得率是通过γ-射线分光计(ge半导体检测器:gmx10p4-70(由ortec制造),多通道分析仪:m7-000(由seikoeg&g制造),数据处理:spectrumnavigator:ds-p300(由seikoeg&g制造)和gammastudio:ds-p600(由seikoeg&g制造))测量的从
225
ac-标记的抗体的放射性计数计算的放射性量与从在前述步骤(1)开始时的放射性计数计算的放射性量之比(%)。
[0233]
实施例3:
225
ac-标记的抗-muc5ac人源化抗体(
225
ac-标记的二价抗体)的生产除了使用在生产实施例2中获得的二价抗体的洗脱物而不是单价抗体的洗脱物外,以与实施例2中相同的方式,获得
225
ac-标记的二价抗体。获得的
225
ac-标记的二价抗体的放射化学纯度(通过从在试验日期和时间的放射性量的衰减计算的放射性量:0.168mbq)为99%,且放射化学得率为20%。
[0234]
实施例4:使用in-111(
111
in)-标记的抗体筛选人源化抗体实施例4-1:
111
in-标记的抗体的制备为了找到具有高肿瘤积聚能力和高最大耐受剂量的抗-muc5ac抗体,将各种抗体用
111
in标记,施用给荷瘤小鼠,并进行spect-ct成像。使用得到的图像计算和比较累积放射
性量和吸收的剂量。
[0235]
所用抗体为在生产实施例1中制备的4种类型的抗-muc5ac人源化抗体和在专利文献1中公开的1种类型的抗-muc5ac嵌合抗体,并将它们用
111
in标记。
[0236]
在专利文献1中公开的嵌合抗体的重链可变区和轻链可变区的氨基酸序列(分别为seq id no: 23和24)如下所示。
[0237]
在具有由下式表示的结构的标记前体和各种抗体的复合物上进行
111
in标记。
[0238]
[重链可变区][轻链可变区][轻链可变区]上述标记的前体具有这样的结构,其中作为螯合位点的dota通过8个聚乙二醇连接至抗体修饰肽(含有17个氨基酸残基的肽,其具有与其中xaa2是赖氨酸残基的seq id no: 10的序列相同的序列)的n-末端,并通过结构中的n-羟基琥珀酰亚胺酯基团连接至在各种抗体中通过eu编号的第252个赖氨酸残基。
[0239]
将所述标记的前体(450 μg)以100 mmol/l溶解在作为溶剂的4-(2-羟乙基)-1-哌嗪乙磺酸缓冲液(ph 5.5)中。将所述溶液与在作为放射性量的10 mbq的作为放射性金属来源的含有
111
in离子的溶液(氯化铟(
111
in)注射液,由nihon medi-physics co., ltd.制造)混合,并于45℃进行标记反应120分钟。
[0240]
在表1中显示了各种
111
in-标记的抗体的放射化学得率、放射化学纯度和施用给动物的放射性量。这里的放射化学得率指,相对于使用的
111
in的放射性量,
111
in-标记的抗体的放射性量。关于放射性测量,使用放射性同位素剂量校准器(doze calibrator)(由capintec制造,型号: crc-15r)。放射化学纯度指与
111
in-标记的抗体对应的峰放射性计数
与如通过滤纸层析分析的滤纸的总放射性计数之比(%)。对于滤纸层析,滤器: 由advantec制造,型号: no. 590, 展开剂: 0.01%edta, 50 mm柠檬酸-柠檬酸钠水溶液)被展开,并使用放射γ-tlc分析仪(由raytest制造,model gita star)检测放射性计数。
[0241]
表1
111
in标记信息(平均值
±
标准差, n=4)实施例4-2:使用荷瘤小鼠的生物分布(荷瘤小鼠的生产方法)将人胰腺癌细胞系sw1990 (0.7
×
107个细胞)从胁腹至其背部皮下地施用给balb/c裸鼠(雄性)。
[0242]
当在sw1990移植后14天肿瘤大小达到约150-300 mm3时,从小鼠的尾静脉施用在实施例4-1中制备的各种
111
in-标记的抗体。从下述计算公式计算肿瘤体积。
[0243]
肿瘤体积=(肿瘤短轴2×
肿瘤长轴)/2表2动物信息(关于每种
111
in-标记的抗体的施用)(平均值
±
标准差, n=4)(评价方法)在下表中的条件下进行spect-ct成像(小动物spect-ct装置: fx-3000,由trifoil制造)。成像时间点为施用后1、6、24、48、72和168小时。对于spect通过osem方法进行图像重建,且对于ct通过fbp方法。进行在每个时间点对肿瘤和肝的voi (感兴趣体积、三维roi)分析。将每器官体积的计数数目校正为%id/g,将物理半衰期从
111
in转化成
225
ac,校正物理半衰期中的差异,并获得添加了生物半衰期的时间活性曲线。从所述时间活性曲线的积分值计算累积放射性量,并在球形模型(olinda/exm ver2.0)中计算吸收的剂量,并针对每种抗体对此进行比较和检查。然而,对于h01l03,在施用后168小时未观察到时间活性曲线的下降。因此,没有考虑生物半衰期,且仅添加了物理半衰期。
[0244]
表3spect成像条件同位素铟-111中+高能量准直仪mmp952
corporation制造)中暴露约15小时,并使用荧光图像(fluoroimage)分析仪(typhoon fla 7000 ip,由ge healthcare制造)得到放射自显影图。使用荧光图像分析仪附带的分析软件“image quant tl”,将获得的放射自显影图用于设置整个切片上的roi,并计算roi中的放射性密度(bq/mm2)。
[0251]
证实了所有
111
in-标记的人源化抗体保留了对muc5ac的结合性质和特异性(图5,muc5ac高表达肿瘤的数据)。证实了与嵌合抗体相比,各种人源化抗体具有更少的非特异性结合(图5,muc5ac低表达、未表达的肿瘤的数据)。
[0252]
从实施例4-2和4-3的结果看,人源化抗体具有比嵌合抗体更高的对muc5ac的特异性,并且具有在肿瘤中的高积聚和在正常器官如肝等中的低积聚。澄清了它提供了与ri-标记的抗体相关的更优越的递送技术。
[0253]
下表中总结了所述实施例的结果。在表中,在spect的吸收的剂量中假定150 mm3计算肿瘤体积。基于在所述实施例中使用的小鼠肝的重量的平均值(1.15
±
0.14 g, n=19),计算肝的吸收的剂量。用n=4 (然而,对于h02l04,n=3)的平均值
±
标准差表示生物分布的数值。
[0254]
表5实施例5:使用荷瘤小鼠评价
225
ac-标记的单价抗体使用根据实施例1生产的
225
ac-标记的单价抗体(h01l03)。根据施用的
225
ac-标记的单价抗体的放射性量,将荷瘤小鼠分为3组:2.5 kbq施用组、5 kbq施用组和10 kbq施用组,并与施用在生产实施例1中生产的人源化抗体(h01l03)的组(抗体对照组)进行比较。每组含有6只小鼠,并在施用后进行总体情况的观察以及体重和肿瘤体积的测量达4周。通过与实施例4-2中相同的程序制备用于评价的荷瘤小鼠,并在sw1990移植后10天肿瘤大小达到约200 mm3时经历实验。各组的动物信息总结如下。
[0255]
表6动物信息(关于每种
225
ac-标记的单价抗体的施用)
平均值
±
标准差, n=6肿瘤体积随着时间的过去的变化示于图6中,且当施用前肿瘤体积为1.0时,在观察时间段的最后一天肿瘤体积的相对比率示于下表中。
225
ac-标记的单价抗体显示出剂量依赖性的肿瘤生长抑制作用,并且在所有剂量均统计上显著地抑制肿瘤生长。
[0256]
表7在观察时间段的最后一天的肿瘤体积与施用前肿瘤体积的相对比率在观察时间段的最后一天进行解剖,且收集肿瘤并称重。肿瘤重量的比较结果示于下表中。发现
225
ac-标记的单价抗体的肿瘤重量为剂量依赖性的方式的低的,且与抗体对照组相比,在所有向其施用
225
ac-标记的单价抗体的组中,肿瘤重量统计上显著地更低。
[0257]
表8肿瘤重量的比较平均值
±
标准差,n=6显著性水平:*p《0.005对抗体对照组体重随着时间的过去的变化的相对值示于图7中。与施用前体重相比,在任何组中均未观察到10%或更多的体重减轻。因此,表明施用
225
ac-标记的单价抗体对总体情况可能没有影响或影响足够低。
[0258]
在观察时间段的最后一天进行解剖,且收集肝、肾和脾并称重。下表中显示了每个器官的重量的比较结果。证实了施用2.5 kbq的
225
ac-标记的单价抗体的组中的肝重量在统计上显著低于抗体对照组;然而,由于没有观察到剂量依赖性,所以这被认为是意外的结果。与抗体对照组相比,在肾或脾中或在其它剂量的肝中未观察到统计上显著的差异,这表明对肝、肾和脾没有影响或影响足够低的可能性。
[0259]
[表9]正常器官重量的比较
平均值
±
标准差,n=6显著性水平:*p《0.05对抗体对照组使用在观察时间段结束时采集的血液样品,第二次评价了肾毒性(使用肌酸酐测定试剂盒(由cayman chemical company制造)测量血浆中的肌酸酐)、肝毒性(使用alt活性试剂盒(由bio vision制造)测量血浆中的谷丙转氨酶(alt))和血液毒性(使用自动血细胞测量设备(型号:thinka cb-1010,由arkray, inc.制造)测量白细胞计数和血小板计数)。对于每个测量值,使用stat preclinica (由takumi information technology co., ltd.制造)确认测量值的同方差性。当发现同方差性时,进行通过dunnett参数检验法的分析,且当同方差性不存在时,进行通过steel非参数检验法的分析。
[0260]
肝毒性和肾毒性的结果示于图8中。在利用
225
ac-标记的单价抗体的所有施用组中,相对于抗体对照组,在5%的显著性水平未观察到统计上显著的差异。血液毒性的结果示于图9中。在血液采样的每个时间点,在
225
ac-标记的单价抗体的每个剂量组中,相对于抗体对照组,在5%的显著性水平未观察到统计上显著的差异。
[0261]
在所述实施例中,确认了
225
ac-标记的单价抗体的肿瘤生长抑制作用。所述抑制作用是剂量依赖性的,并在所有剂量(2.5、5、10 kbq)在5%的显著性水平显示出统计上显著的抑制作用。此外,与施用
225
ac-标记的单价抗体之前的体重相比,未观察到10%或更多的体重减轻,并且提示由
225
ac-标记的单价抗体引起的低肝毒性、低肾毒性和低血液毒性的可能性。从这些结果阐明了
225
ac-标记的单价抗体具有非常高的抗肿瘤作用,是非常安全的,并且是非常有用的癌症治疗剂。
[0262]
实施例6:使用荷瘤小鼠评价高剂量的
225
ac-标记的单价抗体除了将施用的放射性量定到25 kbq/小鼠(实施例5的最低剂量的10倍)以外,以与实施例5相同的方式,评价了
225
ac-标记的单价抗体(
225
ac-标记的单价抗体施用组)。此外,形成施用溶解在含有20 mm抗坏血酸的0.1 m乙酸盐缓冲液中的仅仅在生产实施例1中生产的抗体(h01l03)的溶液的组(抗体对照组)。以与实施例5相同的方式生产在所述实施例中使用的抗体。以与实施例4-2相同的方式制备用于评价的荷瘤小鼠。每组含有5只小鼠,并在施用后进行总体情况的观察、体重和肿瘤体积的测量达4周。每组的动物信息总结如下。
[0263]
表10 抗体对照组
225
ac-标记的单价抗体组施用的放射性量(kbq)-25肿瘤体积(mm3)215
±
54249
±
67体重(g)20.2
±
1.220.8
±
1.3平均值
±
标准差, n=5肿瘤体积随着时间的过去的变化的结果示于图10中。在
225
ac-标记的单价抗体施用组中,抑制了统计上显著的肿瘤生长,并证实了通过施用高剂量的
225
ac-标记的单价抗体
的肿瘤生长抑制作用。
[0264]
在观察时间段的最后一天进行解剖,且收集肿瘤并称重。肿瘤重量的比较结果示于下表中。发现了与抗体对照组相比,在
225
ac-标记的单价抗体组中肿瘤重量统计上显著地低。
[0265] 表11肿瘤重量的比较 抗体对照组
225
ac-标记的单价抗体施用组施用的放射性量(kbq)-25肿瘤重量(g)2.48
±
0.450.56
±
0.20*平均值
±
标准差,n=5显著性水平:*p《0.05对抗体对照组体重随着时间的过去的变化的结果示于图11中。在
225
ac-标记的单价抗体施用组中,在施用早期发现了体重下降;然而,相对比率不低于0.9。
[0266]
在观察时间段的最后一天进行解剖,且收集肝、肾和脾并称重。肿瘤的比较结果示于下表中。发现了与抗体对照组相比,在
225
ac-标记的单价抗体施用组中,仅脾重量统计上显著地低。
[0267]
表12正常器官重量的比较 抗体对照组
225
ac-标记的单价抗体施用组施用的放射性量(kbq)-25肝(g)0.99
±
0.121.08
±
0.03肾(g)0.31
±
0.030.31
±
0.02脾(g)0.07
±
0.030.04
±
0.01*平均值
±
标准差,n=5显著性水平:*p《0.05对抗体对照组肝毒性和肾毒性的结果示于图12中。由于相对于抗体对照组未观察到统计上显著的差异,所以提示所述剂量不诱发肝病或肾病。血液毒性的结果示于图13中。由于相对于抗体对照组未观察到统计上显著的差异,所以提示所述剂量不诱发血液毒性。
[0268]
根据这些结果,还提示
225
ac-标记的单价抗体具有非常高的抗肿瘤作用,是非常安全的,并且是非常有用的癌症治疗剂。
[0269]
作为将小鼠剂量转化成人剂量的方法,可以提及使用下式的方法。
[0270]
按mg/kg的动物剂量x (按kg的动物重量/按kg的人重量) x 0.33根据所述式,在所述实施例中向小鼠的25 kbq/20 g施用对应于以89.0 kbq/kg (人)施用。
[0271]
实施例7:使用荷瘤小鼠评价
225
ac-标记的单价抗体和
225
ac-标记的二价抗体使用荷瘤小鼠,评价了
225
ac-标记的单价抗体和
225
ac-标记的二价抗体的每种抗体的性质。将根据实施例2生产的
225
ac-标记的单价抗体以5 kbq/小鼠或10 kbq/小鼠的施用的放射性量施用给以与实施例4-2相同的方式生产的荷瘤小鼠(
225
ac-标记的单价抗体施用组)。将根据实施例3生产的
225
ac-标记的二价抗体以5 kbq/小鼠或10 kbq/小鼠的施用的放射性量施用给以与实施例4-2相同的方式生产的荷瘤小鼠(
225
ac-标记的二价抗体施用组)。与实施例5和6类似,形成抗体对照组。每组含有6只小鼠,并在施用后进行总体情况的观察
以及体重和肿瘤体积的测量达4周。各组的动物信息总结如下。
[0272]
表13平均值
±
标准差,n=6肿瘤体积随着时间的过去的变化的结果示于图14中。下表中显示了在观察时间段最后一天的肿瘤体积,和当施用前肿瘤体积为1.0时的相对比率。在
225
ac-标记的单价抗体施用组中,抑制了统计上显著的肿瘤生长,并且证实了剂量依赖性的肿瘤生长抑制作用。在
225
ac-标记的二价抗体施用组中,肿瘤生长倾向于受到抑制。
[0273]
表14在观察时间段的最后一天的肿瘤体积与施用前肿瘤体积的相对比率平均值
±
标准差,n=6显著性水平:*p《0.05对抗体对照组在观察时间段的最后一天在异氟烷麻醉下通过放血对小鼠实施安死术,且收集肿瘤并称重。肿瘤重量的比较结果示于下表中。发现了与抗体对照组相比,
225
ac-标记的单价抗体施用组中的肿瘤重量统计上显著地低,并且证实了剂量依赖性的肿瘤生长抑制作用。在
225
ac-标记的二价抗体施用组中,与抗体对照组相比肿瘤重量低,但未发现统计上显著的差异。
[0274]
表15肿瘤重量的比较平均值
±
标准差,n=6显著性水平:*p《0.05对抗体对照组体重随着时间的过去的变化的结果示于图15中。相对比率的平均值不低于0.9。此外,每个个体的相对比率不低于0.8。
[0275]
在观察时间段的最后一天,在异氟烷麻醉下,通过放血对小鼠实施安死术,并进行
解剖。作为解剖的结果,不存在异常发现。此外,收集肝、肾和脾并称重。下表中显示了正常器官的重量的比较结果。与抗体对照组相比,在任一个
225
ac-标记的抗体施用组中没有观察到统计上显著的器官重量下降。
[0276]
表16正常器官重量的比较平均值
±
标准差,n=6图16中显示了
225
ac-标记的单价抗体和
225
ac-标记的二价抗体的肝毒性结果。肾毒性的结果示于图17中。由于相对于抗体对照组未观察到所述值的统计上显著增加,所以提示所述剂量不诱发肝毒性或肾毒性。关于血液毒性,在施用后1周和施用后4周的白细胞计数结果示于图18中。同样,在施用后1周和施用后4周的血小板计数结果示于图19中。关于白细胞计数,与抗体对照组相比,在单价抗体施用组(5 kbq和10 kbq)和二价抗体施用组(10 kbq)中在施用后1周观察到统计上显著的差异,但在施用后4周计数恢复。在二价抗体施用组(5 kbq)中,其在施用后4周表现出与抗体对照组的统计上显著的差异,所述差异不是剂量依赖性的。除了一个个体外,在任何时间点,血小板计数均不下降到低于500x109个细胞/l(正常范围的下限)。根据这些,提示所述剂量不诱发血液毒性。
[0277]
实施例8: 使用in-111(
111
in)-标记的单价抗体和
111
in-标记的二价抗体的药物代谢动力学的比较实施例8-1:每种
111
in-标记的抗体的制备为了比较单价抗体和二价抗体的药物代谢动力学,将单价抗体和二价抗体用
111
in标记,施用给荷瘤小鼠,在施用后20、68和188小时进行生物分布实验,并比较单价抗体和二价抗体的药物代谢动力学。
[0278]
(1)引入螯合剂的每种抗体的生产以与生产实施例1和生产实施例2中相同的方式生产抗体,并获得人源化抗体h01l03的肽修饰的抗体的单价抗体和二价抗体。
[0279]
使含有34 nmol的螯合位点(结构式: l1-4)的0.1 mol/l乙酸钠缓冲液(ph 6.0)和含有34 nmol的单价抗体或二价抗体的、含有0.1 mol/l精氨酸的0.1 mol/l组氨酸缓冲液(ph 6.0)于37℃反应120分钟以产生引入螯合剂的抗体。
[0280]
将其流过脱盐柱(型号: pd-10,由ge healthcare制造),并回收含有引入螯合剂的抗体的级分。使用超滤过滤器(由merck制造,型号:ufc505096)进一步纯化回收的级分。纯化的单价抗体的浓度为7.13 mg/ml,且二价抗体的浓度为5.07 mg/ml。
[0281]
(2)用
111
in放射性标记每种抗体于作为放射性量的91
ꢀ‑ꢀ
92 mbq使用作为放射性金属来源的含
111
in离子的溶液(氯化铟(
111
in)注射液,由nihon medi-physics co., ltd.制造),添加每种引入螯合剂的
抗体(0.05 ml),并将其充分混合。通过使用ph试纸(由merck制造)确认ph为4。将其于45℃反应120分钟。
[0282]
使用超滤过滤器(由merck制造,型号:ufc505096)纯化反应混合物,并用含有20 mmol/l抗坏血酸的90 mmol/l乙酸钠缓冲液进一步替代溶剂。
[0283]
每种
111
in-标记的抗体的放射化学得率对于单价抗体为55%且对于二价抗体为59%。放射化学纯度对于单价抗体为97%且对于二价抗体为98%。施用给动物的放射性量显示在表17中。放射化学得率是
111
in-标记的单价/二价抗体的放射性计数与从在步骤(1)开始时的放射性计数计算的放射性量之比(%)。对于放射性测量,使用了放射性同位素剂量校准器(doze calibrator)(由capintec制造,型号: crc-15r)。放射化学纯度指与
111
in-标记的抗体对应的峰放射性计数与通过过滤器薄层层析分析的薄层平板的总放射性计数之比(%)。对于薄层层析,(薄层平板: 由agilent制造,型号: sgi0001, 展开剂: 100 mmol/l edta溶液(ph 5.0)/乙腈混合溶液(体积比1:1)被展开,并使用放射γ-tlc分析仪(由raytest制造,model gita star)检测放射性计数。
[0284]
表17
111
in标记信息实施例8-2:使用荷瘤小鼠的生物分布将人胰腺癌细胞系sw1990 (0.5
×
107个细胞)从胁腹至其背部皮下地施用给balb/c裸鼠(雄性)。当肿瘤体积达到约300 mm3时,从尾静脉施用在实施例8-1中制备的
111
in-标记的单价抗体和二价抗体。
[0285]
(评价方法)在施用每种
111
in-标记的抗体后,将荷瘤小鼠饲养在代谢笼中,并收集一直到每个时间点(施用后20、68、188小时)排泄的粪便和尿。在每个时间点通过在异氟烷麻醉下放血对荷瘤小鼠实施安死术。收集肿瘤、血液和正常器官(包括身体的剩余部分)并称重。除了称重的器官外,还测量了排泄的粪便和排泄的尿中的放射性量(γ-射线孔闪烁测量装置: jdc-1712,由hitachi aloka medical, ltd.制造)。从每个器官(包括排泄的粪便和排泄的尿)的放射性量(计数)计算相对于剂量的放射性积聚率(%id),并将积聚的放射性量(%id/g)计算为放射性积聚率/器官重量。
[0286]
(结果)显示在每个器官中积聚的放射性量随着时间的过去的变化的结果示于图20中。显示排泄的粪便和排泄的尿的放射性积聚率以及总放射性积聚率随着时间的过去的变化的结果示于图21中。
[0287]
在任何时间点,对于单价抗体而言在血液中积聚的放射性量都高于对于二价抗体而言。据此证实,单价抗体具有比二价抗体更高的血液保留性质。在任何时间点,对于单价抗体而言在肿瘤中积聚的放射性量都高于对于二价抗体而言。证实对于单价抗体而言,在正常器官中的放射性积聚的趋势以脾、肝、肺和肾的顺序较高。证实了二价抗体表现出以肝和脾的顺序显著更高的值,和以睾丸、心、肾和股骨的顺序较高。证实了每种正常器官中的放射性积聚随着时间的过去下降。在任何时间点,二价抗体的排泄量都高于对于单价抗体而言,并且证实二价抗体的清除率更快。对于单价抗体,粪便和尿排泄量是相似的。另一方面,证实了二价抗体的尿排泄高于粪便排泄,且它主要在肾尿道系统中排泄。
[0288]
实施例9:使用
225
ac-标记dotaga-dbco生产
225
ac-标记的抗-muc5ac人源化抗体(1. 螯合剂合成步骤)在所述实施例中使用的螯合位点(dotaga-dbco)的结构由下式(l1-5)表示。根据bernhard等人dotaga-anhydride: a valuable building block for the preparation of dota-like chelating agents chem. eur. j. 2012, 18, 7834-7841描述的方法,生产由式(l1-5)表示的dotaga-dbco。将螯合位点分散在作为溶剂的0.1 mol/l乙酸钠缓冲液(ph 6.0)中以产生含有1.7 mmol/l螯合位点的分散体。使所述分散体(0.004 ml)和作为放射性金属来源的含有
225
ac离子的溶液(0.2 mol/l盐酸水溶液, 放射性浓度1225 mbq/ml,从oak ridge national laboratory生产的产品制备, 液体量: 0.004 ml) 4.9 mbq (通过从在试验日期和时间的放射性的衰减计算)和0.1 mol/l乙酸钠缓冲液(ph 6.0, 0.06 ml)的反应混合物在加热条件下反应以产生
225
ac复合物溶液。螯合位点和放射性金属离子的摩尔比为螯合位点:
225
ac离子= 约670:1,且将反应混合物的加热温度定到70℃,且将加热时间定到30分钟。
[0289]
以与实施例1中相同的方式测量所获得的
225
ac复合物的放射化学纯度。结果,
225
ac复合物的放射化学纯度为85%。获得的
225
ac复合物溶液直接用于紧接的标记步骤。
[0290]
(2. 放射性标记步骤)将在前述(1. 螯合剂合成步骤)中获得的
225
ac复合物的溶液和含有以除了在室温进行反应60分钟以外与在生产实施例2中相同的方式生产的肽修饰的抗体(单价抗体;h01l03)的溶液在未纯化的情况下混合,并于37℃点击反应2小时以产生
225
ac复合物标记的抗体。螯合位点或含有
225
ac-标记的复合物的螯合位点和肽修饰的抗体(单价抗体)的量分别为68 nmol和80 nmol,且第一原子团(dbco)和第二原子团(叠氮化物)的摩尔比为约1:1.2。
[0291]
此外,使用超滤过滤器(由merck制造,型号:ufc505096)纯化通过于37℃反应2小
时获得的
225
ac复合物标记的抗体的溶液。在纯化后
225
ac-标记的单价抗体的放射化学纯度为96%,且放射化学得率为68%。
225
ac-标记的单价抗体的放射化学纯度和放射化学得率的测量方法类似于在实施例1中的那种。
[0292]
实施例10:使用
89
zr-标记的dotaga-dbco生产(hplc纯化) 89
zr-标记的抗-muc5ac人源化抗体(1-1. 螯合剂合成步骤)在所述实施例中,使用与由上述式(l1-5)所示螯合位点相同的螯合位点。将所述螯合位点分散在dmso溶液中以产生含有2.0 mmol/l螯合位点的分散体。使所述分散体(0.150 ml)和作为放射性金属来源的含有
89
zr离子的溶液(0.1 mol/l盐酸水溶液, 放射性浓度1335 mbq/ml,从nihon medi-physics co., ltd.生产的产品制备, 液体量: 0.100 ml) 134 mbq和含有300 mmol/l龙胆酸的780 mmol/l乙酸盐缓冲液(0.050 ml)的反应混合物在加热条件下反应以产生
89
zr复合物溶液。螯合位点和放射性金属离子的摩尔比为螯合位点: 89
zr离子= 约3333:1,且将反应混合物的加热温度定到70℃,且将加热时间定到60分钟。
[0293]
通过以下方法测量所获得的
89
zr复合物的放射化学纯度。也就是说,通过薄层层析(由agilent制造,型号: sgi0001, 展开剂: 乙腈/水混合溶液(体积比1:1))使
89
zr复合物溶液的一部分展开,并然后通过放射γ-tlc分析仪(由raytest制造,model gita star ps)进行测量。在起点附近检测到的峰的放射性(计数)相对于检测到的总放射性(计数)的百分比被定义为
89
zr复合物的放射化学纯度(%)。结果,
89
zr复合物的放射化学纯度为98%。
[0294]
(1-2. 89
zr复合物纯化步骤)通过高效液相层析(hplc)收集在前述(1-1. 螯合剂合成步骤)中获得的
89
zr复合物溶液,并除去未反应的dotaga-dbco。从获得的收集的溶液蒸发溶剂至约30 μl溶液,并将溶液用在标记步骤中。在除去
89
zr复合物标记的抗体的未反应的物质的步骤中测量放射化学得率(hplc回收率)的方法如下。也就是说,在收集的溶液中的放射性百分比被定义为在未反应的物质除去步骤中的hplc回收率(%)相对于在所述步骤开始时负载的放射性量。
[0295]
hplc条件如下,并收集具有约27分钟的保留时间的级分。
[0296]
《hplc条件》检测器:紫外吸收分光光度计(测量波长: 220 nm, 254 nm)/闪烁检测器柱:xbridge c18 3.5 μm, 4.6 x 100 mm,由waters制造流速: 0.5 ml/min面积测量范围: 样品注射以后45分钟流动相a: 10 mmol/l组氨酸缓冲液(ph 6.5)流动相b: 用于液相层析的乙腈流动相c: 乙腈/水混合溶液(1:1)流动相进料:通过如下改变流动相a、流动相b和流动相c的混合比来控制浓度梯度表18
(2. 放射性标记步骤)将通过每个前述步骤中获得的
89
zr复合物的溶液和含有以与在生产实施例2中相同的方式生产的肽修饰的抗体(单价抗体;h01l03)的溶液混合,并于37℃点击反应1.5小时以产生
89
zr复合物标记的抗体。含有
89
zr-标记的复合物的螯合位点和肽修饰的抗体(单价抗体)的量分别为73 pmol和50 nmol,且第一原子团(dbco)和第二原子团(叠氮化物)的摩尔比为约1:685。
[0297]
此外,使用超滤过滤器(由merck制造,型号:ufc505096)纯化通过于37℃反应1.5小时获得的
89
zr复合物标记的抗体的溶液。在纯化后
89
zr复合物标记的抗体的放射化学纯度为95%,且放射化学得率为50%。
89
zr复合物标记的抗体的放射化学纯度和放射化学得率的测量方法如下。也就是说,通过放射γ-tlc分析仪(由raytest制造,model gita star ps)测量薄层层析(由agilent制造,型号: sgi0001, 展开剂是乙腈:0.1 mmol/l edta溶液(体积比1:1)的混合溶液),且在起点附近检测到的峰的放射性(计数)与检测到的总放射性(计数)的百分比被定义为放射化学纯度(%)。此外,在超滤净化后回收的放射性相对于在标记步骤开始时添加的总放射性的百分比被定义为放射化学得率(%)。
[0298]
实施例11:每种
89
zr-或
225
ac-标记的抗-muc5ac人源化抗体在人或小鼠血浆中的稳定性评价根据实施例10生产使用
89
zr-标记的dotaga-dbco制备的
89
zr-标记的抗-muc5ac人源化抗体。除了由前述式(l1-4)所示的螯合位点用作螯合位点以外,根据实施例10生产使用
89
zr-标记的dota-bn-dbco制备的
89
zr-标记的抗-muc5ac人源化抗体。
[0299]
根据实施例2生产使用
225
ac-标记的dota-bn-dbco制备的
225
ac-标记的抗-muc5ac人源化抗体。根据实施例9生产使用
225
ac-标记的dotaga-dbco制备的
225
ac-标记的抗-muc5ac人源化抗体。
[0300]
在所有情况下使用0.1 m乙酸钠缓冲液(ph 6.0)作为溶剂。
[0301]
将各种
89
zr-标记的抗体和
225
ac-标记的抗体与人或小鼠血浆混合,并通过乙酸纤维素膜电泳评价于37℃温育期间在每个经过的时间点的稳定性。此外,为了评价除
89
zr-标记的抗体和
225
ac-标记的抗体以外在血浆中的降解产物,通过在假定从每种螯合剂中消除
89
zr或
225
ac并切割每种接头位点的情况下将每种化合物与每种血浆分别混合来进行乙酸纤维素膜电泳。使用从每个温育时间点收集的每个血浆样品进行乙酸纤维素膜电泳,并在电泳完成后将乙酸纤维素膜暴露于成像板。通过扫描仪型图像分析仪(由ge healthcare制造,型号: typhoon-7000)读取暴露的成像板,并使用成像分析软件(由ge healthcare制
造,软件名称: imagequant)定量和评价各种
89
zr-标记的抗体和
225
ac-标记的抗体的放射化学纯度。评价样品的组成示于表19中。与每种标记的抗体对应的峰的放射性(计数)相对于检测到的总放射性(计数)的百分比被定义为放射化学纯度(%)。
[0302]
表19使用ri-标记的dota-bn-dbco制备的ri-标记的抗-muc5ac人源化抗体n=3[表20]使用ri-标记的dotaga-dbco制备的ri-标记的抗-muc5ac人源化抗体(n=3)n=3关于使用ri-标记的dota-bn-dbco制备的ri-标记的抗-muc5ac人源化抗体,在温育时间后立即取样用于稳定性评价并通过薄层层析测量的血浆样品的放射化学纯度为94%(在小鼠血浆中)和95%(在人血浆中)。最后,在温育378小时时,两者的放射化学纯度均不低于70%。显示结果的图是图22a的上部图片。
[0303]
经历所述评价的
225
ac-标记的抗体的放射化学纯度为77%,从而与在温育时间后立即取样用于稳定性评价并通过薄层层析测量的血浆样品的放射化学纯度显示出差异(小鼠: 90%, 人: 80%)。认为某种固体组分停留到原点,且获得的放射化学纯度低于实际值。最后,在温育168小时时,两者的放射化学纯度均不低于60%。显示结果的图是图22b的上部图片。
[0304]
关于使用ri-标记的dotaga-dbco制备的ri-标记的抗-muc5ac人源化抗体,经历所述评价的
89
zr-标记的抗体的放射化学纯度为94%,且所述值通常与在温育时间后立即测量用于稳定性评价的血浆样品的放射化学纯度(小鼠: 99%, 人: 99%)相同。最后,在温育336
小时时,两者的放射化学纯度均不低于85%。显示结果的图是图22a的下部图片。
[0305]
经历所述评价的
225
ac-标记的抗体的放射化学纯度为100%,且所述值通常与在温育时间后立即测量用于稳定性评价的血浆样品的放射化学纯度(小鼠: 97%, 人: 100%)相同。最后,在温育336小时时,两者的放射化学纯度均不低于80%。显示结果的图是图22b的下部图片。
[0306]
实施例12:ri-标记的抗-muc5ac人源化抗体对muc5ac的结合性质和特异性根据实施例9和实施例10生产了使用
225
ac或
89
zr-标记的dotaga-dbco制备的ri-标记的抗-muc5ac人源化抗体。根据实施例11生产了使用
89
zr-标记的dota-bn-dbco制备的ri-标记的抗-muc5ac人源化抗体。使用这些ri-标记的抗-muc5ac人源化抗体,通过体外arg评价了每种ri-标记的抗体对muc5ac的结合性质和特异性。除了将上述ri-标记的抗-muc5ac人源化抗体用作试验物质以外,根据实施例4-3进行特异性的评价。
89
zr-标记的抗体的结果图像显示在图23中,且
225
ac-标记的抗体的结果显示在图24中。当使用
89
zr-标记的抗体时,为muc5ac阳性肿瘤切片和阴性肿瘤切片的每个完整切片设置roi,并使用roi中的测量值计算对muc5ac阳性肿瘤和阴性肿瘤的结合比率。当使用
225
ac-标记的抗体时,在muc5ac阳性肿瘤切片和阴性肿瘤切片的肿瘤组织中设置多个小rois,并使用平均值计算对muc5ac阳性肿瘤和阴性肿瘤的结合比率。结果,使用
225
ac-标记的dotaga-dbco制备的ri-标记的抗-muc5ac人源化抗体表现出6.5-倍结合比率。使用
89
zr-标记的dotaga-dbco制备的ri-标记的抗-muc5ac人源化抗体表现出138-倍结合比率。使用
89
zr-标记的dota-bn-dbco制备的ri-标记的抗-muc5ac人源化抗体表现出151-倍结合比率。证实了使用
89
zr或
225
ac-标记的dotaga-dbco制备的
89
zr或
225
ac-标记的抗-muc5ac人源化抗体和使用
89
zr-标记的dota-bn-dbco制备的
89
zr-标记的抗-muc5ac人源化抗体维持对muc5ac的结合性质和特异性。
[0307]
实施例13: 使用
89
zr-标记的dota-bn-dbco和dotaga-dbco制备的
89
zr-标记的抗-muc5ac人源化抗体的pet-ct成像使用
89
zr-标记的dota-bn-dbco和dotaga-dbco和根据实施例10生产
89
zr-标记的抗体,将每种施用给荷瘤小鼠,并进行使用pet-ct成像的评价。
[0308]
将人胰腺癌衍生的细胞系sw1990 (0.7
×
107个细胞)(其为muc5ac高表达肿瘤细胞系)从胁腹至其背部皮下地施用给balb/c裸鼠(雄性)。在移植后肿瘤体积达到约150-300 mm3时,从小鼠的尾静脉施用
89
zr-标记的抗-muc5ac人源化抗体。从下述计算公式计算肿瘤体积。
[0309]
肿瘤体积=(肿瘤短轴2×
肿瘤长轴)/2施用的
89
zr-标记的抗-muc5ac人源化抗体的放射化学纯度和动物信息显示在表21中。
[0310]
表21施用的放射性量和动物信息(关于
89
zr-标记的抗体的施用)
(平均值
±
标准差, n=4)在下表中的条件下进行pet-ct成像(小动物pet-ct装置: si78,由bruker制造)。pet和ct成像的时间点为施用后12、48、84、168、252小时。对于pet通过mlem方法进行图像重建,且对于ct通过fbp方法。进行在每个时间点的肿瘤和心(血液)、肝的suv(标准化摄取值)的voi分析,并使用时间-活性曲线比较suv分布。
[0311]
表22pet成像和重建条件同位素89-zr采集时间600秒能量窗30%(357.7-664.3kev)pet图像重建mlemgpu32x320.25(迭代:12)校正散射、随机、衰变、部分容积、衰减表23ct成像条件采集模式静态扫描模式连续(7度/s)x射线源滤光片al-1.0mm像素大小50umx射线管电流771uax射线管电压65kv在
89
zr-标记的抗体施用后48小时进行pet-ct成像的结果显示在图25中。在每个时间点对肿瘤和心(血液)、肝的voi分析结果显示在图26中。此外,在每个时间点肿瘤与肝比率的结果显示在图27中。
[0312]
在肿瘤中积聚的最大值不小于2.8(作为suv),且在施用后84小时肿瘤肝比率的最大值对于使用
89
zr-标记的dota-bn-dbco制备的
89
zr-标记的抗体为3.6,且对于使用
89
zr-标记的dotaga-dbco制备的
89
zr-标记的抗体为3.4。在每个值中均未发现统计上显著的差异。
[0313]
证实了
89
zr-标记的抗体在心(血液)中的积聚随着时间的过去减少,并且它在施用后252小时几乎从血液中消失。此外,在
89
zr-标记的抗体中,在每个时间点在心(血液)中的积聚没有发现统计上显著的差异。类似地,证实了
89
zr-标记的抗体在肝和肌肉中的积聚随着时间的过去减少,并且在
89
zr-标记的抗体中,在每个时间点在每种组织中的积聚中没有发现统计上显著的差异。
[0314]
实施例14: 使用
89
zr-标记的dota-bn-dbco和dotaga-dbco制备的
89
zr-标记的抗-muc5ac人源化抗体的生物分布实验对于更详细的药物代谢动力学的确认,将使用
89
zr-标记的dota-dbco和dotaga-dbco制备的
89
zr-标记的抗体施用给荷瘤小鼠,并在施用后20、68、188小时进行生物分布实验。如在实施例13中根据实施例10生产
89
zr-标记的抗体。
[0315]
对于生物分布实验,通过与实施例4-2中类似的方法从尾静脉向荷瘤小鼠施用
89
zr-标记的抗体。表24中显示了施用的
89
zr-标记的抗-muc5ac人源化抗体的放射化学纯度和动物信息。将约5 mbq的放射性量施用给所有组。
[0316]
[表24]施用的放射性量和动物信息(关于
89
zr-标记的抗体的施用)(平均值
±
标准差, n=4)在施用
89
zr-标记的抗体后,将荷瘤小鼠饲养在代谢笼中,并收集一直到每个时间点(施用后20、68、188小时)排泄的粪便和尿。在每个时间点通过在异氟烷麻醉下放血对荷瘤小鼠实施安死术。收集肿瘤、血液和正常器官(包括身体的剩余部分)并称重。除了称重的器官外,还测量了排泄的粪便和排泄的尿中的放射性量(γ-射线孔闪烁测量装置: jdc-1712,由hitachi aloka medical, ltd.制造)。从每个器官(包括排泄的粪便和排泄的尿)的放射性量(计数)计算相对于剂量的放射性积聚率(%id),并将积聚的放射性量(%id/g)计算为放射性积聚率/器官重量。显示在肿瘤组织和每个器官中积聚的放射性量随着时间的过去的变化的结果示于图28a-d中。从在排泄的粪便和排泄的尿中的放射性积聚(计数)计算相对于剂量的放射性积聚率(%id),且显示随着时间的过去的变化的结果示于图29中。
[0317]
在使用
89
zr-标记的dota-bn-dbco制备的
89
zr-标记的抗体施用后188小时,在肿瘤中积聚的放射性量最高,且在使用
89
zr-标记的dotaga-dbco制备的
89
zr-标记的抗体施用后68小时,在肿瘤中积聚的放射性量最高。在所述时间积聚的放射性量显示不小于20%id/g。在
89
zr-标记的抗体中,在血液中的放射性积聚的时间过程变化倾向于类似地减少,且血液清除率可以判断为具有相同水平。关于排泄,在施用后188小时,粪便和尿中的放射性积聚率不小于65%id。在正常组织中积聚的放射性在施用后20小时最高,并且在20小时后放射性积聚倾向于减少。在施用后20小时具有高放射性积聚的正常组织按所述次序为肝、肺和脾。
[0318]
实施例15:使用
225
ac-标记的dotaga-dbco制备的
225
ac-标记的抗-muc5ac人源化抗体的效力评价将使用
225
ac-标记的dotaga-dbco制备的
225
ac-标记的抗体施用给荷瘤小鼠,并进行研究以证实肿瘤生长抑制作用。根据实施例9生产
225
ac-标记的抗体。以与在实施例4-2中相同的方式制备荷瘤小鼠。
[0319]
将
225
ac-标记的抗体以5 kbq/小鼠或10 kbq/小鼠的放射性量施用给荷瘤小鼠,并评价
225
ac-标记的抗体的性质。此外,提供了一组(抗体对照组),向其施用仅含有溶解在0.1 m乙酸钠缓冲液(ph 6.0)中的抗-muc5ac人源化抗体的溶液。每组含有6只小鼠,并在施用后观察总体情况、测量体重和肿瘤体积4周。结果显示在表25中。
[0320]
表25施用的放射性量和动物信息(关于
225
ac-标记的抗体的施用)确认肿瘤体积随着时间的过去的变化的结果显示在图30 (a)中。与抗体对照组相比,在任何剂量下在
225
ac-标记的抗体施用组中统计上显著地抑制了肿瘤生长,并且证实了通过
225
ac-标记的抗体的施用的肿瘤生长抑制作用。
[0321]
在观察时间段的最后一天进行尸体剖检,且收集肿瘤并称重。肿瘤重量的比较结果显示在表26中。发现了与抗体对照组相比,在所有
225
ac-标记的抗体施用组中肿瘤重量统计上显著地低。
[0322]
表26肿瘤重量的比较平均值
±
标准差, n=6显著性水平: *p《0.05对抗体对照组确认体重随着时间的过去的变化的结果显示在图30(b)中。在所有
225
ac-标记的抗体施用组中,在10 kbq施用组中在早期观察时间段发现体重下降;然而,相对比率不低于0.9。在晚期观察时间段,体重恢复到大约施用前的水平。
[0323]
在观察时间段的最后一天进行尸体剖检,且收集肝、肾和脾并称重。在所有
225
ac-标记的抗体施用组中,未发现与抗体对照组相比组织重量的统计上显著地降低。
[0324]
表27组织重量的比较肝毒性和肾毒性的结果分别显示在图33和34中。由于相对于抗体对照组未观察到
统计上显著的差异,所以提示所述剂量不诱发肝毒性或肾毒性。血液毒性的结果显示在图31和32中。由于与抗体对照组相比未观察到统计上显著的差异,所以提示所述剂量不诱发血液毒性。
[0325]
实施例16:
89
zr随机标记的抗-muc5ac人源化抗体([
89
zr]随机-dfo-抗-muc5ac人源化抗体)的生产将以与在生产实施例2中相同的方式生产的肽修饰的抗体(单价抗体; h01l03) (0.1 mg, 0.7 nmol)和1-(4-异硫氰基苯基)-3-[6,17-二羟基-7,10,18,21-四氧代-27-(n-乙酰基羟氨基)-6,11,17,22-四氮杂二十七烷(heptaeicosine)]硫脲(p-scn-bn-dfo, macrocyclics) (0.26 mg, 0.35 μmol)在0.1 m碳酸氢钠缓冲液中掺合并于室温反应120分钟。反应完成以后,将混合物通过超滤纯化,并用含有100 mmol精氨酸的50 mmol组氨酸缓冲液(ph 6.1) (在下文中称作rh缓冲液)替换溶剂以产生抗-muc5ac人源化抗体,其中dfo随机地键合至抗-muc5ac人源化抗体的氨基基团(在下文中称作“随机-dfo-抗-muc5ac人源化抗体”)。作为通过nanodrop2000 (thermofisher)测量蛋白浓度的结果,随机-dfo-抗-muc5ac人源化抗体溶液的蛋白浓度为1.12 mg/ml。将获得的随机-dfo-抗-muc5ac人源化抗体溶液(89.6 μl, 0.1 mg, 0.67 μmol)与10 μl (11.8 mbq)的89zrcl3溶液和301.6 μl的rh缓冲液混合以促进复合物形成反应。在复合物形成以后,通过超滤进行纯化以获得[
89
zr]随机-dfo-抗-muc5ac人源化抗体。以与在实施例10中相同的方式计算放射化学纯度,且放射化学纯度为97.3%。此外,基于在反应开始时的放射性计算放射化学得率,且放射化学得率为43.0%。
[0326]
实施例17:[
89
zr]随机-dfo-抗-muc5ac人源化抗体的pet-ct成像将在实施例16中获得的[
89
zr]随机-dfo-抗-muc5ac人源化抗体用rh缓冲液稀释并调节至1.27 mbq/22.5 μg蛋白/100 μl/小鼠的浓度,施用给以与在实施例4-2中相同的方式生产的荷瘤小鼠(n=3),并在施用后19、42、86、158小时进行使用pet-ct成像的评价。以与在实施例4-2中相同的方式,计算经历所述评价的动物的肿瘤体积。结果,肿瘤体积的平均值为60.0
±
20.0 mm3。pet成像条件和图像重建方法遵循实施例13中的那些。进行在每个时间点对肿瘤和心(血液)、肝的suv的voi分析,并使用时间-活性曲线比较suv分布。
[0327]
执行pet-ct成像的结果示于图35中。在每个时间点肿瘤、心和肝的voi分析结果示于图36中。根据voi分析结果,在肿瘤中发现了随时间的积聚,在任何时间点suv的平均值均不小于2.7,且在158小时时suv的最大平均值为5.1。证实了除肿瘤外在器官(心(血液)、肝)中的suv随着时间的过去减少。在施用后158小时,suv的肿瘤与肝比率为3.7。
[0328]
实施例18:[
89
zr]随机-dfo-抗-muc5ac人源化抗体的生物分布实验在实施例17中在158小时完成pet-ct成像以后,通过在异氟烷麻醉下放血对小鼠实施安死术。收集肿瘤、血液和正常器官(包括身体的剩余部分)并称重。此外,使用γ-射线孔闪烁测量装置(jdc-1712, hitachi aloka medical, ltd.),测量每个器官的放射性量。从每个器官(包括排泄的粪便和排泄的尿)的放射性量(计数)计算相对于剂量的放射性积聚率(%id),并将积聚的放射性量(%id/g)计算为放射性积聚率/器官重量。
[0329]
在pet-ct成像完成后生物分布的评价结果示于表28中。在施用后158小时肿瘤的放射性分布率为5.1
±
2.3%id,且每单位重量的放射性分布率为49.5
±
5.2%id。证实在肝中的高放射性分布,且在肝中的放射性分布率为5.1%id,且每单位重量的放射性分布率为
10.4%id/g。除肿瘤外,具有高放射性分布率的正常器官按所述次序为肝、肾和肺。
[0330]
表28 放射性分布率(%id)每单位重量的放射性分布率(%id/g)血液4.305.25心0.413.68肺1.017.76脾0.6414.68胰0.130.90肝12.8610.40肾1.474.06肿瘤5.0649.52身体的剩余部分29.176.23排泄的物质44.21-虽然已经在上文参考实施方案描述了本发明,但本发明不限于上述实施方案。在本发明的范围内,可以对本发明的构成和细节做出本领域技术人员可理解的各种改变。
[0331]
本文引用的任何出版物(包括专利和专利申请)中公开的内容特此整体引入作为参考,达到它们已在本文中公开的程度。
[0332]
[工业适用性]本发明的ri-标记的抗-muc5ac人源化抗体在特异性和在肿瘤中的积聚方面是优越的。因此,它对于其中muc5ac被超表达的疾病(特别是癌症)的治疗和/或诊断是非常有用的。
[0333]
本技术基于在日本提交的专利申请号2019-191562 (申请日: 2019年10月18日),其内容全部并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1