免疫耐受的弹性蛋白样重组肽及其使用方法
免疫耐受的弹性蛋白样重组肽及其使用方法
1.相关申请的交叉引用
2.本技术要求2019年8月23日提交的美国临时申请62/890,936的提交日期的权益。该较早提交的申请的内容特此通过引用整体并入本文。
3.序列表的并入
4.本技术包含在提交申请的同时通过efs-web以ascii格式提交的序列表,其含有文件名称21101_0378p1_sequence_listing,其为65,536字节大小,创建于2020年5月29日,并通过引用整体并入本文。
背景技术:
5.免疫检验点抗体可以用于治疗多种癌症。迄今为止,可用的临床免疫检验点抗体是静脉内施用的。免疫检验点抗体的全身施用可有效控制弥散性肿瘤。但是,当肿瘤局限于局部区域时,全身性抗体治疗不是有效的,并且常常伴有副作用。在这样的情况下,免疫检验点抗体的局部递送可能通过增加治疗效力和减少副作用来提供益处。但是,在没有递送系统的情况下,局部施用的抗体在局部区域的保留时间很短,并且对全身循环高暴露。这些挑战使局部免疫检验点抗体治疗的前景不如预期。因此,需要局部地递送免疫检验点抗体的替代方法。
技术实现要素:
6.本文中公开了包含同源氨基酸重复序列和igg结合结构域的重组多肽,其与所述同源氨基酸重复序列具有至少75%氨基酸序列同一性,且其中所述同源氨基酸重复序列是:gly-val-leu-pro-gly-val-gly(seq id no:1);gly-a1a-gly-val-pro-gly(seq id no:2);val-pro-gly-phe-gly-ala-gly-ala-gly(seq id no:3);val-pro-gly-leu-gly-ala-gly-ala-gly(seq id no:4);val-pro-gly-leu-gly-val-gly-ala-gly(seq id no:5);gly-val-leu-pro-gly-val-gly-gly(seq id no:6);gly-val-leu-pro-gly(seq id no:7);gly-leu-val-pro-gly-gly(seq id no:8);gly-leu-val-pro-gly(seq id no:9);gly-val-pro-leu-gly(seq id no:10);gly-ile-pro-gly-val-gly(seq id no:11);gly-gly-val-leu-pro-gly(seq id no:12);gly-val-gly-val-leu-pro-gly(seq id no:14);或gly-val-pro-gly(seq id no:15)。
7.本文中公开了增加治疗剂的效力或增加治疗剂在受试者中的半衰期的方法,所述方法包括给所述受试者施用缀合至重组多肽的治疗剂,其中所述重组多肽包含共价地连接至igg结合结构域的同源氨基酸重复序列,且其中所述治疗剂非共价地缀合至所述igg结合结构域,且其中通过直接注射施用所述缀合物,由此增加所述治疗剂的效力或半衰期。
附图说明
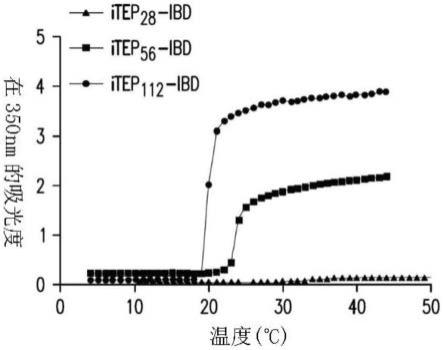
8.图1a-e显示了itep-ibd多肽的转变温度(tt)的表征以及itep-ibd多肽和抗体之间的结合。图1a的代表性图显示了在温度变化时itep-ibd多肽溶液的浊度。溶液的浊度通
过在350nm的吸光度来表征。图1b显示了每种itep-ibd多肽的转变温度依赖于其浓度(n=3个生物学上独立的样品,单因素方差分析和tukey事后检验)。图1c显示了结合至igg的itep-ibd多肽和在贮库中捕集的igg。贮库中igg的百分比依赖于itep-ibd多肽与igg之比(n=5个生物学上独立的样品,单因素方差分析和tukey事后检验)。图1d显示了itep-ibd多肽没有影响αpd-1抗体的靶标结合能力。游离的αpd-1抗体和itep
112-ibd/αpd-1多肽将靶细胞类似地染色(n=6个生物学上独立的样品,未配对双尾t-检验)。图1e的代表性流式细胞计量术图显示了αpd-1抗体和itep
112-ibd/αpd-1多肽的可比较靶标结合能力。将数据显示为平均值
±
标准差(sd)。****p<0.0001,ns=不显著的。
9.图2a-d显示了itep
112-ibd/igg的释放特性和低血浆浓度。图2a显示了来自itep
112-ibd/igg贮库的igg在pbs或小鼠血清中的体外释放曲线(n=3个生物学上独立的样品,未配对双尾t-检验)。图2b显示了皮下注射igg或itep
112-ibd/igg的小鼠的荧光ivis成像(n=5小鼠)。itep
112-ibd多肽与igg之比为8∶1。在图像上用黄色/红色指示经标记的igg的存在。图2c显示了如在图2b中所示的小鼠中剩余igg的辐射效率的定量(n=5小鼠,未配对双尾t-检验)。将在每个时间点的辐射效率标准化至最初辐射效率。通过将时间和标准化的辐射效率拟合至一阶释放模型,计算释放半衰期(t
1/2
)。图2d显示了当单独地或与itep
112-ibd一起注射igg时,磺基-花青7-标记的igg随时间的小鼠血浆浓度(n=5小鼠,未配对双尾t-检验)。itep
112-ibd多肽与igg之比为8∶1。将数据显示为平均值
±
sd。*p<0.5,****p<0.0001。
10.图3a-b显示了itep
28-ibd/igg和itep
56-ibd/igg的体内释放特性。图3a显示了注射itep
28-ibd/igg或itep
56-ibd/igg的小鼠的荧光ivis成像(n=5小鼠)。itep
28-ibd多肽和itep
56-ibd多肽与igg之比为8∶1。图3b显示了在如在图3a中所示的注射部位处剩余igg的辐射效率的定量(n=5小鼠,未配对双尾t-检验)。将数据显示为平均值
±
sd。**p<0.01。
11.图4a-d显示了itep-c-ibd多肽的表征和itep-c-ibd/igg的体内释放特性。图4a的代表性图显示了itep-c-ibd多肽溶液的浊度相对于温度的关系。图4b的图显示了itep-c-ibd多肽的tt的浓度依赖性(n=3个生物学上独立的样品,单因素方差分析和tukey事后检验)。图4c显示了在贮库中的itep-c-ibd多肽捕集的igg(n=5个生物学上独立的样品,单因素方差分析和tukey事后检验)。图4d显示了注射itep
28-c-ibd/igg、itep
56-c-ibd/igg或itep
112-c-ibd/igg的小鼠的荧光ivis成像(n=5小鼠)。itep-c-ibd多肽与igg之比为8∶1。图4e显示了如在图4d中所示的剩余igg的辐射效率的定量与时间的关系(n=5小鼠,单因素方差分析和tukey事后检验)。将数据显示为平均值
±
sd。**p<0.01,****p<0.0001,ns=不显著的。
12.图5a-b显示了在32∶1的比例时itep-c-ibd/igg的体内释放特性。图5a显示了注射itep
28-c-ibd/igg、itep
56-c-ibd/igg或itep
112-c-ibd/igg的小鼠的荧光ivis成像(n=5小鼠)。itep-c-ibd多肽与igg之比为32∶1。图5b显示了在如在图5a中所示的注射部位处剩余igg的辐射效率的定量(n=5小鼠,单因素方差分析和tukey事后检验)。将数据显示为平均值
±
sd。***p<0.001,ns=不显著的。
13.图6a-e显示了itep
112-c-ibd/igg在血液、肿瘤和其它器官中的分布。图6a显示了注射游离igg或itep
112-c-ibd/igg的肿瘤在注射后24和72小时的荧光ivis成像(n=5小鼠)。itep
112-c-ibd多肽与igg之比为8∶1。图6b显示了直接注射游离igg或itep
112-c-ibd/
igg的肿瘤中igg的积累(n=5小鼠,未配对双尾t-检验)。将数据表示为每克组织的注射剂量的百分比,(id%)/克。在注射后24小时(图6c)和72小时(图6d)在脾、肝、肾和肺处的igg的积累(n=5小鼠,未配对双尾t-检验)。图6e显示了在注射后24和72小时注射的igg的小鼠血清浓度(n=5小鼠,未配对双尾t-检验)。将数据显示为平均值
±
sd。*p<0.5,**p<0.01,***p<0.001,****p<0.0001。
14.图7a-e显示了使用不同的数学模型时igg和itep
112-ibd/igg的体内释放动力学。将在每个时间点收集的数据标准化至在注射后立即收集的数据,该时间视作时间零点。使用零阶模型(图7a)、一阶模型(图7b)、higuchi模型(图7c)、hixson-crowell模型(图7d)和korsmeyer-peppas模型(图7e)分析释放动力学。将每条拟合线的方程式和决定系数(r2)显示在每个图上。
15.图8a-b显示了经标记的igg的标准曲线。所述曲线显示了荧光强度与荧光素-标记的igg(图8a)和磺基-花青7-标记的igg(图8b)在pbs溶液中的浓度之间的线性相关。将每条线的方程式和决定系数(r2)显示在图上。从低至高两条标准曲线中igg的浓度为0.0003、0.0009、0.0027、0.0081和0.0243mg/ml。标准曲线中最低igg浓度的荧光信号比背景信号高20倍(图8a)和6倍(图8b)。减去血浆、血清和其它组织的荧光背景,然后使用标准曲线计算这些生物组分中的igg浓度。
具体实施方式
16.通过参考本文包括的以下发明详述、附图和实施例,可以更容易地理解本公开内容。
17.在公开和描述本发明的方法和组合物之前,应当理解,它们不限于具体合成方法(除非另外指出)或特定试剂(除非另外指出),因为这些当然可以变化。还应当理解,本文中使用的术语仅用于描述特定方面的目的,无意是限制性的。尽管与本文描述的那些类似或等同的任何方法和材料都可以用于实践或试验本发明,但是现在描述实施例方法和材料。
18.此外,应当理解,除非另外明确地阐明,否则绝不意图将本文阐述的任何方法解释为要求其步骤以特定顺序执行。因此,在方法权利要求没有实际列举其步骤要遵循的顺序或者没有在权利要求或说明书中另外特别说明所述步骤限于特定顺序的情况下,在任何方面都绝不意图推断顺序。这适用于任何可能的非明确的解释基础,包括与步骤或操作流程的安排有关的逻辑问题,从语法组织或标点符号得出的简单含义,以及在说明书中描述的方面的数目或类型。
19.在本文中提及的所有出版物都通过引用并入本文,以公开和描述与所述出版物引用的对象有关的方法和/或材料。在本文中讨论的出版物仅针对它们在本技术的提交日之前的公开内容而提供。在本文中的任何内容都不应解释为承认:本发明由于在前发明而丧失早于这样的出版物的资格。此外,本文提供的公开日期可能与实际公开日期不同,后者可能需要独立确认。
20.定义
21.如在说明书和所附权利要求书中使用的,单数形式“一个”、“一种”和“所述”包括复数指示物,除非上下文另外清楚地指明。
22.本文中使用的词语“或”是指特定列表的任何一个成员,并且还包括该列表的成员
的任何组合。
23.范围在本文中可以表示为从“约”或“大约”一个特定值,和/或到“约”或“大约”另一个特定值。当表达这样的范围时,另一个方面包括从一个特定值和/或到另一个特定值。类似地,当通过使用先行词“约”或“大约”将值被表示为近似值时,应该理解,特定值形成另一个方面。进一步理解,每个范围的端点相对于其它端点和独立于其它端点都是显著的。还理解,本文中公开了许多值,并且除了所述值本身之外,每个值在本文中也公开为“约”该特定值。例如,如果值“10”被公开,那么“约10”也被公开。还理解,也公开了两个特定单元之间的每个单元。例如,如果公开了10和15,则也公开了11、12、13和14。
24.本文中使用的术语“任选的”或“任选地”是指,随后描述的事件或情况可能发生或可能不发生,并且该描述包括所述事件或情况发生的情形和不发生的情形。
25.本文中使用的术语“样品”是指:来自受试者的组织或器官;细胞(在受试者体内,直接取自受试者,或维持在培养物中的细胞或来自培养的细胞系的细胞);细胞裂解物(或裂解物级分)或细胞提取物;或含有一种或多种源自细胞或细胞材料(例如多肽或核酸)的分子的溶液,其如本文所述进行测定。样品也可以是含有细胞或细胞组分的任何体液或排泄物(例如,但不限于,血液、尿、粪便、唾液、眼泪、胆汁)。
26.本文中使用的术语“受试者”表示施用的靶标,例如人。因此,所公开的方法的受试者可以是脊椎动物,诸如哺乳动物、鱼、鸟、爬行动物或两栖动物。术语“受试者”还包括驯化的动物(例如,猫、狗等)、家畜(例如,牛、马、猪、绵羊、山羊等)和实验动物(例如,小鼠、兔、大鼠、豚鼠、果蝇等)。在一个方面,受试者是哺乳动物。在另一个方面,受试者是人。该术语不表示特定年龄或性别。因此,意图涵盖成年人、儿童、青少年和新生儿受试者以及胎儿,无论是男性还是女性。
27.本文中使用的术语“患者”表示罹患疾病或障碍的受试者。术语“患者”包括人和兽医受试者。在所公开的方法的一些方面,“患者”已被诊断出癌症。在所公开的方法的一些方面,“患者”已被鉴定为需要治疗癌症,例如,在向患者施用治疗剂之前。
28.本文中使用的术语“包含”可以包括方面“由......组成”和“基本上由......组成”。
29.本文中使用的术语“氨基酸”和“氨基酸同一性”表示20种天然存在的氨基酸之一或任何非天然类似物,其可存在于所公开的其变体、肽或片段中的任一种中。因此,本文中使用的“氨基酸”是指天然存在的和合成的氨基酸。例如,为了本发明的目的,高苯丙氨酸、瓜氨酸和正亮氨酸被认为是氨基酸。“氨基酸”还包括氨基酸残基诸如脯氨酸和羟脯氨酸。侧链可以处于(r)或(s)构型。如果使用非天然存在的侧链,可以使用非氨基酸取代基,例如以防止或延缓体内降解。
30.术语“片段”可以表示肽的一部分(例如,至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30个氨基酸等),该部分与参考肽基本相同并保留参考肽的生物活性。在某些方面,所述片段或部分保留本文所述的参考肽的生物活性的至少50%、75%、80%、85%、90%、95%或99%。此外,参考肽的片段可以是参考多肽的连续或邻近部分(例如,十个氨基酸长的肽片段可以是该肽内的任何2-9个连续残基)。
[0031]“变体”可以是指与参考序列在某种方式上的差异,而不仅仅是一个或多个n-端和/或c-端氨基酸残基的简单删除。在变体包括氨基酸残基的置换时,所述置换可以被认为
是保守的或非保守的。保守置换是以下组中的那些:ser、thr和cys;leu、ile和val;glu和asp;lys和arg;phe、tyr和trp;和gln、asn、glu、asp和his。变体可以包括至少一个置换和/或至少一个添加,也可以存在至少一个缺失。变体还可以包括一个或多个非天然存在的残基。例如,变体可以包括在任何位置处的硒代半胱氨酸(例如,硒代-l-半胱氨酸),包括在半胱氨酸的位置。许多其它“非天然”氨基酸替代物是本领域已知的并且可从商业来源获得。非天然存在的氨基酸的例子包括d-氨基酸、具有连接到半胱氨酸的硫原子的乙酰基氨基甲基基团的氨基酸残基、聚乙二醇化的氨基酸和式nh2(ch2)ncooh的ω氨基酸,其中n是2-6个中性的非极性的氨基酸,诸如肌氨酸、叔丁基丙氨酸、叔丁基甘氨酸、n-甲基异亮氨酸和正亮氨酸。苯基甘氨酸可以置换trp、tyr或phe;瓜氨酸和甲硫氨酸亚砜是中性的非极性的,半胱氨酸是酸性的,且鸟氨酸是碱性的。脯氨酸可以被羟脯氨酸置换并保留赋予脯氨酸性质的构象。
[0032]
本文中使用的术语“itep”表示免疫耐受的弹性蛋白样多肽。itep可以不同于先前公开的弹性蛋白样多肽(被称作elp;elp描述于d.m.floss,等人,elastin-like polypeptides revolutionize recombinant protein expression and their biomedical application,trends biotechnol.28(1)(2010)37-45;和t.kowalczyk,等人,elastin-like polypeptides as a promising family of genetically-engineered protein based polymers,world j.microbiol.biotechnol.30(8)(2014)2141-52.)。itep具有相变性质并且是免疫耐受的。本文公开的itep序列可以被称作同源的氨基酸序列,其可以重复例如20至120次,并融合至igg结合结构域以形成本文公开的一种或多种重组多肽。在某些方面,itep序列可以通过接头融合至igg结合结构域(例如,ibd)。在某些方面,术语“itep-ibd多肽”涵盖在itep序列和ibd之间的接头序列。
[0033]
介绍
[0034]
单克隆抗体(例如,igg)广泛用于医学。经常希望限制治疗性igg在靶组织内的分布,因为这会增加igg向靶细胞的生物利用度,同时减少治疗性igg向其它组织和细胞的暴露。igg向其它组织和细胞的暴露经常导致副作用。为了增加igg在靶组织内的分布和积累,已经将igg直接注射到组织中。但是,注射的igg快速地扩散到组织外。本文公开了用于增加igg在组织中的保留时间和保留量的组合物和方法。本文公开的重组多肽和组合物可以包含免疫耐受的弹性蛋白样肽(itep)和igg结合结构域。在某些方面,重组多肽包含同源氨基酸重复(例如,itep和igg结合结构域,其可以被称作“领先的igg发射体”或“pie”)。本文描述的重组多肽和组合物可以在体内形成团聚体,这可以由生理温度触发。团聚体可以用于将igg储存在形成团聚体的组织内。本文公开的重组多肽、组合物和方法可以具有两个元件:从itep组装的团聚体(在本文中也被称作同源氨基酸重复序列)和igg结合结构域,所述igg结合结构域可以与itep连接以形成多肽、融合多肽或重组多肽,后者然后可以用于结合igg。从功能上讲,与本文公开的融合或重组多肽结合的igg的保留或治疗性igg从本文公开的融合或重组多肽的释放可以取决于至少但不限于以下因素:itep(或同源氨基酸重复序列)的序列/疏水性、在公开的重组多肽中igg和同源氨基酸重复之间的比例、以及同源氨基酸重复序列之间的交联状态。交联状态和疏水性也可以决定重组多肽的稳定性。多种重组多肽可以通过调节这些因素而设计和产生,并在本文中进行了描述。
[0035]
与增加igg在靶组织中的保留的其它方法相比,使用本文描述的重组多肽和组合
物递送治疗剂(例如,治疗性抗体或igg)的优点包括、但不限于以下。首先,无需修饰igg(例如,治疗剂或抗体)即可利用本文描述的重组多肽;其它方法需要对igg进行修饰,这在制备程序中增加至少一个步骤。此外,igg的修饰可能损害igg的功能。其次,itep或同源氨基酸重复与igg结合结构域的融合可以作为单一重组蛋白产生。融合蛋白具有优异的同质性、再现性和可扩缩性。第三,可以容易地调节与igg结合的重组多肽的稳定性,该稳定性可以决定igg的保留时间。因此,可以产生与igg结合的重组多肽,使得igg的释放动力学可以受控制或多样化。
[0036]
与igg结合的重组多肽可以用于递送希望在一个或多个特定组织中保留延长的时间段的任何治疗性或诊断性igg。igg的例子包括、但不限于癌症免疫检验点抑制剂,诸如伊匹木单抗和纳武单抗。例如,所述药物在癌症治疗中具有应用和效力。但是,它们的应用已经受到副作用的阻碍,所述副作用由这些药物与免疫细胞(其与癌症治疗无关)的相互作用引起。
[0037]
免疫检验点抗体代表了新药开发中增长最快的领域之一。截止至2018年底,美国食品和药品管理局已经批准了七种免疫检验点抗体,包括:靶向pd-1的派姆单抗、纳武单抗和西米普利单抗(r.m.poole,drugs74(16)(2014)1973-81;e.d.deeks,dmgs 74(11)(2014)1233-9;和a.markham,s.duggan,drugs 78(17)(2018)1841-6),靶向pd-l1的阿特朱单抗、阿维鲁单抗和度伐单抗(a.markham,drugs 76(12)(2016)1227-32;e.s.kim,drugs77(8)(2017)929-37;y.y.syed,drugs 77(12)(2017)1369-76),和靶向ctla-4的伊匹木单抗(f.cameron,等人,drugs 71(8)(2011)1093-104)。这些抗体的适应症覆盖黑素瘤、非小细胞肺癌(nsclc)、泌尿道上皮癌、淋巴瘤等(k.m.hargadon,等人,int immunopharmacol 62(2018)29-39)。在临床实践中,免疫检验点抗体通过静脉内输注施用给患者。静脉内输注后,抗体进入全身血液循环,预期抗体通过该循环到达疾病部位以发挥作用(e.d.lobo,等人,j pharm sci 93(11)(2004)2645-68)。免疫检验点抗体的全身施用,诸如静脉内输注,适用于治疗弥散性疾病,诸如血癌(e.jabbour,等人,blood125(26)(2015)4010-6)。但是,当肿瘤局限于特定区域时,存在与免疫检验点抗体的全身施用有关的挑战。首先,存在可以限制抗体从血液循环进入实体瘤的生理屏障,诸如血流不畅、间质液压力升高和致密的细胞外基质(g.m.thurber,等人,adv drug deliv rev 60(12)(2008)1421-34;和m.tabrizi,等人,aaps j 12(1)(2010)33-43),因此限制了抗体在肿瘤部位的局部生物利用度(c.f.molthoff,等人,br j cancer 65(5)(1992)677-83;l.t.baxter,等人,cancer res 54(6)(1994)1517-28;和c.m.lee,i.f.tannock,bmc cancer 10(2010)255)。静脉内注射的抗体的肿瘤积累为小鼠每克肿瘤的注射剂量的约1%至25%(c.f.molthoff,等人,br j cancer 65(5)(1992)677-83;和a.a.epenetos,等人,br j cancer46(1)(1982)1-8)。在人类患者中的积累要低得多,为每克肿瘤的注射剂量的约0.002%至0.03%(a.a.epenetos,等人,cancer res46(6)(1986)3183-91;和m.r.buist,等人,intj cancer 64(2)(1995)92-8)。免疫检验点抗体的有限肿瘤生物利用度导致治疗效果欠佳。一项后设分析显示,抗-pd-1和抗-pd-l1在具有晚期实体瘤的患者中的总应答率为21%(a.carretero-gonzalez,等人,oncotarget 9(9)(2018)8706-15)。增加治疗性抗体的肿瘤积累将促进抗肿瘤效力,如临床前研究所证实的(a.r.nikpoor,等人,nanomedicine 13(8)(2017)2671-82;和t.h.shin,等人,mol cancer ther 13(3)(2014)651-61)。其次,全身施用的免疫检验点抗
体可以通过血液循环到达健康组织,这可能导致不希望的不良作用(m.a.postow,等人,n englj med 378(2)(2018)158-68;和j.m.michot,等人,eur j cancer54(2016)139-48)。例如,55%的黑素瘤患者在接受抗-pd-1和抗-ctla-4抗体的联合疗法时经历3-4级副作用。所述副作用是严重的,以致于36.4%的患者不得不停止治疗(j.larkin,等人,n engl j med373(1)(2015)23-34)。抗-ctla-4抗体的副作用似乎是剂量依赖性的。在37%的用10mg/kg伊匹木单抗治疗的患者中和18%的用3mg/kg伊匹木单抗治疗的患者中观察到≥3级的副作用(j.d.wolchok,等人,lancet oncol11(2)(2010)155-64)。通过扰乱正常器官的免疫稳态,免疫检验点抗体可以引起器官特异性毒性。通常受影响的器官和组织包括肝、肺、皮肤、胃肠道、内分泌腺和血液系统(a.winer,等人,j thorac dis 10(增刊3)(2018)s480-9;和f.martins,等人,nat rev clin oncol(2019))。第三,免疫检验点抗体的全身施用与治疗的高成本有关。例如,通过静脉内输注进入血液循环后,抗体浓度被高度稀释。为了在疾病部位达到治疗浓度,患者需要接受高剂量的抗体,这部分地使抗体治疗变得昂贵(a.f.shaughnessy,bmj345(2012)e8346)。
[0038]
鉴于抗体的全身施用的那些挑战,免疫检验点抗体的局部施用可能导致治疗局部肿瘤的一些优势(m.f.fransen,等人,clin cancer res 19(19)(2013)5381-9;a.marabelle,等人,j clin invest 123(6)(2013)2447-63;i.sagiv-barfi,等人,sci transl med 10(426)(2018);v.huynh,等人,chembiochem 20(6)(2019)747-53;l.c.sandin,等人,oncoimmunology 3(1)(2014)e27614;和l.c.sandin,等人,cancer immunol res 2(1)(2014)80-90)。对于局部疾病,直接向疾病部位注射抗体可以提高局部生物利用度(r.g.jones,a.martino,crit rev biotechnol 36(3)(2016)506-20)。可以在疾病部位达到高抗体浓度,从而提高治疗效果(k.kitamura,等人,cancer res52(22)(1992)6323-8;和a.d.simmons,等人,cancer immunol immunother57(8)(2008)1263-70)。由于增加的生物利用度,与全身施用相比,局部施用使用低得多的抗体剂量。在一项临床前研究中,免疫检验点抗体向小鼠体内原发性肿瘤的直接注射可以达到与静脉内注射相同或甚至更好的抗肿瘤效果(a.marabelle,等人,j clin invest 123(6)(2013)2447-63)。局部注射所需的免疫检验点抗体的剂量为静脉内注射所需剂量的约1%。局部注射所需的低抗体剂量可以降低抗体治疗的高成本(d.w.grainger,expert opin biol ther 4(7)(2004)1029-44)。由于将低剂量的抗体直接注射到疾病部位,因此抗体向健康组织的暴露可能减少。因此,局部抗体注射也可以降低副作用的风险(a.d.simmons,等人,cancer immunol immunother,57(8)(2008)1263-70;a.marabelle,等人,clin cancer res 19(19)(2013)5261-3;b.kwong,等人,biomaterials32(22)(2011)5134-47;b.kwong,s.a.等人,cancer res73(5)(2013)1547-58)。
[0039]
鉴于动物研究的结果,已启动临床试验以评价免疫检验点抗体在患者中的局部注射的临床益处。在具有不可切除的黑素瘤(nct01672450)的患者中评价了伊匹木单抗和白介素-2的肿瘤内注射。在具有复发性黑素瘤、非霍奇金淋巴瘤、结肠和直肠癌(nct01769222)的患者中应用了肿瘤内伊匹木单抗和局部辐射疗法。一项i/ii期研究评价了与辐射疗法联合的肿瘤内伊匹木单抗和toll-样受体9激动剂用于治疗具有b-细胞淋巴瘤(nct02254772)的患者。从理论上讲,肿瘤内免疫检验点抗体可以应用于任何可以进行瘤内注射的原发性肿瘤。但是,为了治疗转移性肿瘤,肿瘤内免疫检验点抗体应该能够诱导全
身抗肿瘤免疫。在动物研究中,肿瘤内免疫检验点抗体已经被证实对远处肿瘤的抗肿瘤免疫,这被称为伴随远隔效应(w.j.m.mulder,s.gnjatic,nat nanotechnol 12(9)(2017)840-1;m.bilusic,j.l.gulley,editorial:local immunotherapy:a way to convert tumors from“cold”to“hot”,j natl cancer inst 109(12)(2017);m.a.aznar,等人,j immunol 198(1)(2017)31-9;a.marabelle,等人,ann oncol 28(suppl_12)(2017)xii33-43;和v.murthy,j.minehart,d.h.sterman,j natl cancer inst 109(12)(2017))。但是,除了在伊匹木单抗、放射疗法和基于dc的疫苗接种的背景下的少数病例以外,很少描述患者中的伴随远隔免疫(m.a.postow,等人,n engl j med366(10)(2012)925-31;e.f.stamell,等人,int j radiat oncol biol phys 85(2)(2013)293-5;和j.karbach,等人,cancer immunol res 2(5)(2014)404-9)。因此,伴随远隔免疫可以被认为是在未来临床试验中需要观察的重要参数。可替换地,肿瘤内和静脉内免疫检验点抗体的组合被用于治疗转移性瘤。例如,一项i/ii期研究目前正在具有转移性黑素瘤(nct02857569)的患者中试验肿瘤内伊匹木单抗+静脉内纳武单抗。
[0040]
尽管许多临床前和临床研究都在采用这种治疗,但免疫检验点抗体的局部注射的一些挑战仍然存在。首先,抗体在局部位点的保留时间短。例如,在皮下注射后,igg在注射部位的保留时间为约6.8小时(f.wu,等人,pharm res 29(7)(2012)1843-53))。短保留时间要求频繁的局部注射,这可能导致临床不便和低患者顺应性(d.schweizer,等人,controlled release of therapeutic antibody formats,eur j pharm biopharm 88(2)(2014)291-309)。其次,局部注射的抗体最终会进入血液循环。据估计,皮下注射的抗体的全身暴露为静脉内输注的抗体的全身暴露的约50-80%(w.f.richter,b.jacobsen,drug metab dispos 42(11)(2014)1881-9)。局部注射的抗体的高全身暴露导致副作用的高风险(j.ishihara,等人,sci transl med 9(415)(2017))。
[0041]
局部抗体注射需要控制释放系统来解决那些挑战。这样的系统能够增加局部保留时间并减少抗体的全身暴露。此外,该系统应便于局部注射。并且,该系统应当是可调节的以控制抗体的释放。为了开发如本文所述的这样的系统,免疫耐受的弹性蛋白样多肽(itep)被用作载体来递送抗体。itep具有与其转变温度(tt)相关的相变性质。当温度低于tt时,itep可溶于水性溶液中,而当温度高于tt时,itep变得不溶并从溶液中沉淀(p.wang,等人,biomaterials 182(2018)92-103)。例如,如果itep的tt低于体温,则itep在注入体内后会沉淀并形成贮库。多肽或itep贮库缓慢释放,在注射部位停留至多数周(m.amiram,等人,j control release 172(1)(2013)144-51;s.m.sinclair,等人,j control release 171(1)(2013)38-47;m.amiram,等人,proc natl acad sci u s a 110(8)(2013)2792-7;和k.m.luginbuhl,等人,nat biomed eng 1(2017))。如果抗体连接至那些贮库,则预期抗体从注射部位缓慢释放。为了将itep连接至抗体(例如,igg),将igg结合结构域(ibd)连接到itep以产生重组多肽(可以被称作itep-ibd)。“ibd”表示衍生自蛋白g的蛋白结构域(b.guss,等人,embo j5(7)(1986)1567-75;和a.m.gronenborn,g.m.clore,immunomethods2(1)(1993)3-8)。ibd可以以约10nm的高亲和力结合igg(m.hutt,等人,j biol chem287(7)(2012)4462-9;和f.unverdorben,等人,plos one 10(10)(2015)e0139838)。如在本文公开的,结果表明,本文所公开的重组蛋白(例如,itep-ibd)和igg的混合物可以在注射部位形成贮库并捕集igg,从而减慢igg的释放。结果还表明,可以通过控
制本文公开的重组蛋白(例如itep-ibd)的分子量(mw)和结构来微调igg的释放速率。此外,重组蛋白(例如,itep-ibd)被证明会减少局部注射的igg的全身暴露。最后,结果证实,重组蛋白(例如itep-ibd)可以将抗体保留在肿瘤中。总之,本文所述的这些结果证明了所公开的重组多肽(例如itep-ibd)用于局部抗体施用的应用。
[0042]
itep是蛋白。itep可以自组装成类似大小的纳米颗粒(np)。本文公开了使用itep(本文也称为同源氨基酸重复序列)纳米颗粒作为药物递送媒介物的组合物和方法。在某些方面,本文公开的itep可以形成纳米颗粒。在某些方面,本文公开的itep不会形成纳米颗粒。如本文所公开的给定itep是否将形成纳米颗粒可以取决于多种因素,包括、但不限于itep(例如,同源氨基酸重复序列)的长度、疏水性/亲水性、或二嵌段聚合物的组成等。
[0043]
本文公开的itep具有期望的转变性质,并且还可以被小鼠体液免疫耐受。本文还描述了疏水性相反的两对itep,以制备两亲的二嵌段共聚物或融合蛋白。可以通过将两个或更多个蛋白融合在一起来产生融合蛋白。二嵌段共聚物可以用于描述两种不同itep的融合体。共聚物(例如,融合蛋白)自组装成np。例如,seq id no:1和seq id no:2可以融合在一起以形成二嵌段聚合物。在某些方面,然后可以将二嵌段聚合物融合或共价结合至igg结合结构域。
[0044]
组合物
[0045]
重组多肽.本文中使用的术语“重组多肽”表示通过包括重组技术在内的多种方法产生的多肽。本文公开的重组多肽可以包含一个或多个同源氨基酸重复序列(例如,itep)和igg结合结构域。本文中公开了重组多肽。在某些方面,重组多肽可以包含同源氨基酸重复序列。在某些方面,同源氨基酸重复序列可以与同源氨基酸重复序列具有至少75%氨基酸序列同一性。在某些方面,同源氨基酸重复序列可以是:gly-val-leu-pro-gly-val-gly(seq id no:1);gly-ala-gly-val-pro-gly(seq id no:2);val-pro-gly-phe-gly-ala-gly-ala-gly(seq id no:3);val-pro-gly-leu-gly-ala-gly-ala-gly(seq id no:4);val-pro-gly-leu-gly-val-gly-ala-gly(seq id no:5);gly-val-leu-pro-gly-val-gly-gly(seq id no:6);gly-val-leu-pro-gly(seq id no:7);gly-leu-val-pro-gly-gly(seq id no:8);gly-leu-val-pro-gly(seq id no:9);gly-val-pro-leu-gly(seq id no:10);gly-ile-pro-gly-val-gly(seq id no:11);gly-gly-val-leu-pro-gly(seq id no:12);gly-val-gly-val-leu-pro-gly(seq id no:14);或gly-val-pro-gly(seq id no:15);和igg结合结构域。
[0046]
在某些方面,重组多肽包含氨基酸序列gly-(gly-val-leu-pro-gly-val-gly)
28-gly-gly(seq id no:23);gly-(gly-ala-gly-val-pro-gly)
70-gly-gly(seq id no:24);gly-(val-pro-gly-phe-gly-ala-gly-ala-gly)
21-gly-gly(seq id no:25);或gly-(val-pro-gly-leu-gly-ala-gly-ala-gly)
96-gly-gly(seq id no:26)。
[0047]
在某些方面,重组多肽可以进一步包含两个或更多个相同的同源氨基酸重复序列。例如,同源氨基酸序列可以是连续重复20至200次的gly-val-leu-pro-gly-val-gly(seq id no:1)(例如,(gly-val-leu-pro-gly-val-gly)
28
(seq id no:13);(gly-val-leu-pro-gly-val-gly)
56
(seq id no:16);或(gly-val-leu-pro-gly-val-gly)
112
(seq id no:17)。
[0048]
在某些方面,重组多肽可以进一步包含两个或更多个不同的同源氨基酸重复序
列。在某些方面,同源氨基酸序列可以是连续重复20至200次的相同序列并且其融合至可以重复20至200次的不同同源氨基酸序列。
[0049]
在某些方面,重组多肽包含二嵌段共聚物或融合蛋白。二嵌段共聚物或融合蛋白包含两个或三个通过共价键连接在一起的同源氨基酸重复序列。在某些方面,例如,通过将gly-val-leu-pro-gly-val-gly(seq id no:1)融合至gly-ala-gly-val-pro-gly(seq id no:2),可以形成二嵌段聚合物。在某些方面,二嵌段聚合物可以是(seq id no:1)x-(seq id no:2)y或(seq id no:2)y-(seq id no:1)x,其中x和y可以是20-120之间的任何数字,其中20至120之间的任何数字指示各个同源氨基酸序列的重复次数。
[0050]
在某些方面,一个或多个半胱氨酸氨基酸残基可以插在二嵌段共聚物或融合蛋白和igg结合结构域之间。在某些方面,半胱氨酸氨基酸残基的数目可以是1、2、3、4、5、10、15、20、30、40或更多或之间的任何数字。在某些方面,半胱氨酸氨基酸残基的数目可以是四。在某些方面,半胱氨酸氨基酸残基可以被一个或多个甘氨酸氨基酸残基隔开。甘氨酸氨基酸残基的数目可以变化且取决于插入在二嵌段共聚物和igg结合结构域之间的半胱氨酸氨基酸残基的数目。在某些方面,甘氨酸氨基酸残基的数目可以是1、2、3、4、5、10、15、20、30、40或更多或之间的任何数字。在某些方面,甘氨酸氨基酸残基的数目可以是八。例如,当四个半胱氨酸残基插入在二嵌段共聚物和igg结合结构域之间时,可以插入八个甘氨酸氨基酸残基以隔开邻近的半胱氨酸氨基酸残基。在某些方面,二嵌段共聚物或融合蛋白可以是两亲的。在某些方面,二嵌段共聚物或融合蛋白可以与igg结合结构域融合。
[0051]
本文还描述了包含符合下式的氨基酸序列的重组多肽:val-pro-gly-xaa
1-gly-xaa
2-gly-ala-gly,其中xaa1是leu或phe且xaa2是ala或val(seq id no:16-19),其中所述氨基酸序列是重复的。
[0052]
在某些方面,本文描述的重组多肽可以进一步包含位于重组多肽的n-端、c-端或n-端和c-端二者的一个或多个氨基酸残基。在某些方面,所述一个或多个氨基酸残基可以是甘氨酸、丙氨酸或丝氨酸或其组合。在某些方面,重组多肽可以包含氨基酸序列gly-(val-pro-gly-phe-gly-ala-gly-ala-gly)
21-gly-gly(seq id no:25);或gly-(val-pro-gly-leu-gly-ala-gly-ala-gly)
96-gly-gly(seq id no:26);或xx-(val-pro-gly-leu-gly-val-gly-ala-gly)
x-xx(seq id no:27)。如下所述,“xx”可以是在c-端和n-端末端二者处的一个或多个甘氨酸氨基酸残基;且“x”可以是2、3、4、5、10、15、20、30、40、50、100、150、200或之间的任何数字。seq id no:27充当重复“x”次的同源氨基酸重复序列的一个例子,且侧接在c-端和n-端末端二者处的一个或多个甘氨酸氨基酸残基。任何同源氨基酸序列可以侧接在c-端、n-端或两端处的一个或多个甘氨酸氨基酸残基,且在c-端、n-端或两端处的甘氨酸氨基酸残基的数目可以是2、3、4、5、10、15、20、30、40、50、100、150、200或之间的任何数字。
[0053]
在某些方面,鉴定的重组多肽的分子量可以是在10至100kda之间。在某些方面,鉴定的重组多肽的分子量可以是在20至100kda之间。
[0054]
同源氨基酸重复.本文中使用的术语“同源氨基酸重复”或“同源氨基酸重复序列”或“单体”表示包含20种蛋白氨基酸中的任何一种并且线性反复或重复的氨基酸序列。本文中使用的术语“同源氨基酸序列重复”也可以表示itep序列。在某些方面,同源氨基酸重复序列可以重复。同源氨基酸重复序列可以重复2、3、4、5、10、15、20、30、40、50、100、150、200
次或更多次或之间的任何次。在某些方面,同源氨基酸重复可以重复不超过100次。在某些方面,同源氨基酸重复可以重复不超过200次。在另一个方面,同源氨基酸重复可以重复至少20次。在某些方面,同源氨基酸重复序列可以重复20至30次、30至40次、40至50次、50至60次、60至70次、70至80次、80至90次、90至100次、100至110次、或110至120次。
[0055]
在某些方面,同源氨基酸重复序列可以是序列gly-val-leu-pro-gly-val-gly(seq id no:1);gly-ala-gly-val-pro-gly(seq id no:2);val-pro-gly-phe-gly-ala-gly-a1a-gly(seq id no:3);val-pro-gly-leu-gly-ala-gly-ala-gly(seq id no:4);val-pro-gly-leu-gly-val-gly-a1a-gly(seq id no:5);gly-val-leu-pro-gly-val-gly-gly(seq id no:6);gly-val-leu-pro-gly(seq id no:7);gly-leu-val-pro-gly-gly(seq id no:8);gly-leu-val-pro-gly(seq id no:9);gly-val-pro-leu-gly(seq id no:10);gly-ile-pro-gly-val-gly(seq id no:11);gly-gly-val-leu-pro-gly(seq id no:12);gly-val-gly-val-leu-pro-gly(seq id no:14);或gly-val-pro-gly(seq id no:15)。在某些方面,同源氨基酸重复序列可以是序列gly-val-leu-pro-gly-val-gly(seq id no:1)。在某些方面,同源氨基酸重复序列可以是序列gly-ala-gly-val-pro-gly(seq id no:2)。表1列出了同源氨基酸重复序列的实施例。
[0056]
表1.同源氨基酸重复序列
[0057][0058][0059]
在某些方面,同源氨基酸重复序列可以是序列(gly-val-leu-pro-gly-val-gly)
28
(seq id no:13);(gly-val-leu-pro-gly-val-gly)
56
(seq id no:16);或(gly-val-leu-pro-gly-val-gly)
112
(seq id no:17)。
[0060]
在另一个方面,同源氨基酸重复序列不是氨基酸序列:gly-gly-val-pro-gly(seq id no:28)。
[0061]
在某些方面,同源氨基酸重复序列可以包含四个或更多个氨基酸残基。在某些方面,不超过一个脯氨酸可以存在于同源氨基酸重复序列中。同源氨基酸重复序列可以作为天然存在的序列存在于弹性蛋白中。同源氨基酸重复序列还可以天然地侧接在n-端和c-端末端二者处的一个或多个甘氨酸残基。
[0062]
在某些方面,同源氨基酸重复可以是弹性蛋白衍生的。同源氨基酸重复序列可以衍生自小鼠和/或人弹性蛋白。在某些方面,同源氨基酸重复序列可以衍生自小鼠和/或人弹性蛋白,其可以进一步侧接在c-端和n-端末端二者处的一个或多个甘氨酸残基。
[0063]
在某些方面,同源氨基酸重复可以表现出与同源氨基酸重复的某种程度的同一性或同源性,且其中所述同源氨基酸重复可以是seq id no:1-12、14和15中的一个或多个等。同一性程度可以变化,并通过本领域普通技术人员已知的方法来确定。术语“同源性”和“同一性”各自表示两个多肽序列之间的序列相似性。同源性和同一性各自可以通过对比每个序列中的位置来确定,所述位置可以为了对比目的而对齐。当对比的序列中的一个位置被相同的氨基酸残基占据时,则该多肽可以被称作在该位置同一;当等价位点被相同的氨基酸(例如,同一的)或相似的氨基酸(例如,在空间和/或电子性质上相似的)占据时,那么分子可以被称作在该位置同源。序列之间的同源性或同一性的百分比是序列共享的匹配或同源位置的数目的函数。本文描述的重组多肽的同源氨基酸重复序列可以与同源氨基酸重复序列具有至少或约25%、50%、65%、75%、80%、85%、90%、95%、96%、97%、98%或99%同一性或同源性,且其中所述同源氨基酸重复序列可以是seq id no:1-12、14和15中的一个或多个(例如,参见,表1)。
[0064]
在某些方面,本文描述的重组多肽可以进一步包含位于重组多肽的n-端、c-端或n-端和c-端二者处的一个或多个氨基酸残基。一个或多个氨基酸残基可以是甘氨酸、丙氨酸或丝氨酸或其组合。在某些方面,位于重组多肽的n-端、c-端或n-端和c-端二者处的一个或多个氨基酸残基可以是降低免疫原性的任何氨基酸残基。
[0065]
igg结合结构域.本文公开了包含igg结合结构域的重组多肽。在某些方面,重组多肽可以包含共价地结合至igg结合结构域的至少一个同源氨基酸重复序列,该序列可以重复至少两次。
[0066]
在某些方面,公开的重组多肽的igg结合结构域可以衍生自蛋白g。在某些方面,igg结合结构域可以是可结合igg1、igg2、igg3或igg4的序列。本文中使用的术语“衍生自”可以是指“来自”或“基于”。例如,igg结合结构域序列可以衍生自蛋白g序列且是75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同,或是蛋白g基础或原始蛋白g序列的变体或片段。
[0067]
本文中公开了igg结合结构域,其包含以下序列或与以下氨基酸序列具有至少75%同一性:ttyklvingktlkgetttkavdaetaekafkqyandngvdgvwtyddatktftvte(seq id no:18)。在某些方面,igg结合结构域可以包含序列ttyklvingktlkgetttkavdaetaekafkqyandngvdgvwtyddatktftvte(seq id no:18)或其片段或变体。在某些方面,所述变体可以是:ttyklilngktlkgettteavdaataekvfkqyandngvdgewtyddatktftvte(seq id no:19);ttyklvingktlkgettteavdaataekvfkqyandngvdgewtyddatktftvte(seq id no:20);ttyklvingktlkgetttkavdaetaaaafaqyandngvdgvwtyddatktftvte(seq id no:21);ttyklvingktlkgetttkavdaetaaaafaqyarrngvdgvwtyddatktftvte(seq id no:22);或ttyklviagktlkge
ttteavdaataekvfkqyandagvdgewtyddatktftvte(seq id no:29)或其片段或变体。在某些方面,所述片段可以是:tteavdaataekvfkqyandngvdgewtyddatktftvte(seq id no:30);qyandngvdgewtyddatktftvte(seq id no:31);ekvfkqyandngvdgewty(seq id no:32);或ndngvdgewty(seq id no:33)。
[0068]
接头.本文描述的重组多肽可以进一步包含一个或多个接头。在本文公开的组合物或重组多肽内的给定接头可以提供可切割的连接(例如,硫代酸酯键)。可以在本文描述的重组多肽上鉴定可用于连接的位点。在某些方面,在公开的重组多肽中的接头可以包含这样的基团:其可以与igg结合结构域可连接(例如,通过缀合)的重组多肽上的伯胺反应。可用的接头可从商业来源得到。在某些方面,所述接头可以是4-(4-n-马来酰亚胺基苯基)丁酸酰肼盐酸盐(mpbh)。本领域普通技术人员能够选择适当的接头。
[0069]
所述接头可以通过共价键连接至公开的重组多肽。为了形成共价键,可以使用化学反应基团,例如,其具有多种活性羧基(例如酯),其中羟基部分在修饰重组多肽所需的水平上是生理上可接受的。
[0070]
在某些方面,所述一个或多个接头序列可以是肽。在某些方面,所述接头序列可以线性地和连续地重复。例如,接头序列可以重复2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20次。在某些方面,所述接头序列可以是ggggs(seq id no:34)。在某些方面,所述接头序列可以是ggggc(seq id no:35)。在某些方面,所述接头序列可以位于同源氨基酸重复序列和igg结合结构域之间。例如,从n-端至c-端,重组多肽可以包含:共价地结合至接头序列的同源氨基酸重复序列(例如,seq id no:1),所述接头序列可以共价地结合至igg结合结构域;或共价地结合至接头序列的igg结合结构域,所述接头序列可以共价地结合至同源氨基酸重复序列(例如,seq id no:1)。
[0071]
在某些方面,重组多肽可以包含以下氨基酸序列中的任一个:(gvlpgvg)
28-ggggs-ttyklvingktlkgetttkavdaetaekafkqyandngvdgvwtyddatktftvte(seq id no:36);(gvlpgvg)
56-ggggs-ttyklvingktlkgetttkavdaetaekafkqyandngvdgvwtyddatktftvte(seq id no:37);或(gvlpgvg)
112-ggggs-ttyklvingktlkgetttkavdaetaekafkqyandngvdgvwtyddatktftvte(seq id no:38)。
[0072]
在某些方面,本文公开的重组多肽可以进一步包含第二接头序列。在某些方面,所述第二接头序列可以是(ggggc)4(seq id no:39)。在某些方面,所述第二接头必须具有半胱氨酸。所述第二接头可以重复1至20次或之间的任何数字。在某些方面,所述第二接头序列可以位于同源氨基酸重复序列和第一接头序列之间。在某些方面,所述(ggggc)4(seq id no:40)可以位于同源氨基酸重复序列和第一接头序列之间。在某些方面,本文描述的重组多肽可以是(gvlpgvg)
28-(ggggc)
4-ggggs-ttyklvingktlkgetttkavdaetaekafkqyandngvdgvwtyddatktftvte(seq id no:41);(gvlpgvg)
56-(ggggc)
4-ggggs-ttyklvingktlkgetttkavdaetaekafkqyandngvdgvwtyddatktftvte(seq id no:42);或(gvlpgvg)
112-(ggggc)
4-ggggs-ttyklvingktlkgetttkavdaetaekafkqyandngvdgvwtyddatktftvte(seq id no:43)。
[0073]
表2.重组多肽的序列和分子量(mw)的例子。
[0074][0075]a括弧后的下标是括弧中重复序列的数目。将“ggggs”序列(seq id no:34)插入在ibd前面以增加灵活性。
[0076]
治疗剂.本文中公开了进一步包含一种或多种治疗剂的重组多肽。可以将多种治疗剂与本文公开的重组多肽一起掺入、缔合或连接。多种治疗剂可以与本文描述的重组多肽序列连接、结合(例如,非共价)或缔合。在某些方面,可以将治疗剂间接地或直接地掺入本文公开的重组多肽中。所述治疗剂可以是肽、抗体或其片段、抗体-药物缀合物或fc-融合
蛋白。治疗剂也可以是化学化合物、蛋白、肽、小分子或细胞。治疗剂的例子包括、但不限于肽疫苗、抗体、核酸(例如,sirna)和基于细胞的试剂(例如,干细胞、car-t细胞)。在某些方面,治疗剂可以是igg或其片段。在某些方面,一种或多种治疗剂可以是抗癌剂。抗癌剂可以是抗体或其片段,或作为抗体-药物缀合物或fc-融合蛋白的具有抗癌性能的部分的抗体。在某些方面,所述抗癌剂可以是抗-pd-1抗体、抗-pd-l1抗体或抗-ctla-4抗体。在某些方面,所述抗-pd-1抗体可以是纳武单抗、派姆单抗或西米普利单抗。在某些方面,所述抗-pd-l1抗体可以是阿维鲁单抗、度伐单抗或阿特朱单抗。在某些方面,所述抗-ctla-4抗体可以是伊匹木单抗。在某些方面,所述抗癌剂可以是抗癌抗体或其片段、抗癌fc-融合体,或可以是抗体药物-缀合物的部分的抗癌抗体。抗癌抗体或其片段的例子包括、但不限于奥法木单抗(抗-cd20)、贝伐珠单抗(抗-vegf)、blinatumumab(抗-cd3和cd19)、雷莫芦单抗(抗-vegfr2)、达雷木单抗(抗-cd38)、依洛珠单抗(抗-slamf7)、西妥昔单抗(抗-egfr)、阿托珠单抗(抗-cd20)、曲妥珠单抗(抗-her2)、培妥珠单抗(抗-her2)、奈昔木单抗(抗-egfr)、地舒单抗(抗-rankl)、利妥昔单抗(抗-cd20)、司妥昔单抗(抗-il-6)、达妥昔单抗(抗-gd2)、帕木单抗(抗-egfr)和莫加珠单抗(抗-ccr4)。抗癌fc-融合蛋白的例子也包括、但不限于阿柏西普。可以是抗体药物-缀合物的部分的抗癌抗体的例子包括、但不限于吉妥珠单抗奥佐米星、本妥昔单抗、曲妥珠单抗-美坦新偶联物、奥英妥珠单抗和polatuzumab vedotin-piiq。
[0077]
如本文中所述的重组多肽还可以用作支架材料的载体,例如用于细胞粘附和生长,且因此可以用于组织修复或基于细胞的治疗。所述重组多肽也可以用作基质凝胶,例如,以促进体外和体内细胞生长;和作为佐剂。
[0078]
制备重组多肽的方法
[0079]
本文中公开了可以用于生产本文描述的重组多肽的方法。
[0080]
设计.在某些方面,本文描述的包含同源氨基酸重复序列(例如,itep)的重组多肽可以设计为衍生自弹性蛋白的肽的聚合物。包含同源氨基酸重复序列的重组多肽应当在小鼠和人类中是体液上(humorally)耐受的。所选择的重组多肽和同源氨基酸重复序列在本质上不应诱导自身免疫应答(即,所述序列在本质上不应结合b细胞或t细胞受体)。
[0081]
为了降低产生包含免疫原性的同源氨基酸重复序列的重组多肽的可能性,可以采用至少两种策略。首先,在人和小鼠弹性蛋白内常见的现有肽重复序列可以用作同源氨基酸重复序列的组分,以限制产生外在连接序列。第二,当产生一个或多个外在连接序列时,同源氨基酸重复序列应该是四个残基或更长,并且来自弹性蛋白;并且在n-端和c-端侧接一个或多个甘氨酸残基。通过使用更长而不是更短的同源氨基酸重复序列,可以减少外在连接序列的数目。减少或消除外在连接序列可以降低重组多肽或同源氨基酸重复序列的免疫原性。
[0082]
在某些方面,为了使同源氨基酸重复序列具有相变性质,可以将它们设计为具有一个脯氨酸氨基酸残基和一个或多个缬氨酸氨基酸残基。
[0083]
本文公开的重组多肽可以通过常规地用于从核酸产生蛋白或在体外合成多肽的合成方法和重组技术来产生。重组多肽和同源氨基酸重复序列和/或二嵌段聚合物可以以未纯化的或分离的或基本上纯化的形式储存直到以后使用。
[0084]
在某些方面,本文公开的重组多肽可以是重组融合蛋白或二嵌段聚合物。在某些
方面,可以在多种表达系统(例如,大肠杆菌、酵母、昆虫细胞和哺乳动物细胞培养物;和植物)中表达重组多肽。简而言之,可以将编码重组多肽的质粒dna转染进上述任何表达系统的细胞中。在这些系统中的任何一个中产生重组多肽(例如,seq id no:1-seq id no:2)之后,然后也可以将它们纯化、低压冻干和储存直到使用。
[0085]
可以将本文描述的同源氨基酸重复序列修饰成与本文所述的接头在化学上相互作用或包括本文所述的接头。这些重组多肽、同源氨基酸重复序列和肽-接头构建体是在本公开内容的范围内,并且可以与关于完成连接(例如,缀合)至igg结合结构域和/或与治疗剂结合的过程的说明书一起被包装为试剂盒的组件。可以将同源氨基酸重复序列修饰成在n-端、c-端或两端处包括半胱氨酸残基或其它含硫部分(例如,c-sh)。
[0086]
在某些方面,使用本领域普通技术人员已知的方法,可以将治疗剂(例如,igg或抗体)与重组多肽混合。例如,通过移液、轻敲、摇动、涡旋或其它方法,可以将治疗剂(例如,抗体)和重组多肽(例如,itep-ibd)在容器(诸如试管)内的溶液中一起混合。
[0087]
构型.可以独立地选择公开的重组多肽,包括同源氨基酸重复序列、同源氨基酸重复序列的重复次数、igg结合结构域、接头和治疗剂。本领域普通技术人员会理解,组成部分需要以相容的方式缔合。如在本文公开的,本文公开的重组多肽可以用于将治疗剂递送至患者以治疗癌症和自身免疫性疾病。在某些方面,治疗剂可以缀合至重组多肽。在某些方面,重组多肽可以包含共价地连接至igg结合结构域的同源氨基酸重复序列。在某些方面,所述治疗剂可以非共价地缀合至igg结合结构域。通过添加额外的igg结合结构域,可以控制每个重组多肽的治疗剂数目。一个igg结合结构域可以结合(例如,非共价地)一个治疗剂。在某些方面,重组多肽可以包含一个或更多个、或两个或更多个igg结合结构域。因此,重组多肽可以包含两个或更多个治疗剂。例如,包含两个igg结合结构域的重组多肽的线性构型可以是:ibd-itep-ibd、itep-ibd-itep-ibd或ibd-itep-ibed-itep。在某些方面,itep可以是本文公开的任何同源氨基酸重复序列。在某些方面,同源氨基酸重复序列可以是相同的或不同的。在某些方面,所述ibd可以包含本文公开的任何序列。在某些方面,所述ibd可以包含相同的或不同的序列。例如,可以将一个或多个半胱氨酸氨基酸残基添加在同源氨基酸重复序列(例如,itep)的末端之一处,并用作一个或多个igg结合结构域的缀合位点。例如,可以添加八个半胱氨酸残基并为八个igg结合结构域提供八个缀合位点。治疗剂可以是相同的、不同的或其任意组合。当将两个或多个半胱氨酸残基添加到如本文描述的重组多肽的末端时,可以将一个或多个间隔物(例如,甘氨酸残基)插在例如两个半胱氨酸残基之间。根据添加的半胱氨酸残基的数目或所需的治疗分子的数目,可以调整间隔物的数目。间隔物用于提供充足的空间以适应两个或更多个igg结合结构域。间隔物可以是一个或多个甘氨酸或丝氨酸或其组合。可替换地,当在重组多肽中存在超过一个itep序列和/或超过一个ibd时,可以将另外的接头序列掺入重组多肽中。
[0088]
因此,在某些方面,本文公开的重组蛋白和组合物可以包含一种或多种治疗剂。在某些方面,如本文描述的重组多肽(例如,itep)和治疗剂以1∶1(重组多肽∶治疗剂)的比例存在。重组多肽∶治疗剂的比例也可以是2∶2、3∶3、4∶4、5∶5、6∶6、7∶7、8∶8、9∶9、10∶10或其任何其它组合。通过在给定多肽中添加的缀合位点(例如,igg结合结构域或半胱氨酸残基)的数目,可以确定可缀合至本文描述的重组多肽的治疗剂的数目。在某些方面,重组多肽:治疗剂的比例也可以是0.5∶1、1∶1、2∶1、4∶1、8∶1、16∶1、24∶1、32∶1或其任何其它组合。重组多
肽∶治疗剂的比例可以是在0.5∶1(或可替换地,1∶2)至32∶1之间。
[0089]
可以将一个或多个半胱氨酸残基添加在本文描述的重组多肽之间(例如,在两个itep分子或两个同源氨基酸重复序列之间)。通过添加两个或更多个间隔物(例如,甘氨酸残基),可以进一步分离半胱氨酸残基。例如,可以将四个半胱氨酸残基插在二嵌段聚合物(或共聚物或融合蛋白)和igg结合结构域之间。例如,这些半胱氨酸残基可以通过添加八个甘氨酸残基进一步分离。
[0090]
可检测标记.本文描述的重组多肽可以进一步包含一个或多个标记或检测标签(例如,flag
tm
标签、表位或蛋白标签,诸如myc标签、6his和荧光融合蛋白)。在某些方面,所述标记(例如,flag
tm
标签)可以融合至所述重组多肽。在某些方面,公开的方法和组合物进一步包含重组多肽或编码它们的多核苷酸。在不同的方面,所述重组多肽包含至少一个提供表位的氨基酸序列(例如,“表位-标签”),其中所述表位-标签选自:i)添加至蛋白(例如,重组多肽)的n-端和/或c-端的表位-标签;或ii)插入蛋白(例如,重组多肽)的区域中的表位-标签,和替换蛋白(例如,重组多肽)中的许多氨基酸的表位-标签。在某些方面,所述可检测标记可以被称作可检测部分。在某些方面,所述可检测标记或可检测部分可以共价地连接或共价地结合至igg结合结构域。本文中也公开了检测可检测部分的方法。所述方法可以包括给所述受试者施用治疗有效量的如在本文公开的重组多肽,其中所述igg结合结构域共价地或非共价地连接至可检测部分,由此检测所述可检测部分。
[0091]
表位标签是可以针对其产生特异性抗体的短氨基酸链,其在某些方面允许特异性地鉴定和跟踪已添加给活生物体或培养细胞的带标签蛋白。可以使用许多不同的技术来实现带标签分子的检测。这样的技术的例子包括:免疫组织化学、免疫沉淀、流式细胞计量术、免疫荧光显微术、elisa、免疫印迹法(“蛋白质印迹法”)和亲和色谱法。表位标签在主题蛋白上添加已知的表位(例如,抗体结合位点),以提供已知的且经常具有高亲和力的抗体的结合,并从而允许特异性地鉴定和跟踪已添加给活生物体或培养细胞的带标签蛋白。表位标签的例子包括、但不限于myc、t7、gst、gfp、ha(血凝素)、v5和flag标签。前四个例子是衍生自现有分子的表位。相比之下,flag是一种为高抗原性设计的合成的表位标签(参见,例如,美国专利号4,703,004和4,851,341)。表位标签可以具有超出被抗体识别的一种或多种额外功能。
[0092]
在某些方面,公开的方法、重组多肽和组合物包含表位-标签,其中所述表位-标签具有6至15个氨基酸的长度。在一个替代性的方面,所述表位-标签具有9至11个氨基酸的长度。公开的方法和组合物还可以包含含有两个或更多个表位-标签的重组多肽,所述表位-标签被隔开或直接串联。进一步,公开的方法和组合物可以包含2、3、4、5个或甚至更多个表位-标签,只要重组多肽维持其生物活性(例如,“有功能”)。
[0093]
在某些方面,表位-标签可以是vsv-g标签、cd标签、钙调蛋白-结合肽标签、s-标签、avitag、sf-tap-标签、strep-标签、myc-标签、flag-标签、t7-标签、ha(血凝素)-标签、his-标签、s-标签、gst-标签或gfp-标签。这些标签的序列描述在文献中且是本领域技术人员众所周知的。
[0094]
如本文中所述的,术语“免疫学上结合”是抗原表位(例如,表位-标签)与抗体或其片段的抗原特异性部分之间的非共价连接形式。抗体优选是单克隆的,并且必须对所使用的各个表位标签具有特异性。抗体包括鼠、人和人源化抗体。抗体片段是技术人员已知的,
并且尤其包括单链fv抗体片段(scfv片段)和fab-片段。可以通过常规杂交瘤和/或其它重组技术产生抗体。许多抗体是商购可得的。
[0095]
从已知蛋白的结构域或从全蛋白或蛋白和肽构建重组多肽是众所周知的。通常,使用基因工程技术将编码期望的蛋白和/或肽部分的核酸分子连接起来,以产生单个可操作地连接的融合寡核苷酸。适当的分子生物的技术可以参见sambrook等人(molecular cloning:a laboratory manual第二版,cold spring harbor laboratory press,cold spring harbor,ny,usa,1989)。遗传工程改造的多结构域蛋白的例子,包括通过各种接头连接的那些,和含有肽标签的那些,可以参见下述专利文献:美国专利号5,994,104(“interleukin-12fusion protein”);美国专利号5,981,177(“protein fusion method and construction”);美国专利号5,914,254(“expression of fusion polypeptides transported out of the cytoplasm without leader sequences”);美国专利号5,856,456(“linker for linked fusion polypeptides”);美国专利号5,767,260(“antigen-binding fusion proteins”);美国专利号5,696,237(“recombinant antibody-toxin fusion protein”);美国专利号5,587,455(“cytotoxic agent against specific virus infection”);美国专利号4,851,341(“immunoaffinity purification system”);美国专利号4,703,004(“synthesis of protein with an identification peptide”);和wo 98/36087(“immunological tolerance to hiv epitopes”)。
[0096]
官能化肽部分(表位-标签)在主题重组多肽内的放置可以受官能化肽部分的活性以及在融合体中维持至少实质性重组多肽(诸如tcr)生物活性的需要的影响。放置官能化肽的两种方法是:n-端,以及在蛋白部分内表现出易于插入的位置。虽然这些不是可以在其中插入官能化肽的唯一位置,但它们充当好例子,并将用作说明。可以如下鉴定其它合适的插入位置:将试验肽编码序列(例如,编码flag肽的序列)插入构建体的不同位置,然后使用对于用于构建重组多肽的特定部分而言合适的测定法测定所得融合体的适当生物活性和官能化肽活性。使用各种已知技术中的任何一种,包括本文所述的那些,可以测量主题重组多肽的活性。
[0097]
可以容易地修改与生产本文公开的重组多肽的方法有关的本文公开的方法以生产重组多肽的药学上可接受的盐。包括这样的盐的药物组合物和施用它们的方法是在本公开内容的范围内。
[0098]
药物组合物
[0099]
本文公开了包含本文公开的重组多肽的药物组合物。本文还公开了包含重组多肽和药学上可接受的载体的药物组合物。在某些方面,治疗剂可以是抗癌剂或可以用于治疗自身免疫性疾病的药剂。在某些方面,治疗剂可以是抗体或其片段、作为抗体-药物缀合物或fc-融合蛋白的一部分的抗体。在某些方面,药物组合物可以配制用于胃肠外施用、皮下施用或直接注射。在某些方面,通过注射施用可以涵盖向一个或多个疾病部位(例如,肿瘤)直接施用本文公开的任何组合物,所述组合物包括任何重组多肽(包括非共价地结合至治疗剂的重组多肽)。本公开内容的组合物还含有治疗有效量的如本文描述的重组多肽。组合物可以配制用于通过多种施用途径中的任一种施用,并且可以包括一种或多种生理学上可接受的赋形剂,其可以根据施用途径而变化。本文中使用的术语“赋形剂”是指任何化合物或物质,包括也可以被称作“载体”或“稀释剂”的那些。在某些方面,本文公开的组合物和重
组多肽可以进一步包含天然聚合物、佐剂、赋形剂、防腐剂、吸收延迟剂、填充剂、粘结剂、吸收剂、缓冲剂或其组合。制备药物和生理上可接受的组合物在本领域中被认为是常规的,且因此,如果需要,本领域普通技术人员可以咨询许多权威机构以获得指导。
[0100]
本文公开的药物组合物可以制备用于口服或胃肠外施用。制备用于胃肠外施用的药物组合物包括制备用于静脉内(或动脉内)、肌肉内、皮下、腹膜内、透粘膜(例如,鼻内、阴道内或直肠)或透皮(例如,局部)施用的那些。气雾剂吸入也可以用于递送重组多肽。因此,可以制备用于胃肠外施用的组合物,其包括溶解或悬浮在可接受载体中的重组多肽,所述载体包括、但不限于水性载体,诸如水、缓冲水、盐水、缓冲盐水(例如,pbs)等。被包含的一种或多种赋形剂可以帮助接近生理条件,诸如ph调节剂和缓冲剂、张度调节剂、润湿剂、去污剂等。当组合物包含固体组分时(只要它们可以用于口服施用),一种或多种赋形剂可以充当粘结剂或填充剂(例如,用于配制片剂、胶囊剂等)。当组合物被配制用于施用于皮肤或粘膜表面时,一种或多种赋形剂可以是用于配制乳膏剂、软膏剂等的溶剂或乳化剂。可以施用本文公开的任何组合物,使得组合物在注射后变为贮库。例如,在注射之前,本文公开的任何组合物(例如,本文公开的重组多肽,包括治疗剂)可以是在可溶性溶液中。在注射到例如组织中后,组合物会变化并形成贮库。与单独治疗剂的施用相比,可以形成的贮库可以将治疗剂保留在组织中更久。
[0101]
药物组合物可以是无菌的并通过常规灭菌技术进行灭菌或无菌过滤。可以将水溶液包装用于按原样使用或低压冻干,被本公开内容涵盖的低压冻干制品可以在施用前与无菌的水性载体组合。药物组合物的ph通常将在3至11之间(例如,约5至9之间)或6至8之间(例如,约7至8之间)。可以将得到的固体形式的组合物包装在多个单剂量单元中,每个单元含有固定量的上述药剂,诸如在片剂或胶囊剂的密封包装中。也可以将固体形式的组合物以灵活数量包装在容器中,诸如在为可局部应用的乳膏剂或软膏剂设计的可挤压管中。
[0102]
治疗方法
[0103]
本文公开了治疗具有癌症的患者的方法,所述方法包括给所述患者施用治疗有效量的包含本文公开的任何重组多肽的药物组合物。
[0104]
本文公开了治疗具有癌症的患者的方法,所述方法包括:(a)鉴定需要治疗的患者;和(b)给所述患者施用治疗有效量的包含本文公开的任何重组多肽的药物组合物。
[0105]
本文公开了治疗具有自身免疫性疾病的患者的方法,所述方法包括给所述患者施用治疗有效量的包含本文公开的任何重组多肽的药物组合物。本文公开了治疗具有自身免疫性疾病的患者的方法,所述方法包括:(a)鉴定需要治疗的患者;和(b)给所述患者施用治疗有效量的包含本文公开的任何重组多肽的药物组合物。
[0106]
本文中公开了治疗具有癌症的受试者的方法。本文中公开了治疗具有自身免疫性疾病的受试者的方法。本文中公开了治疗任何疾病或障碍的方法,其中要施用给具有疾病或障碍的受试者的治疗剂是抗体或其片段。在某些方面,所述疾病或障碍可以包括、但不限于炎症、自身免疫性疾病、感染性疾病、血液疾病、心血管疾病、代谢疾病、骨疾病、肌肉疾病、疼痛、眼科学疾病等。
[0107]
在某些方面,所述方法可以包括给所述受试者施用治疗有效量的本文公开的药物组合物。在某些方面,所述方法可以进一步包括在施用步骤之前鉴定需要治疗的受试者。
[0108]
本文中公开了在有此需要的受试者中减小肿瘤大小的方法。在某些方面,所述方
法可以包括给所述受试者施用有效量的包含本文公开的任何重组多肽的组合物。在某些方面,所述igg结合结构域可以非共价地结合至治疗剂,由此减小肿瘤大小。在某些方面,所述肿瘤可以是恶性肿瘤。在某些方面,所述恶性肿瘤可以是乳腺癌、卵巢癌、肺癌、结肠癌、胃癌、头颈癌、胶质母细胞瘤、肾癌、宫颈癌、腹膜癌、肾癌、胰腺癌、脑癌、脾癌、前列腺癌、泌尿道上皮癌、皮肤癌、骨髓瘤、淋巴瘤或白血病。
[0109]
本文中也公开了给受试者施用缀合至重组多肽的治疗剂的方法。在某些方面,重组多肽可以包含共价地连接至igg结合结构域的同源氨基酸重复序列,其中所述治疗剂非共价地缀合至所述igg结合结构域。在某些方面,所述缀合物可以通过直接注射进行施用。在某些方面,当将治疗剂以缀合形式作为缀合物施用给受试者时,与以未缀合形式以相同的方式施用给受试者的相同量的治疗剂相比,在受试者中实现以下至少一种:(i)治疗剂的生物利用度更大;(ii)治疗剂的半衰期更大,(iii)治疗剂的全身毒性更小。
[0110]
本文中也公开了在受试者中增加治疗剂的效力或增加治疗剂的半衰期的方法。在某些方面,所述方法可以包括给所述受试者施用非共价地缀合至重组多肽的治疗剂,其中所述重组多肽包含共价地连接至igg结合结构域的同源氨基酸重复序列,其中所述治疗剂非共价地缀合至所述igg结合结构域,且其中通过直接注射施用所述缀合物,由此可以增加治疗剂的效力或半衰期。在某些方面,可以将所述缀合物直接注射进肿瘤或癌症或疾病的部位。
[0111]
在某些方面,可以将缀合物以治疗有效量施用给受试者。在某些方面,可以通过胃肠外注射将缀合物施用给受试者。在某些方面,可以将缀合物皮下施用给受试者。在某些方面,与以未缀合形式施用给受试者的相同量的治疗剂相比,可以增强治疗剂在受试者中的体内效力。
[0112]
可以将上述药物组合物配制成包括治疗有效量的本文公开的任何重组多肽。治疗性施用涵盖预防性应用。基于遗传试验和其它预后方法,在患者对某种癌症或自身免疫性疾病具有临床上确定的倾向或增加的易感性(在某些情况下,大幅增加的易感性)的情况下,医师在与其患者协商后可以选择预防性施用。
[0113]
可以将本文描述的药物组合物以足以延迟、减少或优选地预防临床疾病发作的量施用给受试者(例如,人患者)。因此,在某些方面,所述患者或受试者可以是人患者或受试者。在治疗应用中,可以将组合物以一定量施用给已经具有或诊断出癌症(或自身免疫性疾病)的受试者(例如,人患者),所述量足以至少部分地改善体征或症状,或抑制病症的症状、其并发症和后果的进展(和优选地阻止)。足以实现此目的的量被定义为“治疗有效量”。药物组合物的治疗有效量可以是实现治愈的量,但该结果只是可以实现的几种结果中的一种。如所指出的,治疗有效量包括提供治疗的量,其中癌症(或自身免疫性疾病)的发作或进展被延迟、阻碍或预防,或癌症(或自身免疫性疾病)或癌症(或自身免疫性疾病)的症状得到改善。一种或多种症状可能不太严重。在已经接受治疗的个体中可以加速康复。本领域普通技术人员通过考虑在年龄、体重和其它一般情况方面的个体差异,可以确定存在于本文所述的组合物中并用在应用于哺乳动物(例如,人类)的本文公开的方法中的一种或多种治疗剂的治疗有效量(如上所述)。在某些方面,所述癌症可以是原发性或继发性肿瘤。在其它方面,所述原发性或继发性肿瘤可以是在患者的乳房、肺、结肠、卵巢、头、颈、皮肤、胃肠道、子宫颈、肾、胰腺、脑、脾、前列腺、泌尿道上皮、淋巴结、血液、腹部上皮细胞、骨髓、免疫细胞
(例如,脾、淋巴细胞、胸腺)内。
[0114]
本文公开了治疗具有癌症的患者的方法。所述癌症可以是任何癌症。在某些方面,所述癌症可以是实体癌。在某些方面,所述实体癌可以是肺癌、结肠癌、乳腺癌、脑癌、肝癌、前列腺癌、脾癌、肌癌、卵巢癌、胰腺癌、皮肤癌和黑素瘤。在某些方面,所述癌症可以是乳腺癌、卵巢癌、肺癌、结肠癌、胃癌、头颈癌、胶质母细胞瘤、肾癌、宫颈癌、腹膜癌、肾癌、胰腺癌、脑癌、脾癌、前列腺癌、泌尿道上皮癌、皮肤癌、骨髓瘤、淋巴瘤或白血病。在一个方面,所述癌症可以是转移灶。
[0115]
本文公开了治疗具有自身免疫性疾病的患者的方法。所述自身免疫性疾病可以是任何自身免疫性疾病或障碍。在某些方面,所述自身免疫性疾病或障碍可以是非霍奇金淋巴瘤、类风湿性关节炎、慢性淋巴细胞白血病、多发性硬化、系统性红斑狼疮、自身免疫性溶血性贫血、单纯性红细胞再生障碍、特发性血小板减少性紫癜、伊文思综合征、血管炎、大疱性皮肤障碍、1型糖尿病、舍格伦综合征、德维克病或格雷夫斯病眼病。
[0116]
对该用途有效的量可以取决于癌症(或自身免疫性疾病)的严重程度和受试者的体重以及一般状态和健康,但通常范围为每名受试者每个剂量从约0.05μg至约1000mg(例如,1-15mg/kg)等效量的重组多肽。初始施用和加强施用的合适方案以下面为代表:初始施用,然后通过随后施用以一个或多个小时、天、周或月间隔重复剂量。例如,与每个剂量的未结合的或游离的治疗剂相比,受试者可以接受在约0.05μg至1,000mg等效剂量的范围内的包含治疗剂的重组多肽,每周一次或多次(例如,每周2、3、4、5、6或7或更多次)。例如,受试者可以每周接受0.1μg至2,500mg(例如,2,000、1,500、1,000、500、100、10、1、0.5,或0.1mg)剂量。受试者还可以每二或三周一次接受在每个剂量0.1μg至3,000mg范围内的本文公开的重组多肽。受试者还可以每周接受2mg/kg(基于重组多肽或免疫原性生物缀合物的任何部分或组分的重量来计算重量)。
[0117]
本文公开的药物组合物中的重组多肽的总有效量可以作为单剂量施用给哺乳动物,无论是作为推注还是通过在相对短的时间段内输注,或者可以使用分次治疗方案进行施用,其中在更长的时间段内施用多剂量(例如,每4-6、8-12、14-16或18-24小时一剂,或每2-4天、1-2周,或每个月一次)。可替换地,足以在血液中维持治疗有效浓度的连续静脉内输注也在本公开内容的范围内。
[0118]
因为本公开内容的重组多肽在血清和血流中可以是稳定的,并且在一些情况下更具体而言,包括任何单独组分的重组多肽的剂量可以低于(或高于)未结合时的任何单独组分的有效剂量或治疗有效量。因此,在某些方面,相对于当治疗剂(例如,抗癌剂)单独施用或不作为重组多肽的一部分(或不与其结合)施用时,当作为重组多肽的一部分(或与其结合(例如,非共价结合))施用时,所施用的治疗剂(例如,抗癌剂)可以具有增加的效力或减少的副作用。在某些方面,与单独施用的或不与重组多肽结合的治疗剂相比,当与重组多肽(例如,与其非共价结合)一起施用时,治疗剂可以具有增加的半衰期。
[0119]
在某些方面,本文公开的药物组合物可以与第二种和不同的药物组合物或疗法的施用一起(同时、在其之前或在其之后)施用或与其组合。第二种药物组合物或疗法可以取决于治疗方案以及癌症的类型和严重程度或自身免疫性疾病的类型和严重程度。在某些方面,所述第二种药物组合物或疗法可以是化学疗法。
[0120]
实施例
[0121]
实施例1:用于持续局部递送免疫检验点抗体的免疫耐受的弹性蛋白样多肽(itep)
[0122]
摘要.为了解决与免疫检验点抗体的全身施用相关的挑战,开发了基于免疫耐受的弹性蛋白样多肽(itep)的系统以改善免疫检验点抗体的局部递送。由于itep的相变性质,热敏递送系统可以在注射部位形成缓释贮库。为了将抗体连接到贮库,将igg结合结构域(ibd)融合至itep。本文所述的结果证实,itep-ibd多肽可以延长抗体的释放并增加抗体在局部注射部位的保留时间。通过控制itep-ibd多肽的设计,可以在约17.2至约74.9小时内微调抗体的释放半衰期。使用黑素瘤作为疾病模型,结果表明,itep-ibd多肽将抗体在肿瘤中保留超过72小时。并且,itep-ibd多肽减少了在其它器官和血液循环中的抗体暴露,从而降低了副作用的风险。这些结果提示,itep-ibd多肽可以用作在具有癌症的受试者中局部递送免疫检验点抗体的平台。
[0123]
itep-ibd捕集igg并且不影响igg的结合功能.首先将ibd融合到具有不同分子量(mw)的三种不同itep:itep
28
(seq id no:13)、itep
56
(seq id no:16)和itep
112
(seq id no:17)(表2)。接下来,试验了每种itep-ibd多肽的转变温度(tt)(图1a和1b)。在相同浓度,itep
56-ibd(seq id no:36)的转变温度高于itep
112-ibd(seq id no:37)而低于itep
28-ibd(seq id no:38),这揭示了itep-ibd的分子量和转变温度之间的关系:分子量越高,转变温度越低。结果还表明,每种itep-ibd融合多肽的转变温度与浓度呈函数关系:浓度越高,转变温度越低。总之,itep-ibd多肽的转变温度应低于37℃,使得itep-ibd多肽在注入组织后可以转化为不溶相并形成贮库。接下来,检查了itep-ibd多肽是否可以在贮库处捕集igg。在该实验中,将itep-ibd多肽和igg的混合物在37℃温育以形成贮库。然后收集贮库以分析所含igg的量。发现贮库中igg的比例取决于两个因素:itep-ibd多肽的分子量和itep-ibd多肽与igg的摩尔比(图1c)。当itep
28-ibd与igg的比例为8或更高时,约55%的igg是在贮库中。对于itep
56-ibd和itep
112-ibd,当比例为8或更高时,约90%的igg是在贮库中。这些结果提示,通过控制itep-ibd多肽的比例和分子量可以微调贮库中的igg。由于itep-ibd多肽可以结合igg,因此评估了itep-ibd多肽是否干扰抗体的靶标结合能力。对于该研究,将抗-pd-1(αpd-1)抗体用作模型抗体。el4细胞,即一种在细胞表面上表达pd-1的细胞系,也被用作靶细胞。如流式细胞计量术结果(图1d和1e)所示,与itep
112-ibd结合后,αpd-1抗体仍可以结合el4细胞上的pd-1,类似于游离的αpd-1抗体。这些结果提示,itep-ibd多肽不影响抗体的靶标结合能力。
[0124]
itep-ibd多肽持续释放igg.由于itep-ibd融合多肽可以将igg捕集在贮库中,然后检查了igg从贮库中的释放。首先在体外用两种释放缓冲液试验了igg释放:pbs和100%小鼠血清。发现在前100小时内igg的突释,随后在长时间内稳定释放(图2a)。突释可能来自被释放缓冲液快速浸没的贮库表面的结合igg。稳定释放可能来自贮库内部的结合igg,因为释放缓冲液需要更长的时间才能穿透贮库。在小鼠血清中的突释比在pbs中更明显,这可能是因为血清中存在的蛋白酶促进了贮库的降解。研究发现,蛋白酶导致血清中蛋白和肽的蛋白水解降解,且蛋白酶抑制剂可以减少降解(j.yi,等人,j proteome res 6(5)(2007)1768-81;和r.bottger,等人,plos one 12(6)(2017)e0178943)。此外,血清中的小鼠igg可能与结合的igg竞争对itep-ibd多肽的结合,并在贮库处替代结合的igg。这种替代可能加速igg释放,并且是血清中突释的另一个原因。接下来,在体内检查了在注射部位处的igg释
放。在该实验中,将游离igg或itep
112-ibd和igg的混合物(itep
112-ibd/igg)皮下注射到小鼠体内,并观察在注射部位处剩余的igg随时间的变化。结果表明,itep
112-ibd将igg在注射部位保留超过96小时,与此相比,游离igg在24小时后从注射部位消失(图2b)。随着时间的推移,对在注射部位处的剩余igg的荧光强度进行量化(图2c),并将不同的数学模型用于分析igg的释放动力学(图7)。如不同模型的决定系数所示(表3),发现一阶模型最佳地描述体内igg和itep
112-ibd/igg的释放特性。因此,将一阶模型用于在其它实验中分析igg释放。基于一阶模型的分析,igg和itep
112-ibd/igg的释放半衰期分别为7.1
±
1.0h和20.7
±
1.1h(图2c)。还对比了注射后igg的血浆浓度。当单独皮下注射igg时,igg的血浆浓度远高于当与itep
112-ibd一起注射igg时的血浆浓度(图4.2d)。itep
112-ibd/igg的曲线下面积(auc)(106.9μg/ml/h)比游离igg的auc(1402.7μg/ml/h)低13倍。该数据表明,itep
112-ibd可以减少抗体的全身暴露,这可能降低抗体治疗的副作用的风险。并且,研究了itep
56-ibd/igg和itep
28-ibd/igg在体内的释放(图3a)。基于释放动力学(图2c和3b),itep
112-ibd/igg和itep
56-ibd/igg具有相似的释放半衰期(分别为20.7
±
1.1h和23.2
±
2.2h),而itep
28-ibd/igg具有较短的释放半衰期(17.2
±
2.4h),这是因为itep
28-ibd的tt高于itep
112-ibd和itep
56-ibd(图1b)。
[0125]
表3.用于分析igg和itep
112-ibd/igg的释放动力学的不同模型的决定系数(r2)。
[0126][0127]
itep-ibd融合蛋白的交联影响igg的释放.一项先前的研究表明,分子间交联会影响itep的稳定性(s.dong,等人,theranostics 6(5)(2016)666-78)。因此,试验了itep-ibd多肽的交联是否可以增加贮库的稳定性,从而影响igg从贮库的释放速率。为了交联itep-ibd多肽,在itep和ibd之间引入半胱氨酸残基(表1),并将新的多肽命名为itep-c-ibd。半胱氨酸残基被设计成在氧化条件下形成分子间二硫键,从而交联itep-c-ibd多肽。在生成itep
28-c-ibd、itep
56-c-ibd和itep
112-c-ibd后,试验了它们的tt(图4a和4b)。观察到,加入半胱氨酸残基后tt下降:itep-c-ibd多肽的tt低于相应itep-ibd多肽的tt(图1b和4b)。与itep
28-ibd相比,itep
28-c-ibd的tt下降了3-10℃。还检查了itep-c-ibd贮库中igg的百分比。与itep
28-ibd相比,itep
28-c-ibd在贮库中捕集更高百分比的igg(图1c和4c)。与此同时,itep
56-c-ibd和itep
112-c-ibd分别在贮库中捕集与itep
56-ibd和itep
112-ibd相似百分比的igg(图1c和4c)。然后,在体内检查了itep
28-c-ibd/igg、itep
56-c-ibd/igg和itep
112-c-ibd/igg的释放(图4d)。itep
56-c-ibd/igg具有与itep
112-c-ibd/igg相似的释放半衰期(分别为27.9
±
2.1h和26.1
±
2.0h),和比itep
28-c-ibd/igg(23.2
±
1.7h)更长的释放半衰期(图4e)。并且,itep-c-ibd/igg混合物的释放半衰期长于其相应的itep-ibd/igg混合物的释放半衰期(图2c、3b和4e)。这些结果证实,itep-ibd多肽的交联可以增加igg的释放半衰期。
cancer immunotherapy with reduced evidence of systemic autoimmunity,cancer immunol immunother 57(8)(2008)1263-70;d.w.grainger,expert opin biol ther4(7)(2004)1029-44;和a.marabelle,等人,clin cancer res 19(19)(2013)5261-3)。但是,抗体在局部注射部位的保留时间很短(f.wu,等人,pharm res29(7)(2012)1843-53),这限制了治疗潜力并且需要频繁注射(d.schweizer,等人,eur j pharm biopharm 88(2)(2014)291-309)。因此,需要开发可以在注射部位保留抗体更长时间的抗体递送系统。如本文所述,开发了基于itep-ibd的系统,其可以在注射后在体温形成贮库。使用开发的基于itep-ibd的系统,抗体通过其与ibd的结合被捕集到贮库。然后,贮库可以长时间控制抗体释放。
[0131]
基于itep-ibd的系统的一个特别特征是,可以控制抗体释放速率。本文所述的结果表明,可以使用三种方法来控制igg释放速率。首先,itep-ibd多肽的分子量可以影响转变温度,从而调节igg释放速率。对比了itep
28-ibd/igg混合物、itep
56-ibd/igg混合物和itep
112-ibd/igg混合物,结果表明itep
56-ibd/igg混合物和itep
112-ibd/igg混合物具有类似的igg释放半衰期,两者都比itep
28-ibd/igg混合物更长。itep
28-ibd/igg混合物的igg释放半衰期更短,因为itep
28-ibd多肽的转变温度更高。itep
112-ibd多肽的转变温度略低于itep
56-ibd多肽,但它们具有类似的igg释放半衰期,这可能因为转变温度的微小差异不会导致释放半衰期的显著差异。其次,itep-ibd多肽的交联可以影响igg释放速率。itep-c-ibd多肽被设计成含有半胱氨酸残基,使得分子间二硫键可以交联itep-c-ibd多肽。结果表明,itep-c-ibd/igg混合物的igg释放半衰期长于对应的itep-ibd/igg混合物。分子间交联可以提高体内贮库的稳定性,从而增加释放半衰期。第三种调节igg释放的方法是控制itep-c-ibd多肽与igg的比例。在32∶1的比例itep-c-ibd/igg混合物的igg释放半衰期比在8∶1的比例的半衰期更长,这表明通过增加itep-c-ibd多肽与igg的比例可以提高igg释放半衰期。将该比例从8∶1增加到32∶1没有显著增加itep
28-c-ibd/igg混合物的半衰期(分别为23.2
±
1.7h和24.0
±
2.7h)。该结果的原因可能归因于itep
28-c-ibd多肽的转变温度。随着itep-c-ibd多肽的浓度增加,itep
56-c-ibd多肽和itep
112-c-ibd多肽的转变温度均降低,但itep
28-c-ibd多肽的转变温度没有变化(图4b)。与浓度无关的转变温度可以解释为什么该比例的增加没有显著影响itep
28-c-ibd/igg混合物的释放半衰期。同时,itep
56-c-ibd/igg混合物和itep
112-c-ibd/igg混合物的释放半衰期在8∶1的比例是类似的(分别为27.9
±
2.1h和26.1
±
2.0h),但在32∶1的比例差异很大(分别为38.3
±
5.8h和74.9
±
15.2h)。这种差异的根本原因尚不清楚。itep
112-c-ibd多肽具有与itep
56-c-ibd多肽相比更低的转变温度和更长的长度。对所述差异的一种可能解释是,更低的转变温度和更长的长度在32∶1的比例比在8∶1的比例更显著地增强半衰期。
[0132]
通过组合这三种方法,可以将igg释放半衰期控制在约16至约64小时。具有可调释放速率的抗体递送系统是合乎需要的。急性疾病(如感染)和慢性症状(如类风湿性关节炎)可能需要不同的抗体释放速率。即使对于相同类型的疾病,疾病的不同阶段也可能需要特定的抗体释放率。这些数据提示,基于itep-ibd的系统代表了一种可调节的平台以满足不同疾病和不同疾病状态的不同需求。
[0133]
本文所述的结果证实,itep
112-c-ibd多肽可以将抗体保留在肿瘤中超过72小时。在该实验中,使用了对肿瘤细胞不具有靶标结合能力的人igg,因为该实验的目的是检查itep
112-c-ibd多肽如何影响抗体在肿瘤中的保留。如果抗体可以结合肿瘤细胞上的膜靶
cell 9(1)(2018)63-73;和s.boumazos,cell 158(6)(2014)1243-53)。尚不清楚itep-ibd是否可以影响fc介导的抗体功能。对于一些抗体,诸如αpd-1抗体(r.dahan,等人,cancer cell28(3)(2015)285-95;和t.zhang,等人,cancer immunol immunother 67(7)(2018)1079-90),它们的效应机制不依赖于fc。因此,基于itep-ibd的系统至少可以应用于递送那些抗体,而不会削弱它们的功能。
[0136]
总之,开发了一种用于局部递送抗体的通用系统。该系统可以用于增加治疗效果并减少抗体的副作用。
[0137]
材料和方法.动物和细胞系.体重为19.1
±
1.2g的六周龄雌性balb/c小鼠和体重为17.5
±
1.0g的六周龄雌性c57bl/6小鼠购自jackson laboratory。用补充有10%马血清的dmem培养基培养el4细胞(美国典型培养物保藏中心)。在补充有10%胎牛血清、100μg/ml链霉素和100u/ml青霉素的dmem培养基中培养b16-f10细胞(美国典型培养物保藏中心)。将细胞用95%空气和5%二氧化碳在37℃下培养。
[0138]
基于itep的多肽的表达.合成了编码itep和ibd的dna序列(eurofins genomics)并使用克隆方法插入质粒中(p.wang,等人,theranostics8(1)(2018)223-36;和s.cho,等人,j drug target 24(4)(2016)328-39))。然后将质粒转移到bl21(de3)感受态大肠杆菌细胞中以表达多肽。纯化多肽(s.dong,等人,acta pharmacol sin 38(6)(2017)914-23;和s.dong,等人,mol pharm 14(10)(2017)3312-21)。对于体内研究,多肽中的内毒素水平低于0.25eu/mg(p.wang,等人,biomaterials 182(2018)92-103)。
[0139]
多肽的转变温度的表征.使用紫外-可见分光光度计(varian instruments)在4-50℃的温度范围内监测在不同浓度的每种多肽溶液在350nm的光密度(od350)。将s形剂量-响应非线性回归(graphpad,6.01版)用于拟合od350和温度之间的曲线。曲线的最大一阶导数被确定为转变温度。
[0140]
确定被itep-ibd多肽捕集的igg的百分比.纯度大于97%的人igg购自innovative research。人igg是多克隆的并且包含亚类iggl、igg2、igg3和igg4。通过分级分离从人血浆或血清中纯化人igg。用nhs-荧光素(thermo fisher scientific)标记人igg。将经标记的igg和游离的荧光素通过pd-10脱盐柱用sephadex g-25树脂(ge healthcare)分离两次。将经标记的igg通过使用vivaspin旋转柱(分子质量截止:10,000kda,ge healthcare)的超滤离心进行浓缩。建立了标准曲线,其描绘荧光强度与荧光素标记的igg溶液在pbs中的浓度之间的线性相关性(图8a)。标准曲线中最低igg浓度的荧光信号比背景信号高20倍。将itep、itep-ibd多肽和itep-c-ibd多肽与经标记的igg(1mg/ml)一起以指定的比例在4℃温育过夜。接着,将混合物在37℃温育10分钟,并且然后在20,000g离心10分钟。离心后,将沉淀收集并溶解在pbs溶液中。将溶液转移至96孔板以使用infinite m1000pro微量培养板读数器(tecan)检查荧光强度(激发494nm,发射518nm)。基于标准曲线将荧光强度转换为igg浓度。
[0141]
抗体结合功能测定.el4细胞在细胞表面上表达pd-1,且可以被αpd-1抗体染色。将itep
112-ibd多肽与pe抗-小鼠αpd-1抗体(biolegend,克隆:rmp1-14)一起以2000∶1的比例在4℃温育过夜。然后使用itep
112-ibd/αpd-1混合物和游离的αpd-1抗体对el4细胞进行染色。以前证实,同种型对照抗体不对el4细胞染色,类似于无染色对照(p.zhao,等人,nat biomed eng3(4)(2019)292-305)。因此,在该实验中不包括同种型对照抗体。然后通过流式
细胞计量术对细胞进行计数和分析。被染色的el4细胞的百分比指示itep
112-ibd/αpd-1混合物和游离的αpd-1抗体的靶标结合能力。
[0142]
在体外检查igg释放.将itep
112-ibd多肽和荧光素-标记的igg(1mg/ml)以8∶1的比例和100μl的总体积在4℃温育过夜。然后将itep
112-ibd/igg混合物在37℃温育并离心以收集沉淀。接下来,将沉淀添加到100ul pbs或100%小鼠血清中。小鼠血清从小鼠血液制备,未经过热灭活,保留完整的补体系统和其它血清组分。igg-抗原免疫复合物可以刺激补体系统的经典途径(m.noris,g.remuzzi,semin nephrol 33(6)(2013)479-92)。但是由于在本实验中使用的人igg没有抗原结合能力且不能形成igg-抗原复合物,因此小鼠血清中的补体系统不会被激活或影响igg释放。在每个时间点,取出pbs或小鼠血清以测量荧光强度,从而量化释放的igg。同时,给沉淀加入100μl新的pbs或小鼠血清。在使用如本文所述的标准曲线使用荧光强度来量化小鼠血清中释放的igg之前,减去小鼠血清的荧光背景。
[0143]
在体内检查igg释放.将人igg用磺基-花青7nhs酯(lumiprobe)标记。将游离染料通过pd-10脱盐柱除去,并将经标记的igg用本文所述的vivaspin旋转柱浓缩。将itep-ibd多肽或itep-c-ibd多肽与磺基-花青7-标记的igg一起在4℃温育过夜。然后将itep-c-ibd/igg混合物用0.3%h2o2氧化过夜。将balb/c小鼠剃毛,并在胁腹处皮下注射100μl游离igg(1mg/ml)、itep-ibd/igg混合物(等效量的igg)或itep-c-ibd/igg混合物(等效量的igg)。在本研究中使用的igg用磺基-花青7(一种具有最小自发荧光的近红外染料)标记以降低组织背景(e.a.owens,等人,acc chem res 49(9)(2016)1731-40;和p.s.chan,等人,aaps j 21(4)(2019)59)。在注射后立即开始每24小时通过ivis spectrum(caliper life sciences)对小鼠进行一次成像(激发745nm,发射800nm,曝光1s)。将注射部位的辐射效率通过ivis分析软件进行量化。在量化注射部位的辐射效率之前,调整荧光的标尺以忽略组织自发荧光的影响。随时间变化的辐射效率用于描述体内igg的释放动力学。
[0144]
检测注射的igg的血浆浓度.制作了荧光强度与磺基-花青7-标记的igg的浓度之间的标准曲线(图8b)。在标准曲线中最低igg浓度的荧光信号比背景信号高6倍。给c57bl/6小鼠在胁腹处皮下注射100μl磺基-花青7-标记的igg(1mg/ml)或itep
112-ibd/igg混合物(等效量的igg)。在每个时间点,将来自每只小鼠的三滴血液收集到涂有乙二胺四乙酸(edta)的试管中。然后将试管在20,000g离心10分钟以收集血浆。在pbs中稀释血浆以使用infinite m1000 pro微量培养板读数器(tecan)检查荧光强度(激发750nm,发射773nm)。在通过标准曲线将荧光强度转换为igg浓度之前,减去血浆的荧光背景。
[0145]
确定igg在肿瘤中的保留量和在其它器官中的积累量.给c57bl/6小鼠在胁腹处真皮内注射在50μl pbs中的5
×
105个b16-f10细胞。当肿瘤直径为约0.5cm时,将50μl磺基-花青7-标记的igg(2mg/ml),或itep
112-c-ibd/igg混合物(等效量的igg)直接注射进肿瘤中。在注射后24和72小时,对小鼠实施安乐死。收集肿瘤和其它器官,包括脾、肝、肾和肺。通过ivis spectrum对肿瘤进行成像(激发745nm,发射800nm,曝光1秒)。将收集的肿瘤和器官称重并在pbs中匀浆化。将匀浆物离心以收集上清液并测量荧光强度。从荧光强度减去器官的荧光背景,并通过参考本文所述的标准曲线来量化上清液中igg的量。在即将安乐死之前,还从小鼠收集了血液。将血液在室温保持30分钟,并且然后离心以获得血清。将血清在pbs中稀释以检查荧光强度。从荧光强度减去血清的荧光背景,并通过参考本文所述的标准曲线来量化注射的igg的血清浓度。
[0146]
统计数据.在每个附图图例中描述了每个实验的详细统计数据。未配对的双尾student氏t-检验和单因素方差分析检验用于分析数据。p<0.05被定义为显著差异。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1