用于治疗甲状腺眼病的方法与流程
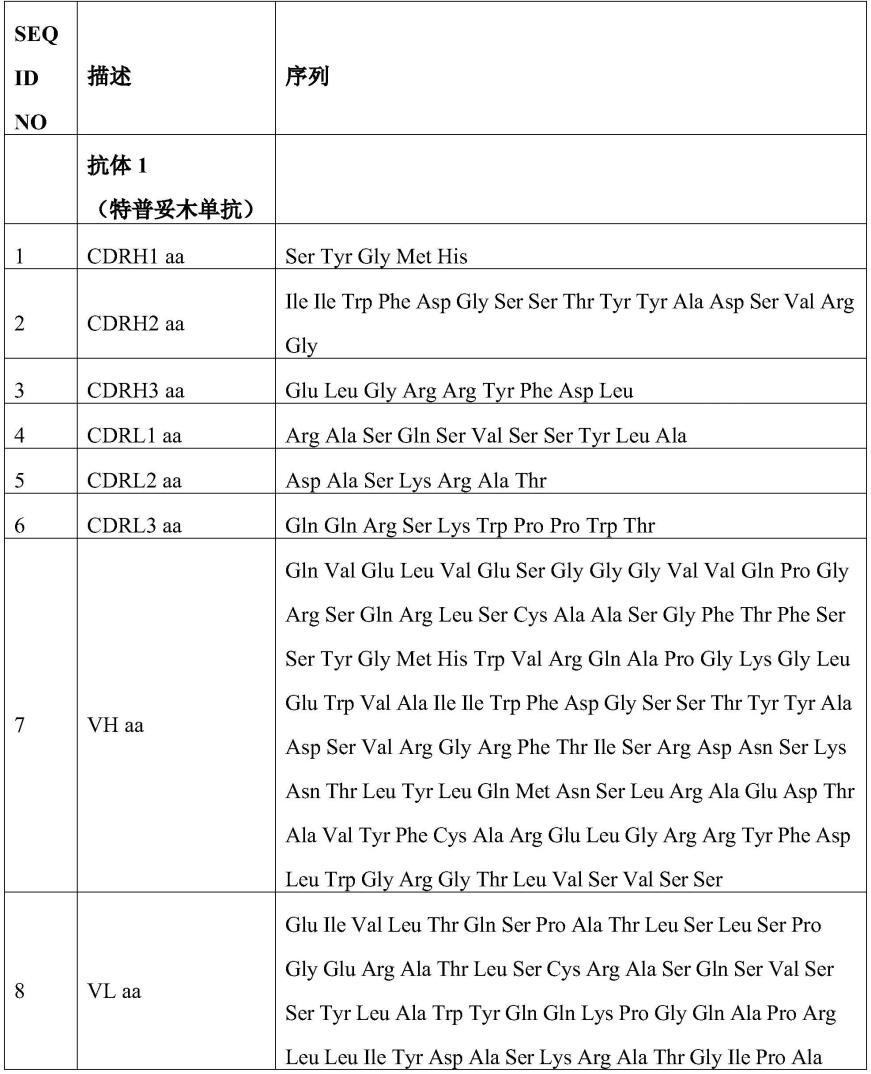
用于治疗甲状腺眼病的方法
1.本技术要求2019年8月28日提交的美国临时申请号62/892,849的权益,其披露内容特此通过援引以其全文并入(就像在本文中书写一样)。
2.甲状腺眼病(ted)也称为甲状腺相关眼病(tao)、格雷夫斯(graves’)眼病或眼眶病(go)、甲状腺毒性眼球突出、甲状腺机能障碍性眼病和若干个其他术语,甲状腺眼病是与甲状腺功能障碍相关的眼眶病。tao被分为两种类型。典型地持续1-3年的活动性ted的特征在于眼眶的软组织中的持续性自身免疫性/炎症性应答。活动性ted造成眼部软组织的扩张和重塑。活动性或急性ted的自身免疫性/炎症性应答自发消退并且病症转变为非活动性ted。非活动性或慢性ted是用于描述活动性ted的长期/永久性后遗症的术语。
背景技术:
3.ted的起因是未知的。ted典型地与格雷夫斯甲状腺机能亢进相关,但也可以作为影响甲状腺并且在眼眶和眶周组织以及很少地在胫前皮肤(胫前粘液性水肿)或足趾(甲状腺杵状指)中产生病变的其他自身免疫性病症的一部分发生。ted是自身免疫性眼眶病,其中眼眶和眼周软组织主要受到对眼睛和视力的继发效应的影响。在ted中,由于眼眶软组织(主要是眼睛肌肉和脂肪)的炎症和扩张,迫使眼睛离开其窝向前(鼓起)-一种称为前垂或眼球突出的现象。
4.根据基于一个主要为农村的明尼苏达州群落的研究,已经估计ted的年发病率为每10万名女性16例,并且每10万名男性2.9例。看起来是女性多数,其中女性受的影响在频率上比男性多2.5-6倍;然而,重度病例在男性中比在女性中更常发生。此外,大多数患者年龄为30-50岁,重度病例看起来在大于50岁的患者中更具经常性。尽管大多数ted病例没有导致视力丧失,但此病症可能引起视力威胁性暴露角膜病变、麻烦的复视(双重视觉)以及压缩性甲状腺机能障碍视神经病变。
5.ted可以在甲状腺机能障碍的全身性并发症之前、与其同时发生或跟随其后。ted的眼部表现包括上眼睑退缩、睑滞后、肿胀、发红(红斑)、结膜炎和眼睛鼓起(眼球突出或前垂)、球结膜水肿、眶周水肿以及具有显著的功能、社交和美容后果的眼部能动性改变。
6.ted的许多体征和症状(包括前垂和眼部充血)由眼眶脂肪组织和眼周肌肉的扩张引起。脂肪组织体积部分由于眼眶脂肪内的新脂肪细胞发育(脂肪生成)而增加。亲水性糖胺聚糖(主要是透明质酸)在眼眶脂肪组织和眼外肌纤维之间的肌束膜结缔组织内的积累进一步扩张了脂肪隔室并且扩大了眼外肌体。透明质酸通过存在于眼眶脂肪和眼外肌内的成纤维细胞产生,并且其在体外的合成通过包括以下的若干种细胞因子和生长因子来刺激:il-1β、干扰素-γ、血小板衍生生长因子、甲状腺刺激激素(tsh)和胰岛素样生长因子i(igf-i)。
7.ted通常被视为格雷夫斯病(gd)的自身免疫性眼眶表现。然而,仅大约30%的患有格雷夫斯甲状腺机能亢进的患者表现出临床相关的眼部病变,这表明病症之间存在机理异种性和差异化。ted的潜在分子机制仍然不清楚。接受的是,在甲状腺刺激激素受体(tshr)上充当激动剂的自身抗体的产生造成格雷夫斯甲状腺机能亢进。tshr的病原性过度刺激导
致甲状腺激素(t3和t4)的过量产生和许多组织的加速代谢。
8.在活动性ted中,自身抗体触发结缔组织和脂肪部分地从刺激透明质酸的过度合成起进行扩张。扩张的组织被t和b细胞浸润、变得发炎、且广泛重塑。已经表明,tshr可能在活动性ted的发展中具有一些病原性作用。实际上,已经在抗tshr抗体与ted活动程度之间发现了正相关性。然而,没有确立明确的联系,并且一部分的ted患者在其整个疾病进程中保持为甲状腺机能正常的。
9.也已经检测到激活胰岛素样生长因子i受体(igf-ir)的抗体并且这些抗体与活动性ted有牵连。不受任何理论的束缚,据信tshr和igf-ir在眼眶成纤维细胞中形成物理和功能性复合物,并且阻断igf-ir看起来减弱igf-i和tsh两者依赖性信号传导。已经表明,使用抗体拮抗剂阻断igf-ir可能降低tshr和igf-i两者依赖性信号传导,且因此中断了在任一种受体上充当激动剂的自身抗体的病理性活动。
10.igf-ir是广泛表达的异四聚体蛋白,该异四聚体蛋白参与许多细胞类型的增殖和代谢功能的调控。它是包含两个亚基的酪氨酸激酶受体。igf-irα含有配体结合结构域,而igf-irβ参与信号传导并且含有酪氨酸磷酸化位点。已经开发针对igf-ir的单克隆抗体并且将其作为若干种类型的实体瘤和淋巴瘤的治疗策略进行评估。
11.对由于格雷夫斯病引起的甲状腺机能亢进的管理是不完美的,因为缺乏靶向疾病的特异性潜在病原性自身免疫机制的疗法。甚至更复杂的是治疗中度至重度活动性ted。尽管近年目睹了对其发病机制的更好理解,但ted仍然是治疗挑战和困境。没有批准的药物用于治疗活动性ted。使用静脉内糖皮质激素(ivgc)和口服糖皮质激素来治疗患有中度至重度活动性ted的患者,但结果很少令人满意。部分应答是经常性的,并且药物停用之后的复发(反弹)不常见。不良事件确实发生,并且许多患者最终需要在其病症已经转变为非活动性ted时进行康复手术。
12.最近,已经将注意力集中于使用生物制剂,这些生物制剂可能特异性干预ted的病原性机制。在2015年,两项小型的单中心随机化临床试验(rct)研究了cd20+b细胞耗尽剂利妥昔单抗(rituximab)分别相对于安慰剂或ivgc的效果。来自两项试验的结果是矛盾的;在第一项试验中,它们是阴性的(与安慰剂没有差异),但在第二项试验中是阳性的(与ivgc可比的有益效果)。因此,利妥昔单抗对中度至重度活动性ted的有效性仍有待确定。最近由欧洲甲状腺协会/欧洲格雷夫斯眼眶病小组(eugogo)发表的指南将利妥昔单抗指示为对ivgc第一疗程的应答性差的患者的可能第二线治疗。与利妥昔单抗一样,没有关于其他潜在治疗剂(诸如阿达木单抗(adalimumab)、依那西普(etanercept)、英夫利昔单抗(infliximab)或者阻断tsh受体的单克隆抗体或小分子)的可靠证据。基于进行中rct,白介素-6受体单克隆抗体托珠单抗(tocilizumab)的使用也仍有待确定。
13.如上所述,已经在充分有力、前瞻性、安慰剂对照试验中证明是有效且安全的中度至重度ted的医学疗法是缺乏的。很少安慰剂对照的先前临床试验表明单独或与放射疗法一起的高剂量糖皮质激素可以减少患有活动性眼病的患者中的炎症相关体征和症状,但仅最低程度地影响前垂并且可能引起剂量限制性不良反应。
14.在患有gd和ted的患者中已经检测到激活igf-ir信号传导的免疫球蛋白。此外,igf-i协同增强促甲状腺素的作用。在发育和代谢中具有作用的跨膜型酪氨酸激酶受体igf-ir也刺激免疫功能,且因此可能在自身免疫性疾病中靶向治疗。在患有gd和ted的人
中,由眼眶成纤维细胞并且由t细胞和b细胞过表达igf-ir。它与tshr形成通过其反式激活的信号传导复合物。眼眶成纤维细胞和纤维细胞的体外研究显示,igf-ir抑制性抗体可以减弱igf-i、促甲状腺素、甲状腺刺激免疫球蛋白和从患有gd和ted的患者分离的免疫球蛋白的作用。这些观察结果促使了全人igf-ir抑制性单克隆抗体特普妥木单抗(teprotumumab)在患有活动性中度至重度ted的患者中的试验。
技术实现要素:
15.本文提供了治疗甲状腺眼病(ted)或降低甲状腺眼病的严重程度并且在治疗ted中实现特定治疗终点诸如减少前垂、复视、ted临床活动度评分及其亚组和单独量度的方法,和改善ted患者的生活质量的方法,这些方法包括向患有ted的受试者施用有效量的胰岛素样生长因子-i受体(igf 1r)抑制剂。
16.某些igf-1r抑制剂能够减少眼眶成纤维细胞和纤维细胞的tshr和igf-ir显示并且减弱igf-i、tsh、甲状腺刺激免疫球蛋白和从患有ted(tao或go)的患者分离的免疫球蛋白的作用。
17.如上所述,ted(tao或go)仍然是未充分治疗的。在批准特普妥木单抗(tepezza
tm
)前,主要由糖皮质激素组成的医学疗法具有有限功效并且呈现安全性问题。熟知的是,用于ed的广泛免疫抑制性治疗(例如糖皮质激素和利妥昔单抗)引起眼球突出的有限减少。在使用三种不同累积剂量的ivgc(2.25g、4.98g、7.47g的甲泼尼龙)的最大rct中,前垂的平均减少是0.6mm,甚至使用最高剂量。使用利妥昔单抗的结果是不同的。此外,ted(tao或go)的晚期病例通常需要更侵入性的手术治疗诸如眼眶减压术。如上所述,用于治疗ted(tao或go)的先前疗法不仅具有有限功效,还具有安全性问题。已经证明igf-1r抑制性单克隆抗体特普妥木单抗在治疗ted方法方面是有效的。
18.如由本领域技术人员所述的,“特普妥木单抗的最惊人和意料不到的作用是治疗相关的眼球突出[即,前垂]的减少。”熟知的是,用于go的免疫抑制性治疗引起眼球突出的有限减少,但在用本文所披露的方法的情况下,眼球突出减少2.46mm的平均值(相对于安慰剂组中的0.15mm)。用任何医学治疗从未实现的这些结果与用眼眶减压术获得的那些结果是可比的”(piantanida,e.和bartalena,l.j endocrinol invest[内分泌研究杂志],2017,40,885-887)。
[0019]
尽管特普妥木单抗对于治疗ted是有效的,但出于各种原因,并非所有患者有益于用特普妥木单抗的治疗。对于ted的替代性疗法,例如对于可以经由替代性方式和根据替代性时间表施用的不同药物仍有未满足的医疗需求。
具体实施方式
[0020]
本文提供了用于治疗甲状腺眼病和相关病症的方法和组合物,如通过以下实施例所说明的。实施例
[0021]
实施例1.一种治疗甲状腺眼病(ted)的方法,该方法包括向受试者施用有效量的胰岛素样生长因子-i受体(igf-1r)抑制剂。
[0022]
实施例2.一种在患有甲状腺眼病(ted)的受试者中将前垂减少至少2mm的方法,该
方法包括向该受试者施用有效量的igf-ir抑制剂。
[0023]
实施例3.如实施例2所述的方法,其中将前垂减少至少3mm。
[0024]
实施例4.如实施例3所述的方法,其中将前垂减少至少4mm。
[0025]
实施例5.如实施例2所述的方法,其中该方法另外包括减少该患有ted的受试者中的临床活动度评分(cas)。
[0026]
实施例6.如实施例5所述的方法,其中将cas减少至少2分。
[0027]
实施例7.如实施例6所述的方法,其中将cas减少至少3分。
[0028]
实施例8.如实施例7所述的方法,其中将前垂减少至少3mm并且将cas减少至少3分。
[0029]
实施例9.一种在患有甲状腺眼病(ted)的受试者中治疗复视或降低复视的严重程度的方法,该方法包括向该受试者施用有效量的胰岛素样生长因子-i受体(igf-1r)抑制剂。
[0030]
实施例10.如实施例9所述的方法,其中该复视是恒定复视。
[0031]
实施例11.如实施例9所述的方法,其中该复视是间歇性复视。
[0032]
实施例12.如实施例9所述的方法,其中该复视是不恒定复视。
[0033]
实施例13.如实施例9-12中任一项所述的方法,其中在停止抑制剂施用之后,复视的严重程度的改善或降低持续至少20周。
[0034]
实施例14.如实施例9-12中任一项所述的方法,其中在停止抑制剂施用之后,复视的严重程度的改善或降低持续至少50周。
[0035]
实施例15.一种在患有甲状腺眼病(ted)的受试者中治疗ted或其症状或降低ted或其症状的严重程度的方法,该方法包括向该受试者施用有效量的胰岛素样生长因子-i受体(igf-1r)抑制剂。
[0036]
实施例16.一种在患有甲状腺眼病(ted)的受试者中在患有ted的受试者中减少眼睛中的前垂的方法,该方法包括向该受试者施用有效量的胰岛素样生长因子-i受体(igf-1r)抑制剂。
[0037]
实施例17.一种在患有甲状腺眼病(ted)的受试者中减少ted的临床活动度评分(cas)的方法,该方法包括向该受试者施用有效量的胰岛素样生长因子-i受体(igf-1r)抑制剂。
[0038]
实施例18.一种在患有甲状腺眼病(ted)的受试者中a)将前垂减少至少2mm并且b)减少临床活动度评分(cas)的方法,该方法包括向该受试者施用有效量的胰岛素样生长因子-i受体(igf-1r)抑制剂。
[0039]
实施例19.如实施例15、16和18中任一项所述的方法,其中将前垂减少至少2mm。
[0040]
实施例20.如实施例19所述的方法,其中将前垂减少至少3mm。
[0041]
实施例21.如实施例20所述的方法,其中将前垂减少至少4mm。
[0042]
实施例22.如实施例15-21中任一项所述的方法,其中将该受试者的临床活动度评分(cas)减少至少2分。
[0043]
实施例23.如实施例22所述的方法,其中将该受试者的临床活动度评分(cas)减少至一(1)。
[0044]
实施例24.如实施例23所述的方法,其中将该受试者的临床活动度评分(cas)减少
至零(0)。
[0045]
实施例25.一种在患有甲状腺眼病(ted)的受试者中改善生活质量的方法,该方法包括向该受试者施用有效量的胰岛素样生长因子-i受体(igf-1r)抑制剂。
[0046]
实施例26.如实施例25所述的方法,其中该生活质量通过格雷夫斯眼病生活质量(go-qol)评估或者其视觉功能或外观分量表来测量。
[0047]
实施例27.如实施例26所述的方法,其中该治疗导致对go-qol的≥8分的改善。
[0048]
实施例28.如实施例26所述的方法,其中该治疗导致对go-qol的功能分量表的改善。
[0049]
实施例29.如实施例26所述的方法,其中该治疗导致对go-qol的外观分量表的改善。
[0050]
实施例30.如实施例1-29中任一项所述的方法,其中该ted是中度至重度ted。
[0051]
实施例31.如实施例1-30中任一项所述的方法,其中该ted是活动性/急性ted。
[0052]
实施例32.如实施例1-30中任一项所述的方法,其中该ted是非活动性/慢性ted。
[0053]
实施例33.如实施例1-32中任一项所述的方法,其中该受试者是已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或者在所述先前治疗之后复发的受试者。
[0054]
实施例34.如实施例1-33中任一项所述的方法,其中该治疗在超过最后一次施用剂量的至少20周内是有效的。
[0055]
实施例35.如实施例34所述的方法,其中该治疗在超过该最后一次施用剂量的至少50周内是有效的。
[0056]
实施例36.如实施例1-35中任一项所述的方法,其中所述igf-1r抑制剂是抗体或小分子,条件是该抗体不是特普妥木单抗。
[0057]
实施例37.如实施例36所述的方法,其中所述igf-1r抑制剂选自甘尼妥单抗(ganitumab)、芬妥木单抗(figitumumab)、medi-573、西妥木单抗(cixutumumab)、达洛妥珠单抗(dalotuzumab)、罗妥木单抗(robatumumab)、ave1642、biib022、珍妥珠单抗(xentuzumab)、艾司妥单抗(istiratumab)、林西替尼(linsitinib)、苦鬼臼脂素、bms-754807、bms-536924、bms-554417、gsk1838705a、gsk1904529a、nvp-aew541、nvp-adw742、gtx-134、ag1024、kw-2450、pl-2258、nvp-aew541、nsm-18、azd3463、azd9362、bi885578、bi893923、tt-100、xl-228和a-928605。
[0058]
实施例38.如实施例36所述的方法,其中所述igf-1r抑制剂是抗体。
[0059]
实施例39.如实施例37所述的方法,其中所述igf-1r抑制剂是适于人疗法的人单克隆抗体、嵌合人单克隆抗体或人源化单克隆抗体。
[0060]
实施例40.如实施例38所述的方法,其中该抗体是静脉内(iv)或皮下(sc)施用的。
[0061]
实施例41.如实施例39所述的方法,其中该抗体是iv施用的。
[0062]
实施例42.如实施例40所述的方法,其中所述抗体选自甘尼妥单抗、芬妥木单抗、medi-573、西妥木单抗、达洛妥珠单抗、罗妥木单抗、ave1642、biib022、珍妥珠单抗和艾司妥单抗。
[0063]
实施例43.如实施例42所述的方法,其中该抗体是甘尼妥单抗。
[0064]
实施例44.如实施例43所述的方法,其中该甘尼妥单抗以下述方式给药:a)1-60mg/kg或75-4500mg,iv,每3周一次;或者
b)0.6-40mg/kg或45-3000mg,iv,每2周一次;或者c)0.3-20mg/kg;或22-1500mg,iv,每周一次。
[0065]
实施例45.如实施例42所述的方法,其中该抗体是芬妥木单抗。
[0066]
实施例46.如实施例45所述的方法,其中该芬妥木单抗以下述方式给药:a)1-60mg/kg或75-4500mg,iv,每3周一次;或者b)0.6-40mg/kg或45-3000mg,iv,每2周一次;或者c)0.3-20mg/kg或22-1500mg,iv,每周一次。
[0067]
实施例47.如实施例42所述的方法,其中该抗体是西妥木单抗。
[0068]
实施例48.如实施例47所述的方法,其中该西妥木单抗以下述方式给药:a)1-45mg/kg或75-3400mg,iv,每3周一次;或者b)0.6-30mg/kg或45-2300mg,iv,每2周一次;或者c)0.3-15mg/kg或22-1200mg,iv,每周一次。
[0069]
实施例49.如实施例42所述的方法,其中该抗体是达洛妥珠单抗。
[0070]
实施例50.如实施例49所述的方法,其中该达洛妥珠单抗以下述方式给药:a)1-90mg/kg或75-6800mg,iv,每3周一次;或者b)0.6-60mg/kg或45-4500mg,iv,每2周一次;或者c)0.3-30mg/kg或22-2300mg,iv,每周一次。
[0071]
实施例51.如实施例42所述的方法,其中该抗体是罗妥木单抗。
[0072]
实施例52.如实施例51所述的方法,其中该罗妥木单抗以下述方式给药:a)1-75mg/kg或75-5700mg,iv,每3周一次;或者b)0.6-50mg/kg或45-3800mg,iv,每2周一次;或者c)0.3-25mg/kg或22-1900mg,iv,每周一次。
[0073]
实施例53.如实施例42所述的方法,其中该抗体是珍妥珠单抗。
[0074]
实施例54.如实施例53所述的方法,其中该珍妥珠单抗以下述方式给药:a)1-112mg/kg或75-8400mg,iv,每3周一次;或者b)0.6-75mg/kg或45-5700mg,iv,每2周一次;或者c)0.3-38mg/kg或22-2900mg,iv,每周一次。
[0075]
实施例55.如实施例42所述的方法,其中该抗体是艾司妥单抗。
[0076]
实施例56.如实施例55所述的方法,其中该艾司妥单抗以下述方式给药:a)1-112mg/kg或75-8400mg,iv,每3周一次;或者b)0.6-75mg/kg或45-5700mg,iv,每2周一次;或者c)0.3-38mg/kg或22-2900mg,iv,每周一次。
[0077]
实施例57.如实施例42所述的方法,其中该抗体是ave1642。
[0078]
实施例58.如实施例57所述的方法,其中该ave1642以下述方式给药:a)1-60mg/kg或75-4500mg,iv,每3周一次;或者b)0.6-40mg/kg或45-3000mg,iv,每2周一次;或者c)0.3-20mg/kg或22-1500mg,iv,每周一次。
[0079]
实施例59.如实施例42所述的方法,其中该抗体是biib022。
[0080]
实施例60.如实施例59所述的方法,其中该biib022以下述方式给药:
a)1-75mg/kg或75-5700mg,iv,每3周一次;或者b)0.6-50mg/kg;或45-3800mg,iv,每2周一次;或者c)0.3-25mg/kg或22-1900mg,iv,每周一次。
[0081]
实施例61.如实施例48所述的方法,其中所述igf-1r抑制剂抗体包含选自下组的至少一条重链和至少一条轻链,该组由以下组成:a)包含seq id no:7的氨基酸序列的重链和包含氨基酸序列seq id no:8的轻链;b)包含seq id no:15的氨基酸序列的重链和包含氨基酸序列seq id no:16的轻链;c)包含seq id no:23的氨基酸序列的重链和包含氨基酸序列seq id no:24的轻链;d)包含seq id no:31的氨基酸序列的重链和包含氨基酸序列seq id no:32的轻链;e)包含seq id no:39的氨基酸序列的重链和包含氨基酸序列seq id no:40的轻链;f)包含seq id no:47的氨基酸序列的重链和包含氨基酸序列seq id no:48的轻链;g)包含seq id no:55的氨基酸序列的重链和包含氨基酸序列seq id no:56的轻链;h)包含seq id no:63的氨基酸序列的重链和包含氨基酸序列seq id no:64的轻链;i)包含seq id no:65的氨基酸序列的重链和包含氨基酸序列seq id no:66的轻链;以及j)包含seq id no:73的氨基酸序列的重链和包含氨基酸序列seq id no:74的轻链。
[0082]
实施例62.如实施例36所述的方法,其中所述igf-1r抑制剂是小分子。
[0083]
实施例63.如实施例61所述的方法,其中所述igf-1r抑制剂是口服给药的。
[0084]
实施例64.如实施例63所述的方法,其中所述igf-1r抑制剂选自林西替尼、苦鬼臼脂素、bms-754807、bms-536924、bms-554417、gsk1838705a、gsk1904529a、nvp-aew541、nvp-adw742、gtx-134、ag1024、kw-2450、pl-2258、nvp-aew541、nsm-18、azd3463、azd9362、bi885578、bi893923、tt-100、xl-228和a-928605。
[0085]
实施例65.如实施例64所述的方法,其中该igf-1r抑制剂是林西替尼。
[0086]
实施例66.如实施例65所述的方法,其中该林西替尼以下述方式给药:a)10-750mg,口服,每日一次,连续给药或10-1500mg/天,每日一次,间歇性给药(每14天中进行长达7天);或者b)6-500mg,口服,每日两次,连续给药或6-1000mg,每日两次,间歇性给药(每14天中进行长达7天);或者c)3-250mg,口服,每日三次,连续给药或3-500mg每日三次,间歇性给药(每14天中进行长达7天)。
[0087]
实施例67.如实施例64所述的方法,其中该igf-1r抑制剂是苦鬼臼脂素。
[0088]
实施例68.如实施例67所述的方法,其中该苦鬼臼脂素以下述方式给药:a)口服,每日一次,20-2000mg;或者b)口服,每日两次,13-1400mg;或者c)口服,每日三次,6-700mg。
[0089]
实施例69.如实施例64所述的方法,其中该igf-1r抑制剂是bms-754807。
[0090]
实施例70.如实施例69所述的方法,其中该bms-754807以下述方式给药:a)每日一次,5-600mg,口服;或者b)每日两次,3-400mg,口服;或者c)每日三次,1-200mg。
[0091]
实施例71.如实施例64所述的方法,其中该igf-1r抑制剂是bms-536924。
[0092]
实施例72.如实施例64所述的方法,其中该igf-1r抑制剂是bms-554417。
[0093]
实施例73.如实施例64所述的方法,其中该igf-1r抑制剂是gsk1838705a。
[0094]
实施例74.如实施例64所述的方法,其中该igf-1r抑制剂是gsk1904529a。
[0095]
实施例75.如实施例64所述的方法,其中该igf-1r抑制剂是nvp-aew541。
[0096]
实施例76.如实施例64所述的方法,其中该igf-1r抑制剂是nvp-adw742。
[0097]
实施例77.如实施例64所述的方法,其中该igf-1r抑制剂是gtx-134。
[0098]
实施例78.如实施例64所述的方法,其中该igf-1r抑制剂是ag1024。
[0099]
实施例79.如实施例64所述的方法,其中该igf-1r抑制剂是pl-2258。
[0100]
实施例80.如实施例64所述的方法,其中该igf-1r抑制剂是nvp-aew541。
[0101]
实施例81.如实施例64所述的方法,其中该igf-1r抑制剂是nsm-18。
[0102]
实施例82.如实施例64所述的方法,其中该igf-1r抑制剂是azd3463。
[0103]
实施例83.如实施例64所述的方法,其中该igf-1r抑制剂是azd9362。
[0104]
实施例84.如实施例64所述的方法,其中该igf-1r抑制剂是bi885578。
[0105]
实施例85.如实施例64所述的方法,其中该igf-1r抑制剂是bi893923。
[0106]
实施例86.如实施例64所述的方法,其中该igf-1r抑制剂是tt-100。
[0107]
实施例87.如实施例64所述的方法,其中该igf-1r抑制剂是xl-228。
[0108]
实施例80.如实施例64所述的方法,其中该igf-1r抑制剂是a-928605。
[0109]
实施例88.如实施例71-88中任一项所述的方法,其中该igf-1r抑制剂以下述方式给药:a)每日一次,1-2000mg,口服;或者b)每日两次,0.6-1400mg,口服;或者c)每日三次,0.3-700mg,口服。
[0110]
实施例89.如实施例64所述的方法,其中该igf-1r抑制剂是kw-2450。
[0111]
实施例90.如实施例90所述的方法,其中该kw-2450以下述方式给药:a)每日一次,1-100mg,口服;或者b)每日两次,0.6-70mg,口服;或者c)每日三次,0.3-30mg,口服。
[0112]
实施例91.如实施例1-30和33-35中任一项所述的方法,其中该ted是非活动性/慢性ted,并且其中该igf-1r抑制剂是特普妥木单抗。
[0113]
本文还提供了用于治疗ted的药物组合物,这些药物组合物包含igf-1r抑制剂。
[0114]
实施例92.一种药物组合物,该药物组合物包含一定量的胰岛素样生长因子-i受体(igf-1r)抑制剂,该量对于以下是治疗有效的:-治疗甲状腺眼病(ted)或其症状或降低甲状腺眼病或其症状的严重程度;-在患有甲状腺眼病(ted)的受试者中将前垂减少至少2mm-在患有甲状腺眼病(ted)的受试者中治疗复视或降低复视的严重程度;-减少甲状腺眼病(ted)的临床活动度评分(cas);-在患有甲状腺眼病(ted)的受试者中a)将前垂减少至少2mm并且b)减少临床活动度评分(cas);和/或-在患有甲状腺眼病(ted)的受试者中改善生活质量,其中该生活质量通过格雷夫斯眼病生活质量(go-qol)评估或者其视觉功能或外观分量表来测量。
[0115]
实施例93.如实施例92所述的药物组合物,其中该igf-1r抑制剂是甘尼妥单抗,被配制用于以下述方式施用:a)1-60mg/kg或75-4500mg,iv,每3周一次;或者b)0.6-40mg/kg或45-3000mg,iv,每2周一次;或者c)0.3-20mg/kg;或22-1500mg,iv,每周一次。
[0116]
实施例94.如实施例92所述的药物组合物,其中该igf-1r抑制剂是芬妥木单抗,被配制用于以下述方式施用:a)1-60mg/kg或75-4500mg,iv,每3周一次;或者b)0.6-40mg/kg或45-3000mg,iv,每2周一次;或者c)0.3-20mg/kg或22-1500mg,iv,每周一次。
[0117]
实施例95.如实施例92所述的药物组合物,其中该igf-1r抑制剂是西妥木单抗,被配制用于以下述方式施用:a)1-45mg/kg或75-3400mg,iv,每3周一次;或者b)0.6-30mg/kg或45-2300mg,iv,每2周一次;或者c)0.3-15mg/kg或22-1200mg,iv,每周一次。
[0118]
实施例96.如实施例92所述的药物组合物,其中该igf-1r抑制剂是达洛妥珠单抗,被配制用于以下述方式施用:a)1-90mg/kg或75-6800mg,iv,每3周一次;或者b)0.6-60mg/kg或45-4500mg,iv,每2周一次;或者c)0.3-30mg/kg或22-2300mg,iv,每周一次。
[0119]
实施例97.如实施例92所述的药物组合物,其中该igf-1r抑制剂是罗妥木单抗,被配制用于以下述方式施用:a)1-75mg/kg或75-5700mg,iv,每3周一次;或者b)0.6-50mg/kg或45-3800mg,iv,每2周一次;或者c)0.3-25mg/kg或22-1900mg,iv,每周一次。
[0120]
实施例98.如实施例92所述的药物组合物,其中该igf-1r抑制剂是珍妥珠单抗,被配制用于以下述方式施用:a)1-112mg/kg或75-8400mg,iv,每3周一次;或者
b)0.6-75mg/kg或45-5700mg,iv,每2周一次;或者c)0.3-38mg/kg或22-2900mg,iv,每周一次。
[0121]
实施例99.如实施例92所述的药物组合物,其中该igf-1r抑制剂是艾司妥单抗,被配制用于以下述方式施用:a)1-112mg/kg或75-8400mg,iv,每3周一次;或者b)0.6-75mg/kg或45-5700mg,iv,每2周一次;或者c)0.3-38mg/kg或22-2900mg,iv,每周一次。
[0122]
实施例100.如实施例92所述的药物组合物,其中该igf-1r抑制剂是ave1642,被配制用于以下述方式施用:a)1-60mg/kg或75-4500mg,iv,每3周一次;或者b)0.6-40mg/kg或45-3000mg,iv,每2周一次;或者c)0.3-20mg/kg或22-1500mg,iv,每周一次。
[0123]
实施例101.如实施例92所述的药物组合物,其中该igf-1r抑制剂是biib022,被配制用于以下述方式施用:a)1-75mg/kg或75-5700mg,iv,每3周一次;或者b)0.6-50mg/kg;或45-3800mg,iv,每2周一次;或者c)0.3-25mg/kg或22-1900mg,iv,每周一次。
2.实施例102.如实施例92所述的药物组合物,其中该igf-1r抑制剂是林西替尼,被配制用于以下述方式施用:a)10-750mg,口服,每日一次,连续给药或10-1500mg/天,每日一次,间歇性给药(每14天中进行长达7天);或者b)6-500mg,口服,每日两次,连续给药或6-1000mg,每日两次,间歇性给药(每14天中进行长达7天);或者c)3-250mg,口服,每日三次,连续给药或3-500mg每日三次,间歇性给药(每14天中进行长达7天)。
[0124]
实施例103.如实施例92所述的药物组合物,其中该igf-1r抑制剂是苦鬼臼脂素,被配制用于以下述方式施用:a)口服,每日一次,20-2000mg;或者b)口服,每日两次,13-1400mg;或者c)口服,每日三次,6-700mg。
[0125]
实施例104.如实施例92所述的药物组合物,其中该igf-1r抑制剂是bms-754807,被配制用于以下述方式施用:a)每日一次,5-600mg,口服;或者b)每日两次,3-400mg,口服;或者c)每日三次,1-200mg,口服。
[0126]
实施例105.如实施例92所述的药物组合物,其中该igf-1r抑制剂选自bms-536924、bms-554417、gsk1838705a、gsk1904529a、nvp-aew541、nvp-adw742、gtx-134、ag1024、pl-2258、nvp-aew541、nsm-18、azd3463、azd9362、bi885578、bi893923、tt-100、xl-228和a-928605,被配制用于以下述方式施用:
a)每日一次,1-2000mg,口服;或者b)每日两次,0.6-1400mg,口服;或者c)每日三次,0.3-700mg,口服。
[0127]
实施例106.如实施例92所述的药物组合物,其中该igf-1r抑制剂是kw-2450,被配制用于以下述方式施用:a)每日一次,1-100mg,口服;或者b)每日两次,0.6-70mg,口服;或者c)每日三次,0.3-30mg,口服。
[0128]
本文还提供了以下实施例。
[0129]
本文提供了治疗甲状腺眼病(ted)或降低甲状腺眼病的严重程度的方法,这些方法包括向该受试者施用有效量的胰岛素样生长因子-i受体(igf 1r)抑制剂。
[0130]
在一些实施例中,所述igf-1r抑制剂是抗体。
[0131]
在一些实施例中,所述抗体igf-1r抑制剂选自甘尼妥单抗、芬妥木单抗、杜斯吉妥单抗(dusigitumab)、西妥木单抗、达洛妥珠单抗、罗妥木单抗、ave1642、biib022和珍妥珠单抗。
[0132]
在一些实施例中,所述igf-1r抑制剂是小分子。
[0133]
在一些实施例中,所述小分子igf-1r抑制剂选自林西替尼、苦鬼臼脂素、bms-754807、bms-536924、bms-554417、gsk1838705a、nvp-aew541、gtx-134和ag1024。
[0134]
本文还提供了一种在患有甲状腺相关眼病甲状腺眼病(ted)的受试者中减少前垂(例如,将前垂减少至少2mm)的方法,该方法包括向该受试者施用有效量的igf-1r抑制剂。
[0135]
本文还提供了一种在患有甲状腺相关眼病甲状腺眼病(ted)的受试者中减少前垂(例如,将前垂减少至少2mm)并且减少临床活动度评分(cas)的方法,该方法包括向该受试者施用有效量的igf-1r抑制剂。
[0136]
本文还提供了一种治疗甲状腺眼病(ted)或降低甲状腺眼病的严重程度的方法,该方法包括向有需要的受试者施用有效量的igf-1r抑制剂,并且其中该igf-1r抑制剂(i)将前垂减少至少2mm;并且(ii)将该受试者中的cas减少至少2分(在量表的7分版本上-如下所述)。
[0137]
本文还提供了一种在患有甲状腺眼病(ted)的受试者中将前垂减少至少4mm的方法,该方法包括向该受试者施用有效量的igf-1r抑制剂。
[0138]
本文还提供了一种治疗甲状腺眼病(ted)或降低甲状腺眼病的严重程度的方法,该方法包括向有需要的受试者施用有效量的igf-1r抑制剂,并且其中该igf-1r抑制剂将前垂减少至少4mm。
[0139]
本文还提供了一种在患有甲状腺眼病(ted)的受试者中治疗复视或降低复视的严重程度的方法,该方法包括向该受试者施用有效量的igf-1r抑制剂。
[0140]
本文还提供了一种降低甲状腺眼病(ted)的严重程度的方法,该方法包括向有需要的受试者施用有效量的药物组合物,该药物组合物包含igf-1r抑制剂、以及药学上可接受的赋形剂或稀释剂或载体。
[0141]
因此,本文提供了一种在患有ted(tao或go)的受试者中将前垂减少至少2mm的方法。该方法包括向该受试者施用有效量的igf-1r抑制剂。
[0142]
本文还提供了一种在患有ted(tao或go)的受试者中将前垂减少至少2mm并且减少临床活动度评分(cas)的方法,该方法包括向该受试者施用有效量的igf-1r抑制剂。
[0143]
本文还提供了一种治疗ted(tao或go)或降低ted的严重程度的方法。该方法包括向有需要的受试者施用有效量的igf-1r抑制剂,并且其中该igf-1r抑制剂(i)将前垂减少至少2mm;并且(ii)将该受试者中的cas减少至少2分(在量表的7分版本上)。
[0144]
在一些实施例中,前垂或眼球突出的减少可以大于2mm,例如2.2mm、2.4mm、2.5mm、2.6mm、2.8mm、3mm、3.2mm、3.4mm、3.5mm、3.6mm、3.8mm、4mm、4.1mm、4.2mm、4.3mm、4.4mm、4.5mm、4.6mm、4.7mm、4.8mm、4.9mm、5mm或超过5mm。
[0145]
在一些实施例中,cas的减少达2分或更多,例如达3、4、5、6或7分。在一个实施例中,cas的减少达2分或更多分。在另一个实施例中,该减少达3分或更多分。在又另一个实施例中,cas的减少达4分或更多分。
[0146]
本文还提供了一种在患有ted(tao或go)的受试者中将前垂减少至少4mm的方法。该方法包括向该受试者施用有效量的igf-1r抑制剂。
[0147]
本文还提供了一种治疗ted或降低ted的严重程度的方法。该方法包括向有需要的受试者施用有效量的igf-1r抑制剂,并且其中该igf-1r抑制剂将前垂或眼球突出减少至少3mm。本文还提供了一种治疗ted或降低ted的严重程度的方法。该方法包括向有需要的受试者施用有效量的igf-1r抑制剂,并且其中该igf-1r抑制剂将前垂或眼球突出减少至少4mm。
[0148]
本文还提供了一种治疗与ted相关的复视或降低复视的严重程度(在患有ted和复视的受试者中)的方法,该方法包括向该受试者施用有效量的igf-1r抑制剂。
[0149]
本文还提供了一种在患有甲状腺眼病(ted)的受试者中治疗复视或降低复视的严重程度的方法,该方法包括向该受试者施用有效量的igf-1r抑制剂。
[0150]
当ted是重度的时,特征在于由于tsh和igf-1受体的激活的眼眶组织重塑的此活动性自身免疫性疾病导致过量的细胞外基质和前垂/复视(一种ted患者的主要生活质量(qol)问题)。
[0151]
本文还提供了一种在患有甲状腺眼病(ted)的受试者中治疗恒定复视(cd)或降低恒定复视的严重程度的方法,该方法包括向该受试者施用有效量的igf-1r抑制剂。本文还提供了一种治疗复视的方法,该方法包括向该受试者施用相对于安慰剂导致改善的复视的有效量的igf-1r抑制剂。
[0152]
应注意并非所有受试者以相同方式对igf-1r抑制剂的施用有应答。当施用至患者群体时,这些患者中的约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%可以有前垂或眼球突出减少至少2mm和cas减少至少2分的应答。在一些实施例中,该应答在这些患者中的至少20%、或至少25%、或至少30%、或至少35%、或至少40%、或至少45%、或至少50%、或至少55%、或至少60%、或至少65%、或至少70%、或至少80%中看到。
[0153]
在一些实施例中,该igf-1r抑制剂在这些受试者中的至少25%、30%、35%、40%、45%50%、55%、60%、65%、70%、75%、80%、或85%中将前垂减少至少3mm。在一些实施例中,该igf-1r抑制剂在这些受试者中的至少25%、30%、35%、40%、45%50%、55%、60%、65%、70%、75%、80%、或85%中将前垂减少至少3.5mm。在一些实施例中,该igf-1r抑制剂在这些受试者中的至少25%、30%、35%、40%、45%50%、55%、60%、65%、70%、75%、
80%、或85%中将前垂减少至少4mm。在一些实施例中,该igf-1r抑制剂在这些受试者中的约40%中将前垂减少至少4mm。
[0154]
本文还提供了一种在患有甲状腺眼病(ted)、甲状腺相关眼病(tao)或格雷夫斯眼病(go)的受试者中减少眼睛中的前垂的方法,该受试者先前已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或者对所述先前治疗有应答且后来复发,该方法包括向所述受试者施用有效量的该igf-1r抑制剂。
[0155]
本文还提供了一种在患有ted的受试者中将一只眼睛中的前垂减少至少2mm而在另一只眼睛(或对侧眼)中没有2mm或更多的恶化的方法,该方法包括向所述受试者施用有效量的igf-1r抑制剂。该受试者是已经受过用所述igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或者在所述先前治疗之后复发的受试者。
[0156]
在一些实施例中,前垂或眼球突出的减少可以大于2mm,例如2.2mm、2.4mm、2.5mm、2.6mm、2.8mm、3mm、3.2mm、3.4mm、3.5mm、3.6mm、3.8mm、4mm、4.1mm、4.2mm、4.3mm、4.4mm、4.5mm、4.6mm、4.7mm、4.8mm、4.9mm、5mm或超过5mm。
[0157]
本文还提供了一种在受试者中减少甲状腺眼病(ted)的临床活动度评分(cas)的方法,该受试者已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或者在所述先前治疗之后复发,该方法包括向有需要的受试者施用有效量的igf-1r抑制剂。
[0158]
在一些实施例中,将cas在所述受试者中减少至一(1)或零(0)(在cas量表的7分版本上-如下所述)。
[0159]
在一些实施例中,cas的减少达2分或更多,例如达3、4、5、6或7分。在一个实施例中,cas的减少达2分或更多分。在另一个实施例中,该减少达3分或更多分。在又另一个实施例中,cas的减少达4分或更多分。在又另一个实施例中,cas的减少达5分或更多分。
[0160]
在一个实施例中,作为治疗的结果,将cas减少至一(1)。在另一个实施例中,作为治疗的结果,将cas减少至零(0)。
[0161]
本文还提供了一种治疗甲状腺眼病(ted)或降低甲状腺眼病的严重程度的方法,该方法包括向已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或对所述先前治疗有应答且后来复发的受试者施用igf-1r抑制剂。
[0162]
本文还提供了在受试者中治疗甲状腺眼病(ted)或降低甲状腺眼病的严重程度的方法,该受试者已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或在所述先前治疗之后复发,该方法包括向有需要的受试者施用有效量的igf-1r抑制剂,并且其中所述igf-1r抑制剂(i)将一只眼睛中的前垂减少至少2mm;(ii)不伴有另一只眼睛(或对侧眼)中的2mm或更多的恶化;并且(iii)将cas在所述受试者中减少至一(1)或零(0)(在量表的7分版本上-如下所述)。
[0163]
本文还提供了一种治疗甲状腺眼病(ted;tao或go)或降低甲状腺眼病的严重程度的方法,该方法包括向有需要的受试者施用有效量的igf-1r抑制剂,其中所述抗体将前垂减少至少2mm并且将cas减少至一(1)或零(0)。如上所述,该受试者是已经受过用所述igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或者在所述先前治疗之后复发的受试者。
[0164]
本文还提供了一种在患有ted的受试者中治疗甲状腺眼病(ted;tao或go)或降低甲状腺眼病的严重程度的方法,该受试者先前已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或者对所述先前治疗有应答且后来复发,该方法包括向有需要的受试
者施用有效量的药物组合物,该药物组合物包含igf-1r抑制剂和药学上可接受的赋形剂或稀释剂或载体。
[0165]
本文还提供了一种在患有甲状腺眼病(ted;tao或go)的受试者中减少眼睛中的前垂的方法,该受试者先前已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或者对所述先前治疗有应答且后来复发,该方法包括向所述受试者施用有效量的该igf-1r抑制剂。
[0166]
本文还提供了一种治疗甲状腺眼病(ted;tao或go)或降低甲状腺眼病的严重程度的方法,该方法包括向已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或对所述先前治疗有应答且后来复发的受试者施用该igf-1r抑制剂。
[0167]
本文还提供了一种在患有甲状腺眼病(ted;tao或go)的受试者中改善生活质量的方法,该受试者已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或者对所述先前治疗有应答且后来复发,该方法包括向该受试者施用有效量的igf-1r抑制剂。
[0168]
本文还提供了一种在患有甲状腺眼病(ted;tao或go)的受试者中治疗复视或降低复视的严重程度的方法,该受试者已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或者对所述先前治疗有应答且后来复发,该方法包括向该受试者施用有效量的igf-1r抑制剂。
[0169]
在一些实施例中,该复视是恒定复视。在一些实施例中,该复视是不恒定复视。在一些实施例中,该复视是间歇性复视。
[0170]
在一些实施例中,在停止igf-1r抑制剂施用之后,复视的严重程度的改善或降低持续至少20、30、40或50周。在一些实施例中,在停止igf-1r抑制剂施用之后,复视的严重程度的改善或降低持续20-30、30-40、40-50或50-60周。在一些实施例中,在停止igf-1r抑制剂施用之后,复视的严重程度的改善或降低持续至少20周。在一些实施例中,在停止igf-1r抑制剂施用之后,复视的严重程度的改善或降低持续至少50周。
[0171]
本文还提供了一种在患有甲状腺眼病(ted;tao或go)的受试者中治疗恒定复视(cd)或降低恒定复视的严重程度的方法,该受试者已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或者对所述先前治疗有应答且后来复发,该方法包括向该受试者施用有效量的igf-1r抑制剂。在一些实施例中,用该igf-1r抑制剂的治疗改善患有重度ted的患者中的cd qol。
[0172]
本文还提供了一种在患有甲状腺眼病(ted;tao或go)的受试者中治疗复视或降低复视的严重程度的方法,该受试者已经受过用igf-1r抑制剂的先前治疗并且对所述先前治疗无应答或者对所述先前治疗有应答且后来复发,该方法包括向该受试者施用相对于安慰剂导致改善的复视的有效量的igf-1r抑制剂,该改善的复视持续至药物停止后的51周。
[0173]
igf-1r抑制剂可以以单剂量或多剂量施用。在一个实施例中,将igf-1r抑制剂以单剂量施用至受试者。在另一个实施例中,将igf-1r抑制剂以多剂量施用至受试者,该多剂量散布于数天、数周或数月的时程内。在一些实施例中,将igf-1r抑制剂每周或每2周或每3周或每4周或每5周或每6周或每7周或每8周或者每月或每2个月或每3个月施用一次。
[0174]
在一些实施例中,将igf-1r抑制剂以多剂量施用并且剂量是相同的每个时间。在一些实施例中,将igf-1r抑制剂以多剂量施用,并且第一次施用时的剂量不同于(可以是更高或更低的)后续次数时的剂量。在一些实施例中,将igf-1r抑制剂以多剂量施用,并且在
每次施用时基于受试者对疗法的应答调整剂量。
[0175]
基于每名患者的不同因素诸如年龄、性别、人种和体重,剂量在患者之间可以进一步变化。在一个实施例中,剂量随患者的体重变化。剂量的范围可以为从约1mg igf-1r抑制剂/千克体重至约100mg igf-1r抑制剂/千克体重。剂量可以例如是1mg、2mg、3mg、5mg、7mg、10mg、12mg、15mg、17mg、20mg、22mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg或100mg igf-1r抑制剂/千克体重。
[0176]
在一些实施例中,剂量是约1mg/kg至约5mg/kg的igf-1r抑制剂。在一些实施例中,剂量是约5mg/kg至约10mg/kg的igf-1r抑制剂。在一些实施例中,剂量是约10mg/kg至约15mg/kg的igf-1r抑制剂。在一些实施例中,剂量是约15mg/kg至约20mg/kg的igf-1r抑制剂。
[0177]
在其中将igf-1r抑制剂以多剂量施用并且第一次施用时的剂量不同于后续次数时的剂量的一些实施例中,第一次施用时的剂量是约1mg/kg至约5mg/kg的igf-1r抑制剂;或约5mg/kg至约10mg/kg的igf-1r抑制剂;或约10mg/kg至约15mg/kg的igf-1r抑制剂;或约15mg/kg至约20mg/kg的igf-1r抑制剂;或约20mg/kg至约25mg/kg的igf-1r抑制剂。一个或多个后续剂量可以高于或低于第一剂量。在一些实施例中,后续剂量是约1mg/kg至约5mg/kg的igf-1r抑制剂;或约5mg/kg至约10mg/kg的igf-1r抑制剂;或约10mg/kg至约15mg/kg的igf-1r抑制剂;或约15mg/kg至约20mg/kg的igf-1r抑制剂;或约20mg/kg至约25mg/kg的igf-1r抑制剂。
[0178]
治疗的持续时间将取决于受试者对疗法的应答,并且其范围可以为从约一个月或4周至约2年或100周。在不同实施例中,治疗可以在约1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、14个月、16个月、18个月、20个月、22个月或2年的总持续时间内提供。在其他实施例中,治疗可以在4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52周的总持续时间内提供,或延长至56、64、72、80、88、96或104周。
[0179]
igf-1r抑制剂可以通过任何合适的途径施用,该任何合适的途径包括但不限于口服、静脉内、肌肉内、动脉内、髓内、腹膜内、鞘内、脑室内、透皮、经皮、局部、皮下、鼻内、肠内、舌下、阴道内或直肠途径。皮下注射器也可以用于施用本文所披露的药物组合物。也可以使用在注射前适于溶于或悬浮于液体媒介物中的固体形式。
[0180]
还提供了其中可以将以上任何实施例与这些实施例中的任一个或多个组合的实施例,只要该组合不是互相排斥的。如本文所用,当一个被定义为与另一个不同时,两个实施例是“互相排斥的”。定义
[0181]
为了有助于对本披露的理解,如本文所用的大量术语和缩写在下文定义如下:
[0182]
如本文所用,术语“抗体”涵盖各种形式的抗体,包括但不限于整个抗体、单克隆抗体、抗体片段、人抗体、人源化抗体、嵌合抗体和基因工程化抗体,只要特征性特性诸如特异性和igf-ir抑制性保留。
[0183]
如本文所用,术语“抗原结合片段”、“片段”和“抗体片段”可互换用于指包含全长抗体的一部分、通常是至少抗原结合部分或其可变区的任何片段。抗体片段的实例包括但不限于双抗体、单链抗体分子、多特异性抗体、fab、fab’、f(ab')2、fv或scfv。此外,如本文
所用,术语“抗体”包括抗体及其抗原结合片段两者。此外,抗体片段包括单链多肽,该单链多肽具有vh链的特征(即能够与vl链组装在一起)或结合igf-ir的vl链的特征(即能够与vh链一起组装为功能性抗原结合袋且从而提供抑制igf-i和igf-ii与igf-ir的结合的特性)。
[0184]
如本文所用,术语“单克隆抗体”或“单克隆抗体组合物”是指单氨基酸组成的抗体分子的制剂。因此,术语“人单克隆抗体”是指显示出单一结合特异性的抗体,这些抗体具有来源于人种系免疫球蛋白序列的可变区和恒定区。在一个实施例中,人单克隆抗体是通过杂交瘤产生的,该杂交瘤包括融合至永生化细胞、从转基因非人动物(例如,转基因小鼠)获得的b细胞,该b细胞具有包含人重链转基因和人轻链转基因的基因组。
[0185]
如本文所用,术语“人抗体”旨在包括具有来源于人种系免疫球蛋白序列的可变区和恒定区的抗体。如本文所用,术语“人源化抗体”是指其中框架或“互补决定区”(cdr)已经被修饰以包含与亲本免疫球蛋白的特异性相比具有不同特异性的免疫球蛋白的cdr的抗体。在优选的实施例中,将鼠类cdr移植至人抗体的框架区中以制备“人源化抗体”。
[0186]
如本文所用,术语“重组人抗体”旨在包括通过重组手段制备、表达、产生或分离的所有人抗体,诸如从诸如sp2-0、ns0或cho细胞的宿主细胞或从为人免疫球蛋白基因转基因的动物(例如,小鼠)分离的抗体,或使用转染至宿主细胞中的重组表达载体表达的抗体。此类重组人抗体具有呈重排形式的来源于人种系免疫球蛋白序列的可变区和恒定区。
[0187]
如本文所用,术语“可变区”(轻链(vl)的可变区、重链(vh)的可变区)表示直接参与抗体与抗原结合的每个轻链和重链对。可变人轻链和重链的结构域具有相同的一般结构并且每个结构域包含四个框架区(fr),其序列是广泛保守的,通过三个“高变区”(或互补决定区,cdr)连接。框架区采取β折叠构象并且cdr可以形成连接β折叠结构的环。每条链中的cdr通过框架区保持其三维结构并且与来自其他链的cdr一起形成抗原结合位点。抗体重链和轻链cdr3区在抗体的结合特异性/亲和力方面起重要作用。
[0188]
术语“互补决定区”、“cdr”、“高变区”或“抗体的抗原结合部分”在本文中可互换使用,并且是指抗体的负责抗原结合的氨基酸残基。高变区包含来自互补决定区或cdr的氨基酸残基。“框架”或“fr”区是除如本文所定义的高变区残基以外的那些可变结构域残基。因此,抗体的轻链和重链从n末端至c末端包含结构域fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。特别地,重链的cdr3是最有助于抗原结合的区。根据kabat等人,sequences of proteins of immunological interest[有免疫学兴趣的蛋白质序列],第5版public health service[公共卫生服务],national institutes of health[国立卫生研究院],bethesda[贝塞斯达],md.[马里兰州](1991))的标准定义和/或来自“高变环”的那些残基来确定cdr和fr区。
[0189]
术语“与igf-ir的结合”或“与igf-ir的特异性结合”在本文中可互换使用,并且意指在体外测定中、优选地在结合测定中的抗体与igf-ir的结合,其中抗体与表面结合并且通过表面等离子体共振(spr)来测量igf-ir的结合。结合意指10-8
m或更小、优选地10-13
至10-9
m的结合亲和力(kd)。可以通过biacore测定(瑞典乌普萨拉(uppsala)的玛西亚生物传感器公司(pharmacia biosensor ab))研究与igf-ir的结合。通过术语ka(来自抗体/抗原复合物的抗体的缔合速率常数)、kd(解离常数)和kd(kd/ka)来定义结合的亲和力。在本文所披露的方法中使用的抗体典型地显示出约10-9
m或更小的kd。
[0190]
在本文所披露的方法中使用的抗体或其抗原结合片段抑制igf-i和igf-ii与igf-ir的结合。将抑制测量为igf-i/igf-ii与细胞上的igf-ir的结合测定中的ic
50
。这种测定对
旨在意指单独的a、单独的b、单独的c、a与b组合、a与c组合、b与c组合、或者a、b与c组合。
[0201]
当披露数值范围以及使用记法“从n1
……
至n2”或“在n1
……
和n2之间”时,其中n1和n2是数字,则除非另外指明,否则这种记法旨在包括这些数字本身以及它们之间的范围。此范围可以是整的或在这些端值之间连续的并且包括这些端值。通过举例,范围“从2至6个碳”旨在包括两个、三个、四个、五个以及六个碳,因为碳以整数单位出现。通过举例,将范围“从1至3μm(微摩尔)”(其旨在包括1μm、3μm和介于两者之间的所有数)与有效数字的任何数字(例如,1.255μm、2.1μm、2.9999μm等)进行比较。
[0202]
如本文所用的关于数值x的术语“约”意指x
±
10%。
[0203]
术语“包含(comprising)”涵盖“包括(including)”以及“组成”,例如“包含”x的组合物可以唯一地由x组成或者可以包括另外的某物,例如x+y。
[0204]
字词“基本上”不排斥“完全”,例如,“基本上不含”y的组合物可以完全不含y。在需要时,字词“基本上”在本文使用的地方可以任选地省略。
[0205]“意向性治疗”群体包括根据随机化治疗分配随机化的所有临床试验受试者。随机化对照试验常常遭受两个主要麻烦的问题,即不顺应性和缺失结局。对此问题的一个潜在解决方案是称为意向性治疗(itt)分析的统计概念。itt分析忽略了不顺应性、方案偏差、退出和随机化后发生的任何事情。itt分析维持从原始随机治疗分配产生的预后平衡。在itt分析中,治疗效果的估计通常是保守的。如果对于所有随机化受试者可获得完全结局数据,则可以更好地应用itt方法。按方案群体被定义为在没有任何重大方案违反的情况下完成研究的itt群体的亚组。参见例如,gupta sk,intention-to-treat concept:a review[意向性治疗概念:综述],perspect clin res.[临床研究展望]2011年7月-9月;2(3):109-112。
[0206]
如本文所用,“甲状腺眼病”(ted)、“甲状腺相关眼病”(tao)、“甲状腺炎症性眼病(tied)”、“格雷夫斯眼病”(go)或“格雷夫斯眼眶病”(go)是指相同的障碍或病症并且可互换使用。它们全部是指与一些自身免疫性甲状腺障碍,最常常是与“格雷夫斯病”(gd),但有时与其他疾病,例如桥本氏甲状腺炎相关的炎症性眼眶病变。
[0207]
术语“前垂”和“眼球突出(exophthalmos)”(也称为眼球突出(exophthalmus)、眼球突出症(exophthalmia)或突眼(exorbitism))是指器官的向前突出、移位、鼓起或突起。如本文所用,这些术语是指眼睛在前面离开眼眶的向前突出、移位、鼓起或突起。前垂和眼球突出被本领域的一些技术人员认为具有相同含义并且常常可互换使用,而其他技术人员认为它们的含义具有细微的差异。眼球突出被一些技术人员用于指重度前垂;或用于指内分泌相关前垂。然而其他技术人员在描述例如患有ted(tao或go)的受试者中的与眼睛相关的前垂时使用术语眼球突出。
[0208]
如本文所用,术语“前垂”和“眼球突出”可互换使用并且是指眼睛在前面离开眼眶的向前突出、移位、凸出或突起。由于眼眶的刚性骨结构仅具有用于扩张的前面开口,因此从侧面或从后面发生的眼眶软组织内容物的任何增加将使眼球向前移位。前垂或眼球突出可能是若干种疾病过程的结果,这些若干种疾病过程包括感染、炎症、肿瘤、创伤、转移、内分泌病变、血管疾病和额外眼眶病变。ted(tao或go)目前被认为是成年人中前垂的最常见原因。眼球突出可以双向的(如在ted(tao或go)中常常看到的),或单向的(如眼眶肿瘤中常常看到的)。
ophthalmology[英国眼科学杂志],1989,73,第8期,639-644)。将基于急性炎症的经典体征(疼痛、发红、肿胀和受损功能)的此得分提议为临床分类,以易于在活动性与非活动性疾病之间进行区分,并且在1997年进行修改(mourits等人,clinical endocrinology[临床内分泌学],1997.47,第1期,9-14)。此方案在下文进一步描述。
[0219]
如本文所用,术语cas是指如下文所披露那样描述和进行评分的方案。根据此方案,对于下文列表中评估的每一种参数的存在给予一分。所有分的总和定义临床活动度并且提供cas。对于第一次评估的患者,仅对1-7项进行评分。cas≥3/7指示活动性go。对于评估第二次或后续次(典型地,1-3个月后)的患者,还对8-10项进行评分;并且cas≥4/10指示活动性疾病。还存在10项cas量表,但在临床试验中,通常使用更适合涉及多次评估的纵向研究的7项量表。
[0220]
cas由七个组分组成:1.自发眼球后疼痛,2.在尝试眼睛移动(向上、左右和向下凝视)时疼痛,3.结膜发红,4.眼睑发红,5.球结膜水肿(结膜肿胀/水肿),6.肉阜/皱襞肿胀,以及7.眼睑肿胀。将每个组分以存在(1分)或不存在(0分)进行评分。每种功效评估下的评分是存在的所有项的总和;产生0-7的范围,其中0或1构成非活动性疾病并且7构成重度活动性眼病。》2分的变化被视为有临床意义。
[0221]
项1自发眼眶疼痛可以是眼球上或后面的疼痛感或压迫感。此疼痛可以由当眼眶组织体积通过细胞外基质的过量合成、流体累积以及细胞浸润和扩增增加时眼眶内压力的升高引起。项2凝视诱发的眼眶疼痛可以是当向上、向下或斜向一边看或尝试看时眼睛的疼痛,即在向上、向下或侧向眼睛移动的情况下或在尝试向上、向下或侧向凝视时的疼痛。这种疼痛可能由特别是在尝试向上凝视时一种或多种发炎肌肉的拉伸引起。通过眼球上的点压不能引发
‘
拉伸疼痛’,如在它是升高眼眶内压力的表现时将预期的。在抗炎治疗之后可以降低两种疼痛。因此,这些种类的疼痛被视为与眼眶中的自身免疫性炎症直接相关,且因此可用于评估ted活动度。
[0222]
ted(tao或go)的肿胀被看作为球结膜水肿(结膜的水肿)和肉阜和/或半月皱襞的肿胀。两者均是ted活动度的体征。肿胀的眼睑可能是由水肿、通过眼眶隔膜的脂肪疝、或纤维化变性引起的。除了肿胀之外,指示活动性ted的其他症状包括结膜、眼睑、肉阜和/或半月皱襞的发红和/或疼痛。
[0223]
还已经开发了其他分级系统用于评估ted(tao或go)。visa分类(视力、炎症、斜视和外观)(dolman,p.j.和rootman,j.,ophthalmic plastic and reconstructive surgery[眼科整形和重建手术],2006,22,第5期,319-324和dolman,p.j.,best practice&research clinical endocrinology&metabolism[临床内分泌学与代谢最佳实践与研究],2012,26,第3期,229-248)和欧洲格雷夫斯眼眶病小组(eugogo)分类(bartalena,l.等人,european journal of endocrinology[欧洲内分泌学杂志],2008,158,第3期,273-285)是
两种此类实例。两种系统均以no specs和cas分类为基础,并且使用用于评估活动度的体征和严重程度的指标。更重要的是,它们允许临床医生指导患有go的患者的治疗。visa在北美和加拿大中更常用,而eugogo则在欧洲中。由于visa和eugogo方案是不可互换的,因此在特定患者中应仅采用其中一个作为参考。格雷夫斯眼病生活质量(go-qol)
[0224]
除了前垂(或眼球突出)和cas之外,生活质量(qol)还通过使用格雷夫斯眼病生活质量(go-qol)问卷来评价。此问卷被设计来确定在治疗之后改善的生活质量。在一些实施例中,问卷可以确定相比于用糖皮质激素的治疗,在根据本文所披露的方法用抗体或其抗原结合片段治疗之后副作用的减少或缺乏。
[0225]
go-qol问卷具有两个自评估分量表。第一个涉及视觉功能对日常活动的影响,而第二个涉及自我感知外观的影响。每个分量表具有8个问题,其回答有:(i)是-很多;(ii)是-一点;或(iii)否-一点也不。每个问题分别被评分为0-2,并且然后将总原始评分在数学上转换为0-100量表,其中0表示对生活质量的最负面影响,并且100表示没有影响。在0-100量表上》8分的变化被视为有临床意义。组合评分从两个分量表获取原始评分,并且同样将它们转换为单一0-100量表。严重程度量度
[0226]
对于睑孔,测量睑边缘之间的距离(以mm计),其中患者看第一眼位,放松坐着,并且在远距离固定的情况下。对于眼睑的肿胀,量度/评价是“不存在/可疑”、“中等”或“重度”。眼睑的发红是不存在或存在的。结膜的发红是不存在或存在的。
[0227]
结膜水肿是不存在或存在的。肉阜或皱襞的炎症是不存在或存在的。对于单独患者使用相同的hertel眼球突出测量器和相同的眼角间距测量眼球突出(以毫米计)。对主观性复视从0至3进行评分(0=无复视;1=间歇性,即当疲倦时或当第一次觉醒时,第一凝视眼位下的复视;2=不恒定,即在凝视极端状态下的复视;3=恒定,即在第一眼位或阅读眼位下的连续复视)。对于眼睛肌肉受累,测量转向(以度计)。角膜受累是不存在的/点状的或角膜病变/溃疡。对于视神经受累,即最佳矫正视敏度、色觉、视神经盘、相对传入瞳孔缺陷,病症是不存在或存在的。此外,如果怀疑视神经压缩,则检查视野。严重程度分类
[0228]
视觉威胁性甲状腺眼病:患有甲状腺机能障碍视神经病变(don)和/或角膜破裂的患者。此类别需要直接干预。
[0229]
中度至重度甲状腺眼病:未患有视觉威胁性疾病的患者,其眼病对日常生活具有足够的影响以证明免疫抑制(如果活动性)或手术干预(如果非活动性)的风险。患有中度至重度甲状腺眼病的患者通常具有以下中的任何一种或多种:睑退缩≥2mm、中度或重度软组织受累、眼球突出高于针对人种和性别的正常值≥3mm、不恒定或恒定复视。
[0230]
轻度甲状腺眼病:甲状腺眼病的特征仅对日常生活具有较小影响而不足以证明免疫抑制或手术治疗正当的患者。它们通常仅具有以下中的一种或多种:较小睑退缩(《2mm)、轻度软组织受累、眼球突出高于针对人种和性别的正常值《3mm、瞬时或无复视以及响应于润滑剂的角膜暴露。对复视的戈尔曼(gorman)分级的评估
[0231]
对主观性复视的戈尔曼评估包括四个类别:无复视(不存在)、当患者疲倦或觉醒时的复视(间歇性)、在凝视极端状态下的复视(不恒定)以及在第一眼位或阅读眼位下的连续复视(恒定)。根据患者正在经历的复视级别对他们进行评分。≥1级的改善被视为有临床意义。
[0232]
可以进行以确定用于治疗ted的功效的另外测试(包括临床试验方案和标准以及引入研究)可以见于us 20190225696 a1中,将该专利特此通过援引以其全文并入。
[0233]
此外,本文所述的igr-1r抑制剂可用于治疗以下受试者中的ted,这些受试者是引入研究中的前垂非应答者(研究眼睛中前垂的《2mm减少)或者是引入研究中的前垂应答者但由于复发而满足重新治疗的标准。实例
[0234]
示例性实施例在以下实例1-31中提供。以下实例仅以说明的方式呈现,并帮助本领域普通技术人员使用本发明。这些实例并不旨在以任何方式另外限制本发明的范围。在一些实施例中,所述igf-1r抑制剂是选自以下实例的抗体或抗体亚组。在一些实施例中,所述igf-1r抑制剂是选自以下实例的小分子或小分子亚组。实例a特普妥木单抗
[0235]
首先提供了被批准用于治疗ted的igf-1r抑制剂特普妥木单抗(tepezza)。特普妥木单抗和其他相关igf-1r抑制剂抗体及其制备方法可见于us 7,572,897、us20190225696和us20190270820中,将这些专利特此通过援引以其全文并入。在某些实施例中,特普妥木单抗可以用作其他igf-1r抑制剂的临床试验中的活性对照,例如如实例31中。
[0236]
表a:特普妥木单抗序列和seq id号
实例1达洛妥珠单抗
[0237]
达洛妥珠单抗和其他相关igf-1r抑制剂抗体及其制备方法可见于wo 2005/058967中,将该专利特此通过援引以其全文并入。重链cdr-达洛妥珠单抗
轻链cdr-达洛妥珠单抗达洛妥珠单抗
[0238]
本披露的一些实施例是包含重链的抗igf-1r抑制剂mab或其抗原结合片段,该重链包含可变重链cdr1、可变重链cdr2和可变重链cdr3,其中可变重链cdr1包含氨基酸序列seq id no:1,可变重链cdr2包含氨基酸序列seq id no:2;并且可变重链cdr3包含氨基酸序列seq id no:3或与seq id no:1、seq id no:2和seq id no:3最佳比对之后具有至少80%的序列同一性的至少cdr。
[0239]
抗igf-1r抑制剂mab或抗体或其抗原结合片段可以另外包含轻链,该轻链与重链配对形成抗原结合结构域。在一些实施例中,轻链包含可变轻链cdr1、可变轻链cdr2和可变轻链cdr3,其中可变轻链cdr1包含氨基酸序列seq id no:4,可变轻链cdr2包含氨基酸序列seq id no:5;并且可变轻链cdr3包含氨基酸序列seq id no:6或与seq id no:4、seq id no:5和seq id no:6最佳比对之后具有至少80%的同源性的至少cdr。
[0240]
在一些实施例中,抗igf-1r抑制剂mab或其抗原结合片段包含seq id no:7的重链
氨基酸序列或在与seq id no:7最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。替代性地或除此之外,抗igf-1r抑制剂mab或其抗原结合片段可以包含具有seq id no:8的氨基酸序列的轻链或在与seq id no:8最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。实例2甘尼妥单抗
[0241]
甘尼妥单抗和其他相关igf-1r抑制剂抗体及其制备方法可见于wo 2006/069202中,将该专利特此通过援引以其全文并入。重链cdr-甘尼妥单抗轻链cdr-甘尼妥单抗甘尼妥单抗
[0242]
本披露的一些实施例是包含重链的抗igf-1r抑制剂mab或其抗原结合片段,该重链包含可变重链cdr1、可变重链cdr2和可变重链cdr3,其中可变重链cdr1包含氨基酸序列seq id no:9,可变重链cdr2包含氨基酸序列seq id no:10;并且可变重链cdr3包含氨基酸序列seq id no:11或与seq id no:9、seq id no:10和seq id no:11最佳比对之后具有至少80%的序列同一性的至少cdr。
[0243]
抗igf-1r抑制剂mab或抗体或其抗原结合片段可以另外包含轻链,该轻链与重链配对形成抗原结合结构域。在一些实施例中,轻链包含可变轻链cdr1、可变轻链cdr2和可变轻链cdr3,其中可变轻链cdr1包含氨基酸序列seq id no:12,可变轻链cdr2包含氨基酸序列seq id no:13;并且可变轻链cdr3包含氨基酸序列seq id no:14或与seq id no:12、seq id no:13和seq id no:14最佳比对之后具有至少80%的同源性的至少cdr。
[0244]
在一些实施例中,抗igf-1r抑制剂mab或其抗原结合片段包含seq id no:15的重链氨基酸序列或在与seq id no:15最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。替代性地或除此之外,抗igf-1r抑制剂mab或其抗原结合片段可以包含具有seq id no:16的氨基酸序列的轻链或在与seq id no:16最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。实例3珍妥珠单抗
[0245]
珍妥珠单抗和其他相关igf-1r抑制剂抗体及其制备方法可见于wo 2014/135611中,将该专利特此通过援引以其全文并入。重链cdr-珍妥珠单抗轻链cdr-珍妥珠单抗珍妥珠单抗珍妥珠单抗
[0246]
本披露的一些实施例是包含重链的抗igf-1r抑制剂mab或其抗原结合片段,该重链包含可变重链cdr1、可变重链cdr2和可变重链cdr3,其中可变重链cdr1包含氨基酸序列seq id no:17,可变重链cdr2包含氨基酸序列seq id no:18;并且可变重链cdr3包含氨基酸序列seq id no:19或与seq id no:17、seq id no:18和seq id no:19最佳比对之后具有
至少80%的序列同一性的至少cdr。
[0247]
抗igf-1r抑制剂mab或抗体或其抗原结合片段可以另外包含轻链,该轻链与重链配对形成抗原结合结构域。在一些实施例中,轻链包含可变轻链cdr1、可变轻链cdr2和可变轻链cdr3,其中可变轻链cdr1包含氨基酸序列seq id no:20,可变轻链cdr2包含氨基酸序列seq id no:21;并且可变轻链cdr3包含氨基酸序列seq id no:22或与seq id no:20、seq id no:21和seq id no:22最佳比对之后具有至少80%的同源性的至少cdr。
[0248]
在一些实施例中,抗igf-1r抑制剂mab或其抗原结合片段包含seq id no:23的重链氨基酸序列或在与seq id no:23最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。替代性地或除此之外,抗igf-1r抑制剂mab或其抗原结合片段可以包含具有seq id no:24的氨基酸序列的轻链或在与seq id no:24最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。实例4ave1642
[0249]
ave1642和其他相关igf-1r抑制剂抗体及其制备方法可见于wo 2003/106621中,将该专利特此通过援引以其全文并入。重链cdr-ave1642轻链cdr-ave1642ave1642
[0250]
本披露的一些实施例是包含重链的抗igf-1r抑制剂mab或其抗原结合片段,该重链包含可变重链cdr1、可变重链cdr2和可变重链cdr3,其中可变重链cdr1包含氨基酸序列seq id no:25,可变重链cdr2包含氨基酸序列seq id no:26;并且可变重链cdr3包含氨基酸序列seq id no:27或与seq id no:25、seq id no:26和seq id no:27最佳比对之后具有至少80%的序列同一性的至少cdr。
[0251]
抗igf-1r抑制剂mab或抗体或其抗原结合片段可以另外包含轻链,该轻链与重链
配对形成抗原结合结构域。在一些实施例中,轻链包含可变轻链cdr1、可变轻链cdr2和可变轻链cdr3,其中可变轻链cdr1包含氨基酸序列seq id no:28,可变轻链cdr2包含氨基酸序列seq id no:29;并且可变轻链cdr3包含氨基酸序列seq id no:30或与seq id no:28、seq id no:29和seq id no:30最佳比对之后具有至少80%的同源性的至少cdr。
[0252]
在一些实施例中,抗igf-1r抑制剂mab或其抗原结合片段包含seq id no:31的重链氨基酸序列或在与seq id no:31最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。替代性地或除此之外,抗igf-1r抑制剂mab或其抗原结合片段可以包含具有seq id no:32的氨基酸序列的轻链或在与seq id no:32最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。实例5芬妥木单抗
[0253]
芬妥木单抗和其他相关igf-1r抑制剂抗体及其制备方法可见于美国专利7,037,498中,将该专利特此通过援引以其全文并入。重链cdr-芬妥木单抗轻链cdr-芬妥木单抗芬妥木单抗
[0254]
本披露的一些实施例是包含重链的抗igf-1r抑制剂mab或其抗原结合片段,该重链包含可变重链cdr1、可变重链cdr2和可变重链cdr3,其中可变重链cdr1包含氨基酸序列seq id no:33,可变重链cdr2包含氨基酸序列seq id no:34;并且可变重链cdr3包含氨基酸序列seq id no:35或与seq id no:33、seq id no:34和seq id no:35最佳比对之后具有至少80%的序列同一性的至少cdr。
[0255]
抗igf-1r抑制剂mab或抗体或其抗原结合片段可以另外包含轻链,该轻链与重链配对形成抗原结合结构域。在一些实施例中,轻链包含可变轻链cdr1、可变轻链cdr2和可变轻链cdr3,其中可变轻链cdr1包含氨基酸序列seq id no:36,可变轻链cdr2包含氨基酸序列seq id no:37;并且可变轻链cdr3包含氨基酸序列seq id no:38或与seq id no:36、seq id no:37和seq id no:38最佳比对之后具有至少80%的同源性的至少cdr。
[0256]
在一些实施例中,抗igf-1r抑制剂mab或其抗原结合片段包含seq id no:39的重链氨基酸序列或在与seq id no:39最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。替代性地或除此之外,抗igf-1r抑制剂mab或其抗原结合片段可以包含具有seq id no:40的氨基酸序列的轻链或在与seq id no:40最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。实例6杜斯吉妥单抗
[0257]
杜斯吉妥单抗(medi-573)和其他相关igf-1r抑制剂抗体及其制备方法可见于美国专利7,939,637中,将该专利特此通过援引以其全文并入。重链cdr-杜斯吉妥单抗
轻链cdr-杜斯吉妥单抗杜斯吉妥单抗杜斯吉妥单抗
[0258]
本披露的一些实施例是包含重链的抗igf-1r抑制剂mab或其抗原结合片段,该重链包含可变重链cdr1、可变重链cdr2和可变重链cdr3,其中可变重链cdr1包含氨基酸序列seq id no:41,可变重链cdr2包含氨基酸序列seq id no:42;并且可变重链cdr3包含氨基酸序列seq id no:43或与seq id no:41、seq id no:42和seq id no:43最佳比对之后具有至少80%的序列同一性的至少cdr。
[0259]
抗igf-1r抑制剂mab或抗体或其抗原结合片段可以另外包含轻链,该轻链与重链配对形成抗原结合结构域。在一些实施例中,轻链包含可变轻链cdr1、可变轻链cdr2和可变轻链cdr3,其中可变轻链cdr1包含氨基酸序列seq id no:44,可变轻链cdr2包含氨基酸序列seq id no:45;并且可变轻链cdr3包含氨基酸序列seq id no:46或与seq id no:44、seq id no:45和seq id no:46最佳比对之后具有至少80%的同源性的至少cdr。
[0260]
在一些实施例中,抗igf-1r抑制剂mab或其抗原结合片段包含seq id no:39的重链氨基酸序列或在与seq id no:47最佳比对之后具有至少85%、90%、95%、97%、98%或
99%序列同一性的至少重链。替代性地或除此之外,抗igf-1r抑制剂mab或其抗原结合片段可以包含具有seq id no:40的氨基酸序列的轻链或在与seq id no:48最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。实例7西妥木单抗
[0261]
西妥木单抗和其他相关igf-1r抑制剂抗体及其制备方法可见于美国专利7,638,605中,将该专利特此通过援引以其全文并入。重链cdr-西妥木单抗西妥木单抗轻链cdr-西妥木单抗
[0262]
本披露的一些实施例是包含重链的抗igf-1r抑制剂mab或其抗原结合片段,该重链包含可变重链cdr1、可变重链cdr2和可变重链cdr3,其中可变重链cdr1包含氨基酸序列seq id no:49,可变重链cdr2包含氨基酸序列seq id no:50;并且可变重链cdr3包含氨基酸序列seq id no:51或与seq id no:49、seq id no:50和seq id no:51最佳比对之后具有至少80%的序列同一性的至少cdr。
[0263]
抗igf-1r抑制剂mab或抗体或其抗原结合片段可以另外包含轻链,该轻链与重链配对形成抗原结合结构域。在一些实施例中,轻链包含可变轻链cdr1、可变轻链cdr2和可变轻链cdr3,其中可变轻链cdr1包含氨基酸序列seq id no:52,可变轻链cdr2包含氨基酸序列seq id no:53;并且可变轻链cdr3包含氨基酸序列seq id no:54或与seq id no:52、seq id no:53和seq id no:54最佳比对之后具有至少80%的同源性的至少cdr。
[0264]
在一些实施例中,抗igf-1r抑制剂mab或其抗原结合片段包含seq id no:55的重链氨基酸序列或在与seq id no:55最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。替代性地或除此之外,抗igf-1r抑制剂mab或其抗原结合片段可以包含具有seq id no:56的氨基酸序列的轻链或在与seq id no:56最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。实例8biib022
[0265]
biib022和其他相关igf-1r抑制剂抗体及其制备方法可见于美国专利7,612,178中,将该专利特此通过援引以其全文并入。重链cdr-biib022轻链cdr-biib022biib022biib022
[0266]
本披露的一些实施例是包含重链的抗igf-1r抑制剂mab或其抗原结合片段,该重链包含可变重链cdr1、可变重链cdr2和可变重链cdr3,其中可变重链cdr1包含氨基酸序列seq id no:57,可变重链cdr2包含氨基酸序列seq id no:58;并且可变重链cdr3包含氨基酸序列seq id no:59或与seq id no:57、seq id no:58和seq id no:59最佳比对之后具有至少80%的序列同一性的至少cdr。
[0267]
抗igf-1r抑制剂mab或抗体或其抗原结合片段可以另外包含轻链,该轻链与重链配对形成抗原结合结构域。在一些实施例中,轻链包含可变轻链cdr1、可变轻链cdr2和可变轻链cdr3,其中可变轻链cdr1包含氨基酸序列seq id no:60,可变轻链cdr2包含氨基酸序列seq id no:61;并且可变轻链cdr3包含氨基酸序列seq id no:62或与seq id no:60、seq id no:61和seq id no:62最佳比对之后具有至少80%的同源性的至少cdr。
[0268]
在一些实施例中,抗igf-1r抑制剂mab或其抗原结合片段包含seq id no:63的重链氨基酸序列或在与seq id no:63最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。替代性地或除此之外,抗igf-1r抑制剂mab或其抗原结合片段可以包含具有seq id no:64的氨基酸序列的轻链或在与seq id no:64最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。实例9罗妥木单抗罗妥木单抗的重链(hc)和轻链(lc)
[0269]
在一些实施例中,抗igf-1r抑制剂mab或其抗原结合片段包含seq id no:65的重链氨基酸序列或在与seq id no:65最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。替代性地或除此之外,抗igf-1r抑制剂mab或其抗原结合片段可以包含具有seq id no:66的氨基酸序列的轻链或在与seq id no:66最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。
[0270]
在一些实施例中,所述igf-1r抑制剂是小分子。实例10林西替尼
[0271]
林西替尼和其他相关igf-1r抑制剂小分子及其制备方法可见于us8101613中,将
该专利特此通过援引以其全文并入。预测林西替尼和其中所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例11苦鬼臼脂素
[0272]
苦鬼臼脂素(axl1717)和其他相关igf-1r抑制剂小分子及其制备方法可见于us us4567253中,将该专利特此通过援引以其全文并入。预测苦鬼臼脂素和其中所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例12gtx-134
[0273]
gtx-134和其他相关igf-1r抑制剂小分子及其制备方法可见于us8063225中,将该专利特此通过援引以其全文并入。预测gtx-134和其中所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例13ag1024
[0274]
ag1024和其他相关igf-1r抑制剂小分子及其制备方法可见于wo 1995024190中,将该专利特此通过援引以其全文并入。预测ag1024和其中所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例14bms-536924
[0275]
bms-536924和其他相关igf-1r抑制剂小分子及其制备方法可见于us7081454中,将该专利特此通过援引以其全文并入。预测bms-536924和其中所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例15nvp-aew541
[0276]
nvp-aew541和其他相关igf-1r抑制剂小分子及其制备方法可见于us7326699中,将该专利特此通过援引以其全文并入。预测nvp-aew541和其中所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例16
bms-754807
[0277]
bms-754807和其他相关igf-1r抑制剂小分子s及其制备方法可见于us7534792中,将该专利特此通过援引以其全文并入。预测bms-754807和其中所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例17gsk1838705a
[0278]
gsk1838705a和其他相关igf-1r抑制剂小分子及其制备方法可见于us7981903中,将该专利特此通过援引以其全文并入。预测gsk1838705a和其中所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例18bms-554417
[0279]
bms-554417和其他相关igf-1r抑制剂小分子及其制备方法可见于us 7081454中,将该专利特此通过援引以其全文并入。预测bms-554417和其中所述的其他igf-1r抑制剂在
本文所述的对于治疗ted的活动度量度或评估中具有活性。实例19nvp-adw742
[0280]
nvp-adw742和其他相关igf-1r抑制剂小分子及其制备方法可见于us 7,326,699中,将该专利特此通过援引以其全文并入。预测nvp-adw742和其中所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例20gsk1904529a
[0281]
gsk1904529a和其他相关igf-1r抑制剂小分子及其制备方法可见于us 8,093.239中,将该专利特此通过援引以其全文并入。预测gsk1904529a和其中所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例21kw-2450
[0282]
上文作为甲苯磺酸盐示出但不限于此的kw-2450和其他相关igf-1r抑制剂小分子及其制备方法可见于wo 2006080450、us7605272和wo 2011158931中,将这些专利特此通过
援引以其全文并入。预测kw-2450和本文所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例22pl-225b
[0283]
pl-225b和其他相关igf-1r抑制剂小分子及其制备方法可见于wo 2012145471和wo 2012007926中,将这些专利特此通过援引以其全文并入。pl225b选择性地抑制igf-1r,从而在igf-1r过表达肿瘤细胞中导致对肿瘤细胞增殖的抑制和肿瘤细胞凋亡的诱导。预测pl-225b和本文所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例23insm-18、去甲二氢愈创木酸(ndga)/马索罗酚、actinex
[0284]
insm-18、去甲二氢愈创木酸(ndga)(上文示出为具有相当立体化学,在这种情况下,其也被称为马索罗酚或actinex,但不限于此)(在该实例中被称为insm-18)和其他相关igf-1r抑制剂小分子及其制备方法可至少见于us 2,373,192中,将该专利特此通过援引以其全文并入。insm-18直接抑制igf-1r和c-erbb2/her2/neu受体的激活,从而导致易感肿瘤细胞群体的增殖减少。预测insm-18和本文所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例24
azd3463
[0285]
azd3463和其他相关igf-1r抑制剂小分子及其制备方法可见于us8,461,170中,将该专利特此通过援引以其全文并入。azd3463是强效的alk/igf-1r抑制剂,从而通过克服克唑替尼抗性和诱导细胞凋亡导致对神经母细胞瘤生长的抑制。预测azd3463和本文所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例25azd9362
[0286]
azd9362和其他相关igf-1r抑制剂小分子及其制备方法可见于degorce,sl等人,"discovery of a potent,selective,orally bioavailable,and efficacious novel 2-(pyrazol-4-ylamino)-pyrimidine inhibitor of the insulin-like growth factor-1 receptor(igf-1r)[强效、选择性、口服生物可利用且有效的胰岛素样生长因子-1受体(igf-1r)的新颖2-(吡唑-4-基氨基)-嘧啶抑制剂的发现],"j med chem[药物化学杂志](2016),59(10),4859-4866中,将该文献特此通过援引以其全文并入。azd9362是igf-1r/insr的双重抑制剂。预测azd9362和本文所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例26bi885578
[0287]
bi885578和其他相关igf-1r抑制剂小分子及其制备方法可见于us10414769、us9150578以及sanderson mp等人,“bi 885578,a novel igf1r/insr tyrosine kinase inhibitor with pharmacokinetic properties that dissociate antitumor efficacy and perturbation of glucose homeostasis[具有离解抗肿瘤功效和葡萄糖稳态扰动的
药代动力学特性的新颖igf1r/insr酪氨酸激酶抑制剂bi 885578],”mol cancer ther[分子癌症治疗学]2015年12月;14(12):2762-72中,将这些文献特此通过援引以其全文并入。bi885578是igf1r/insr酪氨酸激酶抑制剂,该抑制剂的突出之处在于快速的肠吸收和短的体内半衰期(由于快速代谢清除率),从而在肿瘤中导致对细胞增殖的抑制和细胞凋亡的诱导。预测bi885578和本文所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例27bi893923
[0288]
bi893923和其他相关igf-1r抑制剂小分子及其制备方法可见于us8546443和titze mi等人,“an allometric pharmacokinetic/pharmacodynamics model for bi 893923,a novel igf-1receptor inhibitor[新颖igf-1受体抑制剂bi 893923的异速药代动力学/药效动力学模型],”cancer chemother pharmacol[癌症化学疗法和药理学]2017年3月;79(3):545-558中,将这些文献特此通过援引以其全文并入。bi893923是igf1r/insr酪氨酸激酶抑制剂,该抑制剂展示出抗肿瘤功效和良好耐受性。预测bi893923和本文所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例28xl-228
[0289]
xl-228和其他相关igf-1r抑制剂小分子及其制备方法可见于us20090232828中,将该专利特此通过援引以其全文并入。xl-228是宽泛的蛋白质激酶抑制剂,该抑制剂有助于细胞增殖、细胞存活和对细胞毒性剂的抗性。预测xl-228和本文所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例29a-928605
[0290]
a-928605和其他相关igf-1r抑制剂小分子及其制备方法可见于us7772231和wo 2007079164中,将这些专利特此通过援引以其全文并入。a-928605是在纯化酶和细胞内igf-ir磷酸化两者上强效的igf-ir抑制剂。预测a-928605和本文所述的其他igf-1r抑制剂在本文所述的对于治疗ted的活动度量度或评估中具有活性。实例30艾司妥单抗(mm-141)
[0291]
艾司妥单抗和其他相关igf-1r抑制剂抗体及其制备方法可见于美国专利8,476,409中,将该专利特此通过援引以其全文并入。重链cdr-艾司妥单抗轻链cdr-艾司妥单抗
[0292]
本披露的一些实施例是包含重链的抗igf-1r抑制剂mab或其抗原结合片段,该重链包含可变重链cdr1、可变重链cdr2和可变重链cdr3,其中可变重链cdr1包含氨基酸序列seq id no:67,可变重链cdr2包含氨基酸序列seq id no:68;并且可变重链cdr3包含氨基酸序列seq id no:69或与seq id no:67、seq id no:68和seq id no:69最佳比对之后具有至少80%的序列同一性的至少cdr。
[0293]
抗igf-1r抑制剂mab或抗体或其抗原结合片段可以另外包含轻链,该轻链与重链配对形成抗原结合结构域。在一些实施例中,轻链包含可变轻链cdr1、可变轻链cdr2和可变轻链cdr3,其中可变轻链cdr1包含氨基酸序列seq id no:70,可变轻链cdr2包含氨基酸序列seq id no:71;并且可变轻链cdr3包含氨基酸序列seq id no:72或与seq id no:70、seq id no:71和seq id no:72最佳比对之后具有至少80%的同源性的至少cdr。
[0294]
在一些实施例中,抗igf-1r抑制剂mab或其抗原结合片段包含seq id no:73的重链氨基酸序列或在与seq id no:73最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。替代性地或除此之外,抗igf-1r抑制剂mab或其抗原结合片段可以包含具有seq id no:74的氨基酸序列的轻链或在与seq id no:74最佳比对之后具有至少85%、90%、95%、97%、98%或99%序列同一性的至少重链。实例31在患有慢性/非活动性甲状腺眼病(ted)的受试者中评价igf-1r抑制的随机化、双掩蔽、安慰剂和/或活性对照、平行组、多中心研究的描述
[0295]
概述。可以进行多中心、任选地双掩蔽、随机化、平行组、安慰剂和/或活性(例如,特普妥木单抗)对照临床试验以确定本文所披露的任何研究药物在患有活动性/急性或非活动性/慢性中度至重度ted的患者中的功效和安全性。可以在年龄在18岁与80岁之间(包括端值)的男性和非妊娠女性患者中进行研究。将招募患者并且在第1天将其以适当比率(例如,1:1、2:1或3:1)随机分配来接受如本文所述施用的安慰剂或活性对照或研究药物。在基线(第1天)访视前4周内将对受试者针对研究进行筛选。可以按疾病持续时间即≤2年或》2年对受试者进行分层。
[0296]
患者群体。可以设计本研究以评估在1)患有中度至重度活动性/急性ted或2)中度至重度非活动性/慢性ted的患者中的活性和安全性。中度至重度急性疾病可以定义为:i)前垂超出人种/性别正常值或超出患者的ted前值≥3mm,ii)临床活动度评分为至少3,以及iii)在症状发作的15个月内。中度至重度慢性疾病可以定义为:i)前垂超出人种/性别正常值或超出患者的ted前值≥3mm,ii)临床活动度评分为0或1,以及iii)在1年内没有显著进展或炎症性症状。
[0297]
治疗期。治疗期的计划持续时间可以是例如12、24或48周(3、6或12个月),具有任选的开放标签扩展研究期。在治疗期结束时-适当时的第12周、第24周或第48周,主要终点应答者以及选择不加入开放标签扩展研究中的非应答者将参加安全性随访期。在治疗期结束时被视为非应答者的受试者可以加入开放标签扩展研究中。
[0298]
所有受试者将参加例如12周或24周或48周的治疗期。所有研究药物给药或初始研究药物给药将在诊所处在临床工作人员的监督下进行。在每个给药日,将在研究药物给药前完成计划的评估(除了ae和伴随药物使用监测,它们将在整个临床访视中监测)。还可以对经历药物相关不良事件的任何受试者进行另外的电话/电子邮件联系和诊所访视。
[0299]
研究终点。主要终点可以是例如研究眼睛中的前垂或复视。可以将前垂评估为应答者的比例(其中应答者定义为在研究眼睛中经历相对于基线的≥2mm减少而在对侧眼中没有前垂的恶化-≥2mm增加的患者)或评估为使用标准眼球突出测量器(例如,hertel)测量的连续变量(即,相对于基线的平均或中位变化)。可以使用主观戈尔曼量表、高曼(goldman)视野计或颈部运动范围方法中的任一种评估复视,只要对于所有患者使用相同评估。
[0300]
测量为连续变量的次要终点可以包括:前垂,复视,眼眶疼痛,针对下直肌、上直肌、内直肌、外直肌和眼眶脂肪的mdi和pvr,临床活动度评分(cas),小腿围和病变面积,炎症性和纤维化生物标记物,与igf-1r抑制相关的转录组学以及关于格雷夫斯眼病特异性生活质量(go-qol)问卷或其外观和功能分量表的结果。也将评估不良事件。
[0301]
过早停止研究药物给药的受试者将返回诊所并且经受计划的治疗期结束评估,并且将被鼓励留在研究中并参与随访期。
[0302]
纳入标准。主要纳入标准将包括以下:-书面知情同意。-在筛选时年龄在18岁与80岁之间(包括端值)的男性或女性受试者。-对于慢性/非活动性ted:ο中度至重度慢性/非活动性ted(非视觉威胁性的但对日常生活具有明显影响),通常与以下项中的一种或多种相关:睑退缩》2mm、中度或重度软组织受累、和/或不恒定或恒定复视。ο在筛选前ted的初始诊断》2年。如通过患者医疗记录确定的稳定、慢性/非活动性ted的临床诊断,这指示在筛选前至少1年内两只眼睛中cas≤1,或以下项中的全部:(a)在筛选前至少1年内没有前垂进展;(b)如果受试者具有由于ted引起的复视史,则在筛选前至少1年内没有复视进展;(c)在筛选前至少1年内没有炎症性症状;以及在筛选前至少1年内没有新的ted症状。ο在筛选和基线访视时cas≤1。-对于急性/活动性ted:ο中度至重度活动性ted(非视觉威胁性的但对日常生活具有明显影响),通常与以下项中的一种或多种相关:睑退缩≥2mm、中度或重度软组织受累、和/或不恒定或恒定复视。ο活动性ted症状的发作(如通过患者记录确定的)在基线前9个月内。ο在筛选和基线时对于受最严重影响的眼睛cas≥3或≥4(在7项量表上)。ο任选地,与活动性ted相关的格雷夫斯病的临床诊断。-在研究者看来(例如,根据疾病前患者照片),眼球突出高于针对人种和性别的正常值或与患者的ted前状态相比≥3mm。-在筛选时受试者必须是甲状腺机能正常的,具有控制下的基线疾病;或者具有轻度甲状腺机能减退或甲状腺机能亢进(定义为游离甲状腺素[ft4]和游离三碘甲状腺氨酸[ft3]水平高于或低于正常限值《50%)。应尽一切努力来迅速矫正轻度的甲状腺机能减退或甲状腺功能亢进并且在临床试验的全部持续时间内维持甲状腺机能正常状态。-不需要立即的手术眼科干预并且未正在计划在研究过程中的矫正手术/照射。-糖尿病受试者必需具有hba1c≤8.0%。
[0303]
排除标准。如果满足以下标准中的任一个,患者可能没有资格参与研究:-由于视神经病变引起的降低的最佳矫正视敏度,如通过在过去6个月内继发于视神经受累的斯内伦视力表(snellen chart)上2行的视力降低、新的视野缺陷或色觉缺陷定义的。-对医学管理无应答的角膜失代偿。-在筛选与基线之间任一眼睛中cas≥1(对于慢性/非活动性ted)或研究眼睛中≥2分(对于急性/活动性ted)的降低。-在筛选与基线之间研究眼睛中≥2mm的前垂降低。-在眼眶照射前,眼眶减压术或斜视手术。-在筛选前6个月内用于治疗ted的静脉内(iv)或口服类固醇或者用于治疗ted的类固醇滴眼液使用。-在筛选前4周内针对除ted之外的病症的皮质类固醇使用(允许用于皮肤病学病症的局部类固醇和吸入类固醇)。-用利妥昔单抗(或)的先前治疗。-用特普妥木单抗的先前治疗。-在筛选前6个月内用托珠单抗(或)或任何其他非类固醇免疫抑制剂治疗。-在筛选前60天内针对任何病症的研究性药剂的使用或在试验过程期间的预期使用。-鉴定出的预先存在的眼科疾病,根据研究者的判断,该眼科疾病将阻止研究参与或使研究结果的解释复杂化。-在过去12个月内的恶性病症(除了成功治疗的皮肤基底/鳞状细胞癌)。-妊娠或哺乳期女性。-在研究者看来或如通过受试者报告的,目前药物或酒精滥用或前2年内任一者史。-活检证明的或临床怀疑的炎症性肠病(例如,持续超过4周的与腹痛或痉挛/腹绞痛、尿急、里急后重或失禁相关联的腹泻伴有或不伴有血液或直肠出血而没有确认的替代性诊断或者肠炎/结肠炎的内窥镜或放射学证据而没有确认的替代性诊断)。-对研究药物的任何组分的已知超敏反应[或对mab的先前超敏反应]-在研究者看来将阻止纳入在研究中的任何其他病症。-先前加入本研究中或参与研究药物的先前临床试验。-人类免疫缺陷病毒、丙型肝炎或乙型肝炎感染。-在筛选时丙氨酸转氨酶(alt)或天冬氨酸转氨酶(ast)》正常上限(uln)的3倍或估计肾小球滤过率《30ml/min/1.73m2。
[0304]
研究目的
[0305]
本研究的总体目的是研究胰岛素样生长因子-1受体(igf-1r)的单克隆抗体(mab)或小分子抑制剂在治疗患有急性或慢性ted的受试者方面的功效、安全性和耐受性。
[0306]
主要目的是在患有慢性/非活动性ted的受试者中评价研究药物相对于安慰剂或特普妥木单抗对研究眼睛中前垂测量或复视(通过主观性戈尔曼量表的改善、高曼视野计或颈部运动范围方法测量的)从基线至治疗期结束(第12周、第24周或第48周)的平均变化的影响。
[0307]
其他目的包括以下项:
[0308]
评价研究药物相对于安慰剂或特普妥木单抗对格雷夫斯眼病生活质量(go-qol)问卷外观和视觉功能分量表从基线至第12周、第24周和/或第48周的平均变化的影响。
[0309]
在第12周、第24周和/或第48周时评价研究药物相对于安慰剂或特普妥木单抗对前垂应答者率(即,在研究眼睛中相对于基线具有≥2mm减少而在对侧眼中没有前垂的恶化[≥2mm增加]的受试者的百分比)的影响。
[0310]
在第12周、第24周和/或第48周时评价研究药物相对于安慰剂或特普妥木单抗对
双眼复视应答者率(即,基线复视》0、具有≥1级减少的受试者的百分比)的影响。
[0311]
评价研究药物相对于安慰剂或特普妥木单抗对眼眶疼痛(在视觉模拟量表[vas]上测量的)从基线至第12周、第24周和/或第48周的平均变化的影响。
[0312]
在获得mri的受试者上评价研究药物相对于安慰剂或特普妥木单抗对针对下直肌、上直肌、内直肌、外直肌和眼眶脂肪的肌肉直径指数(mdi)和像素值比(pvr)(通过磁共振成像[mri]测量的)从基线至第12周、第24周和/或第48周的平均变化的影响。
[0313]
在第12周、第24周和/或第48周时评价研究药物相对于安慰剂或特普妥木单抗对在研究眼睛中具有≥3的临床活动度评分(cas)的受试者的百分比的影响。
[0314]
在具有基线胫前粘液性水肿(ptm)的受试者中评价研究药物相对于安慰剂或特普妥木单抗对小腿围和病变面积(病变的最大长度和宽度)从基线至第12周、第24周和/或第48周的平均变化的影响。
[0315]
评价研究药物相对于安慰剂或特普妥木单抗对炎症性和纤维化生物标记物在第3周、第12周、第24周和/或第48周时相对于基线的变化的影响。
[0316]
评价研究药物相对于安慰剂或特普妥木单抗对与igf-1r抑制相关的转录物组学在第3周、第12周、第24周和/或第48周时相对于基线的变化的影响。
[0317]
药代动力学和抗药物抗体(ada)目的包括以下项:
[0318]
评价研究药物的药代动力学(pk)以估计暴露量。
[0319]
评价研究药物的免疫原性。
[0320]
安全性和耐受性目的包括以下项:
[0321]
基于不良事件(ae)报告、特别感兴趣的不良事件(aesi;高血糖、听力损害和肌肉痉挛)、伴随药物使用、眼科检查、生命体征、临床安全性实验室评价、心电图(ecg)和免疫原性评估研究药物相对于安慰剂或特普妥木单抗的安全性和耐受性。
[0322]
研究期间的限制条件
[0323]
试验将包括三个阶段:筛选(在第1天前28天)、治疗或干预期(第1天至第12周、第24周和/或第48周)和随访期(在例如治疗期结束后的6周或更长时间内)。筛选涉及一至三次访视。在治疗期期间,将对于12周、24周或48周在第1天/基线时和每3周评估患者。可以在整个治疗期中评估功效,例如:-对于具有24周治疗期的研究在第1天/基线和第12和24周时的cas或者对于12或48周治疗期调整的类似时间表;-对于具有24周治疗期的研究在第1天/基线和第3、6、12、18和24周时的前垂和复视或者对于12或48周治疗期调整的类似时间表;-对于具有24周治疗期的研究在第1天/基线和第12和24周时的ptm或者对于12或48周治疗期调整的类似时间表;以及-对于具有24周治疗期的研究在第1天/基线和第3、6、12、18和24周时的眼眶疼痛或者对于12或48周治疗期调整的类似时间表。
[0324]
将来自治疗期结束时的数据(即第12、24或48周)用于评估主要和次要终点。7组分cas的2分的变化将被视为临床相关的,在急性/活动性ted患者中实现0或1的cas也将被视为临床相关的。前垂将通过使用hertel眼球突出测量器来评估。2mm的变化将被视为临床相关的。生活质量将通过使用格雷夫斯眼病特异性生活质量问卷(go-qol)来评价,该问卷包
括单独或组合地评估的两个分量表;每个分量表上的评分以及总体go-qol量表上的评分具有0至100分的范围,其中8分的变化被视为临床相关的。主观性复视将通过主观性戈尔曼量表的改善或高曼视野计或颈部运动范围方法来评估。
[0325]
参与中心的机构审查和伦理委员会和研究者将批准该研究方案。将从所有患者获得目睹的书面知情同意。数据将由研究者及其员工获得。试验中使用的部分/干预
[0326]
本研究中用于在ted中评价的药物可以包括实例1-22中列出的生物或小分子药物中的任一种。特普妥木单抗可以根据其市售配制品提供。其他研究药物可以如下文给予那样或适当地提供。安慰剂将适于给定研究药物,例如iv盐水或缓冲溶液或匹配的安慰剂片剂/胶囊。患者将接受表1中列出的研究药物、或特普妥木单抗、或安慰剂的等同类型和数量的施用。下文提供了剂量。例如,对于分配至特普妥木单抗组的受试者,可以每3周施用一次药物,以10mg/千克体重的初始剂量开始,然后对于剩余输注是20mg/千克。施用的剂量或频率可以如临床医生或研究协调人认为适当的那样改变。
[0327]
如本文针对表1中列出的抗igf-r1抗体药物所披露的,适用于ted中的剂量范围的下端由将实现如本领域所披露的体外ic
50
的最小浓度(c
min
)估计。适用于ted中的剂量范围的上端估计为推荐2期剂量(rp2d)的三倍(如果它不是最大耐受剂量(mtd))或rp2d的2.5倍(如果它是mtd)。
[0328]
如本文针对表1中列出的抗igf-r1小分子药物所披露的,适用于ted中的剂量范围的下端由将实现如本领域所披露的体外ic
50
的最大浓度(c
max
)估计。适用于ted中的剂量范围的上端估计为推荐2期剂量(rp2d)的三倍(如果它不是最大耐受剂量(mtd))或rp2d的2.5倍(如果它是mtd)。
[0329]
除非另外指明,否则表1中的剂量范围作为针对3周间隔(抗体)或每日(小分子)的总剂量给出。表1.研究药物的列表。
[0330]
在上表1中,*表明rp2d是本领域已知的;并且**表明用igf-1r抑制剂的先前临床经验未已知为发表的。
[0331]
在一些实施例中,其他igf-1r抗体可以是如本文所述那样有用的并且涵盖在本披露内。在一些实施例中,如果用抗igf-r1抗体的先前临床经验未发表,则适用于本披露的剂量可以是1-112mg/kg或75-8400mg,每3周一次(q3w);或0.6-75mg/kg或45-5700mg,每2周一次(q2w);或0.3-38mg/kg或22-2900mg,每周一次(qw)。
[0332]
在一些实施例中,其他igf-1r小分子药物可以是如本文所述那样有用的并且涵盖在本披露内。在一些实施例中,如果用小分子igf-1r抑制剂药物的先前临床经验未发表,则适用于本披露的剂量可以是1-2000mg,每日施用一次(qd);或0.6-1400mg,每日施用两次(bid);或0.3-700mg,每日施用三次(tid)。
[0333]
在治疗期的第1天,将受试者以适当比率(例如,2:1或1:1比率,任选地按疾病持续时间分层)随机化至研究药物。安慰剂剂量(iv盐水或缓冲溶液或匹配的安慰剂片剂/胶囊)将用于保持盲法,这是由于与活性比较剂不同的施用时间表和/或施用方法。详细的研究程序
[0334]
在基线(第1天)访视时,可以将患有更显著前垂的眼睛定义为“研究眼睛”。如果两只眼睛受等同影响,则研究者可以选择“研究眼睛”。将评估两只眼睛的功效但可以使用研究眼睛来评估主要结局量度。
[0335]
将通过以下项来评估功效:前垂(作为使用由赞助者提供的hertel仪器(以求测量一致性)对严重程度临床量度的眼球突出评价测量的)、生活质量(使用go-qol问卷)、复视(作为严重程度临床量度的一部分或使用高曼视野计或颈部运动范围方法测量的)、cas(7项或10项量表)、眼眶疼痛(使用10-cm vas)、眼眶mri和/或ptm(小腿围和病变面积)。
[0336]
在第1天给药前和在治疗期结束(例如,第12周、第24周或第48周)时将收集用于研究药物pk评估的血液样品。可以在第1天治疗前和在整个研究中的治疗之后(例如,对于24
周治疗期,在第3、12和24周时)收集血液样品并且对其分析炎症性和纤维化生物标记物并且评价与igf-1r抑制相关的转录组学。
[0337]
将经由以下项评估安全性:ae和伴随药物使用监测、免疫原性测试、眼科检查、生命体征、临床安全性实验室评价(完全血液计数和化学(包括甲状腺面板和hba1c)、妊娠测试(如果适用)和ecg。
[0338]
研究程序(包括针对每一个的时间安排)的汇总提供于评估时间表(表2)中。
[0339]
知情同意:将在筛选期间从每名受试者获得知情同意。
[0340]
纳入/排除标准:在筛选时和在第1天/基线访视时对每名受试者审查纳入/排除标准。
[0341]
人口统计学:可以在筛选期间从每名受试者获得人口统计学数据。
[0342]
医学史:将在筛选时和在第1天/基线访视时从每名受试者获得医学史,包括甲状腺疾病史和治疗、ted史和治疗以及烟草使用史。ted必须是i)急性/活动性ted(症状的发作在基线前9个月内)或ii)稳定、慢性/非活动性的(未进展、非视觉威胁性的但对日常生活明显影响),其中在筛选前诊断出的ted》2年,但不长于7年。
[0343]
重量:可以在筛选时和在整个研究中(例如对于24周治疗期,第12周/第3个月和第24周/第6个月)记录重量。如果在治疗期期间存在重量变化,则可以调整给药。可以将中期研究获得的重量用于后面剂量的剂量计算。
[0344]
随机化:在第1天(基线)时,将对受试者随机化并且接受第一剂量的研究药物。将在给药前进行基线评估。
[0345]
将如本文所述那样对受试者进行随机化以接受:(a)研究药物;或(b)安慰剂或(c)特普妥木单抗-即,研究可以被设计为具有两个臂以将研究药物与安慰剂或特普妥木单抗进行比较,或可以被设计为具有三个臂以比较研究药物、安慰剂和特普妥木单抗。将如本文所述那样给予研究药物。特普妥木单抗输注:输注将在第1天(基线)时发生,并且此后根据市售给药。安慰剂施用将适当地匹配研究药物或特普妥木单抗。
[0346]
针对安全性的手机(电子邮件)联系-输注后的天数:由研究人员集中于安全性和耐受性方面进行的电话(或电子邮件)联系将在第一次和第二次输注后的输注后的第二天(第1天/基线和第3天)以及此后如认为适当的天数进行。此外,也将由研究人员在输注后的第二天以及此后如认为适当的日期通过电话(或电子邮件)联系在任何后续输注之后经历输注相关事件的受试者。功效评估
[0347]
临床活动度评分(cas):将在筛选、在第1天/基线时和在整个研究中(例如对于24周治疗期,第12周/第3个月和第24周/第6个月)从每名受试者获得cas。对于参加慢性/非活动性研究的患者,在筛选和基线访视时两只眼睛中的cas必须≤1。
[0348]
严重程度临床量度-包括前垂和复视:将在筛选时;在第1天/基线时和在整个研究中(例如对于24周治疗期,治疗期的第3周、第6周、第12周/第3个月、第18周和第24周/第6个月;以及随访期的第30周)获得严重程度临床量度。
[0349]
来自筛选的在研究眼睛中具有前垂的≥2mm减少的受试者没有资格用于随机化。
[0350]
胫前粘液性水肿(ptm)评估:可以任选地在第1天/基线时和在整个研究中(例如对于24周治疗期,第12周/第3个月和第24周/第6个月)进行ptm评估。
[0351]
按10cm视觉模拟量表的眼眶疼痛:可以在第1天/基线时和在整个研究中(例如对于24周治疗期,第3周、第6周、第12周/第3个月、第18周和第24周/第6个月)评估眼眶疼痛。安全性评估
[0352]
妊娠测试:将在所有访视时施用妊娠测试。血清妊娠测试在筛选和第48周(或如果早期从治疗中退出,则在最后一次输注后6个月)时。尿液妊娠测试在所有其他访视时的给药前(如果适用)。对有生育潜力的女性受试者(包括在筛选前绝经期开始《2年、在筛选前《12个月内非疗法诱导的闭经或者没有经手术不育[不存在卵巢和/或子宫]的那些)进行。
[0353]
眼科检查:将在筛选、第1天/基线时和在整个研究中(例如对于24周治疗期,第6周、第12周/第3个月、第18周和第24周/第6个月)进行眼科检查。
[0354]
最佳矫正视敏度、瞳孔检查、色觉评估、石原色板(或等同物)或相关红色饱和度缺损、眼内压和裂隙灯检查。如果与先前访视相比,注意到显著异常,包括2行或更多的视力的丧失、瞳孔异常包括传入性瞳孔缺陷的发展、眼内压的升高、角膜浸润物的发展或其他未在此指明但为眼科医生所关注的异常,将根据眼科医生决定进行对视觉功能的进一步研究。
[0355]
具有由于视神经病变引起的降低的最佳矫正视敏度(通过在过去6个月内继发于视神经受累的斯内伦视力表上2行的视力降低、新的视野缺陷或色觉缺陷定义的)的受试者没有资格用于随机化。
[0356]
生命体征:将在所有诊所访视时测量生命体征(血压、心率、呼吸速率、温度)。将在第1天给药前和给药后、以及在其他剂量/输注日给药前测量生命体征。如果发生输注相关ae,将监测另外的生命体征。
[0357]
12导联ecg:将在筛选、第1天/基线时和在整个研究中(例如对于24周治疗期,第3周、第6周、第12周/第3个月和第24周/第6个月)进行心电图(ecg)。临床实验室测试
[0358]
化学:可以在筛选、第1天/基线时和在整个研究中(例如对于24周治疗期,第3周、第6周、第12周/第3个月、第18周、第24周/第6个月、第30周和第36周)评估化学。
[0359]
甲状腺(ft3、ft4、ths):可以在筛选、第1天/基线时和在整个研究中(例如对于24周治疗期,第3周、第6周、第12周/第3个月、第18周、第24周/第6个月、第30周和第36周)评估甲状腺水平。受试者必须是甲状腺机能正常的,具有控制下的基线疾病或者具有轻度甲状腺机能减退或甲状腺机能亢进(定义为ft4和ft3水平高于或低于正常限值《50%)。应尽一切努力来迅速矫正轻度的甲状腺机能减退或甲状腺功能亢进并且在临床试验的全部持续时间内维持甲状腺机能正常状态。
[0360]
血液学:可以在筛选、第1天/基线时和在整个研究中(例如对于24周治疗期,第3周、第6周、第12周/第3个月、第18周、第24周/第6个月、第30周和第36周)评估血液学。
[0361]
hba1c:可以在筛选时和在整个研究中(例如对于24周治疗期,第12周/第3个月和第24周/第6个月)评估hba1c水平。对于随机化,hba1c必须≤8.0%。如果hba1c在筛选后的任何时间点升高并且被视为有临床意义,则将大约每90天重复一次此举,直到它恢复正常值或基线值。
[0362]
ada/nab样品:可以在第1天/基线时和在整个研究中(例如对于24周治疗期,第3周、第12周/第3个月和第24周/第6个月)获得抗药物抗体(ada)/中和抗体(nab)水平。如果样品在ada测试中呈阳性,则在确认性和反应性滴度测试之后,然后将测试样品中的nab。如
果受试者测试对nab呈阳性,则可以跟踪他/她,直到水平恢复至基线或受试者的值减少或保持稳定。在治疗期(或pw)结束时具有阳性nab测试的任何受试者可以继续被跟踪,直到受试者的值减少或保持稳定。
[0363]
ae/sae评估:将周期性地评估ae/sae,最多并包括在每次访视时。在第1天前2周内和在第1天给药前发生的ae将被视为基线体征/症状。在第1天剂量之后至治疗期结束的发生或恶化的ae将被视为治疗突发性ae(teae)。在随访期期间发生或恶化的ae将被视为给药后ae。将记录从签署知情同意书至研究停止后30天发生的所有sae。
[0364]
伴随药物:将周期性地评估伴随药物,最多并包括在每次访视时。
[0365]
格雷夫斯眼病生活质量(go-qol)问卷:可以在第1天/基线时和在整个研究中周期性地(例如对于24周治疗期,第6周、第12周/第3个月和第24周/第6个月)评估go-qol。
[0366]
pk样品:可以在第1天的给药或输注前和结束时以及在整个研究中周期性地(例如对于24周治疗期,治疗期的第3周和第12周/第3个月)收集pk样品,并且可以在治疗期结束时收集单一样品。将不对从治疗期中过早停止的受试者收集pk样品。
[0367]
生物标记物样品:可以在第1天和在整个研究中(例如对于24周治疗期,治疗期的第3周和第12周/第3个月)收集生物标记物样品,并且可以在治疗期结束时收集单一样品。
[0368]
磁共振成像(mri):受试者可以在第1天和在治疗期结束时的访视时经受mri。随机化和掩蔽试验
[0369]
设计随机化试验以评估功效和安全性。对于慢性/非活动性ted的研究,将患者在(任选地)双掩蔽治疗期中随机分配至三个治疗组之一,该随机分配例如以1:1、2:1或3:1比率,在两个区组中,这些区组按慢性/非活动性疾病持续时间≤2年或》2年分层。
[0370]
了解试验组分配的研究药剂师可以准备掩蔽的剂量和/或输注(如果需要的话)。现场主要研究者将仅在紧急情况下识别患者的干预或治疗组(研究药物、活性对照或安慰剂)。临床活动度评分(cas)的计算
[0371]
临床活动度评分由七个组分组成:自发眼球后疼痛、在尝试眼睛移动(向上、左右和向下凝视)时疼痛、结膜发红、眼睑发红、球结膜水肿、肉阜/皱襞肿胀以及眼睑肿胀。每个组分将被评分为存在或不存在,即1或0。每种功效评估时的评分将是存在的所有项的总和,以产生0-7的范围,其中0或1构成非活动性疾病并且7构成重度活动性眼病。≥2分的变化将被视为有临床意义,在患有急性/活动性疾病的患者中实现0或1的cas评分也将被视为有临床意义。格雷夫斯眼病生活质量(go-qol)的评价
[0372]
将通过使用go生活质量问卷评价生活质量。问卷具有两个自评估分量表;一个覆盖视觉功能对日常活动的影响,另一个评估自我感知外观的影响。视觉功能分量表覆盖诸如驾驶、户外散步、阅读、看电视等的活动。外观分量表询问受试者问题,诸如眼病是否改变受试者的外观、使其他人对受试者具有负面反应、引起社交孤立并且使受试者试图掩蔽他或她的外观。每个分量表具有8个问题,其回答有:是-很多;是-一点;或否-一点也不。每个问题分别被评分为0-2,并且然后将总原始评分在数学上转换为0-100量表,其中0表示对生活质量的最负面影响,并且100表示没有影响。在0-100量表上≥8分的变化已经显示为有临床意义。组合评分从两个分量表获取原始评分,并且同样将它们转换为单一0-100量表。
对复视的戈尔曼分级的评估
[0373]
对主观性复视的戈尔曼评估包括四个类别:无复视(不存在)、当患者疲倦或觉醒时的复视(间歇性)、在凝视极端状态下的复视(不恒定)以及在第一眼位或阅读眼位下的连续复视(恒定)。根据患者正在经历的复视级别对他们进行评分。≥1级的改善被视为有临床意义。心电图
[0374]
可以对于所有受试者如事件计划表(表2)中所述那些或由研究者判断进行12导联ecg。当受试者经历怀疑是ir的ae时,也可以进行12导联ecg。
[0375]
可以在筛选、基线(第1天)时和在整个研究中周期性地(例如对于24周治疗期,第3周、第6周、第12周/第3个月和第24周/第6个月),在受试者已经在仰卧位中持续至少5分钟之后进行单一12导联ecg记录。在筛选时允许单一重复测量以进行资格确定。可以记录和报告以下间隔的测量:rr间隔、pr间隔、qrs宽度、qt间隔和qtcf。评估应包括关于临床意义的评论,无论描图是正常还是异常的;节律;心律失常或传导缺陷的存在;形态学;任何心肌梗塞的证据;或st段、t波和u波异常。临床实验室安全性测试
[0376]
可以在筛选时;在第1天时和在整个研究中周期性地(例如对于24周治疗期,治疗期的第3周、第6周、第12周/第3个月、第18周和第24周/第6个月,以及随访期的第30周和第36周)收集血液(用于血液学、临床化学、甲状腺测量)。
[0377]
可以在筛选时和在整个研究中周期性地(例如,对于24周治疗期,治疗期的第12周/第3个月和随访期的第24周/第6个月)测量hba1c。对于随机化,hba1c必须≤8.0%。如果hba1c在筛选后的任何时间点升高并且被视为有临床意义,则将大约每90天重复一次此举,直到它恢复正常值或基线值。
[0378]
可以在第1天时和在整个研究中周期性地(例如对于24周治疗期,治疗期的第3周、第12周/第3个月和第24周/第6个月)测量抗药物抗体(ada)/中和抗体(nab)。如果样品在ada测试中呈阳性,则在确认性和反应性滴度测试之后,然后将测试样品中的nab。如果受试者测试对nab呈阳性,则可以跟踪他/她,直到水平恢复至基线或受试者的值减少或保持稳定。在治疗期(或pw)结束时具有阳性nab测试的任何受试者可以继续被跟踪,直到受试者的值减少或保持稳定。
[0379]
安全性实验室评估可以包括:
[0380]
妊娠测试:血清妊娠测试在筛选和第48周(或最后一次剂量或输注后6个月)时。尿液妊娠测试在所有其他访视时的给药前(如果适用)。对有生育潜力的女性受试者(包括在筛选前绝经期开始《2年、在筛选前《12个月内非疗法诱导的闭经或者没有经手术不育[不存在卵巢和/或子宫]的那些)进行。
[0381]
眼科检查:最佳矫正视敏度、瞳孔检查、色觉评估、石原色板(或等同物)或相关红色饱和度缺损、眼内压和裂隙灯检查。如果与先前访视相比,注意到显著异常,包括2行或更多的视力的丧失、瞳孔异常包括传入性瞳孔缺陷的发展、眼内压的升高、角膜浸润物的发展或其他未在此指明但为眼科医生所关注的异常,将根据眼科医生决定进行对视觉功能的进一步研究
[0382]
生命体征:将在所有诊所访视时测量血压、心率、呼吸速率和温度。将在第1天和第
3周输注前和输注后、以及在所有其他输注日给药前测量生命体征。如果发生输注相关ae,将监测另外的生命体征。试验的结局
[0383]
具有应答的患者可以定义为在第24周满足主要终点的那些患者。此终点可以包括在研究眼睛中前垂减少2mm或更多而在非研究眼睛中不存在相应量的恶化、或前垂相对于基线的平均或中位变化、或在基线复视》0的受试者中≥1级的复视减少。次级终点可以包括前垂,复视和cas(两者均测量为随时间的连续变量),眼眶疼痛,针对下直肌、上直肌、内直肌、外直肌和眼眶脂肪的mdi和pvr,具有基线ptm的受试者中的小腿围和病变面积,炎症性和纤维化生物标记物,与igf-1r抑制相关的转录组学以及通过使用go-qol仪器对患者的生活质量的评估(该问卷包括测量在视觉功能和作为身体外观变化的结果的心理社会功能方面的限制的两个分量表)。患者也可以根据其应答程度进行分类。将根据不良事件、严重不良事件和由于不良事件引起的退出的发生率评估安全性。结果
[0384]
预期本文所述的igf-1r抑制剂在如本文所披露的针对急性/活动性或慢性/非活动性ted的临床研究中作为研究药物测试时在如本文所述的或如本领域技术人员修改的ted结局量度中具有功效。
[0385]
下表2列出了评估时间表的实例,假设24周治疗期并且使用特普妥木单抗作为活性对照或者模拟它,即以3周周期通过输注给药。本表出于说明性目而作为实例呈现,并且不意指与上文指导不一致。本领域技术人员将理解如何在如例如关于qd给药且与安慰剂而不是活性特普妥木单抗对照相比的口服生物可利用的小分子药物的研究可能预期的不同给药时间表或给药途径的情况下修改这个时间表。
其他实施例
[0386]
提供以上列出的详细描述是为了帮助本领域的技术人员实践本披露。然而,本文
描述和要求权利的本披露的范围并不受本文所披露的具体实施例的限制,因为这些实施例旨在阐明本披露的若干方面。任何等效的实施例都旨在处于本披露的范围之内。事实上,除了本文所示和所述的那些,本披露的各种修改根据前面描述对于本领域技术人员来说也将变得清楚,这些修改并不偏离本发明发现的精神或范围。此类修改也旨在落入所附权利要求的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1