用于将人类神经胶质细胞转化为神经元的组合物和方法与流程
用于将人类神经胶质细胞转化为神经元的组合物和方法
1.相关申请的交叉引用
2.本技术要求于2019年11月25日提交的第62/939,964号美国临时专利申请的优先权,该美国临时专利申请的全部公开内容通过引用并入本文。
技术领域
3.本公开总体涉及用于治疗神经病况和将神经胶质细胞转化为神经元的组合物和方法。
背景技术:
4.一直需要可用于预防和/或治疗各种期望生成功能性神经元的病症和病况的替代组合物和方法。本公开适用于这种需要。
技术实现要素:
5.在一个实施例中,本公开包括一种用于生成神经元的方法,所述方法包含使神经胶质细胞与包含毛喉素和胰岛素的化合物组合接触,其中所述毛喉素和胰岛素的组合足以从所述神经胶质细胞生成所述神经元。在一个实施例中,本公开提供了一种药物组合物,其包含毛喉素和胰岛素的组合,并且所述药物组合物任选地进一步包含维生素c(vc)和克唑替尼(cri)中的一种或两种。在一个实施例中,本公开提供了包含药物组合物的制品,所述药物组合物包含毛喉素和胰岛素的组合,所述制品进一步包含提供组合用于治疗与需要功能性神经元相关的病况的指示的印刷材料。因此,提供了用于将神经胶质细胞重编程为神经元的组合物和方法。本公开证明胰岛素和毛喉素的组合足以产生神经元。胰岛素和毛喉素的组合在本文中也称为“ifsk”。因此,在实施例中,本公开提供了一种无细胞、无病毒和无表达载体的神经元生成方法。在实施例中,生成神经元包含将神经胶质细胞转化为神经元。
6.在实施例中,组合物可包含增强所述神经元生成的附加药剂,诸如维生素c(vc)和克唑替尼(cri)。本公开中提供的数据支持所述化合物组合用于在有此需要的受试者中生成神经元的体内用途,其中所述需要源自产生神经元生成需要的各种病症、病况和损伤中的任何一种,如具体实施方式中进一步描述的。
附图说明
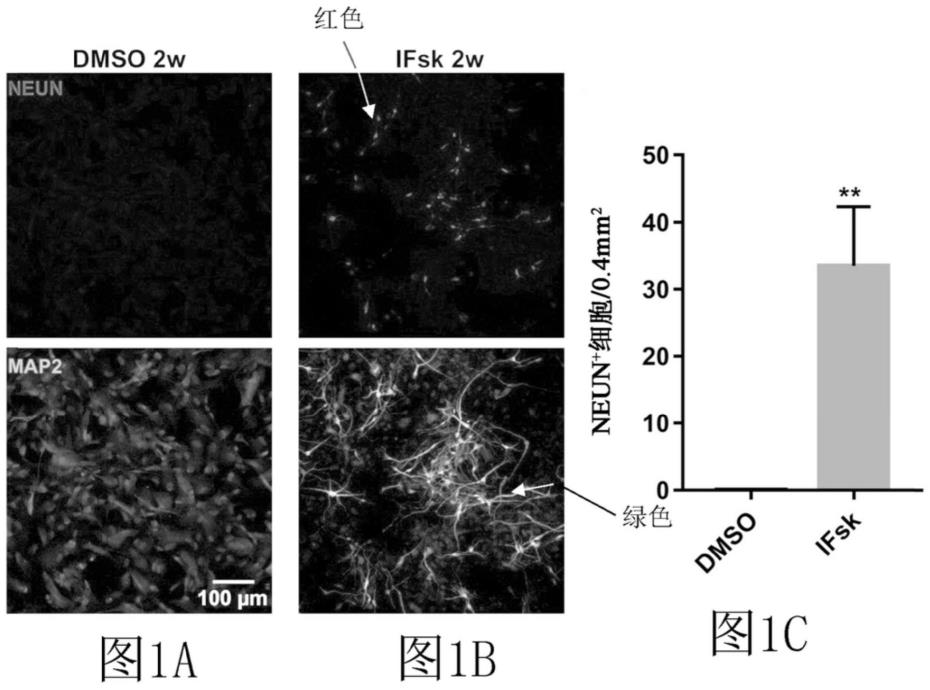
7.图1.将人类星形胶质细胞重编程为神经元的毛喉素和胰岛素(ifsk)治疗。(图1a-图1b)人类星形胶质细胞用0.01%二甲亚砜(dmso)或胰岛素(i)和毛喉素(fsk)组合(50mg/l胰岛素和10μm毛喉素)连续治疗12天。在初始药物治疗后2周用神经元标志物neun(红色)和map2(绿色)进行免疫组织化学。
8.(图1c)在每个视野(0.4mm2)中量化neun
+
细胞的数量。统计分析表明,与dmso对照相比,ifsk一起生成了显著量的神经元。未配对t检验,
**
p《0.01。n=4批。
9.图2.向ifsk中添加克唑替尼和维生素c进一步增加了神经元的产量。(图2a)0.02%dmso的12天治疗几乎没有从人类星形胶质细胞中生成neun
+
或map2
+
神经元。(图2b)用0.25μm克唑替尼和50μg/ml维生素c以及ifsk治疗人类星形胶质细胞导致产生大量神经元。(图2c)neun+细胞的量化表明,cifskv在每个视野(0.4mm2)中一起诱导了75
±
8个神经元,这与dmso对照组有显著差异。未配对t检验,
****
p《0.0001。n=3批。
具体实施方式
10.除非本文另有定义,否则本公开中使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同含义。
11.当呈现一组替代方案时,具体地设想了构成所述组替代方案的成员的任何和所有组合。例如,如果一个项目选自由a、b、c和d组成的群组,则发明人具体设想每个提出的替代方案(例如,单独的a、单独的b等),以及组合如a、b和d;a和c;b和c;等。术语“和/或”在两个或更多个项目的列表中使用时是指所列项目中的任何一个本身或与任何一个或多个其他所列项目的组合。例如,表达“a和/或b”旨在意指a和b中的一个或两者,即单独的a、单独的b或a和b的组合。表达“a、b和/或c”旨在意指单独的a、单独的b、单独的c、a和b的组合、a和c的组合、b和c的组合、或a、b和c的组合。
12.在整个本说明书中给出的每个数值范围都包括其上限值和下限值,以及落入其中的每个较窄的数值范围,就好像此类较窄的数值范围都明确地写在本文中一样。当本文提供数字范围时,该范围被理解为包括范围的边缘以及范围的定义边缘之间的任何数字。例如,“1与10之间”包含1与10之间的任何数字以及数字1和数字10。
13.当提及数字使用术语“约”时,应理解为是指加或减10%。例如,“约100”将包括从90至110。
14.单数术语“一(a)”、“一个(an)”和“该(the)”不旨在限制并且包括复数指代物,除非另有明确说明或上下文另有明确说明。
15.可以将使用本文所述的方法或组合物获得的任何结果与任何合适的参考值进行比较,诸如已知值或对照样品或对照值,鉴于本公开的益处,其合适的实例对于本领域技术人员来说是显而易见的。
16.本公开包含设计用于将人类神经胶质细胞转化为功能性神经元的组合物和方法。在实施例中,该方法包含使神经胶质细胞与有效量的胰岛素和毛喉素的组合接触。在实施例中,使神经胶质细胞与所述组合接触包含向有此需要的受试者施用有效量的胰岛素和毛喉素的组合。
17.毛喉素是可商购的并且其结构是本领域已知的。毛喉素的结构及其分子式可在pubchem id 47936下获得。cri是可商购的并且其结构在本领域中是已知的。cri的结构及其分子式可在pubchem id 11626560下获得。本公开包括每种所述化合物的药学上可接受的盐。
18.胰岛素也是可商购的并且其结构和氨基酸序列也是本领域众所周知的。在实施例中,胰岛素包含动物来源或合成形式的胰岛素。在实施例中,胰岛素包含可从多种来源商购的重组人胰岛素。在实施例中,胰岛素包含二聚体,其包含通过两个二硫键连接在一起的a-链和b-链。a-链包含21个氨基酸,而b-链包含30个残基。cri是可商购的并且其结构是已知
的。在实施例中,胰岛素和毛喉素可能是向受试者施用以将神经胶质细胞转化为神经元的仅有的两种化合物。因此,本公开包括在一个非限制性实施例中向有此需要的受试者施用由胰岛素和毛喉素组成的化合物组合以产生所述神经元生成。然而,本公开包括施用其他化合物。例如,本文证明向胰岛素和毛喉素施用中添加vc和cri增强了胰岛素和毛喉素组合的神经元生成特性。因此,在实施例中,本公开包括向有此需要的受试者施用包含胰岛素、毛喉素以及vc和cri中的一者或两者或由胰岛素、毛喉素以及vc和cri中的一者或两者组成的组合,以产生所描述的神经元生成。在实施例中,预期向有此需要的受试者施用所述化合物组合会导致受试者中的至少一些神经胶质细胞转化为神经元。在实施例中,预期向有此需要的受试者施用所述化合物组合会导致受试者中的至少一种神经胶质细胞转化为神经元。在实施例中,向神经元的转化发生在大约7至14天的时间段内。在实施例中,向神经元的转化发生在7天至8天、7天至9天、7天至10天、8天至9天、8天至10天、8天至11天、9天至10天、9天至11天、9天至12天、10天至11天、10天至12天、10天至13天、11天至12天、11天至13天、11天至14天、12天至13天、12天至14天或13天至14天。在实施例中,转化为神经元的时间不超过7、8、9、10、11、12、13、14、15、16、17、18、19、20或21天。
19.在实施例中,本公开包含但不一定限于从内源性神经胶质细胞生成新的神经元,并且可以包括使用指示的化合物从由于中枢或外周神经系统中的损伤或疾病状况而产生的神经胶质样细胞生成新的神经元,预期其可用于多种疗法,其非限制性实施例包括脑和脊髓修复。
20.使用所述组合物和方法生成的神经元通常是功能性神经元,并且因此能够是以下至少一种的非限制性实例:突触形成、轴突形成、树突形成或神经递质释放。通过所述方法和组合物产生的所生成的神经元的非限制性实例是单极、双极或多极神经元。神经元的非限制性实例包含任何类型的神经元,诸如篮细胞、lugaro细胞、中型多棘神经元、浦肯野细胞或梭形细胞。在实施例中,神经元选自由胆碱能神经元、gaba能神经元、谷氨酸能神经元、多巴胺能神经元、肾上腺素能神经元、运动神经元、肽能神经元和血清素能神经元组成的群组。因此,在实施例中,神经胶质细胞诸如星形胶质细胞被重编程,使得它们被转化为功能性神经元。功能性神经元可以表现出可以包含但不一定限于发射重复动作电位、发育多个树突分支和释放神经递质的特性,该神经递质包括但不一定限于谷氨酸(glutamate/glutamic acid)、多巴胺、乙酰胆碱、血清素、去甲肾上腺素(norepinephrine/noradrenaline)和γ-氨基丁酸(gaba)。因此,预期通过使用本文所述的方法和组合物本公开将促进新的皮质前脑神经元、或中脑神经元、或后脑神经元、或脊髓神经元、或外周神经元或其组合的发育,本领域技术人员可根据需要以鉴于本公开的益处显而易见的方式调整该方法。在实施例中,神经胶质细胞被转化为表达神经元标志物neun(也称为neun)或微管相关蛋白2(map-2)中的一种或两种的神经元。在实施例中,生成的神经元表达dcx。在实施例中,生成的神经元不表达胶质纤维酸性蛋白(gfap)。
21.在实施例中,神经胶质细胞被重编程以形成神经元。转化为神经元的神经胶质细胞可以是任何类型的神经胶质细胞。在实施例中,神经胶质细胞是存在于中枢神经系统包括但不一定限于脑中的非神经元细胞,并且因此在与所述化合物组合接触之前,不产生电脉冲。在实施例中,神经胶质细胞包含星形胶质细胞。在实施例中,星形胶质细胞是原生质或纤维性星形胶质细胞。在实施例中,神经胶质细胞包含反应性星形胶质细胞,其是神经胶
质瘢痕的主要细胞成分。在实施例中,神经胶质细胞是ng2神经胶质细胞。在实施例中,神经胶质细胞是小神经胶质细胞。在实施例中,神经胶质细胞是放射状神经胶质细胞。在实施例中,神经胶质细胞表达一种或多种选自gfap、水通道蛋白-4(aqp4)、谷氨酰胺合成酶、10-甲酰基四氢叶酸脱氢酶(aldh1l1)及其组合的标志物。在实施例中,神经胶质细胞表达gfap。在实施例中,神经胶质细胞表达aqp4。在实施例中,神经胶质细胞表达谷氨酰胺合成酶。在实施例中,神经胶质细胞表达aldh1l1。
22.如本文所用,术语“受试者”是指任何动物受试者。动物受试者的非限制性实例包括人类、实验动物(例如,非人灵长类动物、大鼠、小鼠)、家畜(例如,牛、绵羊、山羊、猪、火鸡、鸡)和家庭宠物(例如,狗、猫、啮齿动物等)。
23.在实施例中,预期本公开可广泛适用于需要神经元生成的任何人类受试者的疗法。在实施例中,需要神经元生成的受试者具有神经病况。由于影响神经元功能和/或减少受试者中功能性神经元数量的多种病况、病症或损伤中的任何一种,产生了对神经元生成的需求。因此,本公开适用于预防和/或治疗病况,其包括但不一定限于缺血性脑损伤,诸如由中风、缺氧或其他脑外伤引起,或神经胶质瘢痕,或神经变性,或衰老,或小头畸形,或导致神经元丢失的严重癫痫。在实施例中,神经病况选自由以下组成的群组:阿尔茨海默病、帕金森病、肌萎缩侧索硬化症(als)、亨廷顿病、癫痫症、身体损伤、中风、脑动脉瘤、外伤性脑损伤、脑震荡、肿瘤、炎症、感染、共济失调、脑萎缩、脊髓萎缩、多发性硬化、外伤性脊髓损伤、缺血性或出血性脊髓病(脊髓病)、全心缺血、缺氧缺血性脑病、栓塞、纤维软骨栓塞性脊髓病、血栓形成、肾病、慢性炎性疾病、脑膜炎、和脑静脉窦血栓形成。
24.在实施例中,本公开适用于治疗有此需要的受试者的神经变性病症。在实施例中,本公开适用于治疗有此需要的受试者的神经病况。在实施例中,受试者需要治疗选自由以下组成的群组的病况:阿尔茨海默病、伴有痴呆的其他病况、慢性创伤性脑病(cte)、帕金森病、亨廷顿病、多发性硬化、脊髓损伤、脊髓性肌萎缩、肌萎缩侧索硬化症(als)和中风。在实施例中,受试者患有阿尔茨海默病。在实施例中,受试者患有伴有痴呆的第二病况。在实施例中,受试者患有cte。在实施例中,受试者患有帕金森病。在实施例中,受试者患有亨廷顿病。在实施例中,受试者患有多发性硬化。在实施例中,受试者患有脊髓损伤。在实施例中,受试者患有肌萎缩。在实施例中,受试者患有als。在实施例中,受试者患有中风。
25.在实施例中,有此需要的受试者是男性。在实施例中,有此需要的受试者是女性。在实施例中,有此需要的受试者是中性。在实施例中,有此需要的受试者是早产儿。在实施例中,早产儿在妊娠36周之前出生。在实施例中,有此需要的受试者是足月儿。在实施例中,足月儿是小于约2个月龄。在实施例中,有此需要的受试者是新生儿。在实施例中,新生儿是小于约1个月龄。在实施例中,有此需要的受试者是婴儿。在实施例中,婴儿是2个月至24个月龄。在实施例中,婴儿是2个月至3个月龄、2个月至4个月龄、2个月至5个月龄、3个月至4个月龄、3个月至5个月龄、3个月至6个月龄、4个月至5个月龄、4个月至6个月龄、4个月至7个月龄、5个月至6个月龄、5个月至7个月龄、5个月至8个月龄、6个月至7个月龄、6个月至8个月龄、6个月至9个月龄、7个月至8个月龄、7个月至9个月龄、7个月至10个月龄、8个月至9个月龄、8个月至10个月龄、8个月至11个月龄、9个月至10个月龄、9个月至11个月龄、9个月至12个月龄、10个月至11个月龄、10个月至12个月龄、10个月至13个月龄、11个月至12个月龄、11个月至13个月龄、11个月至14个月龄、12个月至13个月龄、12个月至14个月龄、12个月至15
个月龄、13个月至14个月龄、13个月至15个月龄、13个月至16个月龄、14个月至15个月龄、14个月至16个月龄、14个月至17个月龄、15个月至16个月龄、15个月至17个月龄、15个月至18个月龄、16个月至17个月龄、16个月至18个月龄、16个月至19个月龄、17个月至18个月龄、17个月至19个月龄、17个月至20个月龄、18个月至19个月龄、18个月至20个月龄、18个月至21个月龄、19个月至20个月龄、19个月至21个月龄、19个月至22个月龄、20个月至21个月龄、20个月至22个月龄、20个月至23个月龄、21个月至22个月龄、21个月至23个月龄、21个月至24个月龄、22个月至23个月龄、22个月至24个月龄和23个月至24个月龄。在实施例中,有此需要的受试者是幼儿。在实施例中,幼儿是1岁至4岁。在实施例中,幼儿是1岁至2岁、1岁至3岁、1岁至4岁、2岁至3岁、2岁至4岁和3岁至4岁。在实施例中,有此需要的受试者是小儿。在实施例中,小儿是2岁至5岁。在实施例中,小儿是2岁至3岁、2岁至4岁、2岁至5岁、3岁至4岁、3岁至5和4岁至5岁。在实施例中,有此需要的受试者是儿童。在实施例中,儿童是6岁至12岁。在实施例中,儿童是6岁至7岁、6岁至8岁、6岁至9岁、7岁至8岁、7岁至9岁、7岁至10岁、8岁至9岁、8岁至10岁、8岁至11岁、9岁至10岁、9岁至11岁、9岁至12岁、10岁至11岁、10岁至12岁和11岁至12岁。在实施例中,有此需要的受试者是青少年。在实施例中,青少年是13岁至19岁。在实施例中,青少年是13岁至14岁、13岁至15岁、13岁至16岁、14岁至15岁、14岁至16岁、14岁至17岁、15岁至16岁、15岁至17岁、15岁至18岁、16岁至17岁、16岁至18岁、16岁至19岁、17岁至18岁、17岁至19岁和18岁至19岁。在实施例中,有此需要的受试者是儿科受试者。在实施例中,儿科受试者是1天龄至18岁。在实施例中,儿科受试者是1天龄至1岁、1天龄至2岁、1天龄至3岁、1岁至2岁、1岁至3岁、1岁至4岁、2岁至3岁、2岁至4岁、2岁至5岁、3岁至4岁、3岁至5岁、3岁至6岁、4岁至5岁、4岁至6岁、4岁至7岁、5岁至6岁、5岁至7岁、5岁至8岁、6岁至7岁、6岁至8岁、6岁至9岁、7岁至8岁、7岁至9岁、7岁至10岁、8岁至9岁、8岁至10岁、8岁至11岁、9岁至10岁、9岁至11岁、9岁至12岁、10岁至11岁、10岁至12岁、10岁至13岁、11岁至12岁、11岁至13岁、11岁至14岁、12岁至13岁、12岁至14岁、12岁至15岁、13岁至14岁、13岁至15岁、13岁至16岁、14岁至15岁、14岁至16岁、14岁至17岁、15岁至16岁、15岁至17岁、15岁至18岁、16岁至17岁、16岁至18岁和17岁至18岁。在实施例中,有此需要的受试者是老年受试者。在实施例中,老年受试者是65岁至95岁或更高。在实施例中,老年受试者是65岁至70岁、65岁至75岁、65岁至80岁、70岁至75岁、70岁至80岁、70岁至85岁、75岁至80岁、75岁至85岁、75岁至90岁、80岁至85岁、80岁至90岁、80岁至95岁、85岁至90岁和85岁至95岁。在实施例中,有此需要的受试者是成年人。在实施例中,成年受试者是20岁至95岁或更高。在实施例中,成年受试者是20岁至25岁、20岁至30岁、20岁至35岁、25岁至30岁、25岁至35岁、25岁至40岁、30岁至35岁、30岁至40岁、30岁至45岁、35岁至40岁、35岁至45岁、35岁至50岁、40岁至45岁、40岁至50岁、40岁至55岁、45岁至50岁、45岁至55岁、45岁至60岁、50岁至55岁、50岁至60岁、50岁至65岁、55岁至60岁、55岁至65岁、55岁至70岁、60岁至65岁、60岁至70岁、60岁至75岁、65岁至70岁、65岁至75岁、65岁至80岁、70岁至75岁、70岁至80岁、70岁至85岁、75岁至80岁、75岁至85岁、75岁至90岁、80岁至85岁、80岁至90岁、80岁至95岁、85岁至90岁和85岁至95岁。在实施例中,有此需要的受试者是1岁至5岁、2岁至10岁、3岁至18岁、21岁至50岁、21岁至40岁、21岁至30岁、50岁至90岁、60岁至90岁、70岁至90岁、60岁至80岁、或65岁至75岁。在实施例中,有此需要的受试者是年轻老年受试者(65至74岁)。在实施例中,有此需要的受试者是中年老年受试者(75至84岁)。在实施例中,有此需要的受试者是老年受试者(》85岁)。
26.在实施例中,根据本公开的方法治疗的受试者没有用胰岛素治疗除了需要神经元生成之外的病况。在实施例中,受试者没有i型或ii型糖尿病。在实施例中,根据本公开的方法治疗的受试者正在用胰岛素治疗除了需要神经元生成之外的病况。在实施例中,受试者确实患有i型或ii型糖尿病。
27.在实施例中,受试者由于损伤而需要所述疗法,损伤可以由本领域已知的多种原因引起,并且通常涉及损伤后的星形胶质细胞增生或包括脑和脊髓在内的中枢神经系统和外周神经系统的疾病过程。
28.一般而言,本公开的方法包含向受试者施用有效量的本文所述的化合物,使得受试者中的神经元数量增加。化合物的施用量与已经获得fda批准的量相同或相似。每种fda批准的药物的剂量可以在例如www.accessdata.fda.gov/scripts/cder/drugsatfda/中找到,与所述化合物有关的公开通过引用并入本文,它存在于本技术或专利的有效提交日期之前。因此,鉴于本公开的益处,可以结合本领域技术人员的知识来确定一种或多种化合物的适当剂量。在实施例中,当确定活性成分有效量和给药方案时,可以考虑受试者的体重和年龄、神经元损伤或疾病的个人史和经历相同神经元损伤的风险,或胶质瘢痕或反应性胶质增生的存在。在实施例中,化合物以一天约0.01nmol至约500nmol的量施用(包括端点),并且包括其间的所有整数和范围,这取决于所使用的递送方法。在实施例中,化合物以一天约0.01nmol至约25nmol、约0.01nmol至约50nmol、约0.01nmol至约75nmol、约25nmol至约50nmol、约25nmol至约75nmol、约25nmol至约100nmol,about、约50nmol至约75nmol、约50nmol至约100nmol、约50nmol至约125nmol、约75nmol至约100nmol、至约75nmol至约125nmol、至约75nmol至约150nmol、至约100nmol至约125nmol至约100nmol至约150nmol、至约100nmol至约175nmol,125nmol至约150nmol、约125nmol至约175nmol、约125nmol至约200nmol、约150nmol至约175nmol、约150nmol至约200nmol、约150nmol至约225nmol、约175nmol至约200nmol、至约175nmol至约225nmol、至约175nmol至约250nmol、至约200nmol至约225nmol至约200nmol至约250nmol、至约200nmol至约275nmol,225nmol至约250nmol、约225nmol至约275nmol、约225nmol至约300nmol、约250nmol至约275nmol、约250nmol至约300nmol、约250nmol至约325nmol、约275nmol至约300nmol、至约275nmol至约325nmol、至约275nmol至约350nmol、至约300nmol至约325nmol至约300nmol至约350nmol、至约300nmol至约375nmol,325nmol至约350nmol、约325nmol至约375nmol、约325nmol至约400nmol、约350nmol至约375nmol、约350nmol至约400nmol、约350nmol至约425nmol、约375nmol至约400nmol、至约375nmol至约425nmol、至约375nmol至约450nmol、至约400nmol至约325nmol至约400nmol至约450nmol、至约400nmol至约475nmol、至约425nmol至约450nmol、至约425nmol至约475nmol、至约425nmol至约500nmol、至约450nmol至约475nmol或至约450nmol至约500nmol的量施用。在实施例中,化合物以单次、多次或控释剂量方案提供。在实施例中,化合物同时施用。在实施例中,化合物顺序施用。在实施例中,所有至少两种化合物作为同一药物制剂的组分施用。在实施例中,组合中的仅有活性成分是毛喉素和胰岛素。在实施例中,组合中的仅有活性成分是毛喉素和胰岛素,以及vc或cri中的至少一种。在实施例中,组合中的仅有活性成分是毛喉素胰岛素、vc和cri。
[0029]“活性成分”是指作用于神经胶质细胞以将所述神经胶质细胞转化为神经元的化合物。因此,“活性成分”不包括添加到例如药物制剂中以含有活性成分或以其他方式促进
将活性成分递送至神经胶质细胞的试剂,此类试剂包括但不一定限于缓冲剂、盐、药学上合适的赋形剂、载体等。因此,在实施例中,本公开包括药物制剂和使用所述制剂的方法,其中药物制剂中的仅有活性成分由胰岛素和毛喉素,胰岛素、毛喉素和vc,或胰岛素、毛喉素、vc和cri组成。然而,在实施例中,所述方法可以与其他合适的神经元生成组合物和方法组合,条件是它们不含细胞和重组多核苷酸组合物。
[0030]
在实施例中,术语“治疗有效剂量”或“药物活性剂量”是指将神经胶质细胞转化为神经元的单独或组合的胰岛素、毛喉素、vc和cri的量。在实施例中,治疗有效剂量治疗神经病况。
[0031]
在实施例中,胰岛素的治疗有效剂量为5mg/ml至100mg/ml。在实施例中,胰岛素的治疗有效剂量为5mg/ml至10mg/ml、5mg/ml和15mg/ml、5mg/ml至20mg/ml、10mg/ml至15mg/ml、10mg/ml至20mg/ml、10mg/ml至25mg/ml、15mg/ml至20mg/ml、15mg/ml至25mg/ml、15mg/ml至30mg/ml、20mg/ml至25mg/ml、20mg/ml至30mg/ml、20mg/ml至35mg/ml、25mg/ml至30mg/ml、25mg/ml至35mg/ml、25mg/ml至40mg/ml、30mg/ml至35mg/ml、30mg/ml至40mg/ml、30mg/ml至45mg/ml、35mg/ml至40mg/ml、35mg/ml至45mg/ml、35mg/ml至50mg/ml、40mg/ml至45mg/ml、40mg/ml至50mg/ml、40mg/ml至55mg/ml、45mg/ml至50mg/ml、45mg/ml至55mg/ml、45mg/ml至60mg/ml、50mg/ml至55mg/ml、50mg/ml至60mg/ml、50mg/ml至65mg/ml、55mg/ml至60mg/ml、55mg/ml至65mg/ml、55mg/ml至70mg/ml、60mg/ml至65mg/ml、60mg/ml至70mg/ml、60mg/ml至75mg/ml、65mg/ml至70mg/ml、65mg/ml至75mg/ml、65mg/ml至80mg/ml、70mg/ml至75mg/ml、70mg/ml至80mg/ml、70mg/ml至85mg/ml、75mg/ml至80mg/ml、75mg/ml至85mg/ml、75mg/ml至90mg/ml、80mg/ml至85mg/ml、80mg/ml至90mg/ml、80mg/ml至95mg/ml、85mg/ml至90mg/ml、85mg/ml至95mg/ml、85mg/ml至100mg/ml、90mg/ml至95mg/ml、90mg/ml至100mg/ml或95mg/ml至100mg/ml。
[0032]
在实施例中,毛喉素的治疗有效剂量为0.1μm至20μm。在实施例中,毛喉素的治疗有效剂量为0.1μm至1μm、0.1μm至5μm、0.1μm至10μm、1μm至5μm、1μm至10μm、1μm至15μm、5μm至10μm、5μm至15μm、5μm至20μm、10μm至15μm、10μm至20μm或15μm至20μm。
[0033]
在实施例中,cri的治疗有效剂量为0.1μm至1μm。在实施例中,cri的治疗有效剂量为0.1μm至0.2μm、0.1μm至0.3μm、0.1μm至0.4μm、0.2μm至0.3μm、0.2μm至0.4μm、0.2μm至0.5μm、0.3μm至0.4μm、0.3μm至0.5μm、0.3μm至0.6μm、0.4μm至0.5μm、0.4μm至0.6μm、0.4μm至0.7μm、0.5μm至0.6μm、0.5μm至0.7μm、0.5μm至0.8μm、0.6μm至0.7μm、0.6μm至0.8μm、0.6μm至0.9μm、0.7μm至0.8μm、0.7μm至0.9μm、0.7μm至1.0μm、0.8μm至0.9μm、0.8至1.0μm或0.9μm至1μm。
[0034]
在实施例中,vc的治疗有效剂量为1μg/ml至10μg/ml。在实施例中,vc的治疗有效剂量为1μg/ml至2μg/ml、1μg/ml至3μg/ml、1μg/ml至4μg/ml、2μg/ml至3μg/ml、2μg/ml至4μg/ml、2μg/ml至5μg/ml、3μg/ml至4μg/ml、3μg/ml至5μg/ml、3μg/ml至6μg/ml、4μg/ml至5μg/ml、4μg/ml至6μg/ml、4μg/ml至7μg/ml、5μg/ml至6μg/ml、5μg/ml至7μg/ml、5μg/ml至8μg/ml、6μg/ml至7μg/ml、6μg/ml至8μg/ml、6μg/ml至9μg/ml、7μg/ml至8μg/ml、7μg/ml至9μg/ml、7μg/ml至10μg/ml、8μg/ml至9μg/ml、8至1.0μg/ml或9μg/ml至1.0μg/ml。
[0035]
在实施例中,至少每天一次或至少每周一次将治疗有效剂量递送至有需要的受试者,持续至少两个连续日或周。在实施例中,至少每天一次或至少每周一次将治疗有效剂量
递送至有此需要的受试者,持续至少3、4、5、6、7、8、9、10、11、12、13、14或15个连续日或周。在实施例中,至少每天一次或至少每周一次将治疗有效剂量递送至有此需要的受试者,持续至少1、2、3、4、5、6、7、8、9、10、11或12个连续周。在实施例中,至少每天一次或至少每周一次将治疗有效剂量递送至有此需要的受试者,持续至多4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个连续日或周。在实施例中,至少每天一次或至少每周一次将治疗有效剂量递送至有此需要的受试者,持续至多1、2、3、4、5、6、7、8、9、10、11或12个连续周或月。在实施例中,将治疗有效剂量递送至有此需要的受试者,至少施用一次,持续至少1、2、3、4、5、6、7、8、9、10、11或12个连续月或年,长期地持续受试者的整个生命周期,或无限期的时间段。在实施例中,每年一次将治疗有效剂量递送至有此需要的受试者,持续连续2年、连续3年或连续5年。在实施例中,每年一次将治疗有效剂量递送至有此需要的受试者,持续连续2年。在实施例中,每年一次将治疗有效剂量递送至有此需要的受试者,持续连续3年。在实施例中,每年一次将治疗有效剂量递送至有此需要的受试者,持续连续5年。
[0036]
在实施例中,本文提供的组合物基本上由毛喉素和胰岛素组成。在实施例中,本文提供的组合物基本上由毛喉素、胰岛素和vc组成。在实施例中,本文提供的组合物基本上由毛喉素、胰岛素、vc和cri组成。
[0037]
可以在药物制剂中提供包含本公开化合物的组合物。药物制剂的形式没有特别限制,但通常包含这些活性成分和至少一种非活性成分。在实施例中,合适的药物组合物可以通过将化合物中的任何一种或组合与药学上可接受的载体、稀释剂或赋形剂混合来制备,并且合适的此类组分是本领域公知的。此类载体、稀释剂和赋形剂的一些实例可见于:《雷明顿:药学科学与实践(remington:the science and practice of pharmacy)》(2005)第21版,philadelphia,pa.lippincott williams&wilkins。在实施例中,药物制剂适用于将活性成分递送穿过血脑屏障,和/或递送至脊髓或中枢神经系统的其他组分。此类组合物可包含例如脂质制剂或其他基于纳米颗粒的递送系统。
[0038]
在实施例中,药物制剂适合口服施用,并且因此可以以雾化、液体或固体剂型提供。固体剂型包括但不一定限于用于吞咽或口服溶解的片剂、胶囊、囊片和条,并且可以提供用于快速或延长释放,或在一段时间内以期望的系列释放不同的化合物。也可以使用包含化合物中的一种或任何组合的单独的药物组合物。
[0039]
关于药物制剂的施用,施用途径可以是任何合适的途径。在实施例中,包含一种或多种化合物的组合物是口服递送的。在其他非限制性实施例中,静脉内、肠胃外、皮下、腹膜内、经皮、通过鼻内滴注、通过植入、动脉内或通过鞘内施用来施用组合物。在实施例中,可以使用可植入医疗装置,诸如泵,包括但不限于渗透泵。在实施例中,包含所述化合物的组合物通过颅内途径递送。
[0040]
在实施例中,本公开包括营养组合物,其被设计成赋予受试者与改善的神经元健康和/或功能相关的有益效果。在某些实施例中,所述组合物可用于改善受试者的总体健康或受试者的认知能力,诸如以用于改善记忆或记忆维持。在实施例中,组合物可用于改善任何或所有短期记忆、长期记忆或运动技能,包括但不一定限于粗大和精细运动技能。因此,包含本文所述的小分子的营养补充剂的使用涵盖在本公开中。
[0041]
在实施例中,本公开的治疗有效剂量实现了至少约50%的神经病况的缓解、治愈、响应率或消退率。在实施例中,治疗有效剂量消除、减少、减缓或延迟一种或多种神经病况
症状。神经病况症状的非限制性实例包括震颤、动作迟缓(运动徐缓)、肌肉僵硬、姿势和平衡受损、自动运动丧失、运动不协调、不受控制的运动、自发的冲击运动、言语变化、麻木和书写变化。在实施例中,神经病况症状是运动症状。运动症状的非限制性实例包括不自主运动障碍或自主运动障碍。在实施例中,神经病况症状是认知症状。认知症状的非限制性实例包括精细运动技能、震颤、癫痫、舞蹈病、肌张力障碍、运动障碍、缓慢或异常的眼球运动、步态受损、姿势受损、平衡受损、言语困难、吞咽困难、组织困难、优先排序困难(difficulty prioritizing)、难以专注于任务、缺乏灵活性、缺乏冲动控制、爆发、对自己的行为和/或能力缺乏意识、处理思想缓慢、学习新信息困难、记忆事情困难、沟通困难、遵照命令困难、执行任务困难。
[0042]
在实施例中,神经病况症状是精神症状。精神症状的非限制性实例包括抑郁、易怒、悲伤或冷漠、社交退缩、失眠、疲劳、缺乏精力、强迫症、躁狂症、躁郁症和体重减轻。在实施例中,神经病况症状是至少一个血管受损。在实施例中,神经病况症状是血脑屏障受损。在实施例中,神经病况症状是血流受损。用于评价神经病况症状的消除、减少、减缓或延迟的测试的非限制性实例包括统一亨廷顿病评定量表(uhdrs)评分、uhdrs总功能能力(tfc)、uhdrs功能评估、uhdrs步态评分、uhdrs总运动评分(tms)、汉密尔顿抑郁量表(ham-d)、哥伦比亚自杀严重程度评定量表(c-ssrs)、蒙特利尔认知评估(moca)、改良rankin量表(mrs)、美国国立卫生研究院卒中量表(nihss)和巴氏指数(bi)、起立-行走计时测试(tug)、chedoke上肢和手功能活动量表(cahai)、符号数字模态测试、受控口语词语联想任务(controlled oral word association tasks)、磁共振成像(mri)、功能磁共振成像(fmri)和正电子发射断层扫描(pet)扫描。
[0043]
在实施例中,治疗有效剂量实现约10%至约100%或更多的治疗有效剂量的缓解、治愈、响应率或消退率。在实施例中,治疗有效剂量实现10%至100%的神经病况的缓解、治愈、响应率或消退率,例如10%至15%、10%至20%、10%至25%、15%至20%、15%至25%、15%至30%、20%至25%、20%至30%、20%至35%、25%至30%、25%至35%、25%至40%、30%至35%、30%至40%、35%至45%、35%至50%、40%至45%、40%至50%、40%至55%、45%至50%、45%至55%、45%至60%、50%至55%、50%至60%、50%至65%、55%至60%、55%至65%、55%至70%、60%至65%、60%至70%、60%至75%、65%至70%、65%至75%、65%至80%、70%至75%、70%至80%、70%至85%、75%至80%、75%至85%、75%至90%、80%至85%、80%至90%、80%至95%、85%至90%、85%至95%、85%至100%、90%至95%、90%至100%或95%至100%。
[0044]
在实施例中,治疗有效剂量消除、减少、减缓或延迟10%至100%的一种或多种神经病况症状,例如10%至约15%、10%至20%、10%至25%、15%至20%、15%至25%、15%至30%、20%至25%、20%至30%、20%至35%、25至30%、25%至35%、25%至40%、30%至35%、30%至40%、35%至45%、35%至50%、40%至45%、40%至50%、40%至55%、45%至50%、45%至55%、45%至60%、50%至55%、50%至60%、50%至65%、55%至60%、55%至65%、55%至70%、60%至65%、60%至70%、60%至75%、65%至70%、65%至75%、65%至80%、70%至75%、70%至80%、70%至85%、75%至80%、75%至85%、75%至90%、80%至85%、80%至90%、80%至95%、85%至90%、85%至95%、85%至100%、90%至95%、90%至100%或95%至100%。
[0045]
在实施例中,在治疗当天、治疗后1天、治疗后3个月、治疗后6个月、治疗后1年和治疗后每年评估神经病况症状。
[0046]
在实施例中,在治疗后1天至治疗后7天评估神经病况症状。在实施例中,可以在治疗后1天至治疗后2天、治疗后1天至治疗后3天、治疗后1天至治疗后4天、治疗后2天至治疗后3天、治疗后2天至治疗后4天、治疗后2天至治疗后5天、治疗后3天至治疗后4天、治疗后3天至治疗后5天、治疗后3天和治疗后6天、治疗后4天至治疗后5天、治疗后4天至治疗后6天、治疗后4天至治疗后7天、治疗后5天至治疗后6天、治疗后5天至治疗后7天或治疗后6天至治疗后7天评估症状。在实施例中,可以在治疗后1周至治疗后4周评估症状。在实施例中,可以在治疗后1周至治疗后2周、治疗后1周至治疗后3周、治疗后1周至治疗后4周、治疗后2周至治疗后3周、治疗后2周至治疗后4周或治疗后3周至治疗后4周评估症状。在实施例中,可以在治疗后1个月至治疗后12个月评估症状。在实施例中,可以在治疗后1个月至治疗后2个月、治疗后1个月至治疗后3个月、治疗后1个月至治疗后4个月、治疗后2个月至治疗后3个月、治疗后2个月至治疗后4个月、治疗后2个月至治疗后5个月、治疗后3个月至治疗后4个月、治疗后3个月至治疗后5个月、治疗后3个月至治疗后6个月、治疗后4个月至治疗后5个月、治疗后4个月至治疗后6个月、治疗后4个月至治疗后7个月、治疗后5个月至治疗后6个月、治疗后5个月至治疗后7个月、治疗后5个月至治疗后8个月、治疗后6个月至治疗后7个月、治疗后6个月至治疗后8个月、治疗后6个月至治疗后9个月、治疗后7个月至治疗后8个月、治疗后7个月至治疗后9个月、治疗后7个月至治疗后10个月、治疗后8个月至治疗后9个月、治疗后8个月至治疗后10个月、治疗后8个月至治疗后11个月、治疗后9个月至治疗后10个月、治疗后9个月至治疗后11个月、治疗后9个月至治疗后12个月、治疗后10个月至治疗后11个月、治疗后10个月至治疗后12个月或治疗后11个月至治疗后12个月评估症状。在实施例中,可以在治疗后1年至治疗后约20年评估症状。在实施例中,可以在治疗后1年至治疗后5年、治疗后1年至治疗后10年、治疗后1年至治疗后15年、治疗后5年至治疗后10年、治疗后5年至治疗后15年、治疗后5年至治疗后20年、治疗后10年至治疗后15年、治疗后10年至治疗后20年或治疗后15年至治疗后20年评估症状。
[0047]
如本文所用,术语“存活率”是指治疗组中的受试者队列在诊断神经病况后在给定时间段后仍然存活。
[0048]
在实施例中,治疗有效剂量实现了约10%至100%或更多的存活率增加。在实施例中,治疗有效剂量实现了10%至100%的存活率增加,例如10%至15%、10%至20%、10%至25%、15%至20%、15%至25%、15%至30%、20%至25%、20%至30%、20%至35%、25%至30%、25%至35%、25%至40%、30%至35%、30%至40%、35%至45%、35%至50%、40%至45%、40%至50%、40%至55%、45%至50%、45%至55%、45%至60%、50%至55%、50%至60%、50%至65%、55%至60%、55%至65%、55%至70%、60%至65%、60%至70%、60%至75%、65%至70%、65%至75%、65%至80%、70%至75%、70%至80%、70%至85%、75%至80%、75%至85%、75%至90%、80%至85%、80%至90%、80%至95%、85%至90%、85%至95%、85%至100%、90%至95%、90%至100%或95%至100%。
[0049]
如本文所用,术语“预期寿命”是指预期受试者存活的时间段。在实施例中,预期寿命由性别决定。在实施例中,预期寿命由遗传学决定。在实施例中,预期寿命由疾病决定。在实施例中,预期寿命由教育决定。在实施例中,预期寿命由心理健康决定。在实施例中,预期
寿命由国家人口决定。
[0050]
在实施例中,治疗有效剂量使预期寿命增加约10%至100%或更多。在实施例中,治疗有效剂量使预期寿命增加10%至100%,例如10%至15%、10%至20%、10%至25%、15%至20%、15%至25%、15%至30%、20%至25%、20%至30%、20%至35%、25%至30%、25%至35%、25%至40%、30%至35%、30%至40%、35%至45%、35%至50%、40%至45%、40%至50%、40%至55%、45%至50%、45%至55%、45%至60%、50%至55%、50%至60%、50%至65%、55%至60%、55%至65%、55%至70%、60%至65%、60%至70%、60%至75%、65%至70%、65%至75%、65%至80%、70%至75%、70%至80%、70%至85%、75%至80%、75%至85%、75%至90%、80%至85%、80%至90%、80%至95%、85%至90%、85%至95%、85%至100%、90%至95%、90%至100%或95%至100%。
[0051]
在实施例中,治疗有效剂量使有此需要的受试者脑内的萎缩量减少约10%至100%或更多。在实施例中,治疗有效剂量使有此需要的受试者脑内的萎缩量减少10%至100%,例如10%至15%、10%至20%、10%至25%、15%至20%、15%至25%、15%至30%、20%至25%、20%至30%、20%至35%、25%至30%、25%至35%、25%至40%、30%至35%、30%至40%、35%至45%、35%至50%、40%至45%、40%至50%、40%至55%、45%至50%、45%至55%、45%至60%、50%至55%、50%至60%、50%至65%、55%至60%、55%至65%、55%至70%、60%至65%、60%至70%、60%至75%、65%至70%、65%至75%、65%至80%、70%至75%、70%至80%、70%至85%、75%至80%、75%至85%、75%至90%、80%至85%、80%至90%、80%至95%、85%至90%、85%至95%、85%至100%、90%至95%、90%至100%或95%至100%。
[0052]
在实施例中,在治疗当天、治疗后1天、治疗后3个月、治疗后6个月、治疗后1年和治疗后每年评估有需要的受试者脑内的萎缩量。
[0053]
在实施例中,在治疗后1天至治疗后7天评估有需要的受试者脑内的萎缩量。在实施例中,可以在治疗后1天至治疗后2天、治疗后1天至治疗后3天、治疗后1天至治疗后4天、治疗后2天至治疗后3天、治疗后2天至治疗后4天、治疗后2天至治疗后5天、治疗后3天至治疗后4天、治疗后3天至治疗后5天、治疗后3天和治疗后6天、治疗后4天至治疗后5天、治疗后4天至治疗后6天、治疗后4天至治疗后7天、治疗后5天至治疗后6天、治疗后5天至治疗后7天或治疗后6天至治疗后7天评估症状。在实施例中,可以在治疗后1周至治疗后4周评估症状。在实施例中,可以在治疗后1周至治疗后2周、治疗后1周至治疗后3周、治疗后1周至治疗后4周、治疗后2周至治疗后3周、治疗后2周至治疗后4周或治疗后3周至治疗后4周评估症状。在实施例中,可以在治疗后1个月至治疗后12个月评估症状。在实施例中,可以在治疗后1个月至治疗后2个月、治疗后1个月至治疗后3个月、治疗后1个月至治疗后4个月、治疗后2个月至治疗后3个月、治疗后2个月至治疗后4个月、治疗后2个月至治疗后5个月、治疗后3个月至治疗后4个月、治疗后3个月至治疗后5个月、治疗后3个月至治疗后6个月、治疗后4个月至治疗后5个月、治疗后4个月至治疗后6个月、治疗后4个月至治疗后7个月、治疗后5个月至治疗后6个月、治疗后5个月至治疗后7个月、治疗后5个月至治疗后8个月、治疗后6个月至治疗后7个月、治疗后6个月至治疗后8个月、治疗后6个月至治疗后9个月、治疗后7个月至治疗后8个月、治疗后7个月至治疗后9个月、治疗后7个月至治疗后10个月、治疗后8个月至治疗后9个月、治疗后8个月至治疗后10个月、治疗后8个月至治疗后11个月、治疗后9个月至治疗后10
个月、治疗后9个月至治疗后11个月、治疗后9个月至治疗后12个月、治疗后10个月至治疗后11个月、治疗后10个月至治疗后12个月或治疗后11个月至治疗后12个月评估症状。在实施例中,可以在治疗后1年至治疗后约20年评估症状。在实施例中,可以在治疗后1年至治疗后5年、治疗后1年至治疗后10年、治疗后1年至治疗后15年、治疗后5年至治疗后10年、治疗后5年至治疗后15年、治疗后5年至治疗后20年、治疗后10年至治疗后15年、治疗后10年至治疗后20年或治疗后15年至治疗后20年评估症状。
[0054]
评价有需要的受试者脑内的萎缩量的测试的非限制性实例包括nissle染色、mri、功能性磁共振fmri和pet扫描。
[0055]
在实施例中,本公开包括制品。在某些方面,制品包括封闭的或密封的包装,其含有本文所述的化合物中的一种或组合,诸如在单独的片剂、胶囊等中。包装可以包含一个或多个容器,诸如封闭或密封的小瓶、瓶子、泡罩(气泡)包装,或用于销售、分配或使用药剂的任何其他合适的包装。因此,包装可以含有药物组合物,该药物组合物包含胰岛素、毛喉素,并且可以进一步包含vc和/或cri。可以包括任何一种或所有这些化合物,并且每种可以单独提供或与其他一种或多种组合提供在相同或不同的剂量制剂中,使得它们可以同时或顺序递送。
[0056]
除了药物组合物,包装还可以含有印刷信息。印刷信息可以提供在标签上,或纸质插页上,或印刷在包装材料本身上。印刷信息可以包括信息,其标识包装中的活性剂、非活性成分的量和类型、一种或多种药物组合物意图治疗何种病况的指示以及服用药物组合物的说明,诸如在给定时间段内服用的剂量数、服用组合物的顺序等。在实施例中,本公开包括包装在包装材料中并在印刷、包装材料上或包装材料中标识的本发明的药物组合物,该组合物用于治疗或预防任何与神经元恶化、神经元不足或神经元功能缺陷有关的疾病、病况或病症。在实施例中,本公开包括营养制剂而不是药物组合物,并且印刷材料提供了关于使用此类制剂来改善神经病况症状的信息。神经病况症状的非限制性实例包括认知功能、记忆、运动功能、整体健康等。
[0057]
提供以下实例以说明本发明,但不旨在以任何方式进行限制。
[0058]
实例
[0059]
如图1所示,本实例证明毛喉素和胰岛素的组合足以将人类星形胶质细胞重编程为神经元。进一步地,如图2所示,将vc和克唑替尼添加到毛喉素和胰岛素的组合中改善了神经元生成。图1和2中的结果是使用以下材料和方法产生的。
[0060]
细胞培养人类星形胶质细胞(sciencell,1800)在实验前在含有杜氏改良伊格尔培养基/营养混合物f-12(dmem/f12)(gibco)、b27补充剂(gibco)、10%胎牛血清(fbs)(gibco)、3.5mm葡萄糖(sigma)、10ng/ml表皮生长因子(egf,alomone labs)、10ng/ml成纤维细胞生长因子2(fgf2,alomone labs)和青霉素/链霉素(gibco)的培养基中培养至少10代。然后将人类星形胶质细胞接种到24孔板(bd biosciences)中的聚-d-赖氨酸(sigma)涂布玻璃盖玻片上,直到细胞密度达到约90%汇合。一半的培养基更换为转化培养基,其只含有dmem/f12和青霉素/链霉素。
[0061]
化合物处理
[0062]
以ifsk或cifskv一起的组合向人类星形胶质细胞提供0.25μm克唑替尼(c)、50mg/l胰岛素(i)、10μm毛喉素(fsk)和50μg/ml维生素c(vc)。用于溶解克唑替尼和毛喉素的相应
量的dmso用作对照。药物处理持续12天,每3天更新一次药物。第12天,将转化培养基和药物更换为含有dmem/f12、b27补充剂、n2补充剂(gibco)、0.5%fbs、5mg/ml vc、1μm y-27632(tocris)和青霉素/链霉素的神经元分化培养基。
[0063]
免疫组织化学
[0064]
细胞首先用4%多聚甲醛(pfa)(alfaaesar)固定在盖玻片上12分钟,然后用磷酸盐缓冲盐水(pbs)洗涤三次。固定后,用在pbs中的2.5%正常驴血清(jackson immunoresearch)、2.5%正常山羊血清(jackson immunoresearch)、0.1%tritonx-100(fisher scientific)在室温下封闭细胞一小时。在封闭过程中,将装有盖玻片的板放置在慢速振荡器上。封闭后,将相同封闭缓冲液中的一抗多克隆抗neun(兔,1:1000,millipore,abn78)和多克隆抗map2(鸡,1:2000,abcam,ab5392)应用到容纳细胞的盖玻片上。一抗孵育在4℃过夜进行。第二天,用pbs洗去一抗。然后将细胞与相应的二抗(1:800,molecular probes)一起在室温下再孵育一小时,然后用pbs洗去二抗三次。在载玻片上计数盖玻片上的细胞。将带有细胞的盖玻片用含有dapi(invitrogen)的安装溶液安装在载玻片上。免疫染色结果的图像用共聚焦显微镜zeiss lsm800拍摄。
[0065]
在一个实施例中,本公开包括一种用于生成神经元的方法,所述方法包含使神经胶质细胞与包含毛喉素和胰岛素的化合物组合接触,其中所述毛喉素和胰岛素的组合足以从所述神经胶质细胞生成所述神经元。
[0066]
在一个实施例中,所述方法进一步包含使所述神经胶质细胞与维生素c(vc)、克唑替尼(cri)或其组合接触。在一个实施例中,所述方法进一步包含使所述神经胶质细胞与所述vc和所述cri的组合接触以相对于通过使所述神经胶质细胞与单独的毛喉素和胰岛素的组合接触所产生的神经元生成来增强神经元生成。在一个实施例中,所述毛喉素包含在至少一种药物制剂中。
[0067]
在一个实施例中,所述胰岛素包含在至少一种药物制剂中。在前述的实施例中,所述毛喉素和胰岛素的组合包含在同一药物制剂中。在前述的实施例中,所述毛喉素和胰岛素是所述至少一种药物制剂中的活性成分。在前述的实施例中,所述毛喉素和胰岛素是所述至少一种药物制剂中的仅有活性成分。在前述的实施例中,所述vc包含在所述至少一种药物制剂中。在前述的实施例中,所述cri包含在所述至少一种药物制剂中。在前述的实施例中,所述vc和所述cri包含在所述至少一种药物制剂中。在前述的实施例中,所述毛喉素、所述胰岛素、所述vc和所述cri包含在所述至少一种药物制剂中。
[0068]
在前述的实施例中,所述神经胶质细胞存在于需要神经元生成的受试者中。在前述的实施例中,所述需要神经元生成的受试者患有神经退化病症。在前述的实施例中,所述受试者需要治疗选自由以下组成的群组的神经病况:阿尔茨海默病、伴有痴呆的其他病况、慢性创伤性脑病(cte)、帕金森病、亨廷顿病、多发性硬化、脊髓损伤、脊髓性肌萎缩、肌萎缩侧索硬化症(als)和中风。在一个实施例中,所述受试者患有阿尔茨海默病。在一个实施例中,所述受试者患有亨廷顿病。
[0069]
在一个实施例中,本公开提供了一种药物组合物,其包含毛喉素和胰岛素的组合,并且所述药物组合物任选地进一步包含维生素c(vc)和克唑替尼(cri)中的一种或两种。在一个实施例中,本公开提供了一种药物,其包含所述毛喉素、所述胰岛素、所述vc和所述cri。在一个实施例中,所述毛喉素和所述胰岛素是活性成分并且是药物制剂中的仅有活性
成分。在一个实施例中,所述毛喉素、所述胰岛素、所述vc和所述cri是活性成分并且是药物制剂中的仅有活性成分。
[0070]
在另一个实施例中,本公开提供了一种包含药物组合物的制品,所述药物组合物包含毛喉素和胰岛素的组合,所述制品进一步包含提供组合用于治疗与需要功能性神经元相关的病况的指示的印刷材料。在一个实施例中,在所述制品中,所述毛喉素和所述胰岛素是活性成分并且是药物制剂中的仅有活性成分。在一个实施例中,在所述制品中,所述药物制剂进一步包含维生素c(vc)或克唑替尼(cri)中的一种。在一个实施例中,在所述制品中,所述vc和所述cri存在于所述药物制剂中,其中所述vc和所述cri是活性成分,并且其中所述毛喉素、所述胰岛素、所述vc和所述cri是所述药物制剂中的仅有活性成分。
[0071]
虽然已经通过特定实施例描述了本发明,但是常规修改对于本领域技术人员来说将是显而易见的,并且此类修改旨在落入本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1