脑膜炎奈瑟氏菌组合物及其方法与流程
脑膜炎奈瑟氏菌组合物及其方法
1.相关申请的交叉引用
2.本技术要求于2019年9月27日提交的美国临时专利申请62/907,097和于2020年6月17日提交的美国临时专利申请63/040,498的权益。所有前述申请在此均通过引用以其整体并入。
技术领域
3.本公开涉及脑膜炎奈瑟氏菌(neisseria meningitidis)组合物及其方法。
背景技术:
4.脑膜炎奈瑟氏菌是可以引起败血症、脑膜炎和死亡的革兰氏阴性包膜细菌。可以基于化学上和抗原上不同的多糖荚膜将脑膜炎奈瑟氏菌分类为至少12种血清组(包括血清组a、b、c、29e、h、i、k、l、w-135(现在大多被称为w)、x、y和z)。具有五种血清组(a、b、c、y和w135)的菌株是导致大多数疾病的原因。
5.尽管有可用的抗生素,但脑膜炎球菌脑膜炎(meningococcal meningitis)是一种破坏性疾病,其可以在数小时内杀死儿童和年轻人。需要针对脑膜炎球菌血清组a、b、c、y和w135和/或x的改进的免疫原性组合物。
6.目前,能有效地对抗广范围的mnb和脑膜炎球菌血清组a、c、y和w和/或x分离株的交叉保护性疫苗或组合物尚不可商购。因此,需要能有效地对抗各种mnb和脑膜炎球菌血清组a、c、y和w和/或x分离株的交叉保护性疫苗或组合物。
7.本公开的进一步目的是提供改进的用于施用脑膜炎球菌疫苗的计划表。根据目前的推荐方案,考虑在不同的年龄段,针对脑膜炎球菌血清组a、c、w、y和b给予四至五次接种。对可以简化免疫接种计划表并扩大接种覆盖范围以进一步减少侵袭性脑膜炎球菌病(invasive meningococcal disease,imd)的有效接种的需求尚未得到满足。
8.发明简述
9.为了满足这些和其它需求,本公开涉及脑膜炎奈瑟氏菌组合物及其方法。
10.本发明人发现了一种在人中诱导免疫应答的方法,所述方法包括向所述人施用组合物,所述组合物包含:a)多肽,其衍生自脑膜炎奈瑟氏菌h因子结合蛋白(fhbp);(b)脑膜炎奈瑟氏菌血清组a荚膜糖缀合物;(c)脑膜炎奈瑟氏菌血清组c荚膜糖缀合物;(d)脑膜炎奈瑟氏菌血清组w荚膜糖缀合物;以及(e)脑膜炎奈瑟氏菌血清组y荚膜糖缀合物,其中所述组合物诱导对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖中的至少一种以及脑膜炎奈瑟氏菌血清组b的免疫应答,其中所述免疫应答包括血清杀菌抗体的滴度,所述滴度高于由针对所述血清组的相应许可疫苗诱导的血清杀菌抗体的滴度。
11.本发明人令人惊讶地发现了一种在人中诱导免疫应答的方法,所述方法包括向所述人施用组合物,所述组合物包含:a)第一多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(b)第二多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(c)脑膜炎奈瑟氏菌血清组a荚膜糖缀合物;(d)脑膜炎奈瑟氏菌血清组c荚膜糖缀合物;(e)脑膜炎奈瑟氏菌
血清组w荚膜糖缀合物;以及(f)脑膜炎奈瑟氏菌血清组y荚膜糖缀合物,其中所述组合物诱导对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖中的至少一种以及脑膜炎奈瑟氏菌血清组b的免疫应答,其中所述免疫应答包括血清杀菌抗体的滴度,所述滴度高于由针对所述血清组的相应许可疫苗诱导的血清杀菌抗体的滴度。
12.在一些实施方式中,多肽包括与选自seq id no:1至seq id no:62的任何一个氨基酸序列具有至少70%同一性的氨基酸序列。
13.在优选的实施方式中,组合物包括:(a)第一多肽,其包括seq id no:1中所示的氨基酸序列;(b)第二多肽,其包括seq id no:2中所示的氨基酸序列;(c)脑膜炎奈瑟氏菌血清组a荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与己二酸二酰肼(adh)接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(d)脑膜炎奈瑟氏菌血清组c荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(e)脑膜炎奈瑟氏菌血清组w荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合;以及(f)脑膜炎奈瑟氏菌血清组y荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合。
14.在一些实施方式中,组合物引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的任一种的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
15.在一些实施方式中,组合物引发对脑膜炎奈瑟氏菌血清组a的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
16.在一些实施方式中,组合物引发对脑膜炎奈瑟氏菌血清组c的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
17.在一些实施方式中,组合物引发对脑膜炎奈瑟氏菌血清组w的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
18.在一些实施方式中,组合物引发对脑膜炎奈瑟氏菌血清组y的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
19.在一些实施方式中,组合物引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的每一种的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
20.在一些实施方式中,组合物引发对脑膜炎奈瑟氏菌血清组b的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎球菌血清组b因子h结合疫苗引发的血清杀菌抗体应答。
21.在一些实施方式中,组合物引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的每一种的免疫应答,其中所述对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖中的每一种的血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖
疫苗引发的血清杀菌抗体应答;并且组合物引发对脑膜炎奈瑟氏菌血清组b的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎球菌血清组b因子h结合疫苗引发的血清杀菌抗体应答;其中所述许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗以及所述许可的脑膜炎球菌血清组b因子h结合疫苗是按顺序施用的,而不是以组合剂量的方式施用。
22.在一些实施方式中,组合物包括佐剂。在一些实施方式中,组合物包括铝佐剂。在一些实施方式中,组合物包括氢氧化铝。在一些实施方式中,组合物包括磷酸铝。在一些实施方式中,组合物包括铝。
23.在一些实施方式中,至少90%的第一多肽与组合物中的铝结合。在一些实施方式中,至少90%的第二多肽与组合物中的铝结合。
24.在一些实施方式中,组合物被配制为无菌液体。在一些实施方式中,组合物包括药物上可接受的防腐剂。在一些实施方式中,组合物包括聚山梨醇酯-80。在一些实施方式中,组合物包括tris-hcl;氯化钠;蔗糖;组氨酸;聚山梨醇酯80;以及磷酸铝。
25.在一些实施方式中,组合物包括约120μg/ml的第一多肽;约120μg/ml的第二多肽;约0.5mg/ml的作为磷酸铝的铝;约0.02mg聚山梨醇酯-80;约10mm组氨酸;以及约150mm氯化钠。
26.在一些实施方式中,组合物每剂量包括约60μg的第一多肽;约60μg的第二多肽;约5μg的与约7.5μg tt缀合的mena荚膜糖;约5μg的与约7.5μg tt缀合的menc荚膜糖;约5μg的与约3.75μg tt缀合的menw荚膜糖;约5μg的与约3.25μg tt缀合的meny荚膜糖;约97μg tris-hcl,ph 6.8
±
0.3;4.69-4.71mg的氯化钠;约28mg的蔗糖;约0.78mg的l-组氨酸;约0.02mg聚山梨醇酯-80;约0.25mg铝;并且进一步包括0.5ml水。
27.在一些实施方式中,免疫应答包括血清杀菌抗体。在一些实施方式中,组合物能够引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的至少一种的加强免疫应答。在一些实施方式中,组合物能够引发对脑膜炎奈瑟氏菌血清组b的加强免疫应答。
28.在一些实施方式中,免疫应答在至多25岁的人中引发。在一些实施方式中,免疫应答在年龄为至少2个月至25岁的人中引发。在一些实施方式中,免疫应答在10至25岁的人中引发。在一些实施方式中,免疫应答在10至26岁的人中引发。在一些实施方式中,免疫应答在年龄为12至《18个月或者18至《24个月的人中引发。在一些实施方式中,免疫应答在年龄为18至《24个月的人中引发。在一些实施方式中,免疫应答在年龄为≥24个月至《10岁的人中引发。
29.在一些实施方式中,免疫应答在针对脑膜炎奈瑟氏菌血清组a、c、w-135和y呈血清反应阴性的人中引发。在一些实施方式中,免疫应答在针对脑膜炎奈瑟氏菌血清组a、c、w-135和y呈血清反应阳性的人中引发。
30.在一些实施方式中,将组合物以至少两次剂量施用于人,其中所述第二剂量在所述第一剂量约6个月后。在一些实施方式中,人的年龄为至少10岁和至多17岁。在一些实施方式中,将第三剂量的组合物施用于人,其中所述人的年龄为至少16岁。
31.在一些实施方式中,将组合物以至多两次剂量施用于人,其中所述第二剂量在所述第一剂量约6个月后。
32.在一些实施方式中,组合物引发针对a22的免疫应答。在一些实施方式中,组合物
引发针对a56的免疫应答。在一些实施方式中,组合物引发针对b24的免疫应答。在一些实施方式中,组合物引发针对b44的免疫应答。
33.在一些实施方式中,组合物每剂量包括约60μg的第一多肽;约60μg的第二多肽;约5μg的与约7.5μg tt缀合的mena荚膜糖;约5μg的与约7.5μg tt缀合的menc荚膜糖;约5μg的与约3.75μg tt缀合的menw荚膜糖;约5μg的与约3.25μg tt缀合的meny荚膜糖;约97μg tris-hcl,ph 6.8
±
0.3;4.69-4.71mg的氯化钠;约28mg的蔗糖;约0.78mg的l-组氨酸;约0.02mg聚山梨醇酯-80;约0.25mg铝;并且进一步包括0.5ml水。
34.一种组合物,所述组合物包括:(a)第一多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(b)第二多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(c)脑膜炎奈瑟氏菌血清组a荚膜糖缀合物;(d)脑膜炎奈瑟氏菌血清组c荚膜糖缀合物;(e)脑膜炎奈瑟氏菌血清组w荚膜糖缀合物;以及(f)脑膜炎奈瑟氏菌血清组y荚膜糖缀合物;其中所述组合物引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的至少一种的免疫应答,其中所述血清杀菌抗体应答高于由针对脑膜炎奈瑟氏菌血清组的许可疫苗引发的血清杀菌抗体应答。
35.在一些实施方式中,多肽包括与选自seq id no:1至seq id no:62的任何一个氨基酸序列具有至少70%同一性的氨基酸序列。
36.一种组合物,所述组合物包括:(a)第一多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(b)第二多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(c)脑膜炎奈瑟氏菌血清组a荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与己二酸二酰肼(adh)接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(d)脑膜炎奈瑟氏菌血清组c荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(e)脑膜炎奈瑟氏菌血清组w荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合;以及(f)脑膜炎奈瑟氏菌血清组y荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合;其中所述组合物引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的至少一种的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
37.一种用于在人中诱导针对脑膜炎奈瑟氏菌血清组b亚族a菌株和针对脑膜炎奈瑟氏菌血清组b亚族b菌株的免疫应答的方法,所述方法包括向所述人施用有效量的组合物。
38.一种用于在人中诱导针对脑膜炎奈瑟氏菌血清组a、脑膜炎奈瑟氏菌血清组c、脑膜炎奈瑟氏菌血清组w和/或脑膜炎奈瑟氏菌血清组y菌株的免疫应答的方法,所述方法包括向所述人施用有效量的组合物。
39.一种用于在人中诱导针对脑膜炎奈瑟氏菌血清组a、脑膜炎奈瑟氏菌血清组b、脑膜炎奈瑟氏菌血清组c、脑膜炎奈瑟氏菌血清组w和/或脑膜炎奈瑟氏菌血清组y菌株的免疫应答的方法,所述方法包括向所述人施用有效量的组合物。
40.一种用于在人中诱导针对脑膜炎奈瑟氏菌血清组a、脑膜炎奈瑟氏菌血清组b、脑膜炎奈瑟氏菌血清组c、脑膜炎奈瑟氏菌血清组w、脑膜炎奈瑟氏菌血清组y和/或脑膜炎奈瑟氏菌血清组x菌株的免疫应答的方法,所述方法包括向所述人施用有效量的组合物。
41.在一些实施方式中,在第一次施用组合物之前,患者先前未接受过多价脑膜炎球菌荚膜糖-载体蛋白缀合物疫苗。
42.在一些实施方式中,在第一次施用组合物之前,患者先前接受过多价脑膜炎球菌荚膜糖-载体蛋白缀合物疫苗。
附图说明
43.图1a至b—如在hsba中,在剂量2后1个月测量的对(图1a)menb测试菌株的免疫应答,以及在剂量1和2后1个月测量的对(图1b)mena、menc、menw和meny测试菌株的免疫应答。误差线代表95%顺式(cis)。menb菌株在括号中注明fhbp变体。
*
menabcwy,n=418-4432;menb-fhbp,n=814-850。对于所有4种menb测试菌株,复合应答=hsba滴度≥lloq。menabcwy,n=227-262;menacwy-crm,n=446-506。
§
menabcwy,n=187-257;menacwy-crm,n=370-495。hsba=具有人补体的血清杀菌活性;mena=脑膜炎球菌血清组a;lloq=定量下限;m-月;menabcwy=五价血清组a、b、c、w、y疫苗;脑膜炎球菌(群a、c、y和w-135)寡糖crm197
44.缀合物疫苗(四价脑膜炎球菌crm疫苗);menb=脑膜炎球菌血清组b;脑膜炎球菌群b二价重组脂蛋白2086(二价rlp2086)。
45.疫苗;menc=脑膜炎球菌血清组c;menw=脑膜炎球菌血清组w;meny=脑膜炎球菌血清组y;pd=剂量后。
46.图2a至b.在任何剂量后7天内报告的(图2a)局部反应和(图2b)全身事件。menabcwy,n=542;menb-fhbp+menacwy-crm,n=1050。
*
在menabcwy/menb-fhbp注射位点处。menabcwy=五价血清组a、b、c、w、y疫苗;脑膜炎球菌(群a、c、y和w-135)寡糖crm197缀合物疫苗(四价脑膜炎球菌crm疫苗);脑膜炎球菌群b二价重组脂蛋白2086(二价rlp2086)。
47.图3.与假设的无接种情况相比,在不同的疫苗施用策略下,在10年内被避免的估计病例。
48.序列标识符
49.seq id no:1列出了重组脑膜炎奈瑟氏菌血清组b 2086变体a05多肽抗原的氨基酸序列。
50.seq id no:2列出了重组脑膜炎奈瑟氏菌血清组b 2086变体b01多肽抗原的氨基酸序列。
51.seq id no:3列出了seq id no:1和seq id no:2的位置1-4处的氨基酸残基。
52.seq id no:4列出了重组奈瑟菌亚族a lp2086多肽(rlp2086)(a05)多肽n端的氨基酸序列。
53.seq id no:5列出了奈瑟菌亚族a lp2086 m98250771多肽(a05)多肽n端的氨基酸序列。
54.seq id no:6列出了脑膜炎奈瑟氏菌血清组b 2086变体b153的氨基酸序列。
55.seq id no:7列出了脑膜炎奈瑟氏菌血清组b 2086变体a04的氨基酸序列。
56.seq id no:8列出了脑膜炎奈瑟氏菌血清组b 2086变体a05的氨基酸序列。
57.seq id no:9列出了脑膜炎奈瑟氏菌血清组b 2086变体a12的氨基酸序列。
58.seq id no:10列出了脑膜炎奈瑟氏菌血清组b 2086变体a22的氨基酸序列。
59.seq id no:11列出了脑膜炎奈瑟氏菌血清组b 2086变体b02的氨基酸序列。
60.seq id no:12列出了脑膜炎奈瑟氏菌血清组b 2086变体b03的氨基酸序列。
61.seq id no:13列出了脑膜炎奈瑟氏菌血清组b 2086变体b09的氨基酸序列。
62.seq id no:14列出了脑膜炎奈瑟氏菌血清组b 2086变体b22的氨基酸序列。
63.seq id no:15列出了脑膜炎奈瑟氏菌血清组b 2086变体b24的氨基酸序列。
64.seq id no:16列出了脑膜炎奈瑟氏菌血清组b 2086变体b44的氨基酸序列。
65.seq id no:17列出了脑膜炎奈瑟氏菌血清组b 2086变体b16的氨基酸序列。
66.seq id no:18列出了脑膜炎奈瑟氏菌血清组b 2086变体a07的氨基酸序列。
67.seq id no:19列出了脑膜炎奈瑟氏菌血清组b 2086变体a19的氨基酸序列。
68.seq id no:20列出了脑膜炎奈瑟氏菌血清组b 2086变体a06的氨基酸序列。
69.seq id no:21列出了脑膜炎奈瑟氏菌血清组b 2086变体a15的氨基酸序列。
70.seq id no:22列出了脑膜炎奈瑟氏菌血清组b 2086变体a29的氨基酸序列。
71.seq id no:23列出了脑膜炎奈瑟氏菌血清组b 2086变体b15的氨基酸序列。
72.seq id no:24列出了重组奈瑟菌亚族b lp2086多肽(rlp2086)(b01)多肽n端的氨基酸序列。
73.seq id no:25列出了奈瑟菌亚族b lp2086 cdc-1573多肽(b01)多肽n端的氨基酸序列。
74.seq id no:26列出了表达因子h结合蛋白(fhbp)b16的脑膜炎奈瑟氏菌血清组a菌株的氨基酸序列。
75.seq id no:27列出了表达fhbp a10的脑膜炎奈瑟氏菌血清组c菌株的氨基酸序列。seq id no:27还列出了表达fhbp a10的脑膜炎奈瑟氏菌血清组w菌株的氨基酸序列。
76.seq id no:28列出了表达fhbp a19的脑膜炎奈瑟氏菌血清组w菌株的氨基酸序列。
77.seq id no:29列出了表达fhbp b47的脑膜炎奈瑟氏菌血清组y菌株的氨基酸序列。
78.seq id no:30列出了表达fhbp b49的脑膜炎奈瑟氏菌血清组x菌株的氨基酸序列。
79.seq id no:31列出了脑膜炎奈瑟氏菌血清组b 2086变体b16的氨基酸序列。
80.seq id no:32列出了脑膜炎奈瑟氏菌血清组b 2086变体a07的氨基酸序列。
81.seq id no:33列出了脑膜炎奈瑟氏菌血清组b 2086变体a19的氨基酸序列。
82.seq id no:34列出了脑膜炎奈瑟氏菌血清组b 2086变体a06的氨基酸序列。
83.seq id no:35列出了脑膜炎奈瑟氏菌血清组b 2086变体a15的氨基酸序列。
84.seq id no:36列出了脑膜炎奈瑟氏菌血清组b 2086变体a29的氨基酸序列。
85.seq id no:37列出了脑膜炎奈瑟氏菌血清组b 2086变体b15的氨基酸序列。
86.seq id no:38列出了表达因子h结合蛋白(fhbp)b16的脑膜炎奈瑟氏菌血清组a菌株的氨基酸序列。
87.seq id no:39列出了表达fhbp a10的脑膜炎奈瑟氏菌血清组c菌株的氨基酸序列。seq id no:39还列出了表达fhbp a10的脑膜炎奈瑟氏菌血清组w菌株的氨基酸序列。
88.seq id no:40列出了表达fhbp a19的脑膜炎奈瑟氏菌血清组w菌株的氨基酸序列。
89.seq id no:41列出了表达fhbp b47的脑膜炎奈瑟氏菌血清组y菌株的氨基酸序列。
90.seq id no:42列出了表达fhbp b49的脑膜炎奈瑟氏菌血清组x菌株的氨基酸序列。
91.seq id no:43列出了脑膜炎奈瑟氏菌血清组b 2086变体b44的氨基酸序列。
92.seq id no:44列出了脑膜炎奈瑟氏菌血清组b 2086变体b09的氨基酸序列。
93.seq id no:45列出了脑膜炎奈瑟氏菌血清组b 2086变体b09的氨基酸序列。
94.seq id no:46列出了脑膜炎奈瑟氏菌血清组b 2086变体a05的氨基酸序列。
95.seq id no:47列出了脑膜炎奈瑟氏菌血清组b 2086变体b01的氨基酸序列。
96.seq id no:48列出了脑膜炎奈瑟氏菌血清组b 2086变体b01的氨基酸序列,其包括在氨基酸位置1处的n端cys。
97.seq id no:49列出了脑膜炎奈瑟氏菌血清组b 2086变体b15的氨基酸序列,其包括在氨基酸位置1处的n端cys。
98.seq id no:50列出了脑膜炎奈瑟氏菌血清组b 2086变体b16的氨基酸序列,其包括在氨基酸位置1处的n端cys。
99.seq id no:51列出了脑膜炎奈瑟氏菌血清组b 2086变体b22的氨基酸序列。
100.seq id no:52列出了脑膜炎奈瑟氏菌血清组b 2086变体a22的氨基酸序列。
101.seq id no:53列出了脑膜炎奈瑟氏菌血清组b 2086变体a12的氨基酸序列。
102.seq id no:54列出了脑膜炎奈瑟氏菌血清组b 2086变体a22的氨基酸序列。
103.seq id no:55列出了脑膜炎奈瑟氏菌血清组b 2086变体a62的氨基酸序列,其包括在氨基酸位置1处的n端cys。
104.seq id no:56列出了脑膜炎奈瑟氏菌血清组b 2086变体a62的氨基酸序列。
105.seq id no:57列出了脑膜炎奈瑟氏菌血清组b 2086变体a29的氨基酸序列,其包括在氨基酸位置1处的n端cys。
106.seq id no:58列出了脑膜炎奈瑟氏菌血清组b 2086变体b22的氨基酸序列。
107.seq id no:59列出了脑膜炎奈瑟氏菌血清组b 2086变体a05的氨基酸序列。
108.seq id no:60列出了脑膜炎奈瑟氏菌血清组b 2086变体a05的氨基酸序列。
109.seq id no:61列出了脑膜炎奈瑟氏菌血清组b 2086变体b24的氨基酸序列。
110.seq id no:62列出了脑膜炎奈瑟氏菌血清组b 2086变体b24的氨基酸序列。
111.seq id no:63列出了脑膜炎奈瑟氏菌血清组b 2086变体a02的氨基酸序列。
112.seq id no:64列出了脑膜炎奈瑟氏菌血清组b 2086变体a28的氨基酸序列。
113.seq id no:65列出了脑膜炎奈瑟氏菌血清组b 2086变体a42的氨基酸序列。
114.seq id no:66列出了脑膜炎奈瑟氏菌血清组b 2086变体a63的氨基酸序列。
115.seq id no:67列出了脑膜炎奈瑟氏菌血清组b 2086变体a76的氨基酸序列。
116.seq id no:68列出了脑膜炎奈瑟氏菌血清组b 2086变体b05的氨基酸序列。
117.seq id no:69列出了脑膜炎奈瑟氏菌血清组b 2086变体b07的氨基酸序列。
118.seq id no:70列出了脑膜炎奈瑟氏菌血清组b 2086变体b08的氨基酸序列。
119.seq id no:71列出了脑膜炎奈瑟氏菌血清组b 2086变体b13的氨基酸序列。
120.seq id no:72列出了脑膜炎奈瑟氏菌血清组b 2086变体b52的氨基酸序列。
121.seq id no:73列出了脑膜炎奈瑟氏菌血清组b 2086变体b107的氨基酸序列。
122.seq id no:74列出了脑膜炎奈瑟氏菌血清组b 2086变体a56的氨基酸序列。
123.发明详述
124.本发明人发现,包括至少一种因子h结合蛋白(fhbp)和脑膜炎奈瑟氏菌血清组a、c、w和y荚膜糖缀合物的组合物是稳定的和免疫原性的。本发明人进一步发现,组合物在人中诱导针对脑膜炎奈瑟氏菌血清组a、c、w、y和b中的至少2、3、4或5种的免疫应答。令人惊讶地,所引发的免疫应答高于由针对脑膜炎奈瑟氏菌的许可疫苗引发的免疫应答。
125.在一个方面,组合物包括至少一种衍生自脑膜炎奈瑟氏菌因子h结合蛋白的多肽和至少一种与载体蛋白缀合的脑膜炎球菌荚膜糖。
126.衍生自因子h结合蛋白(fhbp)的蛋白质。
127.在一个实施方式中,组合物包括任何fhbp,如例如以下多肽中的任一种:b24、b16、b44、a22、b03、b09、a12、a19、a05、a07、a06、a15、a29、b01、a62、b15及其任意组合。优选地,组合物包括a05和bo1多肽的组合。在另一优选的实施方式中,组合物包括b24和a05多肽的组合。在另一实施方式中,组合物包括a05、a12、b09和b44多肽的组合。在一个实施方式中,组合物包括脂化fhbp。在一个实施方式中,组合物不包括非脂化fhbp。
128.在另一实施方式中,组合物包括非脂化fhbp,如描述在以下文献中的非脂化fhbp中的任一种:国际专利公布号wo2012/032489、美国专利公布号us20120093852、国际专利公布号wo2013/132452号和美国专利公布号us20160030543,这些文献各自通过引用以其整体并入本文。在一个实施方式中,组合物包括至少一种非脂化fhbp和至少一种脂化fhbp。
129.在一些实施方式中,组合物包括与以下中的任何一个中所示的氨基酸序列具有至少70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或99.9%同一性的多肽:seq id no:1、seq id no:2、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13、seq id no:14、seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19、seq id no:20、seq id no:21、seq id no:22、seq id no:23、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、seq id no:31、seq id no:32、seq id no:33、seq id no:34、seq id no:35、seq id no:36、seq id no:37、seq id no:38、seq id no:39、seq id no:40、seq id no:41、seq id no:42、seq id no:43、seq id no:44、seq id no:45、seq id no:46、seq id no:47、seq id no:48、seq id no:49、seq id no:50、seq id no:51、seq id no:52、seq id no:53、seq id no:54、seq id no:55、seq id no:56、seq id no:57、seq id no:58、seq id no:59、seq id no:60、seq id no:61和seq id no:62。
130.在优选的实施方式中,组合物包括:(a)第一多肽,其包括seq id no:1中所示的氨基酸序列;(b)第二多肽,其包括seq id no:2中所示的氨基酸序列;(c)脑膜炎奈瑟氏菌血清组a荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与己二酸二酰肼(adh)接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(d)脑膜炎奈瑟氏菌血清组c荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(e)脑膜炎奈瑟氏菌血清组w荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合;以及(f)脑膜炎奈
瑟氏菌血清组y荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合。
131.第一多肽;mnbrlp2086亚族a(a05)蛋白
132.在一个实施方式中,组合物包括第一多肽,所述第一多肽具有seqidno:1中所示的氨基酸序列。多肽是来自脑膜炎奈瑟氏菌菌株m98250771的经修饰的因子h结合蛋白(fhbp)。fhbp的描述公开在wo2012032489和美国专利公布us2012/0093852中,这些文献各自通过引用以其整体并入。多肽的n端被共价连接在所述多肽的三个位置处的三个主要脂肪酸c16:0、c16:1和c18:1脂化。第一多肽包括总计258个氨基酸。
133.mnbrlp2086a05蛋白的代表性一级结构呈现在美国专利10,183,070的图4中。蛋白质的一级结构说明在美国专利10,183,070的图4中,除n端的半胱氨酸和丙三基部分外(使用全化学式说明),所有氨基酸使用单字母符号。该结构包括其中n端半胱氨酸残基被脂化的蛋白质序列的一级结构。蛋白质n端处的n端半胱氨酸残基的氨基基团与形成酰胺键的脂肪酸(r1)附接,并且半胱氨酰巯氢基基团与含有两个酯结合的脂肪酸(r2)的丙三醇部分附接。r1的结构被推断为十六烷酸(c16:0),并且r2的结构取决于mnbrlp2086同种型而变化。
134.与来自脑膜炎奈瑟氏菌菌株m98250771的对应野生型序列相比,第一多肽包括两个被引入所述多肽的n端区中的修饰。由于引入克隆位点,因此在第二位置中添加甘氨酸。第二修饰包括四个氨基酸的缺失。因此,在一个实施方式中,第一多肽在n端处包括c-g-s-s序列(seqidno:3)。参见seqidno:1,前四个氨基酸残基。
135.第一多肽序列与野生型奈瑟菌序列之间的n端差异如下所示。因此,在一个实施方式中,第一多肽包括seqidno:1中所示的氨基酸序列的至少前2、3、4、5、6、7、8、9、10、11、12、13个或更多个氨基酸残基。优选地,第一多肽包括seqidno:1的至少前4、更优选至少前6并且最优选至少前8个氨基酸残基。
136.重组和奈瑟菌亚族alp2086多肽的预测n端序列的比较
137.rlp2086m98250771cgss
‑‑‑‑‑
ggggvaad(seqidno:4)
138.奈瑟菌lp2086m98250771c-ssgs-gsggggvaad(seqidno:5)
139.》a05(seqidno:1)
140.cgssggggvaadigtgladaltapldhkdkglksltledsisqngtltlsaqgaektfkvgdkdnslntgklkndkisrfdfvqkievdgqtitlasgefqiykqdhsavvalqiekinnpdkidslinqrsflvsglggehtafnqlpsgkaeyhgkafssddaggkltytidfaakqghgkiehlktpeqnvelasaelkadekshavilgdtrygseekgtyhlalfgdraqeiagsatvkirekvheigiagkq
141.在一个实施方式中,第一多肽包括seqidno:1中所示的氨基酸序列。在一个实施方式中,第一多肽具有总计258个氨基酸。在一个实施方式中,第一多肽不包括与seqidno:1具有小于100%序列同一性的氨基酸序列。在另一实施方式中,第一多肽由seqidno:1中所示的氨基酸序列组成。在另一实施方式中,第一多肽氨基酸序列kdn。参见例如seqidno:1的氨基酸残基73-75。在另一实施方式中,第一多肽在所述多肽的n端处包括seqidno:3中所示的氨基酸序列。在另一实施方式中,第一多肽在所述多肽的n端处包括seqidno:4中所示的氨基酸序列。
142.在优选的实施方式中,使用本领域已知的标准技术容易地在重组宿主细胞中表达
第一多肽。在另一优选的实施方式中,第一多肽包括seq id no:1的n和/或c结构域上的杀菌表位。在一个实施方式中,第一多肽包括seq id no:1中所示的氨基酸序列的至少前4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100个氨基酸残基。优选地,第一多肽包括seq id no:1的至少前2、更优选至少前4并且最优选至少前8个氨基酸残基。
143.在另一实施方式中,第一多肽包括seq id no:1中所示的氨基酸序列的至少最后4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100个氨基酸残基。
144.在一个实施方式中,组合物包括约30μg/ml的第一多肽,所述第一多肽包括seq id no:1中所示的氨基酸序列。在一个优选的实施方式中,组合物包括约60μg的第一多肽,所述第一多肽包括seq id no:1中所示的氨基酸序列。在一个优选的实施方式中,组合物包括约60μg的第一多肽,所述第一多肽包括seq id no:1中所示的氨基酸序列,其中所述组合物的总体积优选为0.5ml。在另一实施方式中,组合物包括约120μg/ml的第一多肽,所述第一多肽包括seq id no:1中所示的氨基酸序列。
145.第二多肽;mnb rlp2086亚族b(b01)蛋白
146.在一个实施方式中,组合物包括第二多肽,所述第二多肽具有seq id no:2中所示的氨基酸序列。多肽是来自脑膜炎奈瑟氏菌菌株cdc1573的因子h结合蛋白(fhbp)。fhbp的描述公开在wo2012032489和美国专利公布us 2012/0093852中,这些文献各自通过引用以其整体并入。多肽的n端被共价连接在所述多肽的三个位置处的三个主要脂肪酸c16:0、c16:1和c18:1脂化。第二多肽包括总计261个氨基酸。
147.mnb rlp2086 b01蛋白的代表性一级结构呈现在美国专利10,183,070的图5中。蛋白质的一级结构说明在美国专利10,183,070的图5中,除n端的半胱氨酸和丙三基部分外(使用全化学式说明),所有氨基酸使用单字母符号。该结构包括其中n端半胱氨酸残基被脂化的蛋白质序列的一级结构。蛋白质n端处的n端半胱氨酸残基的氨基基团与形成酰胺键的脂肪酸(r1)附接,并且半胱氨酰巯氢基基团与含有两个酯结合的脂肪酸(r2)的丙三醇部分附接。r1的结构被推断为十六烷酸(c16:0),并且r2的结构取决于rlp2086同种型而变化。
148.与来自脑膜炎奈瑟氏菌菌株cdc-1573的对应野生型序列相比,第二多肽包括一个被引入rlp2086亚族b蛋白的n端区中的修饰。第二位置中的甘氨酸是引入克隆位点的结果。
149.与原始奈瑟菌序列的n端差异如下所示。
150.重组和奈瑟菌亚族b lp2086蛋白的预测n端序列的比较
151.rlp2086 cdc-1573cgssggggsggggvtad(seq id no:24)
152.奈瑟菌lp2086 cdc-1573c-ssggggsggggvtad(seq id no:25)
153.在一个实施方式中,第二多肽在n端处包括c-g-s-s序列(seq id no:3)。参见seq id no:2的前四个氨基酸残基。
154.》b01(seq id no:2)
155.cgssggggsggggvtadigtgladaltapldhkdkglksltledsisqngtltlsaqgaektygngdslntgklkndkvsrfdfirqievdgqlitlesgefqvykqshsaltalqteqeqdpehsekmvakrrfrigdiagehtsfdklpkdvmatyrgtafgsddaggkltytidfaakqghgkiehlkspelnvdlavayikpdekhhavisgsvlynqdekgsyslgifgekaqevagsaevetangihhiglaakq
156.在一个实施方式中,第二多肽包括seq id no:2中所示的氨基酸序列。在一个实施方式中,第二多肽具有总计261个氨基酸。在一个实施方式中,第二多肽由seq id no:2中所示的氨基酸序列组成。在另一实施方式中,第二多肽不进一步包括与seq id no:2具有小于100%序列同一性的多肽。在优选的实施方式中,第一多肽和第二多肽在各自多肽的n端处包括c-g-s-s(seq id no:3)序列。
157.在优选的实施方式中,使用本领域已知的标准技术容易地在重组宿主细胞中表达第二多肽。在另一优选的实施方式中,第二多肽包括seq id no:2的n和/或c结构域上的杀菌表位。在一个实施方式中,第二多肽包括seq id no:2中所示的氨基酸序列的至少前2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100个氨基酸残基。优选地,第二多肽包括seq id no:2的至少前2、更优选至少前4并且最优选至少前8个氨基酸残基。
158.在另一实施方式中,第二多肽包括seq id no:2中所示的氨基酸序列的至少最后4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100个氨基酸残基。
159.在一个实施方式中,组合物包括约30μg/ml的第一多肽,所述第一多肽包括seq id no:2中所示的氨基酸序列。在一个优选的实施方式中,组合物包括约60μg的第一多肽,所述第一多肽包括seq id no:2中所示的氨基酸序列。在一个优选的实施方式中,组合物包括约60μg的第二多肽,所述第二多肽包括seq id no:2中所示的氨基酸序列,其中所述组合物的总体积优选为0.5ml。在另一实施方式中,组合物包括120μg/ml的第二多肽,所述第二多肽包括seq id no:2中所示的氨基酸序列。
160.脑膜炎球菌血清组a、c、w和y(menacwy)荚膜糖
161.在整个本说明书中,术语“糖”可以指示多糖或寡糖且包括此二者。多糖从细菌中分离出,或者从细菌中分离出并通过已知方法且任选地通过微流化来定尺寸至一定程度。多糖可以被定尺寸,以便降低多糖样品的粘度和/或改善缀合产物的可过滤性。寡糖具有小数目的重复单元(通常为5-30个重复单元)并且通常是水解的多糖。
162.每种脑膜炎奈瑟氏菌荚膜糖可以与独立地选自由tt、dt、crm197、tt的片段c和蛋白d组成的组的载体蛋白缀合。虽然一种或多种脑膜炎奈瑟氏菌荚膜糖可以与彼此不同的载体蛋白缀合,但在一个实施方式中,它们均与相同的载体蛋白缀合。例如它们均可以与选自由tt、dt、crm197、tt的片段c和蛋白d组成的组的相同载体蛋白缀合。在此背景下,crm197和dt可以被认为是相同的载体蛋白,因为它们仅有一个氨基酸不同。在优选的实施方式中,
所有存在的脑膜炎奈瑟氏菌荚膜糖均与tt缀合。
163.如果组合物中的2种或更多种糖的蛋白载体是相同的,则糖可以与蛋白载体的相同分子缀合(载体分子具有2种以上的不同糖与其缀合)[参见例如wo 04/083251;例如单一载体蛋白可能与以下项缀合:mena和menc;mena和menw;mena和meny;menc和menw;menc和meny;menw和meny;mena、menc和menw;mena、menc和meny;mena、menw和meny;menc、menw和meny;mena、menc、menw和meny。替代地,糖各自可以分别与蛋白载体的不同分子缀合(各蛋白载体分子仅具有一种类型的糖与其缀合)。
[0164]
在一个实施方式中,至少2种不同的糖缀合物分别与相同类型的载体蛋白缀合,其中一种或多种糖经由蛋白载体上的第一类型化学基团与载体蛋白缀合,并且一种或多种糖经由蛋白载体上的第二(不同)类型化学基团与载体蛋白缀合。
[0165]
在一个实施方式中,2种缀合物涉及与相同载体连接的相同糖,但通过不同的缀合化学。在替代的实施方式中,2种不同的糖与蛋白载体上的不同基团缀合。
[0166]
所谓“分别与相同类型的载体蛋白缀合”,其意指糖单个地与相同载体缀合(例如mena通过破伤风类毒素上的氨基基团与破伤风类毒素缀合,并且menc通过破伤风类毒素的不同分子上的羧酸基团与破伤风类毒素缀合)。
[0167]
荚膜糖可以与独立地选自由tt、dt、crm197、tt的片段c和蛋白d组成的组的相同载体蛋白缀合。可以用于本公开的缀合物中的蛋白载体的更完整列表呈现于下。在此背景下,crm197和dt可以被认为是相同的载体蛋白,因为它们仅有一个氨基酸不同。在实施方式中,所有存在的脑膜炎奈瑟氏菌荚膜糖均与tt缀合。
[0168]
糖可以包括以下中的任一种:脑膜炎奈瑟氏菌血清组a荚膜糖(mena)、脑膜炎奈瑟氏菌血清组c荚膜糖(menc)、脑膜炎奈瑟氏菌血清组y荚膜糖(meny)和脑膜炎奈瑟氏菌血清组w荚膜糖(menw)或它们的任意组合。
[0169]
存在于蛋白质载体上的第一和第二化学基团彼此不同且理想上是可以容易地用于缀合目的的天然化学基团。它们可以独立选自由以下各项组成的组:羧基基团、氨基基团、巯基基团、羟基基团、咪唑基基团、胍基基团和吲哚基基团。在一个实施方式中,第一化学基团是羧基并且第二化学基团是氨基,或者反之亦然。下文更详细地解释这些基团。
[0170]
在特定的实施方式中,免疫原性组合物包含至少2种不同的脑膜炎奈瑟氏菌荚膜糖,其中一种或多种荚膜糖选自由mena和menc组成的第一组,所述一种或多种荚膜糖经由蛋白载体上的第一类型化学基团(例如羧基)与载体蛋白缀合,并且一种或多种不同的糖选自由menc、meny和menw组成的第二组,所述一种或多种不同的糖经由蛋白载体上的第二类型化学基团(例如氨基)与载体蛋白缀合。
[0171]
在进一步的实施方式中,本公开的免疫原性组合物包含经由第一类型化学基团(例如羧基)缀合的mena和经由第二类型化学基团(例如氨基)缀合的menc。
[0172]
在另一实施方式中,免疫原性组合物包含经由第一类型化学基团(例如羧基)缀合的menc和经由第二类型化学基团(例如氨基)缀合的meny。
[0173]
在另一实施方式中,免疫原性组合物包含经由第一类型化学基团(例如羧基)缀合的mena和经由第二类型化学基团(例如氨基)缀合的menc、meny和menw。
[0174]
在另一实施方式中,免疫原性组合物包含经由第一类型化学基团(例如羧基)缀合的mena和menc以及经由第二类型化学基团(例如氨基)缀合的meny和menw。
丙酰氨基(wo 00/10599)、硝基苯基-乙胺(gever et al(1979)med.microbiol.immunol.165;171-288)、卤代烷基卤化物(us4057685)、糖苷键(us4673574、us4808700)、己二胺和6-氨基己酸(us4459286)。
[0181]
存在于本公开的免疫原性组合物中的糖缀合物可以通过任何已知的耦合技术来制备。缀合方法可以依赖用1-氰基-4-二甲基氨基吡啶四氟硼酸盐(cdap)与糖进行活化以形成氰酸酯。经活化的糖因此可以直接或经由间隔子(接头)基团与载体蛋白上的氨基基团耦合。例如间隔子可以是胱胺或半胱胺以给出硫醇化多糖,所述硫醇化多糖可以经由硫醚键与载体耦合,所述硫醚键是在与经马来酰亚胺活化的载体蛋白(例如使用gmbs)或全乙酰化载体蛋白(例如使用碘乙酰亚胺或n-琥珀酰亚胺基溴乙酸乙酯溴乙酸乙酯)反应后获得的。任选地,氰酸酯(任选地通过cdap化学制造)与己二胺或adh耦合,并且氨基衍生的糖使用碳二亚胺(例如edac或edc)化学,经由蛋白载体上的羧基基团与载体蛋白缀合。此类缀合物描述在pct发布的申请wo 93/15760(uniformed services university)和wo 95/08348以及wo 96/29094中。
[0182]
其它合适的技术使用卡比尼定(carbiinide)、酰肼、活性酯、降冰片烷(norborane)、与硝基苯甲酸、n-羟基琥珀酰亚胺、s-nhs、edc、tstu。wo 98/42721中描述了多种。缀合可能涉及羰基接头,所述羰基接头可以通过以下方式来形成:将糖的游离羟基基团与cdi反应(bethell et al j.biol.chem.1979,254;2572-4,hearn et alj.chromatogr.1981.218;509-18),随后与蛋白质反应以形成氨基甲酸酯键。这可能涉及将异头端还原成一级羟基基团,任选地用cdi进行一级羟基基团的一级羟基基团保护/去保护反应以形成cdi氨基甲酸酯中间体,以及将cdi氨基甲酸酯中间体与蛋白质上的氨基基团耦合。
[0183]
缀合物还可以通过如us 4365170(jennings)和us 4673574(anderson)中所描述的直接还原胺化法来制备。其它方法描述在ep-0-161-188、ep-208375和ep-0-477508中。
[0184]
进一步的方法涉及通过碳二亚胺缩合(chu c.et al infect.immunity,1983 245 256)(例如使用edac)将用己二酸酰肼(adh)进行衍生化的经溴化氰(或cdap)活化的糖与蛋白载体耦合。
[0185]
在实施方式中,糖上的羟基基团(任选地为经活化的羟基基团,例如通过氰酸酯活化的羟基基团)直接或间接(通过接头)与蛋白质上的氨基或羧基基团连接。当存在接头时,糖上的羟基基团任选地与接头上的氨基基团连接,例如通过使用cdap缀合。接头(例如adh)中的进一步的氨基基团可以例如通过使用碳二亚胺化学(例如通过使用edac)与蛋白质上的羧酸基团缀合。在实施方式中,脑膜炎奈瑟氏菌荚膜糖(或一般糖)在接头与载体蛋白缀合之前先与接头缀合。替代地,接头可以在与糖缀合之前与载体缀合。
[0186]
一般而言,可以使用蛋白载体上的下列类型的化学基团来用于耦合/缀合:
[0187]
a)羧基(例如经由天冬氨酸或谷氨酸)。在一个实施方式中,该基团直接与糖上的氨基基团连接,或通过碳二亚胺化学(例如用edac)与接头上的氨基基团连接。
[0188]
b)氨基基团(例如经由赖氨酸)。在一个实施方式中,该基团直接与糖上的羧基基团连接,或通过碳二亚胺化学(例如用edac)与接头上的羧基基团连接。在另一实施方式中,该基团直接与糖上的用cdap或cnbr活化的羟基基团连接或与接头上的此类基团连接;与具有醛基团的糖或接头连接;与具有琥珀酰亚胺酯基团的糖或接头连接。
[0189]
c)巯基(例如经由半胱氨酸)。在一个实施方式中,该基团通过马来酰亚胺化学与溴或氯乙酰化糖或接头连接。在一个实施方式中,该基团用双重氮联苯胺活化/修饰。
[0190]
d)羟基基团(例如经由酪氨酸)。在一个实施方式中,该基团用双重氮联苯胺活化/修饰。
[0191]
e)咪唑基基团(例如经由组氨酸)。在一个实施方式中,该基团用双重氮联苯胺活化/修饰。
[0192]
f)胍基基团(例如经由精氨酸)。
[0193]
g)吲哚基基团(例如经由色氨酸)。
[0194]
在糖上,通常可以使用以下基团来用于耦合:oh、cooh或nh2。醛基团可以在本领域已知的不同处理(如:高碘酸盐、酸水解、过氧化氢等)之后生成。
[0195]
直接耦合方法:
[0196]
糖-oh+cnbr或cdap
‑‑‑‑
》氰酸酯+nh2-prot
‑‑‑
》缀合物
[0197]
糖-醛+nh2-prot
‑‑‑‑
》schiff碱+nacnbh3
‑‑‑‑
》缀合物
[0198]
糖-cooh+nh2-prot+edac
‑‑‑‑
》缀合物
[0199]
糖-nh2+cooh-prot+edac
‑‑‑‑
》缀合物
[0200]
经由间隔子(接头)方法间接耦合:
[0201]
糖-oh+cnbr或cdap
‑‑
》氰酸酯+nh2
‑‑‑
nh2
‑‑‑
》糖
‑‑‑‑
nh2+cooh-prot+edac
‑‑‑‑
》缀合物
[0202]
糖-oh+cnbr或cdap
‑‑‑‑
》氰酸酯+nh2
‑‑‑‑
sh
‑‑‑‑
》糖
‑‑‑‑
sh+sh-prot(具有暴露的半胱氨酸的天然蛋白或通过例如spdp修饰所述蛋白质的氨基基团后获得)
‑‑‑‑‑
》糖-s-s-prot
[0203]
糖-oh+cnbr或cdap
‑‑‑
》氰酸酯+nh2
‑‑‑
sh
‑‑‑‑‑‑
》糖
‑‑‑‑
sh+马来酰亚胺-prot(氨基基团的修饰)
‑‑‑‑
》缀合物
[0204]
糖-cooh+edac+nh2
‑‑‑‑
nh2
‑‑‑
》糖
‑‑‑‑‑‑
nh2+edac+cooh-prot
‑‑‑
》缀合物
[0205]
糖-cooh+edac+nh2
‑‑‑‑‑
sh
‑‑‑
》糖
‑‑‑‑‑
sh+sh-prot(具有暴露的半胱氨酸的天然蛋白或通过例如spdp修饰所述蛋白质的氨基基团后获得)
‑‑‑‑
》糖-s-s-prot
[0206]
糖-cooh+edac+nh2
‑‑‑
sh
‑‑‑‑
》糖
‑‑‑‑
sh+马来酰亚胺-prot(氨基基团的修饰)
‑‑‑‑
》缀合物
[0207]
糖-醛+nh2
‑‑‑‑
nh2
‑‑‑
》糖
‑‑‑
nh2+edac+cooh-prot
‑‑‑
》缀合物
[0208]
注:可以使用任何合适的碳二亚胺来代替以上的edac。
[0209]
总之,通常用于与糖耦合的蛋白载体化学基团的类型为氨基基团(例如在赖氨酸残基上)、cooh基团(例如在天冬氨酸和谷氨酸残基上)和sh基团(如果可接近的话)(例如在半胱氨酸残基上)。
[0210]
在实施方式中,脑膜炎奈瑟氏菌荚膜糖(或一般糖)中的至少一种与载体蛋白直接缀合;任选地,men w和/或meny和/或menc糖与载体蛋白直接缀合。例如menw;meny;menc;menw和meny;menw和menc;meny和menc;或menw、meny和menc与载体蛋白直接连接。任选地,脑膜炎奈瑟氏菌荚膜糖中的至少一种通过cdap直接缀合。例如menw;meny;menc;menw和meny;menw和menc;meny和menc;或menw、meny和menc通过cdap与载体蛋白直接连接(参见wo 95/08348和wo 96/29094)。在实施方式中,所有脑膜炎奈瑟氏菌荚膜糖均与破伤风类毒素
缀合。
[0211]
在实施方式中,men w和/或y糖与载体蛋白的比率在1:0.5至1:2(w/w)之间和/或menc糖与载体蛋白的比率在1:0.5至1:4或1:0.5至1:1.5(w/w)之间,特别当这些糖任选地使用cdap与蛋白质直接连接时。
[0212]
在实施方式中,脑膜炎奈瑟氏菌荚膜糖(或一般糖)中的至少一种经由接头(例如双官能接头)与载体蛋白缀合。接头任选地是异双官能或同双官能的,具有反应性胺基团和反应性羧酸基团,例如2个反应性胺基团或2反应性羧酸基团。接头具有例如4至20、4至12、5至10个碳原子。可能的接头是adh。
[0213]
在实施方式中,mena;menc;或mena和menc经由接头与载体蛋白(例如破伤风类毒素)缀合。
[0214]
在实施方式中,脑膜炎奈瑟氏菌荚膜糖中的至少一种使用cdap和edac经由接头与载体蛋白缀合。例如mena;menc;或mena和menc使用如上文所描述的cdap和edac经由接头(例如那些在其端点具有两个肼基基团的接头,如adh)与蛋白质缀合。例如cdap用于将糖与接头缀合,并且edac用于将接头与蛋白质缀合。对于mena;menc;或mena和menc,任选地,经由接头的缀合导致糖对载体蛋白的比率在1:0.5至1:6;1:1至1:5或1:2至1:4之间。
[0215]
在实施方式中,当存在mena荚膜糖时,所述mena荚膜糖至少部分地被o-乙酰化,使得至少50%、60%、70%、80%、90%、95%或98%的重复单元在至少一个位置处被o-乙酰化。o-乙酰化例如至少存在于至少50%、60%、70%、80%、90%、95%或98%的重复单元的位置o-3处。
[0216]
在实施方式中,当存在menc荚膜糖时,所述menc荚膜糖至少部分地被o-乙酰化,使得至少30%、40%、50%、60%、70%、80%、90%、95%或98%的(α2
→
9)-连接的neunac重复单元在至少一个或两个位置处被o-乙酰化。o-乙酰化例如存在于至少30%、40%、50%、60%、70%、80%、90%、95%或98%的重复单元的o-7和/或o-8位置处。
[0217]
在实施方式中,当存在menw荚膜糖时,所述menw荚膜糖至少部分地被o-乙酰化,使得至少30%、40%、50%、60%、70%、80%、90%、95%或98%的重复单元在至少一个或两个位置处被o-乙酰化。o-乙酰化例如存在于至少30%、40%、50%、60%、70%、80%、90%、95%或98%的重复单元的o-7和/或o-9位置处。
[0218]
在实施方式中,当存在meny荚膜糖时,所述meny荚膜糖至少部分地被o-乙酰化,使得至少20%、30%、40%、50%、60%、70%、80%、90%、95%或98%的重复单元在至少一个或两个位置处被o-乙酰化。o-乙酰化存在于至少20%、30%、40%、50%、60%、70%、80%、90%、95%或98%的重复单元的7和/或9位置处。
[0219]
o-乙酰化的百分比是指含有o-乙酰化的重复单元的百分比。这可以在缀合之前和/或缀合之后在糖中测量。
[0220]
在本公开免疫原性组合物的一个实施方式中,存在的糖或存在的每种脑膜炎奈瑟氏菌荚膜糖与tt缀合。在进一步的实施方式中,每种脑膜炎奈瑟氏菌荚膜糖分别与单独的载体蛋白缀合。在进一步的实施方式中,每种脑膜炎奈瑟氏菌荚膜糖缀合物的糖:载体比率为1:5至5:1或1:1至1:4(w/w)。在进一步的实施方式中,至少一种、二种或三种脑膜炎奈瑟氏菌荚膜糖缀合物与载体蛋白直接缀合。在进一步的实施方式中,menw和/或meny、menw和/或menc、meny和/或menc、或者menw和menc、以及meny与载体蛋白直接缀合。在进一步的实施
方式中,至少一种、二种或三种脑膜炎奈瑟氏菌糖缀合物通过cdap化学直接缀合。在进一步的实施方式中,menw和/或y糖与载体蛋白的比率在1:0.5至1:2(w/w)之间。在进一步的实施方式中,menc糖与载体蛋白的比率在1:0.5至1:2(w/w)之间。在进一步的实施方式中,至少一种、二种或三种脑膜炎奈瑟氏菌荚膜糖经由接头(其可以是双官能的,如具有两个反应性氨基基团(如adh)或两个反应性羧基基团,或一端为反应性氨基基团并且另一端为反应性羧基基团)与载体蛋白缀合。接头可以具有4至12个碳原子。在进一步的实施方式中,经由接头缀合的脑膜炎奈瑟氏菌荚膜糖或每种脑膜炎奈瑟氏菌荚膜糖通过cdap化学与接头缀合。在进一步的实施方式中,载体蛋白使用碳二亚胺化学(例如使用edac)与接头缀合。在进一步的实施方式中,脑膜炎奈瑟氏菌荚膜糖或每种脑膜炎奈瑟氏菌荚膜糖在载体蛋白与接头缀合之前与接头缀合。在进一步的实施方式中,mena经由接头与载体蛋白缀合(mena糖与载体蛋白的比率可以在1:2至1:5(w/w)之间)。在进一步的实施方式中,menc经由接头与载体蛋白缀合(menc糖与载体蛋白的比率可以在1:2至1:5(w/w)之间)。
[0221]
通过使用天然或略微被定尺寸的多糖缀合物,可以实现以下优势中的一个或多个:1)可通过0.2微米过滤器过滤的具有高免疫原性的缀合物;2)免疫记忆可以被增强(如在实施例三中);3)缀合物中多糖与蛋白质的比率改变,使得缀合物中的多糖与蛋白质的比率(w/w)可以被增加(这可以导致载体抑制作用降低);4)易于水解的免疫原性缀合物(如mena缀合物)可以通过使用较大的多糖进行缀合来稳定。使用较大的多糖可以导致与缀合物载体更多的交联,并且可以减少游离糖从缀合物中的释出。现有技术中描述的缀合物疫苗倾向于在缀合之前将多糖解聚以便改善缀合。保留较大尺寸的糖的脑膜炎球菌(或糖)缀合物疫苗可以提供针对脑膜炎球菌疾病的良好免疫应答。
[0222]
因此,本公开的免疫原性组合物可以包含一种或多种糖缀合物,其中每种糖在缀合之前的平均尺寸高于50kda、75kda、100kda、110kda、120kda或130kda。在一个实施方式中,缀合后的缀合物应该可容易地通过0.2微米过滤器过滤,使得与过滤前样品相比,过滤后获得超过50、60、70、80、90或95%的产率。
[0223]
具体地,本公开的免疫原性组合物包含与载体蛋白缀合的来自血清组a、c、w和y中的至少一种、二种、三种或四种的脑膜炎奈瑟氏菌荚膜糖,其中至少一种、二种、三种或四种或者每种脑膜炎奈瑟氏菌荚膜糖的平均尺寸(重量-平均分子量;mw)高于50kda、60kda、75kda、100kda、110kda、120kda或130kda。
[0224]
在优选的实施方式中,
mena
ah-tt缀合物的平均mw为至少250kda、260kda、270kda、280kda或290kda,最优选为约300kda,并且至多为350kda或330kda。在优选的实施方式中,
menc
ah-tt缀合物的平均mw为至少150kda、160kda、170kda、180kda或190kda,最优选为约200kda,并且至多为250kda或230kda。在优选的实施方式中,menw-tt缀合物的平均mw为至少240kda、250kda、260kda或270kda,最优选为约280kda,并且至多为330kda或310kda。在优选的实施方式中,meny-tt缀合物的平均mw为至少220kda、230kda、240kda或250kda,最优选为约270kda,并且至多为320kda或300kda。
[0225]
免疫原性组合物可以包含与载体蛋白缀合的来自血清组a、c、w和y中的至少一种、二种、三种或四种的脑膜炎奈瑟氏菌荚膜糖,其中至少一种、二种、三种或四种或者每种脑膜炎奈瑟氏菌荚膜糖是天然糖,或者相对于天然多糖的重量平均分子量按高达
×
2、
×
3、
×
4、
×
5、
×
6、
×
7、
×
8、
×
9或
×
10倍被定尺寸。
[0226]
出于本公开的目的,“天然多糖”是指未经受过处理过程的糖,所述处理过程的目的在于减小所述糖的尺寸。在正常纯化程序期间,多糖的尺寸可能会略微减小。此种糖仍然是天然的。仅当多糖经受过定尺寸技术后,多糖才不会被认为是天然的。
[0227]
出于本公开的目的,“按高达
×
2倍被定尺寸”意味着糖经受旨在减小糖尺寸但旨在保留天然多糖尺寸的一半以上的尺寸的处理过程。
×
3、
×
4等以相同的方式解释,即,糖经受旨在减小糖尺寸但旨在保留天然多糖尺寸的三分之一、四分之一以上等的尺寸的处理过程。
[0228]
在本公开的方面中,免疫原性组合物包含与载体蛋白缀合的来自血清组a、c、w和y中的至少一种、二种、三种或四种的脑膜炎奈瑟氏菌荚膜糖,其中至少一种、二种、三种或四种或者每种脑膜炎奈瑟氏菌荚膜糖是天然多糖。
[0229]
在本公开的方面中,免疫原性组合物包含与载体蛋白缀合的来自血清组a、c、w和y中的至少一种、二种、三种或四种的脑膜炎奈瑟氏菌荚膜糖,其中至少一种、二种、三种或四种或者每种脑膜炎奈瑟氏菌荚膜糖按高达
×
1.5、
×
2、
×
3、
×
4、
×
5、
×
6、
×
7、
×
8、
×
9或
×
10倍被定尺寸。
[0230]
本公开的免疫原性组合物任选地包含以下的缀合物:脑膜炎奈瑟氏菌血清组c荚膜糖(menc)、血清组a荚膜糖(mena)、血清组w135荚膜糖(menw)、血清组y荚膜糖(meny)、血清组c和y荚膜糖(mency)、血清组c和a荚膜糖(menac)、血清组c和w荚膜糖(mencw)、血清组a和y荚膜糖(menay)、血清组a和w荚膜糖(menaw)、血清组w和y荚膜糖(men wy)、血清组a、c和w荚膜糖(menacw)、血清组a、c和y荚膜糖(menacy);血清组a、w135和y荚膜糖(menawy)、血清组c、w135和y荚膜糖(mencwy);或血清组a、c、w135和y荚膜糖(menacwy)。这为本文提及的血清组a、c、w和y中的“一种、二种、三种或四种”或者“至少一种”的定义,或者每种脑膜炎奈瑟氏菌糖的定义。
[0231]
在实施方式中,如通过malls所测定的,至少一种、二种、三种、四种或每种脑膜炎奈瑟氏菌糖的平均尺寸在50kda至1500kda、50kda至500kda、50kda至300kda、101kda至1500kda、101kda至500kda、101kda至300kda之间。
[0232]
在实施方式中,当存在mena糖时,其分子量为50-500kda、50-100kda、100-500kda、55-90kda、60-70kda、或70-80kda、或60-80kda。
[0233]
在实施方式中,当存在menc糖时,其分子量为100-200kda、50-100kda、100-150kda、101-130kda、150-210kda、或180-210kda。
[0234]
在实施方式中,当存在meny糖时,其分子量为60-190kda、70-180kda、80-170kda、90-160kda、100-150kda、或110-140kda、50-100kda、100-140kda、140-170kda、或150-160kda。
[0235]
在实施方式中,当存在menw糖时,其分子量为60-190kda、70-180kda、80-170kda、90-160kda、100-150kda、110-140kda、50-100kda、或120-140kda。
[0236]
本文的糖的分子量或平均分子量是指在缀合之前测量的糖的重量-平均分子量(mw),并且通过malls测量。
[0237]
malls技术是本领域众所周知的,并且通常如实施例2中所描述的进行。对于脑膜炎球菌糖的malls分析,可以组合使用两个柱(tskg6000和5000pwxl),并且将糖在水中洗脱。使用光散射检测器(例如在488nm处配备有10mw氩激光的wyatt dawn dsp)和光干涉折
170kda、或110-140kda之间的menw荚膜糖。
[0244]
在本公开的实施方式中,脑膜炎奈瑟氏菌糖缀合物中的至少二种、三种、四种或每种中的每一种的糖剂量任选地为相同或近似相同。
[0245]
在实施方式中,本公开的免疫原性组合物经调节或缓冲至或者经调节至在ph 7.0至8.0、ph 7.2至7.6之间,或大约或确切ph 7.4。
[0246]
本公开的免疫原性组合物或疫苗任选地在稳定剂(例如多羟基化合物(如蔗糖或海藻糖))的存在下冻干。
[0247]
对于上文讨论的脑膜炎奈瑟氏菌糖组合物,完全不使用任何铝盐佐剂或任何佐剂可能是有利的。
[0248]
活性剂可以以不同的浓度存在于本公开的药物组合物或疫苗中。通常,物质的最低浓度为实现其预期用途所必需的量,而最高浓度为将保持在溶液中或均匀悬浮在初始混合物内的最大量。例如治疗剂的最低量任选地为将提供单一治疗有效用量的量。对于生物活性物质,最低浓度为重构时对于生物活性所需的量,并且最高浓度为无法维持均匀悬浮液的点。
[0249]
在另一实施方式中,组合物包括脑膜炎奈瑟氏菌血清组x荚膜多糖与载体分子的缀合物。群x荚膜多糖的结构由不含o-乙酰基基团的通过al-4磷酸二酯键保持在一起的n-乙酰葡糖胺-4-磷酸残基组成。载体分子可以是白喉或破伤风类毒素、crm 197或蛋白d。在优选的实施方式中,如实施例中所例示的,组合物不包括脑膜炎奈瑟氏菌血清组x荚膜多糖的缀合物。
[0250]
下文描述了示例性组合物的进一步描述。
[0251]
组合物和疫苗
[0252]
在一些实施方式中,组合物包括用液体mnb二价rlp2086组合物重构的冻干menacwy-tt组合物。优选地,在室温下重构至少24小时后,冻干menacwy-tt组合物和液体mnb二价rlp2086组合物是相容的和稳定的。
[0253]
在优选的实施方式中,组合物引发针对脑膜炎奈瑟氏菌血清组b和除b之外的脑膜炎奈瑟氏菌血清组的杀菌抗体。例如在一些实施方式中,mnb二价rlp2086组合物引发针对至少脑膜炎奈瑟氏菌血清组a、c、w、y和x的杀菌抗体。
[0254]
此外,本发明人发现,组合物引发针对脑膜炎奈瑟氏菌血清组a、c、w和y的几何平均滴度,其与在针对脑膜炎奈瑟氏菌血清组a、c、w和y的许可疫苗中观察到的几何平均滴度一致。
[0255]
在一些实施方式中,组合物引发针对脑膜炎奈瑟氏菌血清组a、c、w和y的几何平均滴度,其高于在针对脑膜炎奈瑟氏菌血清组a、c、w和y的许可疫苗中观察到的几何平均滴度。
[0256]
此外,本发明人发现,组合物引发针对脑膜炎奈瑟氏菌血清组b的几何平均滴度,其与在针对脑膜炎奈瑟氏菌血清组b的许可疫苗中观察到的几何平均滴度一致。
[0257]
在一些实施方式中,组合物引发针对脑膜炎奈瑟氏菌血清组b的几何平均滴度,其高于在针对脑膜炎奈瑟氏菌血清组b的许可疫苗中观察到的几何平均滴度。
[0258]
在一些实施方式中,包括fhbp的组合物在年龄为至少12个月的人中引发有效的免疫应答。组合物还引发针对脑膜炎奈瑟氏菌血清组x菌株的免疫应答。在一些实施方式中,
组合物包括至少一种因子h结合多肽(fhbp)和至少一种脑膜炎奈瑟氏菌荚膜糖缀合物。在优选的实施方式中,组合物是稳定的,并且引发针对表达与多组分组合物中的fhbp变体同源的fhbp变体的菌株的免疫应答,以及针对表达与多组分组合物中的fhbp变体异源的fhbp变体的菌株的免疫应答。
[0259]
在一些实施方式中,液体mnb二价rlp2086组合物可以容易地重构冻干menacwy-tt组合物,并且组合的组合物是相容的和稳定的。
[0260]
在一个方面,本公开涉及一种针对脑膜炎奈瑟氏菌的组合物。组合物包括:(a)第一脂化多肽,其包括seq id no:1中所示的氨基酸序列;(b)第二脂化多肽,其包括seq id no:2中所示的氨基酸序列;(c)脑膜炎奈瑟氏菌血清组a(mena)荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐化学与己二酸二酰肼(adh)接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素载体蛋白(tt)缀合(mena
ah-tt缀合物);(d)脑膜炎奈瑟氏菌血清组c(menc)荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐化学与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素载体蛋白(tt)缀合(menc
ah-tt缀合物);(e)脑膜炎奈瑟氏菌血清组w135(menw)荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐化学与破伤风类毒素载体蛋白(tt)直接缀合(menw-tt缀合物);(f)脑膜炎奈瑟氏菌血清组y(meny)荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲氨基吡啶四氟硼酸盐化学与破伤风类毒素载体蛋白(tt)直接缀合(meny-tt缀合物)。
[0261]
在另一方面,本公开涉及一种包括mnb二价rlp2086组合物和menacwy-tt组合物的组合的组合物。mnb二价rlp2086组合物是指包括单一脑膜炎奈瑟氏菌多肽组分的组合物,其诱导针对多种脑膜炎奈瑟氏菌血清组b菌株的有效的广泛保护性免疫应答。具体地,在一个实施方式中,mnb二价rlp2086组合物包括mnb rlp2086亚族a蛋白(seq id no:1)和mnb rlp2086亚族b蛋白(seq id no:2)。在一个实施方式中,组合物不包括融合蛋白。在一个实施方式中,组合物不包括嵌合蛋白。在一个实施方式中,组合物不包括杂合蛋白。在一个实施方式中,组合物不进一步包括肽片段。在另一实施方式中,组合物不进一步包括不是fhbp的奈瑟菌多肽。例如在一个实施方式中,组合物不包括pora蛋白。在另一实施方式中,组合物不包括nada蛋白。在另一实施方式中,该组合物不进一步包括奈瑟菌肝素结合抗原(nhba)。在另一实施方式中,组合物不进一步包括奈瑟菌外膜囊泡(omv)。在优选的实施方式中,组合物不进一步包括除第一多肽和第二多肽之外的抗原。在优选的实施方式中,mnb二价rlp2086组合物进一步包括聚山梨醇酯-80。在一个实施方式中,mnb二价rlp2086组合物进一步包括组氨酸缓冲液。在一个实施方式中,mnb二价rlp2086组合物进一步包括氯化钠。在一个实施方式中,mnb二价rlp2086组合物进一步包括磷酸铝。在一个实施方式中,mnb二价rlp2086组合物进一步包括聚山梨醇酯-80、组氨酸缓冲液、氯化钠和磷酸铝。优选地,mnb二价rlp2086组合物是液体配制剂,其中多肽在10mm组氨酸缓冲液,ph 6.0、150mm氯化钠(nacl)加上0.5mg/ml磷酸铝(alpo4)中被配制成120mcg/ml/亚族,并且在0.5ml剂量中进一步包括0.018mg聚山梨醇酯-80。
[0262]
menacwy-tt组合物是指包括脑膜炎奈瑟氏菌血清组a、c、w-135和y的纯化的荚膜多糖的组合物,所述纯化的荚膜多糖各自独立地分别以~3、~3、~1.5和~1.3的比率(tt与多糖)与tt缀合。具体地,组合物包括:(c)脑膜炎奈瑟氏菌血清组a(mena)荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐化学与己二酸二酰肼(adh)接头缀合,其中所述接头通
过碳二亚胺化学与破伤风类毒素载体蛋白(tt)缀合(mena
ah-tt缀合物);(d)脑膜炎奈瑟氏菌血清组c(menc)荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐化学与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素载体蛋白(tt)缀合(menc
ah-tt缀合物);(e)脑膜炎奈瑟氏菌血清组w135(menw)荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐化学与破伤风类毒素载体蛋白(tt)直接缀合(menw-tt缀合物);(f)脑膜炎奈瑟氏菌血清组y(meny)荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲氨基吡啶四氟硼酸盐化学与破伤风类毒素载体蛋白(tt)直接缀合(meny-tt缀合物)。优选地,menacwy-tt组合物以冻干粉末呈现。
[0263]
mena
ah-tt、menc
ah-tt、menw-tt和meny-tt缀合物通过以下步骤制备:制造多糖药物中间体,制造tt药物中间体,将多糖微流化,多糖的衍生化(仅用于menaah-tt和mencah-tt过程),tt的额外纯化以及将个别多糖与tt缀合。
[0264]
关于mena
ah-tt缀合物,首先将mena多糖微流化以减小分子尺寸和粘度,然后用1-氰基-4-二甲基氨基吡啶四氟硼酸盐(cdap)经由氰基化来活化。用己二酸二酰肼(adh)对经活化的mena进行衍生化以形成mena
ah
。mena
ah
和破伤风类毒素(tt)通过由碳二亚胺介导的缩合作用耦合(1-乙基-3-(3-二甲氨基丙基)碳二亚胺(edac)耦合技术)以形成mena
ah-破伤风类毒素缀合物(mena
ah-tt)。
[0265]
关于menc
ah-tt缀合物,首先将menc多糖微流化以减小分子尺寸和粘度,然后用cdap经由氰基化来活化。用己二酸二酰肼(adh)对经活化的menc进行衍生化以形成menc
ah
。menc
ah
和tt通过由碳二亚胺介导的缩合作用耦合(edac耦合技术)以形成menc
ah
破伤风类毒素(menc
ah-tt)。
[0266]
关于menw-tt缀合物,首先将menw多糖微流化以减小分子尺寸和粘度,然后用cdap经由氰基化来活化。经活化的menw与tt直接耦合以形成menw-破伤风类毒素(menw-tt)。
[0267]
关于meny-tt缀合物,首先将meny多糖微流化以减小分子尺寸和粘度,然后用cdap经由氰基化来活化。经活化的meny与tt直接耦合以形成meny-破伤风类毒素(meny-tt)。
[0268]
在另一方面,衍生自至多二种脑膜炎奈瑟氏菌血清组b菌株的多肽抗原诱导针对多种脑膜炎奈瑟氏菌血清组b菌株的有效的广泛保护性免疫应答。因此,在一个实施方式中,组合物不进一步包括非衍生自脑膜炎奈瑟氏菌血清组b fhbp亚族a m98250771菌株和/或脑膜炎奈瑟氏菌血清组b fhbp亚族b cdc1573菌株的多肽。
[0269]
在一个实施方式中,组合物不进一步包括与seq id no:1具有小于100%序列同一性的多肽。在另一实施方式中,组合物不进一步包括与seq id no:2具有小于100%序列同一性的多肽。例如组合物不进一步包括与全长seq id no:1和/或seq id no:2具有小于100%序列同一性的多肽。
[0270]
在一个实施方式中,组合物进一步包括聚山梨醇酯-80、铝、组氨酸和氯化钠。在一个实施方式中,组合物包括约60μg的第一脂化多肽(其包括seq id no:1中所示的氨基酸序列)、约60μg的第二脂化多肽(其包括seq id no:2中所示的氨基酸序列)、与每种多肽的摩尔比为2.8的聚山梨醇酯-80、作为磷酸铝的0.5mg铝/ml、10mm组氨酸和150mm氯化钠,其中所述组合物的总体积优选为约0.5ml。
[0271]
在另一方面,组合物包括约120μg/ml的第一脂化多肽(其包括seq id no:1中所示的氨基酸序列)、约120μg/ml的第二脂化多肽(其包括seq id no:2中所示的氨基酸序列)、
与每种多肽的摩尔比为2.8的聚山梨醇酯-80、作为磷酸铝的0.5mg铝/ml、10mm组氨酸和150mm氯化钠。
[0272]
在进一步的方面,组合物包括a)60μg的第一脂化多肽,其包括seq id no:1中所示的氨基酸序列;b)60μg的第二脂化多肽,其包括seq id no:2中所示的氨基酸序列;c)18μg聚山梨醇酯-80;d)250μg铝;e)780μg组氨酸,以及;f)4380μg氯化钠。
[0273]
在示例性实施方式中,组合物包括约60μg的第一脂化多肽(其由seq id no:1中所示的氨基酸序列组成)、约60μg的第二脂化多肽(其由seq id no:2中所示的氨基酸序列组成)、与第一脂化多肽和与第二脂化多肽的摩尔比为2.8的聚山梨醇酯-80、0.5mg/ml磷酸铝、10mm组氨酸和150mm氯化钠,其中所述组合物的总体积优选为约0.5ml。在示例性实施方式中,组合物是无菌等张的缓冲的液体悬浮液。在示例性实施方式中,组合物的ph为6.0。在示例性实施方式中,第一多肽和第二多肽被吸附到铝上。
[0274]
在一个实施方式中,组合物包括平均tt/多糖比为3的mena
ah-tt缀合物;平均tt/多糖比为3的menc
ah-tt缀合物;平均tt/多糖比为1.5的menw-tt缀合物;以及平均tt/多糖比为1.3的meny-tt缀合物。在优选的实施方式中,组合物包括具有5mcg mena多糖和~15mcg tt的mena
ah-tt缀合物;具有5mcg menc多糖和~15mcg tt的menc
ah-tt缀合物;具有5mcg menw多糖和~7.5mcg tt的menw-tt缀合物;以及具有5mcg meny多糖和~6.5mcg tt的meny-tt缀合物。组合物可以进一步包括tris-hcl、蔗糖和氯化钠。
[0275]
在另一实施方式中,组合物包括mena
ah-tt缀合物;menc
ah-tt缀合物;menw-tt缀合物;以及meny-tt缀合物,其包括mena多糖;menc多糖;menw多糖;和meny多糖以及tt载体蛋白。组合物可以进一步包括蔗糖和托莫他尼(trometanol)。例如在一个实施方式中,组合物包括10μg/ml mena多糖;10μg/ml menc多糖;10μg/ml menw多糖;以及10μg/ml meny多糖;88μg/ml tt载体蛋白;164mm蔗糖;以及1.6mm托莫他尼。
[0276]
在一个实施方式中,组合物的总体积为约0.5ml。在一个实施方式中,组合物的第一剂量的总体积为约0.5ml。“第一剂量”是指在第0天施用的组合物的剂量。“第二剂量”或“第三剂量”是指在第一剂量之后施用的组合物的剂量,其可能或可能不与第一剂量相同。
[0277]
在一个方面,本公开涉及从冻干menacwy-tt组合物产生的液体免疫原性组合物,所述冻干menacwy-tt组合物已经用液体mnb二价rlp2086组合物重构。重构是指通过添加液体稀释剂来将干燥的冻干组合物恢复成液体形式。在优选的实施方式中,液体mnb二价rlp2086组合物不随冻干menacwy-tt组合物施用、不与冻干menacwy-tt组合物共同施用、不与冻干menacwy-tt组合物同时施用,其中冻干menacwy-tt组合物已经用不是所述液体mnb二价rlp2086组合物的液体组合物重构。例如在优选的实施方式中,冻干menacwy-tt组合物不是用由氯化钠和水组成的水性稀释剂重构,并且不随液体mnb二价rlp2086组合物施用、不与液体mnb二价rlp2086组合物共同施用、不与液体mnb二价rlp2086组合物同时施用。
[0278]
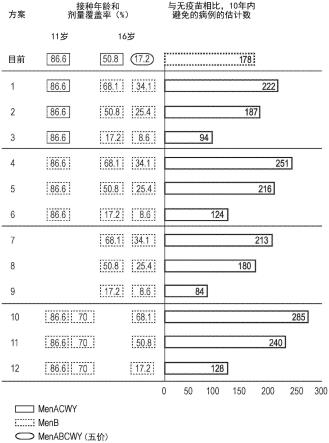
更确切地说,在优选的实施方式中,将冻干menacwy-tt组合物与mnb二价rlp2086组合物在一次施用(即单次施用)中施用于人。所得单次施用(例如menabcwy组合物)可能是由于来自第一容器的mnb二价rlp2086组合物与来自第二容器的冻干menacwy-tt组合物混合而导致的。替代地,单次施用menabcwy组合物可以由包括mnb二价rlp2086组合物和冻干menacwy-tt组合物的一个(单个)容器来导致。用于疫苗或免疫原性组合物的递送装置是本领域已知的。在一个实施方式中,menabcwy组合物与以下中的任一种伴随施用:布洛芬
(ibuprofen)、扑热息痛(paracetamol)和阿莫西林(amoxicillin)。
[0279]
向人施用第一剂量后,组合物是免疫原性的。在一个实施方式中,第一剂量的总体积为约0.5ml。
[0280]
当在相同条件下,在使用人补体进行的血清杀菌测定(hsba)中测量时,组合物在接受第一剂量后的人中诱导的血清免疫球蛋白杀菌滴度比接受所述第一剂量之前的人中的血清免疫球蛋白杀菌滴度高至少1倍,优选高至少2倍。
[0281]
杀菌滴度或杀菌免疫应答针对脑膜炎奈瑟氏菌血清组b。在优选的实施方式中,杀菌滴度或杀菌免疫应答针对脑膜炎奈瑟氏菌血清组b fhbp亚族a菌株和针对脑膜炎奈瑟氏菌血清组b fhbp亚族b菌株。最优选地,杀菌滴度或杀菌免疫应答至少针对脑膜炎奈瑟氏菌血清组b fhbp亚族b b01菌株。
[0282]
在一个实施方式中,当在相同条件下,在使用人补体进行的血清杀菌测定中测量时,组合物在接受组合物的剂量后的人中诱导的血清免疫球蛋白杀菌滴度比接受所述剂量之前的人中的血清免疫球蛋白杀菌滴度高至少1倍,如例如至少1.01倍、1.1倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、11倍、12倍、13倍、14倍、15倍或16倍。
[0283]
在一个实施方式中,组合物是免疫原性组合物。在一个实施方式中,组合物是用于人的免疫原性组合物。在另一实施方式中,组合物是疫苗。“疫苗”是指包括抗原的组合物,所述抗原含有至少一个表位,所述至少一个表位诱导对所述抗原具有特异性的免疫应答。疫苗可以通过皮下、口、口鼻或鼻内施用途径直接施用于受试者。优选地,疫苗经肌内施用。在一个实施方式中,组合物是人疫苗。在一个实施方式中,组合物是针对脑膜炎奈瑟氏菌的免疫原性组合物。
[0284]
在一个实施方式中,组合物是液体组合物。在优选的实施方式中,组合物是液体悬浮液组合物。在另一优选的实施方式中,组合物未被冻干。
[0285]
稳定性
[0286]
术语“稳定”和“稳定性”是指抗原在一段时间内保持免疫原性的能力。稳定性可以在随着时间推移的效力中测量。术语“稳定”和“稳定性”进一步是指免疫原性组合物的物理、化学和构象稳定性。蛋白质组合物的不稳定性可以由以下因素导致:蛋白质分子化学降解或聚集以形成更高阶的聚合物、异二聚体分解成单体、去糖基化、糖基化修饰或任何其它降低本公开中所包括的蛋白质组合物的至少一种生物学活性的结构修饰。稳定性可以通过本领域众所周知的方法来评估,包括对样品的光散射、光(吸光度或光密度)的明显衰减、尺寸(例如通过尺寸排阻色谱法)、体外或体内生物学活性和/或差示扫描量热法(dsc)的特性进行测量。其它用于评估稳定性的方法是本领域已知的,并且且也可以根据本公开使用。
[0287]
在一些实施方式中,与参考标准相比,本公开的稳定配制剂中的抗原可以维持至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%效力至少1个月、2个月、3个月、4个月、5个月、6个月、9个月、12个月、18个月、24个月、30个月、36个月、42个月、48个月、54个月或60个月。在一些实施方式中,与参考标准相比,本公开的稳定配制剂中的抗原可以维持至少50%效力至少1年、2年、3年、4年或5年。术语“稳定”和“稳定性”还是指抗原在一段时间内维持表位或免疫反应性的能力。例如与参考标准相比,本公开的稳定配制剂中的抗原可以维持至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的其表位或免疫反应性至少1个月、2个月、3个月、4个月、5个月、6
个月、9个月、12个月、18个月、24个月、30个月、36个月、42个月、48个月、54个月或60个月。在一些实施方式中,稳定性相对于环境条件进行测量。环境条件的非限制性实施例包括光、温度、冷冻/解冻循环、搅动和ph。本领域技术人员将能使用本文公开的方法或本领域已知的其它方法来确定是否存在抗原性表位或免疫反应性。在一些实施方式中,抗原的稳定性从其配制日期开始测量。在一些实施方式中,抗原的稳定性从其储存条件改变的日期开始测量。储存条件改变的非限制性实施例包括从冷冻变成冷藏、从冷冻变成室温、从冷藏变成室温、从冷藏变成冷冻、从室温变成冷冻、从室温变成冷藏、从光亮变成黑暗或引入搅动。
[0288]
在一个实施方式中,术语“稳定”和“稳定性”包括抗原与铝结合的能力。例如与参考标准相比,本公开的稳定配制剂包括至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的蛋白质,其与配制剂中的铝(例如磷酸铝)结合至少1小时、6小时、12小时、18小时、24小时、1个月、2个月、3个月、4个月、5个月、6个月、9个月、12个月、18个月、24个月、30个月、36个月、42个月、48个月、54个月或60个月。参见,例如实施例13。在优选的实施方式中,至少90%、更优选至少95%并且最优选至少99%的总亚族a rlp2086多肽(例如包括seq id no:1中所示的氨基酸序列的多肽)与组合物中的铝结合。在优选的实施方式中,至少90%、更优选至少95%并且最优选至少99%的总亚族b rlp2086多肽(例如包括seq id no:2中所示的氨基酸序列的多肽)与组合物中的铝结合。
[0289]
铝结合的确定。将包含铝和至少一种蛋白抗原的组合物离心,使得将铝丸粒化。将铝吸附的蛋白离心是本领域已知的。参见,例如egan et al.,vaccine,vol.27(24):3175-3180(2009)。还将铝结合的蛋白丸粒化,而非铝结合的蛋白则保留在上清液中。上清液和丸粒中的总蛋白通过lowry测定来确定。结合蛋白的百分比通过将上清液中的总蛋白除以添加到组合物中的总蛋白再乘以100%来计算。相似地,未结合蛋白的百分比通过将上清液中的总蛋白除以添加到组合物中的总蛋白再乘以100%来计算。对于包含亚族a和亚族b抗原二者的组合物,上清液中的单个亚族a和b蛋白浓度通过离子交换色谱法来确定。亚族a和b蛋白的分离和洗脱使用强阴离子柱和高盐浓度洗脱液进行。使用荧光检测器对亚族a和b蛋白二者进行检测和定量,所述荧光检测器的设置为激发=280run和发射=310run。亚族a和亚族b蛋白在不同的滞留时间洗脱,并且使用针对rlp2086蛋白参考材料生成的标准曲线进行定量。未结合蛋白的百分比通过将上清液中的总蛋白除以添加到组合物中的总蛋白再乘以100%来计算。结合蛋白的百分比通过从100%中减去未结合蛋白的百分比来计算。
[0290]
聚山梨醇酯-80
[0291]
聚山梨醇酯80(ps-80)是非离子表面活性剂。使用基于体外单克隆抗体的效力测定的加速稳定性研究证明,在最终配制剂中在ps-80与mnb rlp2086蛋白的摩尔比较高时亚族b蛋白不稳定。用不同比率的ps-80进行的进一步实验已证明,ps-80与mnb rlp2086蛋白的最佳摩尔比为大约2.8
±
1.4以保持效力。
[0292]
组合物中ps-80的浓度取决于ps-80与多肽的摩尔比。在一个实施方式中,组合物包括与第一多肽和与第二多肽的摩尔比为2.8
±
1.4的ps-80。在一个实施方式中,组合物包括与第一多肽和与第二多肽的摩尔比为2.8
±
1.1的ps-80。在一个实施方式中,组合物包括与多肽的摩尔比为至少1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2或3.3的ps-80。在一个实施方式中,组合物包括与多肽的摩尔比为至多4.0、3.9、3.8、3.7、3.6、3.5、3.4、3.3、3.2、3.1、3.0或2.9的ps-80。任何最小值可以与本文描述的任何最大值
组合以定义范围。优选地,组合物包括与多肽的摩尔比为2.8的ps-80。
[0293]
ps-80与多肽的摩尔比通过从测得的ps-80浓度和测得的总多肽浓度进行计算来确定,其中两个数值均以摩尔表示。例如ps-80与蛋白质的摩尔比通过将最终药物物质中测得的ps-80浓度(例如通过反相高压液相色谱法(rp-hplc))与测得的总蛋白质浓度(例如通过离子交换高压液相色谱法(iex-hplc))进行计算来确定,其中两个数值均以摩尔表示。
[0294]
使用rp-hplc来定量疫苗配制剂中聚山梨醇酯80的浓度。清洁剂的浓度通过皂化脂肪酸部分来确定;聚山梨酸酯80通过在40℃下的碱性水解来转化成游离油酸。样品使用c18柱通过rp-hplc进行分离,并且使用uv检测器在波长200nm下进行定量。
[0295]
第一和第二多肽通过阴离子交换hplc解析。rlp2086(fhbp)亚族a和b蛋白在不同的滞留时间洗脱,并且使用针对各自rlp2086蛋白参考物质生成的标准曲线进行定量。
[0296]
术语“摩尔比”和包括fhbp和ps-80的免疫原性组合物的描述进一步公开在wo2012025873和美国专利公布us 2013/0171194中,这些文献各自通过引用以其整体并入。
[0297]
如本文所用,术语“摩尔比”是指组合物中二种不同元素的摩尔数的比率。在一些实施方式中,摩尔比为清洁剂的摩尔数与多肽的摩尔数的比率。在一些实施方式中,摩尔比为ps-80的摩尔数与蛋白质的摩尔数的比率。在一个实施方式中,基于蛋白质和聚山梨醇酯80浓度,摩尔比可以使用以下等式计算:
[0298]
摩尔比=%ps-80 x 216
[0299]
mg/ml蛋白质
[0300]
在一个实施方式中,组合物包括与mnb rlp2086蛋白的摩尔比在1.4至4.2之间的ps-80以保持效力。在一个实施方式中,组合物包括至少1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7或2.8。组合物包括至多4.2、4.1、4.0、3.9、3.8、3.7、3.7、3.6、3.5、3.4、3.3、3.2、3.1、3.0、2.9或2.8。任何最小值可以与本文描述的任何最大值组合以定义范围。
[0301]
在一个实施方式中,组合物包括约0.0015、0.0017、0.0019、0.0021、0.0023、0.0025、0.0027、0.0029、0.0031、0.0033、0.0035、0.0037、0.0039、0.0041、0.0043、0.0045、0.0047、0.0049、0.0051mg/ml ps-80。优选地,组合物包括约0.0035mg/ml ps-80。
[0302]
在另一实施方式中,组合物包括至少10μg、11μg、12μg、13μg、14μg、15μg、16μg、17μg、18μg、19μg、20μg、21μg、22μg、23μg、24μg或25μg ps-80。在另一实施方式中,组合物包括至多30μg、29μg、28μg、27μg、26μg、25μg、24μg、23μg、22μg、21μg、20μg、19μg或18μg ps-80。任何最小值可以与本文描述的任何最大值组合以定义范围。在优选的实施方式中,组合物包括至少10μg以及至多20μg ps-80。在最优选的实施方式中,组合物包括约18μg ps-80。
[0303]
在另一实施方式中,组合物包括范围在0.0005%至1%的ps-80浓度。例如组合物中的ps-80浓度可以为至少0.0005%、0.005%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.10%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%或1.1%ps-80。在一个实施方式中,组合物中的ps-80浓度可以为至多2.0%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1.0%、0.9%、0.8%或0.7%ps-80。在优选的实施方式中,组合物包括约0.07%ps-80。任何最小值可以与本文描述的任何最大值组合以定义范围。
[0304]
在一些实施方式中,与第一组合物中聚山梨醇酯-80与mnb rlp2086多肽的摩尔比
相比,包括第一组合物和第二组合物的组合的组合物可以具有不同的聚山梨醇酯-80与mnb rlp2086多肽的摩尔比。在一些实施方式中,用于组合的组合物的额外表面活性剂对于维持所述组合的组合物中mnb rlp2086多肽的溶解度和稳定性不是必需的。因此,在一个实施方式中,试剂盒不包含大于0.02mg聚山梨醇酯-80。
[0305]
铝
[0306]
组合物包括作为磷酸铝的铝。添加alpo4作为稳定剂以提供增强的可制造性和稳定性。用于生产磷酸铝的工艺描述在美国专利公布us 2009/0016946中,该文献通过引用以其整体并入。在一个实施方式中,组合物不进一步包括除铝之外的多价阳离子。在一个实施方式中,组合物不进一步包括al(oh)3或al(so4)3。
[0307]
在一个实施方式中,组合物包括至少50μg、60μg、70μg、80μg、90μg、100μg、110μg、120μg、130μg、140μg、150μg、160μg、170μg、180μg、190μg、200μg、210μg、220μg、230μg、240μg或250μg铝。在一个实施方式中,组合物包括至多500μg、490μg、480μg、470μg、460μg、450μg、440μg、430μg、420μg、410μg、400μg、390μg、380μg、370μg、360μg、350μg、340μg、330μg、320μg、310μg、300μg、290μg、280μg、270μg、260μg或250μg铝。任何最小值可以与本文描述的任何最大值组合以定义范围。在最优选的实施方式中,该组合物包括250μg铝。
[0308]
在一个实施方式中,组合物包括至少0.005mg/ml、0.01mg/ml、0.02mg/ml、0.03mg/ml、0.04mg/ml、0.05mg/ml、0.06mg/ml、0.07mg/ml、0.08mg/ml、0.09mg/ml、0.10mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml或0.5mg/ml磷酸铝。在一个实施方式中,组合物包括至多2.0mg/ml、1.9mg/ml、1.8mg/ml、1.7mg/ml、1.6mg/ml、1.5mg/ml、1.4mg/ml、1.3mg/ml、1.2mg/ml、1.1mg/ml、1.0mg/ml、0.9mg/ml、0.8mg/ml或0.7mg/ml ps-80。在优选的实施方式中,该组合物包括约0.07mg/ml ps-80。任何最小值可以与本文描述的任何最大值组合以定义范围。在优选的实施方式中,组合物包括0.5mg/ml磷酸铝。在最优选的实施方式中,组合物包括呈磷酸铝(alpo4)形式的0.5mg铝/ml。该浓度维持亚族a和b蛋白与铝的结合(至少90%结合或更多结合)。
[0309]
在一些实施方式中,当与第一组合物中与铝结合的mnb rlp2086多肽的百分比相比时,第一组合物和第二组合物的组合改变了与铝结合的mnb rlp2086多肽的百分比。在一些实施方式中,第一和第二组合物的组合维持总mnb rlp2086多肽与铝的至少90%的结合。因此,在一个实施方式中,组合的组合物中总mnb rlp2086多肽与铝的百分比为至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%。优选地,组合的组合物中总mnb rlp2086多肽与铝的百分比为至少90%、更优选至少95%并且最优选至少100%。
[0310]
在另一实施方式中,与重构冻干组合物之前液体组合物中与铝结合的多肽的浓度相比,免疫原性组合物中与铝结合的多肽的浓度在24小时后并未降低。在另一实施方式中,与冻干组合物中mena
ah-tt缀合物的浓度相比,免疫原性组合物中mena
ah-tt缀合物的浓度在24小时后并未降低。在一个实施方式中,与重构之前液体组合物中相应的浓度相比,浓度在24小时后降低至多1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%。
[0311]
在另一实施方式中,与冻干组合物中menc
ah-tt缀合物的浓度相比,免疫原性组合物中menc
ah-tt缀合物的浓度在24小时后并未降低。在另一实施方式中,与冻干组合物中
menw-tt缀合物的浓度相比,免疫原性组合物中menw-tt缀合物的浓度在24小时后并未降低。在另一实施方式中,与冻干组合物中meny-tt缀合物的浓度相比,免疫原性组合物中meny-tt缀合物的浓度在24小时后并未降低。在一个实施方式中,与重构之前冻干组合物中相应的浓度相比,浓度在24小时后降低至多1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%。
[0312]
赋形剂
[0313]
在一个实施方式中,组合物包括组氨酸。在一个实施方式中,组合物包括至少650μg、660μg、670μg、680μg、690μg、700μg、710μg、720μg、730μg、740μg、750μg、760μg、770μg、780μg、790μg、800μg、810μg、820μg、830μg、840μg或850μg的组氨酸。在一个实施方式中,组合物包括至多1560μg、1500μg、1400μg、1300μg、1200μg、1100μg、1000μg、950μg、900μg、890μg、880μg、870μg、860μg、850μg、840μg、830μg、820μg、810μg、800μg、790μg或780μg的组氨酸。任何最小值可以与本文描述的任何最大值组合以定义范围。优选地,组合物包括780μg组氨酸。
[0314]
在一个实施方式中,组合物包括tris、磷酸盐或琥珀酸盐缓冲液。在优选的实施方式中,组合物不包括tris缓冲剂。在优选的实施方式中,组合物不包括磷酸盐缓冲剂。在一个优选的实施方式中,组合物不包括琥珀酸盐缓冲剂。在优选的实施方式中,组合物包括组氨酸缓冲剂。
[0315]
在一个实施方式中,组合物包括氯化钠。menabcwy组合物中的氯化钠浓度可以在160.5-161.1mm之间变化。
[0316]
在一个实施方式中,组合物的ph在5.5至7.5之间。在优选的实施方式中,组合物的ph在5.8至7.0之间,最优选ph 5.8至ph 6.0。在一个实施方式中,组合物的ph为至多6.1。在一个实施方式中,组合物的ph为5.8。
[0317]
试剂盒
[0318]
本公开的进一步方面是用于施用组合物的剂量的试剂盒,所述组合物在哺乳动物中引发针对脑膜炎奈瑟氏菌的杀菌抗体。
[0319]
在一个方面,试剂盒包括第一组合物,所述第一组合物包括如上文所描述的第一多肽和如上文所描述的第二多肽。在优选的实施方式中,第一多肽包含seq id no:1中所示的氨基酸序列。在另一优选的实施方式中,第二多肽包含seq id no:2中所示的氨基酸序列。试剂盒进一步包括第二组合物,所述第二组合物包括mena
ah-tt缀合物、menc
ah-tt缀合物、menw-tt缀合物和meny-tt缀合物。在一个实施方式中,试剂盒包括至少两个容器,其中第一容器包括第一组合物,第二容器包括第二组合物。
[0320]
在一个实施方式中,试剂盒包含液体第一组合物和冻干第二组合物。优选地,试剂盒包括液体mnb二价rlp2086组合物和冻干menacwy-tt组合物。
[0321]
在一些实施方式中,包括第一组合物和第二组合物的组合的组合物改变了聚山梨醇酯-80与mnb rlp2086多肽的摩尔比。在一些实施方式中,用于组合的组合物的额外表面活性剂对于维持所述组合的组合物中mnb rlp2086多肽的溶解度和稳定性不是必需的。因此,在一个实施方式中,试剂盒不包含大于0.02mg聚山梨醇酯-80。
[0322]
在本公开的一个实施方式中,试剂盒不进一步包含以下商用免疫原性组合物中的任一种:menactra(r)、menveo(r)、adacel(r)、havrix(r)、gardasil(r)、repevax或它们的
任意组合。例如优选地,试剂盒不进一步包括脑膜炎球菌a、c、y和w-135多糖缀合物(mcv4)组合物,其中载体蛋白是白喉类毒素。在一个实施方式中,试剂盒不进一步包括脑膜炎球菌a、c、y和w-135多糖缀合物(mcv4)组合物,其中载体蛋白是crm
197
。在一个实施方式中,试剂盒不进一步包含nimenrix疫苗,其中nimenrix包含由氯化钠和水组成的稀释剂。
[0323]
杀菌活性
[0324]
mnb的发病率为大约10万分之一,这意味着需要极多数的受试者(40万至6百万以上)来支持统计学上有意义的功效评估。因此,使用人补体进行的血清杀菌测定(hsba)是保护和疫苗功效的替代物,用于评估临床试验中的免疫原性。
[0325]
辉瑞(pfizer)已建立包含2000年至2006年引起imd的分离株的广泛mnb菌株集合(n=至少1263)。mnb分离株从us centers for disease control and prevention(cdc)以及欧洲国家健康和参考实验室系统性收集。
[0326]
在一个实施方式中,采用使用人补体进行的血清杀菌测定(hsba),针对四种脑膜炎奈瑟氏菌血清组b(mnb)菌株来确定通过向人施用组合物所诱导的免疫应答。用于hsba的mnb菌株选自菌株库。菌株库代表系统性收集的临床相关脑膜炎奈瑟氏菌菌株的集合。
[0327]
对所有测试菌株(尤其是表达具有与第一多肽和第二多肽二者异源的序列的脂蛋白2086变体的菌株)的高比率的hsba应答表明,组合物是广泛保护性疫苗,其足以赋予针对表达来自至少血清组b(包括额外的血清组(如血清组x))的rlp2086(fhbp)的脑膜炎奈瑟氏菌菌株的高度血清保护作用。
[0328]
亚族a菌株
[0329]
在一个实施方式中,hsba菌株是表达lp2086(fhbp)亚族a蛋白的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达脂蛋白2086变体的lp2086(fhbp)亚族a菌株,其与表达a05的脑膜炎奈瑟氏菌菌株异源。例如在一个实施方式中,hsba菌株是表达脂蛋白2086变体的lp2086(fhbp)亚族a菌株,其与菌株m98250771异源。
[0330]
在一个实施方式中,hsba菌株是表达fhbp a10的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086(fhbp)a22的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086(fhbp)a56的脑膜炎奈瑟氏菌菌株。在进一步的实施方式中,hsba菌株是lp2086(fhbp)a22和lp2086(fhbp)a56菌株。在另一实施方式中,hsba菌株是表达lp2086 a04的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086 a05的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086 a12的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086 a22的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086 a12的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086 a04的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086 a19的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086 a07的脑膜炎奈瑟氏菌菌株。在进一步的实施方式中,hsba菌株包括表达a22、a12、a19、a05和a07的菌株中的任一种。在一个实施方式中,hsba菌株包括表达a06、a15和a29的菌株中的任一种。
[0331]
在一个实施方式中,免疫应答对与表达a05的脑膜炎奈瑟氏菌菌株异源的脑膜炎奈瑟氏菌血清组b fhpb亚族a菌株具有杀菌性。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b a22菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b a56菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b a06菌株。在一个实施方
式中,免疫应答针对脑膜炎奈瑟氏菌血清组b a15菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b a29菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b a62菌株。在一个实施方式中,免疫应答对与脑膜炎奈瑟氏菌菌株m98250771异源的脑膜炎奈瑟氏菌血清组b亚族a菌株具有杀菌性。
[0332]
在一个实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族a菌株具有杀菌性,所述因子h结合蛋白包括与第一多肽具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在另一实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族a菌株具有杀菌性,所述因子h结合蛋白包括与由脑膜炎奈瑟氏菌菌株m98250771表达的因子h结合蛋白具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在优选的实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族a菌株具有杀菌性,所述因子h结合蛋白包括与由脑膜炎奈瑟氏菌菌株m98250771表达的因子h结合蛋白具有至少80%、更优选至少84%同一性的氨基酸序列。
[0333]
在另一实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族a菌株具有杀菌性,所述因子h结合蛋白包括与第一多肽具有至多81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在另一实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族a菌株具有杀菌性,所述因子h结合蛋白包括与由脑膜炎奈瑟氏菌菌株m98250771表达的因子h结合蛋白具有至多81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在优选的实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族a菌株具有杀菌性,所述因子h结合蛋白包括与由脑膜炎奈瑟氏菌菌株m98250771表达的因子h结合蛋白具有至多85%、更优选至多99%同一性的氨基酸序列。任何最小值可以与本文描述的任何最大值组合以定义范围。
[0334]
在一个实施方式中,由组合物引发的免疫应答不仅对脑膜炎奈瑟氏菌血清组bfhpb亚族a菌株具有杀菌性,而且对表达fhbp亚族a多肽的脑膜炎奈瑟氏菌菌株具有杀菌性,其中血清组不是血清组b。例如在一个优选的实施方式中,由组合物引发的免疫应答对脑膜炎奈瑟氏菌血清组b亚族a菌株和对表达与fhbp a05异源的fhbp亚族a多肽的脑膜炎奈瑟氏菌血清组c菌株具有杀菌性。例如在一个实施方式中,免疫应答针对表达fhbp a10的脑膜炎奈瑟氏菌血清组c菌株。在另一实施方式中,免疫应答针对表达fhbp a19的脑膜炎奈瑟氏菌血清组w菌株。在一个实施方式中,免疫应答对表达fhbp亚族a多肽的脑膜炎奈瑟氏菌菌株具有杀菌性,其中所述菌株与脑膜炎奈瑟氏菌菌株m98250771异源。
[0335]
亚族b菌株
[0336]
在一个实施方式中,hsba菌株是lp2086(fhbp)亚族b菌株。在一个实施方式中,hsba菌株是表达脂蛋白2086变体的lp2086(fhbp)亚族b菌株,其与表达b01的脑膜炎奈瑟氏菌菌株异源。例如在一个实施方式中,hsba菌株是表达脂蛋白2086变体的lp2086(fhbp)亚族b菌株,其与菌株cdc1127异源。在优选的实施方式中,hsba菌株是表达脂蛋白2086变体的lp2086(fhbp)亚族b菌株,其与菌株cdc1573异源。
[0337]
在一个实施方式中,免疫应答对与表达b01的脑膜炎奈瑟氏菌菌株异源的脑膜炎奈瑟氏菌血清组b fhpb亚族b菌株具有杀菌性。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b24菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b44菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b16菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b03菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b09菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b15菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b153菌株。在一个实施方式中,免疫应答对与脑膜炎奈瑟氏菌菌株cdc1573异源的脑膜炎奈瑟氏菌血清组b亚族b菌株具有杀菌性。
[0338]
在一个实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族b菌株具有杀菌性,所述因子h结合蛋白包括与第二多肽具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在另一实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族b菌株具有杀菌性,所述因子h结合蛋白包括与由脑膜炎奈瑟氏菌菌株cdc1573表达的因子h结合蛋白具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在优选的实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族b菌株具有杀菌性,所述因子h结合蛋白包括与由脑膜炎奈瑟氏菌菌株cdc1573表达的因子h结合蛋白具有至少80%同一性、更优选至少87%同一性的氨基酸序列。在另一优选的实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族b菌株具有杀菌性,所述因子h结合蛋白包括与由脑膜炎奈瑟氏菌菌株cdc1573表达的因子h结合蛋白具有100%同一性的氨基酸序列。
[0339]
在另一实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族b菌株具有杀菌性,所述因子h结合蛋白包括与第二多肽具有至多81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在另一实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族b菌株具有杀菌性,所述因子h结合蛋白包括与由脑膜炎奈瑟氏菌菌株cdc1573表达的因子h结合蛋白具有至多81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在优选的实施方式中,免疫应答对表达因子h结合蛋白的脑膜炎奈瑟氏菌血清组b亚族b菌株具有杀菌性,所述因子h结合蛋白包括与由脑膜炎奈瑟氏菌菌株cdc1573表达的因子h结合蛋白具有至多88%同一性、更优选至少99%同一性的氨基酸序列。任何最小值可以与本文描述的任何最大值组合以定义范围。
[0340]
在一个实施方式中,hsba菌株是lp2086(fhbp)b24菌株。在另一实施方式中,hsba菌株是lp2086(fhbp)b44菌株。在进一步的实施方式中,hsba菌株包括lp2086(fhbp)b24和lp2086(fhbp)b44菌株。在一个实施方式中,hsba菌株包括lp2086(fhbp)a22、lp2086(fhbp)a56、lp2086(fhbp)b24和lp2086(fhbp)b44菌株。在一个实施方式中,hsba菌株包括b15。在一个实施方式中,hsba菌株包括b153。在另一实施方式中,hsba菌株是lp2086 b16菌株。在一个实施方式中,hsba菌株是lp2086 b03菌株。在一个实施方式中,hsba菌株是lp2086 b09
菌株。在进一步的实施方式中,hsba菌株包括b24、b16、b44、b03和b09或它们的任意组合。在另一实施方式中,hsba菌株包括b24、b16、b44、a22、b03、b09、a12、a19、a05和a07或它们的任意组合。在另一实施方式中,hsba菌株包括a06、a07、a12、a15、a19、a29、b03、b09、b15和b16或它们的任意组合。
[0341]
在一个实施方式中,所述方法诱导针对脑膜炎奈瑟氏菌血清组b fhpb亚族a菌株和针对脑膜炎奈瑟氏菌血清组b fhpb亚族b菌株的免疫应答。优选地,免疫应答对脑膜炎奈瑟氏菌血清组b fhpb亚族a菌株和对脑膜炎奈瑟氏菌血清组b fhpb亚族b菌株具有杀菌性。
[0342]
在一个实施方式中,由组合物引发的免疫应答不仅对脑膜炎奈瑟氏菌血清组bfhpb亚族b菌株具有杀菌性,而且对表达fhbp亚族b多肽的脑膜炎奈瑟氏菌菌株具有杀菌性,其中血清组不是血清组b。例如在一个优选的实施方式中,由组合物引发的免疫应答对脑膜炎奈瑟氏菌血清组b亚族b菌株和对表达与fhbp b01异源的fhbp亚族b多肽的脑膜炎奈瑟氏菌血清组y菌株具有杀菌性。例如在一个实施方式中,免疫应答针对表达fhbp b16的脑膜炎奈瑟氏菌血清组a菌株。在另一实施方式中,免疫应答针对表达fhbp b47的脑膜炎奈瑟氏菌血清组y菌株。在另一实施方式中,免疫应答针对表达fhbp b49的脑膜炎奈瑟氏菌血清组x菌株。在一个实施方式中,免疫应答对表达fhbp亚族b多肽的脑膜炎奈瑟氏菌菌株具有杀菌性,其中所述菌株与脑膜炎奈瑟氏菌血清组b菌株cdc1573异源。
[0343]
在一个方面,本发明涉及一种组合物的用途,所述组合物包括脑膜炎奈瑟氏菌血清组b因子h结合蛋白(fhbp)的第一脂化多肽变体和脑膜炎奈瑟氏菌血清组b fhbp的第二脂化多肽变体。在一个实施方式中,所述组合物诱导针对至少一种表达选自下组的多肽的脑膜炎奈瑟氏菌血清组b菌株的杀菌免疫应答,所述组由以下各项组成:b a02、a28、a42、a63、a76、b05、b07、b08、b13、b52和b107。例如在一个方面,本发明涉及一种组合物的用途,所述组合物包括:第一脂化多肽,其包括seq id no:1中所示的氨基酸序列;以及第二脂化多肽,其包括seq id no:2中所示的氨基酸序列。
[0344]
在一个实施方式中,hsba菌株是表达fhbp b05的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086(fhbp)b07的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086(fhbp)b08的脑膜炎奈瑟氏菌菌株。在另一实施方式中,hsba菌株是表达lp2086 b13的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086 b52的脑膜炎奈瑟氏菌菌株。在一个实施方式中,hsba菌株是表达lp2086 b107的脑膜炎奈瑟氏菌菌株。在进一步的实施方式中,hsba菌株包括任何一种选自下组的菌株,所述组由以下各项组成:b05、b07、b08、b13、b52和b107。在进一步的实施方式中,hsba菌株包括任何一种选自下组的菌株,所述组由以下各项组成:b05、b07、b08、b13、b52、b107、b01、b24、b44、b16、b03、b09、b15和b153。
[0345]
在一个实施方式中,免疫应答对与表达b01的脑膜炎奈瑟氏菌菌株异源的脑膜炎奈瑟氏菌血清组b亚族b菌株具有杀菌性。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b05菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b07菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b08菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b13菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b52菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b107菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b24菌株。在一个实
施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b44菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b16菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b03菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b09菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b15菌株。在一个实施方式中,免疫应答针对脑膜炎奈瑟氏菌血清组b b153菌株。在一个实施方式中,免疫应答对与脑膜炎奈瑟氏菌菌株cdc1573异源的脑膜炎奈瑟氏菌血清组b亚族b菌株具有杀菌性。
[0346]
在一个实施方式中,免疫应答针对选自下组的脑膜炎奈瑟氏菌血清组b菌株,所述组由以下各项组成:a02、a28、a42、a63和a76。在一个实施方式中,免疫应答针对选自下组的脑膜炎奈瑟氏菌血清组b菌株,所述组由以下各项组成:b05、b07、b08、b13、b52、b107、b01、b24、b44、b16、b03、b09、b15和b153及其任意组合。
[0347]
在一个实施方式中,hsba菌株包括b05、b07、b08、b13、b52和b107或它们的任意组合。在进一步的实施方式中,hsba菌株包括b05、b07、b08、b13、b52和b107、b24、b16、b44、b03和b09或它们的任意组合。在一个实施方式中,hsba菌株包括a02、a28、a42、a63、a76、b05、b07、b08、b13、b52和b107或它们的任意组合。在另一实施方式中,hsba菌株进一步包括a06、a07、a12、a15、a19、a29、b03、b09、b15和b16或它们的任意组合。在另一实施方式中,hsba菌株包括a02、a28、a42、a63、a76、b05、b07、b08、b13、b52和b107、a06、a07、a12、a15、a19、a29、b03、b09、b15和b16及其任意组合。
[0348]
在一个实施方式中,所述方法诱导针对脑膜炎奈瑟氏菌血清组b亚族a菌株和针对脑膜炎奈瑟氏菌血清组b亚族b菌株的免疫应答。优选地,免疫应答对脑膜炎奈瑟氏菌血清组b亚族a菌株和对脑膜炎奈瑟氏菌血清组b亚族b菌株具有杀菌性。在一个实施方式中,所述方法诱导针对选自下组的脑膜炎奈瑟氏菌血清组b菌株的免疫应答,所述组由以下各项组成:a02、a28、a42、a63、a76、b05、b07、b08、b13、b52和b107及其任意组合。在一个实施方式中,所述方法诱导针对选自下组的脑膜炎奈瑟氏菌血清组b菌株的免疫应答,所述组由以下各项组成:a02、a28、a42、a63、a76、b05、b07、b08、b13、b52和b107、a06、a07、a12、a15、a19、a29、b03、b09、b15和b16及其任意组合。
[0349]
滴度
[0350]
在一个实施方式中,当在相同条件下在hsba中测量时,与施用组合物的剂量之前人中的杀菌滴度相比,所述组合物在人中诱导杀菌滴度增加。在一个实施方式中,当在相同条件下在hsba中测量时,与施用组合物的第一剂量之前人中的杀菌滴度相比,杀菌滴度较施用组合物的第一剂量之前人中的杀菌滴度增加。在一个实施方式中,当在相同条件下在hsba中测量时,与施用组合物的第二剂量之前人中的杀菌滴度相比,在组合物的第二剂量之后观察到杀菌滴度增加。在另一实施方式中,当在相同条件下在hsba中测量时,与施用组合物的第三剂量之前人中的杀菌滴度相比,在组合物的第三剂量之后观察到杀菌滴度增加。
[0351]
在一个实施方式中,在施用剂量之后,组合物在人中诱导杀菌滴度,其中当在相同条件下在hsba中测量时,所述杀菌滴度比施用所述剂量之前人中的杀菌滴度高至少1倍。例如当在相同条件下在hsba中测量时,与施用剂量之前人中的杀菌滴度相比,在接受组合物的剂量之后,人中的杀菌滴度可以高出至少1.01倍、1.1倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、11倍、12倍、13倍、14倍、15倍或16倍。
[0352]
在一个实施方式中,“应答者”是指人,其中在施用剂量之后,组合物在人中诱导杀菌滴度,其中所述杀菌滴度比施用所述剂量之前人中的杀菌滴度高至少1倍。在优选的实施方式中,与施用剂量之前人中的杀菌滴度相比,应答者的hsba滴度实现至少≥4倍增长。此种应答者可以被称为具有保护性滴度。在一些实施方式中,保护性滴度为大于1:4的滴度。
[0353]
在一个实施方式中,hsba滴度为产生可测量效果的血清样品的最高稀释度的倒数。例如在一个实施方式中,与t30 cfu值(即,在含有除测试血清之外的所有测定组分的测定孔中孵育后的存活细菌数;100%细菌存活率)相比,hsba滴度为导致mnb细菌减少至少50%(50%细菌存活率)的测试血清的最高2倍稀释度的倒数。
[0354]
在一个实施方式中,当在相同条件下在hsba中测量时,在接受第一剂量之后,组合物在人中诱导的杀菌滴度比接受所述第一剂量之前人中的杀菌滴度高至少2倍(例如高于不存在第一剂量时人中的杀菌滴度)。在一个实施方式中,当在相同条件下在利用人补体进行的人血清杀菌测定(hsba)中测量时,组合物在人中诱导的杀菌滴度比接受第一剂量之前人中的杀菌滴度高至少4倍。在一个实施方式中,当在相同条件下在利用人补体进行的人血清杀菌测定(hsba)中测量时,组合物在人中诱导的杀菌滴度比接受第一剂量之前人中的杀菌滴度高至少8倍。
[0355]
在优选的实施方式中,人血清补体衍生自对给定的hsba测试菌株具有低固有杀菌活性的人。低固有杀菌活性是指,例如针对给定的hsba测试菌株的杀菌滴度至少低于1:4稀释度。在一个实施方式中,人补体衍生自针对给定的hsba测试菌株具有至少低于1:4稀释度(如1:2稀释度)的hsba滴度的人,其中未将组合物施用于人。
[0356]
在施用组合物(如二价rlp2086组合物)之前,人可能表现出低于1:4的hsba滴度,或者在施用组合物之前,人可能表现出≥1:4的hsba滴度。因此,在优选的实施方式和实施例中,将组合物的至少一次剂量施用于人导致hsba滴度比施用之前人中的滴度大至少4倍。在一些实施方式中,将组合物的至少一次剂量施用于人导致hsba滴度至少大于1:4,如例如hsba滴度≥1:8、hsba滴度≥1:16以及hsba滴度≥1:32。本文描述的各自实施例包括对具有≥1:8和/或≥1:16的hsba滴度的人受试者的比例进行评估,其中将二价rlp2086组合物施用于人。在一些实施方式中,与施用组合物之前相比,施用组合物之后人中的滴度增加4倍,这示出了该保护作用与组合物相关联。在一些实施方式中,此类大于1:4的hsba滴度的优选评估示出,在人中诱导的保护作用(即,杀菌免疫应答)与组合物相关联。
[0357]
在一个实施方式中,在施用组合物的第一剂量之后,人具有等于或大于hsba的定量下限(lloq)的hsba滴度。在另一实施方式中,在施用组合物的第二剂量之后,人具有等于或大于hsba的lloq的hsba滴度。在另一实施方式中,在施用组合物的第三剂量之后,人具有等于或大于hsba的lloq的hsba滴度。
[0358]
方法和施用
[0359]
在一个方面,本公开涉及一种在人中诱导针对脑膜炎奈瑟氏菌的免疫应答的方法。在另一方面,本公开涉及一种给人接种疫苗的方法。
[0360]
在一些实施方式中,所述方法包括向人施用组合物,其中所述组合物诱导对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖中的每一种的免疫应答,其中所述免疫应答包括血清杀菌抗体的滴度,并且其中所述滴度高于由针对脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖的许可疫苗诱导的滴度。在一些实施方式中,针对脑膜炎奈瑟氏菌血
清组a、c、w-135和y脑膜炎球菌荚膜多糖的许可疫苗是menveo。
[0361]
在一些实施方式中,所述方法包括向人施用组合物,其中所述组合物诱导对脑膜炎奈瑟氏菌血清组b的免疫应答,其中所述免疫应答包括血清杀菌抗体的滴度,所述滴度高于由针对脑膜炎奈瑟氏菌血清组b的许可疫苗诱导的血清杀菌抗体的滴度。在一些实施方式中,针对脑膜炎奈瑟氏菌血清组b的许可疫苗是trumenba。
[0362]
在一些实施方式中,所述方法包括向人施用组合物,其中所述组合物诱导对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖中的每一种以及脑膜炎奈瑟氏菌血清组b的免疫应答,其中所述免疫应答包括对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖中的每一种的血清杀菌抗体的滴度,所述滴度高于由针对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖的许可疫苗诱导的血清杀菌抗体的滴度,并且其中所述免疫应答包括对脑膜炎奈瑟氏菌血清组b的血清杀菌抗体的滴度,所述滴度高于由针对脑膜炎奈瑟氏菌血清组b的许可疫苗诱导的血清杀菌抗体的滴度。在一些实施方式中,针对脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖的许可疫苗是menveo。在一些实施方式中,针对脑膜炎奈瑟氏菌血清组b的许可疫苗是trumenba。
[0363]
本公开涉及一种用于在任何年龄的人中引发免疫应答的方法。在一些实施方式中,人的年龄为至少4周、5周、6周、7周、8周、9周、10周、11周或12周龄。例如在优选的实施方式中,人的年龄为至少6周龄。如本领域已知的,脑膜炎球菌群a、c、w-135和y缀合物疫苗(如)适用于早在六周龄的婴儿,并且可以施用于年龄为六周龄及以上的任何人。在一些实施方式中,人的年龄为至少6个月、7个月、8个月、9个月、10个月、11个月或12个月。例如在优选的实施方式中,人的年龄为至少12个月。在一个实施方式中,人的年龄在12至18个月之间。在另一方面,本公开涉及一种用于在年龄为至少18个月的患者中引发免疫应答的方法。在一个实施方式中,人的年龄在18至24个月之间。在又另一方面,本公开涉及一种用于在年龄为至少24个月的患者中引发免疫应答的方法。在一个实施方式中,人的年龄在24个月至10岁之间。在另一方面,本公开涉及一种用于在年龄为10岁及以上的患者中引发免疫应答的方法。
[0364]
在一些实施方式中,人的年龄在10岁至25岁之间。在一些实施方式中,人的年龄在10至26岁之间。在一些实施方式中,人的年龄在12至《18个月之间。在一些实施方式中,人的年龄在18至《24个月之间。在一些实施方式中,人的年龄在18至《24个月之间。在一些实施方式中,人的年龄在≥24个月至《10岁之间。
[0365]
在一些实施方式中,人的年龄为至少16岁。在此类实施方式中,所述方法包括向人施用一次剂量,优选地向年龄为至少16岁的人施用至多一次剂量。在一些实施方式中,人的年龄为至多17岁。
[0366]
在一些实施方式中,人的年龄在10至12岁之间。在此类实施方式中,所述方法包括向人施用至少一次剂量。在优选的实施方式中,将第二剂量施用于第一剂量约6个月后的人。在优选的实施方式中,所述方法包括向年龄在10至12岁之间的人施用组合物的第一剂量和第二剂量,并且将组合物的第三剂量施用于所述第一剂量至少四年后的人。
[0367]
在一些实施方式中,所述方法包括向人施用至少两次剂量。在优选的实施方式中,两次剂量相隔至少约6个月。在优选的实施方式中,所述方法包括向年龄在10至12岁之间的人施用组合物的第一剂量和第二剂量,并且将组合物的第三剂量施用于所述第一剂量至少
四年后的人。
[0368]
在一些实施方式中,所述方法包括向约11岁的人施用组合物的第一剂量和向所述第一剂量至少四年后的人施用组合物的至少两次剂量。在一些实施方式中,所述方法包括在第一剂量约五年后施用组合物的第二和后续剂量。
[0369]
在一些实施方式中,人对脑膜炎奈瑟氏菌血清组a呈血清反应阴性。在一些实施方式中,人对脑膜炎奈瑟氏菌血清组c呈血清反应阴性。在一些实施方式中,人对脑膜炎奈瑟氏菌血清组w呈血清反应阴性。在一些实施方式中,人对脑膜炎奈瑟氏菌血清组y呈血清反应阴性。在一些实施方式中,人对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖呈血清反应阴性。
[0370]
在一些实施方式中,人对脑膜炎奈瑟氏菌血清组a呈血清反应阳性。在一些实施方式中,人对脑膜炎奈瑟氏菌血清组c呈血清反应阳性。在一些实施方式中,人对脑膜炎奈瑟氏菌血清组w呈血清反应阳性。在一些实施方式中,人对脑膜炎奈瑟氏菌血清组y呈血清反应阳性。在一些实施方式中,人对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖呈血清反应阳性。
[0371]
在一个实施方式中,所述方法包括向人施用上文描述的组合物的至少一次剂量。在优选的实施方式中,所述方法包括向人施用上文描述的组合物的至多一次剂量。在另一实施方式中,所述方法包括向人施用上文描述的组合物的至少第一剂量和第二剂量。
[0372]
在一个实施方式中,第二剂量在第一剂量后至少20、30、50、60、100、120、160、170或180天以及在第一剂量后至多250、210、200或190天施用。任何最小值可以与本文描述的任何最大值组合以定义范围。
[0373]
在另一实施方式中,第二剂量在第一剂量后约30天施用。在另一实施方式中,第二剂量在第一剂量后约60天施用,如例如在第0、2个月免疫接种计划表中。在另一实施方式中,第二剂量在第一剂量后约180天施用,如例如在第0、6个月免疫接种计划表中。在又另一实施方式中,第二剂量在第一剂量后约120天施用,如例如在第2、6个月免疫接种计划表中。
[0374]
在一个实施方式中,所述方法包括向人施用组合物的两次剂量以及至多两次剂量。在一个实施方式中,两次剂量在第一剂量约6个月后的期间内施用。在一个实施方式中,所述方法不包括向人进一步施用加强剂。如本文所用,“加强剂”是指向人额外施用组合物。向人施用组合物的至多两次剂量可能是有利的。此类优势包括例如促进人遵从完整的施用计划表以及促进所述计划表的成本效益。
[0375]
在一个实施方式中,将第一剂量和第二剂量在约25、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200天的期间内施用于人,以及在第一剂量后至多400、390、380、370、365、350、340、330、320、310、300、290、280、270、260、250、240、230、220、210或200天施用于人。任何最小值可以与本文描述的任何最大值组合以定义范围。优选地,第一和第二剂量将相隔至少4周施用,例如相隔≥8周、相隔≥2个月、相隔≥3个月、相隔≥6个月等。
[0376]
在一个实施方式中,将第一剂量和第二剂量在约30天的期间内施用于人。在另一实施方式中,将第一剂量和第二剂量在约60天的期间内施用于人。在另一实施方式中,将第一剂量和第二剂量在约180天的期间内施用于人。
[0377]
方便的是,第一剂量可以在与另一疫苗基本上相同的时间施用(例如在同一医疗
咨询或求诊医疗保健专业人员的期间或在脑膜炎球菌疫苗第一剂量的24小时内),例如在与b型肝炎病毒疫苗、白喉疫苗、破伤风疫苗、百日咳疫苗(细胞型,或优选地,非细胞型)、b型流感嗜血杆菌(haemophilus influenzae)疫苗、肺炎链球菌(streptococcus pneumoniae)疫苗和/或脊髓灰质炎疫苗(优选灭活的脊髓灰质炎病毒疫苗)基本上相同的时间施用。这些任选地共同施用的疫苗中的每一种可以是单价疫苗,或可以是组合疫苗的一部分(例如作为dtp疫苗的一部分)。
[0378]
方便的是,第二剂量可以在与另一疫苗基本上相同的时间施用(例如在同一医疗咨询或求诊医疗保健专业人员的期间或在脑膜炎球菌疫苗第二剂量的24小时内),例如在与b型肝炎病毒疫苗、白喉疫苗、破伤风疫苗、百日咳疫苗(细胞型或非细胞型)、b型流感嗜血杆菌疫苗、肺炎链球菌疫苗、脊髓灰质炎疫苗(优选灭活的脊髓灰质炎病毒疫苗)、流感疫苗、水痘疫苗、麻疹疫苗、腮腺炎疫苗和/或风疹疫苗基本上相同的时间施用。这些任选地共同施用的疫苗中的每一种可以是单价疫苗,或可以是组合疫苗的一部分(例如作为mmr疫苗的一部分)。
[0379]
方便的是,第三剂量可以在与另一疫苗基本上相同的时间施用(例如在同一医疗咨询或求诊医疗保健专业人员的期间或在脑膜炎球菌疫苗第三剂量的24小时内),例如在与b型肝炎病毒疫苗、白喉疫苗、破伤风疫苗、百日咳疫苗(细胞型或非细胞型)、b型流感嗜血杆菌疫苗、肺炎链球菌疫苗、脊髓灰质炎疫苗(优选灭活的脊髓灰质炎病毒疫苗)、流感疫苗、水痘疫苗、麻疹疫苗、腮腺炎疫苗和/或风疹疫苗基本上相同的时间施用。这些任选地共同施用的疫苗中的每一种可以是单价疫苗,或可以是组合疫苗的一部分(例如作为mmr疫苗的一部分)。
[0380]
在一个实施方式中,相比于二剂量计划表,组合物的三剂量计划表在较大百分比的人中诱导针对多种菌株的杀菌滴度,所述菌株表达与第一和/或第二多肽异源的lp2086(fhbp)。
[0381]
在一个实施方式中,所述方法包括向人施用组合物的三次剂量。在另一实施方式中,所述方法包括施用组合物的至多三次剂量。在一个实施方式中,三次剂量在第一剂量约6个月后的期间内施用。在一个实施方式中,所述方法包括向第三剂量后的人施用加强剂量。在另一实施方式中,所述方法不包括向第三剂量后的人施用加强剂量。在另一实施方式中,所述方法不进一步包括向人施用组合物的第四或加强剂量。在进一步的实施方式中,将至多三次剂量在约6个月的期间内施用于人。
[0382]
在示例性实施方式中,第二剂量在第一剂量后约30天施用,并且第三剂量在第二剂量后约150天施用,如例如在第0、1、6个月免疫接种计划表中。在另一示例性实施方式中,第二剂量在第一剂量后约60天施用,并且第三剂量在第二剂量后约120天施用,如例如在第0、2、6个月免疫接种计划表中。
[0383]
在一个实施方式中,将第一剂量、第二剂量和第三剂量在约150、160、170或180天以及至多240、210、200或190天的期间内施用于人。任何最小值可以与本文描述的任何最大值组合以定义范围。优选地,将第一剂量、第二剂量和第三剂量在约180天或6个月的期间内施用于人。例如可以将第二剂量施用于第一剂量后约60天的人,并且可以将第三剂量施用于第二剂量后约120天的人。因此,示例性的施用计划表包括在约第0、2和6个月向人施用剂量。
[0384]
如上文所描述,可以将免疫原性组合物的多次剂量施用于人,并且在各剂量之间的天数可以变化。所述方法的优势包括例如人遵从施用计划表的灵活性。
[0385]
在一个实施方式中,所述方法包括向人施用同一免疫原性组合物的至多三次剂量。例如在优选的实施方式中,所述方法不包括向人施用第一组合物的第一剂量、向人施用第二组合物的第二剂量以及向人施用第三组合物的第三剂量,其中第一、第二和第三组合物不完全相同。在另一实施方式中,所述方法包括向人施用同一免疫原性组合物的至多四次剂量。
实施例
[0386]
以下实施例说明了本公开的实施方式。除非本文另外注明,否则在120-μg二价rlp2086剂量水平下,以下实施例中所提及的mnb二价rlp2086组合物(其为组合物的优选示例性实施方式)包括:每0.5ml剂量60μg的第一脂化多肽(其包括seq id no:1中所示的氨基酸序列)、每0.5ml剂量60μg的第二脂化多肽(其包括seq id no:2中所示的氨基酸序列)、与第一多肽的摩尔比为2.8的聚山梨醇酯80、与第二多肽的摩尔比为2.8的聚山梨醇酯80、0.5mg al
3+
/ml组合物、10mm组氨酸和150mm氯化钠。
[0387]
更具体地,在120-μg二价rlp2086的剂量水平下,所调查的二价重组rlp2086疫苗包括:(a)60μg的第一脂化多肽,其包括seq id no:no:1中所示的氨基酸序列;(b)60μg的第二脂化多肽,其包括seq id no:2中所示的氨基酸序列;(c)18μg聚山梨醇酯-80;(d)250μg铝;(e)780μg组氨酸,以及;(f)4380μg氯化钠。每一剂量为0.5ml。
[0388]
除非本文另外注明,否则以下实施例中提及的menacwy-tt组合物(其为四价脑膜炎球菌多糖缀合组合物的优选示例性实施方式)包括各自与作为载体蛋白的破伤风类毒素耦合的脑膜炎奈瑟氏菌荚膜多糖a、c、w-135和y。脑膜炎奈瑟氏菌血清组a和c多糖与己二酰肼(ah)间隔子缀合,并且与破伤风类毒素间接缀合,而w-135和y多糖与破伤风类毒素直接缀合。组合物不含任何防腐剂或佐剂。
[0389]
更具体地,以下实施例中所描述的冻干menacwy-tt组合物每剂量(0.5ml)包括5微克的与破伤风类毒素载体蛋白缀合的脑膜炎奈瑟氏菌血清组a多糖;5微克的与破伤风类毒素载体蛋白缀合的脑膜炎奈瑟氏菌血清组c多糖;5微克的与破伤风类毒素载体蛋白缀合的脑膜炎奈瑟氏菌血清组w-135多糖;5微克的与破伤风类毒素载体蛋白缀合的脑膜炎奈瑟氏菌血清组y多糖;28mg蔗糖;97μg氨丁三醇。
[0390]
实施例1:menabcwy组合物
[0391]
通过用0.67ml的mnb二价rlp2086药物产品(描述在下文实施例3中)将冻干menacwy-tt药物产品(描述在下文实施例2中)小瓶重构来制备最终menabcwy组合物,以便抽取menabcwy疫苗的0.5ml剂量以用于肌内注射。下文表1中提供了用于制备menabcwy疫苗的所有组分及其功能。
[0392]
表1
[0393]
menabcwy疫苗的组成
[0394][0395][0396]amenabcwy疫苗中的氯化钠浓度可以基于临床和商用nimenrix药物产品(dp)批次的组成在160.5-161.1mm之间变化。
[0397]
menabcwy是一种由以下各项组成的组合产品:含单剂量冻干menacwy-tt的2ml 1型玻璃小瓶、含有用于重构的mnb二价rlp2086悬浮液的无刻度1ml i型玻璃标准预填充注射器(pfs)、以及13mm小瓶适配器。
[0398]
冻干menacwy-tt药物产品通过将提供的小瓶适配器固定到冻干小瓶并将mnb二价rlp2086 pfs附接到小瓶适配器来重构。该过程旨在促进将mnb悬浮液从pfs无菌递送到小瓶中,并且随后将重构疫苗从小瓶转移到pfs中以进行施用。重构后,将小瓶的内容物通过小瓶适配器抽取到同一注射器中。将小瓶适配器从注射器拆下,并且将注射针固定到pfs以进行肌内(im)注射。mnb二价rlp2086 pfs被设计成具有比trumenba更大的填充体积(~0.67ml,与目前的0.57ml完全不同),以确保可以递送最终疫苗(menabcwy)的目标剂量体积(0.5ml)。
[0399]
最终疫苗组合物包括:以120μg/ml/亚族配制的rlp2086亚族a和b蛋白;含脑膜炎奈瑟氏菌血清组a、c、w和y的纯化的荚膜多糖的10mm组氨酸,所述纯化的荚膜多糖具有10μg/ml/型的浓度,分别以~1:3、~1:3、~1:1.5、~1:1.3的比率与破伤风类毒素缀合;1.2mm tris缓冲液;160.5
–
161.1mm氯化钠;0.5mg/ml的呈磷酸铝(alpo4)形式的铝;1.35mg/ml聚山梨醇酯80;以及56mg/ml蔗糖
[0400]
实施例2:mnb二价rlp2086药物产品的描述和组成
[0401]
mnb二价rlp2086药物产品是一种无菌液体配制剂,其由以下各项构成:以120μg/ml/亚族配制在10mm组氨酸缓冲液中的rlp2086亚族a和b蛋白、150mm氯化钠(nacl)(ph 6.0)以及0.5mg/ml的呈磷酸铝(alpo4)形式的铝。将聚山梨醇酯80(ps-80)添加到药物物质中,以获得ps-80与蛋白质的目标摩尔比。因此,在药物产品配制期间不添加ps-80,但其以相同比率存在于最终药物产品中。将药物产品填充到1ml注射器中。疫苗的单剂量为0.5ml,不含防腐剂。
[0402]
表2 mnb二价rlp2086药物产品的组成
[0403]
成分数量/剂量mnb rlp2086亚族a(seq id no:1)120μg/mlmnb rlp2086亚族b(seq id no:2)120μg/ml氯化钠150mml-组氨酸10mm磷酸铝0.50mg磷酸铝/ml注射用水qs至1ml
[0404]a聚山梨醇酯80(ps-80)是药物物质的一部分。ps-80在药物产品中作为表面活性剂发挥作用。
[0405]b相当于每剂量0.25mg铝
[0406]
聚山梨醇酯80浓度的影响
[0407]
聚山梨醇酯80(ps-80)是非离子表面活性剂。其用于通过防止可能由温度、过滤器、管路、容器/闭合接触和过程混合引起的聚集和吸附来使配制剂中的mnb rlp2086亚族a和b蛋白稳定和溶解。使用基于体外单克隆抗体的效力测定的稳定性研究证明,在最终配制剂中在ps-80与mnb rlp2086蛋白的摩尔比较高时亚族b蛋白不稳定。用不同的ps-80与蛋白质摩尔比进行的实验已证明,ps-80与mnb rlp2086蛋白的最佳摩尔比大约在1.4至4.2之间以保持效力。
[0408]
实施例3:menacwy-tt组合物的描述和组成
[0409]
menacwy-tt药物产品由脑膜炎奈瑟氏菌血清组a、c、w和y的纯化的多糖构成,所述纯化的多糖各自分别以~3、~3、~1.5和~1.3的破伤风类毒素(tt)与多糖比率与破伤风类毒素(tt)缀合。
[0410]
menacwy-tt药物产品以冻干粉末的形式存在,提供在3ml玻璃小瓶中,所述玻璃小瓶具有适用于冻干的溴化丁基橡胶闭合件以及铝制翻转关闭式(flip-off)盖。表3中提供了用于制造menacwy-tt药物产品的所有组分及其功能。
[0411]
表3 menacwy-tt药物产品的组成
[0412][0413]a冻干饼中也含有从存在于各种大块状纯化tt缀合物中的盐产生的氯化钠。氯化钠浓度基于临床和商用批次的组成在10.5-11.1mm之间变化。
[0414]
实施例4:menabcwy组合物的制备
[0415]
在临床使用中,最终menabcwy组合物通过用0.67ml的mnb二价rlp2086将冻干menacwy-tt药物产品小瓶重构来制备。所得menabcwy组合物(疫苗液体药物产品)含有:120mcg/ml/亚族的rlp2086亚族a和b蛋白;含脑膜炎奈瑟氏菌血清组a、c、w和y的纯化的荚膜多糖的10mm组氨酸,所述纯化的荚膜多糖具有10μg/ml/型的浓度,分别以~3、~3、~1.5和~3的比率与破伤风类毒素缀合;以及1.6mm tris缓冲液,所述缓冲液含有160.5至161.1mm氯化钠、0.5mg/ml的呈磷酸铝(alpo4)形式的铝、0.035mg/ml聚山梨醇酯80和56mg/ml的蔗糖,ph为6.05以用于肌内注射。
[0416]
menabcwy疫苗通过将二种药物产品menacwy-tt和mnb二价rlp2086混合来制备。缓冲组分和赋形剂基于各组分的个别发展来选择,并且被示出成提供用于延长的保存期限所需的稳定性。
[0417]
进行用量验证研究以证明,当menacwy-tt药物产品和mnb二价rlp2086药物产品被混合在一起以用于施用menabcwy疫苗时二者是相容的,并且所有药物产品和给药溶液均与施用组分相容,并且所述给药溶液在施用组分中可稳定一段足够的时间以进行剂量制备和施用操作。通过用0.67ml的mnb二价rlp2086药物产品重构menacwy-tt药物产品所制备的menabcwy疫苗在环境温度和光照条件下的在保持时间内的稳定性在重构小瓶和给药注射器中被确认。
[0418]
使用如以下稳定性指示方法测试代表menabcwy疫苗的给药溶液的样品:用于抗原结合和纯度的rp-hplc、bioplex活性分析、elisa以及具有预定验收标准的icp-ms。该研究的结果示出,menabcwy疫苗在室温和光照条件下在24小内具有可接受的稳定性。
[0419]
实施例5:menabcwy疫苗的评价
[0420]
进行研究以评估当用mnb二价rlp2086组合物重构冻干menacwy-tt组合物时是否具有可接受的物理相容性和短期稳定性。将冻干menacwy-tt组合物和液体mnb二价rlp2086组合物组合并在未经控制的室温环境中储存长达24小时以接近现实生活条件。已证明,冻干menacwy-tt组合物可以用液体mnb二价rlp2086组合物通过轻轻的手动混合来重构,并且组合的ph和渗透压在可注射物的典型范围内。在未经控制的室温环境中长达24小时后,缀合物和蛋白质的所有关键属性与对照相似。
[0421]
通过评价组合药物产品的ph、外观、重构容易性和渗透压来评价物理相容性。抗原的稳定性通过elisa,通过评估rlp2086亚族a和亚族b蛋白的浓度、纯度和体外相对抗原性(ivra)以及缀合的脑膜炎球菌a、c、y和w-135多糖的浓度来评价。
[0422]
实施例5至实施例15证明,冻干menacwy-tt组合物和液体mnb二价rlp2086组合物的组合(即,menabcwy组合物)被发现是相容的并且可在室温下稳定至少24小时。
[0423]
用于确定menabcwy组合物中的mening a、c、y和w-135多糖浓度的elisa—mening a、c、y和w-135elisa的开发和用于检测的pab的筛选
[0424]
选择六种用于筛选的抗体以用于elisa测定。用men a、c、y或w-135多糖tt缀合物免疫接种四组十只兔子中的每一只,在开发出抗体后随后将兔子放血。使用与载体蛋白crm
197
缀合的men a、c、y或w-135多糖个别筛选每只兔子的结合和特异性。筛选兔子血清的阳性结合信号,所述阳性结合信号相当于大于背景吸光度三倍以上的吸光度读数。另外,筛选低非特异性结合(其为高于空白样吸光度读数的任何无抗原、次级或检测血清组合的吸光度读数)以及低交叉反应性(其为高于背景吸光度的任何异源血清组吸光度读数)的兔子
血清。汇集满足筛选标准的兔子。标准曲线范围使用crm缀合物来建立,并且用重构的所述冻干menacwy-tt组合物来确认。标准曲线范围使用crm缀合物来建立,并且用重构的冻干menacwy-tt组合物来确认。
[0425]
建立对组合药物产品(menabcwy组合物)中的a、c、y和w缀合物进行定量的可行性。确定在测定中未检测到单独的mnb二价rlp2086组合物。另外,当menabcwy组合物样品中的磷酸铝被溶解时,实现缀合物的完全回收。因此,确定mnb二价rlp2086组合物不会干扰通过elisa定量menacwy-tt缀合物。
[0426]
实施例6:评价用于在menacwy-tt组合物的存在下评估mnb二价rlp2086组合物的方法的适合性
[0427]
对用于在menacwy-tt组合物的存在下确定mnb二价rlp2086组合物亚族a和b蛋白的强度的iex-hplc的适合性进行评价。对在存在menacwy-tt组合物和不存在menacwy-tt组合物的情况下mnb二价rlp2086组合物的总蛋白和结合蛋白结果进行评估。
[0428]
表4
[0429][0430]
实施例7:在menacwy-tt组合物的存在下评价mnb二价rlp2086组合物纯度和峰值比率
[0431]
对用于在menacwy-tt组合物的存在下确定mnb二价rlp2086组合物的纯度的rp-hplc的适合性进行评价。对在存在menacwy-tt组合物和不存在menacwy-tt组合物的情况下mnb二价rlp2086组合物的纯度结果进行比较。重叠的色谱图示出在美国专利10,183,070的图2中。杂质峰的积分的实施例以插入的形式示出在美国专利10,183,070的图2中。评价结果示出,menacwy-tt组合物的存在不会干扰使用rp-hplc方法评价mnb二价rlp2086组合物纯度。
[0432]
实施例8:在menacwy-tt组合物的存在下评价mnb二价rlp2086组合物ivra
[0433]
对用于在menacwy-tt的存在下确定mnb二价rlp2086组合物亚族a(seqid no:1)和亚族b(seq id no:2)蛋白的体外相对抗原性的ivra方法的适合性进行评价。
[0434]
对在存在和不存在menacwy-tt组合物的情况下mnb二价rlp2086组合物亚族a和亚族b蛋白的ivra结果进行比较。可行性评价结果示出,在测定变异性内结果相当,并且menacwy-tt组合物的存不会干扰体外相对抗原性的测定。
[0435]
实施例9:用mnb二价rlp2086组合物重构menacwy-tt组合物小瓶
[0436]
menacwy-tt组合物和mnb二价rlp2086组合物药物产品使用用mnb二价rlp2086组合物重构的menacwy-tt组合物小瓶来实施。取决于所述方法,使用用生理盐水或menacwy-tt组合物基质安慰剂重构的menacwy-tt组合物小瓶来作为对照组。
[0437]
表5
[0438][0439][0440]
确定menacwy-tt组合物的生理盐水重构体积
[0441]
商用产品包装含有小瓶和注射器二者,所述小瓶含有冻干menacwy-tt组合物,并且所述注射器含有用于重构的0.9%生理盐水。为了在用mnb二价rlp2086组合物重构时重现商用疫苗中的最终浓度,必须确定使用来自所述商用产品的注射器所分配的生理盐水量。然后,该相同体积的mnb二价rlp2086组合物将会用于所有重构研究。
[0442]
用mnb二价rlp2086组合物重构menacwy-tt组合物小瓶
[0443]
将mnb二价rlp2086组合物汇集在10ml玻璃小瓶中。将大约800μl的溶液抽取到1ml注射器中。将经调整的注射器内容物注入到含有menacwy-tt组合物的小瓶中。旋转小瓶以溶解内容物。
[0444]
在menabcwy组合物的一式二份的样品上确定ph和外观。在用生理盐水重构的menacwy-tt组合物上以及在用mnb二价rlp2086组合物重构的menacwy-tt组合物上以一式三份测量渗透压。
[0445]
实施例10:用于评价dp基质中mening a、c、y和w-135多糖的稳定性的sec-malls。
[0446]
使用mening a、c、y和w-135多糖作为替代物以评估组合药物产品(menabcwy组合物)中缀合的脑膜炎奈瑟氏菌a、c、y和w-135多糖是否可预期有任何不稳定性。
[0447]
mening a、c、y和w-135多糖的处理
[0448]
试剂制备(“全menabcwy组合物缓冲基质”)
[0449]
将2.24g的蔗糖和7.8mg的tris(氨丁三醇(tromethamine))添加到20ml的具有mnb rlp2086蛋白(组氨酸20mm ph 6.0、nacl 300mm、ps 80 0.07mg/ml、alpo4 1mg/ml(8mm)、各自为240μg/ml的rlp2086亚族a蛋白(seq id no:1)和亚族b(seq id no:2)蛋白)的2x mnb二价rlp2086组合物缓冲液基质中。
[0450]
样品制备
[0451]
将每种mening多糖用全menabcwy组合物缓冲液基质1:1稀释,并且在5℃、25℃和37℃下孵育0、6和24小时。孵育后,将样品悬浮液以14,000rpm旋转1分钟。通过sec-malls分析上清液。
[0452]
实施例11:menabcwy组合物的稳定性—评价组合的mnb二价rlp2086和menacwy-tt组合物的ph、外观和渗透压
[0453]
在重构后立即对组合的mnb二价rlp2086组合物和menacwy-tt组合物(即menabcwy组合物)的ph和外观进行评价,并且在24小时后再次进行评价。
[0454]
所有结果均与预期的一样(表6)。
[0455]
表6
[0456]
menabcwy组合物的外观和ph
[0457]
样品#样品时间点,小时外观ph1menabcwy组合物,rep10均匀的白色悬浮液5.82menabcwy组合物,rep20均匀的白色悬浮液5.83menabcwy组合物,rep 124均匀的白色悬浮液5.84menabcwy组合物,rep 224均匀的白色悬浮液5.85menacwy-tt组合物w/含生理盐水0透明,无色6.36menacwy-tt组合物w/含生理盐水24透明,无色6.4
[0458]
用mnb二价rlp2086组合物重构的menacwy-tt组合物的平均渗透压在用生理盐水重构的menacwy-tt组合物的平均渗透压的3%以内。
[0459]
表7
[0460][0461]
实施例12:组合药物产品中的mening a、c、y和w-135多糖缀合物浓度
[0462]
对menabcwy组合物中mening a、c、y和w-135-tt缀合物的浓度进行初始评估,并且在24小时后再次进行评估。四种缀合物的浓度在二十四小时内是稳定的(表8)。
[0463]
表8
[0464]
通过elisa评价menabcwy组合物中mna、c、y和w缀合物的短期稳定性结果
[0465][0466]
实施例13:评价menabcwy组合物中mnb二价rlp2086蛋白的稳定性
[0467]
组合药物产品中的总体和结合rlp2086亚族a(seq id no:1)和亚族b(seq id no:2)蛋白浓度
[0468]
通过iex-hplc分析menabcwy组合物样品以确定蛋白质浓度。如表9所示,mnb二价rlp2086亚族a(seq id no:1)和亚族b(seq id no:2)蛋白(与铝结合)二者的总蛋白、结合蛋白(与铝结合)以及结合%在24小时内没有改变,这指示rlp2086亚族a和亚族b蛋白在二十四小时内是稳定的。
[0469]
表9
[0470]
总蛋白和结合蛋白稳定性
[0471][0472]
实施例14:组合的menabcwy组合物中的rlp2086蛋白纯度和峰值比率
[0473]
通过rp-hplc分析menabcwy组合物样品以确定rlp2086蛋白的纯度和峰值比率。参见美国专利10,183,070的图3。11.9分钟处的峰值被排除在纯度计算之外。
[0474]
组合药物产品中的rlp2086亚族a和亚族b蛋白ivra
[0475]
混合后对menabcwy组合物样品的ivra进行评价长达24小时。确定menabcwy组合物中rlp2086亚族a(seq id no:1)和亚族b(seq id no:2)蛋白的相对抗原性在二十四小时时间期间内是稳定的。
[0476]
实施例15:通过sec-mals评价全menabcwy组合物缓冲液基质中mening a、c、y和w-135多糖的稳定性
[0477]
在各种温度下孵育6和24小时后通过sec-malls评价全menabcwy组合物缓冲液基质中mening a ps的稳定性
[0478]
将mening a、c、w和y多糖与全menabcwy组合物缓冲液基质混合,并且在5℃、25℃和37℃下孵育长达24小时后通过sec-mals评价稳定性。所有四种多糖在5℃和25℃下长达24小时似乎是稳定的。在37℃下可观察到mening a和y有一些降解。由于mening y多糖在除初始之外的所有测试条件下均形成高mw聚集物,因此无法确定其降解度。
[0479]
表10
[0480][0481]
实施例16:在cba/j小鼠中评估mn五价疫苗和疫苗的脑膜炎奈瑟氏菌血清组b免疫原性
[0482]
在cba/j小鼠中评价用二价mnb fhbp疫苗、trumenba或与四价acwy多糖缀合物疫苗一起配制的二价mnb fhbp疫苗(mn五价abcwy)进行接种后对脑膜炎奈瑟氏菌血清组bfhbp的免疫应答。用以下3种不同疫苗接种成组的cba/j小鼠:五价(abcyw)、(mnb)和(acyw)(表11)。
[0483]
表11
[0484]
研究设计:每种疫苗的剂量水平
[0485]
剂量水平,g/0.25ml剂量
[0486][0487]
对于每一治疗臂,使用各自疫苗的2倍稀释剂量水平(表11)在颈部的颈背中经皮下对cba/j小鼠(25只/组)进行免疫接种。在时间0用疫苗使小鼠接触抗原,并且在第2周用疫苗加强。在第3周pd2收集血清以用于使用二种不同的利用人补体进行的测定(hsba)进行的测试。一种hsba使用fhbp亚族a表达菌株(m98250771),并且另一种使用fhbp亚族b表达菌株(cdc1127)。
[0488]
hsba测量针对脑膜炎奈瑟氏菌血清组b菌株的抗体依赖的、补体介导的杀菌活性。简而言之,将适当稀释的测试血清在96孔微量滴定测定盘中与新制备的脑膜炎奈瑟氏菌b菌株(亚族a或b)的细菌培养物和人补体混合。将测定盘放置在轨道式振动器(orbital shaker)上并在加湿孵育器(37℃/5%co2)中混合30分钟。随后,将来自各个孔的测定反应物的等分试样转移到96孔过滤盘以计算存活细菌。
[0489]
以各给药组(n=25)中在hsba中应答的小鼠的百分比计算出对接种的应答率。当
以预定的稀释水平测试时,杀死≥50%的t
30
对照脑膜炎球菌的小鼠血清样品被视为应答者。t
30
对照孔含有细菌和补体但无测试血清,并且在30分钟测定孵育结束时进行计数。
[0490]
表12和表11
[0491]
表13示出由或mn五价诱导的对脑膜炎奈瑟氏菌血清型b菌株的亚族a和亚族b二者的剂量依赖性应答率相当。如所预期的,nimenrixtm不会诱导对mn b菌株的功能性免疫应答。
[0492]
表12
[0493]
亚族a hsba应答(%应答者)
[0494][0495]a参见表11中的对应剂量水平
[0496]
表13
[0497]
亚族b hsba应答(%应答者)
[0498][0499][0500]a参见表11中的对应剂量水平
[0501]
实施例16:描述含二价rlp2086的五价疫苗(menabcwy)在≥10至《26岁的健康受试者中的免疫原性、安全性和耐受性的研究(b1971057)
[0502]
b1971057是一项2期概念验证(poc)研究,其用于评估penta在≥10至《26岁的健康受试者中的安全性和免疫原性。该研究于2017年4月启动,大约530名受试者接受了penta。
[0503]
脑膜炎球菌疫苗已获得免疫学替代物许可,所述免疫学替代物即为使用人补体进行的血清杀菌测定(hsba),所述测定证明免疫血清能够杀死代表疫苗中所包括的血清组的脑膜炎球菌菌株。对于menacwy应答,在hsba中对来自每种血清组的一种菌株进行评价,并且将penta应答与许可的acwy疫苗menveo进行比较。对于menb评价;对也在trumenba许可研究期间使用的4种血清组b菌株进行测试。
[0504]
研究数据示出,对于acwy评价,penta在1次接种后不劣于menveo,并且对于b评价,penta在2次接种后不次于trumenba。
[0505]
临床研究性penta疫苗
[0506]
对于该研究,临床研究性产品是二价rlp2086(trumenba)、(penta;描述在上文实施例1和实施例4中)、menacwy-crm(menveo)和安慰剂。
[0507]
研究设计
[0508]
b1971057是一项3期、随机、主动对照、观察者不知情的多中心试验,其中大约1590
名受试者被随机分配成接受penta和安慰剂(生理盐水)或trumenba(pfizer)和menveo(gsk)。所有受试者在入组前均未接种过任何脑膜炎球菌群b疫苗。随机化按照先前的接种史分层;~50%未接种过acwy的受试者以及~50%接种过acwy的受试者(在随机化日期之前≥4年接受过含有1或更多个acwy组的疫苗的1次先前剂量)。该接种过acwy的组被包括在内,因为在美国,86%的青少年在大约11岁时接受acwy疫苗的剂量,并且应该在16岁时接受加强剂量。随机化还按照地理区域分层。大约80%的受试者来自美国调查网站,并且大约20%的受试者来自欧洲。区域分层确保足够的群体代表性。该研究分2个阶段进行。阶段1现已完成,包含初级系列的接种时期。阶段1的求诊计划表见下文表14。阶段2将评价免疫的持久性,并且在完成penta的初级系列后大约4年施用加强剂量。
[0509]
表14
[0510]
b1971057阶段1研究设计
[0511][0512][0513]
为了评估免疫应答,在hsba中用脑膜炎球菌群a、b、c、w和y菌株分析功能性抗体。hsba测量人血清中的抗体,所述抗体导致目标脑膜炎球菌菌株的补体依赖性杀伤。为了评估对trumenba和penta的b组分的免疫应答,在hsba中使用4种主要mnb测试菌株(pmb80(a22)、pmb2001(a56)、pmb2948(b24)和pmb2707(b44))来确定该研究中的免疫原性终点。为了评估对menveo和penta的acwy组分的免疫应答,在测试开始之前,在hsba中鉴定了对每个acwy组具有特异性的测试菌株并使其具备资格。用于评价menb的经过验证的测定与用于许可trumenba的测定相同。
[0514]
目的
[0515]
该研究被设计成描述penta的安全性、耐受性和免疫原性,并且描述在施用penta或trumenba和menveo(美国许可的脑膜炎球菌群a、c、w-135和y缀合物疫苗)后对群a、b、c、w和y的免疫应答。nimenrix不用作acwy比较器;它没有在美国获得许可。
[0516]
与1次剂量后观察到的trumenba+menveo的hsba gmt相比,penta的menawy组分的免疫原性基于单剂量后penta的hsba几何平均滴度(gmt)。
[0517]
除将要接受第二menacwy加强剂量的个体(接种过acwy的个体)之外,本发明人还对之前未接受过menacwy疫苗的剂量的个体(未接种过acwy的个体)进行了该评估。对于未接种过acwy的个体,需要满足penta的menacwy组分的poc标准。
[0518]
penta的menb组分的免疫原性标准基于根据第0、6个月计划表施用penta的2次剂量后实现4倍增长和复合hsba应答的点估计值,其预测满足针对第0、6个月计划表建立的3期lci标准。
[0519]
该研究的次要终点包括标准非劣性评价,即2次gmt的比率具有2.0倍裕度和penta b组分的响应者百分比。响应者百分比分析通过将响应者定义为在初级menb菌株的接种2后1个月在hsba滴度和复合响应方面实现实现≥4倍增长,然后计算penta与trumenba之间的差异来进行。获得成功需要不超过10%的差异。
[0520]
对penta的免疫应答以及poc免疫原性结果
[0521]
关于针对在penta与menveo之间的menacwy的杀菌应答,研究b1971057如下示出:在单剂量后,与menveo相比,对于接受penta的受试者,观察到acwy组分的相似hsba gmt。在未接种过acwy的受试者中实现了1.5倍的gmt比率非劣性(ni)裕度(表15),并且在接种过acwy的受试者(表16)中实现了2.0倍的gmt比率ni裕度。
[0522]
表15
[0523]
在未接种过acwy的受试者中,在单剂量后,与menveo相比,penta acwy hsba gmt在1.5倍的gmr ni内
[0524][0525][0526]
对于mena,penta对menveo的poc gmr点估计值》0.612;对于menc,》0.67;对于menw,》0.635;并且对于meny,》0.626。所有这些均实现了。
[0527]
在未接种过acwy的受试者中,在1.5倍的gmr裕度下,确认penta不劣于menveo,因为所有血清组的gmr lci均》0.67
[0528]
对于血清组c、w和y,penta在统计学上大于menveo
[0529]
表16
[0530]
在接种过acwy的受试者中,在单剂量后,与menveo相比,penta acwy hsba gmt在1.5倍的gmr ni内
[0531][0532]
在该研究中,在2.0倍的gmr裕度下,确认penta不劣于menveo,因为在具有acwy背景的受试者中,所有血清组的gmr lci均》0.5
[0533]
trumenba是基于抗体滴度实现4倍增长(和复合应答)的受试者的比例达到预先指定的下限95%置信区间(lci)阈值而获得许可的。当对4倍抗体应答进行评估时,它们可能会受到群体中背景滴度的影响,所述背景滴度可能会独立影响对疫苗具有4倍应答的受试者的比例。另外,所使用的hsba测定由生物组分构成,所述生物组分即使受到严格控制,也可能会影响研究之间的绝对应答标准。考虑到许可lci阈值是基于在不同群体中实现的点估计值并使用不同的补体源计算出的,本发明人还将penta血清组b的应答与来自trumenba+menveo臂的应答进行比较。结果提供在表17中。
[0534]
表17
[0535]
剂量2后1个月所有年龄(10至《26)实现4倍增长和复合应答。
[0536][0537]
b24数据待定
[0538]
对于4种血清组b测试菌株中的三种,sba增长4倍,并且复合应答大大超过预先指
定的点估计值。对于一种菌株pmb80(a22),与78.1%的poc标准pe相比,75.8%的受试者的滴度实现4倍增长(对于trumenba组,点估计值(pe)为73.8);然而,如上文所陈述,在不同的群体中,95%lci标准更难以控制,并且随着时间的推移更是如此。用于为该poc研究创建lci的2期研究招募了欧洲人群体,其中a22的基线hsba率为22.1%。由于penta的pe高于trumenba,因此这表明没有penta的menb组分的免疫干扰。为了证实这一点,次要终点分析示出在2项非劣性分析中trumenba+menveo不劣于penta。实际上,它们满足严格的1.5gmr非劣性裕度(表18)以及在5%裕度下的应答者百分比分析(表19)。
[0539]
表18
[0540]
剂量2后1个月与trumenba相比的penta的gmt和gmt比率。
[0541][0542]
在该研究中,对于a22、a56和b44,在1.5倍的gmr裕度下,确认penta不劣于trumenba,因为gmr lci为》0.67。无干扰
[0543]
表19
[0544]
实现4倍响应的响应者的差异(%)
[0545][0546]
在该研究中,对于a22、a56和b44,在5%裕度下,确认penta不劣于trumenba。
[0547]
trumenba与penta之间没有干扰
[0548]
实施例17:以脑膜炎奈瑟氏菌血清组a、b、c、w和y为目标的五价疫苗对美国的潜在
公共卫生影响
[0549]
目的:为了评价在五价疫苗的接种时间表和依从率的各种假设下美国群体中imd病例进一步减少的可能性。
[0550]
接种方案
[0551]
对四种主要接种方案进行分析,并且将其与根据目前的建议和依从性水平避免的估计病例进行比较(图1)
[0552]
1.在16岁时用penta代替menacwy/menb疫苗,并且在11岁时保留menacwy
[0553]
2.在11岁和16岁时用penta代替menacwy/menb疫苗
[0554]
3.在16岁时用penta代替menacwy/menb疫苗,并且在11岁时不接种menacwy
[0555]
4.在11岁时用penta的2次剂量代替menacwy,并且在16岁时用penta的1次剂量代替menacwy/menb
[0556]
改变每个计划表的疫苗覆盖范围,以估计不同建议对imd减少的总体水平的影响疾病减少估计值基于2018年发布的美国青少年免疫接种覆盖率估计值
[0557]
——86.6%接受≥menacwy的1次剂量
[0558]
——68.1%的青少年接受≥hpv的1次剂量
[0559]
——50.8%接受≥menacwy的2次剂量
[0560]
——17.2%接受≥menb的1次剂量
[0561]
——假设在16岁时2剂量系列中第2剂量的覆盖范围为第1剂量3的覆盖范围的50%,并且假设在11岁时为70%。
[0562]
结果
[0563]
根据目前的覆盖率水平以及总计需要4次注射的接种计划,与完全不接种的假设相比,估计menacwy和menb疫苗在10年内可避免178例imd病例。
[0564]
用penta代替menacwy或/和menb疫苗可消除至少1次注射;假设16岁时的免疫接种覆盖率与目前的menacwy疫苗覆盖范围相似,则估计penta疫苗可避免相似或更高数目的imd病例(图3)。
[0565]
与覆盖率相当的其它接种计划表相比,11岁时penta的两次剂量和16岁时penta的1次剂量(方案10-12)可以预防大多数病例(高达282例)。
[0566]
11岁时penta的一次剂量和16岁时penta的2次剂量(方案4-6)可以预防高达251例病例。
[0567]
由于在16岁时penta的第2剂量的覆盖率略高于目前的menb覆盖率,因此11岁时menacwy疫苗的一次剂量和16岁时penta的2次剂量(方案3)或16岁时penta的2次剂量(方案8,参见图1)可以预防相似数目的imd病例。
[0568]
结论
[0569]
接种策略的疾病影响与获得的覆盖率水平直接相关。
[0570]
用penta代替一次或多次menacwy或menb疫苗剂量可以进一步减少由所有5种脑膜炎球菌血清组引起的imd;
[0571]
减少青少年的疫苗施用次数;
[0572]
潜在地提高对acip建议的依从性,减少就医次数和对个别imd病例的公共卫生应答的成本。
[0573]
由脑膜炎奈瑟氏菌引起的侵袭性脑膜炎球菌病(imd)是一种罕见、进展迅速且可能致命的感染,并且观察到在婴儿和青少年年龄组中的发病率最高。血清组a、b、c、w和y占全球疾病的94%;在美国,大多数疾病是由血清组b、c和y引起的。根据美国2018年的监测数据,imd的发病率为每100,000人0.10个病例。血清组b在美国青少年和年轻成人中占主导地位(在16至23岁中,占病例的62%),并且在所有年龄组中也占主导地位(占病例的36%)。
[0574]
美国免疫实践咨询委员会(advisory committee on immunization practices,acip)目前推荐2种类型的脑膜炎球菌疫苗,以帮助保护健康青少年抵抗imd。四价脑膜炎球菌血清组a、c、w和y(menacwy)疫苗通常被推荐为11至12岁时的主要剂量和16岁时的加强剂量。基于共享的临床决策,建议年龄为16至23岁(优选16至18岁)的青少年和年轻成人接种b型脑膜炎球菌血清组(menb)。2018年,估计年龄为13至17岁的青少年的menacwy接种覆盖范围在≥1次剂量的情况下为86.6%,并且在≥2次剂量的情况下为50.8%。相比之下,仅17.2%的17岁青少年接受了≥menb疫苗的1次剂量,并且这些个体中只有不到50%的个体完成了多剂量接种系列。这些数据表明,美国的许多青少年没有得到充分的抵抗脑膜炎球菌疾病的保护。
[0575]
可以帮助预防由所有5种血清组引起的脑膜炎球菌疾病的单一疫苗(即menabcwy五价疫苗),而不是具有不同接种计划表的2种单独的menb和menacwy疫苗,可以简化免疫接种,减少所要求的注射次数,并且有可能提高接种覆盖率。本发明人开发了一种模型以评价使用五价menabcwy疫苗进行的各种脑膜炎球菌免疫接种程序对公共卫生的影响。
[0576]
2.0方法
[0577]
2.1模型描述
[0578]
开发了一种基于群体的动态模型以估计美国10年期间内避免的imd病例的预期数目。模型结构与之前已在别处完整描述过的结构相似。将群体分层为101个单年年龄段,并且每个年龄段的个体在次年过渡到下一个年龄段。脑膜炎球菌携带是感染性疾病传播的主要来源,并且也是模型计算中的主要考虑因素。通过将群体分层为10个互相排斥的年龄组(0-5个月、6-12个月、1岁、2-4岁、5-9岁、10-14岁、15-19岁、20-24岁、25-59岁和≥60岁)来使脑膜炎球菌携带和传播模型化。每个年龄组由一定比例的个体来表征,所述个体是脑膜炎球菌血清组a、b、c、w和y的携带者,并且具有以下年龄别可能性:发生imd以及将细菌在其年龄组内传播或传播到其它年龄组。每年10个年龄组中的每一组中的脑膜炎球菌携带者的比例是基于以下各项计算出的:(1)之前年的携带普遍性;(2)年龄组内和年龄组之间的细菌传播和混合模式;(3)已接种的个体的数目(接种覆盖率);以及(4)针对携带获取的疫苗功效。在模型内的10年时间范围中的每一年期间,估计目标年龄组中的个体的比例以在4种不同的计划安排方案下接受menacwy、menb和/或menabcwy疫苗。对于所有接种方案,模型估计,发生imd的个体会在有或没有并发症的情况下康复,或者死亡。
[0579]
2.2模型输入
[0580]
每种血清组的基于年龄组的平均imd发病率是从centers for disease control and prevention(cdc)2015-2017年增强版脑膜炎球菌疾病监测报告中获得的。假设menabcwy疫苗提供针对血清组a、b、c、w和y的直接保护。
[0581]
在接受menabcwy疫苗的1次剂量或2次剂量的青少年中,针对血清组b的疫苗功效假设基于已发布的menb fhbp疫苗(二价rlp2086;pfizer inc,philadelphia,
pa)临床研究。在该研究中,在menb-fhbp的1次剂量或2次剂量后,在接种后1个月,在使用人补体进行的测定(hsba)(滴度≥1:8(保护的标准相关度为≥1:4))中,具有血清杀菌活性的受试者的百分比的范围分别为23.8%至67.6%和69.1%至100%。基于这些数据,对于接受menabcwy疫苗的1次剂量或2次剂量的青少年,假设针对血清组b的疫苗功效的估计值分别为30%和85%。
[0582]
针对血清组a、c、w和y的疫苗功效假设基于对已发布的来自menacwy-tt疫苗(pfizer ltd,sandwich,uk)临床研究的免疫原性和功效数据的综述,其中在menb-fhbp的1次剂量后,在接种后1个月,在使用兔补体进行的测定(rsba)或hsba(滴度≥1:8)中,具有血清杀菌活性的受试者的百分比的范围为81.9%至97.4%。基于这些数据,假设针对血清组a、c、w和y的疫苗功效的估计值为95%。
[0583]
对于血清组b,假设由于减少普遍性和传播而导致的对未接种个体的间接保护为0%,并且对于血清组a、c、w和y,假设为36.2%,二者均是从已发布的关于menb和menawy疫苗的文献中获得的。
[0584]
所示的针对血清组b的menabcwy疫苗的5年保护期限和固定的10%年衰减率是基于以下考虑而假设的:(1)先前公布的健康经济模型;以及(2)来自在青少年中进行的3期扩展研究的临床数据,所述研究评价由menb-fhbp疫苗引发的免疫应答的持久性。来自临床研究的结果指示,初次接种后应答率达到峰值,在随后的12个月内下降,然后在48个月内稳定保持在基线以上。对于用于评估保护广度的4种不同血清组b测试菌株,在初次接种后48个月,18.0%至61.3%的受试者的hsba滴度大于或等于定量下限(即1:16或1:8,取决于菌株)。
[0585]
对于评估针对a、c、w和y血清组的menabcwy疫苗(表2)的保护,5年的直接保护期限和10%的年衰减率是基于临床研究数据的保守假设,所述研究评价由menabwy tt在年龄为11至55岁的青少年和成年人中引发的免疫应答在初次接种后10年内的持久性。对于a、c、w和y血清组,在第10年,70.2%至90.7%的已接种受试者的rsba滴度≥1:8,相比之下,在接种后1个月时为99.7%至100%。目前没有关于许可menacwy疫苗的间接保护期限和衰减率的可用数据;因此,模型假设menacwy的衰减率等于menabcwy的衰减率。
[0586]
2.3疫苗接种方案和灵敏度分析
[0587]
接种方案是基于美国现有的青少年脑膜炎球菌接种平台(即,在11岁和16岁时接种)构建的。对以下四种主要接种计划表进行检查,并且将这些计划表与目前的计划表进行比较:(1)在11岁时接种menacwy疫苗的1次剂量,并且在16岁时接种menabcwy疫苗的2次剂量;(2)在11岁时接种menabcwy疫苗的1次剂量,并且在16岁时接种menabcwy疫苗的2次剂量;(3)仅在16岁时接种menabcwy疫苗的2次剂量;以及(4)在11岁时接种menabcwy疫苗的2次剂量,并且在16岁时接种1次剂量。
[0588]
每种主要接种计划表的接种覆盖率假设来自观察到的青少年接种覆盖率、接种年龄和所要求的剂量次数,如2018national immunization survey-teen(nis-teen)中所报告的。与nis-teen调查中所观察到的趋势一致,假设年龄为11岁的青少年的接种覆盖率高于16岁时的接种覆盖率,并且假设11岁时对2剂量系列的依从性(即,完成所建议的剂量系列)高于16岁时对2剂量系列的依从性。
[0589]
对于基础病例分析,假设11岁时第一剂量的接种覆盖率与2018年报告的menacwy
疫苗第一剂量的总体覆盖率(86.6%)相同,并且假设16岁时第一剂量的接种覆盖率与menacwy加强剂量的覆盖率(50.8%)相同。基于这些数据假设接受menabcwy第一剂量的11岁青少年中有80%将完成2剂量系列,然而基于menb疫苗系列完成的可用信息假设在16岁时对2剂量系列的依从性为50%。使用2018年报告的16岁青少年疫苗覆盖率水平对4种脑膜炎球菌施用计划表中的每一种进行灵敏度分析。假设的最高覆盖率与11-12岁时≥人乳头瘤病毒(hpv)疫苗的1次剂量的覆盖率(68.1%)相同,并且假设的最低覆盖率与16岁时≥menb疫苗的1次剂量的覆盖率(17.2%)相同。在对主要给药计划表和接种覆盖率估计值进行考虑之后,对总计13种不同的方案进行评估。
[0590]
3.0结果
[0591]
与未接种脑膜炎球菌疫苗(目前的方案)相比,根据目前的接种计划表和2018年报告的接种覆盖率(menawy,11岁时为86.6%,并且16岁为50.8%;menb,16岁时为17.2%),在11岁至16岁之间,接种menawy和menb疫苗中的每一种的2次剂量,总计4次注射,在未来10年内可能潜在地避免165例imd病例。在该方案下,估计在未来10年内将预防19例血清组b病例(占可预防imd病例总数的11.5%)。取决于接种计划表,用五价menabcwy疫苗代替menacwy和/或menb疫苗将消除1或2次注射,并且潜在地避免更高数目的imd病例(方案1、2、4、5、7、8、10和11)。这是假设16岁时的menabcwy接种覆盖率与2018年menabwy接种覆盖率(50.8%;方案1、4、7和10)相似,或者可能上升到11至12岁时观察到的略高的hpv接种覆盖率(68.1%;方案2、5、8和11)。
[0592]
然而,假设16岁时的menabcwy接种覆盖率与目前的16岁时2剂量menb接种计划表的覆盖率(17.2%)相同,则与目前的接种计划表(图2,方案6)相比,11岁时1次剂量和16岁时2次剂量(即,与目前的计划表相似)的menabcwy计划将预防更少的imd病例(n=137)。这些结果主要是由于以下假设所致的:与目前16岁时报告的相比,menacwy接种覆盖率较低,导致与目前的计划表相比,所避免的血清组a、c、w和y病例的估计数目(n=89;65.0%)较低。
[0593]
3.1基础病例接种覆盖率假设
[0594]
在所有基础病例接种方案(方案1、4、7和10)中,假设
[0595]
menabcwy接种覆盖率与目前的11岁时(86.6%)或16岁时(50.8%)menacwy疫苗的覆盖率相同,则用五价menabcwy疫苗代替menacwy和/或menb疫苗将比目前的计划表避免更多的imd病例(范围,避免189-256例imd病例,取决于计划表)。与目前的接种计划表相比,被避免的imd病例的总数目较高,这主要是由于被预防的血清组b病例的数目(范围,55-111例血清组b病例)较多所致的。在评估的所有基础病例接种方案中,通过在11岁时施用menabcwy疫苗的2次剂量并在16岁时施用1次剂量,可以最大限度地预防疾病(方案10;避免256例病例[111例血清组b病例;146例血清组a、c、w和y病例])。
[0596]
3.2基于替代的接种覆盖率的灵敏度分析
[0597]
如果16岁时的menabcwy接种覆盖率上升到观察到的11至12岁时hpv疫苗的水平(68.1%),则11岁menabcwy疫苗的2次剂量和16岁时1次剂量(方案11;避免299例总病例)对脑膜炎球菌病预防的影响最大。该计划表还将在10年期间内预防占可预防病例总数的最大数目和百分比的血清组b病例(避免140例血清组b病例[46.8%])。次佳计划是在11岁时接种menabcwy疫苗的1次剂量并在16岁时接种menabcwy疫苗的2次剂量(方案5;避免263例病
例;103例血清组b病例;159例血清组a、c、w和y病例)。另外,无论是否包括目前推荐的11岁时menacwy剂量,都将避免相似数目的病例(方案2[避免234例;74例血清组b病例;159例血清组a、c、w和y病例]和方案8[避免220病例;74例血清组b病例;146例血清组a、c、w和y病例])。相比之下,其中假设menabcwy接种覆盖率与目前的16岁时2剂量接种计划表的覆盖率(≥1次剂量为17.2%)相同的计划将导致被预防的估计imd病例少得多,这主要是由于被避免的血清组b病例(方案3、6、9和12)较少所致。在该接种覆盖率假设下,在16岁时接种2次menabcwy疫苗的计划将导致被预防的imd病例的总数目最少(方案9,总计避免93例病例[19例血清组b病例;74例血清组a、c、w和y病例])。
[0598]
4.0讨论
[0599]
这是本发明人所知的第一项研究,所述研究在美国青少年脑膜炎球菌免疫平台的背景下,使五价menabcwy疫苗对预防由5种最普遍的致病血清组(即,血清组a、b、c、w和y)引起的脑膜炎球菌疾病的影响模型化。全球地,以这5种血清组的不同组合为目标的各种单价、二价或四价脑膜炎球菌疫苗配制剂用于帮助预防脑膜炎球菌疾病。在若干国家,正在进行的监测工作已经检测到引起传播性疾病的脑膜炎球菌血清组的变化;这些流行病学转变促使一些全国接种策略发生变化,以包扩menacwy疫苗以用于全面预防imd。部署menabcwy疫苗可能会预防全球94%的估计由这5种血清组引起的imd病例。
[0600]
在美国,自2005年开始推荐青少年接种menacwy,并且于2015年实施menb接种建议。单一五价menabcwy疫苗可以通过消除在不同年龄使用2种不同疫苗进行多次注射的需要来简化免疫接种计划表,从而潜在地提高接种覆盖率并增强针对大多数普遍的致病血清组的保护。根据美国目前的menacwy和menb疫苗的时间表和接种覆盖率,本发明人的模型估计,与未接种相比,接种menacwy和menb疫苗二者可以在10年内潜在地避免165例imd病例。假设menabcwy接种覆盖率与目前的由2018年cdc nis-teen调查指出的menacwy接种覆盖率相似,则本发明人的模型估计,用menabcwy疫苗代替一次或多次menacwy或menb疫苗剂量将导致在美国青少年中多达256例imd病例被避免,同时减少疫苗注射的建议次数。事实上,该研究中所检查的大多数方案都证明,与目前的计划表相比,单一menabcwy疫苗在避免更多数目的病例方面具有额外的益处。
[0601]
青少年免疫接种具有挑战性,部分原因在于预防性良好求诊率(在通常发生免疫接种时)在16岁后稳步下降,并且当与从儿科医生到通常较少参与青少年免疫接种的医疗提供者的转变组合时,可能导致在该年龄组中针对疾病的保护为次优。基于年龄的menabcwy接种平台将通过在青少年更有可能接受和依从多剂量计划并减少注射和求诊次数的年龄进行疫苗施用来支持和促进青少年免疫接种。重要地,用menacwy缀合物疫苗和重组蛋白menb疫苗对青少年进行免疫接种,都会在初次接种后引发保护性免疫应答,并且在加强剂量后引发强健的应答。总之,这些数据不仅支持现有的美国青少年menacwy和menb免疫接种平台,而且支持灵活的menabcwy接种计划表,其中青少年可以在11至16岁之间的任何时间处开始接种系列,并且在整个最高风险期间保持保护。
[0602]
研究示出,社会经济地位、教育和种族也在接种意识、获取和利用以及系列完成率方面发挥作用。因此,menabcwy疫苗可以通过简化脑膜炎球菌接种建议来帮助缩小这些差异,从而减少疫苗获取问题,并且消除围绕现有menb和menacwy疫苗建议的混淆。此外,组合疫苗总体上已被示出成提高各种年龄组的接种覆盖率。
[0603]
实施例18:人对trumenba的免疫应答的广度:由在hsba中敏感的menb菌株表达的fhbp变体的总结
[0604]
引言和目的:trumenba(二价rlp2086)是一种用于预防脑膜炎奈瑟氏菌血清组b(menb)疾病的疫苗,包括两种蛋白抗原,即脑膜炎球菌因子h结合蛋白(fhbp)的变体。fhbp以两个亚族(a和b)的形式存在。在每个亚族内,已鉴定出数百个独特的fhbp变体。尽管存在这种序列多样性,但含有来自每个亚族的一种蛋白质的疫苗被证明可以诱导广泛的覆盖率以覆盖代表fhbp变体多样性的menb菌株。许可基于疫苗在使用人补体进行的血清杀菌测定(hsba)中引发抗体的能力,所述抗体启动补体介导的对侵入性menb菌株的杀伤。由于脑膜炎球菌疾病的地方性,因此无法预测个体可能暴露于哪些fhbp变体。出于该原因,本发明人继续探索由trumenba赋予的覆盖率,并且在此提供额外的证据以说明免疫覆盖率的广度。
[0605]
材料和方法选择menb侵入性菌株(n=109)以确认trumenba的覆盖率广度。所述菌株分别编码22和16种独特的亚族a和亚族b fhbp变体。使用流式细胞术脑膜炎球菌抗原表面表达(meningococcal antigen surface expression,measure)测定来确定fhbp在细菌表面处的表达。使用来自年轻成人的接种前后的血清(受试者匹配)来进行探索性hsba。如果在接种前和后的血清样品之间实现hsba滴度4倍增长,则认为菌株对trumenba免疫血清敏感。
[0606]
结果:109种菌株中有87种(接近80%)在hsba中对trumenba免疫血清敏感。除先前报告的变体之外,这还包括表达fhbp变体a02、a28、a42、a63、a76、b05、b07、b08、b13、b52和b107的菌株。大多数不能被杀死的菌株的fhbp表达水平低于被认为足以在hsba中启动杀菌杀死的水平。参见图3、表1、表2和表3。
[0607]
表20
[0608][0609][0610]
表21
[0611]
由在hsba中被trumenba免疫血清杀死的menb菌株表达的fhbp变体(与a05(seq id no:1)和b01(seq id no:2)的氨基酸序列同一性%)
[0612]
亚族a亚族b
a02(94.3)b02(92.0)a04(96.6)b03(90.8)a05(疫苗抗原)b05(87.7)a06(96.2)b07(87.3)a07(85.4)b08(87.7)a12(85.4)b09(88.1)a15(85.1)b107(89.7)a17(88.1)b13(86.9)a19(88.1)b15(86.5)a22(88.9)b16(86.2)a26(85.8)b24(86.2)a28(96.9)b44(91.6)a42(91.6)b52(91.9)a56(98.1) a63(96.6) a76(95.0) [0613]
表22
[0614]
由在《1000mfi下的且在hsba中未被trumenba免疫血清杀死的菌株表达的fhbp变体
*
(与疫苗抗原a05(seq id no:1)和b01(seq id no:2)的氨基酸序列同一性百分比%)
[0615][0616][0617]
结论:hsba被认为是脑膜炎球菌疫苗功效的替代物。测定复杂性阻止了trumenba免疫血清针对表达数百种独特的fhbp序列变体中的每一种的menb菌株的杀菌活性的证明。为了说明由trumenba赋予的免疫覆盖率的广度,本发明人示出,尽管表达额外不同fhbp变体的menb菌株与疫苗抗原异源,但可能会在hsba中被杀死。
[0618]
实施例19:选择不同的菌株以评估二价fhbp脑膜炎球菌b疫苗的广泛覆盖率
[0619]
尽管脑膜炎奈瑟氏菌的传播通常导致上呼吸道的无症状定植,但在一些个体中,会发生菌血症(bacteremia)和侵袭性脑膜炎球菌疾病(imd)。imd通常表现为脑膜炎(meningitis)和/或败血症(septicemia);很少观察到肺炎(pneumonia)、化脓性关节炎(septic arthritis)、会厌炎(epiglottitis)和中耳炎(otitis media)。高病死率与imd相关联(10%
–
15%),大约20%的幸存者具有严重的终生后遗症,如截肢、听力损失和神经功能缺损。
[0620]
全球几乎所有的脑膜炎球菌疾病都是由12种特征化脑膜炎球菌血清组中的6种(即,a、b、c、w、x和y)引起的。已经针对血清组a、c、w和y开发了基于荚膜多糖的有效疫苗。然而,由于与存在于人神经元细胞上的聚唾液酸结构相似,因此menb多糖的免疫原性很差。近年来,脑膜炎球菌血清组b(menb)尤其与欧洲、美国、加拿大、澳大利亚和新西兰的大部分
imd相关联。尽管基于外膜囊泡(omv)的疫苗已成功用于控制由单一menb爆发菌株引起的流行病,但生成的免疫应答主要针对高度可变的孔蛋白a蛋白(pora)。因此,有效性通常限于目标菌株。因此,一直在寻找能够诱导针对各种menb菌株的保护性杀菌抗体的表面暴露蛋白,以开发广泛有效的menb疫苗。
[0621]
因子h结合蛋白(fhbp;也被称为lp2086和gna1870)是一种在几乎所有menb菌株上表达的保守的表面暴露脂蛋白,被鉴定为此种目标。基于氨基酸序列,fhbp变体分为2个免疫学上不同的亚族(被称为亚族a和亚科b);每种menb菌株都表达单一亚族变体(参见图1a)。
[0622]
menb-fhbp(二价rlp2086;pfizer inc,philadelphia,pa,usa)是一种二价重组蛋白menb疫苗,其由等量的2种重组脂化fhbp抗原构成,其中一种来自亚族a(变体a05),并且另一种来自亚族b(变体b01)。重要地,据预测,该fhbp变体组合能够提供针对各种menb菌株的保护。menb-fhbp已在包括美国、加拿大、欧洲和澳大利亚在内的若干国家和地区被批准用于预防imd。另一menb疫苗menb-4c(4cmenb;glaxosmithkline vaccines,srl,siena,italy)也具有重组fhbp组分(来自亚族b的脂化变体1.1)以及2种其它重组蛋白抗原和omv。因此,menb-4c与menb-fhbp不同,后者含有单一抗原的两种变体以提供广泛的覆盖率。
[0623]
使用人补体进行的血清杀菌测定(hsba)测量脑膜炎球菌细菌的补体依赖的、抗体介导的裂解。hsba滴度被定义为杀死≥50%测定细菌的最高血清稀释度;hsba滴度≥1:4是公认的预防脑膜炎球菌疾病的相关度,并且基于该相关度的hsba应答率已被用作脑膜炎球菌疫苗功效的替代物。sba应答率与血清组c和a多糖疫苗的自然保护特别相关。因为血清组特异性多糖是不可变的,所以来自每种血清组的单一菌株足以推断出广泛的疫苗覆盖率。menb omv疫苗也是有效的,并且疫苗引发的hsba滴度与针对引起流行病的目标菌株的保护相关。考虑到不同脑膜炎球菌疾病菌株之间的蛋白质序列多样性和表达水平变异性有所不同,使用hsba准确预测基于蛋白质的疫苗的菌株覆盖率比以荚膜多糖为目标的疫苗更复杂。例如(pora是omv疫苗免疫接种后赋予保护的血清杀菌抗体的主要目标。pora是一种细胞表面孔蛋白,其小细胞表面暴露区域具有高度的序列多样性。据估计,保护性免疫力需要用表达20种不同pora血清亚型的菌株来证明,以预防美国约80%的散发性menb致病菌株。历史上地,omv疫苗已含有1种pora,并且没有展现针对具有pora序列的菌株保护,与疫苗抗原相比,所述菌株在氨基酸序列上是异源的。因此,选择代表性测试菌株以证明,疫苗引发的抗体可以有效地抵抗脑膜炎球菌疾病菌株,其对于基于蛋白质的疫苗是至关重要的。
[0624]
在临床前和早期临床研究中,由menb-fhbp引发的免疫血清展现出广泛的杀菌抗体,所述抗体可以杀死各种含有与疫苗fhbp变体a05和b01异源的fhbp亚族a和b变体的menb菌株。在对menb-fhbp覆盖率的潜在广度的早期评估中,使用menb-fhbp免疫兔血清在hsba中对100种具有不同的fhbp变体、地理起源和遗传背景的menb分离株进行测试。所测试的100种菌株中有87种在这些hsba中被杀死。对未被杀死的13种菌株的分析表明,给定menb菌株上的阈值fhbp表面表达水平会影响hsba应答。随后确定阈值fhbp表面表达水平,高于该水平的分离株在hsba中可预测地被杀死。对确定菌株敏感性的潜在因素的额外研究发现,杀伤在很大程度上不依赖于fhbp序列变体、多位点序列类型或pora亚型。
[0625]
为了选择具有广泛抗原性和流行病学多样性的菌株以用于临床测试,从美国和欧
洲的实验室和卫生机构收集了1200多种侵袭性menb疾病分离株,以代表收集时同时期的menb分离株的普遍性;所有菌株均含有fhbp基因。使用无偏方法来选择4种抗原性上和流行病学上不同的代表性测试菌株以用于menb-fhbp免疫原性研究。选择标准包括:与疫苗抗原异源且充分反映menb疾病分离株中fhbp的多样性的fhbp变体的表达、低至中等fhbp表面表达水平以及低基线hsba血清反应阳性率。这4种主要menb测试菌株表达来自两种fhbp亚族的fhbp变体(菌株[变体]:pmb2001[a22]、pmb80[a56]、pmb2707[b24]和pmb2948[b44];参见图1a)。
[0626]
为了补充使用4种主要menb测试菌株生成的免疫原性数据,并且为了证明针对4种主要menb测试菌株的免疫应答可预测针对由menb致病分离株表达的fhbp变体的多样性的免疫应答,开发了使用10种额外的测试菌株进行的hsba。选择10种额外的测试菌株,以包括在美国和欧洲的menb致病菌株中发现的普遍的fhbp变体。在此,本发明人(i)描述了用于选择10种额外测试菌株的策略和标准,并且(ii)提供了数据,所述数据证明使用4种主要menb菌株通过hsba测量的免疫应答可预测使用10种额外测试菌株获得的应答,这进一步证明并支持由b-fhbp引发的免疫应答的广泛覆盖率。
[0627]
结果
[0628]
额外menb测试菌株的来源和选择标准
[0629]
10种额外menb测试菌株中有九种是从1263种侵入性致病menb菌株的集合(menb分离株集合)中获得的。对于menb分离株集合,美国菌株来自active bacterial core surveillance站点(2000-2005),覆盖大约13%的群体。欧洲分离株(2001-2006)来自挪威、法国、捷克共和国的公共卫生实验室和曼彻斯特的health protection agency(其覆盖英格兰、威尔士和北爱尔兰),并且被系统地收集(根据在国家参考实验室接到的命令,将每第七或第八个分离株都包括在内),并且在此期间代表大约13%的侵入性menb分离株。表达fhbp变体a07的菌株是从menb分离株集合的扩展中获得的,所述扩展包括来自西班牙和德国的额外551种致病menb菌株(n=1814)。扩展的menb分离株集合用作menb分离株集合中的表达a07的菌株不适合,因为这些菌株上的fhbp的表面表达低,基线血清反应阳性高,并且缺乏现成的补体来源。
[0630]
用于选择额外menb测试菌株的标准是(i)美国和/或欧洲menb致病菌株的fhbp变体普遍性,(ii)fhbp变体需要与由menb主要测试菌株表达的变体不同,(iii)体外fhbp表达水平等于或低于相应fhbp变体组的中值水平以确保菌株代表其所属的变体组,(iv)hsba中的技术相容性,以及(v)正在考虑变体组的主要克隆复合物(如果存在主要复合物的话)。满足这些标准的菌株还需要在hsba中是技术上相容的,包括足够可用的合适人补体批次(fig2)。随机选择每个fhbp变体组中表达水平低于截止水平(即,等于或低于相应fhbp变体组的中值水平)的菌株,其中fhbp变体组内满足所要求的遗传、表型和hsba开发标准的第一菌株成为额外的menb测试菌株。该方法的例外是表达fhbp变体b03的菌株,所述菌株是基于之前在2期研究中的使用情况,与美国fda合作并使用其提供的指南选择的。
[0631]
额外menb测试菌株的特征
[0632]
10种额外选择的menb测试菌株表达fhbp变体a06、a07、a12、a15、a19、a29、b03、b09、b15和b16,这些变体与4种主要测试菌株中的变体(a22、a56、b24、b44)不同,并且与疫苗抗原相比具有不同的序列(表23)。由4种主要测试菌株表达的特异性变体以42.0%(530/
1263)的致病分离株形式存在于menb分离株集合中,并且由10种额外测试菌株表达的特异性变体以额外非重叠38.8%(490/1263)的致病分离株形式存在于menb分离株集合中(图1b)。
[0633]
表23
[0634]
4种主要和10种额外menb测试菌株的特征
[0635][0636][0637]
fhbp=因子h结合蛋白;menb=脑膜炎奈瑟氏菌血清组b;mfi=平均荧光强度;sba=血清杀菌测定。
[0638]amfi
±
1sd来自measure测定。
[0639]b基于menb sba分离株集合(n=1263),除变体组a07之外,所述变体组是从扩展的menb sba分离株集合(n=1814)中计算出的。随机选择每个fhbp变体组中表达水平等于或低于相应fhbp变体组的中值水平的菌株。每个fhbp变体组所采用的截止水平是观察到的中
值mfi加1个sd,使用25.2%%相对sd的精确估计。
[0640]c只有一种菌株表达a56;因此,不包括sd值。
[0641]
免疫原性分析:10种额外菌株的hsba滴度≥lloq的受试者
[0642]
4种主要菌株用于评估参与2项在青少年和年轻成人中进行的关键3期研究的受试者在menb-fhbp的2或3次剂量后的血清学应答。在研究受试者的亚组中评估对额外10种hsba菌株的血清学应答。大多数受试者在用于主要(分别为64.0%
–
99.1%和87.1%
–
99.5%)和10种额外menb测试菌株(分别为51.6%
–
100.0%和71.3%
–
99.3%)中的每一种的剂量2后1个月和剂量3后1个月具有hsba≥定量下限(lloq;即hsba滴度等于1:8或1:16,取决于菌株)(表24)。对于主要和额外menb测试菌株,在第二menb-fhbp剂量后的menb-fhbp受者(第0、2、6个月计划表)中,观察到实现hsba滴度≥lloq的受试者的比例从基线大幅增加,在第三剂量后也有额外的增加。
[0643]
表24
[0644]
主要和额外menb测试菌株的hsba滴度≥lloq(1:8或1:16)的受试者
[0645]
[0646][0647]
fhbp=因子h结合蛋白;hsba=使用人补体进行的血清杀菌测定;lloq=定量下限;menb=脑膜炎奈瑟氏菌血清组b。
[0648]
使用clopper-pearson方法,用精确2侧化95%ci总结观察到的受试者比例。
[0649]
对于a06、a12、a19和a22,lloq=1:16;对于a07、a15、a29、a56、b03、b09、b15、b16、b24和b44,lloq=1:8。
[0650]a可评价的免疫原性群体
[0651]
主要和额外菌株的阳性预测值
[0652]
对主要menb测试菌株和额外10种menb测试菌株的疫苗诱导hsba应答之间的关系进行评估(表25)。在fhbp亚族内,在剂量3后1个月,大多数主要/额外菌株对的阳性预测值(ppv)大于80%。因此,使用主要测试菌株在hsba中测量的免疫应答高度地预测同一亚族内额外菌株的免疫应答。在整个研究中,对于亚族a和b菌株对,剂量2后1个月的ppv通常略低于剂量3后1个月观察到的ppv,并且范围分别为61.6%至100%和70.0%至100%。总之,在将主要和额外菌株hsba应答进行比较时,所有ppv都示出保护性应答的高度可预测性。
[0653]
表25
[0654]
menb-fhbp接种后对主要菌株的免疫应答和对额外菌株的免疫应答的阳性预测值
[0655]
[0656][0657]
hsba=使用人补体进行的血清杀菌测定;lloq=定量下限;menb=脑膜炎奈瑟氏菌血清组b。
[0658]
对于表达变体a07、a15、a29、a56、b03、b09、b15、b16、b24和b44的菌株,lloq=1:8;对于表达变体a06、a12、a19和a22的菌株,lloq=1:16。
[0659]a基于使用clopper-pearson方法观察到的受试者比例的精确2侧化ci。
[0660]bn=主要和额外菌株二者的测定结果有效且确定的受试者的数目,所述受试者在接种2后1个月和接种3后1个月观察到主要菌株的hsba滴度≥lloq;n=在接种2后1个月和接种3后1个月观察到给定额外菌株的hsba滴度≥lloq的受试者的数目。
[0661]
讨论
[0662]
临床评价menb-fhbp疫苗以确定保护广度的关键组成部分是开发使用具有表面蛋白抗原的测试菌株进行的hsba,所述抗原的序列和表达变异性代表收集时同时期的menb致病菌株的多样性。如在青少年和年轻成人中进行的3期研究中所描述的,4种主要menb测试菌株的hsba应答数据强烈表明二价menb-fhbp疫苗提供了广泛的覆盖率以覆盖各种致病脑膜炎球菌菌株,所有4种主要menb测试菌株都表达与疫苗抗原异源的fhbp变体。在此描述的10种额外menb测试菌株为menb-fhbp提供了支持性免疫学数据,并且进一步证实了使用4种主要测试菌株测量对menb-fhbp的免疫应答的有效性。由于针对4种主要测试菌株获得的应答可预测针对额外10种测试菌株获得的应答,因此通过在hsba中评估主要菌株获得的免疫学应答代表了引起侵袭性menb疾病的菌株的多样性。
[0663]
对于menb-fhbp许可研究中假设测试驱动的免疫原性评价,使用无偏方法来从美国和欧洲收集的致病menb的组中选择4种主要menb测试菌株。使用相似的方法来选择10种额外menb hsba测试菌株,同时考虑特定的选择标准以确保测试菌株代表menb分离株的抗原多样性。
[0664]
共同地,14种menb测试菌株代表了大多数普遍的脑膜炎球菌fhbp,其中fhbp变体对应于大约80%的美国和欧洲传播侵袭性致病分离株。
[0665]
阳性预测值分析用于确定表达同一亚家族内的fhbp的主要和额外测试菌株的免疫应答的关联,所述免疫应答通过hsba测量。所有ppv分析都示出了针对主要菌株的保护性应答和针对额外菌株观察到的保护性应答的高度可预测性。这些ppv分析指示,针对4种主要menb测试菌株观察到的应答代表对其它致病menb菌株的应答,所述其它致病menb菌株表达与疫苗抗原变体不同的额外序列多样化fhbp变体。
[0666]
使用来自各个疫苗受者的血清评估menb-fhbp引发的对4种主要和10种额外menb测试菌株的应答,所述应答通过hsba测量。通过确定具有功能性杀菌抗体的已接种受试者的比例,确定了在个体水平上对menb-fhbp覆盖率广度的评估,而这在使用混合血清法时是不可能的。选择4种主要menb测试菌株来代表menb致病imd的多样性,从而使用hsba支持menb-fhbp的潜在覆盖率广度。hsba滴度≥1:4的个体的应答是公认的保护相关度和脑膜炎球菌疫苗功效的替代物。因此,应答提供了对疫苗覆盖率广度的全面和生物学预测评估。hsba应答与4种主要menb测试菌株的相关性描述疫苗覆盖率的广度,通过证明menb-fhbp的保护性杀菌应答得到了支持,所述反应保护性杀菌应答也是针对来自欧洲和美国的各种和同时期menb爆发菌株以及针对非menb致病菌株(即脑膜炎球菌血清组c、y、w和x)观察到的。
[0667]
另一方法(即,基于酶联免疫吸附测定的脑膜炎球菌抗原分型系统(mats))已用于预测menb-4c的疫苗覆盖率。然而,mats只能预测对menb-4c具有特异性的抗原的覆盖率,而不能用于评估具有不同抗原组分的其它疫苗的覆盖率。具体而言,mats测量抗原表达而不是杀菌活性,并且报告为与每种抗原的参考菌株相比的相对效力。如果任何一种组分抗原的相对效力与menb-4c免疫血清的杀菌活性相称(即达到阳性杀菌阈值),则认为菌株对杀伤敏感。然而,由于来自已接种个体的血清不用于mats,因此测定无法响应于免疫接种预测实现hsba滴度≥1:4(即保护相关度)的群体的比例。
[0668]
值得注意的是,进行hsba存在局限性。例如hsba是劳动密集型的,并且可能需要大量的血清和与测定相容的补体,特别在要评估大量菌株和/或血清时更是如此。另外,hsba中所使用的测定试剂和菌株的性能的实验室间差异限制了应答的比较和疫苗覆盖率广度的评估。ppv分析的已知局限性是应答量级对普遍性的依赖性(即,在该背景下,实现额外菌株的hsba≥lloq的受试者的比例)。然而,在该分析中值得注意的是,尽管存在对额外菌株的一系列接种后应答(在剂量2后和剂量3后1个月),但ppv均较高。
[0669]
综合而言,从10种额外menb hsba测试菌株获得的免疫原性数据支持从4种主要menb hsba测试菌株获得的应答数据,并且证实了由menb-fhbp赋予的menb分离株的广泛覆盖率。这是第一项使用关于疫苗抗原序列和表达的menb菌株流行病学、结合认可的保护替代物(hsba)对menb疫苗引发的免疫应答进行严格评估的工作,并且使用这一知识获得了疫苗许可。
[0670]
方法
[0671]
fhbp表面表达的定量
[0672]
对于所有菌株,fhbp表面表达通过measure测定来定量,所述measure测定是一种使用单克隆抗体(mn86-994-11)识别两种fhbp亚族共有的保守fhbp表位进行的流式细胞术测定。measure测定的细节先前已经进行过描述。每个fhbp变体组所采用的截止水平是观察到的中值平均荧光强度加1个标准偏差,使用25.2%%相对标准偏差的精确估计。
[0673]
免疫原性分析
[0674]
在hsba中使用10种额外menb测试菌株中的每一种来测试来自参与menb-fhbp的2项关键3期研究的受试者的血清。将每项研究的共计900名受试者分为3个亚组(每个亚组n=300);将10种额外测试菌株分配到这些亚组中,使得2个亚组各自包括3种测试菌株,并且1个亚组包括4种测试菌株。亚组包括来自300名受试者的样品,以确保将从每项研究中获得≥150个可评价hsba结果。使用3期临床研究血清通过hsba测量的免疫应答基于测定lloq,其为等于1:8或1:16的hsba滴度,这取决于菌株。
[0675]
阳性预测值分析
[0676]
fhbp亚族内每个主要/额外菌株对的ppv被定义为主要菌株应答者(主要菌株的hsba滴度≥lloq)总数目中响应额外菌株(额外菌株的hsba滴度≥lloq)的受试者的比例。ppv分析评估观察到的对4种主要菌株的hsba应答是否预测对来自同一亚族的表达fhbp的额外菌株的免疫应答。
[0677]
实施例20:在健康青少年和年轻成人的2期研究中,五价脑膜炎球菌(menabcwy)疫苗是安全的且耐受性良好的,并且其免疫原性不劣于共同施用的menb-fhbp和menacwy-crm
[0678]
背景:脑膜炎球菌血清组a、b、c、w和y引起全球几乎所有的脑膜炎球菌疾病。接种因血清组b(menb)和四价(menacwy)疫苗的不同给药建议而变得复杂,这可以通过单一五价疫苗来解决。该项在青少年和年轻成人进行的研究评价一种新的五价menabcwy疫苗,所述疫苗将2种许可疫苗menb-fhbp(二价rlp2086)和menacwy-tt组合成单一疫苗。
[0679]
方法:在该项正在进行、随机、对照、观察者不知情的多中心研究(nct03135834)中,将未接种过menb疫苗和未接种过或接种过menacwy的10-25岁健康人以1:2的比例随机组合以接种menabcwy(第0、6个月)或menb-fhbp(第0、6个月)和menacwy-crm(第0个月)。通过用人补体进行的血清杀菌活性测定(hsba)来测量免疫应答,所述测定针对血清组a、c、w和y菌株和4种不同的疫苗异源性menb菌株。终点包括实现滴度从基线增长≥4倍的受试者的百分比。在10%裕度(95%ci下限》-10%)下对免疫应答的非劣性进行先验评估。对安全性进行评估。
[0680]
结果:在剂量2后,高百分比的menabcwy(n=543)和menb-fhbp(n=1057)受者针对4种menb菌株中的每一种都实现了≥4倍增长(75.8-94.7%对67.4-95.0%),并且滴度至少为针对所有所组合的4种菌株的定量下限(79.9%对74.3%;图1a)。对于所有5个终点,menabcwy均不劣于menb-fhbp。menabcwy也不劣于单一menacwy-crm剂量,其中在剂量1或剂量2后分别有75.5-96.9%和93.0-97.4%的menabcwy受者实现针对血清组a、c、w和y≥4倍增长,这取决于先前的menacwy接种(图1b)。menabcwy或menb-fhbp后的局部反应和全身事件也同样频繁,严重程度大多为轻度/中度(图2),并且不受menacwy接种的影响。
[0681]
6.2.2.3menabcwy临床开发程序的免疫原性结果
[0682]
(研究b1971057)该部分研究是整体研究的2期组成部分。对于menabcwy的menb组分,对于pmb80(a22),在接种2后1个月,实现hsba滴度从基线增长4倍的menabcwy和二价rlp2086+menacwy-crm的受者的比例分别为75.8%和73.8%;对于pmb2001(a56),分别为94.7%和95.0%;对于pmb2948(b24),分别为76.1%和67.4%;对于pmb2707(b44),分别为91.7%和86.4%。在接种2后1个月,实现复合应答(对于所有4种menb测试菌株,hsba滴度≥lloq)的menabcwy和二价rlp2086+menacwy-crm受者的比例分别为79.9%和74.3%。
[0683]
结论:这些结果表明,menabcwy,无论是作为单剂量给予还是作为相隔6个月的2剂量系列给予,在2次剂量后针对menb和在1或2次剂量后针对menacwy提供了高度的保护性免疫,其与在分别施用二价rlp2086(第0、6个月)和menacwy-crm(第0个月)时所实现的免疫相似,与之前的acwy接种无关。menabcwy 4倍(与基线相比)免疫应答强健且不劣于分别施用的menb-fhbp和menacwy-crm。根据第0、6个月计划表的接种是安全的且耐受性良好的。有利的益处-风险概况支持menabcwy的进一步发展,以作为目前脑膜炎球菌接种实践的简化替代方案。
[0684]
从研究b1971057(menabcwy[fih])中生成的数据证明,当施用于10至25岁的健康个体时,对menabcwy的应答不劣于trumenba(脑膜炎球菌群b二价重组脂蛋白2086疫苗)(menb评价)和menveo(脑膜炎球菌(群a、c、y和w-135)寡糖crm197缀合物疫苗)(menacwycrm评价)(参见第5.2节)。在该项fih研究中观察到,menabcwy的组成部分之间没有免疫干扰。
[0685]
实施例21:运输应力对悬浮疫苗的影响
[0686]
该实施例说明了运输应力(冲击/跌落、振动、低压/高海拔和温度)对悬浮疫苗的影响。疫苗悬浮液的重新分散是重要的考虑因素。了解可能影响重新分散时间的因素以最大限度地减少最终用户的重新分散时间是关键的产品开发目标。本发明人提出了评估影响悬浮疫苗重新分散时间的参数的系统化方法和相关控制策略。
[0687]
与液体或冻干粉末相比,悬浮疫苗是热力学上不稳定的系统,其在储存和运输期间保持物理特性方面构成重大挑战。尽管运输应力可能会影响产品质量以及疫苗产品的物理特性,但该实施例重点关注运输应力对悬浮疫苗物理特性的影响。对产品质量的影响超出了范围,因为产品质量依赖于分子,并且可以通过产品特异性分析方法和生物学方法进行评估。
[0688]
七十多年以来,含铝佐剂一直被包括在疫苗中,以增强或修饰对抗原的免疫应答。含铝疫苗是一种悬浮液,其中内相由不溶性含铝盐(磷酸铝或氢氧化铝)组成,并且外相是液体载剂。向疫苗药物产品中添加不溶性佐剂会产生悬浮液,其中分散相倾向于随着时间的推移而沉降。理想地,悬浮液应该是均匀的,并且在储存期间发生的任何沉淀都可以在搅拌下很容易地重新分散。比较重新分散前后含有疫苗悬浮液的预填充注射器。通常,在将悬浮液填充到预填充注射器中并长期储存之后,重新分散问题很普遍。无数研究都重点关注添加受控絮凝剂或聚合物添加剂以形成大而松散且易于分散的沉淀物4。若干商用铝基疫苗在其包装说明书中明确指示“即将使用前剧烈摇动”。2010年4月26日,在发生白色沉淀物粘在难以或不可能重新悬浮的shan 5疫苗小瓶上的事故之后,作为预防措施,who建议召回和销毁所有批次的shan 5疫苗5。因此,应该对疫苗悬浮液的重新分散进行彻底评价,以了解影响重新分散时间的因素,并且如果需要的话,可以采取缓解对策。
[0689]
颗粒尺寸、电荷和沉降速率之间的相互影响。在本发明人寻求了解重新分散时间增加的原因时,了解影响悬浮稳定性的因素是至关重要的。在本节中,介绍了关于悬浮稳定性的考虑因素的背景以及两种悬浮液的案例研究,以了解颗粒尺寸、电荷和悬浮液沉降之间的相互影响。
[0690]
在理想的悬浮体系中,分散相悬浮较长时间,并且如果稀疏体系发生沉降,则分散体系可能容易重新悬浮或分散。悬浮稳定性可以通过热力学或动力学手段来实现。热力学稳定性方法包括在悬浮颗粒表面上赋予电荷,从而由于颗粒-颗粒排斥而诱导空间位阻,从
而导致悬浮稳定。另一方面,动力学方法包括增加悬浮液的粘度,从而减少悬浮液的沉降,并且因此提供稳定性。颗粒尺寸在热力学和动力学稳定性的这种相互影响中起着至关重要的作用。对于颗粒尺寸超过亚微米的悬浮体系,透明相与分散相之间的密度差是重要的因素,并且可能导致分散相由于重力而沉降。据报道,颗粒尺寸可能会影响悬浮体系的絮凝或凝聚。例如将peg添加到许多可注射的固体/液体悬浮液中,以允许固体活性成分颗粒形成更大的絮凝沉淀物,从而使沉淀物更容易重新悬浮。虽然超微米颗粒非常适合减缓溶解动力学,但它们受重力效应的影响要多得多,这可能导致相当致密且几乎不可重新悬浮的沉淀物。
[0691]
沉淀或沉降是浓缩悬浮液中集体相互作用的结果。集体相互作用包括流体动力学和颗粒-颗粒相互作用(通过电荷-电荷相互作用确定)。流体动力学效应解释了回流的延迟,所述回流是流体的反向流动以补偿沉降颗粒的运动。颗粒-颗粒相互作用是由于浓缩分散体中的吸引性自耗竭和排斥性结构力所导致的。
[0692]
说明了两种悬浮体系以描述电荷、沉降速率和颗粒尺寸之间的相互影响。对于该说明,该研究中的疫苗悬浮液药物产品被指定为悬浮液1和2。悬浮液1和悬浮液2描绘了类似的颗粒尺寸(大约15μm)。当比较沉降率时,这些悬浮液的表现大不相同。悬浮液1显著更快地沉降,其沉降速率为大约0.04abs/min,而悬浮液2甚至需要数周才开始沉降。尽管具有类似的颗粒尺寸分布,但这种差异是明显的。如前文所讨论的,了解颗粒表面上的电荷变得非常重要。悬浮液1的zeta电位为大约-5mv,而悬浮液2的zeta电位为-45mv。由于悬浮液1在颗粒表面上带有少量电荷,因此热力学悬浮不稳定性促进颗粒-颗粒吸引并最终促进分散相沉降。
[0693]
另一方面,悬浮液2体系的高电荷使体系变得热力学稳定,并且颗粒-颗粒排斥导致分散相沉降显著缓慢。基于此,悬浮液2赋予最大的热力学稳定性并且是所期望的。尽管最大的问题是,在分散体系稳定之后,热力学稳定的悬浮液是否更容易分散,反之亦然,但这如何转化为易于悬浮在疫苗悬浮液注射器中?本发明人的关于这两种悬浮液的数据表明,虽然悬浮液1由于缺乏电荷而在热力学上不稳定,但会导致颗粒-颗粒相互作用,并且可能形成更大的絮凝沉淀物,从而导致更快的沉淀,并且因此使分散相体系易于重新悬浮。另一方面,尽管一旦沉降,较细的颗粒会紧挤在一起而形成更难以重新悬浮的沉降分散相,但由于电荷-电荷极性,悬浮液2需要显著更长的时间才会沉降。
[0694]
基于这些观察和背景,在本发明人的研究中,对两个关键问题进行了测试以了解悬浮1疫苗重新分散时间的增加:运输应力是否会改变热力学悬浮稳定性,从而导致重新分散时间增加?运输期间各个运输应力分量的影响是什么,是否与重新分散时间增加相关?
[0695]
运输应力对热力学悬浮稳定性的影响
[0696]
在另一研究中,疫苗药物产品悬浮液经受模拟运输应力,其包括运输温度、冲击/跌落和振动。热力学悬浮稳定性通过在运输前后测量电荷(zeta电位)、颗粒尺寸分布和沉降速率来确定。
[0697]
药物产品悬浮液表现出大约-5mv的zeta电位值,这表明悬浮液颗粒上存在少量电荷。悬浮液的这种热力学不稳定性促进颗粒-颗粒吸引,并且最终促进分散相沉降。本发明人的数据表明,在注射器的模拟运输前后,zeta电位值、颗粒尺寸分布和测量的沉降速率没有明显变化。这些结果表明,运输应力不会改变药物产品悬浮液的热力学悬浮稳定性。由于
这些特性在运输后没有改变,因此可以得出结论,热力学稳定性不是观察到的重新分散时间增加的驱动因素,并且需要评价运输应力的影响并了解是否有任何特定的物理机制有助于观察到的重新分散时间。
[0698]
各个运输应力对重新分散时间的影响
[0699]
当包装件被运输时,产品将明显经受各种运输应力。这些包括当包装件从不同高度跌落时的冲击/跌落应力、卡车或飞机运输期间的振动,但飞机与卡车之间的振动频率幅度不同。当药物产品注射器经受模拟运输时,评估单个运输应力对重新分散时间的影响
11
。该研究设计还包括评估运输应力对注射器方向的影响。以三种不同的方向保持注射器:尖端帽朝下、尖端帽朝上和尖端帽水平。该研究的目的在于破译各个应力并了解其影响。
[0700]
据观察,冲击/跌落应力减少尖端帽朝下方向的重新分散时间,并且冲击/跌落对尖端帽水平方向和尖端帽朝上方向的重新分散几乎没有影响。
[0701]
另一方面,飞机振动增加了尖端帽朝下方向的重新分散时间。这是有趣的发现,并且可能与飞机运输期间遇到的振动频率有关。注射器处于尖端帽朝下方向时的振动频率可以进一步促进悬浮液的颗粒向下流向注射器孔。飞机振动对尖端帽朝上和水平布置的注射器几乎没有影响。与飞机振动相似,卡车振动增加了尖端帽朝下方向的重新分散时间。这些发现与飞机振动相似,但与飞机振动相比,重新分散时间增加的程度更大。另外,与飞机振动一致,卡车振动对尖端帽朝上和水平布置的注射器几乎没有影响。
[0702]
此外,当针对组合应力(冲击/跌落、飞机振动、卡车振动冲击/跌落)的重新分散时间对注射器进行评估时,数据令人困惑,这表明在实际运输中,很可能一种或多种运输应力模式可以主导结果,即产生完全不同的结果。
[0703]
有趣的是,注意到振动频率强度是基于飞机和卡车振动中所看到的差异的重要因素。当以尖端帽朝下方向放置注射器时,重新分散时间增加,其原因在于:悬浮颗粒的向下运动源于重力并因振动而加剧,从而促进较大颗粒紧密堆积,同时促进较小颗粒填充空隙空间。底部(尤其是注射器的孔)处的颗粒被上面的颗粒重量逐渐压在一起。
[0704]
当药物产品以尖端帽朝上方向运输时,重力效应仍然存在,但沉淀发生在柱塞的较宽表面中而不是窄孔中。物质的堆积不明显。当药物产品以尖端帽水平方向运输时,由布朗运动引起的横向运动和振动产生的对流克服重力。即使当确实发生沉淀时,沉淀也会发生在注射器壁的大表面上,几乎没有机会堆积颗粒。因此,重新悬浮对于尖端帽朝上和尖端帽水平方向都不是问题,其中尖端帽水平方向可能由于较大的表面积而产生略微更好的结果。当运输时,运输振动是导致终止状态的主导力量,在所述终止状态下沉淀被堆积。取决于注射器的方向和不同的可用表面积,重新分散时间对应于这些开放的表面积。
[0705]
减少高重新分散时间的缓解策略
[0706]
根据模拟运输研究数据,清楚的是,尖端帽水平或尖端帽朝上方向可以减少疫苗悬浮液的较高重新分散时间。
[0707]
运输温度对悬浮疫苗的影响
[0708]
除重新分散之外,疫苗悬浮液的产品质量还可能受到运输期间温度的影响。在冷冻之后,佐剂与抗原之间的结合可能会被破坏。分离出来的佐剂倾向于形成颗粒尺寸和重量会变大的团块,然后逐渐沉降到容器的底部。在反复冻融循环之后,团块的尺寸可能会增加。团块的形成影响产品的重新分散、物理和化学特性。《世卫组织疫苗国际包装和运输指
南(who guidelines on the international packaging and shipping of vaccines)》附有摇动测试流程,以确定吸附疫苗是否受到冷冻的影响。该指南还规定,如果有迹象指示在运输期间温度已降至零度以下,则对疫苗的随机样品进行摇动测试。另一方面,较高的温度也可能影响疫苗悬浮液的产品质量,导致颗粒形成和化学特性变化或二者。因此,世卫组织规定,在国际运输期间,隔热a级包装内允许的最高温度为+8℃,保持至少48小时。b级和c级包装允许的最高温度为+30℃。
[0709]
以下条款描述了本发明的额外实施方式:
[0710]
c1.一种组合物,所述组合物包含:(a)第一多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(b)第二多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(c)脑膜炎奈瑟氏菌血清组a荚膜糖缀合物;(d)脑膜炎奈瑟氏菌血清组c荚膜糖缀合物;(e)脑膜炎奈瑟氏菌血清组w荚膜糖缀合物;以及(f)脑膜炎奈瑟氏菌血清组y荚膜糖缀合物;其中所述组合物引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖中的任一种的免疫应答,其中所述血清杀菌抗体应答高于由针对脑膜炎奈瑟氏菌血清组的许可疫苗引发的血清杀菌抗体应答。
[0711]
c2.根据条款c1的方法,其中所述多肽包含与选自seq id no:1至seq id no:62的任何一个氨基酸序列具有至少70%同一性的氨基酸序列。
[0712]
c3.根据条款c1的方法,其中所述组合物包含:(a)第一多肽,其具有seq id no:1中所示的氨基酸序列。(b)第二多肽,其包含seq id no:2中所示的氨基酸序列;(c)脑膜炎奈瑟氏菌血清组a荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与己二酸二酰肼(adh)接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(d)脑膜炎奈瑟氏菌血清组c荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(e)脑膜炎奈瑟氏菌血清组w荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合;以及(f)脑膜炎奈瑟氏菌血清组y荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合,
[0713]
c4.根据条款c1至条款c3中任一项的方法,其中所述组合物引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的任一种的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
[0714]
c5.根据条款c1至条款c3中任一项的方法,其中所述组合物引发对脑膜炎奈瑟氏菌血清组a的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
[0715]
c6.根据条款c1至条款c3中任一项的方法,其中所述组合物引发对脑膜炎奈瑟氏菌血清组c的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
[0716]
c7.根据条款c1至条款c3中任一项的方法,其中所述组合物引发对脑膜炎奈瑟氏菌血清组w的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
[0717]
c8.根据条款c1至条款c3中任一项的方法,其中所述组合物引发对脑膜炎奈瑟氏菌血清组y的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组
a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
[0718]
c9.根据条款c1至条款c3中任一项的方法,其中所述组合物引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的每一种的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
[0719]
c10.根据条款c1至条款c3中任一项的方法,其中所述组合物引发对脑膜炎奈瑟氏菌血清组b的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎球菌血清组b因子h结合疫苗引发的血清杀菌抗体应答。
[0720]
c11.根据条款c1至条款c3中任一项的方法,其中所述组合物引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的每一种的免疫应答,其中所述对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖中的每一种的血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答;并且组合物引发对脑膜炎奈瑟氏菌血清组b的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎球菌血清组b因子h结合疫苗引发的血清杀菌抗体应答;其中所述许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗以及所述许可的脑膜炎球菌血清组b因子h结合疫苗是按顺序施用的,而不是以组合剂量的方式施用。
[0721]
c12.根据条款c1至条款c3中任一项的方法,其中所述组合物包含佐剂。
[0722]
c13.根据条款c1至条款c3中任一项的方法,其中所述组合物包含铝佐剂。
[0723]
c14.根据条款c1至条款c3中任一项的方法,其中所述组合物包含氢氧化铝。
[0724]
c15.根据条款c1至条款c3中任一项的方法,其中所述组合物包含磷酸铝。
[0725]
c16.根据条款c1至条款c3中任一项的方法,其中所述组合物包含铝。
[0726]
c17.根据条款c1至条款c3中任一项的方法,其中至少90%的所述第一多肽与所述组合物中的铝结合。
[0727]
c18.根据条款c1至条款c3中任一项的方法,其中至少90%的所述第二多肽与所述组合物中的铝结合。
[0728]
c19.根据条款c1至条款c3中任一项的方法,其中所述组合物被配制为无菌液体。
[0729]
c20.根据条款c1至条款c3中任一项的方法,其中所述组合物包含药物上可接受的防腐剂。
[0730]
c21.根据条款c1至条款c3中任一项的方法,其中所述组合物包含聚山梨醇酯-80。
[0731]
c22.根据条款c1至条款c3中任一项的方法,其中所述组合物包含tris-hcl;氯化钠;蔗糖;组氨酸;聚山梨醇酯80;以及磷酸铝。
[0732]
c23.根据条款c1至条款c3中任一项的方法,其中所述组合物包含约120μg/ml的所述第一多肽;约120μg/ml的所述第二多肽;约0.5mg/ml的作为磷酸铝的铝;约0.02mg聚山梨醇酯-80;约10mm组氨酸;以及约150mm氯化钠。
[0733]
c24.根据条款c1至条款c3中任一项的方法,其中所述组合物每剂量包含约60μg的所述第一多肽;约60μg的所述第二多肽;约5μg的与约7.5μg tt缀合的mena荚膜糖;约5μg的与约7.5μg tt缀合的menc荚膜糖;约5μg的与约3.75μg tt缀合的menw荚膜糖;约5μg的与约3.25μg tt缀合的meny荚膜糖;约97μg tris-hcl,ph 6.8
±
0.3;4.69-4.71mg的氯化钠;约28mg的蔗糖;约0.78mg的l-组氨酸;约0.02mg聚山梨醇酯-80;约0.25mg铝;并且进一步包含0.5ml水。
[0734]
c25.根据条款c1至条款c3中任一项的方法,其中所述免疫应答包含血清杀菌抗体。
[0735]
c26.根据条款c1至条款c3中任一项的方法,其中所述组合物能够引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的至少一种的加强免疫应答。
[0736]
c27.根据条款c1至条款c3中任一项的方法,其中所述组合物能够引发对脑膜炎奈瑟氏菌血清组b的加强免疫应答。
[0737]
c28.根据条款c1至条款c3中任一项的方法,其中所述免疫应答在10至26岁的人中引发。
[0738]
c29.根据条款c1至条款c3中任一项的方法,其中所述免疫应答在年龄为12至《18个月或者18至《24个月的人中引发。
[0739]
c30.根据条款c1至条款c3中任一项的方法,其中所述免疫应答在年龄为18至《24个月的人中引发。
[0740]
c31.根据条款c1至条款c3中任一项的方法,其中所述免疫应答在年龄为≥24个月至《10岁的人中引发。
[0741]
c32.根据条款c1至条款c3中任一项的方法,其中所述免疫应答在对脑膜炎奈瑟氏菌血清组a、c、w-135和y呈血清反应阴性的人中引发。
[0742]
c33.根据条款c1至条款c3中任一项的方法,其中所述免疫应答在对脑膜炎奈瑟氏菌血清组a、c、w-135和y呈血清反应阳性的人中引发。
[0743]
c34.根据条款c1至条款c3中任一项的方法,其中将所述组合物以至少两次剂量施用于人,其中所述第二剂量在所述第一剂量约6个月后。
[0744]
c35.根据条款c34的方法,其中所述人的年龄为至少10岁和至多17岁。
[0745]
c36.根据条款c35的方法,其中将所述组合物的第三剂量施用于人,其中所述人的年龄为至少16岁。
[0746]
c37.根据条款c1至条款c3中任一项的方法,其中将所述组合物以至多两次剂量施用于人,其中所述第二剂量在所述第一剂量约6个月后。
[0747]
c38.根据条款c1至条款c3中任一项的方法,其中所述组合物引发针对a22的免疫应答。
[0748]
c39.根据条款c1至条款c3中任一项的方法,其中所述组合物引发针对a56的免疫应答。
[0749]
c40.根据条款c1至条款c3中任一项的方法,其中所述组合物引发针对b24的免疫应答。
[0750]
c41.根据条款c1至条款c3中任一项的方法,其中所述组合物引发针对b44的免疫应答。
[0751]
c42.根据条款c1至条款c3中任一项的方法,其中所述组合物每剂量包含约60μg的所述第一多肽;约60μg的所述第二多肽;约5μg的与约7.5μg tt缀合的mena荚膜糖;约5μg的与约7.5μg tt缀合的menc荚膜糖;约5μg的与约3.75μg tt缀合的menw荚膜糖;约5μg的与约3.25μg tt缀合的meny荚膜糖;约97μg tris-hcl,ph 6.8
±
0.3;4.69-4.71mg的氯化钠;约28mg的蔗糖;约0.78mg的l-组氨酸;约0.02mg聚山梨醇酯-80;约0.25mg铝;并且进一步包含0.5ml水。
[0752]
c43.一种组合物,所述组合物包含:(a)第一多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(b)第二多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(c)脑膜炎奈瑟氏菌血清组a荚膜糖缀合物;(d)脑膜炎奈瑟氏菌血清组c荚膜糖缀合物;(e)脑膜炎奈瑟氏菌血清组w荚膜糖缀合物;以及(f)脑膜炎奈瑟氏菌血清组y荚膜糖缀合物;其中所述组合物引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的至少一种的免疫应答,其中所述血清杀菌抗体应答高于由针对脑膜炎奈瑟氏菌血清组的许可疫苗引发的血清杀菌抗体应答。
[0753]
c44.根据条款c43所述的组合物,其中所述多肽包含与选自seq id no:1至seq id no:62的任何一个氨基酸序列具有至少70%同一性的氨基酸序列。
[0754]
c45.一种组合物,所述组合物包含:(a)第一多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(b)第二多肽,其衍生自脑膜炎奈瑟氏菌因子h结合蛋白(fhbp);(c)脑膜炎奈瑟氏菌血清组a荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与己二酸二酰肼(adh)接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(d)脑膜炎奈瑟氏菌血清组c荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(e)脑膜炎奈瑟氏菌血清组w荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合;以及(f)脑膜炎奈瑟氏菌血清组y荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合;其中所述组合物引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖中的每一种的免疫应答,其中所述血清杀菌抗体应答高于由许可的脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖疫苗引发的血清杀菌抗体应答。
[0755]
c46.一种用于在人中诱导针对脑膜炎奈瑟氏菌血清组b亚族a菌株和针对脑膜炎奈瑟氏菌血清组b亚族b菌株的免疫应答的方法,所述方法包括向所述人施用有效量的根据条款c43至条款c45中任一项的组合物。
[0756]
c47.一种用于在人中诱导针对脑膜炎奈瑟氏菌血清组a、脑膜炎奈瑟氏菌血清组c、脑膜炎奈瑟氏菌血清组w和/或脑膜炎奈瑟氏菌血清组y菌株的免疫应答的方法,所述方法包括向所述人施用有效量的根据条款c43至条款c45中任一项的组合物。
[0757]
c48.一种用于在人中诱导针对脑膜炎奈瑟氏菌血清组a、脑膜炎奈瑟氏菌血清组b、脑膜炎奈瑟氏菌血清组c、脑膜炎奈瑟氏菌血清组w和/或脑膜炎奈瑟氏菌血清组y菌株的免疫应答的方法,所述方法包括向所述人施用有效量的根据条款c43至条款c45中任一项的组合物。
[0758]
c49.一种用于在人中诱导针对脑膜炎奈瑟氏菌血清组a、脑膜炎奈瑟氏菌血清组b、脑膜炎奈瑟氏菌血清组c、脑膜炎奈瑟氏菌血清组w、脑膜炎奈瑟氏菌血清组y和/或脑膜炎奈瑟氏菌血清组x菌株的免疫应答的方法,所述方法包括向所述人施用有效量的根据条款c43至条款c45中任一项的组合物。
[0759]
c50.根据条款c46至c49中任一项的方法,其中在根据条款c43至条款c45中任一项的组合物的第一次施用之前,患者先前未接受多价脑膜炎球菌荚膜糖-载体蛋白缀合物疫苗。
[0760]
c51.根据条款c46至c49中任一项的方法,其中在根据条款c1和条款c10中任一项的组合物的第一次施用之前,患者先前已接受多价脑膜炎球菌荚膜糖-载体蛋白缀合物疫苗。
[0761]
c52.有效量的组合物用于在人中诱导针对脑膜炎奈瑟氏菌血清组b的免疫应答的用途,其中所述组合物包含:a)第一脂化多肽,其包含seq id no:1中所示的氨基酸序列;以及b)第二脂化多肽,其包含seq id no:2中所示的氨基酸序列,其中所述组合物诱导针对至少一种表达选自下组的多肽的脑膜炎奈瑟氏菌血清组b菌株的杀菌免疫应答,所述组由以下各项组成:b a02、a28、a42、a63、a76、b05、b07、b08、b13、b52和b107。
[0762]
c53.根据条款c52的用途,其中所述诱导的免疫应答是杀菌的。
[0763]
c54.根据条款c52的用途,其中所述组合物进一步包含聚山梨醇酯-80。
[0764]
c55.根据条款c52至c54中任一项的用途,其中所述组合物进一步包含铝。
[0765]
c56.根据条款c52至c55中任一项的用途,其中所述组合物进一步包含组氨酸缓冲液。
[0766]
c57.根据条款c52至c56中任一项的用途,其中所述组合物进一步包含氯化钠。
[0767]
c58.根据条款c52至c57中任一项的用途,其中所述组合物包含约120μg/ml的所述第一多肽;约120μg/ml的所述第二多肽;约2.8摩尔比的聚山梨醇酯-80;约0.5mg/ml铝;约10mm组氨酸;以及约150mm氯化钠。
[0768]
c59.根据条款c52至c58中任一项的用途,其中所述组合物包含约60μg的所述第一多肽;约60μg的所述第二多肽;约18μg聚山梨醇酯-80;约250μg铝;约780μg组氨酸;以及约4380μg氯化钠。
[0769]
c60.根据条款c52至c59中任一项的用途,其中所述组合物进一步包含至少一种额外免疫原性组合物,所述至少一种额外免疫原性组合物包含四种不同且单独制造的蛋白质-荚膜多糖缀合物的混合物,其中第一缀合物包含与载体蛋白缀合的脑膜炎奈瑟氏菌血清组w荚膜多糖,第二缀合物包含与载体蛋白缀合的脑膜炎奈瑟氏菌血清组y荚膜多糖,第三缀合物包含与载体蛋白缀合的脑膜炎奈瑟氏菌血清组a荚膜多糖,并且第四缀合物包含与载体蛋白缀合的脑膜炎奈瑟氏菌血清组c荚膜多糖,其中所述载体蛋白选自由白喉类毒素、crm
197
和破伤风类毒素组成的组。
[0770]
c61.根据条款c60的用途,其中所述载体蛋白是白喉类毒素。
[0771]
c62.根据条款c60的用途,其中所述载体蛋白是破伤风类毒素。
[0772]
c63.根据条款c60的用途,其中所述至少一种额外免疫原性组合物是液体组合物。
[0773]
c64.根据条款c60的用途,其中所述至少一种额外免疫原性组合物不是冻干的。
[0774]
c65.根据条款c60至c64中任一项的用途,其中所述组合物诱导针对至少一种脑膜炎奈瑟氏菌血清组a菌株的免疫应答。
[0775]
c66.根据条款c60至c64中任一项的用途,其中所述组合物诱导针对至少一种脑膜炎奈瑟氏菌血清组c菌株的免疫应答。
[0776]
c67.根据条款c60至c64中任一项的用途,其中所述组合物诱导针对至少一种脑膜炎奈瑟氏菌血清组w菌株的免疫应答。
[0777]
c68.根据条款c60至c64中任一项的用途,其中所述组合物诱导针对至少一种脑膜炎奈瑟氏菌血清组y菌株的免疫应答。
[0778]
c69.根据条款c60至c64中任一项的用途,其中所述组合物诱导针对脑膜炎奈瑟氏菌血清组a株、脑膜炎奈瑟氏菌血清组c株、脑膜炎奈瑟氏菌血清组y株、脑膜炎奈瑟氏菌血清组w菌株及其任意组合中的至少一种的免疫应答。
[0779]
c70.根据条款c52至c69中任一项的用途,其中所述有效量的所述组合物包含一次剂量。
[0780]
c71.根据条款c52至c70中任一项的用途,其中所述有效量的所述组合物包含两次剂量。
[0781]
c72.根据条款c52至c70中任一项的用途,其中所述有效量的所述组合物进一步包含加强剂量。
[0782]
c73.根据条款c52至c70中任一项的用途,其中所述有效量的所述组合物包含至多两次剂量。
[0783]
c74.根据条款c52至c70中任一项的用途,其中所述有效量的所述组合物包含至多三次剂量。
[0784]
c75.根据条款c52的用途,其中所述组合物不包含杂合蛋白。
[0785]
c76.根据条款c52的用途,其中所述组合物不包含融合蛋白。
[0786]
c77.根据条款c52的用途,其中所述组合物不是冻干的。
[0787]
c78.根据条款c52的用途,其中所述组合物不包含甲醛。
[0788]
c79.根据条款c60的用途,其中所述组合物不包含白喉类毒素或crm。
[0789]
c80.根据条款c60的用途,其中所述脑膜炎奈瑟氏菌血清组a(mena)荚膜糖通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐化学与己二酸二酰肼(adh)接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素载体蛋白(tt)缀合(mena
ah-tt缀合物)。
[0790]
c81.根据条款c60的用途,其中所述脑膜炎奈瑟氏菌血清组c(menc)荚膜糖通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐化学与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素载体蛋白(tt)缀合(menc
ah-tt缀合物)。
[0791]
c82.根据条款c60的用途,其中所述脑膜炎奈瑟氏菌血清组w(menw)荚膜糖在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐化学与破伤风类毒素载体蛋白(tt)直接缀合(menw-tt缀合物)。
[0792]
c83.根据条款c60的用途,其中所述脑膜炎奈瑟氏菌血清组y(meny)荚膜糖在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐化学与破伤风类毒素载体蛋白(tt)直接缀合(meny-tt缀合物)。
[0793]
c84.根据条款c60的用途,其中所述脑膜炎奈瑟氏菌血清组a(mena)荚膜糖通过1-氰基-4-二甲氨基吡啶四氟硼酸盐化学与己二酸二酰肼(adh)接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素载体蛋白(tt)缀合(mena
ah-tt缀合物);所述脑膜炎奈瑟氏菌血清组c(menc)荚膜糖通过1-氰基-4-二甲氨基吡啶四氟硼酸盐化学与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素载体蛋白(tt)缀合(menc
ah-tt缀合物);所述脑膜炎奈瑟氏菌血清组w(menw)荚膜糖在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐化学与破伤风类毒素载体蛋白(tt)直接缀合(menw-tt缀合物);并且所述脑膜炎奈瑟氏菌血清组y(meny)荚膜糖在不存在接头的情况下通过1-氰基-4-二甲氨基吡啶四氟硼酸盐化学与破伤风类毒素载体蛋白(tt)直接缀合(meny-tt缀合物)。
[0794]
c85.根据条款c60的用途,其中所述组合物在不存在己二酸二酰肼(adh)接头的情况下不包含mena荚膜糖。
[0795]
c86.根据条款c52至c85中任一项的用途,其中患者的年龄为12至《18个月或者18
至《24个月。
[0796]
c87.根据条款c52至c85中任一项的用途,其中患者的年龄为18至《24个月。
[0797]
c88.根据条款c52至c85中任一项的用途,其中患者的年龄为≥24个月至《10岁。
[0798]
c89.根据条款c52至c88中任一项的用途,其中当在相同条件下,在使用人补体进行的血清杀菌测定中测量时,所述组合物在接受第一剂量后的人中诱导的血清免疫球蛋白杀菌滴度比接受所述第一剂量之前的人中的血清免疫球蛋白杀菌滴度高至少2倍。
[0799]
c90.根据条款c52至c89中任一项的用途,其中当在相同条件下,在使用人补体进行的血清杀菌测定中测量时,所述组合物在接受第一剂量后的人中诱导的血清免疫球蛋白杀菌滴度比接受所述第一剂量之前的人中的血清免疫球蛋白杀菌滴度高至少4倍。
[0800]
c91.根据条款c52至c90中任一项的用途,其中当在相同条件下,在使用人补体进行的血清杀菌测定中测量时,所述组合物在接受第一剂量后的人中诱导的血清免疫球蛋白杀菌滴度比接受所述第一剂量之前的人中的血清免疫球蛋白杀菌滴度高至少8倍。
[0801]
c92.一种在人中诱导免疫应答的方法,所述方法包括向所述人施用组合物,所述组合物包含:
[0802]
a)第一多肽,其包含seq id no:1中所示的氨基酸序列;(b)第二多肽,其包含seq id no:2中所示的氨基酸序列;(c)脑膜炎奈瑟氏菌血清组a荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与己二酸二酰肼(adh)接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(d)脑膜炎奈瑟氏菌血清组c荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(e)脑膜炎奈瑟氏菌血清组w荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合;以及(f)脑膜炎奈瑟氏菌血清组y荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合。
[0803]
其中所述组合物诱导对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的至少一种的免疫应答,其中所述免疫应答包含血清杀菌抗体的滴度,并且其中所述滴度高于由针对脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖的许可疫苗诱导的滴度。
[0804]
c93.根据权利要求1的方法,其中所述针对脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖的许可疫苗是menveo。
[0805]
c94.一种在人中诱导免疫应答的方法,所述方法包括向所述人施用组合物,所述组合物包含:a)第一多肽,其包含seq id no:1中所示的氨基酸序列;(b)第二多肽,其包含seq id no:2中所示的氨基酸序列;(c)脑膜炎奈瑟氏菌血清组a荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与己二酸二酰肼(adh)接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(d)脑膜炎奈瑟氏菌血清组c荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(e)脑膜炎奈瑟氏菌血清组w荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合;以及(f)脑膜炎奈瑟氏菌血清组y荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合,其中所述组合物诱导对脑膜炎奈瑟氏菌血清组b的免疫应答,其中所述免疫应答包含血清杀菌抗体的滴度,所述滴度高于由针对脑膜炎奈瑟氏菌血清组b的许可疫苗诱导的血清杀菌抗体的滴度。
[0806]
c95.根据条款94的方法,其中所述针对脑膜炎奈瑟氏菌血清组b的许可疫苗是trumenba。
[0807]
c96.一种在人中诱导免疫应答的方法,所述方法包括向所述人施用组合物,所述组合物包含:a)第一多肽,其包含seq id no:1中所示的氨基酸序列;(b)第二多肽,其包含seq id no:2中所示的氨基酸序列;(c)脑膜炎奈瑟氏菌血清组a荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与己二酸二酰肼(adh)接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(d)脑膜炎奈瑟氏菌血清组c荚膜糖,其通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与adh接头缀合,其中所述接头通过碳二亚胺化学与破伤风类毒素缀合;(e)脑膜炎奈瑟氏菌血清组w荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲基氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合;以及(f)脑膜炎奈瑟氏菌血清组y荚膜糖,其在不存在接头的情况下通过1-氰基-4-二甲氨基吡啶四氟硼酸盐与破伤风类毒素直接缀合,其中所述组合物诱导对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的至少一种以及脑膜炎奈瑟氏菌血清组b的免疫应答,其中所述免疫应答包含对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的每一种的血清杀菌抗体的滴度,所述滴度高于由针对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖的许可疫苗诱导的血清杀菌抗体的滴度,并且其中所述免疫应答包含对脑膜炎奈瑟氏菌血清组b的血清杀菌抗体的滴度,所述滴度高于由针对脑膜炎奈瑟氏菌血清组b的许可疫苗诱导的血清杀菌抗体的滴度。
[0808]
c97.根据条款c96的方法,其中所述针对脑膜炎奈瑟氏菌血清组a、c、w-135和y脑膜炎球菌荚膜多糖的许可疫苗是menveo。
[0809]
c98.根据条款c94至c97中任一项的方法,其中所述组合物进一步包含佐剂。
[0810]
c99.根据条款c94至c97中任一项的方法,其中所述组合物进一步包含铝。
[0811]
c100.根据条款c99的方法,其中所述佐剂包含氢氧化铝。
[0812]
c101.根据条款c99的方法,其中所述佐剂包含磷酸铝。
[0813]
c102.根据条款c99的方法,其中至少90%的所述第一多肽与所述组合物中的铝结合。
[0814]
c103.根据条款c94的方法,其中至少90%的所述第二多肽与所述组合物中的铝结合。
[0815]
c104.根据条款c94至c97中任一项的方法,其中所述组合物被配制为无菌液体。
[0816]
c105.根据条款c94至c97中任一项的方法,其中所述组合物进一步包含聚山梨醇酯-80。
[0817]
c106.根据条款c94至c97中任一项的方法,其中所述组合物进一步包含tris-hcl;氯化钠;蔗糖;组氨酸;聚山梨醇酯80;以及磷酸铝。
[0818]
c107.根据条款c94至c97中任一项的方法,其中所述组合物包含约120μg/ml的所述第一多肽;约120μg/ml的所述第二多肽;约0.5mg/ml的作为磷酸铝的铝;约0.02mg聚山梨醇酯-80;约10mm组氨酸;以及约150mm氯化钠。
[0819]
c108.根据条款c94至c97中任一项的方法,其中所述组合物每剂量包含约60μg的所述第一多肽;约60μg的所述第二多肽;约5μg的与约7.5μg tt缀合的mena荚膜糖;约5μg的与约7.5μg tt缀合的menc荚膜糖;约5μg的与约3.75μg tt缀合的menw荚膜糖;约5μg的与约3.25μg tt缀合的meny荚膜糖;约97μg tris-hcl,ph 6.8
±
0.3;4.69-4.71mg的氯化钠;约
28mg的蔗糖;约0.78mg的l-组氨酸;约0.02mg聚山梨醇酯-80;约0.25mg铝;并且进一步包含0.5ml水。
[0820]
c109.根据条款c94至c97中任一项的方法,其中所述组合物能够引发对脑膜炎奈瑟氏菌血清组a、c、w-135和y中的每一种的加强免疫应答。
[0821]
c110.根据条款c94至c97中任一项的方法,其中所述组合物能够引发对脑膜炎奈瑟氏菌血清组b的加强免疫应答。
[0822]
c111.根据条款c94至c97中任一项的方法,其中所述人的年龄在10至26岁之间。
[0823]
c112.根据条款c94至c97中任一项的方法,其中所述人的年龄在12至《18个月或者18至《24个月之间。
[0824]
c113.根据条款c94至c97中任一项的方法,其中所述人的年龄在18至《24个月之间。
[0825]
c114.根据条款c94至c97中任一项的用途,其中所述人的年龄在≥24个月至《10岁之间。
[0826]
c115.根据条款c94至c97中任一项的方法,其中所述人的年龄为至少16岁。
[0827]
c116.根据条款c115的方法,所述方法包括向所述人施用一次剂量。
[0828]
c117.根据条款c94至c97中任一项的方法,其中所述人为10至12岁。
[0829]
c118.根据条款c113的方法,所述方法包括向所述人施用至少两次剂量。
[0830]
c119.根据条款c113的方法,其中所述人的年龄为至多16岁。
[0831]
c120.根据条款c94至c97中任一项的方法,所述方法包括向约11岁的所述人施用至少一次剂量的所述组合物和在所述第一剂量至少四年后向所述人施用进一步剂量的所述组合物。
[0832]
c121.根据条款c94至c97中任一项的方法,所述方法包括向约11岁的所述人施用至少一次剂量的所述组合物和在最后剂量至少四年后向所述人施用进一步剂量的所述组合物。
[0833]
c122.根据条款c116的方法,其中所述进一步剂量的所述组合物在所述最后剂量约五年后施用。
[0834]
c123.根据条款c94至c97中任一项的方法,所述方法包括向约11岁的所述人施用所述组合物的一次剂量和在所述第一剂量约五年后向所述人施用所述组合物的至少两次剂量。
[0835]
c124.根据条款c94至c97中任一项的方法,其中所述人对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖呈血清反应阴性。
[0836]
c125.根据条款c94至c97中任一项的方法,其中所述人对脑膜炎奈瑟氏菌血清组a、c、w-135和y荚膜多糖呈血清反应阳性。
[0837]
c126.根据条款c94至c97中任一项的方法,所述方法包括施用第一剂量和第二剂量的所述组合物,其中所述第二剂量在所述第一剂量约6个月后。
[0838]
c127.根据条款c122的方法,其中所述人的年龄为至多17岁。
[0839]
c128.根据条款c122的方法,所述方法包括在16岁时向所述人施用第三剂量的所述组合物。
[0840]
c129.根据条款c94至c97中任一项的方法,所述方法包括施用至多两次剂量的所
述组合物,其中所述第二剂量在所述第一剂量约6个月后。
[0841]
c130.根据条款c94至c97中任一项的方法,其中所述组合物引发针对表达a22的脑膜炎奈瑟氏菌血清组b菌株的免疫应答。
[0842]
c131.根据条款c94至c97中任一项的方法,其中所述组合物引发针对表达a56的脑膜炎奈瑟氏菌血清组b菌株的免疫应答。
[0843]
c132.根据条款c94至c97中任一项的方法,其中所述组合物引发针对表达b24的脑膜炎奈瑟氏菌血清组b菌株的免疫应答。
[0844]
c133.根据条款c94至c97中任一项的方法,其中所述组合物引发针对表达b44的脑膜炎奈瑟氏菌血清组b菌株的免疫应答。
[0845]
c134.根据条款c94至c97中任一项的方法,其中所述组合物诱导针对脑膜炎奈瑟氏菌血清组b a22、a56、b24、b44菌株或它们的任意组合中的任一种的杀菌免疫应答。
[0846]
c135.根据条款c94至c97中任一项的方法,其中所述组合物诱导针对脑膜炎奈瑟氏菌血清组b b24、b16、b44、a22、b03、b09、a12、a19、a05、a07、b153菌株或它们的任意组合中的任一种的杀菌免疫应答。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1