用于癌症成像和治疗的经改性的GRPR拮抗剂肽
用于癌症成像和治疗的经改性的grpr拮抗剂肽
1.由于疾病进展阶段的存活率低,前列腺癌(prostate cancer,pca)(西方世界男性最常见的恶性病之一)仍然是一项艰巨的医疗任务。研究表明,其越早被诊断,治疗成功率越高,因此需要新的方法。在过去的几十年中,基于快速且几乎完全积聚在肿瘤部位的放射性示踪剂的核医学诊断和治疗癌症已引起越来越多的关注。
2.由于显示出诸如在前列腺癌中过表达以及在健康组织中低表达、快速清除率和高发生率(占所有前列腺癌的92%)等几个优异特性,前列腺特异性膜抗原(psma)示踪剂被经常用于pca的体内放射治疗和成像。然而,使用psma也有一些缺点,例如在疾病的早期状态下表达相当低,以及在肾脏和唾液腺中的高摄取。
3.作为一个有趣的替代方案,胃泌素释放肽受体(grpr)在pca中也表现出良好的发生率(早期高达100%,晚期高达60%),在恶性组织中过表达,并且仅在一个健康组织(胰腺)中表现出高表达。与psma相比,这是一个优势,因为在肾脏区域的转移灶由于肾脏的高摄取而无法通过使用psma示踪剂正确检测到。此外,使用高治疗剂量的一个日益令人担忧的问题似乎是由于psma示踪剂的高度积累而对唾液腺和肾脏造成的损害。
4.发现grpr在pca的早期阶段表现出较高的表达,而在疾病的晚期阶段观察到psma过表达的情况更多。此外,在富含雌激素受体(er)的乳腺癌(breast cancer)中还发现了grpr过表达,这允许对不同的癌症和性别使用相同的示踪剂。因此,grpr示踪剂是一种有用的工具,作为替代物用于psma表达低的患者或更好地诊断肾脏区转移灶。由于更高的表达率和更低的副作用(唾液腺损伤),前列腺癌(早期阶段)的条件性治疗(contingent therapy)受益于grpr示踪剂而不是psma示踪剂。此外,grpr拮抗剂使得能够用于不同性别,因为它在前列腺癌和乳腺癌中过表达。
5.迄今为止,grpr激动剂和拮抗剂都已经并且目前在临床环境中使用。由于激动剂一方面在应用于患者后表现出一些痛苦的副作用,而且由于从非肿瘤组织中的清除速度慢得多而具有更差的药代动力学,因此拮抗剂的开发正在增加。临床使用中grpr衍生物明显少于psma配体。然而,由于所有pca肿瘤中仅92%表达psma,而grpr在所有富雌激素受体(er)的乳腺癌的约85%中也过表达,因此具有临床益处。
6.拮抗性grpr分子的一般必要结构因其次纳摩尔亲和力而包含一个结合单元,该结合单元基于天然铃蟾肽或胃泌素释放肽(grp)的c末端部分。药效部分和n端螯合剂之间的接头部分不一定是必需的,因为尽管存在表现出良好性能的示踪剂,但也有许多报告证明了使用接头单元在药代动力学方面的有益效果。
7.在grpr拮抗剂中,衍生物rm2(dota-pip-d-phe-gln-trp-ala-val-gly-his-sta-leu-nh2)是最常使用的用于选择性grpr成像和治疗的药剂。它主要用
68
ga(88.9%β
+
,e
β+,最大
=1.89mev,t
1/2
=68分钟)标记用于成像,以及用
177
lu(78.6%β-,e
β,最大
=0.498mev,t
1/2
=6.7d)标记用于体内放射治疗,并且可以应用于pca和富含er的乳腺癌,因此迄今为止它被认为是grpr拮抗剂中的黄金标准。
8.68
ga-和
177
lu-rm2都显示出有利的药代动力学,因为高肿瘤积累、从非肿瘤组织的快速清除以及在人体中长时间跨度内在肿瘤中的良好保留,分别导致高对比度和良好的治
疗结果。
9.尽管如此,某些铃蟾肽类似物在动物体内代谢不稳定,这限制了在肿瘤组织中期望的积累。
10.另一方面,必须提到的是,更稳定的grpr衍生物显示出从富含grpr的胰腺中较慢的清除,由于可能的胰腺炎,在用于人类治疗之前必须考虑这一点。
11.在其他恶性适应症中,还有更多的标志物和靶标是令人感兴趣的。这些包括神经调节肽-b受体(铃蟾肽-1受体,nmbr)、铃蟾肽受体亚型3(brs-3)和胆囊收缩素-2受体(cck-2r)。
12.鉴于以上情况,本发明的技术问题可以从提供改进的放射性药物和放射诊断学(特别是在癌症领域)中看出,包括药代动力学特性的改进。
13.该技术问题已通过以下公开的主题得到解决。
14.在第一方面中,本发明涉及一种与内源性受体结合的化合物,所述化合物包含(i)寡肽,其包含二肽,所述二肽具有作为所述二肽的c端氨基酸的trp,其中所述trp经α-氨基酸xaa2替代,由此,与在其他方面相同的化合物中连接trp与n端相邻氨基酸的肽键相比,连接xaa2与n端相邻氨基酸的肽键在血清或血浆(优选哺乳动物的血清或血浆)中的稳定性增加;和(ii)能够产生治疗有效辐射的部分,所述部分与所述寡肽共价结合。
15.受体是能够特异性结合其同源配体的分子。术语“同源配体”表示一类分子并且包括天然配体和根据本发明的化合物。受体优选是多肽或蛋白质。它可以包含多个亚基,这些亚基可以非共价或共价地相互连接。优选地,所述受体是跨膜蛋白或膜相关蛋白。优选地,配体结合位点位于细胞外。
16.术语“内源性”是指受体存在于人体或动物体内,所述动物包括哺乳动物,而哺乳动物包括啮齿动物。优选的受体是下文进一步公开的优选实施方案的主题。
17.第一方面的化合物包含两个部分或由两个部分组成。第一部分是靶向部分。它包含以上公开的寡肽或由以上公开的寡肽组成。第二部分是传递预期治疗效果的部分,在根据第一方面的化合物的情况下,该效果为辐射。因此,应当理解,治疗涉及破坏靶组织,通常是因为靶组织是或包含过度增殖组织,例如恶性组织。
18.如下文将变得更明显,在本发明的其他方面中,第二部分用于诊断目的。
19.在其最广泛的定义中,所述第二部分除了它必须能够产生治疗效果的辐射之外没有特别限制。根据本发明,这种能力由放射性核素传递。这样的放射性核素可以存在于所述化合物中,或者,该化合物可以具有一个部分,所述部分又能够负载有放射性核素。
20.术语“寡肽”具有其本领域公认的含义。它是由主链肽键相互连接的氨基酸的线性序列。就长度而言,优选5至20个氨基酸。这包括具有6、7、8、9、10、11、12、13、14、15、16、17、18或19个氨基酸的寡肽。优选的是6、7、8、9或10个氨基酸。尤其优选9或10个氨基酸,最优选9个氨基酸。虽然术语“寡肽”暗示肽性质,但该术语还包括在性质上并非排他地主要是肽的化合物。优选地,并且假设所述寡肽具有n个氨基酸,连接所述氨基酸的至少(n-1)/2个键是肽键。例如,连接所述氨基酸的n-1、n-2或n-3个键是肽键。
21.相同的考虑参照适用于寡肽的结构单元。换言之,至少有n/2个结构单元是氨基酸。例如,n、n-1、n-2或n-3结构单元是氨基酸。
22.术语“氨基酸”表示具有羧基和氨基的分子。优选的氨基酸是α-氨基酸,包括蛋白
质氨基酸,但也可以使用其他氨基酸,例如β-氨基酸、γ-氨基酸或δ-氨基酸。具体而言,在分子的c端区域可以采用γ-氨基酸;参见下文的进一步优选实施方案。
23.总体而言,优先考虑天然存在的,优选蛋白原α-氨基酸。话虽如此,为了赋予下文进一步详述的特定技术效果,一个或更多个位置,通常不超过寡核苷酸位置的一半,是非天然存在的氨基酸或部分。这些在本文中也被称为修饰的氨基酸或修饰的部分。这样的修饰可以影响立体化学,例如使用d-氨基酸代替其天然存在的l-对应物和/或关于结构和组成的修饰。
24.就氨基酸不位于分子末端的程度而言,应理解给定氨基酸通过主链肽键连接到相邻部分,结果是在这样的情况下不存在游离羧酸盐和伯胺。
25.在所述寡肽内,特别相关的是二肽单元。二肽单元在所述寡肽内的位置没有特别限制。然而,优选所述二肽单元位于寡肽的n端半部内。
26.在所述二肽中,c端氨基酸是色氨酸衍生物。在许多情况下,所述内源性受体的天然存在的配体在性质上也是肽类的,并且在对应位置具有色氨酸。对应位置是在天然存在的配体与第一方面的化合物的序列比对中比对的位置。
27.根据本发明,这样的色氨酸将被修饰。如下文将变得更明显,优选的修饰是那些保留吲哚环的修饰。此外,保留了氨基和羧基官能团。在这个意义上,术语“衍生物”的含义因此受到限制:衍生物必须是芳香族氨基酸,优选具有二元环,更优选吲哚环。此外,根据本发明,色氨酸衍生物是α-氨基酸。
28.根据本发明,色氨酸的修饰用于增加连接色氨酸衍生物(也称为xaa2)与n端相邻氨基酸的肽键在血清或血浆中的稳定性。
29.术语“增加肽键在血清或血浆中的稳定性”和“减少肽键在血清或血浆中的裂解”在本文中等同使用。
30.在血清或血浆中的稳定性优选在哺乳动物血清或血浆中。特别优选并且鉴于优选的应用,在血清或血浆中的稳定性是在人血清或血浆中的稳定性。为了测试和开发的目的,优选的血清或血浆是啮齿动物血清或血浆,例如鼠血清或血浆。为了测定血清或血浆中的稳定性,本发明的化合物例如在37℃下孵育3天(例如72
±
2小时)。
31.用于确定血清或血浆中的稳定性的测定在本领域中是公认的并且包括体外和体内测定。示例性的或优选的测定是所附的实例的一部分。为了确定稳定性是否增加,使用了参照化合物。选择用于评估第一方面的化合物的参照化合物使得所考虑的化合物与参照化合物之间的唯一区别是位置xaa2。在参照化合物中,所述位置是色氨酸。
32.应理解,增加的稳定性意味着统计学上显著增加的稳定性和/或至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少10倍、至少50倍、或至少100倍的增加的稳定性。用于确定所述增加的优选参数是血清/血浆半衰期。用于确定所述增加的优选参数是在人/鼠血清或血浆中孵育72
±
2小时之后完整的放射性标记化合物的量。
33.在替代方法中,所述内源性受体的相应同源配体或与相同受体结合的已确立的治疗剂(例如在grpr为受体的情况下的rm2,也参见下文)可以用作参照化合物。
34.根据第一方面的化合物显示出增强的药代动力学特性。用于比较的参照化合物如上所述,并且是与所考虑的根据第一方面的化合物不同的化合物,其中不同之处仅在于在
根据第一方面的化合物具有trp衍生物的位置处,未修饰的色氨酸存在于所述参照化合物中。或者,增强是与相应的天然配体和/或本领域确立的靶向相同受体的治疗剂相比。就认为是grpr配体的第一方面的化合物而言,优选的本领域确立的化合物是rm2(dota-pip-d-phe-gln-trp-ala-val-gly-his-sta-leu-nh2,其中螯合剂以及非蛋白原氨基酸的缩写在下文进一步解释)。
35.根据本发明的优选受体的天然配体(所述优选受体是下文进一步公开的优选实施方案的主题)如下:在神经调节肽-b受体的情况下为神经调节肽-b,在胃泌素释放肽受体的情况下为胃泌素释放肽,以及在胆囊收缩素-2受体的情况下为胃泌素。
36.在治疗的背景下,应理解高肿瘤摄取和/或肿瘤保留是期望的。这方面的证据在所附实施例中给出。
37.上面给出了实现高肿瘤摄取和保留的技术手段:它是在根据第一方面的化合物中包含的二肽单元内的肽键的稳定化。
38.在第一方面的化合物的一个优选实施方案中,所述二肽中的所述n端相邻氨基酸为l-gln、d-gln、l-his、d-his或gly,优选为l-gln。
39.在又一个优选的实施方案中,所述内源性受体为在癌症疾病中过表达的肽受体,例如神经调节肽-b受体(铃蟾肽-1受体,nmbr)、胃泌素释放肽受体(铃蟾肽-2受体,grpr)、铃蟾肽受体亚型3(brs-3)或胆囊收缩素-2受体(cck-2r),以及其中优选地(a)所述结合具有小于或等于50nm、小于或等于15nm、小于或等于5nm、或者小于或等于1nm的kd;和/或(b)所述化合物是grpr拮抗剂,优选具有小于或等于50nm、小于或等于15nm、小于或等于5nm、或者小于或等于1nm的ic
50
。
40.在与第一方面相关的第二方面中,本发明提供式(i)的化合物
41.s—y—xaa1—xaa2—l-ala—l-val—xaa5—l-his—t
ꢀꢀꢀ(i)42.其中
43.s是能够产生治疗活性辐射的部分;
44.y是任选的接头;
45.xaa1是(i)l-gln、d-gln、l-his、d-his或gly,优选l-gln;或者(ii)与在其他方面相同的化合物中xaa1为gln且xaa2为trp相比增加xaa1—xaa2肽键在血清或血浆中的稳定性的α-氨基酸;
46.xaa2是trp或者与在其他方面相同的化合物中xaa1为gln且xaa2为trp相比增加xaa1—xaa2肽键在血清或血浆中的稳定性的α-氨基酸;
47.条件是:xaa1不是l-gln、d-gln、l-his、d-his和gly中的任一者,并且同时xaa2也不是trp;
48.xaa5是gly、n-me-gly、d-ala、β-ala或2-氨基异丁酸(aib);优选为gly;以及
49.t是任选的端基。
50.第二方面的化合物是针对特定的内源性受体(其为grpr)定制的。因此,它包含数个继承自天然同源配体(其为胃泌素释放肽(grp))的特征。
51.根据第二方面,所述能够产生治疗活性辐射的部分位于n端。第二方面的化合物的核心是具有6个氨基酸的寡肽,其中限定根据本发明待稳定的肽键的二肽位于核心寡肽的1位和2位。
52.任选的接头y可以存在或不存在,并且就存在的程度而言,它可以是将另外的氨基酸掺入第二方面的化合物中的手段。
53.任选的端基t也可以是但不必是延伸第二方面的化合物的肽部分的手段。
54.用于确定血清或血浆中的稳定性是否增加的参照化合物是不同于所考虑的式(i)的化合物的化合物,其中不同之处在于xaa1是gln并且xaa2是trp。如上文关于第一方面的化合物所指出的,可以采用替代的参照化合物,该替代的参照化合物包括天然配体和本领域确立的与grpr(例如rm2)结合的药物。
55.在第一方面和第二方面的化合物的一个优选实施方案中,xaa2是:(a)被修饰成包括以下的trp:(i)与α-碳结合的任选取代的c1至c4烷基部分,取代基选自卤素和羟基;和/或(ii)与吲哚环结合的取代基,取代基选自n-(2,2,2-三氟甲基)、n-甲基、n-乙酰基、5-氟、5-溴、5-碘、5-氯、5-羟基、5-甲氧基、5-甲基、6-氯、7-氯和7-氮杂;(b)1,2,3,4-四氢去甲哈尔满-3-羧酸(l-tpi)。
56.该优选实施方案涉及实现第一方面和第二方面的化合物中存在的二肽部分的主链肽键的稳定性增加的特定结构手段(在第二方面的化合物的情况下称为xaa1–
xaa2)。
57.在这些结构措施中,特别优选的是在该优选实施方案的部分(a)(i)中指定的那些。
58.其更优选的实施方式使得所述任选取代的烷基部分选自
–
ch3、
–
ch2ch3和chnhal
3-n
,其中n为0、1或2,而hal是f、cl、br和/或i,例如
–
cf3;并且优选为
–
ch3。
59.最优选的是xaa2是α-甲基色氨酸。
60.第一方面和第二方面的优选实施方案是表1a和/或b的化合物的衍生物。表1a和b在下文进一步呈现,作为对表1a和b的化合物的术语“衍生物”的解释。
61.第一方面和第二方面的化合物的特别优选的实施方案是式(iiia和iiib)的化合物,如下文进一步公开的。
62.本发明的第三方面涉及式(ii)的化合物
63.s—y—xaa3—xaa4—l-ala—l-val—xaa5—l-his—t
ꢀꢀꢀ
(ii)
64.其中
65.s是能够产生可检测信号的部分;
66.y是任选的接头;
67.xaa3是(i)l-gln、d-gln、l-his、d-his或gly,优选l-gln;或者(ii)与在其他方面相同的化合物中xaa3为gln且xaa4为trp相比降低xaa3—xaa4肽键在血清或血浆中的稳定性的α-氨基酸;
68.xaa4是trp或者与在其他方面相同的化合物中xaa3为gln且xaa4为trp相比降低xaa3—xaa4肽键在血清或血浆中的稳定性的α-氨基酸;
69.其中在xaa4位置处降低其xaa3—xaa4肽键在血清或血浆中的稳定性的所述α-氨基酸不是蛋白原氨基酸;
70.条件是:xaa3不是l-gln、d-gln、l-his、d-his和gly中的任一者,并且同时xaa4也不是trp;
71.xaa5是gly、n-me-gly、β-ala或2-氨基异丁酸(aib);优选为gly;和
72.t是任选的端基。
73.尽管显示出与根据第二方面的式(i)化合物的结构相似性,但式(ii)的化合物的不同之处在于寡肽中包含的二肽部分中的肽键在血清或血浆中具有较低的稳定性。
74.这提供了独特但相关的技术效果:正如在本领域中良好确立的那样,放射性标记的化合物不仅可用于治疗,而且还可用于诊断目的。在诊断环境中,期望更快速的降解。这是因为肿瘤中的代谢活性通常低于周围正常组织,结果是更快速的降解需要更高的肿瘤与背景比,这样更高的肿瘤与背景比允许更敏感、更精确和/或更准确地检测肿瘤和转移灶。
75.应当理解,两个位置xaa3和xaa4与第二方面的化合物的位置xaa1和xaa2对应并对齐,并且被明显地标记仅是为了清楚起见。当谈到具体的结构实施方案时,一方面xaa1和xaa2,另一方面xaa3和xaa4通常将是不同的。这在下文进一步公开的第三方面的优选实施方案的背景中将变得更加明显。
76.为了确定稳定性降低的目的,以上给出的关于第一方面和第二方面的化合物的解释参照适用。因此,可以使用体外和体内血清或血浆测定。优选的读数是血清/血浆半衰期。更优选的读数是在人/鼠血浆中孵育72
±
2小时之后完整的放射性标记的化合物的量。如上所述,用于确定稳定性降低的参照化合物包括与式(ii)的化合物的不同之处仅在于位置xaa3和xaa4分别为gln和trp的化合物。
77.如本领域所确立的,三字母代码通常用于指定氨基酸。如果第一个字母是大写字母,则指的是l形式,而如果第一个字母是小写字母,则指的是d形式。举例来说,trp指的是l-色氨酸,而trp指的是d-色氨酸。本文还使用立体化学的明确指示(例如l-trp和d-trp)。
78.替代的参照化合物是相应的天然配体,在受体为grpr的情况下其为grp,或者是rm2(其是拮抗的)。
79.在式(ii)的化合物的优选实施方案中,xaa3是hse和/或xaa4是bta(3-苯并噻吩基丙氨酸)。
80.在第二方面的化合物的优选实施方案中,s选自放射性部分和能够负载放射性核素的部分。
81.在第三方面的化合物的优选实施方案中,s选自荧光部分、放射性部分和能够负载放射性核素的部分。
82.前述两个优选实施方案涉及部分s的优选实施方式,这取决于考虑其是治疗或诊断化合物。
83.就使用能够负载放射性核素的部分而言,所述部分优选为金属离子螯合剂,优选选自:双(羧甲基)-1,4,8,11-四氮杂双环[6.6.2]十六烷(cbte2a)、环己基-1,2-二胺四乙酸(cdta)、4-(1,4,8,11-四氮杂环十四烷-1-基)-甲基苯甲酸(cpta)、n'-[5-[乙酰基(羟基)氨基]戊基]-n-[5-[[4-[5-氨基戊基-(羟基)氨基]-4-氧代丁酰基]氨基]戊基]-n-羟基丁二酰胺(dfo)、4,11-双(羧甲基)-1,4,8,11-四氮杂双环[6.6.2]十六烷(do2a)、1,4,7,10-四氮杂环十二烷-n,n',n”,n”'-四乙酸(dota)、α-(2-羧乙基)-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸或2-[1,4,7,10-四氮杂环十二烷-4,7,10-三乙酸]-戊二酸(dotaga)、n,n'-二吡啶氧基乙二胺-n,n'-二乙酸酯-5,5'-双(磷酸酯)(dpdp)、二乙烯三胺五乙酸(dtpa)、乙二胺-ν,ν'-四乙酸(edta)、乙二醇-o,o-双(2-氨基乙基)-n,n,n',n'-四乙酸(egta)、n,n-双(羟基苄基)-乙二胺-n,n'-二乙酸(hbed)、羟基乙基二胺三乙酸(hedta)、1-(p-硝基苄基)-1,4,7,10-四氮杂环癸烷-4,7,10-三乙酸酯(hp-doa3)、6-肼基-n-甲基吡
啶-3-甲酰胺(hynic)、1,4,7-三氮杂环壬烷-1-琥珀酸-4,7-二乙酸(nodasa)、1-(1-羧基-3-羧基丙基)-4,7-(carbooxy)-1,4,7-三氮杂环壬烷(nodaga)、1,4,7-三氮杂环壬烷三乙酸(nota)、4,11-双(羧甲基)-1,4,8,11-四氮杂双环[6.6.2]十六烷(te2a)、1,4,8,11-四氮杂环十二烷-1,4,8,11-四乙酸(teta)、三联吡啶-双(亚甲胺四乙酸)(tmt)、1,4,7,10-四氮杂环十三烷-n,n',n”,n”'-四乙酸(trita)、三亚乙基四胺六乙酸(ttha)、n,n
′‑
双[(6-羧基-2-吡啶基)甲基]-4,13-二氮杂-18-冠-6(h2macropa)、4-氨基-4-{2-[(3-羟基-1,6-二甲基-4-氧代-1,4-二氢-吡啶-2-基甲基)-氨基甲酰基]-乙基}庚二酸双-[(3-羟基-1,6-二甲基-4-氧代-1,4-二氢-吡啶-2-基甲基)-酰胺](thp)、6-羧基-1,4,8,11-四氮杂十一烷(n4)、6-{p-[(羧基甲氧基)乙酰基]-氨基苄基}-1,4,8,11-四氮杂十一烷(n4’)、1,4,7,10-四氮杂环十二烷-1,4,7-三乙酸(do3a)、s-乙酰基巯基乙酰基三丝氨酸(mas3)、巯基乙酰基三甘氨酸(mag3)、1,4-双(羟基羰基甲基)-6-[双(羟基羰基甲基)]氨基-6-甲基全氢-1,4-二氮杂卓(aazta)、3,6,9,15-四氮杂双环[9.3.1]十五碳-1(15),11,13-三烯-2,10-二酮(tbpd)、9-氧杂-3,6,12,15,21-五氮杂三环[15,3,2,1]二十碳-1(21),17,19-三烯-2,7,11,16-四二酮(optt)、2-[双(羧甲基)氨基甲基]-2-[(4-异硫氰酸基苄基)氧基-甲基]丙烯-1,3-二氨四乙酸(tame-hex)、4-((4-(3-(双(2-(3-羟基-1-甲基-2-氧代-1,2-二氢吡啶-4-羧酰胺)乙基)氨基)-2-((双(2-(3-羟基-1-甲基-2-氧代-1,2-二氢吡啶-4-羧酰胺)乙基)氨基)甲基)丙基)苯基)氨基)-4-氧代丁酸(me-3,2-hopo)、2,20-(6-((羧甲基)氨基)-1,4-二氮杂环庚烷-1,4-二基)二乙酸)(data)、1,4,7-三氮杂环壬烷-1,4,7-三[甲基(2-羧乙基)次膦酸](trap)及其功能衍生物,例如nopo(1,4,7-三氮杂环壬烷-1,4-双[亚甲基(羟基甲基)次膦酸]-7-[亚甲基(2-羧乙基)次膦酸])、1,4,7,10-四氮杂环十二烷-1,4,7,10-四[亚甲基(2-羧乙基)次膦酸](dotpi)、6,6
′‑
({9-羟基-1,5-双(甲氧基羰基)-2,4-二(吡啶-2-基)-3,7-二氮杂二环[3.3.1]壬烷-3,7-二基}双(亚甲基))吡啶二羧酸(h2bispa2)、1,4,7,10,13-五氮杂环十五烷-n,n
′
,n
″
,n
″′
,n
″″‑
五乙酸(pepa)、1,4,7,10,13,16-六氮杂环十六烷-n,n
′
,n
″
,n
″′
,n
″″
,n
″″′‑
六乙酸(heha)、1,2-[{6-(羧基)-吡啶-2-基}-甲基氨基]乙烷(h2dedpa)、n,n
′‑
双{6-羧基-2-吡啶基甲基}-乙二胺-n,n
′‑
二乙酸(h4octapa)、4,10-双(羧甲基)-1,4,7,10-四氮杂双环[5.5.2]十四烷(cb-do2a)、1,4,7,10-四(氨基甲酰基甲基)-l,4,7,10-四氮杂环十二烷(tcmc)、1,8-二氨基-3,6,10,13,16,19-六氮杂二环[6.6.6]二十烷(sar)及其功能衍生物、{4-[2-(双-羧甲基氨基)-乙基]-7-羧甲基-[1,4,7]三唑烷-1-基}-乙酸(neta)、n,n
′
,n
″‑
三(2-巯基乙基)-1,4,7-三氮杂环壬烷(tacn-tm)、2-(p-异硫氰酸基苄基)-环己基二乙烯三胺五乙酸(chx-a
”‑
dtpa)、n,n
′‑
[1-苄基-1,2,3-三唑-4-基]甲基-n,n
′‑
[6-(羧基)吡啶-2-基]-1,2-二氨基乙烷(h2azapa)、n,n
″‑
[[6-(羧基)吡啶-2-基]甲基]二亚乙基三胺-n,n
′
,n
″‑
三乙酸(h5decapa)、n,n
′‑
双(2-羟基-5-磺基苄基)乙二胺-n,n
′‑
二乙酸(shbed)、3,6,9,15-四氮杂双环[9.3.1]十五碳-1(15),11,13-三烯-3,6,9,-三乙酸(pcta)、和n,n
′‑
(亚甲基膦酸酯)-n,n
′‑
[6-(甲氧基羰基)吡啶-2-基]甲基-1,2-二氨基乙烷(h6phospa),更优选为dota或dotaga;其中优选放射性阳离子与所述螯合剂结合,所述放射性阳离子优选选自
43
sc、
44
sc、
47
sc、
51
cr、
52m
mn、
58
co、
52
fe、
56
ni、
57
ni、
62
cu、
64
cu、
67
cu、
66
ga、
68
ga、
67
ga、
89
zr、
90
y、
86
y、
94m
tc、
99m
tc、
97
ru、
105
rh、
109
pd、
111
ag、
110m
in、
111
in、
113m
in、
114m
in、
117m
sn、
121
sn、
127
te、
140
la、
142
la、
142
pr、
143
pr、
147
nd、
149
gd、
149
pm、
151
pm、
149
tb、
152
tb、
155
tb、
153
sm、
156
eu、
157
gd、
161
tb、
164
tb、
161
ho、
166
ho、
157
dy、
166
dy、
165
dy、
160
er、
165
er、
169
er、
171
er、
166
yb、
169
yb、
175
yb、
167
tm、
172
tm、
177
lu、
186
re、
188
re、
188
w、
191
pt、
195m
pt、
194
ir、
197
hg、
198
au、
199
au、
212
pb、
203
pb、
211
at、
212
bi、
213
bi、
223
ra、
224
ra、
225
ac和
227
th、或包含
18
f的阳离子分子,例如
18
f-[alf]
2+
。
[0084]
对于治疗化合物,优选的核素是
177
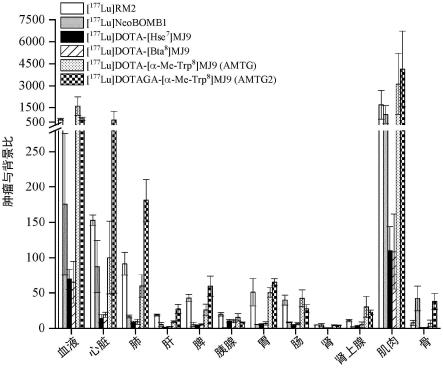
lu。用于诊断化合物的优选核素的实例是
68
ga。
[0085]
在第二方面和第三方面的化合物的优选实施方案中,接头y存在并且(a)包含一个、两个、三个、四个、五个或六个正电荷和/或负电荷;(b)包含一个、两个、三个、四个、五个或六个氨基酸或者由一个、两个、三个、四个、五个或六个氨基酸组成,在所述氨基酸中优选(a)d-氨基酸,更优选(a)d-α-氨基酸;(c)包含pegn或由pegn组成,其中n为选自1、2、3、4、5、6、7、8、9和10的整数;和/或(d)包含能够产生可检测信号的部分。
[0086]
根据以上优选实施方案的条目(d),能够产生可检测信号的合适部分可以是荧光部分或包含或能够负载放射性核素的部分。后者的实例是可以用于
18
f标记的氟化硅接受体部分(sifa)。就包含这样的sifa部分的本发明化合物还包含螯合剂(例如dota或dotaga)而言,这样的化合物将包含两种放射性核素并因此可以用于诊断和治疗两者。
[0087]
在一个优选的实施方案中,所述sifa部分具有由式(vi)表示的结构,
[0088][0089]
其中
[0090]
t-bu表示叔丁基;和
[0091]
虚线标记了将所述部分连接到化合物其余部分的键。
[0092]
sifa部分在接头y内的优选连接位点是2,3-二氨基丙酸的侧链,所述侧链由-ch
2-nh2组成,其中所述侧链的末端氨基优选与羧基形成酰胺键,所述羧基与式(vi)中sifa部分的自由价结合。
[0093]
具有氟化硅接受体部分的接头y是本发明所有方面的化合物的优选接头y。
[0094]
在进一步优选的实施方案中所述接头y包含以下或由以下组成:(a)d-glu-脲-d-glu;(b)一个或两个2,3-二氨基丙酸部分,其任选地被能够产生可检测信号的部分取代;(c)一个、两个、三个、四个、五个或六个连续氨基酸,所述氨基酸包含选自以下的一种或更多种氨基酸或由选自以下的一种或更多种氨基酸组成:d-/l-天冬氨酸、d-/l-鸟氨酸、4-氨基-1-羧甲基-哌啶(pip)、d-/l-2,3-二氨基丙酸、d-/l-丝氨酸、d-/l-瓜氨酸部分、l-磺基丙氨酸(ala(so3h))、氨基戊酸(ava)、4-氨基苯甲酸(paba)和d-phe;和/或(d)对氨基甲基苯胺-二甘醇酸(缩写pabza-dig或ama-dga)、和/或二甘醇酸盐(缩写dig或dga)。
[0095]
特别优选的是y为pip-phe。
[0096]
根据该优选实施方案的条目(a)的d-glu-脲-d-glu部分被认为是使化合物更亲水的一种手段。
[0097]
在第二方面和第三方面的化合物,即治疗活性剂和诊断活性剂两者的进一步优选的实施方案中,端基t存在并且包含以下或由以下组成:(a)抑胃酶氨酸(statine)(sta或(3s,4s)-4-氨基-3-羟基-6-甲基庚酸)、2,6-二甲基庚烷、leu或β-噻吩基-l-丙氨酸(thi);和/或(b)leu、正亮氨酸(nle)、pro、met或1-氨基-1-异丁基-3-甲基-丁烷,其中所述leu的酰胺胺基可以经乙基修饰(nh-乙基)或经nh2修饰(nh-nh2);和/或(c)(s)-1-((s)-2-氨基-4-甲基戊基)吡咯烷-2-甲酰胺(leu-ψ(ch2n)-pro-nh2);条件是:如果t是氨基酸或以氨基酸终止,则所述氨基酸的羧酸基被酰胺化。
[0098]
特别优选的是t为sta-leu-nh2。
[0099]
关于部分y和t的优选选择,通常在本发明的治疗和诊断化合物之间没有区别。
[0100]
如上所述,在本发明所有方面的化合物的优选实施方案中,所述血清或血浆是人血清或血浆。换言之,特别重要的是分别增加或降低人血清或血浆中的稳定性。
[0101]
下面的表1a显示了已知grpr结合剂的序列。在式(i)的化合物的情况下以xaa1开始并以l-his结束的、以及在式(ii)的化合物的情况下以xaa3开始并以l-his结束的六肽序列对应于下表中的第7至12位。可以认识到,遍及该表中显示的grpr结合剂在8位处具有色氨酸(分别对应于xaa2位和xaa4位)。7位(分别对应于xaa1和xaa3)是高度保守的。从下表中可以明显看出,在本领域中,没有认识到连接7位和8位(如表中编号)的肽键是用于微调药代动力学特性的靶位点。
[0102]
表1b和1c显示了经修饰的grpr寻址配体(addressing ligand)的序列以及将在8位处的α-me-trp或bta部分或在7位处的hse部分引入不同的grpr靶向化合物的效果。类似于表1a,在式(i)的化合物的情况下以xaa1开始并以l-his结束的、以及在式(ii)的化合物的情况下以xaa3开始并以l-his结束的六肽序列对应于7至12位。
[0103]
线性grpr靶向肽的代谢降解引起的问题被认为是由中性内肽酶(nep,ec3.4.24.11)引起的,已知其在疏水性氨基酸(例如色氨酸)的n端切割线性肽。因此假设这些肽在几乎所有grpr寻址化合物中存在的二肽gln
7-trp8基序处被切割(表1a)。为了证明在所述位置引入α-me-trp或hse时人血清或血浆中的代谢稳定性增加,合成了不同的grpr靶向配体并引入了上述修饰。对于表1b中显示的几乎所有评估的grpr靶向肽,与包含各自gln
7-trp8的衍生物相比,trp8被α-me-trp8或gln7被hse7取代导致代谢稳定性增强(表1c)。对于大多数这些类似物,grpr亲和力并未因添加α-me-trp而大幅度降低。然而,gln7被hse7取代导致grpr对大多数配体的亲和力明显降低。然而,可以观察到hse部分的稳定作用。
[0104]
类似地,在所述位置处引入bta以证明人血清或血浆中的代谢稳定性降低。对于表1b中所示的大多数评估的grpr寻址化合物,与包含各自gln
7-trp8的衍生物相比,用bta8取代trp8确实导致代谢稳定性降低(表1c)。对于表1b中所示的大多数衍生物,添加bta未显著影响grpr亲和力。
[0105]
因此得出结论,关于grpr靶向配体,哪些氨基酸位于gln
7-trp8二肽的n端和c端侧并不重要。一般来说,bta8的引入降低人血清或血浆中的代谢稳定性,而α-me-trp8或hse7的引入增加人血清或血浆中的代谢稳定性。因此,这些修饰(α-me-trp8、bta8和hse7)能够在整个grpr靶向化合物中得到广泛应用。
[0106]
[0107]
[0108]
[0109][0110]
表1c
[0111][0112]
本发明的优选化合物包括表1a和1b中所示化合物的衍生物。所述衍生物与表1a和1b的化合物的不同之处优选仅在于根据本发明对7位和/或8位(如表中的编号)进行修饰。
[0113]
举例来说,在表1a的任何化合物中,色氨酸可以用α-甲基色氨酸替代,从而获得根据本发明第一方面和第二方面的优选化合物。
[0114]
类似地,在表1a化合物的7位处,gln(或在此适用的情况下,his或gln)可以被hse替代,或在表1a化合物的8位处,trp可以被bta取代,从而获得根据本发明第三方面的优选化合物。
[0115]
适用于xaa1至xaa4的特别优选修饰的内容参照适用于上文公开的这四个位置处的任何修饰,无论是与第一方面、第二方面或第三方面的化合物结合。
[0116]
在第四方面中——这也是第一方面和第二方面的优选实施方案——本发明提供式(iiia)或(iiib)的化合物:
[0117][0118]
在第五方面中——这也是第三方面的优选方面——发明提供式(iv)或(v)的化合物
[0119][0120]
在第六方面中,本发明提供前述权利要求中任一项所述的化合物在药物中的用途。
[0121]
在第七方面中,本发明提供药物组合物,其包含第一方面、第二方面或第四方面的化合物或由第一方面、第二方面或第四方面的化合物组成。
[0122]
在第八方面中,本发明提供诊断组合物,其包含第三方面或第五方面的化合物或由第三方面或第五方面的化合物组成。
[0123]
尽管较不优选,但本发明在另一方面中提供包含第一方面、第二方面或第四方面的化合物或由第一方面、第二方面或第四方面的化合物组成的诊断组合物。同样较不优选的是涉及药物组合物的另一方面,该药物组合物包含第三方面或第五方面的化合物或由第三方面或第五方面的化合物组成。
[0124]
在本发明的药物和诊断组合物中,所述化合物可以是唯一的活性剂。也可以在本
发明的药物组合物中使用多于一种第一方面、第二方面或第四方面的化合物,以及在本发明的诊断组合物中使用多于一种第三方面或第五方面的化合物。
[0125]
尽管不太优选,还设想了本发明的药物和诊断组合物,其中除了一种或更多种本发明化合物之外,还存在另外的药物活性剂或诊断活性剂。
[0126]
药物或诊断组合物还可以包含药学或诊断学可接受的载体、赋形剂和/或稀释剂。合适的载体、赋形剂和/或稀释剂的实例在本领域中是众所周知的并且包括磷酸盐缓冲盐溶液、水、乳液例如油/水乳液、各种类型的润湿剂、无菌溶液等。包含这样的载体的组合物可以通过众所周知的常规方法来配制。这些药物组合物和诊断组合物可以以合适的剂量施用于个体。合适的组合物的施用可以通过不同的方式进行,例如通过静脉内、腹膜内、皮下、肌内、局部、皮内、鼻内或支气管内施用,优选静脉内。特别优选的是,所述施用通过注射进行。也可以将组合物直接施用至靶位点,例如通过基因枪递送至外部或内部靶位点。剂量方案将由主治医师和临床因素决定。正如医学领域所熟知的,任何一位患者的剂量取决于许多因素,包括患者的体型、体表面积、年龄、待施用的具体化合物、性别、施用时间和途径、一般健康状况和其他同时给药的药物。
[0127]
本发明的放射性标记的(例如用
177
lu)化合物的优选剂量为1gbq至100gbq、2gbq至60gbq、2gbq至50gbq、2gbq至10gbq、或3gbq至6gbq。
[0128]
根据本发明的优选医学适应症是过度增殖性疾病,更优选恶性病。
[0129]
因此,在第九方面中,本发明提供用于在治疗癌症的方法中使用的第七方面的药物组合物或者第一方面、第二方面或第四方面中任一者的化合物,其中所述癌症(a)特征在于所述受体的过表达;和/或(b)选自前列腺癌、乳腺癌、神经内分泌肿瘤(neuroendocrine tumor)、非小细胞肺癌(non-small cell lung cancer,nsclc)、小细胞肺癌(small-cell lung cancer,sclc)、胰腺癌(pancreatic cancer)、头/颈鳞状细胞癌(head/neck squamous cell cancer)、神经/胶质母细胞瘤(neuro/glioblastomas)、结直肠癌(colorectal cancer),以及在某种程度上,所述受体是cck-2r,甲状腺髓样癌(medullary thyroid cancer,mtc)。
[0130]
类似地,在第十方面中,本发明提供用于在诊断癌症的方法中使用的第八方面的诊断组合物或者第三方面或第五方面的化合物,其中所述癌症(a)特征在于所述受体的过表达;和/或(b)选自前列腺癌、乳腺癌、神经内分泌肿瘤、非小细胞肺癌(nsclc)、小细胞肺癌(sclc)、胰腺癌、头/颈鳞状细胞癌、神经/胶质母细胞瘤、结直肠癌,以及在所述受体是cck-2r的情况下,甲状腺髓样癌(mtc)。
[0131]
在第十一方面中,本发明提供一种诊断癌症的体外方法,所述癌症(a)特征在于所述受体的过表达;和/或(b)选自前列腺癌、乳腺癌、神经内分泌肿瘤、非小细胞肺癌(nsclc)、小细胞肺癌(sclc)、胰腺癌、头/颈鳞状细胞癌、神经/胶质母细胞瘤、结直肠癌,以及在所述受体是cck-2r的情况下,甲状腺髓样癌(mtc),其中所述方法包括使第八方面的诊断组合物或者第三方面或第五方面的化合物与从个体获得的样品接触。
[0132]
关于在本说明书中、特别是在权利要求中表征的实施方案,旨在将在从属权利要求中提及的每个实施方案与所述从属权利要求所引用的每个权利要求(独立或从属)的每个实施方案组合。例如,在独立权利要求1列举3个备选方案a、b和c,从属权利要求2列举3个备选方案d、e和f以及权利要求3从属于权利要求1和2并列举3个备选方案g、h和i的情况下,
应理解,除非另有明确说明,否则说明书明确地公开了对应于以下组合的实施方案:a、d、g;a、d、h;a、d、i;a、e、g;a、e、h;a、e、i;a、f、g;a、f、h;a、f、i;b、d、g;b、d、h;b、d、i;b、e、g;b、e、h;b、e、i;b、f、g;b、f、h;b、f、i;c、d、g;c、d、h;c、d、i;c、e、g;c、e、h;c、e、i;c、f、g;c、f、h;c、f、i。
[0133]
类似地,并且在独立权利要求和/或从属权利要求没有列举替代方案的那些情况下,应理解,如果从属权利要求引用复数个前述权利要求,则由此涵盖的主题的任何组合被认为是明确公开的。例如,在独立权利要求1、从属权利要求2引用权利要求1、以及从属权利要求3引用权利要求2和1两者的情况下,权利要求3和1的主题的组合如同权利要求3、2和1的主题的组合一样清楚和明确地公开。如果存在引用权利要求1至3中任一项的另外的从属权利要求4,则权利要求4和1、权利要求4、2和1、权利要求4、3和1以及权利要求4、3、2和1的主题的组合被清楚且明确地公开。
[0134]
本发明包括以下条目:
[0135]
1.一种与内源性受体结合的化合物,所述化合物包含:
[0136]
(i)寡肽,该寡肽包含二肽,所述二肽具有作为所述二肽的c端氨基酸的trp,其中所述trp被α-氨基酸xaa2替代,由此,与在其他方面相同的化合物中连接trp与n端相邻氨基酸的肽键相比,连接xaa2与n端相邻氨基酸的肽键在血清或血浆中的稳定性增加;和
[0137]
(ii)能够产生治疗有效辐射的部分,所述部分与所述寡肽共价结合。
[0138]
2.如条目1所述的化合物,其中所述二肽中的所述n端相邻氨基酸为l-gln、d-gln、l-his、d-his或gly,优选为l-gln。
[0139]
3.如条目1或2所述的化合物,其中所述内源性受体为在癌症疾病中过表达的肽受体,例如神经调节肽-b受体(铃蟾肽-1受体,nmbr)、胃泌素释放肽受体(铃蟾肽-2受体,grpr)、铃蟾肽受体亚型3(brs-3)或胆囊收缩素-2受体(cck-2r),以及其中优选地
[0140]
(a)所述结合具有小于或等于15nm的kd;和/或
[0141]
(b)所述化合物是grpr拮抗剂,优选具有小于或等于15nm的ic
50
。
[0142]
4.式(i)的化合物
[0143]
s—y—xaa1—xaa2—l-ala—l-val—xaa5—l-his—t
ꢀꢀꢀ(i)[0144]
其中
[0145]
s是能够产生治疗活性辐射的部分;
[0146]
y是任选的接头;
[0147]
xaa1是(i)l-gln、d-gln、l-his、d-his或gly,优选l-gln;或者
[0148]
(ii)与在其他方面相同的化合物中xaa1为gln且xaa2为trp相比增加xaa1—xaa2肽键在血清或血浆中的稳定性的α-氨基酸;
[0149]
xaa2是trp或者与在其他方面相同的化合物中xaa1为gln且xaa2为trp相比增加xaa1—xaa2肽键在血清或血浆中的稳定性的α-氨基酸;
[0150]
条件是:xaa1不是l-gln、d-gln、l-his、d-his和gly中的任一者,并且同时xaa2也不是trp;
[0151]
xaa5是gly、n-me-gly、d-ala、β-ala或2-氨基异丁酸(aib);优选为gly;以及t是任选的端基。
[0152]
5.如条目1至4中任一项所述的化合物,其中xaa2是
[0153]
(a)被修饰成包括以下的trp:
[0154]
(i)与α-碳结合的任选取代的c1至c4烷基部分,取代基选自卤素和羟基;和/或
[0155]
(ii)吲哚环结合的取代基,取代基选自n-(2,2,2-三氟甲基)、n-甲基、n-乙酰基、5-氟、5-溴、5-碘、5-氯、5-羟基、5-甲氧基、5-甲基、6-氯、7-氯和7-氮杂;
[0156]
(b)1,2,3,4-四氢去甲哈尔满-3-羧酸(l-tpi)。
[0157]
6.如条目5所述的化合物,其中所述任选取代的烷基部分选自
–
ch3、
–
ch2ch3和chnhal
3-n
,其中n为0、1或2,并且hal是f、cl、br和/或i,例如
–
cf3;并且优选为
–
ch3。
[0158]
7.如条目1至6中任一项所述的化合物,其中xaa2是α-me-trp。
[0159]
8.式(ii)的化合物
[0160]
s—y—xaa3—xaa4—l-ala—l-val—xaa5—l-his—t
ꢀꢀꢀ
(ii)
[0161]
其中
[0162]
s是能够产生可检测信号的部分;
[0163]
y是任选的接头;
[0164]
xaa3是(i)l-gln、d-gln、l-his、d-his或gly,优选l-gln;或者
[0165]
(ii)与在其他方面相同的化合物中xaa3为gln且xaa4为trp相比降低xaa3—xaa4肽键在血清或血浆中的稳定性的α-氨基酸;
[0166]
xaa4是trp或者与在其他方面相同的化合物中xaa3为gln且xaa4为trp相比降低xaa3—xaa4肽键在血清或血浆中的稳定性的α-氨基酸;
[0167]
其中降低xaa3—xaa4肽键在血清或血浆中的稳定性的在xaa4位置处的所述α-氨基酸不是蛋白原氨基酸;
[0168]
条件是:xaa3不是l-gln、d-gln、l-his、d-his和gly中的任一者,并且同时xaa4也不是trp;
[0169]
xaa5是gly、n-me-gly、β-ala或2-氨基异丁酸(aib);优选gly;和
[0170]
t是任选的端基。
[0171]
9.如条目8所述的化合物,其中xaa3是hse和/或xaa4是bta。
[0172]
10.如条目4至7中任一项所述的化合物,其中s选自放射性部分和能够负载放射性核素的部分。
[0173]
11.如条目8或9所述的化合物,其中s选自荧光部分、放射性部分和能够负载放射性核素的部分。
[0174]
12.如条目10或11所述的化合物,其中所述能够负载放射性核素的部分为金属离子螯合剂,优选选自:双(羧甲基)-1,4,8,11-四氮杂双环[6.6.2]十六烷(cbte2a)、环己基-1,2-二胺四乙酸(cdta)、4-(1,4,8,11-四氮杂环十四烷-1-基)-甲基苯甲酸(cpta)、n'-[5-[乙酰基(羟基)氨基]戊基]-n-[5-[[4-[5-氨基戊基-(羟基)氨基]-4-氧代丁酰基]氨基]戊基]-n-羟基丁二酰胺(dfo)、4,11-双(羧甲基)-1,4,8,11-四氮杂双环[6.6.2]十六烷(do2a)、1,4,7,10-四氮杂环十二烷-n,n',n”,n”'-四乙酸(dota)、α-(2-羧乙基)-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸或2-[1,4,7,10-四氮杂环十二烷-4,7,10-三乙酸]-戊二酸(dotaga)、n,n'-二吡啶氧基乙二胺-n,n'-二乙酸酯-5,5'-双(磷酸酯)(dpdp)、二乙烯三胺五乙酸(dtpa)、乙二胺-ν,ν'-四乙酸(edta)、乙二醇-o,o-双(2-氨基乙基)-n,n,n',n'-四乙酸(egta)、n,n-双(羟基苄基)-乙二胺-n,n'-二乙酸(hbed)、羟基乙基二胺三乙
酸(hedta)、1-(p-硝基苄基)-1,4,7,10-四氮杂环癸烷-4,7,10-三乙酸酯(hp-doa3)、6-肼基-n-甲基吡啶-3-甲酰胺(hynic)、1,4,7-三氮杂环壬烷-1-琥珀酸-4,7-二乙酸(nodasa)、1-(1-羧基-3-羧基丙基)-4,7-(carbooxy)-1,4,7-三氮杂环壬烷(nodaga)、1,4,7-三氮杂环壬烷三乙酸(nota)、4,11-双(羧甲基)-1,4,8,11-四氮杂双环[6.6.2]十六烷(te2a)、1,4,8,11-四氮杂环十二烷-1,4,8,11-四乙酸(teta)、三联吡啶-双(亚甲胺四乙酸)(tmt)、1,4,7,10-四氮杂环十三烷-n,n',n”,n”'-四乙酸(trita)、三亚乙基四胺六乙酸(ttha)、n,n
′‑
双[(6-羧基-2-吡啶基)甲基]-4,13-二氮杂-18-冠-6(h2macropa)、4-氨基-4-{2-[(3-羟基-1,6-二甲基-4-氧代-1,4-二氢-吡啶-2-基甲基)-氨基甲酰基]-乙基}庚二酸双-[(3-羟基-1,6-二甲基-4-氧代-1,4-二氢-吡啶-2-基甲基)-酰胺](thp)、6-羧基-1,4,8,11-四氮杂十一烷(n4)、6-{p-[(羧基甲氧基)乙酰基]-氨基苄基}-1,4,8,11-四氮杂十一烷(n4’)、1,4,7,10-四氮杂环十二烷-1,4,7-三乙酸(do3a)、s-乙酰基巯基乙酰基三丝氨酸(mas3)、巯基乙酰基三甘氨酸(mag3)、1,4-双(羟基羰基甲基)-6-[双(羟基羰基甲基)]氨基-6-甲基全氢-1,4-二氮杂卓(aazta)、3,6,9,15-四氮杂双环[9.3.1]十五碳-1(15),11,13-三烯-2,10-二酮(tbpd)、9-氧杂-3,6,12,15,21-五氮杂三环[15,3,2,1]二十碳-1(21),17,19-三烯-2,7,11,16-四二酮(optt)、2-[双(羧甲基)氨基甲基]-2-[(4-异硫氰酸基苄基)氧基-甲基]丙烯-1,3-二氨四乙酸(tame-hex)、4-((4-(3-(双(2-(3-羟基-1-甲基-2-氧代-1,2-二氢吡啶-4-羧酰胺)乙基)氨基)-2-((双(2-(3-羟基-1-甲基-2-氧代-1,2-二氢吡啶-4-羧酰胺)乙基)氨基)甲基)丙基)苯基)氨基)-4-氧代丁酸(me-3,2-hopo)、2,20-(6-((羧甲基)氨基)-1,4-二氮杂环庚烷-1,4-二基)二乙酸)(data)、1,4,7-三氮杂环壬烷-1,4,7-三[甲基(2-羧乙基)次膦酸](trap)及其功能衍生物,例如nopo(1,4,7-三氮杂环壬烷-1,4-双[亚甲基(羟基甲基)次膦酸]-7-[亚甲基(2-羧乙基)次膦酸])、1,4,7,10-四氮杂环十二烷-1,4,7,10-四[亚甲基(2-羧乙基)次膦酸](dotpi)、6,6
′‑
({9-羟基-1,5-双(甲氧基羰基)-2,4-二(吡啶-2-基)-3,7-二氮杂二环[3.3.1]壬烷-3,7-二基}双(亚甲基))吡啶二羧酸(h2bispa2)、1,4,7,10,13-五氮杂环十五烷-n,n
′
,n
″
,n
″′
,n
″″‑
五乙酸(pepa)、1,4,7,10,13,16-六氮杂环十六烷-n,n
′
,n
″
,n
″′
,n
″″
,n
″″′‑
六乙酸(heha)、1,2-[{6-(羧基)-吡啶-2-基}-甲基氨基]乙烷(h2dedpa)、n,n
′‑
双{6-羧基-2-吡啶基甲基}-乙二胺-n,n
′‑
二乙酸(h4octapa)、4,10-双(羧甲基)-1,4,7,10-四氮杂双环[5.5.2]十四烷(cb-do2a)、1,4,7,10-四(氨基甲酰基甲基)-l,4,7,10-四氮杂环十二烷(tcmc)、1,8-二氨基-3,6,10,13,16,19-六氮杂二环[6.6.6]二十烷(sar)及其功能衍生物、{4-[2-(双-羧甲基氨基)-乙基]-7-羧甲基-[1,4,7]三唑烷-1-基}-乙酸(neta)、n,n
′
,n
″‑
三(2-巯基乙基)-1,4,7-三氮杂环壬烷(tacn-tm)、2-(p-异硫氰酸基苄基)-环己基二乙烯三胺五乙酸(chx-a
”‑
dtpa)、n,n
′‑
[1-苄基-1,2,3-三唑-4-基]甲基-n,n
′‑
[6-(羧基)吡啶-2-基]-1,2-二氨基乙烷(h2azapa)、n,n
″‑
[[6-(羧基)吡啶-2-基]甲基]二亚乙基三胺-n,n
′
,n
″‑
三乙酸(h5decapa)、n,n
′‑
双(2-羟基-5-磺基苄基)乙二胺-n,n
′‑
二乙酸(shbed)、3,6,9,15-四氮杂双环[9.3.1]十五碳-1(15),11,13-三烯-3,6,9,-三乙酸(pcta)、和n,n
′‑
(亚甲基膦酸酯)-n,n
′‑
[6-(甲氧基羰基)吡啶-2-基]甲基-1,2-二氨基乙烷(h6phospa),
[0175]
更优选为dota或dotaga;
[0176]
其中优选放射性阳离子与所述螯合剂结合,
[0177]
所述放射性阳离子优选选自
43
sc、
44
sc、
47
sc、
51
cr、
52m
mn、
58
co、
52
fe、
56
ni、
57
ni、
62
cu、
64
cu、
67
cu、
66
ga、
68
ga、
67
ga、
89
zr、
90
y、
86
y、
94m
tc、
99m
tc、
97
ru、
105
rh、
109
pd、
111
ag,
110m
in、
111
in、
113m
in、
114m
in、
117m
sn、
121
sn、
127
te、
140
la、
142
la、
142
pr、
143
pr、
147
nd、
149
gd、
149
pm、
151
pm、
149
tb、
152
tb、
155
tb、
153
sm、
156
eu、
157
gd、
161
tb、
164
tb、
161
ho、
166
ho、
157
dy、
166
dy、
165
dy、
160
er、
165
er、
169
er、
171
er、
166
yb、
169
yb、
175
yb、
167
tm、
172
tm、
177
lu、
186
re、
188
re、
188
w、
191
pt、
195m
pt、
194
ir、
197
hg、
198
au、
199
au、
212
pb、
203
pb、
211
at、
212
bi、
213
bi、
223
ra、
224
ra、
225
ac和
227
th、或包含
18
f的阳离子分子,例如
18
f-[alf]
2+
。
[0178]
13.如条目4至12中任一项所述的化合物,其中y存在并且
[0179]
(a)包含一个、两个、三个、四个、五个或六个正电荷和/或负电荷;
[0180]
(b)包含一个、两个、三个、四个、五个或六个氨基酸或者由一个、两个、三个、四个、五个或六个氨基酸组成,在所述氨基酸中优选(a)d-氨基酸,更优选(a)d-α-氨基酸;
[0181]
(c)包含pegn或由pegn组成,n为选自1、2、3、4、5、6、7、8、9和10的整数;和/或
[0182]
(d)包含能够产生可检测信号的部分。
[0183]
14.如条目13所述的化合物,其中所述接头y包含以下或由以下组成:
[0184]
(a)d-glu-脲-d-glu;
[0185]
(b)一个或两个2,3-二氨基丙酸部分,其任选地被能够产生可检测信号的部分取代;
[0186]
(c)一个、两个、三个、四个、五个或六个连续氨基酸,所述氨基酸包含选自以下的一种或更多种氨基酸或由选自以下的一种或更多种氨基酸组成:d-/l-天冬氨酸、d-/l-鸟氨酸、4-氨基-1-羧甲基-哌啶(pip)、d-/l-2,3-二氨基丙酸、d-/l-丝氨酸、d-/l-瓜氨酸部分、l-磺基丙氨酸(ala(so3h))、氨基戊酸(ava)、4-氨基苯甲酸(paba)和d-phe;和/或
[0187]
(d)对氨基甲基苯胺-二甘醇酸(pabza-dig、ama-dga)和/或二甘醇酸盐(dig、dga)。
[0188]
15.如条目4至14中任一项所述的化合物,其中t存在并且包含以下或由以下组成:
[0189]
(a)抑胃酶氨酸(sta或(3s,4s)-4-氨基-3-羟基-6-甲基庚酸)、2,6-二甲基庚烷、leu或β-噻吩基-l-丙氨酸(thi);
[0190]
(b)leu、正亮氨酸(nle)、pro、met或1-氨基-1-异丁基-3-甲基-丁烷,其中所述leu的酰胺胺基可以经乙基修饰(nh-乙基)或经nh2修饰(nh-nh2);和/或
[0191]
(c)(s)-1-((s)-2-氨基-4-甲基戊基)吡咯烷-2-甲酰胺(leu-ψ(ch2n)-pro-nh2);
[0192]
条件是:如果t是氨基酸或以氨基酸终止,则所述氨基酸的羧酸盐被酰胺化。
[0193]
16.如前述条目中任一项所述的化合物,其中所述血清或血浆是人血清或血浆。
[0194]
17.式(iiia)或(iiib)的化合物
[0195][0196]
18.式(iv)或(v)的化合物
[0197][0198]
19.前述条目中任一项所述的化合物在药物中的用途。
[0199]
20.一种药物组合物,其包含条目1至7或10至17中任一项所述的化合物或由条目1至7或10至17中任一项所述的化合物组成,在条目10至13引用条目1至7中任一项的情况下。
[0200]
21.一种诊断组合物,其包含条目8、9、10至16或18中任一项所述的化合物或由条目8、9、10至16或18中任一项所述的化合物组成,在条目10至16引用条目8或9的情况下。
[0201]
22.如条目20所述的药物组合物或如条目1至7或10至17中任一项所述的化合物,在条目10至16引用条目1至7中任一项的情况下,用于治疗癌症的方法中,其中所述癌症:
[0202]
(a)特征在于所述受体的过表达;和/或
[0203]
(b)选自前列腺癌、乳腺癌、神经内分泌肿瘤、非小细胞肺癌(nsclc)、小细胞肺癌(sclc)、胰腺癌、头/颈鳞状细胞癌、神经/胶质母细胞瘤、结直肠癌,以及在所述受体是cck-2r的情况下,甲状腺髓样癌(mtc)。
[0204]
23.如条目20所述的诊断组合物或条目8、9、10至16或18中任一项所述的化合物,在条目10至16引用条目8或9的情况下,用于诊断癌症的方法中,其中所述癌症:
[0205]
(a)特征在于所述受体的过表达;和/或
[0206]
(b)选自前列腺癌、乳腺癌、神经内分泌肿瘤、非小细胞肺癌(nsclc)、小细胞肺癌(sclc)、胰腺癌、头/颈鳞状细胞癌、神经/胶质母细胞瘤、结直肠癌,以及在所述受体是cck-2r的情况下,甲状腺髓样癌(mtc)。
[0207]
24.一种诊断癌症的体外方法,其中所述癌症:
[0208]
(a)特征在于所述受体的过表达;和/或
[0209]
(b)选自前列腺癌、乳腺癌、神经内分泌肿瘤、非小细胞肺癌(nsclc)、小细胞肺癌(sclc)、胰腺癌、头/颈鳞状细胞癌、神经/胶质母细胞瘤、结直肠癌,以及在所述受体是cck-2r的情况下,甲状腺髓样癌(mtc),
[0210]
其中所述方法包括使条目20所述的诊断组合物或条目8、9、10至16或18中任一项所述的化合物,在条目10至16引用条目8或9的情况下,与从个体获得的样品接触。
[0211]
附图示出了:
[0212]
图1:在37℃下在人血浆中孵育72
±
2小时之后分析[
177
lu]rm2(tr=15.3分钟,20分钟内20
→
35%)。色谱图显示了两种重要的代谢物(tr=2.9分钟,54%和tr=8.5分钟,9%)以及剩余的完整示踪剂(tr=15.3分钟,36%)。
[0213]
图2:在37℃下在人血浆中孵育72
±
2小时之后分析[
177
lu]dota-[hse7]mj9(tr=16.1分钟,20分钟内20
→
35%)。色谱图显示了两种重要的代谢物(tr=3.4分钟,30%和tr=8.6分钟,8%)以及剩余的完整示踪剂(tr=15.3分钟,56%)。
[0214]
图3:在37℃下在人血浆中孵育72
±
2小时之后分析[
177
lu]dota-[bta8]mj9(tr=17.9分钟,20分钟内20
→
35%)。色谱图显示了两种代谢物(tr=3.1分钟,79%和tr=12.3分钟,8%)以及剩余的完整示踪剂(tr=17.9分钟,12%)。
[0215]
图4:在37℃下在人血浆中孵育72
±
2小时之后分析[
177
lu]amtg(tr=17.0分钟,20分钟内20
→
35%)。色谱图显示了两种代谢物(tr=1.7分钟,2%和tr=8.0分钟,5%)以及剩余的完整示踪剂(tr=17.0分钟,92%)。
[0216]
图5:在37℃下在鼠血浆中孵育6
±
0.5小时之后分析[
177
lu]rm2(tr=15.5分钟,20分钟内20
→
35%)。色谱图显示了三种代谢物(tr=3.1分钟,2%,tr=8.2分钟,2%和tr=17.3分钟,4%)以及剩余的完整示踪剂(tr=17.0分钟,92%)。
[0217]
图6:在37℃下在鼠血浆中孵育6
±
0.5小时之后分析[
177
lu]amtg(tr=17.0分钟,20分钟内20
→
35%)。色谱图显示了三种代谢物(tr=2.6分钟,2%,tr=13.7分钟,2%和tr=18.8分钟,5%)以及剩余的完整示踪剂(tr=17.0分钟,89%)。
[0218]
图7:在37℃下在鼠血浆中孵育72
±
2小时之后分析[
177
lu]rm2(tr=15.5分钟,20分钟内20
→
35%)。色谱图显示了几种小的代谢物以及剩余的完整示踪剂(tr=15.5分钟,67%)。
[0219]
图8:在37℃下在鼠血浆中孵育72
±
2小时之后分析[
177
lu]amtg(tr=17.0分钟,20分钟内20
→
35%)。色谱图显示了几种代谢物以及剩余的完整示踪剂(tr=17.0分钟,59%)。
[0220]
图9:在携带pc-3肿瘤的cb17-scid小鼠(每只100pmol)上[
177
lu]rm2(白色)、[
177
lu]dota-[hse7]mj9(黑色)和[
177
lu]dota-[bta8]mj9(阴影线)在p.i.1小时时在选定器官中的生物分布(以%id/g计)。数据表示为平均值
±
sd(n=4)。
[0221]
图10:在携带pc-3肿瘤的cb17-scid小鼠上[
177
lu]rm2(白色)、[
177
lu]dota-[hse7]mj9(黑色)和[
177
lu]dota-[bta8]mj9(阴影线)在p.i.1小时时的选定器官的肿瘤与背景比。数据表示为平均值
±
sd(n=4)。
[0222]
图11:在携带pc-3肿瘤的cb17-scid小鼠(每只100pmol)上[
177
lu]rm2(白色)、
[
177
lu]neobomb1(灰色)、[
177
lu]dota-[hse7]mj9(黑色)、[
177
lu]dota-[bta8]mj9(阴影线)、[
177
lu]amtg(虚线)和[
177
lu]amtg2(正方形)在p.i.24小时时在选定器官中的生物分布(以%id/g计)。数据表示为平均值
±
sd(n=4)。
[0223]
图12:在携带pc-3肿瘤的cb17-scid小鼠上[
177
lu]rm2(白色)、[
177
lu]neobomb1(灰色)、[
177
lu]dota-[hse7]mj9(黑色)、[
177
lu]dota-[bta8]mj9(阴影线)、[
177
lu]amtg(虚线)和[177lu]amtg2(正方形)在p.i.24小时时的选定器官的肿瘤与背景比。数据表示为平均值
±
sd(n=4)。
[0224]
图13:在携带pc-3肿瘤的cb17-scid小鼠(每只100pmol)上[
99m
tc]n
4-asp-mj9(灰色,阴影线)、[
99m
tc]n
4-asp-[bta8]mj9(灰色虚线)、[
99m
tc]n
4-[hse7]mj9(灰色,砖块)和[
99m
tc]n
4-[α-me-trp8]mj9(灰色,正方形)在p.i.1小时时在选定器官中的生物分布(以%id/g计)。数据表示为平均值
±
sd(n=4)。
[0225]
图14:在携带pc-3肿瘤的cb17-scid小鼠(每只100pmol)上[
99m
tc]n
4-asp-mj9(灰色,阴影线)、[
99m
tc]n
4-asp-[bta8]mj9(灰色虚线)、[
99m
tc]n
4-[hse7]mj9(灰色,砖块)和[
99m
tc]n
4-[α-me-trp8]mj9(灰色,正方形)在p.i.4小时时在选定器官中的生物分布(n=1)(以%id/g计)。
[0226]
图15:在携带pc-3肿瘤的cb17-scid小鼠上[
99m
tc]n
4-asp-mj9(灰色,阴影线)、[
99m
tc]n
4-asp-[bta8]mj9(灰色虚线)、[
99m
tc]n
4-[hse7]mj9(灰色,砖块)和[
99m
tc]n
4-[α-me-trp8]mj9(灰色,正方形)在p.i.1小时时的选定器官的肿瘤与背景比。数据表示为平均值
±
sd(n=4)。
[0227]
图16:在携带pc-3肿瘤的cb17-scid小鼠上[
99m
tc]n
4-asp-mj9(灰色,阴影线)、[
99m
tc]n
4-asp-[bta8]mj9(灰色虚线)、[
99m
tc]n
4-[hse7]mj9(灰色,砖块)和[
99m
tc]n
4-[α-me-trp8]mj9(灰色,正方形)在p.i.1小时时的选定器官的肿瘤与背景比(n=1)。
[0228]
图17:在携带pc-3肿瘤的cb17-scid小鼠(每只200pmol)上[
99m
tc]n
4-asp-mj9、[
99m
tc]n
4-asp-[bta8]mj9、[
99m
tc]n
4-[hse7]mj9和[
99m
tc]n
4-[α-me-trp8]mj9在p.i.1小时时(顶部)和在p.i.4小时时(底部)的最大强度投影(背侧)。pc-3肿瘤用白色箭头表示。
[0229]
图18:在携带pc-3肿瘤的cb17-scid小鼠(每只100pmol)上[
177
lu]gt50(深灰色,阴影线)、[
177
lu]gt51(深灰色虚线)、[
177
lu]gt52(深灰色,砖块)、[
177
lu]gt53(深灰色,正方形)在p.i.24小时时在选定器官中的生物分布(以%id/g计)。数据表示为平均值
±
sd(n=4)。
[0230]
图19:在携带pc-3肿瘤的cb17-scid小鼠(每只100pmol)上[
177
lu]rm2(顶部)和[
177
lu]amtg(底部)在p.i.1、4、8、24和28小时时的最大强度投影(背侧)。pc-3肿瘤用白色箭头表示。
[0231]
实施例说明了本发明。
[0232]
实施例1:材料和方法(通用)
[0233]
fmoc-(9-芴基甲氧羰基-)和所有其他受保护的氨基酸类似物购自bachem(bubendorf,switzerland)、sigma-aldrich(munich,germany)或iris biotech(marktredwitz,germany)。h-rink酰胺树脂(35目至100目颗粒尺寸,0.4mmol/g至0.6mmol/g载荷)购自sigma-aldrich(munich,germany)。chematech(dijon,france)提供螯合剂dota(
t
bu)3和dotaga(
t
bu)4。
[0234]
所有必需的溶剂和其他有机试剂均购自alfa aesar(karlsruhe,germany)、sigma-aldrich(munich,germany)或vwr(darmstadt,germany)。使用scilogex mx-rl-eanalog rotisserie tube rotator(scilogex,rocky hill,ct,usa)通过手动操作进行肽的固相合成。
[0235]
分析和制备反相高压色谱法(rp-hplc)使用shimadzu梯度系统(shimadzu deutschland gmbh,neufahrn,germany)进行,每个都配备有spd-20a uv/vis检测器(220nm,254nm)。水(0.1%tfa)中不同梯度的乙腈(0.1%tfa)用作所有hplc操作的洗脱剂。
[0236]
对于分析测量,以1ml/分钟的流速使用nucleosil 100 c18(125
×
4.6mm,5μm颗粒尺寸)色谱柱(cs gmbh,langerwehe,germany)。文中引用了特定梯度和相应的保留时间tr以及容量因子k’。
[0237]
以5ml/分钟的恒定流速使用multospher 100rp 18(250
×
10mm,5μm颗粒尺寸)色谱柱(cs gmbh,langerwehe,germany)进行制备型hplc纯化。
[0238]
使用nucleosil 100 c18(5μm,125
×
4.0mm)色谱柱(cs gmbh,langerwehe,germany)进行分析型和制备型放射rp-hplc。
[0239]
用于表征物质的电喷雾电离质谱在expression
l cms质谱仪(advion ltd.,harlow,uk)上获得。通过将紫外光度计的出口连接到来自eg&g ortec(munich,germany)的nai(tl)井型闪烁计数器来检测放射性。
[0240]
放射性探针通过2480自动γ-计数器(perkin elmer,waltham,ma,usa)测量,并使用graphpad prism 6(graphpad software inc.,san diego,ca,usa)测定ic
50
值。
[0241]
对于辐射tlc,使用带有laura
tm
软件的scan-ram
tm
扫描仪(lablogic systems ltd.,broomhill,sheffield,united kindom)。
[0242]
实施例2:合成方案
[0243]
fmoc策略之后的固相肽合成
[0244]
树脂上肽形成
[0245]
将相应的侧链保护的fmoc-aa-oh(1.5当量)溶解在nmp中并通过添加tbtu(1.5当量)、hoat(1.5当量)和dipea(4.5当量)进行预活化。活化10分钟之后,将溶液添加到树脂结合的游离胺肽中,并在室温下振摇1.5小时。随后,树脂用nmp洗涤,在fmoc去保护之后,类似地缀合下一个氨基酸。
[0246]
树脂上fmoc去保护
[0247]
树脂结合的fmoc肽用nmp(v/v)中的20%哌啶处理5分钟,随后处理15分钟。之后,用nmp彻底清洗树脂。
[0248]
树脂上dde去保护
[0249]
通过在室温下添加咪唑(75当量)、盐酸羟胺(100当量)在nmp(7ml)和dcm(3ml)中的溶液3小时进行dde去保护。去保护之后,树脂用nmp洗涤。
[0250]
dota(
t
bu)3或dotaga(
t
bu)4的接合
[0251]
将受保护的螯合剂dota(
t
bu)3或dotaga(
t
bu)4(1.5当量)溶解在nmp中,并通过添加tbtu(1.5当量)、hoat(1.5当量)和dipea(4.5当量)进行预活化。活化10分钟之后,将溶液加入到树脂结合的n端去保护肽(1.0当量)中并在室温下振摇3小时。随后,树脂用nmp和dcm
洗涤。
[0252]
通过酸不稳定保护基团的额外去保护从树脂上裂解肽
[0253]
完全保护的树脂结合肽用dcm洗涤,然后溶解在tfa/tips/dcm(v/v/v;95/2.5/2.5)的混合物中并摇动30分钟。滤出溶液并以相同方式再处理树脂30分钟。将两种滤液合并并在氮气流下浓缩。在将残余物溶解在meoh中并在二乙醚中沉淀之后,倾析液体并将剩余的固体干燥。
[0254]
剩余
t
bu/boc的去保护
[0255]
将粗产物溶解在tfa中并在室温下搅拌6小时,由此进行在从树脂上裂解肽之后剩余的
t
bu/boc保护基团的去除(见上文)。在氮气流下去除tfa之后,获得粗的未保护产物。
[0256]
实施例3:材料和方法(标记实验)
[0257]
冷络合
[0258]
[
nat
ga]镓络合
[0259]
纯化的含螯合剂的配体(在tracepur h2o中10-3
m,1.00当量)和[
nat
ga]ga(no3)3·
6h2o(在tracepur h2o中10mm,1.50当量)用tracepur水稀释至最终浓度10-4
m,然后加热至70℃持续30分钟。冷却至室温之后,获得粗产物。
[0260]
[
nat
lu]镥络合
[0261]
纯化的含螯合剂的配体(在tracepur h2o中10-3
m,1.00当量)和[
nat
lu]lucl3(在tracepur h2o中20mm,2.50当量)用tracepur水稀释至最终浓度为10-4
m,然后加热至95℃持续30分钟。冷却至室温之后,获得粗产物。
[0262]
放射性标记
[0263]
[
125
i]碘标记
[0264]
根据先前公布的程序制备ic
50
研究的参照配体([d-3-[
125
i]i-tyr6]mj9)。简而言之,将0.2mg[d-tyr6]mj9溶解在20μl tracepur水和280μl tris缓冲液(25mm tris hcl,0.4m nacl,ph=7.9)中。将溶液添加至内含150μg(1,3,4,6-四氯-3α,6α-二苯基甘脲,表面结合)的小瓶中之后,添加5.0μl(16mbq)[
125
i]nai(74tbq/mmol,3.1gbq/ml,40mm naoh,hartmann analytic,braunschweig,germany)。将反应溶液在室温下孵育15分钟,然后通过rp-hplc纯化(20分钟内20
→
35%):tr=18.9分钟,k’=10.46。
[0265]
[
177
lu]镥标记
[0266]
用[
177
lu]镥标记是通过使用小组内部开发的程序完成的。因此,含纯化螯合剂配体的溶液(在tracepur h2o中10-3
m,1μl)、乙酸钠缓冲液(1m,ph=5.50,10μl)和约10-30mbq[
177
lu]lucl3(在hcl中0.04m)用hcl(0.04m)稀释至90μl的总体积,然后加热至95℃持续10分钟。标记之后立即添加抗坏血酸钠(0.1m,10μl)以防止辐射分解。[
177
lu]镥的掺入通过放射性tlc(itlc-sg色谱纸,流动相:0.1m柠檬酸三钠)确定。标记化合物的放射化学纯度通过放射rp-hplc确定。
[0267]
[
99m
tc]锝标记
[0268]
使用[
99m
tc]锝标记是使用小组内部开发的程序完成的。因此,将含纯化螯合剂的配体的溶液(在tracepur h2o中10-3
m,5μl)、nahpo4缓冲液(0.05m,ph=11.5、25μl)、柠檬酸钠缓冲液(0.1m,3μl)、sncl2溶液(在抗坏血酸钠溶液(3g/l)中1g/l,5μl)和约50-150mbq[
99m
tco4]-加热至95℃持续10分钟。[
99m
tc]锝的掺入通过放射性tlc(itlc-sg色谱纸,流动
相:等渗nacl)确定。标记化合物的放射化学纯度通过放射rp-hplc确定。
[0269]
实施例4:材料和方法(体外实验)
[0270]
正辛醇-pbs分布系数,logd
7.4
[0271]
在eppendorf管中,将约1mbq的标记示踪剂溶解在1ml的磷酸盐缓冲盐水(pbs,ph=7.4)与正辛醇的1:1混合物(v/v)中。在室温下将悬浮液剧烈混合3分钟之后,将小瓶在9000rpm下离心5分钟(biofuge 15,heraus sepatech,osterode,germany),然后在γ-计数器中测量两层的200μl等分试样。该实验至少重复四次。
[0272]
ic
50
的测定
[0273]
grpr阳性pc-3细胞在dublecco改良eagle培养基/营养混合物f-12与补充有10%胎牛血清的glutamax-i(1:1)(invitrigon)中培养并在37℃下在加湿的5%co2大气中保持。为了确定grpr亲和力(ic
50
),在实验之前24
±
2小时收获细胞并接种在24孔板(1.5
×
105个细胞,1ml/孔)中。
[0274]
去除培养基之后,细胞用500μl hbss(hank's平衡盐溶液(biochrom,berlin,germany,添加1%牛血清白蛋白(bsa))洗涤一次,然后在室温下留在200μl hbss(1%bsa)中9分钟进行平衡。接下来,添加每孔25μl包含作为对照的hbss(1%bsa)或浓度递增的相应配体(hbss中为10-10m–
10-4
m)的溶液,随后添加25μl在hbss(1%bsa)中的[d-3-[
125
i]i-tyr6]mj9(2.0nm)。
[0275]
对于每个浓度,所有实验一式三份进行。在室温下孵育2小时之后,通过去除培养基并用300μl hbss连续冲洗来终止实验。两个步骤的培养基合并为一个馏分,代表游离放射性标记参照的量。之后,用300μl的1m naoh裂解细胞至少15分钟,并与随后洗涤步骤的300μl naoh合并。结合和游离放射性标记参照的量化在γ-计数器中完成。
[0276]
每个配体的ic
50
测定重复两次。
[0277]
内化
[0278]
对于内化研究,在实验之前24
±
2小时收获pc-3细胞并接种在24孔板(1.5
×
105个细胞/孔,1ml)中。去除培养基之后,用500μl dmem/f-12(5%bsa)洗涤细胞一次,并留在200μl dmem/f-12(5%bsa)中在37℃下平衡至少15分钟。每个孔用25μldmem/f-12(5%bsa)或25μl[
nat
lu]rm2(10-3
m)进行阻断处理。接下来,添加25μl的
125
i/
177
lu标记的grpr配体(10nm),并将细胞在37℃下孵育60分钟。
[0279]
通过将24孔板放置在冰上1分钟并连续去除培养基来终止实验。每个孔用300μl冰冷的pbs冲洗,前两步的馏分合并,代表游离放射性标记参照的量。通过将细胞与300μl冰冷的酸洗溶液(0.02m naoac,ph=5.0)在室温下孵育10分钟,然后用300μl冰冷的pbs再次冲洗,可以去除表面结合活性。内化活性通过在300μl naoh(1m)中孵育细胞并与后续用300μl naoh(1m)洗涤步骤的馏分组合来确定。
[0280]
每个实验(控制和阻断)进行六次。游离的、表面结合的和内化的活性在γ-计数器中被量化。数据针对非特异性内化进行校正。
[0281]
血浆研究
[0282]
应用稍作修改的由linder等公布的程序来确定体外代谢稳定性。标记之后立即添加人(200μl)或鼠(100μl)血浆,并将混合物在37℃下孵育72
±
2小时(或6
±
0.5小时)。用冰冷的etoh(150μl[人]、100μl[鼠])和冰冷的mecn(450μl[人]、300μl[鼠])处理蛋白质沉淀,
随后在13000rpm下离心20分钟。倾析上清液并使用放射rp-hplc进一步分析。
[0283]
实施例5:材料和方法(体内实验)
[0284]
所有动物实验均按照德国的一般动物福利法规(德国动物保护法(german animal protection act),18.05.2018修订,art.141 g v.29.3.2017 i 626,批准号rob-55.2-2532.vet_02-18-109)以及动物护理和使用的机构指南(institutional guidelines for the care and use of animals)进行。为了建立肿瘤异种移植物,将pc-3细胞(5
×
106个细胞每200μl)悬浮在dulbecco改良eagle's培养基/ham's f-12(dmem/f-12)与glutamax-i(1:1)和basement membrane matrix type 3(trevigen inc.,gaithersburg,md,usa)的1:1混合物(v/v)中,并皮下接种到6至10周龄雌性cb17-scid小鼠(charles river laboratories international inc.,sulzfeld,germany)的右肩上。当肿瘤体积为125mm3至500mm3(接种之后2至3周)时,使用小鼠进行实验。
[0285]
生物分布
[0286]
将约1至5mbq(100至200pmol)的放射性标记的grpr拮抗剂注射到携带pc-3肿瘤的小鼠的尾静脉中,并在p.i.1、4或24小时(n=4)时处死。取出选定的器官,称重并在γ-计数器(perkin elmer,waltham,ma,usa)中测量。
[0287]
μspect/ct成像
[0288]
在milabs vector4小动物spect/pet/oi/ct设备(milabs,utrecht,the netherlands)上进行成像研究。使用milabs rec软件(版本10.02)和基于像素的相似性调节有序子集期望最大化(similarity-regulated ordered subsets expectation maximization,srosem)算法重建数据,随后使用pmod4.0软件(pmod technologies llc,zurich,switzerland)进行数据分析。对于spect研究,用异氟醚麻醉小鼠,并在尾静脉中注射2至4mbq(100至200pmol)的放射性标记示踪剂。在p.i.1和28小时时内记录静态图像。使用he-gp-rm准直器和逐步多平面床移动的采集时间为45至60分钟。
[0289]
实施例6:结果
[0290]
grpr参照配体
[0291]
rm2(2)
[0292][0293]
neobomb1(3)
[0294][0295]
本发明的示例性合成的拮抗性grpr配体
[0296]
[hse7]mj9-dota(4)
[0297][0298]
[bta8]mj9-dota(5)
[0299][0300]
amtg(6)
[0301][0302]
amtg2(7)
[0303][0304]
hplc
[0305]
[
nat
ga]rm2(15分钟内10
→
90%mecn):tr=6.7分钟,k
‘
=3.47。
[0306]
计算的单一同位素质量(c
78h115
gan
20o19
):1704.8,实测值:m/z=1706.6[m+h]
+
,854.1[m+2h]
2+
。
[0307]
[
nat
ga]dota-[hse7]mj9(15分钟内10
→
90%mecn):tr=6.8分钟,k
‘
=3.53。
[0308]
计算的单一同位素质量(c
77h114
gan
19o19
):1677.8,实测值:m/z=1679.3[m+h]
+
,840.4[m+2h]
2+
。
[0309]
[
nat
ga]dota-[bta8]mj9(15分钟内10
→
90%mecn):tr=7.0分钟,k
‘
=3.67。
[0310]
计算的单一同位素质量(c
78h114
gan
19o19
s):1721.7,实测值:m/z=1723.7[m+h]
+
,862.3[m+2h]
2+
。
[0311]
[
nat
ga]amtg(15分钟内10
→
90%mecn):tr=6.9分钟,k
‘
=3.60。
[0312]
计算的单一同位素质量(c
79h117
gan
20o19
):1718.8,实测值:m/z=1720.0[m+h]
+
,860.6[m+2h]
2+
。
[0313]
[
nat
ga]amtg2(15分钟内10
→
90%mecn):tr=6.9分钟,k
‘
=3.31。
[0314]
计算的单一同位素质量(c
82h121
gan
20o21
):1790.8,实测值:m/z=896.3[m+2h]
2+
,1792.6[m+h]
+
。
[0315]
[
nat
lu]rm2(15分钟内10
→
90%mecn):tr=6.6分钟,k
‘
=3.40。
[0316]
计算的单一同位素质量(c
78h115
lun
20o19
):1810.8,实测值:m/z=1812.2[m+h]
+
,906.8[m+2h]
2+
。
[0317]
[
nat
lu]dota-[hse7]mj9(15分钟内10
→
90%mecn):tr=6.8分钟,k
‘
=3.53。
[0318]
计算的单一同位素质量(c
77h114
lun
19o19
):1783.8,实测值:m/z=1784.9[m+h]
+
,893.6[m+2h]
2+
。
[0319]
[
nat
lu]dota-[bta8]mj9(15分钟内10
→
90%mecn):tr=7.0分钟,k
‘
=3.67。
[0320]
计算的单一同位素质量(c
78h114
lun
19o19
s):1827.8,实测值:m/z=1828.9[m+h]
+
,915.1[m+2h]
2+
。
[0321]
[
nat
lu]amtg(15分钟内10
→
90%mecn):tr=6.8分钟,k
‘
=3.53。
[0322]
计算的单一同位素质量(c
79h117
lun
20o19
):1824.8,实测值:m/z=1826.3[m+h]
+
,913.6[m+2h]
2+
。
[0323]
[
nat
lu]amtg2(15分钟内10
→
90%mecn):tr=7.0分钟,k
‘
=3.38。
[0324]
计算的单一同位素质量(c
82h121
lun
20o21
):1896.8,实测值:m/z=949.5[m+2h]
2+
,1897.6[m+h]
+
。
[0325]
[
nat
lu]neobomb1(15分钟内10
→
90%mecn):tr=9.6分钟,k
‘
=5.00。
[0326]
计算的单一同位素质量(c
77h107
lun
18o18
):1746.7,实测值:m/z=874.5[m+2h]
2+
,1747.3[m+h]
+
。
[0327]
亲水性测定(正辛醇-pbs分布系数,logd
7.4
)
[0328]
确定的
177
lu标记化合物的正辛醇/pbs分布系数(logd
7.4
)列于表2。对于所有化合物,dota或dotaga都用作螯合剂。在
177
lu标记的grpr配体内,发现参照rm2是最亲水的,而3-苯并噻吩基丙氨酸(bta)修饰的衍生物是最亲脂的。
[0329]
表2:放射性标记grpr配体的分布系数(logd
7.4
值)。数据表示为平均值
±
sd(n=8)。
[0330][0331]
grpr亲和力的测定
[0332]
合成的化合物显示出相似范围内的亲和力,而高丝氨酸衍生物的亲和力略有下降。所有的[
nat
ga]镓络合配体因其的[
nat
lu]镥络合对应物而产生了更高的亲和力(表3)。冷标准[d-3-i-tyr6]mj9显示出特别高的亲和力,表明其适合作为所有ic
50
实验的竞争性放射
性标记参照。
[0333]
表3:合成的铃蟾肽拮抗剂对grpr的结合亲和力。使用pc-3细胞(1.5
×
105个细胞/孔)和[d-3-[
125
i]i-tyr6]mj9(c=0.2nm)作为放射性标记参照(2小时,室温,hbss+1%bsa)。数据表示为平均值
±
sd(n=3)。
[0334][0335]
内化
[0336]
为了证明修饰的基于抑胃酶氨酸的grpr配体的拮抗特性,确定了pc-3细胞的内化。正如拮抗剂所预期的那样,所有
177
lu标记的化合物都显示出低内化(表4)。[
177
lu]rm2的内化与其他已公开研究的结果显示出良好的相关性。
[0337]
表4:在pc-3细胞(37℃,dmem/f-12+5%bsa,1.5
×
105个细胞孔)确定的1小时内化活性(c=1nm)的总结,作为所用活性的%。针对非特异性结合(10-3
m[
nat
lu]rm2)对数据进行校正,并表示为平均值
±
sd(n=6)。
[0338][0339]
血浆研究
[0340]
在人血浆中确定了合成的grpr配体的体外稳定性(图1至4),而在鼠血浆中进一步分析了稳定的配体[
177
lu]amtg以及参照[
177
lu]rm2。因此,在标记完成之后立即将仅100μl鼠血浆添加到示踪溶液(最终体积为200μl)中。根据林德等(bioconjugate chem.20,1171-1178(2009)),代谢在鼠血浆中比在人血浆中更快,因此在37℃下孵育6
±
0.5小时之后终止
实验(图5和图6)。然而,由于体积较小,在37℃下孵育72
±
2小时之后额外检查了鼠混合物(图7和图8)。
[0341]
在37℃下孵育72
±
2小时之后,比较人血浆中所有四种
177
lu标记的grpr配体(图1至图4),完整示踪剂的量显示出显着差异。在该时间跨度之后,参照配体[
177
lu]rm2(图1)的体外稳定性确定为仅33.5
±
2.7%,而[
177
lu]dota-[hse7]mj9(40.1
±
1.4%)以及[
177
lu]amtg(77.6
±
10.1%)在37℃下孵育72
±
2小时之后更高。在这四种化合物中,亲脂性最强的衍生物[
177
lu]dota-[bta8]mj9(19.0
±
1.7%)表现出最低的稳定性。第二个参照配体[
177
lu]neobomb1在相同的时间跨度之后表现出60.8
±
1.2%的完整示踪剂量。
[0342]
在鼠血浆中进一步检查了参照化合物[
177
lu]rm2(图5和图7)以及稳定的衍生物[
177
lu]amtg(图6和图8),以确定人血浆与动物血浆之间可能存在的差异。根据linder等,约6小时之后鼠血浆中的代谢与约3天之后在人血浆中的代谢相当。因此,在鼠血浆中6小时之后测定了这两种配体的稳定性,显示出可比较量的完整[
177
lu]amtg(tr=17.0分钟,分别为图6,89%以及图4,92%),但[
177
lu]rm2的完整配体有显著偏差(tr=15.5分钟,分别为图5,92%以及图1,36%)。
[0343]
在更长时间跨度之后(在37℃下孵育72
±
2小时)对鼠血浆中这两种示踪剂的检查表明,[
177
lu]rm2(图7)在比[
177
lu]amtg(图8)更多的位点被鼠内肽酶切割,但尽管如此,完整示踪剂的量似乎更高(分别为67%和59%),这导致人们假设人血浆与动物血浆之间存在重大差异,尤其是对于参照化合物。
[0344]
考虑到这些观察结果,稳定的[
177
lu]amtg在人体内表现出优于参照配体的性能,但在小鼠体内不一定如此。
[0345]
生物分布和μspect/ct研究
[0346]
在cb17-scid小鼠中在p.i.1小时和p.i.24小时检查参照化合物[
177
lu]rm2以及诊断性配体[
177
lu]dota-[hse7]mj9和[
177
lu]dota-[bta8]mj9的体内药代动力学,而治疗性配体[
177
lu]amtg、[
177
lu]amtg2和第二个参照[
177
lu]neobomb1仅在p.i.24小时进行研究(每只100pmol)。数据与图9至图12中所示的参照进行比较。
[0347]
与小鼠中的参照配体相比,在p.i.1h时,两种不稳定的化合物都显示出优异的药代动力学曲线(图9和图10)。对于每个器官,诊断性配体的摄取等于或低于参照值,尤其是对于grpr阳性胰腺,这强调了从该器官更快清除,这可能是由于不稳定位置处更高代谢引起的。有趣的是,这两种诊断性配体的肿瘤摄取都优于参照化合物(图9),这导致肿瘤富集可能达到更高水平的假设,如通过[
177
lu]rm2可以实现的。此外,由于肿瘤中的代谢不如非肿瘤器官中那么快,因此,尽管诊断性衍生物中的键不稳定,在p.i.1小时时也没有来自肿瘤的负面清除作用。
[0348]
如肿瘤与背景比所示(图10),[
177
lu]dota-[hse7]mj9显示出在p.i.1小时时肿瘤与非肿瘤器官之间的对比度最高,而参照显示为这三个中最差的。
[0349]
为了可能用于治疗目的的应用,在p.i.24小时时在cb17-scid小鼠中研究了三种配体以及[
177
lu]neobomb1和稳定的[
177
lu]amtg和[
177
lu]amtg2(图11和图12)。药代动力学曲线证实了在较长时间跨度之后从肿瘤中更快清除不稳定配体的建议。虽然所有四种比较配体在正常组织中的保留相似,但肿瘤保留存在显著差异,因为肿瘤中仍有大量[
177
lu]rm2、[
177
lu]amtg和[
177
lu]amtg2,但只有少量不稳定的化合物。[
177
lu]neobomb1也显示出高
肿瘤保留,但也显示高胰腺保留。所有衍生物的骨摄取都可以通过没有被各自的螯合剂完全络合的[
177
lu]lucl3来解释(图11)。
[0350]
[
177
lu]rm2、[
177
lu]amtg和[
177
lu]amtg2在p.i.24小时时显示比该系列的其他衍生物更高的肿瘤保留(图11)。考虑到该时间跨度之后的肿瘤与背景比,[
177
lu]amtg和[
177
lu]amtg2表现出优异的肿瘤与血液比以及肿瘤与肌肉比(图12)。不稳定的配体以及[
177
lu]neobomb1的肿瘤与背景比均低于参照。在携带pc-3肿瘤的小鼠(每只100pmol)上[
177
lu]rm2和[
177
lu]amtg在p.i.1、4、8、24和28小时时的成像研究显示随时间的体内分布(图19)。两种缀合物均表现出良好的药代动力学,均显示出从grpr阳性组织(胰腺、肠)的快速清除和在肿瘤中的高保留。在[
177
lu]amtg的情况下,背景活性的清除速度较慢,尤其是从胰腺中清除,这是由于体内代谢稳定性增加而预期的。
[0351]
总之,考虑到结果,两种不稳定的配体在p.i.1小时时在小鼠中的表现都优于参照,但在p.i.24小时时在小鼠中的表现明显较差,这与[
177
lu]dota-[bta8]mj9与血浆研究中的观察结果良好相关,因为该化合物在体外显示出最低的代谢稳定性。如前所述,非肿瘤组织中的代谢比肿瘤组织中的代谢更快,这导致了众所周知的grpr拮抗剂的清除作用。在p.i.1小时时gln
7-trp8键的进一步不稳定导致从背景中(而不是从肿瘤中)更快地清除,这与参照相比产生了更好的对比度。然而,在更长的时间跨度后,可以观察到明显更快的肿瘤清除,这证实了更多亲脂性的[
177
lu]dota-[bta8]mj9的酶促降解增加的假设。因此,其可能是有用的诊断剂。
[0352]
另一种不稳定的衍生物[
177
lu]dota-[hse7]mj9在人血浆中没有表现出较小的体外稳定性,但其在小鼠体内的行为表现出较低稳定性,因为它表现出在p.i.1小时时从非肿瘤组织中更快地清除。并且在p.i.24小时时在肿瘤内的少量保留,这证实了较低代谢稳定性的建议。
[0353]
考虑到体外和体内的结果,稳定的化合物[
177
lu]amtg表现出特别好的整体性能。与[
177
lu]rm2相比,它对表达grpr的pc-3细胞具有良好的亲和性、合理的亲脂性、最高的在人体血浆中代谢稳定性以及相同或增强的药代动力学特性。由于其在人血浆中的体外代谢稳定性增强,amtg可能具有与grpr靶向配体(rm2,neobomb1)中的目前黄金标准竞争甚至优于该黄金标准以用于男性表达grpr的恶性肿瘤的靶向放疗的潜力。
[0354]
实施例7:含[
99m
tc]n4的配体
[0355]
经检查的化合物
[0356]n4-asp
4-pip
5-d-phe
6-gln
7-trp
8-ala
9-val
10-gly
11-his
12-sta
13-leu
14-nh2(8)
[0357][0358]n4-asp
4-pip
5-d-phe
6-gln
7-bta
8-ala
9-val
10-gly
11-his
12-sta
13-leu
14-nh2(9)
[0359][0360]n4-pip
5-d-phe
6-hse
7-trp
8-ala
9-val
10-gly
11-his
12-sta
13-leu
14-nh2(10)
[0361][0362]n4-pip
5-d-phe
6-gln
7-α-me-trp
8-ala
9-val
10-gly
11-his
12-sta
13-leu
14-nh2(11)
[0363][0364]
体外数据
[0365]
确定的正辛醇/pbs分布系数(logd
7.4
)以及
9m
tc标记化合物对grpr的结合亲和力(ic
50
)列于表5。对于所有化合物,n4(6-(羧基))-1,4,4,11-四氮杂十一烷)用作螯合剂。表5:分布系数(logd
7.4
值)以及[
99m
tc]n
4-asp-mj9(8)、[
99m
tc]n
4-asp-[bta8]mj9(9)、[
99m
tc]n
4-[hse7]mj9(10)和[
99m
tc]n
4-[α-me-trp8]mj9(11)对grpr的结合亲和力(ic
50
)。在pc-3细胞(1.5
×
105个细胞/孔)并且[d-3-[
125
i]i-tyr6]mj9(c=0.2nm)作为放射性标记的参照来确定结合亲和力(2小时,室温,hbss+1%bsa)。mj9:pip
5-d-phe
6-gln
7-α-me-trp
8-ala
9-val
10-gly
11-his
12-sta
13-leu
14-nh2。
[0366][0367]
在该系列中,发现[
99m
tc]n
4-asp-mj9是最亲水的,而其他三种化合物显示出相似但更亲油的值。所有缀合物表现出在相当低的纳摩尔范围内的ic
50
值(未标记)。然而,与该系列的其他两个配体相比,高丝氨酸和α-甲基色氨酸衍生物表现出略微下降的grpr亲和力。
[0368]
体内数据
[0369]
对cb17-scid小鼠上在p.i.1和4小时时(各200pmol)
99m
tc标记的配体(8)、(9)、
(10)和(11)的体内药代动力学进行了研究。[
99m
tc]n
4-asp-mj9(8)、[
99m
tc]n
4-asp-[bta8]mj9和[
99m
tc]n
4-[hse7]mj9在p.i.1小时时表现出优异的药代动力学,具有高肿瘤积累和低总体背景积累(图13)。[
99m
tc]n
4-asp-[bta8]mj9表现出在grpr阳性胰腺中最低的摄取,这强调了由于不稳定位置处代谢率较高而导致从该器官更快地清除。[
99m
tc]n
4-[hse7]mj9显示了该系列中最高的肿瘤摄取和第二低的胰腺摄取。[
99m
tc]n
4-[α-me-trp8]mj9显示了最高的胰腺积累,这可能是由α-甲基色氨酸修饰增强了代谢稳定性导致的,如前几节所述。在p.i.1小时时的肿瘤与背景比主要有利于[
99m
tc]n
4-asp-mj9,因此有利于由于额外的天冬氨酸修饰而增强的亲水性(图14)。然而,假设在[
177
lu]dota-asp-[bta8]mj9和[
177
lu]dota-[hse7]mj9的情况下如果两种化合物确实显示出与[
99m
tc]n
4-asp-mj9相似的亲水性,则肿瘤与背景比将有所提高。
[0370]
在p.i.4小时时的生物分布研究强调了这些
99m
tc标记的配体在体内的时间过程(图15)。而[
99m
tc]n
4-[α-me-trp8]mj9显示了与p.i.1小时时相比增强的肿瘤积累,该系列的所有其他衍生物显示降低的肿瘤值。这进一步加强了由于α-甲基色氨酸修饰而增加代谢稳定性的建议。在[
99m
tc]锝的情况下,这是不期望的,因为对于诊断而言,在p.i.1小时时的高肿瘤摄取(并且不仅在p.i.4小时时)以及从背景器官中更快清除是期望的。然而,这种修饰对于治疗化合物,例如对于上述
177
lu标记的配体非常有用。由于从背景器官中更快清除有利于诊断化合物,[
99m
tc]n
4-asp-[bta8]mj9因为其增强的代谢不稳定性而具有理想的用途,这通过在大多数器官中在p.i.4小时时的摄取值而被强调。在p.i.4小时时的肿瘤与背景比示于图16中,显示了对于大多数器官[
99m
tc]n
4-asp-mj9和[
99m
tc]n
4-[hse7]mj9最高。
[0371]
由去稳定修饰高丝氨酸和3-苯并噻吩基丙氨酸导致的在p.i.1小时时的优异对比度另外通过μspect/ct成像而被强调(图17)。与未修饰的[
99m
tc]n
4-asp-mj9相比,[
99m
tc]n
4-asp-[bta8]mj9和[
99m
tc]n
4-[hse7]mj9都显示出略微增强的对比度,尽管它们增加了亲脂性。正如预期的那样,[
99m
tc]n
4-[α-me-trp8]mj9与其他三种衍生物相比表现出较差的对比度,因为增加的代谢稳定性导致胰腺和肠道清除减慢,这不利于诊断。
[0372]
实施例8:铃蟾肽-sifa衍生物
[0373]
经检查的化合物
[0374]
[lu]gt50mj9dapornaspaspdap([lu]dotaga)dap(sifa)eue[lu]gt51mj9dapasporndap([lu]dotaga)dap(sifa)eue [lu]gt52mj9pippipaspdap([lu]dotaga)dap(sifa)eue [lu]gt53mj9pipaspdap([lu]dotaga)dap(sifa)eue
ꢀꢀ
[0375]
mj9:h2n-leu-sta-his-gly-val-ala-trp-gln-d-phe-pip-[0376]
体外数据
[0377]
确定的正辛醇/pbs分布系数(logd
7.4
)以及铃蟾肽-sifa化合物对grpr的结合亲和力(ic
50
)列于表6。对于所有化合物,dotaga用作螯合剂。
[0378]
表6:分布系数(logd
7.4
值)以及
177/nat
lu标记的gt50、gt51、gt52和gt53对grpr的结合亲和力(ic
50
)。在pc-3细胞(1.5
×
105个细胞/孔)上并且[d-3-[
125
i]i-tyr6]mj9(c=0.2nm)作为放射性标记的参照来确定结合亲和力(2小时,室温,hbss+1%bsa)。
[0379][0380]
该系列的所有四种化合物都显示出相似的亲水性。[
177
lu]gt50和[
177
lu]gt52的ic
50
值在相当的范围内,而[
177
lu]gt51和[
177
lu]gt53的ic
50
值略有增加。
[0381]
生物分布研究
[0382]
所有四种化合物均包含用于
18
f标记的sifa部分以及用于
68
ga标记或
177
lu标记的螯合剂。这是一个有用的特征,因为基于放射性杂化物的配体提供了理想的治疗诊断对,因为它们在化学上无法区分,无论是使用[
18
f][
nat
ga/
nat
lu]配体还是[
19
f][
68
ga/
177
lu]配体。在cb17-scid小鼠上评估
177
lu标记的配体gt50、gt51、gt52和gt53在p.i.24小时时(每只100pmol)的生物分布。除肝脏和肾脏外,所有衍生物均表现出较低的总体背景保留(图18)。与[
177
lu]rm2、[
177
lu]amtg和[
177
lu]amtg2相比,肿瘤保留减少(图11)。所有铃蟾肽-sifa缀合物都必须进行优化,尤其是考虑到高肾脏保留和略微增强的肝保留。然而,本系列中评估的配体证明了基于放射性杂化物的概念的功能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1