用于核医学细胞毒性双重治疗诊断的智能给药系统和药盒的制作方法
用于核医学细胞毒性双重治疗诊断的智能给药系统和药盒
1.本发明涉及用于核医学-细胞毒性双重治疗诊断的智能药物递送系统和药盒。
2.所述智能给药系统包括
[0003]-具有以下结构的第一化合物
[0004]
ct-l1-chel-s1-tv;
[0005]
或
[0006][0007]
其中cp=ch或n
[0008]
或者
[0009]-具有结构chel-s-tv的第二化合物和具有结构ct-l-tv的第三化合物;
[0010]
其中,在第一、第二和第三化合物中,chel是用于络合放射性同位素的螯合剂的残基;ct是细胞毒性化合物的残基;tv是生物靶向载体;l1和l分别是接头;s1、s2和s分别是间隔子。
[0011]
所述药盒由以下各项组成
[0012]
–
第一容器,其具有第一化合物或包含第一化合物的第一载体物质;
[0013]
或者
[0014]
–
第二容器,其具有第二化合物或含有第二化合物的第二载体物质,
[0015]
和
[0016]
第三容器,其具有第三化合物或包含第三化合物的第三载体物质;
[0017]
其中
[0018]
第一个化合物具有结构
[0019]
ct-l1-chel-s1-tv;
[0020]
或
[0021][0022]
其中cp=ch或n
[0023]
第二化合物具有结构chel-s-tv;
[0024]
且第三化合物具有结构ct-l-tv;
[0025]
其中
[0026]
chel是用于络合放射性同位素的螯合剂的残基;ct是细胞毒性化合物的残基;tv是生物靶向载体;l1和l分别是接头;s1、s2和s分别是间隔子。
[0027]
细胞毒性药物,例如多柔比星,已在化疗中使用了数十年。在常规全身化疗中,细
胞毒性药物以相对高的剂量通过静脉内、口服或腹膜给药。与癌细胞一样,细胞毒性药物也会损害健康组织,尤其是分裂率高的细胞,并引起严重的副作用,其中一些会危及生命,经常迫使治疗的中止。
[0028]
为了减轻副作用,对肿瘤细胞具有高结合亲和性的低剂量靶向细胞毒性药物已经使用了数年。肿瘤亲和性是通过与细胞毒性活性成分缀合的靶向载体介导的。靶向载体通常是膜结合蛋白的激动剂(底物)或拮抗剂(抑制剂),与健康体细胞相比,这些蛋白在肿瘤细胞的包膜上显著过度表达。靶向载体包括简单的有机化合物、具有天然或衍生氨基酸的寡肽和适体。
[0029]
此外,近15年来,影像核医学诊断方法在临床治疗中的应用程度越来越高,例如正电子发射断层扫描(pet)和单光子发射计算机断层扫描(spect)。治疗诊断方法最近也越来越重要。
[0030]
癌症的成像核医学诊断和治疗(治疗诊断学)有助于和补充化疗。
[0031]
在核医学诊断和治疗学中,肿瘤细胞用放射性同位素标记或照射,例如
68
ga或
177
lu。这涉及使用共价(
18
f)或配位(
68
ga、
99m
tc、
177
lu)结合相应放射性同位素的标记前体。在金属放射性同位素的情况下,标记前体包括螯合剂,作为放射性同位素有效和稳定络合的必要化学成分,以及作为功能成分的生物靶向载体(可与肿瘤组织中的靶标结构结合,尤其是膜-结合的蛋白质)。
[0032]
对癌细胞具有高亲和性的靶向载体同样适用于靶向化疗以及核医学诊断和治疗诊断。因此,这些学科的研究是相辅相成的。
[0033]
静脉注射到血液循环后,与放射性同位素络合的核医学标记前体在肿瘤细胞上或肿瘤细胞内积聚。为了最大限度地减少健康组织中的辐射剂量,在诊断检查中使用少量半衰期为数小时至数天的放射性同位素。
[0034]
螯合剂改变了靶向载体的构型和化学性质,通常显著影响其对肿瘤细胞的亲和性。因此,螯合剂和至少一种靶向载体之间的偶联是在复杂的试错试验或所谓的生化筛选中定制的。这涉及合成大量包含螯合剂和靶向载体的标记前体,特别是量化对肿瘤细胞的亲和性。螯合物和与靶向载体的化学偶联对于各自标记前体的生物和核医学效力至关重要。
[0035]
除了高亲和性外,标记前体还必须满足进一步的要求,例如
[0036]
–
各放射性同位素的快速有效络合或共价结合;
[0037]
–
相对于健康组织对肿瘤细胞的高选择性;
[0038]
–
体内稳定性,即生理条件下血清中的生化稳定性。
[0039]
前列腺癌
[0040]
对于发达国家的男性来说,前列腺癌是最常见的癌症类型,也是第三大致命癌症。在这种疾病中,肿瘤的生长是逐渐进行的,在早期诊断的情况下,5年生存率接近100%。如果仅在肿瘤转移时才发现癌症,则存活率会急剧下降。另一方面,对肿瘤采取过早和过于激进的行动可能会不必要地损害患者的生活质量。例如,手术切除前列腺会导致失禁和阳痿。关于疾病阶段的可靠诊断和信息对于成功治疗并为患者提供高质量的生活至关重要。除了医生的前列腺触诊外,一种常见的诊断方法是确定患者血液中的肿瘤标志物。前列腺癌最显著的标志物是血液中前列腺特异性抗原(psa)的浓度。然而,psa浓度的意义是有争议的,
因为该值轻微升高的患者通常没有前列腺癌,但15%的前列腺癌患者血液中的psa浓度没有升高。用于诊断前列腺肿瘤的另一个目标结构是前列腺特异性膜抗原(psma)。与psa相比,无法在血液中检测到psma。它是一种具有酶活性的膜结合糖蛋白。其功能是从n-乙酰-天冬氨酰-谷氨酸(naag)和叶酸-(聚)-γ-谷氨酸中消除c-末端谷氨酸。psma几乎不存在于正常组织中,但在前列腺癌细胞中显著过表达,其表达与肿瘤分期密切相关。前列腺癌的淋巴结和骨转移也显示出40%的psma表达。
[0041]
psma分子靶向的一种策略在于将抗体与psma的蛋白质结构结合。另一种方法是利用psma的酶活性,这是众所周知的。在psma的酶结合袋中,有两个结合谷氨酸的zn
2+
离子。芳香族结合袋位于两个zn
2+
离子中心的前面。该蛋白质能够扩展以适应结合伴侣(诱导契合),因此它不仅可以结合naag,还可以结合叶酸,其中蝶酸基团停靠在芳香族结合口袋内。利用psma的酶促亲和性使底物能够被摄入到细胞中(内吞作用),而与底物的酶促切割无关。
[0042]
因此,psma抑制剂特别适合作为成像诊断和治疗诊断放射性药物或放射性示踪剂的靶向载体。放射性标记的抑制剂与酶的活性位点结合,但不会在那里转化。抑制剂和放射性标记之间的结合因此没有分开。在胞吞作用的促进下,带有放射性标记的抑制剂被摄入细胞中并在肿瘤细胞中积累。
[0043]
对psma具有高亲和性的抑制剂(图示1)通常含有谷氨酸基序和酶促不可切割结构。一种高效的psma抑制剂是2-膦酰基甲基戊二酸或2-膦酰基甲基戊二酸(2pmpa),其中谷氨酸基序与通过psma不能切割的膦酸酯基团结合。另一组psma抑制剂,其用于临床相关放射性药物psma-11(图示2)和psma-617(图示3),是基于尿素的抑制剂。
[0044]
除了谷氨酸基序的结合口袋之外,处理psma的芳香族结合口袋已经证明是有利的。例如,在高效的放射性药物psma11中,l-赖氨酸-脲-l-谷氨酸(kue)结合基序通过己基(己基接头)与芳香族hbed螯合剂(n,n'-双(2-羟基-5-(乙烯-β-羧基)苄基)乙二胺n,n'-二乙酸酯)结合。
[0045]
相反,如果l-赖氨酸-脲-l-谷氨酸(kue)与非芳香族螯合剂dota(1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸酯)结合,被证实在肿瘤组织中的亲和性和积累会降低。然而,为了将dota螯合剂能用于具有治疗性放射性同位素(例如177lu或225ac)的psma亲和的放射性药物,必须调适接头。通过用各种芳香结构目标取代己基,发现了目前的金标准高效放射性药物psma-617。
[0046][0047]
图示1:psma抑制剂
[0048][0049]
图示2:标记前体psma-11
[0050][0051]
图示3:标记前体psma-617
[0052]
肿瘤间质
[0053]
许多肿瘤包含恶性上皮细胞,并被多种非致癌细胞群包围,包括活化的成纤维细胞、内皮细胞、周细胞、免疫调节细胞和细胞外基质中的细胞因子。这些围绕肿瘤的所谓基质细胞在癌的发展、生长和转移中起重要作用。大部分基质细胞是活化的成纤维细胞,称为癌症相关成纤维细胞(caf)。在肿瘤进展过程中,caf会改变其形态和生物学功能。这些改变是由癌细胞和caf之间的细胞间通讯诱导的。caf在这里形成了促进癌细胞生长的微环境。已经表明,仅针对癌细胞的疗法是不够的。有效的疗法必须包括肿瘤微环境,即caf。在超过90%的人类癌症中,caf过表达成纤维细胞活化蛋白(fap)。因此,fap代表了核医学诊断和治疗诊断的一个有希望的攻击点。与psma类似,尤其是fap抑制剂(fapi或fapi)是适合fap标记前体的亲和的生物靶向载体。fap具有通过相同活性中心催化的二肽基肽酶(dpp)和脯
氨酰寡肽酶(prep)的双峰活性。因此,有两种可能的抑制剂类型可抑制fap的dpp活性和/或prep活性。已知的fapprep活性抑制剂对fap的选择性低。然而,在fap和prep都过表达的癌症类型中,尽管fap选择性低,但prep抑制剂也可能适合作为靶向载体。
[0054]
图示4显示了dota缀合的fap标记前体,其中螯合剂与药效团单元偶联((s)-n-(2-(2-氰基-4,4-二氟吡咯烷-1-基)-2-氧基乙基)-6-(4-氨基丁氧基)-喹啉-4-甲酰胺通过4-氨基丁氧基官能团偶联到喹啉上。
[0055][0056]
图示4:dota缀合的fap标记前体
[0057]
骨转移
[0058]
骨转移瘤表达法尼基焦磷酸合酶(fpps),它是hmg-coa还原酶(甲羟戊酸)途径中的一种酶。通过fpps的抑制压制了法尼基的产生,法尼基是信号蛋白与细胞膜对接的重要分子。结果,诱导了致癌骨细胞的凋亡。fpps受到双膦酸类药物的抑制,例如阿仑膦酸、帕米膦酸和唑来膦酸。例如,具有靶向载体帕米膦酸的示踪剂bpamd经常用于治疗骨转移。
[0059]
已发现用于骨转移治疗诊断的一种特别有效的示踪剂是唑来膦酸(zol),它是一种具有杂芳族n单元的羟基双膦酸。与螯合剂nodaga和dota缀合的唑来膦酸(图示5)是目前最有效的骨转移放射治疗剂。
[0060][0061]
图示5:dota唑来膦酸(左)和nodaga唑来膦酸(右)示踪剂
[0062]
现有技术公开了多种用于用放射性同位素诊断和治疗癌症的标记前体。
[0063]
wo 2015055318 a1公开了用于前列腺癌或上皮癌的诊断和治疗诊断的放射性示踪剂,例如尤其是图示3中所示的化合物psma-617。
[0064]
本发明的一个目的是提供用于核医学-细胞毒性双重治疗诊断的药物化合物和药盒。
[0065]
该目的是通过一种智能药物输送系统实现的,该系统包括
[0066]
–
具有以下结构的第一化合物
[0067]
ct-l1-chel-s1-tv;
[0068]
或
[0069][0070]
其中cp=ch或n;
[0071]
或者
[0072]-具有结构chel-s-tv的第二化合物和具有结构ct-l-tv的第三化合物;
[0073]
其中,在第一、第二和第三化合物中,
[0074]
chel是用于络合放射性同位素的螯合剂的残基;ct是细胞毒性化合物的残基;tv是生物靶向载体;l1和l分别是接头;s1、s2和s分别是间隔子。
[0075]
本发明还提供了一种用于核医学
–
细胞毒性双重治疗诊断的药盒,其包括:
[0076]
–
第一容器,其具有第一化合物或包含第一化合物的第一载体物质;
[0077]
或者
[0078]
–
第二容器,其具有第二化合物或含有第二化合物的第二载体物质,
[0079]
和
[0080]
第三容器,其具有第三化合物或包含第三化合物的第三载体物质;
[0081]
其中
[0082]
第一个化合物具有结构
[0083]
ct-l1-chel-s1-tv;
[0084]
或
[0085][0086]
其中cp=ch或n;
[0087]
第二化合物具有结构chel-s-tv;
[0088]
第三化合物具有结构ct-l-tv;
[0089]
其中
[0090]
chel是用于络合放射性同位素的螯合剂的残基;ct是细胞毒性化合物的残基;tv是生物靶向载体;l1和l分别是接头;s1、s2和s分别是间隔子。
[0091]
本发明还涉及一种用于核医学
–
细胞毒性双重治疗诊断的化合物,具有以下结构
[0092]
ct-l1-chel-s1-tv;
[0093]
其中
[0094]
chel是用于络合放射性同位素的螯合剂的残基;ct是细胞毒性化合物的残基;tv是生物靶向载体;l1是接头;s1是间隔子。
[0095]
本发明还涉及一种用于核医学
–
细胞毒性双重治疗诊断的化合物,具有以下结构
[0096][0097]
其中cp=ch或n;
[0098]
其中
[0099]
chel是用于络合放射性同位素的螯合剂的残基;ct是细胞毒性化合物的残基;tv是生物靶向载体;l1是接头;s1和s2分别是间隔子。
[0100]
根据本发明的智能药物递送系统、药盒和化合物的有利实施形式ct-l1-chel-s1-tv和
[0101]
其中cp=ch或n
[0102]
特征在于
[0103]
–
tv是选自结构[1]至[18]之一的靶向载体
[0104]
[0105][0106]
z=h,oh,nh2或cl
[0107][0108]
其中结构[1]至[8]和[18]表示氨基酸序列;
[0109]
–
l和l1独立地具有选自以下的结构
[0110][0111]
其中m1、m2、m3、m4、m5、m6、m7、m8和m9独立地选自包含以下各项的组:酰胺
–
、羧酰胺
–
、次膦酸盐
–
、烷基
–
、三唑
–
、硫脲
–
、乙烯
–
、马来酰亚胺
–
残基、
–
(ch2)
–
、
–
(ch2ch2o)
–
、
–
ch2–
ch(cooh)
–
nh
–
和
–
(ch2)mnh
–
且其中m=1,2,3,4,5,6,7,8,9或10;和
[0112]
n1,n2,n3,n4,n5,n6,n7,n8和n9独立地选自集合{0,1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20};
[0113]-qs是一种方酸残基
[0114][0115]-clv是可切割基团;
[0116]-s与l相同(s=l);和/或
[0117]-s、s1和s2独立地具有选自以下的结构
[0118][0119]
其中o1,o2和o3独立地选自包含以下各项的组:酰胺
–
、羧酰胺
–
、次膦酸盐
–
、烷基
–
、三唑
–
、硫脲
–
、乙烯
–
、马来酰亚胺
–
残基、
–
(ch2)
–
,
–
(ch2ch2o)
–
,
–
ch2–
ch(cooh)
–
nh
–
和
–
(ch2)qnh
–
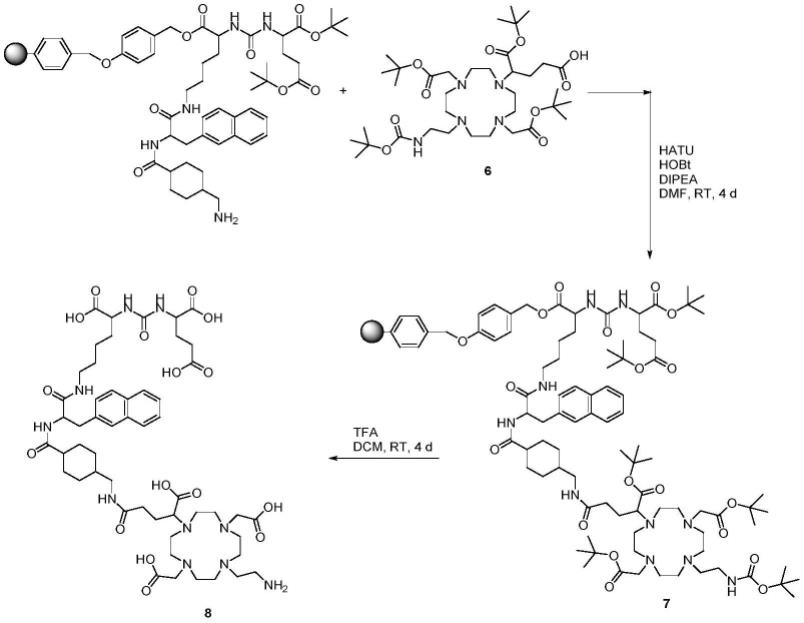
且其中q=1,2,3,4,5,6,7,8,9或10;和
[0120]
p1、p2和p3独立地选自集合{0,1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20};
[0121]-ct是细胞毒性化合物的残基,其选自阿多泽列辛、阿瑞他汀、阿那曲唑、蒽霉素、比卡鲁胺、比泽列辛、硼替佐米、白消安、喜树碱、卡培他滨、卡铂、卡泽列辛、cc-1065、苯丁酸氮芥、顺铂、环磷酰胺、阿糖胞苷(ara c)、达卡巴嗪(dtic)、放线菌素、柔红霉素、地塞米松、双硫仑、多西他赛、多柔比星、多卡霉素a、多卡霉素b1、多卡霉素b2、多卡霉素c1、多卡霉素c2、多卡霉素d、多卡霉素sa、厄里斯莫吉布、依托泊苷(vp-16)、氟达拉滨、氟尿嘧啶(5-fu)、氟他胺、氟维司群、吉西他滨、戈舍瑞林、伊达比星、异环磷酰胺、l-天冬酰胺酶、亮丙瑞林、洛莫司汀(ccnu)、二氯甲基二乙胺(氮芥)、醋酸甲地孕酮、美法仑(bcnu)、甲萘醌、美坦新、二甲双胍、甲氨蝶呤、米拉他赛、米托蒽醌、单甲基奥瑞他汀e(mmae)、莫特塞尼、mytansinoid、萘帕布卡辛、nsc668394、nsc95397、紫杉醇、泼尼松、吡咯并苯二氮卓、双羟萘酸吡啶、白藜芦醇、鲁卡帕里布、s2、s5、盐霉素、saridegib、紫草素、他莫昔芬、替莫唑胺、特西他赛、四唑、维甲酸、维替泊芬、长春碱、长春新碱、长春瑞滨、维斯莫吉布、α-查可宁、α-索拉玛吉、α-茄碱,α-番茄碱;
[0122]
–
ct是选自以下活性成分组的细胞毒性化合物的残基:
[0123]
–
抗代谢药,例如卡培他滨、阿糖胞苷、氟达拉滨、氟尿嘧啶(5-fu)、吉西他滨、甲氨蝶呤;
[0124]
–
烷基化细胞抑制剂,例如阿多泽列辛、比泽列辛、白消安、卡泽列辛、苯丁酸氮芥、环磷酰胺、异环磷酰胺、洛莫司汀(ccnu)、达卡巴嗪(dtic)、顺铂、卡铂、二氯甲基二乙胺、美法仑(bcnu)、替莫唑胺;
[0125]
–
拓扑异构酶抑制剂,例如依托泊苷(vp-16);
[0126]
–
有丝分裂抑制剂,例如长春碱、长春新碱、长春瑞滨、多西他赛、紫杉醇、特西他赛、美坦新、米拉他赛、单甲基奥瑞他汀e(mmae)、mytansinoid、萘帕布卡辛、saridegib;
[0127]
–
抗生素,例如放线菌素、柔红霉素、多柔比星、多卡霉素a、多卡霉素b1、多卡霉素
b2、多卡霉素c1、多卡霉素c2、多卡霉素d、多卡霉素sa、伊达比星、蒽霉素、盐霉素、米托蒽醌;
[0128]
–
酶抑制剂,例如阿瑞他汀、阿那曲唑、喜树碱、l-天冬酰胺酶、莫特塞尼;
[0129]
–
抗雄激素和抗雌激素,例如比卡鲁胺、氟他胺、氟维司群、他莫昔芬、醋酸甲地孕酮;
[0130]
–
parp抑制剂,例如鲁卡帕里布、奥拉帕里布、尼拉帕里布、维利帕里布、伊尼帕里布;
[0131]-蛋白酶体抑制剂,例如硼替佐米;
[0132]-其他,如地塞米松、双硫仑、厄里斯莫吉布、戈舍瑞林、亮丙瑞林、甲萘醌、二甲双胍、nsc668394、nsc95397、泼尼松、吡咯并苯二氮卓、双羟萘酸吡啶、白藜芦醇、s2、s5、紫草素、四唑、维甲酸、维替泊芬、维斯莫吉布、α-查可宁、α-索拉玛吉、α-茄碱、α-番茄碱。
[0133]-可切割基团clv选自包括以下各项的组
[0134][0135]
x=o或
·
nh;
[0136]
y=o或nr
[0137]
r,r1,r2,r3=h或烷基|
[0138]
s=0,1,2,3或
·4[0139][0140]
r=me或
·
ph
[0141]
[0142][0143]
–
螯合剂chel选自包含以下各项的组:h4pypa、edta(乙二胺四乙酸盐)、edtmp(二亚乙基三胺五(亚甲基膦酸))、dtpa(二亚乙基三胺五乙酸盐)及其衍生物、dota(十二碳-1,4,7,10-四胺四乙酸酯)、dotaga(2-(1,4,7,10-四氮杂环十二烷-4,7,10)-戊二酸)和其他dota衍生物、trita(十三碳-1,4,7,10-四胺四乙酸酯)、teta(十四碳-1,4,8,11-四胺四乙酸酯)及其衍生物、nota(九碳-1,4,7-三胺三乙酸酯)及其衍生物例如notaga(1,4,7-三氮杂环壬烷,1-戊二酸,4,7-乙酸酯)、trap(三氮杂环壬烷次膦酸)、nopo(1,4,7-三氮杂环壬烷-1,4-双[亚甲基(羟甲基)-次膦酸]-7-[亚甲基(2-羧乙基)-次膦酸])、pepa(十五碳-1,4,7,10,13-五胺五乙酸酯)、heha(十六碳-1,4,7,10,13,16-六胺六乙酸酯)及其衍生物、hbed(羟基苄基乙二胺)及其衍生物、dedpa及其衍生物例如h2dedpa(1,2-[[6-(羧酸酯-)吡啶-2-基]甲基胺]乙烷)、dfo(去铁胺)及其衍生物、三羟基吡啶酮(thp)及其衍生物例如ym103、teap(四氮杂环癸烷次膦酸)及其衍生物、aazta(6-氨基-6-甲基过氢-1,4-二氮杂-n,n,n',n'-四乙酸酯)及其衍生物例如data((6-戊酸)-6-(氨基)甲基-1,4-二氮杂三乙酸酯);sarar(1-n-(4-氨基苄基)-3,6,10,13,16,19-六氮杂双环[6.6.6]-二十烷-1,
8-二胺)及其盐,(nh2)2sar(1,8-二氨基-3,6,10,13,16,19-六氮杂双环[6.6.6]二十烷)及其盐和衍生物、氨基硫醇及其衍生物;和/或
[0144]
–
第一、第二和第三载体物质选自包括以下各项的组:水、0.45%的nacl水溶液、0.9%的nacl水溶液、林格氏溶液(乳酸林格)、5%葡萄糖水溶液和酒精水溶液。
[0145]
根据本发明的智能药物递送系统和药盒允许以诊断和治疗方式靶向双重癌症治疗的新形式(参见图2和表1)。这涉及以低剂量和高剂量使用相同的活性成分缀合物或两种生物学和药代动力学相似的活性成分缀合物。
[0146]
根据本发明的化合物或活性成分缀合物的结构示意性地显示在图1a至1d中,其中ct表示细胞毒性基团;l、l1各自表示可切割的接头基团;chel表示用放射性同位素标记的螯合剂;s表示可切割的接头或间隔基团;s1、s2分别表示间隔基团,tv表示生物靶向载体。
[0147]
本发明提供的诊断和治疗方式在图2中依据五个膜结合受体(i)至(v)阐明,其中命名ct、l、l1、chel、s、s1、s2和tv具有与上文与图1a至1d相关的阐述相同的含义。图2所示的受体(i)-(v)分配于表1中的诊断和治疗方式(a)、(b1)、(b2)和(c)、(d1)、(d2),分别与定性剂量指示相结合。
[0148]
表1:根据图1的诊断和治疗方式
[0149]
受体方式剂量(i)(a)核医学诊断低(ii)(b1)细胞毒性治疗提高的(iii)(b2)核医学/细胞毒性治疗提高的(iv)(c)核医学诊断低(v)(d1)细胞毒性治疗提高的(iv)+(v)(d2)核医学/细胞毒性治疗提高的
[0150]
在表1中列出的方式(a)、(b1)、(b2)中,使用具有放射性同位素(a、b2)和不具有放射性同位素(b1)的相同活性成分缀合物。在接头l1的内吞作用和切割后,癌细胞在方式(b1)的情况下仅经受细胞毒性活性成分ct,而在方式(b2)的情况下,经受细胞毒性活性成分ct的同时经受放射性同位素发出的辐射。
[0151]
在方式(d2)的情况下使用两种类似的活性成分缀合物,它们具有放射性同位素(iv)和不具有放射性同位素(v)。
[0152]
根据本发明使用的靶向载体tv对膜结合受体具有高结合亲和性。本发明涉及的受体是蛋白质,例如前列腺特异性膜抗原(psma)、成纤维细胞活化蛋白(fap)或法尼基焦磷酸合酶(fpps),它们在各种癌症的肿瘤细胞包膜上过表达。
[0153]
间隔子s、s1、s2将螯合剂chel与靶向载体tv结合,同时充当间隔剂和化学调节剂,补偿由螯合剂chel引起的靶向载体tv的结合亲和性的任何损害,例如由于空间位阻。
[0154]
以类似的方式,接头l和l1以及视需要与l相同的间隔子s将螯合剂chel与细胞毒性活性成分ct或靶向载体tv结合并调节药代动力学特性。许多细胞毒性活性成分是疏水的并且微溶于血清。细胞毒性活性成分ct的显著亲脂性尤其可以在含聚乙二醇(peg)的接头l、l1的帮助下得到有效补偿。这种方法在现有技术中称为“peg化”。
[0155]
接头l和l1还包括基团clv,其在被肿瘤细胞摄取(内吞作用)后,被晚期内体或溶酶体中存在的酶或分子切割,例如谷胱甘肽(γ-l-谷氨酰-l-半胱氨酰甘氨酸,缩写为
gsh),并释放细胞毒性活性成分ct。
[0156]
接头l、l1对药代动力学特性至关重要,并体现了本发明的中心起点,其基于一种相同或两种生物类似的活性成分缀合物,用于双重核医学和细胞毒性治疗,并能够从诊断直接转化为治疗。
[0157]
本发明还提供了一种用于根据上述方式(b2)和(d2)进行靶向、同时核医学/细胞毒性癌症治疗的药盒。首先,通过pet或spect使用适合分子成像的放射性同位素,确定智能给药系统的靶向载体是否与患者肿瘤组织中足够数量表达的分子靶标结合。例如,将psma抑制剂作为靶向载体的智能给药系统用于前列腺癌患者,并且必须在原发肿瘤、淋巴系统转移灶、内脏或骨骼中显示出足够高的选择性蓄积。在这种情况下,智能药物输送系统(sdds)用作治疗前诊断剂,并指示治疗对相应患者的适用性。由于涉及相同的sdds,因此可以确保相同的药代动力学和药效学特性。在这里可以高度确定地预测患者的反应水平。已知的sdds仅包含与靶向载体偶联的细胞抑制剂。因此,在使用已知sdds的情况下,在开始治疗之前无法确定是否适合患者。必要时患者的目标表达是通过不同于sdds的pet放射性示踪剂确定的。然而,通过单独的pet示踪剂测量的pet信号并不代表sdds的结合和药代动力学。但后者对于系统屏障的功效和穿透以及剂量判断至关重要。对于转移性前列腺癌尤其如此,11.8%受影响的患者的dna修复基因发生突变(参见c.c.pritchard,j.mateo,m.f.walsh,n.de sarkar,w.abida,h.beltran,a.garofalo,r.gulati,s.carreira,r.eeles,o.elemento,m.a.rubin等人;转移性前列腺癌男性遗传性dna修复基因突变(inherited dna-repair gene mutations in men with metastatic prostate cancer);n engl j med 2016;375:443-453;doi:10.1056/nejmoa1603144;c.kratochwil,f.l.giesel,c.-p.heussel,d.kazdal,v.endris,c.nientiedt,f.bruchertseifer,m.kippenberger,h.rathke,j.leichsenring,m.hohenfellner,a.morgenstern,u.haberkorn,s.duensing和a.stenzinger;对以psma为目标的α-放射治疗有抵抗力的患者通常在dna损伤修复相关基因中存在突变(patients resistant against psma-targetingα-radiation therapy often harbor mutations in dna damage-repair-associated genes);doi:10.2967/jnumed.119.234559)。根据本发明的化合物在治疗前阶段确定治疗是否适合患者,这与靶表达和药代动力学特征有关。与放射增敏性parpi相结合,例如特别是上述的鲁卡帕里布,建立了一种有效的治疗方法。有许多关于将鲁卡帕里布与放射疗法联合使用的研究。
[0158]
根据指示,可以在没有或使用智能药物递送系统的放射性标记的情况下进行治疗,即通过纯粹的细胞毒性或核医学-细胞毒性手段。在后一种情况下,由于局部高辐射剂量,形成了活性残基(活性氧:ros)并使得对癌细胞的耐药性(多药抗性:mdr)重要的abc转运通道(atp结合盒:abc),例如pgp或ptch1失活,并且抑制了细胞毒性化合物ct从癌细胞的抛出(胞吐作用)。
[0159]
细胞毒性化合物ct(细胞抑制剂)
[0160]
现有技术公开了多种用于癌症治疗的细胞毒性活性成分。
[0161]
例如,鲁卡帕里布及其一些衍生物可抑制参与dna中单链断裂(ssb)修复的酶parp(聚-adp-核糖聚合酶)。parp抑制剂的作用是基于合成诱导的致死性。在dna处于完整状态的健康细胞中,parp抑制不会导致细胞死亡,因为由ssb引起的dna中的双链断裂(dsb)通过
同源重组(hr)进行修复。相比之下,在hr缺陷细胞中,parp抑制会导致细胞死亡,因为dsb在细胞中积累并募集凋亡分子。brca1和brca2(乳腺癌基因)这两个基因在hr中起着至关重要的作用。这些基因的突变会导致dna修复中断并增加肿瘤形成的风险。
[0162]
在20-25%的mcrpc(转移性去势抵抗性前列腺癌)患者中,包括brca1/2在内的hr基因发生突变。这些患者受益于具有高肿瘤特异性的parp抑制剂治疗。也有可能在药物上诱导brca缺乏。活性成分恩扎鲁胺是一种雄激素受体信号通路抑制剂,可导致brca基因下调。恩扎鲁胺给药后,即使没有brca突变的患者也可以受益于鲁卡帕里布的选择性肿瘤毒性。因此可以扩展parp治疗的患者群体。
[0163]
多西他赛和紫杉醇属于紫杉烷类。紫杉烷类抑制微管的解聚并抑制有丝分裂(细胞分裂)。
[0164]
替莫唑胺是一种药学上适用的活性成分(前药),在代谢和自发水解裂解后,释放甲基肼(ch3(nh)nh2),甲基化dna碱并诱导细胞凋亡。
[0165]
单甲基-奥瑞他汀e(mmae)是一种抗肿瘤活性成分,通过抑制微管蛋白聚合来中断细胞周期,从而导致细胞凋亡。
[0166]
表2显示了根据本发明使用的细胞抑制剂。
[0167]
表2:根据本发明使用的活性细胞抑制成分(ct)
[0168]
[0169]
[0170]
[0171]
[0172]
[0173]
[0174]
[0175]
[0176]
[0177]
[0178]
[0179]
[0180]
[0181]
[0182]
[0183]
[0184][0185]
*具有氨基酸序列的肽
[0186]
用于放射性同位素标记的螯合剂chel
[0187]
螯合剂chel旨在用选自包含以下各项的组的放射性同位素标记根据本发明的活性成分缀合物:
44
sc,
47
sc,
55
co,
62
cu,
64
cu,
67
cu,
66
ga,
67
ga,
68
ga,
89
zr,
86
y,
90
y,
89
zr,
90
nb,
99m
tc,
111
in,
135
sm,
159
gd,
149
tb,
160
tb,
161
tb,
165
er,
166
dy,
166
ho,
175
yb,
177
lu,
186
re,
188
re,
211
at,
212
pb,
213
bi,
225
ac和
232
th。现有技术公开了多种用于络合上述放射性同位素的螯合剂。图示6显示了根据本发明使用的螯合剂的实例。
[0188]
[0189][0190]
图示6:根据本发明使用的螯合剂
[0191]
对于核医学诊断(方式(a)、(c))和同时的核医学-细胞毒性治疗诊断(方式(b2)、
(d2)),特别使用放射性同位素
68
ga和
177
lu。根据本发明优选螯合剂dota,它非常适合络合
68
ga和
177
lu。对于
177
lu的络合,优选使用螯合剂h2pypa。h4pypa的合成如图示7所示。
[0192][0193]
(i)dcc,叔丁醇,dcm,rt,12小时,50%;(ii)nabh4,无水甲醇,室温,3-4小时,72%;(iii)seo2,1,4-二噁烷,100℃,12小时,56%;(iv)1.无水甲醇,室温,1小时;2.nabh3cn,无水甲醇,3小时,70%;(v)nabh4,无水甲醇,室温,12小时,92%;(vi)pbr3,无水chcl3/acn,60℃,18小时,70%;(vii)k2co3,无水acn,60℃,24小时,70%;(viii)tfa/dcm,室温,12小时,70%。
[0194]
图示7:
177
lu螯合剂h4pypa的合成
[0195]
酰胺偶联
[0196]
在本发明中,螯合剂chel、细胞毒性化合物ct、靶向载体tv、接头l、l1和间隔子s、s1、s2等官能团优选通过酰胺偶联反应进行偶联。在药物化学中,形成蛋白质骨架的酰胺偶联是最常用的反应。图示8中显示了酰胺偶联的一般示例。
[0197][0198]
图示8:酰胺偶联
[0199]
由于几乎无限的易于获得的羧酸和胺衍生物,酰胺偶联策略为合成新化合物开辟了一条简单的途径。本领域技术人员知道许多用于酰胺偶联的试剂和方案。最常用的酰胺偶联策略是基于羧酸与胺的缩合。为此目的,羧酸通常被活化。在激活之前,其余官能团受到保护。该反应分两步进行,或者在一种反应介质(单罐)中直接转化活化的羧酸,或者在两步中分离活化的“被捕获的”羧酸并与胺反应。
[0200]
此处的羧酸与偶联剂反应形成反应性中间体,该中间体可以以分离形式或直接与胺反应。许多试剂可用于羧酸活化,例如酰卤(氯化物、氟化物)、叠氮化物、酸酐或碳二亚胺。此外,形成的反应性中间体可以是酯,例如五氟苯基酯或羟基琥珀酰亚胺酯。由酰氯或叠氮化物形成的中间体具有高反应性。然而,苛刻的反应条件和高反应性通常是使用敏感
底物或氨基酸的障碍。相比之下,利用碳二亚胺如dcc(二环己基碳二亚胺)或dic(二异丙基碳二亚胺)的酰胺偶联策略开辟了广泛的应用范围。通常,特别是在固相合成的情况下,添加剂被用来提高反应效率。铵盐是高效的肽偶联试剂,具有短的反应时间和最小的外消旋作用。使用某些添加剂,例如hobt,甚至可以完全防止外消旋化。胺试剂与羧酸以等摩尔量使用,以防止与肽的游离胺发生过度反应。鏻盐与羧酸盐反应,这通常需要两个当量的碱,例如diea。与亚胺试剂相比,鏻盐的一个显著优势是鏻不与胺组分的游离氨基反应。这使得能够以摩尔比的酸和胺进行偶联,并有助于防止线性肽的分子内环化和过度使用昂贵的胺组分。
[0201]
酰胺偶联反应策略和试剂的广泛总结可在以下评论文章中找到:
[0202]
–
过去和现在的药物化学合成方法分析(analysis of past and present synthetic methodologies on medicinal chemistry):所有新反应都去哪儿了?(where have all the new reactions gone?)d.g.brown,j.j.med.chem.2016,59,4443-4458;
[0203]
–
肽偶联试剂(peptide coupling reagents),不仅仅是字母汤(more than a letter soup);a.el-faham,f.albericio;chem.修订版2011,111,6557
–
6602;
[0204]
–
重新思考酰胺键合成(rethinking amide bond synthesis);v.r.pattabiraman,j.w.bode;nature,vol.480(2011)22/29;
[0205]
–
酰胺键的形成(amide bond formation):超越偶联剂的神话(beyond the myth of coupling reagents);e.valeur,m.bradley;chem.soc.修订版,2009年,38,606-631。
[0206]
根据本发明使用的那些螯合剂中的许多螯合剂,例如特别是dota,具有一个或多个羧基或酰胺基团。因此,这些螯合剂可以借助现有技术中已知的酰胺偶联策略之一以简单的方式与接头l、l1和/或间隔子s、s1、s2偶联。
[0207]
存在于接头l、l1中的可切割基团clv确保细胞毒性活性成分ct的肿瘤特异性释放,并且在全身循环即血浆中是稳定的。在被癌细胞摄取(内吞作用)后,可切割基团clv被裂解,细胞毒性活性成分ct被释放。
[0208]
下文给出可切割基团clv的一些实例。
[0209]
图示9显示对氨基苯甲酸-缬氨酸-瓜氨酸类型的可切割基团或接头,其被细胞内的蛋白酶切割,尤其是来自组织蛋白酶家族的蛋白酶。组织蛋白酶在前列腺肿瘤细胞中过度表达。
[0210][0211]
图示9:对氨基苯甲酸-缬氨酸-瓜氨酸接头/基团
[0212]
图示10显示了对氨基苯甲酸-谷氨酸-缬氨酸-瓜氨酸类型的可切割基团或接头,其同样被组织蛋白酶切割,并且以小鼠血清中的稳定性提高而著称,这对临床前研究构成了相当大的优势。
[0213][0214]
图示10:对氨基苯甲酸-谷氨酸-缬氨酸-瓜氨酸接头/基团
[0215]
图示11显示在酸性介质(ph《6.2)中水解的可切割的肼基团/接头
[0216]
–
存在于肿瘤组织中。
[0217][0218]
图示11:腙基团/接头
[0219]
图示12中显示的二硫基/接头在二硫交换反应中被溶酶体谷胱甘肽(gsh:γ-l-谷氨酰-l-半胱氨酰甘氨酸)裂解。
[0220][0221]
图示12:二硫基/接头
[0222]
在本发明的上下文中使用的术语具有下文阐明的含义。
[0223]
治疗诊断:使用核医学药物诊断和治疗癌症。
[0224]
示踪剂:合成制备的放射性标记物质,用量极少,可在生物体内转化而不影响新陈代谢。
[0225]
标记前体:含有用于标记的螯合剂或官能团的化合物,所述标记用放射性同位素进行。
[0226]
药盒:一种或多种药物给药形式,任选包含一个或多个容器,所述容器包含一种或多种活性成分,所述活性成分任选存在、溶解、悬浮或乳化在一种或多种载体物质中。
[0227]
容器:用于临床应用的由玻璃、金属或塑料制成的小瓶、隔膜小瓶、注射小瓶或安瓿瓶。
[0228]
载体物质:作为活性药物成分的药物载体的液体或固体物质,一般不具有任何药物活性。
[0229]
智能药物递送系统(sdds):化合物,其包含细胞毒性活性成分、用于释放细胞毒性活性成分的可切割接头、用于在肿瘤组织中积累的靶向载体,以及可选的其他接头或间隔
子和用于标记的螯合剂,所述标记用放射性同位素进行。
[0230]
螯合剂残基:螯合剂作为化合物的一部分,尤其是作为sdds化合物的一部分。
[0231]
靶标:生物靶标结构,尤其是生物体内与靶向载体结合的(膜结合的)受体、蛋白质或抗体。
[0232]
靶向载体:用作靶标的配体、激动剂、拮抗剂或抑制剂并对该靶标具有高度结合亲和性的化学基团或残基。
[0233]
放射性药物:放射性标记化合物或与放射性同位素络合的标记前体,用于核医学诊断和治疗诊断。
[0234]
接头:结构单元、基团或残基,其包含生物可切割的亚基或亚单元,靶向载体、细胞毒性活性成分或螯合剂通过其与另一个结构单元结合。
[0235]
可切割基团:被存在于细胞质、内体或溶酶体中的酶或分子切割的结构单元、基团或残基。
[0236]
间隔子:在靶向载体和螯合剂之间起间隔作用并抵消螯合剂对靶向载体的空间位阻的结构单元。在本发明的特别合适的实施方案中,间隔子包含可切割基团并且被设计为接头。
[0237]
活性成分缀合物:包含细胞毒性活性成分、靶向载体和可切割接头的化合物。
[0238]
双活性成分缀合物:包含细胞毒性活性成分、靶向载体、螯合剂、接头和间隔子的化合物。
实施例
[0239]
实施例1:双活性成分缀合物
[0240]
图示13至22显示了根据图1a的根据本发明的双活性成分缀合物的实例,其包括靶向载体、用于标记的螯合剂(所述标记用放射性同位素进行)和细胞毒性活性成分。
[0241]
[0242]
图示13:替莫唑胺.valcit.qs.dotaga.qs.k.eue(细胞抑制剂:替莫唑胺;可切割接头:valcit;螯合剂:dotaga;靶载体:eue。)
[0243][0244]
图示14:鲁卡帕里布.valcit.qs.dotaga.qs.k.eue
[0245][0246]
图示15:鲁卡帕里布.gluvalcit.qs.dotaga.617.kue
[0247][0248]
图示16:多西他赛.二硫化物.qs.dotaga.617.kue
[0249][0250]
图示17:替莫唑胺.腙.qs.dotaga.qs.kue
[0251][0252]
图示18:多西他赛.valcit.qs.dotaga.qs.kue
[0253][0254]
图示19:鲁卡帕里布.valcit.qs.dotaga.qs.fapi
[0255][0256]
图示20:多西他赛.二硫化物.qs.dotaga.qs.fapi
[0257][0258]
图示21:多西他赛.gluvalcit.qs.dotaga.qs.帕米膦酸盐
[0259][0260]
图示22:替莫唑胺.二硫化物.qs.dotaga.唑来膦酸盐
[0261]
实施例2:根据图1b的双活性成分缀合物
[0262]
图示23、24、25和26显示了根据图1b的根据本发明的双活性成分缀合物的实例,其包括靶向载体、用于标记的螯合剂(所述标记用放射性同位素进行)、可切割的接头和细胞毒性活性成分。
[0263][0264]
图示23:多西他赛.valcit.qs.lys.(aazta).(617.kue)
[0265][0266]
图示24:鲁卡帕里布.gluvalcit.qs.lys.(dotaga).(sa.k.eue)
[0267][0268]
图示25:鲁卡帕里布.valcit.lys.(dotaga).(sa.帕米膦酸盐)
[0269][0270]
图示26:mmae.vc.qs.dotaga 617.kue
[0271]
实施例3:根据图1d的活性成分缀合物。
[0272]
图示27、28、29和30显示了根据图1d的根据本发明活性成分缀合物的实例,其包括靶向载体、可切割的接头和细胞毒性活性成分。
[0273][0274]
图示27:鲁卡帕里布.valcit.qs.k.eue
[0275]
[0276]
图示28:替莫唑胺.二硫化物.qs.唑来膦酸盐
[0277][0278]
图示29:多西他赛.valcit.qs.617.kue
[0279][0280]
图示30:mmae.valcit.qs.617.kue
[0281]
实施例4:psma标记前体的合成策略
[0282]
在本发明的活性成分缀合物的合成中,优选使用方酸二酯。以这种方式,可以通过简单的反应制备多种在某些情况下非常复杂的活性成分缀合物。方酸二酯以其与胺的选择性反应而著称,因此螯合剂、接头、间隔子和靶向载体的偶联不需要保护基团。此外,偶联反应可通过ph值控制。
[0283]
首先,合成psma的靶向载体(见图示31a),纯化后在ph=7的水性介质中,与方酸二酯反应生成与螯合剂偶联的前体(见图示32)。或者,偶联也可以在以三乙胺为碱的有机介质中进行。
[0284]
[0285]
图示31a:qs-kue前驱体的合成
[0286]
通过已知方法合成的用于psma的靶载体例如是psma抑制剂l-赖氨酸-脲-l-谷氨酸(kue)(参见图示31b)。这涉及使聚合物树脂结合和叔丁氧羰基保护的(叔丁基保护的)赖氨酸与二叔丁基保护的谷氨酸反应。在受保护的谷氨酸被三光气活化并与固相结合的赖氨酸偶联后,l-赖氨酸-脲-l-谷氨酸(kue)通过tfa被消除,同时完全脱保护。随后可以通过半制备型hplc以71%的产率将产物与游离赖氨酸分离。
[0287][0288]
图示31b:psma抑制剂kue的固相合成;(a)dipea,三光气,dcm 0℃,4小时;(b)h-lys(tboc)-2ct-聚苯乙烯固相,dcm,rt,16小时;(c)tfa,rt,71%。
[0289]
然后,psma抑制剂kue(1)可以通过方酸二乙酯作为偶联试剂与标记前体偶联(参见图示32)。kue(1)与方酸二酯的偶联是在ph值为7的0.5m磷酸盐缓冲液中进行的。添加两种反应物后,必须用氢氧化钠溶液(1m)重新调节ph值,因为磷酸盐缓冲液的缓冲能力不足。在ph 7时,酸的单一酰胺化在室温下进行,反应时间短。kue-qs(2)在hplc纯化后获得,总产率为16%。
[0290][0291]
图示32:kue与方酸偶联;(d)0.5m磷酸盐缓冲液ph 7,室温,16小时,23%。
[0292]
由此获得的kue方酸单酯是可储存的并且可以用作进一步合成的结构单元。
[0293]
实施例5:kue单元和psma 617接头的固相合成
[0294]
谷氨酸-脲-赖氨酸结合基序kue与芳香族接头单元的结合是通过benesova等人(控制前列腺特异性膜抗原(psma)靶向和dota偶联psma抑制剂的药代动力学特性的接头改性策略(linker modification strategies to control the prostate-specific membrane antigen(psma)-targeting and pharmacokinetic properties of dota-conjugated psma inhibitors);j med chem,2016,59,1761-1775)描述的固相肽合成实现的。benesova等人报道的合成被稍作修改(参见图示33)。
[0295][0296]
图示33.1:kue单元的合成并与芳香族接头偶联;(a)三光气、dipea、dcm;
[0297][0298]
图示33.2:kue单元的合成并与芳香族接头偶联;(b)50%哌啶的dmf溶液;(c)dcm中的化合物(i);
[0299][0300]
图示33.3:kue单元的合成并与芳香族接头偶联;(d)dcm中的四(三苯基)钯和吗啉;(e)dmf中的fmoc 3-(2-萘基)-l-丙氨酸、hbtu和dipea;
[0301][0302]
图示33.4:kue单元的合成并与芳香族接头偶联;(f)dmf中的50%哌啶,dmf中的fmoc4-amcoh、hbtu和dipea;(g)50%哌啶的dmf溶液。
[0303]
实施例6:可偶联的dotaga螯合剂的合成及其与psma-617靶载体-接头单元的偶联
[0304]
合成从市售的do2a(tbu)-gabz出发,其在仲胺上被boc保护的氨基被官能化(参见图示34)。这使得细胞抑制剂-接头单元的后期引入成为可能。
[0305][0306]
图示34:具有偶联能力的dotaga螯合剂的合成。
[0307]
dotaga(cootbu)3(nhboc)-gabz 4的戊二酸侧链的苄基保护基团被还原性去除,以便能够通过接头与psma-靶载体偶联。
[0308]
然后接头-psma缀合物通过酰胺偶联与螯合剂6偶联。
[0309][0310]
图示35:螯合剂6与接头psma-617.kue单元的偶联。
[0311]
图示35中描述了螯合剂6与kue结合的接头的耦合。通过酰胺偶联获得的受保护的psma617衍生物7在三氟乙酸(tfa)的帮助下脱保护并与固相分离。hplc纯化后两步合成的总产率为6%。
[0312]
实施例7:本发明化合物mmae.valcit.qs.617.kue的合成
[0313][0314]
图示36:mmae.valcit.qs.617.kue的合成
[0315]
化合物mmae.valcit.qs.617.kue的合成从市售的mmae.valcit出发,在磷酸盐缓冲液(0.5m)中ph为7和加入dmso的情况下,将其与方酸二乙酯偶联(参见图示36)。随后在添加2%三乙胺的乙醇中,mmae.valcit.qs单元与617.kue-接头-靶载体单元的进行基于固相的耦合。hplc纯化后,合成收率为43%。
[0316]
实施例8:放射性标记
[0317]
对于psma标记前体的放射性标记,使用0.05mhcl从itgge/ga发生器中洗脱
68
ga,并通过阳离子交换柱通过乙醇水溶液洗脱进行处理。根据螯合剂,放射性标记在3.5和5.5之间的ph值和25℃和95℃之间的温度下进行。通过hplc和iptc记录反应进程以确定反应的动力学参数。
[0318]
实施例9:方酸作为络合助剂
[0319]
对于临床应用,络合在低温下有效进行是非常重要的。方酸与游离金属络合,因此可以保护螯合剂位点免受非特异性配位。在不同温度下对trap.qs进行放射性标记的情况下观察到了这种效应。trap在室温下定量络合。相比之下,在相同条件下,在trap.qs的情况下,测得的rcy值仅为50%。如果温度升高,trap.qs的标记产量会上升到定量值。这显示了方酸对络合的影响。图示37中说明了这种效果,可以在螯合剂aazta.qs的帮助下稳定络合具有高配位数的金属,例如锆。
[0320][0321]
图示37:通过aazta.qs协调
[0322]
在根据本发明的药盒的有利实施形式中,其包含第一、第二和/或第三化合物、一个或多个方酸残基qs。使用方酸二酯可以显著简化偶联反应。
[0323]
实施例10a:方酸作为亲和性促进剂
[0324]
此外,本发明人惊奇地发现,方酸基团qs的掺入改善了药理学性质并增加了psma特异性靶向载体的结合亲和性。发明人猜测结合亲和性通过方酸基团qs与arg463的离子相互作用而增加。为了验证这一假设,进行了对接研究。图3和图4显示了基于对接研究的优先安排。arg463位于psma的所谓的精氨酸贴片中。另一个推定的作用机制是基于架向trp541的氢桥,其增加了对psma的芳烃结合口袋的亲和性。
[0325]
方酸基团与富含精氨酸的区域(暗区)中的arg463以及芳烃结合袋中的trp541相互作用。浅色虚线表示距离(以为单位)。活性结合袋中的锌离子显示为球体。结构数据基于通过x射线衍射确定的psma与psma1007(pdb5o5t)的络合物的结构。
[0326]
图5显示了aazta.qs.kue在psma结合口袋中的推定的结合模式。aazta螯合剂突出于psma口袋。qs接头与结合袋的疏水部分相互作用。结合基序位于口袋的药效团部分,并由两个锌离子络合。图6显示了data.qs.eue的假定结合模式。eue结合基序导致接头的延伸和qs接头的相关空间位移,这削弱了与结合袋中氨基酸的静电相互作用。随后的体外测定证实了对接分析的结果。
[0327]
实施例10b:作为排泄调节剂的方酸
[0328]
图示38显示了活性成分缀合物或标记前体的实例,该前体具有psma的靶向载体和与靶向载体偶联的方酸基团。
[0329][0330]
图示38:psma.qs.dota标记前体
[0331]
方酸(qs)与psma示踪剂的结合减少了肾脏中的积聚以及来自相邻前列腺的pet信号的相关掩蔽或干扰,这至关重要地提高了通过pet对前列腺癌进行成像诊断的灵敏度和可靠性。图7a和7b显示了[
68
ga]ga.dota.qs.psma(a)、[
68
ga]ga-psma-11(b)和[
68
ga]ga-psma-617(c)的μpet图像(60分钟p.i.)以及肿瘤组织、肾脏和肝脏的suv值(标准摄取值:suv)图。
[0332]
图示39展示了另一种qs衍生物,该衍生物已在携带肿瘤的动物体内进行了测试。
[0333][0334]
图示39:data.qs.kue
[0335]
data.qs.kue用
68
ga标记,并在携带lncap肿瘤的balb/c小鼠身上进行了体内测试。图8显示[
68
ga]-data.qs.kue在器官中的积累(生物分布)。通过竞争性共注射psma抑制剂pmpa来确定结合的选择性。通过比较,图9显示[
68
ga]-psma-11的生物分布。
[0336]
图10a和10b显示了在携带lncap肿瘤的balb/c小鼠中分别使用[
68
ga]-psma-11和[
68
ga]-data.qs.kue的μpet研究的最大强度投影。
[0337]
图11a和11b显示了[
68
ga]-psma-11和[
68
ga]-data.qs.kue的时间-活性曲线。与psma11相比,在肿瘤富集度大致相同的情况下,data.qs.kue显示出相当低的肾脏展示或肾脏剂量。在使用高电离放射性核素(例如
177
lu而非
68
ga)进行治疗的情况下,data.qs.kue能够显著降低肾毒性。
[0338]
实施例11a:评估选定化合物和化合物成分的体外psma结合亲和性
[0339]
通过基于细胞的测定,靶载体-接头单元qs.kue、qs.k.eue和kue与亲脂接头的亲和性(类似于psma-617)以及子结构nh2.dotaga.617.kue和nh
2-dotaga.qs.kue的亲和性被测定。此外,确定了根据本发明优选的结构mmae.valcit.qs.617.kue(参见图示30)的psma亲和性。
[0340]
用于测定,将lncap细胞移液到多孔板(merckmilliporemultiscreen
tm
)中。将待分析的化合物以增加的浓度分别与确定量或浓度的具有已知kd值的参考化合物
68
ga[ga]psma-10混合,并在具有lncap细胞的孔中孵育45分钟。反复洗涤后,测定细胞结合活性。依据获得的抑制曲线计算出表1中披露的ic
50
值和ki值。
[0341]
表3:psma结合亲和性
[0342][0343][0344]
为了确定非特异性结合,将所有化合物另外与过量的psma抑制剂2-pmpa(2-(膦酰基甲基)-戊酸)混合,并如上所述进行相同的lncap测定。
[0345]
tv接头单元和螯合剂-tv接头单元对psma的亲和性与参考化合物psma-617相似。因此,使用qs作为接头单元导致与使用肽psma-617相当的亲和性。与dotaga螯合剂的偶联或用放射性核素镓68和镥177对其进行标记都不会导致亲和性降低。
[0346]
使用结合单位eue而不是kue会导致psma亲和性显著下降。结果证实了对接研究的发现,即eue衍生物在psma结合口袋中的不利取向。
[0347]
空间要求高的细胞抑制剂mmae与valcit接头和tv接头单元qs.617.kue的耦合导致亲和性明显降低。
[0348]
实施例7b:二聚化合物mmae.valcit.qs.617.kue体外细胞毒性作用的测定
[0349]
在celltiterblue测定中,lncap细胞与待研究物质孵育72小时,然后测定化合物的ic
50
。表4显示了根据本发明优选的化合物mmae.valcit.qs.617.kue(图示30)与纯活性成分mmae相比的ic
50
值。
[0350]
表4:体外细胞毒性作用
[0351]
化合物ic
50
(nm)mmae0.29
±
0.12mmae.valcit.qs.617.kue32.2
±
5.7
[0352]
尽管根据本发明的化合物mmae.valcitqs.617.kue在体外显示出比纯活性成分mmae稍低的细胞毒性,但它仍然处于较低的纳摩尔范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1