用于治疗或预防克罗恩病的组合物和方法与流程
1.本公开涉及通过调节基因表达的方式来治疗克罗恩病(crohn’s disease)的方法,以及可用于这种方法中的组合物。
2.序列表
3.本技术含有已经以ascii格式电子提交并且据此通过引用整体并入的序列表。创建于2020年11月12日的所述ascii副本被命名为51139-021wo2_sequence_listing_11.12.20_st25,并且大小为15,172字节。
背景技术:
4.克罗恩病是一种炎性肠病,其引起消化道炎症,导致腹痛、严重腹泻、疲劳、体重减轻和营养不良。目前克罗恩病无法治愈,并且长期有效的治疗方案有限。对于患有克罗恩病的患者,所述疾病会对其生活方式具有毁灭性的影响,因为克罗恩病的常见症状包括腹泻、抽筋、腹痛、发烧和甚至直肠出血。克罗恩病及其相关并发症经常导致患者需要手术,通常不止一次。仍然需要针对克罗恩病潜在原因的治疗方式,以实现症状的有效改善和疾病缓解。
技术实现要素:
5.本公开涉及用于治疗克罗恩病的组合物和方法。在第一方面,本公开提供了一种通过向有需要的患者(例如,哺乳动物患者,诸如人类患者(例如,成年人类患者))提供一种或多种共同增加含功能性核苷酸结合寡聚化结构域的蛋白2(nod2)的表达和/或活性的剂来治疗患者的克罗恩病的方法。
6.在另一方面,本公开提供了诱导有需要的患者(例如,哺乳动物患者,诸如人类患者(例如,成年人类患者))中的克罗恩病的持续疾病缓解的方法,所述方法包括向患者提供一种或多种增加功能性nod2的表达和/或活性的剂。
7.在另一方面,本公开提供了一种增加患有克罗恩病的患者(例如,哺乳动物患者,诸如人类患者(例如,成年人类患者))中的先天免疫系统对胞壁酰二肽(mdp)的感知的方法,所述方法包括向患者提供一种或多种增加功能性nod2的表达和/或活性的剂。
8.在另一方面,本公开提供了增加患有克罗恩病的患者(例如,哺乳动物患者,诸如人类患者(例如,成年人类患者))中的nfκb信号转导检测的方法,所述方法包括向患者提供一种或多种增加功能性nod2的表达和/或活性的剂。
9.在另一方面,本公开提供了一种治疗患者(例如,哺乳动物患者,诸如人类患者(例如,成年人类患者))中的克罗恩病的方法,所述方法包括:
10.(i)确定患者是否在编码功能性nod2的内源基因(诸如r702w、g908r或l1007fs)中具有功能丧失突变;和
11.(ii)如果患者在内源基因中具有功能丧失突变,则向患者施用一种或多种增加功能性nod2的表达和/或活性的剂
12.在本公开的前述方面中的任一个的一些实施方案中,患者具有nod2表达缺陷(例如,通过功能丧失突变)。例如,患者可能是表达低于正常生理水平的nod2的患者。
13.在本公开的前述方面中的任一个的一些实施方案中,患者在编码功能性nod2的内源基因中具有功能丧失突变。在一些实施方案中,编码功能性nod2的内源基因中的功能丧失突变选自由以下组成的组:r702w、g908r和l1007fs。
14.在另一方面,本公开提供了一种或多种增加功能性nod2的表达和/或活性的剂以用于治疗有需要的患者(例如,哺乳动物患者,诸如人类患者(例如,成年人类患者))中的克罗恩病的方法中。
15.在另一方面,本公开提供了一种或多种用于治疗中的增加功能性nod2的表达和/或活性的剂。
16.在另一方面,本公开提供了一种或多种增加功能性nod2的表达和/或活性的剂以用于治疗有需要的患者(例如,哺乳动物患者,诸如人类患者(例如,成年人类患者))中的克罗恩病的方法中,其中所述方法包括:
17.(i)确定患者是否在编码功能性nod2的内源基因(诸如r702w、g908r或l1007fs)中具有功能丧失突变;和
18.(ii)如果患者在内源基因中具有功能丧失突变,则向患者施用一种或多种增加功能性nod2的表达和/或活性的剂,
19.在本公开的前述三个方面中的任一个的一些实施方案中,患者具有nod2表达缺陷(例如,通过功能丧失突变)。例如,患者可能是表达低于正常生理水平的nod2的患者。
20.在本公开的前述三个方面中的任一个的一些实施方案中,患者在编码功能性nod2的内源基因中具有功能丧失突变。在一些实施方案中,编码功能性nod2的内源基因中的功能丧失突变选自由以下组成的组:r702w、g908r和l1007fs。
21.在另一方面,本公开提供了一种或多种增加功能性nod2的表达和/或活性的剂在制造用于治疗有需要的患者(例如,哺乳动物患者,诸如人类患者(例如,成年人类患者))中的克罗恩病的药物中的用途。患者可能具有nod2表达缺陷(例如,通过功能丧失突变)。例如,患者可能是表达低于正常生理水平的nod2的患者。在本公开的这个方面的一些实施方案中,患者在编码功能性nod2的内源基因中具有功能丧失突变。在本公开的这个方面的一些实施方案中,编码功能性nod2的内源基因中的功能丧失突变选自由以下组成的组:r702w、g908r和l1007fs。
22.在本公开的前述方面中任一个的一些实施方案中,所述一种或多种剂含有(i)一种或多种共同编码nod2的核酸分子,(ii)一种或多种共同增加nod2的表达和/或活性的干扰rna分子,(iii)一种或多种编码一种或多种干扰rna分子(例如,短干扰rna(sirna)、短发夹rna(shrna)和/或微小rna(mirna))的核酸分子,(iv)一种或多种蛋白质本身,和/或(v)一种或多种共同增加nod2的表达和/或活性的小分子。
23.编码功能性nod2的核酸
24.在一些实施方案中,一种或多种剂含有编码功能性nod2的核酸分子。
25.在一些实施方案中,编码功能性nod2的核酸分子与seq id no:1的核酸序列具有至少85%序列同一性(例如,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性)。在一些实施方案中,核酸与seq id no:1
的核酸序列具有至少90%序列同一性(例如,90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性)。在一些实施方案中,核酸与seq id no:1的核酸序列具有至少95%序列同一性(例如,95%、96%、97%、98%、99%或100%序列同一性)。在一些实施方案中,核酸具有seq id no:1的核酸序列。
26.在一些实施方案中,编码的功能性nod2蛋白具有与seq id no:2的氨基酸序列至少85%相同(例如,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%相同)的氨基酸序列。在一些实施方案中,编码的功能性nod2蛋白具有与seq id no:2的氨基酸序列至少90%相同(例如,90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%相同)的氨基酸序列。在一些实施方案中,编码的功能性nod2蛋白具有与seq id no:2的氨基酸序列至少95%相同(例如,95%、96%、97%、98%、99%、或100%相同)的氨基酸序列。在一些实施方案中,编码的功能性nod2蛋白具有seq id no:2的氨基酸序列。
27.在一些实施方案中,功能性nod2蛋白具有通过一个或多个保守氨基酸取代(例如,通过1至50个保守氨基酸取代)而不同于seq id no:2的氨基酸序列的氨基酸序列。
28.通过细胞疗法提供给患者的核酸
29.在一些实施方案中,通过向患者施用含有表达功能性nod2的细胞群的组合物来将核酸分子提供给患者。所述细胞可以是多能细胞,诸如cd34+细胞(例如,造血干细胞和/或骨髓祖细胞)、诱导性多能干细胞和/或胚胎干细胞。
30.在一些实施方案中,将所述组合物全身施用给患者。例如,所述组合物可以通过静脉内注射施用给患者。
31.在一些实施方案中,所述细胞对于患者是自体细胞。在一些实施方案中,所述细胞对于患者是同种异体细胞(例如,hla匹配的同种异体细胞)。
32.在一些实施方案中,所述细胞(例如,多能细胞,诸如cd34+细胞(例如,造血干细胞或骨髓祖细胞)、诱导性多能干细胞和/或胚胎干细胞)被离体转导以表达功能性nod2。例如,所述细胞可以用选自由以下组成的组的病毒载体转导:腺病毒、细小病毒、冠状病毒、弹状病毒、副粘病毒、细小核糖核酸病毒、甲病毒、疱疹病毒、痘病毒和逆转录病毒科家族病毒。在一些实施方案中,所述病毒载体是逆转录病毒科家族病毒载体,诸如慢病毒载体、α逆转录病毒载体或γ逆转录病毒载体。在一些实施方案中,所述逆转录病毒科家族病毒载体含有中央多嘌呤区、土拨鼠肝炎病毒转录后调控元件、5'-ltr、hiv信号序列、hiv psi信号5'-剪接位点、δ-gag元件、3'-剪接位点和3'-自失活ltr。在一些实施方案中,所述病毒载体是假型病毒载体,诸如选自由以下组成的组的假型病毒载体:假型腺病毒、假型细小病毒、假型冠状病毒、假型弹状病毒、假型副粘病毒、假型细小核糖核酸病毒、假型甲病毒、假型疱疹病毒、假型痘病毒和假型逆转录病毒科家族病毒。
33.在一些实施方案中,通过使细胞与病毒载体(例如,上述病毒载体)和降低蛋白激酶c(pkc)活性和/或表达的物质接触来转导细胞。
34.在一些实施方案中,所述降低pkc的活性和/或表达的物质是pkc抑制剂。所述pkc抑制剂可以是星形孢菌素(staurosporine)或其变体。
35.在一些实施方案中,使细胞进一步与斯桃普利胺(stauprimide)接触,例如,如caravatti等人bioorg.med.chem.letters 4:199-404,1994中所描述,其公开内容在此通
过引用整体并入。
36.在一些实施方案中,所述转导细胞的方法包括使细胞与组蛋白脱乙酰酶(hdac)抑制剂接触。
37.在一些实施方案中,所述转导细胞的方法包括使细胞与前列腺素e受体信号传导的活化剂接触。
38.在一些实施方案中,所述前列腺素e受体信号传导的活化剂是小分子,诸如wo 2007/112084或wo 2010/108028中描述的化合物,其中的每一个的公开内容通过引用并入本文,因为这些专利涉及前列腺素e受体信号传导活化剂。
39.在一些实施方案中,所述前列腺素e受体信号传导的活化剂是小分子,诸如有机小分子、前列腺素、wnt通路激动剂、camp/pi3k/akt通路激动剂、ca
2+
第二信使通路激动剂、一氧化氮(no)/血管紧张素信号传导激动剂,或另一种已知刺激所述前列腺素信号传导通路的化合物,诸如选自以下的化合物:美贝维林、氟脲内酯、阿替洛尔、吲哚洛尔、加波沙朵、犬尿烯酸、肼苯哒嗪、噻苯哒唑、荷包牡丹碱、维沙米考、秘鲁苷、丙咪嗪、氯丙酰胺、1,5-五亚甲基四唑、4-氨基吡啶、二氮嗪、苯磷硫胺、12-甲氧基十二碳烯酸、n-甲酰基-met-leu-phe、加拉明、iaa 94、氯三烯和/或这些化合物中的任一者的衍生物。
40.在一些实施方案中,所述前列腺素e受体信号传导的活化剂是天然存在的或合成的化学分子或多肽,其与前列腺素e受体结合和/或相互作用,通常以活化或增加与前列腺素e受体相关的下游信号传导通路中的一种或多种。
41.在一些实施方案中,所述前列腺素e受体信号传导的活化剂选自由以下组成的组:前列腺素(pg)a2(pga2)、pgb2、pgd2、pge1(前列地尔(alprostadil))、pge2、pgf2、pgi2(依前列醇(epoprostenol))、pgh2、pgj2,以及其的衍生物和类似物。
42.在一些实施方案中,所述前列腺素e受体信号传导的活化剂是pge2或dmpg2。
43.在一些实施方案中,所述前列腺素e受体信号传导的活化剂是15d-pgj2、δ2-pgj2、2-羟基十七碳三烯酸(hht)、血栓素(txa2和txb2)、pgi2类似物(例如,伊洛前列素(iloprost)和曲前列素(treprostinil))、pgf2类似物(例如,曲伏前列素(travoprost)、甲基前列腺素三羟甲基氨基甲烷(carboprost tromet hamine)、他氟前列素(tafluprost)、拉坦前列素(latanoprost)、比马前列素(bi matoprost)、异丙基乌诺前列酮(unoprostone isopropyl)、氯前列醇(cloprosten ol)、雌二醇(oestrophan)和苏帕潘(superphan))、pge1类似物(例如,11-脱氧pge1、米索前列醇(misoprostol)和布塔前列素(butaprost)),以及科里醇-a([3aa,4a,5,6aa]-(-)-[六氢-4-(羟甲基)-2-氧代-2h-环戊二烯并/b/呋喃-5-基][1,1'-联苯]-4-甲酸酯)、科里醇-b(2h-环戊二烯并[b]呋喃-2-酮,5-(苯酰氧基)六氢-4-(羟甲基)[3ar-(3aa,4a,5,6aa)])和科里二醇((3ar,4s,5r,6as)-六氢-5-羟基-4-(羟甲基)-2h-环戊二烯并[b]呋喃-2-酮)。
[0044]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是前列腺素e受体配体,诸如前列腺素e2(pge2)或其类似物或衍生物。前列腺素通常是指衍生自含有20个碳原子,包括5碳环的脂肪酸的激素样分子,如本文所述和本领域已知的。pge2“类似物”或“衍生物”的示例性实例包括但不限于16,16-二甲基pge2、16-16二甲基pge2对-(对乙酰酰氨基苯甲酰氨基)苯基酯、11-脱氧-16,16-二甲基pge2、9-脱氧-9-亚甲基-16,16-二甲基pge2、9-脱氧-9-亚甲基pge2、9-酮氟前列醇、5-反式pge2、17-苯基-ω-三去甲pge2、pge2丝氨醇酰
胺、pge2甲酯、16-苯基四去甲pge2、15(s)-15-甲基pge2、15(r)-15-甲基pge2、8-异-15-酮pge2、8-异pge2异丙酯、20-羟基pge2、诺氯前列素(nocloprost)、舒前列酮(sulprostone)、布塔前列素、15-酮pge2和19(r)羟基pge2。
[0045]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是在9-位被卤素取代的具有与pge2相似结构的前列腺素类似物或衍生物(参见例如wo2001/12596,所述专利通过引用整体并入本文),以及2-脱羧基-2-磷酸亚基前列腺素衍生物(诸如us 2006/0247214中描述的那些,所述专利通过引用整体并入本文)。
[0046]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是非基于pge2的配体。在一些实施方案中,所述前列腺素e受体信号传导的活化剂是cay10399、ono_8815ly、ono-ae1-259或cp-533,536。非基于pge2的ep2激动剂的其他实例包括wo 2007/071456中公开的咔唑和芴,关于此类剂的公开内容以引用的方式并入本文。非基于pge2的ep3激动剂的示例性实例包括但不限于ae5-599、mb28767、gr63799x、ono-nt012和ono-ae-248。非基于pge2的ep4激动剂的示例性实例包括但不限于ono-4819、aps-999na、ah23848和ono-ae 1-329。非基于pge2的ep4激动剂的其他实例可见于wo 2000/038663;美国专利号6,747,037;和美国专利号6,610,719,这些专利中的每个的关于此类激动剂的公开内容均以引用的方式并入。
[0047]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是wnt激动剂。wnt激动剂的示例性实例包括但不限于wnt多肽和糖原合酶激酶3(gsk3)抑制剂。适合用作刺激前列腺ep受体信号传导通路的化合物的wnt多肽的示例性实例包括但不限于wnt1、wnt2、wnt2b/13、wnt3、wnt3a、wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt7c、wnt8、wnt8a、wnt8b、wnt8c、wnt1oa、wnt1ob、wnt11、wnt14、wnt15或它们的生物活性片段。适合用作刺激前列腺素ep受体信号传导通路的剂的gsk3抑制剂结合至gsk3a或gsk3或者降低它们的活性。gsk3抑制剂的示例性实例包括但不限于bio(6-溴靛玉红-3'-肟)、licl、li2co3或其他gsk-3抑制剂,如美国专利第6057117号和第6608063号以及us 2004/0092535和us 2004/0209878所示例,以及atp竞争性、选择性gsk-3抑制剂chir-911和chir-837(也分别称为ct-99021/chir-99021和ct-98023/chir-98023)(chiron corporation(emeryville,ca))。chir-99021的结构是
[0048][0049]
或其盐。
[0050]
chir-98023的结构是
[0051][0052]
或其盐。
[0053]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是通过camp/p13k/akt第二信使通路增加信号传导的剂,诸如选自由以下组成的组的剂:二丁酰camp(dbcamp)、佛波酯(phorbol ester)、毛喉素(forskolin)、紫苏灵(sclareline)、8-溴-camp、霍乱毒素(ctx)、氨茶碱(aminophylline)、2,4二硝基苯酚(dnp)、去甲肾上腺素、肾上腺素、异丙肾上腺素、异丁基甲基黄嘌呤(ibmx)、咖啡因、茶碱(二甲基黄嘌呤)、多巴胺(dopamine)、咯利普兰(rolipram)、伊洛前列素、垂体腺苷酸环化酶活化多肽(pacap)和血管活性肠多肽(vip)以及这些剂的衍生物。
[0054]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是通过ca
2+
第二信使通路增加信号传导的剂,诸如选自由以下各项组成的组的剂:bapta-am、芬地林、尼卡地平和这些剂的衍生物。
[0055]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是通过no/血管紧张素信号传导增加信号传导的剂,诸如选自由以下组成的组的剂:l-arg、硝普钠(sodium nitroprusside)、钒酸钠、缓激肽及其衍生物。
[0056]
在一些实施方案中,转导细胞的方法包括使细胞与gsk3抑制剂接触。
[0057]
在一些实施方案中,所述gsk3抑制剂是chir-99021或chir-98023。
[0058]
在一些实施方案中,所述gsk3抑制剂是li2co3。
[0059]
在一些实施方案中,转导细胞的方法包括使细胞与卡拉酚a接触,这在例如ozog等人,blood 134:1298-1311(2019)中描述,其公开内容通过引用并入本文。
[0060]
在一些实施方案中,转导细胞的方法包括使细胞与聚阳离子聚合物接触。
[0061]
在一些实施方案中,所述聚阳离子聚合物是聚凝胺、硫酸鱼精蛋白、聚乙烯亚胺或聚乙二醇/聚-l-赖氨酸嵌段共聚物。
[0062]
在一些实施方案中,所述聚阳离子聚合物是硫酸鱼精蛋白。
[0063]
在一些实施方案中,转导细胞的方法包括使细胞与抑制mtor信号传导的剂接触。所述抑制mtor信号传导的剂可以是例如雷帕霉素(rapamycin),以及其他mtor信号传导的抑制剂。
[0064]
在一些实施方案中,转导细胞的方法包括使细胞与他克莫司(tacrolimus)和/或载体融合蛋白(vectorfusin)接触。
[0065]
在一些实施方案中,转导细胞的方法包括使细胞与环孢菌素(cyclosporine)(诸如环孢菌素a(csa)或环孢菌素h(csh))接触。
[0066]
在一些实施方案中,所述细胞在与所述病毒载体接触(例如,与上文所述的一种或多种剂组合)时旋转(例如,通过离心,即“离心”)。这个过程(在本文中称为“旋转”)可以例如约200xg至约2,000xg的向心力进行。在一些实施方案中,所述细胞在与所述病毒载体接触(例如,与上文所述的一种或多种剂组合)时以约300xg至约1,200xg的向心力旋转。例如,所述细胞可以在与所述病毒载体接触(例如,与上文所述的一种或多种剂组合)时以约300xg、400xg、500xg、600xg、700xg、800xg、900xg、1,000xg、1,100xg或1,200xg的向心力旋转。在一些实施方案中,使所述细胞旋转约10分钟至约3小时(例如,约10分钟、15分钟、20分钟、25分钟、30分钟、35分钟、40分钟、45分钟、50分钟、55分钟、60分钟、65分钟、70分钟、75分钟、80分钟、85分钟、90分钟、95分钟、100分钟、105分钟、110分钟、115分钟、120分钟、125分钟、130分钟、135分钟、140分钟、145分钟、150分钟、155分钟、160分钟、165分钟、170分钟、
175分钟、180分钟或更长)。在一些实施方案中,使所述细胞在室温下,诸如在约25℃的温度下旋转。
[0067]
在一些实施方案中,离体转染细胞(例如,多能细胞,诸如cd34+细胞(例如,造血干细胞或骨髓祖细胞)、诱导性多能干细胞和/或胚胎干细胞)以表达一种或多种蛋白质。例如,可以使用选自由以下组成的组的剂转染细胞:阳离子聚合物、二乙氨基乙基葡聚糖、聚乙烯亚胺、阳离子脂质、脂质体、磷酸钙、活化的树枝状聚合物和磁珠。在一些实施方案中,使用选自由以下组成的组的技术转染细胞:电穿孔、核转染(nucleofection)、挤压穿孔(squeeze-poration)、声致穿孔(sonoporation)、光学转染(optical transfection)、磁转染(magnetofection)和穿刺转染(impalefection)。
[0068]
在一些实施方案中,例如,在细胞是从患有克罗恩病的患者获得的自体细胞的情况下,通过在细胞中在编码缺陷型nod2蛋白的遗传基因座处复制功能性nod2基因来获得细胞(例如,多能细胞,诸如cd34+细胞(例如,造血干细胞或骨髓祖细胞)、诱导性多能干细胞和/或胚胎干细胞)。例如,在一些实施方案中,通过向细胞离体递送核酸酶来获得细胞,所述核酸酶在细胞基因组内的靶位置,诸如编码内源nod2的位置处催化磷酸二酯键的切割。
[0069]
所述核酸酶可以是例如成簇的规则间隔的短回文重复序列(crispr)相关蛋白。在一些实施方案中,所述crispr相关蛋白是crispr相关蛋白9(cas9)或crispr相关蛋白12a(cas12a)。在一些实施方案中,所述crispr相关蛋白是cas1、cas1b、cas2、cas3、cas4、cas5、cas6、cas7、cas8、csy1、csy2、csy3、cse1、cse2、csc1、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmr1、cmr3、cmr4、cmr5、cmr6、csb1、csb2、csb3、csx17、csx14、csx10、csx16、csax、csx3、csx1、csx15、csf1、csf2、csf3、csf4或cpf1核酸内切酶或其同源物(其天然存在的分子的重组),任选使用其密码子优化的基因表达。
[0070]
当使用crispr相关蛋白时,除了将核酸酶递送至细胞外,还可以将向导核糖核酸(grna)递送至细胞。grna可以指导核酸酶在编码nod2的细胞基因组内源区域内或附近位点特异性地实现一个或多个单链断裂或双链断裂。例如,grna可以指导核酸酶在细胞基因组中的内源nod2基因内或附近实现一个或多个单链断裂或双链断裂。在这种情况下,核酸酶可以诱导细胞基因组中的内源nod2基因的永久缺失或失活。
[0071]
在一些实施方案中,grna可以指导核酸酶在含有控制nod2表达的转录调控元件的细胞基因组区域(诸如含有内源nod2启动子的细胞基因组区域)内或附近实现一个或多个单链断裂或双链断裂。在这种情况下,核酸酶可以诱导控制nod2表达的转录调控元件的永久缺失或失活,诸如内源nod2启动子的永久缺失或失活。
[0072]
除了递送核酸酶和grna之外,还可以向细胞递送含有功能性nod2基因的核酸模板。在这种情况下,核酸酶可以在细胞中的内源nod2基因内或附近的基因座处实现单链断裂或双链断裂,从而促进含有功能性nod2基因的核酸模板插入含有单链断裂或双链断裂的基因座。这种插入导致内源nod2基因的永久插入或失活,以及模板核酸编码的功能性nod2基因的稳定表达。
[0073]
在一些实施方案中,代替将编码功能性nod2的模板核酸递送至细胞,递送至细胞的核酸酶可用于直接编辑细胞基因组,从而消除导致缺陷的nod2突变并再现功能性nod2基因表达。例如,在一种被称为碱基编辑的技术中,核酸酶可能在核酸酶活性方面被催化破坏,并且可能与本身含有grna的逆转录酶融合。核酸酶不能催化单链或双链断裂,但保留解
链靶dna所需的解旋酶活性。逆转录酶然后可以使用grna将逆转录酶导向细胞基因组内的靶位点,所述细胞基因组含有例如导致nod2活性缺陷的突变。优选地,grna编码对遗传基因座的编辑(例如,编码氨基酸取代),其恢复功能性nod2活性并消除导致缺陷的突变。一旦定位到靶位点,grna(称为“先导编辑向导rna”或“pegrna”)就可以作为模板,逆转录酶可以从所述模板完成所需的核苷酸编辑。例如,在anzalone等人,nature(2019)doi:10.1038/s41586-019-1711-4中描述了使用含pegrna的逆转录酶来位点特异性地编辑基因座的方法,其公开内容通过引用并入本文。可用于消除细胞中导致缺陷的nod2突变并再现功能性nod2蛋白的表达的用于dna碱基编辑的其他方法描述于cohen,“novel crispr-derived
‘
base editors’surgically alter dna or rna,offering new ways to fix mutations,’science magazine,2017年10月中,其公开内容通过引用并入本文。
[0074]
在一些实施方案中,递送至细胞的核酸酶是转录活化因子样效应物核酸酶、大范围核酸酶或锌指核酸酶。在这些情况下,当细胞与核酸酶接触时,所述细胞还可以与编码功能性nod2的核酸分子接触。在一些实施方案中,编码功能性nod2的核酸分子包含具有分别与位于靶位置的5’和靶位置的3’的核酸序列足够相似的核酸序列的5’同源臂和3’同源臂,以促进同源重组。
[0075]
在一些实施方案中,通过使细胞与编码核酸酶、grna和/或模板核酸的病毒载体接触,将上述核酸酶、grna和/或模板核酸递送至细胞。例如,编码核酸酶、grna和/或模板核酸的所述病毒载体可以是腺相关病毒(aav)、腺病毒、细小病毒、冠状病毒、弹状病毒、副粘病毒、细小核糖核酸病毒、甲病毒、疱疹病毒、痘病毒和逆转录病毒科家族病毒。在一些实施方案中,编码核酸酶、grna和/或模板核酸的所述病毒载体是逆转录病毒科家族病毒载体,诸如慢病毒载体、α逆转录病毒载体或γ逆转录病毒载体。在一些实施方案中,编码核酸酶、grna和/或模板核酸的所述逆转录病毒科家族病毒载体含有中央多嘌呤区、土拨鼠肝炎病毒转录后调控元件、5'-ltr、hiv信号序列、hiv psi信号5'-剪接位点、δ-gag元件、3'-剪接位点和3'-自失活ltr。在一些实施方案中,编码核酸酶、grna和/或模板核酸的所述病毒载体是整合缺陷型慢病毒载体(idlv),如例如wanisch等人,mol ther.17:1316-1332(2009)中所描述,其公开内容通过引用并入本文。在一些实施方案中,编码核酸酶、grna和/或模板核酸的所述病毒载体是选自由以下组成的组的aav:aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10和aavrh74。在一些实施方案中,编码核酸酶、grna和/或模板核酸的所述病毒载体是假型病毒载体,诸如选自由以下组成的组的假型病毒载体:假型aav、假型腺病毒、假型细小病毒、假型冠状病毒、假型弹状病毒、假型副粘病毒、假型细小核糖核酸病毒、假型甲病毒、假型疱疹病毒、假型痘病毒和假型逆转录病毒科家族病毒。
[0076]
在一些实施方案中,通过用编码核酸酶和/或grna和/或含有模板核酸的基因转染细胞,将核酸酶、grna和/或模板核酸递送至细胞。例如,在阳离子聚合物、二乙氨基乙基葡聚糖、聚乙烯亚胺、阳离子脂质、脂质体、磷酸钙、活化的树枝状聚合物和/或磁珠的存在下,通过使细胞与编码核酸酶和/或grna和/或含有模板核酸的基因接触,可以用编码核酸酶和/或grna和/或含有模板核酸的基因转染细胞。在一些实施方案中,使用选自由电穿孔、核转染、挤压穿孔、声致穿孔、光转染、磁转染和穿透组成的组的技术,用编码核酸酶和/或grna和/或含有模板核酸的基因转染细胞。
[0077]
可用于将核酸酶、grna和/或模板核酸递送至细胞的其他方法描述于例如martin
等人,cell stem cell 24:821-828(2019)中,其公开内容通过引用并入本文。
[0078]
在一些实施方案中,在向患者施用组合物之前,前体细胞群从患者或供体分离,并且所述前体细胞离体扩增,以产生将被施用给患者的细胞群。在一些实施方案中,所述前体细胞是cd34+hsc。在一些实施方案中,所述前体细胞在不丧失hsc功能潜力的情况下扩增。
[0079]
在一些实施方案中,通过使前体细胞与一种或多种本文所述或本领域已知的细胞扩增剂接触来离体扩增前体细胞,以促进细胞增殖,从而产生施用给受试者的细胞群。例如,所述扩增剂可以是stemregenin 1,在本领域中也称为化合物sr1,由下式(3)表示。
[0080][0081]
sr1和其他扩增剂描述于例如美国专利第8,927,281号和第9,580,426号中,这些专利中的每个的公开内容通过引用整体并入本文。
[0082]
可以与本公开的组合物和方法结合使用的另外的扩增剂包括化合物um-171,它在美国专利号9,409,906中有所描述,该专利的公开内容以引用的方式整体并入本文。可以用于本文的扩增剂还包括化合物um-171的结构或立体异构变体,诸如描述于us 2017/0037047中的化合物,所述专利的公开内容通过引用整体并入本文。化合物um-171的结构显示于下式(4)中。
[0083][0084]
在一些实施方案中,所述扩增剂是化合物(5)的溴化物盐,诸如由下式(5)表示的化合物。
[0085][0086]
可以与本公开的组合物和方法结合使用的其他扩增剂包括组蛋白脱乙酰基酶(hdac)抑制剂,如例如在wo 2000/023567中所述,所述专利的公开内容通过引用并入本文。可以用于扩增如本文所述的前体细胞群的示例性剂是曲古抑菌素a、环磷酰胺、环磷酰胺a、衣藻菌素(chlamydocin)、丁酸钠、二甲基亚砜、辛二羟肟酸、间羧基肉桂酸双异羟肟酸、hc-毒素、cyl-2、wf-3161、德布地欣(depudecin)和根赤壳菌素(radicicol)等等。
[0087]
在一些实施方案中,在从患者或供体中分离前体细胞之前,给所述患者或供体施用一种或多种刺激多能细胞(例如,cd34+hsc和hpc)从干细胞龛(诸如骨髓)迁移至外周循环的多能细胞动员剂。可以与本公开的组合物和方法结合使用的示例性细胞动员剂是本文所述的和本领域已知的。例如,动员剂可以是c-x-c基序趋化因子受体(cxcr)2(cxcr2)激动剂。cxcr2激动剂可以是gro-β或其截短变体。gro-β及其变体例如在美国专利号6,080,398;6,447,766;和6,399,053中有所描述,这些专利中的每个的公开内容以引用的方式整体并入本文。另外地或可替代地,所述动员剂可以包括cxcr4拮抗剂,诸如普乐沙福或其变体。普乐沙福和结构相似的化合物例如在美国专利号6,987,102;7,935,692;和7,897,590中有所描述,这些专利中的每个的公开内容以引用的方式并入本文。另外地或可替代地,所述动员剂可以包括粒细胞集落刺激因子(g-csf)。使用g-csf作为诱导多能细胞(例如,cd34+hsc和/或hpc)从干细胞龛动员到外周循环的剂描述于例如us 2010/0178271中,所述专利的公开内容通过引用整体并入本文。
[0088]
在一些实施方案中,在将所述细胞群施用给所述患者之前,通过将一种或多种调理剂施用给所述受试者来消融所述患者中的内源性多能细胞群(例如,内源性cd34+hsc或hpc群)。在一些实施方案中,所述方法包括通过在将所述细胞群施用给所述受试者之前将一种或多种调理剂施用给所述受试者来消融所述患者中的内源性多能细胞群(例如,内源性cd34+hsc或hpc群)。所述一种或多种调理剂可以是清髓性调理剂,其耗竭来自所述受试者骨髓的多种造血细胞。例如,所述一种或多种调理剂可以包括烷化剂,诸如氮芥(例如,苯达莫司汀(bendamustine)、苯丁酸氮芥(chlorambucil)、环磷酰胺、异环磷酰胺、氮芥或美法仑(melphalan))、亚硝脲(例如,卡莫司汀(carmustine)、洛莫司汀(lomustine)或链脲霉素(streptozocin))、烷基磺酸盐(例如,白消安(busulfan))、三嗪(例如,达卡巴嗪(dacarbazine)或替莫唑胺(temozolomide))或乙烯亚胺(例如,奥曲肽(altretamine)或噻替派(thiotepa))。在一些实施方案中,所述一种或多种调理剂是非清髓性调理剂,其选择性靶向并消融特定的内源性多能细胞群,诸如内源性cd34+hsc或hpc群。例如,所述一种或多种调理剂可以包括阿糖胞苷、抗胸腺细胞球蛋白、氟达拉滨(fludarabine)或伊达比星(fludarabine)。
[0089]
在一些实施方案中,在将所述细胞群施用给所述受试者后,所施用的细胞或其子代分化为一种或多种选自以下的细胞类型:巨核细胞、血小板细胞、血小板、红细胞、肥大细胞、成肌细胞、嗜碱性细胞、嗜中性粒细胞、嗜酸性粒细胞、小胶质细胞、粒细胞、单核细胞、破骨细胞、抗原呈递细胞、巨噬细胞、树突细胞、自然杀伤细胞、t淋巴细胞和b淋巴细胞。
[0090]
通过病毒基因疗法提供给患者的核酸
[0091]
在一些实施方案中,通过向患者施用一种或多种含有编码功能性nod2的核酸分子的病毒载体,将编码功能性nod2的核酸分子提供给患者。在一些实施方案中,将所述一种或多种病毒载体全身施用给患者。例如,所述一种或多种病毒载体可以通过静脉内注射施用给患者。在一些实施方案中,所述一种或多种病毒载体含有腺病毒、细小病毒、冠状病毒、弹状病毒、副粘病毒、细小核糖核酸病毒、甲病毒、疱疹病毒、痘病毒或逆转录病毒科家族病毒。在一些实施方案中,所述病毒载体是逆转录病毒科家族病毒载体,诸如慢病毒载体、α逆转录病毒载体或γ逆转录病毒载体。在一些实施方案中,所述逆转录病毒科家族病毒载体含有中央多嘌呤区、土拨鼠肝炎病毒转录后调控元件、5'-ltr、hiv信号序列、hiv psi信号5'-剪接位点、δ-gag元件、3'-剪接位点和3'-自失活ltr。在一些实施方案中,所述病毒载体是假型病毒载体,诸如选自由以下组成的组的假型病毒载体:假型腺病毒、假型细小病毒、假型冠状病毒、假型弹状病毒、假型副粘病毒、假型细小核糖核酸病毒、假型甲病毒、假型疱疹病毒、假型痘病毒和假型逆转录病毒科家族病毒。
[0092]
转录调控元件
[0093]
在本公开的前述方面或实施方案中任一个的一些实施方案中,核酸分子含有与遍在启动子可操作地连接的编码功能性nod2的转基因。所述遍在启动子可以是例如延伸因子1α(ef1α)启动子或ef1α启动子的无内含子形式,称为ef1α短(efs)启动子。在一些实施方案中,所述核酸分子含有与组织特异性启动子可操作地连接的编码功能性nod2的转基因。所述组织特异性启动子可以是例如sp146/p47启动子、cd11b启动子、cd68启动子、sp146/gp9启动子或内源nod2启动子。
[0094]
患者群体
[0095]
在本公开的前述方面或实施方案中的任一个的一些实施方案中,患者是哺乳动物,诸如人。在一些实施方案中,所述患者在编码功能性nod2的内源基因中具有功能丧失突变。所述突变可以是例如r702w、g908r或l1007fs。在一些实施方案中,所述突变是杂合的。在一些实施方案中,所述突变是纯合的。
[0096]
在一些实施方案中,所述患者先前已经用一种或多种免疫抑制剂、生物剂和/或皮质类固醇治疗。在一些实施方案中,所述患者对一种或多种免疫抑制剂、生物剂和/或皮质类固醇的治疗没有响应。一种或多种免疫抑制剂可包括例如硫唑嘌呤、甲氨蝶呤(methotrexate)和/或英夫利昔单抗(infliximab)或其他生物剂,包括其他单克隆抗体。
[0097]
在一些实施方案中,在向患者提供一种或多种增加功能性nod2的表达和/或活性的剂之前,所述患者表现出持续的疾病活动性,如通过内窥镜检查、结肠镜检查和/或磁共振肠造影所评估。
[0098]
在一些实施方案中,在向患者提供一种或多种增加功能性nod2的表达和/或活性的剂之前,如果所述患者将经历即将发生的手术程序,那么所述患者已被确定为处于短肠疾病和/或难治性结肠疾病的风险下。
[0099]
在一些实施方案中,在向患者提供一种或多种增加功能性nod2的表达和/或活性的剂之前,所述患者表现出持续的肛周病变,使得所述患者不是结肠直肠切除术的候选者。
[0100]
在一些实施方案中,在向患者提供一种或多种增加功能性nod2的表达和/或活性的剂之前,所述患者表现出受损的功能和/或生活质量。可以通过炎性肠病问卷(inflammatory bowel disease questionnaire;ibdq)、欧洲生活质量问卷(european questionnaire of life quality)或卡诺斯基指数(karnofsky index)来评估功能和/或生活质量。
[0101]
增加nod2表达的剂的治疗活性
[0102]
在一些实施方案中,在向患者提供一种或多种增加功能性nod2的表达和/或活性的剂之前,所述患者表现出持续的疾病缓解。例如,在向患者提供一种或多种增加功能性nod2的表达和/或活性的剂之后,患者可以表现出持续30天、两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月或一年或更长时间的疾病缓解。
[0103]
在一些实施方案中,在向患者提供一种或多种增加功能性nod2的表达和/或活性的剂之后,患者不再需要用免疫抑制剂、生物剂和/或皮质类固醇治疗。例如,所述患者可能在至少三个月内(例如,在约三个月至约一年,诸如三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月或一年或更长时间内)不需要用免疫抑制剂、生物剂和/或皮质类固醇治疗。在一些实施方案中,所述患者至至多五年内不需要用免疫抑制剂、生物剂和/或皮质类固醇治疗。
[0104]
在一些实施方案中,在向患者提供一种或多种增加功能性nod2的表达和/或活性的剂之后,所述患者不会表现出胃肠道中糜烂性疾病的迹象,如通过内窥镜检查和/或放射学所评估。
[0105]
例如,在向患者提供一种或多种增加功能性nod2的表达和/或活性的剂之后,患者在至少三个月内(例如,在约三个月至约一年,诸如三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月或一年或更长时间内)不会表现出胃肠道中糜烂性疾病的迹象,如通过内窥镜检查和/或放射学所评估。在一些实施方案中,所述患者在至少五年内不会表现出胃肠道中糜烂性疾病的迹象,如通过内窥镜检查和/或放射学所评估。
[0106]
药物组合物-表达功能性nod2的细胞
[0107]
在另一方面,本公开提供了一种药物组合物,其包含(i)表达功能性nod2的细胞群(例如,多能细胞)和(ii)一种或多种载体、稀释剂和/或赋形剂。所述细胞(例如,多能细胞)可以是例如人细胞,诸如人hsc或hpc。在一些实施方案中,所述细胞是胚胎干细胞。在一些实施方案中,所述细胞是诱导性多能干细胞。所述细胞可以是例如cd34+细胞,诸如骨髓祖细胞。在一些实施方案中,所述细胞是cd34+、cd38-、cd45ra-、cd90+、cd49f+和/或lin-。
[0108]
在一些实施方案中,所述组合物被配制用于向人类患者施用。例如,所述组合物可以被配制成用于静脉内注射至人类患者。
[0109]
在一些实施方案中,所述细胞(例如,多能细胞)对于患者是自体的。在一些实施方案中,所述细胞(例如,多能细胞)对于患者是同种异体的(例如,对于患者是hla匹配的)。
[0110]
在一些实施方案中,所述细胞(例如,多能细胞)包含与遍在启动子可操作地连接的编码功能性nod2的转基因。所述启动子可以是ef1α启动子或efs启动子。所述细胞可以包含与组织特异性启动子可操作地连接的编码功能性nod2的转基因。所述启动子可以是例如
cd11b启动子、sp146/p47启动子、cd68启动子、sp146/gp9启动子或内源nod2启动子。
[0111]
药物组合物-表达功能性nod2的病毒载体
[0112]
另一方面,本公开提供了一种药物组合物,其包含(i)编码功能性nod2的病毒载体和(ii)一种或多种载体、稀释剂和/或赋形剂。
[0113]
在一些实施方案中,所述病毒载体选自由以下组成的组:逆转录病毒科家族病毒、腺病毒、细小病毒、冠状病毒、弹状病毒、副粘病毒、细小核糖核酸病毒科、甲病毒、疱疹病毒和痘病毒。
[0114]
在一些实施方案中,所述病毒载体是逆转录病毒科家族病毒载体,诸如慢病毒载体、α逆转录病毒载体或γ逆转录病毒载体。在一些实施方案中,所述逆转录病毒科家族病毒载体含有中央多嘌呤区、土拨鼠肝炎病毒转录后调控元件、5'-ltr、hiv信号序列、hiv psi信号5'-剪接位点、δ-gag元件、3'-剪接位点和3'-自失活ltr。在一些实施方案中,所述病毒载体是假型病毒载体,诸如选自由以下组成的组的假型病毒载体:假型腺病毒、假型细小病毒、假型冠状病毒、假型弹状病毒、假型副粘病毒、假型细小核糖核酸病毒、假型甲病毒、假型疱疹病毒、假型痘病毒和假型逆转录病毒科家族病毒。
[0115]
在一些实施方案中,所述组合物被配制用于例如通过静脉内注射至患者向人类患者施用。
[0116]
在一些实施方案中,所述病毒载体包含与遍在启动子可操作地连接的编码功能性nod2的转基因。所述启动子可以是ef1α启动子或efs启动子。在一些实施方案中,所述病毒载体包含与组织特异性启动子可操作地连接的编码nod2的转基因。在一些实施方案中,所述启动子是cd11b启动子、sp146/p47启动子、cd68启动子、sp146/gp9启动子或内源nod2启动子。
[0117]
试剂盒
[0118]
在另一方面,本公开提供了一种试剂盒,其包括本公开的前述方面或实施方案中的任一个的药物组合物。所述试剂盒还可以包括包装插页,所述包装插页指导试剂盒的使用者向患有克罗恩病的人类患者施用药物组合物。在一些实施方案中,所述包装插页指导试剂盒的使用者执行本公开的上述方面或实施方案的方法。
[0119]
定义
[0120]
如本文所用,术语“消融(ablate/ablating/ablation)”、“调理(condition/conditioning)”等是指体内或离体细胞群中一种或多种细胞的耗竭。在本公开的一些实施方案中,可能需要在向患者施用治疗组合物(诸如治疗性细胞群)之前消融患者(诸如经历本文所述疾病治疗的患者)内的内源性细胞。这可以是有益的,例如,为新施用的细胞提供可移植细胞的环境。内源性细胞群的消融可以以选择性靶向特定细胞类型的方式进行,例如,使用抗体-药物缀合物,其结合靶细胞上表达的抗原并随后导致靶细胞的杀伤。另外地或可替代地,可以使用不定位于特定细胞类型而是能够对多种不同细胞发挥其细胞毒性作用的细胞毒素以非特异性方式进行消融。消融的实例包括耗竭至少5%的体内或体外的细胞群中的细胞(例如,至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或更多)。可以使用多种细胞计数技术对细胞样品内的细胞计数进行定量,诸如通过使用计数室、coulter计数器、流式细胞术或本领域已知的其他细胞计数方法。
[0121]
根据本公开的组合物和方法可用于“消融”患者体内的细胞群(即“调理”患者以进
行治疗)的示例性剂包括烷化剂,诸如氮芥(例如,苯达莫司汀、苯丁酸氮芥、环磷酰胺、异环磷酰胺、氮芥或美法仑)、亚硝脲(例如,卡莫司汀、洛莫司汀或链脲霉素)、烷基磺酸盐(例如,白消安)、三嗪(例如,达卡巴嗪或替莫唑胺)或乙烯亚胺(例如,奥曲肽或噻替派)在一些实施方案中,所述一种或多种调理剂是非清髓性调理剂,其选择性靶向并消融特定的内源性多能细胞群,诸如内源性cd34+hsc或hpc群。例如,所述一种或多种调理剂可以包括阿糖胞苷、抗胸腺细胞球蛋白、氟达拉滨或伊达比星。
[0122]
如本文所用,术语“约”是指相对于参考量变化多达30%(例如,25%、20%、25%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%)的量。
[0123]
如本文在所关注的蛋白质的上下文中使用的,术语“活性”是指与蛋白质的野生型形式相关的生物学功能。例如,在酶的上下文中,术语“活性”是指蛋白质以产生相应化学反应产物的方式实现底物周转的能力。例如,可以使用本领域已知的底物周转分析来检测和定量酶的活性水平。又如,在膜结合受体的上下文中,术语“活性”可以指由受体启动的信号转导,例如,在与其同源配体结合时。可以检测和定量参与信号转导通路的受体的活性水平,例如,通过观察受体信号转导结果的增加,诸如一种或多种基因转录的增加(可以例如使用本领域已知的聚合酶链式反应技术检测到)。
[0124]
如本文所用,“激活前列腺素e受体信号传导”等的化合物是指具有增加与特定化合物接触的前列腺素e受体表达细胞中的前列腺素e受体的信号转导活性的能力的化合物,如与未与特定化合物接触的前列腺素e受体表达细胞中的前列腺素e受体信号转导活性相比。可用于测量前列腺素e受体信号转导的测定描述于例如wo 2010/108028中,其公开内容通过引用并入本文,因为它涉及评估前列腺素e受体信号传导的方法。
[0125]
如本文所用,术语“施用(administering、administration)”等等是指通过任何有效途径给患者直接施用治疗剂(例如细胞群,诸如多能细胞群(例如,胚胎干细胞、诱导性多能干细胞、或cd34+细胞))。示例性施用途径在本文中描述并且包括全身施用途径,诸如静脉注射等。
[0126]
如本文所用,术语“同种异体”是指从同一物种的不同受试者获得或衍生的细胞、组织、核酸分子或其他物质。例如,在表达一种或多种本文描述的蛋白质的细胞群(例如,多能细胞群)的情况下,同种异体细胞包括:(i)从未接受治疗的受试者获得,然后(ii)用指导一种或多种所需蛋白质表达的载体转导或转染的那些细胞。短语“指导表达”是指包括编码一种或多种待表达蛋白质的一种或多种多核苷酸。多核苷酸可包含增强所关注蛋白质的表达的其他序列基序。
[0127]
如本文所用,术语“自体”是指从个体自身的细胞、组织、核酸分子等获得或衍生的细胞、组织、核酸分子或其他物质。例如,在表达一种或多种本文描述的蛋白质的细胞群(例如,多能细胞群)的背景下,自体细胞包括从接受治疗的患者获得,然后用载体转导或转染指导一种或多种所关注的蛋白质的表达的那些细胞。
[0128]
如本文所用,术语“细胞类型”是指共享基于基因表达数据在统计学上可分离的表型的一组细胞。例如,常见细胞类型的细胞可共享相似的结构和/或功能特征,诸如相似的基因激活模式和抗原呈递特征谱。常见细胞类型的细胞可包括从常见组织(例如,上皮组织、神经组织、结缔组织或肌肉组织)分离的那些和/或从常见器官、组织系统、血管或生物体的其他结构和/或区域分离的那些。
[0129]
如本文所用,“密码子优化”是指根据编码dna中同义密码子(例如,编码相同氨基酸的密码子)的出现频率在不同物种中有偏差的原理修饰核酸序列的过程。这种密码子简并性使得相同的多肽可以由多种核苷酸序列编码。以这种方式修饰的序列在本文中被称为“密码子优化的”这个过程可以在本说明书中描述的任何序列上进行,以增强表达或稳定性。密码子优化可以诸如美国专利第7,561,972号、第7,561,973号和第7,888,112号中描述的方式进行,所述专利中的每一个通过引用整体并入本文。根据已知方法,翻译起始位点周围的序列可以被转换成共有kozak序列。参见例如,kozak等人,nucleic acids res.15(20):8125-8148,其通过引用整体并入本文。可以并入多个终止密码子。
[0130]
如本文所用,术语“调理(condition和conditioning)”是指接受者准备接受含有细胞群(例如,多能细胞群,诸如cd34+细胞)的移植物的过程。此类程序例如通过选择性耗竭内源性细胞(例如,内源性cd34+细胞等)从而产生空位,所述空位依次被外源性细胞移植物填补,从而促进细胞移植物的植入。根据本文所述的方法,可通过将一种或多种能够消融内源性细胞(例如,cd34+细胞等)、放射疗法或它们的组合的剂施用于受试者来调节受试者以进行细胞移植程序。与本公开的组合物和方法结合使用的调理方案可以是清髓性的或非清髓性的。也可以使用本领域熟知的其他细胞消融剂和方法(例如,抗体和抗体-药物缀合物)。
[0131]
如本文所用,术语“保守突变”、“保守取代”、“保守氨基酸取代”等是指一个或多个氨基酸取代成表现出相似物理化学特性(诸如极性、静电荷和空间体积)的一个或多个不同的氨基酸。下表1中汇总了二十种天然存在的氨基酸中的每一种的这些性质。
[0132]
表1.天然存在的氨基酸的代表性物理化学性质
[0133]
[0134][0135]
由此表应认识到,保守氨基酸家族包括(i)g、a、v、l和i;(ii)d和e;(iii)c、s和t;(iv)h、k和r;(v)n和q;以及(vi)f、y和w。因此,保守突变或取代是一个氨基酸取代成同一氨基酸家族的成员的一种突变或取代(例如,ser取代成thr或lys取代成arg)。
[0136]
如本文在所关注基因的情形中所使用,术语“破坏”是指阻止功能基因产物的形成。根据本发明,如果基因产物实现其正常(野生型)功能,则认为所述基因产物是功能性的。基因的破坏阻止了由所述基因编码的功能性因子(例如,蛋白质)的表达,并且可以通过例如在由所述基因和/或启动子和/或操纵子编码的序列中插入、缺失或取代一个或多个碱基来实现,所述碱基是所述基因在受试者中表达所必需的。被破坏的基因可以通过例如从受试者的基因组中去除至少一部分基因、改变基因以阻止由所述基因编码的功能性因子(例如,蛋白质)的表达、干扰rna或外源基因显性负因子的表达而被破坏。遗传修饰细胞(例如,多能细胞,诸如cd34+细胞、造血干细胞和骨髓祖细胞等)以破坏一种或多种基因的表达的材料和方法在例如us 8,518,701、us9,499,808和us 2012/0222143中详述,其中每一个的公开内容通过引用整体并入本文(在冲突的情况下,以本说明书为准)。
[0137]
如本文所用,术语“胚胎干细胞”和“es细胞”是指来源于胚泡的内细胞团的胚胎来源的全能或多能干细胞,其可在合适条件下保持在体外培养物中。es细胞能够分化为三种脊椎动物胚层中的任何一种细胞,例如内胚层、外胚层或中胚层。es细胞的特征还在于其能
够在合适的体外培养条件下无限繁殖。es细胞描述于例如thomson等人,science 282:1145(1998)中,所述文献的公开内容通过引用并入本文,因为其涉及胚胎干细胞的结构和功能。
[0138]
如本文所用,术语“内源性”描述天然存在于特定生物体(例如,人)中或生物体内的特定位置(例如,器官、组织或细胞,诸如人细胞)中的分子(例如,多肽、核酸或辅因子)。
[0139]
如本文所用,术语“外源性”描述不天然存在于特定生物体(例如,人)中或生物体内的特定位置(例如,器官、组织或细胞,诸如人细胞)中的分子(例如,多肽、核酸或辅因子)。外源性材料包括由外部来源提供给生物体或提供给从其中提取的培养物质的那些材料。
[0140]
如本文所用,术语“扩增剂”是指能够促进给定细胞类型离体增殖的物质。因此,“造血干细胞扩增剂”或“hsc扩增剂”是指能够促进体外造血干细胞群增殖的物质。造血干细胞扩增剂包括实现造血干细胞群增殖使得细胞保留造血干细胞功能潜力的那些。可以与本公开的组合物和方法结合使用的示例性造血干细胞扩增剂包括但不限于芳烃受体拮抗剂,诸如美国专利号8,927,281和9,580,426中描述的那些物质,这些专利中的每个的公开内容以引用的方式整体并入本文,特别是化合物sr1。可以与本公开的组合物和方法结合使用的其他造血干细胞扩增剂包括化合物um-171和美国专利号9,409,906中描述的其他化合物,该专利的公开内容以引用的方式整体并入本文。造血干细胞扩增剂还包括化合物um-171,诸如us 2017/0037047中描述的化合物的结构和/或立体异构变体,该专利的公开内容以引用的方式整体并入本文。适用于本公开的其他造血干细胞扩增剂包括组蛋白脱乙酰基酶(hdac)抑制剂,诸如曲古抑菌a、环磷酰胺、环磷酰胺a、衣藻菌素、丁酸钠、二甲亚砜、辛二羟肟酸、间羧基肉桂酸双异羟肟酸、hc-毒素、cyl-2、wf-3161、德布地欣和根赤壳菌素等,例如在wo 2000/023567中有所描述,该质量的公开内容以引用的方式并入本文。
[0141]
如本文所用,术语“表达”是指以下事件中的一个或多个:(1)从dna序列产生rna模板(例如,通过转录);(2)rna转录物的加工(例如,通过剪接、编辑、5'帽形成和/或3’端加工);(3)将rna翻译成多肽或蛋白质;以及(4)多肽或蛋白质的翻译后修饰。在编码蛋白质产物的基因的上下文中,术语“基因表达”等与术语“蛋白质表达”等可互换使用。受试者中所关注的基因或蛋白质的表达可以通过例如检测来表现:从受试者获得的样品中的编码相应蛋白质的mrna的数量或浓度的增加(如使用本文描述的或本领域已知的rna检测程序所评估,诸如定量聚合酶链式反应(qpcr)和rnaseq技术)、相应蛋白质的数量或浓度的增加(如使用本文所述或本领域已知的蛋白质检测方法所评估,诸如酶联免疫吸附测定法(elisa)等)、和/或相应蛋白质的活性增加(例如,在酶的情况下,如使用本文所述或本领域已知的酶活性测定法所评估)。如本文所用,如果可以在细胞或细胞所在的培养基中检测到上述事件中的一个或多个或全部,则认为细胞“表达”所关注的基因或蛋白质。例如,如果可以检测到以下事件,则认为所关注的基因或蛋白质由细胞或细胞群“表达”:(i)细胞或细胞群产生相应的rna转录物,诸如mrna模板(例如,使用本文所述的rna检测程序);(ii)rna转录物的加工(例如,剪接、编辑、5'帽形成和/或3'末端加工,诸如使用本文所述的rna检测程序);(iii)将rna模板翻译成蛋白质产物(例如,使用本文所述的蛋白质检测程序);和/或(iv)蛋白质产物的翻译后修饰(例如,使用本文所述的蛋白质检测程序)。
[0142]
如本文所用,术语“功能潜力”涉及多能细胞,诸如造血干细胞,是指干细胞的功能性质,包括:1)多能性(指分化成多种不同的血系的能力,包括但不限于粒细胞(例如早幼粒
细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性细胞)、红细胞(例如网织红细胞、红细胞)、血小板细胞(例如巨核细胞、产生血小板的巨核细胞、血小板)、单核细胞(例如单核细胞、巨噬细胞)、树突细胞、小胶质细胞、破骨细胞和淋巴细胞(例如,nk细胞、b细胞和t细胞));2)自我更新(指干细胞产生与母细胞具有同等潜力的子细胞的能力,而且这种能力可以在个体的一生中反复发生而不会衰竭);以及3)干细胞或其子代被重新引入移植受体的能力,然后它们归巢到干细胞龛并重新建立生产性和持续的细胞生长和分化。
[0143]
如本文所用,术语“造血干细胞”和“hsc”是指具有自我更新和分化成不同谱系的成熟血细胞的能力的未成熟血细胞,包括但不限于粒细胞(例如早幼粒细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性细胞)、红细胞(例如网织红细胞、红细胞)、血小板细胞(例如巨核细胞、产生血小板的巨核细胞、血小板)、单核细胞(例如单核细胞、巨噬细胞)、树突细胞、小胶质细胞、破骨细胞和淋巴细胞(例如,nk细胞、b细胞和t细胞)。本领域已知此类细胞可以包括或不包括cd34+细胞。cd34+细胞是表达cd34+细胞表面标志物的未成熟细胞。在人类中,cd34+细胞被认为包括具有上述干细胞特性的细胞亚群,而在小鼠中,hsc是cd34-。此外,hsc还指长期再造hsc(lt-hsc)和短期再造hsc(st-hsc)。lt-hsc和st-hsc根据功能潜力和细胞表面标志物表达进行区分。例如,人hsc可以是cd34+、cd38-、cd45ra-、cd90+、cd49f+和lin-(成熟谱系标志物阴性,包括co2、cd3、cd4、cd7、cd8、cd10、cd11b、cd19、cd20、cd56、cd235a)。在小鼠中,骨髓lt-hsc可以是cd34-、sca-1+、c-kit+、cd135-、slamf1/cd150+、cd48-和lin-(成熟谱系标志物阴性,包括ter119、cd11b、gr1、cd3、cd4、cd8、b220、il-7ra),而st-hsc可以是cd34+、sca-1+、c-kit+、cd135-、slamf1/cd150+和lin-(成熟谱系标志物阴性,包括ter119、cd11b、gr1、cd3、cd4、cd8、b220、il-7ra)。此外,在稳态条件下,st-hsc比lt-hsc更少静息(即更活跃)和更具增殖性。然而、lt-hsc具有更大的自我更新潜力(即,它们可以在整个成年期存活,并且可以通过连续受者进行连续移植),而st-hsc的自我更新能力有限(即,它们只能存活有限的时间,并且不具备连续移植的潜力)。任何这些hsc均可以用于本文所述的任何方法。或者,st-hsc是有用的,因为它们具有高度增殖性,因此可以更快地产生分化的子代。
[0144]
如本文所用,抑制组蛋白去乙酰化的试剂是指物质或组合物(例如,小分子、蛋白质、干扰rna、信使rna或其他天然或合成化合物,或组合物如病毒或由以下物质组成的其他材料)多种物质)能够减弱或阻止组蛋白去乙酰化酶的活性,更特别是通过直接相互作用或通过间接方式(例如通过导致细胞中产生的组蛋白去乙酰化酶的量减少或通过抑制组蛋白脱乙酰酶和乙酰化组蛋白底物之间的相互作用。抑制组蛋白去乙酰化酶的酶活性意味着降低组蛋白去乙酰化酶催化从组蛋白残基(例如,单-、二-或三-甲基化的赖氨酸残基;单甲基化的精氨酸残基)去除乙酰基的能力。,或组蛋白内的对称/不对称二甲基化精氨酸残基)。优选地,这种抑制是特异性的,使得抑制组蛋白去乙酰化的剂降低组蛋白去乙酰化酶从组蛋白残基中去除乙酰基的能力,该浓度低于产生所需的抑制剂的浓度另一种不相关的生物学效应。
[0145]
如本文所用,术语“组蛋白脱乙酰酶”和“hdac”是指催化从组蛋白n-末端赖氨酸残基的ε-氨基中去除乙酰基的酶家族中的任何一种。除非上下文另有说明,否则术语“组蛋白”是指[来自任何物种的任何组蛋白,包括hi、h2a、h2b、h3、h4和h5。人类hdac蛋白或基因产物,包括但不限于hdac-1、hdac-2、hdac-3、hdac-4、hdac-5、hdac-6、hdac-7、hdac-8、
hdac-9、hdac-10和hdac-11。
[0146]
如本文所用,术语“hla匹配”是指其中供体和受体之间没有任何hla抗原不匹配的供体-受体对,诸如为需要造血干细胞移植治疗的受体提供造血干细胞移植物的供体。hla匹配(即所有6个等位基因都匹配)的供体-受体对移植物排斥的风险降低,因为内源性t细胞和nk细胞不太可能将传入的移植物识别为外来物,因此不太可能对移植物产生免疫响应。
[0147]
如本文所用,术语“hla错配”是指其中至少一种hla抗原,特别是hla-a、hla-b、hla-c和hla-dr错配在供体和受体之间的供体-受体对,诸如为需要造血干细胞移植治疗的受体提供造血干细胞移植物的供体。在一些实施方案中,一种单倍型匹配而另一种错配。与hla匹配的供体-受体对相比,hla不匹配的供体-受体对可能具有更高的移植排斥风险,因为在hla不匹配的情况下,内源性t细胞和nk细胞更有可能将传入的移植物识别为外来移植物供体-受体对,因此此类t细胞和nk细胞更有可能对移植物产生免疫响应。
[0148]
如本文所用,术语“诱导性多能干细胞”、“ips细胞”和“ipsc”是指可直接来源于分化的体细胞的多能干细胞。可以通过将特定的重编程因子组引入非多能细胞来产生人类ips细胞,这些因子可以包括例如oct3/4、sox家族转录因子(例如,sox1、sox2、sox3、soxl5)、myc家族转录因子(例如,c-myc、1-myc、n-myc)、kruppel样家族(klf)转录因子(例如,klf1、klf2、klf4、klf5)和/或相关转录因子,诸如nanog、lin28和/或glis1。例如,也可以通过使用mirna、模拟转录因子作用的小分子或谱系区别因子来生成人类ips细胞。人类ips细胞的特征在于它们能够分化为三种脊椎动物胚层中的任何细胞,例如内胚层、外胚层或中胚层。人类ips细胞的特征还在于它们能够在合适的体外培养条件下无限繁殖。人ips细胞描述于例如takahashi和yamanaka,cell 126:663(2006)中,该文献的公开内容以引用的方式并入本文,因为其涉及ips细胞的结构和功能。
[0149]
如本文所用,术语“抑制剂”是指结合靶分子和/或以其他方式抑制靶分子的活性的剂(例如,小分子、肽片段、蛋白质、抗体或其抗原结合片段)。
[0150]
如本文在造血干细胞和/或祖细胞的情形中所使用,术语“动员”是指此类细胞从细胞通常驻留的干细胞龛(例如,骨髓)释放到外周循环中。“动员剂”是能够诱导造血干细胞和/或祖细胞从干细胞龛释放到外周循环中的剂。
[0151]
如本文所用,术语“清髓性(myeloablative或myeloablation)”是指通常通过暴露于细胞毒性剂或辐射而显著损害或破坏造血系统的调理方案。清髓包括通过高剂量的细胞毒剂或破坏造血系统的全身照射引起的完全清髓。
[0152]
如本文所用,术语“非清髓性(non-myeloablative或myelosuppressive)”是指不消除基本上所有宿主来源的造血细胞的调理方案。
[0153]
相对于参考多核苷酸或多肽序列而言的“序列同一性百分比(%)”定义为在将序列比对并且在需要时引入空位以实现最大序列同一性百分比之后,在候选序列中与参考多核苷酸或多肽序列中的核酸或氨基酸相同的核酸或氨基酸的百分比。用于确定核酸或氨基酸序列同一性百分比的比对可以以在本领域技术人员能力范围内的各种方式实现,例如,使用可公开获得的计算机软件,诸如blast、blast-2或megalign软件。本领域技术人员可以确定用于比对序列的适当参数,包括实现在所比较序列的全长上实现最大比对所需的任何算法。例如,可使用序列比较计算机程序blast生成序列同一性百分比值。例如,给定核酸或
氨基酸序列a与给定核酸或氨基酸序列b的序列同一性百分比(也可以表述为给定核酸或氨基酸序列a与给定核酸或氨基酸序列b具有一定的序列同一性百分比)计算公式如下:
[0154]
100
×
(分数x/y)
[0155]
其中x是通过序列比对程序(例如,blast)在所述程序的a和b的比对中评分为相同匹配的核苷酸或氨基酸的数目,并且其中y是b中核酸的总数。应当理解,在核酸或氨基酸序列a的长度不等于核酸或氨基酸序列b的长度的情况下,a对于b的序列同一性百分比将不等于b对于a的序列同一性百分比。
[0156]
如本文所用,术语“药学上可接受的”是指适于与受试者,诸如哺乳动物(例如,人)的组织接触而无过度的毒性、刺激、过敏响应和其他问题并发症的与合理效益/风险比相称的那些化合物、材料、组合物和/或剂型。
[0157]
如本文所用,术语“药物组合物”是指含有治疗剂(例如,将nod2活性和/或表达增加至生理正常水平的剂)的组合物,所述组合物可以施用给受试者,诸如哺乳动物,例如人,以预防、治疗或控制影响哺乳动物的特定疾病或疾患,诸如本文所述的克罗恩病。
[0158]
如本文所用,术语“多能细胞”是指具有发育成多于一种分化细胞类型的能力的细胞,诸如造血谱系的细胞类型(例如,粒细胞(例如,早幼粒细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性细胞)、红细胞(例如,网织红细胞、红细胞)、血小板细胞(例如,巨核细胞、产生血小板的巨核细胞、血小板)、单核细胞(例如,单核细胞、巨噬细胞)、树突细胞、小胶质细胞、破骨细胞和淋巴细胞(例如,nk细胞、b细胞和t细胞))。多能细胞的实例是esc、ipsc和cd34+细胞。
[0159]
如本文所用,术语“启动子”是指dna上由rna聚合酶结合的识别位点。聚合酶驱动转基因的转录。适合与本文所述的组合物和方法一起使用的示例性启动子描述于例如sandelin等人,nature reviews genetics 8:424(2007),该文献的公开内容以引用的方式并入本文,因为它涉及核酸调控元件。此外,术语“启动子”可以指合成启动子,它是生物系统中不天然存在的调节性dna序列。合成启动子包含与自然界不存在的多核苷酸序列相结合的部分天然启动子,可以使用各种转基因、载体和靶细胞类型对其进行优化以表达重组dna。
[0160]
如本文所用,术语“组织特异性启动子”指选择性促进特定细胞类型或组织类型中的所关注基因的表达的启动子。可与本公开的组合物和方法结合使用的组织特异性启动子的实例包括sp146/p47启动子、cd11b启动子、cd68启动子和sp146/gp9启动子等。
[0161]
如本文所用,术语“遍在启动子”是指促进所关注基因在多种细胞类型或组织类型中的表达的启动子,诸如在一种细胞类型中不表现出促进基因表达优于另一种细胞类型或在一种组织类型中不表现出促进基因表达优于另一种组织类型的启动子。可以与本公开的组合物和方法结合使用的遍在启动子的实例包括延伸因子1-α启动子等。
[0162]
如本文所用,术语“质粒”是指其他dna区段可接合到其中的染色体外环状双链dna分子。质粒是一种类型的载体,是能够转运已与其连接的另一种核酸的核酸分子。某些质粒能够在其被引入的宿主细胞中自主复制(例如,具有细菌复制起点的细菌质粒和附加型哺乳动物质粒)。其他载体(例如,非附加型哺乳动物载体)可在导入宿主细胞后整合到宿主细胞的基因组中,并且由此随宿主基因组一起复制。某些质粒能够指导其可操作地连接的基因的表达。
[0163]
如本文所用,如果向患者直接施用治疗剂,或如果向患者施用在体内被加工或代谢以便内源性产生治疗剂的物质,那么认为将治疗剂“提供”给患者。例如,可通过直接施用蛋白质或通过施用在体内被加工或代谢以便内源性产生治疗剂的物质(例如,nod2基因)向患者(诸如患有本文所述的克罗恩病的患者)提供本公开的蛋白质(例如,功能性nod2)。向患者“提供”所关注蛋白质的其他实例是其中向患者施用以下的情况:(i)编码所关注蛋白质的核酸分子,(ii)含有此类核酸分子的载体(例如,病毒载体),(iii)含有此类载体或核酸分子的细胞或细胞群,(iv)干扰rna分子,诸如sirna、shrna或mirna分子,其在施用给患者后刺激蛋白质的内源性表达,或(v)蛋白质前体,其例如通过一种或多种翻译后修饰被加工,以内源性产生所需蛋白质。
[0164]
如本文所用,术语“调控序列”包括控制基因的转录或翻译的启动子、增强子和其他表达控制元件(例如,聚腺苷酸化信号)。此类调控序列描述于例如于perdew等人,regulation of gene expression(humana press,new york,ny,(2014))中;所述文献通过引用并入本文。
[0165]
如本文所用,术语“样品”是指从受试者中分离的样本(例如,血液、血液组分(例如,血清或血浆)、尿液、唾液、羊水、脑脊液、组织(例如,胎盘或真皮组织)、胰液、绒毛膜和细胞)。术语样品也可以涉及制备或加工的样品,诸如含mrna或cdna的样品。
[0166]
如本文所用,术语“剪接变体”是指单个基因的转录产物(即rna),由于在前体mrna内选择性地包含或排除特定外显子(例如,外显子跳跃),所述转录产物可被加工以产生不同的mrna分子。由特定剪接变异体翻译产生的蛋白质在结构和生物活性上可能不同。
[0167]
如本文所用,术语“干细胞”和“未分化细胞”是指处于未分化或部分分化状态的细胞,其具有分化成多种细胞类型的发育潜力。干细胞能够增殖并产生更多此类干细胞,同时保持它们的功能潜力。干细胞可以不对称分裂,这被称为强制性不对称分化,其中一个子细胞保留亲本干细胞的功能潜力,而另一个子细胞表达与亲本细胞不同的其他特定功能、表型和/或发育潜力。子细胞本身可以被诱导增殖并产生子代,这些子代随后分化为一种或多种成熟细胞类型,同时还保留一种或多种具有亲代发育潜力的细胞。分化细胞可以来源于专能细胞,而专能细胞本身来源于专能细胞,依此类推。或者,群体中的一些干细胞可以对称地分裂成两个干细胞。因此,术语“干细胞”是指在特定情况下具有分化成更特化或分化的表型的发育潜力,并且在某些情况下保持增殖而不显著分化的能力的任何细胞亚群。在一些实施方案中,术语干细胞通常是指天然存在的亲本细胞,其子代(子代细胞)通过分化(例如通过获得完全个体特征,如在胚胎细胞和组织的逐渐多样化中所出现)而专门化,通常在不同方向上专门化。一些分化的细胞还具有产生更大发育潜力的细胞的能力。这种能力可以是自然的,也可以是在用各种因素处理后人为诱导的。从干细胞开始的细胞可能会朝着分化的表型发展,但随后可以被诱导“逆转”并重新表达干细胞表型,这个术语通常被本领域的普通技术人员称为“去分化”或“重编程”或“逆分化”。
[0168]
如本文所用,术语“转基因”是指编码基因产物(例如,本文所述的基因产物)的重组核酸(例如,dna或cdna)。基因产物可以是rna、肽或蛋白质。除了基因产物的编码区之外,转基因可以包括或可操作地连接至一个或多个元件以促进或增强表达,诸如启动子、一个或多个增强子、一个或多个去稳定结构域、一个或多个响应元件、一个或多个报告元件、一个或多个隔离元件、一个或多个聚腺苷酸化信号和/或其他功能元件。本公开的实施方案可
以利用任何已知的合适的启动子、一个或多个增强子、一个或多个去稳定结构域、一个或多个响应元件、一个或多个报告元件、一个或多个隔离元件、一个或多个聚腺苷酸化信号和/或其他功能元件。
[0169]
如本文所用,术语“转染”是指常用于将外源dna引入原核或真核宿主细胞中的广泛多种技术中的任一种,例如电穿孔、脂质转染、磷酸钙沉淀、deae-葡聚糖转染、核转染、挤压穿孔、声致穿孔、光学转染、磁转染、穿刺转染等。
[0170]
如本文所用,术语“受试者”和“患者”可互换使用,并且是指处于发展疾病的风险下或已被诊断为患有疾病和/或正在经历疾病治疗的生物体(例如哺乳动物,诸如人),所述疾病诸如本文所述的克罗恩病。
[0171]
如本文所用,术语“转导(transduction和transduce)”是指将病毒载体构建体或其部分引入细胞并随后在细胞中表达由载体构建体或其部分编码的转基因的方法。
[0172]
如本文所用,“治疗(treatment和treating)”是指用于获得有益的或期望的结果,例如临床结果的方法。有益的或期望的结果可包括但不限于减轻或改善一种或多种症状或疾患;减少疾病或疾患的程度;稳定(即,不恶化)疾病、病症或疾患的状态;防止疾病或疾患的传播;延迟或减缓疾病或疾患的进展;改善或缓解疾病或疾患;以及可检测的或不可检测的缓解(部分或全部)。“改善”或“减轻”疾病或疾患是指与在不治疗的情况下的程度或时间过程相比,疾病、病症或疾患的程度和/或不期望的临床表现减轻和/或进展的时间过程减慢或延长。“治疗”还可意指相比于不接受治疗时的预期生存,延长生存。需要治疗者包括已经患有疾患或病症者,以及倾向于或处于发展疾患或病症的风险者,以及其中疾患或病症将被预防者。
[0173]
如本文所用,术语“载体”包括核酸载体,例如dna载体,诸如质粒、rna载体、病毒或其他合适的复制子(例如,病毒载体)。已开发出多种载体,以用于将编码外源蛋白质的多核苷酸递送到原核或真核细胞中。此类表达载体的实例公开于例如wo 1994/011026;该专利以引用的方式并入本文,因为它涉及适合于表达所关注的基因的载体。适于与本文所述的组合物和方法一起使用的表达载体包含多核苷酸序列,以及例如,用于表达蛋白质和/或将这些多核苷酸序列整合到哺乳动物细胞的基因组中的另外的序列元件。可以用于表达本文所述的一种或多种蛋白质的载体包括含有调控序列,诸如启动子和增强子区域的质粒,所述调控序列指导基因转录。此外,用于表达本文所述的一种或多种蛋白质的有用载体可以包含多核苷酸序列,所述多核苷酸序列提高相应基因的翻译速度,或提高由基因转录产生的mrna的稳定性或核输出。此类序列元件的实例是5'和3'非翻译区、ires和聚腺苷酸化信号位点,以指导表达载体上携带的一个或多个基因的有效转录。适于与本文所述的组合物和方法一起使用的表达载体还可以包含编码用于选择包含所述载体的细胞的标记的多核苷酸。合适标志物的实例是编码抗生素(诸如氨苄青霉素、氯霉素、卡那霉素、诺尔丝菌素或博来霉素等)抗性的基因。
[0174]
如本文在向患者(例如,患有克罗恩病的患者)提供治疗剂的情形中所使用,术语“含核苷酸结合寡聚化结构域的蛋白质2”及其缩写“nod2”可互换使用,并且是指编码nod2的基因,或相应的蛋白质产物,视情形而定。术语“含核苷酸结合寡聚化结构域的蛋白质2”和“nod2”包括nod2基因或蛋白质的野生型形式,以及野生型nod2蛋白和编码其的核酸的变体(例如,剪接变体、截短体、串联体和融合构建体等)。
[0175]
如本文所用,术语“功能性nod2”是指nod2基因或蛋白质的野生型形式,以及野生型nod2蛋白和编码其的核酸的变体(例如,剪接变体、截短体、串联体和融合构建体等),只要此类变体保留野生型nod2的正常生理能力,诸如检测细菌肽聚糖,特别是胞壁酰二肽(mdp),和/或刺激对其的免疫响应的能力。此类变体的实例可包括与野生型nod2蛋白的任何氨基酸序列(例如,seq id no:2)具有至少70%序列同一性(例如,70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或99.9%同一性或更多同一性)的蛋白质,诸如具有通过一个或多个保守氨基酸取代而不同于野生型nod2的氨基酸序列的变体,前提是nod2变体保留野生型nod2的治疗功能。
[0176]
seq id no:2对应于uniprot参考序列q9hc29-1,并且如下所示:
[0177]
mgeeggsashdeeerasvllghspgcemcsqeafqaqrsqlvellvsgslegfesvldwllswevlswedyegfhllgqplshlarrlldtvwnkgtwacqkliaaaqeaqadsqspklhgcwdphslhpardlqshrpaivrrlhshvenmldlawergfvsqyecdeirlpiftpsqrarrlldlatvkanglaafllqhvqelpvplalpleaatckkymaklrttvsaqsrflstydgaetlclediytenvlevwadvgmagppqkspatlgleelfstpghlnddadtvlvvgeagsgkstllqrlhllwaagqdfqeflfvfpfscrqlqcmakplsvrtllfehccwpdvgqedifqllldhpdrvlltfdgfdefkfrftdrerhcsptdptsvqtllfnllqgnllknarkvvtsrpaavsaflrkyirtefnlkgfseqgielylrkrhhepgvadrlirllqetsalhglchlpvfswmvskchqelllqeggspktttdmyllilqhfllhatppdsasqglgpsllrgrlptllhlgrlalwglgmccyvfsaqqlqaaqvspddislgflvrakgvvpgstapleflhitfqcffaafylalsadvppallrhlfncgrpgnspmarllptmciqasegkdssvaallqkaephnlqitaaflagllsrehwgllaecqtsekallrrqacarwclarslrkhfhsippaapgeaksvhampgfiwlirslyemqeerlarkaarglnvghlkltfcsvgptecaalafvlqhlrrpvalqldynsvgdigveqllpclgvckalylrdnnisdrgickliecalhceqlqklalfnnkltdgcahsmakllacrqnflalrlgnnyitaagaqvlaeglrgntslqflgfwgnrvgdegaqalaealgdhqslrwlslvgnnigsvgaqalalmlaknvmleelcleenhlqdegvcslaeglkknsslkilklsnncitylgaeallqalerndtilevwlrgntfsleevdklgcrdtrlll(seq id no:2)
[0178]
一示例性nod2核酸序列是欧洲核苷酸档案参考序列af178930.1,其对应于seq id no:1,如下所示:
[0179]
gtagacagatccaggctcaccagtcctgtgccactgggcttttggcgttctgcacaaggcctacccgcagatgccatgcctgctcccccagcctaatgggctttgatgggggaagagggtggttcagcctctcacgatgaggaggaaagagcaagtgtcctcctcggacattctccgggttgtgaaatgtgctcgcaggaggcttttcaggcacagaggagccagctggtcgagctgctggtctcagggtccctggaaggcttcgagagtgtcctggactggctgctgtcctgggaggtcctctcctgggaggactacgagggcttccacctcctgggccagcctctctcccacttggccaggcgccttctggacaccgtctggaataagggtacttgggcctgtcagaagctcatcgcggctgcccaagaagcccaggccgacagccagtcccccaagctgcatggctgctgggacccccactcgctccacccagcccgagacctgcagagtcaccggccagccattgtcaggaggctccacagccatgtggagaacatgctggacctggcatgggagcggggtttcgtcagccagtatgaatgtgatgaaatcaggttgccgatcttcacaccgtcccagagggcaagaaggctgcttgatcttgccacggtgaaagcgaatggattggctgccttccttctacaacatgttcaggaattaccagtcccattggccctgcctttggaagctgccacatgcaagaagtatatggccaagctgaggaccacggtgtctgctcagtctcgcttcctcagtacctatgatggagcagagacgctctgcctggaggacatatacacagagaatgtcctggaggtctgggcagatgtgggcatggctggacccccgcagaagagcccagccaccctgggcctggaggagctcttcagcacccctggccacctcaatgacgatgc
ggacactgtgctggtggtgggtgaggcgggcagtggcaagagcacgctcctgcagcggctgcacttgctgtgggctgcagggcaagacttccaggaatttctctttgtcttcccattcagctgccggcagctgcagtgcatggccaaaccactctctgtgcggactctactctttgagcactgctgttggcctgatgttggtcaagaagacatcttccagttactccttgaccaccctgaccgtgtcctgttaacctttgatggctttgacgagttcaagttcaggttcacggatcgtgaacgccactgctccccgaccgaccccacctctgtccagaccctgctcttcaaccttctgcagggcaacctgctgaagaatgcccgcaaggtggtgaccagccgtccggccgctgtgtcggcgttcctcaggaagtacatccgcaccgagttcaacctcaagggcttctctgaacagggcatcgagctgtacctgaggaagcgccatcatgagcccggggtggcggaccgcctcatccgcctgctccaagagacctcagccctgcacggtttgtgccacctgcctgtcttctcatggatggtgtccaaatgccaccaggaactgttgctgcaggagggggggtccccaaagaccactacagatatgtacctgctgattctgcagcattttctgctgcatgccacccccccagactcagcttcccaaggtctgggacccagtcttcttcggggccgcctccccaccctcctgcacctgggcagactggctctgtggggcctgggcatgtgctgctacgtgttctcagcccagcagctccaggcagcacaggtcagccctgatgacatttctcttggcttcctggtgcgtgccaaaggtgtcgtgccagggagtacggcgcccctggaattccttcacatcactttccagtgcttctttgccgcgttctacctggcactcagtgctgatgtgccaccagctttgctcagacacctcttcaattgtggcaggccaggcaactcaccaatggccaggctcctgcccacgatgtgcatccaggcctcggagggaaaggacagcagcgtggcagctttgctgcagaaggccgagccgcacaaccttcagatcacagcagccttcctggcagggctgttgtcccgggagcactggggcctgctggctgagtgccagacatctgagaaggccctgctccggcgccaggcctgtgcccgctggtgtctggcccgcagcctccgcaagcacttccactccatcccgccagctgcaccgggtgaggccaagagcgtgcatgccatgcccgggttcatctggctcatccggagcctgtacgagatgcaggaggagcggctggctcggaaggctgcacgtggcctgaatgttgggcacctcaagttgacattttgcagtgtgggccccactgagtgtgctgccctggcctttgtgctgcagcacctccggcggcccgtggccctgcagctggactacaactctgtgggtgacattggcgtggagcagctgctgccttgccttggtgtctgcaaggctctgtatttgcgcgataacaatatctcagaccgaggcatctgcaagctcattgaatgtgctcttcactgcgagcaattgcagaagttagctctattcaacaacaaattgactgacggctgtgcacactccatggctaagctccttgcatgcaggcagaacttcttggcattgaggctggggaataactacatcactgccgcgggagcccaagtgctggccgaggggctccgaggcaacacctccttgcagttcctgggattctggggcaacagagtgggtgacgagggggcccaggccctggctgaagccttgggtgatcaccagagcttgaggtggctcagcctggtggggaacaacattggcagtgtgggtgcccaagccttggcactgatgctggcaaagaacgtcatgctagaagaactctgcctggaggagaaccatctccaggatgaaggtgtatgttctctcgcagaaggactgaagaaaaattcaagtttgaaaatcctgaagttgtccaataactgcatcacctacctaggggcagaagccctcctgcaggcccttgaaaggaatgacaccatcctggaagtctggctccgagggaacactttctctctagaggaggttgacaagctcggctgcagggacaccagactcttgctttgaagtctccgggaggatgttcgtctcagtttgtttgtgagcaggctgtgagtttgggccccagaggctgggtgacatgtgttggcagcctcttcaaaatgagccctgtcctgcctaaggctgaacttgttttctgggaacaccataggtcacctttattctggcagaggagggagcatcagtgccctccaggatagacttttcccaagcctacttttgccattgacttcttcccaagattcaatcccaggatgtacaaggacagcccctcctccatagtatgggactggcctctgctgatcctcccaggcttccgtgtgggtcagtggggcccatggatgtgcttgttaactgagtgccttttggtggagaggcccggcctctcacaaaagaccccttaccactgctctgatgaagaggagtacacagaacacataattcaggaagcagctttccccatgtctcgactcatccatccaggccattccccgtctctggttcctcccctcctcctggactcctgcacacgctccttcctctgaggctgaaattcagaatattagtgacctcagctttgatatttcacttacagcacccccaaccctggcacccagggtgggaagggctacaccttagcctgccctcctttccggtgtttaagacatttttggaaggggacacgtgacagccgtttgttccccaagacattctaggtttgc
aagaaaaatatgaccacactccagctgggatcacatgtggacttttatttccagtgaaatcagttactcttcagttaagcctttggaaacagctcgactttaaaaagctccaaatgcagctttaaaaaattaatctgggccagaatttcaaacggcctcactaggcttctggttgatgcctgtgaactgaactctgacaacagacttctgaaatagacccacaagaggcagttccatttcatttgtgccagaatgctttaggatgtacagttatggattgaaagtttacaggaaaaaaaattaggccgttccttcaaagcaaatgtcttcctggattattcaaaatgatgtatgttgaagcctttgtaaattgtcagatgctgtgcaaatgttattattttaaacattatgatgtgtgaaaactggttaatatttataggtcactttgttttactgtcttaagtttatactcttatagacaacatggccgtgaactttatgctgtaaataatcagaggggaataaactgttgagtcaaaac(seq id no:1)
[0180]
如本文所用,“增加nod2的表达和/或活性”的剂是指在施用给患者(例如,患有如本文所述的克罗恩病的人类患者)后促进功能性nod2以生理正常水平表达的剂。因此,nod2的表达或活性增加与用剂治疗之前患者体内存在的量相关。例如,“增加nod2的表达和/或活性”的剂包括这样的剂,其在施用给患有本文所述的克罗恩病的人类患者后,实现功能性nod2的表达水平为在年龄和体重指数相当的未患有克罗恩病的人类受试者中观察到的功能性nod2表达的约20%至约200%。所述剂可例如实现功能性nod2的表达水平为在年龄和体重指数相当且未患克罗恩病的人类受试者中观察到的水平的约20%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约30%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约40%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约50%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约60%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约70%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约80%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约90%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约100%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约110%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约120%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约130%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约140%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约150%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约160%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约170%。在一些实施方案中,所述剂实现功能性nod2的表
达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约180%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约190%。在一些实施方案中,所述剂实现功能性nod2的表达水平为在年龄和体重指数相当且未患有克罗恩病的人类受试者中观察到的水平的约200%。
[0181]
如本文所用,“增加nod2的表达和/或活性”的剂优选不为以足以过度诱导病理的方式刺激功能性nod2表达的剂。例如,“增加nod2的表达和/或活性”的剂理想地是再现nod2缺乏的患者(例如,患有克罗恩病的人类患者)中功能性nod2表达的生理正常水平的剂。
[0182]
如本文所用,术语“烷基”是指单价、任选支链的烷基,诸如具有1至6个或更多个碳原子的烷基。该术语的示例为以下基团,诸如甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正己基等。
[0183]
如本文所用,术语“低级烷基”是指具有1至6个碳原子的烷基。
[0184]
如本文所用,术语“芳基”是指具有单环(例如,苯基)或多个稠合环(例如,萘基)的6至14个碳原子的不饱和芳族碳环基团。优选的芳基包括苯基、萘基、菲基等。
[0185]
如本文所用,术语“芳烷基”和“芳基烷基”可互换使用并且指包含芳基部分的烷基。类似地,术语“芳基低级烷基”等是指含有芳基部分的低级烷基。
[0186]
如本文所用,术语“烷基芳基”是指具有芳基取代基的烷基,包括苄基、苯乙基等。
[0187]
如本文所用,术语“杂芳基”是指单环杂芳族、或双环或三环稠环杂芳族基团。杂芳基的具体实例包括任选取代的吡啶基、吡咯基、呋喃基、噻吩基、咪唑基、噁唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、1,2,3-三唑基、1,2,4-三唑基、1,2,3-噁二唑基、1,2,4-噁二唑基、1,2,5-噁二唑基、1,3,4-噁二唑基、1,3,4-三嗪基、1,2,3-三嗪基、苯并呋喃基、[2,3-二氢苯并呋喃基、异苯并呋喃基、苯并噻吩基、苯并三唑基、异苯并噻吩基、吲哚基、异吲哚基、3h-吲哚基、苯并咪唑基、咪唑并[1,2-a]吡啶基、苯并噻唑基、苯并噁唑基、喹嗪基、喹唑啉基、酞嗪基、喹喔啉基、噌啉基、萘并吡啶基、吡啶并[3,4-b]吡啶基、吡啶并[3,2-b]吡啶基、吡啶并[4,3-b]吡啶基、喹啉基、异喹啉基、四唑基、5,6,7,8-四氢喹啉基、5,6,7,8-四氢异喹啉基、嘌呤基、蝶啶基、咔唑基、呫吨基、苯并喹啉基等。
[0188]
如本文所用,术语“烷基杂芳基”是指具有杂芳基取代基的烷基,包括2-呋喃基甲基、2-噻吩基甲基、2-(1h-吲哚-3-基)乙基等。
[0189]
如本文所用,术语“低级烯基”是指优选具有2至6个碳原子并具有至少1或2个烯基不饱和位点的烯基。示例性的烯基是乙烯基(-ch=ch2)、n-2-丙烯基(烯丙基,-ch2ch=ch2)等。
[0190]
如本文所用,术语“烯基芳基”是指具有芳基取代基的烯基,包括2-苯基乙烯基等。
[0191]
如本文所用,术语“烯基杂芳基”是指具有杂芳基取代基的烯基,包括2-(3-吡啶基)乙烯基等。
[0192]
如本文所用,术语“低级炔基”是指优选具有2至6个碳原子并具有至少1-2个炔基不饱和位点的炔基,优选的炔基包括乙炔基(-c≡ch)、炔丙基(-ch2c≡ch)等。
[0193]
如本文所用,术语“炔基芳基”是指具有芳基取代基的炔基,包括苯乙炔基等。
[0194]
如本文所用,术语“炔基杂芳基”是指具有杂芳基取代基的炔基,包括2-噻吩基乙炔基等。
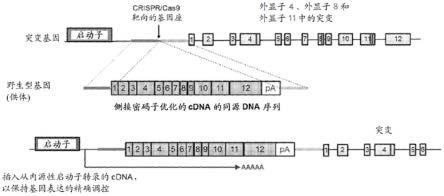
[0195]
如本文所用,术语“环烷基”是指具有3至8个碳原子的单环环烷基,诸如环丙基、环丁基、环戊基、环己基、环庚基、环辛基等。
[0196]
如本文所用,术语“低级环烷基”是指具有单环(例如,环己基)或多个稠合环(例如,降冰片基)的3至8个碳原子的饱和碳环基团。优选的环烷基包括环戊基、环己基、降冰片基等。
[0197]
如本文所用,术语“杂环烷基”是指其中一个或多个环碳原子被杂原子,诸如氮原子、氧原子、硫原子等取代的环烷基。示例性的杂环烷基是吡咯烷基、哌啶基、氧代哌啶基、吗啉基、哌嗪基、氧代哌嗪基、硫代吗啉基、氮杂环庚烷基、二氮杂环庚烷基、氧氮杂环烷基、噻氮杂环烷基、二氧杂噻吩基、氮杂烷基、四氢呋喃基、四氢吡喃基等。
[0198]
如本文所用,术语“烷基环烷基”是指具有环烷基取代基的烷基,包括环己基甲基、环戊基丙基等。
[0199]
如本文所用,术语“烷基杂环烷基”是指具有杂环烷基取代基的c
1-c
6-烷基,包括2-(1-吡咯烷基)乙基、4-吗啉基甲基、(1-甲基-4-哌啶基)甲基和类似。
[0200]
如本文所用,术语“羧基”是指基团-c(o)oh。
[0201]
如本文所用,术语“烷基羧基”是指具有羧基取代基的c
1-c
5-烷基,包括2-羧乙基等。
[0202]
如本文所用,术语“酰基”是指基团-c(o)r,其中r可以是例如c
1-c
6-烷基、芳基、杂芳基、c
1-c
6-烷基芳基,或c
1-c
6-烷基杂芳基等取代基。
[0203]
如本文所用,术语“酰基氧基”是指基团-oc(o)r,其中r可以是例如c
1-c
6-烷基、芳基、杂芳基、c
1-c
6-烷基芳基,或c
1-c
6-烷基杂芳基等取代基。
[0204]
如本文所用,术语“烷氧基”是指基团-or,其中r是例如任选取代的烷基,诸如任选取代的c
1-c
6-烷基、芳基、杂芳基、c
1-c
6-烷基芳基或c
1-c
6-烷基杂芳基等取代基。示例性烷氧基包括例如甲氧基、乙氧基、苯氧基等。
[0205]
如本文所用,术语“烷氧基羰基”是指基团-c(o)or,其中r是例如氢、c
1-c
6-烷基、芳基、杂芳基、c
1-c
6-烷基芳基、或c
1-c
6-烷基杂芳基,以及其他可能的取代基。
[0206]
如本文所用,术语“烷基烷氧基羰基”是指具有烷氧基羰基取代基的烷基,包括2-(苄氧基羰基)乙基等。
[0207]
如本文所用,术语“氨基羰基”是指基团-c(o)nrr',其中每个r和r'可以独立地是例如氢、c
1-c
6-烷基、芳基、杂芳基、c
1-c
6-烷基芳基或c
1-c
6-烷基杂芳基等取代基。
[0208]
如本文所用,术语“烷基氨基羰基”是指具有氨基羰基取代基的烷基,包括2-(二甲基氨基羰基)乙基等。
[0209]
如本文所用,术语“酰基氨基”是指基团-nrc(o)r',其中r和r'中的每一个可以独立地为例如氢、c
1-c
6-烷基、芳基、杂芳基、c
1-c
6-烷基芳基或c
1-c
6-烷基杂芳基等取代基。
[0210]
如本文所用,术语“烷基酰基氨基”是指具有酰基氨基取代基的烷基,包括2-(丙酰氨基)乙基等。
[0211]
如本文所用,术语“脲基”是指基团-nrc(o)nr'r",其中每个r、r'和r"可以独立地为例如氢、c
1-c
6-烷基、芳基、杂芳基、c
1-c
6-烷基芳基、c
1-c
6-烷基杂芳基、环烷基或杂环烷基等取代基。示例性脲基还包括其中r'和r”与它们所连接的氮原子一起形成3-8元杂环烷基环的部分。
[0212]
如本文所用,术语“烷基脲基”是指具有脲基取代基的烷基,包括2-(n'-甲基脲基)乙基等。
[0213]
如本文所用,术语“氨基”是指基团-nrr',其中r和r'中的每一个可以独立地为例如氢、c
1-c
6-烷基、芳基、杂芳基、c
1-c
6-烷基芳基、c
1-c
6-烷基杂芳基、环烷基或杂环烷基等取代基。示例性氨基还包括其中r和r'与它们所连接的氮原子一起可形成3-8元杂环烷基环的部分。
[0214]
如本文所用,术语“烷基氨基”是指具有氨基取代基的烷基,包括2-(1-吡咯烷基)乙基等。
[0215]
如本文所用,术语“铵”是指带正电荷的基团-n
+
rr'r”,其中r、r'和r”中的每一个可以独立地是例如c
1-c
6-烷基、c
1-c
6-烷基芳基、c
1-c
6-烷基杂芳基、环烷基或杂环烷基等取代基。示例性的铵基团还包括其中r和r'与它们所连接的氮原子一起形成3-8元杂环烷基环的部分。
[0216]
如本文所用,术语“卤素”是指氟、氯、溴和碘原子。
[0217]
如本文所用,术语“磺酰基氧基”是指基团-oso
2-r,其中r选自氢、c
1-c
6-烷基、被卤素取代的c
1-c
6-烷基,例如-oso
2-cf3基团、芳基、杂芳基、c
1-c
6-烷基芳基和c
1-c
6-烷基杂芳基。
[0218]
如本文所用,术语“烷基磺酰基氧基”是指具有磺酰基氧基取代基的烷基,包括2-(甲基磺酰基氧基)乙基等。
[0219]
如本文所用,术语“磺酰基”是指基团
“‑
so
2-r”,其中r选自氢、芳基、杂芳基、c
1-c
6-烷基、被卤素取代的c
1-c
6-烷基,例如-so
2-cf3基团、c
1-c
6-烷基芳基或c
1-c
6-烷基杂芳基。
[0220]
如本文所用,术语“烷基磺酰基”是指具有磺酰基取代基的烷基,包括2-(甲基磺酰基)乙基等。
[0221]
如本文所用,术语“亚磺酰基”是指基团
“‑
s(o)-r”,其中r选自氢、c
1-c
6-烷基、被卤素取代的c
1-c
6-烷基,例如,-so-cf3基团、芳基、杂芳基、c
1-c
6-烷基芳基或c
1-c
6-烷基杂芳基。
[0222]
如本文所用,术语“烷基亚磺酰基”是指具有亚磺酰基取代基的c
1-c
5-烷基,包括2-(甲基亚磺酰基)乙基等。
[0223]
如本文所用,术语“硫烷基”是指基团-sr,其中r是例如烷基、芳基、杂芳基、c
1-c
6-烷基芳基或c
1-c
6-烷基杂芳基等取代基。示例性硫烷基是甲基硫烷基、乙基硫烷基等。
[0224]
如本文所用,术语“烷基硫烷基”是指具有硫烷基取代基的烷基,包括2-(乙基硫烷基)乙基等。
[0225]
如本文所用,术语“磺酰基氨基”是指基团-nrso
2-r',其中每个r和r'可以独立地为氢、c
1-c
6-烷基、芳基、杂芳基、c
1-c
6-烷基芳基或c
1-c
6-烷基杂芳基等取代基。
[0226]
如本文所用,术语“烷基磺酰基氨基”是指具有磺酰基氨基取代基的烷基,包括2-(乙基磺酰基氨基)乙基等。
[0227]
除非个别取代基的定义另有限制,否则上述基团,如“烷基”、“烯基”、“炔基”、“芳基”和“杂芳基”等基团可以任选地被取代,例如被一个或多个取代基取代,当价允许时,诸如选自以下的取代基:烷基(例如,c
1-c
6-烷基)、烯基(例如,c
2-c
6-烯基)、炔基(例如,c
2-c
6-炔基)、环烷基、杂环烷基、烷基芳基(例如,c
1-c
6-烷基芳基)、烷基杂芳基(例如,c
1-c
6-烷基
杂芳基、烷基环烷基(例如,c
1-c
6-烷基环烷基),烷基杂环烷基(例如,c
1-c
6-烷基杂环烷基)、氨基、铵、酰基、酰基氧基、酰基氨基、氨基羰基、烷氧基羰基、脲基、芳基、杂芳基、亚磺酰基、磺酰基、烷氧基、硫烷基、卤素、羧基、三卤甲基、氰基、羟基、巯基、硝基等。在一些实施方案中,取代是其中相邻取代基经历闭环的取代,诸如其中涉及邻近官能取代基的情况,因此形成例如内酰胺、内酯、环酐、缩醛、硫代缩醛和缩醛等。
[0228]
如本文所用,术语“任选稠合的”是指可以与环系统,诸如环烷基、杂环烷基、芳基或杂芳基稠合的环状化学基团。可以与任选稠合的化学基团稠合的示例性环系统包括例如吲哚基、异吲哚基、苯并呋喃基、异苯并呋喃基、苯并噻吩基、苯并噁唑基、苯并噻唑基、苯并异噁唑基、苯并异噻唑基、吲唑基、苯并咪唑基、喹啉基、异喹啉基、酞嗪基、喹喔啉基、喹唑啉基、噌啉基、吲哚嗪基、萘啶基、蝶啶基、茚满基、萘基、1,2,3,4-四氢萘基、吲哚满基、异吲哚满基、2,3,4,5-四氢苯并[b]氧庚因基、6,7,8,9-四氢-5h-苯并环庚烯基、色满基等。
[0229]
如本文所用,术语“药学上可接受的盐”是指保留形成盐的非离子化母体化合物的所需生物活性的盐,诸如本文所述化合物的盐。此类盐的实例包括但不限于与无机酸(例如,盐酸、氢溴酸、硫酸、磷酸、硝酸等)形成的酸加成盐,以及与有机酸(诸如,乙酸、草酸、酒石酸、琥珀酸、苹果酸、富马酸、马来酸、抗坏血酸、苯甲酸、鞣酸、扑甲酸、海藻酸、聚谷氨酸、萘磺酸、萘二磺酸、聚半乳糖醛酸)形成的盐。所述化合物还可以作为药学上可接受的季铵盐施用,诸如式-nr,r',r”+
z-的季铵盐,其中每个r、r’和r”可以独立地是例如氢、烷基、苄基、c
1-c
6-烷基、c
2-c6链烯基、c
2-c6炔基、c
1-c
6-烷基芳基、c
1-c6烷基杂芳基、环烷基、杂环等,z是抗衡离子,诸如氯化物、溴化物、碘化物、-o-烷基、甲苯磺酸盐、甲基磺酸盐、磺酸盐、磷酸盐、羧酸盐(诸如苯甲酸盐、琥珀酸盐、乙酸盐、乙醇酸盐、马来酸盐、苹果酸盐、富马酸盐、柠檬酸盐、酒石酸盐、抗坏血酸盐、肉桂酸盐、扁桃酸盐和二苯乙酸盐)等。
[0230]
如本文所用,例如,在蛋白激酶c(pkc)抑制剂(诸如星形孢菌素)的上下文中,术语“变体”是指含有一个或多个相对于参考剂的修饰的剂,并且(i)保留了功能性参考剂的性质(例如,抑制pkc活性的能力)和/或(ii)在细胞(例如,本文所述类型的细胞,诸如和cd34+细胞)内转化为参考剂。在小分子pkc抑制剂(诸如星形孢菌素)的上下文中,参考化合物的结构变体包括与参考化合物在一个或多个取代基的纳入和/或位置不同的那些,以及作为参考化合物异构体的变体,诸如结构异构体(例如,区域异构体)或立体异构体(例如,对映异构体或非对映异构体),以及参考化合物的前药。在干扰rna分子的情况下,变体可以含有一个或多个相对于母体干扰rna分子的核酸取代。
[0231]
本文所述的结构组合物还包括互变异构体、几何异构体(例如,e/z异构体和顺/反异构体)、对映异构体、非对映异构体和外消旋形式,以及它们的药学上可接受的盐。此类盐包括例如与药学上可接受的酸形成的酸加成盐,例如盐酸盐、氢溴酸盐、硫酸盐或硫酸氢盐、磷酸盐或磷酸氢盐、乙酸盐、苯甲酸盐、琥珀酸盐、富马酸盐、马来酸盐、乳酸盐、柠檬酸盐、酒石酸盐、葡糖酸盐、甲磺酸盐、苯磺酸盐、和对甲苯磺酸盐。
[0232]
如本文所用,未描述具有一个或多个立体中心的化合物的立体化学构型的化学结构式将被解释为包括所指示化合物的任何一种立体异构体,或一种或多种此类立体异构体的混合物(例如,任何所示化合物的对映异构体或非对映异构体之一,或者对映异构体的混合物(例如外消旋混合物)或非对映异构体的混合物)。如本文所用,具体描述具有一个或多个立体中心的化合物的立体化学构型的化学结构式将被解释为指所示特定立体异构体的
基本纯形式。“基本纯”形式是指纯度大于85%,诸如纯度为85%至99%、85%至99.9%、85%至99.99%、或85%至100%,诸如纯度为85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.9%、99.99%、99.999%、或100%的化合物,如使用本领域已知的色谱和核磁共振技术所评估。
附图说明
[0233]
图1是显示可用于再现编码缺陷型nod2蛋白的内源基因附近或内部的遗传基因座处的功能性nod2表达的示例性程序的示意图。可以在编码内源性nod2的基因附近或内部的位点处编辑靶细胞(诸如从患有克罗恩病的患者获得的自体细胞)中的遗传基因座。编码内源性nod2的基因可能具有引起nod2缺陷的突变。为了在此位点编辑靶细胞基因组,可以向细胞提供核酸酶,诸如crispr相关蛋白,以及向导rna(grna)和编码功能性nod2的模板核酸。grna可以通过碱基对杂交将核酸酶导向靶细胞内的所需位点。然后核酸酶可以在所需位点催化单链断裂或双链断裂,此时编码功能性nod2的模板核酸可以在所需位点处插入靶细胞基因组。编码功能性nod2的模板核酸可插入于与内源nod2启动子可操作地连接的位点处,从而使得再现功能性nod2蛋白表达。
[0234]
图2a-2c是显示nod2活化通过人单核细胞实现稳健的炎性细胞因子释放的图。将thp-1人单核细胞用10ng/ml pma(图2a)、10ng/ml lps(图2b)或5ng/ml tnfα(图2c)预刺激18小时,然后用mdp处理以诱导nod2信号传导。18-24小时后,通过基于流式细胞仪的珠阵列分析和elisa,测定细胞上清液中的nod2依赖性细胞因子产生。所示数据代表至少3个独立实验。pma:佛波醇12-肉豆蔻酸酯13-乙酸酯;lps:脂多糖;mdp:胞壁酰二肽。thp-1:atcc编号tib-202。
[0235]
图3是显示在没有引发的情况下,nod2活化通过外周血cd14+单核细胞实现稳健的炎性细胞因子释放的图。用mdp处理从健康供体分离的外周血cd14+单核细胞以诱导nod2信号传导。18-24小时后,通过基于流式细胞仪的珠阵列分析,测定细胞上清液中的nod2依赖性细胞因子产生。数据显示细胞因子产量相对于未刺激细胞的倍数增加并代表至少3个独立实验。
[0236]
图4a和4b是证实野生型鼠组织分离的和骨髓来源的单核细胞显示对nod2活化的特征性促炎性响应的图。原代鼠腹腔巨噬细胞(cd11b+)通过lps处理引发过夜,然后通过mdp处理刺激nod2信号传导(图4a)。通过在gm-csf中离体培养产生的鼠骨髓来源的巨噬细胞通过用lps(10ng/ml)过夜处理,然后通过mdp处理刺激nod2信号传导来引发(图4b)。通过elisa检测,nod2刺激导致活性/加工il-1β的释放。所示数据代表至少3个独立实验,其中ut指示从野生型c57bl6小鼠分离的未处理细胞。
[0237]
图5是显示nod2破坏削弱thp-1单核细胞炎性细胞因子对mdp的响应的图。使用crispr-cas9产生了几个nod2突变型thp-1克隆细胞系,以模拟克罗恩病中的nod2缺陷。将野生型(wt)(几个外显子-2和外显子-8靶向的nod2敲除克隆(ko))和经历模拟crispr-cas9 nod2破坏的thp-1细胞(模拟)用lps引发过夜,然后用mdp(10μg/ml)刺激。il-8释放的相对增加表示为相对于未处理细胞(ut)的倍数变化,通过细胞上清液的elisa分析检测。nod2 ko thp-1克隆显示不能对mdp刺激产生促炎性细胞因子响应。所示数据代表至少3个独立实验。统计显著性配对t检验未治疗相比于mdp*p《0.001。
[0238]
图6是显示通过crispr-cas9基因编辑进行nod2破坏削弱了cd34+hsc来源的髓样炎性细胞因子对mdp的响应的图。通过crispr-cas9基因编辑(rnp+向导rna核转染)对自健康供体分离的外周血来源的cd34+细胞进行nod2的靶向破坏。然后将基因编辑细胞、nod2 ko细胞和模拟编辑细胞(仅接受rnp)在细胞因子存在下培养14天,以促进向单核细胞/巨噬细胞谱系定向细胞的分化。然后用mdp(0-100μg/ml)刺激细胞培养物18-24小时,通过elisa测定细胞上清液的il-8细胞因子释放。cd34+细胞中的基因编辑nod2 ko效率(85-90%)通过t7核酸内切酶测定法和crispr编辑推断(ice)分析得到证实(未显示)。所示数据代表2个独立实验。
[0239]
图7a-7c是显示nod2-/-小鼠对mdp的巨噬细胞炎性细胞因子响应受损的图。分别通过在gm-csf或m-csf中离体培养产生的wt和nod2-/-鼠骨髓来源的巨噬细胞(图7a和7b)和单核细胞(图7c)通过用lps(1ng/ml)过夜处理,然后通过mdp处理刺激nod2信号传导来引发。nod2刺激导致wt来源的细胞释放il-6(图7a)、tnfα(图7b)和活性/加工的il-1β(图7c),但在nod2-/-细胞中不存在,如通过流式细胞珠阵列分析或elisa所检测。所示数据代表至少3个独立实验,并且表示为相对于未处理的细胞,mdp处理后细胞因子释放水平的倍数变化。统计学显著性t检验nod2-/-相比于wt*p《0.001。
[0240]
图8a-8d显示了在各种启动子控制下恢复功能性nod2表达以调节基因表达的慢病毒载体的设计和验证,以及使用密码子优化的序列来递送更高的转基因表达。图8a是显示在组成型(ef1α/efs)、髓系特异性(cd11b)或内源性nod2(nod2p)启动子控制下,所产生的一些慢病毒构建体恢复密码子优化(conod2)或wt nod2蛋白或不相关蛋白(gfp)的功能性nod2基因表达的示意图。用慢病毒载体(感染复数(moi)10)转导thp-1单核细胞,4天后通过转基因特异性rt-pcr分析检测wt nod2(图8b)和conod2(图8c)的相对基因表达(相对于未转导的细胞)。插图数据显示了通过基因组dna分析检测的转基因载体拷贝数(vcn)的定量。显示未处理(ut)和转导(lv-nod2,lv-conod2)ht29细胞中人nod2蛋白染色的流式细胞仪点图。所示数据代表3个独立实验(图8d)。
[0241]
图9是显示鼠骨髓hsc的慢病毒转导恢复nod2-/-单核细胞中的功能性nod2表达的图。用编码nod2的慢病毒载体(lv-nod2,efs启动子)转导从wt或nod2-/-小鼠分离的骨髓谱系阴性hsc。然后在gm-csf中通过离体培养产生鼠骨髓来源的巨噬细胞。细胞通过用lps(1ng/ml)过夜处理,然后用mdp(10μg/ml)处理刺激nod2信号传导来引发。18-24小时后,通过elisa检测细胞上清液中nod2介导的il-6产生。il-6产生表示为细胞因子水平相对于未处理细胞(ut)的倍数增加。所示数据代表2个独立实验。统计显著性t检验未转导相比于转导*p《0.001。
[0242]
图10a-10d显示nod2缺陷型thp-1细胞的慢病毒转导可以恢复人单核细胞对mdp的炎性响应。用lv-conod2载体(moi 10)转导thp-1wt和crispr-cas9基因编辑的克隆(nod2ko或模拟编辑的)。转导后三天,thp-1细胞用lps引发,然后用mdp(10μg/ml)处理以刺激nod2活性。(图10a)通过elisa检测,nod2 ko thp-1克隆的慢病毒转导导致nod2依赖性il-8细胞因子释放的恢复。(图10b)thp-1细胞的慢病毒转导效率通过使用gfp报告子-lv构建体评估其的转导而得到证实;流式细胞仪点图显示了在lv moi为10时获得的代表性转导效率。(图10c)通过转导细胞(相对于未转导细胞)的rt-pcr分析证实了nod2基因表达。(图10d)通过分析转导的thp-1细胞中的基因组dna检测的转基因载体拷贝数(平均vcn)的定量。所示数
据代表2-3个独立实验。统计显著性成对t检验转导相比于未转导*p《0.001。
[0243]
图11a-11d是显示nod2缺陷型thp-1细胞的慢病毒转导可以恢复人单核细胞对mdp的炎性响应的图。用编码野生型(nod2)或密码子优化的nod2(conod2)序列或不相关的编码蛋白gfp的慢病毒载体(moi 10)转导thp-1wt和crispr-cas9基因编辑的克隆(ko外显子8克隆1和2,或模拟编辑的)。转导后三天,thp-1细胞用lps引发,然后用mdp(10μg/ml)处理以刺激nod2活性。(图11a)mdp暴露和用lps引发导致野生型和模拟处理的细胞中的il-8释放增加。沿着横轴从左到右的样品表示(i)未转导的细胞,(ii)用mdp处理的未转导的细胞,和(iii)用lps引发的未转导的细胞。(图11b)mdp暴露导致用含有在efs启动子控制下的nod2转基因的慢病毒载体转导的细胞中稳健的il-8释放响应。沿着横轴从左到右的样品表示(i)未转导的细胞,(ii)用mdp处理的未转导的细胞,(iii)在没有mdp的情况下,用含有在efs启动子控制下的野生型nod2转基因的慢病毒载体转导的细胞,(iv)在存在mdp的情况下,用含有在efs启动子控制下的野生型nod2转基因的慢病毒载体转导的细胞,(v)在没有mdp的情况下,用含有在efs启动子控制下的密码子优化的nod2转基因的慢病毒载体转导的细胞,(vi)在存在mdp的情况下,用含有在efs启动子控制下的密码子优化的nod2转基因的慢病毒载体转导的细胞,(vii)在没有mdp的情况下,用含有在cd11b启动子控制下的野生型gfp转基因的慢病毒载体转导的细胞,和(viii)在存在mdp的情况下,用含有在cd11b启动子控制下的野生型gfp转基因的慢病毒载体转导的细胞。(图11c)mdp暴露导致用含有在cd11b启动子控制下的nod2转基因的慢病毒载体转导的细胞中稳健的il-8释放响应。沿着横轴从左到右的样品表示(i)未转导的细胞,(ii)用mdp处理的未转导的细胞,(iii)在没有mdp的情况下,用含有在cd11b启动子控制下的野生型nod2转基因的慢病毒载体转导的细胞,(iv)在存在mdp的情况下,用含有在cd11b启动子控制下的野生型nod2转基因的慢病毒载体转导的细胞,(v)在没有mdp的情况下,用含有在cd11b启动子控制下的密码子优化的nod2转基因的慢病毒载体转导的细胞,(vi)在存在mdp的情况下,用含有在cd11b启动子控制下的密码子优化的nod2转基因的慢病毒载体转导的细胞,(vii)在没有mdp的情况下,用含有在cd11b启动子控制下的野生型gfp转基因的慢病毒载体转导的细胞,和(viii)在存在mdp的情况下,用含有在cd11b启动子控制下的野生型gfp转基因的慢病毒载体转导的细胞。(图11d)mdp暴露导致用含有在内源nod2启动子控制下的nod2转基因的慢病毒载体转导的细胞中稳健的il-8释放响应。沿着横轴从左到右的样品表示(i)未转导的细胞,(ii)用mdp处理的未转导的细胞,(iii)在没有mdp的情况下,用含有在野生型内源nod2启动子控制下的野生型nod2转基因的慢病毒载体转导的细胞,(iv)在存在mdp的情况下,用含有在野生型内源nod2启动子控制下的野生型nod2转基因的慢病毒载体转导的细胞,(v)在没有mdp的情况下,用含有在野生型内源nod2启动子控制下的密码子优化的nod2转基因的慢病毒载体转导的细胞,(vi)在存在mdp的情况下,用含有在野生型内源nod2启动子控制下的密码子优化的nod2转基因的慢病毒载体转导的细胞,(vii)在不存在mdp的情况下,用含有在cd11b启动子控制下的野生型gfp转基因的慢病毒载体转导的细胞,和(viii)在存在mdp的情况下,用含有在cd11b启动子控制下的野生型gfp转基因的慢病毒载体转导的细胞。
[0244]
图12是示出通过外周血来源的cd34+细胞的慢病毒转导进行的nod2基因转移的图。用所产生的慢病毒载体(moi 10&50)转导从健康人志愿者的动员外周血中分离的cd34+细胞,以在髓系特异性启动子(cd11b启动子)或组成型启动子(efs启动子)的控制下转移wt
或密码子优化的nod2。数据显示了通过分析转导后14天从骨髓细胞培养物中分离的基因组dna检测到的转基因载体拷贝数(平均vcn)的定量,并且代表3个独立实验。
[0245]
图13a和13b是显示通过nod2-ko外周血来源的cd34+细胞的慢病毒转导进行的nod2基因转移可以部分恢复分化的cd34+细胞培养物的mdp检测的图。从健康人志愿者的动员外周血中分离的cd34+细胞首先通过crispr-cas9进行基因编辑以破坏nod2(nod2ko或模拟五),然后用lv-conod2载体转导。然后cd34+细胞在体外分化2周(最终培养物由15-30%cd11b+cd14+细胞构成),之后用mdp处理培养物以刺激nod2活性。通过elisa检测,nod2 ko细胞的慢病毒转导导致nod2依赖性(图13a)il-8和(图13b)tnfα细胞因子释放在mdp刺激(1μg/ml)后部分恢复。用所产生的慢病毒载体转导cd34+细胞,以在髓系特异性启动子(cd11b启动子)或组成型启动子(efs启动子)的控制下转移wt nod2或密码子优化的nod2。
[0246]
图14显示了示出基因编辑实现靶向gfp插入cd34+hsc中nod2基因座的能力的一对流式细胞仪等高线图。gfp报告子序列用于验证将有效载荷供体模板靶向插入nod2基因基因座的外显子2中的基因编辑策略。使用crispr-cas9 rnp核转染进行外周血来源的cd34+细胞的基因编辑。使用由aav6载体递送的模板序列实现供体有效载荷递送。特别地,供体有效载荷包括在efs启动子控制下的编码gfp的转基因。通过流式细胞术检测骨髓分化细胞培养物中的gfp+细胞,证实了同源定向修复的效率。所示数据代表2个独立实验。通过’进退式(in-out)’pcr方法证实了对nod2基因座的靶向,其中一个引物位于同源臂外的靶向基因组基因座中,并且其他引物位于转基因盒内(数据未显示)。
具体实施方式
[0247]
本公开提供了用于治疗或预防克罗恩病的组合物和方法。本文所述的组合物和方法可用于例如治疗患有克罗恩病的患者,诸如成年人类患者,以及预防性治疗处于发展克罗恩病的风险下的患者。例如,可通过向患者提供一种或多种提高含功能性核苷酸结合寡聚化结构域的蛋白2(nod2)的表达和/或活性的剂,诸如表达功能性nod2的细胞群(例如,多能细胞群,诸如造血干细胞)来治疗患者。不受机理的限制,提供这种剂可以治疗疾病的潜在原因并逆转其病理生理学。因此,使用本文所述的组合物和方法,不仅可以减轻一种或多种与克罗恩病相关的症状的方式治疗患者,还可以治疗方式或预防方式治疗患者。
[0248]
nod2信号转导
[0249]
nod2是一种细胞内模式识别受体(prr),其识别细菌病原体并相应地启动免疫响应。作为prr,nod2识别细菌脂多糖(lps)、胞壁酰二肽(mdp)和其他病原体相关分子模式(pamp)。nod2是一种属于nod样受体(nlr)家族的110kda细胞质蛋白。其表达主要限于单核细胞和其他抗原呈递细胞(apc)。nlr家族中的蛋白质通常含有负责协调蛋白质寡聚化的核苷酸结合寡聚化结构域(nod)。nod2还含有c末端富含亮氨酸重复序列(lrr)结构域和11个lrr重复序列。lrr结构域协调配体结合和其他蛋白质-蛋白质相互作用。nod2还含有两个n末端胱天蛋白酶相关的募集结构域(card)。card募集蛋白质来促进细胞凋亡。nod2 card也能够通过与rick(一种丝氨酸-苏氨酸激酶)的同嗜性card-card相互作用活化nfκb信号传导。rick随后与ikkγ结合以促进nfκb的ikk依赖性活化。
[0250]
使用本公开的组合物和方法,可以将增加nod2活性和/或表达的剂,诸如表达nod2的细胞(例如,cd34+细胞或本文所述的其他多能细胞)施用给患有克罗恩病的患者(例如,
nod2表达缺陷的患者),从而促进以下有益特征:
[0251]
(i)nod2表达的生理正常水平的恢复;
[0252]
(ii)mdp检测的增加;
[0253]
(iii)nfκb信号转导的增加;和/或
[0254]
(iv)针对病原微生物的增强的免疫响应。
[0255]
不受机理的限制,以下部分描述了增加nod2活性和/或表达并实现一种或多种或所有上述有益表型的剂可如何用于治疗克罗恩病。
[0256]
克罗恩病
[0257]
病因学和nod2恢复疗法
[0258]
克罗恩病是一种由nod2活性缺陷引起的自身炎性疾病。nod2活性的这种异常可以由nod2的核苷酸结合寡聚化结构域(nbd)中聚集的突变触发。此类突变包括r702w、g908r、l1007fs。
[0259]
nod2通常通过nacht与富含亮氨酸重复(lrr)结构域之间的相互作用,以及与细胞伴侣的相互作用而在细胞中保持无活性、自动抑制的构象。nod2在识别mdp后通过与lrr的直接肽相互作用而被活化。nod2和mdp的结合诱导了基于nod2蛋白活化的构象变化。然而,nod2的突变(诸如上文所述的那些)阻止了mdp的相互作用和感知,以及nod2蛋白的后续活化。
[0260]
使用本公开的组合物和方法,可以向患者,诸如患有克罗恩病的人类患者施用表达不含有破坏活性的突变的功能性nod2蛋白的剂。实现这种效果的示例性剂是表达功能性nod2的多能细胞,诸如造血干细胞和造血祖细胞。以下部分描述了产生这种剂的示例性程序,以及这种剂可如何用于治疗患有克罗恩病的患者。
[0261]
诊断
[0262]
患者(例如,人类患者)可以多种方式被诊断为患有克罗恩病。基因检测提供了一种方法,通过这种方法可以将患者诊断为患有克罗恩病(或处于发展克罗恩病的风险下)。例如,遗传分析可用于确定患者编码nod2的内源基因是否具有功能丧失突变,诸如选自由r702w、g908r和l1007fs组成的组的nod2基因的突变。可用于确定患者是否具有这种突变的示例性遗传测试包括本领域已知的和本文描述的聚合酶链式反应(pcr)方法等。
[0263]
临床上,克罗恩病可以通过例如血液测试来检测。在这种情况下,克罗恩病可能表现为贫血,这是一种以红细胞向组织供氧不足为特征的疾病。克罗恩病也可以感染的形式表现(例如,细菌感染),其可以通过鉴定细菌核酸在血液中检测,例如,使用本领域已知的分子生物学技术,诸如基于pcr的方法等。
[0264]
克罗恩病的另一个指标是患者粪便中出现潜血。这可以通过分析从患者获得的粪便样本来容易地评估。
[0265]
克罗恩病也可以通过结肠镜检查来检测。这种程序允许检查整个结肠和回肠末端。如果出现炎性肉芽肿簇,可以确诊为克罗恩病。
[0266]
另一种用于诊断患者患有克罗恩病的有用程序是计算机断层摄影术(ct)。ct扫描可用于检查整个肠道以及肠道外部的组织。这项技术允许检测与克罗恩病相关的并发症,包括脓肿、瘘管和肠阻塞。
[0267]
可用于促进克罗恩病诊断的另一种程序是磁共振成像(mri)。mri对于评估接近肛
门(例如,通过骨盆mri可检测)或小肠(例如,通过mr肠造影术可检测)的瘘管特别有用。任一种或两种都可能是克罗恩病的指征。
[0268]
另一种可用于检测患者的克罗恩病的技术是胶囊内窥镜检查。在这个程序中,病人吞下一个含有微型摄像头的胶囊,所述摄像头可以使小肠可视化。可以检查由此获得的图像的感染迹象,这可能是克罗恩病的指征。
[0269]
在另一种技术中,通过气囊辅助肠镜可以诊断为克罗恩病。在这个程序中,使用内窥镜进一步观察小肠,特别是标准内窥镜无法到达的区域。当胶囊内窥镜检查发现异常,但诊断仍有疑问时,这种技术通常是有用的。
[0270]
预防
[0271]
使用本文所述的组合物和方法,可向受试者(例如,人类受试者)施用一种或多种增加功能性nod2的活性和/或表达(例如,至生理正常水平内)的剂,以预防克罗恩病的发作。受试者可为处于患克罗恩病的风险下,但尚未表现出可观察到的疾病症状的受试者。例如,受试者可以是在编码nod2的内源基因中具有功能丧失突变的受试者,例如选自由r702w、g908r和l1007fs组成的组的nod2基因中的突变。如上所述,使用本领域已知的和本文所述的标准分子生物学技术,包括基于pcr的方法,可以将受试者鉴定为具有这种突变。
[0272]
通过病毒转导产生功能性表达nod2的细胞的方法
[0273]
使用蛋白激酶c调节剂的转导
[0274]
多种剂可以用于降低pkc活性和/或表达。不受机制的限制,此类剂可通过刺激akt信号转导和/或将丝切蛋白维持在脱磷酸化状态来增强病毒转导,从而促进肌动蛋白解聚。这种肌动蛋白解聚事件可以用于除去阻碍病毒载体进入靶细胞核的物理屏障。
[0275]
星形孢菌素及其变体
[0276]
在一些实施方案中,所述降低pkc的活性和/或表达的物质是pkc抑制剂。所述pkc抑制剂可以是星形孢菌素或其变体。例如,所述pkc抑制剂可以是以式(i)表示的化合物
[0277][0278]
其中r1是h、oh、任选取代的烷氧基、任选取代的酰基氧基、任选取代的氨基、任选取代的烷基氨基、任选取代的酰氨基、卤素、任选取代的c
1-6
烷基、任选取代的c
2-6
烯基、任选取代的c
2-6
炔基、任选取代的酰基、任选取代的烷氧基羰基、氧代、硫代羰基、任选取代的羧基或脲基;
[0279]
r2是h、任选取代的c
1-6
烷基、任选取代的c
2-6
烯基、任选取代的c
2-6
炔基或任选取代的酰基;
[0280]
ra和rb各自独立地是h、任选取代的c
1-6
烷基、任选取代的c
2-6
烯基或任选取代的c
2-6
炔基、任选取代的和任选稠合的芳基、任选取代的和任选稠合的杂芳基、任选取代的和任选稠合的环烷基、或任选取代的和任选稠合的杂环烷基,或者ra和rb与它们结合的原子一起连接形成任选取代的和任选稠合的杂环烷基环;
[0281]
rc是o、nrd或s;
[0282]
rd是h、任选取代的c
1-6
烷基、任选取代的c
2-6
烯基或任选取代的c
2-6
炔基;
[0283]
每个x独立地是卤素、任选取代的卤代烷基、氰基、任选取代的氨基、羟基、硫醇、任选取代的烷氧基、任选取代的烷硫基、任选取代的酰基氧基、任选取代的烷氧基羰基、任选取代的羧基、脲基、任选取代的烷基磺酰基、任选取代的芳基磺酰基、任选取代的杂芳基磺酰基、任选取代的环烷基磺酰基、任选取代的杂环烷基磺酰基、任选取代的烷基硫烷基、任选取代的芳基硫烷基、任选取代的杂芳基硫烷基、任选取代的环烷基硫烷基、任选取代的杂环烷基硫烷基、任选取代的烷基亚磺酰基、任选取代的芳基亚磺酰基、任选取代的杂芳基亚磺酰基、任选取代的环烷基亚磺酰基、任选取代的杂环烷基亚磺酰基、任选取代的烷基、任选取代的烯基、任选取代的炔基、任选取代的和任选稠合的芳基、任选取代的和任选稠合的杂芳基、任选取代的和任选稠合的环烷基、或任选取代的和任选稠合的杂环烷基;
[0284]
每个y独立地是卤素、任选取代的卤代烷基、氰基、任选取代的氨基、羟基、硫醇、任选取代的烷氧基、任选取代的烷硫基、任选取代的酰基氧基、任选取代的烷氧基羰基、任选取代的羧基、脲基、任选取代的烷基磺酰基、任选取代的芳基磺酰基、任选取代的杂芳基磺酰基、任选取代的环烷基磺酰基、任选取代的杂环烷基磺酰基、任选取代的烷基硫烷基、任选取代的芳基硫烷基、任选取代的杂芳基硫烷基、任选取代的环烷基硫烷基、任选取代的杂环烷基硫烷基、任选取代的烷基亚磺酰基、任选取代的芳基亚磺酰基、任选取代的杂芳基亚磺酰基、任选取代的环烷基亚磺酰基、任选取代的杂环烷基亚磺酰基、任选取代的烷基、任选取代的烯基、任选取代的炔基、任选取代的和任选稠合的芳基、任选取代的和任选稠合的杂芳基、任选取代的和任选稠合的环烷基、或任选取代的和任选稠合的杂环烷基;
[0285]
‑‑‑
表示任选存在的键;
[0286]
n是0-4的整数;以及
[0287]
m是0-4的整数;
[0288]
或其盐。
[0289]
干扰rna
[0290]
可以与本公开的组合物和方法结合使用的示例性pkc调理剂包括干扰rna分子,诸如短干扰rna(sirna)、短发夹rna(shrna)和/或微rna(mirna),它们减少pkc基因表达。产生干扰rna分子的方法是本领域已知的并且详细描述于例如wo 2004/044136和美国专利第9,150,605号中,这些专利中的每个的公开内容通过引用整体并入本文。
[0291]
使用hdac抑制剂的转导
[0292]
多种剂可用于抑制组蛋白脱乙酰酶,以增加病毒转导过程中转基因的表达。不希望受理论束缚,来自病毒载体的转基因表达减少可能是由组蛋白去乙酰化进行的载体基因组的表观遗传沉默引起的。异羟肟酸代表了一类特别稳健的hdac抑制剂,其通过在这些酶的活性位点结合阳离子锌的异羟肟酸官能团来抑制这些酶。示例性抑制剂包括曲古抑菌素a以及伏立诺他(n-羟基-n'-苯基-辛二酰胺,描述于marks等人,nature biotechnology 25,84至90(2007);stenger,community oncology 4,384-386(2007),其公开内容通过引用并入本文)。其他hdac抑制剂包括帕比司他(panobinostat),描述于drugs of the future 32(4):315-322(2007),其公开内容通过引用并入本文。
[0293]
组蛋白脱乙酰酶的异羟肟酸抑制剂的其他实例包括如下所示的化合物,描述于
bertrand,european journal of medicinal chemistry 45:2095-2116(2010),其公开内容通过引用并入本文。
[0294]
其他不含异羟肟酸取代基的hdac抑制剂也已开发,包括丙戊酸(gottlicher等人,embo j.20(24):6969-6978(2001)和莫西司他(mocetinostat)(n-(2-氨基苯基)-4-[[(4-吡啶-3-基嘧啶-2-基)氨基]甲基]苯甲酰胺,描述于balasubramanian等人,cancer letters 280:211-221(2009)),其中每个的公开内容通过引用并入本文。利用不同于异羟肟酸盐的化学功能的其他小分子抑制剂包括在bertrand,european journal of medicinal chemistry 45:2095-2116(2010)中描述的那些,其公开内容通过引用并入本文。
[0295]
可用于本发明的组合物和方法的组蛋白乙酰化化学调节剂的其他实例包括hdac1、hdac2、hdac3、hdac4、hdac5、hdac6、hdac7、hdac8、hdac9、hdac10、sirt1、sirt2和/或hat的调节剂,诸如丁酰羟肟酸、m344、laq824(达西司他(dacinostat))、ar-42、贝利司他(belinostat)(pxd101)、cudc-101、scriptaid、苯丁酸钠、他喹莫德(tasquinimod)、奎西诺司他(quisinostat)(jnj-26481585)、帕西诺司他(pracinostat)(sb939)、cudc-907、恩替司他(entinostat)(ms-275)、莫西司他(mgcd0103)、tubastatin a hcl、pci-34051、屈辛司他(droxinostat)、pci-24781(阿比司他(abexinostat))、rgfp966、罗西林司他(rocilinostat)(acy-1215)、ci994(他西地那林(tacedinaline))、图巴新(tubacin)、rg2833(rgfp109)、瑞米司他(resminostat)、tubastatin a、brd73954、bg45、4sc-202、cay10603、lmk-235、nexturastat a、tmp269、hpob、cambinol和漆树酸(anacardic acid)。
[0296]
在一些具体实施方案中,hdac抑制剂是scriptaid。
[0297]
使用环孢菌素的转导
[0298]
在一些实施方案中,通过在环孢菌素(诸如环孢菌素a(csa)或环孢菌素h(csh))的存在下转导细胞来产生本公开的治疗性细胞。
[0299]
在一些实施方案中,当与所述细胞接触时,所述环孢菌素的浓度为约1μm至约10μm(例如,约1μm、1.1μm、1.2μm、1.3μm、1.4μm、1.5μm、1.6μm、1.7μm、1.8μm、1.9μm、2μm、2.1μm、2.2μm、2.3μm、2.4μm、2.5μm、2.6μm、2.7μm、2.8μm、2.9μm、3μm、3.1μm、3.2μm、3.3μm、3.4μm、3.5μm、3.6μm、3.7μm、3.8μm、3.9μm、4μm、4.1μm、4.2μm、4.3μm、4.4μm、4.5μm、4.6μm、4.7μm、4.8μm、4.9μm、5μm、5.1μm、5.2μm、5.3μm、5.4μm、5.5μm、5.6μm、5.7μm、5.8μm、5.9μm、6μm、6.1μm、6.2μm、6.3μm、6.4μm、6.5μm、6.6μm、6.7μm、6.8μm、6.9μm、7μm、7.1μm、7.2μm、7.3μm、7.4μm、7.5μm、7.6μm、7.7μm、7.8μm、7.9μm、8μm、8.1μm、8.2μm、8.3μm、8.4μm、8.5μm、8.6μm、8.7μm、8.8μm、8.9μm、9μm、9.1μm、9.2μm、9.3μm、9.4μm、9.5μm、9.6μm、9.7μm、9.8μm、9.9μm或10μm)。
[0300]
使用前列腺素e受体信号传导的活化剂的转导
[0301]
在一些实施方案中,通过在前列腺素e受体信号传导的活化剂的存在下转导细胞来产生本公开的治疗性细胞。
[0302]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是小分子,诸如wo 2007/112084或wo 2010/108028中描述的化合物,其中的每一个的公开内容通过引用并入本文,因为这些专利涉及前列腺素e受体信号传导活化剂。
[0303]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是小分子,诸如有机小
ae1-259或cp-533,536。非基于pge2的ep2激动剂的其他实例包括wo 2007/071456中公开的咔唑和芴,关于此类剂的公开内容以引用的方式并入本文。非基于pge2的ep3激动剂的示例性实例包括但不限于ae5-599、mb28767、gr63799x、ono-nt012和ono-ae-248。非基于pge2的ep4激动剂的示例性实例包括但不限于ono-4819、aps-999na、ah23848和ono-ae 1-329。非基于pge2的ep4激动剂的其他实例可见于wo 2000/038663;美国专利号6,747,037;和美国专利号6,610,719,这些专利中的每个的关于此类激动剂的公开内容均以引用的方式并入。
[0311]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是wnt激动剂。wnt激动剂的示例性实例包括但不限于wnt多肽和糖原合酶激酶3(gsk3)抑制剂。适合用作刺激前列腺ep受体信号传导通路的化合物的wnt多肽的示例性实例包括但不限于wnt1、wnt2、wnt2b/13、wnt3、wnt3a、wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt7c、wnt8、wnt8a、wnt8b、wnt8c、wnt1oa、wnt1ob、wnt11、wnt14、wnt15或它们的生物活性片段。适合用作刺激前列腺素ep受体信号传导通路的剂的gsk3抑制剂结合至gsk3a或gsk3或者降低它们的活性。gsk3抑制剂的示例性实例包括但不限于bio(6-溴靛玉红3
‑’‑
肟)、licl、li2co3或其他gsk-3抑制剂,如美国专利第6057117和第6608063号以及us 2004/0092535和us 2004/0209878所示例,以及atp竞争性、选择性gsk-3抑制剂chir-911和chir-837(也分别称为ct-99021/chir-99021和ct-98023/chir-98023)(chiron corporation(emeryville,ca))。
[0312]
chir-99021的结构是
[0313][0314]
或其盐。
[0315]
chir-98023的结构是
[0316][0317]
或其盐。
[0318]
在一些实施方案中,方法进一步包括使细胞与gsk3抑制剂接触。
[0319]
在一些实施方案中,所述gsk3抑制剂是chir-99021或chir-98023。
[0320]
在一些实施方案中,所述gsk3抑制剂是li2co3。
[0321]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是通过camp/p13k/akt第二信使通路增加信号传导的剂,诸如选自由以下各项组成的组的剂:二丁酰camp(dbcamp)、佛波酯、毛喉素、紫苏灵、8-溴-camp、霍乱毒素(ctx)、氨茶碱、2,4二硝基苯酚(dnp)、去甲肾上腺素、肾上腺素、异丙肾上腺素、异丁基甲基黄嘌呤(ibmx)、咖啡因、茶碱(二甲基黄嘌呤)、多巴胺、咯利普兰、伊洛前列素、垂体腺苷酸环化酶活化多肽(pacap)和血
管活性肠多肽(vip)、以及这些剂的衍生物。
[0322]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是通过ca
2+
第二信使通路增加信号传导的剂,诸如选自由以下各项组成的组的剂:bapta-am、芬地林、尼卡地平和这些剂的衍生物。
[0323]
在一些实施方案中,所述前列腺素e受体信号传导的活化剂是通过no/血管紧张素信号传导增加信号传导的剂,诸如选自由以下组成的组的剂:l-arg、硝普钠、钒酸钠、缓激肽及其衍生物。
[0324]
使用聚阳离子聚合物的转导
[0325]
在一些实施方案中,通过在聚阳离子聚合物的存在下转导细胞来产生本公开的治疗性细胞。在一些实施方案中,所述聚阳离子聚合物是聚凝胺、硫酸鱼精蛋白、聚乙烯亚胺或聚乙二醇/聚-l-赖氨酸嵌段共聚物。
[0326]
在一些实施方案中,所述聚阳离子聚合物是硫酸鱼精蛋白。
[0327]
在一些实施方案中,所述细胞在转导过程中还与扩增剂接触。所述细胞可以是例如造血干细胞,并且所述扩增剂可以是造血干细胞扩增剂,诸如本领域已知的或本文所述的造血干细胞扩增剂。
[0328]
额外的转导增强剂
[0329]
在一些实施方案中,在转导期间,所述细胞还与抑制mtor信号传导的剂接触。所述抑制mtor信号传导的剂可以是例如雷帕霉素,以及其他mtor信号传导的抑制剂。
[0330]
可与本发明的组合物和方法结合使用的其他转导增强剂包括例如他克莫司和载体融合蛋白。
[0331]
旋转
[0332]
在本公开的一些实施方案中,可以例如通过离心使靶向转导的细胞旋转,同时与病毒载体(例如,与本文所述的一种或多种另外的剂组合)一起培养。该“旋转”过程可以以例如约200xg至约2,000xg的向心力进行。向心力可以是例如约300xg至约1,200xg(例如,约300xg、400xg、500xg、600xg、700xg、800xg、900xg、1,000xg、1,100xg、或1,200xg或更大)。在一些实施方案中,将所述细胞旋转约10分钟至约3小时(例如,约10分钟、15分钟、20分钟、25分钟、30分钟、35分钟、40分钟、45分钟、50分钟、55分钟、60分钟、65分钟、70分钟、75分钟、80分钟、85分钟、90分钟、95分钟、100分钟、105分钟、110分钟、115分钟、120分钟、125分钟、130分钟、135分钟、140分钟、145分钟、150分钟、155分钟、160分钟、165分钟、170分钟、175分钟、180分钟或更长)。在一些实施方案中,所述细胞在室温下,诸如在约25℃的温度下旋转。
[0333]
涉及旋转步骤的示例性转导方案描述于例如millington等人,plos one4:e6461(2009);guo等人,journal of virology 85:9824-9833(2011);o’doherty等人,journal of virology 74:10074-10080(2000);和federico等人,lentiviral vectors and exosomes as gene and protein delivery tools,methods in molecular biology 1448,第4章(2016)中,这些文献中的每个的公开内容通过引用并入本文。
[0334]
用于nod2表达的病毒载体
[0335]
病毒基因组提供了丰富的载体来源,这些载体可以用于将外源基因有效递送至哺乳动物细胞中。病毒基因组是尤其可以用于基因递送的载体,因为此类基因组内包含的多核苷酸通常通过一般化或特殊化转导掺入哺乳动物细胞的核基因组中。这些过程作为天然
病毒复制周期的一部分发生,并且不需要添加蛋白质或剂来诱导基因整合。病毒载体的实例是逆转录病毒(例如,逆转录病毒科家族病毒载体)、腺病毒(例如,ad5、ad26、ad34、ad35和ad48)、细小病毒、冠状病毒、负链rna病毒,诸如正粘病毒(例如,流感病毒)、棒状病毒(例如,狂犬病毒和水疱性口炎病毒)、副粘病毒(例如麻疹病毒和仙台病毒)、正链rna病毒(诸如细小核糖核酸病毒和甲病毒)以及双链dna病毒,包括腺病毒、疱疹病毒(例如,1型和2型单纯疱疹病毒、eb病毒、巨细胞病毒)和痘病毒(例如,牛痘、改良安卡拉痘苗(modified vaccinia ankara;mva)、鸡痘和金丝雀痘)。其他病毒包括例如诺沃克(norwalk)病毒、囊膜病毒、黄病毒、呼肠孤病毒、乳多空病毒、嗜肝dna病毒、人乳头瘤病毒、人泡沫病毒和肝炎病毒。逆转录病毒的实例包括:禽白血病-肉瘤、禽c型病毒、哺乳动物c型、b型病毒、d型病毒、致癌逆转录病毒(oncoretrovirus)、htlv-blv组、慢病毒、α逆转录病毒、γ逆转录病毒、泡沫病毒(coffin,j.m.,retroviridae:the viruses and their replication,virology,第三版(lippincott-raven,philadelphia,1996))。其他实例是鼠类白血病病毒、鼠类肉瘤病毒、小鼠乳房肿瘤病毒、牛白血病病毒、猫白血病病毒、猫肉瘤病毒、禽白血病病毒、人t细胞白血病病毒、狒狒内源病毒、长臂猿白血病病毒、梅森辉瑞猴病毒、猿猴免疫缺陷病毒、猿猴肉瘤病毒、劳斯肉瘤病毒和慢病毒。载体的其他实例描述于例如mcvey等人(us 5,801,030)中,该专利的教导以引用的方式并入本文。
[0336]
逆转录病毒载体
[0337]
用于本文描述的方法和组合物中的递送载体可以是逆转录病毒载体。一种可以用于本文所述的方法和组合物中的逆转录病毒载体类型是慢病毒载体。慢病毒载体(lv)是逆转录病毒的亚群,可高效转导范围广泛的分裂和非分裂细胞类型,使转基因稳定、长期表达。delenda,the journal of gene medicine 6:s125(2004)中提供了包装和转导lv的优化策略的概述,该文献的公开内容以引用的方式并入本文。
[0338]
基于慢病毒的基因转移技术的使用依赖于携带高度缺失病毒基因组的重组慢病毒颗粒的体外生产,所述基因组中容纳了所关注的转基因。具体而言,重组慢病毒通过在允许细胞系中的反式共表达来回收(1)包装构建体,即表达gag-pol前体和rev(替代地,反式表达)的载体;(2)表达包膜受体的载体,其通常具有异源性;以及(3)转移载体,包含在不含所有开放阅读框,但保留了复制、衣壳化和表达所期望的序列的病毒cdna中,其中插入了要表达的序列。
[0339]
用于本文描述的方法和组合物中的lv可以包括5'-长末端重复序列(ltr)、hiv信号序列、hiv psi信号5'-剪接位点(sd)、δ-gag元件、rev响应元件(rre)、3'-剪接位点(sa)、延伸因子(ef)1-α启动子和3'-自失活ltr(sin-ltr)中的一种或多种。慢病毒载体任选地包括中央多嘌呤区(cppt)和土拨鼠肝炎病毒转录后调控元件(wpre),如us 6,136,597中所述,该专利的公开内容以引用的方式并入本文,因为其涉及wpre。慢病毒载体可以还包括phr'骨架,它可以包括例如如下提供的。
[0340]
lu等人,journal of gene medicine 6:963(2004)中描述的lentigen lv可以用于表达dna分子和/或转导细胞。用于本文描述的方法和组合物中的lv可以是5'-长末端重复序列(ltr)、hiv信号序列、hiv psi信号5'-剪接位点(sd)、δ-gag元件、rev响应元件(rre)、3'-剪接位点(sa)、延伸因子(ef)1-α启动子和3'-自失活ltr(sin-ltr)。对本领域的技术人员而言显而易见的是,这些区域中的一个或多个任选地被另一个执行类似功能的区
域取代。
[0341]
增强子元件可以用于增加经修饰的dna分子的表达或增加慢病毒整合效率。用于本文描述的方法和组合物中的lv可以包括nef序列。用于本文描述的方法和组合物中的lv可以包括增强载体整合的cppt序列。cppt作为(+)链dna合成的第二个起点,并在其天然hiv基因组中间引入部分链重叠。在转移载体骨架中引入cppt序列大大增加了核转运和整合到靶细胞dna中的基因组总量。用于本文描述的方法和组合物中的lv可以包括土拨鼠转录后调控元件(wpre)。wpre通过促进转录物的核输出和/或通过增加新生转录物的聚腺苷酸化效率而在转录水平上发挥作用,从而增加细胞中的总mrna量。将wpre添加到lv中导致体外和体内由几种不同的启动子造成的转基因表达的水平的显著改善。用于本文描述的方法和组合物中的lv可以包括cppt序列和wpre序列。载体还可包括允许从单个启动子表达多种多肽的ires序列。
[0342]
除了ires序列之外,允许表达多种多肽的其他元件也是有用的。用于本文描述的方法和组合物中的载体可包括允许表达多于一种多肽的多个启动子。用于本文描述的方法和组合物中的载体可包括允许表达多于一种多肽的蛋白质切割位点。允许表达多于一种多肽的蛋白质切割位点的实例在klump等人,gene ther.;8:811(2001),osborn等人,molecular therapy 12:569(2005),szymczak和vignali,expert opin biol ther.5:627(2005)和szymczak等人,nat biotechnol.22:589(2004)中有所描述,这些文献的公开内容以引用的方式并入本文,因为它们涉及允许表达多于一种多肽的蛋白质切割位点。对本领域的技术人员来说很容易理解的是,允许未来鉴定的多种多肽表达的其他元件是有用的,并且可以用于适合与本文所述的组合物和方法一起使用的载体中。
[0343]
用于本文描述的方法和组合物中的载体可以是临床级载体。
[0344]
通过离体转染产生功能性表达nod2的细胞的方法
[0345]
可用于在哺乳动物细胞中实现本文所述的一种或多种蛋白质的治疗有效细胞内浓度的一个平台是通过编码这些剂的基因的稳定表达(例如,通过整合到哺乳动物细胞的核或线粒体基因组中)。这些基因是编码相应蛋白质的一级氨基酸序列的多核苷酸。为了将这些外源基因导入哺乳动物细胞,可以将这些基因整合到载体中。可以通过多种方法将载体引入细胞,包括转化、转染、直接摄取、投射轰击和将载体封装在脂质体中。转染或转化细胞的合适方法的实例是磷酸钙沉淀、电穿孔、显微注射、感染、脂质转染和直接摄取。此类方法更详细地描述于例如green等人,molecular cloning:a laboratory manual,第四版(cold spring harbor university press,new york(2014));以及ausubel等人,current protocols in molecular biology(john wiley&sons,new york(2015))中,其中每一个的公开内容通过引用并入本文。
[0346]
编码本公开的治疗性蛋白质的基因也可以通过将含有编码这种剂的基因的载体靶向细胞膜磷脂而导入哺乳动物细胞。例如,通过将载体分子与vsv-g蛋白(一种对所有细胞膜磷脂都有亲和力的病毒蛋白)连接,载体可以靶向细胞膜的细胞外表面上的磷脂。这样,可以使用本领域技术人员熟知的方法产生构建体。
[0347]
哺乳动物rna聚合酶对编码本公开的一种或多种治疗性蛋白质的多核苷酸的识别和结合对于基因表达是重要的。因此,可在多核苷酸内包括对募集rna聚合酶并促进转录复合物在转录起始位点的组装的转录因子表现出高亲和力的序列元件。这种序列元件包括例
如哺乳动物启动子,其序列可以被特异性转录起始因子和最终的rna聚合酶识别和结合。哺乳动物启动子的实例已经描述于在线公布的smith等人,mol.sys.biol.,3:73中,其公开内容通过引用并入本文。
[0348]
一旦将编码一种或多种治疗性蛋白质的多核苷酸并入哺乳动物细胞的核dna中,就可以通过本领域已知的方法诱导此多核苷酸的转录。例如,可以通过将哺乳动物细胞暴露于外部化学试剂,诸如调节转录因子和/或rna聚合酶与哺乳动物启动子的结合并因此调控基因表达的剂来诱导表达。化学试剂可以用于促进rna聚合酶和/或转录因子与哺乳动物启动子的结合,例如通过除去已结合启动子的阻遏蛋白。替代地,化学试剂可用于增强哺乳动物启动子对rna聚合酶和/或转录因子的亲和力,使得在化学试剂存在的情况下,位于启动子下游的基因的转录速率增加。通过以上机制增强多核苷酸转录的化学试剂的实例是四环素和强力霉素(doxycycline)。这些试剂是商业上可获得的(life technologies,carlsbad,ca),并且可以根据已建立的方案向哺乳动物细胞施用以促进基因表达。
[0349]
可包括在用于在本文所述的组合物和方法中使用的多核苷酸中的其他dna序列元件是增强子序列。增强子代表另一类调控元件,其诱导含有所关注基因的多核苷酸的构象变化,使得dna采用有利于转录因子和rna聚合酶在转录起始位点处结合的三维取向。因此,用于本文所述组合物和方法中的多核苷酸包括编码一种或多种治疗性蛋白质的多核苷酸,并且还包括哺乳动物增强子序列。现在已知许多来自哺乳动物基因的增强子序列,并且实例是来自编码哺乳动物珠蛋白、弹性蛋白酶、白蛋白、甲胎蛋白和胰岛素的基因的增强子。用于在本文所述的组合物和方法中使用的增强子还包括来源于能够感染真核细胞的病毒的遗传物质的那些增强子。实例是复制起点后侧(bp100-270)的sv40增强子、巨细胞病毒早期启动子增强子、复制起点后侧的多瘤增强子以及腺病毒增强子。yaniv等人,nature 297:17(1982)公开了诱导真核基因转录活化的其他增强子序列。
[0350]
用于表达和递送nod2的细胞
[0351]
可以与本文所述的组合物和方法结合使用的细胞包括能够进行进一步分化的细胞。例如,可以与本文所述的组合物和方法结合使用的一种细胞类型是多能细胞。多能细胞是具有发育为多于一种分化细胞类型的能力的细胞。多能细胞的实例是esc、ipsc和cd34+细胞。esc和ipsc能够分化为外胚层(它形成皮肤和神经系统)、内胚层(它形成胃肠道和呼吸道、内分泌腺、肝脏和胰腺)和中胚层(它形成骨骼、软骨、肌肉、结缔组织和大部分循环系统)。
[0352]
可以与本文所述的组合物和方法结合使用的细胞包括造血干细胞和造血祖细胞。造血干细胞(hsc)是未成熟的血细胞,具有自我更新和分化为成熟血细胞的能力,包括但不限于粒细胞(例如早幼粒细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性细胞)、红细胞(例如网织红细胞、红细胞)、血小板细胞(例如巨核细胞、产生血小板的巨核细胞、血小板)、单核细胞(例如单核细胞、巨噬细胞)、树突细胞、小胶质细胞、破骨细胞和淋巴细胞(例如,nk细胞、b细胞和t细胞)。人类hsc是cd34+。此外,hsc还指长期再造hsc(lt-hsc)和短期再造hsc(st-hsc)。这些hsc中的任一者都可以与本文所述的组合物和方法结合使用。
[0353]
hsc和其他多能祖细胞可以从血液制品中获得。血液制品是从身体或身体器官获得的含有造血来源细胞的产品。这些来源包括未分级的骨髓、脐带、胎盘、外周血或外周动员血。所有上述粗制或未分级的血液制品都可以通过多种方式富集具有hsc或骨髓祖细胞
特征的细胞。例如,可以根据它们表达的细胞表面分子选择更成熟、分化的细胞。血液制品可以通过正向选择cd34+细胞进行分级,其中包括能够自我更新、多潜能的造血干细胞亚群,并且可以重新引入移植受体体内,然后它们归巢于造血干细胞龛并重新建立生产性和持续性的造血功能。这种选择是使用例如商购获得磁性抗cd34珠(dynal,lake success,ny)完成的。骨髓祖细胞也可以根据它们表达的标记进行分离。未分级的血液制品可以直接从供体获得,也可以从冷冻保存库中收回。hsc和骨髓祖细胞也可以通过es细胞、ips细胞或其他重编程的成熟细胞类型的分化获得。
[0354]
可以与本文所述的组合物和方法结合使用的细胞包括同种异体细胞和自体细胞。当使用同种异体细胞时,细胞可以任选地与接受细胞治疗的受试者hla匹配。
[0355]
可以与本文所述的组合物和方法结合使用的细胞包括cd34+/cd90+细胞和cd34+/cd164+细胞。这些细胞可能含有更高百分比的hsc。这些细胞描述于radtke等人sci.transl.med.9:1-10,2017和pellin等人nat.comm.1-:2395,2019中,其中每一个的公开内容均在此通过引用整体并入。
[0356]
本文和上文所述的细胞可使用例如多种方法进行遗传修饰以表达nod2(参见例如标题为“通过病毒转导产生功能性表达nod2的细胞的方法”、“通过离体转染产生功能性表达nod2的细胞的方法”和“使用基因编辑技术促进功能性nod2表达”的部分)。一旦细胞已经适应表达生理水平的功能性nod2,这些细胞就具有治疗用途,并且在本文中称为“本公开的治疗性细胞”。
[0357]
使用基因编辑技术促进功能性nod2表达
[0358]
用于破坏和/或整合靶基因到细胞(例如,多能干细胞)基因组中的另一个有用工具是成簇规则间隔的短回文重复序列(crispr)/cas系统,所述系统最初进化为细菌和古菌抵抗病毒感染的适应性防御机制。crispr/cas系统包括质粒dna内的回文重复序列和crispr相关蛋白(cas;例如,cas9或cas12a)。这种dna和蛋白质的集合通过首先将外源dna整合到crispr基因座中来指导靶序列的位点特异性dna切割。含有这些外源序列和crispr基因座的重复间隔体元件的多核苷酸进而在宿主细胞中转录以产生向导rna,所述向导rna随后可与靶序列退火并使cas核酸酶定位于此位点。以此方式,可在外源多核苷酸中引起高位点特异性cas介导的dna切割,这是因为通过rna:dna杂交来管控使cas紧密靠近靶dna分子的相互作用。因此,可设计crispr/cas系统以切割任何所关注靶dna分子。所述技术已被开发用于编辑真核生物基因组(hwang等人,nature biotechnology 31:227(2013),其公开内容通过引用并入本文),并且可用作位点特异性编辑多能干细胞基因组的有效手段,以便在并入编码靶基因的基因之前切割dna。使用crispr/cas调节基因表达已描述于例如wo 2017/182881和us 8,697,359中,这些文献的公开内容均通过引用并入本文。
[0359]
例如,使用本公开的组合物和方法,可以编辑含有编码缺陷型nod2蛋白的核酸的遗传基因座,以便再现功能性nod2表达。这样做的示例性程序示于图1中。如图1所描绘,可以在编码内源性nod2的基因附近或其内部的位点编辑靶细胞(诸如从克罗恩病患者获得的自体细胞)中的遗传基因座。编码内源性nod2的基因可以是例如具有引起nod2缺陷的突变的基因。为了在此位点编辑靶细胞基因组,可以向细胞提供核酸酶,诸如上述crispr相关蛋白,以及向导rna(grna)和编码功能性nod2的模板核酸。grna可将核酸酶导向靶细胞基因组内的所需位点,所述位点位于编码缺陷型nod2蛋白的基因内或附近。例如,这可以通过grna
和靶细胞基因组中所需位点之间的碱基对杂交来实现。在grna与所需位点杂交后,核酸酶可以在所需位点催化单链断裂或双链断裂。在此切割事件之后,编码功能性nod2的模板核酸可以在所需位点插入靶细胞基因组中。在一些实施方案中,诸如在图1所示的情景中,将编码功能性nod2的模板核酸插入可操作地连接至内源nod2启动子的位点处,从而使得再现功能性nod2蛋白表达。
[0360]
替代地,碱基编辑可用于位点特异性编辑靶细胞基因组中所需位点处的一个或多个核碱基,以消除nod2缺陷引起的突变并再现编码功能性nod2的基因的表达。碱基编辑技术可以使用例如突变体cas9,其诱导靶细胞中内源dna的一条链中的单链断裂,此时融合的脱氨酶然后将一个碱基转化为另一个,诸如腺嘌呤(a)转化为肌苷(i)(在dna复制后鸟嘌呤(g)的替代物)。剩余dna链中伴随的t到c的变化是通过dna修复和复制发生的。碱基编辑也可用于rna水平,因为突变体cas13-adar融合蛋白已被部署以结合rna并催化导致a变为i的核碱基修饰。可用于消除细胞中引起缺陷的nod2突变并再现功能性nod2蛋白的表达的dna碱基编辑的示例性方法描述于cohen,“novel crispr-derived
‘
base editors’surgically alter dna or rna,offering new ways to fix mutations,’science magazine,2017年10月,其公开内容通过引用并入本文。
[0361]
在将所关注的基因并入多能干细胞中之前,通过位点特异性切割基因组dna来破坏靶dna的替代方法包括使用锌指核酸酶(zfn)和转录活化因子样效应物核酸酶(talen)。与crispr/cas系统不同,这些酶不含用来定位于特定靶序列的向导多核苷酸。而靶特异性由这些酶内的dna结合结构域控制。zfn和talen在基因组编辑应用中的使用描述于例如urnov等人nature reviews genetics 11:636(201o);和joung等人nature reviews molecular cell biology 14:49(2013)中,每篇文献的公开内容通过引用并入本文。在一些实施方案中,使用上述基因编辑技术破坏内源基因,例如在多能干细胞中。
[0362]
在一些实施方案中,使用基因编辑方法,诸如crispr/cas系统或另一种上述核酸酶,以便将编码功能性nod2蛋白(即,缺乏破坏活性突变的nod2蛋白)的基因直接插入从克罗恩病患者获得的细胞中的内源nod2基因座中。这样,突变体nod2的表达可以被抑制,同时诱导功能性nod2蛋白的表达。
[0363]
增强细胞移植的剂
[0364]
在一些实施方案中,施用给患者的增加功能性nod2活性或表达的一种或多种剂是表达nod2转基因的细胞群(例如,cd34+细胞)。在这种情况下,在将细胞施用给患者之前,可以向患者施用消融cd34+细胞的内源性群体的剂,从而允许施用的cd34+细胞植入患者体内。调理剂的实例包括清髓性调理剂,其消耗患者体内的多种造血细胞。例如,可以用烷化剂对患者进行预处理,所述烷化剂诸如氮芥(例如,苯达莫司汀、苯丁酸氮芥、环磷酰胺、异环磷酰胺、氮芥或美法仑)、亚硝脲(例如,卡莫司汀、洛莫司汀或链脲霉素)、烷基磺酸盐(例如,白消安)、三嗪(例如,达卡巴嗪或替莫唑胺)或乙烯亚胺(例如,奥曲肽或噻替派)。在一些实施方案中,向患者施用选择性消融特定内源细胞群的调理剂,诸如内源性cd34+hsc或hpc群。
[0365]
在一些实施方案中,用前列腺素e受体信号传导的活化剂对患者进行预处理,以帮助促进所施用的表达nod2的细胞的植入。前列腺素e受体信号传导活化剂可以例如选自由以下组成的组:前列腺素(pg)a2(pga2)、pgb2、pgd2、pge1(前列地尔)、pge2、pgf2、pgi2(依
前列醇)、pgh2、pgj2及其衍生物和类似物。
[0366]
在一些实施方案中,用于帮助促进表达nod2的细胞植入的前列腺素e受体信号传导的活化剂是pge2或dmpg2。
[0367]
在一些实施方案中,用于帮助促进表达nod2的细胞植入的前列腺素e受体信号传导的活化剂是15d-pgj2、δi2-pgj2、2-羟基十七碳三烯酸(hht)、血栓素(txa2和txb2)、pgi2类似物(例如,伊洛前列素和曲前列素)、pgf2类似物(例如,曲伏前列素、甲基前列腺素三羟甲基氨基甲烷、他氟前列素、拉坦前列素、比马前列素、异丙基乌诺前列酮、氯前列醇、雌二醇和苏帕潘)、pge1类似物(例如,11-脱氧pge1、米索前列醇和布塔前列素),以及科里醇-a([3aa,4a,5,6aa]-(-)-[六氢-4-(羟甲基)-2-氧代-2h-环戊二烯并/b/呋喃-5-基][1,1'-联苯]-4-甲酸酯)、科里醇-b(2h-环戊二烯并[b]呋喃-2-酮,5-(苯酰氧基)六氢-4-(羟甲基)[3ar-(3aa,4a,5,6aa)])和科里二醇((3ar,4s,5r,6as)-六氢-5-羟基-4-(羟甲基)-2h-环戊二烯并[b]呋喃-2-酮)。
[0368]
在一些实施方案中,用于帮助促进表达nod2的细胞植入的前列腺素e受体信号传导的活化剂是前列腺素e受体配体,诸如前列腺素e2(pge2)或其类似物或衍生物。前列腺素通常是指衍生自含有20个碳原子,包括5碳环的脂肪酸的激素样分子,如本文所述和本领域已知的。pge2“类似物”或“衍生物”的示例性实例包括但不限于16,16-二甲基pge2、16-16二甲基pge2对-(对乙酰酰氨基苯甲酰氨基)苯基酯、11-脱氧-16,16-二甲基pge2、9-脱氧-9-亚甲基-16,16-二甲基pge2、9-脱氧-9-亚甲基pge2、9-酮氟前列醇、5-反式pge2、17-苯基-ω-三去甲pge2、pge2丝氨醇酰胺、pge2甲酯、16-苯基四去甲pge2、15(s)-15-甲基pge2、15(r)-15-甲基pge2、8-异-15-酮pge2、8-异pge2异丙酯、20-羟基pge2、诺氯前列素、舒前列酮、布塔前列素、15-酮pge2和19(r)羟基pge2。
[0369]
在一些实施方案中,用于帮助促进表达nod2的细胞植入的前列腺素e受体信号传导的活化剂是在9-位被卤素取代的具有与pge2相似结构的前列腺素类似物或衍生物(参见例如wo 2001/12596,所述专利通过引用整体并入本文),以及2-脱羧基-2-磷酸亚基前列腺素衍生物(诸如us 2006/0247214中描述的那些,所述专利通过引用整体并入本文)。
[0370]
在一些实施方案中,用于帮助促进表达nod2的细胞植入的前列腺素e受体信号传导的活化剂是非基于pge2的配体。在一些实施方案中,用于帮助促进表达nod2的细胞植入的前列腺素e受体信号传导的活化剂是cay10399、ono_8815ly、ono-ae1-259或cp-533,536。非基于pge2的ep2激动剂的其他实例包括wo 2007/071456中公开的咔唑和芴,关于此类剂的公开内容通过引用并入本文。非基于pge2的ep3激动剂的示例性实例包括但不限于ae5-599、mb28767、gr63799x、ono-nt012和ono-ae-248。非基于pge2的ep4激动剂的示例性实例包括但不限于ono-4819、aps-999na、ah23848和ono-ae 1-329。非基于pge2的ep4激动剂的其他实例可见于wo 2000/038663;美国专利第6,747,037号;和美国专利第6,610,719号,这些专利中的每个的关于此类激动剂的公开内容均通过引用并入。
[0371]
在一些实施方案中,用于帮助促进表达nod2的细胞植入的前列腺素e受体信号传导的活化剂是wnt激动剂。wnt激动剂的示例性实例包括但不限于wnt多肽和糖原合酶激酶3(gsk3)抑制剂。适合用作刺激前列腺ep受体信号传导通路的化合物的wnt多肽的示例性实例包括但不限于wnt1、wnt2、wnt2b/13、wnt3、wnt3a、wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt7c、wnt8、wnt8a、wnt8b、wnt8c、wnt1oa、wnt1ob、wnt11、wnt14、wnt15或它们的生
物活性片段。适合用作刺激前列腺素ep受体信号传导通路的剂的gsk3抑制剂结合至gsk3a或gsk3或者降低它们的活性。gsk3抑制剂的示例性实例包括但不限于bio(6-溴靛玉红-3'-肟)、licl、li2co3或其他gsk-3抑制剂,如美国专利第6057117号和第6608063号以及us2004/0092535和us 2004/0209878所示例,以及atp竞争性、选择性gsk-3抑制剂chir-911和chlr-837(也分别称为ct-99021/chir-99021和ct-98023/chir-98023)(chiron corporation(emeryville,ca))。
[0372]
在一些实施方案中,用于帮助促进表达nod2的细胞植入的前列腺素e受体信号传导的活化剂是通过camp/p13k/akt第二信使通路增加信号传导的剂,诸如选自由以下组成的组的剂:二丁酰camp(dbcamp)、佛波酯、毛喉素、紫苏灵、8-溴-camp、霍乱毒素(ctx)、氨茶碱、2,4二硝基苯酚(dnp)、去甲肾上腺素、肾上腺素、异丙肾上腺素、异丁基甲基黄嘌呤(ibmx)、咖啡因、茶碱(二甲基黄嘌呤)、多巴胺、咯利普兰、伊洛前列素、垂体腺苷酸环化酶活化多肽(pacap)和血管活性肠多肽(vip)以及这些剂的衍生物。
[0373]
在一些实施方案中,用于帮助促进表达nod2的细胞植入的前列腺素e受体信号传导的活化剂是通过ca
2+
第二信使通路增加信号传导的剂,诸如选自由以下组成的组的剂:bapta-am、芬地林、尼卡地平和这些剂的衍生物。
[0374]
在一些实施方案中,用于帮助促进表达nod2的细胞植入的前列腺素e受体信号传导的活化剂是通过no/血管紧张素信号传导增加信号传导的剂,诸如选自由以下组成的组的剂:l-arg、硝普钠、钒酸钠、缓激肽及其衍生物。
[0375]
测量nod2基因表达的方法
[0376]
优选地,本公开的组合物和方法用于促进患者(例如,患有克罗恩病的人类患者)中生理正常水平的功能性nod2的表达。例如,本公开的治疗剂可以刺激nod2缺乏的人类患者(例如,患有克罗恩病的人类患者)中的功能性nod2表达。例如,本公开的治疗剂可以促进克罗恩病患者中的nod2表达,其水平为例如在没有nod2缺乏的可比年龄和体重指数的人类受试者中观察到的功能性nod2表达水平的约20%至约200%(例如,在没有nod2缺乏的可比年龄和体重指数的人类受试者中观察到的功能性nod2表达水平的约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、105%、110%、115%、120%、125%、130%、135%、140%、145%、150%、155%、160%、165%、170%、175%、180%、185%、190%、195%或200%)。
[0377]
例如,通过评估来源于功能性nod2转基因转录的mrna转录物的浓度或相对丰度,可以确定患者体内表达的功能性nod2的表达水平。另外或替代地,可以通过评估由nod2转基因的转录和翻译产生的功能性nod2蛋白的浓度或相对丰度来确定基因表达。也可以使用功能性测定法,诸如mdp检测分析来评估蛋白质浓度。接下来的部分描述了可用于测量nod2转基因在递送至患者(诸如患有本文所述的克罗恩病的患者)后的表达水平的示例性技术。转基因表达可以通过本领域已知的许多方法来评估,包括但不限于核酸测序、微阵列分析、蛋白质组学、原位杂交(例如,荧光原位杂交(fish))、基于扩增的测定法、原位杂交、荧光活化细胞分选(facs)、northern分析和/或mrna的pcr分析。
[0378]
核酸检测
[0379]
可与本文所述的组合物和方法结合使用的用于确定nod2转基因表达检测的基于核酸的方法包括基于成像的技术(例如,northern印迹或southern印迹)。这种技术可以使
用在施用nod2转基因后从患者获得的细胞来进行。northern印迹分析是本领域众所周知的常规技术并且描述于例如molecular cloning,a laboratory manual,第二版,1989,sambrook,fritch,maniatis,cold spring harbor press,10skyline drive,plainview,ny 11803-2500中。用于评估基因和基因产物的状态的典型方案可见于例如ausubel等人编,1995,current protocols in molecular biology,第2单元(northern印迹),第4单元(southern印迹),第15单元(免疫印迹)和第18单元(pcr分析)。
[0380]
可与本文所述的组合物和方法结合使用以评估nod2表达的转基因检测技术还包括微阵列测序实验(例如,sanger测序和下一代测序方法,也称为高通量测序或深度测序)。示例性的下一代测序技术包括但不限于illumina测序、ion torrent测序、454测序、solid测序和纳米孔测序平台。也可以使用本领域已知的其他测序方法。例如,可以使用rna-seq确定mrna水平的转基因表达(例如,如mortazavi等人,nat.methods 5:621-628(2008)中所述,其公开内容通过引用整体并入本文)。rna-seq是一种通过直接测序样品中的rna分子来监测表达的稳健技术。简而言之,此方法可包括将rna断裂成平均长度为200个核苷酸,通过随机引发转化成cdna,以及双链cdna的合成(例如,使用来自agilent technology的仅cdna双链cdna合成试剂盒)。然后,通过为每个文库添加序列衔接子(例如,来自/solexa),将cdna转化为用于测序的分子文库,并且将所得的50-100个核苷酸读数绘制到基因组上。
[0381]
转基因表达水平可以使用基于微阵列的平台(例如,单核苷酸多态性阵列)来确定,因为微阵列技术提供了高分辨率。各种微阵列方法的细节可以在文献中找到。参见例如美国专利第6,232,068号和pollack等人,nat.genet.23:41-46(1999),每篇文献的公开内容通过引用整体并入本文。使用核酸微阵列,mrna样品被逆转录并标记以产生cdna。然后探针可以与排列并固定在固体载体上的一种或多种互补核酸杂交。所述阵列可以被配置例如以使得阵列的每个成员的顺序和位置是已知的。标记探针与特定阵列成员的杂交指示探针来源的样品表达所述基因。可以根据从杂交的探针-样品复合物中检测到的信号的量来定量表达水平。典型的微阵列实验包括以下步骤:1)从分离自样品的rna中制备荧光标记的靶,2)标记的靶与微阵列的杂交,3)阵列的洗涤、染色和扫描,4)扫描图像的分析和5)基因表达谱的产生。微阵列处理器的一个实例是affymetrix系统,其是商业上可获得的,并且包括通过在玻璃表面上直接合成寡核苷酸制造的阵列。如本领域技术人员所知,可以使用其他系统
[0382]
基于扩增的测定法也可用于在递送给患者后测量转基因在靶细胞中的表达水平。在这种分析中,基因的核酸序列在扩增反应(例如,pcr,诸如qpcr)中充当模板。在定量扩增中,扩增产物的量与原始样品中模板的量成比例。根据本文所述的原理,与合适的对照比较提供了基因表达水平的测量,对应于所用的特定探针。使用taqman探针的实时qpcr的方法在本领域中是众所周知的。实时qpcr的详细方案提供于例如gibson等人,genome res.6:995-1001(1996)和heid等人,genome res.6:986-994(1996)中,每篇文献的公开内容通过引用整体并入本文。可以通过rt-pcr技术来确定本文所述的基因表达的水平。用于pcr的探针可以用可检测的标志物标记,诸如(例如)放射性同位素、荧光化合物、生物发光化合物、化学发光化合物、金属螯合剂或酶。
[0383]
蛋白质检测
[0384]
还可以通过测量由所关注的基因编码的相应蛋白质产物(例如,nod2)的浓度或相对丰度来确定转基因表达。可以使用本领域已知的标准检测技术来评估蛋白质水平。适用于本文所述组合物和方法的蛋白质表达测定法包括蛋白质组学方法、免疫组织化学和/或蛋白质印迹分析(western blot analysis)、免疫沉淀、分子结合测定法、elisa、酶联免疫过滤测定法(elifa)、质谱、质谱免疫测定法和生化酶活性测定法。特别是,蛋白质组学方法可以用于产生大规模的蛋白质表达数据集。蛋白质组学方法可以利用质谱来检测并定量多肽(例如,蛋白质)和/或肽微阵列,利用对一组靶蛋白具有特异性的捕获试剂(例如,抗体)来鉴定和测量样品(例如,单细胞样品或多细胞群体)中表达的蛋白质的表达水平。
[0385]
示例性的肽微阵列具有基质结合的多种多肽,寡核苷酸、肽或蛋白质与多种结合多肽中的每一种的结合是可单独检测的。替代地,肽微阵列可以包括多种结合物,包括但不限于单克隆抗体、多克隆抗体、噬菌体展示结合物、酵母双杂交结合物、适体,其可以特异性地检测特定寡核苷酸、肽或蛋白质的结合。肽阵列的例子可见于美国专利第6,268,210号、第5,766,960号和第5,143,854号中,这些专利中每一个的公开内容均通过引用整体并入本文。
[0386]
质谱(ms)可与本文所述的方法结合使用,以在递送转基因后鉴定和表征来自患者(例如,人类患者)的细胞中的转基因表达。本领域已知的任何ms方法可用于确定、检测和/或测量所关注的蛋白质或肽片段,例如lc-ms、esi-ms、esi-ms/ms、maldi-tof-ms、maldi-tof/tof-ms、串联ms等。质谱仪通常含有离子源和光学器件、质量分析器和数据处理电子器件。质量分析仪包括扫描和离子束质谱仪,诸如飞行时间(time-of-flight;tof)和四极质谱仪(q),以及捕集质谱仪,诸如离子阱(it)、轨道阱和傅立叶变换离子回旋共振(fourier transform ion cyclotron resonance;ft-icr),可用于本文所述的方法中。各种ms方法的细节可以在文献中找到。参见例如yates等人,annu.rev.biomed.eng.11:49-79,2009,其公开内容通过引用整体并入本文。
[0387]
在ms分析之前,可以首先通过化学(例如,通过溴化氰切割或酶(例如,胰蛋白酶)消化)将从患者获得的样品中的蛋白质消化成较小的肽。复杂的肽样品也受益于前端分离技术的使用,例如2d-page、hplc、rplc和亲和色谱法。然后,使用离子源将消化的和任选分离的样品离子化,以产生用于进一步分析的带电分子。样品的电离可以通过例如电喷雾电离(esi)、大气压化学电离(apci)、光电离、电子电离、快速原子轰击(fab)/液体二次电离(lsims)、基质辅助激光解吸/电离(maldi)、场电离、场解吸、热喷雾/等离子体喷雾电离和粒子束电离来进行。与电离方法的选择相关的其他信息是本领域技术人员已知的。
[0388]
电离后,消化后的肽段可能会断裂以产生特征ms/ms谱。串联质谱(也称为ms/ms)对分析复杂混合物特别有用。串联ms涉及ms选择的多个步骤,在这些阶段之间发生某种形式的离子断裂,这可以通过在空间上分离的单个质谱仪元件或使用在时间上分离ms步骤的单个质谱仪来实现。在空间分离的串联ms中,元件在物理上是分离且不同的,元件之间通过物理连接来保持高真空。在时间分离的串联ms中,分离是通过在同一位置捕获离子来实现的,随着时间的推移会发生多个分离步骤。然后可以将特征ms/ms谱与肽序列数据库(例如,sequest)进行比较。也可以确定肽的翻译后修饰,例如,通过对照数据库搜索光谱,同时允许特定的肽修饰。
[0389]
施用途径
[0390]
本文所述的组合物可以通过多种途径中的一种或多种,诸如静脉内或通过骨髓移植施用给患者(例如,患有克罗恩病的人类患者)。在任何给定情况下,最合适的施用途径可以取决于所施用的特定组合物、患者、药物配制方法、施用方法(例如,施用时间和施用途径)、患者的年龄、体重、性别、所治疗的疾病的严重程度、患者的饮食和患者的排泄率。可以使用多种施用途径同时治疗单个患者,或患者可以首先通过一种施用途径接受治疗,然后在第二次预约期间,例如1周后、2周后、1个月后、6个月后或1年后,通过另一种施用途径接受治疗。组合物可以向受试者施用一次,或细胞可以每周、每月或每年施用一次或多次(例如,2-10次)。
[0391]
供体细胞的选择
[0392]
在一些实施方案中,接受治疗的患者是提供细胞(例如,多能细胞,诸如cd34+造血干细胞或祖细胞或hpc)的供体,所述细胞随后被修饰以在重新施用给患者之前表达本公开的一种或多种治疗性蛋白质。在这种情况下,取出的细胞(例如,造血干细胞或祖细胞)可在例如并入编码功能性nod2的转基因后重新注入受试者体内,使得细胞可随后归巢至造血组织并建立生产性造血,从而在患者体内繁殖或再繁殖有缺陷或不足的细胞系。在经历治疗的患者也作为细胞供体的情况下,移植的细胞(例如,造血干细胞或祖细胞)不太可能发生移植排斥。这来源于这样一个事实,即注入的细胞来自患者并表达与患者表达相同的hla i类和ii类抗原。替代地,患者和供体可以是不同的。在一些实施方案中,患者和供体是相关的,并且可以例如是hla匹配的。如本文所述,hla匹配的供体-受体对具有降低的移植排斥风险,因为移植受体内的内源性t细胞和nk细胞不太可能将传入的造血干细胞或祖细胞移植物识别为外源的,因此较少可能对移植物产生免疫响应。示例性hla匹配的供体-受体对是遗传相关的供体和受体,诸如家族供体-受体对(例如,同胞供体-受体对)。在一些实施方案中,患者和供体是hla错配的,这发生在供体和受体之间至少一个hla抗原,特别是hla-a、hla-b和hla-dr错配时。例如,为了减少移植排斥的可能性,供体和受体之间可以匹配一种单倍型,而另一种可以是错配的。
[0393]
药物组合物和剂量
[0394]
在将共同表达本公开的一种或多种治疗性蛋白质的细胞群施用给患者的情况下,所施用的细胞数量可以取决于例如所需蛋白质的表达水平、患者、药物配制方法、施用方法(例如,施用时间和施用途径)、患者的年龄、体重、性别、所治疗疾病的严重度,以及患者是否已接受消融内源性多能细胞(例如,内源性cd34+细胞、造血干细胞或祖细胞或小胶质细胞等)的剂。施用的细胞的数量可以是例如1x106个细胞/千克至1x10
12
个细胞/千克或更多(例如,1x107个细胞/千克、1x108个细胞/千克、1x109个细胞/千克、1x10
10
个细胞/千克1x10
11
个细胞/千克、1x10
12
个细胞/千克或更多)。细胞可以未分化状态施用,或在部分或完全分化成小胶质细胞后施用。可以任何合适的剂型施用一定数量的多能细胞。
[0395]
细胞可与一种或多种药学上可接受的载体、稀释剂和/或赋形剂混合。可与本公开的组合物和方法结合使用的示例性载体、稀释剂和赋形剂描述于例如remington:the science and practice of pharmacy(2012,第22版)和美国药典:国家处方集(the united states pharmacopeia:the national formulary)(2015,usp 38nf 33)中。
[0396]
实施例
[0397]
提出以下实施例以便为本领域普通技术人员提供可以如何使用、制备和评估本文
所述的组合物和方法的描述,并且这些实施例仅旨在作为本公开的示例而不旨在限制发明人认为是其的公开的范围。
[0398]
实施例1.用于治疗克罗恩病的表达功能性nod2的多能干细胞的生成
[0399]
用于制备表达功能性nod2的多能细胞(例如,胚胎干细胞(esc)、诱导性多能干细胞(ipsc)或cd34+细胞)的示例性方法是通过转导的方式进行的。可使用本文所述或本领域已知的载体产生技术来工程化逆转录病毒载体(例如,慢病毒载体、α逆转录病毒载体或γ逆转录病毒载体),其含有例如合适的启动子(诸如本文所述的启动子)和编码功能性nod2的多核苷酸。在工程化逆转录病毒载体后,可使用逆转录病毒来转导多能细胞(例如,esc、ipsc或cd34+细胞)以产生表达功能性nod2的多能细胞群。
[0400]
用于制备表达功能性nod2的多能细胞的其他示例性方法是转染技术。使用本文所述和本领域已知的分子生物学程序,可以产生含有启动子和编码功能性nod2的多核苷酸的质粒dna。例如,可以使用本领域已知的基于pcr的技术从人细胞系中扩增编码功能性nod2的核酸,或可以例如使用固相多核苷酸合成程序合成编码功能性nod2的核酸。然后可以将核酸和启动子连接到所关注的质粒中,例如,使用合适的限制性内切核酸酶介导的切割和连接方案。在质粒dna被工程化后,质粒可用于使用例如电穿孔或本文所述的另一种转染技术转染多能细胞(例如,esc、ipsc或cd34+细胞),以产生表达一种或多种编码蛋白的多能细胞群。
[0401]
实施例2.功能性nod2是促炎性细胞因子响应的重要贡献者,并且nod2修复挽救了nod2受损细胞(诸如克罗恩病中观察到的那些)产生细胞因子响应的能力。
[0402]
引言
[0403]
本实施例描述了一系列实验的结果,这些实验以目的是评估nod2在各种细胞系中活化的效果进行,包括功能性nod2被耗尽的克罗恩病模型系统。如本文所述,克罗恩病是一种衰弱性病症,其特征在于内源性细胞不能特别是响应于胞壁酰二肽(mdp)释放炎性细胞因子,。正如这些实验的结果所证明,将功能性nod2递送至系统(诸如通过基于细胞的基因疗法、病毒转导或在所需遗传基因座处插入功能性nod2基因的基因编辑方法)具有恢复细胞产生炎性免疫响应的能力的有益效果。根据这些结果,nod2基因递送代表了一种治疗克罗恩病的稳健方法。
[0404]
结果
[0405]
健康细胞中的nod2信号传导刺激促炎性细胞因子响应
[0406]
首先,进行了一系列实验,以证明nod2活化在健康人单核细胞中刺激炎性免疫响应的能力。图2a-2c显示,事实上,nod2活化在此类细胞中实现了稳健的炎性细胞因子释放。将thp-1人单核细胞用10ng/ml佛波醇12-肉豆蔻酸酯(pma)、10ng/ml脂多糖(lps)或5ng/ml tnfα预刺激18小时,然后用mdp处理以诱导nod2信号传导。18-24小时后,通过基于流式细胞仪的珠阵列分析和elisa测定细胞上清液中的nod2依赖性细胞因子产生。如图2a-2c所证明,nod2活化导致此系统中炎性细胞因子的释放增加。
[0407]
此外,发现nod2活化能够产生稳健的炎性细胞因子响应,即使在没有引发的情况下。用mdp处理从健康人供体分离的外周血cd14+单核细胞以诱导nod2信号传导。然后在18-24小时后,通过基于流式细胞仪珠阵列分析测定细胞上清液中的nod2依赖性细胞因子产生。如图3所示,即使没有预刺激,nod2活化也会导致强烈的炎性细胞因子响应。
[0408]
在野生型鼠组织分离的和骨髓来源的单核细胞中也观察到对nod2活化的稳健的促炎性响应(图4a和4b)。原代鼠腹腔巨噬细胞(cd11b+)通过lps处理引发过夜,然后通过mdp处理刺激nod2信号传导(图4a)。分别地,通过在gm-csf中离体培养产生的鼠骨髓来源的巨噬细胞,通过用lps(10ng/ml)过夜处理,然后通过mdp处理刺激nod2信号传导来引发。nod2刺激导致通过elisa检测到的活性/加工il-1β的释放。
[0409]
功能性nod2的耗竭削弱了促炎性细胞因子响应
[0410]
已经确定了nod2活化引起炎性细胞因子响应,然后进行了另一组实验以评估nod2破坏对炎性细胞因子释放的影响。如图5所示,nod2破坏削弱了thp-1单核细胞对mdp的炎性细胞因子响应。使用crispr-cas9生成了几个nod2-突变型thp-1克隆细胞系,以模拟与克罗恩病相关的nod2缺陷。将野生型(wt)、几个外显子-2和外显子-8靶向的nod2敲除克隆(ko)和经历模拟crispr-cas9 nod2破坏的thp-1细胞(模拟)用lps诱导过夜,然后用mdp(10μg/ml)刺激。nod2 ko thp-1克隆显示不能对mdp刺激产生促炎性细胞因子反应,这证明了nod2信号转导在保持产生炎性细胞因子响应的能力中的作用。
[0411]
为了证明nod2破坏在cd34+造血干细胞(hsc)中的作用,通过crispr-cas9基因编辑(rnp+向导rna核转染)对从健康人供体分离的外周血来源的cd34+细胞进行nod2的靶向破坏。然后将基因编辑的细胞、nod2ko细胞和模拟编辑的细胞(仅接受rnp)在细胞因子存在下培养14天,以促进向单核细胞/巨噬细胞谱系定向细胞的分化。然后用mdp(0-100μg/ml)刺激细胞培养物18-24小时,并通过elisa测定细胞上清液的il-8细胞因子释放。如图6所示,通过crispr-cas9基因编辑的方式破坏nod2表达抑制了响应于mdp的炎性细胞因子的释放。
[0412]
还研究了鼠细胞中nod2破坏的效应。如图7a-7c所示,nod2-/-小鼠对mdp的巨噬细胞炎性细胞因子响应受损。分别通过在gm-csf或m-csf中离体培养产生的wt和nod2-/-鼠骨髓来源的巨噬细胞和单核细胞,通过用lps(1ng/ml)过夜处理,然后通过mdp处理刺激nod2信号传导来引发。nod2刺激导致通过wt来源的细胞释放il-6、tnfα和活性/加工的il-1β。引人注目的是,这种效应在nod2-/-细胞中是不存在的,如通过流式细胞珠阵列分析或elisa所检测。
[0413]
nod2的恢复拯救了细胞释放促炎性细胞因子的能力
[0414]
已经证明功能性nod2是促炎性细胞因子释放的重要贡献者,然后进行了一系列实验来评价功能性nod2递送以在nod2缺陷细胞中恢复促炎性细胞因子响应的能力。图8a-8d显示了一系列旨在恢复功能性nod2表达的慢病毒载体的设计和验证。如这些图所示,一系列不同的启动子被用于控制nod2表达。此外,可以对nod2核酸序列进行密码子优化以进一步增强nod2表达。可以使用的启动子的实例包括组成型启动子(例如,ef1α和efs启动子)以及髓系特异性启动子(例如,cd11b启动子)和内源nod2(nod2p)启动子。简而言之,用慢病毒载体(感染复数(moi)10)转导thp-1单核细胞,并且4天后通过转基因特异性rt-pcr分析检测wt nod2和密码子优化(co)nod2的相对基因表达(相对于未转导的细胞)。如图8a-8d所示,慢病毒转导实现了稳健的nod2表达。
[0415]
慢病毒转导不仅能够恢复nod2表达,而且还具有改善炎性细胞因子释放的作用。如图9所示,鼠骨髓hsc的慢病毒转导恢复了nod2-/-单核细胞中的功能性nod2表达,并且挽救了其释放il-6的能力。简言之,用编码nod2的慢病毒载体转导从wt或nod2-/-小鼠分离的
骨髓谱系阴性hsc。然后在gm-csf中通过离体培养生成鼠骨髓来源的巨噬细胞。将细胞通过用lps(1ng/ml)过夜处理,然后用mdp(10μg/ml)处理刺激nod2信号传导来引发。18-24小时后,通过elisa检测细胞上清液中nod2介导的il-6产生。图9证明,由于nod2表达的恢复,il-6产生增强。
[0416]
图10a-10d证明这种有益效应也适用于人单核细胞。用lv-conod2载体(moi 10)转导thp-1wt和crispr-cas9基因编辑的克隆(nod2ko或模拟编辑的)。转导后三天,thp-1细胞用lps引发,然后用mdp(10μg/ml)处理以刺激nod2活性。nod2 ko thp-1克隆的慢病毒转导导致通过elisa检测到的nod2依赖性il-8细胞因子释放的恢复(图10a)。thp-1细胞的慢病毒转导效率通过使用gfp报告基因-lv构建体评估其的转导而得到证实。通过转导细胞(相对于未转导细胞)的rt-pcr分析证实了nod2基因表达。
[0417]
图11a-11d加强了这一结果,并且进一步证明nod2缺陷型thp-1细胞的慢病毒转导可以恢复人单核细胞对mdp的炎性响应。用lv-conod2载体(moi 10)转导thp-1wt和crispr-cas9基因编辑的克隆(nod2ko或模拟编辑的)。转导后三天,thp-1细胞用lps引发,然后用mdp(10μg/ml)处理以刺激nod2活性。nod2 ko thp-1克隆的慢病毒转导导致通过elisa检测到的nod2依赖性il-8细胞因子释放的恢复。
[0418]
值得注意的是,在cd34+hsc中也观察到了功能性nod2恢复的有益作用。用所产生的慢病毒载体(moi 10&50)转导从健康人志愿者的经动员的外周血中分离的cd34+细胞,以转移在髓系特异性启动子(cd11b启动子)或组成型启动子(efs启动子)控制下的wt或密码子优化的nod2(图12)。如图13a和13b所示,向nod2基因敲除(nod2-ko)外周血来源的cd34+细胞递送nod2的作用是通过分化的cd34+细胞培养物恢复mdp检测。从健康人志愿者的经动员的外周血中分离的cd34+细胞首先通过crispr-cas9进行基因编辑以破坏nod2(nod2ko或模拟物),然后用lv-conod2载体转导。然后cd34+细胞在体外分化2周(最终培养物由15-30%cd11b+cd14+细胞组成),之后用mdp处理培养物以刺激nod2活性。通过elisa检测,nod2 ko细胞的慢病毒转导导致nod2依赖性(图13a)il-8和(图13b)tnfα细胞因子释放在mdp刺激(1μg/ml)后部分恢复。用所产生的慢病毒载体转导cd34+细胞,以转移在髓系特异性启动子(cd11b启动子)或组成型启动子(efs启动子)的控制下的wt nod2或密码子优化的nod2。
[0419]
除了nod2的慢病毒递送之外,在nod2缺陷型细胞中恢复nod2的另一种方法是通过crispr介导的基因编辑的方式进行,这可以具有在期望的遗传基因座处插入功能性nod2转基因的作用。图14示出了这个概念证明。如图14所示,基因编辑可用于实现将经靶向的gfp插入cd34+hsc中的nod2基因座中。gfp报告子序列用于验证将有效载荷供体模板靶向插入nod2基因基因座的外显子2中的基因编辑策略。使用crispr-cas9 rnp核转染进行外周血来源的cd34+细胞的基因编辑。使用由aav6载体递送的模板序列实现供体有效载荷递送。特别地,供体有效载荷包括在efs启动子控制下的编码gfp的转基因。通过流式细胞术检测骨髓分化细胞培养物中的gfp+细胞,证实了同源定向修复的效率。所示数据代表2个独立实验。通过“进退式”pcr方法证实了对nod2基因座的靶向,其中一个引物位于同源臂外的靶向基因组基因座中,并且另一引物位于转基因盒内(数据未显示)。
[0420]
通过用功能性nod2转基因取代图14中使用的gfp报告子,可以将功能性nod2递送至细胞中的所需遗传基因座,从而恢复nod2表达并挽救细胞对mdp产生促炎性细胞因子响应的能力。
[0421]
结论
[0422]
正如这些实验的结果所证明,nod2是造血细胞产生促炎性细胞因子响应的能力的重要贡献者,因为nod2的表达增加了促炎性细胞因子的释放,而nod2的破坏削弱了促炎性细胞因子的释放。克罗恩病与nod2活性降低有关,其继而会阻碍细胞释放促炎性细胞因子的能力。重要的是,前述实验证明了功能性nod2的递送(无论是通过病毒转导、基于细胞的基因疗法,还是在所需遗传基因座处插入功能性nod2转基因的基因编辑方法的方式)挽救了细胞产生促炎性细胞因子响应的能力。
[0423]
实施例3.向患有克罗恩病的患者施用治疗组合物
[0424]
根据本文公开的方法,可以治疗患者,诸如人类患者,从而减轻或缓解克罗恩病的症状和/或靶向所述疾病的潜在生化病因学。为此,可向患者施用例如表达功能性nod2的多能细胞群(例如,esc、ipsc、cd34+细胞)。可将多能细胞群施用给患者,例如全身性(例如,静脉内)。细胞可以以治疗有效量施用,诸如1x106个细胞/kg至1x10
12
个细胞/kg或更多(例如,1x107个细胞/kg、1x108个细胞/kg、1x109个细胞/kg、1x10
10
个细胞/kg、1x10
11
个细胞/kg、1x10
12
个细胞/kg或更多)。
[0425]
在向患者施用细胞群之前,可向患者施用一种或多种剂,以去除患者的内源性造血细胞群,例如通过施用本文所述的调理剂。
[0426]
可以通过各种临床指标来监测治疗的成功。使用本公开的组合物对克罗恩病的有效治疗可以表现为例如(i)持续的疾病缓解,诸如持续至少一年的疾病缓解;(ii)观察到患者不再需要用免疫抑制剂、生物剂和/或皮质类固醇治疗;和/或(iii)观察到患者没有表现出胃肠道中糜烂性疾病的证据,如通过内窥镜和/或放射学所评估。
[0427]
其他实施方案
[0428]
在不偏离本公开的范围和精神的情况下,所述公开的各种修改和变化对本领域技术人员将是显而易见的。尽管已结合具体实施方案对本公开进行了描述,但是应当理解所要求保护的本公开不应当不适当地限定于此类具体实施方案。实际上,所描述的用于执行本公开的方式的各种修改对于本领域的技术人员是显而易见的,且旨在包含在本公开的范围内。
[0429]
其他实施方案在权利要求范围内。
[0430]
权利要求:
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1