作为用于神经退行性状况的生物标志物的激酶的制作方法
conditions)、tau蛋白病(tauopathies)和亨廷顿病,以及与其相关的神经退行性变。在某些实施方案中,生物标志物谱包括对包含至少一种信号传导激酶的生物标志物组的测量,并且生物标志物组可以选自(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式;或(2)一种或多于一种不同的信号传导激酶中的每一种。生物标志物谱可以包括神经退行性蛋白(诸如α-突触核蛋白、淀粉样蛋白β、tau蛋白或亨廷顿蛋白)的一种或更多种寡聚形式的量度。
11.测量的信号传导激酶可以是一种或多于一种激酶。它们可以选自相同的信号传导途径,诸如mtor途径,或选自不同的信号传导途径。
12.测量的神经退行性蛋白的寡聚形式可以是形式的集合,诸如总寡聚α-突触核蛋白,或者单独的寡聚形式,诸如α-突触核蛋白四聚体,或者多于一种形式,诸如α-突触核蛋白二聚体、α-突触核蛋白三聚体和α-突触核蛋白四聚体。神经退行性蛋白的单体形式也可以被测量。因此,例如,生物标志物谱可以包括选自以下的一种或多于一种神经退行性蛋白形式中的每一种的量度:(i)至少一种寡聚形式;(ii)多于一种寡聚形式(例如,寡聚形式的模式);(iii)至少一种寡聚形式和至少一种单体形式;(iv)多于一种寡聚形式和至少一种单体形式;(v)至少一种寡聚形式和多于一种单体形式;以及(vi)多于一种寡聚形式和多于一种单体形式。
13.本文还公开了开发用于治疗神经退行性状况诸如突触核蛋白病性状况、淀粉样蛋白状况、tau蛋白病性状况和亨廷顿病的药物的方法。该方法包括使用生物标志物谱来确定候选药物对状况的影响。生物标志物谱包括生物标志物组的量度,该生物标志物组包括选自以下的生物标志物:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。生物标志物蛋白可以从来自受试者血液的例如神经元来源的微粒(例如外泌体)定量。
14.在某些实施方案中,蛋白物类(protein species)从下文中被称为外泌体的例如从血液、唾液或尿液分离的神经元来源的细胞外囊泡测量。被检查的物类可以来源于外泌体的内部隔室(internal compartment),例如,来源于已经从其中去除了表面蛋白的外泌体。以这种方式测量的生物标志物谱代表了相对简单且非侵入性的测量手段。
15.因此,本公开内容的用于测量神经退行性状况的生物标志物谱的方法可以用于在药物开发中测试药物候选物的神经保护效力,所述药物候选物在本文中有时被称为推定的神经保护剂。例如,本文描述的方法可以用于进一步理解激酶活性的下游效应,并且用于加速有效治疗策略的开发。这样的方法还可以用于识别用于招募(enroll)在临床试验中的受试者,并且可以用于确定突触核蛋白病性状况的诊断、预后、进展或发展突触核蛋白病性状况的风险。本文还提供了治疗通过本公开内容的方法被确定为患有与突触核蛋白病性状况相关的神经退行性变或处于发展与突触核蛋白病性状况相关的神经退行性变的风险的受试者的新颖的方法,特别是神经保护治疗。
16.在一种实施方案中,本文提供了一种方法,该方法包括:a)富集生物样品的集合中的每一个生物样品的神经元来源的微粒,例如外泌体,其中:(i)生物样品的集合来自受试者的组群中的受试者,其中组群包括包含以下的受试者:(1)被诊断为患有处于多于一个不同疾病分期中的每一个的神经退行性状况的多于一个受试者,其中被诊断的受试者中的每一个已经接受推定的神经保护剂,和/或(2)多于一个健康对照受试者,其中生物样品在施
用推定的神经保护剂之前收集和在施用推定的神经保护剂期间再次收集一次或更多次,以及任选地在施用推定的神经保护剂之后收集;b)从微粒例如外泌体的内部隔室中分离蛋白内容物以产生生物标志物样品;c)在生物标志物样品中测量生物标志物组以创建数据集,其中生物标志物组包括:(i)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式;或(ii)多于一种不同的信号传导激酶;以及d)对所述数据集进行统计学分析,以比较所述生物标志物组的差异:(i)比较在个体受试者中随时间的差异,以确定预测疾病进展的速率或对推定的神经保护剂的响应程度的诊断算法;或(ii)比较在不同受试者之间的差异,以确定诊断算法,该诊断算法(1)做出病原诊断,(2)分离临床上相似但病因学上不同的神经退行性紊乱亚组,或(3)预测受试者是否或在多大程度上可能对推定的神经保护剂有响应。在一种实施方案中,方法还包括,在富集之前:i)提供受试者的组群,其中组群包括包含以下的受试者:(i)被诊断为患有处于多于一个不同疾病分期中的每一个的神经退行性状况的多于一个受试者,和/或(ii)多于一个健康对照受试者;ii)向被诊断的受试者中的每一个施用推定的神经保护剂;iii)在施用推定的神经保护剂之前和在施用推定的神经保护剂期间再一次或更多次以及任选地在施用推定的神经保护剂之后,从组群中的受试者的每一个收集生物样品。在另一种实施方案中,信号传导激酶中的至少一种是pi3k-akt-mtor信号传导途径的激酶。在另一种实施方案中,其中信号传导激酶中的至少一种选自丝裂原活化蛋白激酶(mapk或mek)、细胞外信号调节激酶(erk)、糖原合酶激酶3β(gsk3b)、akt激酶和beclin。在另一种实施方案中,其中神经退行性蛋白选自α突触核蛋白、淀粉样蛋白β、tau或亨廷顿蛋白。在另一种实施方案中,神经退行性蛋白的寡聚形式是寡聚形式的集合,例如,α突触核蛋白的寡聚体,例如,α突触核蛋白2-50,例如,α突触核蛋白4-30,例如,α突触核蛋白4-20。在另一种实施方案中,方法还包括:e)针对标准临床测量验证诊断算法中的一个或更多个。在另一种实施方案中,其中统计学分析包括:相关、皮尔逊相关、斯皮尔曼相关、卡方、均值比较(例如,配对t检验、独立t检验、anova)、回归分析(例如,简单回归、多元回归、线性回归、非线性回归、逻辑回归、多项式回归、逐步回归、岭回归、套索回归、弹性网络回归)或非参数分析(例如,wilcoxon秩和检验、wilcoxon符号秩检验、符号检验)。在另一种实施方案中,统计学分析由计算机执行。在另一种实施方案中,其中统计学分析包括机器学习。在另一种实施方案中,受试者是人类。在另一种实施方案中,神经退行性状况是突触核蛋白病性紊乱。在另一种实施方案中,突触核蛋白病性紊乱是帕金森病。在另一种实施方案中,突触核蛋白病性紊乱是路易体痴呆。在另一种实施方案中,标准临床测量选自updrs评分、cgi评分和放射学发现。在另一种实施方案中,神经退行性状况是淀粉样病变、tau蛋白病或亨廷顿病。在另一种实施方案中,生物样品包括静脉血样品。在另一种实施方案中,不同的疾病分期包括疑似、早期、中期和临床晚期中的一个或更多个。在另一种实施方案中,施用期间或之后的时间选自治疗之后1个月、2个月、3个月或更多个月。在另一种实施方案中,富集包括使用一种或更多种脑特异性蛋白标志物。在另一种实施方案中,脑特异性标志物中的至少一种包括k1cam。在另一种实施方案中,分离包括洗涤每一个富集的样品中的外泌体以除去表面膜结合的蛋白。在另一种实施方案中,外泌体用pbs洗涤。在另一种实施方案中,神经退行性蛋白的形式通过凝胶电泳、蛋白印迹或荧光技术来测量。
17.在另一方面,本文提供了一种方法,该方法包括:a)富集来自受试者的生物样品的神经元来源的微粒,例如外泌体;b)从微粒例如外泌体的内部隔室中分离蛋白内容物以产
生生物标志物样品;c)在生物标志物样品中测量生物标志物组以创建数据集,其中生物标志物组包括:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式;或(2)多于一种不同的信号传导激酶;以及d)使用数据集执行以下中的一种:(1)做出病原诊断,(2)将受试者分到多于一个临床上相似但病因学上不同的神经退行性紊乱亚组中的一个,或(3)预测受试者是否或在多大程度上可能对推定的神经保护剂有响应。在另一种实施方案中,使用包括对数据集执行如本文所述的诊断算法。在另一种实施方案中,信号传导激酶中的至少一种是pi3k-akt-mtor信号传导途径的激酶。在另一种实施方案中,其中信号传导激酶中的至少一种选自丝裂原活化蛋白激酶(mapk或mek)、细胞外信号调节激酶(erk)、糖原合酶激酶3β(gsk3b)、akt激酶和beclin。在另一种实施方案中,神经退行性蛋白选自α突触核蛋白、淀粉样蛋白β、tau或亨廷顿蛋白。在另一种实施方案中,神经退行性蛋白的寡聚形式是寡聚形式的集合,例如,α突触核蛋白的寡聚体,例如,α突触核蛋白2-50,例如,α突触核蛋白4-30,例如,α突触核蛋白4-20。在另一种实施方案中,分离神经元来源的外泌体包括:(i)超速离心;(ii)密度梯度离心;或(iii)尺寸排阻色谱法。在另一种实施方案中,分离神经元来源的外泌体包括使用结合脑特异性蛋白的结合部分捕获神经元来源的外泌体。在另一种实施方案中,脑特异性蛋白是l1cam。在另一种实施方案中,从分离的外泌体的表面除去蛋白包括用水溶液(例如,磷酸盐缓冲盐水(“pbs”))洗涤分离的外泌体。在另一种实施方案中,确定神经退行性蛋白的量包括:i)将寡聚α-突触核蛋白的物类分离成多于一个级分;ii)测量一种或多于一种分离的寡聚α-突触核蛋白物类和任选地选自以下的一种或多于一种物类中的每一种:单体α-突触核蛋白、tau-突触核蛋白共聚物、淀粉样蛋白β-突触核蛋白共聚物和tau-淀粉样蛋白β-突触核蛋白共聚物。在另一种实施方案中,将物类分离成多于一个级分包括通过电泳分离。在另一种实施方案中,将物类分离成多于一个级分包括通过色谱法分离。在另一种实施方案中,在分离的物类中确定α-突触核蛋白的至少一种寡聚形式,该至少一种寡聚形式选自具有2个和约100个之间的单体单元、4个和16个之间的单体单元和不多于约30个单体单元的形式。在另一种实施方案中,在分离的物类中确定单体α-突触核蛋白的定量测量。在另一种实施方案中,在分离的物类中测量多于一种不同寡聚α-突触核蛋白物类。在另一种实施方案中,在分离的物类中测量包含α-突触核蛋白和tau的共聚物。在另一种实施方案中,在分离的物类中确定包含α-突触核蛋白和淀粉样蛋白β的共聚物的定量测量。在另一种实施方案中,测量分离的物类包括通过免疫测定来检测一种或多于一种分离的物类。在另一种实施方案中,免疫测定包括免疫印迹。在另一种实施方案中,免疫测定包括蛋白印迹。在另一种实施方案中,免疫测定使用与直接标记物偶联的抗体。在另一种实施方案中,免疫测定使用与间接标记物偶联的抗体。在另一种实施方案中,方法还包括:i)在施用推定的神经保护剂之前和之后测量受试者中的生物标志物;以及ii)确定蛋白的量或生物标志物的模式的变化,其中向正常量或模式的变化指示神经保护剂的效力。在另一种实施方案中,方法还包括:在两个不同的时间测量受试者中的生物标志物;以及确定蛋白的量或生物标志物的模式的变化,其中变化指示神经退行性状态的变化。在另一种实施方案中,方法包括在一定时间段内从受试者收集多于一个生物样品,任选地其中受试者在该时间段期间接受推定的或已知的神经保护剂,其中诊断算法预测疾病进展的速率或对推定的神经保护剂的响应程度。
18.在另一方面,本文提供了一种方法,该方法包括:a)为多于一个受试者中的每一个
提供数据集,该数据集包括指示以下的值:(1)神经退行性状况的状态,和(2)生物标志物组的量度,其中生物标志物组包括:(i)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式;或(ii)多于一种不同的信号传导激酶;以及b)对数据集进行统计学分析以开发推断个体的神经退行性状况的状态的模型。在一种实施方案中,信号传导激酶中的至少一种是pi3k-akt-mtor信号传导途径的激酶。在另一种实施方案中,信号传导激酶中的至少一种选自丝裂原活化蛋白激酶(mapk或mek)、细胞外信号调节激酶(erk)、糖原合酶激酶3β(gsk3b)、akt激酶和beclin。在另一种实施方案中,神经退行性蛋白选自α突触核蛋白、淀粉样蛋白β、tau或亨廷顿蛋白。在另一种实施方案中,神经退行性蛋白的寡聚形式是寡聚形式的集合,例如,α突触核蛋白的寡聚体,例如,α突触核蛋白2-50,例如,α突触核蛋白4-30,例如,α突触核蛋白4-20。在另一种实施方案中,统计学分析由计算机执行。在另一种实施方案中,统计学分析不由计算机执行。在另一种实施方案中,统计学分析包括:相关、皮尔逊相关、斯皮尔曼相关、卡方、均值比较(例如,配对t检验、独立t检验、anova)、回归分析(例如,简单回归、多元回归、线性回归、非线性回归、逻辑回归、多项式回归、逐步回归、岭回归、套索回归、弹性网络回归)或非参数分析(例如,wilcoxon秩和检验、wilcoxon符号秩检验、符号检验)。在另一种实施方案中,统计学分析包括在数据集上训练机器学习算法。在另一种实施方案中,机器学习算法选自:人工神经网络(例如,反向传播网络)、决策树(例如,递归分区过程、cart)、随机森林、判别分析(例如,贝叶斯分类器或fischer分析)、线性分类器(例如,多元线性回归(mlr)、偏最小二乘(pls)回归、主成分回归(pcr))、混合或随机效应模型、非参数分类器(例如k-最近邻)、支持向量机和集成方法(ensemble methods)(例如,bagging、boosting)。在另一种实施方案中,状态选自神经退行性状况的诊断、分期、预后或进展。在另一种实施方案中,状态被测量为分类变量(例如,二元状态或多于一个分类状态中的一个)。在另一种实施方案中,分类包括与患有神经退行性状况一致的诊断(例如,阳性或被诊断为患有神经退行性状况)和与患有神经退行性状况不一致的诊断(例如,阴性或被诊断为未患有神经退行性状况)。在另一种实施方案中,分类包括神经退行性状况的不同分期。在另一种实施方案中,状态被测量为连续变量(例如,在标度上)。在另一种实施方案中,连续变量是神经退行性状况的程度的范围。在另一种实施方案中,受试者是动物,例如鱼、鸟类、两栖动物、爬行动物或哺乳动物,例如啮齿动物、灵长类动物或人类。在另一种实施方案中,多于一个受试者是以下中的至少任一项:10个、25个、50个、100个、200个、400个或800个。在另一种实施方案中,对于每一个受试者,对其确定定量测量的样品在第一时间点采集,并且神经退行性状况的状态在较晚的第二时间点确定。在另一种实施方案中,生物样品包括血液或血液级分(例如,血浆或血清)。在另一种实施方案中,神经退行性状况是突触核蛋白病,例如帕金森病或路易体痴呆。在另一种实施方案中,神经退行性状况是淀粉样病变,例如阿尔茨海默病,tau蛋白病,例如阿尔茨海默病或亨廷顿病。
19.在另一方面,本文提供了一种推断以神经退行性蛋白为特征的神经退行性状况的发展风险、诊断、分期、预后或进展的方法,其中该方法包括:a)从来自受试者的富集神经元来源的微粒(例如外泌体)的生物样品中测量生物标志物组以创建数据集,其中生物标志物组包括:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式;或(2)多于一种不同的信号传导激酶;以及b)对数据集执行模型,例如,如本文所述的模型,以推断神经退行性状况的发展风险、诊断、分期、预后或进展。在一种实施方案中,信号传导激酶
中的至少一种是pi3k-akt-mtor信号传导途径的激酶。在另一种实施方案中,信号传导激酶中的至少一种选自丝裂原活化蛋白激酶(mapk或mek)、细胞外信号调节激酶(erk)、糖原合酶激酶3β(gsk3b)、akt激酶和beclin。在另一种实施方案中,神经退行性蛋白选自α突触核蛋白、淀粉样蛋白β、tau或亨廷顿蛋白。在另一种实施方案中,神经退行性蛋白的寡聚形式是寡聚形式的集合,例如,α突触核蛋白的寡聚体,例如,α突触核蛋白2-50,例如,α突触核蛋白4-30,例如,α突触核蛋白4-20。在另一种实施方案中,对其确定定量测量的神经退行性蛋白形式选自:(i)至少一种寡聚形式;(ii)多于一种寡聚形式;(iii)至少一种寡聚形式和至少一种单体形式;(iv)多于一种寡聚形式和至少一种单体形式;(v)至少一种寡聚形式和多于一种单体形式;以及(vi)多于一种寡聚形式和多于一种单体形式。在另一种实施方案中,寡聚形式中的至少一种包括神经退行性蛋白的物类的集合。在另一种实施方案中,模型包括将神经退行性蛋白的寡聚形式相对于单体形式的相对量与统计学上显著数量的对照个体中的相对量进行比较。在另一种实施方案中,模型包括检测多于一种寡聚形式的相对量的模式,从该模型进行推断。在另一种实施方案中,受试者对于神经退行性状况是无症状的或临床前的。在另一种实施方案中,受试者在常规的办公室访问期间或作为医生的普通医学实践的一部分就诊于医疗保健提供者诸如医生。在另一种实施方案中,模型由计算机执行。在另一种实施方案中,模型不由计算机执行。
20.在另一方面,本文提供了一种用于确定治疗干预在治疗神经退行性状况中的有效性的方法,其中该方法包括:(a)在包括多于一个受试者的群体中的每一个受试者中,通过以下推断神经退行性状况的初始状态:(1)从来自受试者的富集神经元来源的微粒(例如外泌体)的生物样品中测量生物标志物组以创建数据集,其中生物标志物组包括:(i)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式;或(ii)多于一种不同的信号传导激酶;以及(2)使用模型,例如,如本文所述的模型来推断初始状态;(b)在推断之后,向受试者施用治疗干预;(c)在施用之后,在群体中的每一个受试者个体中,通过以下推断神经退行性状况的后续状态:(1)从来自受试者的富集神经元来源的微粒(例如外泌体)的生物样品测量生物标志物组以创建数据集,其中所述生物标志物组包括:(i)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式;或(ii)多于一种不同的信号传导激酶;(2)使用模型推断后续状态;以及(d)基于群体中的初始推断和后续推断,如果后续推断与初始推断相比表现出向正常状态的统计学上显著的变化,则确定治疗干预是有效的,或者如果后续推断与初始推断相比未表现出向正常状态的统计学上显著的变化,则确定治疗干预不是有效的。在另一种实施方案中,信号传导激酶中的至少一种是pi3k-akt-mtor信号传导途径的激酶。在另一种实施方案中,信号传导激酶中的至少一种选自丝裂原活化蛋白激酶(mapk或mek)、细胞外信号调节激酶(erk)、糖原合酶激酶3β(gsk3b)、akt激酶和beclin。在另一种实施方案中,神经退行性蛋白选自α突触核蛋白、淀粉样蛋白β、tau或亨廷顿蛋白。在另一种实施方案中,神经退行性蛋白的寡聚形式是寡聚形式的集合,例如,α突触核蛋白的寡聚体,例如,α突触核蛋白2-50,例如,α突触核蛋白4-30,例如,α突触核蛋白4-20。在另一种实施方案中,治疗干预包括施用药物或药物的组合。在另一种实施方案中,群体包括至少20个、至少50个、至少100个或至少200个受试者,其中受试者中的至少20%、至少35%、至少50%或至少75%最初具有升高的蛋白的寡聚形式相对于蛋白的单体形式的相对量。在另一种实施方案中,受试者中的至少20%、至少25%、至少30%、或至少35%、至少
50%、至少66%、至少80%或100%最初具有神经退行性状况的诊断。在另一种实施方案中,推断由计算机进行。在另一种实施方案中,推断不由计算机进行。
21.在另一方面,本文提供了一种判定有资格进行用于治疗或预防神经退行性状况的治疗干预的临床试验的受试者的方法,该方法包括:a)通过以下确定受试者在神经退行性状况方面是异常的:(1)从来自受试者的富集神经元来源的微粒(例如外泌体)的生物样品测量生物标志物组以创建数据集,其中所述生物标志物组包括:(i)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式;或(ii)多于一种不同的信号传导激酶;(2)对数据集执行模型,例如,如本文所述的模型,以推断受试者在神经退行性状况方面是异常的;以及b)将受试者招募在用于所述神经退行性状况的潜在治疗干预的临床试验中。在一种实施方案中,信号传导激酶中的至少一种是pi3k-akt-mtor信号传导途径的激酶。在另一种实施方案中,信号传导激酶中的至少一种选自丝裂原活化蛋白激酶(mapk或mek)、细胞外信号调节激酶(erk)、糖原合酶激酶3β(gsk3b)、akt激酶和beclin。在另一种实施方案中,神经退行性蛋白选自α突触核蛋白、淀粉样蛋白β、tau或亨廷顿蛋白。在另一种实施方案中,神经退行性蛋白的寡聚形式是寡聚形式的集合,例如,α突触核蛋白的寡聚体,例如,α突触核蛋白2-50,例如,α突触核蛋白4-30,例如,α突触核蛋白4-20。在另一种实施方案中,模型由计算机执行。在另一种实施方案中,模型不由计算机执行。
22.在另一方面,本文提供了一种监测进行用于神经退行性状况的治疗干预的受试者的进展的方法,该方法包括:(a)在受试者中,通过以下推断神经退行性状况的初始状态:(1)从来自受试者的富集神经元来源的微粒(例如外泌体)的生物样品确定生物标志物组的量度,其中所述生物标志物组包括:(i)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式;或(ii)多于一种不同的信号传导激酶;以及(2)执行模型,例如,如本文所述的模型,以推断神经退行性状况的初始状态;(b)推断后,向受试者施用治疗干预;(c)在施用之后,在受试者中,通过以下推断神经退行性状况的后续状态:(1)从受试者的富集神经元来源的微粒体颗粒的生物样品确定包含多于一种不同的信号传导激酶中每一种的量的生物标志物谱,以创建数据集;和(2)执行模型,例如,如本文所述的模型,以推断神经退行性状况的后续状态;(d)基于初始状态推断和后续状态推断,如果后续推断与初始推断相比表现出向正常状态的变化,则确定受试者对治疗干预有积极响应,或者如果后续推断与初始推断相比未表现出向正常状态的变化,则确定治疗干预不是有效的。在一种实施方案中,信号传导激酶中的至少一种是pi3k-akt-mtor信号传导途径的激酶。在另一种实施方案中,信号传导激酶中的至少一种选自丝裂原活化蛋白激酶(mapk或mek)、细胞外信号调节激酶(erk)、糖原合酶激酶3β(gsk3b)、akt激酶和beclin。在另一种实施方案中,神经退行性蛋白选自α突触核蛋白、淀粉样蛋白β、tau或亨廷顿蛋白。在另一种实施方案中,神经退行性蛋白的寡聚形式是寡聚形式的集合,例如,α突触核蛋白的寡聚体,例如,α突触核蛋白2-50,例如,α突触核蛋白4-30,例如,α突触核蛋白4-20。在另一种实施方案中,其中模型由计算机执行。在另一种实施方案中,模型不由计算机执行。
23.在另一方面,本文提供了一种方法,该方法包括:(a)通过本文所公开的方法确定受试者患有神经退行性状况,和(b)向受试者施用对治疗该状况有效的姑息性或神经保护性治疗干预。在一种实施方案中,治疗干预使受试者的生物标志物谱向正常移动,其中向正常移动指示神经保护。
24.在另一方面,本文提供了一种方法,该方法包括向通过如本文所公开的方法确定的具有异常生物标志物模式的受试者施用有效治疗该状况的姑息性或神经保护性治疗干预。在一种实施方案中,受试者对于神经退行性状况是无症状的或临床前的。
25.在另一方面,本文提供了一种试剂盒,该试剂盒包括足以检测以下任一项的试剂:(1)至少一种信号传导激酶和神经退行性蛋白的至少一种寡聚形式;或(2)多于一种不同的信号传导激酶。在一种实施方案中,试剂包括抗体。
26.在另一方面,本文提供了一种推断神经退行性状况的发展风险、诊断、分期、预后或进展的方法,其中该方法包括:a)从来自受试者的富集神经元来源的微粒(例如外泌体)的生物样品测量生物标志物组以创建数据集,其中生物标志物组包括:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式;或(2)多于一种不同的信号传导激酶;和b)将数据集与神经退行性状况的发展风险、诊断、分期、预后或进展相关联。在一种实施方案中,信号传导激酶中的至少一种是pi3k-akt-mtor信号传导途径的激酶。在另一种实施方案中,信号传导激酶中的至少一种选自丝裂原活化蛋白激酶(mapk或mek)、细胞外信号调节激酶(erk)、糖原合酶激酶3β(gsk3b)、akt激酶和beclin。在另一种实施方案中,其中神经退行性蛋白选自α突触核蛋白、淀粉样蛋白β、tau或亨廷顿蛋白。在另一种实施方案中,神经退行性蛋白的寡聚形式是寡聚形式的集合,例如,α突触核蛋白的寡聚体,例如,α突触核蛋白2-50,例如,α突触核蛋白4-30,例如,α突触核蛋白4-20。
27.在另一方面,本文提供了一种方法,该方法包括:(a)识别患有神经退行性状况或可能对神经退行性状况的治疗有积极响应的受试者,其中识别包括:(1)在来自受试者的富集神经元来源的外泌体的样品中(例如,从外泌体的内部内容物)测量生物标志物组,以创建生物标志物谱,其中生物标志物组包括一种或多于一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式;和(2)基于异常的生物标志物谱确定受试者罹患神经退行性状况;以及(b)向所识别的受试者施用有效量的药物组合物以治疗神经退行性状况。在一些实施方案中,神经退行性状况是突触核蛋白病性状况,并且药物组合物包含多巴胺激动剂(例如,普拉克索(pramipexole)(例如,mirapex
tm
)、罗匹尼罗(ropinirole)(例如,requip)、罗替戈汀(rotigotine)(例如,neupro)、阿扑吗啡(apomorphine)(例如,apokyn))、左旋多巴(levodopa)、卡比多巴(carbidopa)-左旋多巴(例如,rytary、sinemet)),mao-b抑制剂(例如,司来吉兰(selegiline)(例如,eldepryl、zelapar)或雷沙吉兰(rasagiline)(例如,azilect)),儿茶酚-o-甲基转移酶(comt)抑制剂(例如,恩他卡朋(entacapone)(comtan)或托卡朋(tolcapone)(tasmar))、抗胆碱能药(例如,苯扎托品(benztropine)(例如,cogentin)或苯海索(trihexyphenidyl))、金刚烷胺(amantadine)或胆碱酯酶抑制剂(例如,利斯的明(rivastigmine)(exelon))。在另一种实施方案中,突触核蛋白病性状况是帕金森病。在另一种实施方案中,药物组合物包含多巴胺激动剂。在另一种实施方案中,药物组合物还包含nk1-拮抗剂。在另一种实施方案中,多巴胺激动剂为6-丙基氨基-4,5,6,7-四氢-1,3-苯并噻唑-2-胺,并且nk1-拮抗剂为阿瑞匹坦或罗拉匹坦(rolapitant)。在另一种实施方案中,药物组合物还包含5ht3-拮抗剂。在另一种实施方案中,多巴胺激动剂为6-丙基氨基-4,5,6,7-四氢-1,3-苯并噻唑-2-胺,并且5ht3拮抗剂为盐酸蒽丹西酮二水合物。
28.在另一方面,本文提供了一种方法,该方法包括向被表征为具有指示神经退行性状况的生物标志物谱或可能对神经退行性状况的治疗有积极响应的受试者施用有效量的
药物组合物以治疗神经退行性状况;其中生物标志物组合包括从受试者的富集神经元来源的外泌体的样品中(例如,从外泌体的内部内容物)测量的生物标志物组,所述生物标志物组包括一种或多于一种信号传导激酶以及任选地神经退行性蛋白的至少一种寡聚形式。在另一种实施方案中,神经退行性状况是帕金森病,并且其中药物组合物包含多巴胺激动剂。
29.在某些实施方案中,生物标志物选自一种或多于一种不同的信号传导激酶,以及任选地一种或多于一种神经退行性蛋白中每一种的一种或多于一种单体形式和/或寡聚形式。
30.在阅读以下说明书和权利要求书后,本公开内容的其他目的对于本领域技术人员来说可能是明显的。
31.附图简述
32.本公开内容的新颖的特征特别地在所附权利要求书中阐述。通过参考以下详细描述和附图将获得对本公开内容的特征和优点的更好理解,该详细描述阐述了其中利用了本公开内容的原理的说明性实施方案,在附图中:
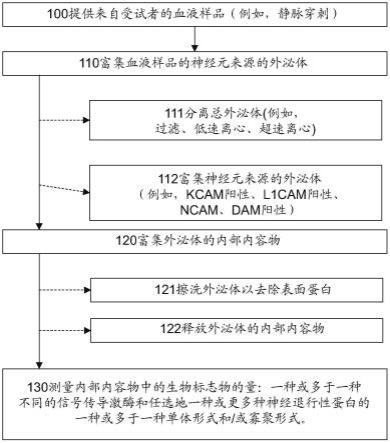
33.图1示出了检测来自外泌体的激酶和任选地神经退行性蛋白形式的示例性方法的流程图。
34.图2示出了验证药物效力的示例性方案的流程图。
35.图3示出了创建和验证用于诊断神经退行性状况的诊断模型的示例性流程图。
36.图4示出了用于通过对生物标志物谱执行诊断算法或模型来根据若干种状态中的任一种对受试者进行分类的示例性流程图。
37.公开内容的详细描述
38.i.用于神经退行性状况的生物标志物
39.本文公开的方法可以用于各种神经退行性状况的诊断和药物开发。这些包括但不限于突触核蛋白病(例如,帕金森病、路易体痴呆、多系统萎缩)、淀粉样蛋白病(amyloidopathy)(例如,阿尔茨海默病)、tau蛋白病(例如,阿尔茨海默病、进行性核上性麻痹、皮质基底节变性)和亨廷顿病。
40.a.生物标志物和生物标志物谱
41.生物标志物是单独地或联合地与特定状况正相关或负相关的分析物。可发挥作为生物标志物的功能的分析物包括可在受试者或受试者样品中检测到的任何生物分子或有机分子或无机分子。可用作生物标志物的生物分子包括但不限于多肽和多核苷酸,包括例如蛋白和肽。
42.如本文所使用的,术语“生物标志物谱”指的是指示一种或多于一种生物标志物中的每一种的量度的数据。在本文所述方法的某些实施方案中使用的生物标志物谱包括一种或多于一种不同激酶的活性的量度。在某些实施方案中,生物标志物谱还可以包括一种或更多种神经退行性蛋白形式的量度。生物标志物谱是包括关于生物标志物的数据的数据集的一种形式。
43.术语“生物标志物谱”还可以被用于指谱中的特定模式,模型推断该特定模式与神经退行性状况的诊断、分期、进展速率、预后、药物响应性和发展风险相关。
44.变量诸如激酶活性的量度,可以是数字和文字的任何组合。测量可以是任何尺度,包括标称(例如,名称或分类)、序数(例如,分类的层次顺序)、间隔(一定顺序的成员之间的
距离)、比率(与有意义的“0”相比的间隔)或对组中事物的数量进行计数的基数量度。在标称尺度上的变量的量度指示名称或分类,诸如“健康的”或“不健康的”、“年老的”或“年轻的”、“形式1”或“形式2”、“受试者1
…
受试者n”等。在序数尺度上的变量的量度产生排序(ranking),诸如“第一”、“第二”、“第三”;或“最年轻”到“最年老”,或从最多到最少的顺序。在比率尺度上的量度包括,例如,在预定义尺度上的任何量度,诸如质量、信号强度、浓度、年龄等,以及统计量度,诸如频率、平均值、中位数、标准偏差或分位数。在比率尺度上的量度可以是相对量或归一化的量度。例如,在一种实施方案中,生物标志物谱包括第一信号传导激酶和第二信号传导激酶的相对量。在另一种实施方案中,生物标志物谱包括两种不同生物标志物蛋白的量的比率。
45.异常谱(例如,各种信号传导激酶的异常绝对量或异常相对量)指示病理活性(或对致病过程的特征性身体响应),并且因此指示未来临床发作的时间和随后的临床进展的速率。此外,生物标志物谱向正常的恢复(例如,信号传导激酶和/或神经退行性蛋白的寡聚形式的绝对量或相对量的减少)反映了候选神经保护性干预的效力。因此,本文描述的生物标志物谱可以用于确定药物候选物关于其神经保护效果的效力。作为一个实际问题,考虑到时间和成本两者的节省,以及作为定量针对致病过程而不是其临床表现的效力的明确手段,它们可能被认为对于神经保护药物试验的实际实施是至关重要的。
46.因此,生物标志物谱不仅发挥作为现有病理状态的诊断特征的功能,而且发挥作为临床发作之前病理学的岗哨的功能,例如当受试者处于症状前或临床前,例如具有不足以用于疾病的诊断的体征或症状时。这是重要的,因为神经保护治疗的相对成功往往表现出与其最早可能的施用有关。此外,据信这些生物标志物谱指示神经退行性状况的分期(例如,神经元损失的速率或神经元损失的累积量)。因此,确定生物标志物谱对于确定治疗的有效性可能是至关重要的,例如,在临床试验中,以及对于被认为对治疗个体中的神经退行性变,包括例如突触核蛋白病、淀粉样蛋白病、tau蛋白病或亨廷顿病有效的治疗干预。
47.b.信号传导激酶
48.这些疾病的特征在于特定信号传导激酶活性(增加或减少)的异常变化。测量受试者中这些信号传导激酶的活性可以用于诊断、预后、患者进展、患者分层以及药物开发和测试。
49.激酶包括参与信号传导途径的任何激酶。
50.与帕金森病相关的激酶或影响帕金森病症状的药物的施用(例如普拉克索(6-丙基氨基-4,5,6,7-四氢-1,3-苯并噻唑-2-胺))包括但不限于mtor(雷帕霉素的机制靶点)、丝裂原活化蛋白激酶(mapk或mek)、细胞外信号调节激酶(erk)、糖原合酶激酶3β(gsk3b)、akt激酶和beclin、富含亮氨酸重复激酶2(lrrk2)、c-jun n末端激酶信号传导途径(jnk)成员(mapk丝氨酸-苏氨酸激酶),以及磷酸酶和张力蛋白同源物(pten)诱导的推定激酶1(phosphatase and tensin homolog(pten)-induced putative kinase 1,pink1)。
51.与阿尔茨海默病相关的激酶包括但不限于tau蛋白激酶,诸如脯氨酸导向的蛋白激酶(pdpk)、非pdpk蛋白激酶,以及酪氨酸蛋白激酶(tpk)。
52.与亨廷顿病相关的激酶包括但不限于丝裂原活化蛋白激酶、mek、erk、jnk、ikk、细胞分裂蛋白激酶5(cdk5)、akt、mkp1。
53.这些疾病也共同共享有毒寡聚多肽物类并且在一些情况下异常磷酸化的寡聚形
式或单体形式的积累,以及在神经元来源的外泌体中检测这样的形式的能力。
54.c.神经退行性蛋白
55.如本文所使用的,术语“神经退行性蛋白”指的是以寡聚化形式与神经退行性变相关的蛋白。神经退行性蛋白包括但不限于α-突触核蛋白、tau、淀粉样蛋白β和亨廷顿蛋白。
56.据信脑多肽的某些寡聚化形式或异常磷酸化形式构成多种神经退行性状况的基础。这包括,例如,α-突触核蛋白在突触核蛋白病性状况中的作用,淀粉样蛋白β在淀粉样蛋白病性状况中的作用,tau在tau蛋白病性状况中的作用,以及亨廷顿蛋白在亨廷顿病中的作用。特别地,目前的证据表明α-突触核蛋白寡聚体可以在pd和其他突触核蛋白病中充当有毒物类。在某些实施方案中,所检测到的寡聚物类是异常磷酸化的物类。
57.神经退行性蛋白的形式包括但不限于(i)至少一种寡聚形式;(ii)联合的多于一种寡聚形式(例如所有寡聚形式或一起测量的寡聚形式的子集,例如α突触核蛋白2-14),(iii)多于一种不同寡聚形式中的每一种;(iv)至少一种寡聚形式和至少一种单体形式;(v)多于一种寡聚形式和至少一种单体形式;以及(vi)至少一种寡聚形式和多于一种单体形式。神经退行性蛋白的形式可以在模型中用于推断尤其是神经退行性状况或向神经退行性状况的进展,通常用包括在模型中的一种或更多种寡聚形式来指示疾病的存在和活性或向疾病的进展。这包括指示突触核蛋白病的存在和活性或向突触核蛋白病的进展的寡聚α-突触核蛋白形式的增加的相对量;指示淀粉样蛋白病的存在和活性或向淀粉样蛋白病的进展的寡聚淀粉样蛋白β的增加的相对量;指示tau蛋白病的存在和活性或向tau蛋白病的进展的寡聚或异常磷酸化tau的增加的相对量;以及指示亨廷顿病的存在和活性或向亨廷顿病的进展的寡聚亨廷顿蛋白的增加的相对量。因此,这样的寡聚体的异常谱指示神经退行性变的过程。
58.神经退行性蛋白形式可以包括一种或更多种寡聚体形式和任选的一种或更多种单体形式。这包括寡聚α-突触核蛋白和任选地单体α-突触核蛋白;寡聚淀粉样蛋白β和任选地单体淀粉样蛋白β;寡聚tau和任选地过度磷酸化tau及任选地单体tau;以及寡聚亨廷顿蛋白和任选地单体亨廷顿蛋白的物类的量。例如,生物标志物谱可以包括(i)至少一种寡聚形式;(ii)多于一种寡聚形式;(iii)至少一种寡聚形式和至少一种单体形式;(iv)多于一种寡聚形式和至少一种单体形式;(v)至少一种寡聚形式和多于一种单体形式;以及(vi)多于一种寡聚形式和多于一种单体形式。
59.蛋白形式可以指的是单独的蛋白物类或物类的集合。例如,α-突触核蛋白的6-聚体是α-突触核蛋白的一种形式。此外,α-突触核蛋白的6-聚体至18-聚体的集合可以共同地是α-突触核蛋白的一种形式。
60.生物标志物谱可以包括蛋白的多于一种形式。在一种实施方案中,生物标志物谱可以包括神经退行性蛋白的多于一种寡聚形式和单体形式中的每一种的定量测量。因此,例如,生物标志物谱可以包括二聚体、三聚体、四聚体、5-聚体、6-聚体、7-聚体、8-聚体、9-聚体、10-聚体、11-聚体、12-聚体、13-聚体、14-聚体、15-聚体、16-聚体、19-聚体、20-聚体、24-聚体、50-聚体等中的每一种的定量测量。
61.如本文所使用的,“突触核蛋白生物标志物谱”指的是包含寡聚α-突触核蛋白和任选地单体α-突触核蛋白的谱,术语“淀粉样蛋白生物标志物谱”指的是包含寡聚β-淀粉样蛋白和任选地单体β-淀粉样蛋白的谱,术语“tau生物标志物谱”指的是包含寡聚tau和任选地
单体tau的谱,术语“亨廷顿蛋白生物标志物谱”指的是包含寡聚亨廷顿蛋白和任选地单体亨廷顿蛋白的谱。
62.如本文所使用的,术语“单体蛋白/多肽”指的是单一的、非聚集的蛋白或多肽分子,包括其任何物类,诸如磷酸化物类。如本文所使用的,术语“寡聚蛋白/多肽”指的是单独的寡聚物类或包含多于一种寡聚物类(包括磷酸化物类)的聚集体。应当理解,如本文所使用的蛋白的寡聚形式的量度可以指的是所有寡聚形式(总寡聚形式)或特定的寡聚形式的量度。特定的寡聚形式可以包括例如特定尺寸范围或物理条件内的形式,诸如例如可溶性原纤维。
63.在这些状况的每一种中,据信本文描述的多肽的寡聚化/聚集形式对神经元是有毒的,因为包含这些多肽的寡聚形式和任选地单体形式的生物标志物谱在推断病理活性的模型中发挥功能。特别地,寡聚形式与单体形式相比的增加的相对量指示病理学。这些生物标志物的量度可以被用于跟踪受试者对现有或正在开发的疗法的响应,以及预测疾病的发展或现有疾病的状态或进展。
64.ii.神经退行性状况和相关蛋白
65.a.突触核蛋白病
66.1.状况
67.如本文所使用的,术语“突触核蛋白病”和“突触核蛋白病性状况”指的是以寡聚α-突触核蛋白的异常谱为特征的状况,所述寡聚α-突触核蛋白是α-突触核蛋白的异常聚集形式。在某些实施方案中,突触核蛋白病表现为临床上明显的突触核蛋白疾病,诸如例如pd、路易体痴呆、多系统萎缩和一些形式的阿尔茨海默病,以及其他罕见的神经退行性紊乱诸如各种神经轴突营养不良。足以用于突触核蛋白疾病的临床诊断的体征和任选地症状是通常足以使诊断这样的状况的本领域技术人员做出这样的临床诊断的那些体征和任选地症状。
68.帕金森病(“pd”)是一种中枢神经系统(cns)的进行性紊乱,在超过60岁的成年群体中具有1%至2%的患病率。pd以运动症状,包括震颤、僵硬、姿势不稳定和随意运动缓慢为特征。占总pd病例的多于90%的该疾病的特发性形式的病因仍然难以捉摸,但现在被认为涉及环境因素和遗传因素两者。运动症状明显与黑质中产生多巴胺的神经元的进行性退化有关。最近,pd已成为公认的一组多系统紊乱中的一种,多系统紊乱主要影响基底神经节(例如,pd)或大脑皮层(例如,路易体痴呆)或基底神经节、脑干和脊髓(例如,多系统萎缩),并且它们都通过主要由被称为α-突触核蛋白的脑蛋白组成的细胞内沉积物(路易体)的存在相关联。因此,这些紊乱连同哈勒沃登-施帕茨综合征(hallevorden-spatz syndrome)、神经元轴突营养不良和创伤性脑损伤通常被称为“突触核蛋白病”。
69.pd的体征和症状可以包括,例如,静止时震颤、僵硬、运动迟缓、姿势不稳和慌张的帕金森步态。pd的一个体征是这些运动功能障碍对卡比多巴-左旋多巴的积极响应。
70.临床上公认的帕金森病分期包括以下:1期-轻度;2期-中度;3期-中期;4期-重度;5期-晚期。
71.普拉克索(以商品名mirapex
tm
出售)是可以治疗特发性帕金森病的药物。普拉克索具有作为细胞外信号调节激酶(erk)激动剂的活性。因此,确定普拉克索和其他激酶调节剂对激酶活性的影响可用于确定药物对帕金森病的有效性。
72.目前,pd的诊断主要依赖于身体检查的结果,身体检查的结果通常通过使用改进的hoehn和yahr分期量表(hoehn和yahr,1967,neurology,17:5,427-442)和统一帕金森病评定量表(updrs)来定量。pd对比其他形式的帕金森症例如进行性核上性麻痹(psp)的鉴别诊断可以证明是困难的,并且误诊可能因此在多达25%的患者中发生。事实上,pd通常在可以做出初始临床诊断之前保持多年未被检测到。当这种情况发生时,黑质中多巴胺神经元的损失已经超过50%并且可能接近70%。针对pd或任何相关的突触核蛋白病的血液测试尚未被验证。虽然使用正电子发射断层扫描(pet)或mri的成像研究已经通过提供关于神经退行性过程的位置和程度的信息而被用于pd的诊断中,但是它们赋予很少或没有关于所观察到的退化的发病机制的信息并且不指导特定的突触核蛋白特异性干预的选择。
73.路易体痴呆(lbd)在美国影响约130万人。症状包括,例如,痴呆、认知波动、帕金森症、睡眠障碍和幻觉。路易体痴呆(lbd)是在阿尔茨海默病之后的第二常见的痴呆形式并且通常在50岁之后发展。像帕金森病一样,lbd以脑中α-突触核蛋白的异常沉积为特征。
74.多系统萎缩(msa)被分类为两种类型,帕金森型和小脑型。帕金森型以例如pd的帕金森症状为特征。小脑型以例如受损的运动和协调、构音障碍(dysarthria)、视觉障碍和吞咽困难为特征。msa症状反映脑的受损区域,尤其是黑质、纹状体、下橄榄核和小脑中的细胞损失和胶质增生(gliosis)或星形胶质细胞的增殖。异常的α-突触核蛋白沉积是特征性的。
75.对于pd和其他突触核蛋白病的诊断错误率可能相对高,尤其是在它们的初始分期,这种情况可能随着有效的疾病改善疗法诸如神经保护疗法的引入而变得重要。
76.2.α-突触核蛋白
77.α-突触核蛋白是一种在人类脑中发现的蛋白。人类α-突触核蛋白由140个氨基酸组成并且由snca基因(也被称为park1)编码。(α-突触核蛋白:基因id:6622;智人(homo sapiens);细胞遗传学定位:4q22.1.)
78.如本文所使用的,术语“α-突触核蛋白”包括正常(未修饰的)物类以及修饰的物类。α-突触核蛋白可以以单体形式或聚集形式存在。α-突触核蛋白单体可以异常地聚集成寡聚体,并且寡聚α-突触核蛋白可以聚集成原纤维。原纤维可以进一步聚集以形成被称为路易体的细胞内沉积物。据信单体α-突触核蛋白及其各种寡聚体平衡地存在。脑中的α-突触核蛋白加工还可以产生其他推定的异常物类,诸如在丝氨酸129处磷酸化的α-突触核蛋白(“p129α-突触核蛋白”)。
79.α-突触核蛋白在人类中枢神经系统(cns)中大量表达并且在各种其他器官中以较小的程度表达。在脑中,α-突触核蛋白主要见于神经元末梢中,尤其是大脑皮层、海马、黑质和小脑中,其中它有助于调节神经递质释放。在正常情况下,这种可溶性单体蛋白倾向于形成抵抗聚集的稳定折叠的四聚体。但是,在某些病理状况中,出于未知的原因,α-突触核蛋白异常地β褶皱、错误折叠、寡聚化和聚集以最终形成原纤维,这是一种能够产生高度细胞毒性中间体的代谢途径。
80.如本文所使用的,术语“单体α-突触核蛋白”指的是单一的、非聚集的α-突触核蛋白分子,包括其任何物类。如本文所使用的,术语“寡聚α-突触核蛋白”指的是包含多于一个α-突触核蛋白分子的聚集体。这包括总寡聚α-突触核蛋白及其形式或所选择的物类。寡聚α-突触核蛋白包括具有至少两个单体单元的形式直至初原纤维(protofibril)形式。这包括具有例如2个和约100个之间单体单元,例如4个和16个之间单体单元或至少2打、3打、4打
evhhqklvff aedvgsnkga iiglmvggvv ia[seq id no:1]。
[0089]
在阿尔茨海默病中,淀粉样蛋白-β和tau蛋白变得寡聚化,并且在脑组织中积累,在脑组织中它们已经表现为引起神经元损伤和损失;事实上,一些人断言这样的可溶性聚集中间体或寡聚体是介导毒性并且构成疾病的播种(seeding)和传播的基础的关键物类(the amyloid-βoligomer hypothesis:beginning of the third decade.cline en,bicca ma,viola kl,klein wl.j alzheimers dis.2018;64(s1):s567-s610;“crucial role of protein oligomerization in the pathogenesis of alzheimer’s and parkinson’s diseases,”choi ml,gandhi s.febs j.2018jun 20)。淀粉样蛋白β寡聚体对于ad的发作和发展是至关重要的并且代表一种受欢迎的药物靶,该药物靶可能是最直接的生物标志物。tau蛋白还可以变得异常过度磷酸化。
[0090]
目前用于定量a-β的单体形式和寡聚形式的方法包括酶联免疫吸附测定(elisa)、用于单一寡聚体检测的方法以及其他,这些方法主要是基于生物传感器的方法(“methods for the specific detection and quantitation of amyloid-βoligomers in cerebrospinal fluid”,schuster j,funke sa.j alzheimers dis.2016may 7;53(1):53-67)。
[0091]
基于表面的荧光强度分布分析(sfida)以高度特异且灵敏的寡聚体定量以及对单体的完全不敏感两者为特征(“advancements of the sfida method for oligomer-based diagnostics of neurodegenerative diseases”,kulawik a.等人,febs lett.2018feb;592(4):516-534)。
[0092]
c.tau蛋白病
[0093]
1.状况
[0094]
如本文所使用的,术语“tau蛋白病”指的是以与神经退行性变相关的tau蛋白的积累和聚集为特征的状况。tau蛋白病包括但不限于阿尔茨海默病(“ad”)、进行性核上性麻痹、皮质基底节变性、17号染色体相关的额颞叶痴呆合并帕金森综合征(frontotemporal dementia with parkinsonism-linked to chromosome 17)和皮克病。
[0095]
ad还以第二病理特征神经原纤维缠结(nft)为特征。nft在解剖学上与神经元损失有关,将nft形成的过程与神经元损伤和脑功能障碍联系起来。nft的主要组分是过度磷酸化形式的tau,这是一种微管相关蛋白。在nft形成期间,tau形成多种不同的聚集物类,包括tau寡聚体。越来越多的证据指示tau寡聚体的形成先于神经原纤维缠结的出现,并且对神经元损失有重要贡献。(j alzheimers dis.2013;37(3):565-8“tauopathies and tau oligomers”,takashima a.)
[0096]
非纤维状、可溶性多聚体表现为比由丝状tau组成的神经原纤维缠结更具毒性。
[0097]
在额颞叶痴呆中,全长tar dna结合蛋白(“tdp-43”)形成积累在额叶脑区域中的有毒的淀粉样蛋白寡聚体。tdp-43蛋白病(其还包括肌萎缩侧索硬化(als))以由多泛素化和过度磷酸化的全长和截短的tdp-43形成的包含体为特征。重组全长人类tdp-43形成结构稳定的球形寡聚体,该球形寡聚体与抗淀粉样蛋白寡聚体特异性抗体共享共同的表位。已经发现tdp-43寡聚体在体外和体内都具有神经毒性。(nat commun.2014sep12;5:4824.full-length tdp-43forms toxic amyloid oligomers that are present in frontotemporal lobar dementia-tdp patients)。在ftld-tdp的不同亚型中,tdp-43寡聚
物的存在和丰度的确定可以使用被称为tdp-o的特异性tdp-43淀粉样蛋白寡聚体抗体来完成(“detection of tdp-43oligomers in frontotemporal lobar degeneration-tdp”,kao pf,ann neurol.2015aug;78(2):211-21)。
[0098]
2.tau
[0099]
tau是一种磷蛋白,在最长的tau同种型上具有79个潜在的丝氨酸(ser)和苏氨酸(thr)磷酸化位点。tau以六种同种型存在,通过它们的结合结构域的数量来区分。三种同种型具有三个结合结构域,并且另外三种同种型具有四个结合结构域。同种型由tau基因的外显子2、外显子3和外显子10中的选择性剪接产生。tau由mapt基因编码,该mapt基因具有11个外显子。单倍群h1表现为与某些痴呆诸如阿尔茨海默病的增加的概率相关。
[0100]
各种tau寡聚物类,包括在6-聚体至18-聚体的范围内的那些,已经牵涉在与tau蛋白病脑紊乱相关的神经毒性过程中,并且通过蛋白印迹和包括单分子荧光的其他技术来测量。(参见,例如,kjaergaard m.,等人,“oligomer diversity during the aggregation of the repeat region of tau”acs chem neurosci.2018jul 17;ghag g等人,“soluble tau aggregates,not large fibrils,are the toxic species that display seeding and cross-seeding behavior”,protein sci.2018aug 20.doi:10.1002/pro.3499;和comerota mm等人,“near infrared light treatment reduces synaptic levels of toxic tau oligomers in two transgenic mouse models of human tauopathies”,mol neurobiol.2018aug 17。)
[0101]
测量寡聚tau物类的方法包括免疫测定。tau可以通过常见的表达随后是色谱法诸如亲和色谱法、尺寸排阻色谱法和阴离子交换色谱法来分离。这种形式可以被用于免疫动物以产生抗体。tau的聚集可以使用花生四烯酸诱导。寡聚体可以通过在蔗糖阶梯梯度(step gradient)上离心来纯化。tau的寡聚形式还可以用于免疫动物并且产生抗体。利用tau寡聚体特异性toc1抗体的夹心酶联免疫吸附测定可以用于检测寡聚tau。tau寡聚体复合物1(toc1)抗体特异性地识别tris不溶、肌氨酰可溶性级分中的寡聚tau物类(shirafuji n.等人,“homocysteine increases tau phosphorylation,truncation and oligomerization”,int j mol sci.2018mar 17;19(3))。(参见,例如,methods cell biol.2017;141:45-64.doi:10.1016/bs.mcb.2017.06.005.epub2017jul 14.production of recombinant tau oligomers in vitro.combs b1,tiernan ct1,hamel c1,kanaan nm)。
[0102]
d.亨廷顿病
[0103]
1.亨廷顿病
[0104]
亨廷顿病是一种由亨廷顿蛋白基因中的常染色体显性突变引起的遗传性疾病。突变以cag三联体的重复为特征。亨廷顿病以进行性神经退行性变为特征。症状包括运动障碍,诸如不自主运动、受损的步态以及吞咽和言语困难。亨廷顿病还以进行性认知减退为特征。
[0105]
2.亨廷顿蛋白
[0106]
亨廷顿蛋白由也被称为htt或hd的亨廷顿基因编码。正常的亨廷顿蛋白具有约3144个氨基酸。该蛋白通常为约300kda。
[0107]
在亨廷顿病(hd)中,全长突变亨廷顿蛋白(mhtt)被裂解成较小的、可溶性的易于
聚集的mhtt片段表现为这种紊乱的病理生理学的关键过程。事实上,含有扩展数量的多聚谷氨酰胺(polyq)重复序列的突变蛋白的聚集和细胞毒性是除了hd之外的若干种疾病的标志。在细胞内,突变亨廷顿蛋白(mhtt)和其他多聚谷氨酰胺扩展突变蛋白作为单体、可溶性寡聚体和不溶性包含体存在。(j huntingtons dis.2012;1(1):119-32.detection of mutant huntingtin aggregation conformers and modulation of sds-soluble fibrillar oligomers by small molecules.sontag em,等人,brain sci.2014mar 3;4(1):91-122.monomeric,oligomeric and polymeric proteins in huntington disease and other diseases of polyglutamine expansion.hoffner g.等人)。在某些实施方案中,寡聚体的高度为2-10nm,具有小于2.5的长宽比(最长跨越距离比最短跨越距离),表明为球状结构。
[0108]
iii.信号传导激酶和神经退行性蛋白的检测与测量
[0109]
a.生物样品
[0110]
如本文所使用的,术语“样品”指的是包含分析物的组合物。样品可以是原始样品,其中分析物以其天然形式与其他材料(例如,源材料)混合;分级的样品,其中分析物至少部分地被富集;或纯化的样品,其中分析物至少大体上是纯的。如本文所使用的,术语“生物样品”指的是包含生物材料的样品,所述生物材料包括例如多肽、多核苷酸、多糖、脂质和这些材料的较高级水平诸如外泌体、细胞、组织或器官。
[0111]
如本文所使用的,术语“微粒”是指具有约50nm至约5000nm流体动力学直径的细胞外微囊泡或脂筏蛋白聚集体。因此,术语微粒包括外泌体(约50nm至约100nm)、微囊泡(约100nm至约300nm)、核外颗粒体(ectosomes)(约50nm至约1000nm)、凋亡小体(约50nm至约5000nm)和相同尺寸的脂质蛋白聚集体。如本文所使用的,在提及一个值时使用的术语“约”是指该值的90%至110%。例如,约1000nm的直径是在900nm到1100nm的范围内的直径。
[0112]
信号传导激酶,以及神经退行性蛋白(诸如α-突触核蛋白、淀粉样蛋白β、tau和亨廷顿蛋白)的形式,可以在来自受试者的体液样品的外泌体中检测到。更特别地,神经元来源的外泌体的分离物是用于检测和分析突触核蛋白病性状况的外泌体的优选子集。特别地,来自外泌体的内部隔室的蛋白是有用的。
[0113]
外泌体可以从来自受试者的各种生物样品分离。在某些实施方案中,生物样品是体液。外泌体的体液来源包括例如血液(例如,全血或其级分诸如血清或血浆,例如外周静脉血)、脑脊液、唾液、乳汁和尿液,或其级分。
[0114]
由于医疗环境中常规静脉穿刺的安全性、可接受性和便利性,使用静脉血作为外泌体的来源是指定用于成人和儿童两者的诊断测试的优选的样品。因为靶分析物可以少量存在于血液中,所以可以采集大量样品。例如,样品可以具有至少5ml、至少10ml、至少20ml的血液。血清可以通过允许全血凝结并且通过例如离心除去凝块来制备。血浆可以通过例如用抗凝血剂诸如edta处理全血并且通过例如离心除去血细胞来制备。血液样品可以通过从受试者采集样品或通过从已经从受试者采集血液的人接收样品来提供。血液样品通常会被冷藏,例如在冰上或在-80℃冷冻。
[0115]
b.测量信号传导激酶和神经退行性蛋白的方法
[0116]
1.信号传导激酶
[0117]
激酶在底物磷酸化中将atp转化为adp。测量激酶活性的各种测定类型是本领域已
知的。
[0118]
a)放射性闪烁
[0119]
放射性闪烁测定测量激酶将
32
p向底物中的掺入。
[0120]
b)fret(荧光共振能量转移)
[0121]
这些测定中的某些使用atp或adp的量作为激酶活性的指示物。在一种这样的测定中,将被测试激酶活性的样品、激酶的底物和atp合并在一起。如果激酶存在,激酶会使用atp使底物磷酸化。剩余的adp可以通过各种测定检测。一种这样的测定是fret(荧光共振能量转移)测定,其中,反应后样品中的adp用供体荧光团或受体荧光团之一标记。将与adp结合并包含该对中的另一个荧光团(即受体荧光团或供体荧光团)的抗体添加到混合物中。抗体与adp结合。在激发后,供体荧光团将能量转移给受体荧光团,受体荧光团发出荧光并且可以被检测到。
[0122]
c)免疫检测
[0123]
在另一种测定中,可以使用对激酶有特异性的抗体来免疫沉淀特异性激酶。沉淀的激酶用于与激酶底物的磷酸化反应。激酶反应的产物通过蛋白印迹检测。
[0124]
d)商购可得的激酶测定
[0125]
许多激酶测定是商购可得的。这些包括,例如,可以从promega(promega.com)获得的测定,这些测定对许多不同的激酶有特异性。另一个实例是通用激酶测定系统,可以从thermo fisher scientific(thermofisher.com)获得。perkinelmer
tm
(perkinelmer.com)将lance(r)激酶测定商业化,该测定使用荧光标记的底物和铕标记的抗磷抗体来识别磷酸化产物,该产物可以通过fret检测。samdi tech,inc.(samditech.com)将使用质谱法的无标签测定商业化。
[0126]
2.神经退行性蛋白
[0127]
蛋白的单体形式和寡聚形式可以通过本领域已知的任何方法来检测,所述方法包括但不限于免疫测定(例如,elisa)、质谱法、尺寸排阻色谱法、蛋白印迹和基于荧光的方法(例如,荧光光谱法或fret)和邻位连接测定。
[0128]
在蛋白印迹中,混合物中的蛋白通过电泳分离。分离的蛋白通常通过电印迹被印迹到固体支持物,诸如硝酸纤维素过滤器上。经印迹的蛋白可以通过与针对α-突触核蛋白寡聚体的结合剂直接结合,或者通过其中例如印迹与针对α-突触核蛋白寡聚体的标记的一级抗体接触的间接结合来检测,该标记的一级抗体被允许与寡聚体结合。通常,印迹被洗涤,以除去未结合的抗体。然后,寡聚形式使用针对一级抗体的标记的抗体(通常被称为二级抗体)或附接至一级抗体的标签来检测。
[0129]
标记物可以包括,例如,金纳米颗粒、乳胶珠、荧光分子、发光蛋白和从底物产生可检测的产物的酶。标签可以包括,例如,生物素。
[0130]
可选择地,混合物中的寡聚物类可以彼此分离并且随后被检测。混合物中的寡聚物类可以通过若干种方法分离。在一种方法中,物类通过电泳分离。这包括凝胶电泳。电泳方法包括聚丙烯酰胺凝胶电泳(“page”)和琼脂糖凝胶电泳。在一种方法中,使用天然page或blue native page。天然page bis-tris凝胶可从例如获得。在被称为“填充-毛细管电泳”或“pce”的方法中,通过在毛细管中填充无孔胶体二氧化硅来产生任意宽的孔。可选择地,物类可以通过色谱法,诸如尺寸排阻色谱法、液相色谱法或气相色谱法
chem.2009;284:11048-11058.[pubmed:19141614])(三聚体和六聚体)中描述。初原纤维结合抗体在例如u.s.2013/0309251(nordstrom等人)中描述。
[0139]
单体α-突触核蛋白可以通过使用被突触核蛋白的寡聚形式独特识别的抗体的免疫测定而与多聚α-突触核蛋白区分开来。另一种方法涉及质量差异的检测,例如使用质谱法。可以使用荧光方法。(参见,例如,sangeeta nath等人,“early aggregation steps inα-synuclein as measured by fcs and fret:evidence for a contagious conformational change”biophys j.2010apr 7;98(7):1302-1311,doi:10.1016/j.bpj.2009.12.4290;和laura tosatto等人,“single-molecule fret studies on alpha-synuclein oligomerization of parkinson’s disease genetically related mutants”,scientific reports 5,2015年12月)。另一种方法涉及测量总α突触核蛋白,随后是非病理性α突触核蛋白的蛋白酶k消化以及剩余的α突触核蛋白的检测。另一种方法涉及α突触核蛋白邻位连接测定。蛋白连接测定探针由针对感兴趣的蛋白产生的抗体产生,针对涉及推定的相互作用的蛋白中的每一种产生一种抗体,这些蛋白与短寡核苷酸缀合。如果探针结合相互作用的蛋白,则寡核苷酸足够接近以引发扩增反应,这可以通过加标签的寡核苷酸检测并且被观察为点状信号,其中每一个点代表相互作用。(roberts rf等人,“direct visualization of alpha-synuclein oligomers reveals previously undetected pathology in parkinson’s disease brain.brain”,2015;138:1642-1657.doi:10.1093/brain/awv040,和nora bengoa-vergniory等人,“alpha-synuclein oligomers:a new hope”,acta neuropathol.2017;134(6):819-838)。
[0140]
α-突触核蛋白的寡聚形式相对于单体的相对量可以被表示为比率。
[0141]
数量或量可以被表示为来自测定的信号输出或表示为转换之后的绝对量,例如从标准曲线转换,例如以质量/体积表示。
[0142]
样品中的α-突触核蛋白物类可以被进一步分层。例如,寡聚体物类可以被分为较低级的寡聚体例如2个至24个单体单元、较高级的寡聚体例如24个至100个单体单元或初原纤维等。
[0143]
b)淀粉样蛋白β
[0144]
寡聚体和单体可以使用酶联免疫吸附测定(elisa)来区分。这种测定类似于夹心elisa。aβ单体含有一个表位,而寡聚体含有多于一个这些表位。因此,如果针对上文独特的表位的表位重叠抗体被用于捕获和检测抗体,则与特定且独特的表位的结合会在这两种抗体之间产生竞争。换言之,单体会被捕获抗体或检测抗体占据,但不被两者占据。(“oligomeric forms of amyloid-βprotein in plasma as a potential blood-based biomarker for alzheimer’s disease”,wang mj等人alzheimers res ther.2017dec15;9(1):98.“potential fluid biomarkers for pathological brain changes in alzheimer's disease:implication for the screening of cognitive frailty”,ruan q等人,mol med rep.2016oct;14(4):3184-98.methods for the specific detection and quantitation of amyloid-βoligomers in cerebrospinal fluid,”schuster j,funke sa.j alzheimers dis.2016may 7;53(1):53-67)。
[0145]
所检测的淀粉样蛋白β的寡聚形式包括,例如,淀粉样蛋白β的4-24聚体。
[0146]
c)tau
[0147]
生物流体例如csf中的tau寡聚体可以通过elisa和蛋白印迹分析使用抗tau寡聚体抗体来测量。(sengupta u,等人,“tau oligomers in cerebrospinal fluid in alzheimer's disease”,ann clin transl neurol.2017apr;4(4):226-235)。
[0148]
所检测的tau的寡聚体包括,例如,低分子量寡聚体,例如不多于20-聚体,例如3-18聚体。脑脊液中可溶性寡聚体的存在可以用单克隆抗寡聚体抗体使用蛋白印迹和夹心酶联免疫吸附测定(selisa)来检测。david,ma等人,“detection of protein aggregates in brain and cerebrospinal fluid derived from multiple sclerosis patients”,front neurol.2014dec 2;5:251。tau的寡聚形式包括寡聚tau的过度磷酸化形式。
[0149]
d)亨廷顿蛋白
[0150]
最近的定量研究已经使用基于tr-fret的免疫测定。一种联合了尺寸排阻色谱法(sec)和时间分辨的荧光共振能量转移(tr-fret)的检测方法允许分辨和阐明脑中天然可溶性mhtt物类和不溶性聚集体的形成和聚集。“fragments of hdhq150 mutant huntingtin form a soluble oligomer pool that declines with aggregate deposition upon aging”,marcellin d.等人,plos one.2012;7(9):e44457.
[0151]
各种已公开的技术已经被用于测定寡聚亨廷顿蛋白物类,所述技术包括,例如琼脂糖凝胶电泳(age)分析(在天然或轻度变性、0.1%sds条件下或在天然条件下的blue-native page),其提供了许多免疫反应性寡聚体;抗亨廷顿蛋白抗体区别地识别特异性亨廷顿蛋白寡聚体。
[0152]
基于tr-fret的一步免疫测定方法已被开发用于定量细胞和组织匀浆中的可溶性和聚集的mhtt(tr-fret-based duplex immunoassay reveals an inverse correlation of soluble and aggregated mutant huntingtin in huntington’s disease.baldo b,等人,chem biol.2012feb 24;19(2):264-75)。
[0153]
基于时间分辨的福斯特能量转移(tr-fret)的测定代表广泛用于定量感兴趣的蛋白的高通量、均质、灵敏的免疫测定。tr-fret对小距离极其敏感,并且因此可以基于暴露的检测和如通过选择性抗体识别的靶蛋白上存在的表位的相对位置来提供构象信息。我们先前已经报道了基于使用对不同氨基末端htt表位有特异性的抗体来定量htt蛋白的tr-fret测定(fodale,v.等人,“polyglutamine-and temperature-dependent conformational rigidity in mutant huntingtin revealed by immunoassays and circular dichroism spectroscopy”,plos one.2014dec 2;9(12):e112262.doi:10.1371/journal.pone.0112262.ecollection 2014)。
[0154]
c.外泌体的分离
[0155]
外泌体是被认为在中间内吞隔室(多泡体(mvb))与质膜融合后从细胞释放的细胞外囊泡。在该过程中释放的囊泡被称为外泌体。外泌体通常在约20nm至约100nm的范围内。
[0156]
许多分离外泌体的方法是本领域已知的。这些包括,例如,免疫亲和捕获方法、基于尺寸的分离方法、差速超速离心、外泌体沉淀和基于微流体的分离技术。(loov等人,“α-synuclein in extracellular vesicles:functional implications and diagnostic opportunities”,m.cell mol neurobiol.2016apr;36(3):437-48.doi:10.1007/s10571-015-0317-0)。
[0157]
样品中外泌体的量可以通过许多方法中的任何一种来确定。这些包括,例如,(a)
acta,1862(2016)403-410。
[0173]
8.对神经元来源的外泌体的富集
[0174]
神经元来源的外泌体是神经元产生的外泌体。优选地,研究对象是cns来源的外泌体,即在中枢神经系统中产生的外泌体,其区别于外周神经系统。本文所述的方法富集包含外泌体的生物样品的神经元来源的外泌体,以及通过延伸,cns来源的外泌体。
[0175]
免疫亲和方法可用于使用脑特异性生物标志物(例如,神经和神经胶质标志物)分离神经元来源的外泌体,一种这样的标志物是l1cam。另一种标志物是kcam。其他相对脑特异性蛋白也可以执行这种能力。神经元来源的外泌体以与脑相关的蛋白标志物,包括,例如kcam、l1cam和ncam以及dat(多巴胺转运体)为特征。(参见,例如,us 2017/0014450、us 2017/0102397、us 9,958,460)。神经元来源的外泌体可以用亲和捕获方法分离。这样的方法包括,例如,附接至针对特异性标志物诸如l1 cam的抗体的顺磁性珠。(参见,例如,shi等人,“plasma exosomalα-alpha-synuclein is likely cns derived and increased in parkinson’s disease”,acta neuropathol.2014november;128(5):639-650)。
[0176]
d.外泌体内容物
[0177]
与人类神经退行性疾病的发病机制相关的许多蛋白,包括激酶,在cns外部以及在脑内产生,并且可以变得附接至穿过血脑屏障进入外周循环的外泌体的外表面。因此,在本文公开的方法的某些实施方案中,外泌体级分被处理以除去结合到外泌体表面的分子。这可以通过例如严格的洗涤程序来完成,诸如用磷酸盐缓冲溶液(pbs)洗涤。在这样的处理之后,外泌体的内容物可以被处理用于测定。
[0178]
然后,经擦洗的外泌体可以被裂解,并且它们的内部内容物被释放用于分析。
[0179]
iv.确定神经退行性状况的诊断、分期、进展、预后和发展风险
[0180]
包含生物样品中选自以下的生物标志物的量的生物标志物谱以及该谱随时间的变化指示神经退行性类型的神经退行性状况的存在、严重程度和方向:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。特别地,本文公开的蛋白生物标志物的异常比率,例如升高的量指示神经退行性变的过程。未受约束的该过程可以导致突触核蛋白病性状况的明显症状。因此,本文提供了在受试者中(例如,在有症状的个体或无症状的个体中)确定神经退行性状况的诊断、分期、进展速率、预后、药物响应性和发展风险的方法,该神经退行性状况以一种或更多种生物标志物蛋白的异常量(各自在本文中被称为“神经病性状态”,例如“突触核蛋白病性状态”、“淀粉样蛋白病性状态”、“tau蛋白病性状态”、“亨廷顿性状态”)为特征。
[0181]
如本文所使用的,术语“诊断”指的是将个体分类为患有或未患有特定的致病性状况,包括例如该状况的分期。
[0182]
如本文所使用的,术语“临床上相似但病因学上不同”指的是共享临床体征和/或症状,但由不同生物学原因引起的状况。
[0183]
如本文所使用的,术语“分期”指的是状况的相对严重程度,例如疑似疾病、早期、中期或晚期。分期可以用于基于病因学、病理生理学、严重程度等对患者进行分组。
[0184]
如本文所使用的,术语“进展”指的是状况的分期或严重程度随着时间的变化或缺乏变化。这包括状况的严重程度的增加、降低或停滞。在某些实施方案中,测量进展的速率,即随时间的变化。
[0185]
如本文所使用的,术语“预后”指的是状况的预期过程,例如进展的可能性。例如,预后可以包括对状况的严重程度可能在某个未来的时间点增加、减少或保持不变的预测。在本公开内容的上下文中,预后可以指的是个体:(1)将发展成神经退行性状况,(2)将从一个分期进展到状况的另一个更晚期的分期,(3)将呈现出状况的严重程度的降低,(4)将以一定的速率呈现出功能衰退,(5)将与状况一起存活持续一定的时间段(例如,存活率)或(6)将具有状况的复发的可能性。状况可以是突触核蛋白病性状况(例如pd、路易体痴呆、多系统萎缩或一些相关的突触核蛋白病)、淀粉样蛋白病性状况(例如阿尔茨海默病)、tau蛋白病性状况(例如阿尔茨海默病)和亨廷顿病。这些术语并不意在是绝对的,如医学诊断领域的任何技术人员将理解的。
[0186]
如本文所使用的,术语“发展风险”指的是为无症状的或临床前的个体将发展为疾病的明确诊断的概率。确定概率包括精确概率和相对概率两者,诸如“较有可能”、“极有可能”、“不太可能”或百分比概率,例如“90%”。风险可以基于年龄、性别、遗传风险和环境风险因素中的任一种与一般群体或与同受试者匹配的群体进行比较。在这样的情况下,受试者可以被确定为与群体的其他成员相比处于增加或降低的风险。处于发展神经退行性状况的增加的风险的受试者可能对例如通过预防该状况的发展、延迟该状况的发作或减轻与该状况相关的症状的严重程度或发病率的神经退行性状况的治疗有积极的响应。
[0187]
v.对激酶的谱建模以推断神经退行性状况的诊断、分期、进展、预后和发展风险
[0188]
确定神经退行性状况的诊断、分期、进展速率、预后和风险是将受试者分类为不同状况或状态内的不同类别或情况的过程,诸如疾病/健康(诊断)、i期/ii期/iii期(分期)、可能缓解/可能进展(预后)或在一定范围内分配评分。使用生物标志物谱进行分类的方法可以包括识别各种状态的特征的谱,并且将来自受试者的谱与类别或状态关联。识别这样的谱可以包括分析来自属于不同状态的受试者的生物标志物谱,并且辨别谱之间的模式或差异。分析可以通过谱的目视检查或通过统计学分析来完成。
[0189]
a.统计学分析
[0190]
通常,分析包括对足够大数量的样品进行统计学分析,以提供统计学上有意义的结果。本领域已知的任何统计学方法可以用于该目的。这样的方法或工具包括但不限于相关、皮尔逊相关、斯皮尔曼相关、卡方、均值比较(例如,配对t检验、独立t检验、anova)、回归分析(例如,简单回归、多元回归、线性回归、非线性回归、逻辑回归、多项式回归、逐步回归、岭回归、套索回归、弹性网络回归)或非参数分析(例如,wilcoxon秩和检验、wilcoxon符号秩检验、符号检验)。这样的工具被包含在商购可得的统计包诸如matlab、jmp统计软件和sas中。这样的方法产生模型或分类器,人们可以使用这些模型或分类器将特定的生物标志物谱分类成特定的状态。
[0191]
统计学分析可以是操作者实现的或通过机器学习来实现。
[0192]
b.机器学习
[0193]
在某些实施方案中,统计学分析通过使用机器学习工具来增强。这样的工具采用学习算法,其中一个或多于一个重要变量(relevant variable or variables)在不同的可能状态中被测量,并且区分状态的模式被确定并被用于对测试受试者进行分类。因此,本公开内容的任何分类方法可以通过比较属于特定突触核蛋白病状态内的各种状况的受试者中的一个或更多个变量的量度来开发。这包括,例如,确定具有不同诊断或在不同时间处于
不同分期的受试者中包括选自以下的生物标志物的量的生物标志物谱,以允许预测诊断、分期、进展、预后、药物响应性或风险:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。也可以包括其他变量,诸如家族史、生活方式、暴露于化学物质、各种表型性状等。
[0194]
1.训练数据集
[0195]
训练数据集是通常包含多于一个受试者(更一般地被称为对象)中的每一个的多于一个特征中的每一个的量度的向量的数据集。特征中的一个可以是受试者的分类,例如,诊断或在标度上的程度的量度。这可以用于监督学习方法。其他特征可以是,例如,选自以下的生物标志物的测量量:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。因此,例如,个体受试者的向量可以包括神经退行性状况的诊断(例如,被诊断为患有或未患有帕金森病)和如本文所述的多于一个生物标志物中的每一个的量度。在某些实施方案中,用于生成分类器的训练数据集包括来自至少100个、至少200个或至少400个不同受试者的数据。分类为患有该状况的受试者对比分类为未患有该状况的受试者的比可以是至少2:1、至少1:1或至少1:2。可选择地,预分类为患有该状况的受试者可以包括不多于66%、不多于50%、不多于33%或不多于20%的受试者。
[0196]
2.学习算法
[0197]
学习算法,也被称为机器学习算法,是使分析模型构建自动化,例如用于聚类、分类或谱识别的计算机执行的算法。学习算法对提供给算法的训练数据集进行分析。
[0198]
学习算法输出模型,也被称为分类器、分类算法或诊断算法。模型接收测试数据作为输入,并且产生将输入数据的推断或分类为属于一个或另一个类别、聚类组或在标度上的位置,诸如诊断、分期、预后、疾病进展、对药物的响应性等作为输出。
[0199]
各种机器学习算法可以被用于推断受试者的状况或状态。机器学习算法可以是有监督的或无监督的。学习算法包括,例如,人工神经网络(例如,反向传播网络)、判别分析(例如,贝叶斯分类器或fischer分析)、支持向量机、决策树(例如,递归分区过程诸如cart分类和回归树)、随机森林、线性分类器(例如,多元线性回归(mlr)、偏最小二乘(pls)回归和主成分回归(pcr))、层级聚类和聚类分析。学习算法会生成可以被用于做出推断,例如关于受试者的疾病状态的推断的模型或分类器。
[0200]
3.验证
[0201]
模型随后可以使用验证数据集来验证。验证数据集通常包括关于与训练数据集相同特征的数据。模型在训练数据集上执行,并且确定真阳性、真阴性、假阳性和假阴性的数量,作为模型的性能的量度。
[0202]
然后,模型可以在验证数据集上测试,以确定其有用性。通常,学习算法会生成多于一个模型。在某些实施方案中,模型可以基于对用于诊断所考虑的状况的标准临床测量的保真度来验证。这些中的一个或更多个可以基于其性能特性来选择。
[0203]
c.计算机
[0204]
基于本文描述的状态中的任一种对受试者的状况的分类可以由可编程的数字计算机来进行。计算机可以包括有形存储器,该有形存储器接收并且任选地至少存储受试者中的蛋白生物标志物(例如,信号传导激酶和任选地神经退行性蛋白)的一种或多于一种寡
聚形式和任选地单体形式的量度;以及处理器,该处理器通过执行体现分类算法的代码来处理该数据。分类算法可以是操作者实现的统计学分析或机器学习实现的统计学分析的结果。
[0205]
系统包括如所描述的与通信网络通信的第一计算机,该通信网络被配置成向计算机传输数据和/或向远程计算机传输测试的结果,诸如如本文所描述的分类。通信网络可以利用例如高速传输网络,包括但不限于数字用户线路(dsl)、电缆调制解调器、光纤、无线、卫星和电力线宽带(bpl)。系统还可以包括通过通信网络连接到第一计算机的远程计算机。
[0206]
d.模型执行和做出推断
[0207]
所选择的模型可以由操作者执行的统计学分析或机器学习产生。在任何情况下,模型可以用于做出关于测试受试者的推断(例如,预测)。可以从取自测试受试者的样品生成生物标志物谱,例如呈测试数据集的形式,例如包括包含由模型使用的特征的值的向量。测试数据集可以包括训练数据集中使用的所有相同特征,或这些特征的子集。然后,模型被应用于测试数据集或在测试数据集上执行。将生物标志物谱与状况、疾病状态、预后、进展的风险、药物响应的可能性等相关联是执行模型的一种形式。关联可以由人或由机器来进行。选择可以取决于关联操作的复杂性。这产生一个推断,例如,将受试者分类为属于一个类别或一个聚类组(诸如诊断)或在标度上的位置(诸如对治疗干预有响应的可能性)。
[0208]
在某些实施方案中,分类器会包括神经退行性蛋白的多于一种寡聚蛋白形式以及通常但不必要地包括神经退行性蛋白的一种或更多种单体形式。分类器可以是或可以不是线性模型,例如形式ax+by+cz=n的线性模型,其中a、b和c是形式x、y和z的测量量。分类器可能需要例如支持向量机分析。例如,推断模型可以进行模式识别,其中生物标志物谱位于正常和异常之间的标度上,其中各种谱更趋向于正常或趋向于异常。因此,分类器可以指示谱是正常或异常的置信水平。异常生物标志物谱可以是这样的谱:当通过a分类算法分析时,该谱将受试者分类到非正常类别中,诸如存在疾病或处于疾病的增加的风险。如果生物标志物的量度位于被认为正常的范围之外,例如与正常范围的统计学上显著的偏差,则该量度可能是异常的。
[0209]
分类器或模型可以从所测量的一种或多于一种形式生成发挥作为模型的功能的单个诊断数值。对神经病理学状态例如突触核蛋白病状态(例如,诊断、分期、进展、预后和风险))进行分类可以包括确定诊断数值是高于还是低于阈值(“诊断水平”)。例如,诊断数值可以是两种不同的信号传导激酶的相对量。例如,该阈值可以基于高于正常个体的诊断数值的某个偏差来确定,所述正常个体没有神经退行性状况例如突触核蛋白病性状况的任何体征。诊断数值的集中趋势的量度,诸如平均值、中位数或众数可以在统计学上显著数量的正常个体和异常个体中确定。高于正常量的截止值可以被选择为神经退行性状况例如突触核蛋白病性状况的诊断水平。该数值可以是,例如,与集中趋势的量度的某种程度的偏差,诸如方差或标准偏差。在一种实施方案中,偏差的量度是z分数或与正常平均值的标准偏差数。
[0210]
模型可以被选择为提供期望水平的灵敏度、特异性或阳性预测能力。例如,诊断水平可以提供80%、90%、95%或98%中的至少任何一个的灵敏度和/或80%、90%、95%或98%中的至少任何一个的特异性,和/或80%、90%、95%或98%中的至少任何一个的阳性预测值。测试的灵敏度是测试为阳性的实际阳性的百分比。测试的特异性是测试为阴性的
实际阴性的百分比。测试的阳性预测值是测试为阳性的受试者为实际阳性的概率。vi.治疗神经退行性状况的治疗干预的开发
[0211]
在另一方面,本文提供了使得能够实际开发用于神经退行性状况的治疗干预的方法,所述神经退行性状况例如突触核蛋白病性状况、淀粉样蛋白病性状况、tau蛋白病性状况和亨廷顿病。方法尤其包括选择进行临床试验的受试者以及确定治疗干预在一组受试者中的有效性。
[0212]
包括监测神经退行性蛋白的生物标志物谱的方法可用于确定实验性治疗干预在预防临床发作或抑制突触核蛋白病的后续进展中是否有效,或者受试者是否应该进入临床试验以测试药物候选物治疗这样的状况的效力。神经退行性蛋白的生物标志物谱或生物标志物谱的变化使得能够直接确定对状况,包括例如基础疾病过程的治疗效果。
[0213]
a.受试者招募
[0214]
临床试验包括对受试者的招募,用于测试潜在治疗干预诸如药物的效力和安全性。通常,受试者被选择为具有一定状态的不同状况,例如,具有或不具有疾病的诊断或处于疾病的不同分期或疾病的不同亚型或不同预后的受试者。临床试验受试者可以被分层成不同的组以进行相同或不同的治疗。分层可以基于任何数量的因素,包括疾病的分期。疾病分期是使用诊断发现以基于诸如病因学、病理生理学和严重程度的因素产生患者聚类的分类系统。它可以用作用于使临床上同质的患者聚类以评估护理质量、临床结果的分析、资源的利用和可选择的治疗的效力的基础。
[0215]
在一种方法中,潜在的临床试验受试者至少部分地基于生物标志物谱分层。因此,例如,具有不同生物标志物谱(例如,较高和较低相对量)的受试者可以被分配到不同的组。
[0216]
临床试验中的受试者的群体应该足以显示药物是否在结果上产生统计学上显著的差异。根据该能力水平,试验中的个体的数量可以是至少20个、至少100个或至少500个受试者。在这些之中,必须存在显著数量的个体表现出与患有神经退行性状况相一致的生物标志物谱(例如,生物标志物的增加的水平)。例如,受试者中的至少20%、至少35%、至少50%或至少66%可能最初具有这样的生物标志物谱(包括,例如,信号传导激酶的各种物类)。此外,显著数量的受试者待在类别状态之间划分。例如,受试者中的至少20%、至少35%、至少50%、至少66%或100%最初可能具有神经退行性状况(例如,突触核蛋白病性状况(例如,pd)、淀粉样蛋白病性状况、tau蛋白病性状况和亨廷顿病)的诊断。
[0217]
b.药物开发
[0218]
在临床试验开始后,治疗干预对不同分层组的有效性可以快速地被确定为随着治疗干预对生物标志物谱的影响而变化,该生物标志物谱包括选自以下的生物标志物:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。更具体地,生物标志物谱的变化预测了治疗干预的临床有效性。方法通常包括首先测试个体以确定包含信号传导激酶和任选地神经退行性蛋白的生物标志物谱。在测量之后,向受试者的至少一个子集施用治疗干预,例如实验药物。通常,受试者的至少一个子集被给予安慰剂或不被给予治疗。在一些情况下,受试者用作他们自己的对照,首先接受安慰剂,并且然后接受实验干预,或者反过来,用于比较。在某些情况下,这可以与施用已经公认的治疗形式联合完成。群体可以根据治疗干预的给药、时间和施用的速率来划分。当在测试受试者中观察到统计学上显著的改善时,伦理考虑可能要求停
止研究。如本文所使用的,“实验药物”和“药物候选物”指的是具有治疗效果或正在测试治疗效果的剂。“推定的神经保护剂”指的是具有神经保护作用或正在被测试为具有神经保护作用的剂。
[0219]
在施用治疗干预之后,再次确定生物标志物谱。
[0220]
治疗干预可以是施用药物候选物。使用标准统计方法,可以确定治疗干预是否对包括选自以下的生物标志物的生物标志物谱产生了有意义的影响:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。通常,与初始生物标志物谱相比,统计学上显著的变化,尤其是向正常谱的转变,指示治疗干预具有神经保护作用,并且因此会延迟临床发作,或减缓或优选地逆转神经退行性状况(例如,突触核蛋白病性状况、淀粉样蛋白病性状况、tau蛋白病性状况、亨廷顿病)的进展。
[0221]
因此,对于其可以测量包括选自(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种的生物标志物的生物标志物谱的受试者包括,例如:(1)对于神经退行性状况(例如,突触核蛋白病性状况、淀粉样蛋白病性状况、tau蛋白病性状况、亨廷顿病)为无症状的受试者;(2)具有最小神经退行性疾病症状且没有暗示神经退行性状况的体征的受试者(例如,其可能被诊断为对于神经退行性状况为“疑似的”或“临床前的”,尤其是当某些遗传和/或环境风险因素已经被确定时);(3)具有“可能的”神经退行性状况的诊断的受试者和被诊断(“明确诊断”)为患有神经退行性状况的受试者。这些包括,例如,(1)对于突触核蛋白病性状况为无症状的受试者,(2)具有最小帕金森症状且没有暗示突触核蛋白病性状况的体征的受试者(例如,其可能被诊断为对于pd或一些相关的突触核蛋白病为“疑似的”或“临床前的”,尤其是当某些遗传和/或环境风险因素已经被确定时);(3)具有“可能的”突触核蛋白病(例如,pd)的诊断的受试者和被诊断(“明确诊断”)为患有突触核蛋白病性状况的受试者。
[0222]
受试者通常是人类,但也包括非人类动物,例如用作pd的模型的非人类动物,诸如啮齿动物(例如,小鼠和大鼠)、猫、犬、其他驯养的四足动物(诸如马、羊和猪)和非人类灵长类动物(例如,猴子)。动物模型包括遗传模型和基于神经毒素的施用的模型两者。在这样的模型中使用的神经毒素包括,例如,6-羟基多巴胺(6-ohda)和1-甲基-1,2,3,6-四氢吡啶(mptp)施用,以及百草枯和鱼藤酮。遗传模型包括snca(α-突触核蛋白、park1和park4)、prkn(parkin rbr e3泛素蛋白连接酶,park2)、pink1(pten诱导的推定激酶1,park6)、dj-1(park7)以及lrrk2(富含亮氨酸重复序列激酶2,park8)的遗传突变。
[0223]
对于神经退行性状况诸如突触核蛋白病的神经保护疗法的临床试验需要迅速地指示潜在疗法的有效性的量度。否则,基于临床观察确定药物效力通常需要许多个月。包含神经退行性蛋白寡聚体和任选地单体的生物标志物谱提供了这样的量度,因此使得能够对罹患致命性脑紊乱诸如pd的受试者中的改善疾病的药物效力的实际评估。
[0224]
c.验证
[0225]
当受试者在临床症状上显示出临床上显著的变化时,他们被称为对疗法有响应。被测试药物的效力通常通过临床测量来验证,例如,通过确定疾病症状、体征和分期。这样的临床测量包括本文所描述的那些,诸如改进的hoehn和yahr分期量表和统一帕金森病评定量表(updrs)。如本文所描述的生物标志物谱还提供对疗法的响应的指示,并且可以在比
其他形式的临床评估更早的时间段这样做。这通常会发生在使用传统方法验证药物后。然而,生物标志物谱可以用来补充或替代临床标志物,以确定药物在受试者或受试者群体中的效力。例如,在疗法开始后约18个月才被传统手段检测到的响应,可以在疗法开始后仅仅12个月、6个月或3个月在生物标志物谱中检测到。因此,在一些实施方案中,对疗法的响应的确定包括在第一时间点确定受试者的第一生物标志物谱,对受试者施用治疗干预;在施用治疗干预后,例如在疗法开始的约以下中的任一项内确定第二生物标志物谱:1个月、3个月、6个月、9个月、12个月、15个月或18个月;并且比较第一生物标志物谱和第二生物标志物谱以识别变化。在生物标志物谱上没有统计学上的显著差异指示对疗法没有响应。向正常生物标志物谱的统计学上的显著变化指示对疗法的积极响应,而远离正常谱的统计学上的显著变化指示对疗法的消极响应或疾病的进展。在治疗干预开始之前已知正常谱的情况下,可以免除第一生物标志物谱的测量,并且确定可以依赖于第二生物标志物谱。
[0226]
vii.治疗方法
[0227]
根据基于如本文所描述的生物标志物谱将受试者分类成的神经退行性状况(例如,突触核蛋白病性状况、淀粉样蛋白病性状况、tau蛋白病性状况、亨廷顿病)的分期或类别,受试者可能需要治疗干预。本文提供了用有效治疗神经退行性状况(例如,突触核蛋白病性状况、和淀粉样蛋白病性状况、tau蛋白病性状况、亨廷顿病)的治疗干预来治疗通过本文公开的方法确定为呈现出该状况的受试者的方法。改变信号传导激酶和任选的神经退行性蛋白水平的治疗干预,并且特别是那些恢复信号传导激酶和任选地神经退行性蛋白水平的治疗干预,反映了有效的治疗,例如,通过本文的方法开发并经临床验证的治疗干预。
[0228]
如本文所使用的,术语“治疗干预”、“疗法”和“治疗”指的是产生治疗效果(例如,是“治疗有效的”)的干预。治疗有效的干预预防疾病诸如突触核蛋白病性状况、减缓疾病的进展、延迟疾病的症状的发作、改善疾病的状况(例如,引起疾病的缓解)、改善疾病的症状或治愈疾病。治疗干预可以包括,例如,治疗的施用、具有治疗目的的药物物质或生物物质或营养物质的施用。对治疗干预的响应可以是完全的或部分的。在一些方面中,与例如施用前的个体或未经历治疗的对照个体相比,疾病的严重程度降低了至少10%。在一些方面中,疾病的严重程度降低了至少25%、50%、75%、80%或90%,或者在一些情况下,使用标准诊断技术不再可检测到。认识到受试者的某些亚组可能对疗法没有响应,治疗有效性的一种量度可以是对至少100名受试者中至少90%的经历干预的受试者的有效性。
[0229]
如本文所使用的,当术语“有效”修饰治疗干预(“有效治疗”或“对......治疗有效”)或药物的量(“有效量”)时,指的是如上文所描述的改善紊乱的治疗或量。例如,对于给定的参数,治疗有效量会示出参数增加或减少至少5%、10%、15%、20%、25%、40%、50%、60%、75%、80%、90%或至少100%。治疗效力也可以被表示为增加或减少
“‑
倍”。例如,治疗有效量可以相比于对照具有至少1.2倍、1.5倍、2倍、5倍的效力或更有效。目前,针对帕金森受试者的运动症状的严重程度的临床效力可以使用标准化量表诸如updrs以及hoehn和yahr量表来测量;对于精神症状和认知症状,可以使用adas-cog或mmpi量表来测量。(公认的是,这样的量表的效用不一定取决于潜在疾病状况的类型或性质。)
[0230]
因此,根据一些方法,首先测试受试者的生物标志物谱,该生物标志物谱包括来自受试者的生物样品中的神经退行性蛋白的寡聚形式和/或单体形式的形式。对适当状况或类别的分类基于生物标志物谱来确定。基于分类,可以做出关于对受试者施用最佳有效治
疗干预的类型、量、途径和时间的决定。
[0231]
a.突触核蛋白病性状况
[0232]
在某些实施方案中,用于pd的改善症状的治疗干预(即,对症的或姑息性治疗)包括施用选自以下的药物:多巴胺激动剂(例如,普拉克索(pramipexole)(例如,mirapex
tm
)、罗匹尼罗(ropinirole)(例如,requip)、罗替戈汀(rotigotine)(例如,neupro)、阿扑吗啡(apomorphine)(例如,apokyn))、左旋多巴(levodopa)、卡比多巴(carbidopa)-左旋多巴(例如,rytary、sinemet)),mao-b抑制剂(例如,司来吉兰(selegiline)(例如,eldepryl、zelapar)或雷沙吉兰(rasagiline)(例如,azilect)),儿茶酚-o-甲基转移酶(comt)抑制剂(例如,恩他卡朋(entacapone)(comtan)或托卡朋(tolcapone)(tasmar))、抗胆碱能药(例如,苯扎托品(benztropine)(例如,cogentin)或苯海索(trihexyphenidyl))、金刚烷胺(amantadine)或胆碱酯酶抑制剂(例如,利斯的明(rivastigmine)(exelon))或一些类似的剂或剂组。
[0233]
在另一种实施方案中,药物是nk1-拮抗剂和6-丙基氨基-4,5,6,7-四氢-1,3-苯并噻唑-2-胺的组合。例如,nk1-拮抗剂可以是罗拉匹坦或阿瑞匹坦,并且6-丙基氨基-4,5,6,7-四氢-1,3-苯并噻唑-2-胺是盐酸普拉克索一水合物。例如,阿瑞匹坦的每日剂量可以在10mg至250mg之间,并且盐酸普拉克索一水合物的每日剂量可以在1.5mg至45mg之间。参见,例如,美国专利申请2020/0147097。在另一种实施方案中,药物是组合产品,包括5ht3-拮抗剂与治疗有效的每日剂量的6-丙基氨基-4,5,6,7-四氢-1,3-苯并噻唑-2-胺组合的递送,例如盐酸蒽丹西酮二水合物和盐酸普拉克索一水合物的组合。盐酸蒽丹西酮二水合物的每日剂量可以为4mg至32mg,并且普拉克索的每日剂量可以为1.5mg至42mg。(参见,例如,美国专利10,799,484。)在某些实施方案中,用于pd的神经保护或改善疾病的治疗干预包括施用推定的改善疾病的药物,如通过引用以其整体并入本文的以下临时专利申请中的任一个所描述的:2017年3月27日提交的序列号62/477187;2017年4月10日提交的序列号62/483,555;2017年4月13日提交的序列号62/485,082;2017年5月26日提交的序列号62/511,424;2017年7月3日提交的序列号62/528,228;2017年4月24日提交的序列号62/489,016;2017年6月30日提交的序列号62/527,215。
[0234]
b.淀粉样蛋白病性状况
[0235]
在某些实施方案中,用于淀粉样蛋白病性状况的改善症状的治疗干预(即,对症的或姑息性治疗)包括施用药物诸如(加兰他敏(galatamine))、(利斯的明)和(多奈哌齐(donepezil))。
[0236]
c.tau蛋白病性状况
[0237]
在某些实施方案中,用于tau蛋白病性状况的改善症状的治疗干预(即,对症的或姑息性治疗)包括施用药物,诸如(加兰他敏)、(利斯的明)和(多奈哌齐)或本文引用的用于pd的对症治疗的药物。
[0238]
d.亨廷顿病
[0239]
在某些实施方案中,用于亨廷顿病的改善症状的治疗干预(即,对症的或姑息性治疗)包括施用药物,诸如丁苯那嗪(tetrabenazine)((替硝苯那嗪(deutrabenazine))、
ionis-htt
rx
,以及各种精神安定剂和苯二氮类。
[0240]
viii.评估对治疗干预响应性的方法
[0241]
在罹患神经退行性紊乱(例如,突触核蛋白病性状况、淀粉样蛋白病性状况、tau蛋白病性状况、亨廷顿病)的受试者中,治疗干预的有效性或受试者对治疗干预的响应性可以通过评估治疗干预对生物标志物谱的影响来确定。这包括在任何神经退行性状态,例如诊断、分期、进展、预后和风险中的有效性。生物标志物谱向更正常谱的变化指示治疗干预的有效性。
[0242]
包含一组选自(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种的生物标志物的生物标志物谱的使用,相比于常规手段(例如,症状学、功能量表或放射学扫描的变化)对于判断在这样的情况下的治疗效力赋予优势。这样的判断效力的常规手段不仅不灵敏、不精确且是半定量的,而且通常在变得具有足够量级以准确测量之前需要很长时间(例如,数年)。因此,所测试的潜在有用治疗的数量显著减少,并且临床试验的费用并且因此有用药物的最终成本显著增加。
[0243]
在某些实施方案中,蛋白生物标志物物类的生物标志物谱通常在施用治疗干预之前、期间和之后被多于一次测量,或者在治疗干预之后在多于一个时间点被多于一次测量。
[0244]
ix.试剂盒
[0245]
在另一方面,本文提供了用于检测选自以下的生物标志物以及解释如此获得的结果的试剂盒:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。试剂盒可以包括容纳用于从体液中分离外泌体的试剂,用于优先地从所有外泌体中分离神经元来源的外泌体的试剂,以及足以检测激酶和/或神经退行性蛋白形式的试剂的容器。
[0246]
例如,用于检测和分期生物样品中的突触核蛋白病疾病状态的试剂盒可以包括试剂、缓冲液、酶、抗体和专用于此目的的其他组合物。试剂盒通常还可以包括使用说明书以及用于数据分析和解释的软件。试剂盒还可以包括用作规范标准品的样品。每一种溶液或组合物可以被容纳在小瓶或瓶中,并且所有小瓶都严密保存在盒中用于商业销售。
实施例
[0247]
以下实施例通过说明的方式而非通过限制的方式来提供。
[0248]
i.实施例1:激酶在突触核蛋白病性状况中具有不同的活性
[0249]
研究的受试者是已经被诊断为患有突触核蛋白病性状况且被给予有活性的治疗干预以及然后被给予不同的、可能被已知为无活性的治疗干预或者反过来的个体组群。或者,研究的受试者是包括已经被诊断为患有突触核蛋白病性状况的多于一个受试者中对突触核蛋白病性状况为无症状的多于一个受试者的组群。在任一种情况下,静脉血液样品在不同时间通过静脉穿刺从每一个受试者采集,包括在基线或对照(例如,无活性的干预治疗)条件下采集以及在施用潜在有活性的(例如,实验干预)治疗期间再次采集。使用本文描述的方法从血液分离神经元来源的外泌体。测量包含在分离的外泌体中的选自以下的生物标志物的量:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。确定表达模式。结果示出在被诊断为
患有突触核蛋白病性状况的受试者的组群中,信号传导激酶和神经退行性蛋白寡聚形式的活性是不同的,达到统计学上显著的程度。被发现在该生物标志物测定的结果中具有显著变化的那些稍后被发现在临床状态中具有成正比的变化。
[0250]
ii.实施例2:受试者分层/临床试验
[0251]
测试未患有pd和患有pd的志愿者受试者,以确定神经元来源的外泌体中选自以下的生物标志物的量:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。基于所确定的量并且使用在上文实施例中确定的截止值,将受试者聚类成若干个测试组。某些测试组被给予安慰剂。其他测试组在临床试验中被施用不同量的化合物。在施用期间和/或施用之后,重复测试。分析收集的量度。确定治疗干预产生了信号传导激酶的活性和神经退行性蛋白的寡聚形式的量中统计学上显著的变化。
[0252]
iii.实施例3:对突触核蛋白病具有神经保护作用的药物候选物的临床试验
[0253]
ii期研究的目标是评估与阿瑞匹坦一起给予并且与或不与任选地洛伐他汀或类似有效的药物一起给予的普拉克索在患有pd和相关紊乱的患者中的安全性、耐受性和初始效力。进行多达30名患有pd(pd)、多系统萎缩(msa)、路易体痴呆(lbd)或相关的突触核蛋白病性紊乱的患者中的序贯治疗、递增剂量、交叉、门诊试验。在进入研究之前的3个月期间,没有一名参与者被允许用多巴胺激动剂或其他中枢活性药物治疗,除了左旋多巴-卡比多巴(sinemet)之外,左旋多巴-卡比多巴(sinemet)在整个试验过程中维持在被认为是医学上可接受的程度的稳定剂量。在基线临床评估和实验室评估(包括统一pd评定量表(updrs-第iii部分)和生物标志物蛋白确定)之后,符合入选标准的同意个体从他们的研究前pd治疗方案切换到包括普拉克索er和阿瑞匹坦的方案。普拉克索er剂量被滴定至最佳耐受的剂量(或9mg/天的最大值),并且然后稳定维持持续多达约12周至16周。然后,与以其最大批准剂量给予的另外的药物(例如,他汀类)的联合治疗可以在临床上认为合适的情况下开始持续另外的3个月,此时所有受试者都恢复到他们入院前的治疗方案。在试验期间,以规律的间隔重复基线效力和安全性测量,包括生物标志物水平的确定。效力被确定为包括选自以下的生物标志物的生物标志物谱向正常的统计学上显著的变化的函数:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。
[0254]
iv.实施例4:诊断
[0255]
受试者表现出具有与pd一致的某些症状,但处于临床前水平,此时仍缺乏该疾病的许多显著临床特征。通过静脉穿刺从受试者采集血液。从血液中的神经元来源的外泌体测量选自以下的生物标志物的量:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。确定生物标志物谱。诊断算法将谱分类为与pd的诊断一致。受试者被诊断为患有pd,并且被置于治疗方案中,要么是缓解症状的姑息性疗法,要么是针对疾病的病因学的用于神经保护的目的的治疗。
[0256]
v.实施例5:分期
[0257]
受试者表现出具有pd的诊断。医生安排对受试者进行血液测试,以确定包括选自以下的生物标志物的生物标志物谱:(1)至少一种信号传导激酶和任选地神经退行性蛋白
的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。基于生物标志物谱,医生确定受试者处于pd的早期并且因此对特定的治疗干预更有响应。
[0258]
vi.实施例6:预后/进展
[0259]
受试者表现出具有pd的诊断。医生安排相隔若干个月对受试者进行第一次血液测试和第二次血液测试,以确定包括选自以下的生物标志物的生物标志物谱:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。基于生物标志物谱,医生确定受试者的疾病正在缓慢进展并且受试者被预期即使在没有风险性治疗干预的情况下也具有许多年的可用寿命(useful life)。
[0260]
vii.实施例7:风险评估
[0261]
受试者在身体检查时呈现出不具有突触核蛋白疾病的症状。在这个病例中,该个体意识到遗传或环境风险因素。医生安排对受试者进行血液测试,以确定包括选自以下的生物标志物的生物标志物谱:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。基于一些或所有可测量的物类与健康对照个体相比的相对正常的生物标志物谱,医生确定受试者具有发展pd的低概率。
[0262]
viii.实施例8:对疗法的响应
[0263]
受试者表现出具有pd的诊断。医生安排在治疗开始之前对受试者进行初始血液测试,以确定包括选自以下的生物标志物的生物标志物谱:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。在一轮治疗之后,但在临床症状改变之前,医生安排进行第二次血液检测。基于谱向正常的变化,医生确定治疗是有效的或者是需要改变剂量还是重复剂量。
[0264]
ix.实施例9:诊断的开发
[0265]
测试未患有pd和患有处于不同的诊断分期的pd的志愿者受试者,以确定包括选自以下的生物标志物的生物标志物谱:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。基于所确定的生物标志物谱,受试者被分类为显示疾病的存在或不存在,以及任选地疾病的分期。谱使用计算机化的学习算法来确定,该计算机化的学习算法在数据分析之后生成推断诊断的分类算法。推断模型选择为产生具有期望的灵敏度和特异性的测试。
[0266]
x.实施例10:生物标志物谱在突触核蛋白病性状况中发生改变
[0267]
作为研究的受试者的个体组群已经被诊断为患有突触核蛋白病性状况。受试者被给予有活性的治疗干预,并且然后给予不同的、可能已知是无活性的治疗干预。可选择地,干预可以以相反的顺序给予。或者,研究的受试者是包括已经被诊断为患有突触核蛋白病性状况的多于一个受试者中对突触核蛋白病性状况为无症状的多于一个受试者的组群。在任一种情况下,在不同时间通过静脉穿刺从每一个受试者采集静脉血液样品,包括在基线或对照(例如,无活性的干预治疗)条件下采集以及在施用潜在有活性的(例如,实验干预)治疗期间再次采集。使用本文描述的方法从血液中分离神经元来源的外泌体。测量包含在分离的外泌体中的选自以下的生物标志物的量:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。
这些数据被组合成数据集。使用统计学方法分析数据集,在这种情况下,使用数据集训练学习算法(例如支持向量机),以开发推断受试者应该被分类为患有还是未患有突触核蛋白病性状况的模型。结果示出了在被诊断为患有突触核蛋白病性状况的受试者的组群中,信号传导激酶的某些物类相对于其他信号传导激酶具有在统计学上显著程度的不同活性。此外,神经退行性蛋白的寡聚形式也发生了达到统计学上显著程度的变化。被发现在该生物标志物测定的结果中具有显著变化的那些稍后被发现在临床状态中具有成正比的变化。
[0268]
xi.实施例11:受试者分层/临床试验
[0269]
测试未患有pd和患有pd的志愿者受试者,以确定包括选自以下的生物标志物的生物标志物谱:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)神经元来源的外泌体中的一种或多于一种不同的信号传导激酶中的每一种。基于所确定的生物标志物谱并且使用在上文实施例中确定的分类器,将受试者聚类到若干个测试组中。某些测试组被给予安慰剂。其他测试组在临床试验中被施用不同量的化合物。在施用期间和任选地在施用之后,重复测试。分析收集的量度。确定治疗干预产生生物标志物谱向正常的统计学上显著的变化。
[0270]
xii.实施例12:对突触核蛋白病具有神经保护作用的药物候选物的临床试验
[0271]
ii期研究的目标是评估与阿瑞匹坦一起给予并且与或不与任选地洛伐他汀或类似有效的药物一起给予的普拉克索在患有pd和相关紊乱的患者中的安全性、耐受性和初始效力。进行多达30名患有pd(pd)、多系统萎缩(msa)、路易体痴呆(lbd)或相关的突触核蛋白病性紊乱的患者中的序贯治疗、递增剂量、交叉、门诊试验。在进入研究之前的3个月期间,没有一名参与者被允许用多巴胺激动剂或其他中枢活性药物治疗,除了左旋多巴-卡比多巴(sinemet)之外,左旋多巴-卡比多巴(sinemet)在整个试验过程中维持在被认为是医学上可接受的程度的稳定剂量。在基线临床评估和实验室评估(包括统一pd评定量表(updrs-第iii部分)和包括选自以下的生物标志物的生物标志物确定:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种)之后,符合入选标准的同意个体从他们的研究前pd治疗方案切换到包括普拉克索er和阿瑞匹坦的方案。普拉克索er剂量被滴定至最佳耐受的剂量(或9mg/天的最大值),并且然后稳定维持持续多达约12周至16周。然后,与以其最大批准剂量给予的另外的药物(例如,他汀类)的联合治疗可以在临床上认为合适的情况下开始持续另外的3个月,此时所有受试者都恢复到他们入院前的治疗方案。在试验期间,以规律的间隔重复基线效力和安全性测量,包括生物标志物水平的确定。效力被确定为生物标志物谱向正常的统计学上显著的变化的函数。
[0272]
xiii.实施例13:诊断
[0273]
受试者表现出具有与pd一致的某些症状,但处于临床前水平,此时仍缺乏该疾病的许多显著临床特征。血液通过静脉穿刺从受试者采集。从血液中神经元来源的外泌体测量选自以下的生物标志物的量:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。确定生物标志物谱。诊断算法将谱分类为与pd的诊断一致。受试者被诊断为患有pd,并且被置于治疗方案中,要么是缓解症状的姑息性疗法,要么是针对疾病的病因学的用于神经保护的目的的治疗。
[0274]
xiv.实施例14:分期
[0275]
受试者表现出具有pd的诊断。医生安排对受试者进行血液测试,以确定包括选自以下的生物标志物的生物标志物谱:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。基于生物标志物谱,医生确定受试者处于pd的早期并且因此对特定的治疗干预更有响应。
[0276]
xv.实施例15:预后/进展
[0277]
受试者表现出具有pd的诊断。医生安排相隔若干个月对受试者进行第一次血液测试和第二次血液测试,以确定包括选自以下的生物标志物的生物标志物谱:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。基于生物标志物谱,医生确定受试者的疾病正在缓慢进展并且受试者被预期即使在没有风险性治疗干预的情况下也具有许多年的可用寿命。
[0278]
xvi.实施例16:风险评估
[0279]
受试者在身体检查时呈现出不具有突触核蛋白疾病的症状。在这个病例中,该个体意识到遗传或环境风险因素。医生安排对受试者进行血液测试,以确定包括选自以下的生物标志物的生物标志物谱:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。基于生物标志物的一些或所有可测量的物类与健康对照个体相比的相对异常的生物标志物谱,医生确定受试者具有发展pd的低概率。
[0280]
xvii.实施例17:对疗法的响应
[0281]
受试者表现出具有pd的诊断。医生安排在治疗开始之前对受试者进行初始血液测试,以确定包括选自以下的生物标志物的生物标志物谱:(1)至少一种信号传导激酶和任选地神经退行性蛋白的至少一种寡聚形式,或(2)一种或多于一种不同的信号传导激酶中的每一种。在一轮治疗之后,但在临床症状改变之前,医生安排进行第二次血液检测。基于向正常的变化,医生确定治疗是有效的或者需要改变剂量还是重复剂量。
[0282]
如本文使用的,除非另外指定,否则以下含义适用。措辞“可以”用于允许性的含义(即,意指有可能),而非强制性的含义(即,意指必须)。措辞“包括/包含(include)”、“包括/包含(including)”和“包括/包含(includes)”等意指包括/包含但不限于。单数形式“一(a)”、“一(a)”和“该”包括复数指示物。因此,例如,尽管对于一个或更多个要素使用了其他术语和措辞,诸如“一个或更多个”,提及“要素(an element)”包括两个或更多个要素的组合。除非另外指明,否则术语“或”是非排他性的,即,涵盖“和”和“或”两者。在修饰语和序列之间的术语“......中的任一个”意指修饰语修饰序列中的每一个成员。因此,例如,措辞“至少1、2或3中的任一个”意指“至少1、至少2或至少3”。措辞“至少一个”包括“多于一个”。术语“基本上由...组成”指的是包含所列举的要素和不实质上影响所要求保护的组合的基本的和新颖的特征的其他要素。
[0283]
虽然本文已经示出和描述了本发明的某些实施方案,但对于本领域技术人员将明显的是,这样的实施方案仅通过实例的方式提供。在不偏离本发明的情况下,本领域技术人员现在将想到许多变化、改变和替换。应当理解,在实践本发明中可以采用本文描述的本发明的实施方案的各种替代选择。意图所附权利要求界定本发明的范围,并且从而涵盖在这些权利要求范围内的方法和结构及其等同物。
[0284]
本说明书中提及的所有出版物和专利申请通过引用并入本文,其程度如同每一个单独的出版物或专利申请被具体地和单独地指明通过引用并入的相同程度。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1