基于深度学习的自动束建模的制作方法
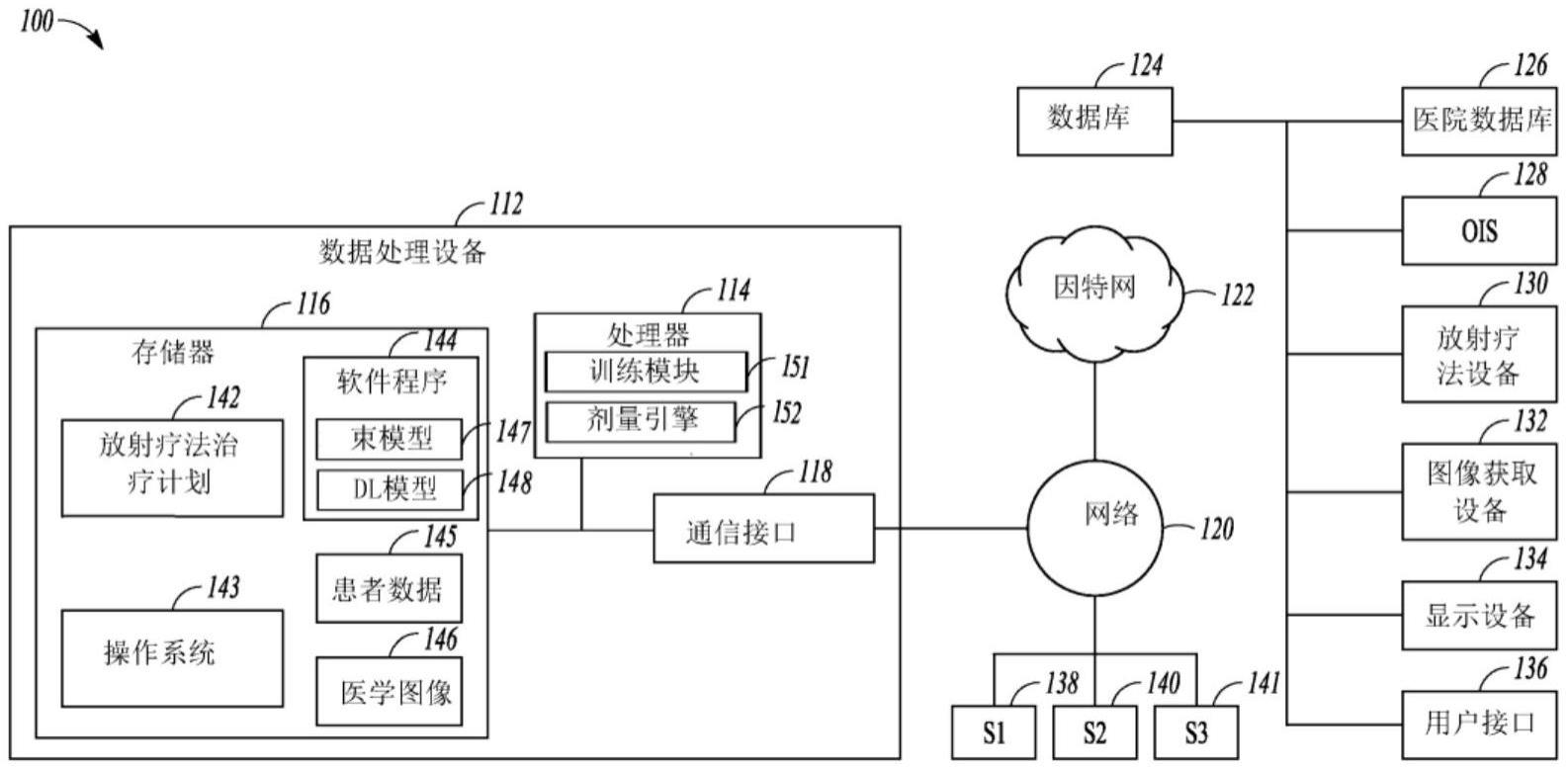
本文献总体上涉及放射疗法治疗系统中的剂量计算,并且更具体地,涉及用于自动生成在放疗治疗计划中使用的束模型的系统和方法。
背景技术:
1、放射疗法(或“放疗”)可以用于治疗哺乳动物(例如,人和动物)组织中的癌症或其他疾病。提供一种这样的放疗技术,该放疗技术使用线性加速器(也称为“linac”),由此通过高能x射线或电子辐射肿瘤。放射疗法的目标是使对靶组织(例如,肿瘤或其他异常组织)的放射剂量最大化,同时使对周围健康组织的损害最小化。与药物的处方类似,医师对靶(肿瘤或其他异常组织)开出预定量的放射剂量,并为周围器官开出临床剂量限制。通常,以准直束形式的电离放射从外部放射源指向患者。可以精确地控制放射束以确保剂量给送。
2、可以使用指定的或可选择的束能量用于给送诊断能级范围或治疗能级范围。放射束的调制可以由一个或更多个衰减器或准直器例如多叶准直器(mlc)和钳口提供。可以通过准直器来调整放射束的强度和形状,以例如通过使投射的束与靶组织的轮廓一致来避免损害与靶组织相邻的健康组织。
3、治疗计划是涉及以下内容的过程:确定用于在约束下实现治疗目标的特定放疗参数。放疗参数的示例包括放射束角度、剂量强度水平、剂量分布等。放射剂量可以使用剂量计算算法来计算。治疗计划过程的成果是放射疗法治疗计划(也称为“治疗计划”或简称为“计划”)。治疗计划可以使用治疗计划系统(tps)制定。在可以向患者给送放疗给送之前,为每个患者定制设计治疗计划。为了创建计划,可以使用一种或更多种医学成像技术例如来自x射线、计算机断层扫描(ct)、核磁共振(mr)、正电子发射断层扫描(pet)、单光子发射计算机断层扫描(spect)或超声波的图像来提供靶肿瘤的图像。临床医师可以使用患者解剖结构的图像来识别靶肿瘤和肿瘤附近的周围器官,描绘要接收规定放射剂量的靶,并且类似地描绘附近组织例如处于可能受到放射治疗损害的风险下的器官(oar)。描绘靶肿瘤与oar或勾画靶肿瘤与oar的轮廓可以手动完成,或者通过使用帮助识别或描绘靶肿瘤和oar的自动软件工具完成。然后可以基于临床和剂量测定的目标和约束(例如,针对部分肿瘤体积或全部肿瘤体积的最大剂量、最小剂量、平均剂量和部分剂量,以及针对关键器官的类似措施)使用优化技术生成放射疗法治疗计划。
4、治疗计划的剂量分布可以使用剂量计算算法生成。用于该算法的束模型包括对从放射疗法机器(例如,linac)发射的放射的能量分布进行描述的参数。束模型参数值会根据不同的放射疗法机器而改变,即使来自同一制造商的同一型号的放射疗法机器也需要不同的束模型参数。机械差异(例如,机械尺寸或材料特征)或者部件值的差异(例如,电子电路部件值)会导致不同放射疗法机器之间的束模型参数值的差异。医学物理学家可以通过以下内容来执行束建模:手动调整模型参数,以使束模型输出剂量分布与来自机器的测量紧密匹配。
技术实现思路
1、治疗计划是确定用于经由放射疗法设备治疗患者的放疗参数的过程。治疗计划过程可以包括使用患者的三维(3d)图像来识别靶区域(例如,肿瘤)并识别肿瘤附近的关键器官。治疗计划的创建可能是耗时的过程,在该过程中,计划者试图遵守各种治疗目标或约束(例如,剂量体积直方图(dvh)、交叠体积直方图(ovh))、考虑它们各自的重要性(例如,权重)以便产生临床上可接受的治疗计划。该治疗计划由数字参数构成,这些数字参数指定一个或更多个放射束的方向、截面形状和强度。一旦生成治疗计划,就可以通过以下操作来执行治疗计划:将患者定位在治疗机器中并且给送由经优化的计划参数指导的规定放射疗法。在一些示例中,放射疗法治疗计划可以包括剂量“划分”,从而可以在预定时间段内向患者提供一系列的放射治疗(例如,在患者的治疗期间可能存在30个至45个部分),其中每次治疗包括总规定剂量的指定部分。在治疗期间,患者相对于治疗机器(例如,linac)的位置以及靶肿瘤相对于治疗机器(例如,linac)的位置是重要考虑因素,以确保辐射靶肿瘤而不辐射健康组织。
2、对于治疗计划系统(tps),为使用剂量计算算法来计算针对特定linac的剂量,需要为linac创建剂量算法的束模型。束模型的生成是tps调试的一部分。束模型可以包括尤其对从放射疗法机器发射的放射的能量分布进行描述的参数,所述参数是供tps计算剂量分布的关键输入。在某些方法中,在安装放射疗法机器并执行最终调整后,客户可以使用用于束建模参考的体模(例如,水体模)来执行对不同设置下的放射束的测量。
3、治疗计划和束建模的一个重要方面是确定束模型参数值。常规的束建模通常需要人类建模者(例如,建模物理学家)手动调整束模型参数,并将具有经手动调整后的模型参数的束模型应用到剂量引擎以计算剂量度量(例如,剂量分布(dose distribution)或剂量分布(dose profile))。在虚拟体模中,人类专家(例如,同一人类建模师,或不同的人例如放射肿瘤学家或医学物理学家)可以验证计算出的剂量满足预先确定的剂量测定验证标准。剂量测定验证标准可以基于对低剂量梯度区域中的有限数目的点的分析,或者基于高剂量梯度区域中的等剂量线之间的距离的测量。人类专家可以通过将检测器(例如,电离室)放置在体模(例如,水体模)中来对期望的剂量和测量结果进行比较,以可视化它们的差异并检查任何差异或验证一致性。如果计算出的剂量不满足预定的剂量测定验证标准,则可以对束模型参数进行进一步的手动调整,直至基于束模型计算出的剂量度量满足预定的剂量测定验证标准。
4、手动调整束模型参数并生成相对应的束模型可能耗时且低效。在一些情况下,人类建模师的任务是例如针对不同能级(例如,6mv、10mv或15mv)以及/或者针对不同类型的准直器生成单独的束模型。束模型参数的手动调整和测试可能需要很长时间来完成,并且需要很高程度的努力。附加地,在一些情况下,手动调整可能会不一致并导致解释错误,特别是对于关于更先进的放射疗法技术(例如,强度调制放射疗法(imrt)或体积调制电弧疗法(vmat))的剂量计划,所述放射疗法技术涉及更复杂的剂量度量和分布表示以及更复杂的剂量计算。例如,imrt剂量给送技术的完整性和复杂性取决于使计划的imrt剂量分布和给送的imrt剂量分布的一致性定量。因此,手动束建模和参数调整可能特别耗时且繁重。
5、本文献讨论了使用基于人工智能(ai)的方法生成束模型的系统、设备和方法。示例性系统包括:存储器,其用于存储经训练的深度学习模型;以及处理器电路,其用于生成束模型。深度学习模型可以被训练以建立机器扫描数据与束模型参数值之间的关系,并且被验证,以实现准确性。处理器电路可以:接收指示放射疗法设备的配置或操作状态的机器扫描数据;将机器扫描数据应用于经训练的深度学习模型以确定束模型参数的值;以及基于所确定的多个束模型参数的值生成束模型。束模型可以被提供给用户或治疗计划系统。
6、根据本文献中讨论的各种示例的基于ai的束建模可以提高先进的放射疗法中的束建模的效率和质量。与常规的手动建模方法相比,如本文中讨论的基于深度学习(dl)的自动束建模可以缩短模型开发和部署周期、减少人类建模者的工作量、提高模型准确性和治疗计划效率。与需要针对模型参数的每个手动调整值的大量剂量计算的手动剂量建模相对,利用如根据本文中的各种示例讨论的基于ai的束建模,可以仅对剂量分布计算一次来确定束模型是否满足给送标准。因此,可以实现对于束建模和治疗计划的总体成本节约并改进放疗。
7、以上内容旨在提供本专利申请的主题的概述。以上内容并不旨在提供本发明的排他性或详尽的解释。本技术包括具体实施方式以提供关于本专利申请的进一步信息。
- 还没有人留言评论。精彩留言会获得点赞!