一种pH响应药物释放的肿瘤靶向制剂及制备方法与流程
一种ph响应药物释放的肿瘤靶向制剂及制备方法
技术领域:
1.本发明属于医用纳米粒子的制备技术领域,具体涉及一种负载抗癌药物blz
‑
945、可靶向传递至肿瘤相关巨噬细胞,且通过ph响应实现药物释放的,一种核壳结构的复合粒子及其制备方法。
技术背景:
2.据近年来研究及临床结果表明,癌细胞在患者体内难以根除,导致癌症极易复发(sci.transl.med.2017,9,eaag2611)。目前,免疫治疗受到持续关注,通过重塑免疫微环境,有望获得持久的免疫监测效果,从而避免肿瘤复发,(biomaterials 178,597
–
607)。在复杂的异质性肿瘤组织中,肿瘤相关巨噬细胞是最丰富的肿瘤浸润性白细胞之一。研究表明,肿瘤相关巨噬细胞在肿瘤微环境中主要表现为抗肿瘤m1亚型和促肿瘤m2亚型,增加m1细胞亚型,减少m2细胞亚型,可以重塑肿瘤微环境,增强抗肿瘤免疫(j.biol.macromol 123,1012
–
1019;j.clin.invest.129,1278
–
1294.)。集落刺激因子1受体能够维持肿瘤相关巨噬细胞的功能,抑制集落刺激因子1受体的功能可以有效重构肿瘤免疫微环境。blz
‑
945是一种高选择性的集落刺激因子1受体的抑制剂,可抑制肿瘤生长(oral oncol.2019,88,29
–
38;j.control.release.2018,277,35
–
47)。
3.因此,将blz
‑
945靶向传递至肿瘤相关巨噬细胞可以有效地抑制肿瘤生长,重新构建肿瘤免疫微环境。目前研究表明,利用纳米粒子的载药能力,并在其表面包覆不同种类的细胞膜进行免疫伪装,可以有效地将药物输送至人体内。红细胞膜具有优异的生物相容性和非免疫原性,其所携带的蛋白质、多糖和唾液酸片段等在抑制免疫攻击中也可以发挥关键作用,从而实现载药纳米粒子在体内的长时间循环,但红细胞膜没有靶向作用到肿瘤细胞的能力(biomaterials 2019,192,292
–
308)。而肿瘤细胞膜则可以借助膜蛋白与肿瘤细胞间的同源结合能力而有效地提升对肿瘤的靶向能力(acs nano 2018,12,5241
–
5252)。因此,在纳米粒子表面包裹红
‑
癌细胞杂化膜可以同时赋予复合材料以免疫伪装特性及肿瘤靶向特性。此外,当复合材料成功作用于肿瘤细胞后,如何成功地将负载药物的纳米粒子暴露于肿瘤细胞成为难点。
技术实现要素:
:
4.本发明的目的在于克服
背景技术:
存在的不足,提供一种ph响应药物释放的肿瘤靶向制剂以及该制剂的制备方法。该复合粒子属于核壳结构纳米粒子,其中,“核”为负载blz
‑
945药物的葡聚糖
‑
聚组氨酸胶束共聚物;“壳”为红
‑
癌细胞杂化膜。该复合粒子具有可以在体内长时间循环、靶向传递药物至肿瘤细胞以及ph响应药物释放的功能。
5.本发明的技术方案如下:
6.一种ph响应药物释放的肿瘤靶向制剂,具有核壳结构,其中,“核”为负载blz
‑
945药物的葡聚糖
‑
聚组氨酸胶束共聚物;“壳”为红
‑
癌细胞杂化膜。
7.一种ph响应药物释放的肿瘤靶向制剂制备方法,首先通过共聚作用制备出葡聚
糖
‑
聚组氨酸胶束共聚物,然后通过疏水作用实现blz
‑
945药物在粒子中的掺杂,最后通过共挤压法完成红
‑
癌细胞杂化膜对纳米粒子的包覆;具体步骤为:首先,将质量比为3:10:1.5:1的葡聚糖、笏甲氧羰基
‑
聚组氨酸、1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐和二甲基氨基吡啶溶于无水二甲基亚砜中,在25℃下搅拌反应48h后,将反应液在去离子水中透析2天,冻干后溶解于体积比为4:1的二甲基亚砜和二乙胺混合液中,放置沉淀后旋转蒸发上清液获得葡聚糖
‑
聚组氨酸胶束共聚物;然后,将质量比为10:3的胶束共聚物和blz
‑
945药物共同溶解于二甲基亚砜中,在25℃条件下搅拌30min,再用去离子水透析24h,0.22μm的聚碳酸酯膜萃取后得到掺杂blz
‑
945药物的共聚物胶束;最后,分别从c57bl/6鼠血液中提取红细胞膜,从小鼠4t1细胞(从410.4瘤株中未经诱变筛得的6
‑
硫鸟嘌噙抗性细胞株)中提取癌细胞膜,与所述掺杂blz
‑
945药物的共聚物胶束混合,其中按质量计,红细胞膜:癌细胞膜:共聚物胶束=1:1:0.5,在37℃条件下超声处理10min后利用0.22μm的聚碳酸酯膜进行挤压,得到红
‑
癌细胞杂化膜包覆的、掺杂blz
‑
945药物的葡聚糖
‑
聚组氨酸胶束共聚物,即所述的ph响应药物释放的肿瘤靶向制剂。
8.本发明利用一种粒径可变载体,通过粒子尺寸对微环境中不同ph的响应情况,使其在到达肿瘤组织后,通过粒子膨胀,导致包覆在其表面的细胞膜破裂,引起载药纳米粒子的外渗,从而促进肿瘤相关巨噬细胞对其进行摄取及内化,重塑肿瘤微环境,实现对肿瘤细胞的抑制作用。此外,m2巨噬细胞膜表面存在特征性的cd206受体,在肿瘤组织的酸性微环境中,通过特殊的ph响应机制,肿瘤靶向制剂中的“核”结构,即掺杂blz
‑
945药物的胶束共聚物,可以涨破表面细胞膜,使葡聚糖暴露并特异性结合cd206受体,进一步提高对肿瘤相关巨噬细胞的靶向性,显著提高其治疗效果。而正常肝脏组织中也存在大量的cd206受体,肿瘤靶向制剂中的“壳”结构,即红
‑
癌细胞杂化膜,可以阻碍其包覆的胶束共聚物(葡聚糖
‑
聚组氨酸共聚物)与肝脏中cd206受体的特异性结合,从而有效避免肿瘤靶向制剂在肝脏中的蓄积。
9.有益效果:
10.1、本发明制备的ph响应药物释放的肿瘤靶向制剂具有良好的生物相容性,无细胞毒性。
11.2、本发明制备的ph响应药物释放的肿瘤靶向制剂中的杂化细胞膜赋予其良好靶向传递药物至肿瘤相关巨噬细胞及体内长时间循环的功能。
12.3、本发明制备的ph响应药物释放的肿瘤靶向制剂在ph<6.9的肿瘤微环境中能够通过载体尺寸膨胀,导致“膜逃逸行为”,而自动释放blz
‑
945药物。
13.4、本发明制备的ph响应药物释放的肿瘤靶向制剂中的杂化细胞膜能够有效减少对肝脏中cd206受体的结合,从而减少药物在肝脏中的蓄积。
14.5、本发明制备的ph响应药物释放的肿瘤靶向制剂能够有效地抑制4t1癌细胞的生长,提升机体存活率。
15.6、本发明制备的ph响应药物释放的肿瘤靶向制剂为其他肿瘤细胞的靶向制剂提供了新的思路。
附图说明:
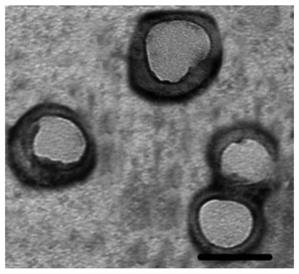
16.图1为本发明实施例1制备的红
‑
癌细胞杂化膜包覆的,掺杂blz
‑
945药物的葡聚
糖
‑
聚组氨酸胶束共聚物的透射电子显微镜照片。
17.图2为本发明实施例2利用动态光散射测定的肿瘤靶向制剂的尺寸随ph的变化情况。
18.图3为本发明实施例3利用传统透析法测定的肿瘤靶向制剂的体外释药行为。
19.图4为本发明实施例4用免疫荧光法观察到的肿瘤相关巨噬细胞、肿瘤靶向制剂以及细胞核在体内的分布情况。
20.图5为本发明实施例5中利用活体成像观察到的细胞膜绿色荧光探针和肿瘤靶向制剂随时间在机体中的蓄积情况。
21.图6为本发明实施例6中测定的空白对照组、blz
‑
945药物以及靶向肿瘤制剂分别对小鼠肿瘤体积的影响。
22.图7为本发明实施例7中测定的对照组、blz
‑
945药物以及靶向肿瘤制剂分别对小鼠生存率的影响。
23.图8为本发明实施例8利用四甲基偶氮唑盐微量酶反应比色法测定的不同剂量肿瘤靶向制剂分别对4t1细胞与巨噬细胞活性的影响。
具体实施方式:
24.以下是本发明的具体实施例用的基本条件,但本发明能实施的范围并不限于这些条件,也不限于这些实施例:
25.环境温度25℃,1个大气压;
26.笏甲氧羰基
‑
聚组氨酸,分子量1200g/mol。
27.葡聚糖,分子量500000g/mol。
[0028]1‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐,分子量191.7g/mol。
[0029]4‑
二甲氨基吡啶,分子量122.2g/mol。
[0030]
blz
‑
945,分子量398.5g/mol。
[0031]
二甲基亚砜,分子量78.1g/mol。
[0032]
二乙胺,分子量74.1g/mol
[0033]
实施例1:
[0034]
首先,将30mg葡聚糖、100mg笏甲氧羰基
‑
聚组氨酸、15mg 1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐和10mg二甲基氨基吡啶溶于10ml无水二甲基亚砜中,在25℃下搅拌反应48h后,将反应液在去离子水中透析2天,冻干后溶解于4ml二甲基亚砜和1ml二乙胺中,放置沉淀后旋转蒸发上清液获得葡聚糖
‑
聚组氨酸胶束共聚物。然后,将10mg胶束共聚物与3mg blz
‑
945共同溶解于二甲基亚砜中,在25℃条件下搅拌30min,再用去离子水透析24h,0.22μm的聚碳酸酯膜萃取后得到掺杂blz
‑
945药物的共聚物胶束。最后,分别从c57bl/6鼠血液中提取红细胞膜,从小鼠4t1细胞中提取癌细胞膜,与掺杂blz
‑
945药物的胶束共聚物混合,其中按质量计,红细胞膜:癌细胞膜:胶束共聚物=1:1:0.5,在37℃条件下超声处理10min后利用0.22μm的聚碳酸酯膜进行挤压,得到红
‑
癌细胞杂化膜包覆的,掺杂blz
‑
945药物的葡聚糖
‑
聚组氨酸胶束共聚物,即肿瘤靶向制剂,其透射电镜照片如图1所示。可以看出本实施例制备的肿瘤靶向制剂为核壳结构的纳米粒子。
[0035]
实施例2:
[0036]
取实施例1制备的肿瘤靶向制剂,利用磷酸缓冲液在7.4
‑
6.3范围内调节其所处ph环境,并利用动态光散射测定其粒子尺寸。其尺寸变化结果如图2所示。当环境ph从7.4调节至6.9时,肿瘤靶向制剂的尺寸出现明显的增大现象,并在ph=6.7时达到最大值。这说明实施例1制备的肿瘤靶向制剂的尺寸直接受到微环境ph的影响。
[0037]
实施例3:
[0038]
将两等份实施例1制备的肿瘤靶向制剂分别在ph=7.4和ph=6.5的tween 80溶液中透析,并在37℃、100rpm/min的摇动培养箱中培养。每2小时取样并加入到等体积的释放介质中,然后利用高效液相色谱分别测定不同ph条件下blz
‑
945的累积释放率,测定结果如图3所示。可以看出实施例1制备的肿瘤靶向制剂在ph=7.4和ph=6.5的环境中,药物释放率分别约为37%和65%,说明实施例1制备的肿瘤靶向制剂在ph=6.5的环境中具有更高的药物释放率。
[0039]
实施例4:
[0040]
利用细胞膜绿色荧光探针对实施例1制备的肿瘤靶向制剂进行免疫荧光染色,并分别向两组荷瘤小鼠注射单独的细胞膜绿色荧光探针及细胞膜绿色荧光探针染色后的肿瘤靶向制剂,其4t1肿瘤组织石蜡切片的共聚焦显微镜照片如图4所示。其中,注射染色后靶向制剂的小鼠组织切片照片中,绿色荧光代表染色后的肿瘤靶向制剂在肿瘤组织的聚集,黄色荧光代表纳米颗粒与肿瘤相关巨噬细胞共定位,表明纳米颗粒具有较强的在肿瘤细胞中的聚集能力以及对肿瘤相关巨噬细胞的靶向性。(注:由于专利附图不支持彩色,因此所述的绿色荧光在附图4中已转变成浅灰色,所述的黄色荧光在图4中已转变成亮白色)
[0041]
实施例5:
[0042]
利用细胞膜绿色荧光探针对肿瘤靶向制剂进行染色,分别向荷瘤小鼠体内注射细胞膜绿色荧光探针及细胞膜绿色荧光探针染色后的肿瘤靶向制剂。经过2、6、12及24h后,利用小动物活体成像系统观察小鼠,细胞膜绿色荧光探针及染色后肿瘤靶向制剂的分布情况如图5所示。制剂在体内循环24h后,注射了染色后肿瘤靶向制剂的小鼠肿瘤部位,荧光强度显著增强,而肝脏的荧光强度则明显下降。说明了实施例1制备的肿瘤靶向制剂具有足够的肿瘤靶向性,并避免了肝脏蓄积。
[0043]
实施例6:
[0044]
将荷瘤小鼠分为对照组、blz
‑
945药物组以及肿瘤靶向制剂组,每组16只。每2天经尾静脉分别做如下处理:无处理、给药5次blz
‑
945以及给药5次实施例1制备的肿瘤靶向制剂,其中,所有给药组的blz
‑
945浓度均为5mg/kg。利用小动物活体成像系统每隔两天测定小鼠肿瘤长宽,并利用公式:肿瘤体积=1/2
×
长
×
宽
×
宽,计算小鼠肿瘤体积,其肿瘤体积计算结果如图6所示。可以看出,肿瘤靶向制剂组的小鼠肿瘤体积一直明显低于对照组以及blz
‑
945药物组,第16天时,肿瘤靶向制剂组的小鼠肿瘤体积仅为416立方毫米,而对照组则高达1186立方毫米。这说明实施例1制备的肿瘤靶向制剂能够有效地抑制肿瘤生长。
[0045]
实施例7:
[0046]
将荷瘤小鼠分为对照组、blz
‑
945药物组以及肿瘤靶向制剂组,每组16只。每2天经尾静脉分别做如下处理:无处理、给药5次blz
‑
945以及给药5次实施例1制备的肿瘤靶向制剂,其中,所有给药组的blz
‑
945浓度均为5mg/kg。利用公式:生存率=存活小鼠数量/16,计算60天内每组小鼠的生存率,其生存率计算结果如图7所示。可以看出,肿瘤靶向制剂组的
小鼠生存率一直远远高于对照组和blz
‑
945药物组,第60天时,生存率仍高达68%。这说明实施例1制备的肿瘤靶向制剂能够有效地提升小鼠生存率。
[0047]
实施例8:
[0048]
采用四甲基偶氮唑盐微量酶反应比色法分别测定肿瘤靶向制剂对4t1细胞和骨髓衍生巨噬细胞的细胞毒性。分别将4t1细胞和骨髓衍生巨噬细胞接种于96孔细胞培养板,在37℃,5%co2培养箱中孵育过夜。每孔加入不同浓度梯度的实施例1制备的肿瘤靶向制剂,在37℃,5%co2培养箱中孵育48小时,倒置显微镜下观察。每孔加入20μl噻唑蓝溶液(5mg/ml),继续培养4小时后,弃去孔内培养液,每孔加入100μl二甲基亚砜溶液,摇床上低速震荡10分钟,使结晶物充分溶解。利用酶联免疫检测仪,在490nm处测量各孔的吸光值,计算实施例1制备的肿瘤靶向制剂对细胞的影响。其细胞活性结果如图8所示。当肿瘤靶向制剂浓度达到500μg/ml时,细胞存活率仍可达到90%,说明实施例1制备的肿瘤靶向制剂具有良好的生物相容性,可认为其无细胞毒性(j.control.release 2012,164,338
–
345)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1