5%规格的葡萄糖酸钙口服溶液及其制备方法与流程
1.本发明属于药物制剂技术领域,具体涉及一种5%规格的葡萄糖酸钙口服溶液及其制备方法。
背景技术:
2.葡萄糖酸钙是常用的有机补钙剂之一,其原料药及相关制剂各国药典均有收载。《中国药典》2015年版二部、2020年版二部均收载了葡萄糖酸钙口服溶液、葡萄糖酸钙片、葡萄糖酸钙含片、葡萄糖酸钙注射液、葡萄糖酸钙颗粒、复方葡萄糖酸钙口服溶液等6种制剂。葡萄糖酸钙口服溶液为我国特有制剂品种,国外药典如《美国药典》、《欧洲药典》、《日本药局方》等均未见收载。
3.葡萄糖酸钙口服溶液,是以葡萄糖酸钙为主药成分,并添加适量辅料制成的剂型为口服溶液剂的药物制剂,可用于预防和治疗钙缺乏症,如骨质疏松、手足抽搐症、骨发育不全、佝偻病以及儿童、妊娠和哺乳期妇女、绝经期妇女、老年人钙的补充。目前国内批准生产的葡萄糖酸钙口服溶液均为10%(10ml:1g)规格。《中国药典》2000年版二部收载了规格为10%(10ml:1g)的葡萄糖酸钙口服溶液处方,其处方组成为:葡萄糖酸钙100g,乳酸5g,氢氧化钙0.5g,蔗糖200g,香精适量,加水制成1000ml。
4.葡萄糖酸钙原料在水中的溶解度不大,1份葡萄糖酸钙需要30份冷水或5份沸水才能完全溶解。而目前国内批准生产的葡萄糖酸钙口服溶液均为10%(10ml:1g),约为其冷水中溶解度的3.3倍。由于药液本身为过饱和溶液,尽管加入适量的助溶剂,在制备及贮存过程中仍易有白色固体物质析出,药物稳定性不好,影响药品质量及临床用药安全。
5.著名药剂学家和药学教育家顾学裘早在1964年就曾发文《葡萄糖酸钙注射液的稳定问题》,对同样是10%规格的另一种剂型葡萄糖酸钙注射液提出“10%葡萄糖酸钙注射液是一种过饱和浓液,在贮藏期间极易析出沉淀
……”
其后至今的几十年中,不断有专家学者撰文指出10%葡萄糖酸钙口服溶液过饱和易析晶的质量风险。同时,各级药监部门的抽检结果也印证该规格产品的隐患,众多厂家多批次抽检不合格,原因均为“可见异物”。
6.根据公开的文献及专利信息,近年来有研究对处方中的辅料进行改良,以提高葡萄糖酸钙口服溶液的稳定性。检索到的专利文献如:申请号为201910935824.0的中国专利公开了一种葡萄糖酸钙口服溶液及其制备方法,该发明所述的组合物包括以下成分:每1000ml葡萄糖酸钙口服溶液中含葡萄糖酸钙80~120g,乳酸1~2g、月桂酸聚乙二醇甘油酯0.5g~2g,三氯蔗糖0.1g~0.5g,氢氧化钠0.05g~0.2g,香精0.05g~0.2g;该发明中各组分协同作用,制备得到的葡萄糖酸钙口服溶液的稳定性与安全性能得到了提高。又如,申请号为201810608904.0的中国专利公开了一种葡萄糖酸钙
‑
l
‑
乳酸钙口服液及其制备方法,该口服液包括以下原料组成:葡萄糖酸钙45
‑
60重量份;l
‑
乳酸钙38
‑
48重量份;乳酸2
‑
5重量份;纯化水900
‑
1100重量份;其中l
‑
乳酸钙中d
‑
乳酸钙含量≤2.0wt%,以上成分相互配合制得具有较高含钙量和稳定性的口服液。
7.但是现有技术在改良时使用了月桂酸聚乙二醇甘油酯等表面活性剂替代原处方
中的氢氧化钙及乳酸作为增溶剂以解决葡萄糖酸钙口服溶液过饱和易析晶的问题。辅料种类及用量的改变,特别是使用表面活性剂作为增溶剂等关键性辅料的变更,可能会引起药物生物利用度的改变,影响产品的疗效。根据国家药品审评中心《已上市化学药品变更研究的技术指导原则(一)》的要求,对药物的处方、辅料、工艺等方面的变更,不应导致药用物质基础的改变,变更对产品的安全性、有效性和质量可控性应不产生影响。
8.因此,在对葡萄糖酸钙口服溶液的处方进行改良方面,若能保持原处方中所用辅料的种类没有改变,通过改变各原料组分的用量进行解决葡萄糖酸钙口服溶液过饱和易析晶的质量风险问题,对葡萄糖酸钙口服溶液的药物稳定性及用药安全性具有重要的意义。
技术实现要素:
9.本发明的目的在于针对目前国内10%规格葡萄糖酸钙口服溶液质量不稳定的问题,而提供的一种5%规格的葡萄糖酸钙口服溶液及其制备方法,既可较好解决葡萄糖酸钙过饱和溶液易析晶的问题,又不会引起药用物质基础的改变,对药物的吸收、利用不会产生明显影响,不会引起安全性、有效性的明显改变。
10.为实现上述目的,本发明采用如下技术方案:一种5%(10ml:0.5g)规格的葡萄糖酸钙口服溶液,其处方组成为:葡萄糖酸钙
ꢀꢀꢀꢀꢀꢀꢀ
50g;乳酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2~5g;氢氧化钙
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.2~0.5g;蔗糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
80~200g;香精
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.05~0.2ml;纯化水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
加至1000ml。
11.所述的5%(10ml:0.5g)规格的葡萄糖酸钙口服溶液,其制备方法步骤如下:(1)按处方量,取氢氧化钙、乳酸与适量纯化水,搅拌溶解,制成乳酸钙液体备用;(2)取配制液总量70%的纯化水,加热煮沸,加入处方量的葡萄糖酸钙,搅拌使其溶解完全,得到葡萄糖酸钙液体;(3)将上述乳酸钙液体和葡萄糖酸钙液体混合均匀,加入蔗糖溶解,再加入香精,用新沸过的纯化水调整总量至1000ml,搅拌均匀;(4)过滤,灌装,灭菌;(5)灯检,包装,即得。
12.本发明通过大量的试验研究发现,降低溶液中葡萄糖酸钙的浓度至5%,对原处方的辅料用量进行调整,能够使葡萄糖酸钙口服溶液达到一个较好的平衡稳定溶液体系。既可较好解决葡萄糖酸钙过饱和溶液易析晶的问题,又不会引起药用物质基础的改变,对药物的吸收、利用不会产生明显影响,不会引起安全性、有效性的明显改变。而且大量的试验研究表明,规格为5%(10ml:0.5g)的葡萄糖酸钙口服溶液,质量更为稳定,且只需要将制剂服用量调整为原规格的2倍,即[用法用量]由“口服。一次10~20毫升,一日3次”调整为“口服。一次20~40毫升,一日3次”,即可保证主药葡萄糖酸钙每次服用量不变,并不会影响药品的临床使用疗效。
[0013]
本发明的有益效果为:
本发明从药物稳定性及用药安全性角度考虑,通过降低溶液中葡萄糖酸钙的浓度,解决了现有技术中10%葡萄糖酸钙过饱和溶液存在的药物稳定性不好,易析晶,影响药品质量及临床用药安全的问题,而且本发明在辅料选择方面,本发明对辅料的种类没有进行变更,依然使用原10%处方的辅料,只是在原处方的基础上对辅料用量进行调整,属于《已上市化学药品变更研究的技术指导原则(一)》中的ⅰ类微小变更,不会引起药用物质基础的改变,对药物的吸收、利用不会产生明显影响,不会引起安全性、有效性的明显改变。
[0014]
本发明制备的5%规格的葡萄糖酸钙口服溶液具有制备工艺简单、质量优、稳定性与安全性能高等优点,将本发明制备得到的5%(10ml:0.5g)规格的葡萄糖酸钙口服溶液产品进行低温试验、6个月的加速试验和24个月长期试验,按葡萄糖酸钙口服溶液质量标准中性状、鉴别、检查、微生物限度、含量测定等考察项目进行检测,各项重点考察项目数据合格,与0月比较均无明显变化。发明人经过研究发现,5%规格的葡萄糖酸钙口服溶液的稳定性、安全性等各项性能都很优异、是一种克服10%规格葡萄糖酸钙口服溶液存在的不足,取代10%规格葡萄糖酸钙口服溶液的理想产品。经查询,未见国内有研发规格为5%(10ml:0.5g)的葡萄糖酸钙口服溶液并获得国家药品监督管理局批文的公开文献报道。
具体实施方式
[0015]
实施例1一种5%(10ml:0.5g)规格的葡萄糖酸钙口服溶液,其处方组成为:葡萄糖酸钙50g;乳酸2g;氢氧化钙0.5g;蔗糖80g;香精0.2ml;纯化水 加至1000ml。
[0016]
其制备方法步骤如下:(1)按处方量,取氢氧化钙、乳酸与适量纯化水,搅拌溶解,制成乳酸钙液体备用;(2)取配制液总量70%的纯化水,加热煮沸,加入处方量的葡萄糖酸钙,搅拌使其溶解完全,得到葡萄糖酸钙液体;(3)将上述乳酸钙液体和葡萄糖酸钙液体混合均匀,加入蔗糖溶解,再加入香精,用新沸过的纯化水调整总量至1000ml,搅拌均匀;(4)过滤,灌装,灭菌;(5)灯检,包装,即得。
[0017]
实施例2一种5%(10ml:0.5g)规格的葡萄糖酸钙口服溶液,其处方组成为:葡萄糖酸钙50g;乳酸3g;氢氧化钙0.3g;蔗糖120g;香精0.1ml;纯化水 加至1000ml。
[0018]
其制备方法步骤如下:(1)按处方量,取氢氧化钙、乳酸与适量纯化水,搅拌溶解,制成乳酸钙液体备用;(2)取配制液总量70%的纯化水,加热煮沸,加入处方量的葡萄糖酸钙,搅拌使其溶解完全,得到葡萄糖酸钙溶液液体;(3)将上述乳酸钙液体和葡萄糖酸钙液体混合均匀,加入蔗糖溶解,再加入香精,用新沸过的纯化水调整总量至1000ml,搅拌均匀;(4)过滤,灌装,灭菌;(5)灯检,包装,即得。
[0019]
实施例3
一种5%(10ml:0.5g)规格的葡萄糖酸钙口服溶液,其处方组成为:葡萄糖酸钙50g;乳酸5g;氢氧化钙0.2g;蔗糖200g;香精0.05ml;纯化水加至1000ml。
[0020]
其制备方法步骤如下:(1)按处方量,取氢氧化钙、乳酸与适量纯化水,搅拌溶解,制成乳酸钙液体备用;(2)取配制液总量(体积)70%的纯化水,加热煮沸,加入处方量的葡萄糖酸钙,搅拌使其溶解完全,得到葡萄糖酸钙液体;(3)将上述乳酸钙液体和葡萄糖酸钙液体混合均匀,加入蔗糖溶解,再加入香精,用新沸过的纯化水调整总量至1000ml,搅拌均匀;(4)过滤,灌装,灭菌;(5)灯检,包装,即得。
[0021]
稳定性研究为了考察本发明5%规格的葡萄糖酸钙口服溶液的质量稳定性,发明人按照《中国药典》2015年版四部“原料药物与药物制剂稳定性试验指导原则(通则9001)”及《化学药物(原料药和制剂)稳定性研究技术指导原则》的要求进行低温、加速、长期稳定性试验考察,取本发明实施例2中制备得到的5%(10ml:0.5g)规格的葡萄糖酸钙口服溶液作为试样,并与10%(10ml:1g)规格的葡萄糖酸钙口服溶液稳定性数据进行比较,具体如下:1、低温试验取两种规格的葡萄糖酸钙口服溶液样品,模拟上市包装,先于2~8℃放置2天,再在40℃放置2天,循环三次,取样按质量标准中性状、鉴别、检查、微生物限度、含量测定等考察项目进行检测。
[0022]
2、加速试验取两种规格的葡萄糖酸钙口服溶液样品,模拟上市包装,于温度40℃
±
2℃,相对湿度75%
±
5%条件下放置6个月,分别于0、1、2、3、6个月末取样测定,按质量标准中性状、鉴别、检查、微生物限度、含量测定等考察项目进行检测。
[0023]
3、长期试验取两种规格的葡萄糖酸钙口服溶液样品,模拟上市包装,于温度25℃
±
2℃、相对湿度60%
±
5%条件下放置24个月,分别于0、3、6、9、12、18、24个月末取样,按质量标准中性状、鉴别、检查、微生物限度、含量测定等考察项目进行检测。
[0024]
4、试验结果5%(10ml:0.5g)规格的葡萄糖酸钙口服溶液样品,经低温试验、6个月的加速试验和24个月长期试验,各项重点考察项目数据合格,与0月比较均无明显变化。
[0025]
10%(10ml:1g)规格的葡萄糖酸钙口服溶液样品,经低温试验、6个月的加速试验和24个月长期试验,有不同程度的析晶现象,性状检查不符合本品质量标准的规定。
[0026]
5、研究结论5%(10ml:0.5g)规格的葡萄糖酸钙口服溶液经稳定性试验考察,证实产品两年内质量稳定。
[0027]
两种规格葡萄糖酸钙口服溶液稳定性试验数据比较结果,证实5%(10ml:0.5g)规格较10%(10ml:1g)规格的葡萄糖酸钙口服溶液质量更为稳定。
[0028]
质量检测
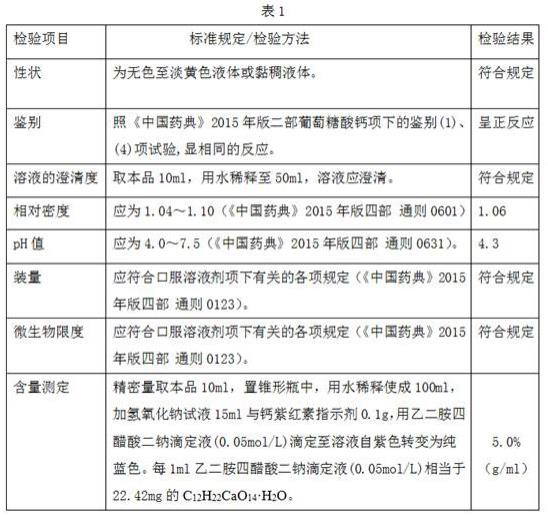
将本发明实施例2中制备得到的5%(10ml:0.5g)规格的葡萄糖酸钙口服溶液产品进行质量检测,检测结果如下表1所示:上述可见,采用本发明方法制备得到的5%(10ml:0.5g)规格的葡萄糖酸钙口服溶液产品的各项检测项目结果均符合葡萄糖酸钙口服溶液质量的有关规定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1