锰磷化钙包裹装载AIPH硒化铋纳米颗粒的制备方法与流程
锰磷化钙包裹装载aiph硒化铋纳米颗粒的制备方法
技术领域
1.本发明涉及纳米材料的合成领域,更具体地涉及制备从硒化铋、装载偶氮引发剂aiph的硒化铋和最终通过生物矿化生成的锰磷化钙包裹装载aiph硒化铋纳米颗粒及各步骤的具体方法。
背景技术:
2.光热治疗作为一种新兴且基于近红外光的无创治疗方式受到很多人的关注,光热治疗具有毒副作用小,治疗效果明显等优点,开发具有光热转化效率高的光热转化剂是实现高效的光热治疗的关键。硒化铋纳米颗粒作为一种光热剂,在肿瘤的光热治疗方面具有很大潜力,尤其在近红外二区,硒化铋纳米颗粒展现出较高的吸收,给肿瘤的光热治疗创造了很好的条件。除此之外,硒化铋纳米颗粒的制备成本低,且具有良好的生物相容性。然而,单一的光热治疗对肿瘤的效果有限,很难将肿瘤细胞彻底清除,需要协同其他治疗方式促进对肿瘤的高效治疗。
3.肿瘤内部由于缺氧,导致以光动力、声动力为代表的依赖于氧气浓度的治疗方式受到很大限制。偶氮化合物是一类可产生自由基的化合物,其产生自由基不取决于氧气浓度,而是依赖于温度,而且这类化合物价格低廉,双亲性好,在工业生产以及聚合物反应中较为常见。aiph作为其中一种偶氮化合物,在高温下产生的自由基可损伤肿瘤细胞的细胞膜,破坏肿瘤细胞的线粒体,增加细胞内活性氧的含量,造成细胞凋亡,结合硒化铋纳米颗粒的光热作用,能够进一步增强光热作用对肿瘤细胞的杀伤。
4.生物矿化是指生物体通过生物大分子的调控生成无机矿物的过程,通过利用生物矿化的方法在纳米颗粒外生长一层锰磷化钙外壳来防止纳米药物的泄漏,特异性的将药物运送到肿瘤部位。2019年黄鹏课题组利用生物矿化的方法将葡萄糖氧化酶靶向到肿瘤区域,实现化学动力治疗与“饥饿”治疗的协同效应。锰磷化钙包裹装载aiph的硒化铋纳米颗粒生物相容性好,能够特异性的靶向到肿瘤部位,结合成像信息实现诊疗一体化。
技术实现要素:
5.由于目前用于治疗肿瘤的纳米药物依赖于细胞内氧气的浓度,靶向效率低,体内循环时间短,本发明旨在合成一种不依赖于氧气浓度可产生自由基,靶向性高,生物相容性好并实现光热和自由基协同治疗的新型药物递送平台。
6.本发明的技术方案具体如下:锰磷化钙包裹装载aiph硒化铋纳米颗粒的制备方法,其特征在于:包含以下步骤:(1)将一定量的五水合硝酸铋加入硝酸溶液中,然后磁力搅拌至五水合硝酸铋完全溶解,得到含有五水合硝酸铋的混合溶液;(2)往步骤(1)得到的混合溶液中按顺序加入一定量的氢氧化钠、聚乙烯吡咯烷酮pvp、乙二醇,并将得到的溶液放到反应釜中150 ℃保持3 h,经二次水净化5次,离心干燥得到氧化铋纳米粒子;
(3)将步骤(2)得到的氧化铋纳米粒子溶于水中,得到氧化铋纳米粒子水溶液,并与含一定量抗坏血酸和硒酸钠的溶液混合,将得到的混合溶液放到反应釜中150 ℃保持12 h,经二次水净化5次,离心干燥得到硒化铋纳米粒子;(4)将步骤(3)得到的硒化铋纳米粒子溶于水中,得到硒化铋纳米粒子水溶液,往其中加入一定量偶氮引发剂aiph后,室温磁力搅拌12 h,离心冷冻干燥得到载有aiph的硒化铋纳米粒子;(5)往tris hcl缓冲液中加入一定量的氯化钙和氯化锰,室温磁力搅拌至氯化钙和氯化锰完全溶解,得到含氯化钙和氯化锰的tris hcl溶液;(6)往hepes缓冲液中加入一定量的磷酸氢二钠,室温磁力搅拌至磷酸氢二钠完全溶解,得到含磷酸氢二钠的hepes溶液,并与步骤(5)得到的含氯化钙和氯化锰的tris hcl溶液混合,得到混合溶液;(7)将步骤(4)得到的载有aiph的硒化铋纳米粒子溶于水中,得到一定浓度的硒化铋纳米粒子水溶液,将其加入到步骤(6)得到的混合溶液中,在30 ℃下保持4 h,离心冷冻干燥得到生物矿化的锰磷化钙包裹装载aiph硒化铋纳米颗粒。
7.进一步的,所述步骤(1)中的硝酸的浓度为1
×
10
‑
4 mol/l ~ 1
×
10
‑
3 mol/l;所述步骤(1)中的五水合硝酸铋的浓度为1
×
10
‑
2 mol/l ~ 1
×
10
‑
1 mol/l。
8.进一步的,所述步骤(2)中的氢氧化钠与pvp质量比为1:11;所述步骤(2)中的乙二醇浓度为9
×
10
‑
2 mol/l ~ 9
×
10
‑
1 mol/l;所述步骤(2)中离心的转速为8000 rpm,离心的时间为10 min。
9.进一步的,所述步骤(3)中抗坏血酸与硒酸钠质量比为3:1,所述步骤(3)中离心的转速为8000 rpm,离心的时间为10 min。
10.进一步的,所述步骤(4)中的载有aiph的硒化铋纳米粒子中的硒化铋纳米粒子与aiph的质量比为1:20;所述步骤(4)中离心的转速为8000 rpm,离心的时间为10 min。
11.进一步的,所述步骤(5)中tris hcl缓冲液浓度为2
×
10
‑
3 mol/l ~ 2
×
10
‑
2 mol/l;所述步骤(5)中含氯化钙和氯化锰的tris hcl溶液中氯化钙浓度为3
×
10
‑
2 mol/l ~ 3
×
10
‑
1 mol/l;所述步骤(5)中含氯化钙和氯化锰的tris hcl溶液中的氯化锰浓度为3
×
10
‑
3 mol/l ~ 3
×
10
‑
2 mol/l。
12.进一步的,所述步骤(6)中hepes缓冲液浓度为2
×
10
‑
3 mol/l ~ 2
×
10
‑
2 mol/l;所述步骤(6)中含磷酸氢二钠的hepes溶液中磷酸氢二钠浓度为8
×
10
‑
4 mol/l ~ 8
×
10
‑
3 mol/l;所述步骤(6)中含氯化锰和氯化钙的tris hcl溶液与含磷酸氢二钠的hepes溶液体积比为1:1。
13.进一步的,所述步骤(7)中硒化铋纳米粒子水溶液浓度为2
×
10
‑
4 mol/l ~ 2
×
10
‑
3 mol/l;所述步骤(7)中离心的转速为8000 rpm,离心的时间为10 min。
14.本发明主要优点有:针对目前纳米药物载体存在的不足,本发明创造性地提出一种在实现多种治疗方式协同治疗的同时又具有较好生物相容性的纳米药物递送平台。本发明中,硒化铋纳米颗粒用于光热治疗,aiph可在光热的条件下分解产生自由基,同时锰磷化钙外壳可防止纳米药物的泄漏,提高纳米递送系统的生物相容性,靶向到肿瘤区域。整个纳米药物递送平台能有效提高治疗效果,减小对正常组织的伤害,解决纳米递送平台的靶向性和协同性等问题,
实现肿瘤的高效治疗。
附图说明
15.为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图:图1为本发明实施例1中锰磷化钙包裹装载aiph硒化铋纳米颗粒的治疗流程图。
16.图2为本发明实施例1中锰磷化钙包裹装载aiph硒化铋纳米颗粒的透射电镜图。
17.图3为本发明实施例1中锰磷化钙包裹装载aiph硒化铋纳米颗粒的动态光散射水合粒径分布图。
18.图4为本发明实施例1中锰磷化钙包裹装载aiph硒化铋纳米颗粒的xps图。
19.图5为本发明实施例1中锰磷化钙包裹装载aiph硒化铋纳米颗粒的体外光热效果图。
20.图6为本发明实施例1中锰磷化钙包裹装载aiph硒化铋纳米颗粒的esr能谱图。
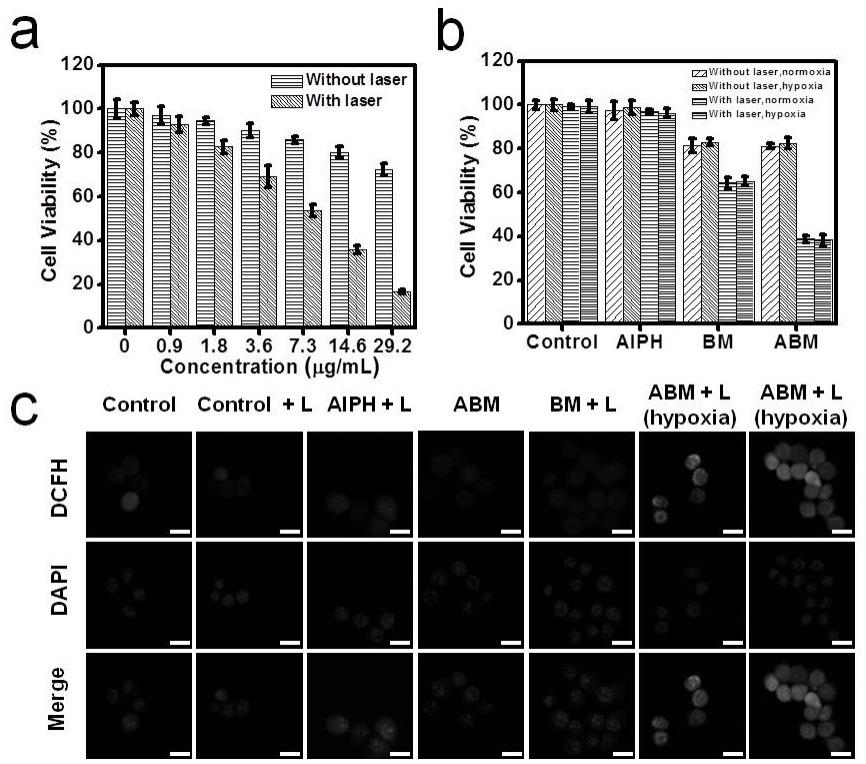
21.图7为本发明实施例1中锰磷化钙包裹装载aiph硒化铋纳米颗粒对4t1癌细胞的体外毒性图。
22.图8为本发明实施例1中锰磷化钙包裹装载aiph硒化铋纳米颗粒在小鼠体内光声成像图。
23.图9为本发明实施例1中锰磷化钙包裹装载aiph硒化铋纳米颗粒在小鼠体内血常规结果图。
具体实施方式
24.以下实施例用于说明本发明,但不用来限制本发明的范围。
25.实施例1制备锰磷化钙包裹装载aiph硒化铋纳米颗粒锰磷化钙包裹装载aiph硒化铋纳米颗粒作用原理如图1所示,包含如下的制备步骤:(1)硒化铋纳米颗粒的制备:将0.182 g五水合硝酸铋完全溶于5 ml 1 mol/l的硝酸溶液中,然后加入0.054 g氢氧化钠、0.6 g pvp、25 ml乙二醇,得到混合溶液,将混合溶液加入不锈钢高压釜中,并在150 ℃保持3 h,用二次水净化5次,离心干燥得到氧化铋纳米颗粒。将0.1 g硒酸钠和0.3 g抗坏血酸溶解于30 ml水中,然后加入10 ml 5mg/ml氧化铋纳米粒子溶液,得到混合溶液,将混合溶液转移到不锈钢高压釜中并在150 ℃保持12 h,用去离子水净化5次,离心后在50 ℃真空烘箱中干燥过夜得到硒化铋纳米颗粒。
26.(2)装载aiph的硒化铋纳米颗粒的制备:将10 mg的硒化铋纳米颗粒溶解在含有0.2 g aiph的5 ml水溶液中,室温磁力搅拌12 h,离心洗涤2次,冷冻干燥得到装载aiph的硒化铋纳米颗粒。
27.(3)锰磷化钙包裹装载aiph硒化铋纳米颗粒的制备:配制含2.5
×
10
‑
1 mol/l氯化钙和2
×
10
‑
2 mol/l氯化锰的浓度为1
×
10
‑
2 mol/l tris hcl混合溶液1,然后配制含6
×
10
‑
3 mol/l磷酸氢二钠的浓度为1
×
10
‑
2 mol/lhepes混合溶液2,取混合溶液1和2各4 ml,然后加入10 mg装载aiph的硒化铋纳米颗粒,在30 ℃下磁力搅拌4 h,离心洗涤,冷冻干燥得到锰磷化钙包裹装载aiph硒化铋纳米颗粒。
28.其肿瘤治疗原理模式图见图1。图2为纳米颗粒的透射电镜图,可以看出纳米颗粒
的平均粒径在190 nm左右。图3纳米颗粒水合粒径约为312 nm,大于tem的测试结果。图4 xps能谱图测定了纳米颗粒的化学成分,证明纳米颗粒的合成。图5体外不同浓度的光热曲线证明了纳米颗粒有良好的光热转换能力。图6的esr能谱图验证了纳米颗粒在近红外照射下温度升高产生自由基的能力。图7是所得纳米颗粒对4t1癌细胞体外毒性情况。从图(7a)中可以看出没有近红外光照射纳米颗粒对细胞毒性较小,只有在近红外光照射的条件下才会对4t1细胞产生大的毒性。不同处理组下,所得最终的纳米颗粒毒性最大,而且对细胞的毒性不依赖于氧气的浓度(7b),同时最终纳米颗粒毒性的增强说明自由基的产生,自由基的产生也增加了细胞内活性氧的水平(7c)。图8的荷瘤小鼠光热成像图体现了该纳米颗粒用作光声成像造影剂的能力。图9为所得纳米颗粒对balb/c小鼠生物相容性检测结果图,从图中可以看出静脉注射纳米颗粒后,不同时间点的血液指标与空白组相比并无明显差距,证明纳米颗粒具有较高的生物相容性。
29.最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其做出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1