一种新型抗炎纳米药物FA-PEG-R-NPs@si-IRE1α
一种新型抗炎纳米药物fa
‑
peg
‑
r
‑
nps@si
‑
ire1
α
技术领域
1.目前,临床使用的大多数抗炎、抗风湿药物大多具有胃肠道反应、骨髓移植、耐药性,恶性肿瘤发生等负面作用,这些负面作用极大地限制了药物的持续使用。因此,研发治疗ra等新型抗炎药物至关重要。本发明涉及一种新型的抗炎纳米药物fa
‑
peg
‑
r
‑
nps@si
‑
ire1α,通过多功能纳米材料系统靶向巨噬细胞给药si
‑
ire1α,待si
‑
ire1α进入巨噬细胞后整合到argonaute蛋白家族,形成rna诱导的沉默复合物(rna
‑
induced silencingcomplex,risc),随后靶向识别ire1αmrna并诱导ire1αmrna切割和降解、沉默ire1αmrna表达,进一步调控巨噬细胞等免疫细胞减少促炎性因子的释放,从而起到减轻关节局部炎症、调节全身免疫状态和减轻疼痛的效果。此发明属于医药卫生领域,可以直接应用于骨外科或创伤修复等临床和基础医学领域。
2.人类肌醇依赖性激酶1(inositol
‑
requiring enzyme 1α,ire1α),由ern1 基因编码,是内质网上的一种跨膜蛋白,具有i型跨膜丝/苏氨酸蛋白激酶和位点特异的核糖核酸内切酶两种酶活性,作为upr重要分子传感器,在细胞处于 er stress时被激活。er stress参与机体许多慢性炎症的发生和发展,机体免疫细胞中激活的er stress与upr信号通路ire1a通过调控促炎因子和抗炎因子的释放,参与控制炎症和疼痛相关的转录和代谢程序,参与炎症反应和炎症过程。
3.我们前期研究发现ire1α作为一个负调控因子,通过抑制gep介导的软骨形成,调控ihh/pthrp信号通路抑制软骨生长,这一调节作用依赖于ire1α的rnase和kinase两个酶活性结构域。进而在类风湿性关节炎患者和骨关节炎患者的关节滑液、滑膜成纤维细胞中检测发现:与对照组相比,ire1α和xbp1s 表达增加、xbp1u表达减少;在正常小鼠和cia模型小鼠关节滑膜成纤维细胞中检测ire1α表达和磷酸化激活均增加;过表达ad
‑
ire1α上调巨噬细胞炎性细胞因子的表达水平(tnfa、il
‑
6、il
‑
1β)上调;ern1
‑
/
‑
缺陷细胞中,致炎因子tnfa、il
‑
1β和lps处理后,il6表达下调;此外,siire1α具有促进t淋巴细胞增生,诱导cd4
+
cd25
+
foxp3
+
treg细胞免疫应答,说明siire1a具有一定抗炎症作用。
4.多功能纳米材料具有很好的靶向性,我们联合多功能纳米材料与sirna 载体特点,设计如下抗炎纳米药物:首先,合成含有二硫键的两亲性氧化还原敏感型阳离子脂质(ss
‑
pbaa
‑
pei,简称nps),并接枝细胞穿膜肽rkkrrqrrr,即合成为ss
‑
pbaa
‑
pei
‑
rkkrrqrrr(简称r
‑
nps),随后静电吸附si
‑
ire1α,自组装形成核心聚合物纳米粒子(r
‑
nps@si
‑
ire1α)。然后利用ph敏感型聚乙二醇(peg)材料进行表面修饰,并最终接枝靶向基团叶酸分子(fa),最终形成纳米胶束载药体系fa
‑
peg
‑
r
‑
nps@si
‑
ire1α。
5.该纳米胶束载药体系fa
‑
peg
‑
r
‑
nps@si
‑
ire1α经尾静脉注射后,通过叶酸分子主动靶向于炎症关节区域巨噬细胞表面过表达的叶酸受体,从而实现纳米药物在受累关节区域的主动聚集。随后,peg与纳米胶束内核氨基连接形成的席夫碱响应于关节区域酸性微环境从而断裂,暴露出内核纳米粒子,并在细胞穿膜肽的作用下,内核纳米粒子进入巨噬细胞内。在巨噬细胞内部,高浓度的还原性物质如gsh等特异性切断内核纳米粒子二硫键,实现
纳米粒子裂解并释放 si
‑
ire1α,巨噬细胞中si
‑
ire1α进一步整合到argonaute蛋白家族形成rna 诱导的沉默复合物risc(rna
‑
induced silencing complex),靶向识别ire1α mrna并诱导ire1αmrna切割和降解,抑制ire1α表达,进而减少巨噬细胞分泌炎性因子,抑制炎症,实现ra治疗过程中局部炎症控制、减轻疼痛及全身免疫调节的终极目标。这一发明可以直接应用于各类炎症性疾病的抗炎治疗,有助于探索与解析纳米材料联合sirna技术抗炎治疗的新机制、为开发各类炎症性疾病的生物制剂提供新方法、新技术。
背景技术:
6.纳米药物fa
‑
peg
‑
r
‑
nps@si
‑
ire1α具体设计如下:1.具有ph和氧化还原双敏感型的靶向纳米胶束载药系统的构建及优化设计构建负载si
‑
ire1α的双敏感靶向纳米胶束载药系统。首先合成含有二硫键的两亲性氧化还原敏感型阳离子脂质(ss
‑
pbaa
‑
pei,简称nps),并接枝细胞穿膜肽rkkrrqrrr,即合成为ss
‑
pbaa
‑
pei
‑
rkkrrqrrr(简称r
‑
nps),随后静电吸附si
‑
ire1α,自组装形成核心聚合物纳米粒子(r
‑
nps@si
‑
ire1α)。然后利用ph敏感型聚乙二醇(peg)材料进行表面修饰,并最终接枝靶向基团叶酸分子(fa),最终形成纳米胶束载药体系fa
‑
peg
‑
r
‑
nps@si
‑
ire1α。
7.2.fa
‑
peg
‑
r
‑
nps@si
‑
ire1α体外性质鉴定及稳定性研究(1)通过核磁共振波谱仪(nmr)、傅里叶变换红外光谱仪(ft
‑
ir)和蛋白凝胶电泳等,详细表征上述各步产物,确定每一步产物的化学结构和组成。(2)通过马尔文粒度分析仪检测纳米载药体系的水动力尺寸。并通过nta (nanoparticle tracking analysis)检测纳米载药体系颗粒浓度和动态分散性能。(3)通过透射电镜(tem)观察纳米材料和前药复合物的形态及粒径大小,并观察在不同ph条件(ph=7.4或ph=6.8)及是否存在gsh条件下纳米前药的形态及粒径变化情况。(4)通过纳米材料的蛋白吸附实验和血红细胞溶血实验,检测前药复合物的血液相容性。(5)荧光光谱仪和小动物荧光成像系统检测纳米载药体系在体外的荧光成像能力。(6)采用透析法,测定已合成的纳米载药体系中si
‑
ire1α体外释放的释放速率及响应性。
8.3.fa
‑
peg
‑
r
‑
nps@si
‑
ire1α的体内动态分布及动物实验优化构建小鼠cia模型。通过尾静脉注射cy5标记的纳米前药即fa
‑
peg
‑
r
‑ꢀ
nps@cy5
‑
si
‑
ire1α,应用小动物活体成像技术明确纳米前药在小鼠体内的运输及代谢过程,到达炎症关节的时间及存留时间,最终确定尾静脉给予fa
‑
peg
‑
r
‑ꢀ
nps@si
‑
ire1α合适的时间点及给药频率。从cia评分、小鼠体重、踝关节直径等几个方面判断治疗组对cia模型小鼠症状和体征的改善情况。
技术实现要素:
9.具有ph和氧化还原双敏感型的靶向纳米胶束载药系统的构建及优化设计构建具有ph和氧化还原双敏感型的靶向纳米胶束载药体系,内核负载si
‑ꢀ
ire1α。首先化学合成两亲性双嵌段氧化还原敏感型阳离子脂质ss
‑
pbaa
‑
pei,并接枝细胞穿膜肽rkkrrqrrr,并随
后静电吸附si
‑
ire1α自组装形成核心聚合物纳米粒子。然后通过醛胺缩合偶联聚乙二醇分子进行表面修饰并最终通过碳二亚胺法连接靶向分子叶酸。
10.通过化学方法合成具有氧化还原敏感型阳离子脂质内核ss
‑
pbaa
‑
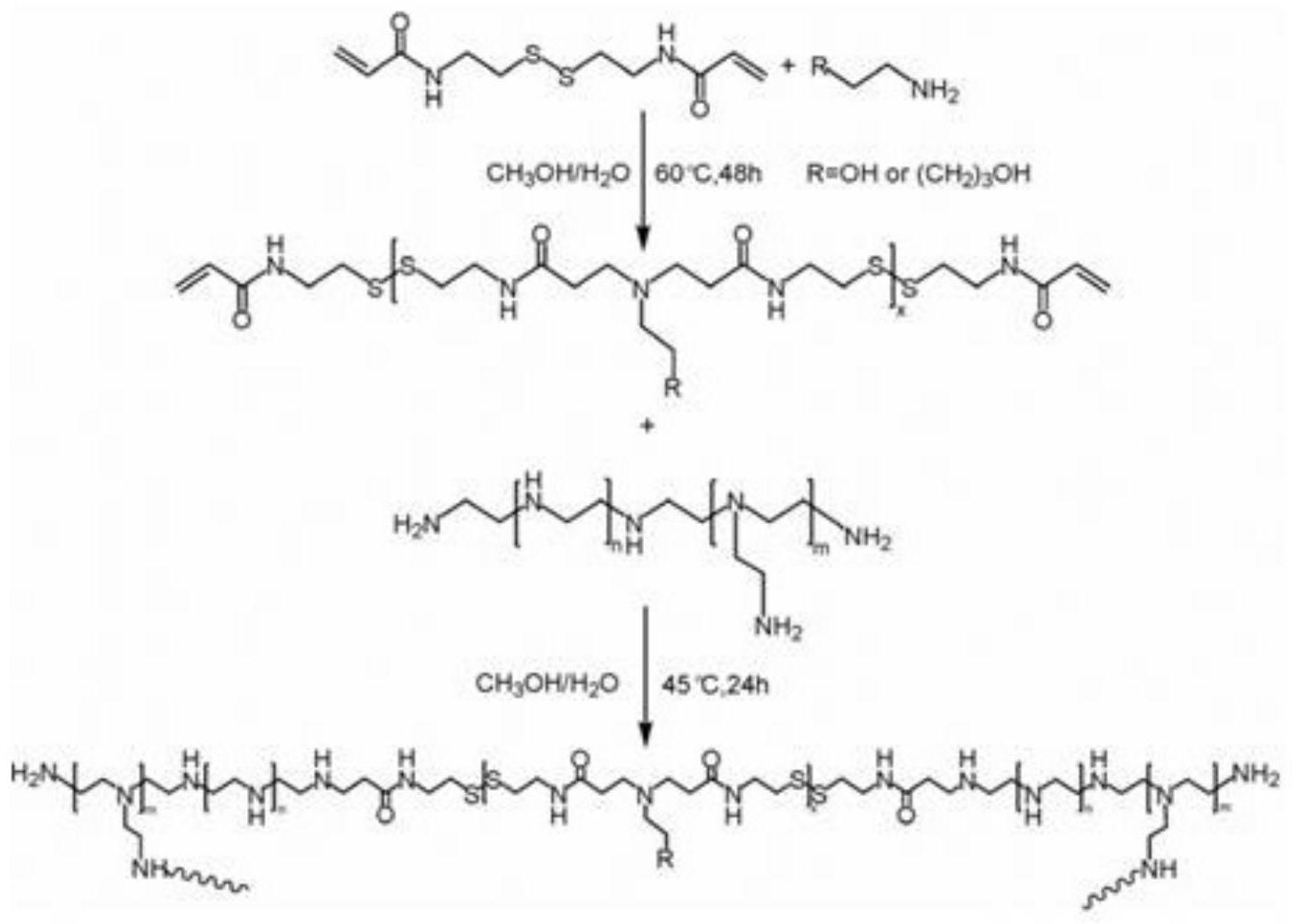
pei 方法如下:纳米载药系统的构建过程一、首先通过化学合成技术路线[见说明书附图1: 载药系统内核的合成(ss
‑
pbaa
‑
pei合成图)],合成具有ph和氧化还原双敏感型的两亲性双嵌段氧化还原敏感型阳离子脂质ss
‑
pbaa
‑
pei;其次,连接细胞穿膜肽并将si
‑
ire1α包载于纳米材料内核:通过巯基与羟基反应的方式将细胞穿膜肽连接在ss
‑
pbaa
‑
pei上,并随后将si
‑
ire1α按照一定比例与其混合采用静电吸附的载药方法将si
‑
ire1α包载,自组装形成初步聚合物纳米粒;第三、按照质量比(10:1)加入peg,通过醛胺缩合反应将r
‑
ss
‑
pbaa
‑
pei@si
‑
ire1α偶联peg,并随后通过碳二亚胺法连接fa,合成前药fa
‑
peg
‑
r
‑
ss
‑
pbaa
‑
pei @si
‑
ire1α,其中,纳米载体材料ss
‑
pbaa
‑
pei里面ss代表的是二硫键;pbaa 代表的是聚β
‑
氨基;pei代表的是聚乙烯亚胺;fa代表叶酸;cho
‑
peg
‑
cooh (一端醛基一端羧基,分子量2000);rr9(r)代表rkkrrqrrr多肽。
[0011]
完整纳米载药体系的构建方法[见说明书附图2:构建完整的纳米载药系统(fa
‑
peg
‑
r
‑
ss
‑
pbaa
‑
pei@si
‑
ire1α化学合成图)]如下:peg外壳连接的 fa具有fr靶向能力,能够靶向到类风湿性关节炎受累关节区域巨噬细胞表面过表达的fr,peg与内核部分通过醛胺缩合反应连接,在关节局部微酸性微环境下,席夫碱断裂、外壳脱落,暴露出内核部分。内核释放出来后,首先在连接在内核表面的穿膜肽的介导下,将内核靶向运载入巨噬细胞内。随后由于内核中存在具有还原性的二硫键,能够被细胞内过量的谷胱甘肽(gsh)还原并断键,从而达到si
‑
ire1α特异性释放的目的。si
‑
ire1α整合入宿主细胞进而发挥作用。同时,对已合成的前药进行理化特性的系统表征。
[0012]
综上,完整纳米载药体系的构建方法如下:peg外壳连接的fa具有fr 靶向能力,能够靶向到类风湿性关节炎受累关节区域巨噬细胞表面过表达的fr, peg与内核部分通过醛胺缩合反应连接,在关节局部微酸性微环境下,席夫碱断裂、外壳脱落,暴露出内核部分。内核释放出来后,首先在连接在内核表面的穿膜肽的介导下,将内核靶向运载入巨噬细胞内。随后由于内核中存在具有还原性的二硫键,能够被细胞内过量的谷胱甘肽(gsh)还原并断键,从而达到si
‑ꢀ
ire1α特异性释放的目的。si
‑
ire1α整合入宿主细胞进而发挥作用。
[0013]
2.纳米载药体系体外性质鉴定及稳定性研究(1)通过透射电子显微镜(tem)观察各组纳米材料和前药复合物形态及粒径大小,并通过动态光散射(dls)测量纳米材料和前药复合物的粒径分布(见说明书附图3:透射电子显微镜示fa
‑
peg
‑
rr9
‑
nps
‑
sirna组纳米前药复合物;附图 4:透射电子显微镜示fa
‑
peg
‑
rr9
‑
nps
‑
cy5@sirna组纳米前药复合物);(2)使用jem
‑
1011透射电镜(tem,jeol,tokyo,japan)和wyatt qels设备 (wyatt technology corp.,santa barbara,ca,usa)分别测得纳米材料和前药复合物的水合粒径和表面电位,见说明书附图5:fa
‑
peg
‑
rr9
‑
nps
‑
sirna组水合粒径为203.3nm(intensity值);表面电位
‑
13.7mv;附图6:fa
‑
peg
‑
rr9
‑
nps
‑ꢀ
cy5@sirna组水合粒径为237.5nm(intensity值);表面电位
‑
14mv;附图7: wl6
‑
peg
‑
rr9
‑
nps
‑
pdna组水合粒径为192.4nm(intensity值);表面电位
‑ꢀ
28.8mv。(3)通过核磁共振波谱仪(nmr)、傅里叶变换红外光谱仪(ft
‑
ir)和蛋白凝胶电泳
等,详细表征上述各步产物荧光光谱、gpc凝胶渗透色谱及核磁氢谱分析,分析纳米前药化学结构和组成,见说明书附图8:fa
‑
peg
‑
rr9
‑
nps
‑
cy5@sirna 组的cy5荧光光谱检测。通过620nm激发光激发,在666nm处检测到最大发射光,符合cy5发射波长范围。证明材料具有cy5荧光;附图9:fa
‑
peg
‑
rr9
‑ꢀ
nps
‑
cy5@sirna组的icg荧光光谱检测。通过750nm激发光激发,在835nm 处检测到最大发射光,符合icg发射波长范围。证明材料具有icg荧光;附图 10:gpc凝胶渗透色谱,ss
‑
pbaa
‑
pei材料的gpc凝胶渗透色谱结果为mn=6621, mw=12318;附图11:核磁氢谱示纳米前药核磁分析:图谱基本信息除溶剂峰外,在8.35,3.59,3.39,3.30,2.81,2.51,2.44ppm处有明显的质子峰。图谱解析目标化合物为聚合物,具有多组质子,其中质子a,b,k,f,h的信号在2.4
‑
2.6ppm, c,d,j的信号在2.7
‑
2.9ppm,e,g,i的信号在3.0
‑
3.6ppm,酰胺上的n
‑
h信号在 8.35ppm附近。(4)琼脂糖凝胶电泳检测,ss
‑
pbaa
‑
pei材料可以有效结合pdna和sirna(说明书附图12:根据琼脂糖凝胶电泳可以看出,ss
‑
pbaa
‑
pei材料可以有效结合 pdna和sirna,在凝胶加样孔内可以明显看出有核酸存在。(1组为载pdna 组纳米材料;2组为载sirna组材料);材料ph响应和gsh响应检测部分,在 ph中性条件下,ss
‑
pbaa
‑
pei聚合物表现为100nm以下球型颗粒(说明书附图 13:在ph中性条件下,ss
‑
pbaa
‑
pei聚合物表现为100nm以下球型颗粒);在 ph酸性条件下,ss
‑
pbaa
‑
pei聚合物出现降解(说明书附图14:在ph 5.5酸性条件下,ss
‑
pbaa
‑
pei聚合物出现降解);在ph酸性条件和gsh处理后,ss
‑ꢀ
pbaa
‑
pei聚合物基本降解完全,没有明显的纳米粒结构(说明书附图15:在 ph5.5酸性条件和gsh处理后,ss
‑
pbaa
‑
pei聚合物基本降解完全,没有明显的纳米粒结构)。
[0014]
3.fa
‑
peg
‑
r
‑
nps@si
‑
ire1α载药体系在小鼠cia模型中的作用与功能按照常规方法—胶原蛋白诱导关节炎(cia)方法构建ra模型,观察包载 si
‑
ire1α的纳米胶束载药体系在cia模型中对ra小鼠症状和体征的作用:根据关节肿胀范围等参数进行关节炎评分,观察不同组小鼠发病时间及疾病进展情况的差异性;使用游标卡尺测量各组小鼠后爪厚度,统计不同组别小鼠疾病症状严重程度的差异性;各组实验动物在末次治疗后3天处死,收集双后肢关节组织,进行形态学评估:通过micro
‑
ct对后肢关节的扫描进行三维重建,并收集分析骨密度等相关数据,对受累关节的骨质流失情况进行定量评估;通过小动物mri,对后肢关节软骨及软组织情况进行三维重建,分析软骨完整度,评估软骨保护情况。
[0015]
检测si
‑
ire1α的纳米胶束载药体系在cia模型中对ra小鼠关节局部炎症状态的作用。
[0016]
综上,通过检测,验证了纳米药物fa
‑
peg
‑
r
‑
nps@si
‑
ire1α具有抑制类风湿性关节炎等炎症相关疾病的相关症状,通过调控巨噬细胞极化、th17/treg 细胞免疫平衡、降低炎性因子分泌等途径抑制炎症、改善全身炎症状态,实现对小鼠炎性关节炎的治疗。
附图说明:
图1是载药系统内核的合成图(ss
‑
pbaa
‑
pei合成图);图2是构建完整的纳米载药系统(fa
‑
peg
‑
r
‑
ss
‑
pbaa
‑
pei@si
‑
ire1α)的化学合成图;图3是电子显微镜示fa
‑
peg
‑
rr9
‑
nps
‑
sirna组纳米前药复合物透射图;
图4是透射电子显微镜示fa
‑
peg
‑
rr9
‑
nps
‑
cy5@sirna组纳米前药复合物透射图;图5是fa
‑
peg
‑
rr9
‑
nps
‑
sirna组水合粒径图;图6是fa
‑
peg
‑
rr9
‑
nps
‑
cy5@sirna组水合粒径图;图7是wl6
‑
peg
‑
rr9
‑
nps
‑
pdna组水合粒径图;图8是fa
‑
peg
‑
rr9
‑
nps
‑
cy5@sirna组的cy5荧光光谱检测图;图9是fa
‑
peg
‑
rr9
‑
nps
‑
cy5@sirna组的icg荧光光谱检测图;图10是gpc凝胶渗透色谱图;图11是纳米前药核磁分析核磁氢谱图;图12是ss
‑
pbaa
‑
pei材料琼脂糖凝胶电泳图;图13是ss
‑
pbaa
‑
pei聚合物ph中性条件下球型颗粒图;图14是ss
‑
pbaa
‑
pei聚合物ph 5.5酸性条件下降解图;图15是ss
‑
pbaa
‑
pei聚合物ph酸性条件和gsh处理后完全降解图。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1