一种小分子在制备突变型葡萄膜黑色素瘤药物中的应用
本发明属于医学药物技术领域,具体涉及一种小分子在制备突变型葡萄膜黑色素瘤药物中的应用。
背景技术:
葡萄膜黑色素瘤(uvealmelanoma,um)是成人最常见的眼内恶性肿瘤,占全身黑色素瘤的5%。约50%的um在疾病进展过程中发生转移,最常见转移灶为肝,约占90%,其次为肺和骨。肝转移患者中位无进展生存期和总体生存期分别仅为3.3个月和10.2个月。巩膜敷贴放疗、经瞳孔热疗等局部治疗或眼球摘除手术等虽可控制原发性um,但由于缺乏有效的化疗药物,um转移率和死亡率高仍是亟待解决的临床难题。
um进展和转移的分子机制与其独特的突变背景相关。与皮肤、黏膜黑色素瘤的braf、nras突变不同,93%um发生鸟嘌呤核苷酸结合蛋白(q)α亚基(guaninenucleotide-bindingproteing(q)subunitalpha,gnaq)或鸟嘌呤核苷酸结合蛋白(11)α亚基(guaninenucleotide-bindingproteing(11)subunitalpha,gna11)突变。g蛋白下游信号通路包括pkc/mapk/mek/erk、pi3k/akt/mtor和trio/rho/rac/yap通路等。g蛋白自身具有gtp酶活性,可使gtp转换为gdp,恢复失活状态。g蛋白广泛存在于真核细胞中,生理状态下,g蛋白失活和激活保持动态平衡,对细胞发育和代谢起着重要的作用。gnaq/gna11突变大多位于5号外显子的第209位密码子(q209),q209对g蛋白的gtp酶活性至关重要,它的突变导致gtp酶活性丢失,下游通路持续激活,生理平衡被打破,导致细胞的增殖和转移。因此,以gnaq/gna11突变细胞作为研究对象,设计特异性靶向抑制剂,对阻断um进展和转移具有重要意义。
石硕于2020年发表的文章《gq突变在葡萄膜黑色素瘤中的作用及其抑制剂研究进展》有如下记载:“基于gnaq/gna11在um的高频突变,靶向gnaq/gna11小分子抑制剂开发可能是um治疗极具前景的策略。然而,靶向gq突变的研究仍处于初始阶段。目前经确证的选择性gq抑制剂仅有ym-254809和fr900359及其衍生物,泛g蛋白抑制剂包括bim-46714及其二聚体bim-46187和多肽类g蛋白拮抗剂-2a、27残基肽(i860a)等。(第1386页左栏最后一段及右栏第一段)”、“基于um中gq的高突变率,靶向gq突变的抑制剂开发可能是攻克um极具前景的方向。但由于不同亚型g蛋白在一级序列和三维结构等方面具有高度相似性,因此,开发对不同g蛋白亚型有高度选择性的抑制剂极富挑战性。目前经证实,可以选择性靶向gq的抑制剂仅有ym-254890和fr900359及其类似物,但该类化合物提取分离工艺复杂、产率低、合成困难而难以批量化生产,此外其在突变型和野生型gq间选择性不强,若开发成药物需要制定策略将化合物精准地传递到靶细胞,以避免干扰正常的gq级联信号。因此,急需开发新型成药性良好的g蛋白选择性抑制剂(第1389页左栏最后一段及右栏第一段)”。
e.livingstone于2020年发表的文章《gnaqandgna11mutantnonuvealmelanoma:asubtypedistinctfrombothcutaneousanduvealmelanoma》(gnaqandgna11mutantnonuvealmelanoma:asubtypedistinctfrombothcutaneousanduvealmelanoma[j].britishjournalofdermatology,2020.)中记载:gnaq/11突变型非葡萄膜黑色素瘤是一种黑色素瘤亚型,在临床上和遗传学上都不同于皮肤黑色素瘤cm和葡萄膜黑色素瘤um。且现有的针对于cm和um的治疗方案对于gnaq/11突变型非葡萄膜黑色素瘤均效果不佳,因此迫切需要针对受影响患者的新的有效治疗方法。(原文:ourfindingssuggestthatgnaq/11mutantnonuvealmelanomasareasubtypeofmelanomathatisbothclinicallyandgeneticallydistinctfromcutaneousanduvealmelanoma.astheyrespondpoorlytoavailabletreatmentregimens,noveleffectivetherapeuticapproachesforaffectedpatientsareurgentlyneeded.)
从上述文献报道可以知晓,现有的针对于um和cm的抑制剂药物对于gnaq/11两种突变型的治疗效果均不佳,而针对于这两种突变型的抑制剂也很难进行开发。目前报道的靶向gnaq/gna11编码蛋白gαq的抑制剂ym-254890和fr900359均为环状缩酚酸肽。ym-254890分离自肉杆菌属培养基,可抑制gαq信号传导,如adp诱导的血小板聚集和细胞内ca离子的移动。将gαq的晶体结构与gdp和ym-254890形成复合物,ym-254890可通过变构稳定作用,使gαq与gdp结合,将gαq锁定在失活状态。fr900359分离自紫金牛属植物,它的作用机制与ym-254890非常相似,能够特异性靶向gαq,抑制其向下游传导信号。由于这两种天然产物化合物的分子结构十分复杂,很难进行流程化生产和进入临床。
因此,如何寻找到可特异性抑制gnaq/gna11突变型um细胞体内外生长的化合物,成为亟待解决的技术问题。
技术实现要素:
本发明的目的就是为了解决上述技术问题,寻找到了一种可特异性抑制gnaq/gna11突变型um细胞体内外生长的化合物,以期实现葡萄膜黑色素瘤的靶向治疗。因此,本发明提供了一种小分子在制备突变型葡萄膜黑色素瘤药物中的应用。
本发明提供了一种小分子在制备突变型葡萄膜黑色素瘤药物中的应用,其中,所述小分子为伊利司莫,其分子结构式如式(ⅰ)所示:
所述突变型葡萄膜黑色素瘤包括gnaq或gna11突变型。
进一步的是,所述伊利司莫的药物作用随着浓度升高而增加。
如本发明实施例研究结果所示,伊利司莫除了可有效杀伤gnaq/gna11突变型um细胞,敲减gnaq降低杀伤作用之外,还能够有效抑制gnaq/gna11突变型um细胞增殖,阻滞细胞周期至g1期。经过研究证实,伊利司莫可在斑马鱼体内抑制gnaq/gna11突变型um细胞增殖、转移;并且伊利司莫还可通过激活hippo信号通路抑制yap进核,改变gnaq/gna11突变型um细胞下游基因表达。
本发明研究发现,伊利司莫对葡萄膜黑色素瘤显示出良好的杀伤效果,且对gnaq/gna11突变型um细胞具有特异杀伤性。与ym-254890和fr900359两类天然化合物不同,伊利司莫的结构式较为简单,适合流程化生产;且相较于gnaq/gna11下游信号通路的单一抑制剂而言,伊利司莫可全面抑制gnaq/gna11突变型um细胞生长,可避免单一信号通路抑制剂产生的旁路激活及耐药性。
如上所述,现有报道中能够用于治疗葡萄膜黑色素瘤um和皮肤性黑色素瘤cm的药物对于抑制gnaq/gna11突变型um细胞生长很难起到作用,而本发明能够有效的抑制gnaq/gna11突变型um细胞生长,对这两种突变型um的特异杀伤性高,且能够在体内抑制gnaq/gna11突变型um细胞的增殖和转移。由此可知,本发明对于本领域技术的贡献在于提供了一种伊利司莫作为抑制剂在治疗gnaq/gna11突变型um的应用;由于伊利司莫结构简单、成本较为低廉且应用成熟,可知本发明克服了现有抑制剂所存在的上述分子结构十分复杂、很难进行流程化生产和难以进入临床的缺点。
本发明的有益效果如下:
本发明提供了一种小分子在制备突变型葡萄膜黑色素瘤药物中的应用,本发明的小分子为伊利司莫,其针对于gnaq/gna11突变型葡萄膜黑色素瘤,可有效杀伤gnaq/gna11突变型um细胞,并有效抑制gnaq/gna11突变型um细胞增殖,阻滞细胞周期至g1期,并能够在体内抑制gnaq/gna11突变型um细胞增殖、转移。
附图说明
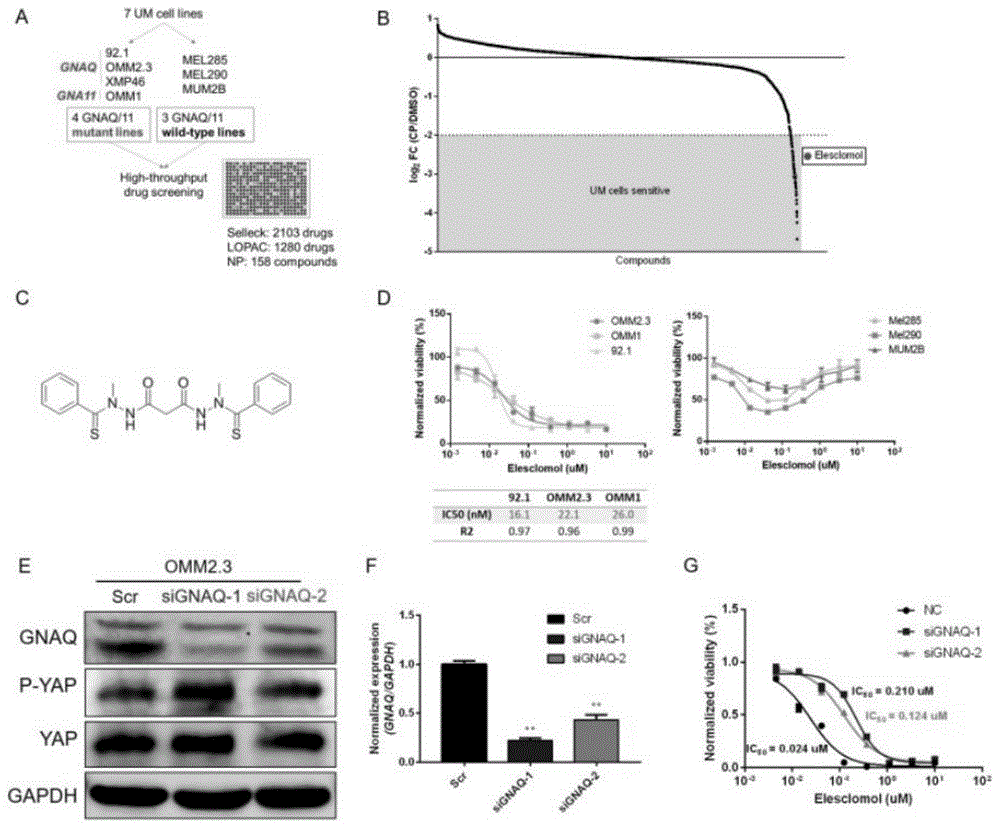
图1中,a:hts流程图;b:hts结果绘制log2fc曲线,灰色面积示log2fc<-2,为有效药物,红点指示伊利司莫;c:伊利司莫的化学结构示意图;d:伊利司莫对gnaq/11突变型um细胞92.1、omm2.3、omm1的ic50,和对gnaq/11野生型um细胞mel285、mel290、mum2b的浓度-细胞活力关系;e:用sirna敲减gnaq,wb检测敲减效率;f:对敲减效率进行灰度值统计,gapdh为内参蛋白,gnaq被敲减至50%以下(p<0.05);g:敲减gnaq检测伊利司莫对omm2.3的ic50。
图2中,a:平板克隆实验,铺设um细胞初始浓度为1000个/孔,伊利司莫浓度分别为0、5、10、20nm,14天后观察细胞克隆形成能力;b:平板克隆实验统计结果(p<0.05);c:软琼脂克隆形成实验,铺设um细胞初始浓度为500个/孔,伊利司莫浓度为0、20nm,28天后观察克隆形成能力;d:软琼脂克隆形成实验统计结果(p<0.05);e:流式细胞技术检测0nm和20nm伊利司莫分别处理18h后的细胞周期分布;f:细胞周期统计图(p<0.05);g:wb实验检测20nm伊利司莫处理18h后周期相关蛋白c-myc、cyclind1表达情况,gapdh作为内参蛋白,条带下显示为实验组与对照组的灰度比值。图3中,a:2dpf时的斑马鱼卵注射红色荧光标记的92.1细胞后,卵黄囊、眼球内、居维管、尾部均出现um瘤体;b:伊利司莫对斑马鱼体内安全浓度检测结果,存活率>80%记为安全浓度;c:试验组斑马鱼用体式荧光显微镜记录0、2、4、6dpt的体内瘤体分布情况;d:荷瘤量计算方式示意;e:计算对照组和试验组6dpt时的荷瘤量并统计(ctrln=24,elen=24),试验组明显低于对照组(p<0.05)。图4中,a:浓度依赖实验,用0、50、100、1000nm伊利司莫处理um细胞2h后检测erk1/2、yap、akt磷酸化及其总蛋白水平;b:时间依赖实验,用100nm伊利司莫处理um细胞0h、0.5h、3h、6h、12h后检测erk1/2、yap磷酸化及其总蛋白水平;c:b图的灰度值统计,伊利司莫可以时间依赖方式促进yap磷酸化,gapdh为内参蛋白,且对gnaq/11突变细胞系更为有效(p<0.05);d:用0、1、2um伊利司莫处理um细胞3h后检测lats1和mst1磷酸化水平改变情况;e:realtime-pcr检测发现,0.1、1um伊利司莫作用um细胞3h后可明显下调ctgf、cyr61的mrna水平(p<0.05)。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行具体描述,有必要指出的是,以下实施例仅仅用于对本发明进行解释和说明,并不用于限定本发明。本领域技术人员根据上述发明内容所做出的一些非本质的改进和调整,仍属于本发明的保护范围。
实施例1
(1)伊利司莫可有效杀伤gnaq/11突变型um细胞,敲减gnaq降低杀伤作用
利用高通量药筛技术(hts)技术,对7株具有不同遗传背景的um细胞系进行了3541种化合物的药效筛选,设用药组细胞存活数与对照组细胞存活数的比值为fc,log2fc<-2为有效药物,发现伊利司莫可有效杀伤gnaq/11突变型um细胞(图1.a、b)。采用cck8实验检测发现,3株gnaq/11突变型细胞系92.1、omm2.3、omm1对该药的ic50分别为16.1nm、22.1nm、26nm,而3株gnaq/11野生型细胞系mel285、mel290、mum2b对该药耐受(图1.c、d)。采用sirna敲减omm2.3细胞的gnaq(图1.e),敲减效率达到50%以上(图1.f),采用cck8实验检测伊利司莫对omm2.3细胞的ic50,发现敲减gnaq后,ic50从0.024um升高至0.124~0.210um(p<0.05)(图1.g)。
上述研究结果说明,伊利司莫对gnaq/11突变型um细胞具有特异性杀伤效果,敲减gnaq可提高伊利司莫对细胞的ic50,降低杀伤作用,伊利司莫可通过调控gnaq影响细胞活力。
实施例2
(2)伊利司莫抑制gnaq/11突变型um细胞增殖,阻滞细胞周期至g1期
平板克隆实验显示,随着伊利司莫浓度升高,对gnaq/11突变型um细胞杀伤作用增强,20nm时即可将细胞克隆杀伤到50%以下(图2.a、b)。软琼脂克隆形成实验也证实伊利司莫可降低um细胞体外成瘤能力(图2.c、d)。流式细胞技术证明伊利司莫可将um细胞阻滞在g1期,s期减少,同时wb实验验证伊利司莫可使周期相关蛋白c-myc和cyclind1表达量下调(图2.e、f、g)。
上述研究结果说明,伊利司莫可抑制gnaq/11突变型um细胞体外增殖能力,通过调控周期相关蛋白c-myc、cyclind1等,将细胞阻滞在g1期。
实施例3
(3)伊利司莫可在斑马鱼体内抑制gnaq/11突变型um细胞增殖、转移
利用tg(kdrl:egfp)转基因斑马鱼构建异种移植肿瘤模型,该转基因斑马鱼用绿色荧光标记了血管内皮细胞,可以观察到全身血管分布,用红色染料cm-dil标记gnaq/11突变型um细胞92.1的细胞膜,使它发红色荧光,用显微注射针将该细胞注射至出生2天的斑马鱼卵黄囊中,使其在卵黄囊中成瘤,并可转移至眼内、居维管、尾部等全身器官,该模型可观察至8dpf(图3.a)。在3dpf鱼卵的培养皿中加入不同浓度伊利司莫,每2天换液,观察8dpf,统计鱼卵存活率以计算安全浓度,存活比例>80%记为安全(图3.b)。对注射92.1后的鱼卵分组,试验组用10um伊利司莫处理,对照组用dmso处理,每2天换液,用体式荧光显微镜分别记录至处理后(dayspost-treatment,dpt)6天(图3.c)。将6dpt时的红色荧光点数量×平均面积记为荷瘤量,发现伊利司莫组的斑马鱼荷瘤量相较于对照组明显降低,远处转移也明显减少(图3.d、e)。
上述研究结果说明,伊利司莫可在斑马鱼体内抑制gnaq/11突变型um细胞增殖、转移。
实施例4
(4)伊利司莫可通过激活hippo信号通路抑制yap进核,改变gnaq/11突变型um细胞下游基因表达
分别用0、50、100、1000nm伊利司莫处理um细胞92.1、omm2.3、mel290、omm1细胞2h后提取总蛋白进行wb,发现yap(s127位点)磷酸化水平随着浓度上升而提高,erk1/2、akt磷酸化水平无明显变化(图4.a)。确定100nm可促进yap磷酸化后,我们设置药物作用时间梯度为0h、0.5h、3h、6h、12h,发现伊利司莫对yap磷酸化的促进作用具有时间依赖性,而对erk1/2磷酸化仍无明显作用(图4.b)。对时间依赖情况进行统计,发现相对于野生型细胞,gnaq/11突变细胞系yap磷酸化水平提高程度更为明显,且持续至药物处理后至少12h,而erk1/2磷酸化无上述趋势(图4.c)。进一步用wb检测伊利司莫对hippo通路中关键激酶的激活情况,发现伊利司莫可上调lats1磷酸化水平(图4.d)。realtime-pcr检测发现0.1、1um伊利司莫作用um细胞3h均可明显下调yap下游经典靶基因ctgf和cyr61(图4.e)。
上述研究结果说明,伊利司莫可通过激活gnaq/11突变型um细胞hippo信号通路中的lats1,促进yap磷酸化,从而改变下游ctgf、cyr61等基因表达。
- 还没有人留言评论。精彩留言会获得点赞!