一种非手性磁控微型支架机器人及其制备方法和应用
1.本发明属于微纳米机器人技术领域,涉及一种非手性磁控微型支架机器人 及其制备方法和应用。
背景技术:
2.在各类退行性关节疾病中,骨性关节炎(osteoarthritis,oa)是最常见的一 种慢性疾病,会影响全身各关节组织。主要症状为膝关节疼痛和日常活动受限, 其中女性患病率大于男性,肥胖人群患病率大于普通人群。
3.koa是一种以持续性关节软骨损伤破坏为主,并致关节软骨下骨增厚,不 同程度的关节滑膜炎症,韧带退化等的疾病。目前临床上对于koa的发病机制 尚未明确,因此并未有针对性的防治方案。治疗koa的方案分为药物治疗和非 药物治疗,保守效果治疗不佳,大多晚期患者需要进行手术治疗,例如关节置 换手术(kta),此类手术有创面大,恢复慢,风险高,费用高等问题。针对 koa病情发展的各个时期都需要进行的软骨再生和修复,干细胞治疗逐渐成为 新型治疗手段被应用于临床。
4.干细胞治疗koa,主要利用干细胞通过诱导可以迅速分化为软骨细胞的特 性,修复损伤的软骨。目前临床上利用干细胞治疗koa的方法为直接将病人体 内提取的干细胞处理后注射入膝关节,以此改善关节腔微环境,修复软骨缺损 部位。但是该方法干细胞利用率低,干细胞需求量大,修复过程较为缓慢。近 年来也有科研团队研究采用宏观支架或微观支架进行体外培养干细胞,采用手 术或注射的方法进行干细胞治疗,但是宏观支架会采用侵入性手术,并造成支 架中心干细胞的死亡。相比之下,微观支架的可注射性,高效率准确运输干细 胞,以及易进入狭小软骨缺损部位,能保证干细胞氧气与营养物质的流通等特 点,更具有未来临床应用价值。目前微观支架为实现精确运输干细胞进入软骨 受损部位,基本采用微型机器人的概念实现。
5.一段时间里,人们认为只有手性结构的微型机器人才能将旋转运动转换为 平移运动,例如螺旋形机器人。直到2014年,u kei cheang教授制造出三珠结 构的非手性微型机器人并验证了其在旋转磁场下的运动性能。此后随着非手性 微型机器人的制造方法发展,bradley j.nelson利用光刻技术进行批量制造非手 性微型机器人,证明可以使用简单工艺、低成本的方法制造简单形状的非手性 机器人。
6.除此之外,关于微型机器人的驱动方式,目前研发的微型机器人中采用的 驱动方式包括了化学驱动、磁场驱动、声波驱动和光驱四大方式。磁场驱动因 其无直接接触、及时控制、生物材料对磁场无响应等特点在微操控系统上得到 广泛应用。因此,在本领域中,开发能够利用磁场驱动的非手性机器人是本领 域的研究重点。
技术实现要素:
7.针对现有技术的不足,本发明的目的在于提供一种非手性磁控微型支架机 器人及其制备方法和应用。本发明的非手性磁控微型支架机器人通过低成本的 光刻制造技术,
使用生物兼容性的材料,采用旋转磁场驱动,实现干细胞的高 效搭载和关节腔内运输,从而有效无创治疗koa,以及其他体内需要干细胞靶 向运输治疗的不同病症。
8.为达到此发明目的,本发明采用以下技术方案:
9.一方面,本发明提供一种非手性磁控微型支架机器人,所述非手性磁控微 型支架机器人包括网状支架主体和位于所述网状支架主体外层的磁性膜层以及 位于磁性膜层外的生物兼容性膜层。
10.本发明所述的非手性磁控微型支架机器人支架结构可供干细胞附着、生长、 增殖、分化,具有保护和支持干细胞的作用,并可在旋转磁场控制下实现定向 运动,进而可以实现对于骨性关节炎患部的靶向治疗。
11.优选地,所述网状支架主体的原料为光刻胶,优选地,所述光刻胶为su
‑
8 系列光刻胶。
12.在本发明中,所述网状支架主体通过光刻胶进行光刻后得到。
13.优选地,所述磁性膜层的材料为铁、钴或镍中的任意一种或至少两种的组 合。
14.优选地,所述生物兼容性膜层的材料为ti、壳聚糖、聚乳酸或羟基磷灰石 中的任意一种或至少两种的组合。
15.优选地,所述磁性膜层的厚度为150
‑
300nm;例如150nm、170nm、180nm、 200nm、220nm、250nm、270nm、290nm或300nm。
16.优选地,所述生物兼容性膜层的厚度为20
‑
100nm;例如20nm、25nm、30 nm、35nm、40nm、45nm、50nm、55nm、60nm、65nm、70nm、80nm、 90nm或100nm。
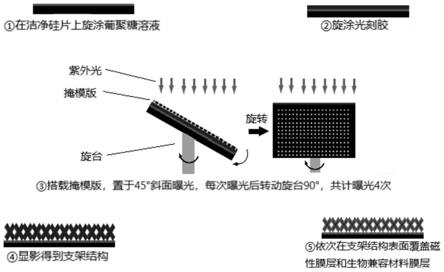
17.优选地,所述非手性磁控微型支架机器人的整体厚度小于等于1mm,例如 可以为1mm、0.8mm、0.5mm、0.3mm、0.2mm、0.1mm、0.08mm、0.05mm 等。
18.优选地,所述非手性磁控微型支架机器人为微米级别;
19.优选地,所述非手性磁控微型支架机器人的高度40微米,长400微米,宽100微米。
20.在本发明中,所述非手性磁控微型支架机器人是非手性结构,该非手性磁 控微型机器人在与外界磁场相互作用后,其将获得手性磁性结构的运动特性。
21.优选地,所述非手性磁控微型支架机器人为近似“l”形的非手性结构,其 夹角为90
‑
179
°
,例如90
°
、95
°
、98
°
、100
°
、110
°
、120
°
、130
°
、140
°
、 150
°
、160
°
、170
°
、179
°
等,优选120
°
。
22.另一方面,本发明提供了如上所述的非手性磁控微型支架机器人的制备方 法,所述制备方法包括以下步骤:
23.(1)对光刻胶进行光刻得到网状支架主体;
24.(2)在网状支架主体表层依次溅射磁性材料膜层和生物兼容性膜层,得到 所述非手性磁控微型支架机器人。
25.优选地,步骤(1)所述对光刻胶进行光刻,具体包括:
26.在基板上旋涂葡聚糖溶液,而后旋涂光刻胶,对光刻胶进行旋转不同方位 的紫外线曝光,完成光刻。
27.在本发明中,为了产生近似“l”形的非手性结构,在光刻胶时根据掩模版 上设计的图案组成l形。
28.优选地,所述基板为硅片。
29.优选地,所述葡聚糖溶液的质量体积浓度为5
‑
20%(w/v),例如5%、6%、 8%、10%、12%、15%、18%或20%,优选10%。
30.在本发明中,在基板上旋涂葡聚糖溶液,是因为葡聚糖膜层可以溶于水, 在制造完成后,放入水中,膜层溶解,机器人可以从基板剥离。
31.优选地,所述旋转不同方位的紫外线曝光为对光刻胶进行1
°‑
89
°
(例如 1
°
、5
°
、10
°
、15
°
、20
°
、30
°
、40
°
、50
°
、60
°
、70
°
、80
°
或89
°
) 斜向紫外曝光,每次曝光后,硅片绕垂直轴旋转90
°
,共计重复进行4次旋转 曝光。
32.优选地,所述对光刻胶进45
°
斜向紫外曝光。
33.在本发明中,步骤(2)所述射磁利用磁控溅射仪器,通过sputtering(溅射) 来完成。
34.优选地,在步骤(2)得到磁性材料膜层和生物兼容性膜层后,将非手性磁 控微型支架机器人与基板剥离。所述剥离的方式为将带有基板的非手性磁控微 型支架机器人没入水中,由于葡聚糖易溶于水溶液,从而使得非手性磁控微型 支架机器人因为葡聚糖层的溶解而脱落。
35.优选地,溶解葡聚糖层时采用超声辅助,加速水进入葡聚糖层,从而加快 葡聚糖溶解速度。
36.另一方面,本发明提供了一种装载干细胞的微型支架机器人,所述装载干 细胞的微型支架机器人包括如上所述的非手性磁控微型支架机器人以及装载在 所述非手性磁控微型支架机器人上的干细胞。
37.本发明提供的非手性磁控微型支架机器人可以实现干细胞的靶向运输,在 医疗应用中实现无创治疗,且运载干细胞效率高,细胞成活率好。
38.在本发明中,对所述的非手性磁控微型支架机器人进行灭菌,而后涂覆多 聚
‑
l
‑
赖氨酸(简称pll),以增加干细胞在机器人内的黏附性能。而后与干细胞 共培养,培养传代至3代,接种数目为1w/ml,共培养3天,得到装载干细胞 的微型支架机器人。
39.优选地,所述灭菌包括等离子体处理、酒精消毒和pbs溶液清洗。
40.优选地,所述等离子体处理的功率为50w,时间为5
‑
20min(例如5min、8 min、10min、15min或20min)。
41.优选地,所述酒精的浓度为70%,酒精消毒的时间为5
‑
30min(例如5min、 8min、10min、15min、20min、25min或30min)。
42.优选地,pbs溶液浓度为10%,清洗6次。
43.优选地,涂覆多聚
‑
l
‑
赖氨酸包含聚
‑
l
‑
赖氨酸溶液浸泡和pbs溶液清洗。
44.优选地,聚
‑
l
‑
赖氨酸溶液的规格为10微克每毫升,浸泡时间为5
‑
20min(例 如5min、8min、10min、15min或20min);pbs溶液浓度为10%,清洗6次。
45.优选地,所述干细胞为sd大鼠的大腿骨髓间充质干细胞,培养传代至3代。
46.另一方面,本发明提供了如上所述的非手性磁控微型支架机器人或所述装 载干细胞的微型支架机器人在制备干细胞治疗药物或者医疗器械中的应用。
47.优选地,所述干细胞治疗药物或者医疗器械为治疗骨关节炎的药物或者医 疗器械。
48.在本发明中,所述非手性磁控微型支架机器人或所述装载干细胞的微型支 架机
器人可以用于治疗骨关节炎,将装载干细胞的微型支架机器人注射至患部 关节腔中,利用磁场发生器,控制机器人运动,使其靶向运动,准确到达软骨 缺损患部,实现对于骨性关节炎的靶向治疗。
49.优选地,所述磁场发生器为三维亥姆霍兹线圈,产生磁场为三维均匀旋转 磁场。
50.本发明的非手性的微型机器人具有简单形状的特征,区别于其他微型机器 人,在三维均匀旋转磁场的控制下实现游泳运动和滚动运动两种运动。
51.本发明能够实现低成本,高效率的体内关节腔靶向治疗,同样也适用于其 他体内需要干细胞靶向运输治疗的不同病症。
52.相对于现有技术,本发明具有以下有益效果:
53.本发明的非手性磁控微型支架机器人中网状支架主体为三维立体纤维状的 规则结构,外层覆盖有磁性膜层和生物兼容性膜层。支架可附着干细胞,作为 干细胞生长迁移基础,具有保护和支持干细胞的作用;微型机器人最大尺寸为 微米,可在外部磁场的驱动下实现运动控制;在三维均匀旋转磁场的控制下实 现游泳运动和滚动运动两种运动。本发明提供的非手性磁控微型支架机器人具 有较低的生产成本,可以进行工业化大批量均一制备;非手性磁控微型支架机 器人进行体外干细胞培养增殖后,通过注射进入关节腔,并通过磁场操控使其 靶向运动,准确到达软骨缺损患部,实现对于骨性关节炎的靶向治疗。本发明 提供的非手性磁控微型支架机器人及其制备方法可以实现对于骨性关节炎软骨 缺损的靶向治疗,能够实现低成本,高效率的体内关节腔靶向治疗,同样也适 用于其他体内需要干细胞靶向运输治疗的不同病症。
附图说明
54.图1为非手性磁控微型支架机器人制备过程示意图。
55.图2a为网状支架主体的主视图,图2b为网状支架主体的侧视图,图2c 为网状支架主体的俯视图。
56.图3为非手性磁控微型支架机器人的截面剖视图,其中1为网状支架主 体,2为磁性膜层,3为生物兼容性膜层。
57.图4为装载干细胞的微型支架机器人的制备过程示意图。
58.图5为利用装载干细胞的微型支架机器人对软骨缺损部位注射应用的示意 图。
具体实施方式
59.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员 应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限 制。
60.实施例1
61.在本实施例中制备非手性磁控微型支架机器人,制备过程如图1所示,具 体包括以下步骤:
62.(1)光刻制造网状支架主体
63.在洁净硅片上旋涂10%浓度的葡聚糖溶液,旋涂角速度为1500rpm,时长 为20s。旋涂后置于80℃下烘烤1min,再置于180℃下烘烤30min,烘干成膜。 涂覆su
‑
8 2050型光刻胶,旋涂角速度为3000rpm,时长为30s。将涂胶完毕的 硅片置于65℃下烘烤1min。将样本固
定于坡度为45
°
的载物台上,胶面上方搭 载掩模版,置于垂直紫外线下曝光,然后顺(逆)时针旋转载物台90
°
,再次 进行同样参数的曝光。重复旋转、曝光的步骤,共计进行4次曝光。将曝光完 毕的样本置于95℃下烘烤7min。将样本在显影液和异丙醇之间循环漂洗,直至 放于异丙醇中时无白色絮状物出现,此时捞出样本进行吹干。
64.(2)利用磁控溅射仪器,通过sputtering,依次溅射150nm的ni作为磁性 材料膜层和20nm的ti作为生物兼容性膜层。对样本使用70%酒精清洗,然后 烘干。plasma处理,功率为50w,时间为10min。将样本进行接触角测试,使 用去离子水,对样本的10个不同位置进行接触角测试,最终数值取平均值(最 终亲水性较好,接触角在20
°‑
35
°
之间,平均值为27
°
,这意味着样本亲水性 较好,细胞更愿意在上面黏附)。将样本浸泡于70%酒精中,15min后取出。采 用10%的pbs溶液清洗6次,自然晾干。将样本置于去离子水中进行超声,将 非手性磁控微型支架机器人从基板上剥离,得到非手性磁控微型支架机器人。
65.如图2a为网状支架主体的主视图,图2b为网状支架主体的侧视图,图2c 为网状支架主体的俯视图。图3为非手性磁控微型支架机器人的截面剖视图, 其中1为网状支架主体,2为磁性膜层,3为生物兼容性膜层。
66.实施例2
67.在本实施例中,制备装载干细胞的微型支架机器人,制备的过程如图4所示, 具体包括以下步骤:
68.(1)pll涂覆
69.将非手性磁控微型支架机器人放入10微克每毫升的pll溶液中,浸泡 10min。取出样本,采用10%的pbs溶液清洗6次,自然晾干。
70.(2)干细胞接种
71.将代数合适的干细胞计数后接种到如上处理后的非手性磁控微型支架机器 人上,培养1周,每1、3、7天进行一次cck
‑
8测试。制备细胞悬液,分为两 组,一组计数后接种到96孔板内,每孔100μl,在37℃,5%co2环境下进行 24h贴壁培养。每孔加入10μl cck
‑
8溶液,培养2h,通过酶标仪测定450nm 处的吸光值(od),计算细胞增殖活力。另一组在预培养前,向各孔中加入不 同浓度的毒性物质(药物、化学试剂等待检测物质),可适当延长预培养时间, 其余步骤同上,计算细胞毒性活力,结果显示与对照组相比,基本无细胞毒性, 具有良好的细胞增殖性能,表明所制造的非手性支架微型机器人为干细胞的良 好生长环境。
72.同样,在注射之前,干细胞为sd大鼠的大腿骨髓间充质干细胞,培养传代 至3代,接种数目为1w/ml,共培养3天后,用移液枪转移到注射器中等待注 射。
73.(3)搭载细胞数目测试
74.分别采用10w,20w,30w数目的细胞,培养一天后,进行细胞搭载计数 测试。10w数目的细胞的测试结果显示平均搭载18个,20w数目的细胞的测试 结果显示平均搭载26个,30w数目的细胞的测试结果显示平均搭载40个细胞。
75.(4)分化测试
76.将干细胞接种到样品上,培养至融合程度90
‑
100%,加入分化因子。每天半 换液,持续诱导分化21
‑
28天后,进行福尔马林固定和包埋切片,最后进行阿利 辛蓝染色。检测得到软骨分化基因表达情况,结果显示,软骨细胞分化的基因 高度表达,包括:agg、col2a1和sox9。
77.实施例3
78.在本实施例中,对装载干细胞的微型支架机器人进行性能测试:
79.非手性磁控微型支架机器人搭载细胞后,施加磁场进行驱动,可在di水中 或不同的生物流体内,具备良好的运动速度,且在两种磁场控制下,具备两种 不同的运动特性。非手性磁控微型支架机器人单体或集群均可以进行长距离靶 向运动,可在具有三维结构的底面和粗糙底面上保持良好的运动速度和稳定性, 轻易翻越障碍。具体性能测试方法如下:
80.(1)运动测试:
81.将非手性磁控微型支架机器人置于di水中,施加磁场,进行游泳和滚动测 试,检查其是否可以进行运动,观察运动速度和稳定性。
82.本测试证明非手性磁控微型支架机器人在清水中具备良好的运动性能。
83.(2)生物流体测试:
84.将非手性磁控微型支架机器人置于不同的生物流体(pbs,脑脊液,小鼠血 清)内,施加磁场,进行游泳和滚动测试,检查其是否可以进行运动,观察运 动速度和稳定性。
85.本测试证明非手性磁控微型支架机器人在生物流体中具备良好的运动性能。
86.(3)流道模拟测试:
87.通过光刻制造不同种类的流道,有腔室和连接腔室的通道。
88.将单个非手性磁控微型支架机器人置于其中一个腔室中,施加磁场,控制其 移动到指定腔室,观测其运动速度和稳定性。
89.对多个非手性磁控微型支架机器人进行同样的实验,测试其运动速度,以及 能成功到达指定点的机器人所占百分比。
90.本测试证明非手性磁控微型支架机器人单体或集群均可以进行长距离靶向 运动。
91.(4)粗糙表面运动测试:
92.用倒模的方式制造具有粗糙表面的3d结构,将装载细胞的机器人在内进行 翻越运送。对单体和群体的测试标准参考流道模拟测试。
93.本测试证明,非手性磁控微型支架机器人单体或集群可轻易翻越障碍,在具 有三维结构的底面和粗糙底面上保持良好的运动速度和稳定性。
94.利用本发明的装载干细胞的非手性磁控微型支架机器人对软骨缺损部位进 行注射,如图5所示,装载干细胞的非手性磁控微型支架机器人能够在磁场驱 动下靶向定位至损伤部位,以进行治疗。
95.申请人声明,本发明通过上述实施例来说明本发明的工艺方法,但本发明 并不局限于上述工艺步骤,即不意味着本发明必须依赖上述工艺步骤才能实施。 所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原 料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范 围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1