一种艾多沙班固体药物组合物及其制备方法与流程
本发明涉及药物组合物领域,具体而言,涉及一种含有聚乙烯醇聚乙二醇共聚物的艾多沙班固体药物组合物及其制备方法。
背景技术:
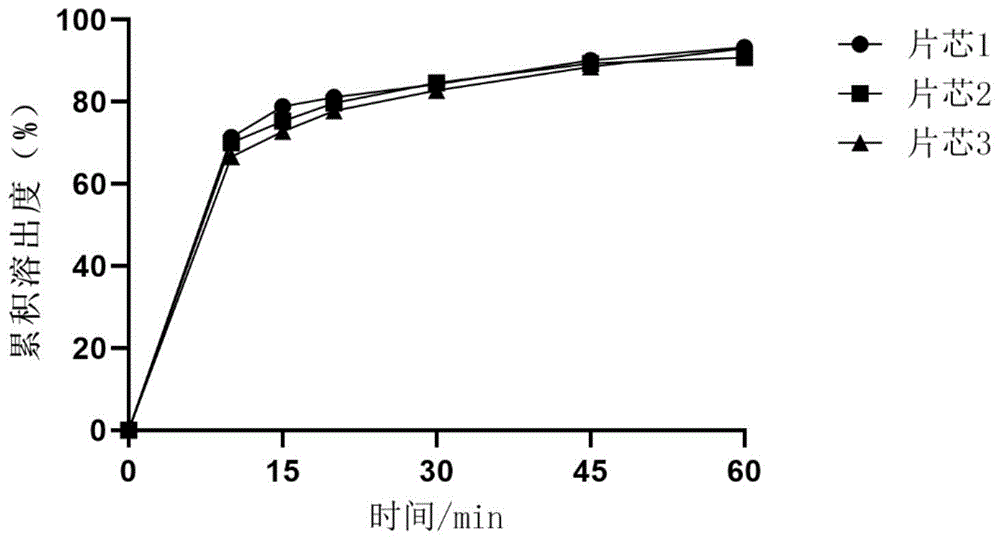
:甲苯磺酸艾多沙班一水合物的化学名称为:n-(5-氯-2-吡啶基)-n’-[(1s,2r,4s)-4-[(二甲氨基)甲酰基]-2-[[4,5,6,7-四氢-5-甲基噻唑并[5,4-c]吡啶-2-基)甲酰]氨基]环己基]乙二酰胺对甲苯磺酸盐一水合物,是一种凝血因子xa的选择性抑制剂,减低凝血酶生成和减少血栓形成,结构式如下:甲苯磺酸艾多沙班在强酸性水溶液中显示良好的溶解性,但在中性水溶液(中性的缓冲液等)中溶解性降低,导致临床效果下降。cn104324015b通过含有选自羟丙基甲基纤维素、甲基纤维素、乙基纤维素、羟丙基纤维素和聚乙烯醇中的1种或2种以上的包衣剂对艾多沙班片剂进行包衣而改善溶出,然而该包衣剂制备得到的片剂杂质较多、稳定性较差。cn108743556a也公开了一种艾多沙班片剂,使用的包衣剂为欧巴代包衣粉。然而,该专利中的处方组成较为复杂,工艺步骤也较为繁琐,其中,将艾多沙班以溶解的形式喷到填充剂上,一方面艾多沙班经历溶解再结晶的过程,晶型有转变的风险,另一方面,以浆液形式加入,片中的最终含量不能得到准确控制。技术实现要素:基于上述技术问题,本发明提供了一种艾多沙班固体药物组合物,其具有简单的工艺步骤、良好的可压性、更优的稳定性及更少的有关物质,且溶出曲线与市售药物组合物的溶出曲线一致。为实现上述目的,本发明提供的技术方案如下:一方面,本发明提供了一种艾多沙班固体药物组合物,含有艾多沙班、填充剂、崩解剂、粘合剂、润滑剂和包衣剂,所述的包衣剂含有所述的粘合剂为羟丙基纤维素。在一些实施方案中,所述的艾多沙班为甲苯磺酸艾多沙班一水合物。在一些实施方案中,以重量份数计,所述的固体药物组合物含有甲苯磺酸艾多沙班一水合物75-85份、填充剂200-300份、崩解剂20-25份、粘合剂10-25份、润滑剂2.5-5份和包衣剂10-25份。在一些实施方案中,以重量份数计,所述的固体药物组合物含有包衣剂12-22份。在一些实施方案中,以重量份数计,所述的固体药物组合物含有包衣剂14-20份。在一些实施方案中,所述的填充剂选自甘露醇、预胶化淀粉、微晶纤维素或其组合。在一些实施方案中,所述的填充剂为甘露醇和预胶化淀粉。在一些实施方案中,以重量份数计,所述的填充剂中,含有甘露醇150-200份,预胶化淀粉50-100份。在一些实施方案中,所述的崩解剂选自交联聚维酮、羧甲基淀粉钠、交联羧甲基纤维素钠或其组合。在一些实施方案中,所述的崩解剂为交联聚维酮。在一些实施方案中,所述的润滑剂选自硬脂酸镁、硬脂酸钙或其组合。在一些实施方案中,所述的润滑剂为硬脂酸镁。在一些实施方案中,所述的包衣剂含有二氧化钛、滑石粉、黄氧化铁和kollicoat在一些实施方案中,以重量份数计,所述的包衣剂含有二氧化钛5-20份、滑石粉10-25份、黄氧化铁1-15份、50-100份。在一些实施方案中,以重量份数计,所述的包衣剂含有二氧化钛10-15份、滑石粉15-20份、黄氧化铁5-10份、kollicoat60-70份。在一些实施方案中,所述的艾多沙班固体药物组合物为片剂。另一方面,本发明提供了一种艾多沙班固体药物组合物的制备方法,包括以下步骤:将粘合剂溶解于水中,得浆液;按照处方量,将艾多沙班与填充剂以及崩解剂混合均匀,加入浆液后在流化床中制粒,干燥,整粒,加入润滑剂混合,压片得到片芯,包衣即得。在一些实施方案中,所述的制备方法包括以下步骤:将羟丙基纤维素溶解于水中,得浆液;按照处方量,将甲苯磺酸艾多沙班一水合物与甘露醇、预胶化淀粉以及交联聚维酮混合均匀,加入浆液后在流化床中制粒,干燥,整粒,加入硬脂酸镁混合,压片得到片芯,包衣即得。在一些实施方案中,所述的片芯的硬度为10-20kg。在一些实施方案中,所述的片芯的硬度为10-15kg。有益效果:本发明提供的艾多沙班固体药物组合物具有更优的可压性、产生更少的杂质、更优的稳定性,且溶出曲线与市售药物组合物的溶出曲线一致。除非本发明另外定义,与本发明相关的科学和技术术语应具有本领域普通技术人员所理解的含义。附图说明图1所示的是,实施例1的溶出曲线。图2所示的是,实施例2的溶出曲线。图3所示的是,实施例3的溶出曲线。具体实施方式下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。本发明实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。实施例1片芯硬度的考察将羟丙基纤维素溶解于水中制得均匀浆液,按照处方量,将甲苯磺酸艾多沙班一水合物与甘露醇、预胶化淀粉以及交联聚维酮混合均匀,加入浆液后在流化床中进行制粒,干燥,整粒,加入硬脂酸镁混合,压片,用硬度仪对片芯进行硬度测试,分别得到硬度为6kg、11kg、14kg的片芯,即片芯1、片芯2、片芯3。处方组成如表1所示:表1溶出曲线对比取本品,照溶出度与释放度测定法(中国药典2015版通则0931,第二法)以ph6.6磷酸盐缓冲液900ml为溶出介质,转速为每分钟50转,依法操作,于10、15、20、30、45、60分钟取样,进行检测,计算累积溶出度。溶出数据见表2。色谱条件:用十八烷基硅烷键合硅胶为填充剂或效能相当的色谱柱,以磷酸盐缓冲液/乙腈为流动相;柱温为40℃;检测波长为290nm,进样量10μl。按外标法以峰面积计算溶出量,结果见表2,溶出曲线见图1。由于在溶出过程45min取样结束后,加入吐温增溶,故60min的溶出数据不参与相似因子f2的计算。表2时间/min101520304560片芯171.478.981.184.390.193.3片芯270.075.379.784.689.490.8片芯366.672.877.882.888.593.0由表2可知,在本发明的硬度下,三种硬度片剂的溶出速率无显著差异。实施例2包衣剂的考察采用实施例1的制备方法,压片时控制硬度范围为10-15kg制得片芯,然后分别进行包衣,所不同的是,使用的包衣剂分别使用自研包衣剂、kollicoat03f42132(即cn104324015b中所述的以羟丙基甲基纤维素为主成分的包衣剂);进行包衣得到处方1、处方2和处方3。处方组成如表3所示,所述的自研包衣剂组成如表4所示。表3所述的自研包衣剂的制备方法为:将如表4所示的处方量的二氧化钛、滑石粉、黄氧化铁和进行混合,得到均匀的黄色固体粉末。表4采用与实施例1相同的方法,检测处方1、处方2、参比制剂在ph6.6磷酸盐缓冲液的溶出介质中的溶出曲线,结果见表5和图2。其中,参比制剂甲苯磺酸艾多沙班片来源于日本第一三共株式会社,规格为60mg,两个批次分别为参比制剂ⅰ、参比制剂ⅱ。表5时间(min)101520304560f2处方162.075.781.687.391.497.980处方256.973.579.685.889.595.376参比制剂ⅱ58.275.783.189.593.699.4/结果显示,处方2包衣片剂的溶出速率较处方1的溶出偏慢,且与原研溶出数据进行对比发现,处方1与原研溶出更接近。实施例3包衣增重的考察采用处方1的制备方法,压片后得到片芯。考察自研包衣粉不同包衣增重对溶出的影响。取预热后的100片片芯计算平均片重作为初始片重,当包衣液用量达到理论增重3.5%和5.0%时,停止包衣。得到处方4和处方5,处方如表6所示:表6采用与实施例1相同的方法,检测各处方和参比制剂在ph6.6磷酸盐缓冲液的溶出介质中的溶出曲线,结果见表7和图3。表7时间/min101520304560f2处方464.872.876.782.286.596.574处方562.270.275.581.286.888.479参比制剂ⅰ61.571.273.278.582.985.9/结果表明,包衣剂用量在10-25mg范围内,优选地,12-22mg,更优选地,14-20mg范围内都能得到合格的甲苯磺酸艾多沙班片,且溶出行为与原研制剂相似。实施例4有关物质的检测对处方1和处方3进行有关物质测定。有关物质测定方法按照高效液相色谱法(中国药典2020年版四部通则0512)测定。供试品溶液分别取处方1和处方3的包衣片适量,精密称定,加溶剂适量使溶解,并定量稀释制成每1ml中约含艾多沙班1.2mg的溶液,作为供试品溶液。对照溶液精密量取对照品溶液1ml,置200ml量瓶中,用溶剂稀释至刻度,摇匀。系统适用性溶液取甲苯磺酸艾多沙班对照品、杂质ⅰ对照品适量,加溶剂溶解并定量稀释制成每1ml中约含艾多沙班1.2mg,杂质ⅰ2.4μg的溶液,作为定位溶液。色谱条件用十八烷基硅烷键合硅胶为填充剂或效能相当的色谱柱;以磷酸盐缓冲液-乙腈为流动相,在检测波长为290nm;柱温为40℃;样品室温度为10℃,进样体积10μl。经检测,处方3中检测出如下结构的杂质i,含量为0.05%,处方1中未检出;处方1和处方3均未检出其他杂质。杂质i为2-{[(1r,2s,5s)-2-(2-((5-氯吡啶-2-基)氨基)-2-氧代乙酰胺基)-5-(二甲氨基甲酰基)环己基]氨基甲酰基}-5-甲基-4,5,6,7-四氢[1,3]噻唑并[5,4-c]吡啶-5-氧化物,结构式如下所示:可见,本发明的自研包衣剂具有较少的杂质。实施例5将处方1制备两个批次,分别为批次1、批次2,分别在加速和长期条件下进行稳定性考察,检测了溶出度并与参比制剂甲苯磺酸艾多沙班片参比制剂ⅱ进行了比较。溶出度取本品,按照溶出度与释放度测定法(中国药典2015版通则0931,第二法)以ph6.0磷酸盐缓冲液900ml为溶出介质,转速为每分钟50转,依法操作,经30分钟时,检测溶出度,限度为30min的溶出度为标示量的75%。溶出度结果如下表8-9所示。表8批号(40℃±2℃、rh75%±5%)03个月批次189%89%批次288%88%参比制剂ⅱ91%82%表9批号(25℃±2℃、rh60%±5%)03个月批次189%87%批次288%86%参比制剂ⅱ91%85%加速试验和长期试验条件下的溶出度结果显示,在加速条件下(40℃±2℃、rh75%±5%),本发明的甲苯磺酸艾多沙班的药物组合物的3个月溶出度与0时一致,但是参比制剂ⅱ的溶出度从91%降到了82%,在长期条件下(25℃±2℃、rh60%±5%),本发明的甲苯磺酸艾多沙班药物组合物的溶出度下降较少,表明本发明的艾多沙班的药物组合物具有更优的稳定性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1