氟达拉滨对RNA病毒的抗病毒感染的新用途
本发明属于医药技术领域,具体为氟达拉滨对rna病毒的抗病毒感染的新用途。
背景技术:
寨卡病毒(zikavirus,zikv)是虫媒病毒,主要通过伊蚊叮咬传播,亦可通过母婴传播,包括宫内感染和产道感染。也有研究支持zikv可通过血液及性传播。zikv为单股正链rna病毒,基因组长度约10.7kb,含5'和3'端两个非蛋白编码区侧翼和一个开放读码框,可编码衣壳蛋白、前膜/膜蛋白、包膜蛋白三个结构蛋白和ns1、ns2a、ns2b、ns3、ns4a、ns4b、ns5七个非结构蛋白(non-structuralproteins)。包膜蛋白主要负责病毒与感染宿主的受体识别,介导病毒入侵,是病毒最主要的保护性抗原。zikv根据ns5进行基因分型,分为亚洲型(如sz01)和非洲型(如mr766)两种型别。针对zikv的感染,目前尚无特效药物治疗和专用疫苗预防。
发热伴血小板减少综合征病毒(severefeverwiththrombocytopeniasyndromevirus,sftsv)感染可引起发热、血小板减少、白细胞减少、多脏器衰竭、脑炎脑病等症状,其中脑炎脑病的发生是与致命结局相关的主要危险因素,sftsv感染病例死亡率高达30%。sftsv主要通过蜱虫叮咬传播,此外也有研究表明接触被感染的家畜或啮齿类动物及患者的血液和分泌物也可能被感染。sftsv是布尼亚病毒科白蛉病毒属病毒,为单股负链rna病毒,基因组包括l(large)、m(medium)、s(small)三个节段。l节段编码rna依赖的rna聚合酶;m节段编码糖蛋白前体;s节段编码核蛋白np(nucleoprotein)与非结构蛋白nss(non-structuralprotein)。sftsv基因组遗传进化分析显示,sftsv毒株主要分为中国基因型(a-d)和日本基因型(e)两个主要分支。目前,还未有批准的可用于治疗sftsv感染的特异性药物,现亟需对sftsv感染的特异性药物开展研究。
手足口病(hand-footandmouthdisease,hfmd)是我国法定报告管理的丙类传染病,由肠道病毒感染引起,以肠道病毒71型(enterovirus71,ev71)感染最为多见,为小于5岁儿童多发的一种常见传染病。大多数患者病情轻微,以手、足和口腔等部位疱疹或斑丘疹为主,可伴有发热、咳嗽,少数患者可进展为重症,甚至死亡。重症患儿可出现中枢神经系统、呼吸系统损害及循环障碍等,引发无菌性脑膜炎、脑炎、脑脊髓炎、急性弛缓性麻痹、神经源性肺水肿和心肌炎等疾病。病毒传播途径主要为粪-口途径或是接触患者鼻咽分泌物,偶尔也会因接触病毒污染的物品而间接感染。四季均有发病,以夏、秋季高发。ev71为小rna病毒科肠道病毒属a组的单股正链rna病毒,无包膜,基因组长约7.4kb,主要编码vp1~vp4(viralrna-encodedp1polyprotein)四种结构蛋白和ns2a~2c和ns3a~3d七种非结构蛋白,具有嗜神经性。目前,针对ev71的感染,尚无特效药物治疗。
上述三种病毒虽分属不同种属,但同为rna病毒,且具有嗜神经性,对人类健康造成严重威胁。因此,开发安全有效的抗病毒治疗方法是对抗这些病毒病原体的当务之急。
氟达拉滨(fludarabine)是一种嘌呤类似物,主要用于治疗慢性淋巴细胞白血病,1991年在美国获准作为抗肿瘤药物使用,经测试对多种肿瘤有效。氟达拉滨的作用机制与胞嘧啶相似,其在血清中去磷酸化为9-p-d-阿拉伯呋喃糖基-2-氟腺嘌呤(2f-ara-a),进而被细胞摄取。进入细胞后,2f-ara-a被脱氧胞苷激酶磷酸化为具有药理活性的形式,三磷酸盐2f-ara-atp,2f-ara-atp进一步与核酸结合,通过抑制核糖核苷酸还原酶和dna聚合酶抑制dna的合成。也有人推测氟达拉滨可以通过减少尿苷和亮氨酸与rna和蛋白质的结合,抑制rna及蛋白的合成。
技术实现要素:
针对上述情况,为弥补上述现有缺陷,本发明提供了一种氟达拉滨对rna病毒的抗病毒感染的新用途。
本发明提供如下的技术方案:本发明氟达拉滨对rna病毒的抗病毒感染的新用途,氟达拉滨在rna病毒的抗病毒感染上的应用。
进一步地,所述氟达拉滨的结构式为:
进一步地,所述rna病毒为zikv。
进一步地,所述rna病毒为sftsv。
进一步地,所述rna病毒为ev71。
进一步地,所述氟达拉滨采用dmso溶解至母液浓度为10mm,-80℃冰箱保存。
采用上述结构本发明取得的有益效果如下:本发明氟达拉滨对rna病毒的抗病毒感染的新用途,通过检测胞内病毒复制增殖情况,表明氟达拉滨对zikv、sftsv及ev71在vero、bhk21及神经细胞u251、hmc3中均有很好的抗病毒感染作用,氟达拉滨是一种有效的广谱抗病毒感染的抑制剂。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
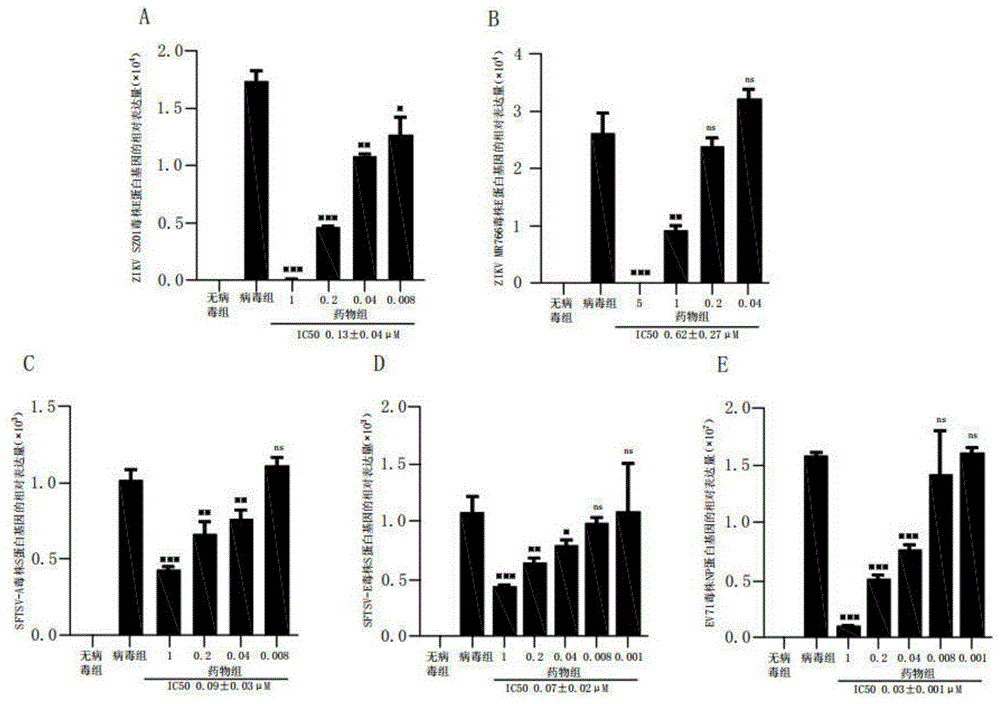
图1为本发明氟达拉滨对rna病毒的抗病毒感染的新用途实施例1的检测结果图;
图2为本发明氟达拉滨对rna病毒的抗病毒感染的新用途实施例1中zikvsz01毒株e蛋白表达的wb图;
图3为本发明氟达拉滨对rna病毒的抗病毒感染的新用途实施例1中sftsv-a毒株np蛋白表达的wb图;
图4为本发明氟达拉滨对rna病毒的抗病毒感染的新用途在光学显微镜下在vero细胞中氟达拉滨对ev71感染的抑制活性;
图5为本发明氟达拉滨对rna病毒的抗病毒感染的新用途实施例2的检测结果图;
图6为本发明氟达拉滨对rna病毒的抗病毒感染的新用途实施例3的检测结果图;
图7为本发明氟达拉滨对rna病毒的抗病毒感染的新用途实施例4的检测结果图;
图8为本发明氟达拉滨对rna病毒的抗病毒感染的新用途实施例5的检测结果图;
图9为本发明氟达拉滨对rna病毒的抗病毒感染的新用途实施例6的检测结果图;
图10为本发明氟达拉滨对rna病毒的抗病毒感染的新用途实施例7的检测结果图;
图11为本发明氟达拉滨对rna病毒的抗病毒感染的新用途实施例8的检测结果图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是,下面描述中使用的词语“前”、“后”、“左”、“右”、“上”和“下”指的是附图中的方向,词语“内”和“外”分别指的是朝向或远离特定部件几何中心的方向。
如图1-11所示,图中**代表p≤0.05,**代表p≤0.01,***代表p≤0.001,ns代表无统计学差异。
实施例1
在vero细胞中检测氟达拉滨对zikvsz01毒株、zikvmr766毒株、sftsv-a型毒株和sftsv-e型毒株及ev71毒株感染的抑制活性
(1)使用含2%fbs的dmed在24孔板中稀释氟达拉滨,使其终浓度为10μm、2μm、0.4μm、0.08μm、0.016μm、0.002μm,每孔加药体积为250μl,每个浓度设置3个重复;
(2)使用含2%fbs的dmem稀释zikvsz01毒株和zikvmr766毒株、sftsv-a型毒株和sftsv-e型毒株、ev71毒株,使得病毒终浓度均为0.1moi,以每孔250μl的量加入(1)中的24孔板(同时添加药物及病毒的孔,记为药物组),同时设置病毒感染的阳性对照组(有病毒无药物,记为病毒组)和阴性对照组(无病毒无药物,记为无病毒组);
(3)使用胰酶消化vero细胞,用10%fbs的dmed将细胞铺到24孔板,调整细胞密度为1x105个/孔,过夜培养后,弃去培养液,以500μl每孔加入(2)中孵育好的培养液,37℃、5%co2培养2h,弃去上清,pbs洗两次,更换为含2%fbs的dmed继续培养24h;
(4)显微镜观察细胞病变;收集细胞裂解液,wb分别检测细胞内参蛋白β-actin、zikvsz01e蛋白、sftsvnp蛋白的表达;提取细胞总rna,用nanodrop测定浓度后每个样本取1μg细胞总rna进行逆转录得到cdna产物,选择gapdh基因作为内参基因,检测zikve基因、sftsvs基因、ev71np基因表达变化以反应氟达拉滨抑制病毒胞内复制情况,基因表达水平的倍数变化按照公式2-△△ct进行计算,其中,△ct=目的基因-内参基因,△△ct=实验组△ct-对照组△ct,graphpadprism8软件处理实验数据。
实验结果如图1所示,在vero细胞中,氟达拉滨可以剂量依赖性抑制zikvsz01和zikvmr766毒株的感染,ic50分别为0.13±0.04μm和0.62±0.27μm;氟达拉滨可以剂量依赖性抑制sftsv-a型和sftsv-e型毒株的感染,ic50分别为0.09±0.03μm和0.07±0.02μm;氟达拉滨可以剂量依赖性抑制ev71毒株的感染,ic50为0.03±0.001μm。
同时,由图2-3的wb实验结果可知,氟达拉滨通过对病毒胞内扩增的抑制,对病毒(zikvsz01和sftsv-a)蛋白的表达也呈剂量依赖性的抑制。
由图4可知,氟达拉滨可剂量依赖性地减少ev71病毒感染引起的细胞病变,其中,图4中a图为无病毒无药物的细胞图,b图为有病毒无药物的感染病变图;图c-e为同时添加药物及病毒的感染病变图,其中c图氟达拉滨添加量为1μm,d图氟达拉滨添加量为0.2μm,e图氟达拉滨添加量为0.04μm。
实施例2
在bhk21细胞中检测氟达拉滨对zikvsz01毒株、sftsv-a型毒株及ev71毒株感染的抑制活性
(1)使用含2%fbs的dmed在24孔板中稀释氟达拉滨,使其终浓度为2μm、0.4μm、0.08μm、0.016μm,每孔加药体积为250μl,每个浓度设置3个重复;
(2)使用含2%fbs的dmem稀释zikvsz01毒株、sftsv-a型毒株及ev71毒株,使得病毒终浓度均为0.1moi,每孔250μl加入(1)中的24孔板(同时添加药物及病毒的孔记为药物组),同时设置病毒感染的阳性对照组(有病毒无药物,记为病毒组)和阴性对照组(无病毒无药物,记为无病毒组);
(3)使用胰酶消化bhk21细胞,用含10%fbs的dmed将细胞铺到24孔板,调整细胞密度为1x105个/孔,过夜培养后,弃去培养液,500μl每孔加入(2)中孵育好的培养液,37℃、5%co2培养2h,弃去上清,pbs洗两次,更换为2%fbs的dmed继续培养24h;
(4)提取细胞总rna,用nanodrop测定浓度后每个样本取1μg细胞总rna进行逆转录得到cdna产物,选择gapdh基因作为内参基因,检测zikve基因、sftsvs基因、ev71np基因表达变化反应氟达拉滨抑制病毒胞内复制情况,基因表达水平的倍数变化按照公式2-△△ct进行计算,其中,△ct=目的基因-内参基因,△△ct=实验组△ct-对照组△ct,graphpadprism8软件处理实验数据。
实验结果如图5所示,在bhk21细胞中,氟达拉滨可以剂量依赖性抑制zikvsz01毒株的感染,ic50为0.41±0.04μm;氟达拉滨可以剂量依赖性抑制sftsv-a型毒株的感染,ic50为0.20±0.001μm;氟达拉滨可以剂量依赖性抑制ev71毒株的感染,ic50为0.36±0.16μm。
实施例3
在神经星形胶质细胞u251中检测氟达拉滨对zikvsz01毒株、sftsv-a型毒株及ev71毒株感染的抑制活性
(1)使用含2%fbs的mem在24孔板中稀释氟达拉滨,使其终浓度为10μm、2.50μm、0.62μm、0.16μm、0.04μm,每孔加药体积为250μl,每个浓度设置3个重复;
(2)使用含2%fbs的mem稀释zikvsz01毒株、sftsv-a型毒株及ev71毒株,使得病毒终浓度均为0.1moi,每孔250μl加入(1)中的24孔板(同时添加药物及病毒的孔记为药物组),同时设置病毒感染的阳性对照组(有病毒无药物,记为病毒组)和阴性对照组(无病毒无药物,记为无病毒组);
(3)使用胰酶消化u251细胞,用含10%fbs的mem将细胞铺到24孔板,调整细胞密度为1x105个/孔,过夜培养后,弃去培养液,500μl每孔加入(2)中孵育好的培养液,37℃、5%co2培养2h,弃去上清,pbs洗两次,更换为2%fbs的mem继续培养24h;
(4)提取细胞总rna,用nanodrop测定浓度后每个样本取1μg细胞总rna进行逆转录得到cdna产物。选择gapdh基因作为内参基因,检测zikve基因、sftsvs基因、ev71np基因表达变化反应氟达拉滨抑制病毒胞内复制情况,基因表达水平的倍数变化按照公式2-△△ct进行计算,其中,△ct=目的基因-内参基因,△△ct=实验组△ct-对照组△ct,graphpadprism8软件处理实验数据。
实验结果如图6所示,在神经星形胶质细胞u251中,氟达拉滨可以剂量依赖性抑制zikvsz01毒株的感染,ic50为0.38±0.12μm;氟达拉滨可以剂量依赖性抑制sftsv-a型毒株的感染,ic50为0.25±0.17μm;氟达拉滨可以剂量依赖性抑制ev71毒株的感染,ic50为0.36±0.07μm。
实施例4
在神经小胶质细胞hmc3中检测氟达拉滨对zikvsz01毒株、sftsv-a型毒株及ev71毒株感染的抑制活性
(1)使用2%fbs的mem在24孔板中稀释氟达拉滨,使其终浓度为10μm、2.5μm、2μm、0.62μm、0.4μm、0.16μm、0.08μm,每孔加药体积为250μl,每个浓度设置3个重复;
(2)使用2%fbs的mem稀释zikvsz01毒株、sftsv-a型毒株及ev71毒株,使得病毒终浓度均为0.1moi,每孔250μl加入(1)中的24孔板(同时添加药物及病毒的孔记为药物组),同时设置病毒感染的阳性对照组(有病毒无药物,记为病毒组)和阴性对照组(无病毒无药物,记为无病毒组);
(3)使用胰酶消化hmc3细胞,用10%fbs的mem将细胞铺到24孔板,调整细胞密度为1x105个/孔,过夜培养后,弃去培养液,250μl每孔加入(2)中孵育好的培养液,37℃、5%co2培养2h,弃去上清,pbs洗两次,更换为2%fbs的mem继续培养24h;
(4)提取细胞总rna,用nanodrop测定浓度后每个样本取1μg细胞总rna进行逆转录得到cdna产物。选择gapdh基因作为内参基因,检测zikve基因、sftsvs基因、ev71np基因表达变化反应氟达拉滨抑制病毒胞内复制情况,基因表达水平的倍数变化按照公式2-△△ct进行计算,其中,△ct=目的基因-内参基因,△△ct=实验组△ct-对照组△ct,graphpadprism8软件处理实验数据。
实验结果如图7所示,在神经小胶质细胞hmc3中,氟达拉滨可以剂量依赖性抑制zikvsz01毒株的感染,ic50为0.32±0.07μm;氟达拉滨可以剂量依赖性抑制sftsv-a型毒株的感染,ic50为0.33±0.01μm;氟达拉滨可以剂量依赖性抑制ev71毒株的感染,ic50为0.94±0.09μm。
实施例5
氟达拉滨对vero、bhk21、u251和hmc3细胞的毒性检测
(1)将vero、bhk21、u251和hmc3细胞分别铺于96孔板中,每孔1x104个,37℃、5%co2条件下培养12h后使用;
(2)使用含2%fbs的dmem或mem稀释氟达拉滨,使其浓度为25μm、12.5μm、6.25μm、3.12μm、1.56μm、0.78μm,每孔100μl,每个浓度设置3个重复,记为药物组,同时设置对照组(记为单纯dmem或mem);
(3)37℃、5%co2条件下培养48h后,显微镜下观察细胞状态;
(4)吸弃96孔板的上清液,每孔加入10μlcck8与90μl含2%fbs的dmem或mem的混合液,37℃、5%co2条件下培养2h,使用酶标仪测定各孔od450的吸光度值;
(5)计算细胞的活性,计算公式为:细胞活性=(药物孔-无细胞孔)×100%/(无药物孔-无细胞孔)。
实验结果如图8所示,不同浓度(25μm、12.5μm、6.25μm、3.12μm、1.56μm、0.78μm)的氟达拉滨与vero、bhk21、u251和hmc3细胞共孵育,37℃培养48h,细胞的半数抑制浓度(cc50)分别为3.10±0.20μm、1.61±0.07μm、6.21±5.3μm和12.56±2.3μm,说明氟达拉滨在有效抗病毒感染浓度是安全的。
实施例6
氟达拉滨在vero细胞中时间依赖性抑制zikvsz01毒株感染
(1)将vero细胞铺板于24孔板中,每孔1x105个细胞,37℃、5%co2条件下培养12h后待用;
(2)按照下述步骤在不同时间点加入氟达拉滨:
a、氟达拉滨在感染前先与vero细胞在37℃共孵育2h,记录此时间点为-2h;
b、病毒与氟达拉滨同时加入到细胞中,记录此时间点为0h;
c、病毒与细胞孵育不同时间点(2h、8h、16h、24h、36h、48h)后,加入氟达拉滨,分别记录时间点为2h、8h、16h、24h、36h、48h,上述试验孔记为药物组,同时设置病毒感染的阳性对照组(有病毒无药物,记为病毒组)及阴性对照组(无病毒无药物,记为无病毒组),每组设置3个重复,氟达拉滨浓度为0.5μm,病毒量为0.1moi;
(3)在37℃、5%co2条件下培养36h后提取细胞总rna,每个样本取1μg细胞总rna进行逆转录得到cdna产物,选择gapdh基因作为内参基因,检测zikve基因片段表达水平变化反应氟达拉滨抑制病毒胞内复制情况,基因表达水平的倍数变化按照公式2-△△ct进行计算,其中,△ct=目的基因-内参基因,△△ct=实验组△ct-对照组△ct,graphpadprism8软件处理实验数据。
(4)37℃、5%co2条件下培养48h后,显微镜下观察细胞状态。
实验结果如图9所示,氟达拉滨与细胞提前孵育2h,可以抑制超过90%的zikv感染;病毒感染后不同时间点加入氟达拉滨,发现病毒感染8h后加入氟达拉滨仍然可以抑制超过60%的zikv,病毒感染24h后加入氟达拉滨抑制接近8.5%的zikv。
实施例7
氟达拉滨在vero细胞中时间依赖性抑制sftsv-a型毒株感染
(1)将vero细胞铺板于24孔板中,每孔1x105个细胞,37℃、5%co2条件下培养12h后待用;
(2)按照下述步骤在不同时间点加入氟达拉滨:
a、氟达拉滨在感染前先与vero细胞在37℃共孵育2h,记录此时间点为-2h;
b、病毒与氟达拉滨同时加入到细胞中,记录此时间点为0h;
c、病毒与细胞孵育不同时间点(2h、8h、16h、24h、36h)后,加入氟达拉滨,分别记录时间点为2h、8h、16h、24h、36h。上述试验孔记为药物组,同时设置病毒感染的阳性对照组(有病毒无药物,记为病毒组)及阴性对照组(无病毒无药物,记为无病毒组),每组设置3个重复,氟达拉滨浓度为0.5μm,病毒量为0.1moi;
(3)在37℃、5%co2条件下培养36h后提取细胞总rna,每个样本取1μg细胞总rna进行逆转录得到cdna产物,选择gapdh基因作为内参基因,检测sftsvs基因片段表达水平变化反应氟达拉滨抑制病毒胞内复制情况,基因表达水平的倍数变化按照公式2-△△ct进行计算,其中,△ct=目的基因-内参基因,△△ct=实验组△ct-对照组△ct,graphpadprism8软件处理实验数据。
实验结果如图10所示,氟达拉滨与细胞提前孵育2h,可以抑制超过74%的sftsv感染;病毒感染后不同时间点加入氟达拉滨,发现病毒感染8h后加入氟达拉滨仍然可以抑制超过70%的sftsv,病毒感染36h后加入氟达拉滨仍可以抑制接近25%的sftsv感染,表明氟达拉滨对sftsv感染抑制的作用时间较长。
实施例8
氟达拉滨在vero细胞中时间依赖性抑制ev71毒株感染
(1)将vero细胞铺板于24孔板中,每孔1x105个细胞,37℃、5%co2条件下培养12h后待用;
(2)按照下述步骤在不同时间点加入氟达拉滨:
a、氟达拉滨在感染前先与vero细胞在37℃共孵育2h,记录此时间点为-2h;
b、病毒与氟达拉滨同时加入到细胞中,记录此时间点为0h;
c、病毒与细胞孵育不同时间点(2h、8h、16h、24h、36h)后,加入氟达拉滨,分别记录时间点为2h、8h、16h、24h、36h。上述试验孔记为药物组,同时设置病毒感染的阳性对照组(有病毒无药物,记为病毒组)及阴性对照组(无病毒无药物,记为无病毒组),每组设置3个重复,氟达拉滨浓度为0.5μm,病毒量为0.1moi;
(3)在37℃、5%co2条件下培养36h后提取细胞总rna,每个样本取1μg细胞总rna进行逆转录得到cdna产物,选择gapdh基因作为内参基因,检测ev71np基因片段表达水平变化反应氟达拉滨抑制病毒胞内复制情况,基因表达水平的倍数变化按照公式2-△△ct进行计算,其中,△ct=目的基因-内参基因,△△ct=实验组△ct-对照组△ct,graphpadprism8软件处理实验数据。
实验结果如图11所示,氟达拉滨与细胞提前孵育2h,可以抑制超过84%的ev71感染;病毒感染后不同时间点加入氟达拉滨,发现病毒感染8h后加入氟达拉滨仍然可以抑制超过80%的ev71,病毒感染36h后加入氟达拉滨仍可以抑制接近23%的ev71感染,表明氟达拉滨对ev71感染抑制的作用时间较长。
要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物料或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物料或者设备所固有的要素。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!