基于微流控芯片从血液中制备凝胶液滴单核细胞疫苗的装置及方法
本发明属于微流控技术与癌症免疫治疗学的交叉领域,具体涉及一种基于微流控芯片从血液中制备凝胶液滴单核细胞疫苗的装置及方法。
背景技术:
20世纪初以来,利用免疫系统的精巧特异性消除肿瘤的方法一直在发展。在过去的十年中,出现了一些有效的策略,因此免疫疗法现在被广泛认为是治疗癌症患者的重要补充工具。癌症疫苗是通过主动免疫来放大肿瘤特异性t细胞反应,一直以来被认为是有效癌症免疫治疗的关键工具。现在基因组学、数据科学和癌症免疫治疗方面的技术进步可以绘制基因组内的突变图谱,合理选择疫苗靶点,并按需生产针对患者个体肿瘤定制疗法。因此,个性化疫苗的临床应用面临的一个关键挑战之一,是快速制造、价格合理和及时交付个体定制的疫苗。
微流控技术具有巨大的潜力,可以为此提供解决方案,因为它可以处理无法大量获得的样品(例如,来自患者活检的细胞),具有成本低效益高,提供高度的自动化,并允许为癌症研究建立复杂的模型。这种工艺可以快速、廉价地制造出具有微米级定义几何形状的芯片,从而使微流控技术为广大研究界所接受。将试剂注入到这种装置中,可以处理和分析10-6到10-16l的液体,从而大大减少了试剂的使用量,提高了灵敏度,实现了精确的单细胞测量。在小的通道尺寸中,粘性力成为主导,水基流体开始表现得像粘性流体。由此产生的层流系统可以精确控制注入的流体,如稳定的浓度梯度或混溶试剂的平行流动。
利用这些技术,微流控芯片可以从血液中简单地分离dna、蛋白质、免疫细胞、细胞外囊泡或罕见的循环肿瘤细胞,然后进行片上多路分析,达到患者分类和按个人所需的药物定量。可以定期采集血样,持续观察患者。这些微流控技术设备需要很小的样本量,并能够创建癌症的即时快照,可作为癌症风险指示、早期检测、肿瘤分类和复发的工具。因此,利用微流控芯片,快速制备不同患者携带自身细胞抗原的细胞疫苗,节省临床治疗准备时间。它也可以很容易地与其他佐剂结合进行联合治疗,这有望为芯片辅助个性化治疗带来新思路。
技术实现要素:
本发明的目的在于提供一种基于微流控芯片从血液中制备凝胶液滴单核细胞疫苗的装置及方法。本发明利用流体力学和液滴微流控技术实现了从血液中高效便捷的制备一种凝胶液滴单核细胞疫苗,将血液、缓冲液、抗原和佐剂依次通入芯片中,即可得到一种海藻酸盐凝胶液滴单核细胞疫苗,并在小鼠(balb/c)肿瘤模型中得到了良好的抑制肿瘤生长和预防效果。本发明装置结构简单,无需任何复杂和昂贵的设备,可实现操作方便,自动化快速的制备肿瘤疫苗。因此,本发明提供了一种快速便捷的疫苗生产平台,在癌症的个性化免疫治疗领域具有应用价值。
本发明的目的通过下述技术方案实现:
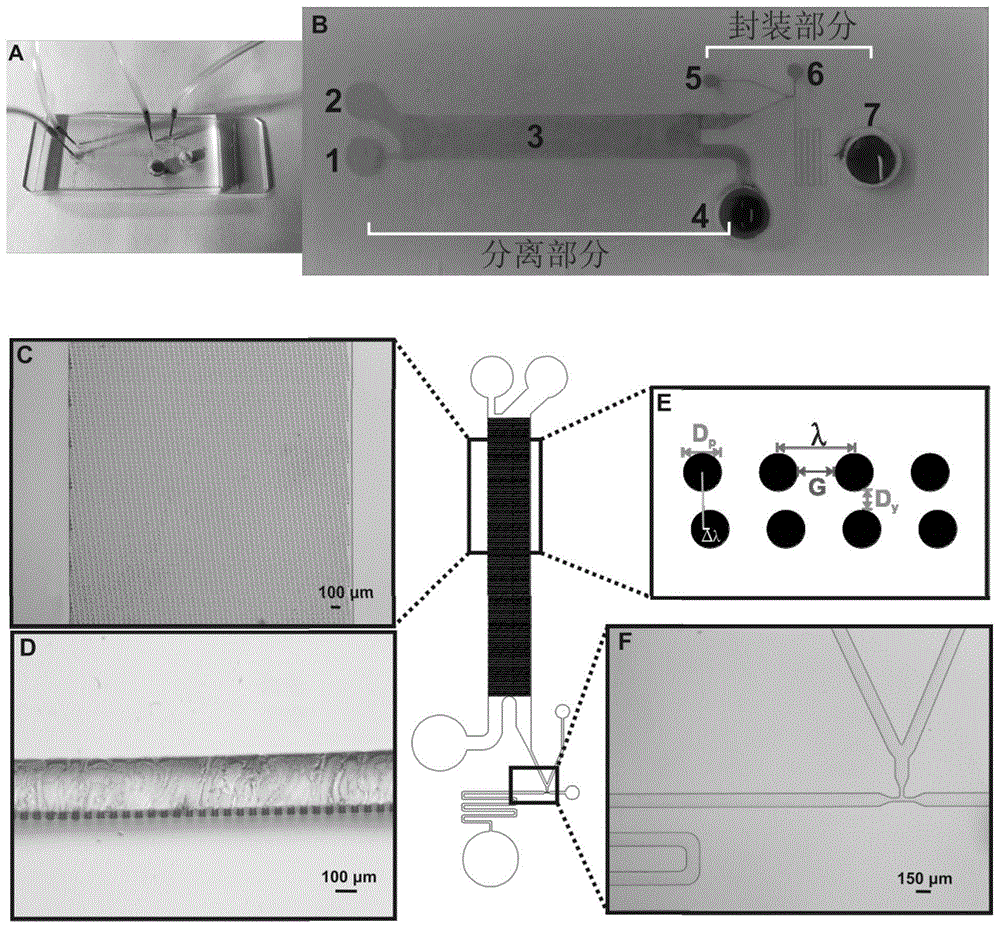
一种基于微流控芯片从血液中制备凝胶液滴单核细胞疫苗的装置,包括分离区域、封装区域。分离区域包括一个血液入口(1)、缓冲液入口(2)、微柱阵列分离区(3)和废液收集区(4);封装区域包括抗原和佐剂入口(5)、油相入口(6)和凝胶液滴肿瘤疫苗收集区(7)。血液入口(1)、缓冲液入口(2)通过通道与微柱阵列分离区(3)的前端连接,废液收集区(4)通过通道与微柱阵列分离区(3)的末端连接;抗原和佐剂入口(5)、油相入口(6)和凝胶液滴肿瘤疫苗收集区(7)之间通过通道连接;微柱阵列分离区(3)的末端通过分离单核细胞的出口通道与抗原和佐剂通道连接,两通道形成v型通道汇合后与油相通道垂直相交形成t型接口通道,t型接口通道之后利用一个蛇形通道和收集区(7)连接。其中,微柱阵列分离区(3)由微柱阵列构成,微柱按照一定尺寸排列,构成一定的偏移通道。其设计原理为:根据横向侧移理论和目标细胞的直径大小,可以计算得到一个临界值,细胞直径大于临界值会按照阵列倾斜角度做横向侧移,进入封装区域;细胞直径小于临界值的会垂直移动进入废液收集区。进入封装区域的细胞利用微流控液滴技术,通过t型结构通道,在流体剪切力和表面张力之间的相互作用下将连续的流体分割成离散的纳升级油包水液滴,液滴包裹细胞、抗原和佐剂。
进一步地,所述装置的具体尺寸如下:芯片长40mm,宽10mm。微柱阵列分离区(3)中的微柱阵列:圆柱高30μm,直径dp=30μm,两个圆柱之间的水平距离g=20μm,圆柱之间的垂直距离dy=10μm,圆心偏移距离△λ=5μm,构成一定的偏移通道,倾角θ=5.7°;根据理论计算得出临界直径dc=9.3μm,血液中大于此临界直径的细胞将会做横向侧移运动,被分离出来,小于此临界直径的细胞会垂直流动进入废液收集区。封装区域v型通道尺寸为150μm×30μm,t型接口通道尺寸为50μm×30μm,蛇形通道尺寸为150μm×30μm。
所述装置的工作原理为:将血液和缓冲液分别通入芯片,其中缓冲液为含海藻酸盐和ca-edta络合物的混合液。血液中单核细胞经过分离区域被分离出来,进入封装区域后,载有单核细胞的缓冲液和混有抗原和佐剂的溶液在v型通道口处混合,之后垂直进入油相通道,产生液滴,在收集区加入适量乙酸使液滴凝胶化,最终得到海藻酸盐凝胶液滴。所得凝胶液滴中封装了单核细胞、抗原和佐剂。随后海藻酸盐凝胶液滴加入到含全氟辛醇(pfo)的水相中,pfo通过分离表面活性剂降低了油水界面的稳定性,一旦油水界面失稳,微凝胶就会立即从油相转移到水相,离心弃去油相,重新分散到水相,得到凝胶液滴抗原装载的单核细胞疫苗。
一种基于上述装置从血液中制备凝胶液滴单核细胞疫苗的方法,包括如下步骤:将上述装置的血液入口(1)、缓冲溶液入口(2)、抗原和佐剂入口(5)和油相入口(6)分别连接泵通入血液、缓冲溶液、抗原和佐剂、油相,在凝胶液滴肿瘤疫苗收集区(7)加入体积比为0.05%-0.1%的乙酸,凝胶化后转移至含有15-25%(v/v)全氟辛醇的水相中,离心,弃去油相,得到凝胶液滴单核细胞疫苗,将其重新分散到水相中备用。
其中,所述的缓冲溶液为含40-50mm海藻酸盐和40-50mmca-edta络合物的pbs缓冲液;
所述的抗原为癌细胞裂解物,富含肿瘤细胞的全部信息;
所述的佐剂为免疫抑制分子、抗体、细胞因子等;
所述的油相为有机氟化物,如氟代烃油;
所述的水相为pbs缓冲液。
本发明基于微流控芯片从血液中制备海藻酸盐凝胶液滴单核细胞疫苗,利用芯片分离的单核细胞,可在海藻酸盐凝胶液滴结构中长期保持活性,快速摄取抗原,保存自身分泌的细胞连接蛋白。因此,本发明具有操作简便、成本低、制备疫苗效率高,并且疫苗治疗和预防效果好,可在癌症的个性化免疫治疗领域得到应用。其还具有如下优点和有益效果:(1)单核细胞在凝胶液滴中可以长期培养存活,而且凝胶液滴中的单核细胞由于抗原的浓度局部提高,从而快速被摄取,大大减少了抗原摄取时间,只需要30-40分钟细胞中抗原达到饱和,提高了疫苗制备效率。(2)由于单核细胞释放的连接蛋白被存储在凝胶液滴中缓慢释放,只需要较少的单核细胞,就可以达到利用常规过继性细胞免疫疗法激发特异性t细胞的比例。
附图说明
图1:(a)微流控芯片示意图;(b)芯片结构图;(c、f)局部放大图;(d)圆柱高度图;(e)结构尺寸图。
图2:(a)海藻酸盐凝胶液滴单核细胞疫苗明场图;(b)海藻酸盐凝胶液滴单核细胞荧光场图;(c)不同时间单核细胞在液滴中摄取抗原的荧光场图;(d)不同单核细胞数量的凝胶液滴疫苗的特异性细胞毒性t淋巴细胞测定;(e)连接蛋白cx43在凝胶液滴中的释放测定。
图3:(a)29天内肿瘤的体积测量;(b)29天内小鼠的体重测量。
图4:(a)免疫之后,29内的肿瘤体积测量;(b)小鼠存活率。
具体实施方式
以下实施例用于进一步说明本发明,但不应理解为对本发明的限制。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1:利用芯片制备凝胶液滴单核细胞疫苗
一种基于微流控芯片从血液中制备凝胶液滴单核细胞疫苗的装置,其结构如图1所示:包括分离区域、封装区域。分离区域包括一个血液入口(1)、缓冲液入口(2)、微柱阵列分离区(3)和废液收集区(4);封装区域包括抗原和佐剂入口(5)、油相入口(6)和凝胶液滴肿瘤疫苗收集区(7)。血液入口(1)、缓冲液入口(2)通过通道与微柱阵列分离区(3)的前端连接,废液收集区(4)通过通道与微柱阵列分离区(3)的末端连接;抗原和佐剂入口(5)、油相入口(6)和凝胶液滴肿瘤疫苗收集区(7)之间通过通道连接;微柱阵列分离区(3)的末端通过分离单核细胞的出口通道与抗原和佐剂通道连接,两通道形成v型通道汇合后与油相通道垂直相交形成t型接口通道(图1f),t型接口通道之后利用一个蛇形通道和收集区(7)连接。其中,微柱阵列分离区(3)由微柱阵列构成,微柱按照一定尺寸排列,构成一定的偏移通道。其设计原理为:根据横向侧移理论和目标细胞的直径大小,可以计算得到一个临界值,细胞直径大于临界值会按照阵列倾斜角度做横向侧移,进入封装区域;细胞直径小于临界值的会垂直移动进入废液收集区。
所述装置的具体尺寸如下:芯片长40mm,宽10mm。微柱阵列分离区(3)中的微柱阵列(图1d、e):圆柱高30μm,直径dp=30μm,两个圆柱之间的水平距离g=20μm,圆柱之间的垂直距离dy=10μm,圆心偏移距离△λ=5μm,构成一定的偏移通道,倾角θ=5.7°;根据理论计算得出临界直径dc=9.3μm,血液中大于此临界直径的细胞将会做横向侧移运动,被分离出来,小于此临界直径的细胞会垂直流动进入废液收集区。封装区域,v型通道尺寸为150μm×30μm,t型接口通道尺寸为50μm×30μm(图1f),蛇形通道尺寸为150μm×30μm。
芯片制作好之后通过照紫外杀菌备用,在制备细胞疫苗之前,将1%的bsa溶液通入芯片,以减少细胞和通道成分的粘附。小鼠眼眶静脉丛取血,血液被储存在一个血液收集管中,预先加入肝素钠作为抗凝剂。缓冲液为含50mm海藻酸盐和50mmca-edta络合物的pbs缓冲液。如图1(a)所示,将血液入口(1)和缓冲溶液入口(2)分别连接到注射泵,以恒定的流量同时驱动样品。流速分别为qv1(血液)=1μl/min,qv2(缓冲液)=5μl/min,待分离部分稳定(约5min左右),之后抗原和佐剂入口(5)和油相入口(6)同样利用注射泵驱动,以产生液滴。其中抗原和佐剂(含抗原和佐剂的pbs缓冲液)流速为1μl/min,油相氟代烃油(hfe7500,novec7500engineeredfluid)流速为1μl/min。抗原为fitc-ova带荧光标记的卵清蛋白(工作浓度5μg/ml),佐剂为anti-pd-1抗体(工作浓度0.1mg/ml)。稳定产生液滴后,在收集口(7),加入体积比为0.1%乙酸,凝胶化2分钟,立即转移至含有20%全氟辛醇的水相中,离心(1000rpm、1min),弃去油相,用1×pbs冲洗2-3次,将凝胶液滴单核细胞疫苗重新分散到水相(1×pbs)中静置40min后备用。
通过倒置荧光显微镜观察制备好的凝胶液滴单核细胞,见图2a-c:图2a为液滴包裹单核细胞的明场图像,图2b为用hoechst33342染细胞核,可以看见在荧光场中细胞核发紫色;抗原在40min时被摄入单核细胞内(图2c),表明单核细胞和抗原被封装在海藻酸盐凝胶液滴中,提高了抗原的局部浓度,使得单核细胞摄取抗原的时间缩短至40min左右。图2d为不同单核细胞数诱导细胞毒性t淋巴细胞(ctl)的百分数。表明随着单核细胞数量的增多,ctl的响应增强,疫苗有着较好的抗癌效果。cx43连接蛋白,是单核细胞呈递抗原的重要蛋白,图2e,为凝胶液滴存储由单核细胞分泌的cx43的量,黑色为凝胶液滴内的cx43的量,红色为液滴外的水相中cx43的量。表明液滴中可以较好存储cx43,进一步解释了该疫苗强烈的ctl响应。
实施例2:海藻酸盐凝胶液滴单核细胞疫苗的抑制肿瘤生长检测
取5-6周龄健康雌性balb/c小鼠24只,小鼠皮下注射1×106个4t1细胞,7天后随机分为6组,每组4只,每组分别打入不同的制剂(200μl)。pbs、癌细胞裂解物-tcl制剂、gd-tcl制剂、mc-tcl制剂、gd-mc-tcl制剂、gd-mc-tcl+anti-pd-1制剂。每7天注射一次制剂,在29天内严格观察肿瘤体积和小鼠体重。如图3所示,凝胶液滴单核细胞疫苗有着很好抑制肿瘤的效果,联合anti-pd-1抗癌效果更佳。而且疫苗对小鼠体重没有影响。
各种制剂制作方法如下:
(1)pbs制剂:1×pbs磷酸盐缓冲液,0.01m,ph=7.4。
(2)癌细胞裂解物-tcl制剂:4t1细胞裂解物,培养4t1乳腺癌肿瘤细胞,用胰蛋白酶消化,溶解在磷酸盐溶液(pbs)中,浓度相当于每毫升107个细胞,之后放入液氮快速冻结(5分钟),解冻(37℃,5分钟),重复5次,然后在2000转离心10分钟。取上层清液,冻干,之后溶解在1×pbs中,工作浓度为5μg/ml。
(3)gd-tcl制剂:利用实施例1的方法,其中血液入口(1)和缓冲液入口(2)都只通入缓冲液,抗原和佐剂入口(5)只通入tcl(5μg/ml),即液滴中只封装了tcl。
(4)mc-tcl制剂:利用常规方法将血液中单核细胞分离出来,计数为1×106个。之后分散到含有tcl(5μg/ml)的溶液中,在细胞培养箱中静置4小时后备用。
(5)gd-mc-tcl制剂:利用实施例1的方法制作,其中抗原和佐剂入口(5)只通入tcl(5μg/ml),其他不变。
(6)gd-mc-tcl+anti-pd-1制剂:利用实施例1的方法制作,其中抗原为tcl(5μg/ml),其他不变。
实施例3:海藻酸盐凝胶液滴单核细胞疫苗的预防肿瘤生长检测
将pbs、gd-tcl、mc-tcl和gd-mc-tcl等制剂(各制剂的制备见实施例2)分别皮下注射到5-6周龄健康雌性balb/c小鼠体内,每七天注射一次,三次后,向小鼠种皮下注射1×106个4t1细胞。之后监测小鼠体重、肿瘤的体积、小鼠存活时间。如图4所示,凝胶液滴单核细胞疫苗有着很好免疫效果,大大抑制了肿瘤的生长,并且使小鼠存活时间延长至60天。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!