一种纳曲酮二元皮下植入剂及其制备方法与流程
本发明属于药物制剂领域,具体涉及一种纳曲酮二元皮下植入剂及其制备方法。
背景技术:
纳曲酮,别名纳屈酮、环丙甲羟二羟吗啡酮、环丙甲羟二氢吗啡酮、纳曲酮(游离碱)或17-(环丙甲基)-4,5-环氧-3,14-二羟基吗啡烷-6-酮;分子式为c20h23no4,分子量为341.4,结构式如下:
纳曲酮是阿片受体桔抗剂,与纳洛酮的作用相似,能明显地减弱或完全阻断阿片受体,甚至反转由静脉注射阿片类药物所产生的作用。盐酸纳曲酮主要用于对已解除阿片类药物毒瘾者的康复期的辅助治疗,使戒除阿片瘾者能维持正常生活,防止或减少复吸。纳曲酮的副作用非常小,因此也是一种非常有潜力和有效的药物;但是,其在临床上使用时效果并不理想,这主要因为成瘾患者每天服药导致依从性差。
中国专利文献cn200610152903.7公开了一种纳曲酮的长效缓释制剂,其由纳曲酮和聚乳酸组成的微球经压片包衣制成,所用的聚乳酸的平均分子量为15-35万道尔顿,外层用聚乳酸将纳曲酮和聚乳酸组成的微球进行包衣,避免了药物突释现象的出现,获得了缓慢释放的效果。
中国专利文献cn201110457641.6公开了一种纳曲酮长效植入剂,该长效纳曲酮植入剂含有聚乳酸和纳曲酮,其为微粒压片包衣结构,微粒经压片制成的缓释微丸,缓释微丸内含有聚乳酸和纳曲酮,缓释微丸内聚乳酸和纳曲酮的重量份比为1:1-2,包衣层为dl-聚乳酸。
曲普瑞林微球的制备及质量控制(龙镭等,湖北民族学院学报,2011,2:28)公开了曲普瑞林微球的制备工艺研究,采用明胶水溶液与曲普瑞林混合液为内水相,注入一定浓度的pva(用聚乙烯醇)溶液中,高速搅拌进行乳化,然后干燥获得缓释微球。
硕士研究论文《聚乳酸微球的制备与研究》(兰婷,西北大学,2007)对盐酸乌拉地尔plla(左旋聚乳酸)缓释微球的制备进行了研究,对制备工艺中的参数进行了筛选考察,其中用盐酸乌拉地尔plla微球包裹外膜的方法解决了药物的突释问题,即在载药微球上分别包裹壳聚糖外膜和壳聚糖+海藻酸钠外膜,得到a,b两种微球;将a,b两种微球和未包裹外膜的载药微球c在相同条件下做体外释放性能的测试,释药平缓,解决了药物“突释”的问题。
在纳曲酮长效植入剂的研究过程中,我们发现纳曲酮长效植入剂存在起效慢、不能迅速达到药物治疗所需的血-药浓度的问题,导致患者在戒毒时间窗内毒瘾发作,进而影响了病人的接受度和治疗效果。但是,增加给药量在解决上述问题的同时,又将带来一系列的副作用。
技术实现要素:
为了解决现有的纳曲酮缓释剂起效慢、不能迅速达到治疗窗的血药浓度的问题,本发明提供了一种纳曲酮二元皮下植入剂及其制备方法,该二元皮下植入剂不仅能够迅速达到治疗窗的血药浓度,而且缓释时间长、药物释放完成度好,因此可以有效提高患者的药物依从性,进而保证治疗效果。
研究过程中,我们发现纳曲酮分散植入剂能迅速提高纳曲酮在动物(或人)体内的血-药浓度,并可维持一周左右。基于此研究发现,我们将长效植入剂(缓释剂)和分散植入剂制备成复合剂(即二元植入剂),其克服了二者分别存在的弊端,优势明显,该二元植入剂不仅能使药物迅速起效,而且长期维持有效的血-药浓度。
为了实现上述目的,本发明是通过以下技术方案来实现的:
第一方面,本发明提供一种纳曲酮二元皮下植入剂,包括a组分和b组分,其中a组分为纳曲酮分散剂,包括纳曲酮活性成分、分散剂和粘合剂;纳曲酮活性成分、分散剂和粘合剂三者质量比为1:0.4-0.9:0.2-0.8,优选为1:0.5-0.9:0.3-0.7,更优选为1:0.6-0.75:0.4-0.6,例如为1:0.65:0.5或1:0.7:0.4;
b组分为纳曲酮缓释剂,包括纳曲酮活性成分和药学上可接受的缓释载体,纳曲酮活性成分和所述缓释载体二者质量比为1:0.5-2,优选为1:0.6-1.5,更优选为1:0.9-1.1,例如为1:0.8、1:1.2或1:1.8;
a组分与b组分的质量比为1:3-6,优选为1:4-5,例如为1:3.5、1:4.5或1:5;
所述纳曲酮活性成分为纳曲酮化合物超微粉和/或其药学上可接受的盐超微粉。
本发明上述纳曲酮二元皮下植入剂中,所述缓释载体包括壳聚糖和聚乳酸,壳聚糖和聚乳酸的质量比为1:0.2-1.0,优选为1:0.3-0.8,更优选为1:0.4-0.6,例如为1:0.7或1:0.9;
优选地,所述聚乳酸的分子量为1.8-40万,优选为2-10万,例如为4万、6万、9万、15万、26万、31万或38万;和/或,所述壳聚糖的分子量为1-60万,优选为10-30万,例如为5万、8万、16万、23万、36万、45万或55万。
上述纳曲酮二元皮下植入剂中,所述分散剂为可压性淀粉cs(或预胶化淀粉);和/或,所述粘合剂为聚乙烯吡咯烷酮(pvp)(或交联聚维酮pvpp),优选为5-10wt%例如6wt%或8wt%聚乙烯吡咯烷酮(pvp)乙醇溶液。
上述纳曲酮二元皮下植入剂中,所述纳曲酮二元皮下植入剂还包括润滑剂,所述润滑剂的质量为相对于a组分和b组分的质量之和的0.05-2wt%,优选为0.08-1.2wt%,例如为0.06wt%、0.1wt%、0.3wt%、0.6wt%、0.8wt%或1.1wt%,所述润滑剂优选为硬脂酸镁。
上述纳曲酮二元皮下植入剂中,所述纳曲酮超微粉一般平均粒径≤15μm,例如粒径为100-800nm,优选为300-500nm,例如为200nm、350nm或450nm,更优选;所述纳曲酮药学上可接受的盐包括无机盐和有机盐,其中无机盐选自硫酸盐、盐酸盐、氢溴酸盐、硝酸盐和磷酸盐中的至少一种;有机盐选自乙酸盐、丙酸盐、丙二酸盐、羟基乙酸盐、2-羟基丙酸盐、双羟基萘酸盐、2-氧代丙酸盐、2-丁烯二酸盐、乙二酸盐、丁二酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐和甲苯磺酸盐中的至少一种;优选地,所述纳曲酮药学上可接受的盐超微粉的粒径为100-800nm,更优选为300-500nm。
第二方面,本发明提供一种上述纳曲酮二元皮下植入剂的制备方法,包括如下步骤:
a.制备纳曲酮活性成分超微粉:将纳曲酮制成纳曲酮活性成分超微粉,例如用球磨机;
b.制备纳曲酮分散剂:将纳曲酮超微粉和分散剂(优选为可压性淀粉cs)充分混匀,然后加入粘合剂(优选为浓度为5-10wt%(例如为6wt%或8wt%)的聚乙烯吡咯烷酮pvp的乙醇溶液,在使用乙醇溶液的情况下,粘合剂的用量按聚乙烯吡咯烷酮计)充分混合,制成软材,然后过筛制成颗粒,整粒,得到纳曲酮分散剂;
c.制备纳曲酮缓释微球:将步骤a制备的纳曲酮活性成分超微粉与药学上可接受的缓释载体(优选地,所述缓释载体包括壳聚糖cts和聚乳酸pla)溶于有机溶剂(所述有机溶剂优选包括二氯甲烷和/或氯仿)中,搅拌形成微球,过滤,干燥,得到纳曲酮缓释微球;
d.压片:将步骤b制备的纳曲酮分散剂和步骤c制备的纳曲酮缓释微球充分混合、压片,得到纳曲酮二元植入剂裸片(裸片每片重例如200-1000mg,进一步例如300mg或400mg);
e.包衣:将步骤d制备的纳曲酮二元植入剂裸片包衣、干燥,即得纳曲酮二元皮下植入剂。
上述制备方法中,所述步骤a中,所述纳曲酮活性成分超微粉的粒径可为100-800nm,优选为300-500nm,例如为200nm、350nm或450nm;和/或,
所述步骤b中,纳曲酮活性成分:分散剂:粘合剂三者质量比为1:0.4-0.9:0.2-0.8,优选为1:0.5-0.9:0.3-0.7,更优选为1:0.6-0.75:0.4-0.6,例如为1:0.65:0.5或1:0.7:0.4;纳曲酮分散剂的粒径可为200-800μm,例如为250μm、400μm、500μm或750μm;和/或,
所述步骤c中,壳聚糖和聚乳酸的质量比为1:0.2-1.0,优选为1:0.3-0.8,更优选为1:0.4-0.6,例如为1:0.7或1:0.9;优选地,所述聚乳酸的分子量为1.8-40万,优选为2-10万,例如为4万、6万、9万、15万、26万、31万或38万;和/或,所述壳聚糖的分子量为1-60万,优选为10-30万,例如为5万、8万、16万、23万、36万、45万或55万;在使用二氯甲烷和氯仿混合物的情况下,二氯甲烷和氯仿的体积比为(1-4):1,例如为1.5:1、2:1或3.5:1;优选地,在30-45℃例如35℃或43℃条件下搅拌形成微球,所述微球的粒径为20-100μm,例如为35μm、50μm、60μm或85μm;和/或,
所述步骤d中,纳曲酮分散剂和纳曲酮缓释微球的质量比可为1:3-6,优选为1:4-5,例如为1:3.5、1:4.5或1:5;优选地,所述压片的条件为在40-50℃例如42℃或49℃的温度下和8-15kn例如9kn或13kn压力下压片;和/或,
所述步骤e中,所述干燥的条件为先在15-25℃例如17℃或24℃悬空干燥30-60s例如40s或55s,再在30-55℃例如35℃、45℃或52℃真空干燥小于48h(例如1-24小时,优选5-24h);优选地,所述包衣包括用浓度为5-10wt%例如5.5wt%或9wt%优选8wt%的聚乳酸pla的乙酸乙酯溶液包衣。
上述制备方法中,所述步骤d中,在充分混合的步骤和压片的步骤之间还包括以下步骤:加入润滑剂充分混匀;所述润滑剂的质量为相对于a组分和b组分的质量之和的0.05-2wt%,优选为0.08-1.2wt%,例如为0.06wt%、0.1wt%、0.3wt%、0.6wt%、0.8wt%或1.1wt%,所述润滑剂优选为硬脂酸镁。
本发明还提供上述制备方法所制备得到的纳曲酮二元皮下植入剂。
本发明中,可压性淀粉cs即为预胶化淀粉,聚乙烯吡咯烷酮pvp即为交联聚维酮。
本发明的技术方案具有如下优点:
(1)本发明研究设计了a组分和b组分组成的纳曲酮二元皮下植入剂,其中a组分为纳曲酮分散剂,其能够迅速起效,b组分为纳曲酮缓释剂,其可长时间起效。a组分和b组分二者制成复合剂,有效地克服了纳曲酮长效制剂起效慢、纳曲酮分散剂维持时间短的弊端,从而使得药物依从性和实用性得到了极大地改善。临床戒毒实践表明,本发明制备的纳曲酮二元皮下植入剂,不仅能够迅速达到患者治疗所需要的血-药浓度,而且能够长时间维持血药浓度(可以维持9个月,>270天)。大量的临床数据表明,使用该二元皮下植入剂后,病人的依从性(乐于接受治疗)和防止毒品复吸的效果良好。
(2)本发明的纳曲酮二元皮下植入剂,由分散剂单元和缓释剂单元组成,分散剂单元能够迅速起效,达到药物治疗窗,缓释剂单元能够长期有效,使得病人长期保持高水平的血药浓度,不仅有效地克服了纳曲酮缓释植入剂不能快速达到病人治疗血-药浓度(治疗窗)的弊端,病人对药物的依从性显著提高,而且有效地克服了缓释剂型药物长期释放(大于180天)起效慢(7天以后)的临床弊端,在增加载药量的同时,可以有效延长药物在人体的滞留时间,增强药效,减少药物的毒副作用。该二元皮下植入剂能够在长达九个月(>270天)的药物释放期内稳定释放,明显地提高了纳曲酮植入剂的临床治疗效果,并降低了其副作用。
(3)本发明的纳曲酮二元皮下植入剂的制备方法,将纳曲酮分散剂颗粒与纳曲酮微球充分混合均匀,形成骨架结构,避免了压片时微球碎裂的出现,同时避免了药物突释现象的出现。该制备方法工艺成熟、稳定性好,为纳曲酮二元皮下植入剂的商业化应用提供了技术支撑。
附图说明
为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中:
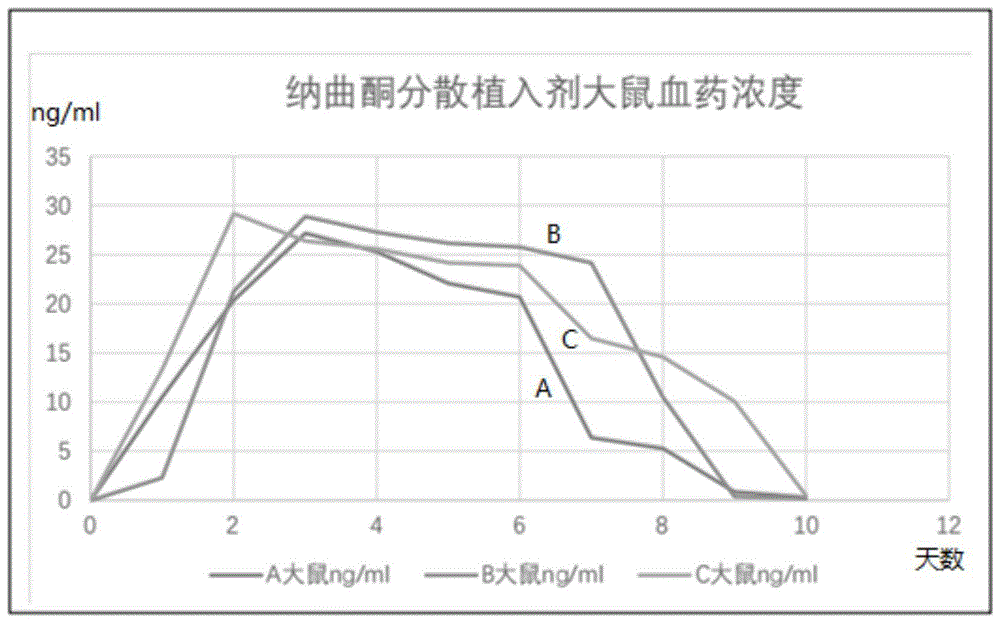
图1是实验例1中纳曲酮分散植入剂植入后10天大鼠血药浓度图;
图2是实验例2中纳曲酮缓释植入剂植入后10天大鼠血药浓度图;
图3和图4分别是实验例3中纳曲酮二元皮下植入剂植入后10天和180天大鼠血药浓度图;
图5和图6分别是实验例4中纳曲酮二元皮下植入剂植入后10天和180天人血药浓度图。
具体实施方式
在具体描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于具体的特定的具体实施方案;本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
除非另外定义,本文中使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同意义。当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。
对比例1纳曲酮分散植入剂的制备
本对比例纳曲酮分散植入剂的原料包括:纳曲酮1000g、分散剂可压性淀粉(cs)667g、粘合剂聚乙烯吡咯烷酮(pvp)750g的5wt%乙醇溶液和润滑剂硬脂酸镁10g。
其制备方法包括以下步骤:
(1)制备纳曲酮超微粉:用球磨机将纳曲酮制成粒径为300-500nm的纳曲酮超微粉;
(2)制粒:将纳曲酮超微粉与和分散剂可压性淀粉(cs)充分混匀,然后加入浓度为5wt%的粘合剂聚乙烯吡咯烷酮(pvp)的乙醇溶液充分混合,制成软材,然后过60目筛制成颗粒,整粒,在50℃下烘干24小时,得到纳曲酮分散剂的颗粒;
(3)压片:将纳曲酮分散剂的颗粒与润滑剂硬脂酸镁充分混合,在压力15kn下进行压片,得到纳曲酮分散剂裸片;
(4)包衣:将纳曲酮分散剂裸片用8%的聚乳酸(pla)乙酸乙酯溶液包衣,得到纳曲酮分散植入剂。
对比例2纳曲酮缓释植入剂的制备
本对比例纳曲酮缓释植入剂的原料包括:纳曲酮1000g、缓释载体壳聚糖(cts)(分子量为20万)667g、缓释载体聚乳酸(pla)(分子量为2万)333g和润滑剂硬脂酸镁20g。
其制备方法包括以下步骤:
(1)制备纳曲酮超微粉:用球磨机将纳曲酮制成粒径为300-500nm的纳曲酮超微粉;
(2)制备纳曲酮缓释微球:按照选定重量称取纳曲酮超微粉、缓释载体壳聚糖(cts)和聚乳酸(pla),充分混匀,溶于二氯甲烷中,作为分散相,将水作为连续相,在1200rpm/min搅拌和40℃条件下,将分散相缓缓加入连续相中形成微球,过滤、干燥,得到粒径为20μm的纳曲酮缓释微球;
(3)压片:将制备的纳曲酮缓释微球和选定重量的硬脂酸镁混匀加热至40℃进行压片,压片压力15kn,得到纳曲酮缓释植入剂裸片;
(4)包衣:将纳曲酮缓释植入剂裸片用8%的聚乳酸(pla)乙酸乙酯溶液包衣,然后先在25℃下悬空干燥60s,再在50℃下真空干燥24h,得到纳曲酮缓释植入剂。
实施例1纳曲酮二元皮下植入剂的制备
本实施例纳曲酮二元皮下植入剂的原料包括:
a组分:纳曲酮1000g、分散剂可压性淀粉(cs)667g、粘合剂聚乙烯吡咯烷酮(pvp)750g的5%乙醇溶液;
b组分:纳曲酮4834g、缓释载体壳聚糖(cts)(分子量为20万)3224g、缓释载体聚乳酸(pla)(分子量为2万)1610g;
润滑剂硬脂酸镁121g。
其制备方法包括以下步骤:
a.制备纳曲酮超微粉:用球磨机将纳曲酮制成粒径为300-500nm的纳曲酮超微粉;
b.制备纳曲酮分散剂:将1000g纳曲酮超微粉与选定重量的分散剂可压性淀粉(cs)(二者质量比为1:0.67)充分混匀,然后加入浓度为5wt%的粘合剂聚乙烯吡咯烷酮(pvp)的乙醇溶液(纳曲酮超微粉与聚乙烯吡咯烷酮的乙醇溶液质量比为1:0.75)充分混合,制成软材,然后过60目筛制成颗粒,整粒,得到粒径为500μm的纳曲酮分散剂;
c.制备纳曲酮缓释微球:称取4834g纳曲酮超微粉、选定重量的缓释载体壳聚糖(cts)和聚乳酸(pla)(纳曲酮的质量与缓释载体壳聚糖和聚乳酸的质量和二者比为1:1,壳聚糖和聚乳酸二者质量比为1:0.5),充分混匀,然后溶于二氯甲烷溶剂中,作为分散相,将水作为连续相。在1200rpm/min搅拌和40℃条件下,将分散相缓缓加入连续相中,形成微球,过滤、干燥,得到粒径为20μm的纳曲酮缓释微球;
d.压片:将纳曲酮分散剂和纳曲酮缓释微球(纳曲酮分散剂和纳曲酮缓释微球二者质量比为1:4)充分混合,然后加入选定重量的润滑剂硬脂酸镁(纳曲酮分散剂和纳曲酮缓释微球的质量和与润滑剂硬脂酸镁的质量二者比为1:0.01)充分混匀,然后在温度40℃下和压力8kn下压片,得到纳曲酮二元植入剂裸片;
e.包衣:将纳曲酮二元植入剂裸片用8%的聚乳酸(pla)乙酸乙酯溶液包衣,然后先在25℃下悬空干燥60s,再在50℃下真空干燥24h,得到纳曲酮二元皮下植入剂。
实施例2
与实施例1类似,只是调整纳曲酮活性成分、分散剂和粘合剂三者质量比为1:0.5:0.4;纳曲酮活性成分和所述缓释载体二者质量比为1:0.7,缓释载体中壳聚糖和聚乳酸的质量比为1:0.7,粘合剂为聚乙烯吡咯烷酮(pvp)的10%乙醇溶液。
实施例3
与实施例1类似,只是调整纳曲酮活性成分、分散剂和粘合剂三者质量比为1:0.8:0.6;纳曲酮活性成分和所述缓释载体二者质量比为1:1.5,缓释载体中壳聚糖和聚乳酸的质量比为1:0.4,粘合剂为聚乙烯吡咯烷酮(pvp)的10%乙醇溶液。
实验例1纳曲酮分散植入剂植入后10天大鼠血药浓度的测定
将对比例1制备的纳曲酮分散植入剂植于大鼠体内,植入后分别于第1,2,3,4,5,6,7,8,9,10天眼眶取血,常规方法分离出血浆。取血浆样品0.5ml,用1.3mol/l碳酸氢钠缓冲液调节ph至8-9,每次加入二氯甲烷5ml,提取三次,合并提取液,分离有机相,在50℃水浴上用氮气吹干,用hplc测定大鼠的血-药浓度。具体实验结果如图1所示。其中,横坐标为时间(天数),纵坐标为血-药浓度(ng/ml)。
实验例2纳曲酮缓释植入剂植入后10天大鼠血药浓度的测定
将对比例2制备的纳曲酮缓释植入剂植于大鼠体内,植入后分别于第0,1,2,3,4,5,6,7,8,9,10天眼眶取血,常规方法分离出血浆。取血浆样品0.5ml,用1.3mol/l碳酸氢钠缓冲液调节ph至8-9,每次加入二氯甲烷5ml,提取三次,合并提取液,分离有机相,在50℃水浴上用氮气吹干,用hplc测定大鼠的血-药浓度。具体实验结果如图2所示。其中,横坐标为时间(天数),纵坐标为血-药浓度(ng/ml)。
实验例3纳曲酮二元皮下植入剂植入后10天和180天大鼠血药浓度的测定
将实施例1制备的纳曲酮二元皮下植入剂植于大鼠体内,植入后分别于第0,1,2,3,4,5,6,7,8,9,10天以及第20,40,60,80,100,120,140,160,180天眼眶取血,常规方法分离出血浆。取血浆样品0.5ml,用1.3mol/l碳酸氢钠缓冲液调节ph至8-9,每次加入二氯甲烷5ml,提取三次,合并提取液,分离有机相,在50℃水浴上用氮气吹干,用hplc测定大鼠的血-药浓度。具体实验结果如图3和图4所示。其中,横坐标为时间(天数),纵坐标为血-药浓度(ng/ml)。
由图1-4可知,与对比例1制备的纳曲酮分散植入剂和对比例2制备的纳曲酮缓释植入剂相比,实施例1制备的纳曲酮二元皮下植入剂克服了纳曲酮纳曲酮缓释植入剂、纳曲酮分散植入剂维持时间短的弊端,植入大鼠后在小于1天的时间内即可起效,而且能够在植入后的180天内稳定释放并保持有效血药浓度。
实验例4纳曲酮二元皮下植入剂的人体血浆的药-时曲线将实施例1制备的纳曲酮二元皮下植入剂植入戒毒病人腹部皮下内,植入后分别于第1,2,3,4,5,6,7,8,9,10天以及第20,40,60,80,100,120,140,160,180天取静脉血,分离出病人血浆,取血浆样品0.5ml,用1.3mol/l碳酸氢钠缓冲液调节ph至8-9,每次加入二氯甲烷5ml,提取三次,合并提取液,分离有机相,在50℃水浴上用氮气吹干,用hplc测定人体的血-药浓度。具体实验结果如图5和图6所示。其中,横坐标为时间(天数),纵坐标为血-药浓度(ng/ml)。
由图5和图6可知,实施例1制备的纳曲酮二元皮下植入剂植入人体后既能够在小于1天的时间内迅速起效达到药物治疗窗,又能够在180天内稳定释放,使得病人能够长期保持有效血药浓度。
- 还没有人留言评论。精彩留言会获得点赞!