一种简便的慢性硬膜下血肿动物造模方法
1.本发明涉及动物实验及医药研究领域,具体涉及一种简便的慢性硬膜下血肿动物造模方法。
背景技术:
2.慢性硬膜下血肿(chronic subdural hematoma,csdh)是神经外科常见的疾病之一,好发于中老年人,手术是目前治疗该疾病最主要的方法,但术后3.7%-38%的复发率却成为影响预后的棘手问题。近年来,诸多学者对csdh展开了相应研究,但研究报道大多为临床观察结果,对其基础性的深入探索因受制于既往动物模型的局限,始终未能广泛而有效地开展。
3.为建立用于实验的csdh动物模型,1927年putman人等以猫和狗作为实验动物采用开颅全血或自体血注射法制作csdh的模型取得了成功,但由于操作复杂、费用昂贵等原因,后期亦未能得到推广应用。1972年watannabe等将血块和脑脊液的混合物置入到狗和猴子的硬膜下腔,制作sdh模型,直到上世纪八十年代,为了更好的推广和控制实验成本,csdh的造模对象转移到了大鼠、小鼠上,aikawa等人采用6-氨基酰胺小鼠腹腔注射的方法制备小鼠csdh模型,2004年eijkenboom采用开颅去骨瓣硬膜下注入自体血的方法制备了大鼠csdh模型。权伟等改进了大鼠csdh的模型,采用创新的速度梯度法+大鼠颅内多次注血法制备csdh模型,刘建辉等采用骨瓣开颅、置管并多次注血的方法制备了csdh模型。
4.至此,采用大鼠、小鼠等小动物建立csdh模型被广泛应用于实验研究,但由于啮齿类动物颅内血肿吸收能力较强、吸收速度快,其可承受的、单次有限体积血肿形成后,第5~12天血肿即完全吸收,难以符合“血肿存留3周及以上”的人体csdh血肿维持时间的标准,且不能满足药物在慢性期作用效果的观察,因此上述方法建立的csdh模型在实验中再次被否定。
5.几年来,人们逐渐把造模动物选择的视线转向了家兔,研究发现家兔与人在生物学特性方面相似性较高,此外家兔方便操作,血液量较小鼠及大鼠充足,方便取血。刘建辉等以兔为对象,采用骨瓣开颅后置管,手术难度较大鼠明显降低,置管既避免了再次开颅又保证了后期的多次注血。为了手术操作的顺利,一般都取骨窗直径约为3mm,对大鼠而言面积约占颅骨顶叶的1/3,对兔面积只占顶叶约1/8-1/6,手术操作带来的影响远小于大鼠。在饲养和后续的实验中,对于留置管子的耐受性和耐受实验的能力较大鼠强,因此兔作为实验对象的优势更突出。
6.刘建辉等人的csdh家兔模型中,采用的制作方式是磨开颅骨,形成约3mm
×
7mm大小骨窗,保留骨瓣并在其后部打一小孔,将硬膜外导管一端穿过小孔并用线捆法固定于骨瓣上。于硬膜上刺一小孔,显微镜下将导管置于硬膜下腔,同时骨瓣复位,逐层缝合颅顶肌层以固定骨瓣。我们研究发现,根据兔颅骨的厚度和大小,取骨瓣本省就不易,在骨瓣上打孔后仍保持骨瓣的完整后回纳整复困难增加,硬膜下的管头留的位置在回纳的骨瓣以下,固定的骨瓣不会像颅骨锁固定一样稳定,随着硬膜下注血是颅内压的增高,骨瓣是否会外
突,并对实验产生的影响值得商榷。因此,在刘建辉等人的造模基础上,改进csdh家兔造模方法,探索建立有效、且易复制的动物模型是进行csdh深入研究的关键问题之一。
技术实现要素:
7.针对上述存在的问题,本发明旨在提供一种简便的慢性硬膜下血肿动物造模方法,该动物模型能最大程度模拟人体csdh体内环境,同时解决动物选择、造模部位、血肿液选择及模型成功判定等一系列问题,且造模成本低廉、模型稳定,易于复制,为慢性硬膜下血肿进一步实验研究提供基础。
8.为了实现上述目的,本发明所采用的技术方案如下:
9.本发明存在技术要点:
10.动物的选择
11.动物造模首先要选择合适的动物,因为不同物种之间可能存在年龄、生物特性及免疫学差异等,不同种属、年龄的动物对可能对实验结果造成误差,甚至导致造模失败。如常见的大鼠、小鼠等小动物因属于啮齿类动物,其颅内血肿吸收能力较强、吸收速度快,其可承受的、单次有限体积血肿形成后,第5~12天血肿即完全吸收,难以符合“血肿存留3周及以上”的人体csdh血肿维持时间的标准。此外大鼠及小鼠体积较小,对造模操作要求更为严格,即使造模成功,需用动物ct证实模型花费较大。因此我团队选择造模动物时选择同种属或代谢行为与人类生物特性相似的动物进行实验,从而缩小或避免种属间生物等特性上的差异,提高造模成功率,同时更好的模拟了人体环境。以家兔为例,我们选择清洁级新西兰兔进行慢性硬膜下血肿模型制作,研究发现家兔与人在生物学特性方面相似性较高,此外家兔方便操作,血液量较小鼠及大鼠充足,方便取血。一般认为家兔1-3月龄为幼年期,4-18月龄为青年期,18-30月龄是为中年期,30月龄以上为老年期。因csdh好发于中老年患者,因此我们造模选择中老年大鼠,即18-36月龄家兔。
12.造模部位选择
13.研究发现csdh患者血肿在额、颞、顶、枕部均可形成,呈新月形,常发生于两个以上部位,但多包含颞部。因此家兔造模时颅骨钻孔位置及置管位置均选择家兔颞部,尽可能与临床发病位置相匹配。
14.造模血肿液选择
15.研究发现csdh患者血肿位于硬脑膜与蛛网膜之间,一般有血肿包膜包裹,血肿由血肿包膜上毛细血管渗出形成,局部蛛网膜完整,故血肿中不含有脑脊液。因此造模时,我们选择家兔自体静脉血注入,避免了排异反应,同时静脉血更接近于毛细血管血液,易于凝固,有助于血肿形成。
16.造模置管选择
17.使用弯钳辅助将一麻。醉用硬膜外导管沿硬脑膜下腔平向颞部置入,软管置入超过骨窗边缘约5mm停止置入,置管后经置入管向颅内注水冲洗,见注水无明显阻力,骨窗流出水清亮,颅内无出血视为置管成功,置入软管的另一头接导管连接器并封管,连接器方便反复多次注血。后将置入导管固定于家兔两耳根中间,此处家兔不易抓挠,防止自己拔管,家兔选择一兔一笼饲养,也避免相互拔管。
18.造模手术方法选择
19.直接采用骨窗开颅置管的方式进行,和人的钻孔引流方式完全相同,3mm骨窗在兔头上占的比例与成人头颅上直径约3cm的骨窗,这个大小的骨窗存在对人的生活并不会产生太大的影响。将管头置于颅骨下5mm,颅骨固定,血肿产生的压力不会因颅骨变化而改变,更接近人的病理过程。
20.自体静脉血注入时间及用量选择
21.因动物颅内血肿吸收能力较强、吸收速度快,单次注血后很快吸收,因此我们在造模后当天耳缘静脉抽取0.5ml自体血,经软管缓慢注入硬膜下腔,保持家兔头低位10min,以使血液凝固于硬膜下,之后分别于造模术后3、6、9、12、15天重复注血操作。针对注射用量的选择,我们设计了3个单次注血剂量,结果表明,三个剂量都能形成csdh,1ml剂量注射后出现异常的概率较大,0.5ml和0.8ml相对安全,单次注血量越大,在动物安全的情况下形成的血肿量越大,越有利于研究,我们研究的兔的脑组织体积平均为9.75
±
0.35ml,1ml的注血量约占脑组织体积的1/10,虽不会立即致死,但如果继续增加注血量风险会增加,因此单次注血量在目前条件下不超过1ml为宜,我们选择每次0.5ml自体血注入。
22.造模成功的判定
23.造模后21天行使用颅脑ct扫描(有条件使用动物ct最佳,临床应用ct也可使用),观察硬膜下血肿形成情况,筛选出造模成功的家兔。
具体实施方式
24.兔慢性硬膜下血肿模型制作方法
25.1.实验动物:清洁级新西兰兔28只,雌雄不限,兔龄7-10月龄,体重2.5
±
0.5kg。实验动物由第四军医大学实验动物中心提供(合格证号:scxk-军2012-0007)。
26.2.实验试剂及器械:
27.3%戊巴比妥北京普博斯生物
28.牙科钻广州安华医疗科技有限公司
29.外科手术器械陕西中医药大学药理实验室提供
30.16排ct德国西门子公司
31.3.动物模型制备方法:家兔采用3%戊巴比妥(30mg/kg)耳缘静脉注射麻醉成功后,去俯卧位固定在兔台上,术前去毛常规消毒铺巾,总行切开头皮暴露右侧颅骨。以矢状缝右侧5mm冠状缝后方5mm为中心,使用牙科钻磨开颅骨,形成大小约3mm
×
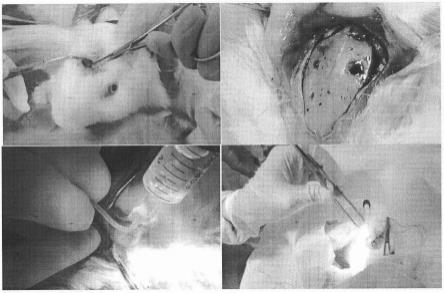
3mm的骨窗,充分暴露硬脑膜,见无明显出血,在骨窗中央用尖刀切开一小孔,将软管(麻醉用硬膜外导管)一端用弯钳辅助沿硬脑膜下腔平向颞部置入,见软管置入超过骨窗边缘约5mm停止置入(置入过程中遇到阻力略退后调整管头方向)。从置入管向颅内注水冲洗,见注水无明显阻力,骨窗流出水清亮,颅内无出血。用小块明胶海绵填塞并用骨蜡填塞密封,缝合头皮并用红霉素软膏涂抹伤口。置入软管的另一头接导管连接器并封管,并固定在两耳根中间,防止自己拔管。造模后当天耳缘静脉抽取0.5ml自体血,经软管缓慢注入硬膜下腔,保持兔头低位10min,以使血液凝固于硬膜下,之后分别于造模术后3、6、9、12、15天重复注血操作,均为0.5ml/次,操作流程见图1。
32.4.造模成功的判定:造模后21天行使用颅脑ct扫描(有条件使用动物ct最佳,临床应用ct也可使用),观察硬膜下血肿形成情况,筛选出造模成功的家兔。
33.5.结果:
34.5.1一般情况:动物在实验过程中共出现7只动物死亡,其中5只是在多次注血后死亡,无特殊表现;1只在注血后立即出现强烈的抽搐、烦躁死亡;1只在第3次注血后活动明显减少,不愿进食,注血当日死亡。
35.5.1血肿形成情况:21日后ct扫描见硬膜下形成等密度新月影为血肿形成即造模成功。在存活的21只动物中,共形成csdh17只(占存活者的81%)。ct扫描诊断为csdh的17只动物开颅确认均为csdh。如图2。具体实施案例培元化瘀方对家兔慢性硬膜下血肿的干预作用及血肿外膜vegf表达影响
36.1.实验材料
37.1.1实验动物
38.本实验采用清洁级健康新西兰成年家兔30只,雌雄不限,7-10月龄,体重(2.5
±
0.5)kg,第四军医大学实验动物中心提供(合格证号:scxk-军2012-0007)。家兔于动物室内分笼喂养,自由饮食,饲养环境温度(22
±
2)℃,相对湿度50%
±
20%,适应性喂养1周。
39.1.2实验用药及试剂
40.培元化瘀方(组成:黄芪30g、当归15g、生地12g、熟地12g、党参6g、红花12g、桃仁6g、地龙6g、黄精12g、鹿角胶6g、甘草6g)。按原方煎制成1g/ml的溶液,由陕西中医药大学附属医院制剂中心制备。
41.0.9%生理盐水北京新里程药业有限公司
42.3%戊巴比妥北京普博斯生物
43.4%多聚甲醛武汉博士德公司
44.抗原修复液中杉金桥
45.鼠抗兔vegf抗体美国abcam公司
46.辣根过氧化物酶标记羊抗兔精彩生物公司
47.dab试剂盒中杉金桥
48.中性树胶中杉金桥
49.磷酸盐缓冲液(pbs)陕西博达生物科技有限公司
50.苏木素-伊红染料陕西博达生物科技有限公司
51.1.3实验仪器
52.电子天平余姚纪铭称重设备公司
53.石蜡标本脱水机德国leica公司
54.石蜡自动包埋机德国leica公司
55.恒冷切片机德国leica公司
56.恒温摊片烘片烤片机上海精密科学仪器有限公司
57.微量进样器北京华仪三谱仪器有限公司
58.牙科钻广州安华医疗科技有限公司
59.外科手术器械陕西中医药大学药理实验室
60.超低温冰箱青岛海尔电器有限公司
61.倒置光学显微镜日本olympus公司
62.16排ct
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
德国西门子公司
63.ipp6.0病理图文采集及分析系统美国media cybernetics公司
64.2.实验方法
65.2.1家兔csdh模型的建立
66.具体操作:兔采用3%戊巴比妥(30mg/kg)耳缘静脉注射麻醉成功后,去俯卧位固定在兔台上,术前去毛常规消毒铺巾,总行切开头皮暴露右侧颅骨。以矢状缝右侧5mm冠状缝后方5mm为中心,使用牙科钻磨开颅骨,形成大小约3mm
×
3mm的骨窗,充分暴露硬脑膜,见无明显出血,在骨窗中央用尖刀切开一小孔,将软管(麻醉用硬膜外导管)一端用弯钳辅助沿硬脑膜下腔平向颞部置入,见软管置入超过骨窗边缘约5mm停止置入(置入过程中遇到阻力略退后调整管头方向)。从置入管向颅内注水冲洗,见注水无明显阻力,骨窗流出水清亮,颅内无出血。用小块明胶海绵填塞并用骨蜡填塞密封,缝合头皮并用红霉素软膏涂抹伤口。置入软管的另一头接导管连接器并封管,并固定在两耳根中间,防止自己拔管。造模后当天耳缘静脉抽取0.5ml自体血,经软管缓慢注入硬膜下腔,保持兔头低位10min,以使血液凝固于硬膜下,之后分别于造模术后3、6、9、12、15天重复注血操作,均为0.5ml/次。
67.2.2 ct筛选csdh造模成功家兔并分组
68.造模成功标准检测:精神状态、活动、饮食及神经功能改变;造模术后21天行颅脑ct扫描,观察硬膜下血肿形成情况。(见图3)
69.ct成像筛选出造模成功的家兔,按照随机数字表法将其随机分为3组:模型组、培元化瘀方低剂量治疗组(以下简称低剂量治疗组)、培元化瘀方高剂量治疗组(以下简称高剂量治疗组)。
70.2.3实验处理方法
71.观察造模前及造模术后第1、3、6、9、12、15天家兔客观反应情况(精神状态、行为活动度、进食量)。
72.分组后模型组开始给予生理盐水灌胃治疗(每次15ml 2次/日,灌胃7天);低剂量治疗组给予培元化瘀方灌胃治疗(3.1g/kg/次,稀释至15ml,2次/日,灌胃7天);高剂量治疗组给予培元化瘀方灌胃治疗,(6.2g/kg/次,稀释至15ml,2次/日,灌胃7天)。(根据“体表面积与剂量换算”理论计算家兔的日剂量,以人的剂量换算所得剂量为动物低剂量、2倍为高剂量)
73.对各组家兔灌胃前及灌胃后第1、3、5、7天行神经功能评估,采purdy评分标准。
74.灌胃后第8天,麻醉各组家兔,切开头皮暴露右侧颅骨,持针器咬除部分骨瓣,注意保持硬膜完整,使用微量进样器吸取硬膜下残余液体,剥离血肿外膜置于4%多聚甲醛中固定。
75.2.4血肿外膜组织石蜡切片的he染色
76.1)组织切片:将血肿外膜进行常规的甲醛固定、石蜡包埋及组织切片。
77.2)切片脱蜡、入水:将切好的石蜡组织切片,置入50℃烤箱过夜后常规用二甲苯脱蜡,经各级乙醇至水洗:二甲苯(i)5min
→
二甲苯(ii)5min
→
100%乙醇2min
→
95%乙醇1min
→
80%乙醇1min
→
75%乙醇1min
→
蒸馏水洗2min。
78.3)苏木素染色5-20min,自来水冲洗,洗去苏木素液。
79.4)用1%盐酸乙醇分化液分化30min。
80.5)将组织切片放入自来水中侵泡,约15min。
81.6)将组织切片放入0.5%伊红液中染色2min。
82.7)自来水冲洗组织切片,将伊红染色洗去。
83.8)常规脱水,透明,封片:95%乙醇(i)1min
→
95%乙醇(ii)1min
→
95%乙醇(ii)1min
→
100%乙醇(i)1min
→
100%乙醇(ii)1min
→
二甲苯石碳酸(3∶1)1min
→
二甲苯(i)1min
→
二甲苯(ii)1min
→
中性树脂封固
84.9)光学显微镜下对血肿外膜组织病理学改变进行观察并拍照。
85.2.5血肿外膜组织vegf免疫组化染色法
86.1)组织切片:将血肿外膜进行常规的甲醛固定、石蜡包埋及组织切片。
87.2)标本染色前处理:石蜡切片,常规脱蜡至水,置入50℃烤片30min
→
二甲苯i10min
→
二甲苯ii10min
→
二甲苯iii10min
→
100%乙醇i10min
→
100%乙醇ii10min
→
95%乙醇5min
→
95%乙醇ii5min
→
90%乙醇ii5min
→
80%乙醇ii5min
→
蒸馏水洗3min
×
3次。
88.3)抗原修复:将切片置于提前配置好的0.01mol/l的柠檬酸缓冲液中,压力锅煮沸20min,自然冷却。pbs漂洗2次每次5min。
89.4)灭活内源性过氧化酶:3%过氧化氢孵育5-10min,pbs冲洗,3min
×
3次。
90.5)酶消化:用前将0.1%胰蛋白酶消化液过滤并水浴至37℃,将玻片预热至37℃,放入消化液消化5-30min,以暴露细胞内抗原。pbs洗3min
×
3次。
91.6)封闭:取山羊血清适量滴至组织切片表面,并确保能覆盖全部组织,室温封闭15min。
92.7)孵育一抗:倾去组织切片表面封闭液,按照1∶300比例稀释后的鼠抗兔vegf抗体滴入组织切片表面,置入湿盒后4℃孵育过夜。
93.8)孵育二抗:一抗孵育24h后取出组织切片,pbs漂洗2次每次5min,在组织切片表面滴加生物素标记的二抗,室温孵育15min。
94.9)链霉卵白素-过氧化物酶孵育:弃二抗孵育液,pbs冲洗,3min
×
3次,在组织切片表面滴加链霉卵白素-过氧化物酶液,室温孵育15min。10)显色:取dab显色试剂盒,及去离子水1ml,将试剂盒内a液、b液、c液依次滴加一滴入1ml去离子水内,并充分混匀。将切片取出后弃链霉卵白素-过氧化物酶孵育液,pbs漂洗2次,每次5min。将新鲜配置的dab显色液滴至组织切片表面显色,当组织切片出现明显的着色时,用自来水冲洗,终止切片的显色。
95.11)复染:将终止染色的组织切片取出,并在组织切片表面滴加适量苏木素染料染核,30s后自来水冲洗,终止染色。
96.12)脱水、透明及封片:终止染色后将组织切片置入与入水时相反顺序的酒精中脱水,再置入二甲苯中透明处理,取出后,滴加适量中性树胶于组织切片表面并利用盖玻片封片,在烘箱烘烤过夜。待中性树胶干燥后保存。
97.13)拍照、读片:于显微镜下拍照并读取结果。
98.14)image pro-plus 6.0软件分析免疫组化图片。400倍视野拍照,每张照片的背景一致且组织充满整个视野。每个组别的切片随机选取三个视野,采取统一的阳性标准即棕黄色,利用image-pro plus6.0软件计算每张照片的平均光密度(od)。
99.2.6统计学处理
计量资料以均数
±
标准差表示(
±
s),应用spss16.0统计软件分析检测结果,组间差异比较采用单因素方差分析,p<0.05为差异有统计学意义。
100.3.实验结果
101.3.1造模结果本实验至末次注血结束时家兔存活21只,其中1只死于麻醉过量,3只于造模后死亡,5只在造模术后陆续注血过程中死亡。死亡率为30.0%。
102.3.2行为学观察结果行为学观察发现:各组家兔造模前各项反应良好;造模术后第1天家兔均出现精神萎靡、活动度减少、进食减少等表现,第3、6天各项反应较前加重,于12、15天表现进一步加重(见表1)。表1 家兔造模前与造模术后各时间点一般状态比较
103.采用purdy评分标准对各组家兔行神经功能评估。总得分范围为2~11分,分数越小神经功能越接近于正常。结果各组家兔治疗前神经功能评分无明显差异(p>0.05);模型组治疗前后神经功能评分无明显差异(p>0.05);低、高剂量治疗组治疗前后神经功能评分比较差异有统计学意义(p<0.05);低、高剂量治疗组与模型组治疗结束后神经功能评分比较差异有统计学意义(p<0.05),高剂量治疗组与低剂量治疗组治疗结束后神经功能评分比较差异有统计学意义(p<0.05),这说明培元化瘀方有利于家兔神经功能的康复。(见表2、图4)表2 治疗前后各组家兔神经功能评分治疗前后各组家兔神经功能评分
104.3.3硬膜下血肿液体积变化
105.各组家兔硬膜下血肿部位可吸出少量淡黄色血肿液,其中高剂量治疗组有1只家兔硬膜下未吸出血肿液。低剂量治疗组与模型组比较,硬膜下血肿液体积差异有统计学意义(p<0.05);高剂量治疗组与模型组比较,硬膜下血肿液体积差异有统计学意义(p<0.01);高剂量治疗组与低剂量治疗组比较,硬膜下血肿液体积差异有统计学意义(p<
0.05)。(见表3、图5)表3 模型组与治疗组家兔硬膜下血肿液体积比较血肿液体积比较
106.3.4常规he染色光镜观察
107.镜下可见血肿外膜出现大量新生毛细血管、成纤维细胞、炎性细胞。成纤维细胞活化明显,提示纤维组织增生活跃并有不同程度的炎性反应。模型组与治疗组病理学变化表现相似,但治疗组纤维组织趋于成熟,炎性反应相对较轻。(见图6)
108.3.5免疫组织化学结果
109.血肿外膜中vegf阳性表达呈棕黄色,vegf的阳性表达可见于内皮细胞、纤维组织及浆细胞的表面。与模型组血肿外膜vegf阳性率(od值)比较,低、高剂量治疗组vegf阳性表达降低,差异有统计学意义(p<0.05);高剂量治疗组与低剂量治疗组vegf阳性表达比较,差异有统计学意义(p<0.05)。(见表4、图7)表4 模型组与治疗组家兔血肿外膜vegf阳性率(od值)比较模型组与治疗组家兔血肿外膜vegf阳性率(od值)比较注:与模型组比较*p<0.05;与低剂量治疗组比较#p<0.05
110.结论分析
111.如图1慢性硬膜下血肿动物模型造模流程:家兔头顶部定位,切开头皮;颅骨钻孔,切开硬脑膜置入引流管,冲洗硬膜下腔血液;封闭颅骨钻孔,缝合头皮,术后按时注血。
112.如图2正常家兔与造模成功后csdh家兔模型颅脑ct图。
113.如图3造模成功后csdh家兔模型颅脑ct图,包括新月形等密度影、新月状混杂低密度影和新月状低密度影等,提示csdh血肿家兔模型造模成功。
114.如图4造模成功后模型组与治疗组家兔治疗前后神经功能评分比较。
115.如图5造模成功后模型组与治疗组家兔治疗前后神经功能评分比较。
116.如图6模型组与治疗组家兔血肿外膜病理学变化(he400)。
117.如图7模型组与治疗组血肿外膜vegf表达(免疫组化400)。
118.上述实验证实用本发明建立的慢性硬膜下血肿动物模型用于实验均取得了阳性结果,再次证实本发明提供的造模方法成本低廉、模型稳定,易于复制,为慢性硬膜下血肿进一步实验研究提供基础。
119.以上资料显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的
技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1