癌症靶标及其应用
1.本发明属于生命科学中肿瘤研究领域,具体为针对小细胞肺癌诊断治疗新靶标分子的发现与应用。
背景技术:
2.小细胞肺癌约占全部肺癌的15%,预后差,小细胞患者其五年生存率还不到7%。究其主要原因,是由于小细胞肺癌的转移能力非常强,超70%的小细胞肺癌患者在最初被确诊时已发生广泛转移。因此,急需加强对小细胞肺癌转移分子机制的研究,为小细胞肺癌患者的临床治疗提供帮助。
3.之前的研究显示,约90%的人小细胞肺癌样本存在抑癌基因rb1和trp53的双缺失或者失活突变。2003年,meuwissen等人通过在小鼠上皮细胞中同时敲除rb1和trp53这两个基因,成功诱导了小细胞肺癌的产生,很好地模拟了人类疾病的发生发展过程。至此,第一例小鼠小细胞肺癌模型被成功建立,该小鼠小细胞肺癌表达神经内分泌相关的分子标志物,包括neuronal cell adhesion molecule(ncam)和achaete-scute complex homolog 1(ascl1),并极易转移到包括肝脏在内的远端组织器官。之后的研究发现,在该小鼠模型的基础上,再同时敲除rb1相关基因p130,或者抑癌基因pten,可显著加速肿瘤的恶性进展和转移。
4.转录共激活因子yap/taz(wwtr1)在多种上皮来源的肿瘤中发挥原癌基因的作用。yap/taz蛋白可以通过激活细胞周期和dna复制来促进细胞的异常增殖,并且可以抵御由于细胞脱落引起的失巢凋亡。而且,yap/taz可以维持细胞的自我更新和肿瘤起始的能力,并通过促进细胞的上皮-间质转变(epithelial to mesenchymal transition,emt)来促进肿瘤的恶性进展和转移。另外,yap/taz在调节肿瘤与肿瘤微环境之间的相互作用中也扮演着重要的角色,并影响微环境中免疫细胞的招募和激活。临床研究发现,yap/taz的表达还与非小细胞肺癌病人的预后不良密切相关。在dna损伤的情况下,yap通过与p73相互作用增强促凋亡相关基因的表达。然而,yap/taz在小细胞肺癌转移中的功能尚不清楚,亟待研究。
技术实现要素:
5.发明人发现wwtr1在小细胞肺癌中发挥抑癌作用,能抑制肿瘤的发展和转移。
6.本发明的目的在于提供一种癌症的药物靶点及防治癌症特别是wwtr1介导的癌症的试剂和方法。
7.本发明第一方面提供一种上调wwtr1基因的表达和/或活性的试剂在制备预防或治疗癌症、抑制肿瘤细胞生长、抑制肿瘤细胞侵袭能力、抑制肿瘤细胞克隆形成能力和抑制肿瘤细胞抗失巢凋亡能力的药物中的用途。
8.在一个或多个实施方案中,所述癌症是wwtr1(taz)介导的癌症。
9.在一个或多个实施方案中,所述癌症是wwtr1表达下降的癌症。
10.在一个或多个实施方案中,所述癌症是受益于wwtr1表达上调的癌症。
11.在一个或多个实施方案中,所述癌症是小细胞肺癌。优选wwtr1表达下降的小细胞肺癌。
12.在一个或多个实施方案中,所述肿瘤细胞是wwtr1表达下降的肿瘤细胞。
13.在一个或多个实施方案中,所述肿瘤细胞是小细胞肺癌细胞。优选wwtr1表达下降的小细胞肺癌细胞。
14.在一个或多个实施方案中,所述活性是wwtr1蛋白入核的活性。
15.在一个或多个实施方案中,上调wwtr1基因的表达和/或活性的试剂选自
16.(1)wwtr1基因或wwtr1激活变体基因,
17.(2)(1)的编码蛋白,
18.(3)含有(1)的核酸构建物,或,
19.(4)wwtr1表达和/或活性的促进剂。
20.在一个或多个实施方案中,所述wwtr1基因包括cdna序列、基因组序列、或其组合。
21.在一个或多个实施方案中,所述wwtr1基因来自哺乳动物,优选人。
22.在一个或多个实施方案中,所述wwtr1基因的编码蛋白的氨基酸序列选自下组:
23.(a)具有seq id no:1-3中任一项所示序列的多肽;
24.(b)将seq id no:1-3中任一项所示序列经过一个或多个(如1-20个;优选地1-10;更优选地1-5个)氨基酸残基的取代、缺失或添加而形成的,且具有(a)多肽功能的由(a)衍生的多肽;或
25.(c)与(a)的多肽序列有90%(优选地93%;更优选地95%或98%)以上同源性且具有(a)多肽功能的由(a)衍生的多肽。
26.在一个或多个实施方案中,所述wwtr1基因的核酸序列选自:
27.(1)编码如seq id no:1-3中任一项所示多肽的多核苷酸;
28.(2)如seq id no:9所示的多核苷酸或与其具有80%(优选地90%;更优选地95%或98%)以上同源性的多核苷酸;
29.(3)在seq id no:9所示多核苷酸的5’端和/或3’端截短或添加1-60个(优选地1-30,更优选地1-10个)核苷酸的多核苷酸;
30.(4)与(1)-(3)任一所述的多核苷酸互补的多核苷酸。
31.在一个或多个实施方案中,wwtr1激活变体基因的编码蛋白的氨基酸序列选自下组:
32.(a)具有seq id no:4-8中任一项所示序列的多肽;
33.(b)将seq id no:4-8中任一项所示序列经过一个或多个(如1-20个;优选地1-10;更优选地1-5个)氨基酸残基的取代、缺失或添加而形成的,且具有(a)多肽功能的由(a)衍生的多肽;或
34.(c)与(a)的多肽序列有90%(优选地93%;更优选地95%或98%)以上同源性且具有(a)多肽功能的由(a)衍生的多肽。
35.在一个或多个实施方案中,所述wwtr1激活变体基因的核酸序列选自:
36.(1)编码如seq id no:4-8中任一项所示多肽的多核苷酸;
37.(2)如seq id no:10所示的多核苷酸或与其具有80%(优选地90%;更优选地95%或98%)以上同源性的多核苷酸;
38.(3)在seq id no:10所示多核苷酸的5’端和/或3’端截短或添加1-60个(优选地1-30,更优选地1-10个)核苷酸的多核苷酸;
39.(4)与(1)-(3)任一所述的多核苷酸互补的多核苷酸。
40.在一个或多个实施方案中,所述核酸构建物是表达载体或整合载体。
41.在一个或多个实施方案中,wwtr1表达和/或活性的促进剂选自下组:小分子化合物、核酸分子或其组合。
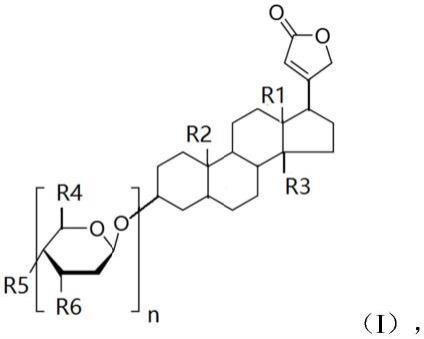
42.在一个或多个实施方案中,所述wwtr1表达和/或活性的促进剂是式i所示化合物:
[0043][0044]
其中r1-r6各自独立选自c1-c4烷基、羟基、卤素或氨基,n为1-9的整数。
[0045]
在一个或多个实施方案中,r1、r2和r4各自独立选自c1-c4烷基或羟基。
[0046]
在一个或多个实施方案中,r1、r2和r4各自独立选自c1-c4烷基。
[0047]
在一个或多个实施方案中,r1、r2和r4是甲基。
[0048]
在一个或多个实施方案中,r3、r5和r6各自独立选自羟基或卤素。
[0049]
在一个或多个实施方案中,r3、r5和r6是羟基。
[0050]
在一个或多个实施方案中,n为2-6的整数,优选3。
[0051]
在一个或多个实施方案中,所述wwtr1表达和/或活性的促进剂是:
[0052][0053]
本发明还提供包含wwtr1基因或wwtr1激活变体基因的核酸构建物,或包含所述核酸构建物的宿主细胞。所述核酸构建物可以是表达载体或整合载体。所述宿主细胞包括原核细胞和真核细胞。
[0054]
本发明还提供药物组合物,包含本文所述的核酸构建物和/或细胞,和药学上可接受的辅料。
[0055]
在本发明的另一方面,提供一种筛选预防或治疗癌症、抑制肿瘤细胞生长、抑制肿
瘤细胞侵袭能力、抑制肿瘤细胞克隆形成能力和抑制肿瘤细胞抗失巢凋亡能力的潜在物质的方法,所述方法包括:
[0056]
(1)用候选物质接触表达wwtr1或其激活变体的体系;和
[0057]
(2)检测所述体系中wwtr1的表达或活性。
[0058]
在一个或多个实施方案中,若所述候选物质可促进wwtr1的表达或活性,则表明该候选物质是预防或治疗癌症、抑制肿瘤细胞生长、抑制肿瘤细胞侵袭能力、抑制肿瘤细胞克隆形成能力和抑制肿瘤细胞抗失巢凋亡能力的潜在物质。
[0059]
在一个或多个实施方案中,所述癌症是wwtr1介导的癌症。
[0060]
在一个或多个实施方案中,所述癌症是wwtr1表达下降的癌症。
[0061]
在一个或多个实施方案中,所述癌症是受益于wwtr1表达上调的癌症。
[0062]
在一个或多个实施方案中,所述癌症是小细胞肺癌。优选wwtr1表达下降的小细胞肺癌。
[0063]
在一个或多个实施方案中,所述肿瘤细胞是wwtr1表达下降的肿瘤细胞。
[0064]
在一个或多个实施方案中,所述肿瘤细胞是小细胞肺癌细胞。优选wwtr1表达下降的小细胞肺癌细胞。
[0065]
在一个或多个实施方案中,步骤(1)包括:在测试组中,将候选物质加入到表达wwtr1或其激活变体的体系中。
[0066]
在一个或多个实施方案中,步骤(2)包括:检测测试组的体系中wwtr1的表达或活性,并与对照组比较,其中所述的对照组是不添加所述候选物质的表达wwtr1或其激活变体的体系。
[0067]
在一个或多个实施方案中,如果测试组中wwtr1或其激活变体的表达或活性在统计学上高于(优选显著高于,如高20%以上,较佳的高50%以上;更佳的高80%以上)对照组,就表明该候选物是预防或治疗癌症、抑制肿瘤细胞生长、抑制肿瘤细胞侵袭能力、抑制肿瘤细胞克隆形成能力和抑制肿瘤细胞抗失巢凋亡能力的潜在物质。
[0068]
在一个或多个实施方案中,所述的表达wwtr1或其激活变体的体系选自:细胞体系(或细胞培养物体系)、亚细胞体系、溶液体系、组织体系、器官体系或动物体系。
[0069]
在一个或多个实施方案中,所述的表达wwtr1或其激活变体的体系是癌症细胞或溶液体系。
[0070]
另一方面,本发明提供一种预防或治疗对象癌症的方法,所述方法包括:上调所述对象的wwtr1基因的表达和/或活性。
[0071]
在一个或多个实施方案中,所述方法包括向需要的患者给予wwtr1基因或其编码蛋白、wwtr1激活变体基因或其编码蛋白、或wwtr1表达和/或活性的促进剂。
[0072]
在一个或多个实施方案中,所述方法的其他特征如本文第一方面中所述。
[0073]
本发明另一方面提供检测wwtr1表达或活性的试剂在制备用于诊断癌症或或其预后的试剂盒中的用途。
[0074]
在一个或多个实施方案中,所述癌症是wwtr1介导的癌症。
[0075]
在一个或多个实施方案中,所述癌症是wwtr1表达下降的癌症。
[0076]
在一个或多个实施方案中,所述癌症是受益于wwtr1表达上调的癌症。
[0077]
在一个或多个实施方案中,所述癌症是小细胞肺癌。优选wwtr1表达下降的小细胞
肺癌。
[0078]
在一个或多个实施方案中,检测wwtr1表达或活性的试剂包括:
[0079]
(1)靶向wwtr1或其转录本的引物或探针,或
[0080]
(2)特异性结合wwtr1的抗体或配体。
[0081]
在一个或多个实施方案中,所述试剂盒还包含rt-pcr所需试剂,例如反转录酶、rna提取试剂、核酸聚合酶,dntp,pcr缓冲液等。
[0082]
在一个或多个实施方案中,所述试剂盒还包含northern所需试剂,例如rna提取试剂、核糖核酸酶抑制剂、northern缓冲液等。
[0083]
在一个或多个实施方案中,所述试剂盒还包含western所需试剂,例如蛋白提取试剂、丙烯酰胺、异硫氰酸胍、tris、sds、temed等。
[0084]
在一个或多个实施方案中,wwtr1基因、其转录本、蛋白的序列如本文第一方面所述。
[0085]
在本发明的另一方面,提供一种诊断癌症或其预后的方法,所述方法包括检测对象中wwtr1的表达或活性。
[0086]
在一个或多个实施方案中,所述方法包括:
[0087]
(1)获取对象的样品,
[0088]
(2)检测对象样品中wwtr1表达或活性,和
[0089]
(3)将对象的wwtr1表达或活性与健康对照的wwtr1表达或活性比较,若对象的wwtr1表达或活性降低,则诊断对象具有癌症或癌症预后不良。
[0090]
在一个或多个实施方案中,所述样品是体液或组织活检物。
[0091]
在一个或多个实施方案中,所述癌症是wwtr1介导的癌症。
[0092]
在一个或多个实施方案中,所述癌症是wwtr1表达下降的癌症。
[0093]
在一个或多个实施方案中,所述癌症是受益于wwtr1表达上调的癌症。
[0094]
在一个或多个实施方案中,所述癌症是小细胞肺癌。优选wwtr1表达下降的小细胞肺癌。
[0095]
本发明还提供式i所示化合物在上调wwtr1表达和/或活性中的用途:
[0096][0097]
其中r1-r6各自独立选自c1-c4烷基、羟基、卤素或氨基,n为1-9的整数。
[0098]
在一个或多个实施方案中,r1、r2和r4各自独立选自c1-c4烷基或羟基。
[0099]
在一个或多个实施方案中,r1、r2和r4各自独立选自c1-c4烷基。
[0100]
在一个或多个实施方案中,r1、r2和r4是甲基。
[0101]
在一个或多个实施方案中,r3、r5和r6各自独立选自羟基或卤素。
[0102]
在一个或多个实施方案中,r3、r5和r6是羟基。
[0103]
在一个或多个实施方案中,n为2-6的整数,优选3。
附图说明
[0104]
图1表明smc具有更强的肝转移能力。
[0105]
a:non-smc和smc裸鼠皮下成瘤实验中肝转移照片。绿色箭头指示转移灶。
[0106]
b:non-smc和smc裸鼠皮下成瘤实验的肝转移百分比。每组三个细胞系。每个细胞系接种5种裸鼠。
[0107]
图2表明taz在non-smc中明显上调。
[0108]
a:rna-seq和atac-seq整合性分析示意图。smc和non-smc中的特异的tf网络根据peca2模型建立。
[0109]
b:taz在smc和non-smc中的表达热图。
[0110]
c:定量pcr检测taz在smc和non-smc中的mrna表达情况。
[0111]
图3显示敲低taz促进小细胞肺癌的恶性进展和转移。
[0112]
a:non-smc敲低taz和对照细胞株之间的比较分析示意图。
[0113]
b:3-d细胞培养实验检测non-smc敲低taz前后侵袭能力的差异。标尺:100μm。
[0114]
c:软琼脂糖成克隆实验检测non-smc敲低taz前后增殖能力的差异。克隆生长代表性图(左),统计分析(右),标尺:100μm。
[0115]
d:免疫印迹实验检测non-smc敲低taz前后抗失巢凋亡能力的差异。cc3:切割的胱冬梅3。内参:tubulin。
[0116]
e:non-smc敲低taz前后在裸鼠中肝转移百分比。
[0117]
f:免疫组织化学染色检测皮下接种non-smc-shtaz或对照细胞的裸鼠肝脏中ncam的蛋白表达水平。标尺:100μm。
[0118]
图4显示过表达taz-4sa抑制小细胞肺癌的恶性进展和转移。
[0119]
a:smc过表达taz-4sa和对照细胞株之间的比较分析示意图。
[0120]
b:3-d细胞培养实验检测smc过表达taz-4sa前后侵袭能力的差异。标尺:100μm。
[0121]
c:软琼脂糖成克隆实验检测non-smc敲低taz前后增殖能力的差异。克隆生长代表性图(左),统计分析(右),标尺:100μm。
[0122]
d:免疫印迹实验检测smc过表达taz-4sa前后抗失巢凋亡能力的差异。cc3:cleaved caspase 3。内参:tubulin。
[0123]
e:smc过表达taz-4sa前后在裸鼠中肝转移百分比。
[0124]
f:免疫组织化学染色检测皮下接种smc-taz-4sa或对照细胞的裸鼠肝脏中ncam的蛋白表达水平。标尺:100μm。
[0125]
图5表明digitoxin处理激活taz明显抑制小细胞肺癌恶性进展和转移。
[0126]
a:免疫组织化学染色检测皮下接种smc-taz-4sa或对照细胞的裸鼠的皮下肿瘤中taz的蛋白表达水平。标尺:100μm。
[0127]
b:皮下接种smc裸鼠,在给与taz激活剂digitoxin处理后与对照组中肝转移百分比。
[0128]
图6表明taz低表达水平与小细胞肺癌的预后不良相关。
[0129]
a:免疫组织化学染色检测临床小细胞肺癌患者手术肿瘤样本中taz的蛋白表达水平。标尺:100μm。
[0130]
b:不同taz蛋白表达水平的小细胞肺癌患者的生存期(overall survival,os)。
具体实施方式
[0131]
通过对人类临床样本、细胞系和以癌症为背景的基因工程小鼠模型的综合分析,发明人证实了taz在小细胞肺癌发展及转移的过程中发挥抑癌作用,可以作为临床治疗的潜在靶标。此外,对人小细胞肺癌样本分析证实,taz的低表达水平与患者的预后不良相关。
[0132]
wwtr1、其变体及其促进剂
[0133]
如本文所用,wwtr1(或称taz)基因编码的多肽命名为“wwtr1”或“taz”。在本发明中,术语“wwtr1”指具有wwtr1活性的seq id no:1-3中任一项所示序列的多肽。该术语还包括具有与wwtr1相同功能的、seq id no:1-3中任一项所示序列的变异形式。这些变异形式包括(但并不限于):若干个(通常为1-50个,优选地1-30个、1-20个、1-10个、1-8个、1-5个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加或缺失一个或数个(通常为20个以内,优选地为10个以内,更优选地为5个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。在本领域中,性能相似的氨基酸往往指具有相似侧链的氨基酸家族,在本领域已有明确定义。这些家族包括具有碱性侧链的氨基酸(例如赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(例如天冬氨酸、谷氨酸)、具有不带电荷的极性侧链的氨基酸(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、具有非极性侧链的氨基酸(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、乳酸、苯丙氨酸、甲硫氨酸、色氨酸)、具有β-分支侧链的氨基酸(例如苏氨酸、缬氨酸、异亮氨酸)和具有芳香侧链的氨基酸(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。又比如,在氨基末端和/或羧基末端添加一个或数个氨基酸通常也不会改变多肽或蛋白的功能。对于许多常见已知非遗传性编码氨基酸的保守氨基酸取代本领域已知。其他非编码氨基酸的保守取代可基于其物理性质与遗传上编码的氨基酸的性质的比较来确定。
[0134]
多肽的变异形式包括:同源序列、保守性变异体、等位变异体、天然突变体、诱导突变体、激活变体。
[0135]
任何与所述wwtr1同源性高(比如与seq id no:1-3中任一项所示的序列的同源性为70%或更高;优选的,同源性为80%或更高;更优选的,同源性为90%或更高,如同源性95%,98%或99%)的、且具有wwtr1相似或相同功能的多肽也包括在本发明内。所述“相同或相似功能”主要是指与抑制肿瘤细胞生长、侵袭、转移的功能。
[0136]
本发明还包括所要求保护的多肽的类似物。这些类似物与天然wwtr1差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。这些蛋白的类似物包括天然或诱导的遗传变异体。诱导变异体可以通过各种技术得到,如通过辐射或暴露于诱变剂而产生随机诱变,还可通过定点诱变法或其他已知分了生物学的技术。类似物还包括具有不同于天然l-氨基酸的残基(如d-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的蛋白并不限于上述例举的代表性的蛋白。
[0137]
本发明还包括wwtr1的激活变体。激活变体具有与wwtr1相似的序列但更高的活性。任何本领域已知的wwtr1的激活变体均可以在本发明中使用,用来提高细胞(例如肿瘤细胞)wwtr1活性,从而抑制肿瘤细胞(例如小细胞肺癌的细胞)生长、侵袭、转移。本领域已知的示例性激活变体包括但不限于taz-4sa、tazs89a、tazs66a、tazs117a、tazs311a,其氨基酸序列如seq id no:4-8中任一项所示。
[0138]
本发明的多肽片段、衍生物或类似物还可以是:(i)成熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽;或(ii)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或融合蛋白)。根据本文的定义这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
[0139]
本发明还涉及编码本发明wwtr1或其变体、类似物、衍生物的多核苷酸序列。所述多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。编码成熟多肽的编码区序列可以与seq id no:9或10中所示的编码区序列相同或者是简并的变异体。
[0140]
本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽的片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的多肽的功能。如本文所用,简并变异体在本发明中是指编码具有seq id no:1-8中任一项的蛋白质,但seq id no:9或10中所示的编码区序列有差别的核酸序列。“编码多肽的多核苷酸”可以是包括编码所述多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
[0141]
本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,优选至少70%,更优选至少80%相同性的多核苷酸。本发明特别涉及在严谨条件下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严谨条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2
×
ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。并且,可杂交的多核苷酸编码的多肽与seq id no:1-8中任一项所示的成熟多肽有相同的生物学功能和活性。
[0142]
本发明的wwtr1核苷酸全长序列或其片段(例如引物或探针)通常可以用pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的dna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。本领域已知的设计引物和探针序列的方法均可用于本文,例如通过软件primer express。
[0143]
此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。目前,已经可以完全通过化
学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
[0144]
本发明还提供了一种包括本发明的基因的重组载体。常见的重组载体包括表达载体和整合载体。表达载体用于在宿主中表达所述基因,表达可以是诱导表达(例如使用诱导启动子)或组成型表达(例如使用组成型启动子)。整合载体用于将所述基因整合到所述宿主的基因组中。作为一种优选的方式,重组载体的启动子下游包含多克隆位点或至少一个酶切位点。当需要表达本发明目的基因时,将目的基因连接入适合的多克隆位点或酶切位点内,从而将目的基因与启动子可操作地连接。作为另一种优选方式,所述的重组载体包括(从5’到3’方向):启动子,目的基因,和终止子。如果需要,所述的重组载体还可以包括选自下组的元件:3’多聚核苷酸化信号;非翻译核酸序列;转运和靶向核酸序列;抗性选择标记(二氢叶酸还原酶、新霉素抗性、潮霉素抗性以及绿色荧光蛋白等);增强子;或操作子。
[0145]
本领域普通技术人员可以使用熟知的方法构建含有本发明所述的基因的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。使用本发明的基因构建重组表达载体时,可在其转录起始核苷酸前加上任何一种增强型、组成型、组织特异型或诱导型启动子。表达载体可以是细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒或其他载体。总之,只要其能够在宿主体内复制和稳定,任何质粒和载体都是可以被采用的。
[0146]
包括本发明基因、表达盒或的载体可以用于转化适当的宿主细胞,以使宿主表达蛋白质。宿主细胞可以是原核细胞,如大肠杆菌,链霉菌属、农杆菌;或是低等真核细胞,如酵母细胞;或高等真核细胞,如动物细胞。本领域一般技术人员都清楚如何选择适当的载体和宿主细胞。用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物(如大肠杆菌)时,可以用cacl2法处理,也可用电穿孔法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法(如显微注射、电穿孔、脂质体包装等)。所述多核苷酸在高等真核细胞中表达时,如果在载体中插入增强子序列时将会使转录得到增强。增强子是dna的顺式作用因子,通常大约有10到300个碱基对,作用于启动子以增强基因的转录。
[0147]
可采用任何适当的常规手段,包括试剂、温度、压力条件等来实施所述的方法。其它增加wwtr1表达的方法是本领域周知的。例如,可通过用强启动子驱动从而增强wwtr1的表达。或者通过增强子来增强该wwtr1基因的表达。适用于本发明方法的强启动子包括但不限于:35s启动子、水稻、玉米的ubi启动子等。本领域一般技术人员清楚如何选择适当的载体、启动子、增强子和宿主细胞。
[0148]
本文所述多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括(但并不限于):常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
[0149]
本发明还涉及上调wwtr1基因的表达和/或活性的试剂。这些试剂通过对wwtr1的影响来抑制肿瘤生长,从而预防和治疗癌症(例如小细胞肺癌)、抑制肿瘤细胞生长、抑制肿
瘤细胞侵袭能力、抑制肿瘤细胞克隆形成能力和抑制肿瘤细胞抗失巢凋亡能力。任何可提高wwtr1的活性、提高其的稳定性、促进其表达、延长其有效作用时间、或促进其基因转录和翻译的物质均可用于本发明,作为上调wwtr1基因的表达和/或活性的试剂。例如,上述的wwtr1基因或wwtr1激活变体基因、其编码蛋白、表达所述蛋白的核酸构建物均包含在上调wwtr1基因的表达和/或活性的试剂中。
[0150]
上调wwtr1基因的表达和/或活性的试剂还包括wwtr1表达和/或活性的促进剂,例如具有上述功能的小分子化合物、核酸分子或其组合。在示例性实施方案中,所述wwtr1表达和/或活性的促进剂是式i所示化合物:
[0151][0152]
其中r1-r6各自独立选自c1-c4烷基、羟基、卤素或氨基,n为1-9的整数。在某些实施方案中,所述wwtr1表达和/或活性的促进剂是:
[0153][0154]
如本文所用,术语“烷基”单独或与其它术语组合使用,是指饱和脂肪族烷基,包括1-20个碳原子的直链或支链烷基以及环状基团。优选地,烷基是指含有1-10个碳原子的中等烷基,如甲基、乙基、丙基、2-异丙基、正丁基、异丁基、叔丁基、戊基及类似烷基。更优选地,是指含有1-4个碳原子的低级烷基,例如甲基、乙基、丙基、2-异丙基、正丁基、异丁基、叔丁基及类似烷基。环状基团可以是单环或多环,并且优选具有3-10个环碳原子。示例性的环状基团包括环丙基、环丙基甲基、环戊基、环己基、金刚烷基、以及取代的和未取代的冰片基、降冰片基和降冰片烯基。烷基可以被取代也可不被取代。当被取代时,取代基个数为1个或多个,优选1-3个,更优选1个或2个,取代基团独立地选自包括卤素、羧基、羟基、低级烷氧基、芳基。
[0155]
本文所用术语“卤素”指f、cl、br、或i。术语“羟基”表示-oh基团。术语“氧代”或基团“氧”表示=o基团。术语“氨基”指-nh2基团。
[0156]
药物组合物
[0157]
本发明还提供了一种组合物,它含有有效量(如0.000001-50wt%;较佳的0.00001-20wt%;更佳的,0.0001-10wt%)的上调wwtr1表达和/或活性的试剂,以及药学上可接受的辅料。所述组合物可用于防治wwtr1相关癌症。任何前述的上调wwtr1表达和/或活性的试剂均可用于组合物的制备。
[0158]
如本文所用,所述“有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。所述“药学上可接受的辅料”指用于治疗剂给药的辅料,包括各种赋形剂和稀释剂。该术语指这样一些药剂辅料:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的辅料是本领域普通技术人员所熟知的。在组合物中药学上可接受的辅料可含有液体,如水、盐水、缓冲液。另外,这些辅料中还可能存在辅助性的物质,如填充剂、润滑剂、助流剂、润湿剂或乳化剂、ph缓冲物质等。所述的辅料中还可以含有细胞转染试剂。
[0159]
在得知了所述上调wwtr1表达和/或活性的试剂的用途后,可以采用本领域熟知的多种方法来将所述试剂(例如基因、蛋白、小分子化合物)或其药物组合物给药于哺乳动物。包括但不限于:皮下注射、肌肉注射、经皮给予、局部给予、植入、缓释给予等;优选的,所述给药方式是非肠道给予的。
[0160]
优选的,可采用基因治疗的手段进行。比如,可直接将上调wwtr1表达和/或活性的试剂通过诸如注射等方法给药于受试者;或者,可通过一定的途径将携带上调wwtr1表达和/或活性的试剂的表达单位(比如表达载体或病毒等)递送到靶点(例如肿瘤细胞)上,并使之表达活性的上调试剂,具体情况需视所述试剂的类型而定,这些均是本领域技术人员所熟知的。
[0161]
本发明所述的上调wwtr1表达和/或活性的试剂的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的上调wwtr1表达和/或活性的试剂的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。通常,当本发明的上调wwtr1表达和/或活性的试剂每天以约0.00001mg-50mg/kg动物体重(例如0.0001mg-10mg/kg动物体重)的剂量给予,能得到令人满意的效果。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
[0162]
药物筛选
[0163]
在得知了wwtr1与相关癌症的密切相关性后,可以基于该特征来筛选上调wwtr1的表达或活性的物质。可从所述的物质中找到对于预防或治疗wwtr1相关癌症有用的药物。
[0164]
因此,本发明提供一种筛选预防或治疗wwtr1相关癌症的潜在物质的方法,所述的方法包括:用候选物质接触表达wwtr1或其激活变体的体系;和(2)检测所述体系中wwtr1的表达或活性。若所述候选物质可促进wwtr1的表达或活性,则表明该候选物质是预防或治疗癌症的潜在物质。
[0165]
所述的表达wwtr1或其激活变体的体系例如可以是细胞(或细胞培养物)体系,所述的细胞可以是内源性表达wwtr1或其激活变体的细胞;或可以是重组表达wwtr1或其激活变体的细胞。所述的表达wwtr1或其激活变体的体系还可以是亚细胞体系、溶液体系、组织体系、器官体系或动物体系(如动物模型,优选非人哺乳动物的动物模型,如鼠、兔、羊、猴
等)等。
[0166]
在本发明的优选方式中,在进行筛选时,为了更易于观察到mcp-1的表达或活性的改变,还可设置对照组,所述的对照组可以是不添加所述候选物质的表达wwtr1或其激活变体的体系。
[0167]
本发明对于wwtr1或其激活变体蛋白的表达、活性、存在量或分泌情况的检测方法没有特别的限制。可以采用常规的蛋白定量或半定量检测技术,例如(但不限于):sds-page法,western-blot法等。
[0168]
诊断和试剂盒
[0169]
基于wwtr1可以抑制肿瘤细胞生长和侵袭,进而抑制肿瘤的发生发展,并且发明人还发现高表达wwtr1的肿瘤预后不良,本发明还提供一种诊断癌症或癌症预后的方法,所述方法包括检测对象中wwtr1的表达或活性。所述方法包括:(1)获取对象的样品,(2)检测对象样品中wwtr1表达或活性,和(3)将对象的wwtr1表达或活性与健康对照的wwtr1表达或活性比较,若对象的wwtr1表达或活性降低,则诊断对象具有癌症或癌症预后不良,尤其是wwtr1相关癌症。优选地,所述癌症是wwtr1表达下降的癌症或受益于wwtr1表达上调的癌症。在具体实施方案中,所述癌症是小细胞肺癌。
[0170]
通常,检测wwtr1表达或活性所使用的试剂包括:(1)靶向wwtr1或其转录本的引物或探针,或(2)特异性结合wwtr1的抗体或配体。引物、探针如本文他处所述。本领域已知的任何特异性结合wwtr1的抗体或配体均可以用于本发明。所述的抗体可以是单克隆抗体或多克隆抗体。可用wwtr1蛋白免疫动物,如家兔,小鼠,大鼠,骆驼等来生产多克隆抗体;多种佐剂可用于增强免疫反应,包括但不限于弗氏佐剂等。与之相似的,表达wwtr1或其具有抗原性的片段的细胞可用来免疫动物来生产抗体。所述的抗体也可以是单克隆抗体,此类单克隆抗体可以利用杂交瘤技术或者单细胞筛选来制备。此外,在知晓了抗体的序列后,可以将抗体的编码序列装载入表达载体中,从而将抗体基因与启动子、终止子等可操作地连接,并在宿主细胞中表达,从而生产抗体。表达载体所需的其他组件,例如启动子、终止子、表达载体可以是细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒或其他载体。总之,只要其能够在宿主体内复制和稳定,任何质粒和载体都是可以被采用的。本领域一般技术人员清楚如何选择适当的载体、启动子、增强子和宿主细胞。
[0171]
检测wwtr1表达或活性的试剂可以制成用于诊断wwtr1相关癌症的试剂盒。此外,所述试剂盒还可包含rt-pcr所需试剂,例如反转录酶、rna提取试剂、核酸聚合酶,dntp,pcr缓冲液等;或者,所述试剂盒还可包含northern所需试剂,例如rna提取试剂、核糖核酸酶抑制剂、northern缓冲液等;或者,所述试剂盒还包含western所需试剂,例如蛋白提取试剂、丙烯酰胺、异硫氰酸胍、tris、sds、temed等。
[0172]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室指南(newyork:coldspringharbor laboratorypress,2002)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0173]
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述
的较佳实施方法与材料仅作示范之用。
[0174]
实施例
[0175]
材料与方法
[0176]
1.蛋白
[0177]
ncam(cat#a0393,abclonal),taz(23306-1-ap,proteintech),taz(cat#4883s,cst),经切割的半胱氨酸蛋白酶3(cleaved caspase 3)(cat##9661,cst),tublin(cat#1699,bioworld)。
[0178]
2.细胞培养
[0179]
293t购自atcc,传代细胞株由8%fbs(gibco)的高糖dmem培养基(hyclone)培养。小鼠原代细胞系由含有8%fbs(gibco)的rpmi1640培养基(hyclone)培养。
[0180]
3.实时荧光定量pcr检测
[0181]
提取rna后,利用反转录试剂盒(invitrogen,carlsbad,ca)合成cdna,采用abi 7500(perkin elmer life science,shelton,ct)检测。引物序列如下:
[0182]
基因正向引物(5'-3')反向引物(5'-3')gapdhacccagaagactgtggatggcacattgggggtaggaacactazgaaggtgatgaatcagcctctggttctgagtcgggtggttctg
[0183]
3.western blot检测
[0184]
细胞或者组织裂解后电泳,电转后将pvdf膜5%牛奶封闭,一抗过夜,二抗室温孵育1小时候dab显色,x光片压片,显影液中1min,在定影液中浸润5-10min,之后离子水冲洗干净,观察条带。
[0185]
4.干扰序列
[0186]
mouse-shtaz#1:cagccgaatctcgcaatgaat
[0187]
mouse-shtaz#2:catgagcacagatatgagat
[0188]
5.裸鼠皮下成瘤
[0189]
在裸鼠成瘤实验中,我们将5
×
106个肿瘤细胞接种到裸鼠皮下。之后隔天测量肿瘤大小,在接种后的第10周收集肿瘤,并分析裸鼠肝转移情况。
[0190]
6.组织切片染色
[0191]
组织切片经过脱蜡,水化,3%过氧化氢室温处理15min,依次经过高火5min,解冻2min,中低温20min微波抗原修复,封闭液封闭,一抗过夜,二抗37℃孵育30min,dab显色5min,苏木精复染,脱水干燥。中性树脂封片,观察。
[0192]
7.matrigel侵袭实验、琼脂糖凝胶成克隆和失巢凋亡实验
[0193]
侵袭实验中,我们将10,000细胞接种到2%的matrigel(bd biosciences)中,培养2-3周后拍照记录。在琼脂糖凝胶成克隆实验中,预先在6孔板底部加1毫升1%的琼脂糖,凝固后,在上层加入1毫升混有5,000细胞接种的0.4%琼脂糖。克隆形成后用0.005%的结晶紫染色、计数。在失巢凋亡实验中,预先将6孔板用3%的低熔点琼脂糖凝胶包被。之后将1x106的non-smc-ctrl和non-smc-shtaz,或者smc-ctrl和smc-taz-4sa细胞铺到包被好的6孔板中,培养24小时后,收蛋白样品,定量,检测cleaved caspase 3的蛋白表达水平。
[0194]
实施例1,taz在高转移的小鼠小细胞肺癌细胞系中显著下调
[0195]
首先,借助rb1
l/l
,trp53
l/l
小细胞肺癌小鼠模型,成功建立了一系列小鼠小细胞肺
癌细胞系。之后,利用这些细胞系进行裸鼠皮下成瘤实验,发现这些细胞系的转移能力存在明显的差异(图1)。将具有高转移能力的细胞系命名为smc(small cell lung cancer metastasizing cells),另一群细胞系则命名为non-smc(non-small cell lung cancer metastasizing cells)。
[0196]
为了寻找与小细胞肺癌转移相关的分子机制,我们通过对rna-seq和atac-seq数据进行整合性分析,建立了在smc和non-smc中的转录因子调节网络(图2,a)。基于rna-seq数据的基因集合富集分析(gene set enrichment analysis,gsea)分析显示,taz在non-smc和smc中明显差异表达(图2,b)。之后,我们也利用定量pcr技术进一步确定了taz的表达水平在高转移能力的smc中明显下降(图2,c)。这些结果提示taz在小细胞肺癌的转移中可能发挥抑制作用。
[0197]
实施例2,敲低taz促进小鼠小细胞肺癌的转移
[0198]
为了验证taz在小细胞肺癌转移中的作用,我们在non-smc中敲低taz,然后通过一系列的体外和体内实验来检测taz对其转移能力的影响(图3,a)。在体外实验中,我们发现,在non-smc中敲低taz明显促进了肿瘤细胞的侵袭能力,克隆形成能力和抗失巢凋亡的能力(图3,b-d)。
[0199]
接下来,为了在体内验证敲低taz的作用,我们将taz敲低的non-smc及对照细胞皮下接种到裸鼠。结果表明taz敲低提高了肿瘤发生肝转移的百分比,促进了小细胞肺癌的转移(图3,e)。我们进行了组织切片染色,结果显示这些转移灶表达小细胞肺癌的分子标志物ncam(图3,f)。
[0200]
实施例3,过表达taz-4sa显著抑制小鼠小细胞肺癌的转移
[0201]
之后,我们通过在高转移能力的smc细胞系中过表达taz的激活突变体taz-4sa检测taz的作用(图4,a)。体外功能实验的结果表明过表达taz-4sa后,smc的侵袭能力、克隆形成能力和抗失巢凋亡能力都被显著抑制(图4,b-d)。
[0202]
接下来,我们将过表达taz-4sa的smc细胞系和对照细胞系接种到裸鼠皮下。结果表明,与对照组相比,taz-4sa过表达的smc在裸鼠中的肝转移发生率显著降低(图4,e)。我们对肝组织进行了组织切片染色,结果显示这些转移灶均表达小细胞肺癌的分子标志物ncam(图4,f)。
[0203]
实施例4,digitoxin处理激活taz明显抑制小鼠小细胞肺癌的转移能力
[0204]
首先在裸鼠皮下接种了smc细胞系,当皮下肿瘤长到200mm3左右,开始通过腹腔给药的方式给与digitoxin(1mg/kg)处理,隔天给药一次。通过对皮下肿瘤的免疫组织化学染色,我们发现digitoxin处理的确可以增加细胞核中taz的表达水平(图5,a)。更重要的是,digitoxin处理显著抑制了smc在裸鼠中的肝脏转移能力(图5,b)。这些结果提示,digitoxin可以激活smc中taz,促进其入核,并且抑制小细胞肺癌的肝转移能力。这一发现为小细胞肺癌的治疗提供了潜在靶点。
[0205]
实施例5,taz的低表达水平与临床小细胞肺癌的预后不良相关。
[0206]
为了分析我们的研究是否具有临床相关性,我们通过与医院合作收集并分析了101例中国小细胞肺癌患者的手术肿瘤样本。首先,我们通过免疫组织化学的染色检测了这些样本中taz的表达水平(图6,a)。通过对这些患者的总生存期进行分析,我们发现taz低表达患者的生存期明显短于高表达患者(图6,b)。这些结果表明,taz在小细胞肺癌的恶性进
展和转移过程中发挥抑癌基因的功能,并可能成为临床治疗小细胞肺癌的潜在靶标。
[0207]
总结与讨论
[0208]
(1)我们利用原发肺癌小鼠模型来源的小细胞肺癌细胞株及相关的生信分析,发现taz在小细胞肺癌的恶性进展中可能发挥抑癌基因的功能。(2)通过功能实验我们证实,敲低taz可以增强小细胞肺癌的转移能力。相反,无论是过表达taz的激活突变体或者是其激活剂,均能有效抑制小细胞肺癌的转移能力。我们进一步对人小细胞肺癌样本分析证实,taz的低表达水平与患者的预后不良相关。综合这些实验结果,我们的研究证实taz是小细胞肺癌中的一个重要抑癌基因,并提出靶向激活taz可作为诊断和治疗小细胞肺癌的潜在策略。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1