AR抑制剂和/或HIF-1α抑制剂在制备药物中的应用的制作方法
本发明属于病毒性肺炎治疗
技术领域:
,具体涉及ar抑制剂和/或hif-1α抑制剂在制备抑制炎症因子风暴药物、预防或治疗病毒性肺炎中的应用。
背景技术:
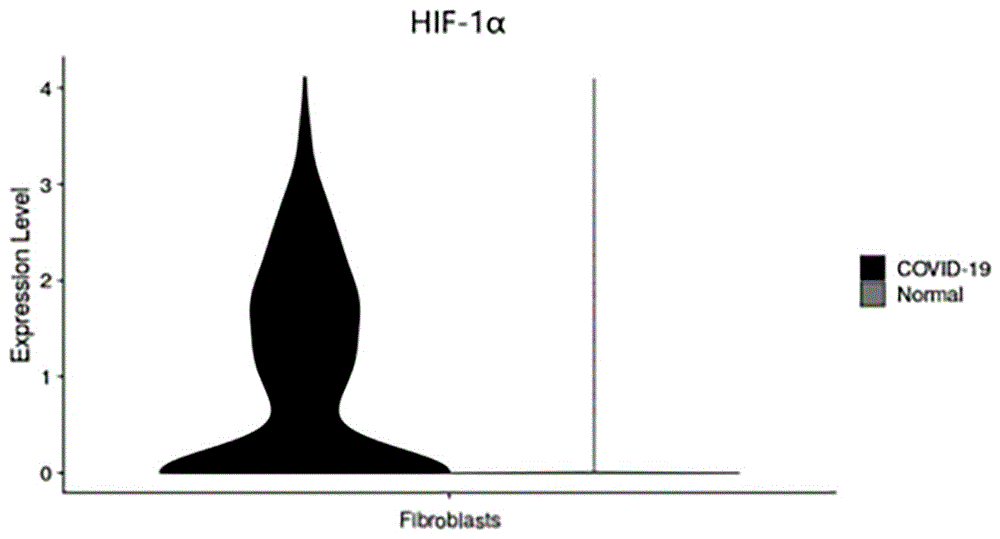
:严重呼吸道感染可导致急性呼吸窘迫综合征(ards)。目前还没有有效的药物治疗已经被证明可以改善ards患者的预后。虽然宿主的炎症反应限制了病原体的传播并最终清除了病原体,但免疫病理是导致组织损伤和ards的主要原因之一。此外,肺成纤维细胞在病毒肺炎中发挥重要的作用。呼吸道病毒感染会引起不同的成纤维细胞激活状态,包括细胞外基质(ecm)合成、损伤反应和干扰素应答状态。在严重流感病毒感染期间,损伤反应的肺成纤维细胞的过度活动诱发致命的免疫病理。通过产生ecm重塑酶和炎症因子,损伤反应的成纤维细胞改变肺部微环境,促进免疫细胞的浸润,损害肺功能。一种靶向损伤反应性肺成纤维细胞的治疗剂,可为严重呼吸道感染后维持肺功能和改善临床疗效提供一种有前景的方法。病毒性肺炎(viralpneumonia)是由上呼吸道病毒感染、向下蔓延所致的肺部炎症,根据症状严重程度,临床分为轻型、中型、重型和危重型。轻度病例临床症状轻微但没有肺炎的影像学表现;中度病例伴随发烧,呼吸道症状和肺炎影像学表现;重症病例出现低氧血症,且静止时的氧饱和度<93%或pao2/fio2<300mmhg;危重症病例则会需要机械通气或icu重症监护等。病毒性肺炎重症与否的关键在于低氧血症,低氧血症会使得肺部产生缺氧的环境;同时,重型患者会快速进展为急性呼吸窘迫综合症(ards)、脓毒症休克、难以纠正的代谢性酸中毒、出凝血功能障碍及多器官功能衰竭等。病毒性肺炎病毒的感染会导致急性呼吸窘迫综合征(ards)从而引发肺组织的炎症反应,炎症反应产生的多种刺激物质使得正常的肺成纤维细胞活化。活化的成纤维细胞可产生大量炎症因子如白介素6以及基质蛋白酶如mmp2等。同时,肺成纤维细胞的活化使得病毒性肺炎临床症状进一步加重。有文献报道称为探究确定呼吸道感染者肺部成纤维细胞活化的上游刺激,通过使用人季节性h3n2病毒或禽类h5n6、h7n9病毒在体外感染正常人支气管上皮细胞(nhbes)是否足以在共培养中驱动人肺成纤维细胞中的炎症转录程序。结果表明nhbes的感染诱导了成纤维细胞中富含炎症状态的基因的表达,这些基因包括细胞因子白介素6(il6);基质蛋白酶基质金属蛋白酶2(mmp2)、基质金属蛋白酶13(mmp13)和adamts4;细胞外基质蛋白酶弹性蛋白(eln)、多功能蛋白聚糖(vcan)、ⅲ型胶原蛋白基因α1(col3a1);血管生长因子(vegfa)等。我们研究发现(suppressionofandrogenreceptor(ar)-ace2/tmprss2axisbyarantagonistsmaybetherapeuticallybeneficialformalecovid-19patients,january2020,ssrnelectronicjournal),ar抑制剂普克鲁胺可以靶向ar-ace2/tmprss2信号轴,通过抑制血管紧张素转换酶2(ace2)和跨膜丝氨酸蛋白酶2(tmprss2)的表达,来降低或阻断covid-19进入宿主细胞。可以看出,调控ace2和tmprss2表达主要是影响新冠感染。同时,现有研究披露(remdesivirinadultswithseverecovid-19:arandomised,double-blind,placebo-controlled,multicentretrial,vol395may16,2020,thelancet,),瑞德西韦用于新冠重症临床实验(nct04257656)的失败也表明单独抗病毒感染并不能改善重症患者的转归,造成病毒性肺炎患者重症化的最主要原因是低氧血症。因此,探寻一种能够抑制低血氧症导致的成纤维细胞活化的药物对于治疗病毒性肺炎特别是中重症病毒性肺炎是迫切需要的。技术实现要素:为了解决上述技术问题,筛选出针对病毒性肺炎特别是具有低血氧症的中重症肺炎治疗的有效药物,发明人在研究中发现病毒性肺炎患者的肺成纤维细胞中hif-1α有较高的表达水平,且hif-1α与ar相互结合形成的复合物能够结合在相关基因的启动子上,从而在转录水平影响相关基因(il6、mmp2、mmp13、adamts4、eln、vcan、col3a1、vegfa)的表达。第一方面,本发明提供了ar抑制剂和/或hif-1α抑制剂在制备抑制炎症因子风暴药物中的应用,所述抑制剂抑制成纤维细胞中ar、hif-1α复合物的形成。在某些实施例中,所述成纤维细胞处于低氧环境。在某些实施例中,通过抑制成纤维细胞中ar、hif-1α复合物的形成影响炎症相关基因的表达,所述相关基因选自:il6、mmp2、mmp13、adamts4、eln、vcan、col3a1、vegfa。在某些实施例中,所述炎症因子风暴由病毒性肺炎引起。在某些实施例中,所述病毒性肺炎为中症或重症。在某些实施例中,所述hif-1α抑制剂选自kc7f2、lw6、px-4782hci中的一种或多种。在某些实施例中,所述ar抑制剂选自恩杂鲁胺(enzalutamide)、阿帕鲁胺(apalutamide)、达洛鲁胺(darolutamide)、普克鲁胺(proxalutamide)、加来特龙(galeterone)、azd3514、shr-3680中的一种或多种。第二方面,本发明还提供了ar抑制剂和/或hif-1α抑制剂在制备预防或治疗病毒性肺炎药物中的应用。在某些实施例中,所述病毒性肺炎为呼吸道合胞病毒肺炎、甲型流感病毒肺炎、新型冠状病毒肺炎。在某些实施例中,所述病毒性肺炎为中、重症肺炎。在某些实施例中,所述hif-1α抑制剂选自kc7f2、lw6、px-4782hci中的一种或多种。在某些实施例中,所述ar抑制剂选自恩杂鲁胺(enzalutamide)、阿帕鲁胺(apalutamide)、达洛鲁胺(darolutamide)、普克鲁胺(proxalutamide)、加来特龙(galeterone)、azd3514、shr-3680中的一种或多种。第三方面,本发明还提供了一种具有抑制由hif-1α引起的ar活化的活性化合物的筛选方法,包括以下步骤:步骤s1,在被检测化合物的存在下,使hif-1α与ar接触;步骤s2,检测hif-1α与ar是否结合;步骤s3,选择抑制步骤s2所述结合的化合物。本发明相对与现有技术具有的效果:1)本发明发现ar抑制剂和/或hif-1α抑制剂通过有效抑制hif-1α与ar相互结合,在低氧环境下的成纤维细胞中,阻止相关基因(il6、mmp2、mmp13、adamts4、eln、vcan、col3a1、vegfa)的转录,使得相关基因的表达量发生改变,相关基因表达的降低会抑制肺部成纤维细胞的活化,进而能够让严重呼吸道感染的急性呼吸窘迫综合征(ards)患者维持肺功能和改善临床疗效。2)本发明提供的采用hif-1α抑制剂与ar抑制剂制备抑制炎症因子风暴药物、预防或治疗病毒性肺炎的药物,具有成本低,毒副作用小,疗效显著的优点,为病毒性肺炎的治疗提供了新策略。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式描述中所需要使用的附图作简单地介绍。图1为新型冠状病毒肺炎感染者的肺成纤维细胞中hif-1α表达量。图2为新型冠状病毒肺炎感染者的肺成纤维细胞中hif-1α表达量放大图。图3a为新型冠状肺炎重症患者和新型冠状肺炎未感染者的肺成纤维细胞中ace2和tmprss2基因的表达水平。图3b为人肺成纤维细胞在添加雄激素培养情况下,缺氧和常氧条件中ace2和tmprss2基因的表达水平。图4为人肺成纤维细胞中hif-1α与ar相互结合形成复合物。图5a-图5h为实施例5中不同组别抑制剂处理后相关基因的表达水平。图6a-图6h为实施例6中不同组别抑制剂处理后相关基因的表达水平。图7a-图7b为实施例7中小鼠存活率及体重变化统计。具体实施方式根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施案例所描述的内容仅用于说明和解释本发明,并不用于限制权利要求书中所详细描述的本发明。除非特别说明,本发明采用的试剂、方法和设备如无特别说明,均为常规方法,所使用的试验材料如无特别说明,均可从商业公司获取。如本文所用,术语“ar”,雄激素受体,属于核受体超家族中的类固醇受体。ar一般由四个结构域组成:n端转录激活区(ntd)、dna结合区(dbd)、铰链区和配体结合区(lbd)。如本文所用,术语“ar抑制剂”指能够用于抑制ar活性的化合物或者组合物。包括但不限于,恩杂鲁胺(enzalutamide)、阿帕鲁胺(apalutamide)、达洛鲁胺(darolutamide)、普克鲁胺(proxalutamide),加来特龙(galeterone),azd3514、shr-3680。如本文所用,术语“hif-1α”,缺氧诱导因子,在细胞中,hif信号级联反应会受到缺氧状态的影响。在缺氧状态下,通常会让细胞持续的细胞分化。然而,缺氧状态促进了血管新生,对于胚胎中的血管系统与癌症肿瘤来说非常重要。如本文所用,术语“hif-1α抑制剂”,指能够用于抑制ar活性的化合物或者组合物。包括但不限于,kc7f2、lw6、px-4782hci中的一种或多种。如本文所用,术语“ar与hif-1α复合物”是指hif-1α通过自身的c端激活域与雄激素受体(ar)的n端结构域相互结合形成的复合物。如本文所用,术语“炎症因子风暴”又叫细胞因子风暴,是指机体感染微生物后引起体液中多种细胞因子,如α肿瘤坏死因子、白细胞介素-1、白细胞介素-6、白细胞介素-12、α干扰素、β干扰素、γ干扰素等迅速大量产生的现象,是引起急性呼吸窘迫综合征和多脏器衰竭的重要原因。免疫系统的日常工作是清除感染,但是如果免疫系统被激活到极限程度或者失去控制,就会伤害宿主。如本文所用,术语“成纤维细胞”是功能活动旺盛的细胞,细胞和细胞核较大,轮廓清楚,核仁大而明显,细胞质弱嗜碱性,具明显的蛋白质合成和分泌活动;处于成熟期或称静止状态的成纤维细胞,胞体变小,呈长梭形,粗面内质网和高尔基复合体均不发达,被称为纤维细胞。在外伤等因素刺激下,部分纤维细胞可重新转变为幼稚的成纤维细胞,其功能活动也得以恢复,参与组织损伤后的修复。如本文所用,“病毒性肺炎的中、重症”,根据国家卫生委员会《中国covid-19感染诊治计划指南》第5版,该病例分为4中类型:(1)轻度病例:临床症状轻微但没有肺炎的影像学表现;(2)中度病例,伴有发烧,呼吸道症状和肺炎影像表现;(3)重度病例,以下任何一种,呼吸商rr>30次/分钟的呼吸窘迫,静止时的氧饱和度<93%或pao2/fio2<30nnhg(1mmhg=0.133kpa);(4)危重症病例:具有以下任一种情况,需要机械通气、电机的呼吸衰竭或需要icu重症监护的其他器官衰竭。在本发明中,所述中症病毒性肺炎包括上述“(2)中度病例”,所述重症病毒性肺炎包括上述“(3)重度病例”和“(4)危重症病例”。如本文所用,上述的“治疗”指疾病或病症或其至少一种可辨的症状的减轻、预防或逆转,与所治疗疾病或病症相关的至少一个可测量身体参数的改善、预防或逆转,抑制或减缓疾病或病症的进展,或延迟疾病或病症的发作。如本文所用,“病毒性肺炎”有流感病毒、副流感病毒、腺病毒、冠状病毒、鼻病毒。呼吸道合胞病毒等。甲型流感病毒和乙型流感病毒主要引发人类流感。甲型流感病毒常常发生抗原变异,从而进一步分为h1n1、h3n2、h5n1、h7n9等亚型。此外,冠状病毒(属于尼多病毒目冠状病毒科)主要造成的人类疾病是呼吸系统的感染。而呼吸道感染是病毒性肺炎发病率和死亡率的主要原因。2019冠状病毒病(covid-19)也称新型冠状病毒,是由严重急性呼吸综合症冠状病毒2(sars-cov-2)所致疾病,而sars-cov-2就是一种有包膜的单链rnaβ属冠状病毒。如本文所用,“药物”,为采用含有hif-1α抑制剂与ar抑制剂或其药理学上可接受的药物组合物。根据本发明提供用于治疗病毒性肺炎的药物,所述药物组合物包含hif-1α抑制剂和ar抑制剂以及药学上可接受的载体或赋形剂。可以制成口服和非口服制剂。口服给药可制成片剂、散剂、颗粒剂、胶囊剂等常用剂型,所用的赋型剂可以为淀粉、乳糖、蔗糖、甘露糖、羟甲基纤维素等中的一种或几种。崩解剂可以为马铃薯淀粉、羟甲基纤维素等中的一种或几种。粘合剂可以为阿拉伯胶、玉米淀粉、明胶、糊精等中的一种或几种。口服制剂除上述剂型外,还可以制成乳剂、糖浆剂等。非口服制剂可以制成注射剂,可以与注射用水、生理盐水、葡萄糖水制成注射剂,也可以在其中加入一定比例的乙醇、丙醇、乙二醇等。实施例1通过生物信息学seurat3.0和singler软件分析新型冠状肺炎重症患者和新型冠状肺炎未感染者单细胞转录组测序数据发现其中感染者肺成纤维细胞中hif-1α的表达水平远高于未感染者肺成纤维细胞中hif-1α的表达水平。新型冠状肺炎感染者单细胞转录组测序数据:gsm4516279,gsm4516280,gsm4516281,gsm4516282数据网站:https://www.ncbi.nlm.nih.gov/geo。新型冠状肺炎未感染者单细胞转录组测序数据:e-mtab-6149、e-mtab-6653数据网站:https://www.ebi.ac.uk/arrayexpress。分析结果如图1所示,表明新型冠状肺炎重症患者肺成纤维细胞中hif-1α高表达。实施例2通过tfmapper与ucscgenomebrowser生物信息分析网站工具分析hif-1α和ar在相关基因(il6、mmp2、mmp13、adamts4、eln、vcan、col3a1、vegfa)启动子区域的结合情况。生物信息分析结果表明hif-1α和ar能够与相关基因(il6、mmp2、mmp13、adamts4、eln、vcan、col3a1、vegfa)的启动子区域发生结合,从而对相关基因的转录产生影响。实施例3图3a为通过生物信息学seurat3.0和singler软件分析新型冠状肺炎重症患者单细胞转录组测序数据和新型冠状肺炎未感染者单细胞转录组测序数据分析ace2和tmprss2基因的表达水平。新型冠状肺炎感染者单细胞转录组测序数据:gsm4516279,gsm4516280,gsm4516281,gsm4516282数据网站:https://www.ncbi.nlm.nih.gov/geo。新型冠状肺炎未感染者单细胞转录组测序数据:e-mtab-6149、e-mtab-6653数据网站:https://www.ebi.ac.uk/arrayexpress。分析结果如图3a所示,实验结果表明,新型冠状肺炎重症患者和新型冠状肺炎未感染者肺成纤维细胞中ace2和tmprss2基因的表达水平低且组间无明显差异。图3b为通过添加雄激素(双氢睾酮),在ar通路激活条件下,探究血管紧张素转换酶2(ace2)和跨膜丝氨酸蛋白酶2(tmprss2)的基因表达水平。在缺氧(37℃,1%o2)条件与常氧条件下,添加双氢睾酮(10nm,购自sigma-aldrich)的培养基培养人的肺成纤维细胞hfl1,48h后,收集细胞,最后通过实时荧光定量pcr(qpcr)检测相关基因的表达水平。实验结果如图3b所示,实验结果表明,肺成纤维细胞在细胞ar信号通路激活条件下,ace2和tmprss2在缺氧与常氧条件下无明显差异。综上,分析新型冠状肺炎重症患者和新型冠状肺炎未感染者的单细胞转录组测序数据发现成纤维细胞中ace2和tmprss2基因的整体表达水平低下且感染者和未感染者组间无明显差异;体外实验研究也验证了在低氧和常氧条件下肺成纤维细胞中的ace2和tmprss2基因组间无明显差异;这也确证了ace2和tmprss2基因并不参与重症的炎症因子风暴。实施例4人肺成纤维细胞hfl1(购自procell普诺赛,货号cl-0106)在低氧(专用低氧培养箱培养条件:37℃,1%o2)条件下,用hfl1培养基(ham’sf-12k+10%fbs+1%p/s)进行培养,随后使用ripa组织/细胞裂解液与pmsf试剂进行蛋白质提取;然后根据抗体和抗原之间的专一性作用原理使用pierce™co-immunoprecipitationkit试剂盒进行免疫共沉淀(co-ip)实验;随后对将免疫共沉淀所得结果进行下一步westernbloting实验。westernbloting实验具体步骤如下:首先,按照配方配制10%sds分离胶与浓缩胶,样品与加样缓冲液混合,100℃冰浴煮沸5min,冰浴、离心后用微量加样器等量加入各泳道进行电泳分离,通过sds-page分离蛋白质,转移至pvdf膜(merckmillipore,ma,usa)并在5%bsa中孵育1小时。将膜在4℃条件下用1:400稀释的一抗hif-1α和ar温育过夜,用tbst洗涤3次后与山羊抗兔二抗温育1小时。室温下pbs缓冲液洗涤3次,每次5min。将膜浸入ecl反应液中,室温1min。移除液体后,将膜用食品保鲜膜覆盖,于阴暗室中环境下通过线片曝光,显影、定影后观察结果。结果如图4a、图4b所示,实验结果表明,在人肺成纤维细胞中hif-1α需要与ar相互结合形成复合物来行使功能。实施例5在常氧(37℃,5%co2)与低氧(37℃,1%o2)环境下培养肺成纤维细胞hfl1(购自procell普诺赛,货号cl-0106),然后使用hif-1α抑制剂与ar抑制剂各自或联合处理肺成纤维细胞hfl1。48h后,收集处理细胞;进而通过实时荧光定量pcr(qpcr)检测相关基因的表达水平。hif-1α抑制剂kc7f2,lw6,px-4782hci(购自selleck,货号:s7946,s8441,s7612)。ar抑制剂enzalutamide,apalutamide,darolutamide,galeterone,azd3514(购自selleck,货号:s1250,s2840,s7559,s2803,s7040),proxalutamide(源自发明专利,公开号:cn106810542a),shr-3680(源自发明专利,公开号:cn103958480b)。hfl1细胞专用培养基(购自procell普诺赛,货号:cm-0106)。不同处理组添加抑制剂成分如表1。表1组1-组14中添加抑制剂成分组别抑制剂成分组1无hif-1α抑制剂或ar抑制剂组2hif-1α抑制剂1,kc7f220μm。(购自selleck,货号:s7946)组3hif-1α抑制剂2,lw620μm。(购自selleck,货号:s8441)组4hif-1α抑制剂3,px-4782hci20μm。(购自selleck,货号:s7612)组5ar抑制剂1,enzalutamide10μm。(购自selleck,货号:s1250)组6ar抑制剂2,apalutamide10μm。(购自selleck,货号:s2840)组7ar抑制剂3,darolutamide10μm。(购自selleck,货号:s7559)组8ar抑制剂4,galeterone10μm。(购自selleck,货号:s2803)组9ar抑制剂5,azd351410μm。(购自selleck,货号:s7040)组10ar抑制剂6,proxalutamide10μm。(源自发明专利,公开号:cn106810542a)组11ar抑制剂7,shr-368010μm。(源自发明专利,公开号:cn103958480b)组12hif-1α抑制剂1(20μm)与ar抑制剂1(10μm)联合处理1组13hif-1α抑制剂2(20μm)与ar抑制剂6(10μm)联合处理2组14hif-1α抑制剂3(20μm)与ar抑制剂7(10μm)联合处理3实验结果如图5a-5h所示,在常氧条件下,两类抑制剂不影响相关基因(il6、eln、vcan、vegfa、mmp2、adamts4、mmp13、col3as1)的表达水平。然而,相对于常氧条件,低氧条件下相关基因(il6、mmp2、mmp13、adamts4、eln、vcan、col3a1、vegfa)表达水平显著增加。此外,在低氧条件下,两类抑制剂可使得相关基因(il6、mmp2、mmp13、adamts4、eln、vcan、col3a1、vegfa)的表达水平明显降低。具体表明,hif-1α抑制剂单独处理组,ar抑制剂单独处理组,以及hif-1α抑制剂与ar抑制剂联合处理组都能够有效抑制相关基因的表达。结果说明,hif-1α抑制剂与ar抑制剂可以通过抑制hif-1α与ar的表达从而影响两者的相互结合从而减少其共同结合在相关基因的启动子区域上,进而影响相关基因的转录进程降低相关基因的表达水平。实施例6通过添加雄激素(双氢睾酮),探究ar通路激活条件下,抑制剂对相关基因的调节。在缺氧(37℃,1%o2)条件下,添加双氢睾酮(10nm,购自sigma-aldrich)的培养基培养不同组别抑制剂(如实施例5中表1所示)处理人的肺成纤维细胞hfl1,48h后,收集细胞,最后通过实时荧光定量pcr(qpcr)检测相关基因的表达水平。实验结果如图6a-6h所示,在低氧与细胞ar信号通路激活的条件下,两类抑制剂都能有效降低相关基因(il6、mmp2、mmp13、adamts4、eln、vcan、col3a1、vegfa)的表达水平。结果表明,肺成纤维细胞在细胞ar信号通路激活条件下,hif-1α抑制剂能够通过抑制自身基因表达影响相关基因的表达;同时,ar抑制剂能够通过影响ar信号通路进而有效抑制相关基因的表达。实施例7通过构建病毒性肺炎小鼠模型,探究hif-1α抑制剂或者ar抑制剂对小鼠病毒性肺炎的影响。病毒性小鼠肺炎模型的构建:选取6-8周龄、体重18-22g的雄性c57bl/6小鼠进行模型制备。实验动物随机分为以下组别:组别处理方式组1正常组组2病毒组,无hif-1α抑制剂或ar抑制剂组3hif-1α抑制剂1,lw6,10mg/kg,灌胃给药,每天一次,连续5天。组4hif-1α抑制剂2,px-4782hci,100mg/kg,腹腔注射给药一次。组5ar抑制剂1,proxalutamide,100mg/kg,腹腔注射给药一次。组6ar抑制剂2,shr-3680,5mg/kg,灌胃给药,每天一次,连续5天。组7lw6(10mg/kg,灌胃给药,每天一次,连续5天)联合shr-3680(5mg/kg,灌胃给药,每天一次,连续5天)。其中正常对照组小鼠经5%水合氯醛轻度麻醉后,用50μlpbs滴鼻,其余各组小鼠经水合氯醛轻度麻醉后,从鼻腔滴入10倍ld50感染量的甲型h1n1流感病毒50μl。给药组于造模后24h按照上述方案给药处理。病毒攻击后观察小鼠存活状况,连续14天,统计小鼠死亡情况和体重变化。表2小鼠平均存活天数及存活率统计组别平均存活天数(d)存活数(只)存活率(%)正常组1410100viruscontrol9.1±2.2100lw611.5±2.54550px-4782hci11.9±2.81660proxalutamide11.0±2.83440shr-368011.3±2.87550lw6+shr-368012.9±2.21880实验结果如图7a-b所示和表2所示。正常对照组小鼠14天存活率为100%,病毒对照组小鼠14d存活率为10%,而hif-1α抑制剂1和2组以及ar抑制剂1和2组小鼠14d存活率分别为:50%、60%、40%和50%。同时,给于hif-1α抑制剂和/或ar抑制剂处理均不同程度地减缓了病毒感染引起的小鼠体重下降,延长了小鼠存活天数。结果表明,hif-1α抑制剂和/或ar抑制剂处理均显著提高了模型小鼠的存活率。以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1