23-O-乙酰升麻醇-3-O-α-L-阿拉伯糖苷在制备抗炎药物中的用途
本申请涉及医药技术领域,特别是涉及23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷在制备抗炎药物中的用途。
背景技术:
炎症是具有血管系统的活体组织对各种损伤因子的刺激所发生的以防御反应为主的基本病理过程。其基本病理变化为变质、渗出、增生,主要临床表现为红、肿、热、痛和功能障碍,以及包括发热、白细胞增多、肝脾肿大等全身反应。炎症按照持续时间可分为急性炎症和慢性炎症。急性炎症是机体对致炎因子的快速反应,目的是把白细胞和血浆蛋白运送到炎症病灶,杀伤和清除致炎因子,主要发生血管反应和白细胞反应;持续时间常为几天,一般不超过一个月。慢性炎症是指持续数周甚至数年的炎症,连绵的炎症反应、组织损伤和修复反应相伴发生,多由急性炎症迁延而来。长期的慢性炎症刺激可引起多种慢性疾病,例如肥胖、心血管疾病、2型糖尿病、肿瘤等。目前临床上常用的甾体和非甾体抗炎药会造成严重的不良反应,所以寻求疗效好、副作用小的抗炎药物是亟待解决的问题。
天然产物是一种很有前景的抗炎药物来源。升麻为毛茛科(ranunculaceae)升麻属(cimicifuga)的多年生草本植物,研究表明升麻具有抗炎、抗病毒、抗骨质疏松、抗氧化等作用。升麻的化学成分主要包括三萜及其苷类、酚酸类、色酮类及其它类型化合物,23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷(23-o-diacetylshengmanol-3-o-α-l-arabinopyranoside,da)首次发现于升麻(cimicifugafoetidal.)的地上部分,是升麻中苷类成分之一,目前尚无研究报道da的药理活性。
技术实现要素:
本申请的发明人通过深入研究,发现23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷具有抗炎作用,并基于此,完成了本申请。
本申请的第一方面提供23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷在制备抗炎药物中的用途。
本申请的第二方面提供一种药物组合物,其包含23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷。
本申请的第三方面提供本申请第二方面的药物组合物在制备抗炎药物中的用途。
23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷能够抑制no释放,抑制il-1β、il-6、tnf-α的分泌,抑制inos、cox-2蛋白的表达,抑制nf-κb的表达,以发挥抗炎作用,进而用于制备抗炎药物。进一步的,包含23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷的药物组合物,同样能够用于制备抗炎药物。
附图说明
为了更清楚地说明本申请实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的实施例。
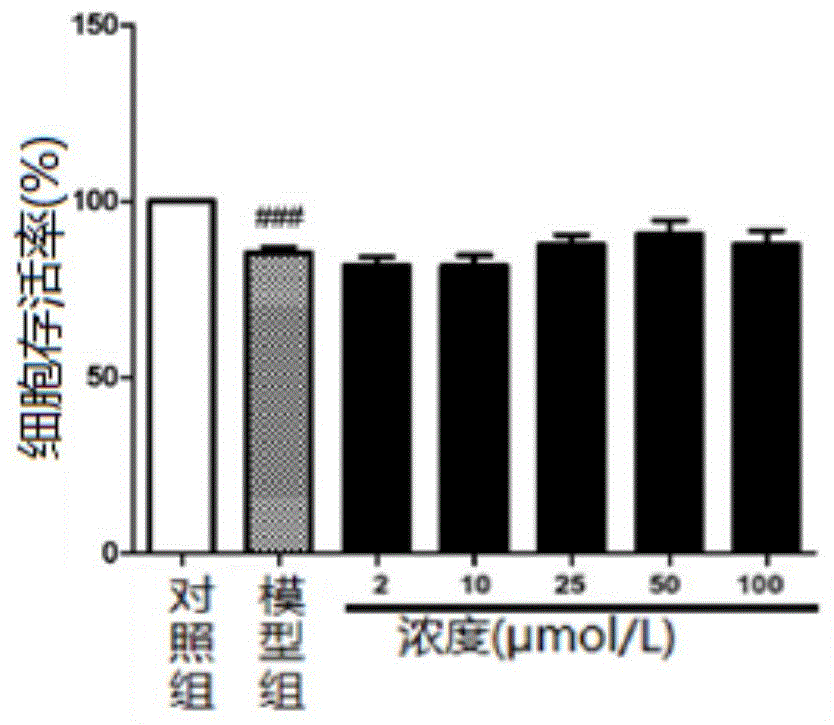
图1显示了da对raw264.7细胞存活率的影响。
图2显示了da对raw264.7细胞释放no含量的影响。
图3显示了da对raw264.7细胞中il-1β、il-6和tnf-α含量的影响。
图4显示了da对raw264.7细胞中inos、cox-2蛋白表达的影响。
图5显示了da对hek293细胞nf-κb表达的影响。
具体实施方式
下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员基于本申请所获得的所有其他实施例,都属于本申请保护的范围。
本申请的第一方面提供23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷在制备抗炎药物中的用途。
本申请所述“抗炎”,包括治疗和/或预防急性炎症,和/或,治疗和/或预防慢性炎症。本申请中所说的“炎症”,指的是急性炎症和/或慢性炎症。发明人在研究中发现,在炎症反应过程中,存在多种炎症介质和/或促炎细胞因子的参与,本申请所述的抗炎药物,通过调控炎症介质和/或促炎细胞因子的分泌或表达,从而发挥抗炎作用。所述炎症介质和促炎细胞因子,包括但不限于no、tnf-α、il-1β、il-6等。
本申请中所述的急性炎症,是机体对致炎因子的快速炎症反应,目的是把白细胞和血浆蛋白运送到炎症病灶,杀伤和清除致炎因子,主要发生血管反应和白细胞反应。本申请所述急性炎症,包括但不限于乙型脑炎、病毒性肝炎、急性肠炎、痛风性关节炎或心包炎等。本申请中所述的慢性炎症是指持续数周甚至数年的炎症,其中,连绵不断的炎症反应、组织损伤和修复反应相伴发生。慢性炎症,可由急性炎症迁延而来;也可隐匿发生而无急性炎症过程;或者在急性炎症反复发作期的间期存在。本申请所述慢性炎症,包括但不限于骨关节炎、类风湿性关节炎、类风湿关节炎、结肠炎、强直性脊柱炎或血管炎等。
本文中,术语“治疗”具有其一般含义,并且在本文特别地是指对已经罹患炎症的哺乳动物个体(优选为人)采用本申请的药物进行处理,以期对所述疾病产生治疗、治愈、缓解、减轻等作用。类似地,如本文使用的,术语“预防”具有其一般含义,并且在本文特别地是指对可能罹患炎症或者对炎症具有罹患风险的哺乳动物个体采用本申请的药物进行处理,以期对所述疾病产生防止、预防、阻止、隔断等作用。
在本申请第一方面的一些实施方式中,所述23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷通过抑制no释放、抑制il-1β、il-6和tnf-α的分泌、抑制inos和cox-2蛋白的表达或抑制nf-κb的表达中的至少一种,发挥抗炎作用。
本申请的第二方面提供一种药物组合物,其包含23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷。
在本申请第二方面的一些实施方式中,所述23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷是以单体的形式提供,或以包含其的植物提取物的形式提供。优选地,所述植物提取物为升麻提取物。升麻提取物的提取方式现有技术中多有报道,本文在此不进行赘述,本领域技术人员可以通过现有的任意方式获取升麻提取物。
在本申请第二方面的一些实施方式中,基于所述药物组合物的总重量,23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷的含量为1-99%。
在本申请第二方面的一些实施方式中,基于所述药物组合物的总重量,23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷的含量为20-80%。
在本申请第二方面的一些实施方式中,基于所述药物组合物的总重量,23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷的含量为40-60%。
在本申请第二方面的一些实施方式中,所述药物组合物还包含药学上可接受的载体或赋形剂。
本文中,“药学上可接受的”表示当以通常用药剂量使用时没有实质的毒性作用,从而可被政府或与其相当的国际组织批准或者已被批准用于动物,更特别地用于人,或者被登录在药典上。
本申请药物组合物中可用的“药学上可接受的载体或赋形剂”可以是药物制剂领域中任何常规的载体,特定载体的选择将取决于用于治疗特定患者的给药方式或疾病类型和状态。用于特定给药模式的合适药物组合物的制备方法完全在药物领域技术人员的知识范围内。本申请所述的药学上可接受的载体或赋形剂,可以是选自溶剂、稀释剂、分散剂、助悬剂、表面活性剂、等渗剂、增稠剂、乳化剂、防腐剂、粘合剂、润滑剂、稳定剂、水合剂、乳化加速剂、缓冲剂、吸收剂、着色剂、香味剂、甜味剂、离子交换剂、脱模剂、涂布剂、矫味剂或抗氧化剂中的至少一种。
如本文使用的,术语“药物组合物”具有其一般含义。此外,本申请的“药物组合物”还可以以保健品、功能性食品、食品、食品添加剂等形式存在或提供。可采用制药领域特别是制剂领域中的常规技术,通过药品生产中常用的提取分离纯化手段得到本申请的药物组合物的原料的有效成分,任选地与一种或更多种药学可接受的载体或赋形剂混合,然后形成所需的剂型,来制备本申请的药物组合物。根据本申请的药物组合物,其为可以适用于口服给药、胃肠外给药或局部给药、外用给药的药物制剂,尤其适用于口服给药。用于口服施用的剂型可包括例如片剂、丸剂、硬或软胶囊剂、溶液剂、混悬剂、乳剂、糖浆剂、散剂、粉剂、细粒剂、颗粒剂、小丸剂、酏剂等,并不限于此。除了活性成分外,这些制剂还可包含稀释剂(例如乳糖、右旋糖、蔗糖、甘露糖醇、山梨糖醇、纤维素和甘氨酸)、润滑剂(例如二氧化硅、滑石、硬脂酸或其镁盐、钙盐和聚乙二醇)。片剂还可包含粘合剂,例如硅酸镁铝、淀粉糊、明胶、黄芪胶、甲基纤维素、羧甲基纤维素钠和聚乙烯吡咯烷。必要时,其还可包含药用添加剂,例如崩解剂(如淀粉、琼脂、海藻酸或其钠盐)、吸收剂、着色剂、香味剂、甜味剂等。片剂可根据常用的混合、造粒或包衣的方法制备。
本申请的第三方面提供本申请第二方面的药物组合物在制备抗炎药物中的用途。
仪器:细胞培养箱:力康生物医疗科技控股有限公司;酶标仪:上海帝肯贸易有限公司;蛋白印迹(westernblotting):美国bio-rad公司;离心机:德国艾本德eppendorf;荧光素酶报告检测系统:promega,wi,usa。
材料:raw264.7小鼠巨噬细胞:美国模式培养物集存库(americantypeculturecollection,atcc);hek293细胞:atcc。23-o-乙酰升麻醇-3-o-α-l-阿拉伯糖苷(da):成都埃法生物科技有限公司,纯度大于98%;磷酸盐缓冲液(pbs)、dmem培养基:bi公司;内毒素(lps):sigma公司;噻唑蓝(mtt,m2128):sigma公司;二甲基亚砜(dmso,细胞培养级):sigma公司;nano2标准品:上海碧云天生物技术有限公司;no检测试剂盒(s0021s):上海碧云天生物技术有限公司;小鼠il-1β、il-6、tnf-α酶联免疫法(elisa)试剂盒:美国r&d公司;ripa裂解液、蛋白酶/磷酸酶抑制剂混合物:康为世纪生物技术有限公司;bca蛋白浓度测定试剂盒(bcaproteinassaykit,pc0020):北京索莱宝科技有限公司;sds-page凝胶制备试剂盒:康为世纪生物技术有限公司;蛋白marker:thermoscientificpagerulertmprestainedproteinladder;10×电泳缓冲液、10×转膜液、20×tbst:北京索莱宝科技有限公司;immobilon-ppvdf(0.45μm26.5cm×3.75mroll1/pk):immobilon-p公司;脱脂奶粉(bd-difcoskimmilk,232100):bddifco公司;辣根酶标记的二抗山羊抗兔igg:美国cellsignalingtechnology公司;inos、cox-2抗体:美国cellsignalingtechnology公司;β-actin抗体:美国santacruz生物技术公司;显影液:美国millipore公司;albuminbovine牛血清白蛋白(bsa,a8010-5):sigma公司;pmsf溶液:北京索莱宝科技有限公司;nf-κb荧光素酶报告基因质粒:天津索罗门生物科技有限公司;荧光素酶报告基因质粒prl-tk:promega,wi,usa;聚乙烯亚胺(pei):德国默克公司;地塞米松:美国sigma公司。
下述实施例中所用实验材料和方法,如无特别说明,均为常规材料和方法。
巨噬细胞是参与先天免疫的主要细胞,当外来病原体如寄生虫、细菌、病毒入侵或受到外界信号刺激时,巨噬细胞会被激活。革兰氏阴性细菌细胞壁外壁的组成成分-脂多糖(lps)是一种内毒素,可以刺激巨噬细胞,诱导细胞产生多种炎症介质和促炎细胞因子,例如分泌no、肿瘤坏死因子(tnf)-α、白介素(il)-1β、il-6、inos、cox-2等,从而诱发炎症反应。raw264.7细胞为小鼠巨噬细胞样细胞系,lps刺激raw264.7小鼠巨噬细胞已经成为公认的研究抗炎药物的细胞模型,本申请中以lps刺激raw264.7小鼠巨噬细胞作为炎症模型。
实施例1da对raw264.7细胞存活率的影响
1.1细胞培养
raw264.7小鼠巨噬细胞用含10%胎牛血清、青霉素100u/mk、链霉素0.1mg/ml、l-谷氨酰胺30mg/ml的dmem培养基培养(完全培养基),于37℃、5%co2恒温培养箱中放置,并每隔2天传代一次。
1.2细胞活力检测
取对数生长期的raw264.7细胞,刮刀刮下,吹散细胞,调整细胞浓度为1×104个/ml,接种于96孔细胞培养板,100μl/孔。各实验组分别加入50μl/孔lps和50μl/孔da,使lps的终浓度为1μg/ml,da的终浓度分别为2μmol/l、10μmol/l、25μmol/l、50μmol/l、100μmol/l;模型组加入50μl/孔lps和50μl/孔完全培养基,使lps的终浓度为1μg/ml;对照组加入100μl/孔完全培养基;空白组为不含细胞的完全培养基。于细胞孵箱中培养24h。弃去细胞板中上清液,每孔中加入20μlmtt溶液(5mg/ml)和100μldmem培养基,并继续孵育4h。弃去细胞板中上清液,每孔加入100μldmso液,微型振荡器上振荡10min,结晶物完全溶解后用酶标仪测定492nm处各孔的吸光度值(od)。通过测得的od值,比较求得终浓度为1μg/ml的lps和不同浓度da在前者的基础上对raw264.7细胞活力的影响。细胞存活率(%)=[(实验组或模型组od值-空白组od值)÷(对照组od值-空白组od值)]×100%,以对照组的细胞存活率为100%,各组细胞存活率结果如图1所示,结果显示终浓度为1μg/ml的lps和在此基础上加入终浓度小于100μmol/l的da,对raw264.7细胞的生长均无显著影响,故后续所用的lps终浓度均为1μg/ml,药物浓度均在100μmol/l以内。
实施例2da抑制raw264.7细胞中no的释放
2.1nano2标准溶液配制
精密吸取nano2标准品(1mol/l)10μl,加入90μl含10%胎牛血清、青霉素100u/mk、链霉素0.1mg/ml、l-谷氨酰胺30mg/ml的dmem培养基,混合均匀,即为100mmol/lnano2溶液,同样的方法配制10mmol/lnano2溶液,在此基础上再以相同方法配制成100μmol/lnano2溶液,以此浓度为最大浓度,依次稀释,得到浓度为100、60、40、20、10、5、2、1、0μmol/l的nano2标准溶液。
2.2no含量测定
取对数生长期的raw264.7细胞,刮刀刮下,离心,吹散细胞,调整细胞浓度为1×104个/ml,按100μl/孔接种于96孔细胞培养板。各实验组分别加入50μl/孔lps和50μl/孔da,使lps的终浓度为1μg/ml,da的终浓度分别为25μmol/l、50μmol/l、100μmol/l;模型组加入50μl/孔lps和50μl/孔完全培养基,使lps的终浓度为1μg/ml;对照组加100μl/孔完全培养基;于孵箱中孵育24h。取各组细胞培养液上清100μl/孔和步骤2.1中各浓度的nano2标准溶液100μl/孔置于96孔板,按50μl/孔依次加入室温griessreagentⅰ和griessreagentⅱ,避光,并在微型振荡器上振荡3min,于酶标仪560nm波长处测定各孔的吸光度值。测定步骤2.1中各浓度的nano2标准溶液得到标准曲线,按照标准曲线计算各组的no2-含量,基于no2-含量与no含量的等值(1:1)关系,得到no含量,结果如图2所示。由图2可知,模型组在1μg/ml的lps刺激下,raw264.7细胞释放no量显著增加(n=5,###p<0.001,与对照组比),表明lps能明显诱导raw264.7细胞释放no;实验组(图中标记25、50、100)no含量较模型组有显著降低(n=5,*p<0.05,***p<0.001,与模型组比),表明da对激活状态raw264.7细胞no释放有显著抑制作用,并呈良好的剂量依赖关系,表明da具有抗炎作用。
实施例3da抑制raw264.7细胞il-1β、il-6和tnf-α的分泌
取对数生长期的raw264.7巨噬细胞,刮刀刮下,离心5min,吹散细胞制成细胞悬液,调整细胞浓度至1×104个/ml,将此浓度的细胞按100μl/孔接种于96孔细胞培养板。各实验组分别加入50μl/孔lps和50μl/孔da,使lps的终浓度为1μg/ml,da的终浓度分别为25μmol/l、50μmol/l、100μmol/l;模型组加50μl/孔lps和50μl/孔完全培养基,使lps的终浓度为1μg/ml;对照组加100μl/孔完全培养基;置37℃、5%co2恒温培养箱中孵育24h。取细胞培养液的上清,根据elisa试剂盒说明书进行操作,并于酶标仪450nm波长处测定各孔od值。按照试剂盒说明书制作的相应标准曲线,计算各组中il-1β、il-6和tnf-α的含量,结果如图3所示。由图3可知,模型组在lps的刺激下,raw264.7细胞释放il-1β、il-6和tnf-α的量明显升高(n=6,###p<0.001,与对照组比),表明lps能显著诱导raw264.7细胞大量合成并释放il-1β、il-6和tnf-α炎症细胞因子。而给予da处理后,各实验组(图中标记25、50、100)il-1β、il-6和tnf-α的含量有显著降低(n=6,*p<0.05,***p<0.001,与模型组比),即il-1β、il-6和tnf-α的生成或释放明显减少,表明da能抑制raw264.7细胞中il-1β、il-6和tnf-α的分泌,且剂量依赖性良好,具有较好的抗炎作用。
实施例4da抑制raw264.7细胞中inos、cox-2蛋白的表达
4.1待测蛋白样品提取
取对数生长期的raw264.7巨噬细胞,刮刀刮下,1000r/s离心5min,吹散细胞制成细胞悬液,调整细胞浓度至20×104个/ml,将此浓度的细胞按2ml/孔接种于6孔细胞培养板。各实验组分别加入50μl/孔lps和50μl/孔da,使lps的终浓度为1μg/ml,da的终浓度分别为25μmol/l、50μmol/l、100μmol/l;模型组加入50μl/孔lps和50μl/孔完全培养基,使lps的终浓度为1μg/ml;对照组加入100μl/孔完全培养基;于恒温培养箱中孵育24h。使用预冷的pbs(2ml/孔)漂洗细胞2次,然后用含有1%蛋白酶抑制剂、1%磷酸酶抑制剂和98%ripa的裂解液处理,收集细胞裂解液并转移至离心管中。冰上裂解30min,裂解过程中每隔10min斡旋20s。预冷的4℃离心机中离心15min,13000g,取上清,测定并调整蛋白浓度为1.5μg/μl左右。按体积加入5×上样缓冲液(loadingbuffer),封口,沸水浴煮10min,分装,各组待测蛋白样品于-20℃保存备用。
其中,标准曲线制作包括:取10μg/μl的bsa母液10μl,用90μlpbs溶液稀释得1μg/μl的bsa。精密吸取0、2、4、8、12、16、18、20μl的1μg/μl的bsa分别置于96孔板内,并用pbs补足20μl/孔,复孔2个。配制1:50的bsa工作液,每孔加入200μl,置于37℃的烘箱内孵育30min,孵育后于酶标仪560nm波长处测定各孔od值。以测得的吸光度值为纵坐标,bsa浓度为横坐标,制作标准曲线。
测定并调整蛋白浓度包括:将离心获得的各组上清液稀释20倍后,混合均匀,按20μl/孔加入96孔细胞培养板内,复孔3个。配制1:50的bsa工作液,每孔加入200μl,置于37℃的烘箱内孵育30min,孵育后于酶标仪560nm波长处测定各孔od值。通过标准曲线计算各组蛋白提取液中蛋白质的含量,然后调整蛋白浓度为1.5μg/μl左右。
4.2免疫蛋白印迹分析
配制8%分离胶溶液10ml:纯水4.8ml、30%丙烯酰胺-亚甲基双丙烯酰胺溶液(acr-bis,29:1)2.7ml、sds-page分离胶缓冲液(4×)2.5ml、10%过硫酸铵(aps)0.1ml、四甲基二乙胺(temed)0.006ml,立即注入准备好的玻璃板间隙中,上层加异丙醇覆盖凝胶,室温静置3h使其凝固(以能看到水胶分界线为准)。回收上层异丙醇。配制5%浓缩胶溶液4ml:纯水2.28ml、30%acr-bis(29:1)0.68ml、sds-page浓缩胶缓冲液(4×)1ml、10%aps0.04ml、temed0.004ml,立即注入玻璃板间空隙,垂直插上梳子,小心,避免混入气泡。待浓缩胶凝固后,将玻璃板放入电泳槽中,灌入电泳缓冲液,拔去梳子。
向上样道中依次加入10μl各组待测蛋白样品,并在两旁泳道分别加入4μl预染蛋白分子量marker,空白孔均加入同体积1×电泳缓冲液。90v恒压电泳,当待测蛋白样品电泳至浓缩胶与分离胶交界处时,改为120v恒压电泳,时间1.5h。待loadingbuffer电泳至距胶边缘化0.5cm处时,停止电泳。参照蛋白分子marker,切下分离胶所需电泳道,切角标记,浸入转膜液备用。
剪取5×8cmpvdf膜(切角标记)两份,并依次浸于甲醇、水和转膜液中各30s,甲醇回收,膜在转膜液中备用。将凝胶、pvdf膜、滤纸在转膜缓冲液中浸泡5min。按下列顺序放好:1层海绵网、1层滤纸、凝胶、pvdf膜、1层滤纸、1层海绵网,赶尽气泡。将电极板放入转膜仪中,灌入转膜液。300ma恒流转膜1.5h。
封闭:将pvdf膜浸于封闭液5%脱脂奶粉中,室温孵育2h。一抗孵育:取出pvdf膜,浸入用稀释好的一抗(1:1000)中,4℃孵育过夜。洗膜:将pvdf膜浸于1×tbst中,置于摇床振荡洗膜4次,每次7min。二抗孵育:加入辣根酶标记的二抗山羊抗兔igg。二抗以1:5000的1×tbst稀释。室温振摇孵育1.5h。洗膜:将pvdf膜浸于1×tbst中,置于摇床振荡洗膜4次,每次7min。
用镊子夹出pvdf膜,适当贴壁(勿令其干燥),放入含有50%a液和50%b液的显影液中,轻轻晃动孵育盒,并覆盖避光盒孵育30-60min。取出条带,放入凝胶成像仪中,运行凝胶成像程序,曝光1-7min,显影结果见图4的a图,采用imagej对a图的结果进行定量分析,结果如b图所示。
根据图4结果可知,以β-actin为内参校正基因,模型组inos、cox-2的蛋白含量与对照组相比有显著增加(n=3,##p<0.01,与对照组比),表明lps能显著增加inos和cox-2的蛋白表达;而给予da处理的实验组(图中标记25、50、100),与模型组相比,inos和cox-2的蛋白含量有显著降低(n=3,**p<0.01,***p<0.001,与模型组比),表明da能够显著抑制raw264.7细胞中inos、cox-2蛋白表达水平。
实施例5da抑制nf-κb的表达
nf-κb作为多种炎症介质表达所必需的转录调节因子,在调节炎症反应具有非常关键的作用。本实施例采用荧光素酶报告基因检测da对hek293细胞中nf-κb表达的影响。
以荧光素酶报告基因质粒prl-tk(10ng/孔)作为参比质粒,和nf-κb荧光素酶报告基因质粒pgl4.32(100ng/孔)转染hek293细胞。hek293细胞以3×104个/孔的密度接种于96孔板;a管:将9.6μgpgl4.32质粒和0.96μgprl-tk参比质粒溶解于100μl无血清的dmem培养基中,混匀。b管:将1μl,1mg/ml的聚乙烯亚胺(polyethylenimine,pei)转染试剂溶于100μl无血清dmem培养基中,混匀室温放置5min;c管:将a管、b管溶液加入含9.4ml的无血清dmem培养基c管中,混匀,静置20min,即配制成转染溶液;向96孔板的每孔中加入100μl转染溶液,转染24h。后弃去转染溶液,向每孔中加入药物溶液刺激细胞。对照组加入有血清培养基(含10%胎牛血清的dmem培养基)100μl;模型组加入含tnf-α的有血清培养基100μl,tnf-α终浓度为20ng/ml;各实验组分别加入含tnf-α和不同浓度的da的有血清培养基100μl,da终浓度分别为1×10-4、1×10-5、1×10-6mol/l,tnf-α终浓度为20ng/ml。以地塞米松(dexmedetomidine,dex)为阳性对照组,加入含tnf-α和阳性对照药dex的有血清培养基100μl,dex终浓度为1×10-6mol/l,tnf-α终浓度为20ng/ml。6h后,各组hek293细胞洗涤、裂解和检测后,荧光素酶活性由荧光素酶报告检测系统进行检测。计算nf-κb荧光素酶质粒相对于参比质粒的表达水平(ra):抑制率(%)=[ra(模型组)-ra(实验组)]×100%/ra(模型组)。抑制率反映的是对hek293细胞中nf-κb表达的抑制效果,其中以对照组的nf-κb抑制率为100%,各组抑制率结果如图5所示,根据图5可知,不同浓度的da(图中标记10-4、10-5、10-6)可抑制nf-κb的表达(n=5,**p<0.01,***p<0.001,与模型组比),作用呈剂量依赖性;从图5可以看出,在1×10-6mol/l浓度下,da对nf-κb的抑制效果与地塞米松相当,在1×10-4mol/l浓度下,da对nf-κb的抑制效果明显优于地塞米松。
综上,da能够抑制no的释放,抑制炎症因子il-1β、il-6、tnf-α的分泌,抑制inos、cox-2蛋白的表达,抑制nf-κb的表达,发挥抗炎作用,从而用于制备抗炎药物。进一步的,包含da的药物组合物,同样能够用于制备抗炎药物。
以上所述仅为本申请的较佳实施例,并非用于限定本申请的保护范围。凡在本申请的精神和原则之内所作的任何修改、等同替换、改进等,均包含在本申请的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!