一种基因治疗脂肪肝的生物药剂及其制备方法与流程
1.本发明涉及脂肪肝药剂,尤其是一种基因治疗脂肪肝的生物药剂及其制备方法。
背景技术:
2.脂肪肝(fatty liver)是指由于各种原因引起的肝细胞内脂肪堆积过多的病变,是一种常见的肝脏病理改变,而非一种独立的疾病。脂肪性肝病正严重威胁国人的健康,成为仅次于病毒性肝炎的第二大肝病,发病率在不断升高,且发病年龄日趋年轻化。正常人肝组织中含有少量的脂肪,如甘油三酯、磷脂、糖脂和胆固醇等,其重量约为肝重量的3%~5%,如果肝内脂肪蓄积太多,超过肝重量的5%或在组织学上肝细胞50%以上有脂肪变性时,就可称为脂肪肝。其临床表现轻者无症状,重者病情凶猛。一般而言,脂肪肝属可逆性疾病,早期诊断并及时治疗常可恢复正常。
3.肝脏是机体脂质代谢的中心器官,肝内脂肪主要来源于食物和外周脂肪组织,导致脂质在肝细胞内沉积的代谢异常机制并没有完全明确,目前证明高血脂、酒精、快速减肥、糖尿病、药物及妊娠等都是脂肪肝的形成的因素。过度营养导致肥胖相关脂肪肝称为非酒精性脂肪肝(nafld),也可称为代谢性脂肪肝,此类脂肪肝占比最多。30%~50%的肥胖症合并脂肪肝,重度肥胖者脂肪肝病变率高达61%~94%。
4.到目前为止,除合理膳食、适当运动等改变生活方式外,尚无防治脂肪肝的特效药物。西药常选用保护肝细胞、降脂药物及抗氧化剂等,如维生素b、c、e,卵磷脂、熊去氧胆酸、水飞蓟素、肌苷、辅酶a、还原型谷胱甘肽、牛磺酸、肉毒碱乳清酸盐、以及某些降脂药物等。而且任何药物进入体内都要经过肝脏解毒,药物多少都有毒副作用,特别是很易对肝脏造成进一步的损害。
技术实现要素:
5.针对现有的不足,本发明提供一种基因治疗脂肪肝的生物药剂及其制备方法。
6.本发明解决其技术问题所采用的技术方案是:一种基因治疗脂肪肝的生物药剂,包括aav2、tbg、apoa4,所述aav2、tbg、apoa4在体外通过基因重组形成能用于静脉注射的基因载体生物药剂。
7.作为优选,所述apoa4是46kda的载脂蛋白a4。
8.作为优选,所述aav2是腺相关病毒2型。
9.作为优选,所述tbg是肝脏特异性表达的启动子。
10.作为优选,所述aav2的病毒载体是pfd
‑
raav
‑
tbg
‑
gfp空质粒。
11.一种基因治疗脂肪肝的生物药剂制备方法,步骤如下,s1,获取治疗性基因,从正常生物体组织cdna库扩增apoa4全长cdna片段,并在该片段两侧增加spei和sa1i酶切位点;s2,在aav2病毒载体pfd
‑
raav
‑
tbg
‑
gfp空质粒上通过spei和sa1i酶切位点将apoa4 cdna克隆入该质粒制成pfd
‑
raav
‑
tbg
‑
apoa4
‑
gfp治疗性质粒;s3,将pfd
‑
raav
‑
tbg
‑
apoa4
‑
gfp质粒通过转染、扩增、纯化制成pfd
‑
raav
‑
tbg
‑
mapoa4
‑
gfp基因载体生物药剂。
12.作为优选,还包括步骤s4,将pfd
‑
raav
‑
tbg
‑
mapoa4
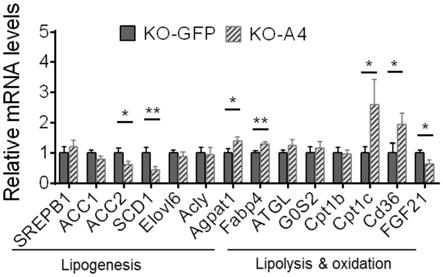
‑
gfp基因载体生物药剂通过生理盐水稀释形成能够静脉注射的生物药剂。
13.作为优选,所述生物药剂稀释到的浓度为2
×
10
10
vg/ml。
14.本发明的有益效果在于:该发明提供一种安全方便的利用基因治疗脂肪肝的生物药剂,是基于基因治疗的生物药剂aav2
‑
tbg
‑
apoa4,是在体外经基因的分离与克隆构建的重组dna,以aav2作为治疗基因向机体靶器官靶细胞的转运的载体;tbg是肝脏特异性表达的启动子,确保基因定向递送至肝脏,在肝脏制造基因产物;治疗基因是apoa4,可编码合成为46kda的载脂蛋白a4;作为脂肪肝药剂,无毒副作用,肝脏脂质蓄积明显减少,脂合成基因表达降低,一次性用药,就可长久持续发挥治疗脂肪肝的效果。
附图说明
15.图1是本发明实施例治疗可显著改善高脂诱导小鼠脂肪肝中脂代谢相关基因的表达图;
16.图2是本发明实施例治疗性apoa4基因序列;
17.图3是本发明实施例治疗性基因载体aav
‑
tbg
‑
apoa4质粒结构;
18.图4是本发明实施例apoa4敲除鼠肝脏不表达apoa4的示意图;
19.图5本发明实施例apoa4基因敲除及基因过表达高脂诱导脂肪肝小鼠体重变化图;
20.图6本发明实施例apoa4基因敲除及基因过表达高脂诱导脂肪肝小鼠肝重变化图;
21.图7本发明实施例apoa4基因敲除及基因过表达鼠高脂诱导脂肪肝he和油红o检测脂滴变化图;
22.图8本发明实施例apoa4基因敲除及基因过表达鼠高脂诱导脂肪肝肝脏甘油三脂变化图;
23.图9本发明实施例apoa4基因敲除及基因过表达鼠高脂诱导脂肪肝肝损伤指标变化图;
24.图10本发明实施例apoa4基因敲除及基因过表达鼠高脂诱导脂肪肝肝脏中脂代谢基因的表达图;
25.图11本发明实施例生物药剂治疗组肝脏表达apoa4蛋白图;
26.图12本发明实施例生物药剂治疗可显著逆转apoa4基因敲除导致的体重增加图;
27.图13本发明实施例生物药剂治疗可显著逆转apoa4基因敲除导致的肝重增加图;
28.图14本发明实施例生物药剂治疗可显著改善高脂诱导的小鼠脂肪肝图。
具体实施方式
29.为了更清楚地说明本发明实施例的目的、技术方案和优点,下面将结合实施例对本发明作进一步说明,进行清楚、完整的描述,显然,所描述的实施例是本发明的部分实施例,而不是全部实施例。基于本发明的实施例,本领域普通技术人员在没有付出创造性劳动的前提下所获得的所有其他实施例,都属于本发明的保护范围。
30.一种基因治疗脂肪肝的生物药剂,包括aav2、tbg、apoa4,所述aav2、tbg、apoa4在体外通过基因重组形成能用于静脉注射的基因载体生物药剂,形成的生物药剂是基于基因治疗的生物药剂aav2
‑
tbg
‑
apoa4,是在体外经基因的分离与克隆构建的重组dna,其中的
aav2为腺相关病毒2型,作为治疗基因向机体靶器官靶细胞的转运的载体,病毒载体是pfd
‑
raav
‑
tbg
‑
gfp空质粒,如图3中所示,约有80%的人携带这种病毒,它会对人体产生影响,但是不会致病;其中的tbg是肝脏特异性表达的启动子,使基因定向递送至肝脏,以肝脏为靶器官,在肝脏制造基因产物;apoa4为46kda的载脂蛋白a4,是人体及动物饮食后诱发的,在小肠和肝脏合成分泌的一种机体内源性载脂蛋白,可经血液到达全身各器官发挥作用,作为治疗基因,无毒副作用;并且其通过一次性静脉注射给药,就可长久持续在肝脏产生apoa4蛋白,在肝脏局部及被分泌运输至机体其它器官产生疗效。
31.一种基因治疗脂肪肝的生物药剂制备方法,步骤如下,
32.s1,获取治疗性基因,从正常生物体组织cdna库扩增apoa4全长cdna片段,并在该片段两侧增加spei和sa1i酶切位点;治疗性基因选择小鼠apoa4(mapoa4)cdna:首先从正常小鼠肝脏组织cdna库扩增apoa4全长cdna片段如图2中所示,扩增时该片段两侧加上了spei和sali酶切位点;
33.s2,在aav2病毒载体pfd
‑
raav
‑
tbg
‑
gfp空质粒(也是阴性对照质粒)上通过spei和sa1i酶切位点将apoa4 cdna克隆入该质粒制成pfd
‑
raav
‑
tbg
‑
apoa4
‑
gfp治疗性质粒,其结构如图3中所示,治疗性基因载体aav
‑
tbg
‑
apoa4质粒结构;
34.s3,将pfd
‑
raav
‑
tbg
‑
apoa4
‑
gfp质粒通过转染、扩增、纯化制成pfd
‑
raav
‑
tbg
‑
mapoa4
‑
gfp基因载体生物药剂,此时该质粒就带有肝脏组织特异性启动子tbg,目的基因携带荧光蛋白gfp,所制成的生物制剂的滴度为5
×
10
12
vg/ml,作为待用的基因载体生物药剂。
35.在使用时,还包括步骤s4,将pfd
‑
raav
‑
tbg
‑
mapoa4
‑
gfp基因载体生物药剂通过生理盐水稀释形成能够静脉注射的生物药剂,根据不同的使用需求将其稀释到相应的浓度,所述生物药剂稀释到的浓度为2
×
10
10
vg/ml就可以满足常规的使用需求,此时对于5周龄大的雄性小鼠来说每只眼底静脉注射100μl(2
×
109vg)即可。
36.具体实施例为:
37.1脂肪肝模型小鼠apoa4基因缺失脂肪肝加重、apoa4基因过表达鼠脂肪肝减轻,
38.1.1apoa4基因敲除和过表达基因工程小鼠肥胖相关脂肪肝模型建立及指标检测,
39.首先对apoa4基因敲除(ko组)鼠及其阴性对照c57bl/6j野生型(wt组)肝脏,用apoa4抗体进行免疫荧光检测,确定ko组鼠无apoa4蛋白产生。随机选择6周龄大的雄性apoa4基因敲除(ko组)、apoa4转基因(tg组)小鼠、以及c57bl/6j野生型(wt阴性对照组)小鼠,给予高脂饲料喂养16周,每组9只。每周称量体重,16周处死小鼠取材。取材时称量肝脏重量;生化检测血浆中肝脏功能指标alt、ast水平;生化检测肝组织甘油三脂(tag)含量;制备肝脏组织切片进行he和油红o染色,观察肝组织的形态学变化和脂质沉积状况。同时取肝脏组织,对wt组和ko组肝脏组织进行转录组测序,每组5例。对两组差异基因进行kegg功能富集,对富集到的与脂代谢相关基因(包括脂合成、脂降解和脂氧化)进行表达量分析。
40.1.2结果如下:
41.1)apoa4基因敲除鼠肝脏无apoa4蛋白:免疫荧光实验显示,野生型小鼠肝脏检出apoa4蛋白,apoa4基因敲除鼠肝脏未检出apoa4蛋白,如图4中所示。
42.2)apoa4抑制体重增加:相比wt组,apoa4基因敲除(ko)组体重明显增加,高脂饲养16周时体重增加了8.3%;而apoa4转基因组(tg)体重降低了5.5%,如图5中所示。
43.3)apoa4抑制肝重增加:相比wt组,ko组肝重明显增加,高脂饲养16周时肝重增加
了38%;而tg组鼠肝重降低了40%,如图6中所示。
44.4)肝脏病理形态及脂滴检测apoa4抑制脂肪蓄积:he、油红o染色显示,如图7中所示,与wt组相比,ko鼠肝细胞气球样变严重、脂质沉积明显增多;而tg组肝组织脂质沉积明显逆转。
45.5)肝脂含量、损伤指标生化检测apoa4抑制肝损伤:生化检测显示,与wt组相比,ko组肝脏甘油三酯(tag)含量,如图8中所示、损伤指标血浆alt和ast显著升高,如图9中所示,表明apoa4缺失导致肝脏脂含量增加、脂肪肝损伤加重;而apoa4转基因鼠以上指标均逆转。
46.6)转录组检测揭示apoa4通过脂代谢抑制脂肪肝分子机制:用wt组和ko组肝脏组织进行转录组测序数据,对两组差异基因进行kegg功能富集,发现ko组肝脏脂合成(lipogenesis)基因表达普遍升高,同时发现大多数脂降解和脂氧化(lipolysisand oxidation)基因表达量降低,如图10中所示,提示apoa4抑制脂肪肝是通过上调肝脏脂合成、下调肝脏脂降解和脂氧化利用的分子机制。
47.由此可知apoa4对高脂诱导的脂肪肝及肝功能受损具有抑制保护作用,apoa4上调肝脏脂合成、下调肝脏脂降解和脂氧化利用是apoa4抑制脂肪肝机制之一。
48.小鼠实验例显示,apoa4基因过表达在脂肪肝模型鼠疗效显著,高脂饲养16周,体重减轻达12.9%,肝重减轻达17%。肝脏脂质蓄积明显减少、甘油三脂含量减少11%;脂合成基因表达普遍降低,而大多数脂降解和脂氧化基因表达量升高。
49.2本生物药剂aav2
‑
tbg
‑
apoa4可逆转apoa4基因敲除导致的脂肪肝加重,
50.2.1给apoa4基因敲除脂肪肝模型小鼠注射脂肪肝生物药剂治疗,
51.给1.1所述的apoa4基因敲除高脂诱导脂肪肝模型鼠一次性注射该脂肪肝生物药剂aav2
‑
tbg
‑
apoa44(ko
‑
a4组),同时注射aav2
‑
tbg
‑
gfp的小鼠(ko
‑
gfp组)为阴性对照。注射后每周称量体重,16周处死小鼠取材。各项检测指标和方法同1.1。两组肝脏脂代谢基因表达量用rt
‑
pcr检测。
52.2.2结果:
53.1)ko
‑
a4治疗组肝脏生产apoa4蛋白:免疫荧光实验显示,ko
‑
gfp阴性对照鼠肝脏未检出apoa4蛋白,而ko
‑
a4治疗组肝脏检出apoa4蛋白,如图11中所示,说明该生物药剂的dna被定向转送至了肝脏,并产生了apoa4蛋白。
54.2)ko
‑
a4治疗组体重减轻:相比ko
‑
gfp阴性对照组,ko
‑
a4治疗组体重明显降低,降低了12.9%,如图12中所示。
55.3)ko
‑
a4治疗组肝重减轻:相比ko
‑
gfp阴性对照组,ko
‑
a4治疗组肝重明显降低,降低了17%,如图13中所示。
56.4)ko
‑
a4治疗组脂质蓄积减轻:he、油红o染色及生化检测甘油三酯tag显示,如图14中所示,相比ko
‑
gfp阴性对照组,ko
‑
a4治疗组脂质蓄积明显减少、tag含量下降(减少11%)。
57.5)ko
‑
a4治疗组脂代谢相关基因表达逆转:用rt
‑
pcr检测两组肝脏脂代谢基因表达量显示,相比ko
‑
gfp阴性对照组,ko
‑
a4治疗组脂代谢相关基因表达量逆转,具体表现在多数肝脏脂合成(lipogenesis)基因表达普遍减低,而大多数脂降解和脂氧化(lipolysis and oxidation)基因表达量升高,如图1中所示,提示该生物药剂抑制脂肪肝是通过下调肝脏脂合成、上调肝脏脂降解和脂氧化的分子机制。
58.由此可知该生物药剂对高脂诱导的脂肪肝具有抑制保护作用,是通过在肝脏产生的apoa4蛋白,下调肝脏脂合成、上调肝脏脂降解和脂的氧化利用发挥其作用。
59.应当理解的是,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,而所有这些改进和变换都应属于本发明所附权利要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1