一种可缓释PSO的杂化多层膜及其制备方法
一种可缓释pso的杂化多层膜及其制备方法
技术领域
1.本发明涉及膜材料领域,具体是涉及一种可缓释pso的杂化多层膜及其制备方法。
背景技术:
2.脊柱融合术,如后外侧腰椎脊柱融合术,棘突间腰椎融合术和脊柱椎间融合术,是一种常见的外科手术方法,可适用于包括变性椎间盘疾病,脊柱不稳和椎管狭窄等多种疾病。提高融合率的关键是植骨材料,该材料应具有成骨性,骨诱导性和骨传导性。使用自体骨作为移植材料,通常会伴有一系列并发症,例如失血、慢性疼痛,动脉或输尿管损伤,神经损伤,骨折和骨盆不稳定。这极大激发了人们对开发替代的骨移植材料的兴趣,例如磷酸钙酶,去矿质的骨,人造移植物和骨形态发生蛋白(bone morphogenetic protein,bmp)等。
3.在过去的二十年中,在骨修复的临床应用中,磷酸盐、去矿质的骨和钛(ti)等无机材料在骨骼重建中的使用广泛,但该类材料仍存在诸如骨骼愈合效果差、延缓愈合等缺点。此外,bmp在增强脊柱融合中实现了较为普遍的应用,尤其是重组人骨形态发生蛋白
‑
2(rhbmp
‑
2)成为了多种骨移植替代物的主要有效成分。但是由于对所需的rhbmp
‑
2的超生理学浓度以及释放动力学的控制不足,该类替代物常会引发异位骨形成、骨过度生长、骨溶解、颈椎融合术后水肿和吞咽困难等问题。
4.理论上,骨形成是一个涉及骨吸收和骨生成的动态过程,其在生理条件下保持平衡,而这种平衡是通过免疫系统来调节的。而在骨修复过程中,使用何种有效成分以及如何使用该有效成分来引导骨间充质干细胞(下称bmscs)向成骨细胞的分化,是必须要解决的重要问题。鉴于rhbmp
‑
2存在上述缺陷,因此,亟待开发出其他具有成骨活性且能够规避rhbmp
‑
2副作用的骨植入替代材料。
5.基于上述问题,在实现本发明过程中,发明人发现:补骨脂素(下称pso)是提取自补骨脂果的主要活性成分,是治疗骨折、骨与关节疾病等处方中常用的草药之一,具有替代bmp来制作骨植入材料的潜力,可能能成为骨组织工程的潜在治疗策略。
技术实现要素:
6.本发明针对现有技术存在的不足,提供一种可缓释pso的杂化多层膜及其制备方法,主要采用层层组装的方法,在基底材料上成功组装了无机多层杂化膜,并装载了pso来诱导新骨形成,通过有机无机杂化多层膜和pso之间的结合促进骨融合,改善了bmscs的增殖、粘附和成骨特性,有利于新骨形成并提高了脊柱融合率。
7.一方面,本发明提供了一种可缓释pso的杂化多层膜:
8.包括基底、顺次组装在所述基底上的若干层薄膜和装载在所述薄膜上的pso;所述薄膜包括基础膜层和外部膜层,所述基础膜层与所述基底直接接触,所述外部膜层的层数不少于12层;
9.其中,所述基础膜层为pei膜,所述外部膜层包括pdha膜。
10.另一方面,本发明基于上述可缓释pso的杂化多层膜,还提供了一种可缓释pso的
杂化多层膜的制备方法,包括以下步骤:
11.步骤一:洗涤所述基底并干燥,随后将所述基底浸泡在pei溶液中,浸泡时间为10~30分钟,随后冲洗以去除松散结合的聚电解质分子,得到所述pei膜;
12.步骤二:将组装上所述pei膜的基底顺次在聚阴离子溶液、聚阳离子溶液、pdha溶液和聚阳离子溶液中各浸泡5~15分钟,每次浸泡完毕后,再用水进行清洗;
13.步骤三:将所述步骤三中的浸泡、清洗过程循环操作,得到[(+/pdha/+/
‑
)
n
/pei]杂化多层膜,其中,“+”代表聚阳离子、
“‑”
代表聚阴离子、n代表循环次数,所述循环次数不少于3次;
[0014]
步骤四:将所述[(+/pdha/+/
‑
)
n
/pei]杂化多层膜置于交联溶液中进行交联反应,反应时间为6~24小时,得到交联后的多层膜,记作x
‑
[(+/pdha/+/
‑
)
n
/pei]杂化多层膜;
[0015]
步骤五:将pso装载在所述x
‑
[(+/pdha/+/
‑
)
n
/pei]杂化多层膜上,得到所述可缓释pso的杂化多层膜。
[0016]
进一步的优化,所述pdha溶液的制备方法为:将陶瓷粉末和多巴胺溶解于缓冲液中,震荡分散,在搅拌下反应12~72小时后,离心除去大颗粒,得到所述pdha溶液。
[0017]
进一步的优化,所述陶瓷粉末为羟基磷灰石、生物活性玻璃、磷酸钙、氧化铝或氧化锆中的任一种,所述陶瓷粉末与所述多巴胺的重量比为8~15:1。
[0018]
进一步的优化,所述聚阴离子溶液为葡聚糖溶液、肝素溶液、硫酸肝素溶液、海藻酸溶液、透明质酸溶液、胶原溶液、明胶溶液、卡拉胶溶液或醋酸纤维素溶液中的任一种,浓度为0.3~5.0mg/ml;
[0019]
所述pdha溶液的浓度为0.3~5.0mg/ml;
[0020]
所述聚阳离子溶液为壳聚糖溶液或聚赖氨酸溶液中的任一种,浓度为0.3~5.0mg/ml。
[0021]
进一步的优化,所述交联溶液为浓度为5~150mg/ml碳化二亚胺溶液、5~25mg/ml硫代琥珀酰亚胺溶液、质量浓度为2.5%戊二醛溶液或质量浓度为1~4%的京尼平溶液中的至少一种。
[0022]
进一步的优化,所述pso的装载方法为:将所述x
‑
[(+/pdha/+/
‑
)
n
/pei]杂化多层膜浸泡到所述pso的乙醇溶液中进装载;或,将含有所述pso的乙醇溶液直接滴加到所述x
‑
[(+/pdha/+/
‑
)
n
/pei]杂化多层膜上;
[0023]
所述pso的乙醇溶液的浓度小于50μm/l。
[0024]
再一方面,本发明还提供了另一种可缓释pso的杂化多层膜,其特征在于:
[0025]
包括基底、顺次组装在所述基底上的若干层薄膜和装载在所述薄膜上的pso;
[0026]
其中,所述基底经过了多巴胺活化处理;
[0027]
所述薄膜的种类包括聚阳离子膜、pdha膜和聚阴离子膜;所述薄膜的排列顺序按照与所述基底的距离由近及远依次为:聚阳离子膜、pdha膜、聚阳离子膜、聚阴离子膜,以该4层膜为一个循环单元,顺次组装,循环次数不少于3次。
[0028]
进一步的优化,所述多巴胺活化处理的方法为:将洗涤干燥后的所述基底浸泡在含有多巴胺的缓冲液中,反应12~72小时;所述含有多巴胺的缓冲液为多巴胺浓度为0.3~5.0mg/ml的tris
‑
hcl缓冲液,其ph为8~9。
[0029]
进一步的优化,所述聚阳离子膜为壳聚糖膜或聚赖氨酸膜中的任一种;
[0030]
所述聚阴离子膜为葡聚糖膜、肝素膜、硫酸肝素膜、海藻酸膜、透明质酸膜、胶原膜、明胶膜、卡拉胶膜或醋酸纤维素膜中的任一种;
[0031]
所述pdha膜的制备方法为:将所述基底浸泡在经多巴胺修饰的羟基磷灰石溶液中制备得到所述pdha膜。
[0032]
本发明的有益效果是:
[0033]
本发明针对脊柱融合手术中,自体骨移植的替代物在临床中存在的问题,如以陶瓷、钛和去矿质的骨等为代表的无机材料存在的成骨特性差的问题,以及以骨形成发生蛋白bmp为代表的刺激骨形成药物独具的爆发性释放的特性,而造成异位骨形成、骨过度生长、骨溶解等术后不良反应等问题,设计了一种可缓释pso的有机无机杂化多层膜,以钛材等作为基底材料,通过层层组装的方式,在基底上涂覆包括pei基础膜和pdha膜在内的多层无机膜,在保留基底如钛材无机相的基础上,增强了基底表面的生物活性,且增强了基材表面的亲水性从而促进细胞的增殖和粘附;随后装载具有促进成骨活性的pso药物,pso在该有机无机杂化多层膜上的装载量有明显的提高,且有机无机杂化多层膜的存在,能够有效控制pso的释放速度。
[0034]
最重要的是,相较于bmp,pso具有更为温和的促成骨能力和更优的经济效益,其通过自噬可对骨形成和骨吸收这一过程产生独特的影响,在这种平衡的调节过程中发挥着重要的作用,能够有效促进成骨分化。总的来说,通过有机无机杂化多层膜和pso之间的结合促进骨融合,改善了bmscs的增殖、粘附和成骨特性,有利于新骨形成并提高了脊柱融合率。
[0035]
综上所述,多层膜中多种不同种类的膜层相互配合:天然多糖良好的生物相容性、羟基磷灰石对骨细胞的良好亲和性,再加上随之装载的pso的长效缓释对成骨的促进作用,能够极大地促进间充质干细胞的增殖和细胞间融合,有效促进骨修复。
附图说明
[0036]
下面结合附图对本发明作进一步说明。
[0037]
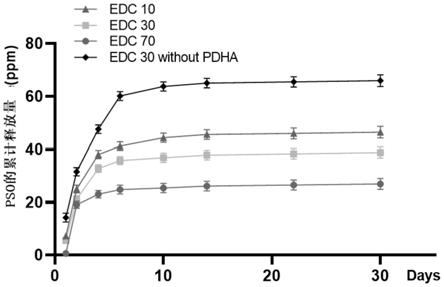
图1为对实施例1、对比例4、对比例5以及对比例8中edc为30mg/ml时制备得到的四组支架进行体外药物释放实验,测定得到的pso药物随时间变化的药物缓释图;
[0038]
图2为对空白对照组(记为blank,下同)、实施例1以及对比例7得到的支架进行细胞试验,得到的免疫荧光染色结果;
[0039]
图3为对空白对照组、实施例1以及对比例7得到的支架进行细胞试验,得到的p62和lc3
‑
ii/lc3
‑
1的蛋白印迹检测结果;
[0040]
图4为对空白对照组、实施例1以及对比例7得到的支架进行细胞试验,得到的p62和lc3
‑
ii/lc3
‑
1的蛋白印迹检测结果的定量分析图;
[0041]
图5为对空白对照组、实施例1以及对比例7得到的支架进行alp染色分析,根据细胞在第3、7、14天时的表达情况得到的alp定量分析结果;
[0042]
图6为对实施例1、对比例4~5得到的支架所做的扫描电镜图像;
[0043]
图7为对实施例1、对比例4、对比例5和对比例8中得到的支架的表面刚度测试结果(单位:mpa);
[0044]
图8为对实施例1、对比例4、对比例5得到的支架进行alp染色分析,得到的不同表面刚度下细胞成骨能力的定量分析结果;
[0045]
图9为将实施例1、对比例1、对比例3得到的支架处理后,植入,术后2个月各组支架中大鼠腰椎手术节段的micro ct图像的三维(3d)重建图像;
[0046]
图10为将实施例1、对比例1、对比例3得到的支架处理后,植入,术后2个月内新形成的骨组织体积密度的组织形态学测量结果;
[0047]
附图11为存储附图2彩色原图的二维码地址。
具体实施方式
[0048]
下面结合具体实施方式对本发明做进一步的说明。
[0049]
为避免歧义,首先对具体实施例中涉及的英文缩写进行解释说明:
[0050]
bmscs:骨髓间充质干细胞;
[0051]
tms:钛网支架
[0052]
pso:补骨脂素;
[0053]
pei:聚乙烯亚胺;
[0054]
ha:透明质酸;
[0055]
pdha:聚多巴胺修饰的羟基磷灰石;
[0056]
chi:壳聚糖;
[0057]
pem:有机无机杂化多层膜;
[0058]
edc:碳化二亚胺。
[0059]
实施例1:
[0060]
制备可缓释pso的杂化多层膜。
[0061]
包括基底、顺次组装在该基底上的若干层薄膜和装载在该薄膜上的pso;上述薄膜包括基础膜层和外部膜层,该基础膜层与上述基底直接接触,该外部膜层的层数为32层;
[0062]
其中,上述的基础膜层为pei膜,外部膜层包括ha膜、pdha膜和chi膜三种膜,以ha膜、chi膜、pdha膜和chi膜顺次组装为一个循环涂覆8次,得到32层外部膜层。
[0063]
以pei膜以及循环组装的ha膜、pdha膜和chi膜为主要组分得到的有机无机杂化多层膜,(pem)具有良好的生物相容性和优异的pso药物装载能力。其中,pei具有较高的结合能力,作为基础膜层,有利于得到装载稳定的pem,该pei膜组装完成后,使得基底材料表面带有正电,随后顺次循环组装ha聚阴离子、pdha、chi聚阳离子。ha可通过作用于bmscs表达的cd44受体而促进细胞分化,增强细胞的增殖、粘附;chi则具有良好的生物相容性和吸附特性,能够促进细胞生长和粘附,pdha是骨骼的主要成分,有助于细胞和软组织的附着,pso则可通过自噬有效促进成骨分化。因此,在pem和pso之间的结合可以更有效地促进骨融合。
[0064]
在本实施例中,该基底为钛网支架。在其他实施例中,采用其它的植入体如peek、pet、不锈钢等作为基底,也能够制备得到具有预期成骨特性的可缓释pso的杂化多层膜。
[0065]
本实施例还给出了该可缓释pso的杂化多层膜的具体制备方法,包括以下步骤:
[0066]
步骤一:洗涤钛网支架并干燥,随后将该钛网支架在pei溶液中浸泡20分钟,随后冲洗以去除松散结合的聚电解质分子,得到所述pei膜;
[0067]
其中,上述pei溶液的浓度为5.0mg/ml。
[0068]
步骤二:将组装上所述pei膜的钛网支架顺次在ha溶液、pdha溶液和chi溶液中各浸泡8分钟,每次浸泡完毕后,再用水进行清洗;
[0069]
其中,ha溶液的浓度为1.0mg/ml、pdha溶液的浓度为1.5mg/ml,chi溶液的浓度为1.0mg/ml;
[0070]
上述pdha溶液的制备方法为:将陶瓷粉末和多巴胺溶解于缓冲液中,震荡分散,在搅拌下反应48小时后,离心除去大颗粒,得到所述pdha溶液。所述陶瓷粉末为羟基磷灰石、生物活性玻璃、磷酸钙、氧化铝或氧化锆中的任一种,所述陶瓷粉末与所述多巴胺的重量比为10:1。
[0071]
步骤三:将所述步骤三中的浸泡、清洗过程循环操作,得到[(+/pdha/+/
‑
)8/pei]杂化多层膜,其中,“+”代表聚阳离子、
“‑”
代表聚阴离子、“8”代表外部膜层循环浸泡涂覆的次数为8次;
[0072]
步骤四:将所述[(+/pdha/+/
‑
)8/pei]杂化多层膜置于交联溶液中进行交联反应,反应时间为24小时,得到交联后的多层膜,记作x
‑
[(+/pdha/+/
‑
)8/pei]杂化多层膜,有必要的话,还应当清洗去除残留的交联溶液,随后干燥;
[0073]
其中,该交联溶液为浓度为30mg/ml edc溶液和11mg/ml的硫代琥珀酰亚胺溶液。
[0074]
在其他实施例中,也可以使用质量浓度为2.5%戊二醛溶液或质量浓度为1~4%的京尼平溶液中的至少一种来替代。
[0075]
步骤五:将所述x
‑
[(+/pdha/+/
‑
)8/pei]杂化多层膜浸泡到所述pso的乙醇溶液中进装载,得到所述可缓释pso的杂化多层膜。
[0076]
其中,该pso的乙醇溶液的浓度为15μm/l。
[0077]
使用本实施例中公开的制备方法,在钛网支架表面共涂覆了33层膜层形成pem,该pem对成骨细胞增殖有明显促进作用,且在临床中,对植入物的锚定具有积极的促进作用,从而可进一步改善早期的骨愈合状况。
[0078]
特别地,针对羟基磷灰石本身具有的在水中易团聚、分散性差的缺点,本实施例中采用多巴胺自聚合技术对其进行表面修饰以提高其分散性。经修饰后,羟基磷灰石的分散性增强、表观粒径减小。大大增加了纳米羟基磷灰石在水中的分散性,并且由于表面聚多巴胺的存在使得纳米粒子能够与氨基结合,使得pdha能够参与到与带氨基聚电解质的层层组装中。此外,在多层膜中,引入羟基磷灰石之后,可明显增加多层膜表面的杨氏模量。进一步地,对组装完成的多层膜进行化学交联,可以进一步提高多层膜的稳定性。且交联剂的浓度对多层膜的表面模量也有影响。
[0079]
表面模量的提高在这里意义重大。一般不同的细胞适应的材料软硬程度不同,神经细胞适合在较软的材料上进行繁殖分化,而骨细胞偏好较硬的材料。而本发明中涉及的骨形态发生蛋白主要用于骨细胞相关的领域,表面模量的提高有利于细胞的铺展、增殖和分化,通过增强多层膜表面的模量促进骨及前骨细胞的黏附增殖和成骨分化,为植入体表面新骨的生成提供良好的物理化学微环境。
[0080]
随之,再将pem置于edc溶液中进行交联,又可进一步提高该pem对药物pso的控释能力,pso在体外实验中的缓释因多层膜的交联而减缓,可以推断得知,pso能够保持在病灶部位的长效缓释,能够显著诱导bmscs的成骨分化。此外,多层膜对所装载的pso有很好的保护作用。
[0081]
实施例2:
[0082]
一种可缓释pso的杂化多层膜,包括基底、顺次组装在所述基底上的若干层薄膜和
装载在所述薄膜上的pso;其中,所述基底经过了多巴胺活化处理;
[0083]
所述薄膜的种类包括聚阳离子膜、pdha膜和聚阴离子膜;所述薄膜的排列顺序按照与所述基底的距离由近及远依次为:聚阳离子膜、pdha膜、聚阳离子膜、聚阴离子膜,以该4层膜为一个循环单元,顺次组装,循环次数为8次。
[0084]
其中,基底材料为钛网支架,对该钛网支架进行多巴胺活化处理:将洗涤干燥后的所述基底浸泡在含有多巴胺的缓冲液中,反应12~72小时;所述含有多巴胺的缓冲液为多巴胺浓度为0.3~5.0mg/ml的tris
‑
hcl缓冲液,其ph为8~9。
[0085]
上述的聚阳离子膜为壳聚糖膜、聚阴离子膜为透明质酸膜;pdha膜的制备方法为:将该支架浸泡在经多巴胺修饰的羟基磷灰石溶液中制备得到该pdha膜。
[0086]
相对于实施例1,本实施例针对金属离子的潜在毒性,利用多巴胺在基底材料上类似于贻贝粘附蛋白的自聚合特性对钛材进行活化,在基底材料上首先创建了一个聚多巴胺层,该层无毒且同样能够与基底之间实现牢固的结合。随后引入多层膜pem,包括chi膜、pdha膜、chi膜、和ha膜,膜层的结构呈[(+/pdha/+/
‑
)8]。其中,ha为聚阴离子,chi为聚阳离子,羟基磷灰石则能为体内新骨生成提供ca
2+
离子源,促进骨及前骨细胞的黏附增殖和成骨分化。多层膜中三种不同种类的膜层相互配合:天然多糖良好的生物相容性、羟基磷灰石对骨细胞的良好亲和性,再加上随之装载的pso药物的长效缓释对成骨的促进作用,能够极大地促进间充质干细胞的增殖和细胞间融合。
[0087]
对比例1:
[0088]
多层膜pem涂覆的钛网支架,但并未负载pso。
[0089]
其他操作和实施例1相同。
[0090]
对比例2:
[0091]
钛网支架直接负载pso,并不含有多层膜pem结构。
[0092]
负载方法和实施例1相同。
[0093]
对比例3:
[0094]
纯钛网支架tms。
[0095]
对比例4:
[0096]
与实施例1相比,本对比例中,交联溶液edc的浓度为10mg/ml。
[0097]
其他操作和实施例1相同。
[0098]
对比例5:
[0099]
与实施例1相比,本对比例中,交联溶液edc的浓度为70mg/ml。
[0100]
其他操作和实施例1相同。
[0101]
对比例6:
[0102]
与实施例1相比,本对比例中,该pso的乙醇溶液的浓度为20μm/l。
[0103]
其他条件和实施例1相同。
[0104]
使用cck
‑
8试剂盒评价pso的细胞毒性,结果表明,培养bmscs48小时后,pso在20μm/l浓度下对bmscs表现出细胞毒性。而其他实施例中优选的5μm/l、10μm/l、15μm/l等浓度则处于安全范围内。
[0105]
接下来,当pso浓度为5μm/l、10μm/l、15μm/l时,通过蛋白印迹实验检测细胞中runx
‑
2、col
‑
1、ocn、p62和lc
‑
3的表达,并对结果进行了量化,检测结果表明:当pso浓度增
加时,骨形成相关的细胞因子如runx
‑
2、col
‑
1和ocn的表达增加。由pso诱导的p62的表达下降和lc3
‑
ii/lc3
‑
i的过表达都呈剂量依赖性,这提示了自噬的激活。
[0106]
对比例7:
[0107]
与实施例1相比,本对比例中,该pso的乙醇溶液的浓度为10μm/l,且还装载了3
‑
ma。
[0108]
其他条件和实施例1相同。
[0109]
此时,对空白对照组、实施例1和对比例7进行对比研究。具体的,经过ocn和lc
‑
3的双标记免疫荧光染色,参见图2,结果发现:pso明显促进了ocn和lc
‑
3的表达,但ocn的表达随后被3
‑
ma抑制,而lc
‑
3的表达水平在3
‑
ma的影响下进一步增强;
[0110]
另外,参见图3和图4,这3组的p62和lc3
‑
ii/lc3
‑
1的蛋白印迹结果与免疫荧光一致,进一步证实了pso能够通过自噬突进促进细胞成骨。
[0111]
接下来,进一步测试了这3组的alp活性,结果表明:实施例1中的pso治疗组中的细胞表现出更强的成骨活性,并其而这一现象随着时间的推移更加明显,而对比例7中则因为添加了3
‑
ma被明显抑制(参见图5)。
[0112]
可见,pso在体外可以通过激活bmscs的自噬途径而产生有效的成骨作用,且作用温和,副作用小。
[0113]
对比例8:
[0114]
与实施例1相比,本实施例中,外部膜层不包括pdha膜,仅包含ha膜和chi膜三种膜,该两种膜顺次循环涂覆16次,得到32层外部膜层。同时在本对比例中,采用edc的浓度分别为10mg/ml、30mg/ml、70mg/ml,共得到3组产品。
[0115]
其他操作和实施例1相同。
[0116]
对比实施例1与对比例4、5,以及对比例8中edc为30mg/ml时制备得到的四组支架,进行体外药物释放实验,讨论交联剂edc溶液的浓度和pdha对pso药物释放的影响。具体检测过程如下:在指定的时间点各抽取1ml实施例1与对比例4、对比例5、新对照组中支架浸泡所得的上清液,利用电感耦合等离子体质谱检测每个时间点上清液中pso的浓度,以此来计算出pso药物的累计释放量。结果参见附图1,edc的浓度越高,pem的药物保留能力越强,且pdha的加入能够显著提高多层膜对药物的控释能力。
[0117]
此外,在tms上装载的薄膜刚度合适,则有利于成骨细胞在体内植入物上的粘附和生长,从而提高脊柱融合率。参见附图6,随着edc浓度的增加,pem包覆的钛网支架表面的结构变得粗糙,且具有更丰富的多孔结构,特别是当edc浓度增加到30mg/ml时,这种现象尤为明显,虽然当浓度增加到70mg/ml时,薄膜的微孔结构和孔隙度相对于30mg/ml时增加的并不明显。
[0118]
再进一步的,采用纳米压痕实验进一步检测对实施例1、对比例4、对比例5和对比例8中得到的支架的力学性能,并计算得到杨氏模量以反映材料的表面刚度,结果参见附图7,当edc浓度增加到30mg/ml时,支架表面刚度的增加最为明显,并且在组装了pdha涂层之后,这种结果被进一步放大了。
[0119]
随后,对实施例1、对比例4、对比例5得到的支架进行alp染色分析,对不同表面刚度下细胞的成骨能力进行定量分析,结果参见附图8:随着材料表面刚度的增加,细胞的成骨能力随之增强,优选的,当edc浓度在30mg/ml附近(具体可取20~40mg/ml)时,支架表面
的刚度是最合适的,且加入pdha之后能产生巨大的协同作用。
[0120]
最后,使用大鼠进行动物实验,对体内成骨能力进行评价。
[0121]
相较于细胞实验,在以大鼠为对象的动物实验中,pso浓度可以调节到更大。具体的,采用大鼠l4
‑
l5后外侧腰椎横突融合模型,取按照实施例1的方法制备得到的pem
‑
tms共3组,分别装载浓度为为1μm/l、10μm/l、50μm/l的pso,分别记为pem
‑
tms+pso
‑
l、pem
‑
tms+pso
‑
m和pem
‑
tms+pso
‑
h,对比例1的支架记为tms,对比例3的支架记为pem
‑
tms,将这些得到的支架植入后,术后2个月进行大鼠脊柱的micro ct扫描,各组支架中大鼠腰椎手术节段的micro ct图像的三维重建以及二维断层扫描图像参见附图9,定性地显示了新骨形成及其形态结构,后续继续对micro ct的结果进行定量分析,显然,附图9中的pem
‑
tms+pso
‑
h组的bv/tv(骨体积/组织总体积)、tb.n(骨小梁数)以及tb.th(骨小梁厚度)最高,且tb.sp(骨小梁间距)最低,表明该组的成骨效果最好。
[0122]
为了进一步证实micro ct图像获得的新骨形成结果,发明人进一步对上述手术后2个月收获的大鼠腰椎阶段进行了组织学分析,得到了新形成的骨组织体积密度的组织形态学测量结果,参见附图10:可以看出来,pem与pso能够促进成骨,且其促进成骨作用与pso的浓度呈正相关,同样在pem
‑
tms+pso
‑
h组中,新骨的增量最多,融合趋势最好。
[0123]
为了更清楚的说明本发明实施例所展示的技术方案及实现的技术效果,附上附图2的彩色原图的二维码查看地址,如附图11所示。
[0124]
除上述优选实施例外,本发明还有其他的实施方式,本领域技术人员可以根据本发明作出各种改变和变形,只要不脱离本发明的精神,均应属于本发明权利要求书中所定义的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1