一种鹅星状病毒的灭活疫苗及其制备方法
技术领域:
:本发明属于生物
技术领域:
,主要涉及疫苗的生产,具体涉及一种鹅星状病毒灭活疫苗及其制备方法。
背景技术:
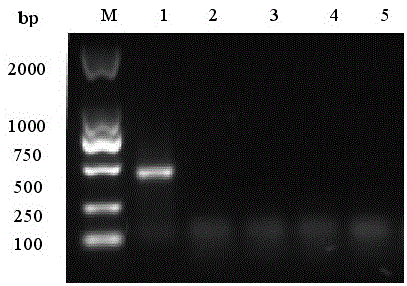
::近年来,山东、江苏及安徽等地区养鹅场暴发了一种以痛风为主要症状的致死性传染病,已有数位学者报道了相关病例,经研究发现导致此次疫情发生的致病原为鹅星状病毒。特别是2017年以来,雏鹅痛风病迅速传遍全国,给我国的养鹅业带来了巨大的经济损失,严重威胁我国养鹅业的发展。鹅星状病毒是禽星状病毒属成员,属于rna病毒,鹅感染星状病毒后表现为腹泻、关节炎及生长障碍,发生较重的致死性肝炎、胆囊炎及肾炎等疾病。2~25日龄雏鹅发病率较高,15日龄以内雏鹅最易感,死亡率一般为15%~36%,最高可达50%。由于禽星状病毒可拥有多个宿主,能够水平、垂直、跨种传播;同时禽星状病毒基因重组、适应新宿主的能力和新型禽星状病毒强毒株的不断发现,使得感染禽星状病毒的禽群净化异常困难。此外,禽星状病毒较强的理化因子抵抗力,对被禽星状病毒污染的环境消毒十分困难。目前,针对禽星状病毒还没有市场化的特异性药物和疫苗。体外适宜增殖细胞系的缺乏,导致可防控禽星状病毒感染的弱毒或灭活疫苗相对较少,更未有商品化的鹅星状病毒疫苗类产品。现有技术中报道了多种疫苗的研发,例如荣雪路等研发和验证了鹅星状病毒重组capsid蛋白亚单位疫苗的免疫效果,研究结果表明鹅星状病毒重组capsid蛋白亚单位疫苗免疫效果良好,能有效预防鹅星状病毒的感染;专利文献cn110699331a报道了一种鹅星状病毒弱毒的制备方法及应用,其采用采用高温处理和低温孵育相结合的方法致弱病毒,用于制备疫苗可有效的预防鹅星状病毒引起的鹅痛风病,然而,鹅星状病毒疫苗的研究仍然较少,基于目前鹅星状病毒在养殖场不断蔓延,导致的经济损失越来越大,因而,亟需研制安全有效的疫苗以及预防和治疗鹅星状病毒用的卵黄抗体和药物等,以对鹅星状病毒疫情进行有效的控制,避免养殖业的经济损失。技术实现要素::为了解决现有技术中鹅星状病毒感染的治疗手段有限,没有有效疫苗的技术问题,本发明旨在提供一种鹅星状病毒灭活疫苗及其制备方法,该疫苗能够刺激产生较高浓度的中和抗体,攻毒试验表明其能实现100%保护,免疫保护效力高。为解决以上技术问题,本发明采用如下技术手段:一种鹅星状病毒灭活疫苗,其特征在于,所述灭活疫苗鹅星状病毒n-goastv-190123株经灭活后制备得到,其中所述鹅星状病毒n-goastv-190123株在中国典型培养物保藏中心cctcc进行用于专利程序的培养物的保藏,其保存号为:cctccno:v202068,分类命名为鹅星状病毒gooseastrovirus;保藏日期为2020年10月14日;保藏地址为:湖北省武汉市武汉大学保藏中心。所述灭活疫苗还包括佐剂。优选的,所述佐剂为montanideisa206佐剂。本发明还请求保护所述鹅星状病毒灭活疫苗的制备方法,包括以下步骤:步骤一,取鹅星状病毒n-goastv-190123毒种用稀释液稀释,稀释至eld50为5×105.00/ml,经绒毛尿囊膜途径接种8~10日龄spf鹅胚,每胚0.2ml,接种后置37℃继续孵育,不必翻蛋;步骤二,spf鹅胚接种后,每日照蛋3次,将在24小时前死亡的鹅胚弃去,24小时以后死亡的鹅胚随时取出,至72小时,将活胚全部取出,气室向上直立,置于4℃冷却12小时;步骤三,将冷却12小时的鹅胚取出,表面消毒后,吸取鹅胚液,每20个鹅胚的胚液混合为一组,在收获胚液的同时,应逐个检查鹅胚,将胚液混浊不清、胎儿腐败及有任何污染可疑的鹅胚弃去不用;步骤四,收获后的胚液置于灭菌瓶中,通过离心机离心后,混合于一个储存罐内,在无菌条件下用灭菌的二级预过滤柱滤过,除去病毒液的残渣和其他杂质,同时取样测定毒价,并采用生理盐水稀释调整胚液的eld50为5×105.00;步骤六,准确量取甲醛,用注射用水配制成10%的甲醛溶液,混合均匀,然后往鹅胚液加入甲醛溶液,随加随搅拌,充分混合,甲醛最终浓度为0.2%,而后将其倒到已灭菌的灭活罐内,37℃灭活24小时,期间不停搅拌,灭活24小时后取样做无菌检验和灭活检验;步骤七,取灭活的病毒液加热至30℃保温,取等体积的montanideisa206佐剂,倒入双层夹套容器并将温度保持在30℃,200r/min低速搅拌并逐渐将灭活病毒液加入,流速5l/min,待灭活病毒液全部加入后,提高搅拌速度至300r/min,30℃持续搅拌15分钟,而后在持续300r/min高速搅拌的情况下冷却至10℃以下,停止搅拌,将乳液在10℃以下静置24小时,分装并加盖密封,4℃左右保存备用,制得鹅星状病毒灭活疫苗。进一步的,所述灭活疫苗是通过皮下注射进行免疫接种。基于以上技术方案,本发明具有如下优点和有益效果:首先,本发明从南阳地区的鹅场分离得到了鹅星状病毒,且经过大量的传代净化得到纯度和毒力较强的毒株鹅星状病毒n-goastv-190123,该毒株对于雏鹅具有较高的致死率,且经传代培养后,其毒力较强,传至第20代,培养物的eld50为5×107.05,增殖能力强,适合作为疫苗生产毒株。其次,本发明通过将鹅星状病毒n-goastv-190123灭活后与佐剂混合制备得到灭活疫苗,所述灭活疫苗能刺激接种动物产生较高浓度的中和抗体,预防病毒感染,同时,其对鹅星状病毒n-goastv-190123以及其他毒株攻毒后的保护率均达到100%,预防和控制鹅星状病毒在鹅群中的传播,对于疫情控制具有重要的意义。综上所述,本发明分离得到了一株毒力强、免疫性能好的鹅星状病毒n-goastv-190123株,将该毒株制备成灭活疫苗免疫后能够产生较高的中和抗体,对鹅群能够达到全部保护,对于养鹅业具有重要的经济价值。附图说明:图1.病料检测结果:其中1,鹅星状病毒(goastv);2,鹅细小病毒(gpv);3,鹅出血性多瘤病毒(ghpv);4,鸭呼肠孤病毒(drv);5,坦布苏病毒(tembusu)。图2.鹅胚传代5次后的检测结果:其中1,第5代次培养物;2,第4代次培养物;3,第3代次培养物;4,第2代次培养物;5,第1代次培养物。图3.动物回归试验剖检结果图:a,肾脏中存在大量的尿酸盐沉积,输尿管充满了尿酸盐;b,肝脏、心脏包被尿酸盐样渗出严重;c,肾小管上皮细胞坏死,皮质局部出血;d,肾小球囊扩张,皮质肾小管上皮细胞变性坏死。图4.中和抗体效价测定结果。具体实施方式:实施例1:鹅星状病毒的分离与鉴定1.病料的采集病料样品采自河南省南阳地区发病的养殖场,发病鹅品种包括:泰州鹅和朗德鹅,病死雏鹅表现为关节肿胀,白色游离尿酸盐沉积,剖检可见白色尿酸盐沉积在心、肝和肾等部位,部分病例在皮下和胆囊内亦有尿酸盐沉积。参照张清水论文(张清水.新发肾致病型鹅星状病毒的分离鉴定及弱毒株选育[d].中国农业大学,2019.)中的方法,对发病雏鹅样品中可能存在的鹅细小病毒(gpv)、鹅出血性多瘤病毒(ghpv)、鸭呼肠孤病毒(drv)、坦布苏病毒(tembusu)及鹅星状病毒(goastv)等病毒基因进行检测,其中goastv-sf为5’-attcttggctcggttgtc-3’;goastv-sr为5’-cctgtgttgctccttctc-3’,扩增片段大小为489bp。检测结果如图1所示,其中鹅细小病毒(gpv)、鹅出血性多瘤病毒(ghpv)、鸭呼肠孤病毒(drv)、坦布苏病毒(tembusu)检测均为阴性,鹅星状病毒(goastv)检测呈阳性。无菌取经检测为鹅星状病毒(goastv)阳性的病死雏鹅的肝和肾适量,加入5倍体积的生理盐水,剪碎、充分匀浆并反复冻融5次,12000rpm离心10min,取上清,经0.22μm滤器过滤除菌后得到组织匀浆上清进行病毒分离操作。2.病毒的分离将组织匀浆上清采用绒毛尿囊膜途径接种5枚8日龄spf鹅胚(0.5ml/枚),放入37℃孵化箱中继续孵育,每天对接种鹅胚进行检查,观察鹅胚死亡情况,弃去24h内死亡鹅胚。若未出现死亡,则于接种后第7天将鹅胚放入-20℃冰箱冷冻处死,无菌操作打开鹅胚,将鹅胚肝脏、脾脏、肾脏等脏器及鹅胚尿囊膜进行研磨,取研磨后上清接种下一代鹅胚,按照上述方式在鹅胚中连续传代5个代次。3.病毒的鉴定与保藏3.1rt-pct检测鹅星状病毒(goastv)对每一代次的培养物进行检测,结果如图2所示,每个代次的培养物均能扩增出496bp的特异性条带,表明病毒能够在spf鹅胚中有效的增殖,最终分离得到了。经病毒分离,最终分离得到两株病毒,分别命名为鹅星状病毒n-goastv-190123和鹅星状病毒n-goastv-190178,对rt-pcr产物测序表明,两者序列与报道的鹅星状病毒存在高度同源性,都属于鹅星状病毒,且二者的序列同源性高达97.5%。3.2病原半数致死量(eld50)的测定采用spf鹅胚对分离得到的病毒进行继续传代,直至第20代次,取的第1、5、10、15、20代次的病毒液用灭菌的生理盐水进行10倍梯度稀释,共8组稀释度(10-1~10-8),每个稀释度按0.2ml/枚的剂量经绒毛尿囊膜途径接种8日龄spf鹅胚5枚,置于37℃孵化箱进行孵化,每天早中晚各照胚1次,弃去24h内死亡鹅胚,连续观察5天并记录死亡情况,根据死亡数量,按reed-muench法计算病毒的鵝胚半数致死量eld50。具体结果如下表1所示:表1第1-5代病毒鵝胚半数致死量eld50的测定代次第1代第5代第10代第15代第20代n-goastv-190123eld505×104.005×105.255×106.305×107.005×107.05n-goastv-190178eld505×103.505×104.555×105.455×105.505×105.50基于表1的结果可知,本发明分离得到的鹅星状病毒n-goastv-190123第1代传代培养物的eld50为5×104.00,随着传代的进行,毒力逐渐增强,当传至第15代,培养物的eld50为5×107.00,当传至第20代,培养物的eld50为5×107.05。表明采用同样的传代方法,传代到第15代次时,毒力基本稳定在eld50为5×107.00左右。鹅星状病毒n-goastv-190178传代至10代时,毒力基本稳定在eld50为5×105.45左右,以上试验表明,本发明所分离得到的鹅星状病毒n-goastv-190123相比鹅星状病毒n-goastv-190178,毒力更强。3.2动物回归试验将50羽5日龄雏鹅随机分为两组,每组20羽。其中对照组10羽,每只经皮下注射0.2ml生理盐水,回归试验组每组20羽,每只经皮下接种0.2ml病毒稀释液(稀释至eid50为5×105.0/ml)。相同的饲养条件下观察15天,记录试验雏鹅感染后的临床症状及剖检变化。攻毒两天后,雏鹅开始发病,发病雏鹅在攻毒鹅星状病毒n-goastv-190123毒株4天后左右达到死亡高峰,雏鹅长至20日龄左右时,攻毒试验组的雏鹅死亡率可达65%,攻毒鹅星状病毒n-goastv-190178毒株5天后左右达到死亡高峰,雏鹅长至20日龄左右时,攻毒试验组的雏鹅死亡率可达35%。攻毒试验组的雏鹅临床均表现为倦动厌食,精神不振,排灰白色稀便。剖检死亡雏鹅,两种病毒攻毒后都可见内脏器官肝脏、心脏表面有大量白色尿酸盐沉积,肾脏表面及输尿管内也可见明显的灰白色尿酸盐。固定化肾脏组织,he染色结果表明肾皮质近浆膜面局部出血,皮质肾小管上皮细胞变性,大量坏死;肾小球囊扩张,系膜细胞数量减少,皮质肾小管上皮细胞变性,多量坏死,具体试验结果如图3所示。以上结果表明,本发明分离的goastv攻毒后表现为典型的鹅星状病毒感染的典型症状,且发病快,最快仅攻毒4天即发病达到死亡高峰,攻毒15日后死亡率高达65%。其中鹅星状病毒n-goastv-190123相比鹅星状病毒n-goastv-190178具有更高的致死率。3.4病毒的保藏通过以上试验,本发明获得了一株高致病性的鹅星状病毒n-goastv-190123,将其在中国典型培养物保藏中心(cctcc)进行用于专利程序的培养物的保藏,其保存号为:cctccno:v202068,分类命名为鹅星状病毒(gooseastrovirus);保藏日期为2020年10月14日;保藏地址为:湖北省武汉市武汉大学保藏中心。实施例2:鹅星状病毒灭活疫苗的制备1.灭活疫苗的制备步骤一,取第15-20代次的鹅星状病毒n-goastv-190123毒种用稀释液进行稀释,稀释至eld50为5×105.00/ml,经绒毛尿囊膜途径接种8~10日龄spf鹅胚,每胚0.2ml,接种后置37℃继续孵育,不必翻蛋;步骤二,spf鹅胚接种后,每日照蛋3次,将在24小时前死亡的鹅胚弃去,24小时以后死亡的鹅胚随时取出,至72小时,将活胚全部取出,气室向上直立,置于4℃冷却12小时;步骤三,将冷却12小时的鹅胚取出,表面消毒后,吸取鹅胚液,每20个鹅胚的胚液混合为一组,在收获胚液的同时,应逐个检查鹅胚,将胚液混浊不清、胎儿腐败及有任何污染可疑的鹅胚弃去不用;步骤四,收获后的胚液置于灭菌瓶中,通过离心机离心后,混合于一个储存罐内,在无菌条件下用灭菌的二级预过滤柱滤过,除去病毒液的残渣和其他杂质,同时取样测定毒价,并采用生理盐水稀释调整胚液的eld50为5×105.00;步骤六,准确量取甲醛,用注射用水配制成10%的甲醛溶液,混合均匀,然后往鹅胚液加入甲醛溶液,随加随搅拌,充分混合,甲醛最终浓度为0.2%,而后将其倒到已灭菌的灭活罐内,37℃灭活24小时,期间不停搅拌,灭活24小时后取样做无菌检验和灭活检验;步骤七,取灭活的病毒液加热至30℃保温,取等体积的montanideisa206佐剂,倒入双层夹套容器并将温度保持在30℃,低速(200r/min)搅拌并逐渐将灭活病毒液加入,流速5l/min,待灭活病毒液全部加入后,提高搅拌速度至300r/min,30℃持续搅拌15分钟,而后在持续300r/min高速搅拌的情况下冷却至10℃以下,停止搅拌,将乳液在10℃以下静置24小时,分装并加盖密封,4℃左右保存备用,制得鹅星状病毒n-goastv-190123灭活疫苗。基于以上同样的方法,制备得到鹅星状病毒n-goastv-190178灭活疫苗。2.疫苗的检验2.1物理性状检验外观:为均匀乳剂。剂型:为水包油包水型,用移液枪吸取少量疫苗滴于清洁冷水表面,呈云雾状扩散。稳定性:吸取疫苗10ml加入离心管中,以3000r/min离心15分钟,管底析出的水相不超过0.5ml,表明本发明制备得到的疫苗具有良好的稳定性。无菌检验:按《中国兽药典》附录进行检验,结果均无细菌生长。2.2安全性检验2.2.1鹅胚接种检验:采用绒毛尿囊膜途径接种10枚5日龄spf鹅胚(0.5ml灭活疫苗/枚),放入37℃孵化箱中继续孵育,每天对接种鹅胚进行检查,每日照蛋2次,观察鹅胚死亡情况,连续观察7天,未见鹅胚死亡。2.2.2雏鹅接种检验:选取goastv检测为阴性的、10日龄的健康雏鹅35羽,其中5羽作为对照组,剩余30羽随机分为高、中、低剂量组三个组别,分别按照2ml、1ml和0.5ml的接种量进行疫苗接种,在相同条件下饲喂,连续观察28天,试验组和对照组雏鹅都采食正常,精神状态较好,无死亡或发生疫病的情形,以上试验表明本发明的疫苗具有较好的安全性。2.3疫苗的保护效率测定2.3.1中和抗体效价测定取10-15日龄的goastv核酸检测和血清检测均为阴性的健康雏鹅15羽,随机分为对照组和试验组,每羽进行单独编号,其中试验组经皮下注射疫苗1ml/羽,对照组皮下注射等量生理盐水,接种14天后进行第二次接种,加强免疫,分别于首次接种3、7、14、28、60、90日后采血,分离血清,测定血清中鹅星状病毒的中和抗体效价,并计算各组的平均中和抗体效价,其中当血清中中和抗体滴度≤1:2时记为1log2。具体结果如下图4所示,鹅星状病毒n-goastv-190123灭活疫苗相比鹅星状病毒n-goastv-190178灭活疫苗能够产生更高滴度的中和抗体水平,在首次接种14天和28天后,其中和抗体浓度均能达到8log2以上,且在接种60天和90天后也仍能保持较高的中和抗体水平,对于病毒具有一定的预防作用。2.3.2攻毒保护率测定取10-15日龄的健康雏鹅900羽,分为3组,其中组1采用n-goastv-190123灭活疫苗进行接种(经皮下注射疫苗1ml/羽),组2采用n-goastv-190178灭活疫苗进行接种(经皮下注射疫苗1ml/羽),组3位对照组,皮下注射等量生理盐水,分别进行两次接种,间隔14天,在首次免疫后第28天,每组进一步分为3组,分别采用n-goastv-190123病毒稀释液(经皮下注射1ml/羽,eid50为5×105.0/ml)、n-goastv-190178病毒稀释液(经皮下注射1ml/羽,eid50为5×105.0/ml)进行攻毒,设置注射生理盐水的对照组,攻毒后观察14日,计算攻毒14日后的存活率,具体结果见下表2所示。表2攻毒保护试验结果(成活率,%)n-goastv-190123n-goastv-190178生理盐水n-goastv-190123灭活疫苗100%100%100%n-goastv-190178灭活疫苗85%98%100%对照组48%70%100%基于表2的结果可知,注射n-goastv-190123灭活疫苗的雏鹅,在攻毒后的保护率均为100%,而注射n-goastv-190178灭活疫苗的雏鹅,在采用n-goastv-190178病毒稀释液攻毒后,其保护率达到98%,而当采用毒力较强的n-goastv-190123病毒稀释液攻毒后,其存活率仅为85%。以上结果表明,本发明所分离得到的n-goastv-190123所制备得到的灭活疫苗具有更好的保护力,且具有较好的交叉保护力,该毒株相对而言是合适的疫苗毒株。因此,将其在中国典型培养物保藏中心(cctcc)进行用于专利程序的培养物的保藏,其保存号为:cctccno:v202068,分类命名为鹅星状病毒(gooseastrovirus);保藏日期为2020年10月14日;保藏地址为:湖北省武汉市武汉大学保藏中心。以上实施例仅是对本发明技术方案的详细阐述,在此基础上所进行的常规调整都落入本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1