一种注射乳剂及其制备方法与流程
1.本发明涉及药物制剂加工技术领域,具体地说,涉及一种注射乳剂及其制备方法。
背景技术:
2.相对于口服制剂,注射剂具有起效迅速、生物利用度高的优势,特别在抢救危急重症患者中可以发挥独特作用。然而,由于注射剂的吸收过程短或几乎没有吸收过程,一旦发生不良反应,其严重程度往往比口服药物或其他剂型更大。因此需要严格进行质控。且由于许多药物的水溶性较差,因溶解度所限在制备过程中需要使用大量有机溶媒或增溶剂等手段来达到增溶的目的,但加入有机溶媒后,在药物释放过程中会引起药物的再沉淀,许多增溶剂也会引起生物膜形态的改变及组织损伤,容易引起毒性反应,或对注射局部或血管易产生刺激性,降低患者顺应性。
3.例如,阿加曲班(argatroban),化学名为(2r,4r)
‑4‑
甲基
‑1‑
{(2s)
‑2‑
[(3rs)
‑3‑
甲基
‑
1,2,3,4
‑
四氢
‑8‑
喹啉磺酰氨基]
‑5‑
胍基戊酰基}哌啶
‑2‑
甲酸一水合物,分子量为526.65。阿加曲班是一种高活性、高选择性的凝血酶抑制剂,其抗凝血作用不依赖体内的抗凝血酶,而是直接与血液中游离的凝血酶结合并使其灭活;另外由于阿加曲班分子量较小,可以直接进入血栓内部,灭活已经与纤维蛋白结合的凝血酶,间接抑制凝血酶的产生,因此极低浓度的阿加曲班即可抑制由凝血酶诱导的血小板凝聚反应。由于阿加曲班能大大降低血浆中凝血酶
‑
抗凝血酶复合物的水平,有效改善患者的高凝状态,因此在慢性血栓栓塞性疾病中有非常好的临床效果。但水溶性较差是制备阿加曲班注射液的一大难题。目前上市的阿加曲班注射液处方为每瓶含阿加曲班250mg,d
‑
山梨醇750mg和无水乙醇1000mg,或每瓶含阿加曲班10mg,无水乙醇300mg和甘油900mg。这两种处方均通过加入有机溶剂增加阿加曲班的溶解度,但是有机溶剂的引入同时也增加了用药风险和生产难度,生产成本高,产品质量难以控制。
[0004]
又如,紫杉醇(paclitaxel,商品名taxol)是从红豆杉属红豆杉科植物短叶紫杉(taxus brevidolia,pacific yew)中提取的高效抗癌药,它是一种复杂的二萜类化合物,分子式为c
47
h
51
no
14
,相对分子质量为853.9。紫杉醇具有良好的抗癌活性,用于治疗卵巢癌、乳腺癌、结肠癌、非小细胞肺癌、颈癌等。紫杉醇在甲醇、乙醇或三氯甲烷中溶解,在乙醚中微溶,在水中几乎不溶。在制备成注射液的过程中常需要采用大量乙醇作为溶剂,增加了用药风险。
[0005]
再如,左西孟旦(simendan)是一种治疗心力衰竭的药物,由于其水溶性极差,目前上市的制剂多为灭菌无水乙醇溶液,其中还含有聚乙二醇400或羟丙基倍他环糊精和枸橼酸,其性状为黄绿色至橙黄色的澄明液体,遇热色渐深,无法避免采用有机溶媒的弊端。
[0006]
现有技术中,为了减少有机溶媒或增溶剂的使用,已有在制备时,将水溶性差的活性成分先溶解在有机溶媒或增溶剂中,再后续去除的方法,但该方式仍有残留风险,无法完全避免使用有机溶媒或增溶剂的弊端。且该方式生产成本较高、产品质量不易控制。
[0007]
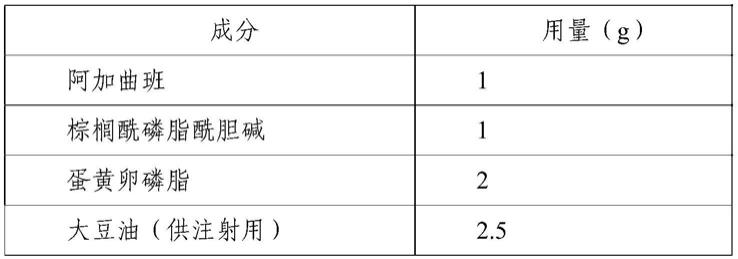
综上,急需研发一种新的难溶性药物注射剂制备技术,避免使用大量有机溶媒或
增溶剂,以解决现有技术问题。
技术实现要素:
[0008]
针对现有技术的不足,本发明的目的是提供一种在不添加大量有机溶媒或增溶剂的情况下,仍能将难溶于水的活性物质制备为稳定的注射乳剂的方法。
[0009]
为了实现该目的,本发明的技术方案如下:
[0010]
一种制备注射乳剂的方法,所述注射乳剂中的活性成分极微溶解于水,且至少略溶于大豆油,所述方法为:先将乳化剂和甘油依次溶解于油相溶剂后,再加入所述活性成分作为油相;
[0011]
所述乳化剂为大豆卵磷脂、蛋黄卵磷脂、棕榈酰磷脂酰胆碱中的一种或多种;所述油相溶剂为中链甘油三酸酯和大豆油。
[0012]
本发明针对难溶性药物活性成分如何制备为稳定且安全性更佳的注射乳剂进行了大量研究,发现当在制备油相时,先将特定乳化剂与甘油依次溶解于适宜的脂溶性的溶剂中,再加入特定溶解性能的活性成分进行乳化后,可使得制得的乳剂液滴中油水界面张力急剧减小,单体液滴比未加甘油前的尺寸更小,电导值减小且稳定性增加,从而增加活性成分最终在乳剂中的稳定性和载药量。此方法无需大量具有安全隐患或影响药物稳定性的有机溶媒或增溶剂,仅通过制备组分和步骤的配合,即可实现提升患者顺应性、增加产品稳定性的作用。
[0013]
本发明中的“极微溶解”和“略溶”等的判断标准依据《中国药典》2020年版(四部)凡例的规定。“至少略溶于大豆油”指活性成分具有在大豆油中很好的溶解性,具体可为略溶、溶解、易溶、极易溶解于大豆油。
[0014]
本发明中,所述乳化剂与甘油的质量比为(10
‑
40):1,优选为(10
‑
30):1。
[0015]
所述乳化剂为质量比为(2
‑
1):1的大豆卵磷脂与棕榈酰磷脂酰胆碱,或质量比为(2
‑
1):1的蛋黄卵磷脂与棕榈酰磷脂酰胆碱。
[0016]
所述中链甘油三酸酯和所述大豆油的质量比为1:(1.5
‑
2.5);在制备时,先将所述乳化剂和甘油依次溶解于所述中链甘油三酸酯中,之后再与所述大豆油混合。
[0017]
本发明活性成分可通过上述方式良好地溶解于特定油相中,改善其溶解度,提高制剂的载药量。
[0018]
当采用本发明的特定乳化剂配合少量的甘油后,即可在后续乳剂中使特定溶解性能的活性成分同特定的油相溶剂一起,在水相中形成更小的液滴,实现更好的分散,使活性成分能更稳定地分配在油相或油水界面,外水相中药物含量相对较少,避免活性成分与水的直接接触,起到更好的“屏障隔离”作用,从而增加活性成分(尤其是易水解或对ph变化敏感的活性成分)的稳定性,并减少活性成分与血管的接触,进而有效降低活性成分引起静脉炎的可能性,增加使用时的顺应性,且稳定的油相介质还可给活性成分的释放过程提供一个适宜的环境,使其缓慢释放,减少活性成分在贮藏过程中可能发生的沉淀。
[0019]
本发明所述注射乳剂的配方中,所述活性成分的重量百分比为0.25%~5.00%;所述乳化剂的重量百分比为3%~20%,优选为3%~15%;所述油相溶剂的重量百分比为10%~30%,优选为10%~20%。
[0020]
本发明方法还包括在所述油相制备完成后,将所述油相与水混合,先通过剪切制
备为初乳,之后在调节ph值后,进一步均质制得乳剂的步骤;
[0021]
所述油相与水混合时,温度控制为30~60℃,优选为30~50℃;
[0022]
和/或,在制备初乳时,所述油相与水的质量比为(0.2
‑
1):1。
[0023]
本发明通过控制油相和水相的比例,以及油相和水相的温度使制备方式可更好地与所选特定组分特性相互配合,实现理想的制备效果。
[0024]
具体在油相中加入配方量70%左右的水后进行剪切,制备初乳,调整ph值后,再以剩余的配方量水定容后进行均质。
[0025]
剪切的转速为8000
‑
12000rpm,时间为8
‑
12min。
[0026]
本发明均质时先采用低压均质,再采用高压均质,具体为:低压均质的压力为100bar~400bar,优选为200~300bar,低压均质的次数为2~6次,优选为3~4次;高压均质的压力为500bar~800bar,优选为600~700bar,高压均质的次为数6~12次,优选为8~10次。
[0027]
本发明对均质的方式进行了筛选、优化,使其能更好地配合所选组分特性,获得更好地制备效果。
[0028]
本发明在均质前,所述初乳的ph值为2~7,优选为3~6;调节ph值时采用的ph调节剂包括:无水枸橼酸、盐酸、油酸、氢氧化钠、油酸钠中的一种或多种。
[0029]
在均质后,本发明还包括灌装、采用旋转蒸汽灭菌柜121℃,12min热压灭菌方式进行灭菌的步骤。
[0030]
本发明还提供一种注射乳剂,其以上述方法制备得到。
[0031]
所述注射乳剂的活性成分可为阿加曲班、紫杉醇或左西孟旦。
[0032]
本发明的有益效果至少在于:
[0033]
本发明通过在加入活性成分前,添加少量甘油与特定乳化剂、油相溶剂配合,再后续将其制备成乳剂的方式,既避免了在制备难溶性药物注射液时使用大量有机溶媒或增溶剂,降低了毒性反应或刺激性,提升了患者的顺应性,又提高了注射乳剂的稳定性和载药量,获得了理想的综合效果。
具体实施方式
[0034]
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
[0035]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0036]
实施例1
[0037]
本实施例提供一种本发明的阿加曲班注射乳剂及其制备方法。
[0038]
阿加曲班在水中溶解度不足1mg/ml,属于《中国药典》2020年版(四部)凡例中规定的极微溶解于水。阿加曲班在大豆油中的溶解度超过250mg/ml,属于《中国药典》2020年版(四部)凡例中规定的易溶于大豆油。
[0039]
具体如下:
[0040]
阿加曲班注射乳剂处方见表1。
[0041]
表1
[0042]
成分用量(g)阿加曲班1棕榈酰磷脂酰胆碱1蛋黄卵磷脂2甘油0.1大豆油(供注射用)2.5中链甘油三酸酯1.5氢氧化钠适量注射用水至20ml
[0043]
具体制备方法如下:
[0044]
1.将棕榈酰磷脂酰胆碱、蛋黄卵磷脂和甘油依次加入处方量的中链甘油三酸酯中,充分搅拌使溶解,之后将其加入处方量大豆油中作为溶剂;
[0045]
2.将阿加曲班加入上述溶剂中,充分搅拌使溶解作为油相,控制油相温度为35
±
5℃;
[0046]
3.将油相与约70%处方量注射用水(温度与油相一致),通过10000rpm转速、10min剪切制备成初乳;
[0047]
4.加入0.1m氢氧化钠溶液调节ph值至5.0
‑
6.0的范围内;
[0048]
5.在低压均质200bar压力下均质4次,在高压均质600bar的压力下均质10次,得乳剂;
[0049]
6.灌装,通过121℃,12min热压灭菌方式进行灭菌。
[0050]
实施例2
[0051]
本实施例提供一种本发明的紫杉醇注射乳剂及其制备方法。
[0052]
紫杉醇在水中溶解度不足0.1mg/ml,属于《中国药典》2020年版(四部)凡例中规定的几乎不溶于水。紫杉醇在大豆油中的溶解度超过250mg/ml,属于《中国药典》2020年版(四部)凡例中规定的易溶于大豆油。
[0053]
具体如下:
[0054]
紫杉醇注射乳剂处方见表2。
[0055]
表2
[0056]
成分用量(g)紫杉醇3棕榈酰磷脂酰胆碱1.5大豆卵磷脂1.5甘油0.3大豆油(供注射用)7中链甘油三酸酯3无水枸橼酸适量注射用水至100ml
[0057]
具体制备方法如下:
[0058]
1.将棕榈酰磷脂酰胆碱、大豆卵磷脂、甘油依次加入处方量的中链甘油三酸酯中,充分搅拌使溶解,之后将其加入处方量大豆油中作为溶剂;
[0059]
2.将紫杉醇加入上述溶剂中,充分搅拌使溶解作为油相,控制油相温度为45
±
5℃;
[0060]
3.将油相与约70%处方量注射用水(温度与油相一致),通过8000rpm转速、12min剪切制备成初乳;
[0061]
4.加入无水枸橼酸调节ph值至3.0
‑
5.0的范围内;
[0062]
5.在低压均质300bar压力下均质3次,在高压均质700bar的压力下均质8次,得乳剂;
[0063]
6.灌装,通过121℃,12min热压灭菌方式进行灭菌。
[0064]
实施例3
[0065]
本实施例提供一种本发明的左西孟旦注射乳剂及其制备方法。
[0066]
左西孟旦在水中溶解度不足0.1mg/ml,属于《中国药典》2020年版(四部)凡例中规定的几乎不溶于水。左西孟旦在大豆油中的溶解度超过25mg/ml,属于《中国药典》2020年版(四部)凡例中规定的略溶于大豆油。
[0067]
具体如下:
[0068]
左西孟旦注射乳剂处方见表3。
[0069]
表3
[0070]
成分用量(g)左西孟旦0.25棕榈酰磷脂酰胆碱1.0大豆卵磷脂2.0甘油0.1大豆油(供注射用)7中链甘油三酸酯3无水枸橼酸适量注射用水至100ml
[0071]
具体制备方法如下:
[0072]
1.将棕榈酰磷脂酰胆碱、大豆卵磷脂、甘油依次加入处方量的中链甘油三酸酯中,充分搅拌使溶解,之后将其加入处方量大豆油中作为溶剂;
[0073]
2.将左西孟旦加入上述溶剂中,充分搅拌使溶解作为油相(控制油相温度为35
±
5℃);
[0074]
3.将油相与约70%处方量注射用水(温度与油相一致),通过12000rpm转速、8min剪切制备成初乳;
[0075]
4.加入无水枸橼酸调节ph值至3.0
‑
5.0的范围内;
[0076]
5.在低压均质200bar压力下均质4次,在高压均质600bar的压力下均质8次,得乳剂;
[0077]
6.灌装,通过121℃,12min热压灭菌方式进行灭菌。
[0078]
对比例1
[0079]
本对比例提供一种阿加曲班注射液及其制备方法。
[0080]
处方组成见表4:
[0081]
表4
[0082]
组分用量(g)阿加曲班10.0无水乙醇300甘油900盐酸适量氢氧化钠适量注射用水至2l
[0083]
制备工艺:
[0084]
溶液混合:称取处方量甘油、无水乙醇、全量体积的10%注射用水,搅拌5min备用;
[0085]
主药溶解:加入处方量的阿加曲班,搅拌使溶解完全;
[0086]
定容:补加注射用水至全量,并搅拌混合均匀;
[0087]
ph调节:使用0.1m氢氧化钠调节ph值至5.0
‑
6.0的范围内;
[0088]
灭菌:灌装,通过121℃,12min热压灭菌方式进行灭菌。
[0089]
对比例2
[0090]
本对比例提供一种紫杉醇注射液及其制备方法。
[0091]
处方组成见表5:
[0092]
表5
[0093]
组分用量(g)紫杉醇3.0g蓖麻油聚烃氧酯(35)263.5g无水乙醇至500ml无水枸橼酸0.2g
[0094]
制备工艺:
[0095]
①
称取处方量的紫杉醇原料加入处方量的无水乙醇中,搅拌使其完全溶解(a液);
[0096]
②
称取处方量的蓖麻油聚烃氧酯(35),水浴加热至约30℃(b液);
[0097]
③
将b溶液加入a溶液中,搅拌均匀;
[0098]
④
安瓿瓶灌封,5ml/支。
[0099]
对比例3
[0100]
本对比例提供一种左西孟旦注射液及其制备方法。
[0101]
处方组成见表6:
[0102]
表6
[0103]
组分用量(g)左西孟旦0.25羟丙基倍他环糊精85.0无水枸橼酸0.2
无水乙醇至100ml
[0104]
制备工艺:
[0105]
①
称取处方量的羟丙基倍他环糊精加入处方量的无水乙醇中,搅拌使其完全溶解,加入无水枸橼酸调节ph至3.0
‑
5.0的范围内;
[0106]
②
称取处方量的左西孟旦,搅拌使溶解;
[0107]
③
过滤除菌;
[0108]
④
安瓿瓶灌封,5ml/支。
[0109]
对比例4
[0110]
本对比例提供一种阿加曲班注射液及其制备方法。
[0111]
处方组成见表7:
[0112]
表7
[0113][0114][0115]
具体制备方法如下:
[0116]
1.将棕榈酰磷脂酰胆碱、蛋黄卵磷脂加入处方量的中链甘油三酸酯中,充分搅拌使溶解,之后将其加入处方量大豆油中作为溶剂;
[0117]
2.将阿加曲班加入上述溶剂中,充分搅拌使溶解作为油相,控制油相温度为35
±
5℃;
[0118]
3.将油相与约70%处方量注射用水(温度与油相一致),通过10000rpm转速、10min剪切制备成初乳;
[0119]
4.加入0.1m氢氧化钠溶液调节ph值至5.0
‑
6.0的范围内;
[0120]
5.在低压均质200bar压力下均质4次,在高压均质600bar的压力下均质10次,得乳剂;
[0121]
6.灌装,通过121℃,12min热压灭菌方式进行灭菌。
[0122]
对比例5
[0123]
本对比例提供一种阿加曲班注射乳剂及其制备方法。其与实施例1的配方相同,区别仅在于:制备时,甘油的加入顺序不同,实施例1在油相中加入,对比例5在水相中加入。
[0124]
具体处方组成见表8:
[0125]
表8
[0126][0127][0128]
具体制备方法如下:
[0129]
1.将棕榈酰磷脂酰胆碱、蛋黄卵磷脂依次加入处方量的中链甘油三酸酯中,充分搅拌使溶解,之后将其加入处方量大豆油中作为溶剂;
[0130]
2.将阿加曲班加入上述溶剂中,充分搅拌使溶解作为油相,控制油相温度为35
±
5℃;
[0131]
3.将甘油加入约70%处方量注射用水(温度与油相一致)中,并加入油相,通过10000rpm转速、10min剪切制备成初乳;
[0132]
4.加入0.1m氢氧化钠溶液调节ph值至5.0
‑
6.0的范围内;
[0133]
5.在低压均质200bar压力下均质4次,在高压均质600bar的压力下均质10次,得乳剂;
[0134]
6.灌装,通过121℃,12min热压灭菌方式进行灭菌。
[0135]
对比例6
[0136]
本对比例提供一种紫杉醇注射乳剂及其制备方法。其与实施例2的配方和制备方法相同,区别仅在于:以泊洛沙姆替代棕榈酰磷脂酰胆碱。
[0137]
具体处方组成见表9:
[0138]
表9
[0139]
成分用量(g)紫杉醇3泊洛沙姆1.5大豆卵磷脂1.5甘油0.3大豆油(供注射用)7中链甘油三酸酯3无水枸橼酸适量注射用水至100ml
[0140]
具体制备方法如下:
[0141]
1.将泊洛沙姆、大豆卵磷脂、甘油依次加入处方量的中链甘油三酸酯中,充分搅拌使溶解,之后将其加入处方量大豆油中作为溶剂;
[0142]
2.将紫杉醇加入上述溶剂中,充分搅拌使溶解作为油相,控制油相温度为45
±
5℃;
[0143]
3.将油相与约70%处方量注射用水(温度与油相一致),通过8000rpm转速、12min剪切制备成初乳;
[0144]
4.加入无水枸橼酸调节ph值至3.0
‑
5.0的范围内;
[0145]
5.在低压均质300bar压力下均质3次,在高压均质700bar的压力下均质8次,得乳剂;
[0146]
6.灌装,通过121℃,12min热压灭菌方式进行灭菌。
[0147]
对比例7
[0148]
本对比例提供一种左西孟旦注射乳剂及其制备方法。其与实施例3相同,区别仅在于:大豆卵磷脂与棕榈酰磷脂酰胆碱的质量比为3:1,总量不变。
[0149]
具体处方组成见表10:
[0150]
表10
[0151]
成分用量(g)左西孟旦0.25棕榈酰磷脂酰胆碱0.75大豆卵磷脂2.25甘油0.1大豆油(供注射用)7中链甘油三酸酯3无水枸橼酸适量注射用水至100ml
[0152]
具体制备方法如下:
[0153]
1.将棕榈酰磷脂酰胆碱、大豆卵磷脂、甘油依次加入处方量的中链甘油三酸酯中,充分搅拌使溶解,之后将其加入处方量大豆油中作为溶剂;
[0154]
2.将左西孟旦加入上述溶剂中,充分搅拌使溶解作为油相(控制油相温度为35
±
5℃);
[0155]
3.将油相与约70%处方量注射用水(温度与油相一致),通过12000rpm转速、8min剪切制备成初乳;
[0156]
4.加入无水枸橼酸调节ph值至3.0
‑
5.0的范围内;
[0157]
5.在低压均质200bar压力下均质4次,在高压均质600bar的压力下均质8次,得乳剂;
[0158]
6.灌装,通过121℃,12min热压灭菌方式进行灭菌。
[0159]
对比例8
[0160]
本对比例提供一种阿加曲班注射乳剂及其制备方法。其与实施例1的配方相同,区别仅在于:中链甘油三酸酯和所述大豆油的质量比为1:1,总量不变。
[0161]
具体处方组成见表11:
℃;
[0179]
3.将油相与约70%处方量注射用水(温度与油相一致),通过10000rpm转速、10min剪切制备成初乳;
[0180]
4.加入0.1m氢氧化钠溶液调节ph值至5.0
‑
6.0的范围内;
[0181]
5.在低压均质200bar压力下均质4次,在高压均质600bar的压力下均质10次,得乳剂;
[0182]
6.灌装,通过121℃,12min热压灭菌方式进行灭菌。
[0183]
实验例1
[0184]
取新西兰家兔32只,随机分成4组,1~4组分别按10mg/kg的剂量在家兔右耳缘静脉注射实施例1、实施例2、对比例1和对比例2的注射液。各组每天给药1次,连续给药2周,每天对动物和注射部位进行肉眼观察,观察注射部位有无充血、水肿、坏死等刺激反应。获得的观察结果见表13。
[0185]
表13
[0186]
样品活性成分单支注射液体积血管刺激试验实施例130mg0.6ml无变化对比例130mg3ml轻度充血和/出血实施例230mg1ml轻度充血和/出血对比例230mg5ml明显充血、肿胀、耳下垂
[0187]
实施例1相比对比例1、实施例2相比对比例2载药量明显提高,且可降低注射液的给药体积,降低注射局部刺激。
[0188]
实验例2
[0189]
将实施例1和对比例1样品分别进行高温60℃和光照(5000lux)考察10天,对其有关物质的变化情况进行对比。
[0190]
有关物质测试方法为:高效液相色谱法(《中国药典》2020年版(四部)通则0512),色谱柱:十八烷基硅烷键合硅胶为填充剂(es chromegabond hc c18,250
×
4.6mm,5μm),流动相a:0.02mol/l甲酸铵缓冲液(用甲酸调节ph值至3.5),流动相b:乙腈,按下表14进行梯度洗脱,流速:1.0ml/min,柱温:55℃,在259nm波长下检测。
[0191]
表14
[0192][0193]
溶液的配制方法为:溶剂:乙腈
‑
水(30:70);空白辅料溶液:精密量取空白辅料4ml(约相当于阿加曲班20mg时的辅料量),置10ml量瓶中,用溶剂稀释至刻度,摇匀。系统适用
性溶液:取杂质a、杂质ag
‑
x1、杂质ag
‑
x2和阿加曲班对照品各适量,加溶剂溶解并定量稀释制成含阿加曲班2mg/ml和各杂质4μg/ml的混合溶液。供试品溶液:分别精密量取实施例1、对比例1样品4ml,置10ml量瓶中,用溶剂稀释至刻度,摇匀。对照品溶液:取阿加曲班对照品适量,加乙腈
‑
水(30:70)溶解并定量稀释制成含阿加曲班4μg/ml的溶液。灵敏度溶液:精密量取对照品溶液适量,用乙腈
‑
水(30:70)定量稀释制成约含1μg/ml的溶液。系统适用性试验:精密量取系统适用性溶液10μl,注入液相色谱仪,记录色谱图,出峰顺序依次为杂质a、杂质ag
‑
x1、杂质ag
‑
x2、阿加曲班,各色谱峰间的分离度应符合要求(≥1.5);量取灵敏度溶液10μl,注入液相色谱仪,记录色谱图,主峰的信噪比应不小于10。具体操作:精密量取溶剂、空白辅料溶液、供试品溶液和对照品溶液各10μl,分别注入液相色谱仪,记录色谱图。供试品溶液的色谱图中如有杂质峰,按乘以校正因子的外标法计算杂质含量,均应符合表15中相应限度规定。小于灵敏度溶液主峰面积的峰忽略不计(0.05%)。
[0194]
表15
[0195][0196][0197]
实施例1的阿加曲班乳状注射液与对比例1的阿加曲班注射液稳定性对比见表16。
[0198]
表16
[0199]
[0200]
将实施例1和对比例1样品进行对比,通过稳定性考察显示制备成本发明实施例1的乳剂后稳定性相比于对比例1有一定程度提高。
[0201]
实验例3
[0202]
将实施例2和对比例2样品分别进行高温60℃考察10天,对其有关物质的变化情况进行对比。
[0203]
有关物质测试方法为:用内容量移液管分别精密量取实施例2、对比例2样品适量,加乙腈溶解并定量稀释制成每1ml中约含紫杉醇1.2mg的溶液,作为供试品溶液;精密量取供试品溶液适量,用乙腈定量稀释制成每1ml中约含紫杉醇1.2μg的溶液,作为对照溶液;另取紫杉醇和7
‑
表
‑
10
‑
去乙酰基紫杉醇对照品适量,用乙腈溶解并稀释制成每1ml中约含紫杉醇1.2mg、7
‑
表
‑
10
‑
去乙酰基紫杉醇12μg的溶液,作为系统适用性溶液。用内容量移液管精密量取处方量的空白辅料2ml,置10ml量瓶中,加乙腈溶解并稀释至刻度,摇匀,作为辅料溶液。照高效液相色谱法(《中国药典》2020年版(四部)通则0512)试验,用十八烷基硅烷键合硅胶为填充剂(ymc ods
‑
a4.6mm
×
150mm 3μm或性能相当的色谱柱),以乙腈
‑
水(40:60)为流动相a,乙腈为流动相b,按表17进行梯度洗脱,流速为1.2ml/min,柱温35℃,检测波长227nm。
[0204]
表17
[0205][0206]
取系统适用性溶液10μl,注入液相色谱仪,获得的信息见表18。7
‑
表
‑
10
‑
去乙酰基紫杉醇与紫杉醇的分离度应大于1.2,再精密量取供试品溶液和对照溶液各10μl,分别注入液相色谱仪,记录色谱图。供试品溶液色谱图中如有杂质峰(扣除溶剂峰和辅料峰),各已知杂质峰面积乘以校正因子均不得过表18中的限度规定。供试品溶液色谱图中小于对照溶液主峰面积0.5倍(0.05%)的峰忽略不计。
[0207]
表18
[0208][0209][0210]
结果见表19。
[0211]
表19
[0212][0213]
将实施例2和对比例2样品进行对比,通过稳定性考察显示制备成本发明实施例2的乳剂后稳定性优于对比例2的注射液。
[0214]
实验例4
[0215]
将实施例3和对比例3样品分别进行高温60℃考察10天,通过目测对其性状变化情况进行对比。
[0216]
结果见表20。
[0217]
表20
[0218][0219][0220]
将实施例3和对比例3样品进行对比,通过稳定性考察显示制备成本发明乳剂后可减少稳定性过程中发生颜色变化或沉淀析出,本发明实施例3的乳剂稳定性优于对比例3的注射液。
[0221]
实验例5
[0222]
用马尔文zs90激光粒度仪测定了上述实施例1、实施例2、实施例3、对比例4、对比例5、对比例6、对比例7、对比例8和对比例9制备得到的乳剂样品的粒径、粒度分布情况(检测三次,取平均值),并观察其外观,再对它们分别在高温40℃条件下放置1个月后的粒径、粒度分布情况进行检测(检测三次,取平均值),并观察其外观。其中pdi值为粒径多分散指数,其值越小代表粒径越均一。结果见表21。
[0223]
表21
[0224][0225]
将实施例1和对比例4样品进行对比,结果显示加入甘油后,乳剂的平均粒径更小,粒径更均一,且在高温条件下更稳定。
[0226]
将实施例1和对比例5、8、9样品进行对比,结果显示在本发明配方体系下,甘油的加入方式、油相溶剂选择及油相溶剂与乳化剂的复配比例均会影响乳剂的平均粒径和粒径均一性。将实施例2和对比例6样品进行对比,实施例3和对比例7样品进行对比,结果显示在本发明配方体系下,乳化剂选择和乳化剂复配比例也会影响乳剂的平均粒径和粒径均一性和稳定性。
[0227]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1